Fabricante de medicamentos: Novartis Pharmaceuticals Corporation (Updated: 2025-01-27)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
ZYKADIA® (ceritinib) cápsulas, para administración oral
ZYKADIA® (ceritinib) comprimidos, para administración oral
Aprobación inicial en EE. UU.: 2014
CAMBIOS IMPORTANTES RECIENTES
| Advertencias y precauciones, reacciones adversas gastrointestinales (5.1) | 8/2021 |
INDICACIONES Y USO
POSOLOGÍA Y ADMINISTRACIÓN
Dosis recomendada: 450 mg por vía oral una vez al día con alimentos. (2.2)
CONTRAINDICACIONES
Ninguna. (4)
ADVERTENCIAS Y PRECAUCIONES
- Reacciones adversas gastrointestinales: ZYKADIA puede causar reacciones adversas gastrointestinales. Si son graves o intolerables, suspenda el tratamiento si no responden a antieméticos o antidiarreicos; una vez que mejoren, reanude la administración de ZYKADIA a una dosis reducida. (2.3, 5.1)
- Hepatotoxicidad: ZYKADIA puede causar hepatotoxicidad. Controle las pruebas de laboratorio hepáticas al menos mensualmente. Suspenda el tratamiento, reduzca la dosis o interrumpa permanentemente la administración de ZYKADIA. (2.3, 5.2)
- Enfermedad pulmonar intersticial/Neumonitis: Se produjo en el 2,4 % de los pacientes. Interrumpa permanentemente la administración de ZYKADIA en pacientes diagnosticados con enfermedad pulmonar intersticial (EPI)/neumonitis relacionada con el tratamiento. (2.3, 5.3)
- Prolongación del intervalo QT: ZYKADIA puede causar prolongación del intervalo QTc. Controle los electrocardiogramas y los electrolitos en pacientes con insuficiencia cardíaca congestiva, bradiarritmias, anomalías electrolíticas o aquellos que están tomando medicamentos que se sabe que prolongan el intervalo QTc. Suspenda el tratamiento, reduzca la dosis o interrumpa permanentemente la administración de ZYKADIA. (2.3, 5.4)
- Hiperglucemia: ZYKADIA puede causar hiperglucemia. Controle la glucosa en ayunas antes del tratamiento y periódicamente a partir de entonces. Inicie u optimice los medicamentos antihiperglucémicos según sea necesario. Suspenda el tratamiento, reduzca la dosis o interrumpa permanentemente la administración de ZYKADIA. (2.3, 5.5)
- Bradicardia: ZYKADIA puede causar bradicardia. Controle la frecuencia cardíaca y la presión arterial regularmente. Suspenda el tratamiento, reduzca la dosis o interrumpa permanentemente la administración de ZYKADIA. (2.3, 5.6)
- Pancreatitis: Pueden producirse elevaciones de lipasa y/o amilasa y pancreatitis. Controle la lipasa y la amilasa antes del tratamiento y periódicamente a partir de entonces, según esté clínicamente indicado. Suspenda el tratamiento, reduzca la dosis de ZYKADIA. (2.3, 5.7)
- Toxicidad embriofetal: ZYKADIA puede causar daño fetal. Avise a las mujeres en edad fértil sobre el riesgo potencial para el feto y sobre el uso de métodos anticonceptivos eficaces. (5.8, 8.1, 8.3)
REACCIONES ADVERSAS
Las reacciones adversas más comunes (incidencia ≥ 25 %) en pacientes tratados con ZYKADIA 450 mg con alimentos son diarrea, náuseas, dolor abdominal, vómitos y fatiga; y con ZYKADIA 750 mg en ayunas son diarrea, náuseas, vómitos, fatiga, dolor abdominal, disminución del apetito y pérdida de peso. (6)
Para notificar SOSPECHAS DE REACCIONES ADVERSAS, póngase en contacto con Novartis Pharmaceuticals Corporation al 1-888-669-6682 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES MEDICAMENTOSAS
- Inhibidores e inductores del CYP3A: Evite el uso concomitante de ZYKADIA con inhibidores o inductores potentes del CYP3A. Si el uso concomitante de un inhibidor potente del CYP3A es inevitable, reduzca la dosis de ZYKADIA. (2.4, 7.1)
- Sustratos del CYP3A: Evite la administración concomitante de ZYKADIA con sustratos sensibles del CYP3A. (7.2)
- Sustratos del CYP2C9: Evite la administración concomitante de ZYKADIA con sustratos del CYP2C9 para los que los cambios mínimos en la concentración pueden provocar toxicidades graves. (7.2)
USO EN POBLACIONES ESPECÍFICAS
Consulte el apartado 17 para obtener INFORMACIÓN PARA EL PACIENTE y el etiquetado del paciente aprobado por la FDA.
Revisado: 10/2021
Tabla de contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1
INDICACIONES Y USO
2
POSOLOGÍA Y ADMINISTRACIÓN
2.1
Selección del Paciente
2.2
Posología Recomendada
2.3
Modificaciones de la Posología por Reacciones Adversas
2.4
Modificación de la Posología para Inhibidores Potentes del CYP3A
2.5
Modificación de la Posología para Pacientes con Insuficiencia Hepática Grave
3
FORMAS Y CONCENTRACIONES FARMACÉUTICAS
4
CONTRAINDICACIONES
5
ADVERTENCIAS Y PRECAUCIONES
5.1
Reacciones Adversas Gastrointestinales
5.2
Hepatotoxicidad
5.3
Enfermedad Intersticial Pulmonar/Neumonitis
5.4
Prolongación del Intervalo QT
5.5
Hiperglucemia
5.6
Bradicardia
5.7
Pancreatitis
5.8
Toxicidad Embrio-Fetal
6
REACCIONES ADVERSAS
6.1
Experiencia en Ensayos Clínicos
7
INTERACCIONES MEDICAMENTOSAS
7.1
Efecto de Otros Medicamentos sobre ZYKADIA
7.2
Efecto de ZYKADIA sobre Otros Medicamentos
7.3
Medicamentos que Prolongan el Intervalo QT
7.4
Medicamentos que Causan Bradicardia
8
USO EN POBLACIONES ESPECÍFICAS
8.1
Embarazo
8.2
Lactancia
8.3
Mujeres y Hombres en Edad Reproductiva
8.4
Uso Pediátrico
8.5
Uso Geriátrico
8.6
Insuficiencia Hepática
11
DESCRIPCIÓN
12
FARMACOLOGÍA CLÍNICA
12.1
Mecanismo de Acción
12.2
Farmacodinamia
12.3
Farmacocinética
13
TOXICOLOGÍA NO CLÍNICA
13.1
Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
13.2
Toxicología y/o Farmacología Animal
14
ESTUDIOS CLÍNICOS
14.1
Cáncer de Pulmón de Células No Pequeñas (CPNP) metastásico ALK-positivo previamente no tratado
14.2
Cáncer de Pulmón de Células No Pequeñas (CPNP) metastásico ALK-positivo previamente tratado
16
PRESENTACIÓN/CONSERVACIÓN Y MANIPULACIÓN
17
INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no se enumeran.
1 INDICACIONES Y USO
ZYKADIA® está indicado para el tratamiento de pacientes adultos con cáncer de pulmón de células no pequeñas (CPNP) metastásico cuyos tumores son positivos para la cinasa del linfoma anaplásico (ALK), según lo detectado por una prueba aprobada por la FDA [ver Dosis y Administración (2.1)].
2 DOSIS Y ADMINISTRACIÓN
2.1
Selección del paciente
Seleccione pacientes para el tratamiento del CPNM metastásico con ZYKADIA basándose en la presencia de positividad de ALK en las muestras tumorales [véase Estudios clínicos (14.1)].
La información sobre las pruebas aprobadas por la FDA para la detección de reordenamientos de ALK en el CPNM está disponible en: http://www.fda.gov/CompanionDiagnostics.
2.2
Dosis recomendada
La dosis recomendada de ZYKADIA es de 450 mg por vía oral una vez al día con alimentos hasta la progresión de la enfermedad o toxicidad inaceptable [véase Farmacología clínica (12.3)].
Si se olvida una dosis de ZYKADIA, repóngala a menos que la siguiente dosis deba tomarse dentro de las 12 horas.
Si se producen vómitos durante el tratamiento, no administre una dosis adicional y continúe con la siguiente dosis programada de ZYKADIA.
2.3
Modificaciones de la dosis para reacciones adversas
| Reducción de la dosis | Dosis recomendada |
| Primera reducción de la dosis | 300 mg por vía oral una vez al día con alimentos |
| Segunda reducción de la dosis | 150 mg por vía oral una vez al día con alimentos |
Interrumpa ZYKADIA en pacientes que no toleren 150 mg administrados por vía oral una vez al día con alimentos.
Las modificaciones de la dosis para reacciones adversas seleccionadas de ZYKADIA se proporcionan en la Tabla 2. Si se requiere una reducción de la dosis debido a una reacción adversa no incluida en la Tabla 2, reduzca la dosis diaria de ZYKADIA en 150 mg.
| Reacción adversa | ZYKADIA Modificación de la dosis |
| Reacciones adversas gastrointestinales [ver Advertencias y precauciones (5.1)] | |
| Náuseas, vómitos o diarrea graves o intolerables a pesar del tratamiento óptimo con antieméticos o antidiarreicos | Suspender hasta que mejore, luego reanudar ZYKADIA con la dosis inmediatamente inferior. |
| Hepatotoxicidad [ver Advertencias y precauciones (5.2)] | |
| Elevación de ALT o AST superior a 5 veces el LSN con elevación de bilirrubina total inferior o igual a 2 veces el LSN | Suspender hasta la recuperación a los valores basales o a menos de 3 veces el LSN, luego reanudar ZYKADIA con la dosis inmediatamente inferior. |
| Elevación de ALT o AST superior a 3 veces el LSN con elevación de bilirrubina total superior a 2 veces el LSN en ausencia de colestasis o hemólisis | Interrumpir permanentemente ZYKADIA. |
| Enfermedad pulmonar intersticial/Neumonitis [ver Advertencias y precauciones (5.3)] | |
| Cualquier grado de EPI/neumonitis relacionada con el tratamiento | Interrumpir permanentemente ZYKADIA. |
| Prolongación del intervalo QT [ver Advertencias y precauciones (5.4)] | |
| Intervalo QTc superior a 500 mseg en al menos 2 ECG separados | Suspender hasta que el intervalo QTc sea inferior a 481 mseg o hasta la recuperación a los valores basales si el QTc basal es superior o igual a 481 mseg, luego reanudar ZYKADIA con la dosis inmediatamente inferior. |
| Prolongación del intervalo QTc en combinación con torsades de pointes o taquicardia ventricular polimórfica o signos/síntomas de arritmia grave | Interrumpir permanentemente ZYKADIA. |
| Hiperglucemia [ver Advertencias y precauciones (5.5)] | |
| Hiperglucemia persistente superior a 250 mg/dL a pesar del tratamiento antihiperglucémico óptimo | Suspender hasta que la hiperglucemia esté adecuadamente controlada, luego reanudar ZYKADIA con la dosis inmediatamente inferior. Si no se puede lograr un control adecuado de la hiperglucemia con el manejo médico óptimo, interrumpa ZYKADIA. |
| Bradicardia [ver Advertencias y precauciones (5.6)] | |
| Bradicardia sintomática que no es potencialmente mortal | Suspender hasta la recuperación a una bradicardia asintomática o a una frecuencia cardíaca de 60 lpm o superior, evaluar los medicamentos concomitantes que se sabe que causan bradicardia. Si la bradicardia no se puede atribuir a otro fármaco, reanudar ZYKADIA con la dosis inmediatamente inferior. |
| Bradicardia clínicamente significativa que requiere intervención o bradicardia potencialmente mortal en pacientes que toman un medicamento concomitante que también se sabe que causa bradicardia o un medicamento que se sabe que causa hipotensión | Suspender hasta la recuperación a una bradicardia asintomática o a una frecuencia cardíaca de 60 lpm o superior. Si el medicamento concomitante se puede ajustar o suspender, reanudar ZYKADIA con la dosis inmediatamente inferior con monitorización frecuente. |
| Bradicardia potencialmente mortal en pacientes que no toman un medicamento concomitante que también se sabe que causa bradicardia o que se sabe que causa hipotensión | Interrumpir permanentemente ZYKADIA. |
| Pancreatitis [ver Advertencias y precauciones (5.7)] | |
| Elevación de lipasa o amilasa superior a 2 veces el LSN | Suspender hasta la recuperación a menos de 1,5 veces el LSN, luego reanudar ZYKADIA con la dosis inmediatamente inferior. |
| Abreviaturas: AST, aspartato aminotransferasa; ALT, alanina aminotransferasa; LSN, límite superior de la normalidad; EPI, enfermedad pulmonar intersticial; ECG, electrocardiograma; lpm, latidos por minuto. | |
2.4
Modificación de la dosis para inhibidores potentes del CYP3A
Evite el uso concomitante de inhibidores potentes del CYP3A durante el tratamiento con ZYKADIA [véase Interacciones medicamentosas (7.1), Farmacología clínica (12.3)].
Si el uso concomitante de un inhibidor potente del CYP3A es inevitable, reduzca la dosis de ZYKADIA aproximadamente en un tercio, redondeando al múltiplo más cercano de la dosis de 150 mg. Después de suspender un inhibidor potente del CYP3A, reanude la dosis de ZYKADIA que se tomaba antes de iniciar el inhibidor potente del CYP3A.
2.5
Modificación de la dosis para pacientes con insuficiencia hepática grave
Para pacientes con insuficiencia hepática grave (Child-Pugh C), reduzca la dosis de ZYKADIA aproximadamente en un tercio, redondeando al múltiplo más cercano de la dosis de 150 mg [véase Uso en poblaciones específicas (8.6), Farmacología clínica (12.3)].
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Cápsulas: cápsula de gelatina dura de 150 mg con tapa azul opaca y cuerpo blanco opaco que contiene un polvo blanco a blanquecino. La tapa azul opaca está marcada con tinta negra con “LDK 150MG” y el cuerpo blanco opaco está marcado con tinta negra con “NVR”.
Tabletas: tableta recubierta con película de 150 mg, azul claro, redonda, biconvexa con bordes biselados, sin ranura, grabada con “NVR” en un lado y “ZY1” en el otro lado.
4 CONTRAINDICACIONES
Ninguna.
5 ADVERTENCIAS Y PRECAUCIONES
5.1
Reacciones adversas gastrointestinales
Se produjeron reacciones adversas gastrointestinales graves en pacientes tratados con ZYKADIA 750 mg en ayunas [véase Reacciones adversas (6.1)]. Diarrea, náuseas, vómitos o dolor abdominal se produjeron en el 95% de 925 pacientes, incluidos casos graves (Grado 3 o 4) en el 14% de los pacientes tratados con ZYKADIA en los estudios clínicos. La diarrea, las náuseas, los vómitos o el dolor abdominal que provocaron interrupciones o reducciones de la dosis se produjeron en el 36% de los pacientes y que provocaron la interrupción del tratamiento se produjeron en el 1,6% de los pacientes.
La incidencia y la gravedad de las reacciones adversas gastrointestinales se redujeron en los pacientes tratados con ZYKADIA 450 mg con alimentos en un estudio de optimización de la dosis (ASCEND-8). Diarrea, náuseas, vómitos o dolor abdominal se produjeron en el 79% de los 108 pacientes tratados con ZYKADIA a la dosis recomendada de 450 mg con alimentos. De estos, el 53% fueron eventos de Grado 1 y el 24% fueron eventos de Grado 2. Un paciente (0,9%) experimentó diarrea de Grado 3 y un paciente (0,9%) experimentó vómitos de Grado 3. Un paciente (0,9%) requirió un ajuste de la dosis debido a los vómitos. Once (10%) pacientes presentaron diarrea, náuseas, vómitos o dolor abdominal que requirieron al menos una interrupción de la dosis.
Controle y maneje a los pacientes utilizando los estándares de atención, incluidos antidiarreicos, antieméticos o reposición de líquidos, según sea necesario. Suspenda ZYKADIA si la reacción adversa gastrointestinal es grave o intolerable y no responde a los antieméticos o antidiarreicos. Una vez que mejore, reanude la administración de ZYKADIA a una dosis reducida [véase Posología y administración (2.3)].
5.2
Hepatotoxicidad
Se produjo hepatotoxicidad inducida por fármacos en pacientes tratados con ZYKADIA [véase Reacciones adversas (6.1)]. Elevaciones en la alanina aminotransferasa (ALT) > 5 veces el límite superior de la normalidad (LSN) se produjeron en el 28% y elevaciones en la aspartato aminotransferasa (AST) > 5 veces el LSN se produjeron en el 16% de 925 pacientes en los estudios clínicos. Elevaciones concomitantes en ALT > 3 veces el LSN y bilirrubina total > 2 veces el LSN, con fosfatasa alcalina < 2 veces el LSN se produjeron en el 0,3% de los pacientes en los estudios clínicos. Aproximadamente el 1% de los pacientes requirieron la interrupción permanente debido a la hepatotoxicidad.
Controle con pruebas de laboratorio hepáticas, incluidas ALT, AST y bilirrubina total, una vez al mes y según esté clínicamente indicado, con pruebas más frecuentes en pacientes que desarrollan elevaciones de transaminasas. Según la gravedad de la reacción adversa, suspenda ZYKADIA con reanudación a una dosis reducida o suspenda permanentemente ZYKADIA [véase Posología y administración (2.3)].
5.3
Enfermedad pulmonar intersticial/Neumonitis
Se produjeron enfermedades pulmonares intersticiales (EPI)/neumonitis graves, potencialmente mortales o mortales en pacientes tratados con ZYKADIA [véase Reacciones adversas (6.1)]. En los estudios clínicos, se informó EPI/neumonitis en el 2,4% de 925 pacientes tratados con ZYKADIA. Se informó EPI/neumonitis de Grado 3 o 4 en el 1,3% de los pacientes, con eventos mortales informados en el 0,2% de los pacientes. Diez pacientes (1,1%) interrumpieron el tratamiento con ZYKADIA en los estudios clínicos debido a EPI/neumonitis.
Controle a los pacientes para detectar síntomas pulmonares indicativos de EPI/neumonitis. Excluya otras causas potenciales de EPI/neumonitis e interrumpa permanentemente el tratamiento con ZYKADIA en pacientes diagnosticados con EPI/neumonitis relacionada con el tratamiento [véase Posología y administración (2.3)].
5.4
Prolongación del intervalo QT
Se produjo prolongación del intervalo QTc, que puede provocar un mayor riesgo de taquiarritmia ventricular (p. ej., torsades de pointes) o muerte súbita, en pacientes tratados con ZYKADIA [véase Reacciones adversas (6.1)]. En los estudios clínicos, el 6% de 919 pacientes con al menos una evaluación electrocardiográfica (ECG) posterior a la basal presentaron un aumento desde la basal de QTc > 60 mseg. Aproximadamente el 1,3% de los pacientes que tomaban ZYKADIA 750 mg en ayunas presentaron un QTc > 500 mseg. ZYKADIA causa aumentos dependientes de la concentración en el intervalo QTc [véase Farmacología clínica (12.2)]. En los estudios clínicos, el 0,2% de los pacientes interrumpieron el tratamiento con ZYKADIA debido a la prolongación del QTc.
Cuando sea posible, evite el uso de ZYKADIA en pacientes con síndrome de QT largo congénito. Realice un control periódico con ECG y electrolitos en pacientes con insuficiencia cardíaca congestiva, bradiarritmias, anomalías electrolíticas o aquellos que estén tomando medicamentos que se sabe que prolongan el intervalo QTc. Según la gravedad de la reacción adversa, suspenda ZYKADIA, con reanudación a una dosis reducida, o suspenda permanentemente ZYKADIA [véase Posología y administración (2.3)].
5.5
Hiperglucemia
Se produjo hiperglucemia en pacientes tratados con ZYKADIA [véase Reacciones adversas (6.1)]. En los estudios clínicos, la hiperglucemia de Grado 3 o 4, según los valores de laboratorio, se produjo en el 13% de 925 pacientes.
Controle la glucosa sérica en ayunas antes de comenzar el tratamiento con ZYKADIA y periódicamente a partir de entonces, según esté clínicamente indicado. Inicie u optimice los medicamentos antihiperglucémicos según sea necesario. Según la gravedad de la reacción adversa, suspenda ZYKADIA con reanudación a una dosis reducida o suspenda permanentemente ZYKADIA [véase Posología y administración (2.3)].
5.6
Bradicardia
Se produjo bradicardia en pacientes tratados con ZYKADIA [véase Reacciones adversas (6.1)]. En los estudios clínicos, la bradicardia sinusal, definida como una frecuencia cardíaca < 50 latidos por minuto, se observó como un hallazgo nuevo en el 1,1 % de 925 pacientes. La bradicardia se notificó como una reacción adversa en el 1 % de los pacientes. Ningún paciente requirió la interrupción del tratamiento y el 0,1 % requirió la interrupción con posterior reducción de la dosis por bradicardia.
Evite el uso de ZYKADIA en combinación con otros productos que se sabe que causan bradicardia (p. ej., betabloqueantes, bloqueadores de los canales de calcio no dihidropiridínicos, clonidina y digoxina) en la medida de lo posible. Controle la frecuencia cardíaca y la presión arterial regularmente. Según la gravedad de la reacción adversa, suspenda ZYKADIA y reanude la administración a una dosis reducida una vez que se resuelva la bradicardia, o suspenda permanentemente ZYKADIA [véase Posología y administración (2.3)].
5.7
Pancreatitis
Se produjo pancreatitis en pacientes tratados con ZYKADIA [véase Reacciones adversas (6.1)]. La pancreatitis, incluida una muerte, se produjo en menos del 1 % de los pacientes que recibieron ZYKADIA en los estudios clínicos. Se produjeron elevaciones de grado 3 o 4 de amilasa en el 7 % de los pacientes que recibieron ZYKADIA en los estudios clínicos, mientras que se produjeron elevaciones de grado 3 o 4 de lipasa en el 14 % de los pacientes.
Controle la lipasa y la amilasa antes de iniciar el tratamiento con ZYKADIA y periódicamente a partir de entonces según lo indicado clínicamente. Según la gravedad de las anomalías de laboratorio, suspenda ZYKADIA y reanude la administración a una dosis reducida [véase Posología y administración (2.3)].
5.8
Toxicidad embriofetal
Según su mecanismo de acción y los hallazgos de los estudios en animales, ZYKADIA puede causar daño fetal cuando se administra a una mujer embarazada. En estudios en animales, la administración de ceritinib a ratas y conejos durante la organogénesis a exposiciones plasmáticas maternas inferiores a la dosis humana recomendada provocó un aumento de las anomalías esqueléticas en ratas y conejos.
Avise a las mujeres embarazadas del riesgo potencial para el feto. Avise a las mujeres en edad fértil que utilicen métodos anticonceptivos eficaces durante el tratamiento con ZYKADIA y durante 6 meses después de la finalización del tratamiento. Debido a la posibilidad de genotoxicidad, avise a los varones con parejas femeninas en edad fértil que utilicen preservativos durante el tratamiento con ZYKADIA y durante 3 meses después de la finalización del tratamiento [véase Uso en poblaciones específicas (8.1, 8.3), Toxicología no clínica (13.1)].
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas clínicamente significativas se describen en otras partes del etiquetado:
- Reacciones adversas gastrointestinales [see Warnings and Precautions (5.1)]
- Hepatotoxicidad [see Warnings and Precautions (5.2)]
- Enfermedad pulmonar intersticial/Neumonitis [see Warnings and Precautions (5.3)]
- Prolongación del intervalo QT [see Warnings and Precautions (5.4)]
- Hiperglucemia [see Warnings and Precautions (5.5)]
- Bradicardia [see Warnings and Precautions (5.6)]
- Pancreatitis [see Warnings and Precautions (5.7)]
6.1
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan bajo condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no pueden compararse directamente con las tasas en los ensayos clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica.
Los datos de la sección Advertencias y precauciones reflejan la exposición a ZYKADIA 750 mg una vez al día en condiciones de ayuno en 925 pacientes con NSCLC ALK positivo en siete estudios clínicos, incluidos ASCEND-4 y ASCEND-1, que se describen a continuación, un estudio aleatorizado con control activo, dos estudios de un solo brazo y dos estudios de aumento de dosis. La mayoría de los pacientes inscritos en estos estudios habían recibido tratamiento previo con quimioterapia y/o crizotinib para el NSCLC. Entre estos 925 pacientes, las reacciones adversas más comunes (incidencia ≥ 25%) fueron diarrea, náuseas, vómitos, fatiga, dolor abdominal, disminución del apetito y pérdida de peso. Aproximadamente el 45% de los pacientes que iniciaron el tratamiento con ZYKADIA 750 mg en ayunas tuvieron una reacción adversa que requirió al menos una reducción de la dosis y el 66% de los pacientes tuvieron una reacción adversa que requirió al menos una interrupción de la dosis. La mediana del tiempo hasta la primera reducción de la dosis por cualquier motivo fue de 7 semanas.
Estudio de optimización de la dosis: régimen de dosificación de 450 mg al día con alimentos
En ASCEND-8, un estudio de optimización de dosis, se comparó ZYKADIA 450 mg al día con alimentos (N = 108) con 750 mg al día en ayunas (N = 110) tanto en pacientes previamente tratados como no tratados con NSCLC ALK positivo. El perfil de seguridad general de ZYKADIA 450 mg con alimentos fue consistente con ZYKADIA 750 mg en ayunas, excepto por una reducción en las reacciones adversas gastrointestinales, mientras que se logró una exposición comparable en estado estacionario [see Clinical Pharmacology (12.3)]. Las reacciones adversas más comunes (incidencia ≥ 25%) en el grupo de 450 mg con alimentos fueron diarrea, náuseas, dolor abdominal, vómitos y fatiga. La incidencia y la gravedad de las reacciones adversas gastrointestinales (diarrea 59%, náuseas 43% y vómitos 38%) se redujeron para los pacientes tratados con ZYKADIA 450 mg con alimentos; se informaron reacciones adversas de grado ≥ 3 en dos pacientes (1,9%): diarrea de grado 3 y vómitos de grado 3 en un paciente cada uno [see Warnings and Precautions (5.1)].
En pacientes tratados con ZYKADIA 450 mg con alimentos, el 24% de los pacientes tuvo una reacción adversa que requirió al menos una reducción de la dosis y el 56% de los pacientes tuvo una reacción adversa que requirió al menos una interrupción de la dosis. La mediana del tiempo hasta la primera reducción de la dosis por cualquier motivo fue de 8 semanas.
NSCLC metastásico ALK positivo no tratado previamente
La seguridad de ZYKADIA se evaluó en ASCEND-4, un estudio multicéntrico, abierto, aleatorizado y con control activo de 376 pacientes con NSCLC ALK positivo no tratados previamente [see Clinical Studies (14.1)]. Los pacientes recibieron ZYKADIA 750 mg al día (N = 189) en condiciones de ayuno o quimioterapia y quimioterapia de mantenimiento (N = 187). Los regímenes de quimioterapia fueron pemetrexed (500 mg/m2) y la elección del investigador de cisplatino (75 mg/m2) o carboplatino [área bajo la curva (AUC) de 5 – 6 mg*min/mL] administrados cada 21 días. Los pacientes que completaron 4 ciclos de quimioterapia sin enfermedad progresiva recibieron pemetrexed (500 mg/m2) como terapia de mantenimiento de agente único cada 21 días. La mediana de la duración de la exposición a ZYKADIA fue de 18 meses.
Las características demográficas de la población del estudio fueron 57% mujeres, mediana de edad 54 años (rango, 22 a 81 años), 22% de edad 65 años o mayor, 54% blancos, 42% asiáticos, 2% negros y 2% otras razas. Los pacientes se inscribieron en las regiones de Europa (53%), Asia Pacífico (42%) y América del Sur (5%). La mayoría de los pacientes tenían adenocarcinoma (97%), nunca habían fumado (61%) y el 32% tenía metástasis cerebrales en el momento del cribado.
Las siguientes reacciones adversas fatales ocurrieron en 4 pacientes tratados con ZYKADIA: infarto de miocardio, infección del tracto respiratorio, neumonitis y causa desconocida.
Se informaron reacciones adversas graves en el 38% de los pacientes tratados con ZYKADIA. Las reacciones adversas graves más frecuentes fueron neumonía (4%), derrame pleural (4%), vómitos (4%), náuseas (3%), disnea (3%), hiperglucemia (3%), aumento de AST (2%), infección pulmonar (2 %) y derrame pericárdico (2%).
Entre los pacientes tratados con ZYKADIA, se produjeron interrupciones de la dosis debido a reacciones adversas en el 77%, se requirieron reducciones de la dosis en el 66% y se produjeron reacciones adversas que llevaron a la interrupción del tratamiento en el 12% de los pacientes. Las reacciones adversas más frecuentes, informadas en al menos el 10% de los pacientes tratados con ZYKADIA, que llevaron a interrupciones o reducciones de la dosis fueron: aumento de ALT (48%), aumento de AST (34%), vómitos (15%), aumento de creatinina en sangre (14%), aumento de gamma-glutamil transpeptidasa (GGT) (13%), diarrea (13%) y náuseas (13%). Las reacciones adversas más frecuentes que llevaron a la interrupción de ZYKADIA en el 1% o más de los pacientes en ASCEND-4 fueron aumento de creatinina en sangre (2,1%), aumento de amilasa (1,1%) y aumento de lipasa (1,1%).
Las Tablas 3 y 4 resumen las reacciones adversas y las anomalías de laboratorio, respectivamente, en ASCEND-4.
| ZYKADIA N = 189 |
Quimioterapia N = 175a |
|||
| Todos los grados | Grado 3-4 | Todos los grados | Grado 3-4 | |
| % | % | % | % | |
| Gastrointestinales** | ||||
| Diarrea | 85 | 4.8 | 11 | 1.1 |
| Náuseas | 69 | 2.6 | 55 | 5 |
| Vómitos | 67 | 5 | 36 | 6 |
| Dolor abdominalb | 40 | 3.7 | 13 | 0 |
| Estreñimiento | 20 | 0 | 22 | 0 |
| Trastorno esofágicoc | 15 | 0.5 | 8 | 0.6 |
| Generales | ||||
| Fatigad | 45 | 7 | 49 | 6 |
| Dolor torácico no cardíaco | 21 | 1.1 | 10 | 0.6 |
| Dolor de espalda | 19 | 1.6 | 18 | 2.3 |
| Pirexia | 19 | 0 | 14 | 1.1 |
| Dolor en las extremidades | 13 | 0 | 7 | 0 |
| Dolor musculoesquelético | 11 | 0.5 | 6 | 0.6 |
| Prurito | 11 | 0.5 | 5 | 0 |
| Metabolismo y Nutrición | ||||
| Disminución del apetito | 34 | 1.1 | 32 | 1.1 |
| Pérdida de peso | 24 | 3.7 | 15 | 0.6 |
| Respiratorias | ||||
| Tos | 25 | 0 | 17 | 0 |
| Piel | ||||
| Erupcióne | 21 | 1.1 | 8 | 0.6 |
| Neurológico | ||||
| Dolor de cabeza | 19 | 0.5 | 13 | 1.1 |
| Mareo | 12 | 1.1 | 10 | 0.6 |
| Cardíaco | ||||
| Prolonged QT interval | 12 | 2.6 | 1.1 | 0.6 |
| Pericarditisf | 4.2 | 1.6 | 2.3 | 1.1 |
| *National Cancer Institute Common Terminology Criteria for Adverse Events (version 4.03). **Para la frecuencia de reacciones adversas gastrointestinales a la dosis recomendada de 450 mg con alimentos [see Warnings and Precautions (5.1), Adverse Reactions (6.1)]. aDoce pacientes asignados al azar a la quimioterapia no recibieron el medicamento del estudio. bDolor abdominal (dolor abdominal, dolor abdominal superior, malestar abdominal y malestar epigástrico). cTrastorno esofágico (dispepsia, enfermedad por reflujo gastroesofágico y disfagia). dFatiga (fatiga y astenia). eErupción (erupción cutánea, dermatitis acneiforme, erupción maculopapular). fPericarditis (derrame pericárdico y pericarditis). |
||||
Reacciones adversas clínicamente significativas adicionales que ocurren en el 2% o más de los pacientes tratados con ZYKADIA 750 mg en condiciones de ayuno incluyeron: trastorno de la visión (4% compuesto por deterioro de la visión, visión borrosa, fotopsia, trastorno de la acomodación, presbicia, agudeza visual reducida o flotadores vítreos), bradicardia (4%), EPI/neumonitis (2%), hepatotoxicidad (2%) e insuficiencia renal (2%). Además, la reacción adversa de fotosensibilidad se reportó en el 1.1% de los pacientes.
| ZYKADIA N = 189 |
Chemotherapy N = 175a |
|||
| Todos los grados | Grado 3-4 | Todos los grados | Grado 3-4 | |
| % | % | % | % | |
| Química | ||||
| ALT elevada | 91 | 34 | 65 | 3.4 |
| AST elevada | 86 | 21 | 58 | 2.3 |
| GGT elevada | 84 | 49 | 67 | 10 |
| Fosfatasa alcalina elevada | 81 | 12 | 47 | 1.7 |
| Creatinina elevada | 77 | 4.2 | 37 | 0.6 |
| Hiperglucemia | 53 | 10 | 67 | 10 |
| Hipofosfatemia | 38 | 3.7 | 27 | 4.0 |
| Amilasa elevada | 37 | 8 | 43 | 4.5 |
| Hiperbilirrubinemia (total) | 15 | 0.5 | 6 | 0.6 |
| Lipasa elevadab | 13 | 6 | 7 | 0.6 |
| Hematología | ||||
| Anemia | 67 | 4.2 | 84 | 11 |
| Neutropenia | 27 | 2.1 | 58 | 20 |
| Trombocitopenia | 16 | 1.0 | 38 | 4.6 |
| Abreviaturas: ALT, alanina aminotransferasa; AST, aspartato aminotransferasa; GGT, gamma-glutamil transpeptidasa. *National Cancer Institute Common Terminology Criteria for Adverse Events (versión 4.03). aDoce pacientes aleatorizados a quimioterapia no recibieron el fármaco del estudio. bEn el grupo de ZYKADIA, ningún paciente tuvo evaluaciones de laboratorio de lipasa al inicio del estudio, 112 tuvieron evaluaciones posteriores al inicio del estudio. En el grupo de quimioterapia, un paciente tuvo evaluaciones de laboratorio de lipasa al inicio del estudio, pero ninguna evaluación posterior al inicio del estudio; 49 pacientes tuvieron evaluaciones posteriores al inicio del estudio. |
||||
Cáncer de Pulmón No Microcítico (CPNM) Metastásico ALK-Positivo Previamente Tratado
La seguridad de ZYKADIA se evaluó en ASCEND-1, un estudio clínico multicéntrico, de un solo brazo, abierto, de 255 pacientes ALK-positivos (246 pacientes con CPNM y 9 pacientes con otros cánceres que recibieron ZYKADIA a una dosis de 750 mg al día en condiciones de ayuno) [ver Estudios Clínicos (14.2)]. La mediana de la duración de la exposición a ZYKADIA fue de 6 meses.
Las características de la población del estudio fueron: Mediana de edad 53 años, edad menor de 65 (84%), mujeres (53%), blancos (63%), asiáticos (34%), histología de adenocarcinoma de CPNM (90%), nunca o exfumadores (97%), Eastern Cooperative Oncology Group Performance Status (ECOG PS) 0 o 1 (89%), metástasis cerebrales (49%) y número de terapias previas 2 o más (67%).
Las reacciones adversas fatales en pacientes tratados con ZYKADIA ocurrieron en el 5% de los pacientes, que consistieron en: Neumonía (4 pacientes), insuficiencia respiratoria, EPI/neumonitis, neumotórax, hemorragia gástrica, deterioro general de la salud física, tuberculosis pulmonar, taponamiento cardíaco y sepsis (1 paciente cada uno).
Las reacciones adversas graves notificadas en el 2% o más de los pacientes en ASCEND-1 fueron convulsiones, neumonía, EPI/neumonitis, disnea, deshidratación, hiperglucemia y náuseas.
Se produjeron reducciones de dosis debido a reacciones adversas en el 59% de los pacientes tratados con ZYKADIA. Las reacciones adversas más frecuentes, notificadas en al menos el 10% de los pacientes, que llevaron a reducciones o interrupciones de la dosis fueron: aumento de la ALT (29%), náuseas (20%), aumento de la AST (16%), diarrea (16%) y vómitos (16%). La interrupción del tratamiento debido a reacciones adversas se produjo en el 10% de los pacientes tratados con ZYKADIA. Las reacciones adversas más frecuentes que llevaron a la interrupción en el 1% o más de los pacientes en ASCEND-1 fueron neumonía, EPI/neumonitis y disminución del apetito.
Las Tablas 5 y 6 resumen las reacciones adversas y las anomalías de laboratorio, respectivamente, en ASCEND-1.
| ZYKADIA N = 255 |
||
| Todos los Grados | Grado 3-4 | |
| % | % | |
| Gastrointestinales** | ||
|
Diarrea |
86 | 6 |
|
Náuseas |
80 | 4 |
|
Vómitos |
60 | 4 |
|
Dolor abdominala |
54 | 2 |
|
Estreñimiento |
29 | 0 |
|
Trastorno esofágicob |
16 | 1 |
| Generales | ||
|
Fatigac |
52 | 5 |
| Metabolismo y Nutrición | ||
|
Disminución del apetito |
34 | 1 |
| Piel | ||
|
Erupciónd |
16 | 0 |
| Respiratorias | ||
|
Enfermedad pulmonar intersticial/neumonitis |
4 | 3 |
| Abreviatura: ALK, quinasa del linfoma anaplásico. *National Cancer Institute Common Terminology Criteria for Adverse Events (versión 4.03). **Para la frecuencia de las reacciones adversas gastrointestinales a la dosis recomendada de 450 mg con alimentos [ver Advertencias y precauciones (5.1), Reacciones adversas (6.1)]. aDolor abdominal (dolor abdominal, dolor abdominal superior, molestias abdominales y molestias epigástricas). bTrastorno esofágico (dispepsia, enfermedad por reflujo gastroesofágico y disfagia). cFatiga (fatiga y astenia). dErupción (erupción, erupción maculopapular y dermatitis acneiforme). |
||
Reacciones adversas clínicamente significativas adicionales que ocurrieron en el 2% o más de los pacientes tratados con ZYKADIA 750 mg en ayunas incluyeron neuropatía (17% compuesta por parestesia, debilidad muscular, alteración de la marcha, neuropatía periférica, hipoestesia, neuropatía sensorial periférica, disestesia, neuralgia, neuropatía motora periférica, hipotonía o polineuropatía), trastorno de la visión (9% compuesto por deterioro de la visión, visión borrosa, fotopsia, trastorno de la acomodación, presbicia o reducción de la agudeza visual), intervalo QT prolongado (4%) y bradicardia (3%). Además, la reacción adversa de fotosensibilidad se reportó en el 1.2% de los pacientes.
| ZYKADIA N = 255 |
||
| Todos los Grados | Grado 3-4 | |
| % | % | |
| Hematología | ||
|
Anemia |
84 | 5 |
| Química | ||
|
Increased ALT |
80 | 27 |
|
Increased AST |
75 | 13 |
|
Increased creatinine |
58 | 2 |
|
Hiperglucemia |
49 | 13 |
|
Hipofosfatemia |
36 | 7 |
|
Increased lipase |
28 | 10 |
|
Hiperbilirrubinemia (total) |
15 | 1 |
| Abbreviations: ALT, alanine aminotransferase; AST, aspartate aminotransferase; ALK, anaplastic lymphoma kinase. *National Cancer Institute Common Terminology Criteria for Adverse Events (version 4.03). |
||
7 INTERACCIONES MEDICAMENTOSAS
7.1
Efecto de otros medicamentos en ZYKADIA
Inhibidores potentes del CYP3A
Un inhibidor potente del CYP3A4/P-gp (ketoconazol) aumentó la exposición sistémica a ceritinib [ver Farmacología clínica (12.3)], lo que puede aumentar la incidencia y la gravedad de las reacciones adversas de ZYKADIA. Evite el uso concomitante de inhibidores potentes del CYP3A durante el tratamiento con ZYKADIA. Si el uso concomitante de inhibidores potentes del CYP3A es inevitable, reduzca la dosis de ZYKADIA [ver Posología y administración (2.4)].
No consuma pomelo ni zumo de pomelo, ya que pueden inhibir el CYP3A.
Inductores potentes del CYP3A
Un inductor potente del CYP3A4/P-gp (rifampicina) disminuyó la exposición sistémica a ceritinib [ver Farmacología clínica (12.3)], lo que puede disminuir la eficacia de ZYKADIA. Evite el uso concomitante de inductores potentes del CYP3A durante el tratamiento con ZYKADIA.
7.2
Efecto de ZYKADIA en otros medicamentos
Sustratos del CYP3A
El ceritinib aumentó la exposición sistémica a un sustrato sensible del CYP3A (midazolam) [ver Farmacología clínica (12.3)]. Evite la administración conjunta de ZYKADIA con sustratos sensibles del CYP3A. Si el uso concomitante es inevitable, considere la reducción de la dosis del(de los) sustrato(s) sensible(s) del CYP3A. Si ZYKADIA se administra conjuntamente con otros sustratos del CYP3A, consulte el etiquetado del sustrato del CYP3A para obtener recomendaciones sobre la dosificación con inhibidores potentes del CYP3A.
Sustratos del CYP2C9
El ceritinib aumentó la exposición sistémica a un sustrato del CYP2C9 (warfarina) [ver Farmacología clínica (12.3)]. Aumente la frecuencia de la monitorización del INR si la administración conjunta con warfarina es inevitable, ya que el efecto anticoagulante de la warfarina puede verse aumentado.
Evite la administración conjunta de ZYKADIA con sustratos del CYP2C9 para los que unos cambios mínimos en la concentración pueden provocar toxicidades graves. Si el uso concomitante de dichos sustratos del CYP2C9 es inevitable, considere la reducción de la dosis de los sustratos del CYP2C9 administrados conjuntamente.
7.3
Medicamentos que prolongan el intervalo QT
ZYKADIA causa aumentos dependientes de la concentración en el intervalo QTc. Cuando sea posible, evite la administración conjunta de ZYKADIA con otros productos con un potencial conocido para prolongar el intervalo QTc [ver Advertencias y precauciones (5.4), Farmacología clínica (12.2)].
7.4
Medicamentos que causan bradicardia
ZYKADIA puede causar bradicardia. Cuando sea posible, evite la administración conjunta de ZYKADIA con otros productos conocidos por causar bradicardia [ver Advertencias y precauciones (5.6), Farmacología clínica (12.2)].
8 USO EN POBLACIONES ESPECÍFICAS
8.1
Embarazo
Resumen del riesgo
Basándose en estudios en animales y en su mecanismo de acción [ver Farmacología clínica (12.1)], ZYKADIA puede causar daño fetal cuando se administra a una mujer embarazada. Los datos limitados disponibles sobre el uso de ZYKADIA en mujeres embarazadas son insuficientes para informar sobre un riesgo. La administración de ceritinib a ratas y conejas durante el período de organogénesis a exposiciones plasmáticas maternas inferiores a la dosis humana recomendada provocó un aumento de las anomalías esqueléticas en ratas y conejas (ver Datos). Avise a la mujer embarazada del riesgo potencial para el feto.
En la población general de EE. UU., el riesgo estimado de fondo de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente.
Datos
Datos en animales
En un estudio de desarrollo embriofetal en el que se administraron dosis diarias de ceritinib a ratas embarazadas durante la organogénesis, se observaron anomalías esqueléticas relacionadas con la dosis a dosis tan bajas como 50 mg/kg (menos de 0,5 veces la exposición humana por AUC a la dosis recomendada). Los hallazgos incluyeron osificaciones retardadas y variaciones esqueléticas.
En conejas embarazadas a las que se administró ceritinib diariamente durante la organogénesis, se observaron anomalías esqueléticas relacionadas con la dosis, incluida la osificación incompleta, a dosis iguales o > 2 mg/kg/día (aproximadamente 0,015 veces la exposición humana por AUC a la dosis recomendada). Se observó una baja incidencia de anomalías viscerales, incluida la vesícula biliar ausente o mal posicionada y la arteria cardíaca subclavia retroesofágica, a dosis iguales o > 10 mg/kg/día (aproximadamente 0,13 veces la exposición humana por AUC a la dosis recomendada). Se produjo toxicidad materna y aborto en conejas a dosis de 35 mg/kg o más. Además, se observó embrioletalidad en conejas a una dosis de 50 mg/kg.
8.2
Lactancia
Resumen del riesgo
No hay datos sobre la presencia de ceritinib o sus metabolitos en la leche materna, los efectos de ceritinib en el niño amamantado o sus efectos sobre la producción de leche. Debido a la posibilidad de reacciones adversas graves en los niños amamantados, se debe aconsejar a las mujeres que no amamanten durante el tratamiento con ZYKADIA y durante las 2 semanas posteriores a la finalización del tratamiento.
8.3
Mujeres y hombres en edad fértil
Prueba de embarazo
Verificar el estado del embarazo en mujeres en edad fértil antes de iniciar el tratamiento con ZYKADIA [ver Uso en poblaciones específicas (8.1)].
Anticoncepción
ZYKADIA puede causar daño fetal cuando se administra a una mujer embarazada [ver Uso en poblaciones específicas (8.1)].
Mujeres
Se debe aconsejar a las mujeres en edad fértil que utilicen métodos anticonceptivos eficaces durante el tratamiento con ZYKADIA y durante los 6 meses posteriores a la finalización del tratamiento.
Hombres
Basándose en la posibilidad de genotoxicidad, se debe aconsejar a los hombres con parejas femeninas en edad fértil que utilicen preservativos durante el tratamiento con ZYKADIA y durante los 3 meses posteriores a la finalización del tratamiento [ver Toxicología no clínica (13.1)].
8.4
Uso pediátrico
No se ha establecido la seguridad y eficacia de ZYKADIA en pacientes pediátricos.
8.5
Uso en geriatría
De los 925 pacientes en los estudios clínicos de ZYKADIA, el 18% tenía 65 años o más, mientras que el 5% tenía 75 años o más. No se observaron diferencias generales en la seguridad o la eficacia entre estos sujetos y los sujetos más jóvenes.
8.6
Insuficiencia hepática
Para los pacientes con insuficiencia hepática grave (Child-Pugh C), reduzca la dosis de ZYKADIA [ver Posología y administración (2.5)]. No se recomienda ningún ajuste de dosis para pacientes con insuficiencia hepática leve (Child-Pugh A) o moderada (Child-Pugh B).
11 DESCRIPCIÓN
Ceritinib es un inhibidor de la quinasa para administración oral. La fórmula molecular de ceritinib es C28H36N5O3ClS. El peso molecular es 558.14 g/mol. Ceritinib se describe químicamente como 5-cloro-N4-[2-[(1-metiletil)sulfonil]fenil]-N2-[5-metil-2-(1-metiletoxi)-4-(4-piperidinil)fenil]-2,4-pirimidindiamina.
La estructura química de ceritinib se muestra a continuación:
Ceritinib es un polvo blanco a casi blanco o amarillo claro.
ZYKADIA se suministra como cápsulas de gelatina dura impresas que contienen 150 mg de ceritinib y los siguientes ingredientes inactivos: dióxido de silicio coloidal, cubiertas de cápsulas de gelatina dura, hidroxipropilcelulosa de baja sustitución, estearato de magnesio, celulosa microcristalina y glicolato de almidón sódico. La cubierta de la cápsula está compuesta por FD&C Blue # 2, gelatina y dióxido de titanio.
ZYKADIA se suministra como comprimidos recubiertos con película que contienen 150 mg de ceritinib y los siguientes ingredientes inactivos: dióxido de silicio coloidal, croscarmelosa sódica, hidroxipropilcelulosa de baja sustitución, estearato de magnesio, celulosa microcristalina y povidona. El recubrimiento del comprimido contiene FD&C Blue # 2 laca de aluminio, hipromelosa, polietilenglicol 4000, talco y dióxido de titanio.
12 FARMACOLOGÍA CLÍNICA
12.1
Mecanismo de acción
Ceritinib es un inhibidor de la quinasa. Los objetivos de la inhibición de ceritinib identificados en ensayos bioquímicos o celulares a concentraciones clínicamente relevantes incluyen ALK, el receptor del factor de crecimiento similar a la insulina 1 (IGF-1R), el receptor de insulina (InsR) y ROS1. Entre estos, ceritinib es más activo contra ALK. Ceritinib inhibió la autofosforilación de ALK, la fosforilación mediada por ALK de la proteína de señalización STAT3 y la proliferación de células cancerosas dependientes de ALK en ensayos in vitro e in vivo.
Ceritinib inhibió la proliferación in vitro de líneas celulares que expresan las proteínas de fusión EML4-ALK y NPM-ALK y demostró una inhibición dependiente de la dosis del crecimiento de xenoinjertos de NSCLC positivo para EML4-ALK en ratones y ratas. Ceritinib exhibió actividad antitumoral dependiente de la dosis en ratones portadores de xenoinjertos de NSCLC positivos para EML4-ALK con resistencia demostrada a crizotinib, a concentraciones dentro de un rango clínicamente relevante.
12.2
Farmacodinámica
Electrofisiología cardíaca
Se encontró que doce de 919 pacientes (1.3%) tratados con ZYKADIA 750 mg una vez al día en condiciones de ayuno con al menos una evaluación de ECG posterior al inicio tenían un QTc > 500 mseg y 58 pacientes (6%) tuvieron un aumento del QTc > 60 mseg desde el inicio. En ASCEND-4, un análisis de tendencia central de los datos de QTc a concentraciones promedio en estado estacionario demostró que el límite superior del IC del 90 % bilateral para QTc fue de 15.3 mseg con ZYKADIA 750 mg una vez al día en condiciones de ayuno. Un análisis farmacocinético/farmacodinámico sugirió una prolongación del intervalo QTc dependiente de la concentración [ver Advertencias y precauciones (5.4)].
Diez de 925 pacientes (1.1%) tuvieron bradicardia definida como < 50 latidos por minuto [ver Advertencias y precauciones (5.6)].
12.3
Farmacocinética
Después de una sola administración oral de ZYKADIA en pacientes, el AUC y la Cmáx aumentaron proporcionalmente a la dosis de 50 mg a 750 mg en condiciones de ayuno.
Después de ZYKADIA 750 mg una vez al día en condiciones de ayuno, se alcanzó el estado estacionario a los 15 días con una razón de acumulación media geométrica de 6.2 después de 3 semanas. La exposición sistémica aumentó de forma mayor que proporcional a la dosis después de dosis repetidas de 50 mg a 750 mg una vez al día en condiciones de ayuno.
Absorción
Después de una sola administración oral de ZYKADIA en pacientes, los niveles plasmáticos máximos (Cmáx) de ceritinib se alcanzaron alrededor de 4 a 6 horas.
Efecto de los alimentos
Un estudio del efecto de los alimentos realizado en sujetos sanos con una dosis única de 500 mg de cápsulas de ZYKADIA mostró que una comida rica en grasas (que contiene aproximadamente 1000 calorías y 58 gramos de grasa) aumentó el AUC de ceritinib en un 73 % y la Cmáx en un 41 % y una comida baja en grasas (que contiene aproximadamente 330 calorías y 9 gramos de grasa) aumentó el AUC de ceritinib en un 58 % y la Cmáx en un 43 % en comparación con las condiciones de ayuno.
Un estudio del efecto de los alimentos realizado en sujetos sanos con una dosis única de 750 mg de comprimidos de ZYKADIA mostró que una comida rica en grasas (que contiene aproximadamente 1000 calorías y 58 gramos de grasa) aumentó el AUC de ceritinib en un 64 % y la Cmáx en un 58 % y una comida baja en grasas (que contiene aproximadamente 330 calorías y 9 gramos de grasa) aumentó el AUC de ceritinib en un 39 % y la Cmáx en un 42 % en comparación con las condiciones de ayuno.
Estudio de optimización de dosis: Régimen de dosificación de 450 mg al día con alimentos
En un estudio de optimización de dosis (ASCEND-8) en pacientes que recibieron una dosis de 450 mg de cápsulas de ZYKADIA al día con alimentos (aproximadamente 100 a 500 calorías y 1.5 a 15 gramos de grasa) o 750 mg al día en ayunas, no hubo diferencias clínicamente significativas en la exposición sistémica en estado estacionario de ceritinib (AUC) entre el grupo de 450 mg con alimentos y el grupo de 750 mg en ayunas.
Distribución
Ceritinib se une en un 97 % a las proteínas plasmáticas humanas, independientemente de la concentración del fármaco. El volumen de distribución aparente medio geométrico (Vd/F) es de 4230 L después de una dosis única de 750 mg de ZYKADIA en condiciones de ayuno en pacientes. Ceritinib también tiene una ligera distribución preferencial a los glóbulos rojos, en relación con el plasma, con una relación sangre-plasma in vitro media de 1.35.
Eliminación
Después de una dosis única de 750 mg de ZYKADIA en condiciones de ayuno, la vida media terminal plasmática aparente media geométrica (t1/2) de ceritinib fue de 41 horas en pacientes. Ceritinib demuestra una FC no lineal a lo largo del tiempo. El aclaramiento aparente medio geométrico (CL/F) de ceritinib fue menor en estado estacionario (33.2 L/h) después de una dosis diaria de 750 mg que después de una dosis única de 750 mg (88.5 L/h).
Metabolismo: Los estudios in vitro demostraron que el CYP3A era la principal enzima implicada en el aclaramiento metabólico de ceritinib. Después de la administración oral de una dosis única de 750 mg radiomarcada en condiciones de ayuno, ceritinib fue el principal componente circulante (82 %) en el plasma humano.
Excreción: Después de la administración oral de una dosis única de 750 mg radiomarcada en condiciones de ayuno, el 92 % de la dosis administrada se recuperó en las heces (con un 68 % como compuesto original sin cambios), mientras que el 1.3 % de la dosis administrada se recuperó en la orina.
Poblaciones específicas
La edad, el sexo, la raza, el peso corporal y la insuficiencia renal leve a moderada (CLcr de 30 a < 90 ml/min estimada con Cockcroft-Gault) no tienen un efecto clínicamente importante sobre la exposición sistémica a ceritinib según los análisis farmacocinéticos poblacionales. Los pacientes con insuficiencia renal grave (CLcr < 30 ml/min) no se incluyeron en el ensayo clínico.
Pacientes con insuficiencia hepática: Después de una dosis única de 750 mg de ZYKADIA en ayunas, la media geométrica de la exposición sistémica (AUC0-INF) de ceritinib aumentó en un 66% y el AUC0-INF de ceritinib no unido aumentó en un 108% en sujetos con insuficiencia hepática grave (Child-Pugh C) en comparación con sujetos con función hepática normal [ver Dosis y administración (2.5)]. La exposición sistémica total y no unida de ceritinib fue similar en sujetos con insuficiencia hepática leve (Child-Pugh A) a moderada (Child-Pugh B) en comparación con sujetos con función hepática normal.
Estudios de interacción farmacológica
Efecto de los inhibidores potentes de CYP3A/P-gp sobre ceritinib: La coadministración de una dosis única de 450 mg de ZYKADIA en ayunas con ketoconazol (un inhibidor potente de CYP3A/P-gp) durante 14 días aumentó el AUC de ceritinib en 2.9 veces y la Cmax en un 22%. Se predijo que el AUC en estado estacionario de ceritinib a una dosis de 450 mg una vez al día en ayunas con ketoconazol durante 14 días sería similar al AUC en estado estacionario de ceritinib a una dosis de 750 mg solo en ayunas.
Efecto de los inductores potentes de CYP3A/P-gp sobre ceritinib: La coadministración de una dosis única de 750 mg de ZYKADIA en ayunas con rifampina (un inductor potente de CYP3A/P-gp) durante 14 días disminuyó el AUC de ceritinib en un 70% y la Cmax en un 44%.
Efecto de ceritinib sobre los sustratos de CYP3A: La coadministración de una dosis única de midazolam (un sustrato sensible de CYP3A) después de 3 semanas de ZYKADIA (750 mg al día en ayunas) aumentó el AUC de midazolam en 5.4 veces y la Cmax en 1.8 veces en comparación con midazolam administrado solo [ver Interacciones medicamentosas (7.2)].
Efecto de ceritinib sobre los sustratos de CYP2C9: La coadministración de una dosis única de warfarina (un sustrato de CYP2C9) después de 3 semanas de ZYKADIA (750 mg al día en ayunas) aumentó el AUC de S-warfarina en un 54% sin cambios en la Cmax en comparación con la warfarina administrada sola [ver Interacciones medicamentosas (7.2)].
Efecto de los agentes reductores de ácido sobre ceritinib: La coadministración de una dosis única de 750 mg de ZYKADIA en ayunas con un inhibidor de la bomba de protones (esomeprazol) durante 6 días en sujetos sanos disminuyó el AUC de ceritinib en un 76% y la Cmax en un 79%; sin embargo, la coadministración de una dosis única de 750 mg de ZYKADIA en ayunas con inhibidores de la bomba de protones durante 6 días en un subgrupo de pacientes de ASCEND-1 sugirió un menor efecto sobre la exposición a ceritinib que el observado en sujetos sanos, ya que el AUC disminuyó en un 30% y la Cmax disminuyó en un 25% y no se observó ningún efecto clínicamente significativo sobre la exposición a ceritinib en estado estacionario.
Efecto de los transportadores sobre la disposición de ceritinib: Ceritinib es un sustrato del transportador de salida P-gp, pero no es un sustrato de BCRP, MRP2, OCT1, OAT2 o OATP1B1 in vitro.
Efecto de ceritinib sobre los transportadores: Según los datos in vitro, es poco probable que ceritinib inhiba P-gp, BCRP, MRP2, OATP1B1, OATP1B3, OAT1, OAT3, OCT1 u OCT2 a concentraciones clínicas.
13 TOXICOLOGÍA NO CLÍNICA
13.1
Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
No se han realizado estudios de carcinogenicidad con ceritinib.
Ceritinib no fue mutagénico in vitro en el ensayo de reversión de mutación bacteriana (Ames), pero indujo aberraciones numéricas (aneugénicas) en el ensayo citogenético in vitro utilizando linfocitos humanos y micronúcleos en la prueba de micronúcleos in vitro utilizando células TK6. Ceritinib no fue clastogénico en el ensayo de micronúcleos in vivo en ratas.
No hay datos sobre el efecto de ceritinib en la fertilidad humana. No se realizaron estudios de fertilidad/desarrollo embrionario temprano con ceritinib. No hubo efectos adversos en los órganos reproductivos masculinos o femeninos en los estudios de toxicología general realizados en monos y ratas con exposiciones ≥ 0,5 y 1,5 veces, respectivamente, de la exposición humana por AUC a la dosis recomendada.
13.2
Toxicología y/o Farmacología Animal
Los órganos diana en modelos animales no clínicos incluyeron, pero no se limitaron a, el páncreas, los conductos biliopancreáticos/biliares, el tracto gastrointestinal y el hígado. Se observó atrofia focal de las células acinares pancreáticas en ratas a 1,5 veces la exposición humana por AUC a la dosis recomendada. Se observó necrosis del conducto biliopancreático y del conducto biliar en ratas con exposiciones ≥ 5% de la exposición humana por AUC a la dosis recomendada. También se observó inflamación y vacuolación de los conductos biliares en monos con exposiciones ≥ 0,5 veces la exposición humana por AUC a la dosis recomendada. Los monos mostraron necrosis y hemorragia mínimas frecuentes del duodeno a 0,5 veces la exposición humana por AUC, y en ratas a una exposición similar a la observada clínicamente.
Ceritinib cruzó la barrera hematoencefálica en ratas con una relación de exposición cerebro-sangre (AUCinf) de aproximadamente el 15%.
14 ESTUDIOS CLÍNICOS
14.1
Cáncer de pulmón de células no pequeñas metastásico (CPNM) ALK-positivo previamente no tratado
La eficacia de ZYKADIA para el tratamiento de pacientes con CPNM ALK-positivo que no habían recibido terapia sistémica previa para la enfermedad metastásica se evaluó en un estudio multicéntrico, abierto, aleatorizado y controlado con activo (ASCEND-4, NCT01828099). Se requirió que los pacientes tuvieran un estado de rendimiento de la Organización Mundial de la Salud (OMS) de 0 a 2 y CPNM ALK-positivo, según lo identificado por el ensayo VENTANA ALK (D5F3) CDx. Se permitió la inscripción de pacientes neurológicamente estables con metástasis en el sistema nervioso central (SNC) que no requirieran dosis crecientes de esteroides para controlar los síntomas del SNC. No eran elegibles los pacientes con diabetes mellitus no controlada; antecedentes de enfermedad pulmonar intersticial (EPI) o neumonitis intersticial; o antecedentes de pancreatitis, o aumento de amilasa o lipasa debido a enfermedad pancreática.
La principal medida de resultado de eficacia fue la supervivencia libre de progresión (SLP), según lo determinado por el Comité de Revisión Independiente Ciega (CRIC) de acuerdo con RECIST v1.1. Las medidas de resultado de eficacia adicionales fueron la supervivencia general (SG), la tasa de respuesta general (TRG) y la duración de la respuesta (DR), determinadas por el CRIC, la tasa de respuesta intracraneal general (TRIG), la duración de la respuesta intracraneal (DRIC), determinada por el neurorradiólogo del CRIC, y los resultados notificados por el paciente.
Los pacientes se asignaron aleatoriamente 1:1 para recibir ZYKADIA 750 mg por vía oral diariamente en ayunas o quimioterapia y quimioterapia de mantenimiento. La aleatorización se estratificó por estado de rendimiento de la OMS, quimioterapia adyuvante/neoadyuvante previa y presencia o ausencia de metástasis cerebrales. Los pacientes aleatorizados a quimioterapia recibieron pemetrexed (500 mg/m2) y la elección del investigador de cisplatino (75 mg/m2) o carboplatino (AUC de 5 – 6 mg*min/mL) administrados el día 1 de cada ciclo de 21 días durante un máximo de 4 ciclos, seguidos de pemetrexed (500 mg/m2) cada 21 días. El tratamiento en ambos brazos continuó hasta la progresión de la enfermedad o la toxicidad inaceptable.
Las características de la población del estudio fueron: 57% mujeres, mediana de edad 54 años (rango, 22 a 81 años), 22% de 65 años o más, 54% blancos, 42% asiáticos, 2% negros y 2% de otras razas. La mayoría de los pacientes tenían adenocarcinoma (97%) y nunca habían fumado (61%). Las metástasis del SNC estaban presentes en el 32% (n = 121) de los pacientes. Aproximadamente la mitad (n = 55) tenía metástasis del SNC medibles, según lo determinado por el neurorradiólogo del CRIC, y el 71% (n = 39) de estos pacientes no recibieron radioterapia intracraneal previa. De los aleatorizados a quimioterapia, el 43% recibió ZYKADIA como la siguiente terapia antineoplásica después de la quimioterapia a base de platino.
Los resultados de eficacia de ASCEND-4 se resumen en la Tabla 7 y la Figura 1.
| Parámetro de eficacia | ZYKADIA (N = 189) |
Quimioterapia (N = 187) |
| Supervivencia libre de progresión | ||
| Número de eventos, n (%) | 89 (47%) | 113 (60%) |
| Enfermedad progresiva, n (%) | 79 (42%) | 105 (56%) |
| Muerte, n (%) | 10 (5%) | 8 (4%) |
| SLP mediana en meses (IC del 95%) | 16.6 (12.6, 27.2) | 8.1 (5.8, 11.1) |
| Razón de riesgos (IC del 95%)a | 0.55 (0.42, 0.73) | |
| Valor pb | < 0.0001 | |
| Tasa de respuesta general | ||
| Tasa de respuesta general, % (IC del 95%)c | 73 (66, 79) | 27 (21, 34) |
| Respuesta completa, % | 1 | 0 |
| Respuesta parcial, % | 72 | 27 |
| Duración de la respuesta | ||
| Número de respondedores | n = 137 | n = 50 |
| Mediana en meses (IC del 95%) | 23.9 (16.6, NE) | 11.1 (7.8, 16.4) |
| Abreviaturas: CRIC, Comité de Revisión Independiente Ciega; IC, intervalo de confianza; NE, no estimable. aModelo de riesgos proporcionales de Cox estratificado por metástasis cerebrales (ausencia frente a presencia), estado de rendimiento de la OMS (0 frente a ≥ 1) y quimioterapia adyuvante previa (ausencia frente a presencia). bPrueba de rango logarítmico estratificada por metástasis cerebrales (ausencia frente a presencia), estado de rendimiento de la OMS (0 frente a ≥ 1) y quimioterapia adyuvante previa (ausencia frente a presencia). cIC binomial exacta del 95% de Clopper y Pearson. |
||
No hubo diferencias significativas en la supervivencia global en un análisis intermedio preespecificado realizado con el 42% de los eventos necesarios para el análisis final.
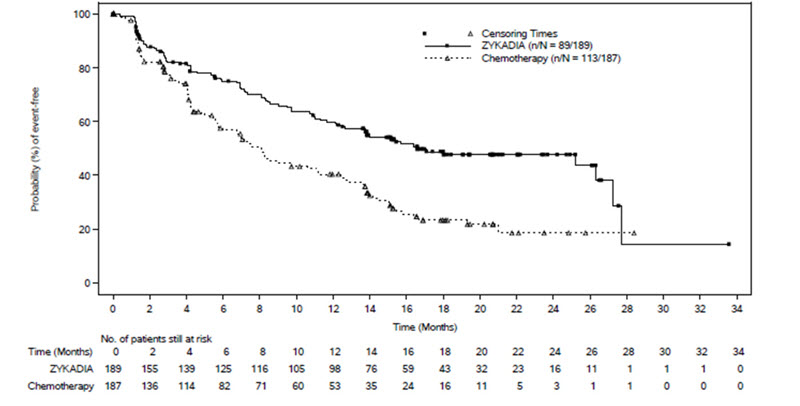
Figura 1: Gráfico de Kaplan-Meier de la supervivencia libre de progresión según la evaluación de BIRC por brazo de tratamiento en ASCEND-4
La actividad antitumoral de ZYKADIA en el cerebro se evaluó en pacientes con enfermedad medible según lo determinado por el neurorradiólogo de BIRC al inicio del estudio (N = 55) de acuerdo con RECIST 1.1.
| Evaluación de la respuesta tumoral intracraneal | ZYKADIA (N = 28) |
Quimioterapia (N = 27) |
| Tasa general de respuesta intracraneal, % (IC del 95%)a |
57% (37, 76) |
22% (9, 42) |
| Respuesta completa, % | 7% | 7% |
| Respuesta parcial, % | 50% | 15% |
| Duración de la respuesta intracraneal | ||
| Número de respondedores | n = 16 | n = 6 |
| Mediana en meses (IC del 95%) | 16.6 (8.1, NE) | NE (1.5, NE) |
| Abreviaturas: BIRC, Comité de Revisión Independiente Ciega; IC, intervalo de confianza; SNC, sistema nervioso central; NE, no estimable. aIC binomial exacta del 95% de Clopper y Pearson. |
||
Los análisis exploratorios de las medidas de resultados informadas por el paciente sugirieron un retraso en el tiempo hasta el desarrollo o el empeoramiento de la disnea en los pacientes tratados con ZYKADIA en comparación con la quimioterapia. El retraso en la aparición o el empeoramiento de la disnea informado por el paciente puede ser una sobreestimación, ya que los pacientes no estaban cegados a la asignación del tratamiento.
14.2
Cáncer de pulmón de células no pequeñas metastásico ALK-positivo previamente tratado
La eficacia de ZYKADIA se evaluó en un ensayo clínico multicéntrico, de un solo brazo y abierto (ASCEND-1, NCT01283516). Se inscribió un total de 163 pacientes con cáncer de pulmón de células no pequeñas metastásico ALK-positivo que progresaron mientras recibían crizotinib o eran intolerantes a éste. La principal medida de resultado de eficacia fue la tasa de respuesta objetiva (TRO) según RECIST v1.0, evaluada tanto por los investigadores como por el BIRC. La duración de la respuesta fue una medida de resultado adicional. Todos los pacientes recibieron ZYKADIA a una dosis de 750 mg una vez al día en ayunas.
Las características de la población del estudio fueron: mediana de edad 52 años, edad menor de 65 años (87%), mujeres (54%), blancos (66%), asiáticos (29%), nunca fumadores o exfumadores (97%), estado funcional ECOG 0 o 1 (87%), progresión con crizotinib previo (91%), número de tratamientos previos 2 o más (84%) e histología de adenocarcinoma (93%). Los sitios de metástasis extratorácicas incluyeron el cerebro (60%), el hígado (42%) y los huesos (42%). La positividad de ALK se verificó retrospectivamente mediante la revisión de los resultados de las pruebas locales para el 99% de los pacientes.
Los resultados de eficacia de ASCEND-1 se resumen en la Tabla 9.
| Parámetro de eficacia | Investigador Evaluación (N = 163) |
BIRC Evaluación (N = 163) |
| Tasa de respuesta general, % (IC del 95%) |
55% (47, 62) |
44% (36, 52) |
| Respuesta completa, % | 1.2% | 2.5% |
| Respuesta parcial, % | 53% | 41% |
| Duración de la respuesta, mediana (meses) (IC del 95%) |
7.4 (5.4, 10.1) |
7.1 (5.6, NE) |
| Abreviaturas: BIRC, Comité de Revisión Independiente Ciega; IC, intervalo de confianza; NE, no estimable. 1Tasa de respuesta general y duración de la respuesta determinadas por RECIST v1.0. |
||
El análisis de la evaluación del BIRC fue similar al análisis de la evaluación del investigador.
16 SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
ZYKADIA cápsulas de 150 mg
Cápsula de gelatina dura con tapa azul opaca y cuerpo blanco opaco; tapa azul opaca marcada con tinta negra con “LDK 150MG”, cuerpo blanco opaco marcado con tinta negra con “NVR”. Disponible en:
Frascos de 70 cápsulas………………………………………………………………………………NDC 0078-0640-70
Conservar a 20°C a 25°C (68°F a 77°F); se permiten excursiones entre 15°C a 30°C (59°F a 86°F) [véase Temperatura ambiente controlada USP].
ZYKADIA comprimidos de 150 mg
Comprimido recubierto con película, azul claro, redondo, biconvexo con bordes biselados, sin ranura, grabado con “NVR” en un lado y “ZY1” en el otro lado. Disponible en:
Frascos de 84 comprimidos………………………………………………………………………NDC 0078-0694-84
Conservar a 20°C a 25°C (68°F a 77°F); se permiten excursiones entre 15°C a 30°C (59°F a 86°F) [véase Temperatura ambiente controlada USP].
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
Aconseje al paciente que lea la información para el paciente aprobada por la FDA (Información para el Paciente).
Reacciones Adversas Gastrointestinales
Informe a los pacientes que la diarrea, náuseas, vómitos y dolor abdominal son las reacciones adversas gastrointestinales reportadas con mayor frecuencia. Informe a los pacientes sobre las opciones de cuidados de apoyo, como medicamentos antieméticos y antidiarreicos. Aconseje a los pacientes que se comuniquen con su proveedor de atención médica si presentan síntomas gastrointestinales graves o intolerables. Informe a los pacientes que si se producen vómitos durante el tratamiento, no deben tomar una dosis adicional, sino que deben continuar con la siguiente dosis programada de ZYKADIA [see Warnings and Precautions (5.1)].
Hepatotoxicidad
Informe a los pacientes sobre los signos y síntomas de hepatotoxicidad. Aconseje a los pacientes que se comuniquen con su proveedor de atención médica de inmediato si presentan signos o síntomas de hepatotoxicidad [see Warnings and Precautions (5.2)].
Enfermedad Pulmonar Intersticial/Neumonitis
Informe a los pacientes sobre los riesgos de ILD/neumonitis grave o mortal. Aconseje a los pacientes que se comuniquen con su proveedor de atención médica de inmediato para informar síntomas respiratorios nuevos o que empeoran [see Warnings and Precautions (5.3)].
Arritmias
Informe a los pacientes sobre los riesgos de la prolongación del intervalo QTc y la bradicardia. Aconseje a los pacientes que se comuniquen con su proveedor de atención médica de inmediato para informar dolor o malestar en el pecho, cambios en los latidos del corazón, palpitaciones, mareos, aturdimiento, desmayos y cambios en el uso o nuevo uso de medicamentos para el corazón o la presión arterial [see Warnings and Precautions (5.4, 5.6)].
Hiperglucemia
Informe a los pacientes sobre los signos y síntomas de hiperglucemia. Aconseje a los pacientes que se comuniquen con su proveedor de atención médica de inmediato si presentan signos o síntomas de hiperglucemia [see Warnings and Precautions (5.5)].
Pancreatitis
Informe a los pacientes sobre los signos y síntomas de la pancreatitis y la necesidad de controlar los niveles de lipasa y amilasa antes de iniciar el tratamiento y periódicamente a partir de entonces, según esté clínicamente indicado [see Warnings and Precautions (5.7)].
Fotosensibilidad
Informe a los pacientes sobre los signos y síntomas de fotosensibilidad. Aconseje a los pacientes que eviten la exposición prolongada al sol y que usen protector solar o ropa protectora durante el tratamiento con ZYKADIA [see Adverse Reactions (6.1)].
Toxicidad Embrio-Fetal
- Aconseje a las mujeres embarazadas y a las mujeres en edad fértil sobre el riesgo potencial para el feto y que informen a su proveedor de atención médica de un embarazo conocido o sospechado [see Warnings and Precautions (5.8), Use in Specific Populations (8.3)].
- Aconseje a las mujeres en edad fértil que utilicen un método anticonceptivo eficaz durante el tratamiento con ZYKADIA y durante 6 meses después de finalizar el tratamiento [see Use in Specific Populations (8.3)].
- Aconseje a los hombres con parejas femeninas en edad fértil que utilicen condones durante el tratamiento con ZYKADIA y durante 3 meses después de finalizar el tratamiento [see Use in Specific Populations (8.3), Nonclinical Toxicology (13.1)].
Lactancia
Aconseje a las mujeres que no amamanten durante el tratamiento con ZYKADIA y durante 2 semanas después de finalizar el tratamiento [see Use in Specific Populations (8.2)].
Interacciones Medicamentosas
Informe a los pacientes que no consuman pomelo ni jugo de pomelo durante el tratamiento con ZYKADIA [see Drug Interactions (7.1)].
Instrucciones de Dosificación
Aconseje a los pacientes que tomen ZYKADIA con alimentos [see Dosage and Administration (2.2)]. Aconseje a los pacientes que tomen la dosis olvidada de ZYKADIA a menos que la siguiente dosis deba tomarse dentro de las 12 horas siguientes [see Dosage and Administration (2.2)].
Distribuido por:
Novartis Pharmaceuticals Corporation
East Hanover, New Jersey 07936
© Novartis
T2021-132
PROSPECTO PARA EL PACIENTE
| Esta información para el paciente ha sido aprobada por la Administración de Alimentos y Medicamentos de los EE. UU. | Revisado: Enero de 2025 | ||||
| INFORMACIÓN PARA EL PACIENTE ZYKADIA® (zai kay dee ah) (ceritinib) cápsulas (ceritinib) comprimidos |
|||||
| Lea este folleto de información para el paciente que viene con ZYKADIA antes de comenzar a tomarlo y cada vez que le recarguen la receta. Puede haber información nueva. Esta información no reemplaza hablar con su proveedor de atención médica sobre su condición médica o tratamiento. | |||||
| ¿Cuál es la información más importante que debo saber sobre ZYKADIA? ZYKADIA puede causar efectos secundarios graves, incluyendo: Problemas estomacales e intestinales (gastrointestinales). ZYKADIA puede causar problemas estomacales e intestinales, incluyendo diarrea, náuseas, vómitos y dolor en el área del estómago. Siga las instrucciones de su proveedor de atención médica sobre cómo tomar medicamentos para ayudar con estos síntomas. Llame a su proveedor de atención médica para obtener asesoramiento si sus síntomas son graves o no se pueden tolerar. Problemas hepáticos. ZYKADIA puede causar daño hepático. Su proveedor de atención médica debe realizar análisis de sangre al menos una vez al mes para controlar su hígado durante el tratamiento con ZYKADIA. Informe a su proveedor de atención médica de inmediato si presenta alguno de los siguientes síntomas: |
|||||
| • se siente cansado | • tiene picazón en la piel | ||||
| • su piel o la parte blanca de sus ojos se ponen amarillas | • tiene náuseas o vómitos | ||||
| • tiene disminución del apetito | • tiene dolor en el lado derecho del área del estómago | ||||
| • su orina se oscurece o se vuelve marrón (color té) | • sangra o se le forman moretones con más facilidad de lo normal | ||||
| Problemas pulmonares (neumonitis). ZYKADIA puede causar inflamación grave o potencialmente mortal de los pulmones durante el tratamiento que puede provocar la muerte. Los síntomas pueden ser similares a los síntomas del cáncer de pulmón. Informe a su proveedor de atención médica de inmediato si tiene algún síntoma nuevo o que empeora, incluyendo: | |||||
| • dificultad para respirar o falta de aliento | • tos con o sin mucosidad | ||||
| • fiebre | • dolor en el pecho | ||||
| Problemas cardíacos. ZYKADIA puede causar latidos cardíacos muy lentos, muy rápidos o anormales. Su proveedor de atención médica puede controlar su corazón durante el tratamiento con ZYKADIA. Informe a su proveedor de atención médica de inmediato si siente dolor o malestar nuevo en el pecho, mareos o aturdimiento, si se desmaya o tiene latidos cardíacos anormales. Informe a su proveedor de atención médica si comienza a tomar o si tiene algún cambio en los medicamentos para el corazón o la presión arterial. Consulte “¿Cuáles son los posibles efectos secundarios de ZYKADIA?” para obtener más información sobre los efectos secundarios. |
|||||
| ¿Qué es ZYKADIA? ZYKADIA es un medicamento recetado que se usa para tratar a personas con cáncer de pulmón de células no pequeñas (CPCNP) que:
No se sabe si ZYKADIA es seguro y eficaz en niños. |
|||||
Antes de tomar ZYKADIA, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si:
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos recetados, medicamentos de venta libre, vitaminas y suplementos herbales. |
|||||
¿Cómo debo tomar ZYKADIA?
|
|||||
¿Qué debo evitar mientras tomo ZYKADIA?
|
|||||
| ¿Cuáles son los posibles efectos secundarios de ZYKADIA? ZYKADIA puede causar efectos secundarios graves, incluyendo:
|
|||||
| • aumento de la sed | • aumento del hambre | • dolores de cabeza | • dificultad para pensar o concentrarse | ||
| • orinar con frecuencia | • visión borrosa | • cansancio | • aliento con olor a fruta | ||
Los efectos secundarios más comunes de ZYKADIA incluyen:
Estos no son todos los posibles efectos secundarios de ZYKADIA. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088. |
|||||
¿Cómo debo guardar ZYKADIA?
Mantenga ZYKADIA y todos los medicamentos fuera del alcance de los niños. |
|||||
| Información general sobre el uso seguro y eficaz de ZYKADIA A veces, los medicamentos se recetan para fines distintos de los que figuran en un prospecto de información para el paciente. No use ZYKADIA para una afección para la que no se lo recetaron. No se lo dé a otras personas, incluso si tienen los mismos síntomas que usted. Podría causarles daño. Puede pedirle a su proveedor de atención médica o farmacéutico más información sobre ZYKADIA que esté escrita para profesionales de la salud. |
|||||
| ¿Cuáles son los ingredientes de ZYKADIA? Ingrediente activo: ceritinib Ingredientes inactivos cápsulas: dióxido de silicio coloidal, cápsulas de gelatina dura, hidroxipropilcelulosa de baja sustitución, estearato de magnesio, celulosa microcristalina y glicolato de almidón sódico. La cápsula contiene FD&C Blue # 2, gelatina y dióxido de titanio. Ingredientes inactivos comprimidos: Núcleo del comprimido: dióxido de silicio coloidal, croscarmelosa sódica, hidroxipropilcelulosa de baja sustitución, estearato de magnesio, celulosa microcristalina y povidona. Recubrimiento del comprimido: laca de aluminio FD&C Blue # 2, hipromelosa, polietilenglicol 4000, talco y dióxido de titanio. Distribuido por: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. Para obtener más información, visite www.zykadia.com o llame al 1-888-669-6682. |
|||||
T2025-01
PANEL DE VISUALIZACIÓN PRINCIPAL
NDC 0078-0694-84
Zykadia®
(ceritinib) tabletas
150 mg
84 Tabletas
Rx only
NOVARTIS


