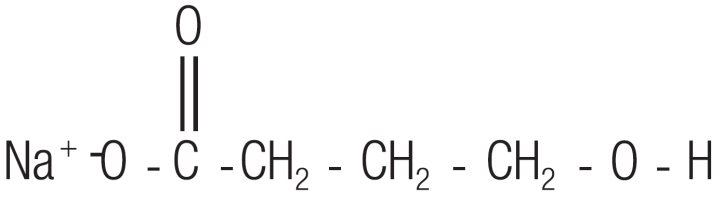Fabricante de medicamentos: Jazz Pharmaceuticals, Inc. (Updated: 2023-04-25)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
XYREM® (oxibato de sodio) solución oral, CIII
Aprobación inicial en EE. UU.: 2002
ADVERTENCIA: DEPRESIÓN DEL SISTEMA NERVIOSO CENTRAL (SNC) Y ABUSO Y USO INDEBIDO.
Consulte la información de prescripción completa para ver la advertencia completa en el recuadro.
Depresión del sistema nervioso central
- •
- Xyrem es un depresor del SNC, y puede ocurrir depresión respiratoria con el uso de Xyrem (5.1, 5.4)
Abuso y uso indebido
- •
- Xyrem es la sal de sodio del gamma-hidroxibutirato (GHB). El abuso o mal uso de GHB ilícito se asocia con reacciones adversas del SNC, que incluyen convulsiones, depresión respiratoria, disminución del conocimiento, coma y muerte (5.2, 9.2)
Xyrem solo está disponible a través de un programa restringido llamado XYWAV y XYREM REMS (5.3)
INDICACIONES Y USO
Xyrem es un depresor del sistema nervioso central indicado para el tratamiento de la cataplejía o la somnolencia diurna excesiva (SDE) en pacientes de 7 años de edad en adelante con narcolepsia (1).
DOSIFICACIÓN Y ADMINISTRACIÓN
Dosificación para pacientes adultos
- •
- Iniciar la dosificación a 4.5 g por noche por vía oral, dividida en dos dosis (2.1).
- •
- Ajustar la dosis al efecto en incrementos de 1.5 g por noche a intervalos semanales (0.75 g al acostarse y 0.75 g tomados de 2.5 a 4 horas después) (2.1).
- •
- Rango de dosis recomendado: 6 g a 9 g por noche por vía oral (2.1).
|
Dosis nocturna total |
Tomar al acostarse |
Tomar de 2.5 a 4 horas después |
|
4.5 g por noche |
2.25 g |
2.25 g |
|
6 g por noche |
3 g |
3 g |
|
7.5 g por noche |
3.75 g |
3.75 g |
|
9 g por noche |
4.5 g |
4.5 g |
Dosage for Pediatric Patients (7 years of Age and Older)
- •
- The recommended starting dosage, titration regimen, and maximum total nightly dosage are based on body weight (2.2).
Información importante sobre la administración
- •
- Prepare ambas dosis antes de acostarse; diluya cada dosis con aproximadamente ¼ de taza de agua en los envases proporcionados por la farmacia (2.3).
- •
- Espere 2 horas después de comer antes de tomar la dosis (2.3).
- •
- Tome cada dosis mientras esté en la cama y acuéstese después de tomarla (2.3).
Patients with Hepatic Impairment
Recommended starting dosage is one-half of the original dosage per night administered orally, divided into two doses (2.4).
DOSAGE FORMS AND STRENGTHS
Oral solution, 0.5 g per mL (3)
CONTRAINDICATIONS
WARNINGS AND PRECAUTIONS
- •
- CNS depression: Use caution when considering the concurrent use of Xyrem with other CNS depressants (5.1).
- •
- Caution patients against hazardous activities requiring complete mental alertness or motor coordination within the first 6 hours of dosing or after first initiating treatment until certain that Xyrem does not affect them adversely (5.1).
- •
- Depression and suicidality: Monitor patients for emergent or increased depression and suicidality (5.5).
- •
- Confusion/Anxiety: Monitor for impaired motor/cognitive function (5.6).
- •
- Parasomnias: Evaluate episodes of sleepwalking (5.7).
- •
- High sodium content in Xyrem: Monitor patients with heart failure, hypertension, or impaired renal function (5.8).
ADVERSE REACTIONS
Most common adverse reactions in adults (≥5% and at least twice the incidence with placebo) were nausea, dizziness, vomiting, somnolence, enuresis, and tremor (6.1).
Most common adverse reactions in pediatric patients (≥5%) were nausea, enuresis, vomiting, headache, weight decreased, decreased appetite, dizziness, and sleepwalking (6.1).
Para reportar SOSPECHAS DE REACCIONES ADVERSAS, comuníquese con Jazz Pharmaceuticals, Inc. al 1-800-520-5568, o con la FDA al 1-800-FDA-1088 o www.fda.gov/Medwatch.
DRUG INTERACTIONS
USE IN SPECIFIC POPULATIONS
See 17 for PATIENT COUNSELING INFORMATION and Medication Guide.
Revised: 4/2023
Tabla de Contenido
FULL PRESCRIBING INFORMATION: CONTENTS*
ADVERTENCIA: DEPRESIÓN DEL SISTEMA NERVIOSO CENTRAL
y ABUSO Y USO INDEBIDO.
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Información de dosificación para adultos
2.2 Información de dosificación pediátrica
2.3 Instrucciones importantes de administración para todos los pacientes
2.4 Modificación de la dosis en pacientes con insuficiencia hepática
2.5 Ajuste de la dosis con la administración conjunta de divalproex sódico
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Depresión del sistema nervioso central
5.2 Abuso y uso indebido
5.3 XYWAV and XYREM REMS
5.4 Depresión respiratoria y trastornos respiratorios del sueño
5.5 Depresión y tendencias suicidas
5.6 Otras reacciones adversas psiquiátricas o de comportamiento
5.7 Parasomnias
5.8 Uso en pacientes sensibles a una alta ingesta de sodio
6 REACCIONES ADVERSAS
6.1 Experiencia en ensayos clínicos
6.2 Experiencia posterior a la comercialización
7 INTERACCIONES CON OTROS MEDICAMENTOS
7.1 Alcohol, hipnóticos sedantes y depresores del SNC
7.2 Divalproex sódico
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso pediátrico
8.5 Uso geriátrico
8.6 Insuficiencia hepática
9 ABUSO Y DEPENDENCIA DE DROGAS
9.1 Sustancia controlada
9.2 Abuso
9.3 Dependencia
10 SOBREDOSIS
10.1 Experiencia en humanos
10.2 Signos y síntomas
10.3 Tratamiento recomendado para la sobredosis
10.4 Centro de control de intoxicaciones
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Cataplejía en la narcolepsia adulta
14.2 Somnolencia diurna excesiva en la narcolepsia adulta
14.3 Cataplejía y somnolencia diurna excesiva en la narcolepsia pediátrica
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANIPULACIÓN
16.1 Cómo se suministra
16.2 Almacenamiento
16.3 Manipulación y eliminación
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
- *
- Las secciones o subsecciones que se omiten de la información de prescripción completa no se enumeran.
ADVERTENCIA RECUADRADA
ADVERTENCIA: DEPRESIÓN DEL SISTEMA NERVIOSO CENTRAL
y ABUSO Y MAL USO.
- •
-
Depresión del sistema nervioso central
Xyrem (oxibato de sodio) es un depresor del SNC. En ensayos clínicos a dosis recomendadas, se produjo obnubilación y depresión respiratoria clínicamente significativa en pacientes adultos tratados con Xyrem [ver Advertencias y precauciones (5.1)]. Muchos pacientes que recibieron Xyrem durante los ensayos clínicos en narcolepsia estaban recibiendo estimulantes del sistema nervioso central [ver Ensayos clínicos (14)].
- •
-
Abuso y mal uso
Xyrem® (oxibato de sodio) es la sal sódica del gamma-hidroxibutirato (GHB). El abuso o mal uso de GHB ilícito, ya sea solo o en combinación con otros depresores del SNC, se asocia con reacciones adversas del SNC, que incluyen convulsiones, depresión respiratoria, disminución del nivel de conciencia, coma y muerte [ver Advertencias y precauciones (5.2)].
Debido a los riesgos de depresión del SNC y abuso y mal uso, Xyrem solo está disponible a través de un programa restringido bajo una Estrategia de Evaluación y Mitigación de Riesgos (REMS) llamada XYWAV y XYREM REMS [ver Advertencias y precauciones (5.3)].
1 INDICACIONES Y USO
Xyrem está indicado para el tratamiento de la cataplejía o la somnolencia diurna excesiva (EDS) en pacientes de 7 años de edad o mayores con narcolepsia.
2 DOSIS Y ADMINISTRACIÓN
2.1 Información sobre la dosificación en adultos
La dosis inicial recomendada es de 4,5 gramos (g) por noche administrada por vía oral, dividida en dos dosis: 2,25 g a la hora de acostarse y 2,25 g tomadas de 2,5 a 4 horas después (ver Tabla 1). Aumente la dosis en 1,5 g por noche a intervalos semanales (0,75 g adicionales a la hora de acostarse y 0,75 g tomadas de 2,5 a 4 horas después) hasta el rango de dosis efectivo de 6 g a 9 g por noche por vía oral. La dosis puede ajustarse gradualmente en función de la eficacia y la tolerabilidad. No se han estudiado dosis superiores a 9 g por noche y no deben administrarse normalmente.
Tabla 1: Régimen de dosis recomendado de Xyrem para adultos (g = gramos)
|
Si la dosis total nocturna de un paciente es: |
Tomar a la hora de acostarse: |
Tomar de 2,5 a 4 horas después: |
|
4,5 g por noche |
2,25 g |
2,25 g |
|
6 g por noche |
3 g |
3 g |
|
7,5 g por noche |
3,75 g |
3,75 g |
|
9 g por noche |
4,5 g |
4,5 g |
2.2 Información sobre la dosificación pediátrica
Xyrem se administra por vía oral dos veces por noche. La dosis pediátrica inicial recomendada, el régimen de titulación y la dosis total máxima por noche se basan en el peso del paciente, como se especifica en la Tabla 2. La dosis puede ajustarse gradualmente en función de la eficacia y la tolerabilidad.
Tabla 2: Dosis recomendada de Xyrem para pacientes pediátricos de 7 años de edad o mayores*
|
Peso del paciente |
Dosis inicial |
Aumento máximo de la dosis semanal |
Dosis máxima recomendada |
|||
|
Tomar a la hora de acostarse: |
Tomar de 2,5 a 4 horas después: |
Tomar a la hora de acostarse: |
Tomar de 2,5 a 4 horas después: |
Tomar a la hora de acostarse: |
Tomar de 2,5 a 4 horas después: |
|
|
<20 kg** |
No hay suficiente información para proporcionar recomendaciones específicas de dosificación para pacientes que pesan menos de 20 kg. |
|||||
|
20 kg a <30 kg |
≤1 g |
≤1 g |
0,5 g |
0,5 g |
3 g |
3 g |
|
30 kg a <45 kg |
≤1,5 g |
≤1,5 g |
0,5 g |
0,5 g |
3,75 g |
3,75 g |
|
≥45 kg |
≤2,25 g |
≤2,25 g |
0,75 g |
0,75 g |
4,5 g |
4,5 g |
* Para pacientes que duermen más de 8 horas por noche, la primera dosis de Xyrem puede administrarse a la hora de acostarse o después de un período inicial de sueño.
** Si Xyrem se usa en pacientes de 7 años de edad o mayores que pesan menos de 20 kg, se debe considerar una dosis inicial más baja, aumentos máximos semanales más bajos y una dosis máxima total nocturna más baja.
Nota: Algunos pacientes pueden lograr mejores respuestas con dosis desiguales a la hora de acostarse y de 2.5 a 4 horas después.
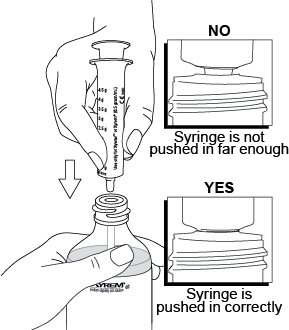
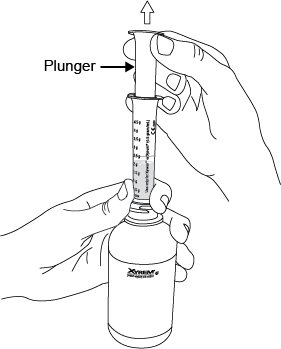
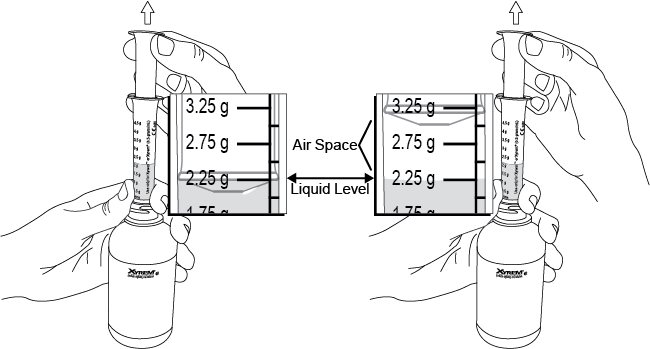
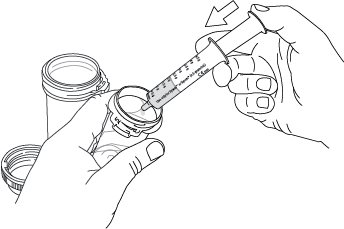
2.3 Instrucciones importantes de administración para todos los pacientes
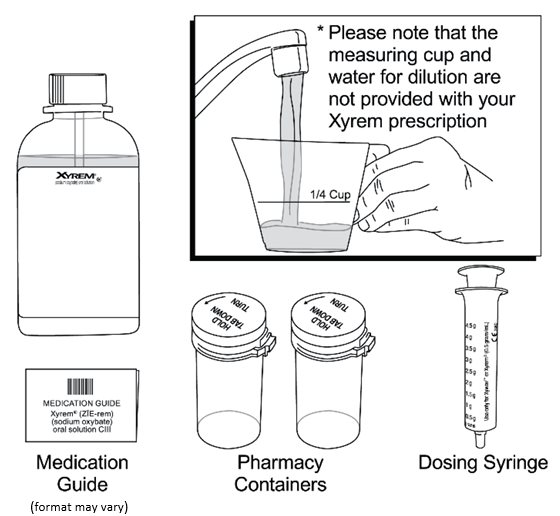
La dosis total nocturna de Xyrem se divide en dos dosis. Prepare ambas dosis de Xyrem antes de acostarse. Antes de la ingestión, cada dosis de Xyrem debe diluirse con aproximadamente ¼ de taza (aproximadamente 60 ml) de agua en los envases de farmacia vacíos proporcionados.
Tome la primera dosis nocturna de Xyrem al menos 2 horas después de comer [ver Farmacología clínica (12.3)]. Tome la segunda dosis nocturna de 2.5 a 4 horas después de la primera dosis.
Los pacientes deben tomar ambas dosis de Xyrem mientras están en la cama y acostarse inmediatamente después de la dosificación, y permanecer en la cama después de la ingestión de cada dosis. Xyrem puede hacer que los pacientes se queden dormidos abruptamente sin sentirse somnolientos primero [ver Reacciones adversas (6.2)]. Los pacientes a menudo se quedarán dormidos dentro de los 5 minutos de tomar Xyrem, y generalmente se quedarán dormidos dentro de los 15 minutos, aunque el tiempo que tarda cualquier paciente individual en quedarse dormido puede variar de una noche a otra. Los pacientes pueden necesitar configurar una alarma para despertarse para la segunda dosis. En raras ocasiones, los pacientes pueden tardar hasta 2 horas en quedarse dormidos.
Si se omite la segunda dosis, esa dosis debe omitirse y Xyrem no debe tomarse nuevamente hasta la noche siguiente. Ambas dosis de Xyrem nunca deben tomarse al mismo tiempo.
2.4 Modificación de la dosis en pacientes con insuficiencia hepática
La dosis inicial recomendada en pacientes con insuficiencia hepática es la mitad de la dosis original por noche, administrada por vía oral dividida en dos dosis [ver Uso en poblaciones específicas (8.6) y Farmacología clínica (12.3)].
2.5 Ajuste de la dosis con la coadministración de divalproex sódico
Al iniciar divalproex sódico en pacientes que toman una dosis estable de Xyrem, se recomienda una reducción de la dosis de Xyrem en al menos un 20% con el uso concomitante inicial [ver Interacciones medicamentosas (7.2) y Farmacología clínica (12.3)]. Al iniciar Xyrem en pacientes que ya toman divalproex sódico, se recomienda una dosis inicial más baja de Xyrem. Posteriormente, la dosis de Xyrem se puede ajustar en función de la respuesta clínica individual y la tolerabilidad.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Xyrem es una solución oral transparente a ligeramente opalescente, en una concentración de 0.5 g por mL (0.5 g/mL de oxibato de sodio equivalente a 0.413 g/mL de oxybate).
4 CONTRAINDICACIONES
Xyrem está contraindicado para su uso en:
- •
- combinación con hipnóticos sedantes [ver Advertencias y precauciones (5.1)].
- •
- combinación con alcohol [ver Advertencias y precauciones (5.1)].
- •
- pacientes con deficiencia de succínico semialdehído deshidrogenasa [ver Farmacología clínica (12.3)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Depresión del Sistema Nervioso Central
Xyrem es un depresor del sistema nervioso central (SNC). En ensayos clínicos en adultos a las dosis recomendadas, se produjo obnubilación y depresión respiratoria clínicamente significativa en pacientes tratados con Xyrem. Xyrem está contraindicado en combinación con alcohol e hipnóticos sedantes. El uso concomitante de Xyrem con otros depresores del SNC, incluidos, entre otros, analgésicos opioides, benzodiazepinas, antidepresivos o antipsicóticos sedantes, fármacos antiepilépticos sedantes, anestésicos generales, relajantes musculares y/o depresores del SNC ilícitos, puede aumentar el riesgo de depresión respiratoria, hipotensión, sedación profunda, síncope y muerte. Si se requiere el uso de estos depresores del SNC en combinación con Xyrem, se debe considerar la reducción de la dosis o la interrupción de uno o más depresores del SNC (incluido Xyrem). Además, si se requiere el uso a corto plazo de un opioide (por ejemplo, postoperatorio o perioperatorio), se debe considerar la interrupción del tratamiento con Xyrem.
Los profesionales de la salud deben advertir a los pacientes sobre el manejo de maquinaria peligrosa, incluidos automóviles o aviones, hasta que estén razonablemente seguros de que Xyrem no los afecta negativamente (por ejemplo, afecta el juicio, el pensamiento o las habilidades motoras). Los pacientes no deben participar en ocupaciones o actividades peligrosas que requieran completa alerta mental o coordinación motora, como operar maquinaria o un vehículo motorizado o volar un avión, durante al menos 6 horas después de tomar Xyrem. Se debe interrogar a los pacientes sobre los eventos relacionados con la depresión del SNC al inicio de la terapia con Xyrem y periódicamente a partir de entonces.
Xyrem solo está disponible a través de un programa restringido bajo un REMS [ver Advertencias y precauciones (5.3)].
5.2 Abuso y Mal uso
Xyrem es una sustancia controlada de la Lista III. El ingrediente activo de Xyrem, el oxibato sódico o gamma-hidroxibutirato (GHB), es una sustancia controlada de la Lista I. El abuso de GHB ilícito, ya sea solo o en combinación con otros depresores del SNC, se asocia con reacciones adversas del SNC, que incluyen convulsiones, depresión respiratoria, disminución del nivel de conciencia, coma y muerte. La aparición rápida de la sedación, junto con las características amnésicas de Xyrem, particularmente cuando se combina con alcohol, ha demostrado ser peligrosa para el usuario voluntario e involuntario (por ejemplo, víctima de agresión). Debido a que se han reportado casos de uso ilícito y abuso de GHB, los médicos deben evaluar cuidadosamente a los pacientes para determinar si tienen antecedentes de abuso de drogas y hacer un seguimiento cercano de estos pacientes, observándolos en busca de signos de mal uso o abuso de GHB (por ejemplo, aumento del tamaño o la frecuencia de la dosificación, comportamiento de búsqueda de drogas, cataplejía fingida) [ver Abuso y dependencia de las drogas (9.2)].
Xyrem solo está disponible a través de un programa restringido bajo un REMS [ver Advertencias y precauciones (5.3)].
5.3 XYWAV y XYREM REMS
Xyrem solo está disponible a través de un programa de distribución restringido llamado XYWAV y XYREM REMS debido a los riesgos de depresión del sistema nervioso central y abuso y mal uso [ver Advertencias y precauciones (5.1, 5.2)].
Los requisitos notables del XYWAV y XYREM REMS incluyen los siguientes:
- •
- Los profesionales de la salud que recetan Xyrem están especialmente certificados
- •
- Xyrem solo será dispensado por la farmacia central que está especialmente certificada
- •
- Xyrem solo se dispensará y enviará a pacientes que estén inscritos en el XYWAV y XYREM REMS con documentación de uso seguro
Se puede obtener más información en www.XYWAVXYREMREMS.com o al 1-866-997-3688.
5.4 Depresión respiratoria y respiración del sueño alterada
Xyrem puede afectar el impulso respiratorio, especialmente en pacientes con función respiratoria comprometida. En sobredosis, se ha reportado depresión respiratoria potencialmente mortal [ver Sobredosis (10)].
En un estudio en adultos que evaluó los efectos depresores respiratorios de Xyrem a dosis de hasta 9 g por noche en 21 pacientes con narcolepsia, no se demostraron cambios relacionados con la dosis en la saturación de oxígeno en el grupo en su conjunto. Uno de los cuatro pacientes con apnea del sueño preexistente de moderada a grave tuvo un empeoramiento significativo del índice de apnea/hipopnea durante el tratamiento.
En un estudio en adultos que evaluó los efectos de Xyrem 9 g por noche en 50 pacientes con apnea obstructiva del sueño, Xyrem no aumentó la gravedad de la respiración del sueño alterada y no afectó negativamente la duración promedio y la gravedad de la desaturación de oxígeno en general. Sin embargo, hubo un aumento significativo en el número de apneas centrales en pacientes que tomaron Xyrem, y se midió una desaturación de oxígeno clínicamente significativa (≤55%) en tres pacientes (6%) después de la administración de Xyrem, con un paciente que se retiró del estudio y dos que continuaron después de instancias únicas breves de desaturación.
Durante la evaluación polisomnográfica (PSG), se observó apnea del sueño central y desaturación de oxígeno en pacientes pediátricos con narcolepsia tratados con Xyrem.
Los médicos deben ser conscientes de que se han observado apneas centrales aumentadas y eventos de desaturación clínicamente relevantes con la administración de Xyrem en pacientes adultos y pediátricos.
En ensayos clínicos en adultos en 128 pacientes con narcolepsia, dos sujetos tuvieron depresión profunda del SNC, que se resolvió después de una intervención respiratoria de apoyo. Otros dos pacientes interrumpieron el oxibato sódico debido a dificultades severas para respirar y un aumento de la apnea obstructiva del sueño. En dos ensayos controlados que evaluaron las medidas de PSG en pacientes adultos con narcolepsia, 40 de 477 pacientes se incluyeron con un índice de apnea/hipopnea basal de 16 a 67 eventos por hora, lo que indica una respiración del sueño alterada de leve a grave. Ninguno de los 40 pacientes tuvo un empeoramiento clínicamente significativo de la función respiratoria, medido por el índice de apnea/hipopnea y la pulsioximetría a dosis de 4,5 g a 9 g por noche.
Los médicos deben ser conscientes de que los trastornos respiratorios relacionados con el sueño tienden a ser más frecuentes en pacientes obesos, en hombres, en mujeres posmenopáusicas que no reciben terapia de reemplazo hormonal y entre pacientes con narcolepsia.
5.5 Depresión y Suicidabilidad
En ensayos clínicos en adultos en pacientes con narcolepsia (n=781), hubo dos suicidios y dos intentos de suicidio en pacientes tratados con Xyrem, incluidos tres pacientes con antecedentes de trastorno psiquiátrico depresivo. De los dos suicidios, un paciente usó Xyrem en combinación con otros medicamentos. Xyrem no estuvo involucrado en el segundo suicidio. Las reacciones adversas de depresión fueron reportadas por el 7% de los 781 pacientes tratados con Xyrem, con cuatro pacientes (<1%) que interrumpieron el tratamiento debido a la depresión. En la mayoría de los casos, no se requirió ningún cambio en el tratamiento con Xyrem.
En un ensayo controlado en adultos, con pacientes aleatorizados a dosis fijas de 3 g, 6 g o 9 g por noche de Xyrem o placebo, hubo un solo evento de depresión a la dosis de 3 g por noche. En otro ensayo controlado en adultos, con pacientes titulados desde una dosis inicial de 4.5 g por noche, las incidencias de depresión fueron 1 (1.7%), 1 (1.5%), 2 (3.2%) y 2 (3.6%) para las dosis de placebo, 4.5 g, 6 g y 9 g por noche, respectivamente.
En el ensayo clínico pediátrico en pacientes con narcolepsia (n=104), un paciente experimentó ideación suicida y dos pacientes reportaron depresión mientras tomaban Xyrem.
La aparición de depresión en pacientes tratados con Xyrem requiere una evaluación cuidadosa e inmediata. Los pacientes con antecedentes de enfermedad depresiva y/o intento de suicidio deben ser monitoreados cuidadosamente para detectar la aparición de síntomas depresivos mientras toman Xyrem.
5.6 Otras Reacciones Adversas Conductuales o Psiquiátricas
Durante los ensayos clínicos en adultos en pacientes con narcolepsia, el 3% de los 781 pacientes tratados con Xyrem experimentaron confusión, con una incidencia que generalmente aumenta con la dosis.
Menos del 1% de los pacientes interrumpieron el medicamento debido a la confusión. La confusión se reportó en todas las dosis recomendadas de 6 g a 9 g por noche. En un ensayo controlado en adultos donde los pacientes fueron aleatorizados a dosis diarias totales fijas de 3 g, 6 g o 9 g por noche o placebo, se demostró una relación dosis-respuesta para la confusión, con el 17% de los pacientes a 9 g por noche experimentando confusión. En todos los casos en ese ensayo controlado, la confusión se resolvió poco después de la interrupción del tratamiento. En el Ensayo 3 donde el oxibato de sodio se tituló desde una dosis inicial de 4.5 g por noche, hubo un solo evento de confusión en un paciente a la dosis de 9 g por noche. En la mayoría de los casos en todos los ensayos clínicos en adultos en pacientes con narcolepsia, la confusión se resolvió poco después de la interrupción de la dosificación o con el tratamiento continuo.
La ansiedad ocurrió en el 5.8% de los 874 pacientes que recibieron Xyrem en ensayos clínicos en adultos en otra población.
Otras reacciones neuropsiquiátricas reportadas en ensayos clínicos en adultos en pacientes con narcolepsia y en el entorno posterior a la comercialización incluyeron alucinaciones, paranoia, psicosis, agresión y agitación.
En el ensayo clínico pediátrico en pacientes con narcolepsia, se reportaron reacciones neuropsiquiátricas, incluida la psicosis aguda, la confusión y la ansiedad, mientras se tomaba Xyrem.
La aparición o el aumento en la ocurrencia de eventos conductuales o psiquiátricos en pacientes adultos y pediátricos que toman Xyrem debe ser monitoreado cuidadosamente.
5.7 Parasomnias
El sonambulismo, definido como un comportamiento confuso que ocurre por la noche y a veces asociado con deambular, se reportó en el 6% de los 781 pacientes con narcolepsia tratados con Xyrem en ensayos clínicos controlados en adultos y estudios abiertos a largo plazo, con <1% de los pacientes que interrumpieron el tratamiento debido al sonambulismo. Las tasas de sonambulismo fueron similares para los pacientes que tomaron placebo y los pacientes que tomaron Xyrem en ensayos clínicos controlados. No está claro si algunos o todos los episodios de sonambulismo reportados corresponden a verdadero sonambulismo, que es una parasomnia que ocurre durante el sueño no REM, o a cualquier otro trastorno médico específico. Se reportaron cinco casos de sonambulismo con posible lesión o lesión significativa durante un ensayo clínico de Xyrem en pacientes con narcolepsia.
Las parasomnias, incluido el sonambulismo, también se han reportado en el ensayo clínico pediátrico y en la experiencia posterior a la comercialización con Xyrem. Por lo tanto, los episodios de sonambulismo deben evaluarse completamente y deben considerarse intervenciones apropiadas.
5.8 Uso en Pacientes Sensibles a la Alta Ingesta de Sodio
Xyrem tiene un alto contenido de sal. En pacientes sensibles a la ingesta de sal (por ejemplo, aquellos con insuficiencia cardíaca, hipertensión o insuficiencia renal), considere la cantidad de ingesta diaria de sodio en cada dosis de Xyrem. La Tabla 3 proporciona el contenido aproximado de sodio por dosis de Xyrem.
Tabla 3
Contenido Aproximado de Sodio por Dosis Nocturna Total de Xyrem (g = gramos)
|
Dosis de Xyrem |
Contenido de Sodio/Exposición Nocturna Total |
|
3 g por noche |
550 mg |
|
4.5 g por noche |
820 mg |
|
6 g por noche |
1100 mg |
|
7.5 g por noche |
1400 mg |
|
9 g por noche |
1640 mg |
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas clínicamente significativas aparecen en otras secciones del etiquetado:
- •
- Depresión del SNC [ver Advertencias y precauciones (5.1)]
- •
- Abuso y mal uso [ver Advertencias y precauciones (5.2)]
- •
- Depresión respiratoria y respiración desordenada durante el sueño [ver Advertencias y precauciones (5.4)]
- •
- Depresión y suicidio [ver Advertencias y precauciones (5.5)]
- •
- Otras reacciones adversas conductuales o psiquiátricas [ver Advertencias y precauciones (5.6)]
- •
- Parasomnias [ver Advertencias y precauciones (5.7)]
- •
- Uso en pacientes sensibles a la ingesta alta de sodio [ver Advertencias y precauciones (5.8)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica clínica.
Pacientes adultos
Xyrem se estudió en tres ensayos clínicos controlados con placebo (Ensayos N1, N3 y N4, descritos en las Secciones 14.1 y 14.2) en 611 pacientes con narcolepsia (398 sujetos tratados con Xyrem y 213 con placebo). Un total de 781 pacientes con narcolepsia fueron tratados con Xyrem en ensayos clínicos controlados y no controlados.
La sección 6.1 y la tabla 4 presentan reacciones adversas de tres ensayos controlados agrupados (N1, N3, N4) en pacientes con narcolepsia.
Reacciones adversas que llevaron a la interrupción del tratamiento:
De los 398 pacientes con narcolepsia tratados con Xyrem, el 10.3% de los pacientes interrumpieron el tratamiento debido a reacciones adversas en comparación con el 2.8% de los pacientes que recibieron placebo. La reacción adversa más común que llevó a la interrupción del tratamiento fue la náusea (2.8%). La mayoría de las reacciones adversas que llevaron a la interrupción del tratamiento comenzaron durante las primeras semanas de tratamiento.
Reacciones adversas comúnmente observadas en ensayos clínicos controlados:
Las reacciones adversas más comunes (incidencia ≥5% y dos veces la tasa observada con placebo) en pacientes tratados con Xyrem fueron náuseas, mareos, vómitos, somnolencia, enuresis y temblores.
Reacciones adversas que ocurren con una incidencia del 2% o más:
La tabla 4 enumera las reacciones adversas que ocurrieron con una frecuencia del 2% o más en cualquier grupo de tratamiento para tres ensayos controlados y fueron más frecuentes en cualquier grupo de tratamiento con Xyrem que con placebo. Las reacciones adversas se resumen por dosis al inicio. Casi todos los pacientes en estos estudios iniciaron el tratamiento a 4.5 g por noche. En los pacientes que permanecieron en tratamiento, las reacciones adversas tendieron a ocurrir al principio y a disminuir con el tiempo.
Tabla 4
Reacciones adversas que ocurren en ≥2% de los pacientes adultos y con mayor frecuencia con Xyrem que con placebo en tres ensayos controlados (N1, N3, N4) por sistema corporal y dosis al inicio
| Reacción adversa | Placebo (n=213) % |
Xyrem 4.5g (n=185) % |
Xyrem 6g (n=258) % |
Xyrem 9g (n=178) % |
|---|---|---|---|---|
|
CUALQUIER REACCIÓN ADVERSA |
62 |
45 |
55 |
70 |
|
TRAStORNOS GASTROINTESTINALES |
||||
|
Náuseas |
3 |
8 |
13 |
20 |
|
Vómitos |
1 |
2 |
4 |
11 |
|
Diarrea |
2 |
4 |
3 |
4 |
|
Dolor abdominal superior |
2 |
3 |
1 |
2 |
|
Sequedad de boca |
2 |
1 |
2 |
1 |
|
TRAstornos generales y condiciones del sitio de administración |
||||
|
Dolor |
1 |
1 |
<1 |
3 |
|
Sensación de embriaguez |
1 |
0 |
<1 |
3 |
|
Edema periférico |
1 |
3 |
0 |
0 |
|
TRAstornos musculoesqueléticos y del tejido conjuntivo |
||||
|
Cataplexia |
1 |
1 |
1 |
2 |
|
Espasmos musculares |
2 |
2 |
<1 |
2 |
|
Dolor en la extremidad |
1 |
3 |
1 |
1 |
|
TRAstornos del sistema nervioso |
||||
|
Mareo |
4 |
9 |
11 |
15 |
|
Somnolencia |
4 |
1 |
3 |
8 |
|
Temblor |
0 |
0 |
2 |
5 |
|
Trastorno de la atención |
0 |
1 |
0 |
4 |
|
Parestesia |
1 |
2 |
1 |
3 |
|
Parálisis del sueño |
1 |
0 |
1 |
3 |
|
TRAstornos psiquiátricos |
||||
|
Desorientación |
1 |
1 |
2 |
3 |
|
Irritabilidad |
1 |
0 |
<1 |
3 |
|
Sonambulismo |
0 |
0 |
0 |
3 |
|
Ansiedad |
1 |
1 |
1 |
2 |
|
TRAstornos renales y urinarios |
||||
|
Enuresis |
1 |
3 |
3 |
7 |
|
TRAstornos de la piel y del tejido subcutáneo |
||||
|
Hiperhidrosis |
0 |
1 |
1 |
3 |
Información de relación dosis-respuesta
En los ensayos clínicos en narcolepsia, se observó una relación dosis-respuesta para náuseas, vómitos, parestesia, desorientación, irritabilidad, trastorno de la atención, sensación de embriaguez, sonambulismo y enuresis. La incidencia de todas estas reacciones fue notablemente mayor a 9 g por noche.
En los ensayos controlados en narcolepsia, las interrupciones del tratamiento debido a reacciones adversas fueron mayores a dosis más altas de Xyrem.
Pacientes pediátricos (de 7 años de edad o más)
En el ensayo clínico pediátrico (Ensayo N5), 104 pacientes de 7 a 17 años (37 pacientes de 7 a 11 años; 67 pacientes de 12 a 17 años) con narcolepsia recibieron Xyrem durante un máximo de un año. Este estudio incluyó un período de continuación de seguridad de etiqueta abierta en el que los pacientes elegibles recibieron Xyrem durante un máximo de 2 años adicionales. La exposición media y máxima en todo el estudio fue de 371 y 987 días, respectivamente.
Reacciones adversas que llevaron a la interrupción del tratamiento
En el ensayo clínico pediátrico, 7 de 104 pacientes informaron reacciones adversas que llevaron a la retirada del estudio (alucinación, táctil; ideación suicida; disminución del peso; síndrome de apnea del sueño; labilidad afectiva; ira, ansiedad, depresión; y dolor de cabeza).
Reacciones adversas en el ensayo clínico pediátrico
Las reacciones adversas más comunes (≥5%) fueron náuseas (20%), enuresis (19%), vómitos (18%), dolor de cabeza (17%), disminución del peso (13%), disminución del apetito (9%), mareos (8%) y sonambulismo (6%).
Información adicional sobre la seguridad en pacientes pediátricos aparece en las siguientes secciones:
- •
- Depresión respiratoria y respiración alterada durante el sueño [ver Advertencias y precauciones (5.4)]
- •
- Depresión y suicidio [ver Advertencias y precauciones (5.5)]
- •
- Otras reacciones adversas conductuales o psiquiátricas [ver Advertencias y precauciones (5.6)]
- •
- Parasomnias [ver Advertencias y precauciones (5.7)]
El perfil general de reacciones adversas de Xyrem en el ensayo clínico pediátrico fue similar al observado en el programa de ensayos clínicos en adultos.
6.2 Experiencia postcomercialización
Las siguientes reacciones adversas se han identificado durante el uso posterior a la aprobación de Xyrem. Debido a que estas reacciones se informan voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco:
- artralgia, disminución del apetito, caída*, retención de líquidos, resaca, dolor de cabeza, hipersensibilidad, hipertensión, deterioro de la memoria, nicturia, ataque de pánico, visión borrosa y disminución del peso.
-
* La aparición repentina de sueño en pacientes que toman oxibato de sodio, incluso en posición de pie o al levantarse de la cama, ha provocado caídas complicadas por lesiones, en algunos casos que requieren hospitalización.
7 INTERACCIONES MEDICAMENTOSAS
7.1 Alcohol, Hipnóticos sedantes y depresores del SNC
Xyrem está contraindicado para su uso en combinación con alcohol o hipnóticos sedantes. El uso de otros depresores del SNC puede potenciar los efectos depresores del SNC de Xyrem [ver Advertencias y Precauciones (5.1)].
7.2 Divalproex sódico
El uso concomitante de Xyrem con divalproex sódico da como resultado un aumento en la exposición sistémica a GHB, lo que demostró causar un mayor deterioro en algunas pruebas de atención y memoria de trabajo en un estudio clínico [ver Farmacología Clínica (12.3)]. Se recomienda una reducción inicial de la dosis de Xyrem cuando se usa concomitantemente con divalproex sódico [ver Dosificación y Administración (2.5)]. Se aconseja a los prescriptores monitorear la respuesta del paciente de cerca y ajustar la dosis en consecuencia si se justifica el uso concomitante de Xyrem y divalproex sódico.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgos
No hay datos adecuados sobre el riesgo de desarrollo asociado con el uso de oxibato de sodio en mujeres embarazadas. La administración oral de oxibato de sodio a ratas embarazadas (150, 350 o 1,000 mg/kg/día) o conejos (300, 600 o 1,200 mg/kg/día) durante todo el período de organogénesis no produjo evidencia clara de toxicidad para el desarrollo; sin embargo, la administración oral a ratas durante todo el embarazo y la lactancia resultó en un aumento de las muertes fetales y una disminución de la viabilidad y el crecimiento postnatal de las crías, a una dosis clínicamente relevante [ver Datos].
En la población general de los EE. UU., el riesgo de fondo estimado de defectos de nacimiento mayores y aborto espontáneo en embarazos clínicamente reconocidos es del 2-4% y del 15-20%, respectivamente. El riesgo de fondo de defectos de nacimiento mayores y aborto espontáneo para la población indicada es desconocido.
Consideraciones Clínicas
Trabajo de parto o parto
Xyrem no se ha estudiado en el trabajo de parto o el parto. En la anestesia obstétrica utilizando una formulación inyectable de oxibato de sodio, los recién nacidos tuvieron medidas cardiovasculares y respiratorias estables, pero estaban muy somnolientos, lo que provocó una ligera disminución en las puntuaciones de Apgar. Hubo una caída en la tasa de contracciones uterinas 20 minutos después de la inyección. La transferencia placentaria es rápida y el gamma-hidroxibutirato (GHB) se ha detectado en recién nacidos al nacer después de la administración intravenosa de GHB a las madres. Los efectos posteriores del oxibato de sodio sobre el crecimiento, el desarrollo y la maduración posteriores en humanos son desconocidos.
Datos
Datos de animales
La administración oral de oxibato de sodio a ratas embarazadas (150, 350 o 1,000 mg/kg/día) o conejos (300, 600 o 1,200 mg/kg/día) durante todo el período de organogénesis no produjo evidencia clara de toxicidad para el desarrollo. Las dosis más altas probadas en ratas y conejos fueron aproximadamente 1 y 3 veces, respectivamente, la dosis humana máxima recomendada (MRHD) de 9 g por noche sobre una base de superficie corporal (mg/m2).
La administración oral de oxibato de sodio (150, 350 o 1,000 mg/kg/día) a ratas durante todo el embarazo y la lactancia resultó en un aumento de las muertes fetales y una disminución de la viabilidad postnatal de las crías y el aumento de peso corporal a la dosis más alta probada. La dosis sin efecto para la toxicidad del desarrollo pre y postnatal en ratas es menor que la MRHD sobre una base de mg/m2.
8.2 Lactancia
Resumen de Riesgos
El GHB se excreta en la leche materna después de la administración oral de oxibato de sodio. No hay suficiente información sobre el riesgo para un lactante amamantado, y no hay suficiente información sobre la producción de leche en las madres lactantes. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de Xyrem y cualquier posible efecto adverso en el lactante amamantado por Xyrem o por la condición materna subyacente.
8.4 Uso Pediátrico
La seguridad y eficacia de Xyrem en el tratamiento de la cataplejía o la somnolencia diurna excesiva en pacientes pediátricos (de 7 años de edad o más) con narcolepsia se han establecido en un estudio doble ciego, controlado con placebo y de retirada aleatorizada [ver Reacciones adversas (6.1) y Estudios clínicos (14.3)].
En el ensayo clínico pediátrico con administración de Xyrem en pacientes con narcolepsia, se han reportado reacciones adversas graves de apnea central del sueño y desaturación de oxígeno documentadas mediante evaluación polisomnográfica; depresión; ideación suicida; reacciones neuropsiquiátricas que incluyen psicosis aguda, confusión y ansiedad; y parasomnias, incluyendo sonambulismo [ver Advertencias y precauciones (5.4, 5.5, 5.6, 5.7) y Reacciones adversas (6.1)].
La seguridad y eficacia de Xyrem en pacientes pediátricos menores de 7 años no se han establecido.
Datos de toxicidad en animales juveniles
En un estudio en el que se administró oxibato de sodio (0, 100, 300 o 900 mg/kg/día) por vía oral a ratas durante el período juvenil de desarrollo (días 21 a 90 posnatales), se observó mortalidad a las dos dosis más altas probadas. Las muertes ocurrieron durante la primera semana de dosificación y se asociaron con signos clínicos (incluida la disminución de la actividad y la frecuencia respiratoria) consistentes con los efectos farmacológicos del fármaco. Se observó una reducción del aumento de peso corporal en machos y hembras y un retraso en la maduración sexual en machos a la dosis más alta probada. La dosis sin efecto para los efectos adversos en ratas juveniles se asocia con exposiciones plasmáticas (AUC) menores que las de la dosis humana máxima recomendada (9 g/noche).
8.5 Uso Geriátrico
Los estudios clínicos de Xyrem en pacientes con narcolepsia no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. En ensayos controlados en otra población, 39 (5%) de 874 pacientes tenían 65 años o más. Las interrupciones del tratamiento debido a reacciones adversas aumentaron en los ancianos en comparación con los adultos más jóvenes (21% vs. 19%). La frecuencia de los dolores de cabeza aumentó marcadamente en los ancianos (39% vs. 19%). Las reacciones adversas más comunes fueron similares en ambas categorías de edad. En general, la selección de la dosis para un paciente anciano debe ser cautelosa, comenzando generalmente en el extremo inferior del rango de dosificación, lo que refleja la mayor frecuencia de disminución de la función hepática, renal o cardíaca, y de enfermedades concomitantes u otra terapia farmacológica.
8.6 Insuficiencia Hepática
Debido a un aumento en la exposición a Xyrem, la dosis inicial debe reducirse a la mitad en pacientes con insuficiencia hepática [ver Dosificación y administración (2.4) y Farmacología clínica (12.3)].
9 ABUSO DE DROGAS Y DEPENDENCIA
9.1 Sustancia Controlada
Xyrem es una sustancia controlada de la Lista III bajo la Ley Federal de Sustancias Controladas. El uso no médico de Xyrem podría conllevar sanciones evaluadas bajo los controles de la Lista I más estrictos.
9.2 Abuso
Xyrem (oxibato sódico), la sal sódica del GHB, produce efectos en el sistema nervioso central dependientes de la dosis, incluidos efectos hipnóticos y de refuerzo subjetivo positivos. El inicio del efecto es rápido, lo que aumenta su potencial de abuso o mal uso.
El abuso de drogas es el uso intencional no terapéutico de un producto o sustancia farmacéutica, incluso una sola vez, por sus efectos psicológicos o fisiológicos deseables. El mal uso es el uso intencional, con fines terapéuticos, de un fármaco por un individuo de una manera diferente a la prescrita por un profesional sanitario o para quien no fue prescrito. El mal uso y el abuso de drogas pueden ocurrir con o sin progresión a la adicción. La adicción a las drogas es un conjunto de fenómenos conductuales, cognitivos y fisiológicos que pueden incluir un fuerte deseo de tomar la droga, dificultades para controlar el consumo de drogas (por ejemplo, continuar consumiendo drogas a pesar de las consecuencias dañinas, dar una prioridad más alta al consumo de drogas que a otras actividades y obligaciones), y posible tolerancia o dependencia física.
El inicio rápido de la sedación, junto con las características amnésicas del GHB, particularmente cuando se combina con alcohol, ha demostrado ser peligroso para el usuario voluntario e involuntario (por ejemplo, víctima de agresión).
El GHB ilícito se abusa en entornos sociales principalmente por adultos jóvenes. Algunas de las dosis que se estima que se abusan están en un rango de dosificación similar al que se utiliza para el tratamiento de pacientes con cataplejía. El GHB tiene algunas similitudes con el etanol en un rango de dosis limitado, y también se ha informado de cierta tolerancia cruzada con el etanol. Se han notificado casos de dependencia grave y deseo intenso de GHB cuando el fármaco se toma durante todo el día. Los patrones de abuso que indican dependencia incluyen: 1) el uso de dosis cada vez más grandes, 2) aumento de la frecuencia de uso, y 3) uso continuado a pesar de las consecuencias adversas.
Debido a que se ha informado de uso ilícito y abuso de GHB, los médicos deben evaluar cuidadosamente a los pacientes para detectar antecedentes de abuso de drogas y seguir de cerca a estos pacientes, observándolos en busca de signos de mal uso o abuso de GHB (por ejemplo, aumento del tamaño o la frecuencia de la dosificación, comportamiento de búsqueda de drogas, cataplejía fingida). Deseche Xyrem de acuerdo con las regulaciones estatales y federales. Es seguro desechar Xyrem por el desagüe sanitario.
9.3 Dependencia
La dependencia física es un estado que se desarrolla como resultado de la adaptación fisiológica en respuesta al uso repetido de drogas, que se manifiesta por signos y síntomas de abstinencia después de la interrupción abrupta o una reducción significativa de la dosis de un fármaco. Ha habido informes de casos de abstinencia, que van de leves a graves, después de la interrupción del uso ilícito de GHB en dosis repetidas frecuentes (18 g a 250 g por día) en exceso del rango de dosificación recomendado. Los signos y síntomas de abstinencia de GHB después de la interrupción abrupta incluyeron insomnio, inquietud, ansiedad, psicosis, letargo, náuseas, temblores, sudoración, calambres musculares, taquicardia, dolor de cabeza, mareos, fatiga y somnolencia de rebote, confusión y, particularmente en el caso de la abstinencia grave, alucinaciones visuales, agitación y delirio. Estos síntomas generalmente disminuyeron en 3 a 14 días. En casos de abstinencia grave, puede ser necesaria la hospitalización. Los efectos de la interrupción de Xyrem no se han evaluado sistemáticamente en ensayos clínicos controlados. En la experiencia de los ensayos clínicos con Xyrem en pacientes con narcolepsia/cataplejía a las dosis recomendadas, dos pacientes informaron ansiedad y uno informó insomnio después de la interrupción abrupta al final del ensayo clínico; en los dos pacientes con ansiedad, la frecuencia de la cataplejía había aumentado marcadamente al mismo tiempo.
Tolerancia
La tolerancia es un estado fisiológico caracterizado por una respuesta reducida a un fármaco después de la administración repetida (es decir, se requiere una dosis más alta de un fármaco para producir el mismo efecto que se obtuvo una vez con una dosis más baja). La tolerancia a Xyrem no se ha estudiado sistemáticamente en ensayos clínicos controlados. Ha habido algunos informes de casos de síntomas de tolerancia que se desarrollan después del uso ilícito en dosis muy superiores al régimen de dosificación recomendado de Xyrem. Los estudios clínicos de oxibato sódico en el tratamiento de la abstinencia alcohólica sugieren una posible tolerancia cruzada con el alcohol. La seguridad y eficacia de Xyrem en el tratamiento de la abstinencia alcohólica no se han establecido.
10 SOBREDOSIS
10.1 Experiencia humana
La información sobre sobredosis con Xyrem se deriva en gran medida de informes en la literatura médica que describen síntomas y signos en personas que han ingerido GHB ilícitamente. En estas circunstancias, la coingestión de otras drogas y alcohol era común y pudo haber influido en la presentación y gravedad de las manifestaciones clínicas de la sobredosis.
En los ensayos clínicos en adultos se informaron dos casos de sobredosis con Xyrem. En el primer caso, una dosis estimada de 150 g, más de 15 veces la dosis máxima recomendada, causó que un paciente estuviera sin respuesta con breves períodos de apnea y fuera incontinente de orina y heces. Esta persona se recuperó sin secuelas. En el segundo caso, se informó de un fallecimiento después de una sobredosis múltiple de drogas que consistía en Xyrem y numerosas otras drogas.
10.2 Signos y síntomas
La información sobre los signos y síntomas asociados con la sobredosis de Xyrem se deriva de informes sobre el uso ilícito de GHB. La presentación del paciente después de una sobredosis está influenciada por la dosis ingerida, el tiempo transcurrido desde la ingestión, la coingestión de otras drogas y alcohol, y el estado de alimentación (alimentado o en ayunas). Los pacientes han mostrado diferentes grados de depresión de la conciencia que pueden fluctuar rápidamente entre un estado confusional, agitado y combativo con ataxia y coma. Se ha observado vómitos (incluso cuando está obnubilado), diaforesis, dolor de cabeza y habilidades psicomotoras deterioradas. No se han descrito cambios pupilares típicos para ayudar en el diagnóstico; la reactividad pupilar a la luz se mantiene. Se ha informado de visión borrosa. Se ha observado un aumento en la profundidad del coma y acidosis a dosis más altas. Se han informado mioclonías y convulsiones tónico-clónicas. La respiración puede no verse afectada o puede comprometerse en cuanto a ritmo y profundidad. Se ha observado respiración de Cheyne-Stokes y apnea. La bradicardia y la hipotermia pueden acompañar la inconsciencia, así como la hipotonía muscular, pero los reflejos tendinosos permanecen intactos.
10.3 Tratamiento recomendado de la sobredosis
Se debe instituir de inmediato un cuidado sintomático y de apoyo general, y se puede considerar la descontaminación gástrica si se sospecha la coingestión de otras sustancias. Debido a que los vómitos pueden ocurrir en presencia de obnubilación, puede ser necesario adoptar una postura adecuada (posición lateral izquierda) y proteger las vías respiratorias mediante intubación. Aunque el reflejo nauseoso puede estar ausente en pacientes profundamente comatosos, incluso los pacientes inconscientes pueden volverse combativos ante la intubación, por lo que se debe considerar la inducción rápida de secuencia (sin el uso de sedantes). Se deben controlar de cerca los signos vitales y la conciencia. La bradicardia informada con sobredosis de GHB ha respondido a la administración intravenosa de atropina. No se puede esperar una reversión de los efectos depresores centrales de Xyrem mediante la administración de naloxona o flumazenilo. El uso de hemodiálisis y otras formas de eliminación extracorpórea del fármaco no se ha estudiado en casos de sobredosis de GHB, pero se ha informado en casos de acidosis asociada con ingestas de GHB de 125 g o más; sin embargo, debido al metabolismo rápido del oxibato de sodio, estas medidas pueden no ser necesarias.
10.4 Centro de Control de Envenenamientos
Al igual que en el manejo de todos los casos de sobredosis de medicamentos, se debe considerar la posibilidad de ingestión de múltiples fármacos. Se recomienda al proveedor de atención médica que recoja muestras de orina y sangre para un análisis toxicológico de rutina y que consulte con un centro regional de control de envenenamientos (1-800-222-1222) para obtener recomendaciones de tratamiento actuales.
11 DESCRIPCIÓN
El oxibato sódico, un depresor del SNC, es el ingrediente activo de Xyrem. El nombre químico del oxibato sódico es 4-hidroxibutirato sódico. La fórmula molecular es C4H7NaO3, y el peso molecular es de 126,09 g/mol. La estructura química es:
El oxibato sódico es un polvo blanco a blanquecino, cristalino que es muy soluble en soluciones acuosas. Cada mL de Xyrem contiene 0,5 g de oxibato sódico (equivalente a 0,413 g/mL de oxibato) en Agua Purificada USP, neutralizada a un pH de 7,5 con ácido málico.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Xyrem es un depresor del SNC. El mecanismo de acción de Xyrem en el tratamiento de la narcolepsia es desconocido. El oxibato sódico es la sal sodada del ácido gamma-hidroxibutírico (GHB), un compuesto endógeno y metabolito del neurotransmisor GABA. Se plantea que los efectos terapéuticos de Xyrem en la cataplejia y la somnolencia diurna excesiva se median a través de las acciones de GABAB en neuronas noradrenérgicas y dopaminérgicas, así como en neuronas talámicas y corticoespinales.
12.2 Farmacocinética
La farmacocinética del GHB es no lineal y es similar después de tomas individuales o repetidas de Xyrem.
Absorción
Después de la administración oral de Xyrem, el GHB se absorbe rápidamente en el rango clínico de dosis, con una biodisponibilidad absoluta de aproximadamente un 88%. Las concentraciones plasmáticas medias en pico (Cmax) tras la administración de cada una de las dos dosis de 2.25 g dadas en condiciones de ayuno con un intervalo de 4 horas fueron similares. El tiempo medio al punto plasmático pico (Tmax) osciló entre 0.5 y 1.25 horas. Después de la administración oral de Xyrem, los niveles plasmáticos de GHB aumentaron más que proporcionalmente a la dosis, con un aumento de 3.7‐veces en los niveles sanguíneos cuando la dosis diaria total se duplica de 4.5 g a 9 g. No se han estudiado dosis únicas superiores a 4.5 g.
Efecto de los alimentos
La administración de Xyrem inmediatamente después de una comida alta en grasa resultó en una absorción retardada (Tmax promedio aumentado de 0.75 hr a 2 hr) y una reducción en Cmax del GHB en un promedio del 59% y de la exposición sistémica (AUC) en un 37%.
Distribución
El GHB es un compuesto hidrofílico con un volumen aparente de distribución promediando 190 mL/kg a 384 mL/kg. En concentraciones de GHB que varían de 3 mcg/mL a 300 mcg/mL, menos del 1% se une a las proteínas plasmáticas.
Eliminación
Metabolismo
Estudios en animales indican que el metabolismo es la vía principal de eliminación del GHB, produciendo dióxido de carbono y agua a través del ciclo tricarboxílico (ciclo de Krebs) y secundariamente por beta-oxidación. La vía principal implica una enzima ligada a NADP+ citosólica, el dehidrogenasa de GHB, que cataliza la conversión de GHB a semialdehído succínico, que luego se biotransforma en ácido succínico por la enzima semialdehído succínico deshidrogenasa. El ácido succínico entra en el ciclo de Krebs donde se metaboliza a dióxido de carbono y agua. Una segunda enzima oxidorreductasa mitocondrial, una transhidrogenasa, también cataliza la conversión al semialdehído succínico en presencia de α-cetoglutarato. Una vía alternativa de biotransformación implica β-oxidación a través del 3,4-dihidroxibutirato a dióxido de carbono y agua. No se han identificado metabolitos activos.
Excreción
La depuración del GHB se realiza casi exclusivamente por biotransformación a dióxido de carbono, que luego se elimina por espiración. En promedio, menos del 5% de la droga sin cambiar aparece en la orina humana en un plazo de 6 a 8 horas después de la dosificación. La excreción fecal es insignificante. El GHB tiene una vida media de eliminación de 0.5 a 1 hora.
Poblaciones específicas
Pacientes geriátricos
Existe una experiencia limitada con Xyrem en ancianos. Los resultados de un estudio de farmacocinética (n=20) en otra población estudiada indican que las características farmacocinéticas del GHB son consistentes entre adultos más jóvenes (edad 48 a 64 años) y adultos mayores (edad 65 a 75 años).
Pacientes pediátricos
La farmacocinética del oxibato sódico se evaluó en pacientes pediátricos de 7 a 17 años de edad (n=29). Las características farmacocinéticas del oxibato sódico se mostraron similares en adultos y pacientes pediátricos. Se descubrió que el peso corporal era el factor intrínseco principal que afectaba la farmacocinética del oxibato.
Pacientes masculinos y femeninos
En un estudio de 18 mujeres y 18 hombres voluntarios adultos sanos, no se detectaron diferencias por género en la farmacocinética del GHB después de una dosis oral única de 4.5 g de Xyrem.
Grupos raciales o étnicos
No hay suficientes datos para evaluar las diferencias farmacocinéticas entre las razas.
Pacientes con insuficiencia renal
No se ha realizado ningún estudio farmacocinético en pacientes con insuficiencia renal.
Pacientes con insuficiencia hepática
La farmacocinética del GHB en 16 pacientes cirróticos, la mitad sin ascitis (Clase A de Child) y la mitad con ascitis (Clase C de Child), se comparó con la cinética en 8 sujetos con función hepática normal después de una dosis oral única de 25 mg/kg de Xyrem. Los valores de AUC se duplicaron en los pacientes cirróticos, con una depuración oral aparente reducida de 9.1 mL/min/kg en adultos sanos a 4.5 y 4.1 mL/min/kg en pacientes de Clase A y Clase C, respectivamente. La vida media de eliminación fue significativamente más larga en pacientes de Clase C y Clase A que en pacientes de control (t1/2 promedio de 59 y 32 minutos, respectivamente, en comparación con 22 minutos). La dosis inicial de Xyrem debería reducirse en pacientes con insuficiencia hepática [ver Dosificación y Administración (2.4) y Uso en Poblaciones Específicas (8.6)].
Estudios de interacciones de fármacos
Los estudios in vitro con microsomas hepáticos humanos en pool indican que el oxibato sódico no inhibe significativamente las actividades de las isoenzimas humanas CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP2E1 o CYP3A hasta la concentración de 3 mM (378 mcg/mL), un nivel considerablemente más alto que los niveles alcanzados con las dosis recomendadas.
Se llevaron a cabo estudios de interacción farmacológica en adultos sanos (edad 18 a 50 años) con Xyrem y divalproex sódico, diclofenaco e ibuprofeno:
- •
- Divalproex sódico: La coadministración de Xyrem (6 g por día en dos dosis iguales de 3 gramos administradas con cuatro horas de diferencia) con divalproex sódico (ácido valproico, 1250 mg por día) aumentó la exposición sistémica media a GHB, como lo demuestra el AUC, en aproximadamente un 25% (rango de relación AUC de 0,8 a 1,7), mientras que la Cmax fue comparable. La coadministración no pareció afectar la farmacocinética del ácido valproico. Se observó un mayor deterioro en algunas pruebas de atención y memoria de trabajo con la coadministración de ambos fármacos que con cualquiera de los fármacos por separado [ver Interacciones medicamentosas (7.2) y Dosis y administración (2.5)].
- •
- Diclofenaco: La coadministración de Xyrem (6 g por día en dos dosis iguales de 3 gramos administradas con cuatro horas de diferencia) con diclofenaco (50 mg/dosis dos veces al día) no mostró diferencias significativas en la exposición sistémica a GHB. La coadministración no pareció afectar la farmacocinética del diclofenaco.
- •
- Ibuprofeno: La coadministración de Xyrem (6 g por día en dos dosis iguales de 3 gramos administradas con cuatro horas de diferencia) con ibuprofeno (800 mg/dosis cuatro veces al día, también administradas con cuatro horas de diferencia) dio como resultado una exposición sistémica comparable a GHB, como lo demuestran los valores de Cmax y AUC plasmáticos. La coadministración no afectó la farmacocinética del ibuprofeno.
Los estudios de interacción medicamentosa en adultos sanos no demostraron interacciones farmacocinéticas entre Xyrem y clorhidrato de protriptilina, tartrato de zolpidem y modafinilo. Además, no hubo interacciones farmacocinéticas con el inhibidor de la alcohol deshidrogenasa fomepizol. Sin embargo, no se pueden descartar las interacciones farmacodinámicas con estos fármacos. La alteración del pH gástrico con omeprazol no produjo ningún cambio significativo en la farmacocinética de GHB. Además, los estudios de interacción medicamentosa en adultos sanos no demostraron interacciones farmacocinéticas o farmacodinámicas clínicamente significativas entre Xyrem y duloxetina HCl.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Carcinogénesis
La administración de oxibato de sodio a ratas en dosis orales de hasta 1.000 mg/kg/día durante 83 (machos) o 104 (hembras) semanas no produjo un aumento en los tumores. La exposición plasmática (AUC) en la dosis más alta probada fue 2 veces mayor que en humanos a la dosis humana máxima recomendada (MRHD) de 9 g por noche.
Los resultados de los estudios de carcinogenicidad de 2 años en ratones y ratas con gamma-butirolactona, un compuesto que se metaboliza a oxibato de sodio in vivo, no mostraron evidencia clara de actividad carcinogénica. Los AUC plasmáticos de oxibato de sodio alcanzados en las dosis más altas probadas en estos estudios fueron menores que en humanos a la MRHD.
Mutagénesis
El oxibato de sodio fue negativo en la prueba de mutación genética bacteriana in vitro, una prueba de aberración cromosómica in vitro en células de mamíferos y en una prueba de micronúcleos de rata in vivo.
Deterioro de la Fertilidad
La administración oral de oxibato de sodio (150, 350 o 1.000 mg/kg/día) a ratas macho y hembra antes y durante el apareamiento y continuando en las hembras hasta el inicio de la gestación no produjo efectos adversos sobre la fertilidad. La dosis más alta probada es aproximadamente igual a la MRHD en una base de mg/m2.
14 ESTUDIOS CLÍNICOS
La eficacia de Xyrem para el tratamiento de la cataplejía o la somnolencia diurna excesiva (EDS) en pacientes de 7 años de edad o mayores con narcolepsia se ha establecido en los siguientes ensayos adecuados y bien controlados:
- •
- Cataplejía en narcolepsia adulta en los ensayos N1 y N2 [ver Estudios clínicos (14.1)]
- •
- Somnolencia diurna excesiva (EDS) en narcolepsia adulta en los ensayos N3 y N4 [ver Estudios clínicos (14.2)]
- •
- Cataplejía y EDS en narcolepsia pediátrica en el ensayo N5 [ver Estudios clínicos (14.3)]
14.1 Cataplejía en narcolepsia adulta
La eficacia de Xyrem en el tratamiento de la cataplejía se estableció en dos ensayos multicéntricos, aleatorizados, doble ciego, controlados con placebo, de grupos paralelos (ensayos N1 y N2) en pacientes con narcolepsia (ver Tabla 5). En los ensayos N1 y N2, el 85% y el 80% de los pacientes, respectivamente, también estaban siendo tratados con estimulantes del SNC. Los altos porcentajes de uso concomitante de estimulantes hacen imposible evaluar la eficacia y seguridad de Xyrem independientemente del uso de estimulantes. En cada ensayo, el período de tratamiento fue de 4 semanas y las dosis nocturnas totales de Xyrem oscilaron entre 3 g y 9 g, con la dosis nocturna total administrada en dos dosis iguales. La primera dosis de cada noche se tomó a la hora de acostarse y la segunda dosis se tomó de 2,5 a 4 horas después. No hubo restricciones en el tiempo entre el consumo de alimentos y la dosificación.
El ensayo N1 reclutó a 136 pacientes narcolépticos con cataplejía de moderada a grave (mediana de 21 ataques de cataplejía por semana) en el momento basal. Antes de la aleatorización, se retiraron los medicamentos con posibles efectos sobre la cataplejía, pero los estimulantes se continuaron a dosis estables. Los pacientes fueron aleatorizados para recibir placebo, Xyrem 3 g por noche, Xyrem 6 g por noche o Xyrem 9 g por noche.
El ensayo N2 fue un ensayo de retirada aleatorizada con 55 pacientes narcolépticos que habían estado tomando Xyrem de etiqueta abierta durante 7 a 44 meses antes de ingresar al estudio. Para ser incluidos, los pacientes debían tener un historial de al menos 5 ataques de cataplejía por semana antes de cualquier tratamiento para la cataplejía. Los pacientes fueron aleatorizados para continuar el tratamiento con Xyrem a su dosis estable (que oscilaba entre 3 g y 9 g por noche) o para recibir placebo durante 2 semanas. El ensayo N2 se diseñó específicamente para evaluar la eficacia continua del oxibato de sodio después del uso a largo plazo.
La medida principal de eficacia en los ensayos N1 y N2 fue la frecuencia de los ataques de cataplejía.
Tabla 5
Número mediano de ataques de cataplejía en los ensayos N1 y N2
|
Ensayo/Grupo de dosificación |
Línea de base |
Cambio mediano desde la línea de base |
Comparación con placebo (valor p) |
|
Ensayo N1 (Ensayo prospectivo, aleatorizado, de grupo paralelo) |
|||
|
(ataques medianos/semana) |
|||
|
Placebo (n=33) |
20.5 |
-4 |
– |
|
Xyrem 6 g por noche (n=31) |
23.0 |
-10 |
0.0451 |
|
Xyrem 9 g por noche (n=33) |
23.5 |
-16 |
0.0016 |
|
Ensayo N2 (Ensayo de retirada aleatorizada) |
|||
|
(ataques medianos/2 semanas) |
|||
|
Placebo (n=29) |
4.0 |
21 |
– |
|
Xyrem (n=26) |
1.9 |
0 |
<0.001 |
En el ensayo N1, tanto las dosis de Xyrem de 6 g como de 9 g por noche dieron como resultado reducciones estadísticamente significativas en la frecuencia de los ataques de cataplejía. La dosis de 3 g por noche tuvo poco efecto. En el ensayo N2, los pacientes aleatorizados a placebo después de interrumpir el tratamiento con Xyrem de etiqueta abierta a largo plazo experimentaron un aumento significativo en los ataques de cataplejía (p<0.001), lo que proporciona evidencia de la eficacia a largo plazo de Xyrem. En el ensayo N2, la respuesta fue numéricamente similar para los pacientes tratados con dosis de 6 g a 9 g por noche, pero no se observó ningún efecto en los pacientes tratados con dosis inferiores a 6 g por noche, lo que sugiere poco efecto a estas dosis.
14.2 Somnolencia Diurna Excesiva en Narcolepsia en Adultos
La eficacia de Xyrem en el tratamiento de la somnolencia diurna excesiva en pacientes con narcolepsia se estableció en dos ensayos aleatorizados, doble ciego, controlados con placebo (ensayos N3 y N4) (ver Tablas 6 a 8). El setenta y ocho por ciento de los pacientes en el ensayo N3 también estaban siendo tratados con estimulantes del SNC.
El ensayo N3 fue un ensayo multicéntrico, aleatorizado, doble ciego, controlado con placebo, de grupos paralelos que evaluó a 228 pacientes con síntomas de moderados a graves al ingresar al estudio, incluida una puntuación mediana de la Escala de Somnolencia de Epworth (ver más abajo) de 18 y una puntuación de la Prueba de Mantenimiento de la Vigilia (ver más abajo) de 8.3 minutos. Los pacientes fueron aleatorizados a uno de 4 grupos de tratamiento: placebo, Xyrem 4.5 g por noche, Xyrem 6 g por noche o Xyrem 9 g por noche. El período de tratamiento doble ciego en este ensayo fue de 8 semanas. Los antidepresivos se retiraron antes de la aleatorización; los estimulantes se continuaron a dosis estables.
Las medidas de eficacia primarias en el ensayo N3 fueron la Escala de Somnolencia de Epworth y la Impresión Clínica Global de Cambio. La Escala de Somnolencia de Epworth está diseñada para evaluar el grado de somnolencia en situaciones cotidianas haciendo al paciente una serie de preguntas. En estas preguntas, se pidió a los pacientes que calificaran sus posibilidades de dormitar durante cada una de las 8 actividades en una escala de 0-3 (0=nunca; 1=ligero; 2=moderado; 3=alto). Las puntuaciones totales más altas indican una mayor tendencia a la somnolencia. La Impresión Clínica Global de Cambio se evalúa en una escala de 7 puntos, centrada en Sin Cambio, y que va desde Mucho Peor hasta Mucho Mejor. En el ensayo N3, los pacientes fueron calificados por evaluadores que basaron sus evaluaciones en la gravedad de la narcolepsia en la línea de base.
En el ensayo N3, se observaron mejoras estadísticamente significativas en la puntuación de la Escala de Somnolencia de Epworth en la semana 8 y en la puntuación de la Impresión Clínica Global de Cambio en la semana 8 con las dosis de Xyrem de 6 g y 9 g por noche en comparación con el grupo placebo.
Tabla 6
Cambio desde la línea de base en la puntuación de somnolencia diurna (Escala de Somnolencia de Epworth) en la semana 8 en el ensayo N3 (Rango 0-24)
|
Grupo de Tratamiento |
Línea de Base |
Semana 8 |
Cambio Mediano desde la Línea de Base en la Semana 8 |
Valor p |
|
Placebo (n=59) |
17.5 |
17.0 |
-0.5 |
– |
|
Xyrem 6 g por noche (n=58) |
19.0 |
16.0 |
-2.0 |
<0.001 |
|
Xyrem 9 g por noche (n=47) |
19.0 |
12.0 |
-5.0 |
<0.001 |
Tabla 7
Proporción de pacientes con una Impresión Clínica Global de Cambio Muy Mejorada o Mejorada en los síntomas diurnos y nocturnos en el ensayo N3
|
Grupo de Tratamiento |
Porcentajes de Respondedores |
Cambio desde la Línea de Base
Significancia en comparación con el Placebo |
|
Placebo (n=59) |
22% |
– |
|
Xyrem 6 g por noche (n=58) |
52% |
<0.001 |
|
Xyrem 9 g por noche (n=47) |
64% |
<0.001 |
El ensayo N4 fue un ensayo multicéntrico, aleatorizado, doble ciego, controlado con placebo, de grupos paralelos que evaluó a 222 pacientes con síntomas de moderados a graves al ingresar al estudio, incluida una puntuación mediana en la Escala de Somnolencia de Epworth de 15 y una puntuación en la Prueba de Mantenimiento de la Vigilia (ver más abajo) de 10,3 minutos. Al ingresar, los pacientes debían estar tomando modafinilo a dosis estables de 200 mg, 400 mg o 600 mg diarios durante al menos 1 mes antes de la aleatorización. Los pacientes inscritos en el estudio fueron aleatorizados a uno de 4 grupos de tratamiento: placebo, Xyrem, modafinilo o Xyrem más modafinilo. Xyrem se administró en una dosis de 6 g por noche durante 4 semanas, seguido de 9 g por noche durante 4 semanas. El modafinilo continuó en los grupos de tratamiento con modafinilo solo y Xyrem más modafinilo a la dosis previa del paciente. El ensayo N4 no fue diseñado para comparar los efectos de Xyrem con el modafinilo porque los pacientes que recibieron modafinilo no fueron titulados a una dosis máxima. Los pacientes aleatorizados a placebo o a tratamiento con Xyrem fueron retirados de su dosis estable de modafinilo. Los pacientes que tomaban antidepresivos podían continuar con estos medicamentos a dosis estables.
La medida principal de eficacia en el ensayo N4 fue la Prueba de Mantenimiento de la Vigilia. La Prueba de Mantenimiento de la Vigilia mide la latencia al inicio del sueño (en minutos) promediada en 4 sesiones a intervalos de 2 horas después de la polisomnografía nocturna. Para cada sesión de prueba, se le pidió al sujeto que permaneciera despierto sin utilizar medidas extraordinarias. Cada sesión de prueba termina después de 20 minutos si no se produce el sueño, o después de 10 minutos, si se produce el sueño. La puntuación general es la latencia media del sueño para las 4 sesiones.
En el ensayo N4, se observó una mejora estadísticamente significativa en el cambio en la puntuación de la Prueba de Mantenimiento de la Vigilia desde el inicio en la semana 8 en los grupos de Xyrem y Xyrem más modafinilo en comparación con el grupo placebo.
Este ensayo no fue diseñado para comparar los efectos de Xyrem con el modafinilo, porque los pacientes que recibieron modafinilo no fueron titulados a una dosis máximamente efectiva.
Tabla 8
Cambio en la línea de base en la puntuación de la Prueba de Mantenimiento de la Vigilia (en minutos) en la semana 8 en el ensayo N4
|
Grupo de tratamiento |
Línea de base |
Semana 8 |
Cambio medio desde la línea de base en la semana 8 |
Valor p |
|
Placebo (modafinilo retirado) (n=55) |
9.7 |
6.9 |
-2.7 |
– |
|
Xyrem (modafinilo retirado) (n=50) |
11.3 |
12.0 |
0.6 |
<0.001 |
|
Xyrem más modafinilo (n=54) |
10.4 |
13.2 |
2.7 |
<0.001 |
14.3 Cataplexia y Somnolencia Diurna Excesiva en Narcolepsia Pediátrica
La eficacia de Xyrem en el tratamiento de la cataplexia y la somnolencia diurna excesiva en pacientes pediátricos de 7 años de edad o mayores con narcolepsia se estableció en un estudio de retirada aleatorizado, doble ciego, controlado con placebo (Ensayo N5) (NCT02221869). El estudio se llevó a cabo en 106 pacientes pediátricos (edad mediana: 12 años; rango: 7 a 17 años) con un historial de base de al menos 14 ataques de cataplexia en un período típico de 2 semanas antes de cualquier tratamiento para los síntomas de la narcolepsia. De los 106 pacientes, 2 no recibieron el fármaco del estudio y 63 pacientes fueron aleatorizados 1:1 a continuar el tratamiento con Xyrem o a placebo. La aleatorización al placebo se detuvo temprano ya que el criterio de eficacia se cumplió en el análisis intermedio preplanificado.
Los pacientes ingresaron al estudio tomando una dosis estable de Xyrem o eran Xyrem-naïve. Los estimulantes del SNC estaban permitidos al ingreso, y aproximadamente el 50% de los pacientes usaron una dosis estable de estimulante durante los períodos de dosis estable y doble ciego. Los pacientes Xyrem-naïve fueron iniciados y titulados en función del peso corporal durante un período de hasta 10 semanas. La dosis total nocturna se administró en dos dosis divididas, con la primera dosis administrada por la noche y la segunda administrada de 2,5 a 4 horas después [ver Dosificación y Administración (2.2)]. Una vez que se logró una dosis estable de Xyrem, estos pacientes ingresaron al período de dosis estable de 2 semanas; los pacientes que tomaban una dosis estable de Xyrem al ingreso al estudio continuaron tomando esta dosis durante 3 semanas, antes de la aleatorización. La eficacia se estableció en dosis que van de 3 g a 9 g de Xyrem por noche.
La medida principal de eficacia fue el cambio en la frecuencia de los ataques de cataplexia. Además, se evaluó el cambio en la gravedad de la cataplexia con la Impresión Global Clínica de Cambio para la gravedad de la cataplexia [ver Estudios Clínicos (14.2) para la descripción de la escala]. La eficacia de Xyrem en el tratamiento de la somnolencia diurna excesiva en pacientes pediátricos con narcolepsia se evaluó con el cambio en la puntuación de la Escala de Somnolencia de Epworth (Niños y Adolescentes). La Escala de Somnolencia de Epworth (Niños y Adolescentes) es una versión modificada de la escala utilizada en los ensayos clínicos para adultos descritos anteriormente [ver Estudios Clínicos (14.2) para la descripción y la puntuación]. El cambio general en la condición de la narcolepsia se evaluó mediante la Impresión Global Clínica de Cambio para la narcolepsia en general. La eficacia se evaluó durante o al final del período de tratamiento doble ciego de 2 semanas, en relación con las últimas 2 semanas o al final del período de dosis estable (ver Tablas 9 y 10).
Los pacientes pediátricos que tomaban dosis estables de Xyrem que fueron retirados del tratamiento con Xyrem y aleatorizados a placebo durante el período de tratamiento doble ciego experimentaron un aumento estadísticamente significativo en los ataques de cataplexia semanales en comparación con los pacientes que fueron aleatorizados a continuar el tratamiento con Xyrem. Los pacientes aleatorizados a recibir placebo durante el período de tratamiento doble ciego experimentaron un empeoramiento estadísticamente significativo de la EDS en comparación con los pacientes aleatorizados a continuar recibiendo Xyrem (ver Tabla 9).
Tabla 9
Número de ataques de cataplexia semanales y puntuación de la Escala de Somnolencia de Epworth (Niños y Adolescentes) (Ensayo N5)
|
Grupo de tratamiento |
Línea de base*,† |
Período de tratamiento doble ciego‡,§ |
Cambio mediano desde la línea de base |
Comparación con placebo (valor p¶) |
|
Número mediano de ataques de cataplexia (ataques/semana) |
||||
|
Placebo (n=32) |
4.7 |
21.3 |
12.7 |
– |
|
Xyrem (n=31) |
3.5 |
3.8 |
0.3 |
<0.0001 |
|
Puntuación mediana de la Escala de Somnolencia de Epworth (Niños y Adolescentes) |
||||
|
Placebo (n=31**) |
11 |
12 |
3 |
– |
|
Xyrem (n=30**) |
8 |
9 |
0 |
0.0004 |
* Para el número semanal de ataques de cataplejía, el valor basal se calcula a partir de los últimos 14 días del período de dosis estable.
† Para la puntuación de la Escala de Somnolencia de Epworth, el valor basal se recopila al final del período de dosis estable.
‡ El número semanal de ataques de cataplejía se calcula a partir de todos los días dentro del período de tratamiento doble ciego.
§ Para la Escala de Somnolencia de Epworth, el valor se recopila al final del período de tratamiento doble ciego.
¶ Valor p del análisis de covarianza (ANCOVA) basado en rangos con el tratamiento como factor y el valor basal de rango como covariable.
** Un paciente en cada uno de los grupos de tratamiento no tenía puntuación ESS basal disponible y no se incluyó en este análisis.
Los pacientes aleatorizados para recibir placebo durante el período de tratamiento doble ciego experimentaron un empeoramiento estadísticamente significativo de la gravedad de la cataplejía y la narcolepsia en general según la evaluación del clínico en comparación con los pacientes aleatorizados para continuar recibiendo Xyrem (ver Tabla 10).
Tabla 10
Impresión Clínica Global de Cambio (CGIc) para la gravedad de la cataplejía y la narcolepsia en general (Ensayo N5)
|
Empeoró, %† |
CGIc Gravedad de la cataplejía* |
CGIc Narcolepsia en general* |
||
|
Placebo |
Xyrem |
Placebo |
Xyrem |
|
|
Mucho peor o mucho peor |
66% |
17% |
59% |
10% |
|
Valor p§ |
0.0001 |
<0.0001 |
||
* Las respuestas indican un cambio en la gravedad o los síntomas en relación con la recepción del tratamiento con Xyrem en el momento basal.
† Porcentajes basados en el número total de valores observados.
‡ Dos pacientes aleatorizados a Xyrem no completaron las evaluaciones CGIc y fueron excluidos del análisis.
§ Valor p de la prueba de chi-cuadrado de Pearson.
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
16.1 Cómo se suministra
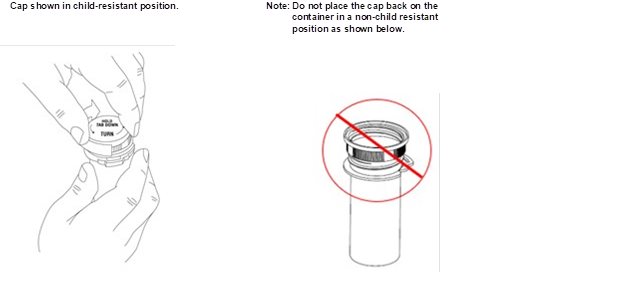
Xyrem es una solución oral clara a ligeramente opalescente. Cada receta incluye una botella de Xyrem con un adaptador de botella presionado adjunto, un dispositivo de medición oral (jeringa de plástico) y una Guía de medicación. La farmacia proporciona dos recipientes vacíos con tapas a prueba de niños con cada envío de Xyrem.
Cada botella ámbar contiene solución oral de Xyrem a una concentración de 0,5 g por mL (0,5 g/mL de oxibato de sodio equivalente a 0,413 g/mL de oxibato) y tiene un tapón a prueba de niños.
Una botella de 180 mL NDC 68727-100-01
16.2 Almacenamiento
Manténgase fuera del alcance de los niños.
Xyrem debe almacenarse a 25°C (77°F); se permiten desviaciones a 15°C a 30°C (59°F a 86°F) (véase Temperatura controlada de la habitación de USP).
Distribuya en recipientes herméticos.
Las soluciones preparadas después de la dilución deben consumirse en un plazo de 24 horas.
16.3 Manipulación y eliminación
Xyrem es un medicamento de Clase III bajo la Ley de Sustancias Controladas. Xyrem debe manejarse de acuerdo con las regulaciones estatales y federales. Es seguro desechar Xyrem por el desagüe sanitario.
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente y/o cuidador que lea el etiquetado del paciente aprobado por la FDA (Guía de medicamentos e Instrucciones de uso).
Depresión del sistema nervioso central
Informe a los pacientes y/o cuidadores que Xyrem puede causar depresión del sistema nervioso central, incluyendo depresión respiratoria, hipotensión, sedación profunda, síncope y muerte. Indique a los pacientes que no participen en actividades que requieran alerta mental o coordinación motora, incluyendo el manejo de maquinaria peligrosa, durante al menos 6 horas después de tomar Xyrem. Indique a los pacientes y/o sus cuidadores que informen a sus proveedores de atención médica de todos los medicamentos que toman [ver Advertencias y precauciones (5.1)].
Abuso y mal uso
Informe a los pacientes y/o cuidadores que el ingrediente activo de Xyrem es gamma-hidroxibutirato (GHB), que está asociado con reacciones adversas graves con el uso ilícito y el abuso [ver Advertencias y precauciones (5.2)].
XYWAV y XYREM REMS
Xyrem está disponible solo a través de un programa restringido llamado XYWAV y XYREM REMS [ver Advertencias y precauciones (5.3)]. Informe al paciente y/o cuidador de los siguientes requisitos notables:
- •
- Xyrem se dispensa solo por la farmacia central
- •
- Xyrem se dispensará y enviará solo a pacientes inscritos en XYWAV y XYREM REMS
Xyrem está disponible solo en la farmacia central que participa en el programa. Por lo tanto, proporcione a los pacientes y/o cuidadores el número de teléfono y el sitio web para obtener información sobre cómo obtener el producto.
Alcohol o hipnóticos sedantes
Aconseje a los pacientes y/o cuidadores que el alcohol y otros hipnóticos sedantes no deben tomarse con Xyrem [ver Contraindicaciones (4)].
Sedación
Informe a los pacientes y/o cuidadores que es probable que el paciente se duerma rápidamente después de tomar Xyrem (a menudo dentro de 5 y generalmente dentro de 15 minutos), pero el tiempo que tarda en dormirse puede variar de una noche a otra. La aparición repentina del sueño, incluso en posición de pie o al levantarse de la cama, ha provocado caídas complicadas por lesiones, en algunos casos que requieren hospitalización [ver Reacciones adversas (6.2)]. Indique a los pacientes y/o cuidadores que el paciente debe permanecer en la cama después de la ingestión de la primera y segunda dosis nocturnas. Indique a los pacientes y/o cuidadores que el paciente no debe tomar su segunda dosis nocturna hasta 2.5 a 4 horas después de la primera dosis [ver Dosificación y administración (2.3)].
Efectos de los alimentos en Xyrem
Informe a los pacientes y/o cuidadores que la primera dosis nocturna debe tomarse al menos 2 horas después de comer.
Depresión respiratoria y respiración desordenada durante el sueño
Informe a los pacientes que Xyrem puede afectar el impulso respiratorio, especialmente en pacientes con función respiratoria comprometida, y puede causar apnea [ver Advertencias y precauciones (5.4)].
Depresión y suicidio
Indique a los pacientes y/o cuidadores que se pongan en contacto con un proveedor de atención médica de inmediato si el paciente desarrolla estado de ánimo depresivo, interés o placer notablemente disminuido en las actividades habituales, cambio significativo en el peso y/o el apetito, agitación o retardo psicomotor, aumento de la fatiga, sentimientos de culpa o inutilidad, pensamiento lento o concentración deteriorada, o ideación suicida [ver Advertencias y precauciones (5.5)].
Otras reacciones adversas conductuales o psiquiátricas
Informe a los pacientes y/o cuidadores que Xyrem puede causar reacciones adversas conductuales o psiquiátricas, incluyendo confusión, ansiedad y psicosis. Indíqueles que notifiquen a su proveedor de atención médica si ocurre alguno de estos tipos de síntomas [ver Advertencias y precauciones (5.6)].
Sonambulismo
Indique a los pacientes y/o cuidadores que Xyrem se ha asociado con sonambulismo y otros comportamientos durante el sueño, y que se pongan en contacto con su proveedor de atención médica si esto ocurre [ver Advertencias y precauciones (5.7)].
Consumo de sodio
Indique a los pacientes y/o cuidadores que Xyrem contiene una cantidad significativa de sodio y los pacientes que son sensibles a la ingesta de sodio (por ejemplo, aquellos con insuficiencia cardíaca, hipertensión o insuficiencia renal) deben limitar su ingesta de sodio [ver Advertencias y precauciones (5.8)].
Distribuido por:
Jazz Pharmaceuticals, Inc.
Palo Alto, CA 94304
Protegido por las patentes de EE. UU. Nos. 8,772,306; 9,050,302; 9,486,426; 10,213,400; 10,864,181; y 11,253,494.
Guía de medicación
|
GUÍA DEL MEDICAMENTO |
|
Lea esta Guía del Medicamento cuidadosamente antes de comenzar a tomar XYREM usted o su hijo, y cada vez que reciba o su hijo reciba una nueva receta. Puede haber nueva información. Esta información no reemplaza hablar con su médico sobre su condición médica o tratamiento, o la de su hijo. |
|
¿Cuál es la información más importante que debo saber sobre XYREM?
Pregúntele a su médico si no está seguro de si usted o su hijo están tomando algún medicamento de la lista anterior.
Llame a su médico de inmediato si usted o su hijo tienen alguno de estos efectos secundarios graves.
|
|
¿Qué es XYREM? XYREM es un medicamento recetado que se usa para tratar los siguientes síntomas en personas de 7 años de edad o mayores con narcolepsia:
No se sabe si XYREM es seguro y eficaz en niños menores de 7 años. |
|
No tome XYREM si usted o su hijo:
|
|
Antes de tomar XYREM, informe a su médico sobre todas las condiciones médicas, incluso si usted o su hijo:
Informe a su médico sobre todos los medicamentos que toma usted o su hijo, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos herbales. Especialmente, dígale a su médico si usted o su hijo toman otros medicamentos para ayudarlo a dormir (sedantes). Conozca los medicamentos que toma usted o su hijo. Mantenga una lista de ellos para mostrársela a su médico y farmacéutico cuando reciba o su hijo reciba un nuevo medicamento. |
|
¿Cómo debo tomar o administrar XYREM?
|
|
¿Cuáles son los posibles efectos secundarios de XYREM? XYREM puede causar efectos secundarios graves, que incluyen:
Llame a su médico de inmediato si usted o su hijo tienen síntomas de problemas de salud mental o un cambio en el peso o el apetito.
Los efectos secundarios más comunes de XYREM en adultos incluyen:
Los efectos secundarios más comunes de XYREM en niños incluyen:
Los efectos secundarios pueden aumentar al tomar dosis más altas de XYREM. Estos no son todos los posibles efectos secundarios de XYREM. Para obtener más información, consulte a su médico o farmacéutico. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088. |
|
¿Cómo debo almacenar XYREM?
XYREM viene en un paquete a prueba de niños. Mantenga XYREM y todos los medicamentos fuera del alcance de los niños y las mascotas.
|
|
Información general sobre el uso seguro y eficaz de XYREM. Los medicamentos a veces se recetan para fines distintos de los que se enumeran en una Guía de medicamentos. No use XYREM para una condición para la que no fue recetado. No le dé XYREM a otras personas, incluso si tienen los mismos síntomas. Puede hacerles daño. Puede pedirle a su farmacéutico o médico información sobre XYREM que esté escrita para profesionales de la salud. |
|
¿Cuáles son los ingredientes de XYREM?
Distribuido por: Para obtener más información, visite www.XYWAVXYREMREMS.com o llame al REMS de XYWAV y XYREM al 1-866-997-3688. |
Esta Guía de Medicación ha sido aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos. Fecha de emisión: 9/2020
Instrucciones de uso
XYREM® (ZĪE-rem)
(oxibato de sodio)
Solución oral, CIII
Lea cuidadosamente estas Instrucciones de uso antes de que usted (o su hijo) empiece a tomar XYREM y cada vez que reponga el medicamento. Puede haber nueva información. Esta información no sustituye la conversación con su médico sobre el estado o el tratamiento médico de usted (o de su hijo).
Información importante:
- •
- Usted tendrá que dividir la dosis prescrita de XYREM (para usted o su hijo) en 2 recipientes de farmacia separados para mezclar.
- •
- Usted tendrá que mezclar XYREM con agua antes de tomar o administrarle la dosis a su hijo.
- •
- Guarde de forma segura las dosis de XYREM preparadas y tome within 24 horas después de mezclarlas. Si la dosis preparada no se toma en este tiempo, deseche la mezcla. Consulte la sección “Cómo desechar (eliminar) XYREM” a continuación para saber cómo deshacerse de XYREM de forma segura.
- •
- Ambas dosis de XYREM se deben tomar estando en la cama.
- •
- Los recipientes de farmacia se pueden enjuagar con agua y vaciar en el desagüe del fregadero.
Materiales que necesitará para mezclar y tomar (o administrar a su hijo) XYREM. Vea la Figura A:
- •
- Botella de XYREM
- •
- Jeringa de dosificación para medir y dispensar la dosis de XYREM
- •
- Taza de medir capaz de medir aproximadamente ¼ taza de agua (no provista con el envío de XYREM)
- •
- 2 recipientes de farmacia vacíos con tapas resistentes a niños para mezclar, almacenar y tomar las dosis de XYREM
- •
- Reloj despertador (no representado que puede estar incluido en el primer envío)
- •
- Guía de medicación
Figura A
Paso 1: Configuración
- •
- Tome la botella de XYREM, la jeringa y los recipientes de farmacia de la caja de envío.
- •
- Saque la jeringa del envoltorio de plástico. Use solo la jeringa proporcionada con la prescripción de XYREM.
- •
- Llene una taza de medir (no proporcionada) con aproximadamente ¼ taza de agua disponible para mezclar su dosis.
- •
- Asegúrese de que los recipientes de farmacia estén vacíos.
- •
- Abra ambos recipientes de farmacia sujetando la lengüeta debajo de la tapa y girando en sentido contrario al de las agujas del reloj (izquierda). Vea la Figura B.
Figura B
Retire la banda de protección contra manipulación tirando en las perforaciones y luego retire la tapa de la botella de XYREM presionando hacia abajo mientras gira la tapa en sentido contrario al de las agujas del reloj. Vea la Figura C.
Figura C
Paso 2. Preparar la primera dosis de XYREM (preparar antes de acostarse)
Coloque la botella de XYREM en una superficie dura y plana y sostenga la botella con una mano y con la otra mano presione firmemente la jeringa en la apertura central de la botella. Vea la Figura D.
Figura D
Tire del émbolo hasta que el medicamento fluya a la jeringa y el nivel del líquido coincida con la marca en la jeringa que corresponde a la dosis de usted o de su hijo. Vea la Figura E.
Figura E
Nota: El medicamento XYREM no fluirá a la jeringa a menos que mantenga la botella en posición vertical.
La Figura F muestra un ejemplo de extraer una dosis de XYREM de 2,25 g. La Figura G muestra un ejemplo si se forma un espacio de aire al extraer la dosis.
Figura F Figura G
Nota: Si se forma un espacio de aire entre el émbolo y el líquido al extraer el medicamento, alinee el nivel del líquido con la marca en la jeringa que corresponde a la dosis de usted o de su hijo. Vea la Figura G anterior.
- •
- Después de extraer la primera dosis dividida de XYREM, retire la jeringa de la apertura de la botella de XYREM.
- •
- Vacíe todo el medicamento de la jeringa en uno de los recipientes de farmacia vacíos proporcionados presionando hacia abajo el émbolo hasta que se detenga. Vea la Figura H.
Figura H
- •
- Con una taza de medir, vierta aproximadamente ¼ taza de agua en el recipiente de farmacia. Tenga cuidado de añadir solo agua al recipiente de farmacia y no más XYREM.
- •
- Todas las botellas enviadas de XYREM contienen el medicamento concentrado. El agua para mezclar el medicamento no se proporciona en el envío.
- •
- Después de mezclar el medicamento y el agua en el recipiente de farmacia provisto, coloque la tapa resistente a niños en el recipiente de farmacia lleno y gire la tapa en sentido de las agujas del reloj (derecha) hasta que haga clic y se bloquee en su posición resistente a niños. Vea la Figura I.
- •
- Precaución: la tapa del recipiente de farmacia es reversible con un lado no resistente a niños. Vea la Figura J. Asegúrese de que se use el lado resistente a niños de la tapa para evitar el acceso al medicamento de los niños.
Figura I Figura J
Paso 3. Preparar la segunda dosis de XYREM (preparar antes de acostarse)
- •
- Repita el paso 2 extrayendo la cantidad de medicamento recetada para su (o la de su hijo) segunda dosis:
- o
- vaciando la jeringa en el segundo recipiente de la farmacia
- o
- añadiendo aproximadamente ¼ de taza de agua y
- o
- cerrando el recipiente de la farmacia
Paso 4. Guarde las dosis preparadas de XYREM
- •
- Vuelva a colocar la tapa en el frasco de XYREM y guarde el frasco de XYREM y ambas dosis preparadas en un lugar seguro. Guárdelo en un lugar cerrado con llave si es necesario.
- •
- Mantenga el frasco de XYREM y ambas dosis preparadas de XYREM fuera del alcance de los niños y las mascotas.
- •
- Enjuague la jeringa con agua y vierta el líquido por el desagüe del lavabo presionando el émbolo hasta que se detenga.
Paso 5. Tome o administre la primera dosis de XYREM
- •
- A la hora de acostarse, y antes de tomar (o administrar) la primera dosis de XYREM, coloque la segunda dosis de XYREM en un lugar seguro. Los cuidadores deben asegurarse de que todas las dosis de XYREM se mantengan en un lugar seguro hasta que se administren. Es posible que desee configurar una alarma para 2½ a 4 horas después para asegurarse de que se despierte para tomar (o administrar) la segunda dosis.
- •
- Cuando sea el momento de tomar (o administrar) la primera dosis de XYREM, retire la tapa del recipiente de la farmacia presionando la pestaña de seguridad para niños y girando la tapa en sentido contrario a las agujas del reloj.
- •
- Beba (o haga que su hijo beba) toda la primera dosis de XYREM mientras está sentado en la cama. Vuelva a colocar la tapa en el primer recipiente de la farmacia y acuéstese inmediatamente a dormir (o haga que su hijo se acueste a dormir).
- •
- Usted (o su hijo) debe quedarse dormido pronto. Algunas personas se quedan dormidas en 5 minutos y la mayoría se quedan dormidas en 15 minutos. Algunos pacientes tardan menos tiempo en dormirse y otros tardan más. El tiempo que tarda usted (o su hijo) en dormirse puede variar de una noche a otra.
Paso 6. Tome o administre la segunda dosis de XYREM
- •
- Cuando se despierte 2½ a 4 horas después para su (o la de su hijo) segunda dosis de XYREM, retire la tapa del segundo recipiente de la farmacia.
- •
- Si usted (o su hijo) se despierta antes de la alarma y han pasado al menos 2½ horas desde la primera dosis de XYREM, apague la alarma y tome (o administre a su hijo) la segunda dosis de XYREM.
- •
- Beba (o haga que su hijo beba) toda la segunda dosis de XYREM mientras está sentado en la cama. Vuelva a colocar la tapa en el segundo recipiente de la farmacia y acuéstese inmediatamente (o haga que su hijo se acueste) para continuar durmiendo.
¿Cómo debo guardar XYREM?
- •
- Guarde XYREM en el frasco original antes de mezclarlo con agua. Después de mezclar, guarde XYREM en los recipientes de la farmacia proporcionados por la farmacia. La tapa del frasco original es a prueba de niños. La tapa del recipiente de la farmacia es a prueba de niños solo cuando se utiliza el lado a prueba de niños de la tapa.
- •
- Guarde XYREM a temperatura ambiente entre 68°F y 77°F (20°C y 25°C).
- •
- La solución de XYREM preparada después de mezclarla con agua debe tomarse en un plazo de 24 horas o vaciarse por el desagüe del lavabo.
Desechar (eliminar) XYREM
- •
- Cuando haya terminado de usar un frasco de XYREM:
- o
- vaciar cualquier XYREM no utilizado por el desagüe del lavabo
- o
- tachar la etiqueta del frasco de XYREM con un marcador (no incluido en el envío de XYREM)
- o
- colocar el frasco vacío de XYREM en la basura
- •
-
Mantenga XYREM y todos los medicamentos fuera del alcance de los niños y las mascotas.
Distribuido por:
Jazz Pharmaceuticals, Inc.
Palo Alto, CA 94304
Estas instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos. Revisado: 4/2023