Fabricante de medicamentos: Octapharma Pharmazeutika Produktionsgesellschaft m.b.H. (Updated: 2010-08-20)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
Wilate, Complejo Factores de la Coagulación VIII y Factor de von Willebrand (Humano), Polvo para Solución, Solo para uso Intravenous.
Aprobación inicial en EE.UU.: 2009
INDICACIONES Y USOS
•
Wilate es un Complejo Factores de la Coagulación VIII y Factor de von Willebrand (Humano) indicado para el tratamiento de episodios de hemorragia espontánea y provocada por trauma en pacientes con enfermedad de von Willebrand grave (VWD), así como en pacientes con VWD leve o moderada en los que se sabe o se sospecha que el uso de desmopresina es ineficaz o está contraindicado. (
1
)
•Wilate no está indicado para la profilaxis de episodios de hemorragia espontánea ni para prevenir el exceso de sangrado durante y después de la cirugía en pacientes con VWD.
•Wilate no está indicado para la Hemofilia A
•
DOSIS Y ADMINISTRACIÓN
•Solo para uso Intravenous (2)
• (2)
| Tipo de Hemorragias | Dosis de Carga (IU VWF:RCo/kg PC) | Dosis de Mantenimiento (IU VWF:RCo/kg PC) | Objetivo Terapéutico |
|---|---|---|---|
|
Menores (2) |
20 – 40 IU/kg (2) |
20 – 30 IU/kg cada 12 – 24 horas (2) |
Niveles de VWF:RCo y actividad de FVIII > 30% (2) |
|
Mayores (2) |
40 – 60 IU/kg (2) |
20 – 40 IU/kg cada 12 – 24 horas (2) |
Niveles de VWF:RCo y actividad de FVIII > 50% (2) |
• (2)
FORMAS Y POTENCIAS DE DOSIS
•
Wilate es un polvo estéril liofilizado para reconstitución para inyección intravenosa, provisto en las siguientes potencias nominales por vial (
3
):
•500 IU VWF:RCo y 500 IU de actividad de FVIII en 5 mL
•1000 IU VWF:RCo y 1000 IU de actividad de FVIII en 10 mL
•
CONTRAINDICACIONES
•
Hipersensibilidad con reacción anafiláctica conocida o severa sistémica a productos derivados del plasma humano, a cualquier ingrediente de la formulación o a componentes del recipiente. (
4
)
•
ADVERTENCIAS Y PRECAUCIONES
•
Reacción de hipersensibilidad (
5.1
)
•
Eventos tromboembólicos asociados con productos de Factores de la Coagulación VIII y Factor de von Willebrand (VWF/FVIII): se deben monitorizar los niveles plasmáticos de la actividad de FVIII para evitar niveles de FVIII excesivos sostenidos, lo que puede aumentar el riesgo de eventos trombóticos (
5.2
)
•
Potencial de inducir anticuerpos contra el Factor VIII (inhibidores) y anticuerpos contra VWF, especialmente en pacientes con tipo 3 de VWD (
5.3
)
•
Riesgo teórico de transmisión de agentes infecciosos ya que el producto se fabrica a partir de plasma humano (
5.4
)
REACCIONES ADVERSAS
•
Las reacciones adversas más comunes en estudios clínicos en VWD fueron urticaria y mareos (cada una 2,2%) (
6.1
).
•
•Para reportar REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Octapharma USA Inc. al teléfono # 866-766-4860 o con la FDA al 1-800-FDA-1088 o en www.fda.gov/medwatch.
•
INTERACCIONES MEDICAMENTOSAS
•
Ninguna conocida (
7
).
•
USO EN POBLACIONES ESPECÍFICAS
•
Embarazo: Sin datos en humanos ni en animales. Utilizar solo si es claramente necesario (
8.1
).
•
•Consulte 17 para INFORMACIÓN DE ASESORAMIENTO AL PACIENTE.
•Revisado: agosto 2010
•
•
•_____________________________________________
•
•
Consulte 17 para INFORMACIÓN DE ASESORAMIENTO AL PACIENTE.
Revisado: 8/2010
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDOS*
1 INDICACIONES Y USOS
2 DOSIS Y ADMINISTRACIÓN
2.1 Dosis en la enfermedad de von Willebrand
2.2 Cronograma de dosificación
2.3 Administración
3 FORMAS Y FUERZAS DÓSICAS
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Hipersensibilidad
5.2 Riesgo tromboembólico
5.3 Formación de inhibidores
5.4 Riesgo de infección de plasma humano
5.5 Monitoreo y Pruebas de Laboratorio
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Post-Comercialización
7 INTERACCIONES MEDICAMENTOSAS
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Trabajo de parto y parto
8.3 Madres lactantes
8.4 Uso pediátrico
8.5 Uso geriátrico
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
12.2 Farmacodinámica
12.3 Farmacocinética
14 ESTUDIOS CLÍNICOS
15 REFERENCIAS
16 SUMINISTRO/CONSERVACIÓN Y MANIPULACIÓN
17 INFORMACIÓN DE CONSEJO AL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no se enumeran.
1 INDICACIONES Y USO
Wilate es un Complejo de Factor VIII de la Coagulación/Factor de von Willebrand (Humano) indicado para el tratamiento de episodios de sangrado espontáneos e inducidos por trauma en pacientes con enfermedad de von Willebrand grave (VWD), así como en pacientes con VWD leve o moderada en los que se sabe o se sospecha que el uso de desmopresina es ineficaz o contraindicado.
No se han realizado ensayos clínicos para evaluar la seguridad y la eficacia de la dosificación profiláctica con Wilate para prevenir el sangrado espontáneo en sujetos con VWD.
Wilate no está indicado para la prevención de sangrado excesivo durante y después de la cirugía en pacientes con VWD.
Wilate no está indicado para la hemofilia A.
2 DOSIS Y ADMINISTRACIÓN
- Para uso intravenoso tras la reconstitución
- El tratamiento debe iniciarse bajo la supervisión de un médico con experiencia en el tratamiento de trastornos de la coagulación.
- Cada frasco de Wilate contiene la cantidad indicada en Unidades Internacionales (IU) de la actividad del factor de von Willebrand (VWF) medida con el ensayo del cofactor de ristocetina (VWF:RCo) y la actividad del factor VIII de la coagulación (FVIII) medida con el ensayo con sustrato cromogénico.
- El número de unidades de las actividades de VWF:RCo y FVIII administradas se expresa en IU, las cuales están relacionadas con los estándares actuales de la OMS para los productos de VWF y FVIII. Las actividades de VWF:RCo y FVIII en el plasma se expresan ya sea como un porcentaje (en relación con el plasma humano normal) o en IU (en relación con los Estándares Internacionales de las actividades de VWF:RCo y FVIII en el plasma).
2.1 Dosificación en la enfermedad de von Willebrand
La proporción entre las actividades de VWF:RCo y FVIII en Wilate es aproximadamente 1:1.
La dosis debe ajustarse según la extensión y la ubicación del sangrado. En pacientes con la enfermedad tipo 3 de VWD, especialmente en aquellos con hemorragias gastrointestinales (GI), pueden requerirse dosis más altas.
2.2 Programación de la dosificación
Se requiere la supervisión del médico en el régimen de tratamiento. Un guía para la dosificación en el tratamiento de hemorragias mayores y menores se proporciona en
Tabla 1
.
El control cuidadoso del tratamiento de reemplazo es especialmente importante en hemorragias que amenazan la vida. Cuando se utiliza un producto de VWF que contiene FVIII, el médico tratante debe ser consciente de que el tratamiento continuo puede causar un incremento excesivo de la actividad de FVIII.[
1
]
Tabla 1 Guía de dosificación de Wilate para el tratamiento de hemorragias menores y mayores
| Tipo de hemorragias | Dosis de carga (IU VWF:RCo /kg PC) | Dosis de mantenimiento (IU VWF:RCo /kg PC) | Objetivo terapéutico |
|---|---|---|---|
|
Hemorragias menores |
20-40 IU/kg |
20-30 IU/kg cada 12-24 horas* |
Niveles de actividad VWF:RCo y FVIII superiores al 30% |
|
Hemorragias mayores |
40-60 IU/kg |
20-40 IU/kg cada 12-24 horas* |
Niveles de actividad VWF:RCo y FVIII superiores al 50% |
* Esto puede necesitar continuar durante hasta 3 días en hemorragias leves y 5-7 días en hemorragias graves.
Las dosis repetidas se administran durante el tiempo que sea necesario en función del seguimiento reiterado de las medidas clínicas y de laboratorio adecuadas.
Aunque la dosis puede estimarse de acuerdo con las pautas anteriores, se recomienda encarecidamente que siempre que sea posible, se realicen pruebas de laboratorio adecuadas en el plasma del paciente en intervalos apropiados para garantizar que se han alcanzado y mantenido niveles adecuados de actividad VWF:RCo y FVIII.
En el improbable caso de que un paciente que esté sangrando activamente se salte una dosis, puede ser apropiado adoptar una dosificación en función del nivel de los factores de coagulación medidos, la extensión del sangrado y la condición clínica del paciente.
2.3 Administración
Wilate se administra por infusión intravenosa. Wilate se suministra con un dispositivo de transferencia Mix2Vial
TM
para la reconstitución del polvo liofilizado en diluyente, una jeringa de 10 mL, un conjunto de infusión y dos hisopos con alcohol.
Instrucciones para la reconstitución:
|
|
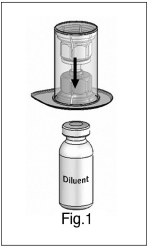
1) Calentar el Polvo y el Diluyente en los viales cerrados hasta la temperatura ambiente. Esta temperatura debe mantenerse durante la reconstitución. Si se utiliza un baño de agua para calentar, se debe tener cuidado de evitar que el agua entre en contacto con los tapones de goma (sin látex) o las tapas de los viales. La temperatura del baño de agua no debe exceder los +37 °C (98 °F).
2) Retirar las tapas del vial del concentrado (Wilate) y del vial del diluyente y limpiar los tapones de goma con un hisopo con alcohol. |
|
|
3) Despegar la tapa del paquete exterior del dispositivo de transferencia Mix2Vial™. Para mantener la esterilidad, dejar el dispositivo Mix2Vial™ en el empaque exterior transparente. Colocar el vial del diluyente sobre una superficie nivelada y sujetar el vial firmemente. Tomar el Mix2Vial™ en su empaque exterior e invertirlo sobre el vial del diluyente. Empujar el cánula de plástico azul del Mix2Vial™ firmemente a través del tapón de goma del vial del diluyente (Fig. 1). Mientras sujetamos el vial del diluyente, retirar cuidadosamente el empaque exterior del Mix2Vial™, teniendo cuidado de dejar que el Mix2Vial™ esté firmemente unido al vial del diluyente (Fig. 2). |
|
|
4) Con el vial del concentrado (Wilate) sostenido firmemente sobre una superficie nivelada, invertir rápidamente el vial del diluyente con el Mix2Vial™ unido y empujar el extremo de la cánula de plástico transparente del Mix2Vial™ firmemente a través del tapón del concentrado (Wilate) (Fig. 3). El diluyente se extraerá hacia el vial del concentrado (Wilate) por el vacío. |
|
|
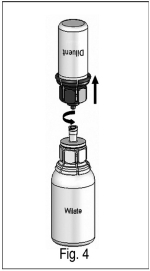
5) Con ambos viales todavía unidos, girar suavemente el vial del producto para asegurar que el producto se disuelva completamente en una solución clara. Una vez que los contenidos del vial de Wilate se hayan disuelto por completo, sujetar firmemente ambas partes, la transparente y la azul del Mix2Vial™. Girar el Mix2Vial™ en dos piezas separadas (Fig. 4) y desechar el vial del diluyente vacío y la parte azul del Mix2Vial™. |
- El polvo debe reconstituirse solo inmediatamente antes de la inyección. Como Wilate no contiene conservantes, la solución debe usarse inmediatamente después de la reconstitución.
- Los productos farmacéuticos parenterales deben inspeccionarse visualmente en busca de partículas y decoloración antes de la administración, siempre que la solución y el recipiente lo permitan.
- La solución filtrada es clara o ligeramente opalescente, incolora o ligeramente amarilla. Si el concentrado no se disuelve por completo o se forma un agregado, la preparación no debe usarse.
Instrucciones para la inyección:
- Con el vial de Wilate aún en posición vertical, conectar una jeringa plástica desechable al Mix2Vial™ (parte transparente de plástico). Invertir el sistema y extraer el Wilate reconstituido en la jeringa.
- Una vez que Wilate se haya transferido a la jeringa, sujetar firmemente el cilindro de la jeringa (manteniendo el émbolo de la jeringa hacia abajo) y desconectar el Mix2Vial™ de la jeringa. Desechar el Mix2Vial™ (parte transparente de plástico) y el vial de Wilate vacío.
- Limpiar el sitio de inyección previsto con un hisopo con alcohol.
- Conectar una aguja de infusión adecuada a la jeringa.
- Inyectar la solución intravenosamente a una velocidad lenta de 2-4 mL/minuto.
- Como medida de precaución, se debe medir la frecuencia del pulso del paciente antes y durante la inyección. Si se produce un aumento marcado en la frecuencia del pulso, la velocidad de inyección debe reducirse o la administración debe interrumpirse.
- Cualquier producto no utilizado o material de desecho debe desecharse de acuerdo con los requisitos locales.
Incompatibilidades
Wilate no debe mezclarse con otros productos medicinales ni administrarse simultáneamente con otras preparaciones intravenosas en el mismo conjunto de infusión.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Wilate es un polvo estéril liofilizado para reconstitución para inyección intravenosa, disponible en las siguientes concentraciones nominales por frasco:
- 500 UI de VWF:RCo y 500 UI de actividad FVIII en 5 mL
- 1000 UI de VWF:RCo y 1000 UI de actividad FVIII en 10 mL
4 CONTRAINDICACIONES
Wilate está contraindicado en pacientes que hayan experimentado una reacción anafiláctica o sistémica grave a productos derivados del plasma, a cualquier ingrediente de la formulación o a componentes del envase. Para obtener una lista completa de los ingredientes, consulte
Descripción
(
11
).
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Hipersensibilidad
Se han observado reacciones de hipersensibilidad o alérgicas (que pueden incluir angioedema, ardor y picazón en el sitio de infusión, escalofríos, enrojecimiento, urticaria generalizada, dolor de cabeza, ronchas, hipotensión, letargo, náuseas, inquietud, taquicardia, opresión en el pecho, hormigueo, vómitos, sibilancias) al usar Wilate, y en algunos casos pueden progresar a anafilaxia grave (incluido el shock) con o sin fiebre.[
2
] Monitoree de cerca a los pacientes que reciben Wilate y observe cuidadosamente cualquier síntoma durante el período de infusión.
Informe a los pacientes sobre los primeros signos de reacciones de hipersensibilidad, que incluyen ronchas, urticaria generalizada, opresión en el pecho, sibilancias, hipotensión y anafilaxia. Si se presentan síntomas alérgicos, suspenda la administración de inmediato y comuníquese con el médico. Dado que los anticuerpos inhibidores pueden ocurrir simultáneamente con reacciones anafilácticas, los pacientes que experimenten una reacción anafiláctica también deben evaluarse para detectar la presencia de inhibidores.[
2
]
5.2 Riesgo tromboembólico
Cuando se utiliza un producto que contiene FVIII y VWF, el médico tratante debe tener en cuenta que el tratamiento continuado puede causar un aumento excesivo de la actividad de FVIII.[
1
] Monitoree los niveles plasmáticos de VWF:RCo y las actividades de FVIII en los pacientes que reciben Wilate para evitar niveles sostenidamente elevados de actividad de VWF y FVIII, lo que puede aumentar el riesgo de eventos trombóticos.
5.3 Formación de inhibidores
Los pacientes con VWD, especialmente los pacientes de tipo
3
, pueden desarrollar anticuerpos neutralizantes (inhibidores) contra VWF. Si un paciente desarrolla inhibidores de VWF (o FVIII), la afección se manifestará como una respuesta clínica inadecuada. Por lo tanto, si no se alcanzan los niveles plasmáticos de actividad de VWF esperados, o si el sangrado no se controla con una dosis adecuada o dosis repetidas, realice un análisis adecuado para determinar si hay un inhibidor de VWF presente. En pacientes con anticuerpos contra VWF, el VWF no es efectivo y la infusión de esta proteína puede provocar eventos adversos graves. Considere otras opciones terapéuticas para dichos pacientes. La atención de estos pacientes debe ser dirigida por médicos con experiencia en el cuidado de pacientes con trastornos hemostáticos.[
3
] En todos estos casos, se recomienda ponerse en contacto con un centro especializado en trastornos hemorrágicos.
Dado que los anticuerpos inhibidores pueden ocurrir simultáneamente con reacciones anafilácticas, los pacientes que experimenten una reacción anafiláctica también deben evaluarse para detectar la presencia de inhibidores.[
2
]
5.4 Riesgo de infección por plasma humano
Wilate se fabrica a partir de plasma humano. Debido a que este producto se fabrica a partir de sangre humana, puede llevar un riesgo de transmisión de agentes infecciosos, como virus, y teóricamente, el agente de la enfermedad de Creutzfeldt-Jakob variante (vCJD). También existe la posibilidad de que haya agentes infecciosos desconocidos en dichos productos. El riesgo de que estos productos transmitan virus se ha reducido mediante la selección de donantes de plasma que hayan estado expuestos previamente a ciertos virus, mediante pruebas para detectar la presencia de ciertas infecciones virales actuales, y mediante la inactivación y eliminación de ciertos virus durante la fabricación. A pesar de estas medidas, estos productos aún pueden transmitir enfermedades. [
4
]
Registre el número de lote del producto cada vez que se administre Wilate a un paciente y considere la vacunación adecuada (contra el virus de la hepatitis A y B) de los pacientes que reciben Wilate de forma regular o repetida. TODAS las infecciones que un médico sospeche que posiblemente hayan sido transmitidas por este producto deben ser informadas por el médico u otro proveedor de atención médica a Octapharma USA, Inc., número de teléfono 1-866-766-4860.
5.5 Monitoreo y pruebas de laboratorio
Monitoree los niveles plasmáticos de VWF:RCo y las actividades de FVIII en los pacientes que reciben Wilate para evitar niveles sostenidamente elevados de actividad de VWF y FVIII, lo que puede aumentar el riesgo de eventos trombóticos, especialmente en pacientes con factores de riesgo clínicos o de laboratorio conocidos.
Monitoree el desarrollo de inhibidores de VWF y FVIII. Realice análisis para determinar si hay inhibidores de VWF y/o FVIII presentes si el sangrado no se controla con la dosis esperada de Wilate. [
5
]
6 REACCIONES ADVERSAS
Las reacciones adversas más comunes al tratamiento con Wilate en pacientes con VWD han sido urticaria y mareos.
Las reacciones adversas más graves al tratamiento con Wilate en pacientes con VWD han sido reacciones de hipersensibilidad.
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no se pueden comparar directamente con las tasas en los ensayos clínicos de otro medicamento y es posible que no reflejen las tasas observadas en la práctica clínica.
Hubo 92 pacientes con VWD que recibieron Wilate en 5676 ocasiones, incluyendo estudios clínicos que involucraron el uso profiláctico, tratamiento a demanda, cirugía y farmacocinética. Sus datos de seguridad mostraron que las reacciones adversas más comunes fueron urticaria y mareos (cada una con 2 pacientes; 2.2%). También hubo cuatro pacientes (4.4%) que mostraron seroconversión de anticuerpos contra el parvovirus B19 sin signos clínicos de enfermedad. No se ha informado de seroconversión desde la implementación de pruebas de minipool en el plasma utilizado para la fabricación de Wilate.
6.2 Experiencia posterior a la comercialización
Las siguientes reacciones adversas se han identificado durante el uso posterior a la aprobación de Wilate. Debido a que estas reacciones se informan voluntariamente desde una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al producto.
Las reacciones adversas posteriores a la comercialización informadas en pacientes tratados por VWD incluyen reacciones de hipersensibilidad, disnea, náuseas, vómitos y tos.
7 INTERACCIONES MEDICAMENTOSAS
No se conocen interacciones con otros medicamentos.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Categoría C en el embarazo. No se han realizado estudios de reproducción animal con Wilate. Tampoco se sabe si Wilate puede causar daño fetal cuando se administra a una mujer embarazada o puede afectar la capacidad reproductiva. Wilate solo debe administrarse a una mujer embarazada si es claramente necesario.
8.2 Trabajo de parto y parto
Wilate no se ha estudiado en el trabajo de parto o el parto. Sólo debe administrarse a mujeres deficientes en VWF durante el trabajo de parto o el parto si está claramente indicado. [
6
]
8.4 Uso pediátrico
Once pacientes pediátricos con VWD entre 5 y 16 años de edad (8 de tipo 3, 1 de tipo 2, 2 de tipo 1) fueron tratados con Wilate por 234 episodios de hemorragia (EHs) en estudios clínicos. Estos estudios mostraron que el 88% de las EHs fueron tratadas con éxito en esta población (
Tabla 7
). No se necesita ajuste de dosis para pacientes pediátricos ya que las dosis administradas fueron similares a las utilizadas en la población adulta (
Tabla 8
).
8.5 Uso geriátrico
Aunque algunos de los pacientes que participaron en los estudios de Wilate tenían más de 65 años, el número de pacientes fue insuficiente para permitir un análisis de subgrupo que apoyara recomendaciones en la población geriátrica.
11 DESCRIPCIÓN
Wilate es un complejo de Factor de von Willebrand/Factor VIII de Coagulación (Humano) purificado, estéril y derivado de plasma humano. Wilate se suministra como un polvo liofilizado para reconstitución para inyección intravenosa.
Wilate está etiquetado con las actividades reales de VWF:RCo y FVIII en UI por vial. La actividad de VWF (VWF:RCo) se determina utilizando un método de aglutinación manual referenciado al “Estándar Internacional de la OMS para el Concentrado de Factor de von Willebrand”. La actividad de FVIII se determina utilizando un ensayo de sustrato cromogénico referenciado al “Estándar Internacional de la OMS para el Concentrado de Factor VIII de Coagulación Humana”. Las metodologías de ensayo son de acuerdo con la Farmacopea Europea (Ph.Eur.).
Wilate no contiene conservantes. El diluyente para la reconstitución del polvo liofilizado es Agua para Inyección con 0.1% de Polisorbato 80.
No se añade albúmina como estabilizador. La actividad específica resultante de Wilate es ≥ 60 UI de VWF:RCo y ≥ 60 UI de actividad de FVIII por mg de proteína total.
La composición nominal de Wilate es la siguiente:
| Componente | Cantidad/ Vial de 5 mL | Cantidad/ Vial de 10 mL |
|---|---|---|
|
VWF:RCo |
500 UI |
1000 UI |
|
FVIII |
500 UI |
1000 UI |
|
Proteína total |
≤ 7.5 mg |
≤ 15.0 mg |
|
Glicina |
50 mg |
100 mg |
|
Sacarosa |
50 mg |
100 mg |
|
Cloruro de sodio |
117 mg |
234 mg |
|
Citrato de sodio |
14.7 mg |
29.4 mg |
|
Cloruro de calcio |
0.8 mg |
1.5 mg |
|
Agua para inyección |
5 mL |
10 mL |
|
Polisorbato 80 |
1 mg/mL |
1 mg/mL |
Wilate se deriva de grandes pools de plasma humano recolectados en centros de donación de plasma aprobados por la FDA de EE. UU. Todas las donaciones de plasma se someten a pruebas de marcadores virales de acuerdo con los requisitos de las directrices de la UE CPMP y la FDA. Además, el límite para el título de ADN del parvovirus B19 humano en el pool de fabricación se establece para no exceder 10
4
UI/mL.
El producto se fabrica a partir de crioprecipitado, que se reconstituye en un tampón y se trata con hidróxido de aluminio seguido de dos pasos de cromatografía diferentes, ultrafiltración y diafiltración, y filtración estéril. El proceso de fabricación incluye dos pasos de inactivación viral, a saber, el tratamiento con una mezcla de solvente orgánico/detergente (S/D), compuesta por fosfato de tri-n-butilo (TNBP) y Octoxinol-9, y un tratamiento térmico en seco terminal (TDH) del producto liofilizado en el envase final [a +100°C (212°F) durante 120 minutos a un nivel de humedad residual especificado de 0.
7
– 1.6%]. Además, el paso de cromatografía de intercambio iónico utilizado durante la fabricación de Wilate también elimina algunos virus [
7
]. Los factores de reducción de virus acumulativos medios de estos pasos se resumen en
Tabla 2
.
Tabla 2 Reducción de Virus Durante la Fabricación de Wilate
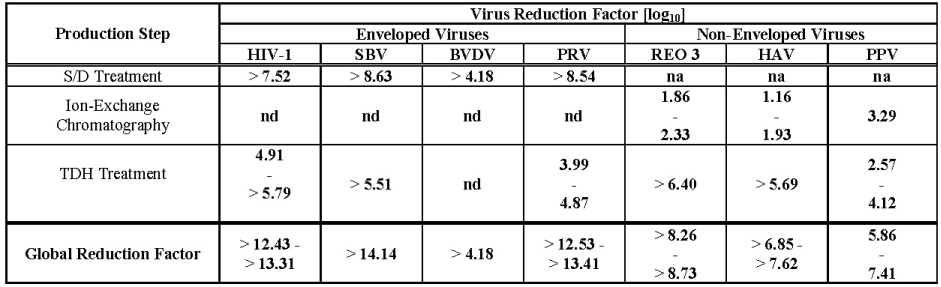
na: no aplicable
nd: no realizado (reagentes S/D presentes)
VIH-1: Virus de Inmunodeficiencia Humana – 1
SBV: Virus Sindbis
BVDV: Virus de la Diarrea Viral Bovina
PRV: Virus de la Pseudorrabia
REO 3: Reovirus Tipo 3
HAV: Virus de la Hepatitis A
PPV: Parvovirus Porcino
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
VWF y FVIII son constituyentes normales del plasma humano. VWF es una proteína multimérica con dos funciones clave. Es una molécula adhesiva, que media la unión entre las plaquetas y los tejidos subendoteliales dañados. También es una proteína portadora, involucrada en el transporte y la estabilización de FVIII. Los pacientes que sufren de VWD tienen una deficiencia o anormalidad de VWF. Esta reducción en la concentración de VWF en el flujo sanguíneo resulta en una actividad de FVIII correspondientemente baja y una función anormal de la plaqueta, lo que resulta en hemorragia excesiva. [
8
]
El VWF en Wilate se deriva del plasma humano normal y se espera que se comporte de la misma manera que el VWF endógeno. Por lo tanto, la administración de VWF permite la corrección de las anormalidades hemostáticas en pacientes con VWD en dos niveles:
- El VWF restablece la adhesión de las plaquetas al subendotelio vascular en el sitio del daño vascular (ya que se une tanto al subendotelio vascular como a la membrana de la plaqueta), proporcionando hemostasia primaria, como se muestra por la reducción del tiempo de sangrado. Este efecto se produce inmediatamente.
-
El VWF induce la corrección de la deficiencia asociada de FVIII en VWD. Administrada por vía intravenosa, VWF se une con FVIII endógeno (que es producido normalmente por el paciente), y al estabilizar este factor, evita su rápida degradación. Esta acción se retrasa ligeramente. Sin embargo, la administración de una preparación de VWF que contiene FVIII como Wilate restaura rápidamente el nivel de actividad de FVIII a lo normal. [
8
]
12.3 Farmacocinética
Se realizó un estudio abierto, prospectivo, aleatorizado, controlado, de dos brazos en cruce de fase 2 con Wilate y un producto comparador en 6 sitios en los EE. UU. En este estudio, los perfiles farmacocinéticos (PC) de Wilate se determinaron por la actividad de FVIII, VWF: RCo, VWF: Ag y VWF: CB.
Cada uno de los veintidós sujetos con VWD hereditario [Tipo 1, n = 6; Tipo 2, n = 9 (6 Tipo 2A, 1 Tipo 2B y 2 Tipo 2M); y Tipo 3, n = 7] recibió una dosis intravenosa en bolo de Wilate que contenía aproximadamente 40 UI de VWF: RCo / kg PC. Veinte sujetos completaron el estudio según el protocolo. Los parámetros de PC de VWF: RCo y FVIII se resumen en
Tabla 3
y
Tabla 4
, respectivamente.
Tabla 3 Parámetros farmacocinéticos de VWF: RCo: media ± DE (rango)
| Parámetros | Tipo VWD I (n = 5) | Tipo VWD II (n = 9) | Tipo VWD III (n = 6) | Total (n = 20) |
|---|---|---|---|---|
|
Cmax (UI/dL) |
74 ± 13 (62 – 91) |
77 ± 18 (40 – 100) |
79 ± 13 (65 – 102) |
76 ± 15 (40 – 102) |
|
AUC(0-inf) (UI*h/dL) |
1633 ± 979 (984 – 3363) |
1172 ± 421 (571 – 1897) |
995 ± 292 (527 – 1306) |
1235 ± 637 (527 – 3363) |
|
Semivida (hrs) |
24,7 ± 17,9 (11,2 – 48,5 ) |
15,3 ± 6,3 (6,0 – 26,4) |
9,1 ± 2,6 (5,7 – 12,9 ) |
15,8 ± 11,0 (5,7 – 48,5) |
|
CL (mL/h/kg) |
3,1 ± 1,1 (1,2 – 4,1) |
4,1 ± 1,7 (2,0 – 7,1) |
4,2 ± 1,4 (3,0 – 6,6) |
3,9 ± 1,5 (1,2 – 7,1) |
|
Vss (mL/kg) |
81,7 ± 38,5 (15,3 – 74,2) |
76,6 ± 35,4 (45,3 – 158,8) |
49,4 ± 16,7 (29,7 – 67,1) |
69,7 ± 33,2 (29,7 – 158,8) |
|
MRT (hrs) |
32,7 ± 25,8 (15,3 – 74,2) |
19,7 ± 5,6 (9,9 – 27,1) |
11,9 ± 2,9 (9,2 – 15,9) |
20,6 ± 14,8 (9,2 – 74,2) |
Recuperación
(%IU/kg)
1.8 ± 0.2
(1.5 – 2.0)
1.8 ± 0.5
(1.0 – 2.4)
2.1 ± 0.3
(1.8 – 2.6)
1.9 ± 0.4
(1.0 – 2.6)
C
max
= concentración máxima; AUC = área bajo la curva; CL = aclaramiento; Vss = volumen de distribución en estado estable; MRT = tiempo medio de residencia
Los parámetros farmacocinéticos reportados en
Tabla 3
se basan en los valores de VWF:RCo obtenidos utilizando un método analítico modificado del Sistema de Coagulación Behring (BCS). Se utilizó el BCS modificado debido a su menor variabilidad validada en comparación con el BCS estándar. Las concentraciones medidas (IU VWF:RCo/mL) son más altas con el BCS modificado que con el método analítico estándar del BCS que se utiliza en algunos laboratorios clínicos. La C
max
ajustada a la dosis y el AUC determinados por este método modificado del BCS son aproximadamente 1.5 veces más altos que los obtenidos por el método estándar del BCS. No se ha encontrado diferencia en la recuperación incremental.
Tabla 4 Parámetros Farmacocinéticos de FVIII:C: media ± SD (rango) – cromogénico
| Parámetros | Tipo I de VWD (n = 5) | Tipo II de VWD (n = 8*) | Tipo III de VWD (n = 6) | Total (n = 19*) |
|---|---|---|---|---|
|
Cmax (IU/dL) |
117.1 ± 12.1 (103 – 135) |
147.2 ± 32.6 (102 – 206) |
120 ± 23 (91 – 148) |
112 ± 23 (59 – 148) |
|
AUC(0-inf) (IU*hr/dL) |
1187 ± 382 (523 – 1483) |
1778 ± 1430 (544 – 4821) |
2670 ± 854 (1874 – 3655) |
2290 ± 1045 (464 – 4424) |
|
Vida media (hrs) |
17.5 ± 4.9 (10.9 – 23.8) |
23.6 ± 8.3 (12.6 – 34.7) |
16.1 ± 3.1 (11.8 – 20.1) |
19.6 ± 6.9 (10.9 – 34.7) |
|
CL (mL/h/kg) |
4.4 ± 3.7 (2.5 – 11.0) |
2.5 ± 0.9 (1.2 – 3.5) |
2.0 ± 0.6 (1.4 – 2.8) |
2.9 ± 2.1 (1.2 – 11.0) |
|
Vss (mL/kg) |
95.0 ± 53.8 (57.1 – 190.0) |
79.5 ± 23.1 (52.8 – 116.2) |
44.2 ± 10.4 (31.8 – 57.1) |
72.4 ± 36.2 (31.8 – 190.0) |
|
MRT (hrs) |
24.1 ± 5.5(17.2 – 31.5) |
35.1 ± 14.2 (17.5 – 61.6) |
23.0 ± 3.7 (18.0 – 27.7) |
28.4 ± 11.1 (17.2 – 61.6) |
|
Recuperación (%IU/kg) |
1.9 ± 0.5 (1.1 – 2.5) |
2.2 ± 0.4 (1.6 – 2.8) |
2.5 ± 0.5 (2.0 – 3.0) |
2.2 ± 0.5 (1.1 – 3.0) |
C
max
= concentración máxima; AUC = área bajo la curva; CL = aclaramiento; Vss = volumen de distribución en estado estable; MRT = tiempo medio de residencia
Efecto de la edad y el tipo de VWD en la farmacocinética de Wilate:
Debido al tamaño pequeño de la muestra (en subconjuntos de edad o tipo de VWD) y a la alta variabilidad farmacocinética, es difícil concluir si la edad o el tipo de VWD tuvieron algún impacto en la farmacocinética de Wilate.
Efecto del género en la farmacocinética de Wilate:
Según los datos farmacocinéticos de Wilate de 8 hombres y 12 mujeres, parece que las mujeres (4.35 ± 1.54 mL/hr/kg) tenían un aclaramiento de VWF:RCo más alto que los hombres (3.16 ± 1.19 mL/hr/kg). No se conoce la importancia clínica de este hallazgo.
14 ESTUDIOS CLÍNICOS
La eficacia clínica de Wilate en el control del sangrado en pacientes con VWD se determinó en cuatro estudios clínicos prospectivos. Esto incluyó el tratamiento de 1068 episodios de sangrado (BEs). Los datos se obtuvieron de 70 pacientes con VWD, de los cuales 37 tenían tipo 3. Los BEs se resumen en
Tabla 5
. Los BEs tratados se analizaron en cuanto a eficacia utilizando un conjunto de criterios objetivos además de una escala subjetiva de eficacia hemostática de 4 puntos (excelente, bueno, moderado y ninguno). Al evaluar la eficacia utilizando estos criterios objetivos, el tratamiento de un episodio de sangrado se clasificó como éxito solo si ninguno de los criterios enumerados a continuación se cumplía:
- el episodio también se trató con otro producto que contiene VWF (excluyendo sangre entera),
- el paciente recibió una transfusión de sangre durante el episodio,
- tratamiento de seguimiento con una dosis diaria de Wilate que fue igual o superior al 50% (≥ 50%) de la dosis inicial (para episodios de sangrado con más de 1 día de tratamiento),
-
duración del tratamiento de más de 4 días (>
4 días) en casos de sangrado grave (que no sea gastrointestinal), -
duración del tratamiento de más de 3 días (>
3 días) en casos de sangrado moderado (que no sea gastrointestinal), -
duración del tratamiento de más de 2 días (>
2 días) en casos de sangrado leve (que no sea gastrointestinal), - la última calificación de eficacia del episodio de sangrado fue ‘moderada’ o ‘ninguna’.
Entre los 70 pacientes con VWD que recibieron Wilate en estudios clínicos (excluyendo el estudio de PK), 45 de ellos recibieron tratamiento a demanda para BEs. Utilizando los criterios objetivos mencionados anteriormente, la eficacia correspondiente para cada evento de sangrado se clasificó como exitosa en el 84% de los episodios. En estos 45 pacientes con BEs, el 93% de los BEs tratados con éxito ocurrieron en pacientes con VWD tipo 3 (n=25).
Tabla 5 Proporción de tratamientos exitosos de episodios de sangrado con Wilate (n=45)
| 95% CI | ||||
|---|---|---|---|---|
|
Episodios* |
Exitosos |
% Éxitos |
CL Inferior |
CL Superior |
|
1068 |
898 |
84.1 |
81.8 |
86.2 |
La información de dosificación para las 972 “episodios de sangrado” tratados con éxito (1.423 infusiones) de sangrado regional se resume en
Tabla 6
. Con el fin de atribuir éxito/fallo al sangrado regional que se produjo al mismo tiempo, el sangrado en diferentes sitios en el mismo intervalo de tiempo se consideraría como BEs separados. Así, el número de estos “episodios” sería diferente del de la evaluación general de éxito/fallo de Wilate en el tratamiento de los episodios de sangrado en
Tabla 5
.
Tabla 6 Dosis administradas (VWF:RCo en UI/kg) en episodios de sangrado * tratados con éxito con Wilate: Media ± DE (Rango) (n = 45)
| Ubicación | Todas las dosis consideradas | Dosis inicial | Dosis posteriores | |||
|---|---|---|---|---|---|---|
|
|
# de infusiones |
Dosis: Media ± DE (Rango) |
# de infusiones |
Dosis: Media ± DE (Rango) |
# de infusiones |
Dosis: Media ± DE (Rango) |
|
Articulaciones |
801 |
26 ± 12 (7 – 69) |
542 |
28 ± 13 (7 – 69) |
259 |
21 ± 10 (7 – 60) |
|
Epistaxis |
132 |
24 ± 11 (8 – 78) |
91 |
25 ± 10 (13 – 78) |
41 |
22 ± 14 (8 – 77) |
|
Tracto GI |
125 |
40 ± 20 (9 – 76) |
64 |
43 ± 19 (9 – 76) |
61 |
36 ± 21 (9 – 76) |
|
Oral |
41 |
26 ± 14 (8 – 80) |
33 |
27 ± 14 (10 – 80) |
8 |
24 ± 18 (8 – 60) |
|
Ginecológico |
87 |
27 ± 14 (9 – 77) |
52 |
28 ± 17 (12 – 77) |
35 |
26 ± 9 (9 – 52) |
|
Otros ** |
237 |
23 ± 12 (10 – 95) |
189 |
24 ± 12 (12 – 95) |
48 |
20 ± 13 (10 – 95) |
**”Otro” incluye principalmente hemorragias musculares, hematuria, equimosis, hematoma y otros sitios misceláneos de hemorragia.
La mayoría de los episodios de hemorragia fueron tratados durante 1-3 días. En pacientes con hemorragias gastrointestinales, la duración del uso del producto para controlar la hemorragia podría ser mucho más larga (hasta 7 días).
Para pacientes pediátricos (≤ 16 años), se proporciona un resumen del número de episodios de hemorragia tratados y los correspondientes grados de eficacia objetiva en
Tabla 7
.
Tabla 7 Eficacia en episodios de hemorragia en la población pediátrica (5 a 16 años) (n = 11) – Proporción de tratamientos exitosos de episodios de hemorragia con Wilate
| 95% IC | ||||
|---|---|---|---|---|
|
Episodios* |
Exitoso |
% éxitos |
IC inferior |
IC superior |
|
234 |
205 |
87,6 |
82,7 |
91,5 |
La información de dosificación para los 211 episodios de sangrado tratados con éxito (289 infusiones) se resume en
Tabla 8
. Se cuentan múltiples sitios de sangrado como episodios separados.
Tabla 8 Dosis administradas (VWF:RCo en UI/kg) en episodios de sangrado* tratados con éxito con Wilate en la población pediátrica (5 a 16 años) (n = 11): Media ± DE (Rango)
| Ubicación | Todas las dosis consideradas | Dosis inicial | Dosis posteriores | |||
|---|---|---|---|---|---|---|
|
|
Número de infusiones |
Dosis: Media ± DE (Rango) |
Número de infusiones |
Dosis: Media ± DE (Rango) |
Número de infusiones |
Dosis: Media ± DE (Rango) |
|
Articulaciones |
158 |
30 ± 13 (12 – 69) |
117 |
32 ± 13 (14 – 69) |
41 |
25 ± 9 (12 – 62) |
|
Epistaxis |
30 |
27 ± 14 (12 – 77) |
25 |
25 ± 10 (14 – 52) |
5 |
37 ± 25 (12 – 77) |
|
Tracto gastrointestinal |
1 |
22 (N/A) |
1 |
22 (N/A) |
0 |
N/A |
|
Oral |
23 |
25 ± 8 (16 – 52) |
21 |
24 ± 8 (16 – 52) |
2 |
25 ± 13 (16 – 35) |
|
Ginecológico |
58 |
27 ± 13 (12 – 69) |
33 |
27 ± 16 (12 – 69) |
25 |
26 ± 8 (12 – 52) |
|
Otro* |
19 |
25 ± 7 (16 – 37) |
14 |
27 ± 7 (19 – 37) |
5 |
19 ± 4 (16 – 26) |
**”Otro” incluye principalmente sangrados musculares, hematuria, equimosis, hematoma y otros sitios de sangradoMisceláneos
15 REFERENCIAS
- Mannucci P.M.: Trombosis venosa emboólica en la enfermedad de von Willebrand. Thromb Haemost 2002; 88: 378-379
- Mollison.P.L., Engelfriet C.P., Contreras M.: Algunos efectos desfavorables de la transfusión; en Klein H.G., Anstee D.J. (eds): Mollison’s Blood Transfusion in Clinical Medicine. Blackwell Publishing, 2005, pp 666-700
- Mannucci P.M., Federici A.B.: Anticuerpos contra el factor de von Willebrand en la enfermedad de von Willebrand; en Aledort L.M. (ed): Inhibidores a los Factores de Coagulación. Nueva York, Plenum Press, 1995, pp 87-92
- Y. Kasper, C.K., Kipnis, S.A. Hepatitis y Concentrados de Factores de Coagulación. JAMA1972; 221: 510
- X. Biggs, R. Ictericia y Anticuerpos Dirigidos contra los Factores VIII y IX en Pacientes Tratados por Hemofilia o Enfermedad de Christmas en el Reino Unido. Br J Haematol 1974; 26: 313-329
- Azzi A., Morfini M., Mannucci P.M.: La transmisión asociada a la transfusión del parvovirus B19. Transfus.Med.Rev. 1999; 13: 194-204
- Stadler M., et al. Caracterización de un nuevo concentrado de doble inactivación de virus de alto grado de pureza de factor de von Willebrand y factor VIII (Wilate). DOI: 10.1016/j.biologicals. Biologicals 2006, 34: 281-288 1-8.
- Mannucci P.M.: Tratamiento de la enfermedad de von Willebrand. New England Journal of Medicine 2004; 351: 683-694
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
| Número NDC | Tamaño | Cantidad de proteína |
|---|---|---|
|
67467-182-01 67467-182-02 |
500 UI de actividad VWF:RCo y 500 UI de actividad FVIII en 5 mL 1000 UI de actividad VWF:RCo y 1000 UI de actividad FVIII en 10 mL |
≤ 7,5 mg ≤ 15,0 mg |
- Wilate se suministra en un paquete con un vial de una dosis en polvo y un vial de diluyente (Agua para inyección con 0,1% de polisorbato 80), junto con un dispositivo de transferencia Mix2VialTM, una jeringa de 10 mL, un conjunto de infusión y dos hisopos de alcohol.
- Cada vial de Wilate contiene la cantidad etiquetada de UI de actividad VWF:RCo medida usando un método de aglutinación manual, y UI de actividad FVIII medida con un ensayo con sustrato cromogénico.
- Los componentes utilizados en el empaque de Wilate no contienen látex.
- Almacene Wilate hasta 36 meses a +2°C a +8°C (36°F a 46°F) protegido de la luz desde la fecha de fabricación. Dentro de este período, Wilate puede almacenarse por un período de hasta 6 meses a temperatura ambiente (máximo de +25°C o 77°F). La fecha de inicio del almacenamiento a temperatura ambiente debe registrarse claramente en la caja del producto. Una vez almacenado a temperatura ambiente, el producto no debe volver al refrigerador. La vida útil entonces expira después del almacenamiento a temperatura ambiente, o la fecha de expiración en el vial del producto, la que sea primero. No congelar.
- No use después de la fecha de expiración.
- Almacene en el recipiente original para proteger de la luz.
- Reconstituya el polvo Wilate solo justo antes de la inyección. Use la solución inmediatamente después de la reconstitución. Use la solución reconstituida en una ocasión solo y deseche cualquier solución restante.
17 INFORMACIÓN PARA EL PACIENTE
-
Informe a los pacientes de los signos tempranos de reacciones de hipersensibilidad, incluyendo urticaria, urticaria generalizada, opresión en el pecho, sibilancias, hipotensión y anafilaxia. Si se presentan síntomas alérgicos, los pacientes deben interrumpir la administración de inmediato y contactar a su médico [véase
Advertencias y Precauciones
(
5.1
)]. -
Informe a los pacientes que someterse a múltiples tratamientos con Wilate puede aumentar el riesgo de eventos trombóticos, por lo que se requiere un seguimiento frecuente de las actividades de VWF:RCo y FVIII en el plasma. [véase
Advertencias y Precauciones
(
5.2
)]. -
Informe a los pacientes que existe una posibilidad de desarrollar inhibidores de VWF, lo que puede llevar a una respuesta clínica inadecuada. Por lo tanto, si no se alcanzan los niveles esperados de actividad de VWF en el plasma, o si no se controla el sangrado con una dosis adecuada o dosificación repetida, contactar al médico tratante.[
2
] [véase
Advertencias y Precauciones
(
5.3
)]. -
Informe a los pacientes que a pesar de los procedimientos para la selección de donantes y plasma, así como los de inactivación o eliminación de agentes infecciosos, la posibilidad de transmisión de agentes infecciosos con productos derivados del plasma no puede excluirse por completo [véase
Advertencias y Precauciones
(
5.4
)].
Fabricado por:
Octapharma Pharmazeutika Produktionsges.m.b.H.
Oberlaaer Strasse 235
A-1100 Viena, Austria
Número de licencia en EE.UU.: 1646
Distribuido por:
Octapharma USA Inc.
121 River Street, 12.º piso
Hoboken, NJ 07030
PANEL DE VISUALIZACIÓN PRINCIPAL
ETIQUETA DEL PAQUETE – PANEL PRINCIPAL DE MUESTRA
Factor de Von Willebrand/Factor VIII de Coagulación Complejo (Humano)
Octapharma Pharmazeutika Produktionsges.m.b.H
500 UI/5 mL
NDC 67467-182-01

1000 UI/10 mL
NDC 67467-182-02