Fabricante de medicamentos: Takeda Pharmaceuticals America, Inc. (Updated: 2023-10-13)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
VYVANSE® (lisdexamfetamina dimesilato) cápsulas, para uso oral, CII
VYVANSE® (lisdexamfetamina dimesilato) tabletas masticables, para uso oral, CII
Aprobación inicial en EE. UU.: 2007
ADVERTENCIA: ABUSO, MAL USO Y ADICCIÓN
Consulte la información completa de prescripción para obtener la advertencia completa en recuadro.
VYVANSE tiene un alto potencial de abuso y mal uso, lo que puede conducir al desarrollo de un trastorno por uso de sustancias, incluida la adicción. El mal uso y el abuso de estimulantes del SNC, incluido VYVANSE, pueden provocar sobredosis y muerte (5.1, 9.2, 10):
- Antes de prescribir VYVANSE, evalúe el riesgo de abuso, mal uso y adicción de cada paciente.
- Eduque a los pacientes y sus familias sobre estos riesgos, el almacenamiento adecuado del medicamento y la eliminación adecuada de cualquier medicamento no utilizado.
- Durante todo el tratamiento, vuelva a evaluar el riesgo de cada paciente y controle con frecuencia los signos y síntomas de abuso, mal uso y adicción.
CAMBIOS MAYORES RECIENTES
INDICACIONES Y USO
VYVANSE es un estimulante del sistema nervioso central (SNC) indicado para el tratamiento de (1):
- Trastorno por déficit de atención e hiperactividad (TDAH) en adultos y pacientes pediátricos de 6 años o más
- Trastorno por atracón (BED) moderado a grave en adultos
Limitaciones de uso:
- Los pacientes pediátricos con TDAH menores de 6 años experimentaron más pérdida de peso a largo plazo que los pacientes de 6 años o más (8.4)
- VYVANSE no está indicado para la pérdida de peso. El uso de otros fármacos simpaticomiméticos para la pérdida de peso se ha asociado con eventos adversos cardiovasculares graves. No se ha establecido la seguridad y eficacia de VYVANSE para el tratamiento de la obesidad (5.2)
DOSIFICACIÓN Y ADMINISTRACIÓN
| Población indicada | Dosis inicial | Programa de titulación | Dosis recomendada | Dosis máxima |
|---|---|---|---|---|
| TDAH (Adultos y pacientes pediátricos de 6 años o más) (2.2) | 30 mg cada mañana | 10 mg o 20 mg semanalmente | 30 mg a 70 mg por día | 70 mg por día |
| BED (Adultos) (2.3) | 30 mg cada mañana | 20 mg semanalmente | 50 mg a 70 mg por día | 70 mg por día |
FORMAS DE DOSIFICACIÓN Y FUERZAS
CONTRAINDICACIONES
ADVERTENCIAS Y PRECAUCIONES
- Riesgos para los pacientes con enfermedad cardíaca grave: Evite el uso en pacientes con anomalías cardíacas estructurales conocidas, miocardiopatía, arritmia cardíaca grave, enfermedad de la arteria coronaria u otra enfermedad cardíaca grave (5.2)
- Aumento de la presión arterial y la frecuencia cardíaca: Monitorear la presión arterial y el pulso. (5.3)
- Reacciones adversas psiquiátricas: Antes de iniciar VYVANSE, evaluar a los pacientes para detectar factores de riesgo para desarrollar un episodio maníaco. Si aparecen nuevos síntomas psicóticos o maníacos, considere suspender VYVANSE. (5.4)
- Supresión del crecimiento a largo plazo en pacientes pediátricos: Monitorear de cerca el crecimiento (altura y peso) en pacientes pediátricos. Los pacientes pediátricos que no crecen o no aumentan de altura o peso como se esperaba pueden necesitar interrumpir su tratamiento. (5.5)
- Vasculopatía periférica, incluido el fenómeno de Raynaud: Es necesaria una observación cuidadosa de los cambios digitales durante el tratamiento con VYVANSE. Puede ser apropiada una evaluación clínica adicional (por ejemplo, derivación a reumatología) para los pacientes que desarrollan signos o síntomas de vasculopatía periférica. (5.6)
- Síndrome serotoninérgico: Mayor riesgo cuando se administra conjuntamente con agentes serotoninérgicos (por ejemplo, ISRS, IRSN, triptanes), pero también durante situaciones de sobredosis. Si ocurre, suspenda VYVANSE e inicie un tratamiento de apoyo (4, 5.7, 10)
- Tics motores y verbales, y empeoramiento del síndrome de Tourette: Antes de iniciar VYVANSE, evaluar los antecedentes familiares y evaluar clínicamente a los pacientes para detectar tics o síndrome de Tourette. Monitorear regularmente a los pacientes para detectar la aparición o el empeoramiento de tics o síndrome de Tourette. Suspenda el tratamiento si es clínicamente apropiado. (5.8)
REACCIONES ADVERSAS
Las reacciones adversas más comunes (incidencia ≥5% y a una tasa al menos dos veces mayor que el placebo) en pacientes pediátricos de 6 a 17 años, y/o adultos con TDAH fueron anorexia, ansiedad, disminución del apetito, disminución del peso, diarrea, mareos, boca seca, irritabilidad, insomnio, náuseas, dolor abdominal superior y vómitos (6.1)
Las reacciones adversas más comunes (incidencia ≥ 5% y a una tasa al menos dos veces mayor que el placebo) en adultos con BED fueron boca seca, insomnio, disminución del apetito, aumento de la frecuencia cardíaca, estreñimiento, sensación de nerviosismo y ansiedad (6.1)
Para informar las REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Takeda Pharmaceuticals al 1-800-828-2088 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES MEDICAMENTOSAS
Agentes acidificantes y alcalinizantes: Los agentes que alteran el pH urinario pueden alterar los niveles sanguíneos de anfetamina. Los agentes acidificantes disminuyen los niveles sanguíneos de anfetamina, mientras que los agentes alcalinizantes aumentan los niveles sanguíneos de anfetamina. Ajuste la dosis de VYVANSE según corresponda (2.6, 7.1)
USO EN POBLACIONES ESPECÍFICAS
Ver 17 para INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y Guía de medicamentos.
Revisado: 10/2023
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
ADVERTENCIA: ABUSO, MAL USO Y ADICCIÓN
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Selección previa al tratamiento
2.2 Información general de administración
2.3 Dosis para el tratamiento del TDAH
2.4 Dosis para el tratamiento del BED moderado a grave en adultos
2.5 Dosis en pacientes con insuficiencia renal
2.6 Modificaciones de la dosis debido a interacciones medicamentosas
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Abuso, mal uso y adicción
5.2 Riesgos para pacientes con enfermedad cardíaca grave
5.3 Aumento de la presión arterial y la frecuencia cardíaca
5.4 Reacciones adversas psiquiátricas
5.5 Supresión a largo plazo del crecimiento en pacientes pediátricos
5.6 Vasculopatía periférica, incluido el fenómeno de Raynaud
5.7 Síndrome serotoninérgico
5.8 Tics motores y verbales, y empeoramiento del síndrome de Tourette
6 REACCIONES ADVERSAS
6.1 Experiencia en ensayos clínicos
6.2 Experiencia postcomercialización
7 INTERACCIONES MEDICAMENTOSAS
7.1 Medicamentos que tienen interacciones clínicamente importantes con las anfetaminas
7.2 Medicamentos que no tienen interacciones clínicamente importantes con VYVANSE
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso pediátrico
8.5 Uso geriátrico
8.6 Insuficiencia renal
9 ABUSO Y DEPENDENCIA DE LA DROGA
9.1 Sustancia controlada
9.2 Abuso
9.3 Dependencia
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
12.2 Farmacodinámica
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis e insuficiencia de la fertilidad
13.2 Toxicología y/o farmacología animal
14 ESTUDIOS CLÍNICOS
14.1 Trastorno por déficit de atención e hiperactividad (TDAH)
14.2 Trastorno por atracón (BED)
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANEJO
16.1 Cómo se suministra
16.2 Almacenamiento y manejo
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
ADVERTENCIA RECUADRADA
ADVERTENCIA: ABUSO, USO INDEBIDO Y ADICCIÓN
VYVANSE tiene un alto potencial de abuso y uso indebido, lo que puede llevar al desarrollo de un trastorno por uso de sustancias, incluida la adicción. El uso indebido y abuso de estimulantes del SNC, incluidos VYVANSE, puede provocar sobredosis y muerte [ver Sobredosis (10)], y este riesgo aumenta con dosis más altas o métodos de administración no aprobados, como inhalar por la nariz o inyecciones.
Antes de prescribir VYVANSE, evalúe el riesgo de abuso, uso indebido y adicción de cada paciente. Eduque a los pacientes y sus familias sobre estos riesgos, el almacenamiento adecuado del medicamento y la eliminación adecuada de cualquier medicamento no utilizado. A lo largo del tratamiento con VYVANSE, vuelva a evaluar el riesgo de abuso, uso indebido y adicción de cada paciente y controle con frecuencia signos y síntomas de abuso, uso indebido y adicción [ver Advertencias y Precauciones (5.1), Abuso y Dependencia de Medicamentos (9.2)].
1 INDICACIONES Y USO
VYVANSE® está indicado para el tratamiento de:
- Trastorno por Déficit de Atención e Hiperactividad (TDAH) en adultos y pacientes pediátricos de 6 años o más [ver Estudios Clínicos (14.1)]
- Trastorno por atracón (TA) moderado a grave en adultos [ver Estudios Clínicos (14.2)].
Limitaciones de uso:
- Los pacientes pediátricos con TDAH menores de 6 años experimentaron más pérdida de peso a largo plazo que los pacientes de 6 años o más [ver Uso en poblaciones específicas (8.4)].
- VYVANSE no está indicado ni recomendado para la pérdida de peso. El uso de otros fármacos simpaticomiméticos para la pérdida de peso se ha asociado con eventos adversos cardiovasculares graves. La seguridad y eficacia de VYVANSE para el tratamiento de la obesidad no se han establecido [ver Advertencias y precauciones (5.2)].
2 DOSIS Y ADMINISTRACIÓN
2.1 Evaluación previa al tratamiento
Antes de tratar a pacientes con VYVANSE, evaluar:
- la presencia de enfermedad cardíaca (es decir, realizar una historia clínica cuidadosa, antecedentes familiares de muerte súbita o arritmia ventricular, y examen físico) [ver Advertencias y precauciones (5.2)].
- los antecedentes familiares y evaluar clínicamente a los pacientes para detectar tics motores o verbales o síndrome de Tourette antes de iniciar VYVANSE [ver Advertencias y precauciones (5.8)].
2.2 Información general de administración
Tome VYVANSE por vía oral en la mañana con o sin alimentos; evite las dosis de la tarde debido al potencial de insomnio. VYVANSE se puede administrar de una de las siguientes maneras:
Información para cápsulas de VYVANSE:
- Trague las cápsulas de VYVANSE enteras, o
- Abra las cápsulas, vacíe y mezcle todo el contenido con yogur, agua o jugo de naranja. Si el contenido de la cápsula incluye algún polvo compactado, se puede usar una cuchara para romper el polvo. El contenido debe mezclarse hasta que esté completamente disperso. Consuma toda la mezcla inmediatamente. No debe almacenarse. El ingrediente activo se disuelve completamente una vez disperso; sin embargo, puede quedar una película que contiene los ingredientes inactivos en el vaso o recipiente una vez que se consume la mezcla.
Información para tabletas masticables de VYVANSE:
- Las tabletas masticables de VYVANSE deben masticarse completamente antes de tragarlas.
Las cápsulas de VYVANSE se pueden sustituir por tabletas masticables de VYVANSE en una base de unidad por unidad/mg por mg (por ejemplo, cápsulas de 30 mg para tabletas masticables de 30 mg) [ver Farmacología clínica (12.3)].
No tome menos de una cápsula o tableta masticable por día. Una sola dosis no debe dividirse.
2.3 Dosis para el tratamiento del TDAH
La dosis inicial recomendada en adultos y pacientes pediátricos de 6 años o más es de 30 mg una vez al día en la mañana. La dosis se puede ajustar en incrementos de 10 mg o 20 mg a intervalos de aproximadamente una semana hasta la dosis máxima recomendada de 70 mg una vez al día [ver Estudios clínicos (14.1)].
2.4 Dosis para el tratamiento del BED moderado a grave en adultos
La dosis inicial recomendada en adultos es de 30 mg una vez al día, que se debe titular en incrementos de 20 mg a intervalos de aproximadamente una semana para alcanzar la dosis objetivo recomendada de 50 mg a 70 mg una vez al día. La dosis máxima recomendada es de 70 mg una vez al día [ver Estudios clínicos (14.2)]. Suspenda VYVANSE si el atracón no mejora.
2.5 Dosis en pacientes con insuficiencia renal
En pacientes con insuficiencia renal grave (TFG de 15 a < 30 mL/min/1,73 m2), la dosis máxima no debe exceder los 50 mg una vez al día. En pacientes con enfermedad renal en etapa terminal (ERT, TFG < 15 mL/min/1,73 m2), la dosis máxima recomendada es de 30 mg una vez al día [ver Uso en poblaciones específicas (8.6)].
2.6 Modificaciones de la dosis debido a interacciones medicamentosas
Los agentes que alteran el pH urinario pueden afectar la excreción urinaria y alterar los niveles sanguíneos de anfetamina. Los agentes acidificantes (por ejemplo, ácido ascórbico) disminuyen los niveles sanguíneos, mientras que los agentes alcalinizantes (por ejemplo, bicarbonato de sodio) aumentan los niveles sanguíneos. Ajuste la dosis de VYVANSE en consecuencia [ver Interacciones medicamentosas (7.1)].
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
VYVANSE (lisdexamfetamine dimesylate) capsules:
- Capsules 10 mg: cuerpo rosado/tapa rosada (impresa con S489 y 10 mg)
- Capsules 20 mg: cuerpo marfil/tapa marfil (impresa con S489 y 20 mg)
- Capsules 30 mg: cuerpo blanco/tapa naranja (impresa con S489 y 30 mg)
- Capsules 40 mg: cuerpo blanco/tapa azul verdosa (impresa con S489 y 40 mg)
- Capsules 50 mg: cuerpo blanco/tapa azul (impresa con S489 y 50 mg)
- Capsules 60 mg: cuerpo azul aguamarina/tapa azul aguamarina (impresa con S489 y 60 mg)
- Capsules 70 mg: cuerpo azul/tapa naranja (impresa con S489 y 70 mg)
VYVANSE (lisdexamfetamine dimesylate) comprimidos masticables:
- Comprimidos masticables 10 mg: Comprimido redondo de color blanco a blanquecino con ’10’ grabado en un lado y ‘S489’ en el otro
- Comprimidos masticables 20 mg: Comprimido hexagonal de color blanco a blanquecino con ’20’ grabado en un lado y ‘S489’ en el otro
- Comprimidos masticables 30 mg: Comprimido triangular de arco de color blanco a blanquecino con ’30’ grabado en un lado y ‘S489’ en el otro
- Comprimidos masticables 40 mg: Comprimido en forma de cápsula de color blanco a blanquecino con ’40’ grabado en un lado y ‘S489’ en el otro
- Comprimidos masticables 50 mg: Comprimido cuadrado de arco de color blanco a blanquecino con ’50’ grabado en un lado y ‘S489’ en el otro
- Comprimidos masticables 60 mg: Comprimido de arco de diamante de color blanco a blanquecino con ’60’ grabado en un lado y ‘S489’ en el otro
4 CONTRAINDICACIONES
VYVANSE está contraindicado en pacientes con:
- Hipersensibilidad conocida a los productos de anfetamina u otros ingredientes de VYVANSE. Se han observado reacciones anafilácticas, síndrome de Stevens-Johnson, angioedema y urticaria en informes postcomercialización [ver Reacciones adversas (6.2)].
- Pacientes que toman inhibidores de la monoaminooxidasa (IMAO), o dentro de los 14 días de suspender los IMAO (incluidos los IMAO como linezolid o azul de metileno intravenoso), debido a un mayor riesgo de crisis hipertensiva [ver Advertencias y precauciones (5.7) y Interacciones medicamentosas (7.1)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Abuso, mal uso y adicción
VYVANSE tiene un alto potencial de abuso y mal uso. El uso de VYVANSE expone a las personas a los riesgos de abuso y mal uso, lo que puede conducir al desarrollo de un trastorno por uso de sustancias, incluida la adicción. VYVANSE puede desviarse para uso no médico a canales o distribución ilícitos [ver Abuso y dependencia de drogas (9.2)]. El mal uso y el abuso de estimulantes del SNC, incluido VYVANSE, pueden provocar sobredosis y muerte [ver Sobredosis (10)], y este riesgo aumenta con dosis más altas o métodos de administración no aprobados, como el esnifar o la inyección.
Antes de prescribir VYVANSE, evalúe el riesgo de abuso, mal uso y adicción de cada paciente. Eduque a los pacientes y sus familias sobre estos riesgos y la eliminación adecuada de cualquier medicamento no utilizado. Aconseje a los pacientes que guarden VYVANSE en un lugar seguro, preferiblemente bajo llave, e instruya a los pacientes para que no le den VYVANSE a nadie más. Durante todo el tratamiento con VYVANSE, vuelva a evaluar el riesgo de abuso, mal uso y adicción de cada paciente y controle con frecuencia los signos y síntomas de abuso, mal uso y adicción.
5.2 Riesgos para pacientes con enfermedad cardíaca grave
Se ha informado de muerte súbita en pacientes con anomalías cardíacas estructurales u otras enfermedades cardíacas graves que fueron tratados con estimulantes del SNC a la dosis recomendada para el TDAH. Evite el uso de VYVANSE en pacientes con anomalías cardíacas estructurales conocidas, miocardiopatía, arritmia cardíaca grave, enfermedad de las arterias coronarias u otra enfermedad cardíaca grave.
5.3 Aumento de la presión arterial y la frecuencia cardíaca
Los estimulantes del SNC causan un aumento de la presión arterial (aumento medio de aproximadamente 2 a 4 mm Hg) y la frecuencia cardíaca (aumento medio de aproximadamente 3 a 6 lpm). Algunos pacientes pueden tener aumentos más grandes.
Controle a todos los pacientes tratados con VYVANSE para detectar posibles taquicardia e hipertensión.
5.4 Reacciones adversas psiquiátricas
Exacerbación de la psicosis preexistente
Los estimulantes del SNC pueden exacerbar los síntomas de alteración del comportamiento y trastorno del pensamiento en pacientes con un trastorno psicótico preexistente.
Inducción de un episodio maníaco en pacientes con trastorno bipolar
Los estimulantes del SNC pueden inducir un episodio maníaco o mixto. Antes de iniciar el tratamiento con VYVANSE, evalúe a los pacientes para detectar factores de riesgo de desarrollar un episodio maníaco (por ejemplo, comorbilidad o antecedentes de síntomas depresivos o antecedentes familiares de suicidio, trastorno bipolar y depresión).
Nuevos síntomas psicóticos o maníacos
Los estimulantes del SNC, a la dosis recomendada, pueden causar síntomas psicóticos o maníacos (por ejemplo, alucinaciones, pensamiento delirante o manía) en pacientes sin antecedentes de enfermedad psicótica o manía. En un análisis agrupado de múltiples estudios a corto plazo, controlados con placebo, de estimulantes del SNC, los síntomas psicóticos o maníacos ocurrieron en aproximadamente el 0,1% de los pacientes tratados con estimulantes del SNC en comparación con el 0% de los pacientes tratados con placebo. Si ocurren estos síntomas, considere suspender VYVANSE.
5.5 Supresión del crecimiento a largo plazo en pacientes pediátricos
Los estimulantes del SNC se han asociado con pérdida de peso y disminución de la tasa de crecimiento en pacientes pediátricos.
En un ensayo controlado con placebo de 4 semanas de VYVANSE en pacientes pediátricos de 6 a 12 años de edad con TDAH, hubo una disminución relacionada con la dosis del peso en los grupos de VYVANSE en comparación con el aumento de peso en el grupo placebo. Además, en estudios de otro estimulante, hubo una disminución en el aumento de la altura [ver Reacciones adversas (6.1)].
Controle de cerca el crecimiento (peso y altura) en los pacientes pediátricos tratados con VYVANSE. Los pacientes que no están creciendo o aumentando de altura o peso como se esperaba pueden necesitar interrumpir su tratamiento. VYVANSE no está aprobado para su uso en pacientes pediátricos menores de 6 años de edad [ver Uso en poblaciones específicas (8.4)].
5.6 Vasculopatía periférica, incluido el fenómeno de Raynaud
Los estimulantes del SNC, incluido VYVANSE, utilizados para tratar el TDAH están asociados con vasculopatía periférica, incluido el fenómeno de Raynaud. Los signos y síntomas suelen ser intermitentes y leves; sin embargo, las secuelas han incluido ulceración digital y/o descomposición de tejidos blandos. Los efectos de la vasculopatía periférica, incluido el fenómeno de Raynaud, se observaron en informes posteriores a la comercialización y en las dosis terapéuticas de estimulantes del SNC en todos los grupos de edad durante el curso del tratamiento. Los signos y síntomas generalmente mejoraron después de la reducción de la dosis o la interrupción del estimulante del SNC.
Es necesaria una observación cuidadosa de los cambios digitales durante el tratamiento con VYVANSE. Puede ser apropiada una evaluación clínica adicional (por ejemplo, derivación a reumatología) para los pacientes tratados con VYVANSE que desarrollan signos o síntomas de vasculopatía periférica.
5.7 Síndrome serotoninérgico
El síndrome serotoninérgico, una reacción potencialmente mortal, puede ocurrir cuando las anfetaminas se usan en combinación con otros medicamentos que afectan los sistemas neurotransmisores serotoninérgicos, como los inhibidores de la monoaminooxidasa (IMAO), los inhibidores selectivos de la recaptación de serotonina (ISRS), los inhibidores de la recaptación de serotonina y norepinefrina (IRSN), los triptanes, los antidepresivos tricíclicos, el fentanilo, el litio, el tramadol, el triptófano, la buspirona y la hierba de San Juan [ver Interacciones medicamentosas (7.1)]. La coadministración con inhibidores del citocromo P450 2D6 (CYP2D6) también puede aumentar el riesgo con una mayor exposición al metabolito activo de VYVANSE (dextroanfetamina). En estas situaciones, considere un medicamento alternativo no serotoninérgico o un medicamento alternativo que no inhiba el CYP2D6 [ver Interacciones medicamentosas (7.1)].
Los síntomas del síndrome serotoninérgico pueden incluir cambios en el estado mental (por ejemplo, agitación, alucinaciones, delirio y coma), inestabilidad autonómica (por ejemplo, taquicardia, presión arterial lábil, mareos, diaforesis, rubor, hipertermia), síntomas neuromusculares (por ejemplo, temblor, rigidez, mioclono, hiperreflexia, incoordinación), convulsiones y/o síntomas gastrointestinales (por ejemplo, náuseas, vómitos, diarrea).
El uso concomitante de VYVANSE con medicamentos IMAO está contraindicado [ver Contraindicaciones (4)].
Suspenda el tratamiento con VYVANSE y cualquier agente serotoninérgico concomitante inmediatamente si aparecen síntomas de síndrome serotoninérgico e inicie un tratamiento sintomático de apoyo. Si el uso concomitante de VYVANSE con otros medicamentos serotoninérgicos o inhibidores del CYP2D6 está clínicamente justificado, inicie VYVANSE con dosis más bajas, controle a los pacientes para detectar la aparición del síndrome serotoninérgico durante el inicio o la titulación del medicamento e informe a los pacientes sobre el mayor riesgo de síndrome serotoninérgico.
5.8 Tics motores y verbales, y empeoramiento del síndrome de Tourette
Los estimulantes del SNC, incluida la anfetamina, se han asociado con la aparición o exacerbación de tics motores y verbales. También se ha informado un empeoramiento del síndrome de Tourette [ver Reacciones adversas (6.2)].
Antes de iniciar VYVANSE, evalúe los antecedentes familiares y evalúe clínicamente a los pacientes para detectar tics o síndrome de Tourette. Controle regularmente a los pacientes tratados con VYVANSE para detectar la aparición o el empeoramiento de tics o síndrome de Tourette y suspenda el tratamiento si es clínicamente apropiado.
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas se describen con más detalle en otras secciones del etiquetado:
- Hipersensibilidad conocida a productos de anfetamina u otros ingredientes de VYVANSE [ver Contraindicaciones (4)]
- Crisis hipertensiva cuando se utiliza de forma concomitante con inhibidores de la monoaminooxidasa [ver Contraindicaciones (4) e Interacciones farmacológicas (7.1)]
- Abuso, uso indebido y adicción [ver Recuadro de advertencia, Advertencias y precauciones (5.1) y Abuso y dependencia de drogas (9.2, 9.3)]
- Riesgos para los pacientes con enfermedades cardíacas graves [ver Advertencias y precauciones (5.2)]
- Aumento de la presión arterial y la frecuencia cardíaca [ver Advertencias y precauciones (5.3)]
- Reacciones adversas psiquiátricas [ver Advertencias y precauciones (5.4)]
- Supresión del crecimiento a largo plazo en pacientes pediátricos [ver Advertencias y precauciones (5.5)]
- Vasculopatía periférica, incluido el fenómeno de Raynaud [ver Advertencias y precauciones (5.6)]
- Síndrome serotoninérgico [ver Advertencias y precauciones (5.7)]
- Tics motores y verbales, y empeoramiento del síndrome de Tourette [ver Advertencias y precauciones (5.8)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no pueden compararse directamente con las tasas de los ensayos clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica.
Trastorno por déficit de atención con hiperactividad
Los datos de seguridad de esta sección se basan en los datos de los estudios clínicos controlados de grupos paralelos de 4 semanas de duración de VYVANSE en pacientes pediátricos y adultos con TDAH [ver Estudios clínicos (14.1)].
Reacciones adversas asociadas con la interrupción del tratamiento en ensayos clínicos de TDAH
En el ensayo controlado en pacientes pediátricos de 6 a 12 años (Estudio 1), el 8 % (18/218) de los pacientes tratados con VYVANSE interrumpieron el tratamiento debido a reacciones adversas, en comparación con el 0 % (0/72) de los pacientes tratados con placebo. Las reacciones adversas notificadas con mayor frecuencia (1 % o más y el doble de la tasa del placebo) fueron criterios de voltaje del ECG para la hipertrofia ventricular, tic, vómitos, hiperactividad psicomotora, insomnio, disminución del apetito y erupción cutánea [2 casos para cada reacción adversa, es decir, 2/218 (1 %)]. Las reacciones adversas notificadas con menor frecuencia (menos del 1 % o menos del doble de la tasa del placebo) fueron dolor abdominal superior, sequedad de boca, pérdida de peso, mareos, somnolencia, logorrea, dolor torácico, ira e hipertensión.
En el ensayo controlado en pacientes pediátricos de 13 a 17 años (Estudio 4), el 3 % (7/233) de los pacientes tratados con VYVANSE interrumpieron el tratamiento debido a reacciones adversas, en comparación con el 1 % (1/77) de los pacientes tratados con placebo. Las reacciones adversas notificadas con mayor frecuencia (1 % o más y el doble de la tasa del placebo) fueron disminución del apetito (2/233; 1 %) e insomnio (2/233; 1 %). Las reacciones adversas notificadas con menor frecuencia (menos del 1 % o menos del doble de la tasa del placebo) fueron irritabilidad, dermatilomanía, cambios de humor y disnea.
En el ensayo controlado en adultos (Estudio 7), el 6 % (21/358) de los pacientes tratados con VYVANSE interrumpieron el tratamiento debido a reacciones adversas, en comparación con el 2 % (1/62) de los pacientes tratados con placebo. Las reacciones adversas notificadas con mayor frecuencia (1 % o más y el doble de la tasa del placebo) fueron insomnio (8/358; 2 %), taquicardia (3/358; 1 %), irritabilidad (2/358; 1 %), hipertensión (4/358; 1 %), dolor de cabeza (2/358; 1 %), ansiedad (2/358; 1 %) y disnea (3/358; 1 %). Las reacciones adversas notificadas con menor frecuencia (menos del 1 % o menos del doble de la tasa del placebo) fueron palpitaciones, diarrea, náuseas, disminución del apetito, mareos, agitación, depresión, paranoia e inquietud.
Reacciones adversas que ocurren con una incidencia del ≥5 % o más entre los pacientes tratados con VYVANSE con TDAH en ensayos clínicos
Las reacciones adversas más frecuentes (incidencia ≥5 % y con una tasa al menos dos veces superior a la del placebo) notificadas en pacientes pediátricos de 6 a 17 años, y/o adultos fueron anorexia, ansiedad, disminución del apetito, pérdida de peso, diarrea, mareos, sequedad de boca, irritabilidad, insomnio, náuseas, dolor abdominal superior y vómitos.
Reacciones adversas que ocurren con una incidencia del 2 % o más entre los pacientes tratados con VYVANSE con TDAH en ensayos clínicos
Las reacciones adversas notificadas en los ensayos controlados en pacientes pediátricos de 6 a 12 años (Estudio 1), pacientes pediátricos de 13 a 17 años (Estudio 4) y pacientes adultos (Estudio 7) tratados con VYVANSE o placebo se presentan en las Tablas 1, 2 y 3 a continuación.
| VYVANSE (n=218) |
Placebo (n=72) |
|
|---|---|---|
| Disminución del apetito | 39% | 4% |
| Insomnio | 22% | 3% |
| Dolor abdominal superior | 12% | 6% |
| Irritabilidad | 10% | 0% |
| Vómitos | 9% | 4% |
| Pérdida de peso | 9% | 1% |
| Náuseas | 6% | 3% |
| Sequedad bucal | 5% | 0% |
| Mareos | 5% | 0% |
| Affect lability | 3% | 0% |
| Sarpullido | 3% | 0% |
| Pyrexia | 2% | 1% |
| Somnolencia | 2% | 1% |
| Tic | 2% | 0% |
| Anorexia | 2% | 0% |
| VYVANSE (n=233) |
Placebo (n=77) |
|
|---|---|---|
| Disminución del apetito | 34% | 3% |
| Insomnio | 13% | 4% |
| Pérdida de peso | 9% | 0% |
| Sequedad bucal | 4% | 1% |
| Palpitaciones | 2% | 1% |
| Anorexia | 2% | 0% |
| Temblor | 2% | 0% |
| VYVANSE (n=358) |
Placebo (n=62) |
|
|---|---|---|
| Disminución del apetito | 27% | 2% |
| Insomnio | 27% | 8% |
| Sequedad bucal | 26% | 3% |
| Diarrea | 7% | 0% |
| Náuseas | 7% | 0% |
| Ansiedad | 6% | 0% |
| Anorexia | 5% | 0% |
| Sensación de nerviosismo | 4% | 0% |
| Agitación | 3% | 0% |
| Aumento de la presión arterial | 3% | 0% |
| Hyperhidrosis | 3% | 0% |
| Inquietud | 3% | 0% |
| Disminución de peso | 3% | 0% |
| Dyspnea | 2% | 0% |
| Aumento del ritmo cardíaco | 2% | 0% |
| Temblor | 2% | 0% |
| Palpitaciones | 2% | 0% |
Además, en la población adulta se observó disfunción eréctil en el 2,6 % de los varones tratados con VYVANSE y en el 0 % de los que recibieron placebo; se observó disminución de la libido en el 1,4 % de los sujetos tratados con VYVANSE y en el 0 % de los que recibieron placebo.
Pérdida de peso y disminución de la velocidad de crecimiento en pacientes pediátricos con TDAH
En un ensayo controlado de VYVANSE en pacientes pediátricos de 6 a 12 años (Estudio 1), la pérdida de peso media desde el inicio después de 4 semanas de tratamiento fue de -0,9, -1,9 y -2,5 libras, respectivamente, para los pacientes que recibieron 30 mg, 50 mg y 70 mg de VYVANSE, en comparación con un aumento de peso de 1 libra para los pacientes que recibieron placebo. Las dosis más altas se asociaron con una mayor pérdida de peso a las 4 semanas de tratamiento. El seguimiento cuidadoso del peso en pacientes pediátricos de 6 a 12 años que recibieron VYVANSE durante más de 12 meses sugiere que los pacientes pediátricos medicados de forma constante (es decir, tratamiento durante 7 días a la semana durante todo el año) tienen una ralentización en la tasa de crecimiento, medida por el peso corporal, como lo demuestra un cambio medio desde el inicio en el percentil, normalizado por edad y sexo, de -13,4 en 1 año (los percentiles medios al inicio y a los 12 meses fueron de 60,9 y 47,2, respectivamente). En un ensayo controlado de 4 semanas de duración con VYVANSE en pacientes pediátricos de 13 a 17 años, la pérdida de peso media desde el inicio hasta el punto final fue de -2,7, -4,3 y -4,8 libras, respectivamente, para los pacientes que recibieron 30 mg, 50 mg y 70 mg de VYVANSE, en comparación con un aumento de peso de 2,0 libras para los pacientes que recibieron placebo.
El seguimiento cuidadoso del peso y la estatura en pacientes pediátricos de 7 a 10 años que fueron asignados aleatoriamente a grupos de tratamiento con metilfenidato o sin medicación durante más de 14 meses, así como en subgrupos naturalistas de pacientes pediátricos recién tratados con metilfenidato y sin medicación durante más de 36 meses (hasta las edades de 10 a 13 años), sugiere que los pacientes pediátricos de 7 a 13 años medicados de forma constante (es decir, tratamiento durante 7 días a la semana durante todo el año) tienen una ralentización temporal en la tasa de crecimiento (de media, un total de aproximadamente 2 cm menos de crecimiento en altura y 2,7 kg menos de crecimiento en peso en 3 años), sin evidencia de rebote del crecimiento durante este período de desarrollo. En un ensayo controlado de anfetamina (proporción de enantiómeros d a l de 3:1) en pacientes pediátricos de 13 a 17 años, el cambio medio de peso desde el inicio dentro de las 4 semanas iniciales de tratamiento fue de -1,1 libras y -2,8 libras, respectivamente, para los pacientes que recibieron 10 mg y 20 mg de anfetamina. Las dosis más altas se asociaron con una mayor pérdida de peso dentro de las 4 semanas iniciales de tratamiento [ver Advertencias y precauciones (5.5)].
Pérdida de peso en adultos con TDAH
En el ensayo controlado en adultos (Estudio 7), la pérdida de peso media después de 4 semanas de tratamiento fue de 2,8 libras, 3,1 libras y 4,3 libras, para los pacientes que recibieron dosis finales de 30 mg, 50 mg y 70 mg de VYVANSE, respectivamente, en comparación con un aumento de peso medio de 0,5 libras para los pacientes que recibieron placebo.
Trastorno por atracón
Los datos de seguridad de esta sección se basan en los datos de dos estudios de 12 semanas de duración, de grupos paralelos, de dosis flexible, controlados con placebo, en adultos con trastorno por atracón [ver Estudios clínicos 14.2]. Se excluyeron los pacientes con factores de riesgo cardiovascular distintos de la obesidad y el tabaquismo.
Reacciones adversas asociadas con la interrupción del tratamiento en ensayos clínicos sobre el trastorno por atracón
En los ensayos controlados con pacientes de 18 a 55 años, el 5,1 % (19/373) de los pacientes tratados con VYVANSE interrumpieron el tratamiento debido a reacciones adversas, en comparación con el 2,4 % (9/372) de los pacientes tratados con placebo. Ninguna reacción adversa individual llevó a la interrupción del tratamiento en el 1 % o más de los pacientes tratados con VYVANSE. Entre las reacciones adversas menos frecuentes (menos del 1 % o menos del doble de la tasa del placebo) se encuentran el aumento de la frecuencia cardíaca, dolor de cabeza, dolor abdominal superior, disnea, erupción cutánea, insomnio, irritabilidad, sensación de nerviosismo y ansiedad.
Reacciones adversas que ocurren con una incidencia del 5 % o más y al menos el doble que el placebo entre los pacientes tratados con VYVANSE con trastorno por atracón en ensayos clínicos
Las reacciones adversas más frecuentes (incidencia ≥5 % y a una tasa al menos dos veces mayor que la del placebo) notificadas en adultos fueron sequedad de boca, insomnio, disminución del apetito, aumento de la frecuencia cardíaca, estreñimiento, sensación de nerviosismo y ansiedad.
Reacciones adversas que ocurren con una incidencia del 2 % o más y al menos el doble que el placebo entre los pacientes tratados con VYVANSE con trastorno por atracón en ensayos clínicos
Las reacciones adversas notificadas en los ensayos controlados agrupados en pacientes adultos (Estudios 11 y 12) tratados con VYVANSE o placebo se presentan en la Tabla 4 a continuación.
| VYVANSE (N=373) |
Placebo (N=372) |
|
|---|---|---|
| Sequedad de boca | 36% | 7% |
| Insomnio* | 20% | 8% |
| Disminución del apetito | 8% | 2% |
| Aumento de la frecuencia cardíaca† | 7% | 1% |
| Sensación de nerviosismo | 6% | 1% |
| Estreñimiento | 6% | 1% |
| Ansiedad | 5% | 1% |
| Diarrea | 4% | 2% |
| Decreased Weight | 4% | 0% |
| Hiperhidrosis | 4% | 0% |
| Vómitos | 2% | 1% |
| Gastroenteritis | 2% | 1% |
| Paresthesia | 2% | 1% |
| Prurito | 2% | 1% |
| Dolor en la parte superior del abdomen | 2% | 0% |
| Energy Increased | 2% | 0% |
| Infección del tracto urinario | 2% | 0% |
| Pesadillas | 2% | 0% |
| Inquietud | 2% | 0% |
| Dolor orofaríngeo | 2% | 0% |
6.2 Experiencia posterior a la comercialización
Las siguientes reacciones adversas se han identificado durante el uso de VYVANSE posterior a la aprobación. Debido a que estas reacciones se notifican de forma voluntaria a partir de una población de tamaño incierto, no siempre es posible estimar con fiabilidad su frecuencia o establecer una relación causal con la exposición al fármaco. Estos eventos son los siguientes: cardiomyopathy, mydriasis, diplopia, difficulties with visual accommodation, blurred vision, eosinophilic hepatitis, anaphylactic reaction, hypersensitivity, dyskinesia, dysgeusia, motor and verbal tics, bruxism, depresión, dermatillomania, alopecia, agresión, Stevens-Johnson Syndrome, chest pain, angioedema, urticaria, seizures, libido changes, frequent or prolonged erections, estreñimiento, rhabdomyolysis, and intestinal ischemia.
7 INTERACCIONES MEDICAMENTOSAS
7.1 Medicamentos que tienen interacciones clínicamente importantes con las anfetaminas
| Inhibidores de la MAO (IMAO) | |
| Impacto clínico | Los antidepresivos IMAO retrasan el metabolismo de la anfetamina, lo que aumenta el efecto de las anfetaminas sobre la liberación de norepinefrina y otras monoaminas de las terminaciones nerviosas adrenérgicas, lo que provoca dolores de cabeza y otros signos de crisis hipertensiva. Pueden producirse efectos neurológicos tóxicos e hiperplexia maligna, a veces con resultados mortales. |
| Intervención | No administre VYVANSE durante ni en los 14 días posteriores a la administración de IMAO [ver Contraindicaciones (4)]. |
| Fármacos serotoninérgicos | |
| Impacto clínico | El uso concomitante de VYVANSE y fármacos serotoninérgicos aumenta el riesgo de síndrome serotoninérgico. |
| Intervención | Comience con dosis más bajas y controle a los pacientes para detectar signos y síntomas del síndrome serotoninérgico, particularmente durante el inicio de VYVANSE o el aumento de la dosis. Si se produce el síndrome serotoninérgico, suspenda VYVANSE y los fármacos serotoninérgicos concomitantes [ver Advertencias y precauciones (5.7)]. |
| Inhibidores de CYP2D6 | |
| Impacto clínico | El uso concomitante de VYVANSE e inhibidores de CYP2D6 puede aumentar la exposición a la dextroanfetamina, el metabolito activo de VYVANSE, en comparación con el uso del fármaco solo y aumentar el riesgo de síndrome serotoninérgico. |
| Intervención | Comience con dosis más bajas y controle a los pacientes para detectar signos y síntomas del síndrome serotoninérgico, particularmente durante el inicio de VYVANSE y después de un aumento de la dosis. Si se produce el síndrome serotoninérgico, suspenda VYVANSE y el inhibidor de CYP2D6 [ver Advertencias y precauciones (5.7) y Sobredosis (10)]. |
| Agentes alcalinizantes | |
| Impacto clínico | Los agentes alcalinizantes urinarios pueden aumentar las concentraciones en sangre y potenciar la acción de la anfetamina. |
| Intervención | Se debe evitar la administración conjunta de VYVANSE y agentes alcalinizantes urinarios. |
| Agentes acidificantes | |
| Impacto clínico | Los agentes acidificantes urinarios pueden reducir las concentraciones en sangre y la eficacia de las anfetaminas. |
| Intervención | Aumente la dosis en función de la respuesta clínica. |
| Antidepresivos tricíclicos | |
| Impacto clínico | Puede aumentar la actividad de los agentes tricíclicos o simpaticomiméticos, provocando aumentos notables y sostenidos de la concentración de d-anfetamina en el cerebro; los efectos cardiovasculares pueden verse potenciados. |
7.2 Medicamentos que no tienen interacciones clínicamente importantes con VYVANSE
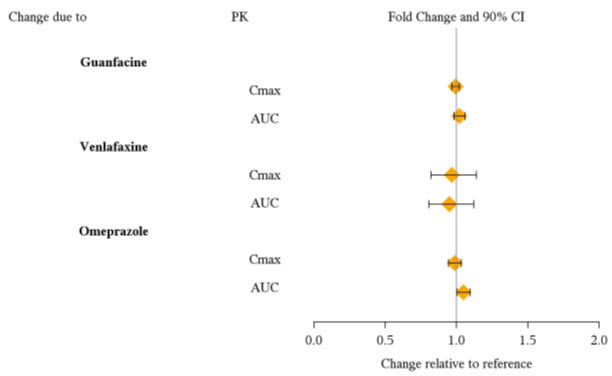
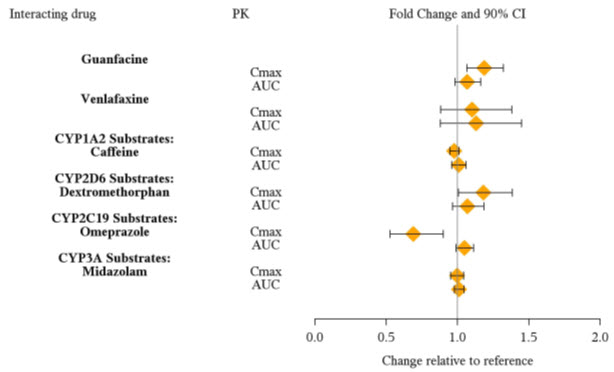
Desde una perspectiva farmacocinética, no es necesario ajustar la dosis de VYVANSE cuando se administra conjuntamente con guanfacina, venlafaxina u omeprazol. Además, no es necesario ajustar la dosis de guanfacina o venlafaxina cuando se administra conjuntamente con VYVANSE [ver Farmacología clínica (12.3)].
Desde una perspectiva farmacocinética, no es necesario ajustar la dosis de los fármacos que son sustratos de CYP1A2 (p. ej., teofilina, duloxetina, melatonina), CYP2D6 (p. ej., atomoxetina, desipramina, venlafaxina), CYP2C19 (p. ej., omeprazol, lansoprazol, clobazam) y CYP3A4 (p. ej., midazolam, pimozida, simvastatina) cuando VYVANSE se administra conjuntamente [ver Farmacología clínica (12.3)].
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Registro de Exposición al Embarazo
Existe un registro de exposición al embarazo que monitorea los resultados del embarazo en mujeres expuestas a medicamentos para el TDAH durante el embarazo. Se alienta a los profesionales de la salud a registrar a los pacientes llamando al Registro Nacional de Embarazo para Psicoestimulantes al 1-866-961-2388 o visitando en línea https://womensmentalhealth.org/clinical-and researchprograms/pregnancyregistry/adhd-medications/.
Resumen de Riesgos
Los datos limitados disponibles de la literatura publicada y los informes postcomercialización sobre el uso de VYVANSE en mujeres embarazadas no son suficientes para informar un riesgo asociado a los medicamentos para defectos de nacimiento importantes y aborto espontáneo. Se han observado resultados adversos del embarazo, incluida la entrega prematura y el bajo peso al nacer, en bebés nacidos de madres dependientes de las anfetaminas [ver Consideraciones Clínicas]. En estudios de reproducción animal, el lisdexamfetamina dimesilato (un profármaco de la d-anfetamina) no tuvo efectos sobre el desarrollo morfológico embrionario-fetal o la supervivencia cuando se administró por vía oral a ratas y conejos preñados durante todo el período de organogénesis. No se realizaron estudios pre y posnatales con lisdexamfetamina dimesilato. Sin embargo, la administración de anfetamina (relación d- a l- de 3:1) a ratas preñadas durante la gestación y la lactancia provocó una disminución de la supervivencia de las crías y una disminución del peso corporal de las crías que se correlacionó con un retraso en los hitos del desarrollo a dosis clínicamente relevantes de anfetamina. Además, se observaron efectos adversos en el rendimiento reproductivo en las crías cuyas madres fueron tratadas con anfetamina. También se han informado efectos neuroquímicos y conductuales a largo plazo en estudios de desarrollo animal utilizando dosis clínicamente relevantes de anfetamina [ver Datos].
El riesgo de fondo estimado de defectos de nacimiento importantes y aborto espontáneo para la población indicada es desconocido. Todos los embarazos tienen un riesgo de fondo de defectos de nacimiento, pérdida u otros resultados adversos. En la población general de los EE. UU., el riesgo de fondo estimado de defectos de nacimiento importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2-4% y del 15-20%, respectivamente.
Consideraciones Clínicas
Reacciones adversas fetales/neonatales
Las anfetaminas, como VYVANSE, causan vasoconstricción y, por lo tanto, pueden disminuir la perfusión placentaria. Además, las anfetaminas pueden estimular las contracciones uterinas, lo que aumenta el riesgo de parto prematuro. Los bebés nacidos de madres dependientes de las anfetaminas tienen un mayor riesgo de parto prematuro y bajo peso al nacer.
Monitorear a los bebés nacidos de madres que toman anfetaminas para detectar síntomas de abstinencia como dificultades para alimentarse, irritabilidad, agitación y somnolencia excesiva.
Datos
Datos de animales
El lisdexamfetamina dimesilato no tuvo efectos aparentes sobre el desarrollo morfológico embrionario-fetal o la supervivencia cuando se administró por vía oral a ratas y conejos preñados durante todo el período de organogénesis a dosis de hasta 40 y 120 mg/kg/día, respectivamente. Estas dosis son aproximadamente 5.5 y 33 veces, respectivamente, la dosis humana máxima recomendada (MRHD) de 70 mg/día administrada a adultos, sobre una base de superficie corporal mg/m2.
Se realizó un estudio con anfetamina (relación enantiómero d- a l- de 3:1) en el que ratas preñadas recibieron dosis orales diarias de 2, 6 y 10 mg/kg desde el día 6 de gestación hasta el día 20 de lactancia. Todas las dosis causaron hiperactividad y disminución del aumento de peso en las presas. Se observó una disminución de la supervivencia de las crías a todas las dosis. Se observó una disminución del peso corporal de las crías a 6 y 10 mg/kg que se correlacionó con retrasos en los hitos del desarrollo, como la separación prepucio y la apertura vaginal. Se observó un aumento de la actividad locomotora de las crías a 10 mg/kg en el día 22 posparto, pero no a las 5 semanas después del destete. Cuando las crías se probaron para el rendimiento reproductivo en la maduración, el aumento de peso gestacional, el número de implantaciones y el número de crías entregadas disminuyeron en el grupo cuyas madres habían recibido 10 mg/kg.
Una serie de estudios de la literatura en roedores indican que la exposición prenatal o temprana posnatal a la anfetamina (d- o d, l-) a dosis similares a las utilizadas clínicamente puede resultar en alteraciones neuroquímicas y conductuales a largo plazo. Los efectos conductuales informados incluyen déficits de aprendizaje y memoria, actividad locomotora alterada y cambios en la función sexual.
8.2 Lactancia
Resumen de Riesgos
La lisdexamfetamina es un profármaco de la dextroanfetamina. Basándose en informes de casos limitados en la literatura publicada, la anfetamina (d- o d, l-) está presente en la leche materna, a dosis relativas para el lactante del 2% al 13.8% de la dosis materna ajustada al peso y una relación leche/plasma que oscila entre 1.9 y 7.5. No hay informes de efectos adversos en el lactante amamantado. Se desconocen los efectos neurodesarrolladores a largo plazo en los bebés por la exposición a la anfetamina. Es posible que las dosis grandes de dextroanfetamina puedan interferir con la producción de leche, especialmente en mujeres cuya lactancia no está bien establecida. Debido al potencial de reacciones adversas graves en los lactantes amamantados, incluidas reacciones cardiovasculares graves, aumento de la presión arterial y la frecuencia cardíaca, supresión del crecimiento y vasculopatía periférica, se debe aconsejar a los pacientes que la lactancia no se recomienda durante el tratamiento con VYVANSE.
8.4 Uso Pediátrico
TDAH
La seguridad y la eficacia de VYVANSE se han establecido en pacientes pediátricos con TDAH de 6 a 17 años [ver Dosificación y Administración (2.3), Reacciones Adversas (6.1), Farmacología Clínica (12.3), y Estudios Clínicos (14.1)].
La seguridad y la eficacia de VYVANSE no se han establecido en pacientes pediátricos menores de 6 años.
La seguridad y eficacia de VYVANSE se evaluaron en un estudio doble ciego, aleatorizado, de grupos paralelos, controlado con placebo, de dosis fija en pacientes pediátricos de 4 a 5 años con TDAH, seguido de un estudio de extensión de etiqueta abierta de 1 año. En estos estudios, los pacientes experimentaron tasas elevadas de reacciones adversas, incluida la pérdida de peso, la disminución del IMC, la disminución del apetito, el insomnio, las infecciones (respiratorias superiores y nasofaríngeas), la irritabilidad y la labilidad afectiva.
Con la misma dosis de VYVANSE, la exposición media en estado estacionario de dextroanfetamina fue aproximadamente un 44% más alta en pacientes pediátricos de 4 a 5 años en comparación con los pacientes pediátricos de 6 a 11 años.
BED
La seguridad y eficacia de VYVANSE no se han establecido en pacientes pediátricos con BED menores de 18 años.
Supresión del crecimiento
El crecimiento debe controlarse durante el tratamiento con estimulantes, incluido VYVANSE, y los pacientes pediátricos que no crecen o no aumentan de peso como se espera pueden necesitar interrumpir su tratamiento [ver Advertencias y precauciones (5.5) y Reacciones adversas (6.1)].
Datos de animales jóvenes
Los estudios realizados en ratas y perros jóvenes a dosis clínicamente relevantes mostraron supresión del crecimiento que se revirtió parcial o totalmente en perros y ratas hembras, pero no en ratas machos después de un período de recuperación sin fármacos de cuatro semanas.
Se realizó un estudio en el que ratas jóvenes recibieron dosis orales de 4, 10 o 40 mg/kg/día de lisdexanfetamina dimetilsulfato desde el día 7 hasta el día 63 de edad. Estas dosis son aproximadamente 0,3, 0,7 y 3 veces la dosis diaria humana máxima recomendada de 70 mg en base a mg/m2 para un niño. Se observaron disminuciones relacionadas con la dosis en el consumo de alimentos, el aumento de peso corporal y la longitud de la corona-nalgas; después de un período de recuperación sin fármacos de cuatro semanas, los pesos corporales y las longitudes de la corona-nalgas se habían recuperado significativamente en las hembras, pero aún estaban sustancialmente reducidos en los machos. El tiempo hasta la apertura vaginal se retrasó en las hembras a la dosis más alta, pero no hubo efectos del fármaco sobre la fertilidad cuando los animales se aparearon a partir del día 85 de edad.
En un estudio en el que perros jóvenes recibieron lisdexanfetamina dimetilsulfato durante 6 meses a partir de las 10 semanas de edad, se observó una disminución del aumento de peso corporal a todas las dosis probadas (2, 5 y 12 mg/kg/día, que son aproximadamente 0,5, 1 y 3 veces la dosis diaria humana máxima recomendada en base a mg/m2 para un niño). Este efecto se revirtió parcial o totalmente durante un período de recuperación sin fármacos de cuatro semanas.
8.5 Uso geriátrico
Los estudios clínicos de VYVANSE no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. Otra experiencia clínica informada y datos farmacocinéticos [ver Farmacología clínica (12.3)] no han identificado diferencias en las respuestas entre los pacientes ancianos y los más jóvenes. En general, la selección de la dosis para un paciente anciano debe comenzar en el extremo inferior del rango de dosificación, lo que refleja la mayor frecuencia de disminución de la función hepática, renal o cardíaca, y de enfermedades concomitantes u otra terapia farmacológica.
8.6 Insuficiencia renal
Debido a la reducción del aclaramiento en pacientes con insuficiencia renal grave (TFG 15 a < 30 mL/min/1,73 m2), la dosis máxima no debe exceder los 50 mg/día. La dosis máxima recomendada en pacientes con ERC (TFG < 15 mL/min/1,73 m2) es de 30 mg/día [ver Farmacología clínica (12.3)].
La lisdexanfetamina y la d-anfetamina no son dializables.
9 ABUSO DE DROGAS Y DEPENDENCIA
9.1 Sustancia Controlada
VYVANSE contiene lisdexanfetamina, un profármaco de anfetamina, una sustancia controlada de la Lista II.
9.2 Abuso
VYVANSE tiene un alto potencial de abuso y uso indebido, lo cual puede llevar al desarrollo de un trastorno por uso de sustancias, incluyendo adicción [ver Advertencias y precauciones (5.1)]. VYVANSE puede ser desviado para su uso no médico en canales o distribución ilícitos.
El abuso es el uso no terapéutico intencional de un medicamento, aunque sea una sola vez, para lograr un efecto psicológico o fisiológico deseado. El uso indebido es el uso intencional, con fines terapéuticos, de un medicamento por parte de una persona de una manera distinta a la prescrita por un profesional de la salud o para quien no fue prescrito. La adicción a las drogas es un conjunto de fenómenos conductuales, cognitivos y fisiológicos que pueden incluir un fuerte deseo de tomar la droga, dificultades para controlar su uso (por ejemplo, continuar usando la droga a pesar de las consecuencias perjudiciales, darle una prioridad más alta al uso de la droga que a otras actividades y obligaciones) y posible tolerancia o dependencia física.
El uso indebido y abuso de lisdexanfetamina, un profármaco de anfetamina, puede causar aumento de la frecuencia cardíaca, frecuencia respiratoria o presión arterial; sudoración; pupilas dilatadas; hiperactividad; inquietud; insomnio; disminución del apetito; pérdida de coordinación; temblores; enrojecimiento de la piel; vómitos; y/o dolor abdominal. También se han observado ansiedad, psicosis, hostilidad, agresión e ideación suicida o homicida con el abuso y/o uso indebido de estimulantes del sistema nervioso central. El uso indebido y abuso de estimulantes del sistema nervioso central, incluyendo VYVANSE, puede resultar en sobredosis y muerte [ver Sobredosis (10)], y este riesgo aumenta con dosis más altas o métodos de administración no aprobados, como inhalar o inyectar.
Estudios de VYVANSE en Abusadores de Drogas
Se realizó un estudio de responsabilidad por abuso, aleatorizado, doble ciego, controlado con placebo, cruzado, en 38 pacientes con antecedentes de abuso de drogas, con dosis únicas de 50, 100 o 150 mg de VYVANSE, 40 mg de sulfato de d-anfetamina de liberación inmediata (una sustancia controlada de la Lista II) y 200 mg de clorhidrato de dietilpropion (una sustancia controlada de la Lista IV). VYVANSE 100 mg produjo significativamente menos “Efectos de Gusto por la Droga” según lo medido por la puntuación del Cuestionario de Evaluación de Drogas, en comparación con 40 mg de d-anfetamina; y 150 mg de VYVANSE demostró efectos de “Gusto por la Droga” similares a 40 mg de d-anfetamina y 200 mg de dietilpropion.
La administración intravenosa de 50 mg de lisdexanfetamina mesilato a individuos con antecedentes de abuso de drogas produjo respuestas subjetivas positivas en escalas que miden “Gusto por la Droga”, “Euforia”, “Efectos de Anfetamina” y “Efectos de Benzedrina” que fueron mayores que el placebo pero menores que los producidos por una dosis equivalente (20 mg) de d-anfetamina intravenosa.
9.3 Dependencia
Dependencia Física
VYVANSE puede producir dependencia física. La dependencia física es un estado que se desarrolla como resultado de una adaptación fisiológica en respuesta al uso repetido de un medicamento, manifestada por signos y síntomas de abstinencia después de la interrupción abrupta o una reducción significativa de la dosis de un medicamento. Los signos y síntomas de abstinencia después de la interrupción abrupta o reducción de la dosis después de un uso prolongado de estimulantes del sistema nervioso central, incluyendo VYVANSE, incluyen estado de ánimo disfórico; depresión; fatiga; sueños vívidos y desagradables; insomnio o hipersomnia; aumento del apetito; y retraso psicomotor o agitación.
Tolerancia
VYVANSE puede producir tolerancia. La tolerancia es un estado fisiológico caracterizado por una respuesta reducida a un medicamento después de su administración repetida (es decir, se requiere una dosis más alta de un medicamento para producir el mismo efecto que se obtuvo anteriormente con una dosis más baja).
10 SOBREDOSIS
Efectos clínicos de la sobredosis
La sobredosis de estimulantes del SNC se caracteriza por los siguientes efectos simpaticomiméticos:
- Efectos cardiovasculares que incluyen taquiarritmias e hipertensión o hipotensión. El vasoespasmo, el infarto de miocardio o la disección aórtica pueden precipitar la muerte súbita cardíaca. Puede desarrollarse miocardiopatía de Takotsubo.
- Efectos sobre el SNC que incluyen agitación psicomotriz, confusión y alucinaciones. Pueden producirse síndrome serotoninérgico, convulsiones, accidentes cerebrovasculares y coma.
- Puede desarrollarse hipertermia potencialmente mortal (temperaturas superiores a 104 °F) y rabdomiólisis.
Manejo de la sobredosis
Considere la posibilidad de la ingestión de múltiples fármacos. El perfil farmacocinético de VYVANSE debe tenerse en cuenta al tratar a pacientes con sobredosis. La lisdexamfetamina y la d-anfetamina no son dializables. Considere comunicarse con la línea de ayuda contra intoxicaciones (Poison Help line) (1-800-222-1222) o con un toxicólogo médico para obtener recomendaciones adicionales sobre el manejo de la sobredosis.
11 DESCRIPCIÓN
VYVANSE (lisdexamfetamina dimesilato), un estimulante del sistema nervioso central, se administra por vía oral una vez al día. La designación química para el lisdexamfetamina dimesilato es (2S)-2,6-diamino-N-[(1S)-1-metil-2-feniletiletil] hexanamida dimetanosulfonato. La fórmula molecular es C15H25N3O∙(CH4O3S)2, lo que corresponde a un peso molecular de 455.60. La estructura química es:
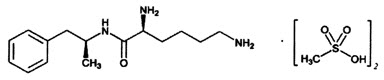
El lisdexamfetamina dimesilato es un polvo blanco a blanco apagado que es soluble en agua (792 mg/mL).
Información para las cápsulas de VYVANSE:
Las cápsulas de VYVANSE contienen 10 mg, 20 mg, 30 mg, 40 mg, 50 mg, 60 mg y 70 mg de lisdexamfetamina dimesilato (equivalente a 5.8 mg, 11.6 mg, 17.3 mg, 23.1 mg, 28.9 mg, 34.7 mg y 40.5 mg de lisdexamfetamina).
Ingredientes inactivos: celulosa microcristalina, croscarmelosa sódica y estearato de magnesio. Las cápsulas contienen gelatina, dióxido de titanio y uno o más de los siguientes: FD&C Rojo #3, FD&C Amarillo #6, FD&C Azul #1, óxido de hierro negro y óxido de hierro amarillo.
Información para las tabletas masticables de VYVANSE:
Las tabletas masticables de VYVANSE contienen 10 mg, 20 mg, 30 mg, 40 mg, 50 mg y 60 mg de lisdexamfetamina dimesilato (equivalente a 5.8 mg, 11.6 mg, 17.3 mg, 23.1 mg, 28.9 mg y 34.7 mg de lisdexamfetamina).
Ingredientes inactivos: dióxido de silicio coloidal, croscarmelosa sódica, goma guar, estearato de magnesio, manitol, celulosa microcristalina, sucralosa, sabor artificial de fresa.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Lisdexamfetamina es un profármaco de dextroanfetamina. Las anfetaminas son aminas simpaticomiméticas no catecolaminérgicas con actividad estimulante del SNC. Se desconoce el modo exacto de acción terapéutica en el TDAH y el BED.
12.2 Farmacodinamia
Las anfetaminas bloquean la recaptación de norepinefrina y dopamina en la neurona presináptica y aumentan la liberación de estas monoaminas al espacio extraneuronal. El fármaco original, lisdexamfetamina, no se une a los sitios responsables de la recaptación de norepinefrina y dopamina in vitro.
12.3 Farmacocinética
Se han realizado estudios farmacocinéticos después de la administración oral de lisdexamfetamina dimesilato en adultos sanos (formulaciones de cápsulas y tabletas masticables) y pacientes pediátricos (de 6 a 12 años) con TDAH (formulación de cápsulas). Después de la administración de una dosis única de lisdexamfetamina dimesilato, se encontró que la farmacocinética de la dextroanfetamina era lineal entre 30 mg y 70 mg en un estudio pediátrico (de 6 a 12 años) y entre 50 mg y 250 mg en un estudio en adultos. Los parámetros farmacocinéticos de la dextroanfetamina después de la administración de lisdexamfetamina dimesilato en adultos mostraron una baja variabilidad interindividual (<25%) e intraindividual (<8%). No hay acumulación de lisdexamfetamina y dextroanfetamina en estado estacionario en adultos sanos.
Absorción
Formulación de cápsulas
Después de la administración oral de una dosis única de la cápsula de VYVANSE (30 mg, 50 mg o 70 mg) en pacientes de 6 a 12 años con TDAH en condiciones de ayuno, el Tmax de lisdexamfetamina y dextroanfetamina se alcanzó aproximadamente a la 1 hora y a las 3.5 horas después de la dosis, respectivamente. Los valores de AUC y Cmax normalizados por peso/dosis fueron los mismos en pacientes pediátricos de 6 a 12 años que en los adultos después de dosis únicas de 30 mg a 70 mg de la cápsula de VYVANSE.
Efecto de los alimentos en la formulación de cápsulas
Ni los alimentos (una comida rica en grasas o yogur) ni el jugo de naranja afectan el AUC y Cmax observados de la dextroanfetamina en adultos sanos después de la administración oral de una dosis única de 70 mg de cápsulas de VYVANSE. Los alimentos prolongan el Tmax aproximadamente 1 hora (de 3.8 horas en estado de ayuno a 4.7 horas después de una comida rica en grasas o a 4.2 horas con yogur). Después de un ayuno de 8 horas, el AUC de la dextroanfetamina después de la administración oral de lisdexamfetamina dimesilato en solución y como cápsulas intactas fue equivalente.
Formulación de tabletas masticables
Después de la administración de una dosis única de 60 mg de la tableta masticable de VYVANSE en sujetos sanos en condiciones de ayuno, el Tmax de lisdexamfetamina y dextroanfetamina se alcanzó aproximadamente a la 1 hora y a las 4.4 horas después de la dosis, respectivamente. En comparación con la cápsula de VYVANSE de 60 mg, la exposición (Cmax y AUC) a la lisdexamfetamina fue aproximadamente un 15% menor. La exposición (Cmax y AUCinf) de la dextroanfetamina es similar entre la tableta masticable de VYVANSE y la cápsula de VYVANSE.
Efecto de los alimentos en la formulación de tabletas
La administración de 60 mg de la tableta masticable de VYVANSE con alimentos (una comida rica en grasas) disminuye la exposición (Cmax y AUCinf) de la dextroanfetamina entre un 5% y un 7%, y prolonga el Tmax medio aproximadamente 1 hora (de 3.9 horas en estado de ayuno a 4.9 horas).
Eliminación
Las concentraciones plasmáticas de lisdexamfetamina no convertida son bajas y transitorias, generalmente se vuelven no cuantificables a las 8 horas después de la administración. La vida media de eliminación plasmática de la lisdexamfetamina promedió típicamente menos de una hora en voluntarios de 6 años o más. La vida media de eliminación plasmática de la dextroanfetamina fue de aproximadamente 8.6 a 9.5 horas en pacientes pediátricos de 6 a 12 años y de 10 a 11.3 horas en adultos sanos.
Metabolismo
La lisdexamfetamina se convierte en dextroanfetamina y l-lisina principalmente en la sangre debido a la actividad hidrolítica de los glóbulos rojos después de la administración oral de lisdexamfetamina dimesilato. Los datos in vitro demostraron que los glóbulos rojos tienen una alta capacidad para metabolizar la lisdexamfetamina; se produjo una hidrólisis sustancial incluso a niveles bajos de hematocrito (33% de lo normal). La lisdexamfetamina no se metaboliza por las enzimas del citocromo P450.
Excreción
Después de la administración oral de una dosis de 70 mg de lisdexamfetamina dimesilato radiactivo a 6 sujetos sanos, aproximadamente el 96% de la dosis oral de radiactividad se recuperó en la orina y solo el 0.3% se recuperó en las heces durante un período de 120 horas. De la radiactividad recuperada en la orina, el 42% de la dosis estaba relacionada con la anfetamina, el 25% con el ácido hipúrico y el 2% con la lisdexamfetamina intacta.
Poblaciones específicas
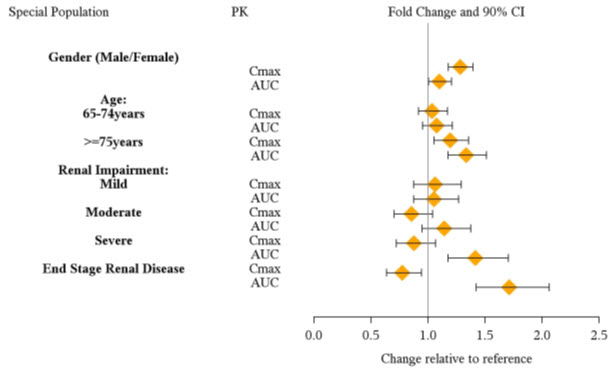
Las exposiciones de la dextroanfetamina en poblaciones específicas se resumen en la Figura 1.
|
| Figura 1: Poblaciones específicas*: |
|
|
Estudios de interacción medicamentosa
Los efectos de otros medicamentos en las exposiciones de dextroanfetamina se resumen en la Figura 2.
| Figura 2: Efecto de otros medicamentos en VYVANSE: |
|
|
Los efectos de VYVANSE en las exposiciones de otros medicamentos se resumen en la Figura 3.
| Figura 3: Efecto de VYVANSE en otros medicamentos: |
|
|
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis y Deterioro de la Fertilidad
Carcinogénesis
No se han realizado estudios de carcinogenicidad con lisdexamfetamina dimesilato. No se encontró evidencia de carcinogenicidad en estudios en los que se administró d-, l-anfetamina (relación enantiomérica de 1:1) a ratones y ratas en la dieta durante 2 años a dosis de hasta 30 mg/kg/día en ratones machos, 19 mg/kg/día en ratonas hembras y 5 mg/kg/día en ratas machos y hembras.
13.2 Toxicología y/o Farmacología Animal
La administración aguda de altas dosis de anfetamina (d- o d, l-) ha demostrado producir efectos neurotóxicos duraderos, incluido daño irreversible de las fibras nerviosas, en roedores. La importancia de estos hallazgos para los humanos es desconocida.
14 ESTUDIOS CLÍNICOS
14.1 Trastorno por Déficit de Atención e Hiperactividad (TDAH)
Pacientes pediátricos de 6 a 12 años con TDAH
Se llevó a cabo un estudio doble ciego, aleatorizado, controlado con placebo, de grupos paralelos (Estudio 1) en pacientes pediátricos de 6 a 12 años (N=290) que cumplían con los criterios del DSM-IV para el TDAH (ya sea el tipo combinado o el tipo hiperactivo-impulsivo). Los pacientes fueron aleatorizados para recibir dosis finales de 30 mg, 50 mg o 70 mg de VYVANSE o placebo una vez al día por la mañana durante un total de cuatro semanas de tratamiento. Todos los pacientes que recibieron VYVANSE iniciaron con 30 mg durante la primera semana de tratamiento. Los pacientes asignados a los grupos de dosis de 50 mg y 70 mg fueron titulados en 20 mg por semana hasta que alcanzaron su dosis asignada. El resultado principal de eficacia fue el cambio en la puntuación total desde el inicio hasta el punto final en las valoraciones del investigador en la Escala de Valoración del TDAH (ADHD-RS), un cuestionario de 18 ítems con un rango de puntuación de 0 a 54 puntos que mide los síntomas centrales del TDAH, que incluye subescalas tanto hiperactivas/impulsivas como de inatención. El punto final se definió como la última semana de tratamiento posterior a la aleatorización (es decir, semanas 1 a 4) para la que se obtuvo una puntuación válida. Todos los grupos de dosis de VYVANSE fueron superiores al placebo en el resultado principal de eficacia. Los efectos medios en todas las dosis fueron similares; sin embargo, la dosis más alta (70 mg/día) fue numéricamente superior a las dos dosis más bajas (Estudio 1 en la Tabla 6). Los efectos se mantuvieron durante todo el día según las valoraciones de los padres (Escala de Valoración de los Padres de Conners) por la mañana (aproximadamente a las 10 am), por la tarde (aproximadamente a las 2 pm) y a primera hora de la tarde (aproximadamente a las 6 pm).
Se llevó a cabo un estudio doble ciego, controlado con placebo, aleatorizado, de diseño cruzado, de aula análoga (Estudio 2) en pacientes pediátricos de 6 a 12 años (N=52) que cumplían con los criterios del DSM-IV para el TDAH (ya sea el tipo combinado o el tipo hiperactivo-impulsivo). Tras una optimización de la dosis de 3 semanas de duración con Adderall XR® en etiqueta abierta, los pacientes fueron asignados aleatoriamente para continuar con su dosis optimizada de Adderall XR (10 mg, 20 mg o 30 mg), VYVANSE (30 mg, 50 mg o 70 mg) o placebo una vez al día por la mañana durante 1 semana cada tratamiento. Las evaluaciones de eficacia se realizaron a las 1, 2, 3, 4.5, 6, 8, 10 y 12 horas después de la dosis utilizando las puntuaciones de comportamiento de Swanson, Kotkin, Agler, M.Flynn y Pelham (SKAMP-DS), una subescala de 4 ítems del SKAMP con puntuaciones que van de 0 a 24 puntos que mide los problemas de comportamiento que conducen a interrupciones en el aula. Se observó una diferencia significativa en el comportamiento de los pacientes, basada en el promedio de las valoraciones del investigador en el SKAMP-DS a través de las 8 evaluaciones, entre los pacientes cuando recibieron VYVANSE en comparación con los pacientes cuando recibieron placebo (Estudio 2 en la Tabla 6). El efecto del fármaco alcanzó significación estadística desde las 2 hasta las 12 horas después de la dosis, pero no fue significativo a la 1 hora.
Se llevó a cabo un segundo estudio doble ciego, controlado con placebo, aleatorizado, de diseño cruzado, de aula análoga (Estudio 3) en pacientes pediátricos de 6 a 12 años (N=129) que cumplían con los criterios del DSM-IV para el TDAH (ya sea el tipo combinado o el tipo hiperactivo-impulsivo). Tras una optimización de la dosis de 4 semanas de duración con VYVANSE (30 mg, 50 mg, 70 mg) en etiqueta abierta, los pacientes fueron asignados aleatoriamente para continuar con su dosis optimizada de VYVANSE o placebo una vez al día por la mañana durante 1 semana cada tratamiento. Se observó una diferencia significativa en el comportamiento de los pacientes, basada en el promedio de las valoraciones del investigador en las puntuaciones de comportamiento del SKAMP a través de las 7 evaluaciones realizadas a las 1.5, 2.5, 5.0, 7.5, 10.0, 12.0 y 13.0 horas después de la dosis, entre los pacientes cuando recibieron VYVANSE en comparación con los pacientes cuando recibieron placebo (Estudio 3 en la Tabla 6, Figura 4).
Pacientes pediátricos de 13 a 17 años con TDAH
Se llevó a cabo un estudio doble ciego, aleatorizado, controlado con placebo, de grupos paralelos (Estudio 4) en pacientes pediátricos de 13 a 17 años (N=314) que cumplían con los criterios del DSM-IV para el TDAH. En este estudio, los pacientes fueron aleatorizados en una proporción de 1:1:1:1 a una dosis diaria por la mañana de VYVANSE (30 mg/día, 50 mg/día o 70 mg/día) o placebo durante un total de cuatro semanas de tratamiento. Todos los pacientes que recibieron VYVANSE iniciaron con 30 mg durante la primera semana de tratamiento. Los pacientes asignados a los grupos de dosis de 50 mg y 70 mg fueron titulados en 20 mg por semana hasta que alcanzaron su dosis asignada. El resultado principal de eficacia fue el cambio en la puntuación total desde el inicio hasta el punto final en las valoraciones del investigador en la Escala de Valoración del TDAH (ADHD-RS). El punto final se definió como la última semana de tratamiento posterior a la aleatorización (es decir, semanas 1 a 4) para la que se obtuvo una puntuación válida. Todos los grupos de dosis de VYVANSE fueron superiores al placebo en el resultado principal de eficacia (Estudio 4 en la Tabla 6).
Pacientes pediátricos de 6 a 17 años: Tratamiento a corto plazo en el TDAH
Se llevó a cabo un estudio doble ciego, aleatorizado, controlado con placebo y activo, de grupos paralelos, de optimización de la dosis (Estudio 5) en pacientes pediátricos de 6 a 17 años (n=336) que cumplían con los criterios del DSM-IV para el TDAH. En este estudio de ocho semanas, los pacientes fueron aleatorizados a una dosis diaria por la mañana de VYVANSE (30, 50 o 70 mg/día), un control activo o placebo (1:1:1). El estudio consistió en un período de selección y lavado (hasta 42 días), un período de evaluación doble ciego de 7 semanas (que consistió en un período de optimización de la dosis de 4 semanas seguido de un período de mantenimiento de la dosis de 3 semanas) y un período de lavado y seguimiento de 1 semana. Durante el período de optimización de la dosis, los sujetos fueron titulados hasta que se alcanzó una dosis óptima, basada en la tolerabilidad y el juicio del investigador. VYVANSE mostró una eficacia significativamente mayor que el placebo. La reducción media ajustada al placebo desde el inicio en la puntuación total del ADHD-RS-IV fue de 18.6. Los sujetos que recibieron VYVANSE también mostraron una mayor mejoría en la escala de valoración de la impresión clínica global de mejoría (CGI-I) en comparación con los sujetos que recibieron placebo (Estudio 5 en la Tabla 6).
Pacientes pediátricos de 6 a 17 años: Tratamiento de mantenimiento en el TDAH
Estudio de Mantenimiento de la Eficacia (Estudio 6) – Se llevó a cabo un estudio de retirada aleatorizado, doble ciego, controlado con placebo en pacientes pediátricos de 6 a 17 años (N=276) que cumplían con el diagnóstico de TDAH (criterios del DSM-IV). Un total de 276 pacientes fueron inscritos en el estudio, 236 pacientes participaron en el Estudio 5 y 40 sujetos se inscribieron directamente. Los sujetos fueron tratados con VYVANSE de etiqueta abierta durante al menos 26 semanas antes de ser evaluados para la entrada en el período de retirada aleatorizado. Los pacientes elegibles tuvieron que demostrar una respuesta al tratamiento, definida por CGI-S <3 y puntuación total en el ADHD-RS ≤22. Los pacientes que mantuvieron la respuesta al tratamiento durante 2 semanas al final del período de tratamiento de etiqueta abierta fueron elegibles para ser aleatorizados a un tratamiento continuo con la misma dosis de VYVANSE (N=78) o cambiados a placebo (N=79) durante la fase de doble ciego. Los pacientes fueron observados para detectar recaídas (fallo del tratamiento) durante la fase de doble ciego de 6 semanas. Se produjo una proporción significativamente menor de fallos del tratamiento entre los sujetos de VYVANSE (15,8%) en comparación con el placebo (67,5%) al final del período de retirada aleatorizado. La medida del punto final se definió como la última semana de tratamiento posterior a la aleatorización en la que se observó una puntuación total válida de ADHD-RS y CGI-S. El fallo del tratamiento se definió como un aumento ≥50% (empeoramiento) en la puntuación total de ADHD-RS y un aumento ≥2 puntos en la puntuación de CGI-S en comparación con las puntuaciones al entrar en la fase de retirada aleatorizada de doble ciego. Los sujetos que se retiraron del período de retirada aleatorizado y que no proporcionaron datos de eficacia en su última visita con tratamiento se clasificaron como fallos del tratamiento (Estudio 6, Figura 5).
Adultos: Tratamiento a corto plazo en TDAH
Se llevó a cabo un estudio de grupos paralelos, aleatorizado, doble ciego, controlado con placebo (Estudio 7) en adultos de 18 a 55 años (N=420) que cumplían con los criterios del DSM-IV para el TDAH. En este estudio, los pacientes fueron aleatorizados para recibir dosis finales de 30 mg, 50 mg o 70 mg de VYVANSE o placebo durante un total de cuatro semanas de tratamiento. Todos los pacientes que recibieron VYVANSE se iniciaron con 30 mg durante la primera semana de tratamiento. Los pacientes asignados a los grupos de dosis de 50 mg y 70 mg fueron titulados en 20 mg por semana hasta que alcanzaron su dosis asignada. El resultado principal de eficacia fue el cambio en la puntuación total desde el inicio hasta el punto final en las valoraciones del investigador en la Escala de Valoración del TDAH (ADHD-RS). El punto final se definió como la última semana de tratamiento posterior a la aleatorización (es decir, semanas 1 a 4) para la que se obtuvo una puntuación válida. Todos los grupos de dosis de VYVANSE fueron superiores al placebo en el resultado principal de eficacia (Estudio 7 en la Tabla 6).
El segundo estudio fue un estudio de aula analógico modificado, multicéntrico, aleatorizado, doble ciego, controlado con placebo, cruzado (Estudio 8) de VYVANSE para simular un entorno laboral en 142 adultos de 18 a 55 años que cumplían con los criterios del DSM-IV-TR para el TDAH. Hubo una fase de optimización de la dosis de etiqueta abierta de 4 semanas con VYVANSE (30 mg/día, 50 mg/día o 70 mg/día por la mañana). Los pacientes fueron luego aleatorizados a una de dos secuencias de tratamiento: 1) VYVANSE (dosis optimizada) seguido de placebo, cada uno durante una semana, o 2) placebo seguido de VYVANSE, cada uno durante una semana. Las evaluaciones de eficacia se realizaron al final de cada semana, utilizando la Medida de Producto Permanente del Rendimiento (PERMP), una prueba matemática ajustada a las habilidades que mide la atención en el TDAH. Los resultados de la puntuación total de PERMP provienen de la suma del número de problemas matemáticos intentados más el número de problemas matemáticos respondidos correctamente. El tratamiento con VYVANSE, en comparación con el placebo, dio como resultado una mejora estadísticamente significativa en la atención en todos los puntos de tiempo posteriores a la dosis, medida por las puntuaciones totales promedio de PERMP durante el transcurso de un día de evaluación, así como en cada punto de tiempo medido. Las evaluaciones de PERMP se administraron antes de la dosis (-0,5 horas) y a las 2, 4, 8, 10, 12 y 14 horas después de la dosis (Estudio 8 en la Tabla 6, Figura 6).
Adultos: Tratamiento de mantenimiento en TDAH
Se llevó a cabo un estudio de diseño de retirada aleatorizado, doble ciego, controlado con placebo (Estudio 9) en adultos de 18 a 55 años (N=123) que tenían un diagnóstico documentado de TDAH o cumplían con los criterios del DSM-IV para el TDAH. Al entrar en el estudio, los pacientes deben haber tenido documentación de tratamiento con VYVANSE durante un mínimo de 6 meses y tuvieron que demostrar una respuesta al tratamiento, definida por la Gravedad de la Impresión Clínica Global (CGI-S) ≤3 y la puntuación total en el ADHD-RS <22. La puntuación total de ADHD-RS es una medida de los síntomas centrales del TDAH. La puntuación de CGI-S evalúa la impresión del clínico sobre el estado actual de la enfermedad del paciente y varía de 1 (no está enfermo en absoluto) a 7 (extremadamente enfermo). Los pacientes que mantuvieron la respuesta al tratamiento en la semana 3 de la fase de tratamiento de etiqueta abierta (N=116) fueron elegibles para ser aleatorizados a un tratamiento continuo con la misma dosis de VYVANSE (N=56) o cambiados a placebo (N=60) durante la fase de doble ciego. Los pacientes fueron observados para detectar recaídas (fallo del tratamiento) durante la fase de doble ciego de 6 semanas. El punto final de eficacia fue la proporción de pacientes con fallo del tratamiento durante la fase de doble ciego. El fallo del tratamiento se definió como un aumento ≥50% (empeoramiento) en la puntuación total de ADHD-RS y un aumento ≥2 puntos en la puntuación de CGI-S en comparación con las puntuaciones al entrar en la fase de doble ciego. El mantenimiento de la eficacia para los pacientes tratados con VYVANSE se demostró por la proporción significativamente menor de pacientes con fallo del tratamiento (9%) en comparación con los pacientes que recibieron placebo (75%) al final del período de doble ciego (Estudio 9, Figura 7).
| Número de estudio (Rango de edad) | Punto final principal | Grupo de tratamiento | Puntuación media inicial (DE) | Cambio medio de LS desde el inicio (EE) | Diferencia sustraída por placebo* (IC del 95%) |
|---|---|---|---|---|---|
| DE: desviación estándar; EE: error estándar; Media de LS: media de mínimos cuadrados; IC: intervalo de confianza. | |||||
|
|||||
| Estudio 1 (6 – 12 años) |
ADHD-RS-IV | VYVANSE (30 mg/día)† | 43.2 (6.7) | -21.8 (1.6) | -15.6 (-19.9, -11.2) |
| VYVANSE (50 mg/día)† | 43.3 (6.7) | -23.4 (1.6) | -17.2 (-21.5, -12.9) | ||
| VYVANSE (70 mg/día)† | 45.1(6.8) | -26.7 (1.5) | -20.5 (-24.8, -16.2) | ||
| Placebo | 42.4 (7.1) | -6.2 (1.6) | — | ||
| Estudio 2 (6 – 12 años) |
Promedio SKAMP-DS | VYVANSE (30, 50 o 70 mg/día)† | — ‡ | 0.8 (0.1) § | -0.9 (-1.1, -0.7) |
| Placebo | — ‡ | 1.7 (0.1) § | — | ||
| Estudio 3 (6 – 12 años) |
Promedio SKAMP-DS | VYVANSE (30, 50 o 70 mg/día)† | 0.9 (1.0)¶ | 0.7 (0.1)§ | -0.7 (-0.9, -0.6) |
| Placebo | 0.7 (0.9)¶ | 1.4 (0.1)§ | — | ||
| Estudio 4 (13 – 17 años) |
ADHD-RS-IV | VYVANSE (30 mg/día)† | 38.3 (6.7) | -18.3 (1.2) | -5.5 (-9.0, -2.0) |
| VYVANSE (50 mg/día)† | 37.3 (6.3) | -21.1 (1.3) | -8.3 (-11.8, -4.8) | ||
| VYVANSE (70 mg/día)† | 37.0 (7.3) | -20.7 (1.3) | -7.9 (-11.4, -4.5) | ||
| Placebo | 38.5 (7.1) | -12.8 (1.2) | — | ||
| Estudio 5 (6 – 17 años) |
ADHD-RS-IV | VYVANSE (30, 50 o 70 mg/día)† | 40.7 (7.3) | -24.3 (1.2) | -18.6 (-21.5, -15.7) |
| Placebo | 41.0 (7.1) | -5.7 (1.1) | — | ||
| Estudio 7 (18 – 55 años) |
ADHD-RS-IV | VYVANSE (30 mg/día)† | 40.5 (6.2) | -16.2 (1.1) | -8.0 (-11.5, -4.6) |
| VYVANSE (50 mg/día)† | 40.8 (7.3) | -17.4 (1.0) | -9.2 (-12.6, -5.7) | ||
| VYVANSE (70 mg/día)† | 41.0 (6.0) | -18.6 (1.0) | -10.4 (-13.9, -6.9) | ||
| Placebo | 39.4 (6.4) | -8.2 (1.4) | — | ||
| Estudio 8 (18 – 55 años) |
Promedio PERMP | VYVANSE (30, 50 o 70 mg/día)† | 260.1 (86.2)¶ | 312.9 (8.6)§ | 23.4 (15.6, 31.2) |
| Placebo | 261.4 (75.0)¶ | 289.5 (8.6)§ | — | ||
Figura 4 Puntuación media de LS de la subescala de comportamiento SKAMP por tratamiento y punto de tiempo para pacientes pediátricos de 6 a 12 años con TDAH después de 1 semana de tratamiento doble ciego (Estudio 3)
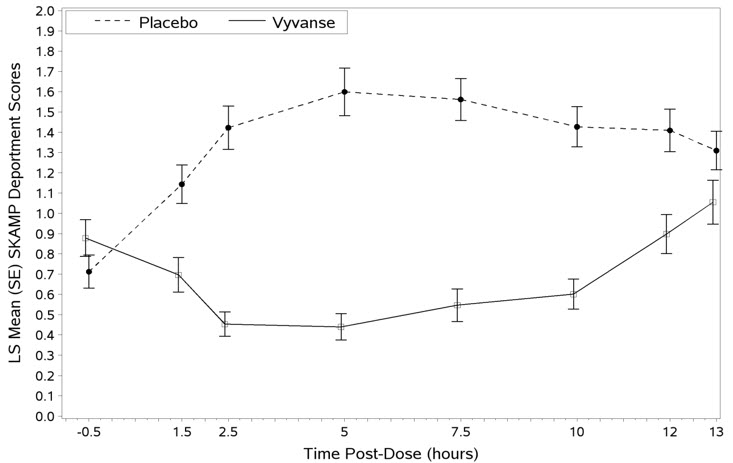
Una puntuación más alta en la escala SKAMP-Deportment indica síntomas más graves
Figura 5 Proporción estimada de Kaplan-Meier de pacientes con fracaso del tratamiento para pacientes pediátricos de 6 a 17 años (Estudio 6)
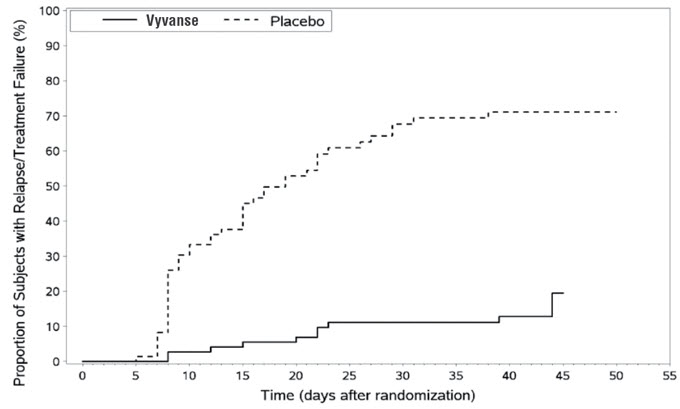
Figura 6 Puntuación total media de LS (SE) de PERMP por tratamiento y punto de tiempo para adultos de 18 a 55 años con TDAH después de 1 semana de tratamiento doble ciego (Estudio 8)
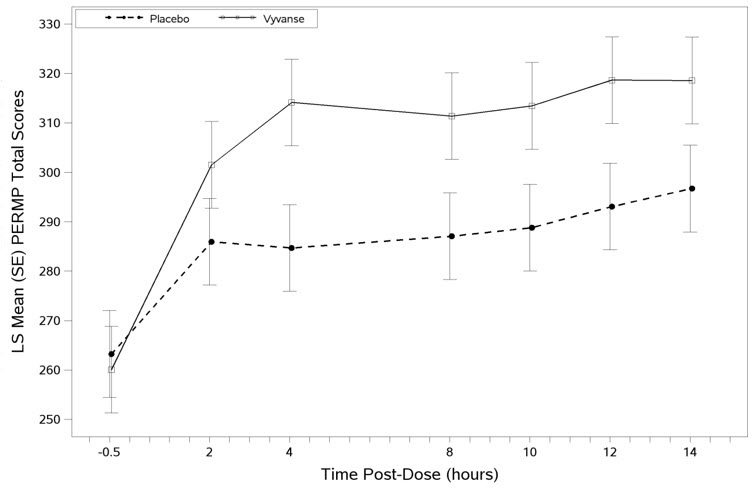
Una puntuación más alta en la escala PERMP indica síntomas menos graves.
Figura 7 Proporción estimada de Kaplan-Meier de sujetos con recaída en adultos con TDAH (Estudio 9)
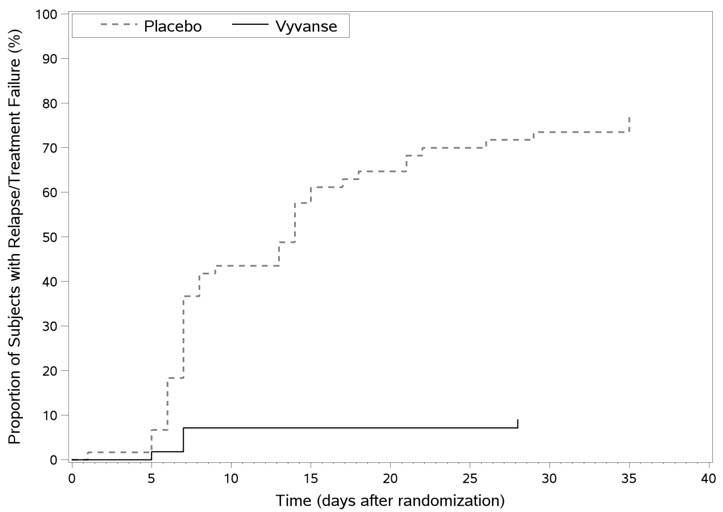
14.2 Trastorno por atracón (BED)
Un estudio de fase 2 evaluó la eficacia de VYVANSE 30, 50 y 70 mg/día en comparación con placebo para reducir el número de días de atracón/semana en adultos con BED al menos moderado a grave. Este estudio aleatorizado, doble ciego, de grupos paralelos, controlado con placebo, de titulación de dosis forzada (Estudio 10) consistió en un período de tratamiento doble ciego de 11 semanas (3 semanas de titulación de dosis forzada seguidas de 8 semanas de mantenimiento de la dosis). VYVANSE 30 mg/día no fue estadísticamente diferente del placebo en el criterio de valoración principal. Las dosis de 50 y 70 mg/día fueron estadísticamente superiores al placebo en el criterio de valoración principal.
La eficacia de VYVANSE en el tratamiento del BED se demostró en dos estudios aleatorizados, doble ciego, multicéntricos, de grupos paralelos, controlados con placebo, de optimización de la dosis (Estudio 11 y Estudio 12) en adultos de 18 a 55 años (Estudio 11: N=374, Estudio 12: N=350) con BED moderado a grave. Se confirmó un diagnóstico de BED utilizando los criterios del DSM-IV para el BED. La gravedad del BED se determinó en función de tener al menos 3 días de atracón por semana durante las 2 semanas previas a la visita de referencia y de tener una puntuación de la Escala de gravedad de la impresión clínica global (CGI-S) ≥4 en la visita de referencia. Para ambos estudios, un día de atracón se definió como un día con al menos 1 episodio de atracón, según el diario diario de atracones del sujeto.
Ambos estudios de 12 semanas consistieron en un período de optimización de la dosis de 4 semanas y un período de mantenimiento de la dosis de 8 semanas. Durante la optimización de la dosis, los sujetos asignados a VYVANSE comenzaron el tratamiento con la dosis de titulación de 30 mg/día y, después de 1 semana de tratamiento, posteriormente se titularon a 50 mg/día. Se realizaron aumentos adicionales a 70 mg/día según la tolerancia y la indicación clínica. Después del período de optimización de la dosis, los sujetos continuaron con su dosis optimizada durante la duración del período de mantenimiento de la dosis.
El resultado de eficacia principal para los dos estudios se definió como el cambio desde la línea de base en la semana 12 en el número de días de atracón por semana. La línea de base se define como el promedio semanal del número de días de atracón por semana durante los 14 días previos a la visita de referencia. Los sujetos de ambos estudios con VYVANSE tuvieron una reducción estadísticamente significativa desde la línea de base en el número medio de días de atracón por semana en la semana 12. Además, los sujetos con VYVANSE mostraron una mayor mejoría en comparación con el placebo en los resultados secundarios clave con una mayor proporción de sujetos calificados como mejorados en la escala de calificación CGI-I, una mayor proporción de sujetos con cesación de atracones de 4 semanas y una mayor reducción en la puntuación total de la Escala de obsesión compulsiva de Yale-Brown modificada para el atracón (Y-BOCS-BE).
| Número de estudio | Grupo de tratamiento | Medida de eficacia principal: Días de atracón por semana en la semana 12 | ||
|---|---|---|---|---|
| Puntuación media de referencia (DE) | Cambio medio de LS desde la línea de base (EE) | Diferencia sustraída por placebo* (IC del 95%) | ||
| DE: desviación estándar; EE: error estándar; Media de LS: media de mínimos cuadrados; IC: intervalo de confianza. | ||||
| Estudio 11 | VYVANSE (50 o 70 mg/día)† | 4.79 (1.27) | -3.87 (0.12) | -1.35 (-1.70, -1.01) |
| Placebo | 4.60 (1.21) | -2.51 (0.13) | — | |
| Estudio 12 | VYVANSE (50 o 70 mg/día)† | 4.66 (1.27) | -3.92 (0.14) | -1.66 (-2.04, -1.28) |
| Placebo | 4.82 (1.42) | -2.26 (0.14) | — | |
Se llevó a cabo un estudio de diseño de retiro aleatorizado, doble ciego, controlado con placebo (Estudio 13) para evaluar el mantenimiento de la eficacia basado en el tiempo hasta la recaída entre VYVANSE y placebo en adultos de 18 a 55 años (N=267) con BED moderado a severo. En este estudio a largo plazo, los pacientes que habían respondido a VYVANSE en la fase de tratamiento abierto de 12 semanas anterior se asignaron aleatoriamente a la continuación de VYVANSE o placebo durante un máximo de 26 semanas de observación para la recaída. La respuesta en la fase de etiqueta abierta se definió como 1 o menos días de atracones cada semana durante cuatro semanas consecutivas antes de la última visita al final de la fase de etiqueta abierta de 12 semanas y una puntuación CGI-S de 2 o menos en la misma visita. La recaída durante la fase de doble ciego se definió como tener 2 o más días de atracones cada semana durante dos semanas consecutivas (14 días) antes de cualquier visita y tener un aumento en la puntuación CGI-S de 2 o más puntos en comparación con la línea de base de retiro aleatorizado. Se demostró el mantenimiento de la eficacia para los pacientes que tuvieron una respuesta inicial durante el período de etiqueta abierta y luego continuaron con VYVANSE durante la fase de retiro aleatorizado de doble ciego de 26 semanas, siendo VYVANSE superior al placebo según lo medido por el tiempo hasta la recaída.
Figura 8 Proporciones estimadas de Kaplan-Meier de sujetos con recaída en adultos con BED (Estudio 13)
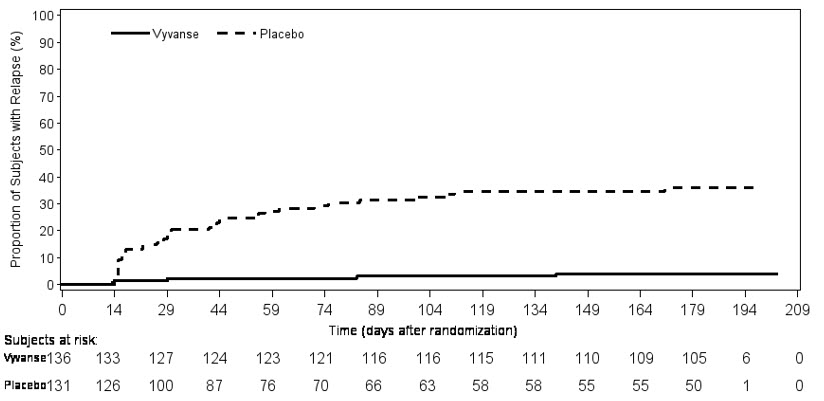
El examen de subgrupos de población según la edad (no hubo pacientes mayores de 65 años), el sexo y la raza no reveló ninguna evidencia clara de respuesta diferencial en el tratamiento del BED.
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
16.1 Cómo se suministra
VYVANSE (lisdexamfetamine dimesylate) cápsulas:
- Cápsulas de VYVANSE 10 mg: cuerpo rosado/tapa rosada (impresa con S489 y 10 mg), frascos de 100, NDC 59417-101-10
- Cápsulas de VYVANSE 20 mg: cuerpo marfil/tapa marfil (impresa con S489 y 20 mg), frascos de 100, NDC 59417-102-10
- Cápsulas de VYVANSE 30 mg: cuerpo blanco/tapa naranja (impresa con S489 y 30 mg), frascos de 100, NDC 59417-103-10
- Cápsulas de VYVANSE 40 mg: cuerpo blanco/tapa verde azulada (impresa con S489 y 40 mg), frascos de 100, NDC 59417-104-10
- Cápsulas de VYVANSE 50 mg: cuerpo blanco/tapa azul (impresa con S489 y 50 mg), frascos de 100, NDC 59417-105-10
- Cápsulas de VYVANSE 60 mg: cuerpo azul aguamarina/tapa azul aguamarina (impresa con S489 y 60 mg), frascos de 100, NDC 59417-106-10
- Cápsulas de VYVANSE 70 mg: cuerpo azul/tapa naranja (impresa con S489 y 70 mg), frascos de 100, NDC 59417-107-10
VYVANSE (lisdexamfetamine dimesylate) comprimidos masticables:
- Comprimidos masticables de VYVANSE 10 mg: Comprimido redondo de color blanco a blanquecino con ’10’ grabado en un lado y ‘S489’ en el otro, frascos de 100, NDC 59417-115-01
- Comprimidos masticables de VYVANSE 20 mg: Comprimido hexagonal de color blanco a blanquecino con ’20’ grabado en un lado y ‘S489’ en el otro, frascos de 100, NDC 59417-116-01
- Comprimidos masticables de VYVANSE 30 mg: Comprimido triangular de arco de color blanco a blanquecino con ’30’ grabado en un lado y ‘S489’ en el otro, frascos de 100, NDC 59417-117-01
- Comprimidos masticables de VYVANSE 40 mg: Comprimido en forma de cápsula de color blanco a blanquecino con ’40’ grabado en un lado y ‘S489’ en el otro, frascos de 100, NDC 59417-118-01
- Comprimidos masticables de VYVANSE 50 mg: Comprimido cuadrado de arco de color blanco a blanquecino con ’50’ grabado en un lado y ‘S489’ en el otro, frascos de 100, NDC 59417-119-01
- Comprimidos masticables de VYVANSE 60 mg: Comprimido de arco de diamante de color blanco a blanquecino con ’60’ grabado en un lado y ‘S489’ en el otro, frascos de 100, NDC 59417-120-01
16.2 Almacenamiento y manipulación
Dispense en un recipiente hermético y resistente a la luz, como se define en la USP.
Almacenar a temperatura ambiente, de 20°C a 25°C (68°F a 77°F). Se permiten excursiones entre 15°C y 30°C (59°F a 86°F) [ver Temperatura ambiente controlada de la USP].
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente que lea el etiquetado del paciente aprobado por la FDA (Guía de medicamentos).
Abuso, mal uso y adicción
Eduque a los pacientes y a sus familias sobre los riesgos de abuso, mal uso y adicción a VYVANSE, que pueden provocar sobredosis y muerte, y sobre la eliminación adecuada de cualquier medicamento no utilizado [ver Advertencias y precauciones (5.1), Abuso y dependencia de drogas (9.2), Sobredosis (10)]. Aconseje a los pacientes que guarden VYVANSE en un lugar seguro, preferiblemente bajo llave, e instruya a los pacientes para que no le den VYVANSE a nadie más.
Riesgos para los pacientes con enfermedad cardíaca grave
Aconseje a los pacientes que existen riesgos potenciales para los pacientes con enfermedad cardíaca grave, incluida la muerte súbita, con el uso de VYVANSE. Instruya a los pacientes para que se pongan en contacto con un profesional sanitario inmediatamente si desarrollan síntomas como dolor torácico de esfuerzo, síncope inexplicable u otros síntomas sugestivos de enfermedad cardíaca [ver Advertencias y precauciones (5.2)].
Aumento de la presión arterial y la frecuencia cardíaca
Instruya a los pacientes que VYVANSE puede causar elevaciones de su presión arterial y frecuencia cardíaca y que deben ser monitoreados para detectar tales efectos.
Reacciones adversas psiquiátricas
Aconseje a los pacientes que VYVANSE a las dosis recomendadas puede causar síntomas psicóticos o maníacos incluso en pacientes sin antecedentes de síntomas psicóticos o manía [ver Advertencias y precauciones (5.4)].
Supresión del crecimiento a largo plazo en pacientes pediátricos
Aconseje a los pacientes que VYVANSE puede causar un retraso en el crecimiento, incluida la pérdida de peso [ver Advertencias y precauciones (5.5)].
Problemas de circulación en los dedos de las manos y los pies [Vasculopatía periférica, incluida la enfermedad de Raynaud]
Instruya a los pacientes que comienzan el tratamiento con VYVANSE sobre el riesgo de vasculopatía periférica, incluida la enfermedad de Raynaud, y los signos y síntomas asociados: los dedos de las manos o los pies pueden sentirse entumecidos, fríos, dolorosos y/o pueden cambiar de color pálido a azul a rojo. Instruya a los pacientes para que informen a su médico de cualquier entumecimiento nuevo, dolor, cambio de color de la piel o sensibilidad a la temperatura en los dedos de las manos o los pies. Instruya a los pacientes para que llamen a su médico inmediatamente si presentan algún signo de heridas inexplicables que aparezcan en los dedos de las manos o los pies mientras toman VYVANSE. Una evaluación clínica adicional (por ejemplo, derivación a reumatología) puede ser apropiada para ciertos pacientes [ver Advertencias y precauciones (5.6)].
Síndrome serotoninérgico
Advierta a los pacientes sobre el riesgo de síndrome serotoninérgico con el uso concomitante de VYVANSE y otros fármacos serotoninérgicos, incluidos los ISRS, los IRSN, los triptanes, los antidepresivos tricíclicos, el fentanilo, el litio, el tramadol, el triptófano, la buspirona, la hierba de San Juan y los fármacos que alteran el metabolismo de la serotonina (en particular los IMAO, tanto los destinados a tratar trastornos psiquiátricos como otros, como la linezolida [ver Contraindicaciones (4), Advertencias y precauciones (5.7) y Interacciones medicamentosas (7.1)]. Aconseje a los pacientes que se pongan en contacto con su profesional sanitario o que acudan a la sala de urgencias si experimentan signos o síntomas de síndrome serotoninérgico.
Medicamentos concomitantes
Aconseje a los pacientes que notifiquen a sus médicos si están tomando o planean tomar cualquier medicamento recetado o de venta libre, ya que existe la posibilidad de que se produzcan interacciones [ver Interacciones medicamentosas (7.1)].
Tics motores y verbales, y empeoramiento del síndrome de Tourette
Aconseje a los pacientes que pueden aparecer tics motores y verbales y un empeoramiento del síndrome de Tourette durante el tratamiento con VYVANSE. Instruya a los pacientes para que notifiquen a su profesional sanitario si aparece algún tic nuevo o si empeora algún tic o el síndrome de Tourette [ver Advertencias y precauciones (5.8)].
Registro de embarazo
Aconseje a los pacientes que existe un registro de exposición al embarazo que monitoriza los resultados del embarazo en mujeres expuestas a VYVANSE durante el embarazo [ver Uso en poblaciones específicas (8.1)].
Embarazo
Aconseje a los pacientes sobre los posibles efectos fetales del uso de VYVANSE durante el embarazo. Aconseje a los pacientes que notifiquen a su profesional sanitario si quedan embarazadas o tienen intención de quedar embarazadas durante el tratamiento con VYVANSE [ver Uso en poblaciones específicas (8.1)].
Lactancia
Aconseje a las mujeres que no den el pecho si están tomando VYVANSE [ver Uso en poblaciones específicas (8.2)].
Instrucciones de administración
- Cápsulas: Aconseje a los pacientes que tomen las cápsulas enteras o vacías y mezclen todo el contenido con yogur, agua o zumo de naranja. Aconseje a los pacientes que consuman la mezcla inmediatamente y que no la guarden para uso futuro [ver Dosificación y administración (2.2)].
- Comprimidos masticables: Aconseje a los pacientes que los comprimidos masticables deben masticarse completamente antes de tragarlos [ver Dosificación y administración (2.2)].
SECCIÓN NO CLASIFICADA SPL
Distribuido por:
Takeda Pharmaceuticals America, Inc.
Lexington, MA 02421
Hecho en EE. UU.
Para obtener más información, llame al 1-800-828-2088
VYVANSE® y el logotipo de VYVANSE® son marcas comerciales registradas de Takeda Pharmaceuticals U.S.A., Inc.
©2023 Takeda Pharmaceuticals U.S.A., Inc. Todos los derechos reservados.
Patente de EE. UU. No. 7,105,486, 7,223,735, 7,655,630, 7,659,253, 7,659,254, 7,662,787, 7,662,788, 7,671,030, 7,671,031, 7,674,774, 7,678,770, 7,678,771, 7,687,466, 7,687,467, 7,713,936, 7,718,619, 7,723,305
Guía de medicación
| GUÍA TERAPÉUTICA VYVANSE® (Vi’ – vans) (dimesilato de lisdexamfetamina) Cápsulas y Tabletas Masticables, CII |
||||
|---|---|---|---|---|
| Esta Guía Terapéutica ha sido aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos. | Revisada: 10/2023 | |||
|
¿Cuál es la información más importante que debo saber sobre VYVANSE?
|
||||
| ¿Qué es VYVANSE? VYVANSE es un medicamento de prescripción estimulante del sistema nervioso central (SNC) utilizado para el tratamiento de:
VYVANSE no se usa en niños menores de 6 años con TDAH. |
||||
No tome VYVANSE si usted o su hijo son:
|
||||
Antes de tomar VYVANSE, informe a su médico sobre todas las afecciones médicas, incluso si usted o su hijo:
Informe a su médico sobre todos los medicamentos que usted o su hijo toman, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos herbales. |
||||
|
|
|||
| Lleve una lista de todos los medicamentos para mostrársela a su médico y farmacéutico cuando obtenga un medicamento nuevo. Su médico decidirá si VYVANSE se puede tomar con otros medicamentos. No comience ningún medicamento nuevo durante el tratamiento con VYVANSE sin hablar primero con su médico. |
||||
¿Cómo se debe tomar VYVANSE?
Si usted o su hijo toman demasiado VYVANSE, llame a su médico o a la línea de ayuda para envenenamiento al 1-800-222-1222 o vaya a la sala de emergencias del hospital más cercano de inmediato. |
||||
| ¿Cuáles son los posibles efectos secundarios de VYVANSE? VYVANSE puede causar efectos secundarios graves, que incluyen:
|
||||
|
|
|||
| Los efectos secundarios más comunes de VYVANSE en niños de 6 a 17 años y adultos con TDAH incluyen: | ||||
|
|
|||
| Los efectos secundarios más comunes de VYVANSE en adultos con BED incluyen: | ||||
|
|
|||
| Estos no son todos los posibles efectos secundarios de VYVANSE. Llámele a su médico para recibir asesoramiento médico sobre los efectos secundarios. Puede informar de los efectos secundarios a la FDA al 1-800-FDA-1088. |
||||
¿Cómo debo almacenar VYVANSE?
Mantenga VYVANSE y todos los medicamentos fuera del alcance de los niños. |
||||
| Información general sobre el uso seguro y eficaz de VYVANSE. Las medicinas a veces se prescriben para fines distintos a los indicados en una Guía de Medicación. No use VYVANSE para una condición para la que no se le ha prescrito. No le dé VYVANSE a otras personas, incluso si tienen los mismos síntomas que usted. Puede dañarles y es ilegal. Puede pedir a su farmacéutico o proveedor de atención médica información sobre VYVANSE escrita para profesionales de la salud. |
||||
| ¿Cuáles son los ingredientes de VYVANSE? Ingrediente activo: dimesilato de lisdexamfetamina Ingredientes inactivos de la cápsula: celulosa microcristalina, sodio croscarmelosa y estearato de magnesio. Las cápsulas (impresas con S489) contienen gelatina, dióxido de titanio y uno o más de los siguientes: FD&C Rojo #3, FD&C Amarillo #6, FD&C Azul #1, Óxido de hierro negro y Óxido de hierro amarillo. Ingredientes inactivos del comprimido masticable: dióxido de silicio coloidal, sodio croscarmelosa, goma guar, estearato de magnesio, manitol, celulosa microcristalina, sucralosa, sabor artificial a fresa. Distribuido por: Takeda Pharmaceuticals América, Inc., Lexington, MA 02421. VYVANSE® y el Logotipo de VYVANSE® son marcas registradas de Takeda Pharmaceuticals U.S.A., Inc. © 2023 Takeda Pharmaceuticals U.S.A., Inc. Todos los derechos reservados. Para más información, vaya a www.vyvanse.com o llame al 1-800-828-2088. |
||||
Panel de visualización principal – Etiqueta de botella de cápsulas de 10 mg
NDC 59417-101-10
Vyvanse®
(lisdexamfetamina
dimelsilato) cápsulas
10 mg
CII
Receta médica sólo
100 CÁPSULAS
Takeda

PANEL DE EXHIBICIÓN PRINCIPAL – Etiqueta de frasco de cápsulas de 20 mg
NDC 59417-102-10
Vyvanse®
(lisdexamfetamina
dimesilato) cápsulas
20 mg
CII
Sólo receta médica
100 CÁPSULAS
Takeda

PANEL DE MOSTRACIÓN PRINCIPAL – Etiqueta de Frasco de Cápsulas de 30 mg
NDC 59417-103-10
Vyvanse®
(lisdexamfetamina
dimesilato) cápsulas
30 mg
CII
Receta médica únicamente
100 CÁPSULAS
Takeda

PANEL DE DESPLIEGUE PRINCIPAL – Etiqueta de frasco con cápsulas de 40 mg
NDC 59417-104-10
Vyvanse®
(lisdexamfetamida disulfato) cápsulas
40 mg
CII
Receta médica únicamente
100 CÁPSULAS
Takeda

PANEL DE DESPLIEGUE PRINCIPAL – Etiqueta de botella de cápsula de 50 mg
NDC 59417-105-10
Vyvanse®
(lisdexamfetamina
dimesilato) cápsulas
50 mg
CII
Sólo con receta
100 CÁPSULAS
Takeda

PANEL PRINCIPAL DE VISUALIZACIÓN – Etiqueta de botella de cápsulas de 60 mg
NDC 59417-106-10
Vyvanse®
(lisdexamfetamina
dimesilato) cápsulas
60 mg
CII
Receta médica solamente
100 CÁPSULAS
Takeda

PANEL DE VISUALIZACIÓN PRINCIPAL – Etiqueta de frasco de cápsulas de 70 mg
NDC 59417-107-10
Vyvanse®
(lisdexamfetamina
dimesilato) cápsulas
70 mg
CII
Rx solo
100 CÁPSULAS
Takeda

Panel principal de visualización – Etiqueta del frasco de 10 mg Tablet
NDC 59417-115-01
Vyvanse®
(lisdexamfetamina
dimesilato) tabletas masticables
10 mg
100 TABLETAS
MASTICABLES
Mastique por completo las tabletas
antes de tragar. No trague
las tabletas enteras.
CII
Rx sólo
Takeda

PANEL DE MUESTRA PRINCIPAL – Etiqueta de frasco de tableta de 20 mg
NDC 59417-116-01
Vyvanse®
(lisdexamfetamina
dimesilato) comprimidos masticables
20 mg
100 COMPRIMIDOS
MASTICABLES
Mastique completamente los comprimidos
antes de tragar. No trague los comprimidos enteros.
CII
Receta médica únicamente
Takeda

PANEL DE MONITOR PRINCIPAL – Etiqueta del frasco de tabletas 30 mg
NDC 59417-117-01
Vyvanse®
(lisdexamfetamina
dimesilato) tabletas masticables
30 mg
100 TABLETAS
MASTICABLES
Mastique las tabletas completamente
antes de tragar. No se trague las tabletas enteras.
CII
Receta médica solamente
Takeda

PANEL PRINCIPAL DE EXPOSICIÓN – Etiqueta de botella de tableta de 40 mg
NDC 59417-118-01
Vyvanse®
(lisdexamfetamina
dimesilato) tabletas masticables
40 mg
100 TABLETAS
MÁSTICABLES
Masticar las tabletas completamente
antes de tragar. No
trague las tabletas enteras.
CII
Receta médica únicamente
Takeda
PANEL DE MOSTRACIÓN PRINCIPAL – Etiqueta del frasco de tabletas de 50 mg
NDC 59417-119-01
Vyvanse®
(lisdexanfetamina
dimesilato) tabletas masticables
50 mg
100 TABLETAS
MASTICABLES
Mastique las tabletas completamente
antes de tragar. No se trague las tabletas enteras.
CII
Únicamente receta médica
Takeda

ETIQUETA PRINCIPAL DEL ENVASE – Etiqueta del frasco de tabletas de 60 mg
NDC 59417-120-01
Vyvanse®
(lisdexamfetamina
dimesilato) comprimidos masticables
60 mg
100 COMPRIMIDOS
MASTICABLES
Mastique los comprimidos completamente
antes de tragarlos. No se trague los comprimidos enteros.
CII
Receta médica solamente
Takeda