Fabricante de medicamentos: Pfizer Laboratories Div Pfizer Inc (Updated: 2025-01-01)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
VYNDAQEL® (tafamidis meglumine) cápsulas, para administración oral
Aprobación inicial en EE. UU.: 2019
VYNDAMAX™ (tafamidis) cápsulas, para administración oral
Aprobación inicial en EE. UU.: 2019
INDICACIONES Y USO
VYNDAQEL y VYNDAMAX son estabilizadores de transtiretina indicados para el tratamiento de la miocardiopatía de amiloidosis mediada por transtiretina hereditaria o de tipo salvaje en adultos para reducir la mortalidad cardiovascular y la hospitalización relacionada con problemas cardiovasculares. (1)
DOSIFICACIÓN Y ADMINISTRACIÓN
FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Cápsulas: Tafamidis meglumine 20 mg y tafamidis 61 mg. (3)
CONTRAINDICACIONES
Ninguna. (4)
REACCIONES ADVERSAS
Para reportar REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Pfizer Inc. al 1-800-438-1985 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
USO EN POBLACIONES ESPECÍFICAS
Consulte 17 para obtener INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y el etiquetado del paciente aprobado por la FDA.
Revisado: 10/2023
Tabla de contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1. INDICACIONES Y USO
2. DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis Recomendada
2.2 Instrucciones de Administración
3. FORMAS Y CONCENTRACIONES FARMACÉUTICAS
4. CONTRAINDICACIONES
6. REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
7. INTERACCIONES MEDICAMENTOSAS
7.1 Sustratos de BCRP
8. USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.3 Mujeres y Hombres en Edad Reproductiva
8.4 Uso Pediátrico
8.5 Uso Geriátrico
10. SOBREDOSIFICACIÓN
11. DESCRIPCIÓN
12. FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13. TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14. ESTUDIOS CLÍNICOS
16. PRESENTACIÓN/ALMACENAMIENTO Y MANEJO
17. INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no se enumeran.
1. INDICACIONES Y USO
VYNDAQEL y VYNDAMAX están indicados para el tratamiento de la cardiomiopatía de amiloidosis transtiretina mediada por tipo salvaje o hereditaria (ATTR-CM) en adultos para reducir la mortalidad cardiovascular y la hospitalización relacionada con eventos cardiovasculares.
2. DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis recomendada
La dosis recomendada es VYNDAQEL 80 mg (cuatro cápsulas de tafamidis meglumina de 20 mg) por vía oral una vez al día o VYNDAMAX 61 mg (una cápsula de tafamidis de 61 mg) por vía oral una vez al día.
VYNDAMAX y VYNDAQEL no son sustituibles por mg [ver Farmacología clínica (12.3)].
2.2 Instrucciones de administración
Las cápsulas deben tragarse enteras y no deben machacarse ni cortarse.
Si se olvida una dosis, indique a los pacientes que tomen la dosis tan pronto como la recuerden o que se salten la dosis olvidada y tomen la siguiente dosis a la hora programada habitualmente. No duplique la dosis.
3. FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
VYNDAQEL está disponible como:
- •
- tafamidis meglumine 20 mg: cápsula oblonga, amarilla, opaca, impresa con “VYN 20” en rojo.
VYNDAMAX está disponible como:
- •
- tafamidis 61 mg: cápsula oblonga, marrón rojizo, opaca, impresa con “VYN 61” en blanco.
4. CONTRAINDICACIONES
Ninguna.
6. Reacciones adversas
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan bajo condiciones ampliamente variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no pueden compararse directamente con las tasas en los ensayos clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica.
Los datos reflejan la exposición de 377 pacientes con ATTR-CM a 20 mg u 80 mg (administrados como cuatro cápsulas de 20 mg) de VYNDAQEL administrados diariamente durante un promedio de 24.5 meses (que van desde 1 día hasta 111 meses).
Los eventos adversos se evaluaron a partir de ensayos clínicos de ATTR-CM con VYNDAQEL, principalmente un ensayo controlado con placebo de 30 meses [ver Estudios Clínicos (14)]. La frecuencia de eventos adversos en pacientes tratados con VYNDAQEL 20 mg (n=88) u 80 mg (n=176; administrados como cuatro cápsulas de 20 mg) fue similar a la del placebo (n=177).
En el ensayo controlado con placebo de 30 meses, proporciones similares de pacientes tratados con VYNDAQEL y pacientes tratados con placebo suspendieron el medicamento del estudio debido a un evento adverso: 12 (7%), 5 (6%) y 11 (6%) de los grupos de VYNDAQEL 80 mg, VYNDAQEL 20 mg y placebo, respectivamente.
7. INTERACCIONES MEDICAMENTOSAS
7.1 BCRP Substrates
Tafamidis inhibe la proteína de resistencia al cáncer de mama (BCRP) en humanos [see Clinical Pharmacology (12.3)]. La coadministración de tafamidis y medicamentos que son sustratos de BCRP puede aumentar la exposición de los sustratos de este transportador (p. ej., methotrexate, rosuvastatin, imatinib) y el riesgo de toxicidades relacionadas con el sustrato. Monitorizar las señales de toxicidades relacionadas con el sustrato de BCRP y modificar la dosis del sustrato si es apropiado.
8. USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgo
Según los hallazgos de estudios en animales, VYNDAQEL y VYNDAMAX pueden causar daño fetal cuando se administran a una mujer embarazada. Sin embargo, los datos humanos limitados disponibles con el uso de VYNDAQEL en mujeres embarazadas (a una dosis de 20 mg por día) no han identificado ningún riesgo asociado con el fármaco para defectos congénitos importantes, aborto espontáneo o resultados adversos maternos o fetales. En estudios de reproducción en animales, la administración oral de tafamidis meglumina a conejas embarazadas durante la organogénesis provocó efectos adversos en el desarrollo (mortalidad embriofetal, reducción del peso corporal fetal y malformación fetal) a una dosis que proporciona aproximadamente 9 veces la exposición humana (AUC) a la dosis máxima recomendada para humanos (MRHD) de VYNDAQEL (80 mg), y un aumento de la incidencia de variaciones esqueléticas fetales a una dosis que proporciona una exposición humana equivalente (AUC) a la MRHD. Se observó mortalidad postnatal, retraso del crecimiento y deterioro del aprendizaje y la memoria en la descendencia de ratas embarazadas a las que se administró tafamidis meglumina durante la gestación y la lactancia a una dosis aproximadamente 2 veces superior a la MRHD en función del área de superficie corporal (mg/m2) (ver Datos). Avise a las mujeres embarazadas sobre el riesgo potencial para el feto. Informe los embarazos a la línea de información de Pfizer al 1-800-438-1985.
Se desconoce el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de fondo de defectos de nacimiento, pérdida u otros resultados adversos. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente.
Datos
Datos en animales
En ratas embarazadas, la administración oral de tafamidis meglumina (0, 15, 30 y 45 mg/kg/día) durante toda la organogénesis provocó una disminución del peso corporal fetal a ≥30 mg/kg/día (aproximadamente 10 veces la exposición humana a la MRHD en función del AUC). El nivel sin efecto adverso observado (NOAEL) para el desarrollo embriofetal en ratas fue de 15 mg/kg/día (aproximadamente 7 veces la exposición humana a la MRHD en función del AUC).
En conejas embarazadas, la administración oral de tafamidis meglumina (0, 0.5, 2 y 8 mg/kg/día) durante toda la organogénesis provocó un aumento de la mortalidad embriofetal, una reducción del peso corporal fetal y un aumento de la incidencia de malformaciones fetales a 8 mg/kg/día (aproximadamente 9 veces la exposición humana a la MRHD en función del AUC), que también fue tóxica para la madre. Se observaron mayores incidencias de variaciones esqueléticas fetales a dosis ≥0.5 mg/kg/día (aproximadamente equivalente a la exposición humana a la MRHD en función del AUC).
En el estudio pre y postnatal, las ratas embarazadas recibieron administración oral de tafamidis meglumina en dosis de 0, 5, 15 o 30 mg/kg/día durante todo el embarazo y la lactancia (día 7 de gestación a día 20 de lactancia). Se observó disminución de la supervivencia y el peso corporal, retraso de la maduración sexual masculina y efectos neuroconductuales (deterioro del aprendizaje y la memoria) en la descendencia de las madres tratadas con 15 mg/kg/día (aproximadamente 2 veces la MRHD en base a mg/m2). El NOAEL para el desarrollo pre y postnatal en ratas fue de 5 mg/kg/día (aproximadamente equivalente a la MRHD en base a mg/m2).
8.2 Lactancia
Resumen de Riesgo
No hay datos disponibles sobre la presencia de tafamidis en la leche materna, el efecto en el lactante o el efecto en la producción de leche. El tafamidis está presente en la leche de rata (ver Datos). Cuando un fármaco está presente en la leche animal, es probable que el fármaco esté presente en la leche materna. Según los hallazgos de estudios en animales que sugieren la posibilidad de reacciones adversas graves en el lactante, se recomienda a los pacientes que no se recomienda la lactancia materna durante el tratamiento con VYNDAQEL o VYNDAMAX.
Datos
A ratas hembra embarazadas y lactantes se les administraron dosis orales diarias repetidas de tafamidis meglumina (15 mg/kg/día) seguidas de una dosis única de tafamidis meglumina 14C por sonda oral en el día 4 o 12 de lactancia. Se observó radiactividad en la leche a la 1 hora después de la dosis y aumentó posteriormente. La proporción de la mayor radiactividad asociada con tafamidis meglumina 14C en la leche (8 horas después de la dosis) frente al plasma (1 hora después de la dosis) fue de aproximadamente 1,6 en el día 12, lo que indica que la tafamidis meglumina se transfiere a la leche después de la administración oral.
8.3 Mujeres y hombres en edad fértil
Anticoncepción
Mujeres
Según los hallazgos de estudios en animales, VYNDAQEL y VYNDAMAX pueden causar daño fetal cuando se administran a una mujer embarazada [ver Uso en poblaciones específicas (8.1)]. Considere la planificación y prevención del embarazo para las mujeres en edad fértil.
8.4 Uso pediátrico
No se ha establecido la seguridad y eficacia de VYNDAQEL y VYNDAMAX en pacientes pediátricos.
8.5 Uso geriátrico
No se requiere ajuste de dosis para pacientes de edad avanzada (≥65 años) [ver Farmacología clínica (12.3)]. Del número total de pacientes en el estudio clínico (n=441), el 90,5% tenía 65 años o más, con una mediana de edad de 75 años.
10. SOBREDOSIS
Existe una experiencia clínica mínima con sobredosis. Durante los ensayos clínicos, dos pacientes ingirieron accidentalmente una dosis única de VYNDAQEL de 160 mg sin eventos adversos. La dosis más alta de tafamidis meglumina administrada a voluntarios sanos en un ensayo clínico fue de 480 mg como dosis única. Se reportó un evento adverso de hordeolum leve a esta dosis.
11. DESCRIPCIÓN
VYNDAQEL (tafamidis meglumina) y VYNDAMAX (tafamidis) contienen tafamidis como principio activo, que es un estabilizador selectivo de la transtiretina.
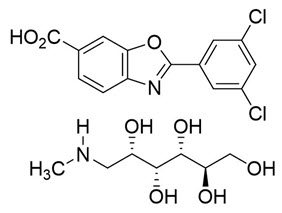
El nombre químico de la tafamidis meglumina es ácido 2-(3,5-diclorofenil)-1,3-benzoxazol-6-carboxílico mono (1-desoxi-1-metilamino-D-glucitol). La fórmula molecular es C14H7Cl2NO3 C7H17NO5, y el peso molecular es 503,33 g/mol. La fórmula estructural es:
La cápsula de gelatina blanda de tafamidis meglumina de 20 mg para administración oral contiene una suspensión de color blanco a rosa de tafamidis meglumina 20 mg (equivalente a 12,2 mg de ácido tafamidis libre), y los siguientes excipientes inactivos: hidróxido de amonio al 28 %, azul brillante FCF, carmín, gelatina, glicerina, óxido de hierro (amarillo), polietilenglicol 400, polisorbato 80, ftalato de polivinilacetato, propilenglicol, monooleato de sorbitán, sorbitol y dióxido de titanio.
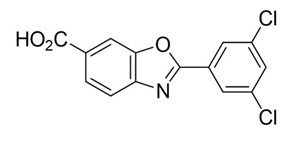
El nombre químico de tafamidis es ácido 2-(3,5-diclorofenil)-1,3-benzoxazol-6-carboxílico. La fórmula molecular es C14H7Cl2NO3, y el peso molecular es 308,12 g/mol. La fórmula estructural es:
La cápsula de gelatina blanda de tafamidis de 61 mg para administración oral contiene una suspensión de color blanco a rosa de tafamidis 61 mg y los siguientes excipientes inactivos: hidróxido de amonio al 28 %, hidroxitolueno butilado, gelatina, glicerina, óxido de hierro (rojo), polietilenglicol 400, polisorbato 20, povidona (valor K 90), ftalato de polivinilacetato, propilenglicol, sorbitol y dióxido de titanio.
12. FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Tafamidis es un estabilizador selectivo de TTR. Tafamidis se une a TTR en los sitios de unión de tiroxina, estabilizando el tetrámero y ralentizando la disociación en monómeros, el paso limitante de la velocidad en el proceso amiloidogénico.
12.2 Farmacodinamia
Se utilizó un ensayo de estabilización de TTR patentado como marcador farmacodinámico y se evaluó la estabilidad del tetrámero de TTR ex vivo. El ensayo de estabilización de TTR cuantifica la medición inmunoturbidimétrica del tetrámero de TTR estable en plasma antes y después del tratamiento con desnaturalización in vitro de 2 días con urea. Utilizando este ensayo patentado, se observa una tendencia dosis-dependiente a una mayor estabilización del tetrámero de TTR para VYNDAQEL 80 mg en comparación con VYNDAQEL 20 mg. Sin embargo, se desconoce la relevancia clínica de una mayor estabilización del tetrámero de TTR para los resultados cardiovasculares.
VYNDAQEL estabilizó tanto el tetrámero de TTR de tipo salvaje como los tetrámeros de las 14 variantes de TTR probadas clínicamente después de la administración diaria una vez al día. Tafamidis también estabilizó el tetrámero de TTR para las 25 variantes probadas ex vivo.
VYNDAQEL y VYNDAMAX pueden disminuir las concentraciones séricas de tiroxina total, sin un cambio concomitante en la hormona estimulante del tiroides (TSH). Esta reducción en los valores de tiroxina total es probablemente el resultado de una reducción de la unión de tiroxina o el desplazamiento de la transtiretina (TTR) debido a la alta afinidad de unión de tafamidis al receptor de tiroxina TTR. No se han observado hallazgos clínicos correspondientes compatibles con hipotiroidismo.
Los biomarcadores asociados con la insuficiencia cardíaca (NT-proBNP y Troponina I) favorecieron a VYNDAQEL sobre el placebo.
12.3 Farmacocinética
No se observaron diferencias clínicamente significativas en la Cmax en estado estacionario y el área bajo la curva de concentración plasmática en función del tiempo (AUC) de tafamidis para la cápsula de VYNDAMAX de 61 mg en comparación con VYNDAQEL administrado como cuatro cápsulas de 20 mg.
La exposición a tafamidis aumenta proporcionalmente con la administración única (hasta 480 mg) o múltiple (hasta 80 mg) (de 1 a 6 veces la dosis recomendada aprobada) una vez al día.
El aclaramiento aparente fue similar después de la administración única y repetida de VYNDAQEL 80 mg.
Absorción
Las concentraciones máximas medianas de tafamidis se produjeron dentro de las 4 horas posteriores a la administración de la dosis.
Distribución
El volumen de distribución aparente en estado estacionario de tafamidis meglumina es de 16 litros y 18,5 litros para tafamidis. La unión a proteínas plasmáticas de tafamidis es >99% in vitro. Tafamidis se une principalmente a TTR.
Eliminación
La semivida media de tafamidis es de aproximadamente 49 horas. El aclaramiento oral aparente de tafamidis meglumina es de 0,228 L/h (0,263 L/h para tafamidis). El grado de acumulación del fármaco en estado estacionario después de la administración diaria repetida de tafamidis es aproximadamente 2,5 veces mayor que el observado después de una dosis única.
Poblaciones específicas
No se observaron diferencias clínicamente significativas en la farmacocinética de tafamidis en función de la edad, la raza/etnia (caucásica y japonesa) o la insuficiencia renal.
Pacientes con insuficiencia hepática
Los pacientes con insuficiencia hepática moderada (puntuación de Child-Pugh de 7 a 9) tuvieron una exposición sistémica disminuida (aproximadamente 40%) y un aclaramiento aumentado (aproximadamente 68%) de tafamidis en comparación con los sujetos sanos. Como los niveles de TTR son más bajos en sujetos con insuficiencia hepática moderada que en sujetos sanos, la exposición a tafamidis en relación con la cantidad de TTR es suficiente para mantener la estabilización del tetrámero de TTR en estos pacientes. No se observaron diferencias clínicamente significativas en la farmacocinética de tafamidis en pacientes con insuficiencia hepática leve (puntuación de Child Pugh de 5 a 6) en comparación con los sujetos sanos. Se desconoce el efecto de la insuficiencia hepática grave en tafamidis.
Estudios de interacción farmacológica
Estudios Clínicos
Sustratos de CYP3A4: No se observaron diferencias clínicamente significativas en la farmacocinética de midazolam (un sustrato de CYP3A4) o en la formación de su metabolito activo (1-hidroximidazolam) cuando se administró una dosis única de 7,5 mg de midazolam antes y después de un régimen de 14 días de VYNDAQEL 20 mg una vez al día.
Sustratos de BCRP: El tafamidis inhibe la proteína resistente al cáncer de mama (BCRP). En un estudio clínico en participantes sanos, el AUCinf y la Cmax del sustrato de BCRP rosuvastatina aumentaron en un 96,75 % y un 85,59 %, respectivamente, después de dosis múltiples de VYNDAMAX 61 mg de dosificación diaria.
Estudios In Vitro
Enzimas del Citocromo P450: El tafamidis induce CYP2B6 y CYP3A4 y no induce CYP1A2. El tafamidis no inhibe CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP3A4/5 o CYP2D6.
UDP glucuronosiltransferasa (UGT): El tafamidis inhibe las actividades intestinales de UGT1A1, pero ni induce ni inhibe otras UDP glucuronosiltransferasas (UGT) sistémicamente.
Sistemas de Transporte: Los estudios in vitro y las predicciones de modelos muestran que el tafamidis tiene un bajo potencial para inhibir los transportadores de aniones orgánicos OAT1 y OAT3 a concentraciones clínicamente relevantes. El tafamidis no mostró un potencial para inhibir la proteína de resistencia a múltiples fármacos (MDR1) (también conocida como P-glicoproteína; P-gp), el transportador de cationes orgánicos OCT2, los transportadores de extrusión de múltiples fármacos y toxinas MATE1 y MATE2K y el polipéptido transportador de aniones orgánicos OATP1B1 y OATP1B3.
13. TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Carcinogénesis
No hubo evidencia de una mayor incidencia de neoplasia en el ratón transgénico (Tg)-rasH2 después de la administración diaria repetida durante 26 semanas a dosis diarias de 0, 10, 30 o 90 mg/kg. No hubo evidencia de una mayor incidencia de neoplasia en un estudio de carcinogenicidad de 2 años en ratas con exposiciones de hasta 18 veces el AUC a la MRHD.
Mutagénesis
No hubo evidencia de mutagenicidad o clastogenicidad in vitro, y un estudio de micronúcleos in vivo en ratas fue negativo.
Deterioro de la Fertilidad
No hubo efectos de tafamidis meglumina sobre la fertilidad, el rendimiento reproductivo o el comportamiento de apareamiento en la rata a ninguna dosis. Las ratas recibieron dosis diarias (0, 5, 15 y 30 mg/kg/día) antes de la cohabitación (durante al menos 15 días para las hembras y 28 días para los machos), durante todo el período de cohabitación hasta el día anterior a la terminación de los machos y hasta la implantación de las hembras (día 7 de gestación). No se observaron efectos adversos en ratas macho y hembra en cuanto a toxicidad, fertilidad y comportamiento de apareamiento a ninguna dosis. El nivel sin efecto adverso observado paterno y materno para la toxicidad reproductiva de tafamidis meglumina es de 30 mg/kg/día, aproximadamente 4 veces la MRHD en base a mg/m2.
14. ESTUDIOS CLÍNICOS
La eficacia se demostró en un estudio multicéntrico, internacional, aleatorizado, doble ciego y controlado con placebo en 441 pacientes con ATTR-CM de tipo salvaje o hereditario (NCT01994889).
Los pacientes fueron aleatorizados en una proporción de 1:2:2 para recibir VYNDAQEL 20 mg (n=88), VYNDAQEL 80 mg (administrado como cuatro cápsulas de VYNDAQEL de 20 mg) (n=176) o placebo coincidente (n=177) una vez al día durante 30 meses, además del tratamiento estándar (p. ej., diuréticos). La asignación del tratamiento se estratificó por la presencia o ausencia de un genotipo TTR variante, así como por la gravedad de la enfermedad basal (clase NYHA). Los pacientes trasplantados fueron excluidos de este estudio. La Tabla 1 describe las características demográficas y basales de los pacientes.
| Característica | Tafamidis agrupado N=264 |
Placebo N=177 |
|---|---|---|
| Abreviaturas: ATTRm = amiloide de transtiretina variante, ATTRwt = amiloide de transtiretina de tipo salvaje | ||
|
Edad — años |
||
|
Media (desviación estándar) |
74.5 (7.2) |
74.1 (6.7) |
|
Mediana (mínimo, máximo) |
75 (46, 88) |
74 (51, 89) |
|
Sexo — número (%) |
||
|
Masculino |
241 (91.3) |
157 (88.7) |
|
Femenino |
23 (8.7) |
20 (11.3) |
|
TTR Genotype — número (%) |
||
|
ATTRm |
63 (23.9) |
43 (24.3) |
|
ATTRwt |
201 (76.1) |
134 (75.7) |
|
Clase NYHA — número (%) |
||
|
Clase NYHA I |
24 (9.1) |
13 (7.3) |
|
Clase NYHA II |
162 (61.4) |
101 (57.1) |
|
Clase NYHA III |
78 (29.5) |
63 (35.6) |
El análisis principal utilizó una combinación jerárquica aplicando el método de Finkelstein-Schoenfeld (F-S) a la mortalidad por todas las causas y la frecuencia de hospitalizaciones relacionadas con enfermedades cardiovasculares, que se definió como el número de veces que un sujeto fue hospitalizado (es decir, ingresado en un hospital) por morbilidad relacionada con enfermedades cardiovasculares. El método comparó a cada paciente con todos los demás pacientes dentro de cada estrato de manera pareada que procedió de forma jerárquica utilizando la mortalidad por todas las causas seguida de la frecuencia de hospitalizaciones relacionadas con enfermedades cardiovasculares cuando los pacientes no podían diferenciarse en función de la mortalidad.
Este análisis demostró una reducción significativa (p=0.0006) en la mortalidad por todas las causas y la frecuencia de hospitalizaciones relacionadas con enfermedades cardiovasculares en los grupos combinados de VYNDAQEL 20 mg y 80 mg versus placebo (Tabla 2).
| Análisis principal | VYNDAQEL combinado N=264 |
Placebo N=177 |
|---|---|---|
|
||
|
Número (%) de sujetos vivos* en el mes 30 |
186 (70.5) |
101 (57.1) |
|
Número medio de hospitalizaciones relacionadas con enfermedades cardiovasculares durante 30 meses (por paciente por año) entre los que estaban vivos en el mes 30 |
0.297 |
0.455 |
|
Valor p del método F-S |
0.0006 |
|
El análisis de los componentes individuales del análisis principal (mortalidad por todas las causas y hospitalización relacionada con enfermedades cardiovasculares) también demostró reducciones significativas para VYNDAQEL versus placebo.
La razón de riesgo del modelo de riesgo proporcional de Cox de mortalidad por todas las causas para VYNDAQEL combinado versus placebo fue de 0.70 (intervalo de confianza del 95% [IC] 0.51, 0.96), lo que indica una reducción relativa del 30% en el riesgo de muerte en relación con el grupo placebo (p=0.026). Aproximadamente el 80% de las muertes totales fueron relacionadas con enfermedades cardiovasculares en ambos grupos de tratamiento. En la Figura 1 se presenta una gráfica de Kaplan-Meier del tiempo hasta el evento de mortalidad por todas las causas.
|
|
Figura 1: Mortalidad por todas las causas* |
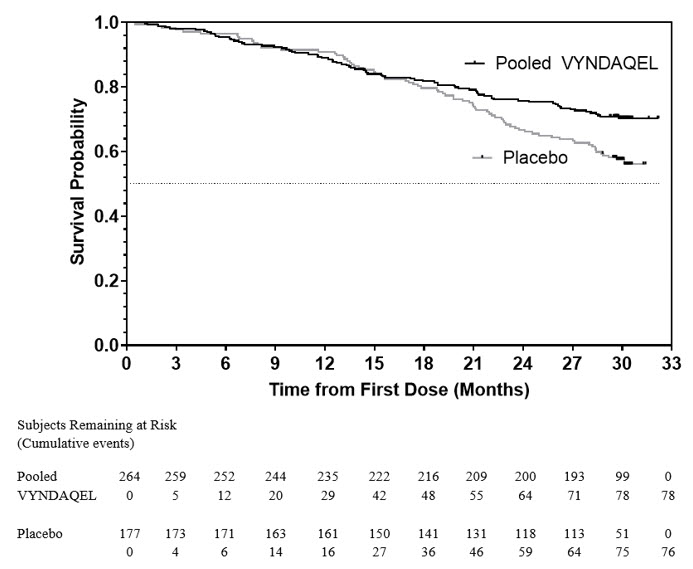 |
Se observaron significativamente menos hospitalizaciones relacionadas con enfermedades cardiovasculares con VYNDAQEL en comparación con el placebo, con una reducción del riesgo del 32%, lo que corresponde a una Razón de Riesgo Relativa de 0.68 (Tabla 3).
| VYNDAQEL agrupado N=264 |
Placebo N=177 |
|
|---|---|---|
|
||
|
Número total (%) de sujetos con hospitalizaciones relacionadas con enfermedades cardiovasculares |
138 (52.3) |
107 (60.5) |
|
Hospitalizaciones relacionadas con enfermedades cardiovasculares por año* |
0.48 |
0.70 |
|
Diferencia en el tratamiento entre VYNDAQEL agrupado y placebo (Razón de Riesgo Relativa)* |
0.68 |
|
|
Valor p* |
<0.0001 |
|
Los efectos del tratamiento de VYNDAQEL en la capacidad funcional y el estado de salud se evaluaron mediante la Prueba de Caminata de 6 Minutos (6MWT) y la puntuación del Cuestionario General de Cardiomiopatía de Kansas City (KCCQ-OS), respectivamente. Se observó un efecto de tratamiento significativo a favor de VYNDAQEL por primera vez en el mes 6 y se mantuvo constante hasta el mes 30 tanto en la distancia de la 6MWT como en la puntuación del KCCQ-OS (Figura 2 y Tabla 4).
Figura 2: Cambio desde la línea de base hasta el mes 30 en la distancia de la 6MWT y la puntuación del KCCQ-OS
Abreviaturas: 6MWT=Prueba de Caminata de 6 Minutos, KCCQ-OS=Cuestionario General de Cardiomiopatía de Kansas City.
El panel A muestra el cambio desde la línea de base hasta el mes 30 en pacientes con VYNDAQEL agrupados en comparación con pacientes con placebo en la distancia de la 6MWT.
El panel B muestra el cambio desde la línea de base hasta el mes 30 en pacientes con VYNDAQEL agrupados en comparación con pacientes con placebo en la puntuación del KCCQ-OS.
La puntuación del Cuestionario General de Cardiomiopatía de Kansas City (KCCQ-OS) se compone de cuatro dominios que incluyen Síntomas Totales (Frecuencia de Síntomas y Carga de Síntomas), Limitación Física, Calidad de Vida y Limitación Social. Las puntuaciones generales y de los dominios oscilan entre 0 y 100, siendo las puntuaciones más altas las que representan un mejor estado de salud. Los cuatro dominios favorecieron a VYNDAQEL agrupado en comparación con el placebo en el mes 30 y demostraron efectos de tratamiento similares a la puntuación del KCCQ-OS (Figura 2 y Tabla 4). La distribución del cambio desde la línea de base hasta el mes 30 para el KCCQ-OS (Figura 3) muestra que la proporción de pacientes con peores puntuaciones de KCCQ-OS fue menor para el grupo tratado con VYNDAQEL agrupado en comparación con el placebo, y la proporción con puntuaciones mejoradas fue mayor (Figura 3).
Figura 3: Histograma del cambio desde la línea de base hasta el mes 30 en la puntuación general del KCCQ
Abreviatura: KCCQ-OS = Cuestionario de Cardiomiopatía de Kansas City-Resumen general.
| Abreviaturas: 6MWT = Prueba de los 6 minutos de marcha; KCCQ-OS = Cuestionario de Cardiomiopatía de Kansas City-Resumen general; SD = desviación estándar; LS = mínimos cuadrados; SE = error estándar; IC = intervalo de confianza | |||||
|
Variables principales |
Media basal (DE) |
Cambio desde la basal hasta el mes 30, Media LS (EE) |
Diferencia de tratamiento con respecto al placebo |
||
|
VYNDAQEL agrupado |
Placebo |
VYNDAQEL agrupado |
Placebo |
||
|
6MWT |
351 |
353 |
-55 |
-131 |
76 |
|
KCCQ-OS |
67 |
66 |
-7 |
-21 |
14 |
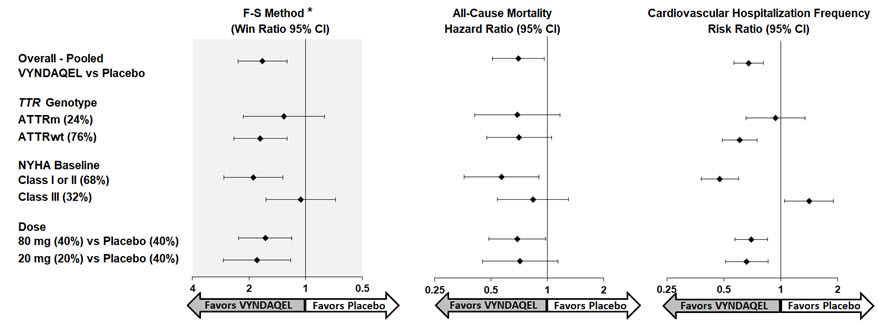
Los resultados del método F-S representados por la razón de victorias para el criterio de valoración combinado y sus componentes (mortalidad por todas las causas y frecuencia de hospitalización relacionada con las enfermedades cardiovasculares) favorecieron sistemáticamente a VYNDAQEL frente al placebo en todos los subgrupos (tipo salvaje, variante y clase I y II de la NYHA, y III), excepto para la frecuencia de hospitalización relacionada con las enfermedades cardiovasculares en la clase III de la NYHA (Figura 4). La razón de victorias es el número de pares de “victorias” de pacientes tratados con VYNDAQEL dividido por el número de pares de “victorias” de pacientes con placebo. Los análisis de 6MWT y KCCQ-OS también favorecieron a VYNDAQEL en relación con el placebo dentro de cada subgrupo.
Figura 4: Resultados por subgrupo, dosis y componentes del análisis principal
Abreviaturas: ATTRm = amiloide de transtiretina variante, ATTRwt = amiloide de transtiretina de tipo salvaje, F-S = Finkelstein Schoenfeld, IC = Intervalo de Confianza
*Resultados F-S presentados utilizando la razón de victorias (basada en la mortalidad por todas las causas y la frecuencia de hospitalización cardiovascular)
Los trasplantes de corazón y los dispositivos de asistencia mecánica cardíaca se tratan como muerte.
Los resultados del análisis principal, 6MWT al mes 30 y KCCQ-OS al mes 30 fueron estadísticamente significativos tanto para las dosis de 80 mg como de 20 mg de VYNDAQEL frente al placebo, con resultados similares para ambas dosis.
16. CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANIPULACIÓN
Las cápsulas de gelatina blanda VYNDAQEL 20 mg (tafamidis meglumina) son de color amarillo, opacas, oblongas y llevan impresa la leyenda “VYN 20” en rojo, y se suministran en las siguientes configuraciones de envase:
| Cápsulas VYNDAQEL | ||
|---|---|---|
| Configuración del envase | Concentración | NDC |
|
Caja de 4 cajas intermedias. Cada caja intermedia contiene 3 blíster. Cada blíster contiene 10 cápsulas (120 cápsulas en total). |
20 mg |
NDC 0069-1975-40 |
Las cápsulas de gelatina blanda VYNDAMAX 61 mg (tafamidis) son de color marrón rojizo, opacas, oblongas y llevan impresa la leyenda “VYN 61” en blanco, y se suministran en las siguientes configuraciones de envase:
| Cápsulas VYNDAMAX | ||
|---|---|---|
| Configuración del envase | Concentración | NDC |
|
Caja de 3 blíster. Cada blíster contiene 10 cápsulas (30 cápsulas en total). |
61 mg |
NDC 0069-8730-30 |
Conserve VYNDAQEL y VYNDAMAX a temperatura ambiente controlada de 20°C a 25°C (68°F a 77°F); se permiten excursiones a 15°C a 30°C (59°F a 86°F) [véase Temperatura ambiente controlada USP].
17. INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
Aconseje al paciente que lea el etiquetado del paciente aprobado por la FDA (Información para el paciente).
Embarazo
Notifique los embarazos a la línea de información de Pfizer al 1-800-438-1985. Informe a las mujeres embarazadas y a las mujeres en edad fértil sobre el riesgo potencial para el feto. Aconseje a las mujeres que informen a su proveedor de atención médica sobre un embarazo conocido o sospechoso [ver Uso en poblaciones específicas (8.1)].
Lactancia
Aconseje a las mujeres que no deben amamantar durante el tratamiento con VYNDAQEL o VYNDAMAX [ver Uso en poblaciones específicas (8.2)].
La etiqueta de este producto puede haber sido actualizada. Para obtener información completa de prescripción, visite www.pfizer.com.
Para obtener información médica sobre VYNDAQEL o VYNDAMAX, visite www.pfizermedinfo.com o llame al 1‑800‑438‑1985.
SECCIÓN NO CLASIFICADA DE SPL
LAB-0497-6.0
PROSPECTO PARA EL PACIENTE
|
Esta Información para el Paciente ha sido aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos. |
Emitido: 10/2023 |
|
INFORMACIÓN PARA EL PACIENTE |
|
|
VYNDAQEL® (VIN-duh-kel) |
VYNDAMAX™ (VIN-dah-max) |
|
¿Qué son VYNDAQEL y VYNDAMAX? |
|
|
Antes de tomar VYNDAQEL o VYNDAMAX, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluyendo si usted:
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados o de venta libre, las vitaminas y los suplementos a base de hierbas. |
|
|
¿Cómo debo tomar VYNDAQEL o VYNDAMAX?
|
|
|
¿Cuáles son los posibles efectos secundarios de VYNDAQEL y VYNDAMAX? |
|
|
¿Cómo debo almacenar VYNDAQEL y VYNDAMAX?
|
|
|
Información general sobre el uso seguro y eficaz de VYNDAQEL y VYNDAMAX. |
|
|
¿Cuáles son los ingredientes de VYNDAQEL y VYNDAMAX?
|
|
PANEL PRINCIPAL DE EXHIBICIÓN – Blíster de Cápsulas de 20 mg
NDC 0069-1975-12
Vyndaqel®
(tafamidis meglumine) cápsulas
20 mg por cápsula
Pfizer Labs.
LOT/EXP
DESPRENDER Y EMPUJAR
PRINCIPAL PANEL DE PRESENTACIÓN – Cartón de blíster con cápsulas de 20 mg
Vyndaqel®
(tafamidis meglumine) cápsulas
20 mg por cápsula*
Atención Farmacéutico: Vyndaqel NO es sustituible por mg
con otros productos de tafamidis.
NO PARA VENTA INDIVIDUAL
Pfizer
Contiene: Un total de 30 cápsulas por caja.
Cada caja contiene 3 blísteres. Cada
blíster contiene 10 cápsulas.
Rx solamente
PRINCIPAL PANEL DE PRESENTACIÓN – Cartón de blíster de cápsulas de 20 mg
NDC 0069-1975-40
Vyndaqel®
(tafamidis meglumine) cápsulas
20 mg por cápsula*
Atención Farmacéutico: Vyndaqel NO es sustituible por mg con otros
productos de tafamidis.
Pfizer
Contiene: Un total de 120 cápsulas por caja.
Cada caja contiene 4 cajas intermedias.
Cada caja intermedia contiene 3 blísteres
tarjetas. Cada tarjeta blíster contiene 10 cápsulas.
Rx solamente
PRINCIPAL PANEL DE PRESENTACIÓN – Cápsula de 61 mg, blíster
NDC 0069-8730-01
Vyndamax™
(tafamidis) cápsulas
61 mg por cápsula
Pfizer Labs.
LOT/EXP
PEEL & PUSH (Despegar y Presionar)
PRINCIPAL PANEL DE PRESENTACIÓN – Cartón de blíster con cápsulas de 61 mg
NDC 0069-8730-30
Vyndamax™
(tafamidis) cápsulas
61 mg por cápsula
Atención Farmacéutico: Vyndamax NO es sustituible por mg con
productos de tafamidis meglumina.
Pfizer
Contiene: Un total de 30 cápsulas por cartón.
Cada cartón contiene 3 blíster. Cada
blíster contiene 10 cápsulas.
Rx solamente