Fabricante de medicamentos: Novo Nordisk (Updated: 2024-11-01)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
Estos puntos destacados no incluyen toda la información necesaria para usar VICTOZA de manera segura y eficaz. Consulte la información de prescripción completa para VICTOZA.
VICTOZA® (liraglutide) inyección, para uso subcutáneo
Aprobación inicial en EE. UU.: 2010
ADVERTENCIA: RIESGO DE TUMORES DE CÉLULAS C DE TIROIDES
Consulte la información de prescripción completa para ver el recuadro de advertencia completo.
- •
-
Liraglutide causa tumores de células C de tiroides en exposiciones clínicamente relevantes en ambos sexos de ratas y ratones. Se desconoce si VICTOZA causa tumores de células C de tiroides, incluido el carcinoma medular de tiroides (CMT), en humanos, ya que no se ha determinado la relevancia humana de los tumores de células C de tiroides en roedores inducidos por liraglutida (5.1, 13.1).
- •
-
VICTOZA está contraindicado en pacientes con antecedentes personales o familiares de CMT o en pacientes con síndrome de neoplasia endocrina múltiple tipo 2 (MEN 2). Aconseje a los pacientes sobre el riesgo potencial de CMT y los síntomas de los tumores de tiroides (4, 5.1).
CAMBIOS RECIENTES IMPORTANTES
Advertencias y precauciones, aspiración pulmonar durante la anestesia general o la sedación profunda (5.8)…………………………………11/2024
INDICACIONES Y USO
VICTOZA es un agonista del receptor del péptido 1 similar al glucagón (GLP-1) indicado:
- •
- como complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos y pacientes pediátricos de 10 años o mayores con diabetes mellitus tipo 2 (1).
- •
- para reducir el riesgo de eventos cardiovasculares adversos mayores en adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular establecida (1).
Limitaciones de uso:
- •
- No es para el tratamiento de la diabetes mellitus tipo 1.
- •
- No debe coadministrarse con otros productos que contengan liraglutida.
DOSIFICACIÓN Y ADMINISTRACIÓN
-
-
- •
-
Pacientes adultos: Iniciar con 0.6 mg inyectados por vía subcutánea una vez al día durante una semana y luego aumentar a 1.2 mg al día. Si se requiere un control glucémico adicional, aumente la dosis a 1.8 mg al día después de una semana de tratamiento con la dosis diaria de 1.2 mg (2.1).
- •
-
Pacientes pediátricos: Iniciar con 0.6 mg inyectados por vía subcutánea una vez al día durante al menos una semana. Si se requiere un control glucémico adicional, aumente la dosis a 1.2 mg al día y si aún se requiere un control glucémico adicional, aumente la dosis a 1.8 mg al día después de al menos una semana de tratamiento con la dosis diaria de 1.2 mg (2.1).
- •
- Inspeccione visualmente antes de cada inyección. Úselo solo si la solución es transparente, incolora y no contiene partículas (2.3).
- •
- Inyecte VICTOZA por vía subcutánea una vez al día a cualquier hora del día, independientemente de las comidas, en el abdomen, el muslo o la parte superior del brazo (2.3).
- •
- Cuando use VICTOZA con insulina, adminístrelo como inyecciones separadas. Nunca mezcle. (2.3).
FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Inyección: solución de 6 mg/mL en una pluma precargada para un solo paciente que administra dosis de 0.6 mg, 1.2 mg o 1.8 mg (3).
CONTRAINDICACIONES
- •
- Pacientes con antecedentes personales o familiares de carcinoma medular de tiroides o en pacientes con síndrome de neoplasia endocrina múltiple tipo 2 (4).
- •
- Pacientes con una reacción de hipersensibilidad grave a liraglutida o a cualquiera de los excipientes de VICTOZA (4).
ADVERTENCIAS Y PRECAUCIONES
- •
-
Pancreatitis: Reportes posteriores a la comercialización, incluyendo pancreatitis hemorrágica o necrotizante fatal y no fatal. Suspenda inmediatamente si se sospecha pancreatitis. No reinicie si se confirma la pancreatitis (5.2).
- •
-
Nunca comparta una pluma de VICTOZA entre pacientes, incluso si se cambia la aguja (5.3).
- •
-
Hipoglucemia: Los pacientes adultos que toman una secretagogo de insulina o insulina pueden tener un mayor riesgo de hipoglucemia, incluyendo hipoglucemia grave. En pacientes pediátricos de 10 años de edad y mayores, el riesgo de hipoglucemia fue mayor con VICTOZA independientemente del uso de insulina y/o metformina. Puede ser necesaria la reducción de la dosis de secretagogos de insulina o insulina (5.4).
- •
-
Lesión Renal Aguda: Posterior a la comercialización, generalmente en asociación con náuseas, vómitos, diarrea o deshidratación, que a veces puede requerir hemodiálisis. Tenga precaución al iniciar o aumentar las dosis de VICTOZA en pacientes con insuficiencia renal (5.5).
- •
-
Reacciones de Hipersensibilidad: Reportes posteriores a la comercialización de reacciones de hipersensibilidad graves (p. ej., reacciones anafilácticas y angioedema). Suspenda VICTOZA y busque atención médica de inmediato (5.6).
- •
-
Enfermedad Aguda de la Vesícula Biliar: Si se sospecha colelitiasis o colecistitis, están indicados estudios de la vesícula biliar (5.7).
- •
-
Aspiración Pulmonar Durante Anestesia General o Sedación Profunda: Se ha reportado en pacientes que reciben agonistas del receptor de GLP-1 sometidos a cirugías o procedimientos electivos. Indique a los pacientes que informen a los profesionales de la salud sobre cualquier cirugía o procedimiento planificado (5.8).
REACCIONES ADVERSAS
- •
- Las reacciones adversas más comunes (incidencia ≥5%) en ensayos clínicos son náuseas, diarrea, vómitos, disminución del apetito, dispepsia, estreñimiento (6.1).
- •
- Los eventos relacionados con la inmunogenicidad, incluyendo urticaria, fueron más comunes entre los pacientes tratados con VICTOZA (0.8%) que entre los pacientes tratados con el comparador (0.4%) en ensayos clínicos (12.6).
Para reportar REACCIONES ADVERSAS SOSPECHOSAS, contacte a Novo Nordisk Inc. al 1-877-484-2869 o a la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES CON MEDICAMENTOS
- •
-
Efectos del retraso del vaciamiento gástrico en los medicamentos orales: VICTOZA retrasa el vaciamiento gástrico y puede afectar la absorción de medicamentos orales administrados concomitantemente (7).
USO EN POBLACIONES ESPECÍFICAS
- •
- Embarazo: VICTOZA debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto (8.1).
Consulte 17 para obtener INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y la Guía del Medicamento.
Revisado: 11/2024
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
ADVERTENCIA EN EL RECUADRO
ADVERTENCIA: RIESGO DE TUMORES DE CÉLULAS C TIROIDEAS
- •
-
La liraglutida causa tumores de células C tiroideas dependientes de la dosis y de la duración del tratamiento a exposiciones clínicamente relevantes en ambos sexos de ratas y ratones. Se desconoce si VICTOZA causa tumores de células C tiroideas, incluido el carcinoma medular de tiroides (CMT), en humanos, ya que no se ha determinado la relevancia para los humanos de los tumores de células C tiroideas en roedores inducidos por liraglutida [ver Advertencias y precauciones (5.1) y Toxicología no clínica (13.1)].
- •
-
VICTOZA está contraindicado en pacientes con antecedentes personales o familiares de CMT y en pacientes con síndrome de neoplasia endocrina múltiple tipo 2 (MEN 2). Aconseje a los pacientes sobre el riesgo potencial de CMT con el uso de VICTOZA e infórmeles sobre los síntomas de los tumores tiroideos (por ejemplo, una masa en el cuello, disfagia, disnea, ronquera persistente). El control rutinario de la calcitonina sérica o el uso de la ecografía tiroidea tienen un valor incierto para la detección temprana de CMT en pacientes tratados con VICTOZA [ver Contraindicaciones (4) y Advertencias y precauciones (5.1)].
1 INDICACIONES Y USO
VICTOZA está indicado:
- •
- como complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos y pacientes pediátricos de 10 años o más con diabetes mellitus tipo 2,
- •
- para reducir el riesgo de eventos cardiovasculares adversos mayores (muerte cardiovascular, infarto de miocardio no mortal o accidente cerebrovascular no mortal) en adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular establecida.
Limitaciones de uso:
VICTOZA no debe utilizarse en pacientes con diabetes mellitus tipo 1.
VICTOZA contiene liraglutida y no debe administrarse conjuntamente con otros productos que contengan liraglutida.
2 DOSIS Y ADMINISTRACIÓN
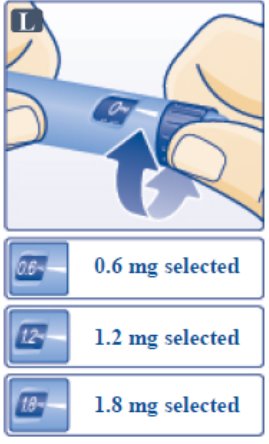
2.1 Dosis Recomendada
Pacientes Adultos
- •
- La dosis inicial recomendada de VICTOZA es de 0.6 mg inyectada por vía subcutánea una vez al día durante una semana. La dosis de 0.6 mg una vez al día está destinada a reducir los síntomas gastrointestinales [ver Reacciones Adversas (6.1)] durante el ajuste inicial de la dosis y no es eficaz para el control glucémico en adultos.
- •
- Después de una semana con la dosis de 0.6 mg una vez al día, aumente la dosis a 1.2 mg inyectada por vía subcutánea una vez al día.
- •
- Si se requiere un control glucémico adicional, aumente la dosis a la dosis máxima recomendada de 1.8 mg inyectada por vía subcutánea una vez al día después de al menos una semana de tratamiento con la dosis de 1.2 mg una vez al día.
Pacientes Pediátricos de 10 Años o Más
- •
- La dosis inicial recomendada de VICTOZA es de 0.6 mg inyectada por vía subcutánea una vez al día.
- •
- Si se requiere un control glucémico adicional, aumente la dosis en incrementos de 0.6 mg después de al menos una semana con la dosis actual.
- •
- La dosis máxima recomendada es de 1.8 mg inyectada por vía subcutánea una vez al día.
2.2 Recomendaciones Sobre la Dosis Olvidada
- •
- Indique a los pacientes que olviden una dosis de VICTOZA que reanuden el régimen de dosificación una vez al día según lo prescrito con la siguiente dosis programada. No administre una dosis extra ni aumente la dosis para compensar la dosis olvidada.
- •
- Si han transcurrido más de 3 días desde la última dosis de VICTOZA, reinicie VICTOZA a 0.6 mg una vez al día para mitigar cualquier síntoma gastrointestinal asociado con el reinicio del tratamiento. Tras el reinicio, VICTOZA debe ajustarse a criterio del profesional de la salud.
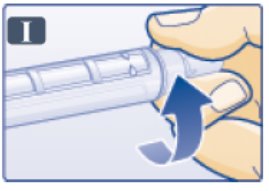
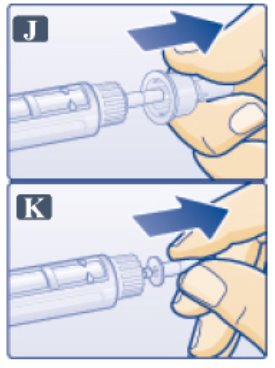
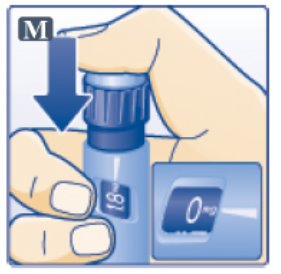
2.3 Instrucciones Importantes de Administración
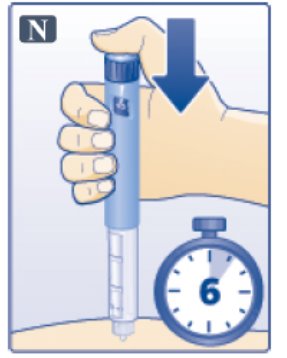
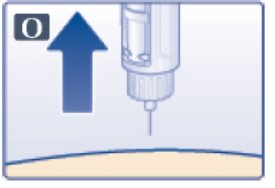
- •
- Inspeccione visualmente antes de cada inyección. Úselo solo si la solución es transparente, incolora y no contiene partículas.
- •
- Inyecte VICTOZA por vía subcutánea una vez al día a cualquier hora del día, independientemente de las comidas.
- •
- Inyecte VICTOZA por vía subcutánea en el abdomen, el muslo o la parte superior del brazo. No es necesario ajustar la dosis si se cambia el lugar y/o el horario de la inyección.
- •
- Rote los sitios de inyección dentro de la misma región para reducir el riesgo de amiloidosis cutánea [ver Reacciones Adversas (6.2)].
- •
- Cuando use VICTOZA con insulina, adminístrelos como inyecciones separadas. Nunca los mezcle. Es aceptable inyectar VICTOZA e insulina en la misma región del cuerpo, pero las inyecciones no deben estar adyacentes entre sí.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Inyección: 18 mg/3 mL (6 mg/mL) solución transparente e incolora en un bolígrafo prellenado de un solo uso para pacientes que administra dosis de 0.6 mg, 1.2 mg o 1.8 mg.
4 CONTRAINDICACIONES
VICTOZA está contraindicado en pacientes con:
- •
- antecedentes personales o familiares de carcinoma medular de tiroides (CMT) o en pacientes con síndrome de neoplasia endocrina múltiple tipo 2 (NEM 2) [ver Advertencias y precauciones (5.1)].
- •
- reacción de hipersensibilidad grave a liraglutida o a cualquiera de los excipientes de VICTOZA. Se han notificado reacciones de hipersensibilidad graves, incluyendo reacciones anafilácticas y angioedema, con VICTOZA [ver Advertencias y precauciones (5.6)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Riesgo de tumores de células C tiroideas
La liraglutida causa tumores de células C tiroideas (adenomas y/o carcinomas) dependientes de la dosis y de la duración del tratamiento a exposiciones clínicamente relevantes en ambos sexos de ratas y ratones [véase Toxicología no clínica (13.1)]. Se detectaron carcinomas malignos de células C tiroideas en ratas y ratones. Se desconoce si VICTOZA causará tumores de células C tiroideas, incluido el carcinoma medular de tiroides (CMT), en humanos, ya que no se ha determinado la relevancia para los humanos de los tumores de células C tiroideas en roedores inducidos por liraglutida.
Se han notificado casos de CMT en pacientes tratados con VICTOZA en el periodo postcomercialización; los datos de estos informes son insuficientes para establecer o excluir una relación causal entre el CMT y el uso de VICTOZA en humanos.
VICTOZA está contraindicado en pacientes con antecedentes personales o familiares de CMT o en pacientes con NEM 2. Aconseje a los pacientes sobre el riesgo potencial de CMT con el uso de VICTOZA e infórmeles de los síntomas de los tumores tiroideos (p. ej., una masa en el cuello, disfagia, disnea, ronquera persistente).
La monitorización rutinaria de la calcitonina sérica o el uso de la ecografía tiroidea tienen un valor incierto para la detección precoz del CMT en pacientes tratados con VICTOZA. Dicha monitorización puede aumentar el riesgo de procedimientos innecesarios, debido a la baja especificidad de la prueba para la calcitonina sérica y a una alta incidencia de fondo de enfermedad tiroidea. Una concentración significativamente elevada de calcitonina sérica puede indicar CMT y los pacientes con CMT suelen tener valores de calcitonina >50 ng/L. Si se mide la calcitonina sérica y se observa que está elevada, se debe evaluar más a fondo al paciente. Los pacientes con nódulos tiroideos observados en la exploración física o en las imágenes del cuello también deben ser evaluados más a fondo.
5.2 Pancreatitis
Según los informes espontáneos postcomercialización, se ha observado pancreatitis aguda, incluida la pancreatitis hemorrágica o necrosante mortal y no mortal, en pacientes tratados con VICTOZA. Después de iniciar el tratamiento con VICTOZA, observe cuidadosamente a los pacientes para detectar signos y síntomas de pancreatitis (incluido dolor abdominal intenso persistente, a veces irradiado a la espalda y que puede o no ir acompañado de vómitos). Si se sospecha pancreatitis, se debe interrumpir inmediatamente el tratamiento con VICTOZA e iniciar el tratamiento adecuado. Si se confirma la pancreatitis, no se debe reiniciar el tratamiento con VICTOZA.
En los ensayos de control glucémico de VICTOZA, ha habido 13 casos de pancreatitis entre los pacientes tratados con VICTOZA y 1 caso en un paciente tratado con un comparador (glimepirida) (2,7 frente a 0,5 casos por 1000 pacientes-año). Nueve de los 13 casos con VICTOZA se notificaron como pancreatitis aguda y cuatro como pancreatitis crónica. En un caso en un paciente tratado con VICTOZA, se observó pancreatitis con necrosis y provocó la muerte; sin embargo, no se pudo establecer la causalidad clínica. Algunos pacientes tenían otros factores de riesgo de pancreatitis, como antecedentes de colelitiasis o abuso de alcohol.
VICTOZA se ha estudiado en un número limitado de pacientes con antecedentes de pancreatitis. Se desconoce si los pacientes con antecedentes de pancreatitis tienen un mayor riesgo de desarrollar pancreatitis con VICTOZA.
5.3 Nunca comparta un bolígrafo VICTOZA entre pacientes
Los bolígrafos VICTOZA nunca deben compartirse entre pacientes, incluso si se cambia la aguja. Compartir el bolígrafo supone un riesgo de transmisión de patógenos transmitidos por la sangre.
5.4 Hipoglucemia
Los pacientes adultos que reciben VICTOZA en combinación con un secretagogo de insulina (p. ej., sulfonilurea) o insulina pueden tener un mayor riesgo de hipoglucemia, incluida la hipoglucemia grave. En pacientes pediátricos de 10 años o más, el riesgo de hipoglucemia fue mayor con VICTOZA independientemente del uso de insulina y/o metformina. [véase Reacciones adversas (6.1), Interacciones medicamentosas (7.2)].
El riesgo de hipoglucemia puede reducirse mediante una reducción de la dosis de sulfonilurea (u otros secretagogos de insulina administrados concomitantemente) o insulina. Informe a los pacientes que utilizan estos medicamentos concomitantes y a los pacientes pediátricos del riesgo de hipoglucemia y edúquelos sobre los signos y síntomas de la hipoglucemia.
5.5 Lesión renal aguda
No se ha encontrado que VICTOZA sea directamente nefrotóxico en estudios animales o ensayos clínicos.
Ha habido informes postcomercialización de insuficiencia renal aguda y empeoramiento de la insuficiencia renal crónica, que a veces pueden requerir hemodiálisis en pacientes tratados con VICTOZA [véase Reacciones adversas (6.2)]. Algunos de estos eventos se notificaron en pacientes sin enfermedad renal subyacente conocida. La mayoría de los eventos notificados ocurrieron en pacientes que habían experimentado náuseas, vómitos, diarrea o deshidratación [véase Reacciones adversas (6.1)]. Algunos de los eventos notificados ocurrieron en pacientes que recibían uno o más medicamentos que se sabe que afectan la función renal o el estado de hidratación. La alteración de la función renal se ha revertido en muchos de los casos notificados con tratamiento de apoyo y la interrupción de los agentes potencialmente causantes, incluido VICTOZA. Tenga precaución al iniciar o aumentar las dosis de VICTOZA en pacientes con insuficiencia renal [véase Uso en poblaciones específicas (8.6)].
5.6 Reacciones de hipersensibilidad
Se han notificado reacciones de hipersensibilidad graves (p. ej., reacciones anafilácticas y angioedema) después de la comercialización en pacientes tratados con VICTOZA [véase Reacciones adversas (6.2)]. Si se produce una reacción de hipersensibilidad, interrumpa el tratamiento con VICTOZA; trátela rápidamente según los estándares de atención y realice un seguimiento hasta que desaparezcan los signos y síntomas.
Se han notificado anafilaxia y angioedema con otros agonistas del receptor GLP-1. Use precaución en pacientes con antecedentes de anafilaxia o angioedema con otro agonista del receptor GLP, ya que se desconoce si estos pacientes estarán predispuestos a estas reacciones con VICTOZA. VICTOZA está contraindicado en pacientes que han tenido una reacción de hipersensibilidad grave a la liraglutida o a cualquiera de los excipientes de VICTOZA [véase Contraindicaciones (4)].
5.7 Enfermedad aguda de la vesícula biliar
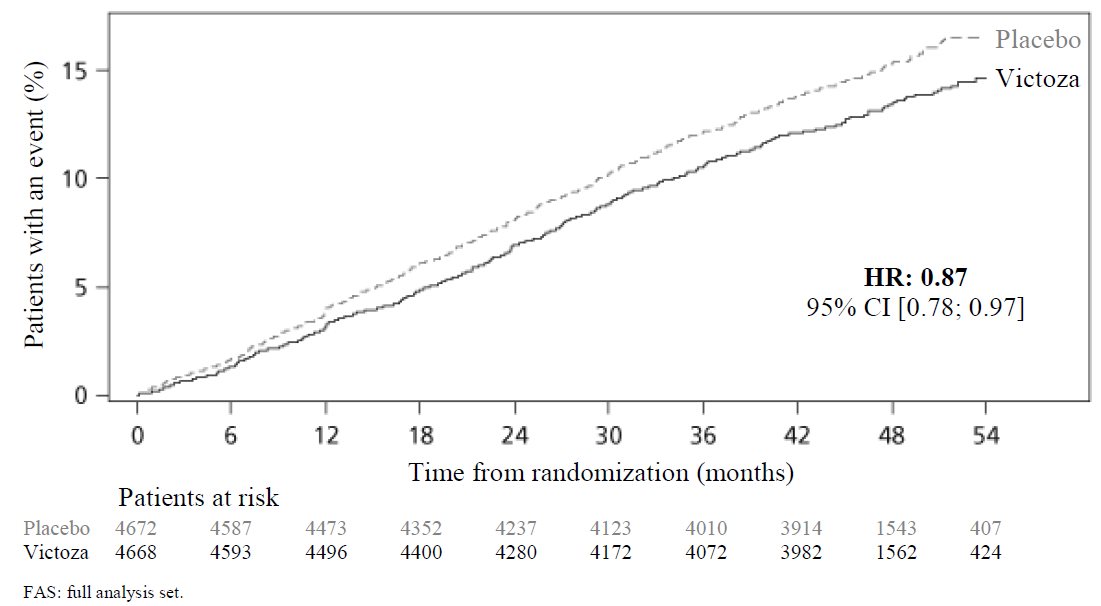
Se han notificado eventos agudos de enfermedad de la vesícula biliar, como colelitiasis o colecistitis, en ensayos con agonistas del receptor GLP-1 y después de la comercialización. En el ensayo LEADER [véase Estudios clínicos (14.3)], el 3,1 % de los pacientes tratados con VICTOZA frente al 1,9 % de los pacientes tratados con placebo notificaron un evento agudo de enfermedad de la vesícula biliar, como colelitiasis o colecistitis
[véase Reacciones adversas (6.1)]. Si se sospecha colelitiasis, están indicados los estudios de la vesícula biliar y el seguimiento clínico adecuado.
5.8 Aspiración pulmonar durante anestesia general o sedación profunda
VICTOZA retrasa el vaciado gástrico [véase Farmacología clínica (12.2)]. Se han notificado casos raros de aspiración pulmonar después de la comercialización en pacientes que recibían agonistas del receptor GLP-1 sometidos a cirugías o procedimientos electivos que requerían anestesia general o sedación profunda y que tenían contenido gástrico residual a pesar del cumplimiento de las recomendaciones de ayuno preoperatorio.
Los datos disponibles son insuficientes para establecer recomendaciones para mitigar el riesgo de aspiración pulmonar durante la anestesia general o la sedación profunda en pacientes que toman VICTOZA, incluyendo si la modificación de las recomendaciones de ayuno preoperatorio o la interrupción temporal de VICTOZA podrían reducir la incidencia de contenido gástrico retenido. Indique a los pacientes que informen a los profesionales sanitarios antes de cualquier cirugía o procedimiento planificado si están tomando VICTOZA.
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas graves se describen a continuación o en otras secciones de la información de prescripción:
- •
- Riesgo de tumores de células C de tiroides [ver Advertencias y precauciones (5.1)]
- •
- Pancreatitis [ver Advertencias y precauciones (5.2)]
- •
- Hipoglucemia [ver Advertencias y precauciones (5.4)]
- •
- Lesión renal aguda [ver Advertencias y precauciones (5.5)]
- •
- Reacciones de hipersensibilidad [ver Advertencias y precauciones (5.6)]
- •
- Enfermedad aguda de la vesícula biliar [ver Advertencias y precauciones (5.7)]
- •
- Aspiración pulmonar durante la anestesia general o sedación profunda [ver Advertencias y precauciones (5.8)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan bajo condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no pueden compararse directamente con las tasas en los ensayos clínicos de otro medicamento y es posible que no reflejen las tasas observadas en la práctica.
Reacciones adversas comunes
La seguridad de VICTOZA en pacientes con diabetes mellitus tipo 2 se evaluó en 5 ensayos controlados con placebo sobre el control glucémico en adultos y un ensayo de 52 semanas de duración en pacientes pediátricos de 10 años de edad y mayores [ver Estudios clínicos (14.1)]. Los datos de la Tabla 1 reflejan la exposición de 1673 pacientes adultos a VICTOZA y una duración media de exposición a VICTOZA de 37,3 semanas. La edad media de los pacientes adultos fue de 58 años, el 4% tenía 75 años o más y el 54% eran hombres. La población era 79% blanca, 6% negra o afroamericana, 13% asiática; el 4% era de origen hispano o latino. Al inicio del estudio, la población tenía diabetes durante un promedio de 9 años y una HbA1c media de 8,4%. La función renal estimada al inicio del estudio era normal o levemente alterada en el 88% y moderadamente alterada en el 12% de la población combinada.
La Tabla 1 muestra las reacciones adversas comunes en adultos, excluyendo la hipoglucemia, asociadas con el uso de VICTOZA para el tratamiento de la diabetes mellitus tipo 2. Estas reacciones adversas ocurrieron con mayor frecuencia con VICTOZA que con placebo y ocurrieron en al menos el 5% de los pacientes tratados con VICTOZA. En general, el tipo y la gravedad de las reacciones adversas en pacientes pediátricos de 10 años de edad y mayores fueron comparables a los observados en la población adulta.
Tabla 1 Reacciones adversas notificadas en ≥ 5% de los pacientes adultos tratados con VICTOZA para la diabetes mellitus tipo 2
Se calcularon las proporciones acumuladas combinando estudios utilizando pesos de Cochran-Mantel-Haenszel.
En un análisis de ensayos controlados con placebo y activo, los tipos y la frecuencia de reacciones adversas comunes, excluyendo la hipoglucemia, fueron similares a las listadas en la Tabla 1.
Otras reacciones adversas
Reacciones adversas gastrointestinales
En el grupo de 5 ensayos clínicos en adultos controlados con placebo para el control glucémico, las retiradas debido a reacciones adversas gastrointestinales se produjeron en el 4,3% de los pacientes tratados con VICTOZA y en el 0,5% de los pacientes tratados con placebo. Las retiradas debido a eventos adversos gastrointestinales se produjeron principalmente durante los primeros 2-3 meses de los ensayos.
Reacciones en el lugar de la inyección
Se notificaron reacciones en el lugar de la inyección (por ejemplo, erupción en el lugar de la inyección, eritema) en aproximadamente el 2% de los pacientes adultos tratados con VICTOZA en los cinco ensayos clínicos de control glucémico, doble ciego, con una duración de al menos 26 semanas. Menos del 0,2% de los pacientes tratados con VICTOZA suspendieron el tratamiento debido a reacciones en el lugar de la inyección.
Hipoglucemia
En 5 ensayos clínicos en adultos para el control glucémico, controlados con placebo y con una duración de al menos 26 semanas, la hipoglucemia que requirió la ayuda de otra persona para el tratamiento se produjo en 8 pacientes tratados con VICTOZA (7,5 eventos por 1000 pacientes-año). De estos 8 pacientes tratados con VICTOZA, 7 pacientes estaban usando concomitantemente una sulfonilurea.
|
Paciente incapaz de automedicarse
|
-
- 0
|
-
- 2.2 (0.06)
|
|
Paciente capaz de automedicarse
|
-
- 16.7 (0.95)
|
-
- 27.4 (1.16)
|
|
No clasificado
|
-
- 0
|
-
- 0
|
“Paciente que no puede autotratarse” se define como un evento que requiere la asistencia de otra persona para el tratamiento.
En un ensayo clínico controlado con placebo de 26 semanas en pacientes pediátricos de 10 años de edad y mayores con una extensión abierta de 26 semanas, el 21.2% de los pacientes tratados con VICTOZA (edad media de 14.6 años) con diabetes mellitus tipo 2, tuvieron hipoglucemia con una glucosa en sangre <54 mg/dL con o sin síntomas (335 eventos por 1000 pacientes-año). No se produjeron episodios de hipoglucemia grave en el grupo de tratamiento con VICTOZA (la hipoglucemia grave se definió como un episodio que requería la asistencia de otra persona para administrar activamente carbohidratos, glucagón u otras acciones de reanimación).
Carcinoma papilar de tiroides
En ensayos de control glucémico en adultos de VICTOZA, hubo 7 casos reportados de carcinoma papilar de tiroides en pacientes tratados con VICTOZA y 1 caso en un paciente tratado con un comparador (1.5 vs. 0.5 casos por 1000 pacientes-año). La mayoría de estos carcinomas papilares de tiroides tenían <1 cm en su diámetro mayor y se diagnosticaron en muestras de patología quirúrgica después de la tiroidectomía impulsada por los hallazgos en la detección especificada por el protocolo con calcitonina sérica o ultrasonido de tiroides.
Colelitiasis y colecistitis
En los ensayos de control glucémico en adultos de VICTOZA, la incidencia de colelitiasis fue del 0.3% tanto en pacientes tratados con VICTOZA como en pacientes tratados con placebo. La incidencia de colecistitis fue del 0.2% tanto en pacientes tratados con VICTOZA como en pacientes tratados con placebo.
En el ensayo LEADER [ver Estudios Clínicos (14.3)], la incidencia de colelitiasis fue del 1.5% (3.9 casos por 1000 pacientes-año de observación) en adultos tratados con VICTOZA y del 1.1% (2.8 casos por 1000 pacientes-año de observación) en pacientes tratados con placebo, ambos con un tratamiento estándar de atención. La incidencia de colecistitis aguda fue del 1.1% (2.9 casos por 1000 pacientes-año de observación) en adultos tratados con VICTOZA y del 0.7% (1.9 casos por 1000 pacientes-año de observación) en pacientes tratados con placebo. La mayoría de los eventos requirieron hospitalización o colecistectomía.
Pruebas de laboratorio
Bilirrubina
En los cinco ensayos de control glucémico en adultos de al menos 26 semanas de duración, se produjeron concentraciones séricas de bilirrubina ligeramente elevadas (elevaciones de no más del doble del límite superior del rango de referencia) en el 4.0% de los pacientes tratados con VICTOZA, el 2.1% de los pacientes tratados con placebo y el 3.5% de los pacientes tratados con un comparador activo. Este hallazgo no estuvo acompañado de anomalías en otras pruebas hepáticas. Se desconoce la importancia de este hallazgo aislado.
Calcitonina
La calcitonina, un marcador biológico del CMT, se midió a lo largo del programa de desarrollo clínico. Al final de los ensayos de control glucémico en adultos, las concentraciones séricas medias ajustadas de calcitonina fueron mayores en los pacientes tratados con VICTOZA en comparación con los pacientes tratados con placebo, pero no en comparación con los pacientes que recibieron un comparador activo. Las diferencias entre los grupos en los valores medios ajustados de calcitonina sérica fueron de aproximadamente 0.1 ng/L o menos. Entre los pacientes adultos con calcitonina pretratamiento <20 ng/L, se produjeron elevaciones de calcitonina a >20 ng/L en el 0.7% de los pacientes tratados con VICTOZA, el 0.3% de los pacientes tratados con placebo y el 0.5% de los pacientes tratados con un comparador activo. Se desconoce la importancia clínica de estos hallazgos.
Lipasa y amilasa
En un ensayo de control glucémico en adultos en pacientes con insuficiencia renal, se observó un aumento medio del 33% para la lipasa y del 15% para la amilasa desde el inicio para los pacientes tratados con VICTOZA, mientras que los pacientes tratados con placebo tuvieron una disminución media de la lipasa del 3% y un aumento medio de la amilasa del 1%.
En el ensayo LEADER, la lipasa y la amilasa séricas se midieron de forma rutinaria. Entre los pacientes adultos tratados con VICTOZA, el 7.9% tuvo un valor de lipasa en algún momento durante el tratamiento mayor o igual a 3 veces el límite superior de lo normal en comparación con el 4.5% de los pacientes tratados con placebo, y el 1% de los pacientes tratados con VICTOZA tuvo un valor de amilasa en algún momento durante el tratamiento mayor o igual a 3 veces el límite superior de lo normal en comparación con el 0.7% de los pacientes tratados con placebo.
Se desconoce la importancia clínica de las elevaciones de lipasa o amilasa con VICTOZA en ausencia de otros signos y síntomas de pancreatitis [ver Advertencias y precauciones (5.2)].
Signos vitales
VICTOZA no tuvo efectos adversos sobre la presión arterial. Se han observado aumentos medios desde el inicio en la frecuencia cardíaca de 2 a 3 latidos por minuto en pacientes adultos tratados con VICTOZA en comparación con placebo.
6.2 Experiencia posterior a la comercialización
Las siguientes reacciones adversas adicionales se han notificado durante el uso posterior a la aprobación de VICTOZA. Debido a que estos eventos se notifican voluntariamente a partir de una población de tamaño incierto, generalmente no es posible estimar de forma fiable su frecuencia o establecer una relación causal con la exposición al fármaco.
- •
-
Gastrointestinales: Pancreatitis aguda, pancreatitis hemorrágica y necrotizante que a veces provoca la muerte, íleo
- •
-
Trastornos generales y alteraciones en el lugar de administración: Reacciones alérgicas: erupción cutánea y prurito
- •
-
Hepatobiliares: Elevaciones de las enzimas hepáticas, hiperbilirrubinemia, colestasis, colecistitis, colelitiasis que requiere colecistectomía, hepatitis
- •
-
Sistema inmunitario: Angioedema y reacciones anafilácticas
- •
-
Metabolismo y nutrición: Deshidratación resultante de náuseas, vómitos y diarrea
- •
-
Neoplasias: Carcinoma medular de tiroides
- •
-
Sistema nervioso: Disgeusia, mareos
- •
-
Pulmonares: Se ha producido aspiración pulmonar en pacientes que reciben agonistas del receptor de GLP-1 sometidos a cirugías o procedimientos electivos que requieren anestesia general o sedación profunda.
- •
-
Renales y urinarias: Aumento de la creatinina sérica, insuficiencia renal aguda o empeoramiento de la insuficiencia renal crónica, que a veces requiere hemodiálisis.
- •
-
Piel y tejido subcutáneo: Amiloidosis cutánea
7 INTERACCIONES MEDICAMENTOSAS
7.1 Efectos del Retraso en el Vaciado Gástrico sobre los Medicamentos Orales
VICTOZA causa un retraso en el vaciado gástrico y, por lo tanto, tiene el potencial de afectar la absorción de los medicamentos orales administrados concomitantemente. En los ensayos de farmacología clínica, VICTOZA no afectó la absorción de los medicamentos administrados por vía oral a ningún grado clínicamente relevante [ver Farmacología Clínica (12.3)]. No obstante, se debe tener precaución cuando se administran medicamentos orales concomitantemente con VICTOZA.
7.2 Uso Concomitante con un Secretagogo de Insulina (p. ej., Sulfonilurea) o con Insulina
VICTOZA estimula la liberación de insulina en presencia de concentraciones elevadas de glucosa en sangre. Los pacientes que reciben VICTOZA en combinación con un secretagogo de insulina (p. ej., sulfonilurea) o insulina pueden tener un mayor riesgo de hipoglucemia, incluida la hipoglucemia grave. Al iniciar VICTOZA, considere reducir la dosis de secretagogos de insulina administrados concomitantemente (como las sulfonilureas) o insulina para reducir el riesgo de hipoglucemia [ver Advertencias y Precauciones (5.4) y Reacciones Adversas (6.1)].
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgo
Basándose en estudios de reproducción animal, puede haber riesgos para el feto por la exposición a VICTOZA durante el embarazo. VICTOZA debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
Los estudios de reproducción animal identificaron un aumento en los resultados adversos del desarrollo por la exposición durante el embarazo. La exposición a liraglutida se asoció con muertes embrionarias tempranas y un desequilibrio en algunas anomalías fetales en ratas embarazadas a las que se administró liraglutida durante la organogénesis en dosis que se aproximan a las exposiciones clínicas a la dosis máxima recomendada en humanos (MRHD) de 1.8 mg/día. En conejas embarazadas a las que se administró liraglutida durante la organogénesis, se observó una disminución del peso fetal y un aumento en la incidencia de anomalías fetales mayores a exposiciones inferiores a las exposiciones humanas a la MRHD [ver Datos en Animales].
El riesgo de base estimado de defectos congénitos importantes para las mujeres con diabetes pregestacional no controlada (Hemoglobina A1C >7) es del 6 al 10%. Se ha informado que la tasa de defectos congénitos importantes es tan alta como del 20 al 25% en mujeres con una Hemoglobina A1C >10. En la población general de EE. UU., el riesgo de base estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2-4% y del 15-20%, respectivamente.
Consideraciones Clínicas
Riesgo materno y/o embrionario/fetal asociado a la enfermedad
El control deficiente de la diabetes durante el embarazo aumenta el riesgo materno de cetoacidosis diabética, preeclampsia, abortos espontáneos, parto prematuro y complicaciones del parto. El control deficiente de la diabetes aumenta el riesgo fetal de defectos congénitos importantes, muerte fetal y morbilidad relacionada con la macrosomía.
Datos en Animales
Las ratas hembra a las que se administraron dosis subcutáneas de 0,1, 0,25 y 1,0 mg/kg/día de liraglutida a partir de 2 semanas antes del apareamiento hasta el día 17 de gestación tuvieron exposiciones sistémicas estimadas 0,8, 3 y 11 veces la exposición humana a la MRHD según la comparación del AUC plasmático. El número de muertes embrionarias tempranas en el grupo de 1 mg/kg/día aumentó ligeramente. Se produjeron anomalías y variaciones fetales en los riñones y los vasos sanguíneos, osificación irregular del cráneo y un estado de osificación más completo en todas las dosis. El hígado moteado y las costillas mínimamente torcidas se produjeron a la dosis más alta. La incidencia de malformaciones fetales en los grupos tratados con liraglutida que superaron los controles concurrentes e históricos fueron orofaringe deformada y/o abertura estrecha en la laringe a 0,1 mg/kg/día y hernia umbilical a 0,1 y 0,25 mg/kg/día.
Las conejas preñadas a las que se administraron dosis subcutáneas de 0,01, 0,025 y 0,05 mg/kg/día de liraglutida desde el día 6 hasta el día 18 de gestación inclusive, tuvieron exposiciones sistémicas estimadas inferiores a la exposición humana a la MRHD de 1,8 mg/día en todas las dosis, según el AUC plasmático. La liraglutida disminuyó el peso fetal y aumentó de forma dosis-dependiente la incidencia de anomalías fetales mayores totales en todas las dosis. La incidencia de malformaciones superó los controles concurrentes e históricos a 0,01 mg/kg/día (riñones, escápula), ≥ 0,01 mg/kg/día (ojos, extremidad anterior), 0,025 mg/kg/día (cerebro, cola y vértebras sacras, vasos sanguíneos principales y corazón, ombligo), ≥ 0,025 mg/kg/día (esternón) y a 0,05 mg/kg/día (huesos parietales, vasos sanguíneos principales). Se produjeron osificación irregular y/o anomalías esqueléticas en el cráneo y la mandíbula, vértebras y costillas, esternón, pelvis, cola y escápula; y se observaron variaciones esqueléticas menores dependientes de la dosis. Se produjeron anomalías viscerales en los vasos sanguíneos, pulmones, hígado y esófago. Se observó vesícula biliar bilobulada o bifurcada en todos los grupos de tratamiento, pero no en el grupo control.
En ratas hembra preñadas a las que se administraron dosis subcutáneas de 0,1, 0,25 y 1,0 mg/kg/día de liraglutida desde el día 6 de gestación hasta el destete o la interrupción de la lactancia en el día 24 de lactancia, las exposiciones sistémicas estimadas fueron 0,8, 3 y 11 veces la exposición humana a la MRHD de 1,8 mg/día, según el AUC plasmático. Se observó un ligero retraso en el parto en la mayoría de las ratas tratadas. El peso corporal medio del grupo de las ratas neonatales de las madres tratadas con liraglutida fue inferior al de las ratas neonatales de las madres del grupo control. Se produjeron costras sangrantes y comportamiento agitado en las ratas macho descendientes de madres tratadas con 1 mg/kg/día de liraglutida. El peso corporal medio del grupo desde el nacimiento hasta el día 14 posparto tendió a ser menor en las ratas de la generación F2 descendientes de ratas tratadas con liraglutida en comparación con las ratas de la generación F2 descendientes de los controles, pero las diferencias no alcanzaron significación estadística para ningún grupo.
8.2 Lactancia
Resumen de Riesgo
No hay datos sobre la presencia de VICTOZA en la leche materna, los efectos en el lactante o los efectos sobre la producción de leche. La liraglutida estuvo presente en la leche de ratas lactantes [ver Datos].
Deben considerarse los beneficios para el desarrollo y la salud de la lactancia materna junto con la necesidad clínica de la madre de VICTOZA y cualquier posible efecto adverso en el lactante por VICTOZA o por la enfermedad materna subyacente.
Datos
En ratas lactantes, la liraglutida estuvo presente sin cambios en la leche a concentraciones aproximadamente del 50% de las concentraciones plasmáticas maternas.
8.4 Uso Pediátrico
Se ha establecido la seguridad y eficacia de VICTOZA como complemento de la dieta y el ejercicio para mejorar el control glucémico en la diabetes mellitus tipo 2 en pacientes pediátricos de 10 años de edad y mayores. El uso de VICTOZA para esta indicación está respaldado por un ensayo clínico controlado con placebo de 26 semanas y una extensión abierta de 26 semanas en 134 pacientes pediátricos de 10 a 17 años de edad con diabetes mellitus tipo 2, un estudio farmacocinético pediátrico y estudios en adultos con diabetes mellitus tipo 2 [ver Farmacología Clínica (12.3) y Estudios Clínicos (14.1,14.2)]. El riesgo de hipoglucemia fue mayor con VICTOZA en pacientes pediátricos, independientemente del uso de insulina y/o metformina [ver Reacciones Adversas (6.1)].
No se ha establecido la seguridad y eficacia de VICTOZA en pacientes pediátricos menores de 10 años.
8.5 Uso Geriátrico
En los grupos de tratamiento con VICTOZA de los ensayos de control glucémico, un total de 832 (19.3%) de los pacientes tenían entre 65 y 74 años de edad y 145 (3.4%) tenían 75 años de edad o más [ver Estudios Clínicos (14.1)]. En el grupo de tratamiento con VICTOZA del ensayo LEADER [ver Estudios Clínicos (14.3)], un total de 1738 (37.2%) pacientes tenían entre 65 y 74 años, 401 (8.6%) tenían entre 75 y 84 años y 17 (0.4%) tenían 85 años o más al inicio del estudio.
No se han observado diferencias generales en la seguridad o eficacia de VICTOZA entre pacientes de 65 años o mayores y pacientes más jóvenes.
8.6 Insuficiencia Renal
No se recomienda ajustar la dosis de VICTOZA en pacientes con insuficiencia renal [ver Farmacología Clínica (12.3)]. La seguridad y eficacia de VICTOZA se evaluó en un estudio clínico de 26 semanas que incluyó pacientes con insuficiencia renal moderada (TFGe de 30 a 60 ml/min/1.73 m2) [ver Estudios Clínicos (14.1)].
En el grupo de tratamiento con VICTOZA del ensayo LEADER [ver Estudios Clínicos (14.3)], 1932 (41.4%) pacientes tenían insuficiencia renal leve, 999 (21.4%) pacientes tenían insuficiencia renal moderada y 117 (2.5%) pacientes tenían insuficiencia renal grave al inicio del estudio. No se observaron diferencias generales en la seguridad o eficacia en estos pacientes en comparación con los pacientes con función renal normal.
Existe experiencia limitada con VICTOZA en pacientes con enfermedad renal en etapa terminal. Ha habido informes posteriores a la comercialización de insuficiencia renal aguda y empeoramiento de la insuficiencia renal crónica, que a veces puede requerir hemodiálisis [ver Advertencias y precauciones (5.5) y Reacciones adversas (6.2)]. Tenga precaución en pacientes que experimentan deshidratación.
8.7 Insuficiencia Hepática
Existe experiencia limitada en pacientes con insuficiencia hepática leve, moderada o grave. Por lo tanto, VICTOZA debe usarse con precaución en esta población de pacientes. No se recomienda ajustar la dosis de VICTOZA en pacientes con insuficiencia hepática [ver Farmacología Clínica (12.3)].
8.8 Gastroparesia
VICTOZA retrasa el vaciamiento gástrico. VICTOZA no se ha estudiado en pacientes con gastroparesia preexistente.
10 SOBREDOSIS
Se han notificado sobredosis en ensayos clínicos y tras la comercialización de VICTOZA. Los efectos observados han incluido náuseas intensas, vómitos intensos e hipoglucemia grave. En caso de sobredosis, se debe iniciar el tratamiento de apoyo adecuado según los signos y síntomas clínicos del paciente.
11 DESCRIPCIÓN
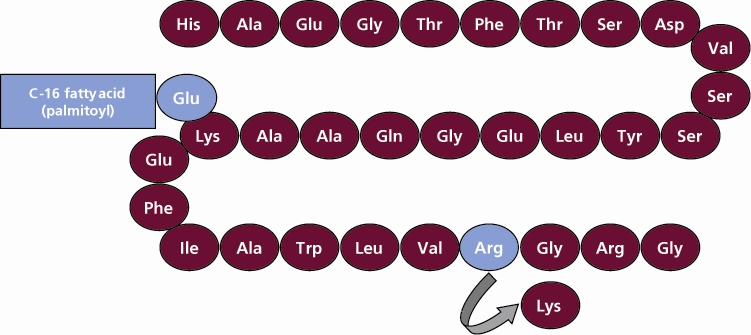
VICTOZA contiene liraglutida, un análogo del GLP-1 humano y actúa como un agonista del receptor GLP-1. El precursor peptídico de la liraglutida, producido por un proceso que incluye la expresión de ADN recombinante en Saccharomyces cerevisiae, ha sido diseñado para ser 97% homólogo al GLP-1 humano nativo mediante la sustitución de arginina por lisina en la posición 34. La liraglutida se produce uniendo un ácido graso C-16 (ácido palmítico) con un espaciador de ácido glutámico en el residuo de lisina restante en la posición 26 del precursor peptídico. La fórmula molecular de la liraglutida es C172H265N43O51 y el peso molecular es 3751.2 Daltons. La fórmula estructural (Figura 1) es:
Figura 1 Fórmula estructural de liraglutida
La inyección de VICTOZA es una solución estéril, acuosa, transparente, incolora o casi incolora para uso subcutáneo. Cada 1 mL de solución de VICTOZA contiene 6 mg de liraglutida y los siguientes ingredientes inactivos: dihidrato de fosfato disódico, 1,42 mg; propilenglicol, 14 mg; fenol, 5,5 mg; y agua para inyección. VICTOZA tiene un pH de aproximadamente 8,15; se puede agregar ácido clorhídrico o hidróxido de sodio para ajustar el pH. Cada pluma precargada contiene una solución de 3 mL de VICTOZA equivalente a 18 mg de liraglutida (base libre, anhidra).
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
La liraglutida es un agonista del receptor del péptido similar al glucagón (GLP-1) humano acilado con una homología de secuencia de aminoácidos del 97% con el GLP-1(7-37) humano endógeno. El GLP-1(7-37) representa <20% del GLP-1 endógeno circulante total. Al igual que el GLP-1(7-37), la liraglutida activa el receptor GLP-1, un receptor de superficie celular unido a la membrana acoplado a la adenilil ciclasa mediante la proteína G estimulatoria, Gs, en las células beta pancreáticas. La liraglutida aumenta el AMP cíclico (AMPc) intracelular, lo que conduce a la liberación de insulina en presencia de concentraciones elevadas de glucosa. Esta secreción de insulina disminuye a medida que las concentraciones de glucosa en sangre disminuyen y se acercan a la euglucemia. La liraglutida también disminuye la secreción de glucagón de una manera dependiente de la glucosa. El mecanismo de reducción de la glucosa en sangre también implica un retraso en el vaciado gástrico.
El GLP-1(7-37) tiene una semivida de 1,5 a 2 minutos debido a la degradación por las enzimas endógenas ubicuas, la dipeptidil peptidasa IV (DPP-IV) y las endopeptidasas neutras (NEP). A diferencia del GLP-1 nativo, la liraglutida es estable contra la degradación metabólica por ambas peptidasas y tiene una semivida plasmática de 13 horas después de la administración subcutánea. El perfil farmacocinético de la liraglutida, que la hace adecuada para la administración una vez al día, es el resultado de la autoasociación que retrasa la absorción, la unión a proteínas plasmáticas y la estabilidad contra la degradación metabólica por DPP-IV y NEP.
12.2 Farmacodinamia
El perfil farmacodinámico de VICTOZA es consistente con su perfil farmacocinético observado después de la administración subcutánea única, ya que VICTOZA redujo la glucosa en ayunas, pre-comida y postprandial durante todo el día [ver Farmacocinética (12.3)].
La glucosa en ayunas y postprandial se midió antes y hasta 5 horas después de una comida estandarizada después del tratamiento hasta el estado estacionario con 0,6, 1,2 y 1,8 mg de VICTOZA o placebo. En comparación con el placebo, el AUC0-300min de glucosa plasmática postprandial fue un 35% menor después de 1,2 mg de VICTOZA y un 38% menor después de 1,8 mg de VICTOZA.
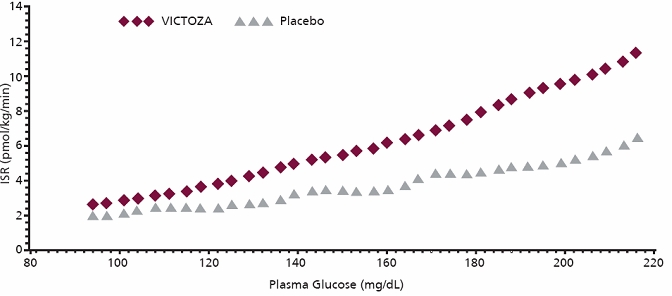
Secreción de insulina dependiente de la glucosa
Se investigó el efecto de una dosis única de 7,5 mcg/kg (~ 0,7 mg) de VICTOZA en las tasas de secreción de insulina (ISR) en 10 pacientes con diabetes mellitus tipo 2 durante la infusión de glucosa graduada. En estos pacientes, en promedio, la respuesta de ISR aumentó de una manera dependiente de la glucosa (Figura 2).
Figura 2 Tasa media de secreción de insulina (ISR) versus concentración de glucosa después de una dosis única de VICTOZA 7,5 mcg/kg (~ 0,7 mg) o placebo en pacientes con diabetes mellitus tipo 2 (N=10) durante la infusión de glucosa graduada
Secreción de glucagón
VICTOZA redujo la glucosa en sangre al estimular la secreción de insulina y reducir la secreción de glucagón. Una dosis única de VICTOZA 7,5 mcg/kg (~ 0,7 mg) no afectó la respuesta de glucagón a bajas concentraciones de glucosa.
Vaciado gástrico
VICTOZA provoca un retraso en el vaciado gástrico, reduciendo así la velocidad a la que la glucosa postprandial aparece en la circulación.
Electrofisiología cardíaca (QTc)
El efecto de VICTOZA sobre la repolarización cardíaca se probó en un estudio de QTc. VICTOZA a concentraciones de estado estacionario con dosis diarias de hasta 1,8 mg no produjo prolongación del QTc.
12.3 Farmacocinética
Absorción
Después de la administración subcutánea, se alcanzan las concentraciones máximas de liraglutida a las 8-12 horas posteriores a la administración de la dosis. Las exposiciones máxima media (Cmax) y total (AUC) de liraglutida fueron 35 ng/mL y 960 ng·h/mL, respectivamente, para una dosis única subcutánea de 0,6 mg. Después de las administraciones de dosis únicas subcutáneas, la Cmax y el AUC de liraglutida aumentaron proporcionalmente en el rango de dosis terapéutico de 0,6 mg a 1,8 mg. A 1,8 mg de VICTOZA, la concentración media de estado estacionario de liraglutida durante 24 horas fue de aproximadamente 128 ng/mL. El AUC0-∞ fue equivalente entre la parte superior del brazo y el abdomen, y entre la parte superior del brazo y el muslo. El AUC0-∞ del muslo fue un 22% menor que el del abdomen. Sin embargo, las exposiciones a liraglutida se consideraron comparables entre estos tres sitios de inyección subcutánea. La biodisponibilidad absoluta de liraglutida después de la administración subcutánea es de aproximadamente el 55%.
Distribución
El volumen de distribución aparente medio después de la administración subcutánea de 0,6 mg de VICTOZA es de aproximadamente 13 L. El volumen de distribución medio después de la administración intravenosa de VICTOZA es de 0,07 L/kg. La liraglutida se une extensamente a las proteínas plasmáticas (>98%).
Eliminación
El aclaramiento aparente medio después de la administración subcutánea de una dosis única de liraglutida es de aproximadamente 1,2 L/h con una semivida de eliminación de aproximadamente 13 horas.
Metabolismo
Durante las 24 horas iniciales después de la administración de una dosis única de [3H]-liraglutida a sujetos sanos, el componente principal en el plasma fue la liraglutida intacta. La liraglutida se metaboliza endógenamente de manera similar a las proteínas grandes sin un órgano específico como vía principal de eliminación.
Excreción
Después de una dosis de [3H]-liraglutida, no se detectó liraglutida intacta en la orina o las heces. Solo una parte menor de la radiactividad administrada se excretó como metabolitos relacionados con la liraglutida en la orina o las heces (6% y 5%, respectivamente). La mayor parte de la radiactividad de la orina y las heces se excretó durante los primeros 6-8 días.
Poblaciones específicas
Pacientes geriátricos
Según un estudio farmacocinético en sujetos ancianos sanos (de 65 a 83 años) y análisis farmacocinéticos poblacionales de pacientes de 18 a 80 años, la edad no tuvo efecto en la farmacocinética de VICTOZA [ver Uso en Poblaciones Específicas (8.5)].
Pacientes pediátricos
Se realizó un análisis farmacocinético poblacional de VICTOZA utilizando datos de 72 pacientes pediátricos (de 10 a 17 años) con diabetes mellitus tipo 2. El perfil farmacocinético de VICTOZA en los pacientes pediátricos fue consistente con el de los adultos.
Pacientes masculinos y femeninos
Según los resultados de los análisis farmacocinéticos poblacionales, las mujeres tienen una depuración ajustada por peso de VICTOZA un 25% menor en comparación con los hombres.
Grupos raciales o étnicos
La raza y la etnia no tuvieron efecto en la farmacocinética de VICTOZA según los resultados de los análisis farmacocinéticos poblacionales que incluyeron sujetos blancos, negros o afroamericanos, asiáticos y hispanos o latinos/ no hispanos o latinos.
Peso corporal
El peso corporal afecta significativamente la farmacocinética de VICTOZA según los resultados de los análisis farmacocinéticos poblacionales. La exposición a liraglutida disminuye con un aumento en el peso corporal basal. Sin embargo, las dosis diarias de 1.2 mg y 1.8 mg de VICTOZA proporcionaron exposiciones sistémicas adecuadas en el rango de peso corporal de 40 – 160 kg evaluado en los ensayos clínicos. Liraglutida no se estudió en pacientes con peso corporal > 160 kg.
Pacientes con insuficiencia renal
Se evaluó la farmacocinética de una sola dosis de VICTOZA en pacientes con diferentes grados de insuficiencia renal. Se incluyeron en el ensayo pacientes con insuficiencia renal leve (clara ncia de creatinina estimada 50 – 80 mL/min) a grave (clara ncia de creatinina estimada < 30 mL/min) y sujetos con enfermedad renal en etapa terminal que requieren diálisis. En comparación con los sujetos sanos, el AUC de liraglutida en la insuficiencia renal leve, moderada y grave y en la enfermedad renal en etapa terminal fue en promedio un 35%, un 19%, un 29% y un 30% menor, respectivamente [ver Uso en Poblaciones Específicas (8.6)].
Pacientes con insuficiencia hepática
Se evaluó la farmacocinética de una sola dosis de VICTOZA en pacientes con diferentes grados de insuficiencia hepática. Se incluyeron en el ensayo pacientes con insuficiencia hepática leve (puntuación Child Pugh 5 – 6) a grave (puntuación Child Pugh > 9). En comparación con los sujetos sanos, el AUC de liraglutida en pacientes con insuficiencia hepática leve, moderada y grave fue en promedio un 11%, un 14% y un 42% menor, respectivamente [ver Uso en Poblaciones Específicas (8.7)].
Estudios de interacción de fármacos
Evaluación in vitro de interacciones fármaco-fármaco
VICTOZA tiene un bajo potencial de interacciones fármaco-fármaco farmacocinéticas relacionadas con el citocromo P450 (CYP) y la unión a proteínas plasmáticas.
Evaluación in vivo de interacciones fármaco-fármaco
Los estudios de interacción fármaco-fármaco se realizaron en estado estacionario con VICTOZA 1.8 mg/día. Antes de la administración del tratamiento concomitante, los sujetos recibieron un aumento de dosis semanal de 0.6 mg para alcanzar la dosis máxima de 1.8 mg/día. La administración de los fármacos interactuantes se programó de modo que el Cmax de VICTOZA (8 – 12 h) coincidiera con el pico de absorción de los fármacos coadministrados.
Digoxina
Se administró una dosis única de digoxina 1 mg 7 horas después de la dosis de VICTOZA en estado estacionario. La administración concomitante con VICTOZA resultó en una reducción del AUC de digoxina en un 16%; el Cmax disminuyó en un 31%. El tiempo mediano hasta la concentración máxima (Tmax) de la digoxina se retrasó de 1 h a 1.5 h.
Lisinopril
Se administró una dosis única de lisinopril 20 mg 5 minutos después de la dosis de VICTOZA en estado estacionario. La coadministración con VICTOZA resultó en una reducción del AUC de lisinopril en un 15%; el Cmax disminuyó en un 27%. El Tmax mediano de lisinopril se retrasó de 6 h a 8 h con VICTOZA.
Atorvastatina
VICTOZA no cambió la exposición total (AUC) de atorvastatina después de una dosis única de atorvastatina 40 mg, administrada 5 horas después de la dosis de VICTOZA en estado estacionario. El Cmax de atorvastatina disminuyó en un 38% y el Tmax mediano se retrasó de 1 h a 3 h con VICTOZA.
Acetaminofén
VICTOZA no cambió la exposición total (AUC) de acetaminofén después de una dosis única de acetaminofén 1000 mg, administrada 8 horas después de la dosis de VICTOZA en estado estacionario. El Cmax de acetaminofén disminuyó en un 31% y el Tmax mediano se retrasó hasta 15 minutos.
Griseofulvina
VICTOZA no cambió la exposición total (AUC) de griseofulvina después de la administración conjunta de una dosis única de griseofulvina 500 mg con VICTOZA en estado estacionario. El Cmax de griseofulvina aumentó en un 37% mientras que el Tmax mediano no cambió.
Anticonceptivos orales
Se administró una dosis única de un producto combinado de anticonceptivos orales que contiene 0.03 mg de etinilestradiol y 0.15 mg de levonorgestrel en condiciones de alimentación y 7 horas después de la dosis de VICTOZA en estado estacionario. VICTOZA disminuyó el Cmax de etinilestradiol y levonorgestrel en un 12% y un 13%, respectivamente. No hubo efecto de VICTOZA en la exposición total (AUC) de etinilestradiol. VICTOZA aumentó el AUC0-∞ de levonorgestrel en un 18%. VICTOZA retrasó el Tmax tanto para el etinilestradiol como para el levonorgestrel en 1.5 h.
Insulina detemir
No se observó interacción farmacocinética entre VICTOZA e insulina detemir cuando se administraron inyecciones subcutáneas separadas de insulina detemir 0.5 Unidades/kg (dosis única) y VICTOZA 1.8 mg (estado estacionario) en pacientes con diabetes mellitus tipo 2.
12.6 Inmunogenicidad
La incidencia observada de anticuerpos contra el fármaco depende en gran medida de la sensibilidad y la especificidad del ensayo. Las diferencias en los métodos de ensayo impiden realizar comparaciones significativas de la incidencia de anticuerpos contra el fármaco en los estudios que se describen a continuación con la incidencia de anticuerpos contra el fármaco en otros estudios, incluidos aquellos con VICTOZA u otros productos de liraglutida.
Un subconjunto de pacientes tratados con VICTOZA (1104 de 2501, 44%) en cinco ensayos clínicos doble ciego en adultos de 26 semanas de duración o más se sometieron a pruebas para detectar la presencia de anticuerpos anti-liraglutida al final del tratamiento [ver Estudios Clínicos (14.1)] y 102/1104 (9%) de los pacientes tratados con VICTOZA desarrollaron anticuerpos anti-liraglutida. De estos 102 pacientes tratados con VICTOZA, 56 (5%) pacientes desarrollaron anticuerpos que reaccionaron de forma cruzada con el GLP-1 nativo. Estos anticuerpos de reacción cruzada no se analizaron para determinar el efecto neutralizante contra el GLP-1 nativo y, por lo tanto, no se evaluó el potencial de neutralización clínicamente significativa del GLP-1 nativo. Los anticuerpos que tuvieron un efecto neutralizante sobre la liraglutida en un ensayo in vitro se produjeron en 12 (1%) de los pacientes tratados con VICTOZA. No se identificó ningún efecto clínicamente significativo de los anticuerpos anti-liraglutida sobre la eficacia de VICTOZA.
En cinco ensayos doble ciego en adultos sobre el control glucémico de VICTOZA, se produjeron eventos de un compuesto de eventos adversos potencialmente relacionados con la inmunogenicidad (p. ej., urticaria, angioedema) en el 0.8% de los pacientes tratados con VICTOZA y en el 0.4% de los pacientes tratados con el comparador. La urticaria representó aproximadamente la mitad de los eventos en este compuesto para los pacientes tratados con VICTOZA. Los pacientes que desarrollaron anticuerpos anti-liraglutida no tuvieron más probabilidades de desarrollar eventos del compuesto de eventos de inmunogenicidad que los pacientes que no desarrollaron anticuerpos anti-liraglutida.
En el ensayo LEADER [ver Estudios Clínicos (14.3)], se detectaron anticuerpos anti-liraglutida en 11 de los 1247 (0.9%) pacientes adultos tratados con VICTOZA con mediciones de anticuerpos. De los 11 pacientes adultos tratados con VICTOZA que desarrollaron anticuerpos anti-liraglutida, no se observó que ninguno desarrollara anticuerpos neutralizantes contra la liraglutida, y 5 pacientes (0.4%) desarrollaron anticuerpos de reacción cruzada contra el GLP-1 nativo.
En un ensayo clínico con pacientes pediátricos de 10 años o más [ver Estudios Clínicos (14.2)], se detectaron anticuerpos anti-liraglutida en 1 (2%) paciente tratado con VICTOZA en la semana 26 y en 5 (9%) pacientes tratados con VICTOZA en la semana 53. Ninguno de los 5 pacientes tenía anticuerpos con reacción cruzada al GLP-1 nativo ni anticuerpos neutralizantes.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Se realizó un estudio de carcinogenicidad de 104 semanas en ratones CD-1 machos y hembras a dosis de 0,03, 0,2, 1,0 y 3,0 mg/kg/día de liraglutida administrada mediante inyección subcutánea en bolo, lo que produjo exposiciones sistémicas 0,2, 2, 10 y 45 veces la exposición humana, respectivamente, a la dosis máxima recomendada para humanos (MRHD) de 1,8 mg/día, según la comparación del AUC plasmático. Se observó un aumento relacionado con la dosis en adenomas de células C tiroideas benignos en los grupos de 1,0 y 3,0 mg/kg/día con incidencias del 13% y 19% en machos y del 6% y 20% en hembras, respectivamente. No se produjeron adenomas de células C en los grupos control ni en los grupos de 0,03 y 0,2 mg/kg/día. Se produjeron carcinomas de células C malignos relacionados con el tratamiento en el 3% de las hembras del grupo de 3,0 mg/kg/día. Los tumores de células C tiroideas son hallazgos poco frecuentes durante las pruebas de carcinogenicidad en ratones. Se observó un aumento relacionado con el tratamiento en fibrosarcomas en la piel dorsal y la hipodermis, la superficie corporal utilizada para la inyección del fármaco, en machos del grupo de 3 mg/kg/día. Estos fibrosarcomas se atribuyeron a la alta concentración local del fármaco cerca del lugar de inyección. La concentración de liraglutida en la formulación clínica (6 mg/mL) es 10 veces superior a la concentración en la formulación utilizada para administrar 3 mg/kg/día de liraglutida a ratones en el estudio de carcinogenicidad (0,6 mg/mL).
Se realizó un estudio de carcinogenicidad de 104 semanas en ratas Sprague Dawley machos y hembras a dosis de 0,075, 0,25 y 0,75 mg/kg/día de liraglutida administrada mediante inyección subcutánea en bolo con exposiciones 0,5, 2 y 8 veces la exposición humana, respectivamente, resultantes de la MRHD según la comparación del AUC plasmático. Se observó un aumento relacionado con el tratamiento en adenomas de células C tiroideas benignos en machos en los grupos de 0,25 y 0,75 mg/kg/día de liraglutida con incidencias del 12%, 16%, 42% y 46% y en todos los grupos de hembras tratados con liraglutida con incidencias del 10%, 27%, 33% y 56% en los grupos de 0 (control), 0,075, 0,25 y 0,75 mg/kg/día, respectivamente. Se observó un aumento relacionado con el tratamiento en carcinomas de células C tiroideas malignos en todos los grupos de machos tratados con liraglutida con incidencias del 2%, 8%, 6% y 14% y en hembras a 0,25 y 0,75 mg/kg/día con incidencias del 0%, 0%, 4% y 6% en los grupos de 0 (control), 0,075, 0,25 y 0,75 mg/kg/día, respectivamente. Los carcinomas de células C tiroideas son hallazgos poco frecuentes durante las pruebas de carcinogenicidad en ratas.
Los estudios en ratones demostraron que la proliferación de células C inducida por liraglutida dependía del receptor GLP-1 y que la liraglutida no causaba la activación del protooncogén REordenado durante la Transfección (RET) en las células C tiroideas.
Se desconoce la relevancia para los humanos de los tumores de células C tiroideas en ratones y ratas y no se ha determinado mediante estudios clínicos o no clínicos [véase Advertencia en recuadro y Advertencias y precauciones (5.1)].
La liraglutida resultó negativa con y sin activación metabólica en la prueba de Ames para la mutagenicidad y en una prueba de aberración cromosómica de linfocitos de sangre periférica humana para la clastogenicidad. La liraglutida resultó negativa en pruebas de micronúcleos in vivo repetidas en ratas.
En estudios de fertilidad en ratas que utilizaron dosis subcutáneas de 0,1, 0,25 y 1,0 mg/kg/día de liraglutida, los machos fueron tratados durante 4 semanas antes y durante el apareamiento y las hembras fueron tratadas 2 semanas antes y durante el apareamiento hasta el día 17 de gestación. No se observaron efectos adversos directos sobre la fertilidad masculina a dosis de hasta 1,0 mg/kg/día, una dosis alta que produce una exposición sistémica estimada 11 veces superior a la exposición humana a la MRHD, según el AUC plasmático. En ratas hembras, se produjo un aumento de las muertes embrionarias tempranas a 1,0 mg/kg/día. Se observó una reducción del aumento de peso corporal y del consumo de alimentos en las hembras a la dosis de 1,0 mg/kg/día.
14 ESTUDIOS CLÍNICOS
14.1 Ensayos de control glucémico en adultos con diabetes mellitus tipo 2
En ensayos de control glucémico en adultos, VICTOZA se ha estudiado como monoterapia y en combinación con uno o dos medicamentos antidiabéticos orales o insulina basal. VICTOZA también se estudió en un ensayo de resultados cardiovasculares (ensayo LEADER).
En cada uno de los ensayos controlados con placebo, el tratamiento con VICTOZA produjo mejoras clínica y estadísticamente significativas en la hemoglobina A1c y la glucosa plasmática en ayunas (FPG) en comparación con el placebo.
Todos los pacientes tratados con VICTOZA comenzaron con 0,6 mg/día. La dosis se aumentó en intervalos semanales de 0,6 mg hasta alcanzar 1,2 mg o 1,8 mg para los pacientes aleatorizados a estas dosis más altas. VICTOZA 0,6 mg no es efectivo para el control glucémico y se pretende únicamente como dosis inicial para reducir la intolerancia gastrointestinal [ver Dosificación y Administración (2)].
Monoterapia
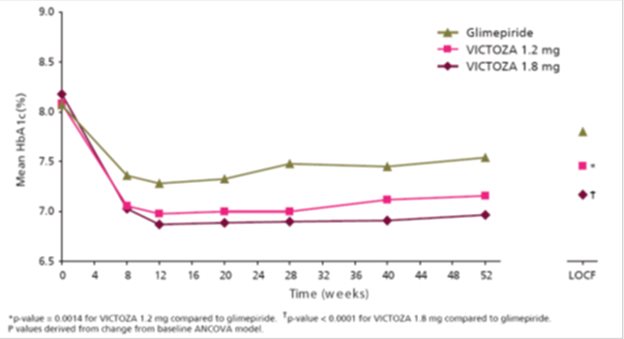
En este ensayo de 52 semanas, 746 pacientes adultos con diabetes mellitus tipo 2 fueron aleatorizados a VICTOZA 1,2 mg, VICTOZA 1,8 mg o glimepirida 8 mg. Los pacientes que fueron aleatorizados a glimepirida se trataron inicialmente con 2 mg diarios durante dos semanas, aumentando a 4 mg diarios durante otras dos semanas y finalmente aumentando a 8 mg diarios.
El tratamiento con VICTOZA 1,8 mg y 1,2 mg resultó en una reducción estadísticamente significativa en la HbA1c en comparación con la glimepirida (Tabla 3). El porcentaje de pacientes que suspendieron el tratamiento debido a la ineficacia terapéutica fue del 3,6% en el grupo de tratamiento con VICTOZA 1,8 mg, del 6,0% en el grupo de tratamiento con VICTOZA 1,2 mg y del 10,1% en el grupo de tratamiento con glimepirida.
La edad media de los participantes fue de 53 años y la duración media de la diabetes fue de 5 años. Los participantes eran el 49,7% hombres, el 77,5% blancos, el 12,6% negros o afroamericanos y el 35,0% de etnia hispana o latina. El IMC medio fue de 33,1 kg/m2.
Tabla 3 Resultados de un ensayo de monoterapia de 52 semanas en adultos con diabetes mellitus tipo 2a