Fabricante de medicamentos: Eli Lilly and Company (Updated: 2024-11-01)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
TRULICITY (dulaglutida) inyección, para uso subcutáneo
Aprobación inicial en EE. UU.: 2014
ADVERTENCIA: RIESGO DE TUMORES DE CÉLULAS C DE TIROIDES
Consulte la información de prescripción completa para ver el recuadro de advertencia completo.
- Dulaglutide causa tumores de células C de tiroides en ratas. Se desconoce si TRULICITY causa tumores de células C de tiroides, incluido el carcinoma medular de tiroides (CMT), en humanos, ya que no se ha determinado la relevancia humana de los tumores de células C de tiroides en roedores inducidos por dulaglutida (5.1, 13.1).
- TRULICITY está contraindicado en pacientes con antecedentes personales o familiares de CMT y en pacientes con síndrome de neoplasia endocrina múltiple tipo 2 (NEM 2). Aconseje a los pacientes sobre el riesgo potencial de CMT y los síntomas de los tumores de tiroides (4, 5.1).
CAMBIOS RECIENTES IMPORTANTES
INDICACIONES Y USO
TRULICITY® es un agonista del receptor del péptido-1 similar al glucagón (GLP-1) indicado (1):
- Como complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos y pacientes pediátricos de 10 años de edad y mayores con diabetes mellitus tipo 2.
- Para reducir el riesgo de eventos cardiovasculares adversos mayores en adultos con diabetes mellitus tipo 2 que tienen enfermedad cardiovascular establecida o múltiples factores de riesgo cardiovascular.
Limitaciones de uso:
- No se ha estudiado en pacientes con antecedentes de pancreatitis. Considere otras terapias antidiabéticas en estos pacientes (1, 5.2).
- No es para el tratamiento de la diabetes mellitus tipo 1 (1).
- No se recomienda en pacientes con enfermedad gastrointestinal grave, incluida la gastroparesia grave (1, 5.6).
DOSIFICACIÓN Y ADMINISTRACIÓN
Dosis para adultos (2.1)
- La dosis inicial recomendada es de 0.75 mg inyectada por vía subcutánea una vez por semana.
- Después de 4 semanas, la dosis puede aumentarse a 1.5 mg una vez por semana para un control glucémico adicional.
- Si se necesita un control glucémico adicional, aumente la dosis en incrementos de 1.5 mg después de al menos 4 semanas con la dosis actual.
- La dosis máxima recomendada es de 4.5 mg inyectada por vía subcutánea una vez por semana.
Dosis pediátrica (2.2)
- La dosis inicial recomendada es de 0.75 mg inyectada por vía subcutánea una vez por semana.
- Si se necesita un control glucémico adicional, aumente la dosis a la dosis máxima recomendada de 1.5 mg una vez por semana después de al menos 4 semanas con la dosis de 0.75 mg.
Recomendaciones con respecto a la dosis olvidada (2.3)
- Si olvida una dosis, administre la dosis olvidada lo antes posible si faltan al menos 3 días (72 horas) para la siguiente dosis programada.
Instrucciones importantes de administración (2.4)
- Administrar una vez por semana a cualquier hora del día con o sin alimentos.
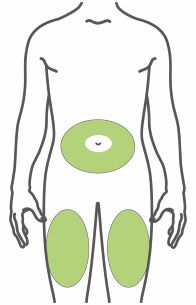
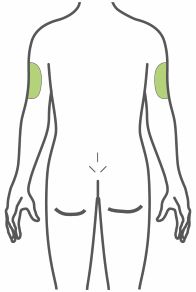
- Inyectar por vía subcutánea en el abdomen, el muslo o la parte superior del brazo.
FORMAS FARMACÉUTICAS Y CONCENTRACIONES
CONTRAINDICACIONES
ADVERTENCIAS Y PRECAUCIONES
- Tumores de células C tiroideas: Ver Recuadro de advertencia (5.1).
- Pancreatitis: Se ha informado en ensayos clínicos. Suspenda inmediatamente si se sospecha pancreatitis. No reinicie si se confirma la pancreatitis (5.2).
- Hipoglucemia: El uso concomitante con un secretagogo de insulina o insulina puede aumentar el riesgo de hipoglucemia, incluida la hipoglucemia grave. Puede ser necesario reducir la dosis del secretagogo de insulina o insulina (5.3).
- Reacciones de hipersensibilidad: Se han producido reacciones de hipersensibilidad graves (p. ej., reacciones anafilácticas y angioedema). Suspenda TRULICITY y busque atención médica de inmediato (5.4).
- Lesión renal aguda: Controle la función renal en pacientes con insuficiencia renal que reporten reacciones gastrointestinales adversas graves (5.5).
- Reacciones adversas gastrointestinales graves: El uso puede estar asociado con reacciones adversas gastrointestinales, a veces graves. No se ha estudiado en pacientes con enfermedad gastrointestinal grave y no se recomienda en estos pacientes (5.6).
- Complicaciones de la retinopatía diabética: Se han informado en un ensayo de resultados cardiovasculares. Controle a los pacientes con antecedentes de retinopatía diabética (5.7).
- Enfermedad aguda de la vesícula biliar: Si se sospecha colelitiasis o colecistitis, están indicados estudios de la vesícula biliar (5.8).
- Aspiración pulmonar durante anestesia general o sedación profunda: Se ha informado en pacientes que reciben agonistas del receptor GLP-1 sometidos a cirugías o procedimientos electivos. Indique a los pacientes que informen a los profesionales de la salud sobre cualquier cirugía o procedimiento planificado (5.9).
REACCIONES ADVERSAS
Las reacciones adversas más comunes (incidencia ≥5%) son náuseas, diarrea, vómitos, dolor abdominal y disminución del apetito (6.1).
Para informar REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Eli Lilly and Company al 1-800-LillyRx (1-800-545-5979) o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES CON MEDICAMENTOS
USO EN POBLACIONES ESPECÍFICAS
Embarazo: Debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto (8.1).
Ver 17 para INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y Guía del Medicamento.
Revisado: 11/2024
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
ADVERTENCIA: RIESGO DE TUMORES DE CÉLULAS C DEL TIROIDES
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis para Adultos
2.2 Dosis Pediátrica
2.3 Recomendaciones sobre Dosis Olvidadas
2.4 Instrucciones Importantes de Administración
3 FORMAS Y CONCENTRACIONES FARMACÉUTICAS
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Riesgo de Tumores de Células C del Tiroides
5.2 Pancreatitis
5.3 Hipoglucemia con el Uso Concomitante de Secretagogos de Insulina o Insulina
5.4 Reacciones de Hipersensibilidad
5.5 Lesión Renal Aguda
5.6 Reacciones Adversas Gastrointestinales Graves
5.7 Complicaciones de la Retinopatía Diabética en Pacientes con Antecedentes de Retinopatía Diabética
5.8 Enfermedad Aguda de la Vesícula Biliar
5.9 Aspiración Pulmonar Durante Anestesia General o Sedación Profunda
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Postcomercialización
7 INTERACCIONES MEDICAMENTOSAS
7.1 Medicamentos Orales
7.2 Uso Concomitante con un Secretagogo de Insulina (p. ej., Sulfonilurea) o con Insulina
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
8.6 Insuficiencia Renal
8.7 Insuficiencia Hepática
8.8 Gastroparesia
10 SOBREDOSIFICACIÓN
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
12.6 Inmunogenicidad
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis y Deterioro de la Fertilidad
13.2 Toxicología y/o Farmacología Animal
14 ESTUDIOS CLÍNICOS
14.1 Descripción General de los Ensayos Clínicos
14.2 Ensayos de Control Glucémico en Monoterapia en Adultos con Diabetes Mellitus Tipo 2
14.3 Ensayos de Control Glucémico en Terapia Combinada en Adultos con Diabetes Mellitus Tipo 2
14.4 Ensayos de Control Glucémico en Adultos con Diabetes Mellitus Tipo 2 y Enfermedad Renal Crónica Moderada a Grave
14.5 Ensayo de Resultados Cardiovasculares en Adultos con Diabetes Mellitus Tipo 2 y Enfermedad Cardiovascular o Múltiples Factores de Riesgo Cardiovascular
14.6 Ensayo de Control Glucémico en Pacientes Pediátricos de 10 Años o Mayores con Diabetes Mellitus Tipo 2
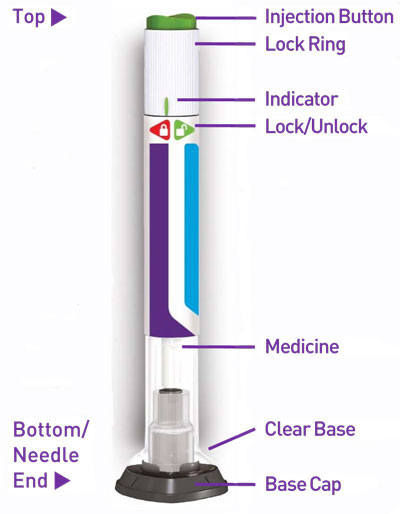
16 PRESENTACIÓN/ALMACENAMIENTO Y MANEJO
16.1 Presentación
16.2 Almacenamiento y Manejo
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no se enumeran.
ADVERTENCIA EN EL RECUADRO
ADVERTENCIA: RIESGO DE TUMORES DE CÉLULAS C TIROIDEAS
-
En ratas macho y hembra, el dulaglutida causa un aumento relacionado con la dosis y la duración del tratamiento en la incidencia de tumores de células C tiroideas (adenomas y carcinomas) después de la exposición de por vida. Se desconoce si TRULICITY causa tumores de células C tiroideas, incluido el carcinoma medular de tiroides (CMT), en humanos, ya que no se ha determinado la relevancia para los humanos de los tumores de células C tiroideas en roedores inducidos por dulaglutida
[ver Advertencias y precauciones (5.1), y Toxicología no clínica (13.1)]. -
TRULICITY está contraindicado en pacientes con antecedentes personales o familiares de CMT y en pacientes con síndrome de neoplasia endocrina múltiple tipo 2 (NEM 2). Oriente a los pacientes sobre el riesgo potencial de CMT con el uso de TRULICITY e infórmeles sobre los síntomas de los tumores tiroideos (p. ej., masa en el cuello, disfagia, disnea, ronquera persistente). El control rutinario de la calcitonina sérica o el uso de la ecografía tiroidea tienen un valor incierto para la detección temprana de CMT en pacientes tratados con TRULICITY
[ver Contraindicaciones (4) y Advertencias y precauciones (5.1)].
1 INDICACIONES Y USO
TRULICITY® está indicado para:
- Como complemento a la dieta y el ejercicio para mejorar el control glucémico en adultos y pacientes pediátricos de 10 años o más con diabetes mellitus tipo 2.
- Reducir el riesgo de eventos cardiovasculares adversos mayores (muerte cardiovascular, infarto de miocardio no mortal o accidente cerebrovascular no mortal) en adultos con diabetes mellitus tipo 2 que tienen enfermedad cardiovascular establecida o múltiples factores de riesgo cardiovascular.
Limitaciones de Uso
TRULICITY:
- No se ha estudiado en pacientes con antecedentes de pancreatitis [ver Advertencias y precauciones (5.2)]. Considere otras terapias antidiabéticas en pacientes con antecedentes de pancreatitis.
- No debe utilizarse en pacientes con diabetes mellitus tipo 1.
- No se ha estudiado en pacientes con enfermedad gastrointestinal grave, incluida la gastroparesia grave, por lo que no se recomienda en estos pacientes [ver Advertencias y precauciones (5.6)].
2 DOSIS Y ADMINISTRACIÓN
2.1 Dosis para adultos
- La dosis inicial recomendada de TRULICITY es de 0,75 mg administrada por vía subcutánea una vez por semana. Siga el esquema de aumento de la dosis que se describe a continuación para reducir el riesgo de reacciones adversas gastrointestinales [véase Advertencias y precauciones (5.6) y Reacciones adversas (6.1)].
- Después de 4 semanas, la dosis puede aumentarse a 1,5 mg una vez por semana para lograr un control glucémico adicional.
- Si se necesita un control glucémico adicional, aumente la dosis en incrementos de 1,5 mg después de al menos 4 semanas con la dosis actual.
- La dosis máxima recomendada es de 4,5 mg administrada por vía subcutánea una vez por semana.
2.2 Dosis pediátrica
- La dosis inicial recomendada de TRULICITY es de 0,75 mg administrada por vía subcutánea una vez por semana.
- Si se necesita un control glucémico adicional, aumente la dosis a la dosis máxima recomendada de 1,5 mg una vez por semana después de al menos 4 semanas con la dosis de 0,75 mg para reducir el riesgo de reacciones adversas gastrointestinales [véase Advertencias y precauciones (5.6) y Reacciones adversas (6.1)].
2.3 Recomendaciones sobre la dosis olvidada
- Si se olvida una dosis, indique a los pacientes que la administren lo antes posible si quedan al menos 3 días (72 horas) hasta la siguiente dosis programada. Si quedan menos de 3 días antes de la siguiente dosis programada, omita la dosis olvidada y administre la siguiente dosis el día programado regularmente. En cada caso, los pacientes pueden reanudar su régimen de dosificación regular una vez por semana.
- El día de administración semanal puede cambiarse, si es necesario, siempre que la última dosis se haya administrado 3 o más días antes del nuevo día de administración.
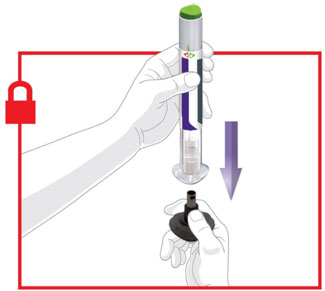
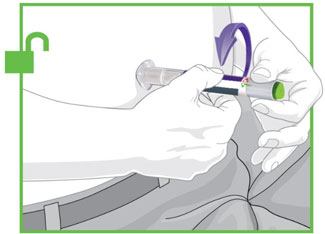
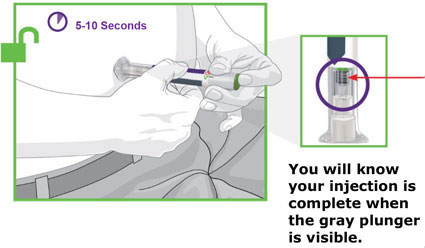
2.4 Instrucciones importantes de administración
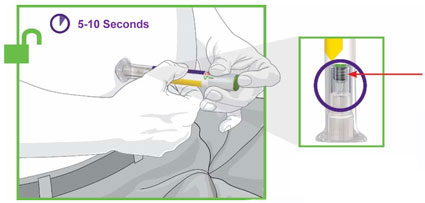
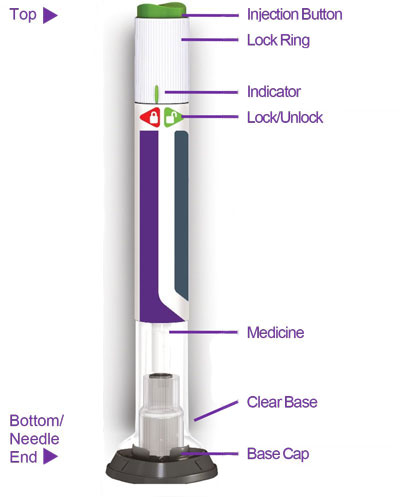
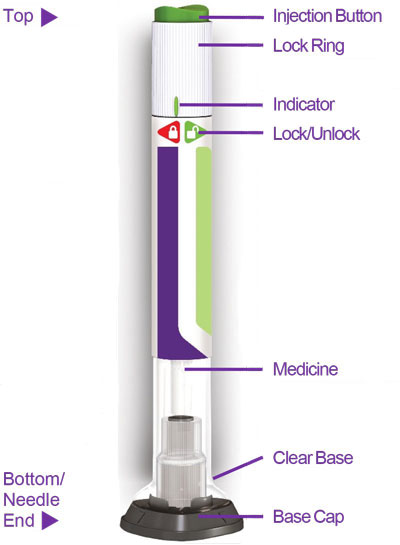
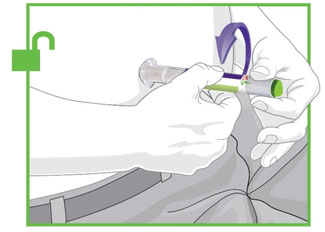
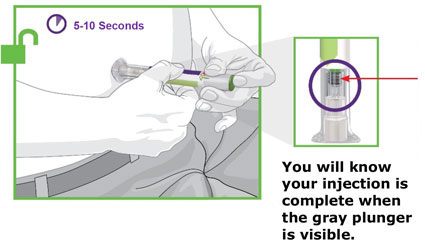
- Antes de iniciar el tratamiento, capacite a los pacientes y a sus cuidadores sobre la técnica de inyección adecuada [véase Instrucciones de uso].
- Administre TRULICITY una vez por semana, a cualquier hora del día, con o sin alimentos.
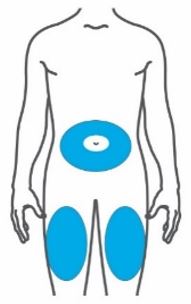
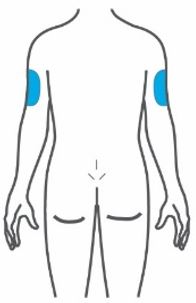
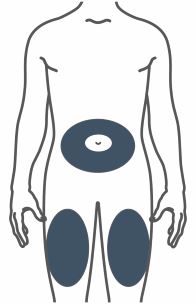
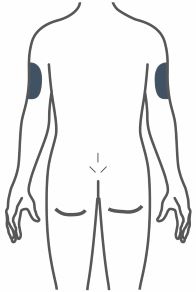
- Inyecte TRULICITY por vía subcutánea en el abdomen, el muslo o la parte superior del brazo.
- Rote los lugares de inyección con cada dosis.
- Inspeccione visualmente TRULICITY antes de usarlo. Debe tener un aspecto transparente e incoloro. No use TRULICITY si observa partículas o coloración.
- Cuando se use TRULICITY con insulina, adminístrese como inyecciones separadas y nunca se mezcle. Es aceptable inyectar TRULICITY e insulina en la misma zona del cuerpo, pero las inyecciones no deben ser adyacentes entre sí.
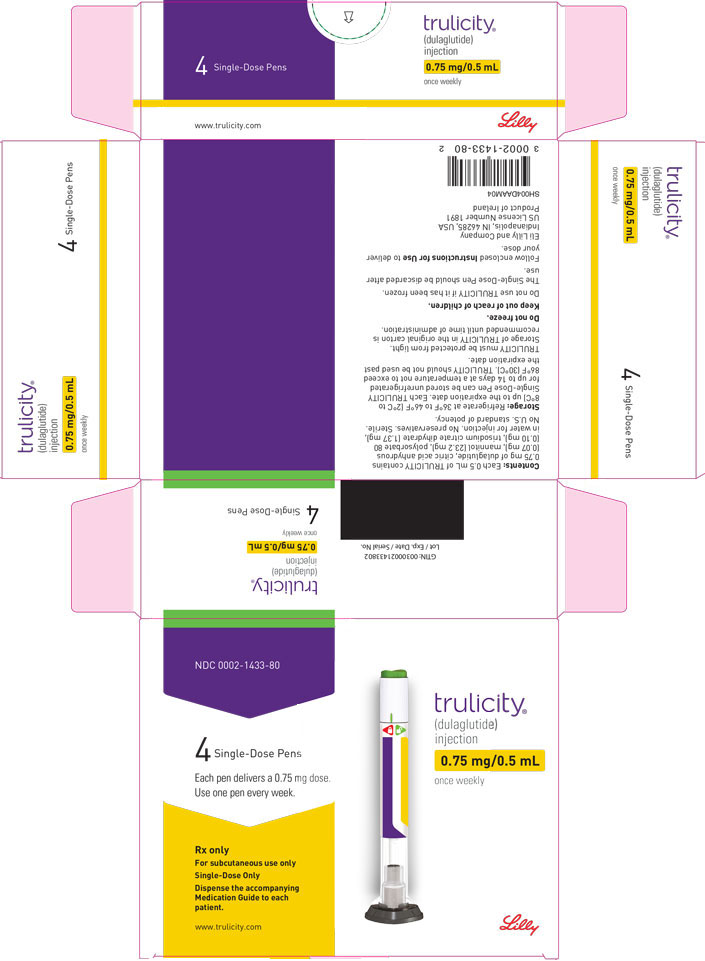
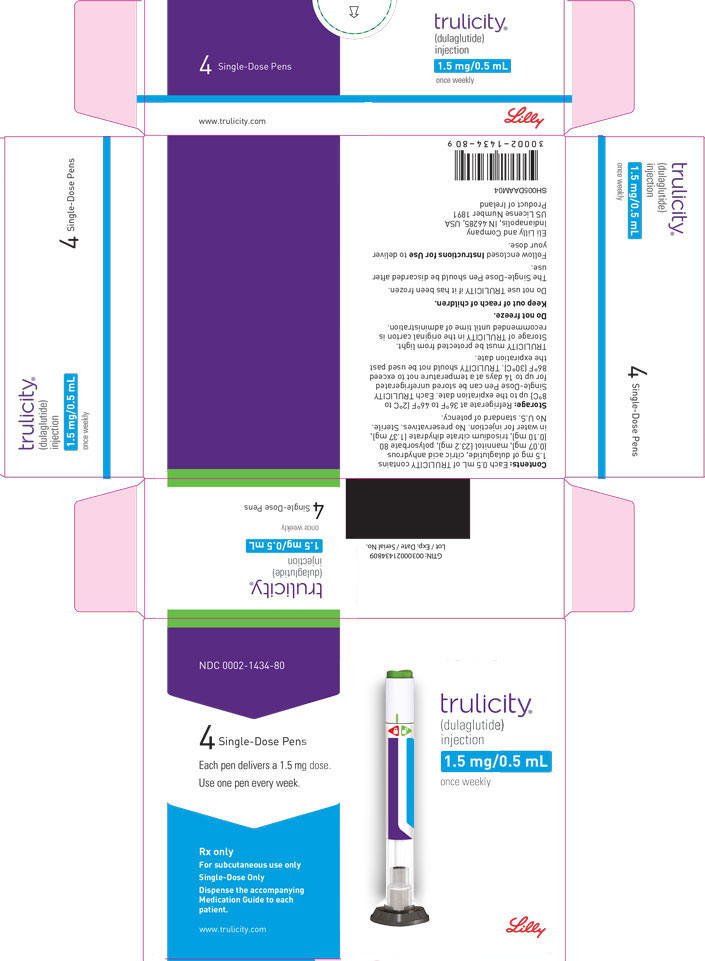
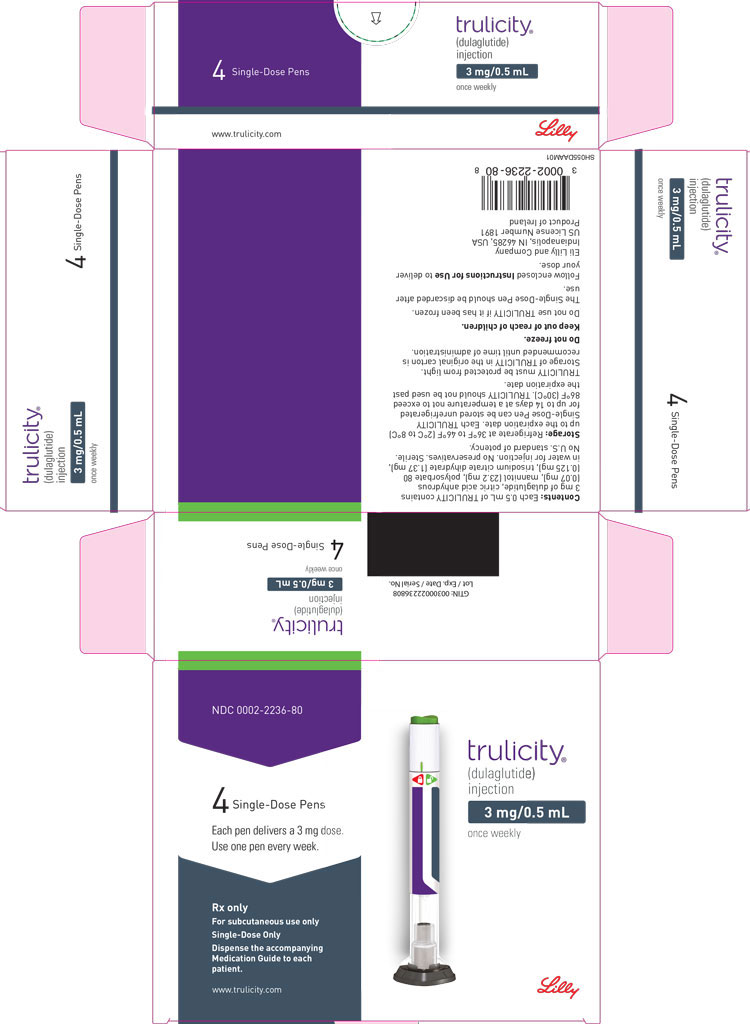
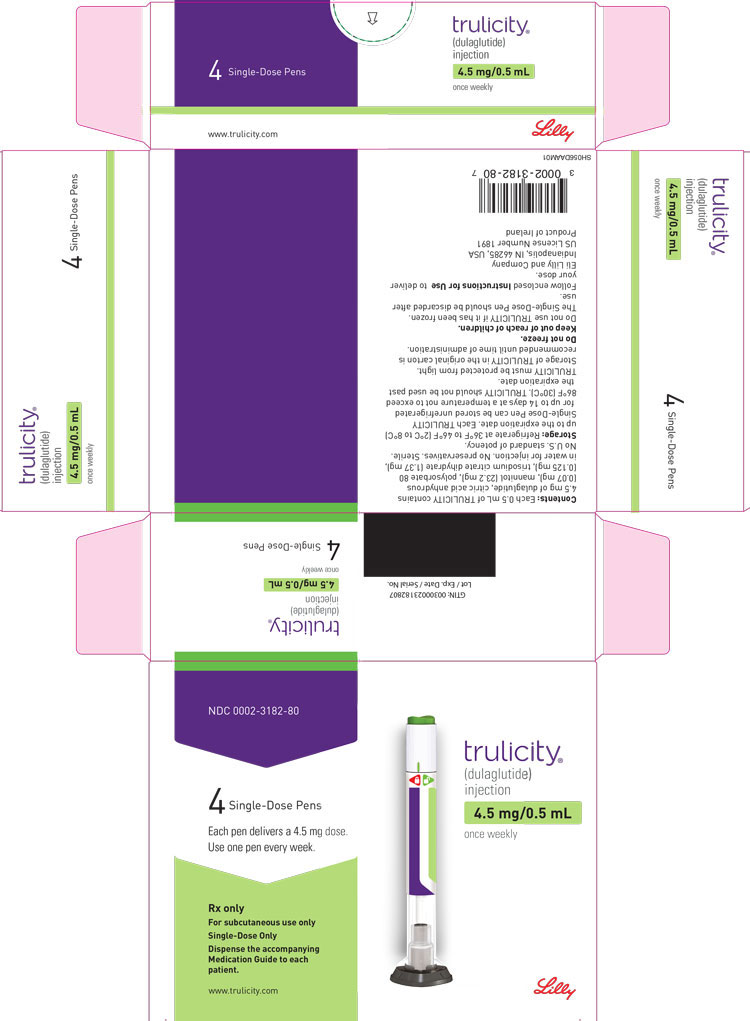
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Inyección: TRULICITY es una solución transparente e incolora disponible como:
- Solución 0.75 mg/0.5 mL en un bolígrafo de dosis única
- Solución 1.5 mg/0.5 mL en un bolígrafo de dosis única
- Solución 3 mg/0.5 mL en un bolígrafo de dosis única
- Solución 4.5 mg/0.5 mL en un bolígrafo de dosis única
4 CONTRAINDICACIONES
TRULICITY está contraindicado en pacientes con:
- Antecedentes personales o familiares de carcinoma medular de tiroides (CMT) o en pacientes con síndrome de neoplasia endocrina múltiple tipo 2 (NEM 2) [ver Advertencias y precauciones (5.1)].
- Reacción de hipersensibilidad grave a dulaglutida o a cualquiera de los componentes del producto. Se han notificado reacciones de hipersensibilidad graves, incluidas reacciones anafilácticas y angioedema, con TRULICITY [ver Advertencias y precauciones (5.4)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Riesgo de tumores de células C tiroideas
En ratas macho y hembra, el dulaglutida causa un aumento relacionado con la dosis y dependiente de la duración del tratamiento en la incidencia de tumores de células C tiroideas (adenomas y carcinomas) después de la exposición de por vida [ver Toxicología no clínica (13.1)]. Los agonistas del receptor del péptido 1 similar al glucagón (GLP-1) han inducido adenomas y carcinomas de células C tiroideas en ratones y ratas a exposiciones clínicamente relevantes. Se desconoce si TRULICITY causará tumores de células C tiroideas, incluido el carcinoma medular de tiroides (CMT), en humanos, ya que no se ha determinado la relevancia humana de los tumores de células C tiroideas en roedores inducidos por dulaglutida.
Se reportó un caso de CMT en un paciente tratado con TRULICITY en un ensayo clínico. Este paciente tenía niveles de calcitonina previos al tratamiento aproximadamente 8 veces el límite superior de lo normal (LSN). Se reportó un caso adicional de hiperplasia de células C con niveles elevados de calcitonina después del tratamiento en el ensayo de resultados cardiovasculares (REWIND). Se han reportado casos de CMT en pacientes tratados con liraglutida, otro agonista del receptor GLP-1, en el período posterior a la comercialización; los datos en estos informes son insuficientes para establecer o excluir una relación causal entre el CMT y el uso del agonista del receptor GLP-1 en humanos.
TRULICITY está contraindicado en pacientes con antecedentes personales o familiares de CMT o en pacientes con NEM 2. Oriente a los pacientes sobre el riesgo potencial de CMT con el uso de TRULICITY e infórmeles sobre los síntomas de los tumores tiroideos (p. ej., una masa en el cuello, disfagia, disnea, ronquera persistente).
El monitoreo rutinario de la calcitonina sérica o el uso de ultrasonido tiroideo tienen un valor incierto para la detección temprana de CMT en pacientes tratados con TRULICITY. Dicho monitoreo puede aumentar el riesgo de procedimientos innecesarios, debido a la baja especificidad de la prueba para la calcitonina sérica y una alta incidencia de fondo de enfermedad tiroidea. Los valores significativamente elevados de calcitonina sérica pueden indicar CMT y los pacientes con CMT generalmente tienen valores de calcitonina >50 ng/L. Si se mide la calcitonina sérica y se encuentra elevada, se debe evaluar más al paciente. Los pacientes con nódulos tiroideos observados en el examen físico o en imágenes del cuello también deben ser evaluados más a fondo.
5.2 Pancreatitis
En un análisis agrupado de los estudios de registro originales, se informaron 12 (3,4 casos por 1000 años-paciente) reacciones adversas relacionadas con pancreatitis en pacientes expuestos a TRULICITY versus 3 en comparadores no incretínicos (2,7 casos por 1000 años-paciente). Un análisis de eventos adjudicados reveló 5 casos de pancreatitis confirmada en pacientes expuestos a TRULICITY (1,4 casos por 1000 años-paciente) versus 1 caso en comparadores no incretínicos (0,88 casos por 1000 años-paciente).
Según un análisis de eventos adjudicados en un ensayo clínico que evalúa Trulicity 1,5 mg, 3 mg o 4,5 mg una vez por semana, la pancreatitis ocurrió en 1 paciente expuesto a TRULICITY 1,5 mg (0,2%), en 2 pacientes expuestos a TRULICITY 3 mg (0,3%) y 3 pacientes expuestos a TRULICITY 4,5 mg (0,5%).
Después del inicio de TRULICITY, observe cuidadosamente a los pacientes en busca de signos y síntomas de pancreatitis, incluido el dolor abdominal intenso persistente, a veces que irradia hacia la espalda, que puede o no ir acompañado de vómitos. Si se sospecha pancreatitis, suspenda inmediatamente TRULICITY e inicie el manejo adecuado. Si se confirma la pancreatitis, no se debe reiniciar TRULICITY. TRULICITY no se ha evaluado en pacientes con antecedentes de pancreatitis. Considere otras terapias antidiabéticas en pacientes con antecedentes de pancreatitis.
5.3 Hipoglucemia con el uso concomitante de secretagogos de insulina o insulina
Los pacientes que reciben TRULICITY en combinación con un secretagogo de insulina (p. ej., sulfonilurea) o insulina pueden tener un mayor riesgo de hipoglucemia, incluida la hipoglucemia grave [ver Reacciones adversas (6.1) e Interacciones medicamentosas (7)].
El riesgo de hipoglucemia puede reducirse mediante una reducción en la dosis de sulfonilurea (u otro secretagogo de insulina administrado concomitantemente) o insulina. Informe a los pacientes que usan estos medicamentos concomitantes sobre el riesgo de hipoglucemia y edúquelos sobre los signos y síntomas de la hipoglucemia.
5.4 Reacciones de hipersensibilidad
Ha habido informes posteriores a la comercialización de reacciones de hipersensibilidad graves, incluidas reacciones anafilácticas y angioedema en pacientes tratados con TRULICITY [ver Reacciones adversas (6.2)]. Si ocurre una reacción de hipersensibilidad, suspenda TRULICITY; trate rápidamente según el estándar de atención y controle hasta que los signos y síntomas desaparezcan. TRULICITY está contraindicado en pacientes con una reacción de hipersensibilidad grave previa a dulaglutida o a cualquiera de los componentes de TRULICITY.
Se han reportado anafilaxia y angioedema con otros agonistas del receptor GLP-1. Tenga precaución en un paciente con antecedentes de angioedema o anafilaxia con otro agonista del receptor GLP-1 porque se desconoce si dichos pacientes estarán predispuestos a la anafilaxia con TRULICITY.
5.5 Lesión renal aguda
En pacientes tratados con agonistas del receptor GLP-1, incluida TRULICITY, ha habido informes posteriores a la comercialización de insuficiencia renal aguda y empeoramiento de la insuficiencia renal crónica, que a veces puede requerir hemodiálisis. Algunos de estos eventos se informaron en pacientes sin enfermedad renal subyacente conocida. La mayoría de los eventos reportados ocurrieron en pacientes que habían experimentado náuseas, vómitos, diarrea o deshidratación. Debido a que estas reacciones pueden empeorar la función renal, tenga precaución al iniciar o aumentar las dosis de TRULICITY en pacientes con insuficiencia renal. Monitoree la función renal en pacientes con insuficiencia renal que reporten reacciones gastrointestinales adversas graves [ver Uso en poblaciones específicas (8.6)].
5.6 Reacciones adversas gastrointestinales graves
El uso de TRULICITY se ha asociado con reacciones adversas gastrointestinales, a veces graves [ver Reacciones adversas (6.1)]. En el conjunto de ensayos controlados con placebo, se informaron reacciones adversas gastrointestinales graves con mayor frecuencia entre los pacientes que recibieron TRULICITY (0,75 mg 2,2 %, 1,5 mg 4,3 %) que con placebo (1,4 %).
TRULICITY no se ha estudiado en pacientes con enfermedad gastrointestinal grave, incluida la gastroparesia grave, por lo que no se recomienda en estos pacientes.
5.7 Complicaciones de la retinopatía diabética en pacientes con antecedentes de retinopatía diabética
En un ensayo de resultados cardiovasculares con un seguimiento mediano de 5,4 años que incluyó a pacientes con diabetes tipo 2 con enfermedad cardiovascular establecida o múltiples factores de riesgo cardiovascular, se produjeron complicaciones de retinopatía diabética en pacientes tratados con TRULICITY 1,5 mg (1,9 %) y placebo (1,5 %). Estos eventos se determinaron prospectivamente como un criterio de valoración compuesto secundario. La proporción de pacientes con complicaciones de retinopatía diabética fue mayor entre los pacientes con antecedentes de retinopatía diabética al inicio del estudio (TRULICITY 8,5 %, placebo 6,2 %) que entre los pacientes sin antecedentes conocidos de retinopatía diabética (TRULICITY 1 %, placebo 1 %).
La mejora rápida en el control de la glucosa se ha asociado con un empeoramiento temporal de la retinopatía diabética. Los pacientes con antecedentes de retinopatía diabética deben ser controlados para detectar la progresión de la retinopatía diabética.
5.8 Enfermedad aguda de la vesícula biliar
Se han notificado eventos agudos de enfermedad de la vesícula biliar, como colelitiasis o colecistitis, en ensayos con agonistas del receptor GLP-1 y después de la comercialización. En un ensayo de resultados cardiovasculares con un seguimiento mediano de 5,4 años, la colelitiasis se produjo a una tasa de 0,62/100 pacientes-año en pacientes tratados con TRULICITY y de 0,56/100 pacientes-año en pacientes tratados con placebo después de ajustar según la colecistectomía previa. Se notificaron eventos graves de colecistitis aguda en el 0,5 % y el 0,3 % de los pacientes tratados con TRULICITY y placebo, respectivamente. Si se sospecha colelitiasis, están indicados los estudios de la vesícula biliar y el seguimiento clínico adecuado.
5.9 Aspiración pulmonar durante la anestesia general o sedación profunda
TRULICITY retrasa el vaciado gástrico [ver Farmacología clínica (12.2)]. Se han notificado casos poco frecuentes después de la comercialización de aspiración pulmonar en pacientes que recibían agonistas del receptor GLP-1 sometidos a cirugías o procedimientos electivos que requerían anestesia general o sedación profunda que tenían contenido gástrico residual a pesar del cumplimiento de las recomendaciones de ayuno preoperatorio.
Los datos disponibles son insuficientes para establecer recomendaciones para mitigar el riesgo de aspiración pulmonar durante la anestesia general o la sedación profunda en pacientes que toman TRULICITY, incluyendo si la modificación de las recomendaciones de ayuno preoperatorio o la interrupción temporal de TRULICITY podrían reducir la incidencia de contenido gástrico retenido. Indique a los pacientes que informen a los profesionales de la salud antes de cualquier cirugía o procedimiento planificado si están tomando TRULICITY.
6 REACCIONES ADVERSAS
Las siguientes reacciones serias se describen a continuación o en otra parte de la información de prescripción:
- Riesgo de tumores de células C de tiroides [ver Advertencias y precauciones (5.1)]
- Pancreatitis [ver Advertencias y precauciones (5.2)]
- Hipoglucemia con el uso concomitante de secretagogos de insulina o insulina [ver Advertencias y precauciones (5.3)]
- Reacciones de hipersensibilidad [ver Advertencias y precauciones (5.4)]
- Lesión renal aguda [ver Advertencias y precauciones (5.5)]
- Reacciones adversas gastrointestinales graves [ver Advertencias y precauciones (5.6)]
- Complicaciones de la retinopatía diabética en pacientes con antecedentes de retinopatía diabética [ver Advertencias y precauciones (5.7)]
- Enfermedad aguda de la vesícula biliar [ver Advertencias y precauciones (5.8)]
- Aspiración pulmonar durante la anestesia general o la sedación profunda [ver Advertencias y precauciones (5.9)]
6.1 Experiencia en ensayos clínicos
Debido a que los estudios clínicos se realizan bajo condiciones ampliamente variables, las tasas de reacciones adversas observadas en los estudios clínicos de un medicamento no se pueden comparar directamente con las tasas en los estudios clínicos de otro medicamento y es posible que no reflejen las tasas observadas en la práctica.
Reacciones adversas en los ensayos clínicos en adultos con diabetes mellitus tipo 2
Conjunto de ensayos controlados con placebo en adultos para dosis de TRULICITY de 0.75 mg y 1.5 mg
Los datos de la Tabla 1 se derivan de un conjunto de ensayos controlados con placebo e incluyen 1670 pacientes adultos con diabetes mellitus tipo 2 expuestos a TRULICITY con una duración media de exposición de 23,8 semanas [ver Estudios clínicos (14)]. La edad media de los pacientes fue de 56 años, el 1% tenía 75 años o más y el 53% eran hombres. La población era 69% blanca, 7% negra o afroamericana, 13% asiática; El 30% eran de etnia hispana o latina. Al inicio del estudio, la población tenía diabetes durante un promedio de 8 años, una HbA1c media del 8,0 % y el 2,5 % de la población informó retinopatía. La función renal estimada al inicio del estudio fue normal o levemente alterada (eGFR ≥60 ml/min/1,73 m2) en el 96 %.
La Tabla 1 muestra las reacciones adversas, excluyendo la hipoglucemia, que ocurrieron en ≥5 % de los pacientes adultos tratados con TRULICITY y con mayor frecuencia que con placebo en un conjunto de ensayos controlados con placebo.
|
a Incluye diarrea, aumento del volumen fecal, deposiciones frecuentes. |
|||
|
b Incluye arcadas, vómitos, vómitos en proyectil. |
|||
|
c Incluye molestias abdominales, dolor abdominal, dolor abdominal inferior, dolor abdominal superior, sensibilidad abdominal, dolor gastrointestinal. |
|||
|
d Incluye fatiga, astenia, malestar general. |
|||
|
Nota: Los porcentajes reflejan el número de pacientes que informaron al menos 1 aparición de la reacción adversa emergente del tratamiento. |
|||
| Reacción adversa | Placebo (N=568) % |
TRULICITY 0.75 mg (N=836) % |
TRULICITY 1.5 mg (N=834) % |
| Náuseas | 5.3 | 12.4 | 21.1 |
| Diarreaa | 6.7 | 8.9 | 12.6 |
| Vómitosb | 2.3 | 6.0 | 12.7 |
| Dolor abdominalc | 4.9 | 6.5 | 9.4 |
| Disminución del apetito | 1.6 | 4.9 | 8.6 |
| Dispepsia | 2.3 | 4.1 | 5.8 |
| Fatigad | 2.6 | 4.2 | 5.6 |
Reacciones Adversas Gastrointestinales
En el conjunto de ensayos controlados con placebo, las reacciones adversas gastrointestinales (GI) ocurrieron con mayor frecuencia entre los pacientes que recibieron TRULICITY en comparación con los pacientes que recibieron placebo (placebo 21%, 0.75 mg 32%, 1.5 mg 41%). Un mayor porcentaje de pacientes que recibieron TRULICITY 0.75 mg (1.3%) y TRULICITY 1.5 mg (3.5%) interrumpieron el tratamiento debido a reacciones adversas gastrointestinales que los pacientes que recibieron placebo (0.2%). Los investigadores calificaron la gravedad de las reacciones adversas gastrointestinales que ocurrieron en aquellos tratados con 0.75 mg y 1.5 mg de TRULICITY como “leves” en el 58% y 48% de los casos, respectivamente, “moderadas” en el 35% y 42% de los casos, respectivamente, o “graves” en el 7% y 11% de los casos, respectivamente.
Las siguientes reacciones adversas gastrointestinales se reportaron con mayor frecuencia en pacientes tratados con TRULICITY que en pacientes tratados con placebo (frecuencias listadas, respectivamente, como: placebo; 0.75 mg; 1.5 mg): estreñimiento (0.7%, 3.9%, 3.7%), flatulencia (1.4%, 1.4%, 3.4%), distensión abdominal (0.7%, 2.9%, 2.3%), enfermedad por reflujo gastroesofágico (0.5%, 1.7%, 2.0%) y eructos (0.2%, 0.6%, 1.6%).
Ensayo de Rango de Dosis en Adultos para Dosis de TRULICITY de 3 mg y 4.5 mg
Tabla 2 muestra las reacciones adversas que ocurrieron ≥5% en cualquiera de los grupos de tratamiento durante 36 semanas en un ensayo clínico con 1842 pacientes adultos con diabetes mellitus tipo 2 tratados con TRULICITY 1.5 mg, 3 mg o 4.5 mg por vía subcutánea una vez por semana como complemento a la metformina [ver Estudios Clínicos (14.3)]. El perfil de reacciones adversas es consistente con ensayos clínicos previos en adultos.
|
a Los porcentajes reflejan el número de pacientes que reportaron al menos 1 ocurrencia emergente del tratamiento de la reacción adversa. |
|||
| Reacción Adversa | TRULICITY 1.5 mg (N=612) % |
TRULICITY 3 mg (N=616) % |
TRULICITY 4.5 mg (N=614) % |
| Náuseas | 13.4 | 15.6 | 16.4 |
| Diarrea | 7.0 | 11.4 | 10.7 |
| Vómitos | 5.6 | 8.3 | 9.3 |
| Dispepsia | 2.8 | 5.0 | 2.6 |
Otras Reacciones Adversas en Adultos
Hipoglucemia
Tabla 3 resume la incidencia de hipoglucemia en los estudios clínicos controlados con placebo en pacientes adultos con diabetes mellitus tipo 2: episodios con un nivel de glucosa <54 mg/dL con o sin síntomas, e hipoglucemia grave, definida como un episodio que requiere la asistencia de otra persona para administrar activamente carbohidratos, glucagón u otras acciones de reanimación.
| Placebo | TRULICITY 0.75 mg | TRULICITY 1.5 mg | |
| Adición a Metformin | |||
| (26 semanas) | N=177 | N=302 | N=304 |
| Hipoglucemia con un nivel de glucosa <54 mg/dL | 0 | 0.3 | 0.7 |
| Hipoglucemia grave | 0 | 0 | 0 |
| Adición a Metformin + Pioglitazone | |||
| (26 semanas) | N=141 | N=280 | N=279 |
| Hipoglucemia con un nivel de glucosa <54 mg/dL | 1.4 | 2.1 | 0 |
| Hipoglucemia grave | 0 | 0 | 0 |
| Adición a Glimepiride | |||
| (24 semanas) | N=60 | – | N=239 |
| Hipoglucemia con un nivel de glucosa <54 mg/dL | 0 | – | 3.3 |
| Hipoglucemia grave | 0 | – | 0 |
| En Combinación con Insulina Glargine ± Metformin | |||
| (28 semanas) | N=150 | – | N=150 |
| Hipoglucemia con un nivel de glucosa <54 mg/dL | 9.3 | – | 14.7 |
| Hipoglucemia grave | 0 | – | 0.7 |
| Adición a SGLT2i ± Metformin | |||
| (24 semanas) | N=140 | N=141 | N=142 |
| Hipoglucemia con un nivel de glucosa <54 mg/dL | 0.7 | 0.7 | 0.7 |
| Hipoglucemia grave | 0 | 0.7 | 0 |
La hipoglucemia fue más frecuente cuando TRULICITY se usó en combinación con una sulfonilurea o insulina que cuando se usó con no secretagogos. En un ensayo clínico en adultos de 78 semanas, la hipoglucemia (nivel de glucosa <54 mg/dL) ocurrió en el 20% y el 21% de los pacientes cuando TRULICITY 0.75 mg y 1.5 mg, respectivamente, se coadministraron con una sulfonilurea. La hipoglucemia grave ocurrió en el 0% y el 0.7% de los pacientes cuando TRULICITY 0.75 mg y 1.5 mg, respectivamente, se coadministraron con una sulfonilurea. En un ensayo clínico en adultos de 52 semanas, la hipoglucemia (nivel de glucosa <54 mg/dL) ocurrió en el 77% y el 69% de los pacientes cuando TRULICITY 0.75 mg y 1.5 mg, respectivamente, se coadministraron con insulina prandial. La hipoglucemia grave ocurrió en el 2.7% y el 3.4% de los pacientes cuando TRULICITY 0.75 mg y 1.5 mg, respectivamente, se coadministraron con insulina prandial. Consulte Tabla 3 para la incidencia de hipoglucemia en pacientes tratados en combinación con insulina glargina basal.
En el ensayo clínico con pacientes adultos con TRULICITY 1.5 mg, TRULICITY 3 mg o TRULICITY 4.5 mg una vez por semana, como adyuvante a la metformina, las incidencias de hipoglucemia (nivel de glucosa <54 mg/dL) hasta las 36 semanas fueron del 1.1%, el 0.3% y el 1.1%, respectivamente, y las incidencias de hipoglucemia grave fueron del 0.2%, el 0% y el 0.2%, respectivamente.
Colelitiasis y Colecistitis
En un ensayo de resultados cardiovasculares en pacientes adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular (CV) establecida o múltiples factores de riesgo cardiovascular con un seguimiento mediano de 5.4 años [ver Estudios Clínicos 14.5], la colelitiasis se produjo a una tasa de 0.62/100 pacientes-años en pacientes tratados con TRULICITY y de 0.56/100 pacientes-años en pacientes tratados con placebo después de ajustar por colecistectomía previa. Se notificaron eventos graves de colecistitis aguda en el 0.5% y el 0.3% de los pacientes con TRULICITY y placebo, respectivamente.
Aumento de la Frecuencia Cardíaca y Reacciones Adversas Relacionadas con la Taquicardia
En pacientes adultos, TRULICITY 0.75 mg y 1.5 mg resultaron en un aumento medio de la frecuencia cardíaca (FC) de 2 – 4 latidos por minuto (lpm).
Se notificaron reacciones adversas de taquicardia sinusal con más frecuencia en pacientes expuestos a TRULICITY. La taquicardia sinusal se notificó en el 3.0%, el 2.8% y el 5.6% de los pacientes tratados con placebo, TRULICITY 0.75 mg y TRULICITY 1.5 mg, respectivamente. La persistencia de taquicardia sinusal (notificada en más de 2 visitas) se notificó en el 0.2%, el 0.4% y el 1.6% de los pacientes tratados con placebo, TRULICITY 0.75 mg y TRULICITY 1.5 mg, respectivamente. Los episodios de taquicardia sinusal, asociados con un aumento concomitante desde la línea de base en la frecuencia cardíaca de ≥15 latidos por minuto, se notificaron en el 0.7%, el 1.3% y el 2.2% de los pacientes tratados con placebo, TRULICITY 0.75 mg y TRULICITY 1.5 mg, respectivamente.
Hipersensibilidad
En estudios clínicos, se produjeron reacciones adversas de hipersensibilidad sistémica, a veces graves (por ejemplo, urticaria grave, erupción cutánea sistémica, edema facial, hinchazón de los labios), en el 0.5% de los pacientes adultos con TRULICITY.
Reacciones en el Sitio de Inyección
En los estudios controlados con placebo en adultos, se notificaron reacciones en el sitio de inyección (por ejemplo, erupción en el sitio de inyección, eritema) en el 0.5% de los pacientes tratados con TRULICITY y en el 0.0% de los pacientes tratados con placebo.
Prolongación del Intervalo PR y Reacciones Adversas de Bloqueo AV de Primer Grado
Se observó un aumento medio desde la línea de base en el intervalo PR de 2 – 3 milisegundos en pacientes adultos tratados con TRULICITY, en contraste con un disminución media de 0.9 milisegundos en pacientes tratados con placebo. La reacción adversa de bloqueo AV de primer grado ocurrió con más frecuencia en pacientes tratados con TRULICITY que en los tratados con placebo (0.9%, 1.7% y 2.3% para placebo, TRULICITY 0.75 mg y TRULICITY 1.5 mg, respectivamente). En los electrocardiogramas, un aumento del intervalo PR a al menos 220 milisegundos se observó en el 0.7%, el 2.5% y el 3.2% de los pacientes tratados con placebo, TRULICITY 0.75 mg y TRULICITY 1.5 mg, respectivamente.
Reacciones Adversas en el Ensayo Clínico de Pacientes Pediátricos de 10 Años o Más con Diabetes Mellitus Tipo 2
TRULICITY se administró a 150 pacientes pediátricos de 10 años o más con diabetes mellitus tipo 2 durante una duración media de 41.3 semanas [ver Estudios Clínicos (14.6)]. La edad media fue de 14.5 años y el 71% de los pacientes eran mujeres. En general, el 55% eran blancos, el 15% eran negros o afroamericanos, el 12% eran asiáticos, el 10% eran indígenas americanos o nativos de Alaska, el 5% eran de otras razas y el 3% tenían raza desconocida. Además, el 55% eran hispanos o latinos, el 42% no eran hispanos o latinos y el 3% tenían etnia desconocida. Al inicio, la duración media de la diabetes mellitus tipo 2 era de 2 años, la HbA1c media era del 8.1%, el peso medio era de 90.5 kg y el IMC medio era de 34.1 kg/m2.
El perfil de seguridad en pacientes pediátricos tratados con TRULICITY 0.75 mg y 1.5 mg por vía subcutánea una vez por semana fue consistente con el descrito anteriormente para pacientes adultos con diabetes mellitus tipo 2, con la excepción de las reacciones en el sitio de inyección. En pacientes pediátricos, la incidencia de reacciones en el sitio de inyección fue del 3.9% (2 pacientes) en el grupo de TRULICITY 0.75 mg, del 3.8% (2 pacientes) en el grupo de TRULICITY 1.5 mg y del 2.0% (1 paciente) en el grupo de placebo.
6.2 Experiencia Poscomercialización
Las siguientes reacciones adversas adicionales se han reportado durante el uso poscomercialización de TRULICITY. Debido a que estos eventos se reportan voluntariamente de una población de tamaño incierto, generalmente no es posible estimar de forma fiable su frecuencia o establecer una relación causal con la exposición al fármaco.
- Gastrointestinales: íleo
- Hepatobiliares: colecistitis, colelitiasis que requiere colecistectomía, colestasis, elevación de las enzimas hepáticas, hepatitis
- Hipersensibilidad: reacciones anafilácticas, angioedema
- Trastornos del Sistema Nervioso: disgeusia
- Pulmonares: Se ha producido aspiración pulmonar en pacientes que reciben agonistas del receptor de GLP-1 sometidos a cirugías o procedimientos electivos que requieren anestesia general o sedación profunda.
- Renales: insuficiencia renal aguda o empeoramiento de la insuficiencia renal crónica, que a veces requiere hemodiálisis
7 INTERACCIONES MEDICAMENTOSAS
7.1 Medicamentos Orales
TRULICITY retarda el vaciado gástrico y, por lo tanto, tiene el potencial de reducir la velocidad de absorción de los medicamentos orales administrados concomitantemente. El retraso en el vaciado gástrico es dependiente de la dosis, pero se atenúa con la escalada de dosis recomendada a dosis más altas de TRULICITY [ver Dosis y Administración (2.1)]. El retraso es mayor después de la primera dosis y disminuye con las dosis subsiguientes. En estudios de farmacología clínica, TRULICITY 1.5 mg no afectó la absorción de los medicamentos administrados por vía oral a un grado clínicamente relevante [ver Farmacología Clínica (12.3)]. Existe experiencia limitada con el uso de medicamentos concomitantes en ensayos clínicos con dosis de TRULICITY de 3 mg y 4.5 mg.
Monitorizar los niveles de medicamentos orales con un índice terapéutico estrecho (p. ej., warfarina) cuando se administran concomitantemente con TRULICITY.
7.2 Uso concomitante con un secretagogo de insulina (p. ej., sulfonilurea) o con insulina
Al iniciar TRULICITY, considere reducir la dosis de secretagogos de insulina administrados concomitantemente (como las sulfonilureas) o la insulina para reducir el riesgo de hipoglucemia [ver Advertencias y precauciones (5.3) y Reacciones adversas (6.1)].
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de riesgo
Los datos limitados con TRULICITY en mujeres embarazadas no son suficientes para determinar un riesgo asociado al fármaco para defectos congénitos importantes y aborto espontáneo. Existen consideraciones clínicas con respecto a los riesgos de la diabetes mal controlada en el embarazo [ver Consideraciones clínicas]. Basándose en estudios de reproducción animal, puede haber riesgos para el feto por la exposición a dulaglutida durante el embarazo. TRULICITY solo debe usarse durante el embarazo si el beneficio potencial justifica el riesgo potencial para el feto.
En ratas embarazadas a las que se administró dulaglutida durante la organogénesis, se produjeron muertes embrionarias tempranas, reducciones del crecimiento fetal y anomalías fetales a exposiciones sistémicas al menos 6 veces superiores a la exposición humana a la dosis máxima recomendada para humanos (MRHD) de 4,5 mg/semana. En conejas embarazadas a las que se administró dulaglutida durante la organogénesis, se produjeron anomalías fetales importantes a 5 veces la exposición humana a la MRHD. Los efectos adversos embrio/fetales en animales se produjeron en asociación con la disminución del peso materno y el consumo de alimentos atribuidos a la farmacología de la dulaglutida [ver Datos].
El riesgo de fondo estimado de defectos congénitos importantes es del 6–10% en mujeres con diabetes pregestacional con una HbA1c >7% y se ha informado que es tan alto como del 20–25% en mujeres con una HbA1c >10%. Se desconoce el riesgo de fondo estimado de aborto espontáneo para la población indicada. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2–4% y del 15–20%, respectivamente.
Consideraciones clínicas
Riesgo materno y/o embrio/fetal asociado a la enfermedad
La diabetes mal controlada en el embarazo aumenta el riesgo materno de cetoacidosis diabética, preeclampsia, abortos espontáneos, parto prematuro y complicaciones del parto. La diabetes mal controlada aumenta el riesgo fetal de defectos congénitos importantes, muerte fetal y morbilidad relacionada con la macrosomía.
Datos
Datos en animales
Las ratas embarazadas que recibieron dosis subcutáneas de 0,49, 1,63 o 4,89 mg/kg de dulaglutida cada 3 días durante la organogénesis tuvieron exposiciones sistémicas 2, 6 y 18 veces superiores a la exposición humana a la dosis máxima recomendada para humanos (MRHD) de 4,5 mg/semana, respectivamente, según la comparación del área bajo la curva de concentración-tiempo (AUC) en plasma. Se observaron pesos fetales reducidos asociados con la disminución de la ingesta de alimentos maternos y la disminución del aumento de peso atribuidos a la farmacología de la dulaglutida a ≥1,63 mg/kg. También se observaron osificaciones esqueléticas irregulares y aumentos en la pérdida postimplantacional a 4,89 mg/kg.
En conejas embarazadas que recibieron dosis subcutáneas de 0,04, 0,12 o 0,41 mg/kg de dulaglutida cada 3 días durante la organogénesis, las exposiciones sistémicas en conejas embarazadas fueron 0,5, 2 y 5 veces la exposición humana a la MRHD, según la comparación del AUC en plasma. Se observaron malformaciones viscerales fetales de agenesia lobular pulmonar y malformaciones esqueléticas de las vértebras y/o costillas junto con la disminución de la ingesta de alimentos maternos y la disminución del aumento de peso atribuidos a la farmacología de la dulaglutida a 0,41 mg/kg.
En un estudio prenatal-posnatal en ratas madres F0 que recibieron dosis subcutáneas de 0,2, 0,49 o 1,63 mg/kg cada tres días desde la implantación hasta la lactancia, las exposiciones sistémicas en ratas embarazadas fueron 1, 2 y 7 veces la exposición humana a la MRHD, según la comparación del AUC en plasma. Las crías F1 de las ratas madres F0 que recibieron 1,63 mg/kg de dulaglutida tuvieron un peso corporal medio estadísticamente significativamente menor desde el nacimiento hasta el día posnatal 63 para los machos y el día posnatal 84 para las hembras. La descendencia F1 de las ratas madres F0 que recibieron 1,63 mg/kg de dulaglutida tuvo una disminución de la fuerza de agarre de las extremidades anteriores y posteriores, y los machos tuvieron una separación balano-prepucial retrasada. Las hembras tuvieron una disminución de la respuesta de sobresalto. Estos hallazgos físicos pueden estar relacionados con el tamaño reducido de la descendencia en relación con los controles, ya que aparecieron en las evaluaciones posnatales tempranas, pero no se observaron en una evaluación posterior. La descendencia femenina F1 de las ratas madres F0 que recibieron 1,63 mg/kg de dulaglutida tuvo un tiempo medio de escape más largo y un número medio de errores mayor en relación con el control concurrente durante 1 de 2 ensayos en la parte de evaluación de la memoria del laberinto acuático de Biel. Estos hallazgos se produjeron junto con la disminución de la ingesta de alimentos maternos F0 y la disminución del aumento de peso atribuidos a la actividad farmacológica a 1,63 mg/kg. Se desconoce la relevancia humana de estos déficits de memoria en las ratas hembras F1.
8.2 Lactancia
Resumen de riesgo
No hay datos sobre la presencia de dulaglutida en la leche materna, los efectos en el lactante o los efectos sobre la producción de leche. No se determinó la presencia de dulaglutida en la leche de animales lactantes tratados. Deben considerarse los beneficios para el desarrollo y la salud de la lactancia materna junto con la necesidad clínica de la madre de TRULICITY y cualquier posible efecto adverso en el lactante amamantado por TRULICITY o por la afección materna subyacente.
8.4 Uso en pediatría
Se ha establecido la seguridad y eficacia de TRULICITY como complemento de la dieta y el ejercicio para mejorar el control glucémico en pacientes pediátricos de 10 años o más con diabetes mellitus tipo 2. El uso de TRULICITY para esta indicación se basa en un ensayo multicéntrico, aleatorizado, doble ciego, de brazos paralelos y controlado con placebo de 26 semanas de duración realizado en 154 pacientes pediátricos de 10 años o más con diabetes mellitus tipo 2 [véase Estudios clínicos (14.6)].
Los pacientes pediátricos tratados con TRULICITY informaron una mayor incidencia de reacciones relacionadas con el sitio de inyección en comparación con los adultos tratados con TRULICITY [véase Reacciones adversas (6.1)].
No se ha establecido la seguridad y eficacia de TRULICITY en pacientes pediátricos menores de 10 años.
8.5 Uso en geriatría
En los ensayos de control glucémico en adultos [véase Estudios clínicos (14.2, 14.3)], 620 (19%) de los pacientes tratados con TRULICITY tenían 65 años o más y 65 (2%) de los pacientes tratados con TRULICITY tenían 75 años o más al inicio del estudio. En el brazo de tratamiento con TRULICITY 1,5 mg del ensayo REWIND (ensayo de resultados cardiovasculares en adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular o múltiples factores de riesgo cardiovascular) [véase Estudios clínicos (14.5)], 2619 (53%) pacientes tenían 65 años o más, y 484 (10%) pacientes tenían 75 años o más al inicio del estudio.
No se han observado diferencias generales en la seguridad o eficacia de TRULICITY entre los pacientes de 65 años o más y los pacientes adultos más jóvenes.
8.6 Insuficiencia renal
TRULICITY se ha estudiado en pacientes con diversos grados de función renal, incluido un ensayo clínico específico en pacientes con enfermedad renal crónica moderada a grave. En estos estudios no se observaron diferencias generales en la seguridad o eficacia según la función renal [véase Estudios clínicos (14.2, 14.3, 14.4)].
En un estudio de farmacología clínica en pacientes con insuficiencia renal, incluida la enfermedad renal terminal (ERT), no se observó ningún cambio clínicamente relevante en la farmacocinética (FC) de dulaglutida. En el ensayo de 52 semanas en pacientes con diabetes tipo 2 e insuficiencia renal moderada a grave, el comportamiento farmacocinético de TRULICITY 0,75 mg y 1,5 mg una vez por semana fue similar al demostrado en estudios clínicos previos [véase Farmacología clínica (12.3)].
No se recomienda ningún ajuste de dosis en pacientes con insuficiencia renal, incluida la enfermedad renal terminal (ERT). Controlar la función renal en pacientes con insuficiencia renal que presenten reacciones gastrointestinales adversas graves. Usar TRULICITY con precaución en pacientes con ERT [véase Advertencias y precauciones (5.5), Farmacología clínica (12.3)].
8.7 Insuficiencia hepática
En un estudio de farmacología clínica en pacientes con diversos grados de insuficiencia hepática, no se observó ningún cambio clínicamente relevante en la FC de dulaglutida [véase Farmacología clínica (12.3)]. Sin embargo, la experiencia clínica en pacientes con insuficiencia hepática leve, moderada o grave es limitada; por lo tanto, usar TRULICITY con precaución en estas poblaciones de pacientes.
8.8 Gastroparesia
La dulaglutida retarda el vaciado gástrico. TRULICITY no se ha estudiado en pacientes con gastroparesia preexistente. Usar TRULICITY con precaución en pacientes con gastroparesia.
10 SOBREDOSIS
Se han notificado sobredosis en estudios clínicos. Los efectos asociados con estas sobredosis fueron principalmente eventos gastrointestinales leves o moderados (p. ej., náuseas, vómitos) e hipoglucemia no grave. En caso de sobredosis, se debe iniciar el tratamiento de soporte adecuado (incluido el control frecuente de la glucosa plasmática) de acuerdo con los signos y síntomas clínicos del paciente.
11 DESCRIPCIÓN
El dulaglutida es un agonista del receptor del péptido similar al glucagón-1 humano (GLP-1). La molécula es una proteína de fusión que consiste en 2 cadenas idénticas unidas por puentes disulfuro, cada una de las cuales contiene una secuencia análoga de GLP-1 N-terminal unida covalentemente a la porción Fc de una cadena pesada de inmunoglobulina G4 (IgG4) humana modificada mediante un pequeño enlace peptídico y se produce utilizando un cultivo de células de mamíferos (ovario de hámster chino). La porción análoga de GLP-1 del dulaglutida tiene un 90 % de homología con el GLP-1 (7-37) humano nativo. Se introdujeron modificaciones estructurales en la parte de la molécula GLP-1 responsable de la interacción con la enzima dipeptidil peptidasa-IV (DPP-4). Se realizaron modificaciones adicionales en un área con un epítopo de células T potencial y en las áreas de la parte Fc de IgG4 de la molécula responsables de la unión a los receptores Fc de alta afinidad y la formación de media anticuerpo. El peso molecular total del dulaglutida es de aproximadamente 63 kilodaltons.
La inyección TRULICITY (dulaglutida) es una solución transparente, incolora, estéril y sin conservantes para uso subcutáneo. Cada pluma de dosis única contiene una solución de 0,5 ml de 0,75 mg, 1,5 mg, 3 mg o 4,5 mg de dulaglutida y los siguientes excipientes: ácido cítrico anhidro (0,07 mg), manitol (23,2 mg), polisorbato 80 (0,10 mg para 0,75 mg y 1,5 mg; 0,125 mg para 3 mg y 4,5 mg) y citrato trisódico dihidrato (1,37 mg), en agua para inyección.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
TRULICITY contiene dulaglutida, que es un agonista del receptor de GLP-1 humano con un 90% de homología de secuencia de aminoácidos con el GLP-1 humano endógeno (7-37). La dulaglutida activa el receptor de GLP-1, un receptor de la superficie celular unido a la membrana acoplado a la adenilil ciclasa en las células beta pancreáticas. La dulaglutida aumenta el AMP cíclico intracelular (AMPc) en las células beta, lo que lleva a la liberación de insulina dependiente de la glucosa. La dulaglutida también disminuye la secreción de glucagón y retrasa el vaciado gástrico.
12.2 Farmacodinamia
TRULICITY reduce la glucosa en ayunas y las concentraciones de glucosa posprandial (GPP) en pacientes con diabetes mellitus tipo 2. La reducción de la glucosa en ayunas y posprandial se puede observar después de una sola dosis.
Glucosa en ayunas y posprandial
En un estudio de farmacología clínica en pacientes con diabetes mellitus tipo 2, el tratamiento con TRULICITY una vez por semana resultó en una reducción de las concentraciones de glucosa en ayunas y GPP a las 2 horas, y el AUC incremental de la glucosa sérica posprandial, en comparación con el placebo (-25.6 mg/dL, -59.5 mg/dL y -197 mg*h/dL, respectivamente); estos efectos se mantuvieron después de 6 semanas de dosificación con la dosis de 1.5 mg.
Secreción de insulina de primera y segunda fase
Tanto la secreción de insulina de primera como de segunda fase aumentaron en pacientes con diabetes tipo 2 tratados con TRULICITY en comparación con placebo.
Secreción de insulina y glucagón
TRULICITY estimula la secreción de insulina dependiente de la glucosa y reduce la secreción de glucagón. El tratamiento con TRULICITY 0.75 mg y 1.5 mg una vez por semana aumentó la insulina en ayunas desde el valor inicial en la semana 26 en 35.38 y 17.50 pmol/L, respectivamente, y la concentración de péptido C en 0.09 y 0.07 nmol/L, respectivamente, en un ensayo de monoterapia. En el mismo ensayo, la concentración de glucagón en ayunas se redujo en 1.71 y 2.05 pmol/L desde el valor inicial con TRULICITY 0.75 mg y 1.5 mg, respectivamente.
12.3 Farmacocinética
La farmacocinética de la dulaglutida es similar entre los sujetos sanos y los pacientes con diabetes mellitus tipo 2. Después de la administración subcutánea, el tiempo hasta la concentración plasmática máxima de dulaglutida en estado estacionario varía de 24 a 72 horas, con una mediana de 48 horas. Después de alcanzar el estado estacionario, la relación de acumulación fue de aproximadamente 1.56. Las concentraciones plasmáticas de dulaglutida en estado estacionario se alcanzaron entre 2 y 4 semanas después de la administración una vez por semana. El lugar de administración subcutánea (abdomen, parte superior del brazo y muslo) no tuvo un efecto estadísticamente significativo sobre la exposición a la dulaglutida.
Absorción: la biodisponibilidad absoluta media de la dulaglutida después de la administración subcutánea de dosis únicas de 0.75 mg y 1.5 mg fue del 65% y el 47%, respectivamente. Se estimó que la biodisponibilidad subcutánea absoluta para las dosis de 3 mg y 4.5 mg era similar a la de 1.5 mg, aunque esto no se ha estudiado específicamente. Las concentraciones de dulaglutida aumentaron aproximadamente de forma proporcional a la dosis de 0.75 mg a 4.5 mg.
Distribución: el volumen de distribución central medio aparente de la población fue de 3.09 L y el volumen de distribución periférico medio aparente de la población fue de 5.98 L.
Eliminación
La depuración media aparente de la población de dulaglutida fue de 0.142 L/h. La vida media de eliminación de la dulaglutida fue de aproximadamente 5 días.
Metabolismo: se presume que la dulaglutida se degrada en sus aminoácidos componentes mediante las vías generales del catabolismo de las proteínas.
Poblaciones específicas
Los factores intrínsecos de edad (≥ 65 años), sexo, raza, etnia, peso corporal o insuficiencia renal o hepática no tuvieron un efecto clínicamente relevante sobre la farmacocinética de la dulaglutida, como se muestra en la Figura 1.
Abreviaturas: AUC = área bajo la curva de tiempo-concentración; IC = intervalo de confianza; Cmáx = concentración máxima; IRT = insuficiencia renal terminal; FC = farmacocinética.
Nota: Los valores de referencia para las comparaciones de peso, edad, sexo y raza son 93 kg, 56 años, hombre y blanco, respectivamente; los grupos de referencia para los datos de insuficiencia renal y hepática son sujetos con función renal y hepática normal de los respectivos estudios de farmacología clínica. Los valores de peso que se muestran en el gráfico (70 y 120 kg) son los percentiles 10o y 90o del peso en la población farmacocinética.
Figura 1: Impacto de los factores intrínsecos en la farmacocinética de la dulaglutida.
Pacientes pediátricos
Se realizó un análisis farmacocinético poblacional para dulaglutida 0,75 mg y 1,5 mg utilizando datos de 128 pacientes pediátricos de 10 años de edad y mayores con diabetes mellitus tipo 2. El AUC en pacientes pediátricos fue aproximadamente un 37% menor que en pacientes adultos. Sin embargo, no se determinó que esta diferencia fuera clínicamente significativa.
Pacientes con insuficiencia renal
La exposición sistémica a dulaglutida aumentó en un 20, 28, 14 y 12% para los subgrupos de insuficiencia renal leve, moderada, grave y ESRD, respectivamente, en comparación con los sujetos con función renal normal. Los valores correspondientes para el aumento de la Cmax fueron del 13, 23, 20 y 11%, respectivamente (Figura 1). Además, en un ensayo clínico de 52 semanas en pacientes con diabetes mellitus tipo 2 e insuficiencia renal moderada a grave, el comportamiento farmacocinético de TRULICITY 0,75 mg y 1,5 mg una vez por semana fue similar al demostrado en estudios clínicos previos [ver Advertencias y precauciones (5.5), Uso en poblaciones específicas (8.6)].
Pacientes con insuficiencia hepática
La exposición sistémica a dulaglutida disminuyó en un 23, 33 y 21% para los grupos con insuficiencia hepática leve, moderada y grave, respectivamente, en comparación con los sujetos con función hepática normal, y la Cmax disminuyó en una magnitud similar (Figura 1) [ver Uso en poblaciones específicas (8.7)].
Estudios de interacción farmacológica
El efecto potencial de los medicamentos coadministrados sobre la farmacocinética de dulaglutida 1,5 mg y viceversa se estudió en varios estudios de dosis única y múltiple en sujetos sanos, pacientes con diabetes mellitus tipo 2 y pacientes con hipertensión.
Potencial de dulaglutida para influir en la farmacocinética de otros fármacos
Dulaglutida retrasa el vaciamiento gástrico y, como resultado, puede reducir el grado y la velocidad de absorción de los medicamentos administrados por vía oral de forma conjunta. En estudios de farmacología clínica, dulaglutida a una dosis de 1,5 mg no afectó la absorción de los medicamentos orales probados en ningún grado clínicamente relevante. El retraso en el vaciamiento gástrico depende de la dosis, pero se atenúa con el aumento de dosis recomendado a dosis más altas de TRULICITY [ver Dosis y administración (2.1), Interacciones farmacológicas (7.1)]. El retraso es mayor después de la primera dosis y disminuye con las dosis posteriores. Las medidas farmacocinéticas que indican la magnitud de estas interacciones se presentan en la Figura 2.
Abreviaturas: AUC = área bajo la curva de tiempo-concentración; IC = intervalo de confianza; Cmax = concentración máxima; PK = farmacocinética.
Nota: El grupo de referencia es la medicación coadministrada sola.
Figura 2: Impacto de dulaglutida 1,5 mg en la farmacocinética de los medicamentos coadministrados.
Potencial de los fármacos coadministrados para influir en la farmacocinética de dulaglutida
En un estudio de farmacología clínica, la coadministración de una dosis única de 1,5 mg de dulaglutida con una dosis de 100 mg de sitagliptina en estado estacionario causó un aumento en el AUC y la Cmax de dulaglutida de aproximadamente 38% y 27%, lo que no se considera clínicamente relevante.
12.6 Inmunogenicidad
La incidencia observada de anticuerpos contra el fármaco depende en gran medida de la sensibilidad y la especificidad del ensayo. Las diferencias en los métodos de ensayo impiden comparaciones significativas de la incidencia de anticuerpos contra el fármaco en los estudios descritos a continuación con la incidencia de anticuerpos contra el fármaco en otros estudios.
En ensayos de control glucémico en adultos con diabetes mellitus tipo 2 (monoterapia y terapia combinada) [ver Estudios clínicos (14.2, 14.3)], durante un período de tratamiento que oscila entre 24 y 104 semanas, 64/3907 (1,6%) de los pacientes tratados con TRULICITY desarrollaron anticuerpos anti-dulaglutida (denominados anticuerpos contra el fármaco (ADA)). De los 64 pacientes tratados con TRULICITY que desarrollaron ADA, 34 pacientes (0,9% de la población general) desarrollaron anticuerpos neutralizantes de dulaglutida y 36 pacientes (0,9% de la población general) desarrollaron anticuerpos contra el GLP-1 nativo. No se identificó ningún efecto clínicamente significativo de los ADA sobre la farmacocinética, la farmacodinamia, la seguridad o la eficacia de TRULICITY durante la duración del tratamiento de 24 a 104 semanas en los ensayos en adultos con diabetes mellitus tipo 2.
Durante el período controlado de 26 semanas del ensayo de control glucémico en pacientes pediátricos de 10 años de edad o mayores con diabetes mellitus tipo 2 [ver Estudios clínicos (14.6)], 4/101 (4%) de los pacientes pediátricos tratados con TRULICITY desarrollaron ADA. De los 4 pacientes pediátricos que desarrollaron ADA, 1 paciente (1% de la población general) desarrolló anticuerpos neutralizantes de dulaglutida y 3 pacientes (3% de la población general) desarrollaron anticuerpos contra el GLP-1 nativo. Durante el período de 52 semanas posteriores al inicio del mismo ensayo (a través del seguimiento de seguridad), 6/103 (6%) de los pacientes tratados con TRULICITY desarrollaron ADA. De los 6 pacientes que desarrollaron ADA, 1 paciente (1% de la población general) desarrolló anticuerpos neutralizantes de dulaglutida y 4 pacientes (4% de la población general) desarrollaron anticuerpos contra el GLP-1 nativo. Debido a la baja incidencia de ADA, se desconoce el efecto de estos anticuerpos sobre la farmacocinética, la farmacodinamia, la seguridad o la eficacia de TRULICITY en pacientes pediátricos.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogenicidad, Mutagénesis y Deterioro de la Fertilidad
Se realizó un estudio de carcinogenicidad de 2 años con dulaglutida en ratas macho y hembra a dosis de 0.05, 0.5, 1.5 y 5 mg/kg (0.2, 3, 8 y 24 veces la dosis máxima recomendada para humanos (MRHD) de 4.5 mg una vez por semana según el AUC) administrada por inyección subcutánea dos veces por semana. En ratas, la dulaglutida provocó un aumento relacionado con la dosis y la duración del tratamiento en la incidencia de tumores de células C tiroideas (adenomas y/o carcinomas) en comparación con los controles, a ≥3 veces la MRHD según el AUC. Se observó un aumento estadísticamente significativo en los adenomas de células C en ratas que recibieron dulaglutida a ≥0.5 mg/kg. Se produjeron aumentos numéricos en los carcinomas de células C tiroideas a 5 mg/kg (24 veces la MRHD según el AUC) y se consideraron relacionados con el tratamiento a pesar de la ausencia de significancia estadística.
Se realizó un estudio de carcinogenicidad de 6 meses con dulaglutida en ratones transgénicos rasH2 a dosis de 0.3, 1 y 3 mg/kg administradas por inyección subcutánea dos veces por semana. La dulaglutida no produjo un aumento en la incidencia de hiperplasia o neoplasia de células C tiroideas en ninguna dosis.
La dulaglutida es una proteína recombinante; no se han realizado estudios de genotoxicidad.
La relevancia para humanos de los tumores de células C tiroideas en ratas es desconocida y no pudo determinarse mediante estudios clínicos o no clínicos [ver Advertencia en recuadro y Advertencias y precauciones (5.1)].
En estudios de fertilidad y desarrollo embrionario temprano en ratas macho y hembra, no se observaron efectos adversos de la dulaglutida sobre la morfología del esperma, el apareamiento, la fertilidad, la concepción y la supervivencia embrionaria hasta 16.3 mg/kg (55 veces la MRHD según el AUC). En ratas hembra, se observó un aumento en el número de hembras con diestro prolongado y una disminución relacionada con la dosis en el número medio de cuerpos lúteos, sitios de implantación y embriones viables a ≥4.9 mg/kg (≥13 veces la MRHD según el AUC), lo que ocurrió en presencia de una disminución en el consumo de alimentos maternos y el aumento de peso corporal.
13.2 Toxicología y/o Farmacología Animal
Las ratas Zucker diabéticas obesas (ZDF) recibieron 0.5, 1.5 o 5 mg/kg/dos veces por semana de dulaglutida (1, 3 y 13 veces la MRHD según el AUC) durante 3 meses. Se observaron aumentos del 12% al 33% en la amilasa total y pancreática, pero no en la lipasa, en todas las dosis sin correlatos inflamatorios pancreáticos microscópicos en animales individuales. Otros cambios en los animales tratados con dulaglutida incluyeron un aumento del epitelio ductal interlobular sin proliferación activa de células ductales (≥0.5 mg/kg), un aumento de la atrofia acinar con/sin inflamación (≥1.5 mg/kg) y un aumento de la inflamación neutrofílica del páncreas acinar (5 mg/kg).
El tratamiento de monos durante 12 meses con 8.15 mg/kg/dos veces por semana de dulaglutida (casi 200 veces la MRHD según el AUC) no demostró evidencia de inflamación pancreática o neoplasia intraepitelial pancreática. En 4 de 19 monos tratados con dulaglutida, hubo un aumento en las células caliciformes dentro de los conductos pancreáticos, pero no hubo diferencias con respecto al grupo control en la amilasa o lipasa total al final del estudio. No hubo cambios proliferativos en las células C tiroideas.
14 ESTUDIOS CLÍNICOS
14.1 Resumen de los ensayos clínicos
TRULICITY se ha estudiado en adultos como monoterapia y en combinación con metformina, sulfonilurea, metformina y sulfonilurea, metformina y tiazolidinediona, inhibidores del cotransportador de sodio-glucosa 2 (SGLT2i) con o sin metformina, insulina basal con o sin metformina, e insulina prandial con o sin metformina. TRULICITY también se ha estudiado en pacientes con diabetes mellitus tipo 2 y deterioro renal moderado a grave.
Se realizó una escalada de dosis en un ensayo en adultos con dosis de TRULICITY de hasta 4,5 mg agregadas a la metformina. Todos los demás estudios clínicos en adultos evaluaron TRULICITY 0,75 mg y 1,5 mg sin escalada de dosis; los pacientes iniciaron y mantuvieron 0,75 mg o 1,5 mg durante la duración de los ensayos [ver Estudios clínicos (14.2, 14.3, 14.4)].
TRULICITY 0,75 mg y 1,5 mg se estudió en pacientes pediátricos de 10 años o más con diabetes tipo 2 en combinación con o sin tratamiento con metformina y/o insulina basal [ver Estudios clínicos (14.6)].
En pacientes con diabetes mellitus tipo 2, TRULICITY produjo reducciones desde el inicio en HbA1c en comparación con placebo. No se observaron diferencias generales en la eficacia glucémica entre los subgrupos demográficos (edad, sexo, raza/etnia, duración de la diabetes).
Se realizó un ensayo de resultados cardiovasculares en pacientes adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular (CV) establecida o múltiples factores de riesgo cardiovascular. Los pacientes fueron asignados aleatoriamente a TRULICITY 1,5 mg o placebo, ambos agregados al tratamiento estándar. TRULICITY redujo significativamente el riesgo de la primera aparición del criterio de valoración compuesto principal de muerte CV, IM no fatal o accidente cerebrovascular no fatal [ver Estudios clínicos (14.5)].
14.2 Ensayos de control glucémico en monoterapia en adultos con diabetes mellitus tipo 2
En un ensayo doble ciego con criterio de valoración principal a las 26 semanas, 807 pacientes adultos tratados inadecuadamente con dieta y ejercicio, o con dieta y ejercicio y un agente antidiabético usado a una dosis submáxima, fueron asignados aleatoriamente a TRULICITY 0,75 mg una vez por semana, TRULICITY 1,5 mg una vez por semana, o metformina 1500 a 2000 mg/día después de un período de lavado de dos semanas. El setenta y cinco por ciento (75%) de la población aleatorizada recibió tratamiento con un agente antidiabético en la visita de selección. La mayoría de los pacientes tratados previamente con un agente antidiabético recibieron metformina (~90%) a una dosis mediana de 1000 mg diarios y aproximadamente el 10% recibió una sulfonilurea.
Los pacientes tenían una edad media de 56 años y una duración media de la diabetes tipo 2 de 3 años. El cuarenta y cuatro por ciento eran hombres. La raza blanca, negra y asiática representó el 74%, el 7% y el 8% de la población, respectivamente. El veintinueve por ciento de la población del ensayo procedía de EE. UU.
El tratamiento con TRULICITY 0,75 mg y 1,5 mg una vez por semana produjo una reducción en HbA1c desde el inicio a las 26 semanas (Tabla 4). La diferencia en el tamaño del efecto observado entre TRULICITY 0,75 mg y 1,5 mg, respectivamente, y la metformina excluyó el margen de no inferioridad preespecificado del 0,4%.
|
Abreviatura: HbA1c = hemoglobina A1c. |
||||||||
|
a Población por intención de tratar. Se utilizó el último valor observado (LOCF) para imputar los datos faltantes. Los datos posteriores al inicio del tratamiento de rescate se tratan como faltantes. En la semana 26, la eficacia primaria faltaba para el 10%, el 12% y el 14% de las personas asignadas aleatoriamente a TRULICITY 0,75 mg, TRULICITY 1,5 mg y metformina, respectivamente. |
||||||||
|
b Media de mínimos cuadrados ajustada para el valor basal y otros factores de estratificación. |
||||||||
|
‡ Los pacientes incluidos en el análisis son un subconjunto de la población ITT que tuvo al menos una evaluación posterior al inicio del estudio. El análisis principal incluyó 265 individuos en cada uno de los brazos de tratamiento. |
||||||||
| Punto temporal principal de 26 semanas | ||||||||
| TRULICITY 0,75 mg | TRULICITY 1,5 mg | Metformina 1500-2000 mg |
||||||
| Población por intención de tratar (ITT) (N)‡ | 270 | 269 | 268 | |||||
| HbA1c (%) (Media) | ||||||||
| Basal | 7,6 | 7,6 | 7,6 | |||||
| Cambio desde el basalb | -0,7 | -0,8 | -0,6 | |||||
| Glucosa sérica en ayunas (mg/dL) (Media) | ||||||||
| Valor inicial | 161 | 164 | 161 |
| Cambio desde el valor inicialb | -26 | -29 | -24 |
| Peso Corporal (kg) (Media) | |||
| Valor inicial | 91.8 | 92.7 | 92.4 |
| Cambio desde el valor inicialb | -1.4 | -2.3 | -2.2 |
14.3 Ensayos de terapia combinada para el control glucémico en adultos con diabetes mellitus tipo 2
Ensayo controlado con Sitagliptina (como complemento a la Metformina)
En este ensayo doble ciego controlado con placebo con criterio principal de valoración a las 52 semanas, se asignaron al azar 972 pacientes adultos a placebo, TRULICITY 0,75 mg una vez por semana, TRULICITY 1,5 mg una vez por semana o sitagliptina 100 mg/día (después de 26 semanas, los pacientes del grupo de tratamiento con placebo recibieron sitagliptina 100 mg/día enmascarada durante el resto del ensayo), todo ello como complemento a la metformina. La asignación al azar se realizó después de un período de introducción de 11 semanas para permitir un período de titulación de la metformina, seguido de un período de estabilización glucémica de 6 semanas. Los pacientes tenían una edad media de 54 años; una duración media de la diabetes tipo 2 de 7 años; el 48% eran hombres; raza: blanca, negra y asiática fueron el 53%, el 4% y el 27%, respectivamente; y el 24% de la población del ensayo estaban en los EE. UU.
En el punto temporal de las 26 semanas controlado con placebo, el cambio de HbA1c fue del 0,1%, -1,0%, -1,2% y -0,6% para placebo, TRULICITY 0,75 mg, TRULICITY 1,5 mg y sitagliptina, respectivamente. El porcentaje de pacientes que lograron una HbA1c <7,0% fue del 22%, 56%, 62% y 39% para placebo, TRULICITY 0,75 mg, TRULICITY 1,5 mg y sitagliptina, respectivamente. A las 26 semanas, hubo una reducción de peso media de 1,4 kg, 2,7 kg, 3,0 kg y 1,4 kg para placebo, TRULICITY 0,75 mg, TRULICITY 1,5 mg y sitagliptina, respectivamente. Hubo una reducción media de la glucosa en ayunas de 9 mg/dL, 35 mg/dL, 41 mg/dL y 18 mg/dL para placebo, TRULICITY 0,75 mg, TRULICITY 1,5 mg y sitagliptina, respectivamente.
El tratamiento con TRULICITY 0,75 mg y 1,5 mg una vez por semana produjo una reducción estadísticamente significativa de la HbA1c en comparación con el placebo (a las 26 semanas) y en comparación con la sitagliptina (a las 26 y 52 semanas), todo ello en combinación con metformina (Tabla 5 y Figura 3).
|
Abreviaturas: HbA1c = hemoglobina A1c. |
|||
|
a Todos los pacientes con ITT asignados al azar después de la parte de búsqueda de dosis del ensayo. Se utilizó el último dato observado (LOCF) para imputar los datos que faltaban. En la semana 52, faltaba la eficacia primaria para el 15%, el 19% y el 20% de las personas asignadas al azar a TRULICITY 0,75 mg, TRULICITY 1,5 mg y sitagliptina, respectivamente. |
|||
|
b Media ajustada de mínimos cuadrados (LS) para el valor basal y otros factores de estratificación. |
|||
|
‡ Los pacientes incluidos en el análisis son un subconjunto de la población ITT que tuvo al menos una evaluación posterior a la basal. El análisis principal incluyó 276, 277 y 270 individuos asignados al azar a TRULICITY 0,75 mg, TRULICITY 1,5 mg y sitagliptina, respectivamente. |
|||
|
†† Valor p unilateral ajustado por multiplicidad <0,001, para la superioridad de TRULICITY en comparación con la sitagliptina, evaluado solo para HbA1c. |
|||
|
## p<0,001 TRULICITY en comparación con sitagliptina, evaluado solo para HbA1c <7,0%. |
|||
| Punto temporal principal de 52 semanas | |||
| TRULICITY 0,75 mg |
TRULICITY 1,5 mg |
Sitagliptina 100 mg |
|
| Población por intención de tratar (ITT) (N)‡ | 281 | 279 | 273 |
| HbA1c (%) (Media) | |||
| Basal | 8,2 | 8,1 | 8,0 |
| Cambio desde la línea de baseb | -0,9 | -1,1 | -0,4 |
| Diferencia con respecto a la sitagliptinab (IC del 95%) | -0,5 (-0,7, -0,3)†† | -0,7 (-0,9, -0,5)†† | – |
| Porcentaje de pacientes con HbA1c <7,0% | 49## | 59## | 33 |
| Glucosa plasmática en ayunas (mg/dL) (Media) | |||
| Valor inicial | 174 | 173 | 171 |
| Cambio desde el valor inicialb | -30 | -41 | -14 |
| Diferencia con sitagliptinab (IC del 95%) | -15 (-22, -9) | -27 (-33, -20) | – |
| Peso corporal (kg) (Media) | |||
| Valor inicial | 85.5 | 86.5 | 85.8 |
| Cambio desde el valor inicialb | -2.7 | -3.1 | -1.5 |
| Diferencia con sitagliptinab (IC del 95%) | -1.2 (-1.8, -0.6) | -1.5 (-2.1, -0.9) | – |
|
Media de HbA1c ajustada para la HbA1c basal y el país. |
|||
| Número de pacientes con datos observados | |||
| Placebo | 139 | 108 | |
| TRULICITY 0.75 mg | 281 | 258 | 238 |
| TRULICITY 1.5 mg | 279 | 249 | 225 |
| Sitagliptin | 273 | 241 | 219 |
Figura 3: Media ajustada de HbA1c en cada punto temporal (ITT, MMRM) y en la semana 52 (ITT, LOCF) en pacientes adultos con diabetes mellitus tipo 2
Ensayo de rango de dosis de TRULICITY 1,5, 3 mg y 4,5 mg (como complemento a la metformina)
En este ensayo doble ciego de brazos paralelos con criterio principal de valoración a las 36 semanas, se aleatorizó un total de 1842 pacientes adultos 1:1:1 a TRULICITY 1,5 mg, TRULICITY 3 mg o TRULICITY 4,5 mg una vez por semana, todos como complemento a la metformina (NCT03495102).
Después de la aleatorización, todos los pacientes recibieron TRULICITY 0,75 mg una vez por semana. La dosis se aumentó cada 4 semanas a la dosis superior siguiente hasta que los pacientes alcanzaron la dosis asignada (1,5 mg, 3 mg o 4,5 mg). Los pacientes debían permanecer con la dosis de estudio asignada durante la duración del ensayo.
Los pacientes tenían una edad media de 57,1 años; una duración media de la diabetes tipo 2 de 7,6 años; el 51,2% eran hombres; raza: blanca, negra y asiática fueron el 85,8%, el 4,5% y el 2,4%, respectivamente; y el 27,6% de la población del ensayo estaba en EE. UU.
A las 36 semanas, el tratamiento con TRULICITY 4,5 mg produjo una reducción estadísticamente significativa en la HbA1c y en el peso corporal en comparación con TRULICITY 1,5 mg (Tabla 6 y Figura 4).
|
Abreviaturas: HbA1c = hemoglobina A1c |
|||
|
a Población por intención de tratar. En la semana 36, faltaba la eficacia primaria para el 7%, el 7% y el 6% de las personas tratadas con TRULICITY 1,5 mg, TRULICITY 3 mg y TRULICITY 4,5 mg, respectivamente. |
|||
|
b Media de mínimos cuadrados ajustada para el valor basal y otros factores de estratificación. Los datos faltantes se imputaron utilizando la imputación múltiple. |
|||
|
c Los pacientes con datos de HbA1c faltantes en la semana 36 se consideraron como no alcanzando el objetivo de HbA1c. |
|||
|
^ p=0,0001 para la superioridad en comparación con TRULICITY 1,5 mg, error de tipo I general controlado. |
|||
|
^^ p<0,0001 para la superioridad en comparación con TRULICITY 1,5 mg, error de tipo I general controlado. |
|||
| Punto temporal principal de 36 semanas | |||
| TRULICITY 1,5 mg |
TRULICITY 3 mg |
TRULICITY 4,5 mg |
|
| Población por intención de tratar (ITT) (N) | 612 | 616 | 614 |
| HbA1c (%) (Media) | |||
| Basal | 8,6 | 8,6 | 8,6 |
| Cambio desde el valor basalb | -1,5 | -1,6 | -1,8 |
| Diferencia de 1,5 mgb (IC del 95%) | -0,1 (-0,2, 0,0) | -0,2 (-0,4, -0,1) ^ | |
| Porcentaje de pacientes con HbA1c <7,0% c |
50 | 56 | 62 |
| Glucosa sérica en ayunas (mg/dL) (Media) | |||
| Basal | 185 | 184 | 183 |
| Cambio desde el valor basalb | -45 | -46 | -51 |
| Diferencia de 1,5 mgb (IC del 95%) | – 2 (-7, 3) | -6 (-11, -2) | |
| Peso corporal (kg) (Media) | |||
| Basal | 95,5 | 96,3 | 95,4 |
| Cambio desde la línea basalb | -3.0 | -3.8 | -4.6 |
| Diferencia de 1.5 mgb (IC del 95%) | -0.9 (-1.4, -0.4) | -1.6 (-2.2, -1.1) ^^ | |
| Número de pacientes con datos observados | |||
| TRULICITY 1.5 mg | 612 | 567 | |
| TRULICITY 3 mg | 616 | 572 | |
| TRULICITY 4.5 mg | 614 | 575 | |
Media de HbA1c observada en las visitas programadas y estimación basada en la imputación múltiple (MI) de abandono en la semana 36.
Figura 4: Media de HbA1c en cada punto temporal (ITT) y en la semana 36 (ITT, MI)
Ensayo controlado con placebo (como complemento a la sulfonilurea)
En este ensayo doble ciego controlado con placebo de 24 semanas, 299 pacientes adultos fueron aleatorizados y recibieron placebo o TRULICITY 1,5 mg una vez por semana, ambos como complemento a la glimepirida. Los pacientes tenían una edad media de 58 años; una duración media de la diabetes tipo 2 de 8 años; el 44% eran hombres; raza: blanca, negra y asiática representaron el 83%, el 4% y el 2%, respectivamente; y el 24% de la población del ensayo estaban en los EE. UU.
A las 24 semanas, el tratamiento con TRULICITY 1,5 mg una vez por semana produjo una reducción estadísticamente significativa de la HbA1c en comparación con el placebo (Tabla 7).
|
Abreviaturas: HbA1c = hemoglobina A1c. |
||
|
a Población por intención de tratar. Los datos posteriores al inicio del tratamiento de rescate se tratan como perdidos. En la semana 24, la eficacia primaria faltaba para el 10% y el 12% de las personas asignadas al azar a TRULICITY 1,5 mg y placebo, respectivamente. |
||
|
b Media de mínimos cuadrados de ANCOVA ajustada para el valor basal y otros factores de estratificación. Se utilizó la imputación múltiple de placebo, con respecto a los valores basales, para modelar un lavado del efecto del tratamiento para los pacientes con datos faltantes de la semana 24. |
||
|
c Los pacientes con datos de HbA1c faltantes en la semana 24 se consideraron no respondedores. |
||
|
†† p<0,001 para la superioridad de TRULICITY 1,5 mg en comparación con el placebo, error de tipo I general controlado. |
||
| Punto temporal principal de 24 semanas | ||
| Placebo | TRULICITY 1,5 mg |
|
| Población por intención de tratar (ITT) (N) | 60 | 239 |
| HbA1c (%) (Media) | ||
| Basal | 8,4 | 8,4 |
| Cambio desde el valor basalb | -0,3 | -1,3 |
| Diferencia con respecto al placebob (IC del 95%) | -1,1 (-1,4, -0,7)†† | |
| Porcentaje de pacientes con HbA1c <7,0%c | 17 | 50†† |
| Glucosa sérica en ayunas (mg/dL) (Media) | ||
| Basal | 175 | 178 |
| Cambio desde el valor basalb | 2 | -28 |
| Diferencia con respecto al placebob (IC del 95%) | -30 (-44, -15)†† | |
| Peso corporal (kg) (Media) | ||
| Basal | 89,5 | 84,5 |
| Cambio desde el valor basalb | -0,2 | -0,5 |
| Diferencia con respecto al placebob (IC del 95%) | -0,4 (-1,2, 0,5) | |
Ensayo controlado con placebo y exenatida (como complemento a metformina y tiazolidinediona)
En este ensayo controlado con placebo con criterio principal de valoración a las 26 semanas, se aleatorizó a 976 pacientes adultos para que recibieran placebo, TRULICITY 0,75 mg una vez por semana, TRULICITY 1,5 mg una vez por semana o exenatida 10 mcg dos veces al día, todo ello como complemento a las dosis máximas toleradas de metformina (≥1500 mg al día) y pioglitazona (hasta 45 mg al día). La asignación al grupo de tratamiento con exenatida fue abierta, mientras que las asignaciones al tratamiento con placebo, TRULICITY 0,75 mg y TRULICITY 1,5 mg fueron ciegas. Después de 26 semanas, los pacientes del grupo de tratamiento con placebo se aleatorizaron a TRULICITY 0,75 mg una vez por semana o TRULICITY 1,5 mg una vez por semana para mantener el cegamiento. La aleatorización se produjo después de un período de introducción de 12 semanas; durante las 4 semanas iniciales del período de introducción, los pacientes fueron titulados a las dosis máximas toleradas de metformina y pioglitazona; a esto le siguió un período de estabilización glucémica de 8 semanas antes de la aleatorización. Los pacientes aleatorizados a exenatida comenzaron con una dosis de 5 mcg dos veces al día durante 4 semanas y luego se aumentó a 10 mcg dos veces al día. Los pacientes tenían una edad media de 56 años; una duración media de la diabetes tipo 2 de 9 años; el 58% eran hombres; raza: blanca, negra y asiática fueron el 74%, el 8% y el 3%, respectivamente; y el 81% de la población del ensayo estaban en los EE. UU.
El tratamiento con TRULICITY 0,75 mg y 1,5 mg una vez por semana produjo una reducción estadísticamente significativa de la HbA1c en comparación con el placebo (a las 26 semanas) y en comparación con la exenatida a las 26 semanas (Tabla 8 y Figura 5). Durante el período de ensayo de 52 semanas, el porcentaje de pacientes que requirieron rescate glucémico fue del 8,9% en el grupo de tratamiento con TRULICITY 0,75 mg una vez por semana + metformina y pioglitazona, del 3,2% en el grupo de tratamiento con TRULICITY 1,5 mg una vez por semana + metformina y pioglitazona y del 8,7% en el grupo de tratamiento con exenatida dos veces al día + metformina y pioglitazona.
|
Abreviaturas: BID = dos veces al día; HbA1c = hemoglobina A1c. |
||||
|
a Población por intención de tratar. Se utilizó el último dato observado (LOCF) para imputar los datos que faltaban. Los datos posteriores al inicio del tratamiento de rescate se consideran como perdidos. En la semana 26, la eficacia primaria faltaba para el 23%, el 10%, el 7% y el 12% de los individuos aleatorizados a placebo, TRULICITY 0,75 mg, TRULICITY 1,5 mg y exenatida, respectivamente. |
||||
|
b Media de mínimos cuadrados (LS) ajustada para el valor basal y otros factores de estratificación. |
||||
|
‡ Los pacientes incluidos en el análisis son un subconjunto de la población ITT que tuvo al menos una evaluación posterior a la basal. El análisis principal incluyó 119, 269, 271 y 266 individuos aleatorizados a placebo, TRULICITY 0,75 mg, TRULICITY 1,5 mg y exenatida, respectivamente. |
||||
|
‡‡ Valor p unilateral ajustado por multiplicidad <0,001, para la superioridad de TRULICITY en comparación con el placebo, evaluado solo para HbA1c. |
||||
|
†† Valor p unilateral ajustado por multiplicidad <0,001, para la superioridad de TRULICITY en comparación con la exenatida, evaluado solo para HbA1c. |
||||
|
** p<0.001 TRULICITY en comparación con placebo, evaluado solo para HbA1c <7.0%. |
||||
|
## p<0.001 TRULICITY en comparación con exenatida, evaluado solo para HbA1c <7.0%. |
||||
| Punto temporal principal de 26 semanas | ||||
| Placebo | TRULICITY 0,75 mg |
TRULICITY 1,5 mg |
Exenatida 10 mcg BID |
|
| Población por intención de tratar (ITT) (N)‡ | 141 | 280 | 279 | 276 |
| HbA1c (%) (Media) | ||||
| Basal | 8,1 | 8,1 | 8,1 | 8,1 |
| Cambio desde la basalb | -0,5 | -1,3 | -1,5 | -1,0 |
| Diferencia respecto al placebob (IC del 95%) | – | -0.8 (-1.0, -0.7)‡‡ | -1.1 (-1.2, -0.9)‡‡ | – |
| Diferencia respecto a exenatidab (IC del 95%) | – | -0.3 (-0.4, -0.2)†† | -0.5 (-0.7, -0.4)†† | – |
| Porcentaje de pacientes con HbA1c <7.0% | 43 | 66**, ## | 78**, ## | 52 |
| Glucosa sérica en ayunas (mg/dL) (Media) | ||||
| Valor basal | 166 | 159 | 162 | 164 |
| Cambio respecto al valor basalb | -5 | -34 | -42 | -24 |
| Diferencia respecto al placebob (IC del 95%) | – | -30 (-36, -23) | -38 (-45, -31) | – |
| Diferencia respecto a exenatidab (IC del 95%) | – | -10 (-15, -5) | -18 (-24, -13) | – |
| Peso corporal (kg) (Media) | ||||
| Valor basal | 94.1 | 95.5 | 96.2 | 97.4 |
| Cambio respecto al valor basalb | 1.2 | 0.2 | -1.3 | -1.1 |
| Diferencia respecto al placebob (IC del 95%) | – | -1.0 (-1.8, -0.3) | -2.5 (-3.3, -1.8) | – |
| Diferencia respecto a exenatidab (IC del 95%) | – | 1.3 (0.6, 1.9) | -0.2 (-0.9, 0.4) | – |
|
Media de HbA1c ajustada para el valor basal de HbA1c y el país. |
|||
| Número de pacientes con datos observados | |||
| Placebo | 141 | 108 | |
| TRULICITY 0.75 mg | 280 | 251 | |
| TRULICITY 1.5 mg | 279 | 259 | |
| Exenatida | 276 | 242 | |
Figura 5: Media ajustada de HbA1c en cada punto temporal (ITT, MMRM) y en la semana 26 (ITT, LOCF)
Ensayo controlado con placebo (como complemento a un inhibidor de SGLT2, con o sin metformina)
En este ensayo doble ciego, controlado con placebo, de 24 semanas de duración, se aleatorizó a 423 pacientes adultos para que recibieran TRULICITY 0,75 mg, TRULICITY 1,5 mg o placebo, como complemento a la terapia con un inhibidor del cotransportador de sodio-glucosa 2 (SGLT2i) (96% con y 4% sin metformina). Trulicity se administró una vez por semana, y el SGLT2i se administró de acuerdo con la etiqueta del país local. Los pacientes tenían una edad media de 57 años; una duración media de la diabetes tipo 2 de 9,4 años; el 50% eran hombres; raza: blanca, negra y asiática fueron el 89%, el 3% y el 0,2%, respectivamente; y el 21% de la población del ensayo estaba en los EE. UU.
A las 24 semanas, el tratamiento con TRULICITY 0,75 mg y 1,5 mg una vez por semana produjo una reducción estadísticamente significativa de la HbA1c desde el inicio en comparación con el placebo (Tabla 9).
El peso corporal medio basal fue de 90,5, 91,1 y 92,9 kg en los grupos placebo, TRULICITY 0,75 mg y TRULICITY 1,5 mg, respectivamente. Los cambios medios desde el inicio en el peso corporal en la semana 24 fueron de -2,0, -2,5 y -2,9 kg para placebo, TRULICITY 0,75 mg y TRULICITY 1,5 mg, respectivamente. La diferencia con respecto al placebo (IC del 95%) fue de -0,9 kg (-1,7, -0,1) para TRULICITY 1,5 mg.
|
Abreviaturas: HbA1c = hemoglobina A1c; SGLT2i = inhibidores del cotransportador de sodio-glucosa-2. |
|||
|
a Población por intención de tratar. En la semana 24, faltaba la eficacia primaria para el 3%, el 4% y el 6% de las personas tratadas con placebo, TRULICITY 0,75 mg y TRULICITY 1,5 mg, respectivamente. |
|||
|
b Media de mínimos cuadrados ajustada para el valor basal y otros factores de estratificación. Se aplicó la imputación múltiple de placebo, utilizando los valores basales y de la semana 24 del brazo de placebo, para modelar un lavado del efecto del tratamiento para los pacientes que faltaban los valores de la semana 24 (HbA1c, glucosa sérica en ayunas y peso corporal). |
|||
|
c Los pacientes con datos de HbA1c faltantes en la semana 24 se consideraron no respondedores. |
|||
|
†† p<0,001 para la superioridad de TRULICITY en comparación con el placebo, error de tipo I general controlado. |
|||
| Punto temporal principal de la semana 24 | |||
| Placebo | TRULICITY 0,75 mg |
TRULICITY 1,5 mg |
|
| Población por intención de tratar (ITT) (N) | 140 | 141 | 142 |
| HbA1c (%) (Media) | |||
| Basal | 8,1 | 8,1 | 8,0 |
| Cambio desde el basalb | -0,6 | -1,2 | -1,3 |
| Diferencia con respecto al placebob (IC del 95%) | – | -0,7 (-0,8, -0,5)†† | -0,8 (-0,9, -0,6)†† |
| Porcentaje de pacientes con HbA1c <7,0%c | 31 | 59†† | 67†† |
| Glucosa sérica en ayunas (mg/dL) (Media) | |||
| Basal | 153 | 162 | 161 |
| Cambio desde el basalb | -6 | -25 | -30 |
| Diferencia con respecto al placebob (IC del 95%) | – | -19 (-25, -13) | -24 (-30, -18)†† |
Ensayo controlado con Insulina Glargina (como complemento a Metformina y Sulfonilurea)
En este ensayo comparador abierto (doble ciego con respecto a la asignación de dosis de TRULICITY) con un criterio de valoración principal a las 52 semanas, se aleatorizó a 807 pacientes adultos para que recibieran TRULICITY 0,75 mg una vez por semana, TRULICITY 1,5 mg una vez por semana o insulina glargina una vez al día, todo ello como complemento a las dosis máximas toleradas de metformina y glimepirida. La aleatorización se produjo después de un período de introducción de 10 semanas; durante las 2 primeras semanas del período de introducción, los pacientes fueron titulados a las dosis máximas toleradas de metformina y glimepirida. A esto le siguió un período de estabilización glucémica de 6 a 8 semanas antes de la aleatorización.
Los pacientes aleatorizados a insulina glargina comenzaron con una dosis de 10 unidades una vez al día. Los ajustes de la dosis de insulina glargina se realizaron dos veces por semana durante las 4 primeras semanas de tratamiento en función de la glucosa plasmática en ayunas (FPG) automedida, seguidos de una titulación semanal hasta la semana 8 del tratamiento, utilizando un algoritmo que tenía como objetivo una glucosa plasmática en ayunas de <100 mg/dL. Sólo el 24% de los pacientes fueron titulados al objetivo en el criterio de valoración principal de las 52 semanas. La dosis de glimepirida podría reducirse o suspenderse después de la aleatorización (a discreción del investigador) en caso de hipoglucemia persistente. La dosis de glimepirida se redujo o se suspendió en el 28%, el 32% y el 29% de los pacientes aleatorizados a TRULICITY 0,75 mg, TRULICITY 1,5 mg y glargina, respectivamente.
Los pacientes tenían una edad media de 57 años; una duración media de la diabetes tipo 2 de 9 años; el 51% eran hombres; raza: blanca, negra y asiática fueron el 71%, el 1% y el 17%, respectivamente; y el 0% de la población del ensayo estaban en los EE. UU.
El tratamiento con TRULICITY una vez por semana dio como resultado una reducción de la HbA1c desde el inicio a las 52 semanas cuando se utilizó en combinación con metformina y sulfonilurea (Tabla 10). La diferencia en el tamaño del efecto observado entre TRULICITY 0,75 mg y 1,5 mg, respectivamente, y la glargina en este ensayo excluyó el margen de no inferioridad preespecificado del 0,4%.
|
Abreviaturas: HbA1c = hemoglobina A1c. |
||||||||
|
a Población por intención de tratar. Se utilizó el último dato observado (LOCF) para imputar los datos que faltaban. Los datos posteriores al inicio del tratamiento de rescate se tratan como datos que faltan. En la semana 52, la eficacia principal faltaba para el 17%, el 13% y el 12% de los individuos aleatorizados a TRULICITY 0,75 mg, TRULICITY 1,5 mg y glargina, respectivamente. |
||||||||
|
b Media ajustada de mínimos cuadrados (LS) para el valor basal y otros factores de estratificación. |
||||||||
|
‡ Los pacientes incluidos en el análisis son un subconjunto de la población ITT que tuvo al menos una evaluación posterior al inicio del estudio. El análisis principal incluyó 267, 263 y 259 individuos aleatorizados a TRULICITY 0,75 mg, TRULICITY 1,5 mg y glargina, respectivamente. |
||||||||
| Punto temporal principal de la semana 52 | ||||||||
| TRULICITY 0,75 mg |
TRULICITY 1,5 mg |
Insulina Glargina | ||||||
| Población por intención de tratar (ITT) (N)‡ | 272 | 273 | 262 | |||||
| HbA1c (%) (Media) | ||||||||
| Valor basal | 8,1 | 8,2 | 8,1 | |||||
| Cambio desde el valor basalb | -0,8 | -1,1 | -0,6 | |||||
| Glucosa sérica en ayunas (mg/dL) (Media) | ||||||||
| Valor basal | 161 | 165 | 163 | |||||
| Cambio desde el valor basalb | -16 | -27 | -32 | |||||
| Diferencia con respecto a la insulina glarginab (IC del 95%) | 16 (9, 23) | 5 (-2, 12) | – | |||||
| Peso corporal (kg) (Media) | ||||||||
| Valor basal | 86,4 | 85,2 | 87,6 | |||||
| Cambio desde la línea basalb | -1.3 | -1.9 | 1.4 |
| Diferencia de la insulinab (IC del 95%) | -2.8 (-3.4, -2.2) | -3.3 (-3.9, -2.7) | – |
Ensayo controlado con placebo (como complemento a la insulina basal, con o sin metformina)
En este ensayo doble ciego, controlado con placebo, de 28 semanas de duración, se asignaron al azar 300 pacientes adultos a placebo o a TRULICITY 1,5 mg una vez por semana, como complemento a la insulina glargina basal titulada (con o sin metformina). Los pacientes tenían una edad media de 60 años; una duración media de la diabetes tipo 2 de 13 años; el 58 % eran hombres; raza: blanca, negra y asiática representaron el 94 %, el 4 % y el 0,3 %, respectivamente; y el 20 % de la población del ensayo estaba en EE. UU.
La dosis inicial media de insulina glargina fue de 37 unidades/día para los pacientes que recibieron placebo y de 41 unidades/día para los pacientes que recibieron TRULICITY 1,5 mg. En la aleatorización, la dosis inicial de insulina glargina en pacientes con HbA1c <8,0 % se redujo en un 20 %.
A las 28 semanas, el tratamiento con TRULICITY 1,5 mg una vez por semana produjo una reducción estadísticamente significativa de la HbA1c en comparación con el placebo (Tabla 11).
|
Abreviaturas: HbA1c = hemoglobina A1c. |
||
|
a Población por intención de tratar. A la semana 28, faltaba la eficacia primaria para el 12 % y el 8 % de las personas asignadas al azar a placebo y TRULICITY 1,5 mg, respectivamente. |
||
|
b Media de mínimos cuadrados de ANCOVA ajustada para el valor basal y otros factores de estratificación. Se utilizó la imputación múltiple de placebo, con respecto a los valores basales, para modelar un efecto de lavado del tratamiento para los pacientes con datos faltantes de la semana 28. |
||
|
c Los pacientes con datos de HbA1c faltantes en la semana 28 se consideraron no respondedores. |
||
|
†† p<0,001 para la superioridad de TRULICITY 1,5 mg en comparación con el placebo, error de tipo I general controlado. |
||
|
† p≤0,005 para la superioridad de TRULICITY 1,5 mg en comparación con el placebo, error de tipo I general controlado. |
||
| Punto temporal principal de 28 semanas | ||
| Placebo | TRULICITY 1,5 mg |
|
| Población por intención de tratar (ITT) (N) | 150 | 150 |
| HbA1c (%) (Media) | ||
| Valor basal | 8,3 | 8,4 |
| Cambio desde el valor basalb | -0,7 | -1,4 |
| Diferencia con respecto al placebob (IC del 95 %) | -0,7 (-0,9, -0,5)†† | |
| Porcentaje de pacientes con HbA1c <7,0 %c | 33 | 67†† |
| Glucosa sérica en ayunas (mg/dL) (Media) | ||
| Valor basal | 156 | 157 |
| Cambio desde el valor basalb | -30 | -44 |
| Diferencia con respecto al placebob (IC del 95 %) | -14 (-23, -4)† | |
| Peso corporal (kg) (Media) | ||
| Valor basal | 92,6 | 93,3 |
| Cambio desde el valor basalb | 0,8 | -1,3 |
| Diferencia con respecto al placebob (IC del 95 %) | -2,1 (-2,9, -1,4)†† | |
Ensayo controlado con Insulina Glargina (Combinación con Insulina Prandial, con o sin
Metformina)
En este ensayo comparador abierto (doble ciego con respecto a la asignación de dosis de TRULICITY) con un criterio de valoración principal a las 26 semanas, se inscribieron 884 pacientes adultos con 1 o 2 inyecciones de insulina al día. La aleatorización se produjo después de un período de introducción de 9 semanas; durante las 2 primeras semanas del período de introducción, los pacientes continuaron con su régimen de insulina previo al ensayo, pero se pudo iniciar y/o aumentar la dosis de metformina, según el criterio del investigador; a esto le siguió un período de estabilización glucémica de 7 semanas antes de la aleatorización.
En el momento de la aleatorización, los pacientes interrumpieron su régimen de insulina previo al ensayo y se asignaron aleatoriamente a TRULICITY 0,75 mg una vez por semana, TRULICITY 1,5 mg una vez por semana o insulina glargina una vez al día, todo ello en combinación con insulina lispro prandial 3 veces al día, con o sin metformina. La insulina lispro se tituló en cada brazo según la glucosa preprandial y antes de acostarse, y la insulina glargina se tituló para alcanzar un objetivo de glucosa plasmática en ayunas de <100 mg/dL. Solo el 36% de los pacientes aleatorizados a glargina alcanzaron el objetivo de glucosa en ayunas en el momento principal de las 26 semanas.
Los pacientes tenían una edad media de 59 años; una duración media de la diabetes tipo 2 de 13 años; el 54% eran hombres; raza: blanca, negra y asiática fueron el 79%, el 10% y el 4%, respectivamente; y el 33% de la población del ensayo estaban en los EE. UU.
El tratamiento con TRULICITY 0,75 mg y 1,5 mg una vez por semana produjo una reducción de la HbA1c desde el inicio del tratamiento. La diferencia en el tamaño del efecto observado entre TRULICITY 0,75 mg y 1,5 mg, respectivamente, y la glargina en este ensayo excluyó el margen de no inferioridad preespecificado del 0,4% (Tabla 12).
|
Abreviatura: HbA1c = hemoglobina A1c |
|||
|
a Población por intención de tratar. Se utilizó el último dato observado (LOCF) para imputar los datos que faltaban. Los datos posteriores al inicio del tratamiento de rescate se tratan como datos que faltan. En la semana 26, la eficacia principal faltaba para el 14%, el 15% y el 14% de las personas asignadas aleatoriamente a TRULICITY 0,75 mg, TRULICITY 1,5 mg y glargina, respectivamente. |
|||
|
b Media de mínimos cuadrados (LS) ajustada para el valor basal y otros factores de estratificación. |
|||
|
‡ Los pacientes incluidos en el análisis son un subconjunto de la población ITT que tuvo al menos una evaluación posterior al inicio del tratamiento. El análisis principal incluyó 275, 273 y 276 individuos asignados aleatoriamente a TRULICITY 0,75 mg, TRULICITY 1,5 mg y glargina, respectivamente. |
|||
| Momento principal de la semana 26 | |||
| TRULICITY 0,75 mg |
TRULICITY 1,5 mg |
Insulina Glargina | |
| Población por intención de tratar (ITT) (N)‡ | 293 | 295 | 296 |
| HbA1c (%) (Media) | |||
| Valor basal | 8,4 | 8,5 | 8,5 |
| Cambio desde el valor basalb | -1,6 | -1,6 | -1,4 |
| Glucosa sérica en ayunas (mg/dL) (Media) | |||
| Valor basal | 150 | 157 | 154 |
| Cambio desde el valor basalb | 4 | -5 | -28 |
| Diferencia con respecto a la insulina glarginab (IC del 95%) | 32 (24, 41) | 24 (15, 32) | – |
| Peso corporal (kg) (Media) | |||
| Valor basal | 91,7 | 91,0 | 90,8 |
| Cambio desde el valor basalb | 0,2 | -0,9 | 2,3 |
| Diferencia con respecto a la insulina glarginab (IC del 95%) | -2.2 (-2.8, -1.5) | -3.2 (-3.8, -2.6) | – |
14.4 Ensayos de control glucémico en adultos con diabetes mellitus tipo 2 y enfermedad renal crónica de moderada a grave
En este ensayo comparador abierto (doble ciego con respecto a la asignación de dosis de TRULICITY) con criterio de valoración principal a las 26 semanas, se aleatorizó y trató a un total de 576 pacientes adultos con diabetes tipo 2 para comparar TRULICITY 0,75 mg y 1,5 mg con insulina glargina (NCT01621178).
Los pacientes con insulina y otra terapia antidiabética (p. ej., fármacos antidiabéticos orales, pramlintide) interrumpieron las terapias no insulínicas y se les ajustó la dosis de insulina durante 12 semanas antes de la aleatorización. Los pacientes que solo recibían insulina mantuvieron una dosis estable de insulina durante 3 semanas antes de la aleatorización. En la aleatorización, los pacientes interrumpieron su régimen de insulina previo al ensayo y se aleatorizaron a TRULICITY 0,75 mg una vez por semana, TRULICITY 1,5 mg una vez por semana o insulina glargina una vez al día, todo ello en combinación con insulina lispro prandial. Para los pacientes aleatorizados a insulina glargina, la dosis inicial de insulina glargina se basó en la dosis de insulina basal previa a la aleatorización. Se permitió la titulación de la insulina glargina con un objetivo de glucosa plasmática en ayunas de ≤150 mg/dL. Se permitió la titulación de la insulina lispro con un objetivo de glucosa preprandial y a la hora de acostarse de ≤180 mg/dL.
Los pacientes tenían una edad media de 65 años; una duración media de la diabetes tipo 2 de 18 años; el 52% eran hombres; raza: blanca, negra y asiática fueron el 69%, el 16% y el 3%, respectivamente; y el 32% de la población del ensayo estaban en los EE. UU. Al inicio del estudio, la TFG media general fue de 38 mL/min/1,73 m2, el 30% de los pacientes tenían una TFG <30 mL/min/1,73 m2, y el 45% de los pacientes tenían macroalbuminuria. Los pacientes que recibían más de 70 unidades/día de insulina basal fueron excluidos del ensayo.
El tratamiento con TRULICITY 0,75 mg y 1,5 mg una vez por semana produjo una reducción de la HbA1c a las 26 semanas desde el inicio del estudio. La diferencia en el tamaño del efecto observado entre TRULICITY 0,75 mg y 1,5 mg, respectivamente, y la glargina en este ensayo excluyó el margen de no inferioridad preespecificado del 0,4%. La glucosa plasmática media en ayunas aumentó en los brazos de TRULICITY (Tabla 13).
El peso corporal medio basal fue de 90,9 kg, 88,1 kg y 88,2 kg en los brazos de TRULICITY 0,75 mg, TRULICITY 1,5 mg e insulina glargina, respectivamente. Los cambios medios desde el inicio del estudio en la semana 26 fueron de -1,1, -2 y 1,9 kg en los brazos de TRULICITY 0,75 mg, TRULICITY 1,5 mg e insulina glargina, respectivamente.
|
Abreviatura: HbA1c = hemoglobina A1c |
|||
|
a En el análisis se utilizó la población por intención de tratar (todos los pacientes aleatorizados y tratados), independientemente de la interrupción del fármaco del estudio o del inicio de la terapia de rescate. En la semana 26, faltaba la eficacia primaria para el 12%, el 15% y el 9% de las personas aleatorizadas y tratadas con TRULICITY 0,75 mg, TRULICITY 1,5 mg e insulina glargina, respectivamente. Los datos que faltaban se imputaron utilizando la imputación múltiple dentro del grupo de tratamiento. |
|||
|
b Media de mínimos cuadrados (MC) del modelo de mezcla de patrones de ANCOVA ajustado para el valor basal y otros factores de estratificación. |
|||
| Punto temporal principal de 26 semanas | |||
| TRULICITY 0,75 mg |
TRULICITY 1,5 mg |
Insulina Glargina | |
| Población por intención de tratar (N) | 190 | 192 | 194 |
| HbA1c (%) (Media) | |||
| Basal | 8,6 | 8,6 | 8,6 |
| Cambio desde el valor basalb | -0,9 | -1,0 | -1,0 |
| Diferencia con respecto a la insulina glarginab (IC del 95%) | 0,0 (-0,2, 0,3) | -0,1 (-0,3, 0,2) | |
| Porcentaje de pacientes con HbA1c <8,0% | 73 | 75 | 74 |
| Glucosa sérica en ayunas (mg/dL) (Media) | |||
| Basal | 167 | 161 | 170 |
| Cambio desde la línea basalb | 6 | 14 | -23 |
| Diferencia de la insulina glarginab (IC del 95%) | 30 (16, 43) | 37 (24, 50) | |
14.5 Ensayo de resultados cardiovasculares en adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular o múltiples factores de riesgo cardiovascular
El ensayo REWIND (NCT01394952) fue un ensayo multinacional, multicéntrico, aleatorizado, controlado con placebo y doble ciego. En este ensayo, 9901 pacientes adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular (CV) establecida o múltiples factores de riesgo cardiovascular se asignaron aleatoriamente a TRULICITY 1.5 mg o placebo, ambos añadidos al tratamiento estándar. La duración media del seguimiento fue de 5,4 años. La variable principal fue el tiempo hasta la primera aparición de un resultado compuesto de tres componentes de eventos cardiovasculares adversos mayores (MACE), que incluía muerte CV, infarto de miocardio (IM) no mortal y accidente cerebrovascular no mortal.
Los pacientes elegibles para entrar en el ensayo tenían 50 años o más, padecían diabetes mellitus tipo 2, tenían un valor de HbA1c ≤9,5% sin límite inferior en la selección y tenían una enfermedad CV establecida, o no tenían una enfermedad CV establecida pero sí múltiples factores de riesgo CV. Los pacientes en quienes se confirmó una enfermedad CV establecida (31,5% de los pacientes aleatorizados) tenían antecedentes de al menos uno de los siguientes: IM (16,2%); isquemia miocárdica mediante una prueba de esfuerzo o con imágenes cardíacas (9,3%); accidente cerebrovascular isquémico (5,3%); revascularización coronaria, carotídea o arterial periférica (18,0%); angina inestable (5,9%); u hospitalización por angina inestable con al menos uno de los siguientes: cambios en el ECG, isquemia miocárdica en las imágenes o necesidad de intervención coronaria percutánea (12,0%). Los pacientes en quienes se confirmó que no tenían enfermedad CV establecida, pero sí múltiples factores de riesgo CV, representaron el 62,8% de la población del ensayo aleatorizado.
En la línea basal, las características demográficas y de la enfermedad estaban equilibradas entre los grupos de tratamiento. Los pacientes tenían una edad media de 66 años; el 46% eran mujeres; raza: blanca, negra y asiática fueron el 76%, el 7% y el 4%, respectivamente.
La HbA1c basal mediana fue del 7,2%. La duración media de la diabetes tipo 2 fue de 10,5 años y el IMC medio fue de 32,3 kg/m2.
En la línea basal, el 50,5% de los pacientes tenían insuficiencia renal leve (eGFR ≥60 pero <90 mL/min/1,73 m2), el 21,6% tenían insuficiencia renal moderada (eGFR ≥30 pero <60 mL/min/1,73 m2), y el 1,1% de los pacientes tenían insuficiencia renal grave (eGFR <30 mL/min/1,73 m2) de 9713 pacientes cuyos valores de eGFR estaban disponibles.
En la línea basal, el 94,7% de los pacientes estaban tomando medicamentos antidiabéticos, con el 10,5% de los pacientes tomando tres o más medicamentos antidiabéticos. Los medicamentos antidiabéticos de fondo más comunes utilizados en la línea basal fueron metformina (81,2%), sulfonilurea (46,0%) e insulina (23,9%). En la línea basal, la enfermedad CV y los factores de riesgo se manejaron con inhibidores de la ECA o bloqueadores del receptor de la angiotensina (81,5%), betabloqueantes (45,6%), bloqueadores de los canales de calcio (34,4%), diuréticos (46,5%), terapia con estatinas (66,1%), agentes antitrombóticos (58,7%) y aspirina (51,7%). Durante el ensayo, los investigadores debían modificar los medicamentos antidiabéticos y cardiovasculares para lograr los objetivos de tratamiento estándar local con respecto a la glucosa en sangre, los lípidos y la presión arterial, y manejar a los pacientes que se recuperaban de un síndrome coronario agudo o un accidente cerebrovascular según las directrices de tratamiento locales.
Para el análisis principal, se utilizó un modelo de riesgos proporcionales de Cox para probar la superioridad. El error de tipo I se controló en múltiples pruebas. TRULICITY redujo significativamente el riesgo de la primera aparición del criterio principal compuesto de muerte CV, IM no mortal o accidente cerebrovascular no mortal (HR: 0,88, IC del 95% 0,79, 0,99). Consulte la Figura 6 y la Tabla 14.
El estado vital estuvo disponible para el 99,7% de los pacientes en el ensayo. Se registraron un total de 1128 muertes durante el ensayo REWIND. La mayoría de las muertes en el ensayo se adjudicaron como muertes CV, y las muertes no CV fueron comparables entre los grupos de tratamiento (4,4% en pacientes tratados con TRULICITY y 5,0% en pacientes tratados con placebo). Hubo 536 muertes por todas las causas (10,8%) en el grupo de dulaglutida en comparación con 592 muertes (12,0%) en el grupo placebo.
| Número de pacientes en riesgo | ||||||||
| Placebo | 4952 | 4791 | 4625 | 4437 | 4275 | 3575 | 742 | |
| Dulaglutida | 4949 | 4815 | 4670 | 4521 | 4369 | 3686 | 741 | |
Figura 6. CURVA DE KAPLAN MEIER: Tiempo hasta la primera aparición de MACE en el ensayo REWIND
|
a Todos los pacientes aleatorizados. |
|||
|
b Modelo de riesgos proporcionales de Cox con el tratamiento como factor. El error de tipo I se controló para los criterios de valoración principales y secundarios. |
|||
|
c p=0,026 para superioridad (bilateral). |
|||
|
d Número y porcentaje de pacientes con eventos. |
|||
|
e Los resultados para los componentes de MACE, accidente cerebrovascular fatal y no fatal, e infarto de miocardio fatal y no fatal se enumeran descriptivamente con fines de apoyo. No se debe inferir significación estadística, ya que estos IC no se ajustan por multiplicidad. |
|||
| Tiempo hasta la primera aparición de: | TRULICITY N=4949 |
Placebo N=4952 |
Razón de Riesgo (IC del 95%)b |
| Compuesto de infarto de miocardio no fatal, accidente cerebrovascular no fatal, muerte cardiovascular (MACE)d | 594 (12,0%) | 663 (13,4%) | 0,88 (0,79; 0,99)c |
| Muerte cardiovasculard,e | 317 (6,4%) | 346 (7,0%) | 0,91 (0,78; 1,06) |
| Infarto de miocardio no fatald,e | 205 (4,1%) | 212 (4,3%) | 0,96 (0,79; 1,16) |
| Accidente cerebrovascular no fatald,e | 135 (2,7%) | 175 (3,5%) | 0,76 (0,61; 0,95) |
| Infarto de miocardio fatal o no fatald,e | 223 (4,5%) | 231 (4,7%) | 0,96 (0,79; 1,15) |
| Accidente cerebrovascular fatal o no fatald,e | 158 (3,2%) | 205 (4,1%) | 0,76 (0,62; 0,94) |
14.6 Ensayo de control glucémico en pacientes pediátricos de 10 años o más con diabetes mellitus tipo 2
En este ensayo clínico multicéntrico, aleatorizado, doble ciego, controlado con placebo, de brazos paralelos y con una extensión abierta de etiqueta de 26 semanas más, 154 pacientes pediátricos de 10 años o más con diabetes mellitus tipo 2, que tenían un control glucémico inadecuado a pesar de la dieta y el ejercicio, fueron aleatorizados a recibir TRULICITY subcutáneo una vez por semana (0,75 mg y 1,5 mg) o placebo subcutáneo una vez por semana, en combinación con o sin metformina y/o tratamiento con insulina basal (NCT02963766).
En general, en este ensayo, las características demográficas y de la enfermedad basal fueron comparables entre los grupos de tratamiento. En la línea de base, el 71% de los pacientes eran mujeres y la edad media era de 14,5 años (rango de 10 a 17 años). En general, el 55% eran blancos, el 15% eran negros o afroamericanos, el 12% eran asiáticos, el 10% eran indios americanos o nativos de Alaska, el 5% eran de otras razas y el 3% tenían raza desconocida. Además, el 55% eran hispanos o latinos, el 42% no eran hispanos o latinos y el 3% tenían etnia desconocida. En la línea de base, la duración media de la diabetes mellitus tipo 2 era de 2 años, la HbA1c media era del 8,1%, el peso medio era de 90,5 kg y el IMC medio era de 34,1 kg/m2.
En este ensayo, TRULICITY una vez por semana (0,75 mg y 1,5 mg, combinados) (con o sin metformina y/o insulina basal) fue superior al placebo (p < 0,001) en el cambio desde la línea de base en la HbA1c en la semana 26 en pacientes pediátricos de 10 años o más con diabetes mellitus tipo 2 (ver Tabla 15).
|
Abreviaturas: HbA1c = hemoglobina A1c. |
||||
|
a Resultados combinados para TRULICITY 0,75 mg y 1,5 mg. La comparación de las dos dosis juntas y de forma individual con el placebo se especificó previamente con un error de tipo I global controlado. |
||||
|
b El cambio desde la línea de base y la diferencia con el placebo se analizaron utilizando un análisis de covarianza con efectos para el tratamiento, el valor basal como covariable y factores de estratificación que fueron la HbA1c en el cribado (< 8% vs ≥ 8%), el uso de insulina en la línea de base (sí/no), el uso de metformina en la línea de base (sí/no). |
||||
|
c Para la HbA1c y la Glucosa en Ayunas en Sangre, se realizó una imputación múltiple para los datos faltantes guiada por el método de lavado. En la semana 26, la eficacia primaria (HbA1c) faltaba para el 8%, el 6% y el 10% de los pacientes en el placebo, TRULICITY 0,75 mg y TRULICITY 1,5 mg, respectivamente. |
||||
|
d Para el porcentaje de pacientes con HbA1c < 7%, los datos faltantes se imputaron como no alcanzando el objetivo. |
||||
| Placebo | TRULICITY 0,75 mg una vez por semana | TRULICITY 1,5 mg una vez por semana | TRULICITY una vez por semana Combinadoa |
|
| Población con intención de tratar (N) | 51 | 51 | 52 | 103 |
| HbA1c (%) (Media)c | ||||
| Línea de base Cambio desde la línea de base en la semana 26b Diferencia con el placebo (95% IC)b |
8,1 0,6 – |
7,9 -0,6 -1,2 (-1,8, -0,6) |
8,2 -0,9 -1,5 (-2,1, -0,9) |
8,0 -0,8 -1,4 (-1,9, -0,8) |
| Porcentaje de pacientes con HbA1c < 7,0% en la semana 26d | 14% | 55% | 48% | 52% |
| Glucosa en Ayunas en Sangre (mg/dL) (Media)c | ||||
| Línea de base Cambio desde la línea de base en la semana 26b Diferencia con el placebo (95% IC)b |
159 17,1 – |
149 -12,8 -29,9 (-50,7, -9,1) |
163 -24,9 -42,0 (-63,0, -20,9) |
156 -18,9 -35,9 (-54,2, -17,6) |
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
16.1 Presentación
TRULICITY (dulaglutida) inyección es una solución transparente e incolora que se presenta en plumas de dosis única. TRULICITY se envasa en una caja de cartón que contiene 4 plumas de dosis única de TRULICITY y se presenta de la siguiente manera:
| Concentración total por volumen total | NDC |
| 0.75 mg/0.5 mL | NDC 0002-1433-80 |
| 1.5 mg/0.5 mL | NDC 0002-1434-80 |
| 3 mg/0.5 mL | NDC 0002-2236-80 |
| 4.5 mg/0.5 mL | NDC 0002-3182-80 |
16.2 Almacenamiento y manipulación
- Conserve TRULICITY en el refrigerador a una temperatura de 2°C a 8°C (36°F a 46°F).
- Si es necesario, cada pluma de dosis única puede conservarse a temperatura ambiente, sin superar los 30°C (86°F) durante un máximo de 14 días.
- No congele TRULICITY. No utilice TRULICITY si se ha congelado.
- Proteja TRULICITY de la luz. Se recomienda conservar TRULICITY en su envase original hasta el momento de la administración.
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente que lea el etiquetado del paciente aprobado por la FDA (Guía de medicamentos e Instrucciones de uso).
- Informe a los pacientes que TRULICITY causa tumores de células C tiroideas benignos y malignos en ratas y que no se ha determinado la relevancia de este hallazgo en humanos. Aconseje a los pacientes que informen a su médico sobre los síntomas de tumores tiroideos (por ejemplo, un bulto en el cuello, ronquera persistente, disfagia o disnea) [véase Advertencia en recuadro y Advertencias y precauciones (5.1)].
- Informe a los pacientes que el dolor abdominal intenso persistente, que puede irradiarse a la espalda y que puede (o no) ir acompañado de vómitos, es el síntoma característico de la pancreatitis aguda. Indique a los pacientes que interrumpan el tratamiento con TRULICITY de inmediato y que se pongan en contacto con su médico si se produce dolor abdominal intenso persistente [véase Advertencias y precauciones (5.2)].
- Informe a los pacientes que el riesgo de hipoglucemia puede aumentar cuando TRULICITY se usa en combinación con un secretagogo de insulina (como una sulfonilurea) o insulina. Eduque a los pacientes sobre los signos y síntomas de la hipoglucemia [véase Advertencias y precauciones (5.3)].
- Avise a los pacientes del riesgo potencial de deshidratación debido a reacciones adversas gastrointestinales y tome precauciones para evitar la depleción de líquidos. Informe a los pacientes tratados con TRULICITY del riesgo potencial de empeoramiento de la función renal y explique los signos y síntomas asociados al deterioro renal, así como la posibilidad de diálisis como intervención médica si se produce insuficiencia renal [véase Advertencias y precauciones (5.5)].
- Informe a los pacientes del riesgo potencial de reacciones adversas gastrointestinales graves. Indique a los pacientes que se pongan en contacto con su proveedor de atención médica si presentan síntomas gastrointestinales graves o persistentes [véase Advertencias y precauciones (5.6)].
- Informe a los pacientes que se han notificado reacciones de hipersensibilidad graves con el uso de TRULICITY. Avise a los pacientes sobre los síntomas de las reacciones de hipersensibilidad e indíqueles que dejen de tomar TRULICITY y busquen atención médica de inmediato si se producen estos síntomas [véase Advertencias y precauciones (5.4)].
- Informe a los pacientes que deben ponerse en contacto con su médico si experimentan cambios en la visión durante el tratamiento con TRULICITY [véase Advertencias y precauciones (5.7)].
- Informe a los pacientes que TRULICITY puede hacer que su estómago se vacíe más lentamente, lo que puede provocar complicaciones con la anestesia o la sedación profunda durante cirugías o procedimientos planificados. Indique a los pacientes que informen a los proveedores de atención médica antes de cualquier cirugía o procedimiento planificado si están tomando TRULICITY [véase Advertencias y precauciones (5.9)].
- Informe a los pacientes del riesgo potencial de colelitiasis o colecistitis. Indique a los pacientes que se pongan en contacto con su médico si se sospecha colelitiasis o colecistitis para un seguimiento clínico adecuado [véase Advertencias y precauciones (5.8)].
- Aconseje a los pacientes que informen a su proveedor de atención médica si están embarazadas o planean quedar embarazadas [véase Uso en poblaciones específicas (8.1)].
- Informe a los pacientes que si se olvidan una dosis y faltan al menos 3 días (72 horas) hasta la siguiente dosis programada, deben administrarla lo antes posible y luego reanudar su horario de dosificación semanal habitual. Si se olvida una dosis y la siguiente dosis programada regularmente se debe en 1 o 2 días, informe al paciente que no administre la dosis olvidada y que en su lugar reanude TRULICITY con la siguiente dosis programada regularmente [véase Dosificación y administración (2.3)].
Eli Lilly and Company, Indianápolis, IN 46285, EE. UU.
Número de licencia de EE. UU. 1891
Copyright © 2014, 2024, Eli Lilly and Company. Todos los derechos reservados.
TRU-0018-USPI-20241101
Guía de medicación
|
Esta Guía del Medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de los EE. UU. |
Revisado: Noviembre 2024 |
|||||||
|
TRU-0010-MG-20241101 |
||||||||
| Guía del Medicamento TRULICITY® (TRU-li-si-tee) (dulaglutida) inyección, para uso subcutáneo |
||||||||
| Lea esta Guía del Medicamento antes de comenzar a usar TRULICITY y cada vez que le surtan una nueva receta. Puede haber información nueva. Esta información no reemplaza hablar con su proveedor de atención médica sobre su condición médica o su tratamiento. | ||||||||
|
¿Cuál es la información más importante que debo saber sobre TRULICITY?
|
||||||||
¿Qué es TRULICITY?
|
||||||||
No use TRULICITY si:
|
||||||||
Antes de usar TRULICITY, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si:
|
||||||||
| Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos herbales. TRULICITY puede afectar la forma en que funcionan algunos medicamentos, y algunos medicamentos pueden afectar la forma en que funciona TRULICITY. Antes de usar TRULICITY, informe a su proveedor de atención médica si está tomando otros medicamentos para tratar la diabetes, incluida la insulina o las sulfonilureas, que podrían aumentar su riesgo de hipoglucemia. Hable con su proveedor de atención médica sobre la hipoglucemia y cómo controlarla. Conozca los medicamentos que toma. Lleve una lista de ellos para mostrársela a su proveedor de atención médica y farmacéutico cuando obtenga un nuevo medicamento. |
||||||||
¿Cómo debo usar TRULICITY?
|
||||||||
| ¿Cuáles son los posibles efectos secundarios de TRULICITY? TRULICITY puede causar efectos secundarios graves, que incluyen:
|
||||||||
| Los efectos secundarios más comunes de TRULICITY pueden incluir: | ||||||||
|
|
|||||||
| Informe a su proveedor de atención médica si tiene algún efecto secundario que le moleste o que no desaparezca. Estos no son todos los posibles efectos secundarios de TRULICITY. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088. | ||||||||
| Información general sobre el uso seguro y eficaz de TRULICITY. Los medicamentos a veces se recetan para fines distintos de los que se enumeran en una Guía de medicamentos. No use TRULICITY para una afección para la que no se lo recetaron. No le dé TRULICITY a otras personas, incluso si tienen los mismos síntomas que usted. Puede causarles daño. Esta Guía de medicamentos resume la información más importante sobre TRULICITY. Si desea más información, hable con su proveedor de atención médica. Puede pedirle a su farmacéutico o proveedor de atención médica información sobre TRULICITY que esté escrita para profesionales de la salud. |
||||||||
| ¿Cuáles son los ingredientes de TRULICITY? Ingrediente activo: dulaglutida Ingredientes inactivos: ácido cítrico anhidro, manitol, polisorbato 80, citrato trisódico dihidrato, en agua para inyección TRULICITY® es una marca registrada de Eli Lilly and Company. Fabricado por: Eli Lilly and Company, Indianápolis, IN 46285, EE. UU., Número de licencia de EE. UU. 1891 www.TRULICITY.com. Copyright © 2014, 2024, Eli Lilly and Company. Todos los derechos reservados. Para obtener más información, visite www.TRULICITY.com o llame al 1-800-545-5979. |
||||||||
Instrucciones de uso de TRULICITY 0.75 MG, pluma de dosis única
| Antes de comenzar | |||
| Retire | Compruebe | Inspeccione | Prepare |
| Retire el bolígrafo del refrigerador. Deje puesto el tapón de la base hasta que esté listo para inyectarse. |
Compruebe la etiqueta del bolígrafo para asegurarse de que tiene el medicamento correcto y que no ha caducado. | Compruebe que el bolígrafo no esté dañado e inspeccione el medicamento para asegurarse de que no esté turbio, decolorado o que no tenga partículas. | Lávese las manos. |
| Elija el lugar de inyección | |||
| Su proveedor de atención médica puede ayudarle a elegir el lugar de inyección que mejor le convenga. | |||
Instrucciones de uso de TRULICITY 1.5 MG pluma de dosis única
| Antes de comenzar | ||||
| Retire | Compruebe | Inspeccione | Prepare | |
| Retire la pluma del refrigerador. Deje puesta la tapa de la base hasta que esté listo para inyectarse. |
Compruebe la etiqueta de la pluma para asegurarse de que tiene el medicamento correcto y que no ha caducado. | Compruebe que la pluma no esté dañada e inspeccione el medicamento para asegurarse de que no esté turbio, decolorado o que no tenga partículas. | Lávese las manos. | |
| Elija el lugar de la inyección | ||||
| Su proveedor de atención médica puede ayudarle a elegir el lugar de la inyección que sea mejor para usted. | ||||
| Almacenamiento y manipulación |
|
Instrucciones de uso del bolígrafo de dosis única TRULICITY 3 MG
| Instrucciones de uso | ||
| TRULICITY®(TRU-li-si-tee) (dulaglutida) inyección, para uso subcutáneo Bolígrafo de dosis única de 3 mg/0.5 mL usar 1 vez por semana (una vez por semana) |
||
 |
||
 |
||
Información sobre el bolígrafo de dosis única de TRULICITY
Lea atentamente estas instrucciones de uso y la guía del medicamento antes de usar el bolígrafo de dosis única de TRULICITY. Consulte con su profesional sanitario sobre la forma correcta de inyectarse TRULICITY.
- El bolígrafo de dosis única de TRULICITY (bolígrafo) es un dispositivo desechable de administración de medicamentos prellenado. Cada bolígrafo contiene 1 dosis de TRULICITY (3 mg/0.5 mL). Cada bolígrafo solo debe usarse 1 vez.
- TRULICITY se usa 1 vez por semana. Puede marcar su calendario para recordar cuándo debe tomar su próxima dosis.
Antes de comenzar
| Retire | Compruebe | Inspeccione | Prepare |
| Retire el bolígrafo del refrigerador. Deje puesto el tapón de la base hasta que esté listo para inyectarse. |
Compruebe la etiqueta del bolígrafo para asegurarse de que tiene el medicamento correcto y que no ha caducado. Fecha de caducidad |
Compruebe que el bolígrafo no esté dañado e inspeccione el medicamento para asegurarse de que no esté turbio, decolorado o que no tenga partículas. | Lávese las manos. |
Elija el lugar de inyección
Su profesional sanitario puede ayudarle a elegir el lugar de inyección que mejor le convenga.
Información importante
Eliminación del bolígrafo
Almacenamiento y manipulación
Preguntas frecuentes
Otra información
Dónde obtener más información
Almacenamiento y manipulación
- Conserve su pluma en el refrigerador entre 2°C y 8°C (36°F a 46°F).
- Puede conservar su pluma a temperatura ambiente por debajo de 30°C (86°F) durante un máximo de 14 días.
- No congele su pluma. Si la pluma se ha congelado, deséchela y utilice una pluma nueva.
- Se recomienda conservar la pluma en su embalaje original. Proteja su pluma del calor y la luz directos.
- La pluma tiene piezas de vidrio. Manipúlela con cuidado. Si se cae sobre una superficie dura, no la utilice. Utilice una pluma nueva para su inyección.
- Mantenga su pluma TRULICITY y todos los medicamentos fuera del alcance de los niños.
Preguntas frecuentes
¿Qué ocurre si veo burbujas de aire en mi pluma?
Las burbujas de aire son normales.
¿Qué ocurre si desbloqueo la pluma y presiono el botón verde de inyección antes de retirar la tapa base?
No retire la tapa base. Deseche la pluma y consiga una nueva.
¿Qué ocurre si hay una gota de líquido en la punta de la aguja al retirar la tapa base?
Una gota de líquido en la punta de la aguja es normal.
¿Necesito mantener presionado el botón de inyección hasta que se complete la inyección?
Esto no es necesario, pero puede ayudarle a mantener la pluma estable y firme contra la piel.
He oído más de 2 clics durante mi inyección: 2 clics más fuertes y 1 suave. ¿He recibido mi inyección completa?
Algunas personas pueden oír un clic suave justo antes del segundo clic fuerte. Ese es el funcionamiento normal de la pluma. No retire la pluma de la piel hasta que oiga el segundo clic más fuerte.
¿Qué ocurre si hay una gota de líquido o sangre en mi piel después de la inyección?
Esto es normal.
No estoy seguro de si mi pluma ha funcionado correctamente.
Compruebe si ha recibido su dosis. Su dosis se administró correctamente si el émbolo gris es visible (véase el paso 3). También póngase en contacto con Lilly al 1-800-Lilly-Rx (1-800-545-5979) para obtener más instrucciones. Mientras tanto, guarde su pluma de forma segura para evitar una punción accidental con la aguja.
Otra información
- Si tiene problemas de visión, no utilice su pluma sin la ayuda de una persona capacitada para utilizar la pluma TRULICITY.
Dónde obtener más información
- Si tiene alguna pregunta o problema con su pluma de dosis única TRULICITY, póngase en contacto con Lilly al 1-800-Lilly-Rx (1-800-545-5979) o llame a su proveedor de atención médica.
- Para obtener más información sobre la pluma de dosis única TRULICITY, visite nuestro sitio web en: www.trulicity.com.
Estas instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los EE. UU.
Eli Lilly and Company
Indianapolis, IN 46285, EE. UU.
Número de licencia de EE. UU. 1891
TRULICITY es una marca comercial registrada de Eli Lilly and Company.
Copyright © 2020, 2023, Eli Lilly and Company. Todos los derechos reservados.
La pluma TRULICITY cumple con los requisitos actuales de precisión de la dosis y funcionalidad de ISO 11608-1:2012 y 11608-5:2012.
Implementado: 04/2023
TRU3MG-0002-IFU-20230407
Instrucciones de uso de TRULICITY 4.5 MG pluma de dosis única
| Instrucciones de uso | ||
| TRULICITY®(TRU-li-si-tee) (dulaglutida) inyección, para uso subcutáneo Bolígrafo de dosis única de 4.5 mg/0.5 mL usar 1 vez por semana (una vez por semana) |
||
Información sobre el bolígrafo de dosis única de TRULICITY
Lea atentamente estas instrucciones de uso y la guía del medicamento antes de usar su bolígrafo de dosis única de TRULICITY. Consulte con su proveedor de atención médica sobre la forma correcta de inyectarse TRULICITY.
- El bolígrafo de dosis única de TRULICITY (bolígrafo) es un dispositivo de administración de medicamentos desechable y prellenado. Cada bolígrafo contiene 1 dosis de TRULICITY (4.5 mg/0.5 mL). Cada bolígrafo solo debe usarse 1 vez.
- TRULICITY se usa 1 vez por semana. Puede marcar su calendario para recordar cuándo debe tomar su próxima dosis.
Antes de comenzar
| Retire | Compruebe | Inspeccione | Prepare |
| Retire el bolígrafo del refrigerador. Deje puesto el tapón de la base hasta que esté listo para inyectarse. |
Compruebe la etiqueta del bolígrafo para asegurarse de que tiene el medicamento correcto y que no ha caducado. Fecha de caducidad |
Compruebe que el bolígrafo no esté dañado e inspeccione el medicamento para asegurarse de que no esté turbio, decolorado o que no tenga partículas. | Lávese las manos. |
Elija el sitio de inyección
Su proveedor de atención médica puede ayudarle a elegir el sitio de inyección que mejor le convenga.
Información importante
Eliminación del bolígrafo
Almacenamiento y manipulación
Preguntas frecuentes
Otra información
Dónde obtener más información
Almacenamiento y manipulación
- Conserve su pluma en el refrigerador entre 2°C y 8°C (36°F a 46°F).
- Puede conservar su pluma a temperatura ambiente por debajo de 30°C (86°F) durante un máximo de 14 días.
- No congele su pluma. Si la pluma se ha congelado, deséchela y utilice una pluma nueva.
- Se recomienda conservar la pluma en su embalaje original. Proteja su pluma del calor y la luz directos.
- La pluma tiene piezas de vidrio. Manipúlela con cuidado. Si se cae sobre una superficie dura, no la utilice. Utilice una pluma nueva para su inyección.
- Mantenga su pluma TRULICITY y todos los medicamentos fuera del alcance de los niños.
Preguntas frecuentes
¿Qué ocurre si veo burbujas de aire en mi pluma?
Las burbujas de aire son normales.
¿Qué ocurre si desbloqueo la pluma y presiono el botón verde de inyección antes de retirar la tapa de la base?
No retire la tapa de la base. Deseche la pluma y consiga una nueva.
¿Qué ocurre si hay una gota de líquido en la punta de la aguja al retirar la tapa de la base?
Una gota de líquido en la punta de la aguja es normal.
¿Debo mantener presionado el botón de inyección hasta que se complete la inyección?
Esto no es necesario, pero puede ayudarle a mantener la pluma estable y firme contra la piel.
He oído más de 2 clics durante mi inyección: 2 clics más fuertes y 1 suave. ¿He recibido mi inyección completa?
Algunas personas pueden oír un clic suave justo antes del segundo clic fuerte. Ese es el funcionamiento normal de la pluma. No retire la pluma de la piel hasta que oiga el segundo clic más fuerte.
¿Qué ocurre si hay una gota de líquido o sangre en mi piel después de la inyección?
Esto es normal.
No estoy seguro de si mi pluma ha funcionado correctamente.
Compruebe si ha recibido su dosis. Su dosis se administró correctamente si el émbolo gris es visible (véase el paso 3). También póngase en contacto con Lilly al 1-800-Lilly-Rx (1-800-545-5979) para obtener más instrucciones. Mientras tanto, guarde su pluma de forma segura para evitar una punción accidental con la aguja.
Otra información
- Si tiene problemas de visión, no utilice su pluma sin la ayuda de una persona capacitada para utilizar la pluma TRULICITY.
Dónde obtener más información
- Si tiene alguna pregunta o problema con su pluma TRULICITY de dosis única, póngase en contacto con Lilly al 1-800-Lilly-Rx (1-800-545-5979) o llame a su proveedor de atención médica.
- Para obtener más información sobre la pluma TRULICITY de dosis única, visite nuestro sitio web en: www.trulicity.com.
Estas instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de EE. UU.
Eli Lilly and Company
Indianapolis, IN 46285, EE. UU.
Número de licencia de EE. UU. 1891
TRULICITY es una marca comercial registrada de Eli Lilly and Company.
Copyright © 2020, 2023, Eli Lilly and Company. Todos los derechos reservados.
La pluma TRULICITY cumple con los requisitos actuales de precisión de la dosis y funcionalidad de ISO 11608-1:2012 y 11608-5:2012.
Implementado: 04/2023
TRU4.5MG-0002-IFU-20230407
ETIQUETA DEL ENVASE – Trulicity®, 0,75 mg/0,5 mL, Bolígrafos de Dosis Única
NDC 0002-1433-80
4 Bolígrafos de dosis única
Cada bolígrafo administra una dosis de 0.75 mg.
Usar un bolígrafo cada semana.
trulilcity®
(dulaglutida) inyección
0.75 mg/0.5 mL
una vez por semana
Sólo con receta médica
Sólo para uso subcutáneo
Dosis única
Entregue la Guía del medicamento adjunta a cada paciente.
www.trulicity.com
Lilly
ETIQUETA DEL ENVASE – Trulicity®, 1,5 mg/0,5 mL, Bolígrafos de Dosis Única
NDC 0002-1434-80
4 Bolígrafos de dosis única
Cada bolígrafo administra una dosis de 1.5 mg.
Usar un bolígrafo cada semana.
trulicity®
(dulaglutida) inyección
1.5 mg/0.5 mL
una vez por semana
Sólo con receta médica
Sólo para uso subcutáneo
Dosis única
Entregue la Guía del medicamento adjunta a cada paciente.
www.trulicity.com
Lilly
ETIQUETA DEL ENVASE – Trulicity®, 3 mg/0,5 mL, plumas de dosis única
NDC 0002-2236-80
4 Bolígrafos de dosis única
Cada bolígrafo administra una dosis de 3 mg.
Usar un bolígrafo cada semana.
trulicity®
(dulaglutida) inyección
3 mg/0.5 mL
una vez por semana
Sólo con receta médica
Sólo para uso subcutáneo
Dosis única
Entregue la Guía del medicamento adjunta a cada paciente.
www.trulicity.com
Lilly
ETIQUETA DEL ENVASE – Trulicity®, 4,5 mg/0,5 mL, Bolígrafos de Dosis Única
NDC 0002-3182-80
4 Bolígrafos de dosis única
Cada bolígrafo administra una dosis de 4,5 mg.
Usar un bolígrafo cada semana.
trulicity®
(dulaglutida) inyección
4,5 mg/0,5 mL
una vez por semana
Sólo con receta médica
Sólo para uso subcutáneo
Dosis única
Entregue la Guía del medicamento adjunta a cada paciente.
www.trulicity.com
Lilly


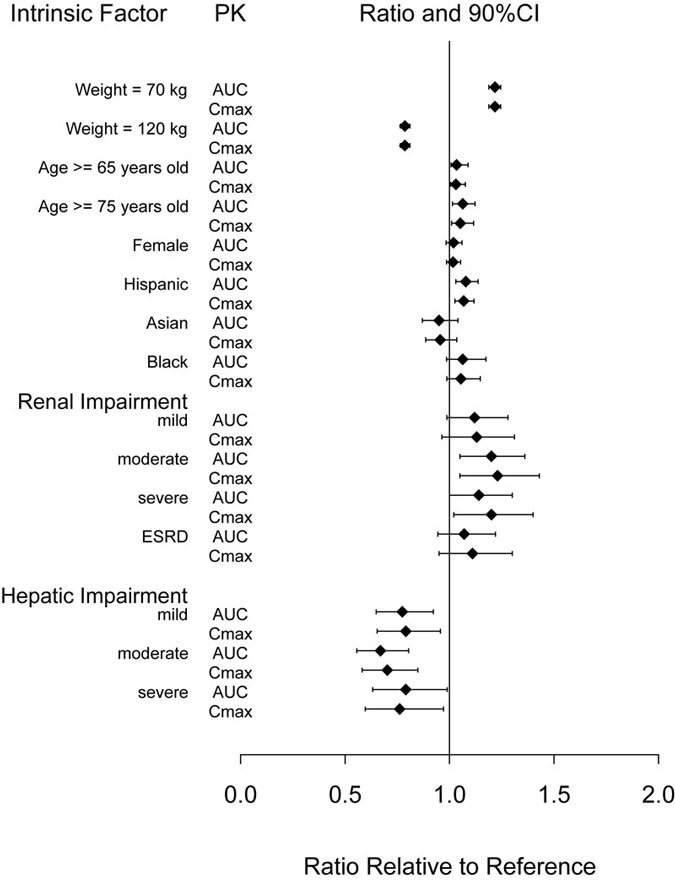
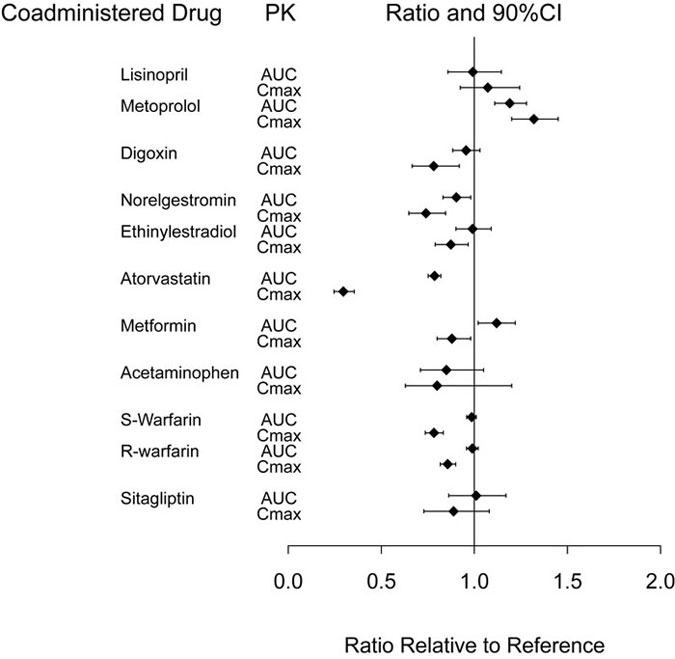
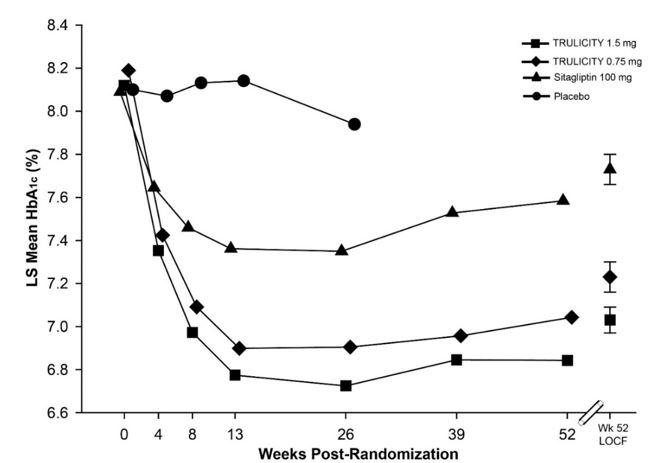
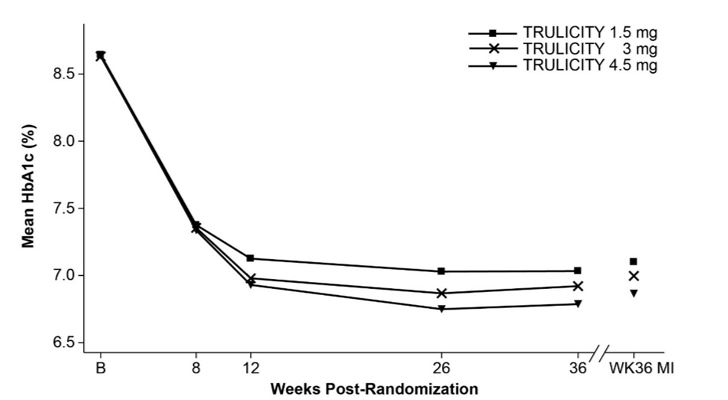
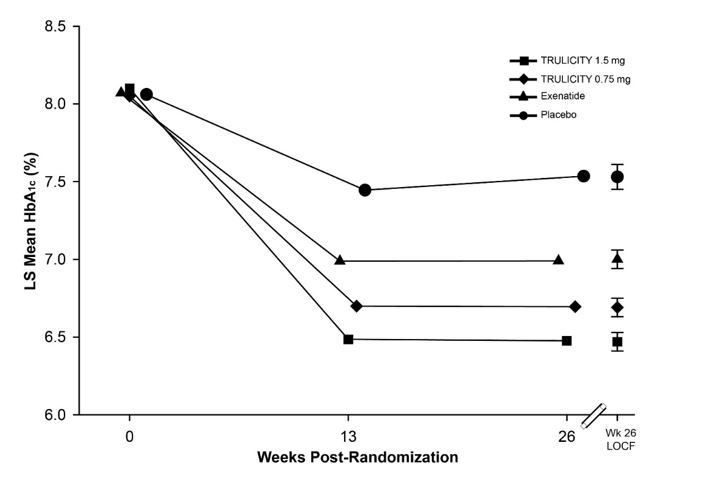
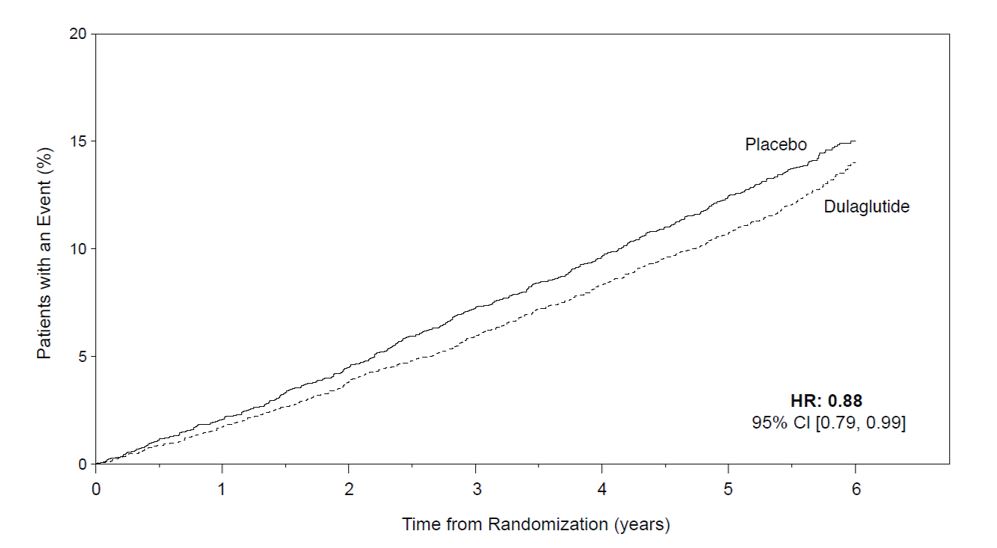






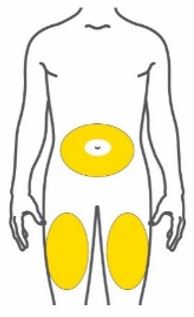
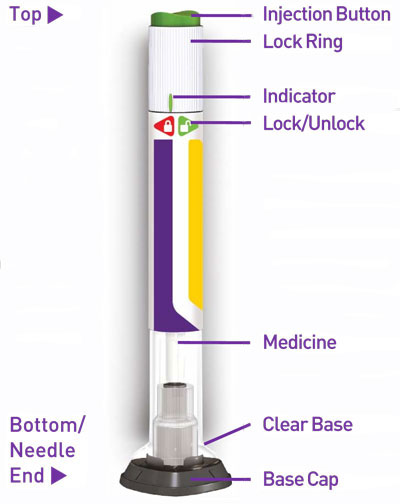
 Asegúrese de que el bolígrafo esté
Asegúrese de que el bolígrafo esté 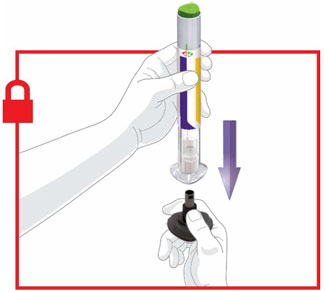

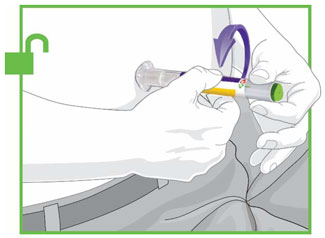
 Continúe sosteniendo la base transparente firmemente contra su piel hasta que escuche un segundo clic. Esto ocurre cuando la aguja comienza a retraerse en aproximadamente 5 a 10 segundos.
Continúe sosteniendo la base transparente firmemente contra su piel hasta que escuche un segundo clic. Esto ocurre cuando la aguja comienza a retraerse en aproximadamente 5 a 10 segundos.