Fabricante de medicamentos: Janssen Biotech, Inc. (Updated: 2024-09-23)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
TREMFYA
®(guselkumab) inyección, para uso subcutáneo
TREMFYA
®PEN (guselkumab) inyección, para uso subcutáneo
TREMFYA
®(guselkumab) inyección, para uso intravenoso
Aprobación inicial en EE. UU.: 2017
CAMBIOS RECIENTES IMPORTANTES
INDICACIONES Y USO
DOSIFICACIÓN Y ADMINISTRACIÓN
- Complete todas las vacunas apropiadas para la edad según lo recomendado por las pautas de inmunización actuales antes de iniciar el tratamiento. (
2.1)
Dosificación recomendada
Psoriasis en placas
- 100 mg administrados por inyección subcutánea en la semana 0, la semana 4 y cada 8 semanas a partir de entonces. (
2.2)
Artritis psoriásica
- 100 mg administrados por inyección subcutánea en la semana 0, la semana 4 y cada 8 semanas a partir de entonces. TREMFYA se puede usar solo o en combinación con un DMARD convencional (por ejemplo, metotrexato). (
2.3)
Colitis ulcerosa
-
Inducción:
200 mg administrados por infusión intravenosa durante al menos una hora en la semana 0, la semana 4 y la semana 8. (
2.4) -
Mantenimiento: 100 mg administrados por inyección subcutánea en la semana 16 y cada 8 semanas a partir de entonces, o 200 mg administrados por inyección subcutánea en la semana 12 y cada 4 semanas a partir de entonces. Use la dosis recomendada efectiva más baja para mantener la respuesta terapéutica. (
2.4)
FORMAS Y FUERZAS DE DOSIFICACIÓN
Inyección subcutánea (
3)
- Inyección: 100 mg/mL en un inyector de un solo uso controlado por el paciente One-Press.
- Inyección: 200 mg/2 mL en un bolígrafo precargado de dosis única (TREMFYA PEN).
- Inyección: 100 mg/mL en una jeringa precargada de dosis única.
- Inyección: 200 mg/2 mL en una jeringa precargada de dosis única.
Infusión intravenosa (
3)
- Inyección: 200 mg/20 mL (10 mg/mL) solución en un vial de dosis única.
CONTRAINDICACIONES
Reacciones de hipersensibilidad graves a guselkumab o a cualquiera de los excipientes. (
4)
ADVERTENCIAS Y PRECAUCIONES
-
Reacciones de hipersensibilidad: Pueden ocurrir reacciones de hipersensibilidad graves, incluida la anafilaxia. (
5.1) -
Infecciones: TREMFYA puede aumentar el riesgo de infección. No inicie el tratamiento con TREMFYA en pacientes con infección activa clínicamente importante hasta que la infección se resuelva o se trate adecuadamente. Si se desarrolla dicha infección, suspenda TREMFYA hasta que la infección se resuelva. (
5.2) -
Tuberculosis (TB): Evalúe la TB antes de iniciar el tratamiento con TREMFYA. (
5.3) -
Inmunizaciones: Evite el uso de vacunas vivas. (
5.4)
REACCIONES ADVERSAS
Las reacciones adversas más comunes asociadas con TREMFYA son:
-
Psoriasis en placas y artritis psoriásica(≥1%): infecciones del tracto respiratorio superior, dolor de cabeza, reacciones en el sitio de inyección, artralgia, bronquitis, diarrea, gastroenteritis, infecciones por tiña y herpes simple. (
6.1) - Colitis ulcerosa
-
Inducción(≥2%): infecciones del tracto respiratorio. (
6.1) -
Mantenimiento(≥3%): reacciones en el sitio de inyección, artralgia e infección del tracto respiratorio superior. (
6.1)
Para informar sobre REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Janssen Biotech, Inc. al 1-800-526-7736 o con la FDA al 1-800-FDA-1088 o
www.fda.gov/medwatch.
Consulte 17 para obtener INFORMACIÓN PARA EL PACIENTE y la Guía de medicamentos.
Revisado: 9/2024
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
1.1 Psoriasis en Placas
1.2 Artritis Psoriásica
1.3 Colitis Ulcerosa
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Evaluaciones y Vacunaciones Recomendadas Antes del Inicio del Tratamiento
2.2 Dosis Recomendada para Psoriasis en Placas
2.3 Dosis Recomendada para Artritis Psoriásica
2.4 Dosis Recomendada para Colitis Ulcerosa
2.5 Instrucciones de Preparación y Administración para Inyección Subcutánea
2.6 Instrucciones de Preparación y Administración para Infusión Intravenosa (Colitis Ulcerosa)
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de Hipersensibilidad
5.2 Infecciones
5.3 Evaluación Previa al Tratamiento para Tuberculosis
5.4 Vacunaciones
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Postcomercialización
7 INTERACCIONES MEDICAMENTOSAS
7.1 Sustratos de CYP450
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
12.6 Inmunogenicidad
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Psoriasis en Placas
14.2 Artritis Psoriásica
14.3 Colitis Ulcerosa
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANEJO
16.1 Forma de Suministro
16.2 Almacenamiento y Manejo
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
1 INDICACIONES Y USO
1.1 Psoriasis en placas
TREMFYA está indicado para el tratamiento de pacientes adultos con psoriasis en placas de moderada a grave que son candidatos a terapia sistémica o fototerapia.
1.2 Artritis psoriásica
TREMFYA está indicado para el tratamiento de pacientes adultos con artritis psoriásica activa.
1.3 Colitis ulcerosa
TREMFYA está indicado para el tratamiento de pacientes adultos con colitis ulcerosa de moderada a gravemente activa.
2 DOSIS Y ADMINISTRACIÓN
2.1 Evaluaciones e Inmunizaciones Recomendadas Antes de Iniciar el Tratamiento
-
Evaluar a los pacientes para detectar infección por tuberculosis (TB) antes de iniciar el tratamiento con TREMFYA
[ver
Advertencias y Precauciones (5.3)]
.
-
Completar todas las vacunas apropiadas para la edad de acuerdo con las pautas de inmunización actuales
[ver
Advertencias y Precauciones (5.4)]
.
2.2 Dosis Recomendada para la Psoriasis en Placas
TREMFYA se administra mediante inyección subcutánea. La dosis recomendada es de 100 mg en la Semana 0, la Semana 4 y cada 8 semanas a partir de entonces.
2.3 Dosis Recomendada para la Artritis Psoriásica
TREMFYA se administra mediante inyección subcutánea. La dosis recomendada es de 100 mg en la Semana 0, la Semana 4 y cada 8 semanas a partir de entonces.
TREMFYA puede administrarse solo o en combinación con un fármaco antirreumático modificador de la enfermedad convencional (cDMARD) (por ejemplo, metotrexato).
2.4 Dosis Recomendada para la Colitis Ulcerosa
Inducción:
La dosis de inducción recomendada de TREMFYA es de 200 mg administrada mediante infusión intravenosa durante al menos una hora en la Semana 0, la Semana 4 y la Semana 8
[ver
.
Mantenimiento:
La dosis de mantenimiento recomendada de TREMFYA/TREMFYA PEN es:
- 100 mg administrados mediante inyección subcutánea en la Semana 16 y cada 8 semanas a partir de entonces, o
- 200 mg administrados mediante inyección subcutánea en la Semana 12 y cada 4 semanas a partir de entonces.
Utilizar la dosis recomendada efectiva más baja para mantener la respuesta terapéutica.
2.5 Instrucciones de Preparación y Administración para la Inyección Subcutánea
- Administrar TREMFYA/TREMFYA PEN por vía subcutánea. Cada jeringa precargada, inyector One-Press o pluma precargada es para un solo uso en un solo paciente. Instruir a los pacientes para que inyecten la cantidad total (1 mL o 2 mL), lo que proporciona 100 mg o 200 mg de TREMFYA.
- TREMFYA/TREMFYA PEN está destinado a ser utilizado bajo la guía y supervisión de un profesional sanitario. TREMFYA/TREMFYA PEN puede ser administrado por un profesional sanitario, o un paciente/cuidador puede inyectarlo después de una capacitación adecuada sobre la técnica correcta de inyección subcutánea.
- Antes de la inyección, retire TREMFYA/TREMFYA PEN del refrigerador y deje que alcance la temperatura ambiente (30 minutos) sin quitar la tapa de la aguja.
- Inyectar en la parte delantera de los muslos, la parte inferior del abdomen excepto las 2 pulgadas alrededor del ombligo, o la parte posterior de la parte superior de los brazos (solo profesional sanitario o cuidador).
-
No inyectar TREMFYA/TREMFYA PEN en áreas donde la piel esté sensible, magullada, roja, dura, gruesa, escamosa o afectada por psoriasis
[ver
Instrucciones de uso].
-
El TREMFYA/TREMFYA PEN
Instrucciones de uso contiene instrucciones más detalladas para el paciente sobre la preparación y administración de TREMFYA/TREMFYA PEN
[ver
Instrucciones de uso]
.
- Si se olvida una dosis, administrarla lo antes posible. A partir de entonces, reanudar la dosificación en el momento programado habitual.
- Inspeccionar TREMFYA/TREMFYA PEN visualmente para detectar partículas y decoloración antes de la administración. TREMFYA/TREMFYA PEN es una solución clara e incolora a ligeramente amarilla que puede contener pequeñas partículas traslúcidas. No utilizar si el líquido contiene partículas grandes, está decolorado o turbio. TREMFYA/TREMFYA PEN no contiene conservantes; por lo tanto, desechar cualquier producto no utilizado que quede en la jeringa precargada, el inyector One-Press o la pluma precargada.
2.6 Instrucciones de Preparación y Administración para la Infusión Intravenosa (Colitis Ulcerosa)
Instrucciones de preparación:
- Retire y luego descarte 20 mL de la Inyección de Cloruro de Sodio al 0.9% del contenedor de infusión de 250 mL, lo que equivale al volumen de TREMFYA que se agregará.
- Retire 20 mL de TREMFYA del vial y agréguelo al contenedor de infusión intravenosa de 250 mL de Inyección de Cloruro de Sodio al 0.9% para una concentración final de 0.8 mg/mL. Mezcle suavemente la solución diluida. Deseche el vial con cualquier solución restante.
- Inspeccione visualmente la solución diluida para detectar partículas y decoloración antes de la infusión. Infunda la solución diluida durante un período de al menos una hora.
- Utilice únicamente un equipo de infusión con un filtro en línea, estéril, no pirogénico, de baja unión a proteínas (tamaño de poro de 0.2 micrómetros).
- No infunda TREMFYA de forma concomitante en la misma línea intravenosa con otros productos medicinales.
- Deseche cualquier producto medicinal no utilizado de acuerdo con los requisitos locales.
Instrucciones de administración:
- La solución de TREMFYA para infusión intravenosa debe ser diluida, preparada e infundida por un profesional sanitario utilizando una técnica aséptica. TREMFYA no contiene conservantes. Cada vial es para un solo uso en un solo paciente.
- Inspeccione TREMFYA visualmente para detectar partículas y decoloración antes de la administración. TREMFYA es una solución clara e incolora a ligeramente amarilla que puede contener pequeñas partículas traslúcidas. No lo use si el líquido contiene partículas grandes, está decolorado o turbio.
Almacenamiento de la solución diluida:
- La solución de infusión diluida se puede conservar a temperatura ambiente hasta 25 °C (77 °F) durante un máximo de 10 horas. El tiempo de almacenamiento a temperatura ambiente comienza una vez que se ha preparado la solución diluida. La infusión debe completarse dentro de las 10 horas posteriores a la dilución en el contenedor de infusión.
- No congelar.
- Deseche cualquier porción no utilizada de la solución de infusión.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
TREMFYA/TREMFYA PEN es una solución transparente e incolora a amarillo claro.
Inyección Subcutánea
- Inyección: 100 mg/mL en un inyector de dosis única One-Press controlado por el paciente.
- Inyección: 200 mg/2 mL en una pluma precargada de dosis única (TREMFYA PEN).
- Inyección: 100 mg/mL en una jeringa precargada de dosis única.
- Inyección: 200 mg/2 mL en una jeringa precargada de dosis única.
4 CONTRAINDICACIONES
TREMFYA está contraindicado en pacientes con antecedentes de reacción de hipersensibilidad grave a guselkumab o a cualquiera de los excipientes
[ver
Advertencias y precauciones (5.1)]
.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de hipersensibilidad
Se han notificado reacciones de hipersensibilidad graves, incluida la anafilaxia, con el uso posterior a la comercialización de TREMFYA. Algunos casos requirieron hospitalización. Si se produce una reacción de hipersensibilidad grave, suspenda TREMFYA e inicie la terapia adecuada.
5.2 Infecciones
TREMFYA puede aumentar el riesgo de infección. En ensayos clínicos en sujetos con psoriasis en placas, las infecciones ocurrieron en el 23% de los sujetos en el grupo TREMFYA frente al 21% de los sujetos en el grupo placebo durante las 16 semanas de tratamiento. Las infecciones del tracto respiratorio superior, la gastroenteritis, las infecciones por tiña y las infecciones por herpes simple ocurrieron con mayor frecuencia en el grupo TREMFYA que en el grupo placebo
[ver
Reacciones adversas (6.1)]
. La tasa de infecciones graves para el grupo TREMFYA y el grupo placebo fue ≤ 0,2%. Se observó un riesgo similar de infección en ensayos controlados con placebo en sujetos con artritis psoriásica y colitis ulcerosa. No se debe iniciar el tratamiento con TREMFYA en pacientes con cualquier infección activa clínicamente importante hasta que la infección se resuelva o se trate adecuadamente.
En pacientes con una infección crónica o antecedentes de infección recurrente, considere los riesgos y beneficios antes de prescribir TREMFYA. Indique a los pacientes que busquen ayuda médica si se presentan signos o síntomas de infección crónica o aguda clínicamente importante. Si un paciente desarrolla una infección clínicamente importante o grave o no responde a la terapia estándar, controle al paciente de cerca y suspenda TREMFYA hasta que la infección se resuelva.
5.3 Evaluación previa al tratamiento para la tuberculosis
Evalúe a los pacientes para detectar infección por tuberculosis (TB) antes de iniciar el tratamiento con TREMFYA. Inicie el tratamiento de la TB latente antes de administrar TREMFYA. En ensayos clínicos, 105 sujetos con psoriasis en placas, 71 sujetos con artritis psoriásica y 31 sujetos con colitis ulcerosa con TB latente que fueron tratados simultáneamente con TREMFYA y profilaxis adecuada para la TB no desarrollaron TB activa. Controle a los pacientes para detectar signos y síntomas de TB activa durante y después del tratamiento con TREMFYA. Considere la terapia anti-TB antes de iniciar TREMFYA en pacientes con antecedentes de TB latente o activa en quienes no se puede confirmar un curso de tratamiento adecuado. No administre TREMFYA a pacientes con infección activa por TB.
5.4 Inmunizaciones
Evite el uso de vacunas vivas en pacientes tratados con TREMFYA. Los medicamentos que interactúan con el sistema inmunitario pueden aumentar el riesgo de infección después de la administración de vacunas vivas. Antes de iniciar la terapia con TREMFYA, complete todas las vacunas apropiadas para la edad de acuerdo con las pautas de inmunización actuales. No hay datos disponibles sobre la respuesta a las vacunas vivas o inactivas.
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas se discuten con mayor detalle en otras secciones del etiquetado:
- Reacciones de hipersensibilidad
[ver
Contraindicaciones (4) y
Advertencias y precauciones (5.1)]
- Infecciones
[ver
Advertencias y precauciones (5.2)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica.
Psoriasis en placas
En los ensayos clínicos, un total de 1823 sujetos con psoriasis en placas de moderada a grave recibieron TREMFYA. De estos, 1393 sujetos estuvieron expuestos a TREMFYA durante al menos 6 meses y 728 sujetos estuvieron expuestos durante al menos 1 año.
Los datos de dos ensayos controlados con placebo y activos (PsO1 y PsO2) en 1441 sujetos (edad media 44 años; 70% hombres; 82% blancos) se agruparon para evaluar la seguridad de TREMFYA (100 mg administrados por vía subcutánea en las semanas 0 y 4, seguido de cada 8 semanas).
Semanas 0 a 16:
En el período controlado con placebo de 16 semanas de los ensayos clínicos agrupados (PsO1 y PsO2), los eventos adversos ocurrieron en el 49% de los sujetos en el grupo TREMFYA en comparación con el 47% de los sujetos en el grupo placebo y el 49% de los sujetos en el grupo adalimumab con licencia en EE. UU. Los eventos adversos graves ocurrieron en el 1.9% de los sujetos en el grupo TREMFYA (6.3 eventos por 100 años-sujeto de seguimiento) en comparación con el 1.4% de los sujetos en el grupo placebo (4.7 eventos por 100 años-sujeto de seguimiento), y en el 2.6% de los sujetos en el grupo adalimumab con licencia en EE. UU. (9.9 eventos por 100 años-sujeto de seguimiento).
La Tabla 1 resume las reacciones adversas que ocurrieron a una tasa de al menos el 1% y a una tasa más alta en el grupo TREMFYA que en el grupo placebo durante el período controlado con placebo de 16 semanas.
| TREMFYA
* |
Adalimumab
† |
Placebo N=422 n (%) |
|
|---|---|---|---|
|
|||
| Infecciones de las vías respiratorias superiores | 118 (14.3) | 21 (10.7) | 54 (12.8) |
| Dolor de cabeza | 38 (4.6) | 2 (1.0) | 14 (3.3) |
| Reacciones en el sitio de inyección | 37 (4.5) | 15 (7.7) | 12 (2.8) |
| Artralgia | 22 (2.7) | 4 (2.0) | 9 (2.1) |
| Diarrea | 13 (1.6) | 3 (1.5) | 4 (0.9) |
| Gastroenteritis | 11 (1.3) | 4 (2.0) | 4 (0.9) |
| Infecciones por tiña | 9 (1.1) | 0 | 0 |
| Infecciones por herpes simplex | 9 (1.1) | 0 | 2 (0.5) |
Las reacciones adversas que ocurrieron en < 1% pero > 0.1% de los sujetos en el grupo TREMFYA y a una tasa más alta que en el grupo placebo hasta la semana 16 en PsO1 y PsO2 fueron migraña, infecciones por cándida y urticaria.
Reacciones adversas específicas
Infecciones
Las infecciones ocurrieron en el 23% de los sujetos en el grupo TREMFYA en comparación con el 21% de los sujetos en el grupo placebo.
Las infecciones más comunes (≥ 1%) fueron infecciones del tracto respiratorio superior, gastroenteritis, infecciones por tiña e infecciones por herpes simple; todos los casos fueron de gravedad leve a moderada y no llevaron a la interrupción de TREMFYA.
Elevación de las enzimas hepáticas
Se informó con más frecuencia de elevación de las enzimas hepáticas en el grupo TREMFYA (2.6%) que en el grupo placebo (1.9%). De los 21 sujetos a los que se informó que tenían elevación de las enzimas hepáticas en el grupo TREMFYA, todos los eventos, excepto uno, fueron de gravedad leve a moderada y ninguno de los eventos llevó a la interrupción de TREMFYA.
Artritis psoriásica
TREMFYA se estudió en dos ensayos controlados con placebo en sujetos con artritis psoriásica (748 sujetos con TREMFYA y 372 sujetos con placebo). De los 748 sujetos que recibieron TREMFYA, 375 sujetos recibieron TREMFYA 100 mg en la semana 0, la semana 4 y cada 8 semanas a partir de entonces y 373 sujetos recibieron TREMFYA 100 mg cada 4 semanas. El perfil de seguridad general observado en sujetos con artritis psoriásica tratados con TREMFYA es generalmente consistente con el perfil de seguridad en sujetos con psoriasis en placas con la adición de bronquitis y disminución del recuento de neutrófilos. En el período controlado con placebo de 24 semanas, combinado en los dos estudios, la bronquitis ocurrió en el 1.6% de los sujetos en el grupo TREMFYA q8w y el 2.9% de los sujetos en el grupo TREMFYA q4w en comparación con el 1.1% de los sujetos en el grupo placebo. La disminución del recuento de neutrófilos ocurrió en el 0.3% de los sujetos en el grupo TREMFYA q8w y el 1.6% de los sujetos en el grupo TREMFYA q4w en comparación con el 0% de los sujetos en el grupo placebo. La mayoría de los eventos de disminución del recuento de neutrófilos fueron leves, transitorios, no asociados con infección y no llevaron a la interrupción.
Colitis ulcerosa
TREMFYA se estudió hasta por 12 semanas en sujetos con colitis ulcerosa activa moderada a grave en un estudio de inducción aleatorizado, doble ciego, controlado con placebo (UC1) y un estudio de búsqueda de dosis de inducción aleatorizado, doble ciego, controlado con placebo (UC3; NCT04033445). La seguridad a largo plazo hasta las 44 semanas se evaluó en sujetos que respondieron a la terapia de inducción en un estudio de mantenimiento aleatorizado, doble ciego, controlado con placebo (UC2)
[ver
.
En los estudios de inducción (UC1 y UC3), 522 sujetos recibieron al menos una dosis del régimen de inducción intravenosa de TREMFYA (es decir, 200 mg en la semana 0, la semana 4 y la semana 8). La respuesta clínica se definió como una disminución en la puntuación de Mayo modificada (mMS) de ≥30% y ≥2 puntos desde el inicio con una disminución de ≥1 desde el inicio en la subpuntuación de sangrado rectal (RBS) o RBS de 0 o 1. En el estudio de mantenimiento (UC2), los sujetos que lograron una respuesta clínica después de 12 semanas de tratamiento de inducción intravenosa con TREMFYA se aleatorizaron y recibieron TREMFYA 100 mg cada 8 semanas (con la primera dosis administrada en la semana 4 de UC2) o TREMFYA 200 mg cada 4 semanas (con la primera dosis administrada en la semana 0 de UC2), por inyección subcutánea (SC) durante un máximo de 44 semanas adicionales.
Las infecciones del tracto respiratorio ocurrieron en ≥2% de los sujetos tratados con TREMFYA y a una tasa más alta que el placebo (8.8% de los sujetos tratados con TREMFYA vs. 7.3% de los sujetos tratados con placebo) hasta la semana 12 en los estudios de inducción (UC1 y UC3). Las infecciones del tracto respiratorio incluyeron COVID-19, influenza, nasofaringitis, infección del tracto respiratorio, infección del tracto respiratorio superior e infección viral del tracto respiratorio.
Las reacciones adversas que ocurrieron en ≥3% de los sujetos tratados con TREMFYA y a una tasa más alta que el placebo hasta la semana 44 en el estudio de mantenimiento (UC2) se muestran en la Tabla 2.
| TREMFYA
* |
TREMFYA
* |
Placebo N=192 n (%) |
|
|---|---|---|---|
|
|||
| Reacciones en el sitio de inyección | 2 (1.1) | 17 (8.9) | 2 (1) |
| Artralgia | 8 (4.3) | 15 (7.9) | 13 (6.8) |
| Infección de las vías respiratorias superiores | 6 (3.2) | 13 (6.8) | 8 (4.2) |
6.2 Experiencia postcomercialización
Las siguientes reacciones adversas se han notificado durante la posaprobación de TREMFYA. Debido a que estas reacciones se notifican voluntariamente de una población de tamaño incierto, no siempre es posible estimar de forma fiable su frecuencia o establecer una relación causal con la exposición a TREMFYA.
Trastornos del sistema inmunitario: Hipersensibilidad, incluida la anafilaxia
[ver
Advertencias y precauciones (5.1)]
Trastornos de la piel y del tejido subcutáneo: Erupción
[ver
Advertencias y precauciones (5.1)]
7 INTERACCIONES MEDICAMENTOSAS
7.1 Sustratos de CYP450
La formación de enzimas CYP450 puede verse alterada por el aumento de los niveles de ciertas citocinas (por ejemplo, IL-1, IL-6, IL-10, TNFα, interferón) durante la inflamación crónica.
Los resultados de un estudio exploratorio de interacción fármaco-fármaco en sujetos con psoriasis en placas de moderada a grave sugirieron un bajo potencial de interacciones farmacológicas clínicamente relevantes para los fármacos metabolizados por CYP3A4, CYP2C9, CYP2C19 y CYP1A2, pero no se puede descartar el potencial de interacción para los fármacos metabolizados por CYP2D6. Sin embargo, los resultados fueron muy variables debido al número limitado de sujetos en el estudio.
Tras el inicio de TREMFYA en pacientes que reciben sustratos de CYP450 concomitantes, en particular aquellos con un índice terapéutico estrecho, considere la posibilidad de controlar el efecto terapéutico o la concentración del fármaco y considere el ajuste de la dosis según sea necesario
[ver
.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Registro de exposición durante el embarazo
Existe un registro de embarazos que monitoriza los resultados del embarazo en mujeres expuestas a TREMFYA durante el embarazo. Se debe animar a las pacientes a que se inscriban en el registro visitando www.mothertobaby.org/ongoing-study/tremfya-guselkumab, llamando al 1-877-311-8972 o enviando un correo electrónico a MotherToBaby@health.ucsd.edu.
Resumen de riesgos
Los datos disponibles de la literatura, los informes posteriores a la comercialización y el registro de embarazo en curso con el uso de TREMFYA en mujeres embarazadas son insuficientes para establecer un riesgo asociado al fármaco de defectos de nacimiento importantes, aborto espontáneo u otros resultados adversos maternos o fetales. Se sabe que los anticuerpos IgG humanos atraviesan la barrera placentaria; por lo tanto, TREMFYA puede transmitirse de la madre al feto en desarrollo.
En un estudio combinado de desarrollo embrio-fetal y desarrollo pre y postnatal, no se observaron efectos adversos en el desarrollo en los bebés nacidos de monos preñados después de la administración subcutánea de guselkumab durante la organogénesis hasta el parto a dosis de hasta 18 veces la exposición (AUC) en humanos administrados 200 mg por vía intravenosa y 32 veces la exposición (AUC) a la dosis de 200 mg administrada por vía subcutánea.
(ver
. Se desconoce la importancia clínica de estos hallazgos no clínicos.
Todos los embarazos tienen un riesgo de fondo de defectos de nacimiento, pérdida u otros resultados adversos. Se desconoce el riesgo de fondo de defectos de nacimiento importantes y aborto espontáneo para la población indicada. En la población general de EE. UU., el riesgo de fondo estimado de defectos de nacimiento importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente.
Consideraciones clínicas
Riesgo materno y embrionario/fetal asociado a la enfermedad
Los datos publicados sugieren que el riesgo de resultados adversos del embarazo en mujeres con enfermedad inflamatoria intestinal (EII) está asociado con un aumento de la actividad de la enfermedad. Los resultados adversos del embarazo incluyen parto prematuro (antes de las 37 semanas de gestación), bebés con bajo peso al nacer (menos de 2500 g) y pequeños para la edad gestacional al nacer.
Datos
Datos en animales
En un estudio combinado de desarrollo embrio-fetal y desarrollo pre y postnatal, se administraron a monos cynomolgus preñados dosis subcutáneas semanales de guselkumab desde el inicio de la organogénesis hasta el parto a una dosis (50 mg/kg) que resultó en exposiciones (AUC) 18 veces la exposición en humanos administrados 200 mg por vía intravenosa y 32 veces la exposición humana a 200 mg administrados por vía subcutánea. Se produjeron muertes neonatales en la descendencia de un mono control, tres monos a los que se administró guselkumab a 10 mg/kg/semana (4 veces la exposición (AUC) en humanos administrados 200 mg por vía intravenosa y 7 veces la exposición (AUC) a 200 mg administrados por vía subcutánea) y tres monos a los que se administró guselkumab a 50 mg/kg/semana (18 veces la exposición (AUC) en humanos administrados 200 mg por vía intravenosa y 32 veces la exposición (AUC) después de una dosis subcutánea de 200 mg). Se desconoce la importancia clínica de estos hallazgos. No se observaron efectos relacionados con el guselkumab en el desarrollo funcional o inmunológico en los bebés desde el nacimiento hasta los 6 meses de edad.
8.2 Lactancia
Resumen de riesgos
No hay datos sobre la presencia de guselkumab en la leche materna, los efectos en el lactante amamantado o los efectos en la producción de leche. No se detectó guselkumab en la leche de monos cynomolgus lactantes. La IgG materna endógena y los anticuerpos monoclonales se transfieren a la leche materna. Se desconocen los efectos de la exposición gastrointestinal local y el grado de exposición sistémica en el lactante amamantado al guselkumab. Se deben considerar los beneficios para el desarrollo y la salud de la lactancia materna junto con la necesidad clínica de la madre de TREMFYA y cualquier posible efecto adverso en el lactante amamantado de TREMFYA o de la condición materna subyacente.
8.4 Uso pediátrico
No se ha establecido la seguridad y eficacia de TREMFYA en pacientes pediátricos (menores de 18 años).
8.5 Uso geriátrico
De los 4303 sujetos con psoriasis en placas, artritis psoriásica o colitis ulcerosa expuestos a TREMFYA, un total de 240 sujetos tenían 65 años o más, y 23 sujetos tenían 75 años o más. Los estudios clínicos de TREMFYA, dentro de cada indicación, no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos adultos más jóvenes.
No se observaron diferencias clínicamente significativas en la farmacocinética del guselkumab en función de la edad
[ver
.
11 DESCRIPCIÓN
Guselkumab, un antagonista de la interleucina-23, es un anticuerpo monoclonal humano de inmunoglobulina G1 lambda (IgG1λ). Guselkumab se produce en una línea celular de mamíferos utilizando tecnología de ADN recombinante y tiene un peso molecular aproximado de aproximadamente 147 kDa.
TREMFYA
®(guselkumab) inyección es una solución estéril, sin conservantes, transparente e incolora a ligeramente amarilla.
TREMFYA para inyección subcutánea
Disponible como una solución de 100 mg/mL en una jeringa precargada de vidrio de 1 mL o 2 mL, en una pluma precargada de 2 mL o en un inyector controlado por el paciente One-Press de 1 mL para uso subcutáneo.
Cada jeringa precargada de 1 mL de TREMFYA o inyector controlado por el paciente One-Press administra 100 mg de guselkumab, L-histidina (0,6 mg), L-histidina monohidrocloruro monohidratado (1,5 mg), polisorbato 80 (0,5 mg), sacarosa (79 mg) y agua para inyección a pH 5,8.
Cada jeringa precargada de 2 mL de TREMFYA o pluma precargada (TREMFYA PEN) administra 200 mg de guselkumab, L-histidina (1,2 mg), L-histidina monohidrocloruro monohidratado (3 mg), polisorbato 80 (1 mg), sacarosa (158 mg) y agua para inyección a pH 5,8.
TREMFYA para infusión intravenosa
Disponible como una solución de 10 mg/mL en un vial de dosis única de 20 mL para uso intravenoso.
Cada vial de 20 mL de TREMFYA administra 200 mg de guselkumab, EDTA disódico dihidratado (0,4 mg), L-histidina (11,3 mg), L-histidina monohidrocloruro monohidratado (26,6 mg), L-metionina (8 mg), polisorbato 80 (10 mg), sacarosa (1700 mg) y agua para inyección a pH 5,8.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Guselkumab es un anticuerpo monoclonal IgG1λ humano que se une selectivamente a la subunidad p19 de la interleucina 23 (IL-23) e inhibe su interacción con el receptor de IL-23. La IL-23 es una citocina natural que participa en las respuestas inflamatorias e inmunitarias normales. Guselkumab inhibe la liberación de citocinas y quimiocinas proinflamatorias.
12.2 Farmacodinamia
En sujetos evaluados con psoriasis en placas, guselkumab redujo los niveles séricos de IL-17A, IL-17F e IL-22 en relación con los niveles previos al tratamiento según análisis exploratorios de los marcadores farmacodinámicos.
En sujetos evaluados con artritis psoriásica, los niveles séricos de proteína C reactiva de fase aguda, amiloide A sérica e IL-6, y las citocinas efectoras Th17 IL-17A, IL-17F e IL-22 estaban elevados al inicio del estudio. Los niveles séricos de estas proteínas medidos en la semana 4 y la semana 24 disminuyeron en comparación con el inicio del estudio después del tratamiento con guselkumab en la semana 0, la semana 4 y cada 8 semanas a partir de entonces.
Se desconoce la relación entre estos marcadores farmacodinámicos y el(los) mecanismo(s) por los que guselkumab ejerce sus efectos clínicos.
12.3 Farmacocinética
Guselkumab exhibió una farmacocinética lineal en sujetos sanos y sujetos con psoriasis en placas después de inyecciones subcutáneas. En sujetos con psoriasis en placas, después de la administración subcutánea de 100 mg de TREMFYA en las semanas 0 y 4, y cada 8 semanas a partir de entonces, la concentración sérica mínima media de guselkumab en estado estacionario fue de aproximadamente 1.2 mcg/ml.
La farmacocinética de guselkumab en sujetos con artritis psoriásica fue similar a la de sujetos con psoriasis en placas. Después de la administración subcutánea de 100 mg de TREMFYA en las semanas 0, 4 y cada 8 semanas a partir de entonces, la concentración sérica mínima media de guselkumab en estado estacionario fue de aproximadamente 1.2 mcg/ml.
Después de la dosificación de mantenimiento subcutánea de 100 mg de TREMFYA cada 8 semanas o 200 mg de TREMFYA cada 4 semanas en sujetos con colitis ulcerosa, las concentraciones séricas mínimas medias de guselkumab en estado estacionario fueron de aproximadamente 1.4 mcg/ml y 10.7 mcg/ml, respectivamente.
Absorción
Después de una única inyección subcutánea de 100 mg en sujetos sanos, guselkumab alcanzó una concentración sérica máxima media (± DE) de 8.09 ± 3.68 mcg/ml aproximadamente 5.5 días después de la dosis. La biodisponibilidad absoluta de guselkumab después de una única inyección subcutánea de 100 mg se estimó en aproximadamente un 49 % en sujetos sanos.
Después del régimen de dosis de inducción intravenosa recomendado de TREMFYA 200 mg en las semanas 0, 4 y 8, la concentración sérica máxima media (± DE) de guselkumab en la semana 8 fue de 68.3 ± 17.3 mcg/ml en sujetos con colitis ulcerosa.
Distribución
En sujetos con psoriasis en placas, el volumen de distribución aparente fue de 13.5 L. En sujetos con colitis ulcerosa, el volumen de distribución aparente en estado estacionario fue de 10.1 L.
Eliminación
La eliminación aparente en sujetos con psoriasis en placas fue de 0.516 l/día. La vida media promedio de guselkumab fue de aproximadamente 15 a 18 días en sujetos con psoriasis en placas en todos los ensayos.
La eliminación aparente en sujetos con colitis ulcerosa fue de 0.531 l/día. La vida media promedio de guselkumab fue de aproximadamente 17 días en sujetos con colitis ulcerosa.
Metabolismo
No se ha caracterizado la vía exacta a través de la cual se metaboliza guselkumab. Como anticuerpo monoclonal IgG humano, se espera que guselkumab se degrade en pequeños péptidos y aminoácidos a través de vías catabólicas de la misma manera que la IgG endógena.
Poblaciones específicas
No se observaron diferencias aparentes en la eliminación en sujetos ≥ 65 años de edad en comparación con sujetos < 65 años de edad, lo que sugiere que no es necesario ajustar la dosis en sujetos de edad avanzada. La eliminación y el volumen de distribución de guselkumab aumentan a medida que aumenta el peso corporal; sin embargo, los datos de los ensayos clínicos observados indican que no se justifica el ajuste de la dosis en función del peso corporal. No se han realizado ensayos específicos para determinar el efecto de la insuficiencia renal o hepática en la farmacocinética de guselkumab.
Interacciones farmacológicas
Los análisis farmacocinéticos poblacionales indicaron que el uso concomitante de AINE, corticosteroides orales y DMARD convencionales como metotrexato (MTX), azatioprina (AZA) y 6-mercaptopurina (6-MP) no afectó la eliminación de guselkumab.
Sustratos del citocromo P450
Los efectos de guselkumab sobre la farmacocinética de midazolam (metabolizado por CYP3A4), warfarina (metabolizado por CYP2C9), omeprazol (metabolizado por CYP2C19), dextrometorfano (metabolizado por CYP2D6) y cafeína (metabolizado por CYP1A2) se evaluaron en un estudio exploratorio con 6 a 12 sujetos evaluables con psoriasis en placas de moderada a grave. Los cambios en el AUC
inf de midazolam, S-warfarina, omeprazol y cafeína después de una dosis única de guselkumab no fueron clínicamente relevantes. Para el dextrometorfano, los cambios en el AUC
inf después de guselkumab no fueron clínicamente relevantes en 9 de 10 sujetos; sin embargo, se observó un cambio de 2.9 veces en el AUC
inf en un individuo
[ver
Interacciones farmacológicas (7.1)]
.
12.6 Inmunogenicidad
La incidencia observada de anticuerpos contra el fármaco depende en gran medida de la sensibilidad y especificidad del ensayo. Las diferencias en los métodos de ensayo impiden comparaciones significativas de la incidencia de anticuerpos contra el fármaco en los estudios descritos a continuación con la incidencia de anticuerpos contra el fármaco en otros estudios, incluidos los de guselkumab o de otros productos de guselkumab.
Psoriasis en placas
Hasta la semana 52, aproximadamente el 6% de los sujetos tratados con TREMFYA desarrollaron anticuerpos contra el fármaco. De los sujetos que desarrollaron anticuerpos contra el fármaco, aproximadamente el 7% tenían anticuerpos que se clasificaron como anticuerpos neutralizantes. Entre los 46 sujetos que desarrollaron anticuerpos contra guselkumab y tenían datos evaluables, 21 sujetos exhibieron niveles mínimos más bajos de guselkumab, incluido un sujeto que experimentó pérdida de eficacia después de desarrollar títulos altos de anticuerpos. Hasta la semana 156, aproximadamente el 9% de los sujetos tratados con TREMFYA desarrollaron anticuerpos contra el fármaco y de estos sujetos, aproximadamente el 6% se clasificaron como anticuerpos neutralizantes. Sin embargo, los anticuerpos contra guselkumab generalmente no se asociaron con cambios en la respuesta clínica o el desarrollo de reacciones en el sitio de inyección.
Artritis psoriásica
Hasta la semana 24, el 2% (n=15) de los sujetos tratados con TREMFYA desarrollaron anticuerpos contra el fármaco. De estos sujetos, 1 tenía anticuerpos que se clasificaron como anticuerpos neutralizantes. En general, el pequeño número de sujetos que fueron positivos para anticuerpos contra guselkumab limita la conclusión definitiva del efecto de la inmunogenicidad en la farmacocinética, eficacia y seguridad de guselkumab.
Colitis ulcerosa
Hasta la semana 56 en los estudios UC1, UC2 y UC3, el 11% (n=48) de los sujetos tratados con TREMFYA en la dosis recomendada desarrollaron anticuerpos contra el fármaco. De estos sujetos que dieron positivo para anticuerpos anti-guselkumab y fueron evaluables para anticuerpos neutralizantes, el 16% (n=6) tenían anticuerpos que se clasificaron como anticuerpos neutralizantes. La mayoría de los sujetos que fueron positivos para anticuerpos contra guselkumab tenían títulos bajos. Dos sujetos con los títulos de anticuerpos más altos exhibieron niveles mínimos bajos de guselkumab. No se identificó ningún efecto clínicamente significativo de los anticuerpos contra el fármaco en las reacciones en el sitio de inyección o la eficacia de guselkumab, durante la duración del tratamiento de 56 semanas.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
No se han realizado estudios en animales para evaluar el potencial carcinogénico o mutagénico de TREMFYA.
No se observaron efectos en los parámetros de fertilidad después de que los conejillos de indias machos recibieran guselkumab por vía subcutánea a una dosis de 25 mg/kg dos veces por semana (6 veces la exposición (AUC) en humanos que recibieron 200 mg por vía intravenosa y 10 veces la exposición (AUC) a la dosis subcutánea de 200 mg).
No se observaron efectos en los parámetros de fertilidad después de que las conejillas de indias hembras recibieran guselkumab por vía subcutánea a dosis de hasta 100 mg/kg dos veces por semana (12 veces la exposición (AUC) en humanos que recibieron 200 mg por vía intravenosa y 21 veces la exposición (AUC) a la dosis subcutánea de 200 mg).
14 ESTUDIOS CLÍNICOS
14.1 Psoriasis en Placas
Cuatro ensayos multicéntricos, aleatorizados, doble ciego (PsO1 [NCT02207231], PsO2 [NCT02207244], PsO3 [NCT02203032] y PsO4 [NCT02905331]) reclutaron sujetos de 18 años de edad o mayores con psoriasis en placas de moderada a grave que eran elegibles para terapia sistémica o fototerapia. Los sujetos tenían una puntuación de Evaluación Global del Investigador (IGA) ≥3 (“moderada”) en una escala de 5 puntos de gravedad general de la enfermedad, una puntuación del Índice de Área y Severidad de la Psoriasis (PASI) ≥12 y un área de superficie corporal (BSA) afectada mínima del 10%. Los sujetos con psoriasis guttata, eritrodérmica o pustulosa fueron excluidos.
Ensayos PsO1 y PsO2
En PsO1 y PsO2, 1443 sujetos fueron aleatorizados a recibir TREMFYA (100 mg en las semanas 0 y 4 y cada 8 semanas a partir de entonces) administrado con una jeringa precargada, placebo o adalimumab con licencia de EE. UU. (80 mg en la semana 0 y 40 mg en la semana 1, seguido de 40 mg cada dos semanas a partir de entonces).
Ambos ensayos evaluaron las respuestas en la semana 16 en comparación con el placebo para los dos criterios de valoración coprimarios:
- la proporción de sujetos que lograron una puntuación IGA de 0 (“despejado”) o 1 (“mínimo”);
- la proporción de sujetos que lograron al menos una reducción del 90% desde el inicio en la puntuación compuesta PASI (PASI 90).
Las comparaciones entre TREMFYA y adalimumab con licencia de EE. UU. fueron criterios de valoración secundarios en los siguientes puntos de tiempo:
- en la semana 16 (PsO1 y PsO2), las proporciones de sujetos que lograron una puntuación IGA de 0 o 1, una respuesta PASI 90 y una respuesta PASI 75;
- en la semana 24 (PsO1 y PsO2), y en la semana 48 (PsO1), las proporciones de sujetos que lograron una puntuación IGA de 0, una puntuación IGA de 0 o 1 y una respuesta PASI 90.
Otros resultados evaluados incluyeron la mejora en los síntomas de la psoriasis evaluados en el Diario de Síntomas y Signos de la Psoriasis (PSSD) y las mejoras en la psoriasis del cuero cabelludo en la semana 16.
En ambos ensayos, los sujetos fueron predominantemente hombres y blancos, con una edad media de 44 años y un peso medio de 90 kg. En el inicio, los sujetos tenían una BSA afectada mediana de aproximadamente el 21%, una puntuación PASI mediana de 19 y el 18% tenía antecedentes de artritis psoriásica. Aproximadamente el 24% de los sujetos tenían una puntuación IGA de grave. En ambos ensayos, el 23% había recibido terapia sistémica biológica previa.
Respuesta Clínica
La Tabla 3 presenta los resultados de eficacia en la semana 16 en PsO1 y PsO2.
| PsO1 | PsO2 | |||
|---|---|---|---|---|
| Criterio de valoración | TREMFYA (N=329) n (%) |
Placebo (N=174) n (%) |
TREMFYA (N=496) n (%) |
Placebo (N=248) n (%) |
| Respuesta IGA de 0/1 | 280 (85) | 12 (7) | 417 (84) | 21 (8) |
| Respuesta PASI 90 | 241 (73) | 5 (3) | 347 (70) | 6 (2) |
La Tabla 4 presenta los resultados de un análisis de todos los sitios de América del Norte (es decir, EE. UU. y Canadá), que demuestra la superioridad de TREMFYA frente al adalimumab con licencia en EE. UU.
| PsO1 | PsO2 | |||
|---|---|---|---|---|
| Variable de valoración | TREMFYA (N=115) † |
Adalimumab
‡ † |
TREMFYA (N=160) † |
Adalimumab
‡ † |
| Respuesta IGA de 0/1 (despejada o mínima) | ||||
| Semana 16 | 97 (84) | 70 (61) | 119 (74) | 50 (62) |
| Semana 24 | 97 (84) | 62 (54) | 119 (74) | 46 (57) |
| Semana 48 | 91 (79) | 62 (54) | NA | NA |
| Respuesta IGA de 0 (despejada) | ||||
| Semana 24 | 61 (53) | 27 (23) | 76 (48) | 23 (28) |
| Semana 48 | 54 (47) | 28 (24) | NA | NA |
| Respuesta PASI 75 | ||||
| Semana 16 | 105 (91) | 80 (70) | 132 (83) | 51 (63) |
| Respuesta PASI 90 | ||||
| Semana 16 | 84 (73) | 47 (41) | 102 (64) | 34 (42) |
| Semana 24 | 92 (80) | 51 (44) | 113 (71) | 41 (51) |
| Semana 48 | 84 (73) | 53 (46) | NA | NA |
Se observó una mejora en la psoriasis que afectaba el cuero cabelludo en los sujetos aleatorizados a TREMFYA en comparación con el placebo en la semana 16.
El examen de la edad, el sexo, la raza, el peso corporal y el tratamiento previo con agentes sistémicos o biológicos no identificó diferencias en la respuesta a TREMFYA entre estos subgrupos.
Mantenimiento y Durabilidad de la Respuesta
Para evaluar el mantenimiento y la durabilidad de la respuesta (PsO2), los sujetos aleatorizados a TREMFYA en la semana 0 y que fueron respondedores PASI 90 en la semana 28 fueron re-aleatorizados para continuar el tratamiento con TREMFYA cada 8 semanas o retirarse de la terapia (es decir, recibir placebo).
En la semana 48, el 89% de los sujetos que continuaron con TREMFYA mantuvieron PASI 90 en comparación con el 37% de los sujetos que fueron re-aleatorizados a placebo y retirados de TREMFYA. Para los respondedores en la semana 28 que fueron re-aleatorizados a placebo y retirados de TREMFYA, el tiempo medio hasta la pérdida de PASI 90 fue de aproximadamente 15 semanas.
Resultados Reportados por el Paciente
Se observaron mayores mejoras en los síntomas de la psoriasis (picazón, dolor, escozor, ardor y tirantez de la piel) en la semana 16 en TREMFYA en comparación con el placebo en ambos ensayos según el Diario de Síntomas y Signos de Psoriasis (PSSD). Mayores proporciones de sujetos con TREMFYA en comparación con adalimumab con licencia de EE. UU. lograron una puntuación de síntomas PSSD de 0 (sin síntomas) en la semana 24 en ambos ensayos.
Ensayo PsO3
PsO3 [NCT02203032] evaluó la eficacia de 24 semanas de tratamiento con TREMFYA en sujetos (N=268) que no habían logrado una respuesta adecuada, definida como IGA ≥2 en la semana 16 después del tratamiento inicial con ustekinumab con licencia de EE. UU. (dosificado a 45 mg o 90 mg según el peso basal del sujeto en la semana 0 y la semana 4). Estos sujetos fueron aleatorizados para continuar con el tratamiento con ustekinumab con licencia de EE. UU. cada 12 semanas o cambiar a TREMFYA 100 mg en las semanas 16, 20 y cada 8 semanas a partir de entonces. Las características basales de los sujetos aleatorizados fueron similares a las observadas en PsO1 y PsO2.
En sujetos con una respuesta inadecuada (IGA ≥2 en la semana 16 a ustekinumab con licencia de EE. UU.), mayores proporciones de sujetos con TREMFYA en comparación con ustekinumab con licencia de EE. UU. lograron una puntuación IGA de 0 o 1 con una mejora de ≥2 grados en la semana 28 (31% vs. 14%, respectivamente; 12 semanas después de la aleatorización).
Ensayo PsO4
PsO4 [NCT02905331] evaluó la eficacia, seguridad y farmacocinética de TREMFYA administrado con el inyector One-Press. En este estudio, 78 sujetos fueron aleatorizados para recibir TREMFYA (100 mg en las semanas 0 y 4 y cada 8 semanas a partir de entonces) [N=62], o placebo [N=16]. Las características basales de los sujetos fueron comparables a las observadas en PsO1 y PsO2. Los criterios de valoración coprimarios fueron los mismos que los de PsO1 y PsO2. Los criterios de valoración secundarios incluyeron la proporción de sujetos que lograron una puntuación IGA de 0 en la semana 16 y la proporción de sujetos que lograron una respuesta PASI 100 en la semana 16.
Una mayor proporción de sujetos en el grupo guselkumab logró una puntuación IGA de 0 o 1 o una respuesta PASI 90 en la semana 16 (81% y 76%, respectivamente) que en el grupo placebo (0% para ambos criterios de valoración). La proporción de sujetos que lograron una puntuación IGA de 0 en la semana 16 fue mayor en el grupo guselkumab en comparación con el grupo placebo (56% vs. 0%). La proporción de sujetos que lograron una respuesta PASI 100 en la semana 16 fue mayor en el grupo guselkumab en comparación con el grupo placebo (50% vs. 0%).
14.2 Artritis Psoriásica
La seguridad y eficacia de TREMFYA se evaluaron en 1120 sujetos en 2 ensayos aleatorizados, doble ciego, controlados con placebo (PsA1 [NCT03162796] y PsA2 [NCT03158285]) en sujetos adultos con artritis psoriásica activa (PsA) (≥3 articulaciones inflamadas, ≥3 articulaciones sensibles y un nivel de proteína C reactiva (PCR) de ≥0,3 mg/dL en PsA1 y ≥5 articulaciones inflamadas, ≥5 articulaciones sensibles y un nivel de PCR de ≥0,6 mg/dL en PsA2) que no habían respondido adecuadamente a las terapias estándar (por ejemplo, DMARDs convencionales [cDMARDs], apremilast o fármacos antiinflamatorios no esteroideos [AINE]). Los sujetos de estos ensayos tenían un diagnóstico de PsA durante al menos 6 meses según los criterios de clasificación para la artritis psoriásica (CASPAR) y una duración media de PsA de 4 años en el momento basal.
En PsA1, aproximadamente el 31% de los sujetos habían sido tratados previamente con hasta 2 agentes anti-factor de necrosis tumoral alfa (anti-TNFα), mientras que en PsA2 todos los sujetos eran biológicos ingenuos. Aproximadamente el 58% de los sujetos de ambos ensayos tenían uso concomitante de metotrexato (MTX). Se incluyeron sujetos con diferentes subtipos de PsA en ambos ensayos, incluida la artritis poliarticular con ausencia de nódulos reumatoides (40%), espondilitis con artritis periférica (30%), artritis periférica asimétrica (23%), afectación interfalángica distal (7%) y artritis mutilans (1%). En el momento basal, más del 65% y el 42% de los sujetos tenían entesitis y dactilitis, respectivamente, y el 79% tenía ≥3% de afectación de la piel por psoriasis de superficie corporal (BSA).
PsA1 evaluó a 381 sujetos que fueron tratados con placebo SC, TREMFYA 100 mg SC en las semanas 0, 4 y cada 8 semanas (q8w) a partir de entonces, o TREMFYA 100 mg SC cada 4 semanas (q4w). PsA2 evaluó a 739 sujetos que fueron tratados con placebo SC, TREMFYA 100 mg SC en las semanas 0, 4 y q8w a partir de entonces, o TREMFYA 100 mg SC q4w. El criterio de valoración principal en ambos ensayos fue el porcentaje de sujetos que lograron una respuesta ACR20 en la semana 24.
Respuesta Clínica
En ambos ensayos, los sujetos tratados con TREMFYA 100 mg q8w demostraron una mayor respuesta clínica, incluida ACR20, en comparación con el placebo en la semana 24 (Tablas 5 y 6). Se observaron respuestas similares independientemente de la exposición previa a anti-TNFα en PsA1, y en ambos ensayos se observaron respuestas similares independientemente del uso concomitante de cDMARD, el tratamiento previo con cDMARD, el sexo y el peso corporal.
| Placebo (N=126) |
TREMFYA 100 mg q8w (N=127) |
||
|---|---|---|---|
| Tasa de respuesta | Tasa de respuesta | Diferencia con placebo (IC del 95%) | |
|
|||
| Respuesta ACR 20 | |||
| Semana 16 | 25% | 52% | 27 (15, 38) |
| Semana 24 | 22% | 52% | 30 (19, 41) |
| Respuesta ACR 50 | |||
| Semana 16 | 13% | 23% | 10 (1, 19) |
| Semana 24 | 9% | 30% | 21 (12, 31) |
| Respuesta ACR 70 | |||
| Semana 16 | 6% | 8% | 2 (-4, 8) |
| Semana 24 | 6% | 12% | 6 (-0.3, 13) |
| Placebo (N=246) |
TREMFYA 100 mg q8w (N=248) |
||
|---|---|---|---|
| Tasa de respuesta | Tasa de respuesta | Diferencia con placebo (IC del 95%) | |
|
|||
| Respuesta ACR 20 | |||
| Semana 16 | 34% | 55% | 22 (13, 30) |
| Semana 24 | 33% | 64% | 31 (23, 40) |
| Respuesta ACR 50 | |||
| Semana 16 | 9% | 29% | 19 (13, 26) |
| Semana 24 | 14% | 32% | 17 (10, 24) |
| Respuesta ACR 70 | |||
| Semana 16 | 1% | 14% | 13 (9, 17) |
| Semana 24 | 4% | 19% | 15 (9, 20) |
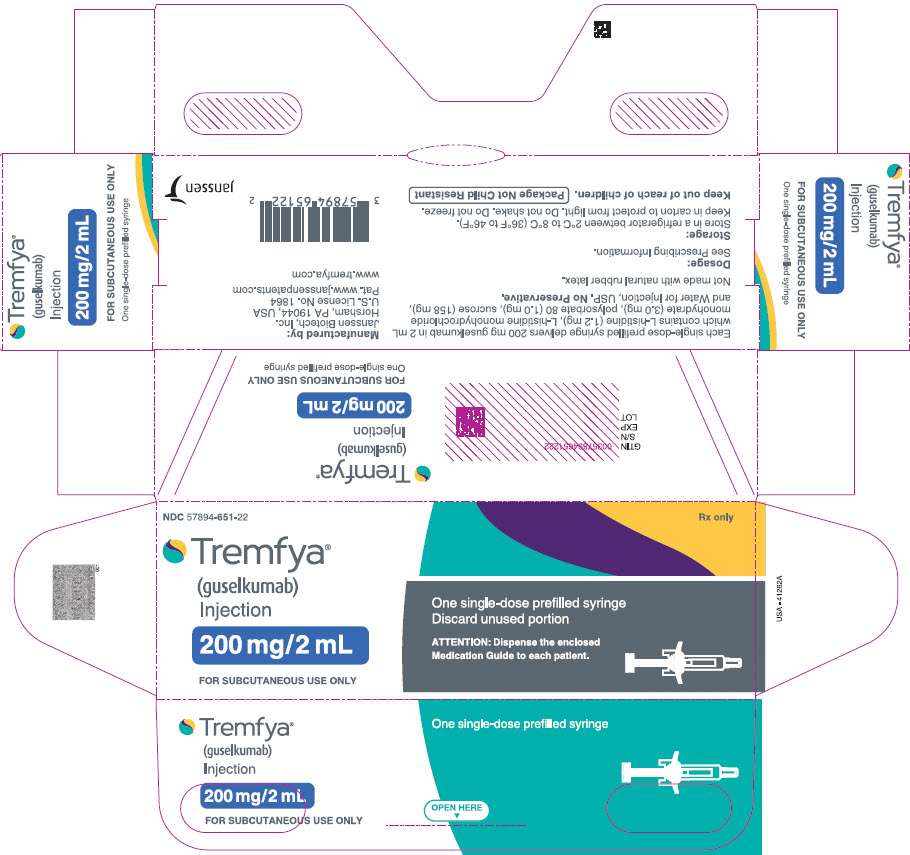
El porcentaje de sujetos que lograron una respuesta ACR20 en PsA2 por visita se muestra en la Figura 1.
Figura 1: Sujetos que logran una respuesta ACR 20 por visita hasta la semana 24 en PsA2
Los resultados de los componentes de los criterios de respuesta ACR se muestran en la Tabla 7.
| PsA1 | PsA2 | |||
|---|---|---|---|---|
| Placebo (N=126) |
TREMFYA 100 mg q8w (N=127) |
Placebo N=246 |
TREMFYA 100 mg q8w (N=248) |
|
|
||||
| No. de articulaciones inflamadas | ||||
| Inicio | 10.1 (7.1) | 10.9 (9.3) | 12.3 (6.9) | 11.7 (6.8) |
| Cambio medio en la semana 16 | -4.2 (7.0) | -7.3 (7.0) | -5.8 (7.1) | -7.2 (6.0) |
| Cambio medio en la semana 24 | -5.1 (6.9) | -7.3 (8.0) | -6.4 (7.2) | -8.1 (6.1) |
| No. de articulaciones sensibles | ||||
| Inicio | 19.8 (14.4) | 20.2 (14.5) | 21.6 (13.1) | 19.8 (11.9) |
| Cambio medio en la semana 16 | -4.5 (10.8) | -10.2 (10.4) | -6.8 (10.5) | -9.0 (9.4) |
| Cambio medio en la semana 24 | -6.8 (13.0) | -10.5 (12.0) | -7.3 (11.2) | -10.4 (9.5) |
| Evaluación del dolor por parte del paciente | ||||
| Inicio | 5.8 (2.2) | 6.0 (2.1) | 6.3 (1.8) | 6.3 (2.0) |
| Cambio medio en la semana 16 | -0.8 (2.3) | -1.7 (2.4) | -0.9 (2.3) | -2.2 (2.5) |
| Cambio medio en la semana 24 | -0.7 (2.4) | -2.2 (2.6) | -1.1 (2.4) | -2.5 (2.5) |
| Evaluación global del paciente | ||||
| Inicio | 6.1 (2.2) | 6.5 (2.0) | 6.5 (1.8) | 6.5 (1.9) |
| Cambio medio en la semana 16 | -1.0 (2.3) | -2.0 (2.6) | -1.0 (2.3) | -2.3 (2.6) |
| Cambio medio en la semana 24 | -0.9 (2.5) | -2.5 (2.7) | -1.2 (2.6) | -2.5 (2.5) |
| Evaluación global del médico | ||||
| Baseline | 6.3 (1.7) | 6.2 (1.7) | 6.7 (1.5) | 6.6 (1.6) |
| Cambio medio en la semana 16 | -1.9 (2.2) | -2.9 (2.4) | -2.1 (2.2) | -3.5 (2.3) |
| Cambio medio en la semana 24 | -2.2 (2.3) | -3.5 (2.4) | -2.5 (2.3) | -3.8 (2.3) |
| Índice de discapacidad (HAQ-DI) | ||||
| Baseline | 1.2 (0.7) | 1.2 (0.6) | 1.3 (0.6) | 1.3 (0.6) |
| Cambio medio en la semana 16 | -0.1 (0.5) | -0.3 (0.5) | -0.1 (0.5) | -0.3 (0.5) |
| Cambio medio en la semana 24 | -0.1 (0.5) | -0.3 (0.6) | -0.2 (0.5) | -0.4 (0.5) |
| CRP (mg/dL) | ||||
| Baseline | 1.4 (1.9) | 1.6 (2.4) | 2.1 (2.7) | 2.0 (2.4) |
| Cambio medio en la semana 16 | -0.2 (1.5) | -0.6 (2.2) | -0.6 (2.5) | -1.0 (2.2) |
| Cambio medio en la semana 24 | -0.0 (2.8) | -0.7 (2.1) | -0.5 (2.5) | -1.1 (2.2) |
El tratamiento con TREMFYA dio lugar a una mejora en las manifestaciones cutáneas de la psoriasis en los sujetos con PsA.
El tratamiento con TREMFYA resultó en una mejora en la dactilitis y la entesitis en los sujetos con dactilitis o entesitis preexistentes.
Función física
Los sujetos tratados con TREMFYA en el grupo TREMFYA 100 mg q8w tanto en PsA1 como en PsA2 mostraron una mayor mejora media desde la línea de base en la función física en comparación con los sujetos tratados con placebo, evaluada mediante el Índice de Discapacidad del Cuestionario de Evaluación de Salud (HAQ-DI) en las semanas 16 y 24. En ambos estudios, la proporción de respondedores de HAQ-DI (mejora de ≥0.35 en la puntuación de HAQ-DI) fue mayor en el grupo de dosis TREMFYA q8w en comparación con el placebo en las semanas 16 y 24.
Otros resultados relacionados con la salud
El estado de salud general fue evaluado mediante la encuesta de salud de formato corto (SF-36). En la semana 24, los sujetos en el grupo de dosis TREMFYA 100 mg q8w tanto en PsA1 como en PsA2 mostraron una mayor mejora desde la línea de base en el resumen del componente físico (PCS) del SF-36 en comparación con el placebo. No se observó una mejora estadísticamente significativa en el MCS del SF-36. En la semana 24, hubo una mejora numérica en los dominios de funcionamiento físico, rol físico, dolor corporal, salud general, funcionamiento social y vitalidad, pero no en los dominios de rol emocional y salud mental. La fatiga fue evaluada mediante la puntuación de la Evaluación Funcional de la Terapia de Enfermedades Crónicas – Fatiga (FACIT-F) en los estudios PsA1 y PsA2. El tratamiento con TREMFYA resultó en una mejora en la fatiga medida por FACIT-F.
14.3 Colitis ulcerosa
Ensayo de inducción: UC1
En el estudio de inducción de 12 semanas (UC1; NCT04033445), 701 sujetos con colitis ulcerosa moderada a gravemente activa fueron aleatorizados en una proporción de 3:2 para recibir TREMFYA 200 mg o placebo por infusión intravenosa en la semana 0, la semana 4 y la semana 8. La actividad de la enfermedad fue evaluada mediante la puntuación modificada de Mayo (mMS), una puntuación de Mayo de 3 componentes (0-9) que consta de las siguientes subpuntuaciones (de 0 a 3 para cada subpuntuación): frecuencia de las deposiciones (SFS), sangrado rectal (RBS) y hallazgos en la endoscopia revisada centralmente (ES). Un ES de 2 se definió por eritema marcado, ausencia de patrón vascular, fragilidad y/o erosiones; un ES de 3 se definió por sangrado espontáneo y ulceración. Los sujetos inscritos con una mMS entre 5 y 9 y un ES de 2 o 3 se clasificaron como teniendo colitis ulcerosa moderada a gravemente activa. Se inscribieron sujetos con respuesta inadecuada, pérdida de respuesta o intolerancia a los corticosteroides, inmunomoduladores (azatioprina, 6-mercaptopurina), terapia biológica (bloqueadores de TNF, vedolizumab) y/o inhibidores de Janus quinasa (JAK).
Al inicio en UC1, la mMS mediana fue 7, el 64% de los sujetos tenían enfermedad gravemente activa (mMS ≥7) y el 68% de los sujetos tenían un ES de 3. En UC1, el 49% de los sujetos habían fallado previamente (respuesta inadecuada, pérdida de respuesta o intolerancia) el tratamiento con al menos una terapia biológica y/o un inhibidor de JAK, el 48% eran naïve a la terapia biológica y al inhibidor de JAK, y el 3% habían recibido previamente pero no habían fallado una terapia biológica o un inhibidor de JAK. La edad media era de 39 años (rango de 18 a 79 años); el 43% eran mujeres; y el 72% se identificaron como blancos, el 21% como asiáticos, el 1% como negros o afroamericanos, <1% como indios americanos o nativos de Alaska y <1% como grupos raciales múltiples. A los sujetos inscritos se les permitió usar dosis estables de aminosalicilatos orales, inmunomoduladores (azatioprina, 6-mercaptopurina, metotrexato) y/o corticosteroides orales (hasta 20 mg/día de prednisona o equivalente). Al inicio, el 72% de los sujetos estaban recibiendo aminosalicilatos, el 21% estaban recibiendo inmunomoduladores y el 43% estaban recibiendo corticosteroides. Las terapias biológicas o inhibidores de JAK concomitantes no estaban permitidos.
En UC1, el punto final primario fue la remisión clínica en la semana 12 definida por la mMS. Los puntos finales secundarios en la semana 12 incluyeron la mejora endoscópica, la respuesta clínica y la mejora histológica endoscópica mucosa (ver
Tabla 8).
| Punto final | Placebo | TREMFYA 200 mg Intravenous Infusion |
Diferencia de tratamiento (95% CI) |
|---|---|---|---|
|
|||
| Remisión clínica | |||
| Población total | N=280 8% |
N=421 23% |
15% (10%, 20%) |
| Fracaso previo de biológico y/o inhibidor de JAK | N=136 4% |
N=208 13% |
|
| Sin fracaso previo de biológico o inhibidor de JAK | N=144 12% |
N=213 32% |
|
| Mejora endoscópica | |||
| Población total | N=280 11% |
N=421 27% |
16% (10%, 21%) |
| Fracaso previo de biológico y/o inhibidor de JAK | N=136 5% |
N=208 15% |
|
| Sin fracaso previo de biológico o inhibidor de JAK | N=144 17% |
N=213 38% |
|
| Respuesta clínica | |||
| Población total | N=280 28% |
N=421 62% |
34% (27%, 41%) |
| Fracaso previo de biológico y/o inhibidor de JAK | N=136 20% |
N=208 51% |
|
| Sin fracaso previo de biológico o inhibidor de JAK | N=144 35% |
N=213 71% |
|
| Mejora histológica de la mucosa endoscópica (HEMI) | |||
| Población total | N=280 8% |
N=421 24% |
16% (11%, 21%) |
| Fracaso previo de biológico y/o inhibidor de JAK | N=136 4% |
N=208 13% |
|
| Sin falla previa a biológico o inhibidor de JAK | N=144 10% |
N=213 33% |
|
El estudio UC1 no fue diseñado para evaluar la relación de la mejora histológica endoscópica de la mucosa en la semana 12 con la progresión de la enfermedad y los resultados a largo plazo.
Subpuntuaciones de frecuencia de heces y sangrado rectal
Se observaron disminuciones en las subpuntuaciones de sangrado rectal y frecuencia de heces tan pronto como en la semana 4 en los sujetos tratados con TREMFYA en comparación con el placebo.
Evaluación endoscópica
La normalización de la apariencia endoscópica de la mucosa (remisión endoscópica) se definió como ES de 0. En la semana 12 de UC1, una mayor proporción de sujetos tratados con TREMFYA en comparación con los sujetos tratados con placebo lograron la remisión endoscópica (15% vs 5%).
Respuesta a la fatiga
En UC1, los sujetos tratados con TREMFYA experimentaron una mejora clínicamente significativa en la fatiga, evaluada mediante el PROMIS-Fatigue Short form 7a, en la semana 12, en comparación con los sujetos tratados con placebo. No se ha establecido el efecto de TREMFYA para mejorar la fatiga después de 12 semanas de inducción.
Ensayo de mantenimiento: UC2
El ensayo de mantenimiento (UC2) evaluó a 568 sujetos que recibieron uno de dos regímenes de inducción intravenosa de TREMFYA, incluido el régimen recomendado de 200 mg, durante 12 semanas en los estudios UC1 o UC3 (estudio de búsqueda de dosis de inducción) y demostraron respuesta clínica por mMS después de 12 semanas. Los sujetos fueron re-aleatorizados para recibir un régimen de mantenimiento subcutáneo de TREMFYA 100 mg cada 8 semanas, TREMFYA 200 mg cada 4 semanas o placebo por hasta 44 semanas adicionales.
En UC2, el 42% de los sujetos habían fallado (respuesta inadecuada, pérdida de respuesta o intolerancia) al tratamiento con uno o más biológicos o inhibidores de JAK.
El criterio de valoración principal fue la remisión clínica en la semana 44 definida por mMS. Los criterios de valoración secundarios incluyeron la remisión clínica sin corticosteroides, la mejora endoscópica, la mejora histológica endoscópica de la mucosa, todos en la semana 44 y el mantenimiento de la remisión clínica en la semana 44 en los sujetos que lograron la remisión clínica 12 semanas después del tratamiento de inducción intravenosa con TREMFYA (ver
Tabla 9).
| Criterio de valoración | Placebo | TREMFYA 100 mg cada 8 semanas Inyección subcutánea * |
TREMFYA 200 mg cada 4 semanas Inyección subcutánea † |
Diferencia de tratamiento vs Placebo (IC del 95%) |
|
|---|---|---|---|---|---|
| TREMFYA 100 mg |
TREMFYA 200 mg |
||||
|
|||||
| Remisión clínica ‡ |
|||||
| Población total § |
N=190 19% |
N=188 45% |
N=190 50% |
25% (16%, 34%) ¶ |
30% (21%, 38%) ¶ |
| Fracaso previo de biológicos y/o inhibidores de JAK # |
N=75 8% |
N=77 40% |
N=88 40% |
||
| Sin fracaso previo de biológicos o inhibidores de JAK Þ |
N=115 26% |
N=111 49% |
N=102 59% |
||
| Remisión clínica sin corticosteroides ß |
|||||
| Población total § |
N=190 18% |
N=188 45% |
N=190 49% |
26% (17%, 34%) ¶ |
29% (20%, 38%) ¶ |
| Fracaso previo de biológicos y/o inhibidores de JAK # |
N=75 7% |
N=77 40% |
N=88 40% |
||
| Sin fracaso previo de biológicos o inhibidores de JAK Þ |
N=115 26% |
N=111 49% |
N=102 57% |
||
| Mejora endoscópica à |
|||||
| Población total § |
N=190 19% |
N=188 49% |
N=190 52% |
30% (21%, 38%) ¶ |
31% (22%, 40%) ¶ |
| Fallo previo de biológico y/o inhibidor de JAK # |
N=75 8% |
N=77 45% |
N=88 42% |
||
| Sin fallo previo de biológico o inhibidor de JAK Þ |
N=115 26% |
N=111 52% |
N=102 60% |
||
| Mejora histológica endoscópica de la mucosa (HEMI) è |
|||||
| Población total § |
N=190 17% |
N=188 44% |
N=190 48% |
26% (17%, 34%) ¶ |
30% (21%, 38%) ¶ |
| Fallo previo de biológico y/o inhibidor de JAK # |
N=75 8% |
N=77 38% |
N=88 39% |
||
| Sin fallo previo de biológico o inhibidor de JAK Þ |
N=115 23% |
N=111 48% |
N=102 56% |
||
| Mantenimiento de la remisión clínica en la semana 44 en los sujetos que lograron la remisión clínica después de 12 semanas de inducción | |||||
| Población total ð |
N=59 34% |
N=66 61% |
N=69 72% |
26% (9%, 43%) ø |
38% (23%, 54%) ¶ |
| Fallo previo de biológico y/o inhibidor de JAK # |
N=15 27% |
N=20 60% |
N=18 56% |
||
| Sin fallo previo de biológico o inhibidor de JAK ý |
N=44 36% |
N=46 61% |
N=51 78% |
||
El estudio UC2 no fue diseñado para evaluar la relación de la mejora histológica endoscópica de la mucosa en la semana 44 con la progresión de la enfermedad y los resultados a largo plazo.
Evaluación endoscópica
La normalización del aspecto endoscópico de la mucosa (remisión endoscópica) se definió como ES de 0. En UC2, mayores proporciones de sujetos tratados con TREMFYA 100 mg cada 8 semanas o TREMFYA 200 mg cada 4 semanas lograron la remisión endoscópica en la semana 44 en comparación con los sujetos tratados con placebo (35% y 34%, respectivamente, frente al 15%).
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
16.1 Cómo se suministra
La inyección de TREMFYA
®/TREMFYA
®PEN (guselkumab) es una solución transparente e incolora a amarillo claro que se suministra de la siguiente manera:
Inyección subcutánea
- Caja de un inyector de dosis única de 100 mg/mL controlado por el paciente One-Press (NDC: 57894-640-11)
- Caja de una pluma precargada de dosis única de 200 mg/2 mL (TREMFYA PEN) (NDC: 57894-651-02)
- Caja de una jeringa precargada de dosis única de 100 mg/mL con una aguja fija de 27G y media pulgada ensamblada en un sistema de administración de protección de aguja pasiva (NDC: 57894-640-01)
- Caja de una jeringa precargada de dosis única de 200 mg/2 mL con una aguja fija de 27G y media pulgada ensamblada en un sistema de administración de protección de aguja pasiva (NDC: 57894-651-22)
16.2 Almacenamiento y manipulación
TREMFYA es estéril y no contiene conservantes. Deseche cualquier porción no utilizada.
- Conservar en nevera entre 2 °C y 8 °C (36 °F y 46 °F).
- Conservar en el embalaje original hasta el momento de su uso.
- Proteger de la luz hasta su uso.
- No congelar.
- No agitar.
- No está hecho con látex de caucho natural.
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente y/o cuidador que lea la información para pacientes aprobada por la FDA
(Guía del Medicamento e Instrucciones de Uso) antes de comenzar el tratamiento con TREMFYA, y cada vez que se renueve la receta, ya que puede haber nueva información que necesiten saber.
Reacciones de hipersensibilidad
Aconseje a los pacientes que suspendan el uso de TREMFYA y busquen atención médica inmediata si experimentan cualquier síntoma de reacciones de hipersensibilidad graves
[ver
Advertencias y precauciones (5.1)].
Infecciones
Indique a los pacientes la importancia de comunicar cualquier antecedente de infecciones al profesional sanitario y de ponerse en contacto con él si desarrollan cualquier síntoma de infección
[ver
Advertencias y precauciones (5.2)]
.
Vacunas
Aconseje a los pacientes tratados con TREMFYA que eviten el uso de vacunas vivas
[ver
Advertencias y precauciones (5.4)]
.
Instrucciones sobre la técnica de inyección
Indique a los pacientes o cuidadores que realicen la primera autoinyección bajo la supervisión y la orientación de un profesional sanitario cualificado para recibir la formación adecuada sobre la técnica de inyección subcutánea. Indique a los pacientes que se autoadministran el medicamento que se inyecten la dosis completa de TREMFYA/TREMFYA PEN
[ver
Guía del Medicamento e
Instrucciones de Uso]
.
Instruya a los pacientes o cuidadores sobre la técnica de eliminación adecuada de las agujas y jeringas. Las agujas y jeringas deben eliminarse en un contenedor resistente a las perforaciones. Aconseje a los pacientes y cuidadores que no vuelvan a utilizar las agujas o jeringas.
Recuerde a los pacientes que si olvidan tomar su dosis de TREMFYA/TREMFYA PEN, deben inyectarse la dosis tan pronto como lo recuerden. A continuación, deben tomar su siguiente dosis a la hora programada correspondiente.
Embarazo
Aconseje a las pacientes que existe un registro de embarazos que monitoriza los resultados del embarazo en pacientes expuestas a TREMFYA durante el mismo
[ver
Uso en poblaciones específicas (8.1)].
SECCIÓN NO CLASIFICADA DE SPL
Fabricado por:
Janssen Biotech, Inc.
Horsham, PA 19044, USA
Licencia de EE. UU. No. 1864
Para información de patentes: www.janssenpatents.com
© Johnson & Johnson y sus afiliados 2017–2024
Guía de medicación
| Guía del Medicamento | |||||
|---|---|---|---|---|---|
| TREMFYA ®(trem fye´ ah) (guselkumab) inyección, para uso subcutáneo |
TREMFYA ®(trem fye´ ah) PEN (guselkumab) inyección, para uso subcutáneo |
TREMFYA ®(trem fye´ ah) (guselkumab) inyección, para uso intravenoso |
|||
| Esta Guía del Medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos. | Revisado: 09/2024 | ||||
|
¿Cuál es la información más importante que debo saber sobre TREMFYA? |
|||||
|
|||||
|
|
||||
|
|||||
|
|
|
|||
| Ver ” ¿Cuáles son los posibles efectos secundarios de TREMFYA?” para obtener más información sobre los efectos secundarios. |
|||||
| ¿Qué es TREMFYA? | |||||
| TREMFYA es un medicamento recetado que se usa para tratar a adultos: | |||||
|
|||||
| No se sabe si TREMFYA es seguro y eficaz en niños menores de 18 años. | |||||
| No use TREMFYA si ha tenido una reacción alérgica grave a guselkumab o a cualquiera de los otros ingredientes de TREMFYA. Consulte el final de esta Guía del Medicamento para obtener una lista completa de los ingredientes de TREMFYA. | |||||
| Antes de usar TREMFYA, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si: |
|||||
|
|||||
| Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos herbales. | |||||
| ¿Cómo debo usar TREMFYA/TREMFYA PEN? | |||||
| Vea las ” Instrucciones de uso” detalladas que vienen con TREMFYA/TREMFYA PEN para obtener información sobre cómo preparar e inyectar una dosis de TREMFYA, y cómo desechar correctamente la jeringa precargada de TREMFYA usada, el inyector One-Press o la pluma precargada (TREMFYA PEN). |
|||||
|
|||||
|
¿Cuáles son los posibles efectos secundarios de TREMFYA? |
|||||
| Los efectos secundarios más comunes de TREMFYA incluyen: | |||||
|
|
|
|||
| Estos no son todos los posibles efectos secundarios de TREMFYA. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088. | |||||
¿Cómo debo almacenar TREMFYA?
Mantenga TREMFYA y todos los medicamentos fuera del alcance de los niños. |
|||||
| Información general sobre el uso seguro y eficaz de TREMFYA. | |||||
| Los medicamentos a veces se recetan para fines distintos de los que se enumeran en una Guía de medicamentos. No use TREMFYA para una afección para la que no fue recetado. No le dé TREMFYA a otras personas, incluso si tienen los mismos síntomas que usted. Puede hacerles daño. Puede pedirle a su proveedor de atención médica o farmacéutico información sobre TREMFYA que esté escrita para profesionales de la salud. | |||||
| ¿Cuáles son los ingredientes de TREMFYA? Ingrediente activo: guselkumab Ingredientes inactivos: Jeringa precargada de dosis única, inyector One-Press controlado por el paciente de dosis única, pluma precargada de dosis única para uso subcutáneo: L-histidina, L-histidina monohidrocloruro monohidratado, polisorbato 80, sacarosa y agua para inyección. Vial de dosis única para infusión intravenosa: EDTA disódico dihidratado, L-histidina, L-histidina monohidrocloruro monohidratado, L-metionina, polisorbato 80, sacarosa y agua para inyección. |
|||||
| Fabricado por: Janssen Biotech, Inc., Horsham, PA 19044, EE. UU., Número de licencia de EE. UU. 1864 Para información de patentes: www.janssenpatents.com © Johnson & Johnson y sus afiliadas 2017–2024 Para obtener más información, llame al 1-800-526-7736 o visite www.tremfya.com. |
|||||
INSTRUCCIONES DE USO
TREMFYA
®[trem fye’ ah]
(guselkumab)
injection, for subcutaneous use
200mg/2mL Prefilled Syringe
Estas Instrucciones de uso contienen información sobre cómo inyectar TREMFYA.

Información importante que necesita saber antes de inyectar TREMFYA
TREMFYA viene en una jeringa precargada de dosis única que contiene una dosis de 200 mg.
Si su profesional de la salud decide que usted o un cuidador pueden administrar sus inyecciones de TREMFYA en casa, debe recibir capacitación sobre la forma correcta de preparar e inyectar TREMFYA antes de usar la jeringa precargada.
Lea estas Instrucciones de uso antes de usar su jeringa precargada TREMFYA y cada vez que reciba una recarga. Puede haber nueva información. Este folleto no reemplaza hablar con su profesional de la salud sobre su condición médica o su tratamiento.
Cada jeringa precargada TREMFYA solo se puede usar una vez. Deseche la jeringa precargada usada (vea
Paso 4) después de una dosis, incluso si queda medicamento en ella. No reutilice su jeringa precargada TREMFYA.
La jeringa precargada TREMFYA está diseñada para inyectarse debajo de la piel, no en el músculo o la vena. Después de la inyección, la aguja se retraerá hacia el dispositivo y se bloqueará en su lugar.
 Información de almacenamiento
Información de almacenamiento
Almacenar en el refrigerador entre
36°F to 46°F (2°C to 8°C).
No congele la jeringa precargada TREMFYA.
No agite su jeringa precargada TREMFYA.
Mantenga la jeringa precargada TREMFYA y todos los medicamentos fuera del alcance de los niños.
Mantenga la jeringa precargada TREMFYA en la caja original para protegerla de la luz y los daños físicos.
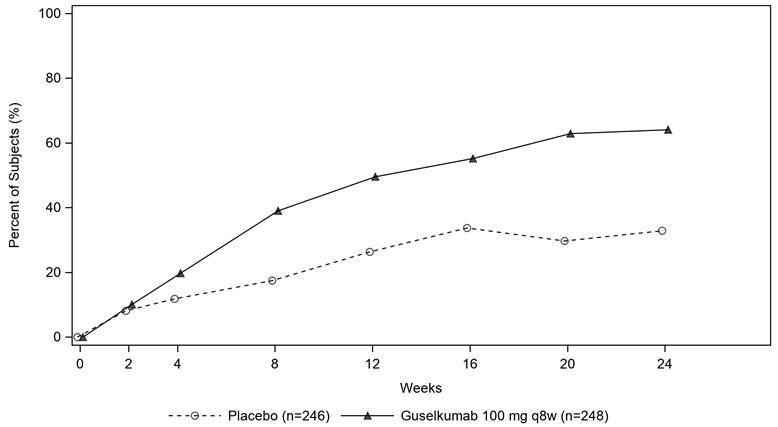
Partes de la jeringa precargada
1. Prepárese
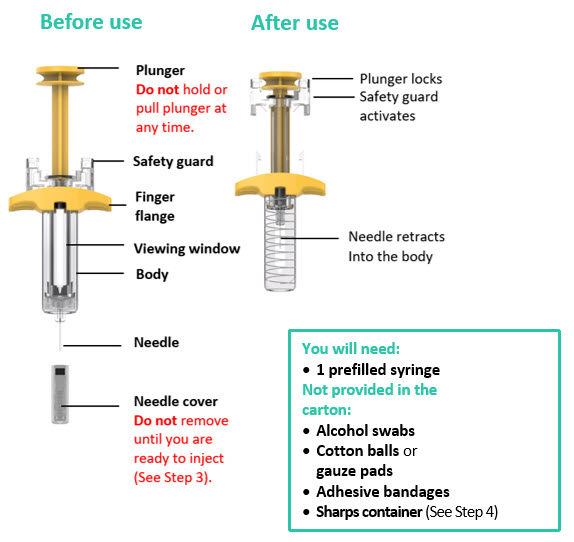
Deje que TREMFYA alcance la temperatura ambiente e inspeccione la caja
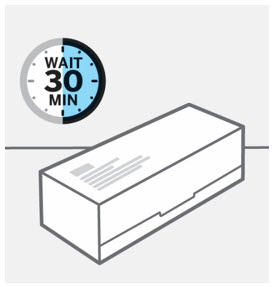
Retire la caja del refrigerador y deje que la caja repose sobre una superficie plana a temperatura ambiente durante aproximadamente
30 minutos antes de usar.
No caliente la jeringa precargada de ninguna otra manera.
Compruebe la fecha de caducidad (‘EXP’).
Nouse su jeringa precargada si la fecha de caducidad ha pasado o si el sello de la caja está roto.
Comuníquese con su profesional de la salud o farmacéutico para obtener una nueva jeringa precargada.
2. Prepárese para inyectar TREMFYA
Saque la jeringa precargada de la caja.
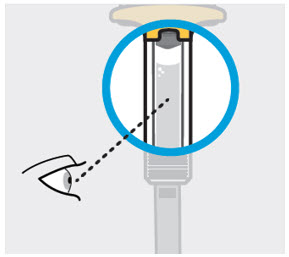
Inspeccione el líquido para ver que esté claro e incoloro a ligeramente amarillo
Compruebe el líquido en la ventana de visualización. Debe ser claro e incoloro a ligeramente amarillo y puede contener pequeñas partículas blancas o transparentes. También puede ver burbujas de aire. Esto es normal.
No inyecte si el líquido es:
- turbio o
- descolorido o
- tiene partículas grandes
No use la jeringa precargada si se cae. Llame a su profesional de la salud o farmacéutico para obtener una nueva jeringa precargada.
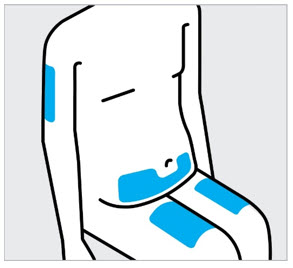
Elija el sitio de inyección
Seleccione un sitio de las siguientes áreas para su inyección:
- Parte delantera de los muslos
- Área del estómago inferior (abdomen inferior), excepto un área de 2 pulgadas alrededor de su ombligo (ombligo)
- Parte posterior de la parte superior de los brazos (solo si otra persona le está administrando la inyección)
No inyecte en la piel que esté sensible, magullada, roja, escamosa, gruesa o dura. Evite las áreas con cicatrices o estrías.
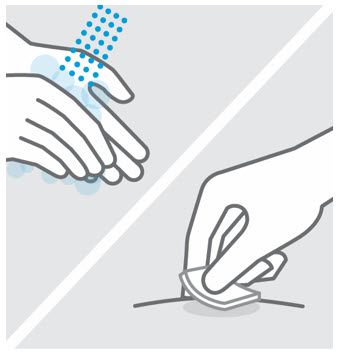
Lávese las manos y limpie el sitio de inyección
Lávese bien las manos con agua y jabón.
Limpie el sitio de inyección elegido con una torunda con alcohol y deje que se seque.
No toque, abanique o sople sobre el sitio de inyección después de limpiarlo.
3. Inyecte TREMFYA
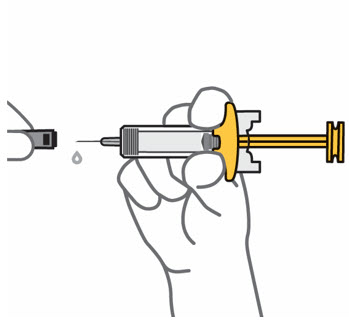
Retire la cubierta de la aguja cuando esté listo para inyectar
Sostenga la jeringa precargada por el cuerpo y tire de la cubierta de la aguja hacia afuera. Es normal ver unas gotas de líquido.
Inyecte TREMFYA dentro de los 5 minutos de quitar la cubierta de la aguja.
No vuelva a colocar la cubierta de la aguja, ya que esto puede dañar la aguja o causar una lesión por pinchazo de aguja.
No toque la aguja ni la deje tocar ninguna superficie.
No use la jeringa precargada si se cae. Llame a su profesional de la salud o farmacéutico para obtener una nueva jeringa precargada.
No sostenga ni tire del émbolo en ningún momento.
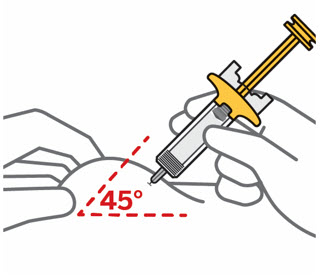
Pellizque el sitio de inyección e inserte la aguja en un ángulo de aproximadamente 45 grados
Es importante pellizcar suficiente piel para inyectar debajo de la piel y no en el músculo.
Inserte la aguja con un movimiento rápido y parecido a una flecha.
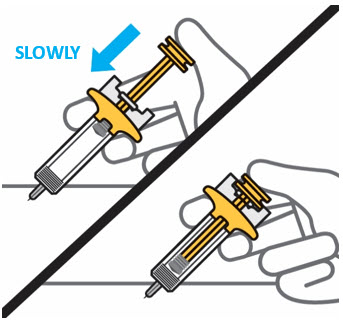
Presione lentamente el émbolo hasta el final hasta que se detenga para inyectar todo el líquido
Sentirá algo de resistencia al presionar el émbolo, esto es normal.
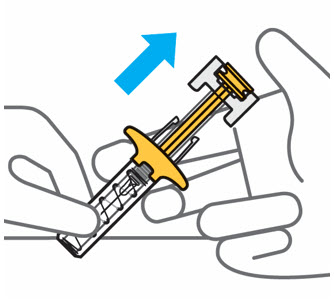
Libere la presión del émbolo para retirar la aguja de la piel
La aguja se retraerá dentro del dispositivo y se bloqueará en su lugar.
4. Después de su inyección
Revise el sitio de inyección
Puede haber una pequeña cantidad de sangre o líquido en el sitio de inyección. Sostenga suavemente presión sobre el sitio de inyección con una bola de algodón o una gasa hasta que se detenga cualquier sangrado.
No frote el sitio de inyección.
Si es necesario, cubra el sitio de inyección con un vendaje.
Deseche su jeringa precargada
Coloque la jeringa precargada usada en un contenedor de eliminación de objetos punzantes aprobado por la FDA inmediatamente después de su uso.
No deseche (elimine) su jeringa precargada en la basura de su hogar.
No recicle su contenedor de eliminación de objetos punzantes usado.
Para obtener más información, consulte
Eliminación de la jeringa precargada TREMFYA.
Eliminación de la jeringa precargada TREMFYA
Si no tiene un contenedor de eliminación de objetos punzantes aprobado por la FDA, puede usar un contenedor doméstico que sea:
- hecho de plástico de alta resistencia
- se puede cerrar con una tapa hermética y resistente a las perforaciones, sin que los objetos punzantes puedan salir
- vertical y estable durante el uso
- a prueba de fugas
- adecuadamente etiquetado para advertir sobre los residuos peligrosos dentro del contenedor
Cuando su contenedor de eliminación de objetos punzantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de eliminar su contenedor de eliminación de objetos punzantes. Puede haber leyes estatales o locales sobre cómo debe desechar las agujas y jeringas usadas.
Para obtener más información sobre la eliminación segura de objetos punzantes y para obtener información específica sobre la eliminación de objetos punzantes en el estado en el que vive, visite el sitio web de la FDA en: www.fda.gov/safesharpsdisposal. También puede consultar con su farmacéutico.
 ¿Necesita ayuda?
¿Necesita ayuda?
Llame a su proveedor de atención médica para hablar sobre cualquier pregunta que pueda tener. Para obtener asistencia adicional o para compartir sus comentarios, llame al 800-526-7736.
Fabricado por:
Janssen Biotech, Inc.
Horsham, PA 19044, EE. UU.
Licencia de EE. UU. No. 1864
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los EE. UU.
Aprobado: Septiembre/2024
INSTRUCCIONES DE USO
TREMFYA
®PEN
[trem fye’ ah Pen]
(guselkumab)
inyección, para uso subcutáneo
200mg/2mL Pluma precargada
Estas Instrucciones de uso contienen información sobre cómo inyectar TREMFYA PEN.
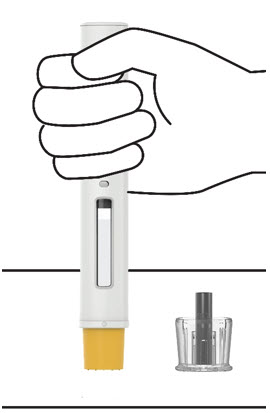
Información importante que necesita saber antes de inyectar TREMFYA PEN
TREMFYA PEN viene en una pluma precargada de dosis única que contiene una dosis de 200 mg.
Si su profesional sanitario decide que usted o un cuidador pueden administrar sus inyecciones de TREMFYA PEN en casa, debe recibir capacitación sobre la forma correcta de preparar e inyectar TREMFYA PEN antes de usar la pluma precargada.
Lea estas Instrucciones de uso antes de usar su pluma precargada y cada vez que obtenga una nueva pluma precargada.
Puede haber nueva información. Este folleto no reemplaza hablar con su profesional sanitario sobre su condición médica o su tratamiento.
Cada TREMFYA PEN solo se puede usar una vez. Deseche la pluma precargada usada (ver
Paso 4) después de una dosis, incluso si aún queda medicamento en ella. No reutilice su pluma precargada.
 Información de almacenamiento
Información de almacenamiento
Almacenar en refrigerador entre
36°F to 46°F (2°C to 8°C).
No congele su TREMFYA PEN.
No agite su TREMFYA PEN.
Mantenga su TREMFYA PEN y todos los medicamentos fuera del alcance de los niños.
Mantenga su TREMFYA PEN en la caja original para protegerlo de la luz y los daños físicos.
Partes de TREMFYA PEN

1. Prepárese
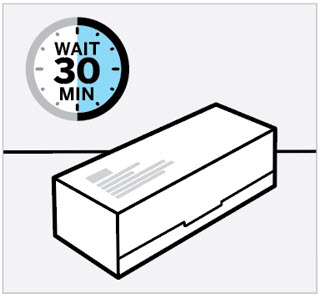
Deje que TREMFYA PEN alcance la temperatura ambiente e inspeccione la caja
Retire la caja del refrigerador y deje que la caja repose sobre una superficie plana a temperatura ambiente durante aproximadamente
30 minutos antes de usar.
No caliente la pluma precargada de ninguna otra manera.
Compruebe la fecha de caducidad (‘EXP’).
No use la pluma precargada si la fecha de caducidad ha pasado o si el sello de la caja está roto.
Comuníquese con su profesional sanitario o farmacéutico para obtener una nueva pluma precargada.
2. Prepárese para inyectar TREMFYA PEN
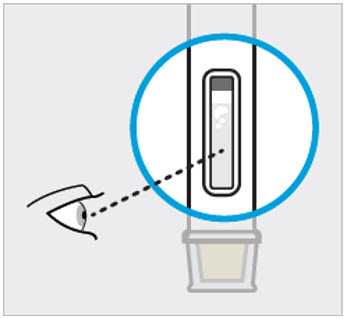
Saque su pluma precargada de la caja.
Inspeccione el líquido en la ventana para ver que está claro e incoloro a ligeramente amarillo
Compruebe el líquido en la ventana de visualización. Debe ser claro e incoloro a ligeramente amarillo y puede contener pequeñas partículas blancas o transparentes. También puede ver burbujas de aire. Esto es normal.
No inyecte si el líquido es:
- turbio o
- descolorido o
- tiene partículas grandes
Llame a su profesional sanitario o farmacéutico para obtener una nueva pluma precargada.
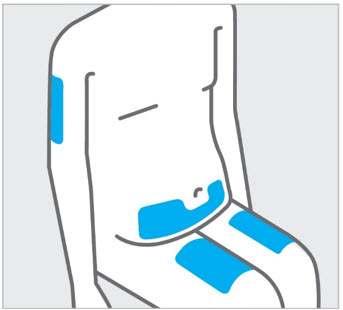
Elija el sitio de inyección
Seleccione una de las siguientes áreas para su inyección:
- Parte delantera de los muslos
- Área del abdomen inferior (abdomen inferior), excepto un área de 2 pulgadas alrededor del ombligo (ombligo)
- Parte posterior de la parte superior de los brazos (solo si otra persona le está administrando la inyección)
No inyecte en la piel que esté sensible, magullada, roja, escamosa, gruesa o dura. Evite las áreas con cicatrices o estrías.

Lávese las manos y limpie el sitio de inyección
Lávese bien las manos con agua y jabón.
Limpie el sitio de inyección elegido con una torunda con alcohol y deje que se seque.
No toque, abanique ni sople sobre el sitio de inyección después de limpiarlo.
3. Inyecte TREMFYA PEN
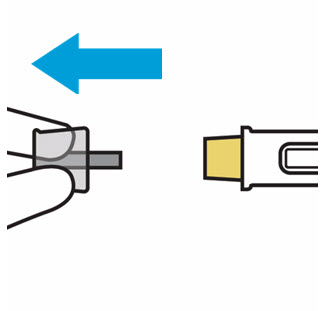
Retire la tapa cuando esté listo para inyectar
| ¡No toque la protección de la aguja amarilla! |
| Esto puede iniciar la inyección y no recibirá la dosis. |
Tire de la tapa hacia arriba. Es normal ver unas gotas de líquido.
Inyecte TREMFYA PEN dentro de los 5 minutos de quitar la tapa.
No vuelva a colocar la tapa, ya que esto puede dañar la aguja.
No use su pluma precargada si se cae después de quitar la tapa. Llame a su profesional sanitario o farmacéutico para obtener una nueva pluma precargada.
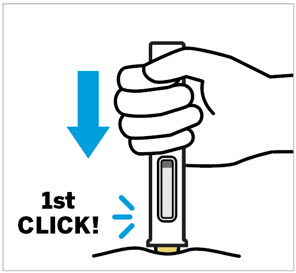
Coloque la pluma precargada recta sobre el sitio de inyección y luego empuje y sostenga la pluma precargada
| ¡No levante la pluma precargada durante la inyección! |
| Si lo hace, la protección de la aguja amarilla se bloqueará y no se administrará la dosis completa. |
Coloque la pluma precargada directamente sobre el sitio de inyección con la protección de la aguja amarilla contra la piel y la ventana de visualización hacia usted.
Presione hacia abajo la pluma precargada y manténgala presionada contra la piel.
Oirá el primer clic.
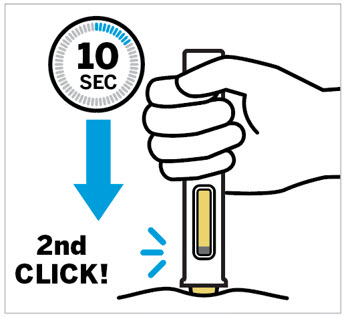
Mantenga la pluma precargada firmemente contra la piel durante unos 10 segundos para escuchar un segundo clic.
Ya casi ha terminado.
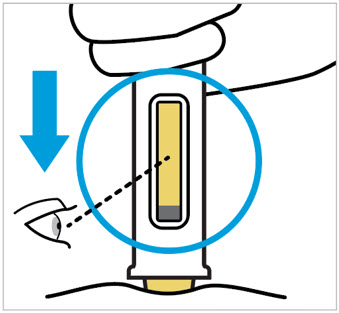
Mantenga firmemente contra la piel y confirme que la inyección está completa.
La inyección estará completa cuando la varilla del émbolo deje de moverse y llene la ventana de visualización.
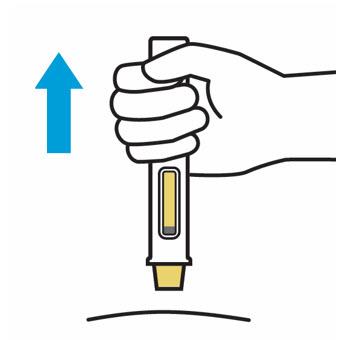
Levante la pluma recta hacia arriba.
4. Después de la inyección
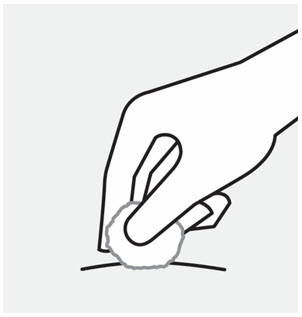
Revise el sitio de inyección.
Puede haber una pequeña cantidad de sangre o líquido en el sitio de inyección. Mantenga una presión suave sobre el sitio de inyección con una bola de algodón o una gasa hasta que deje de sangrar.
No frote el sitio de inyección. Si es necesario, cubra el sitio de inyección con un vendaje.

Deseche la pluma precargada y la tapa.
Deposite la pluma precargada y la tapa usadas en un contenedor de eliminación de objetos punzantes aprobado por la FDA inmediatamente después de su uso.
No tire (deseche) la pluma precargada en la basura de su casa.
No recicle el contenedor de eliminación de objetos punzantes usado.
Para obtener más información, consulte
Eliminación de la pluma TREMFYA.
Eliminación de la pluma TREMFYA
Si no tiene un contenedor de eliminación de objetos punzantes aprobado por la FDA, puede utilizar un contenedor doméstico que sea:
- hecho de plástico resistente
- se pueda cerrar con una tapa hermética y resistente a las perforaciones, sin que los objetos punzantes puedan salir
- vertical y estable durante el uso
- resistente a las fugas
- adecuadamente etiquetado para advertir de los residuos peligrosos dentro del contenedor
Cuando el contenedor de eliminación de objetos punzantes esté casi lleno, deberá seguir las directrices de su comunidad para la forma correcta de eliminar el contenedor de eliminación de objetos punzantes. Puede haber leyes estatales o locales sobre cómo debe desechar las agujas y jeringas usadas.
Para obtener más información sobre la eliminación segura de objetos punzantes y para obtener información específica sobre la eliminación de objetos punzantes en el estado en el que vive, visite el sitio web de la FDA en: www.fda.gov/safesharpsdisposal. También puede consultar con su farmacéutico.
 ¿Necesita ayuda?
¿Necesita ayuda?
Llame a su proveedor de atención médica para hablar sobre cualquier pregunta que pueda tener. Para obtener asistencia adicional o para compartir sus comentarios, llame al 800-526-7736.
Fabricado por:
Janssen Biotech, Inc.
Horsham, PA 19044, EE. UU.
Licencia de EE. UU. No. 1864
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los EE. UU.
Aprobado: Septiembre/2024
INSTRUCCIONES DE USO
TREMFYA
®
(trem fye’ ah)
(guselkumab)
Jeringa precargada
DOSIS ÚNICA
Importante
TREMFYA se presenta como una jeringa precargada de dosis única que contiene una dosis de 100 mg. Cada jeringa precargada de TREMFYA solo se puede usar una vez. Deseche la jeringa precargada usada (vea
Paso 3) después de una dosis, incluso si queda medicamento en ella. No reutilice su jeringa precargada de TREMFYA.
Si su profesional de la salud decide que usted o un cuidador pueden administrarse las inyecciones de TREMFYA en casa, debe recibir capacitación sobre la forma correcta de preparar e inyectar TREMFYA usando la jeringa precargada antes de intentar inyectarse. No intente inyectarse hasta que su profesional de la salud le haya mostrado la forma correcta de administrar las inyecciones.
Lea estas Instrucciones de uso antes de usar su jeringa precargada de TREMFYA y cada vez que reciba una recarga. Puede haber nueva información. Este folleto no reemplaza hablar con su profesional de la salud sobre su condición médica o su tratamiento.
La jeringa precargada de TREMFYA está diseñada para inyectarse debajo de la piel, no en el músculo ni en la vena. Después de la inyección, la aguja se retraerá hacia el cuerpo del dispositivo y se bloqueará en su lugar.
 Información de almacenamiento
Información de almacenamiento
Almacenar en refrigerador a
36° to 46°F (2° to 8°C).
No congele la jeringa precargada de TREMFYA.
Mantenga la jeringa precargada de TREMFYA y todos los medicamentos fuera del alcance de los niños.
No agite su jeringa precargada de TREMFYA.
Mantenga la jeringa precargada de TREMFYA en la caja original para protegerla de la luz y los daños físicos.
Partes de la jeringa precargada
Antes de usar

Después de usar
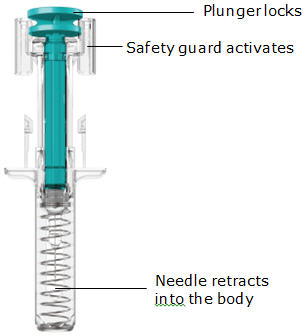
|
Necesitará estos suministros:
No se proporciona en la caja de la jeringa precargada de TREMFYA:
|
1. Prepárese para su inyección
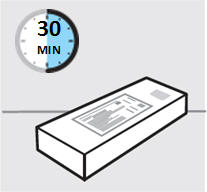
Inspeccione la caja
Retire la caja de la jeringa precargada de TREMFYA del refrigerador.
Mantenga la jeringa precargada en la caja y déjela reposar sobre una superficie plana a temperatura ambiente durante
al menos 30 minutos antes de usarla.
No caliente la jeringa precargada de ninguna otra manera.
Compruebe la fecha de caducidad (‘EXP’)en el panel posterior de la caja.
No utilice la jeringa precargada si la fecha de caducidad ha pasado.
No inyecte TREMFYA si las perforaciones de la caja están rotas. Llame a su proveedor de atención médica o farmacéutico para una recarga.
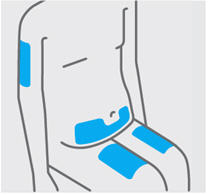
Elija el sitio de inyección
Seleccione una de las siguientes áreas para su inyección:
- Parte delantera de los muslos(recomendado)
- Área inferior del estómago (abdomen inferior), excepto un área de 2 pulgadas alrededor del ombligo (ombligo)
- Parte posterior de la parte superior de los brazos (solo si otra persona le está administrando la inyección)
No inyecte en la piel que esté sensible, magullada, roja, dura, gruesa, escamosa o afectada por psoriasis.
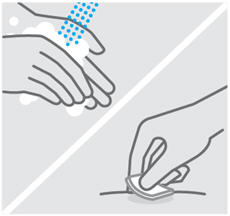
Limpie el sitio de inyección
Lávese bien las manos con agua y jabón.
Limpie el sitio de inyección elegido con una torunda con alcohol y deje que se seque.
No toque, abanique o sople sobre el sitio de inyección después de limpiarlo.
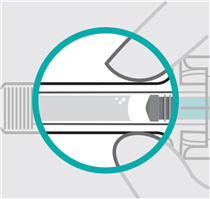
Inspeccione el líquido
Saque la jeringa precargada de TREMFYA de la caja.
Compruebe el líquido de la jeringa precargada de TREMFYA en la ventana de visualización. Debe ser transparente a ligeramente amarillo y puede contener pequeñas partículas blancas o transparentes. También puede ver una o más burbujas de aire. Esto es normal.
No inyecte si el líquido está turbio o descolorido, o tiene partículas grandes. Llame a su proveedor de atención médica o farmacéutico para una recarga.
2. Inyecte TREMFYA usando la jeringa precargada
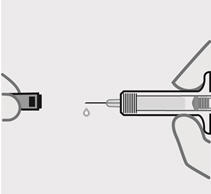
Retire la cubierta de la aguja
Sostenga la jeringa precargada por el cuerpo y tire de la cubierta de la aguja hacia afuera. Es normal ver una gota de líquido.
Inyecte TREMFYA dentro de los 5 minutos de retirar la cubierta de la aguja.
No vuelva a colocar la cubierta de la aguja, ya que esto puede dañar la aguja o causar una lesión por pinchazo de aguja.
No toque la aguja ni deje que toque ninguna superficie.
No utilice una jeringa precargada de TREMFYA si se cae. Llame a su proveedor de atención médica o farmacéutico para una recarga.
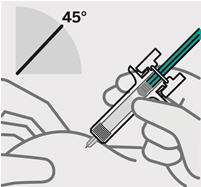
Coloque los dedos e inserte la aguja
Coloque el pulgar, el índice y el dedo medio
directamente debajo de la brida del dedo, como se muestra.
No toque el émbolo o el área por encima de la brida del dedo, ya que esto puede hacer que el dispositivo de seguridad de la aguja se active.
Use la otra mano para pellizcar la piel en el sitio de inyección. Coloque la jeringa en un ángulo de aproximadamente 45 grados con respecto a la piel.
Es importante pellizcar suficiente piel para
inyectar debajo de la piel y no en el músculo.
Inserte la aguja con un movimiento rápido y parecido a una flecha.
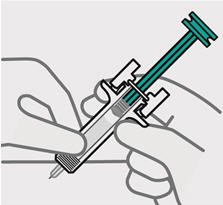
Suelte el pellizco y reposicione la mano
Use su mano libre para sujetar el cuerpo de la jeringa precargada.
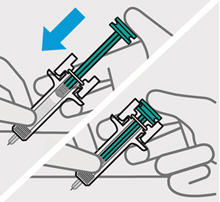
Presione el émbolo
Coloque el pulgar de la mano opuesta sobre el émbolo y presione el émbolo
hasta el fondo hasta que se detenga.
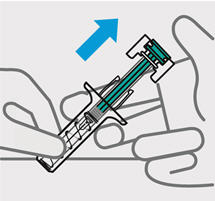
Libere la presión del émbolo
El protector de seguridad cubrirá la aguja y se bloqueará en su lugar, retirando la aguja de la piel.
3. Después de su inyección
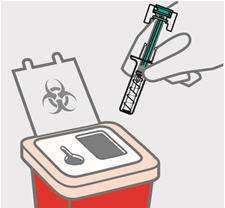
Deseche la jeringa precargada
Coloque la jeringa precargada de TREMFYA usada en un contenedor de eliminación de objetos punzantes aprobado por la FDA inmediatamente después de su uso.
No tire (deseche) la jeringa precargada de TREMFYA en la basura de su casa.
No recicle su contenedor de eliminación de objetos punzantes usado.
Para obtener más información, consulte ”
¿Cómo debo desechar la jeringa precargada usada?”
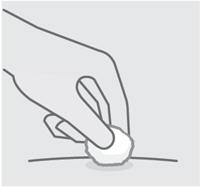
Compruebe el sitio de inyección
Puede haber una pequeña cantidad de sangre o líquido en el sitio de inyección. Mantenga presión sobre la piel con una bola de algodón o una gasa hasta que deje de sangrar.
No frote el sitio de inyección.
Si es necesario, cubra el sitio de inyección con una venda.
 ¿Necesita ayuda?
¿Necesita ayuda?
Llame a su proveedor de atención médica para hablar sobre cualquier pregunta que pueda tener. Para obtener asistencia adicional o para compartir sus comentarios, llame al 800-JANSSEN (800-526-7736).
¿Cómo debo desechar la jeringa precargada usada?
Si no tiene un contenedor de eliminación de objetos punzantes aprobado por la FDA, puede usar un contenedor doméstico que sea:
- hecho de plástico resistente
- se puede cerrar con una tapa ajustada y resistente a las perforaciones, sin que los objetos punzantes puedan salir
- vertical y estable durante el uso
- resistente a las fugas
- debidamente etiquetado para advertir sobre los residuos peligrosos dentro del contenedor
Cuando su contenedor de eliminación de objetos punzantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de desechar su contenedor de eliminación de objetos punzantes. Puede haber leyes estatales o locales sobre cómo debe desechar las agujas y jeringas usadas.
Para obtener más información sobre la eliminación segura de objetos punzantes y para obtener información específica sobre la eliminación de objetos punzantes en el estado en el que vive, visite el sitio web de la FDA en: www.fda.gov/safesharpsdisposal
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos.
Fabricado por:
Janssen Biotech, Inc. Horsham, PA 19044
Licencia de EE. UU. No. 1864
Aprobado: Diciembre de 2017
INSTRUCCIONES DE USO
TREMFYA
®
[trem fye´ ah]
(guselkumab)
injection, for subcutaneous use
One-Press Patient-Controlled Injector
Estas “Instrucciones de uso” contienen información sobre cómo inyectar TREMFYA.
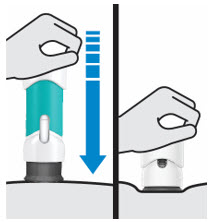
Información importante que necesita saber antes de inyectar TREMFYA
TREMFYA viene en un inyector One-Press de dosis única que contiene una dosis de 100 mg.
| Durante la inyección, empuje el mango hasta el final hasta que el cuerpo de color verde azulado no sea visible para inyectar la dosis completa. NO LEVANTE ONE-PRESS durante la inyección. Si lo hace, el One-Press se bloqueará y no recibirá la dosis completa. |
Cada inyector One-Press solo se puede usar una vez. Deseche (vea
Paso 3) después de una dosis, incluso si queda medicamento en él. No reutilice su inyector One-Press.
Si su proveedor de atención médica decide que usted o un cuidador pueden administrar sus inyecciones de TREMFYA en casa, debe recibir capacitación sobre la forma correcta de preparar e inyectar TREMFYA utilizando el inyector One-Press. No intente inyectarse hasta que haya sido capacitado por su proveedor de atención médica.
Lea estas Instrucciones de uso antes de usar su inyector One-Press y cada vez que obtenga un nuevo inyector One-Press. Puede haber nueva información.
Este folleto no reemplaza hablar con su proveedor de atención médica sobre su condición médica o su tratamiento.
 Información de almacenamiento
Información de almacenamiento
Almacenar en el refrigerador a
36° to 46°F (2° to 8°C).
No congele su inyector One-Press.
No agite su inyector One-Press.
Mantenga su inyector One-Press y todos los medicamentos fuera del alcance de los niños.
Mantenga su inyector One-Press en la caja original para protegerlo de la luz y los daños físicos.
 ¿Necesita ayuda?
¿Necesita ayuda?
Llame a su proveedor de atención médica para hablar sobre cualquier pregunta que pueda tener. Para obtener asistencia adicional o para compartir sus comentarios, llame al 800-JANSSEN (800-526-7736).
Partes del inyector One-Press
Antes de usarDespués de usar
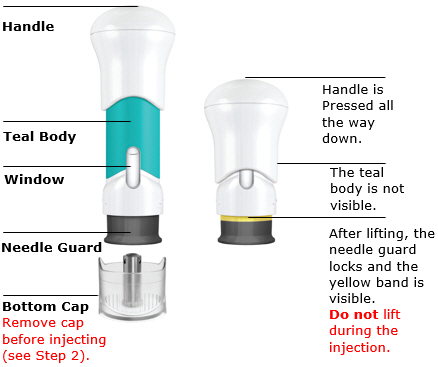
Necesitará:
No se proporciona en la caja:
|
1. Preparación para inyectar TREMFYA
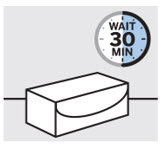
Inspeccione la caja y deje que TREMFYA alcance la temperatura ambiente
Retire la caja del inyector One-Press del refrigerador.
Mantenga el inyector One-Press en la caja y déjelo reposar sobre una superficie plana a temperatura ambiente durante
al menos 30 minutos antes de usarlo.
No caliente el inyector One-Press de ninguna otra manera.
Compruebe la fecha de caducidad (‘EXP’) en la caja
No utilice el inyector One-Press si la fecha de caducidad ha pasado.
No inyecte TREMFYA si el sello de la caja está roto. Llame a su proveedor de atención médica o farmacéutico para obtener un nuevo inyector One-Press.
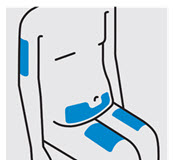
Elija el sitio de inyección
Seleccione una de las siguientes áreas para su inyección:
- Parte delantera de los muslos (recomendado)
- Área inferior del estómago (abdomen inferior), excepto un área de 2 pulgadas alrededor del ombligo (ombligo)
- Parte posterior de la parte superior de los brazos (solo si otra persona le está administrando la inyección)
No inyecte en la piel que esté sensible, magullada, roja, dura, gruesa, escamosa o afectada por psoriasis.
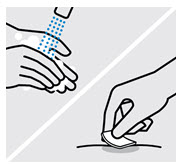
Lávese las manos
Lávese bien las manos con agua y jabón.
Limpie el sitio de inyección
Limpie el sitio de inyección elegido con una torunda con alcohol y deje que se seque.
No toque, abanique ni sople sobre el sitio de inyección después de limpiarlo.
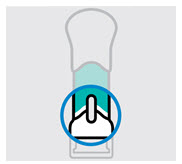
Inspeccione el líquido en la ventana
Saque el inyector One-Press de la caja.
Compruebe el líquido en la ventana. Debe ser transparente a ligeramente amarillo y puede contener pequeñas partículas blancas o transparentes. También puede ver una o más burbujas de aire. Esto es normal.
No inyecte si el líquido es:
- turbio,
- descolorido, o
- tiene partículas grandes.
Llame a su proveedor de atención médica o farmacéutico para obtener un nuevo inyector One-Press.
2. Inyección de TREMFYA
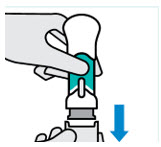
Retire la tapa inferior
Mantenga las manos alejadas del protector de la aguja después de retirar la tapa. Es normal que se vean unas gotas de líquido.
Inyecte TREMFYA dentro de los 5 minutos de retirar la tapa.
No vuelva a colocar la tapa. Esto podría dañar la aguja.
No utilice un inyector One-Press si se cae después de retirar la tapa. Llame a su proveedor de atención médica o farmacéutico para obtener un nuevo inyector One-Press.
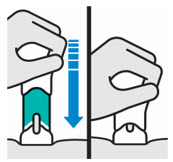
Coloque recto sobre la piel.
Empuje el mango hasta el fondo hasta que el cuerpo verde azulado no sea visible
| ¡NO LEVANTE ONE-PRESS durante la inyección! Si lo hace, el protector de la aguja se bloqueará, mostrando una banda amarilla, y no recibirá la dosis completa. |
Puede escuchar un clic cuando la inyección comienza. Siga presionando.
Si siente resistencia, siga presionando. Esto es normal.
El medicamento se inyecta a medida que presiona. Hágalo a una velocidad que le resulte cómoda.
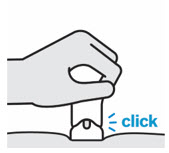
Confirme que su inyección está completa
Su inyección está completa cuando:
- El cuerpo verde azulado no es visible.
- Ya no puede presionar el mango hacia abajo.
- Puede escuchar un clic.
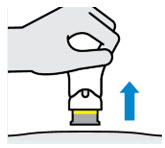
Levante hacia arriba en línea recta
La banda amarilla indica que el protector de la aguja está bloqueado.
3. Después de su inyección

Deseche su inyector One-Press
Deposite su inyector One-Press usado en un contenedor de eliminación de objetos punzantes inmediatamente después de su uso.
No deseche (elimine) su inyector One-Press en la basura de su hogar.
No recicle su contenedor de eliminación de objetos punzantes usado.
Para obtener más información, consulte ”
Eliminación del inyector One-Press de TREMFYA“.
Revise el sitio de inyección
Puede haber una pequeña cantidad de sangre o líquido en el sitio de inyección. Mantenga presión sobre su piel con una bola de algodón o una gasa hasta que deje de sangrar.
No frote el sitio de inyección.
Si es necesario, cubra el sitio de inyección con una venda.
Eliminación del inyector One-Press de TREMFYA
Si no tiene un contenedor de eliminación de objetos punzantes aprobado por la FDA, puede usar un contenedor doméstico que sea:
- hecho de plástico de alta resistencia
- se puede cerrar con una tapa hermética y resistente a las perforaciones, sin que los objetos punzantes puedan salir
- vertical y estable durante el uso
- a prueba de fugas
- adecuadamente etiquetado para advertir sobre los residuos peligrosos dentro del contenedor
Cuando su contenedor de eliminación de objetos punzantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de desechar su contenedor de eliminación de objetos punzantes. Puede haber leyes estatales o locales sobre cómo debe desechar las agujas y jeringas usadas.
Para obtener más información sobre la eliminación segura de objetos punzantes y para obtener información específica sobre la eliminación de objetos punzantes en el estado en el que vive, visite el sitio web de la FDA en: www.fda.gov/safesharpsdisposal. También puede consultar con su farmacéutico.
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos.
Fabricado por:
Janssen Biotech, Inc. Horsham, PA 19044
Licencia de EE. UU. No. 1864
Revisado: junio de 2023
PANEL PRINCIPAL DE PRESENTACIÓN – Jeringa de 100 mg/mL Caja – NDC 57894-640-01
Tremfya
®
(guselkumab)
Injection
100 mg/mL
PARA USO SUBCUTÁNEO ÚNICAMENTE
Rx solamente
NDC 57894-640-01
Una jeringa precargada de dosis única
Deseche la porción no utilizada
No contiene conservante
ATENCIÓN: Entregue la
Guía de medicamentos adjunta a cada paciente
PANEL PRINCIPAL DE VISUALIZACIÓN – Jeringa en caja de 100 mg/mL – NDC 57894-640-11
Tremfya
®
(guselkumab)
Inyección
100 mg/mL
SOLO PARA USO SUBCUTÁNEO
Rx only
NDC 57894-640-11
Inyector de dosis única One-Press
controlado por el paciente
Deseche la porción no utilizada
No contiene conservantes
ATENCIÓN: Entregue la Guía de Medicamentos adjunta
a cada paciente

PANEL PRINCIPAL DE VISUALIZACIÓN – Vial Cartón de 200 mg/20 mL
NDC 57894-650-02
Tremfya
®
(guselkumab)
Injection
200 mg/20 mL
(10 mg/mL)
PARA INFUSIÓN
INTRAVENOSA ÚNICAMENTE
Atención: Entregue la
Guía del Medicamento
adjunta a cada paciente.
Rx solamente
Vial de dosis única
Deseche la porción no utilizada
PANEL PRINCIPAL DE VISUALIZACIÓN – Pluma de 200 mg/2 mL Caja
NDC 57894-651-02
Tremfya
®PEN
(guselkumab)
Inyección
200 mg/2 mL
PARA USO SUBCUTÁNEO ÚNICAMENTE
Rx only
Una pluma precargada de dosis única
Deseche la porción no utilizada
ATENCIÓN: Entregue la Guía del Medicamento
adjunta a cada paciente.
PANEL PRINCIPAL DE VISUALIZACIÓN – Jeringa de 200 mg/2 mL Caja
NDC 57894-651-22
Tremfya
®
(guselkumab)
Injection
200 mg/2 mL
PARA USO SUBCUTÁNEO ÚNICAMENTE
Rx solamente
Una jeringa precargada de dosis única
Deseche la porción no utilizada
ATENCIÓN: Entregue la
Guía de medicamentos adjunta a cada paciente.