Fabricante de medicamentos: Accord Healthcare Inc. (Updated: 2024-02-15)
INFORMACIÓN DESTACADA DE LA INFORMACIÓN DE PRESCRIPCIÓN
Cápsulas de temozolomida, para uso oral
Aprobación inicial en los EE. UU.: 1999
CAMBIOS IMPORTANTES RECIENTES
INDICACIONES Y USO
DOSIFICACIÓN Y ADMINISTRACIÓN
- Administrar por vía oral o intravenosa. (
2.4)
-
Glioblastoma recién diagnosticado:
- 75 mg/m
2una vez al día durante 42 a 49 días concomitantes con radioterapia focal seguida de una dosis inicial de mantenimiento de 150 mg/m
2una vez al día los días 1 a 5 de cada ciclo de 28 días durante 6 ciclos. Puede aumentar la dosis de mantenimiento a 200 mg/m
2para los ciclos 2 a 6 según la toxicidad. (
2.1)
- Proporcionar profilaxis para la neumonía por Pneumocystis (PCP) durante la fase concomitante y continuar en pacientes que desarrollen linfopenia hasta la resolución al Grado 1 o menor. (
2.1)
- 75 mg/m
-
Tratamiento adyuvante del astrocitoma anaplásico recién diagnosticado:
Comenzando 4 semanas después del final de la radioterapia, administrar cápsulas de temozolomida por vía oral en una dosis única los días 1-5 de un ciclo de 28 días durante 12 ciclos. La dosis recomendada para el Ciclo 1 es de 150 mg/m2por día y para los Ciclos 2 a 12 es de 200 mg/m
2si el paciente no experimentó toxicidad o una toxicidad mínima en el Ciclo 1. (
2.2)
-
Astrocitoma anaplásico refractario: Dosis inicial de 150 mg/m
2una vez al día los días 1 a 5 de cada ciclo de 28 días. (
2.2)
FORMAS FARMACÉUTICAS Y CONCENTRACIONES
- Cápsulas: 5 mg, 20 mg, 100 mg, 140 mg, 180 mg y 250 mg. (
3)
CONTRAINDICACIONES
- Historial de hipersensibilidad grave a la temozolomida o cualquier otro ingrediente en las cápsulas de temozolomida y dacarbazina.
(
4)
ADVERTENCIAS Y PRECAUCIONES
-
Mielosupresión: Monitorear el recuento absoluto de neutrófilos (ANC) y el recuento de plaquetas antes de cada ciclo y durante el tratamiento. Los pacientes geriátricos y las mujeres tienen un mayor riesgo de desarrollar mielosupresión.
(
5.1,
8.5)
-
Hepatotoxicidad: Se han reportado hepatotoxicidad fatal y grave. Realizar pruebas de función hepática al inicio, a la mitad del primer ciclo, antes de cada ciclo subsiguiente y aproximadamente de 2 a 4 semanas después de la última dosis de temozolomida. (
5.2)
-
Neumonía por Pneumocystis (PCP): Monitorear de cerca a todos los pacientes, especialmente a aquellos que reciben esteroides, por el desarrollo de linfopenia y PCP. (
5.3)
-
Neoplasias malignas secundarias:Se han observado síndromes mielodisplásicos y neoplasias malignas secundarias, incluyendo leucemia mieloide. (
5.4)
-
Toxicidad embrio-fetal: Puede causar daño fetal. Aconsejar a las mujeres con potencial reproductivo sobre el riesgo potencial para el feto y el uso de anticoncepción efectiva. Aconsejar a los pacientes masculinos con parejas embarazadas o parejas femeninas con potencial reproductivo para usar condones. (
5.5,
8.1,
8.3)
-
Exposición a cápsulas abiertas:Las cápsulas de temozolomida no deben abrirse, masticarse ni disolverse, sino tragarse enteras con un vaso de agua. (
5.6)
REACCIONES ADVERSAS
- Las reacciones adversas más comunes (≥20%) son: alopecia, fatiga, náuseas, vómitos, cefalea, estreñimiento, anorexia y convulsiones. (
6.1)
- Las anomalías de laboratorio hematológicas de Grado 3 a 4 más comunes (≥10%) en pacientes con astrocitoma anaplásico son: disminución de linfocitos, disminución de plaquetas, disminución de neutrófilos y disminución de leucocitos. (
6.1)
Para reportar SOSPECHAS DE REACCIONES ADVERSAS, comuníquese con Accord Healthcare Inc., al 1-866-941-7875 o con la FDA al 1-800-FDA-1088 o
USO EN POBLACIONES ESPECÍFICAS
- Lactancia: Aconsejar no amamantar. (
8.2)
Consulte la sección 17 para INFORMACIÓN DE ASESORAMIENTO AL PACIENTE e información de etiquetado aprobada por la FDA para el paciente.
Revisado: 12/2023
Tabla de Contenidos
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDOS*
1 INDICACIONES Y USO
1.1 Glioblastoma Recién Diagnosticado
1.2 Astrocitoma Anaplásico
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Monitoreo para Informar la Dosificación y Administración
2.2 Dosificación Recomendada y Modificaciones de Dosis para Glioblastoma Recién Diagnosticado
2.3 Dosificación Recomendada y Modificaciones de Dosis para Astrocitoma Anaplásico
2.4 Preparación y Administración
3 FORMAS FARMACÉUTICAS Y CONCENTRACIONES
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Mielosupresión
5.2 Hepatotoxicidad
5.3 Neumonía por Neumocistis
5.4 Neoplasias Secundarias
5.5 Toxicidad Embrio-Fetal
5.6 Exposición a Cápsulas Abiertas
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Poscomercialización
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.3 Mujeres y Hombres con Potencial Reproductivo
8.4 Uso Pediátrico
8.5 Uso Geriátrico
8.6 Insuficiencia Renal
8.7 Insuficiencia Hepática
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinámica
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
13.2 Toxicología Animal y/o Farmacología
14 ESTUDIOS CLÍNICOS
14.1 Glioblastoma Recién Diagnosticado
14.2 Astrocitoma Anaplásico
15 REFERENCIAS
16 PRESENTACIÓN/ALMACENAMIENTO Y MANIPULACIÓN
17 INFORMACIÓN PARA EL ASESORAMIENTO DEL PACIENTE
- *
- No se enumeran las secciones o subsecciones omitidas de la información completa de prescripción.
1 INDICACIONES Y USO
1.1 Glioblastoma recién diagnosticado
La cápsula de temozolomida está indicada para el tratamiento de adultos con glioblastoma recién diagnosticado, concomitantemente con radioterapia y luego como tratamiento de mantenimiento.
1.2 Astrocitoma anaplásico
La cápsula de temozolomida está indicada para:
- el tratamiento adyuvante de adultos con astrocitoma anaplásico recién diagnosticado;
- el tratamiento de adultos con astrocitoma anaplásico refractario
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Monitoreo para informar la dosificación y administración
Antes de la dosificación, retener las cápsulas de temozolomida hasta que los pacientes tengan un recuento absoluto de neutrófilos (ANC) de 1,5 x 10
9/L o superior y un recuento de plaquetas de 100 x 10
9/L o superior.
Para la radioterapia concomitante, obtener un hemograma completo antes del inicio del tratamiento y semanalmente durante el tratamiento. Para los ciclos de tratamiento de 28 días, obtener un hemograma completo antes del tratamiento el Día 1 y el Día 22 de cada ciclo. Realizar hemogramas completos semanalmente hasta la recuperación si el ANC cae por debajo de 1,5 x 10
9/L y el recuento de plaquetas cae por debajo de 100 x 10
9/L.
Para el uso concomitante con radioterapia focal, obtener un hemograma completo semanalmente y según lo indique clínicamente.
2.2 Dosificación recomendada y modificaciones de dosis para glioblastoma recién diagnosticado
Administrar las cápsulas de temozolomida por vía oral o intravenosa una vez al día durante 42 a 49 días consecutivos durante la fase de uso concomitante con radioterapia focal, y luego una vez al día los días 1 a 5 de cada ciclo de 28 días durante 6 ciclos durante la fase de uso de mantenimiento.
Proporcionar profilaxis para la neumonía por Pneumocystis (PCP) durante la fase de uso concomitante y continuar en pacientes que desarrollen linfopenia hasta la resolución al Grado 1 o inferior
[ver
Advertencias y precauciones (5.3)]
.
Fase de uso concomitante:
La dosis recomendada de la cápsula de temozolomida es de 75 mg/m
2por vía oral una vez al día durante 42 a 49 días en combinación con radioterapia focal. La radioterapia focal incluye la cama tumoral o el sitio de resección con un margen de 2 a 3 cm.
Se han utilizado otros esquemas de administración.
Obtener un hemograma completo semanalmente. Las modificaciones de dosis recomendadas debido a reacciones adversas durante la fase de uso concomitante se proporcionan en la Tabla 1.
| Reacción adversa | Interrupción | Discontinuación |
| Recuento absoluto de neutrófilos |
Retener temozolomida si ANC es mayor o igual a 0,5 x 10 9/L y menor a 1,5 x 10 9/L. Reanudar temozolomida a la misma dosis cuando ANC sea mayor o igual a 1,5 x 10 9/L. |
Discontinuar temozolomida si el recuento de ANC es menor a 0,5 x 10
9/L. |
| Recuento de plaquetas |
Retener temozolomida si el recuento de plaquetas es mayor o igual a 10 x 10 9/L y menor a 100 x 10 9/L. Reanudar temozolomida a la misma dosis cuando el recuento de plaquetas sea mayor o igual a 100 x 10 9/L. |
Discontinuar temozolomida si el recuento de plaquetas es menor a 10 x 10
9/L. |
| Reacción adversa no hematológica (excepto alopecia, náuseas, vómitos) |
Retener temozolomida si ocurre una reacción adversa de Grado 2. Reanudar temozolomida a la misma dosis cuando se resuelva al Grado 1 o menos. |
Discontinuar temozolomida si ocurre una reacción adversa de Grado 3 o 4. |
Fase de uso de mantenimiento con un solo agente:
Comenzando 4 semanas después de completar la fase de uso concomitante, administrar las cápsulas de temozolomida por vía oral una vez al día los días 1 a 5 de cada ciclo de 28 días durante 6 ciclos. La dosis recomendada de las cápsulas de temozolomida en la fase de uso de mantenimiento es:
-
Ciclo 1: 150 mg/m
2por día en los días 1 a 5.
-
Ciclos 2 a 6: Se puede aumentar a 200 mg/m
2por día en los días 1 a 5 antes de comenzar el Ciclo 2 si no se requieren interrupciones o discontinuaciones de dosis (
Tabla 1). Si la dosis no se aumenta al inicio del Ciclo 2,
noaumentar la dosis para los Ciclos 3 a 6.
Obtener un hemograma completo el Día 22 y luego semanalmente hasta que el ANC esté por encima de 1,5 x 10
9/L y el recuento de plaquetas esté por encima de 100 x 10
9/L. No iniciar el próximo ciclo hasta que el ANC y el recuento de plaquetas excedan estos niveles.
Las modificaciones de dosis recomendadas debido a reacciones adversas durante la fase de uso de mantenimiento se proporcionan en la
Tabla 2.
Si se retiene temozolomida, reducir la dosis para el próximo ciclo en 50 mg/m
2por día. Discontinuar permanentemente temozolomida en pacientes que no puedan tolerar una dosis de 100 mg/m
2por día.
| Reacciones adversas | Interrupción y reducción de la dosis | Discontinuación |
|
Recuento absoluto de neutrófilos |
Suspender temozolomida si RAN menor de 1 x 109/L. Cuando el RAN sea superior a 1,5 x 109/L, reanudar temozolomida a dosis reducida para el próximo ciclo. |
Discontinuar temozolomida si no se puede tolerar una dosis de 100 mg/m2 por día. |
|
Recuento de plaquetas |
Suspender temozolomida si el recuento de plaquetas es menor de 50 x 109/L. Cuando el recuento de plaquetas sea superior a 100 x 109/L, reanudar temozolomida a dosis reducida para el próximo ciclo. |
Discontinuar temozolomida si no se puede tolerar una dosis de 100 mg/m2 por día. |
|
Reacción adversa no hematológica (excepto alopecia, náuseas, vómitos) |
Suspender temozolomida si se produce una reacción adversa de Grado 3. Cuando se resuelva a Grado 1 o menos, reanudar temozolomida a dosis reducida para el próximo ciclo. |
Discontinuar temozolomida si se produce una reacción adversa recurrente de Grado 3 después de la reducción de dosis, si se produce una reacción adversa de Grado 4, o si no se puede tolerar una dosis de 100 mg/m2 por día. |
2.3 Dosis recomendada y modificaciones de la dosis para astrocitoma anaplásico
Tratamiento adyuvante del astrocitoma anaplásico recién diagnosticado
Comenzando 4 semanas después del final de la radioterapia, administrar las cápsulas de temozolomida por vía oral en una dosis única los días 1 a 5 de un ciclo de 28 días durante 12 ciclos. La dosis recomendada de la cápsula de temozolomida es:
- Ciclo 1: 150 mg/m2 por día en los días 1 a 5.
- Ciclos 2 a 12: 200 mg/m2 por día en los días 1 a 5 si el paciente no experimentó toxicidad o toxicidad mínima en el Ciclo 1. Si la dosis no se aumentó al inicio del Ciclo 2, no aumente la dosis durante los Ciclos 3 a 6.
Las pruebas recomendadas de hemograma completo y las modificaciones de la dosis debido a reacciones adversas durante el tratamiento adyuvante se proporcionan anteriormente y en la Tabla 2 [ver Dosificación y administración (2.2)].
Astrocitoma anaplásico refractario
La dosis inicial recomendada de temozolomida es de 150 mg/m2 una vez al día en los Días 1 a 5 de cada ciclo de 28 días. Aumentar la dosis de temozolomida a 200 mg/m2 por día si se cumplen las siguientes condiciones en el nadir y en el Día 1 del siguiente ciclo:
- RAN es mayor o igual a 1,5 x 109/L y
- El recuento de plaquetas es mayor o igual a 100 x 109/L
Continuar con temozolomida hasta progresión de la enfermedad o toxicidad inaceptable.
Obtener un hemograma completo el Día 22 y luego semanalmente hasta que el RAN esté por encima de 1,5 x 109/L y el recuento de plaquetas esté por encima de 100 x 109/L. No iniciar el siguiente ciclo hasta que el RAN y el recuento de plaquetas excedan estos niveles.
Si el RAN es menor de 1 x 109/L o el recuento de plaquetas es menor de 50 x 109/L durante cualquier ciclo, reducir la dosis de temozolomida para el próximo ciclo en 50 mg/m2 por día. Discontinuar permanentemente temozolomida en pacientes que no puedan tolerar una dosis de 100 mg/m2 por día.
2.4 Preparación y administración
Temozolomida es un medicamento peligroso. Siga los procedimientos aplicables de manipulación y eliminación especiales.1
Cápsulas de temozolomida
Tomar las cápsulas de temozolomida a la misma hora cada día. Administrar las cápsulas de temozolomida de manera consistente con respecto a los alimentos (en ayunas vs. no en ayunas) [ver Farmacología clínica (12.3)]. Para reducir las náuseas y los vómitos, tomar las cápsulas de temozolomida con el estómago vacío o al acostarse y considerar la terapia antieméti ca antes y después de la administración de las cápsulas de temozolomida.
Tragar las cápsulas de temozolomida enteras con agua. Aconsejar a los pacientes que no abran, mastiquen o disuelvan el contenido de las cápsulas [ver Advertencias y precauciones (5.6)].
Si las cápsulas se abren o dañan accidentalmente, tomar precauciones para evitar la inhalación o el contacto con la piel o las membranas mucosas. En caso de contacto con el polvo, lavar el área afectada con agua inmediatamente.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
- Cápsulas de temozolomida, USP para administración oral
- Las cápsulas de 5 mg tienen cuerpos blancos con tapas verdes. El cuerpo de la cápsula está impreso con ‘5’. La tapa está impresa con ‘TMZ’.
- Las cápsulas de 20 mg tienen cuerpos blancos con tapas amarillas. El cuerpo de la cápsula está impreso con ’20’. La tapa está impresa con ‘TMZ’.
- Las cápsulas de 100 mg tienen cuerpos blancos con tapas rosas. El cuerpo de la cápsula está impreso con ‘100’. La tapa está impresa con ‘TMZ’.
- Las cápsulas de 140 mg tienen cuerpos blancos con tapas azules transparentes. El cuerpo de la cápsula está impreso con ‘140’. La tapa está impresa con ‘TMZ’.
- Las cápsulas de 180 mg tienen cuerpos blancos con tapas burdeos. El cuerpo de la cápsula está impreso con ‘180’. La tapa está impresa con ‘TMZ’.
- Las cápsulas de 250 mg tienen cuerpos blancos con tapas blancas. El cuerpo de la cápsula está impreso con ‘250’. La tapa está impresa con ‘TMZ’.
4 CONTRAINDICACIONES
Temozolomida está contraindicada en pacientes con antecedentes de reacciones de hipersensibilidad graves a:
- temozolomida o cualquier otro ingrediente en las cápsulas de temozolomida; y
- dacarbazina, ya que tanto temozolomida como dacarbazina se metabolizan al mismo metabolito activo 5-(3metiltriazen-1-il)-imidazol-4-carboxamida.
Las reacciones a temozolomida han incluido anafilaxia
[ver
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Mielosupresión
La mielosupresión, incluida la pancitopenia, leucopenia y anemia, algunas con desenlaces fatales, han ocurrido con temozolomida
[ver
6.2)].
En MK-7365-006, la mielosupresión generalmente ocurrió durante los primeros ciclos de terapia y generalmente no fue acumulativa. Los nadires medianos ocurrieron a los 26 días para las plaquetas (rango: 21 a 40 días) y 28 días para los neutrófilos (rango: 1 a 44 días). Aproximadamente el 10% de los pacientes requirieron hospitalización, transfusión de sangre o interrupción de la terapia debido a la mielosupresión. Se ha demostrado en ensayos clínicos que los pacientes geriátricos y las mujeres tienen un mayor riesgo de desarrollar mielosupresión.
Obtenga un hemograma completo y monitoree el recuento de ANC y plaquetas antes del inicio del tratamiento y según esté clínicamente indicado durante el tratamiento. Cuando se utilice temozolomida en combinación con radioterapia, obtenga un hemograma completo antes del inicio del tratamiento, semanalmente durante el tratamiento y según esté clínicamente indicado [ver Dosificación y Administración
(
2.1,
2.2,
2.3)].
Para mielosupresión grave, suspenda la temozolomida y luego reanude con la misma dosis o dosis reducida, o descontinúe permanentemente, según la ocurrencia [ver Dosificación y Administración
(
2.1,
2.2,
2.3)].
5.2 Hepatotoxicidad
Se han reportado casos de hepatotoxicidad fatal y grave en pacientes que reciben temozolomida. Realice pruebas de función hepática al inicio, a mitad del primer ciclo, antes de cada ciclo subsiguiente y aproximadamente de dos a cuatro semanas después de la última dosis de temozolomida.
5.3 Neumonía por Neumocistis
Se ha reportado neumonía por Neumocistis (PCP) en pacientes que reciben temozolomida. El riesgo de PCP aumenta en pacientes que reciben esteroides o con regímenes de tratamiento más prolongados con temozolomida.
Para pacientes con glioblastoma recién diagnosticado, proporcione profilaxis de PCP para todos los pacientes durante la fase concomitante. Continúe la profilaxis de PCP en pacientes que experimenten linfopenia, hasta la resolución a Grado 1 o menos
[ver
Dosificación y Administración (2.1)].
Monitoree a todos los pacientes que reciben temozolomida para detectar el desarrollo de linfopenia y PCP.
5.4 Neoplasias Secundarias
La incidencia de neoplasias secundarias aumenta en pacientes tratados con regímenes que contienen temozolomida. Se han observado casos de síndrome mielodisplásico y neoplasias secundarias, incluida leucemia mieloide, después de la administración de temozolomida.
5.5 Toxicidad Embrio-Fetal
Según los hallazgos de estudios en animales y su mecanismo de acción, la temozolomida puede causar daño fetal cuando se administra a una mujer embarazada. Se han reportado resultados adversos del desarrollo tanto en pacientes embarazadas como en parejas embarazadas de pacientes masculinos. La administración oral de temozolomida a ratas y conejos durante el período de organogénesis resultó en embriolatalidad y polimorfaligismos en dosis menores a la dosis máxima humana basada en el área de superficie corporal.
Advierta a las mujeres embarazadas y a las mujeres con potencial reproductivo sobre el posible riesgo para el feto. Aconseje a las mujeres con potencial reproductivo que usen anticoncepción eficaz durante el tratamiento con temozolomida y durante 6 meses después de la última dosis. Debido al posible riesgo de efectos genotóxicos en el esperma, aconseje a los pacientes masculinos con parejas con potencial reproductivo que usen condones durante el tratamiento con temozolomida y durante 3 meses después de la última dosis. Aconseje a los pacientes masculinos que no donen semen durante el tratamiento con temozolomida y durante 3 meses después de la última dosis
[ver
Uso en Poblaciones Específicas (8.1,
8.3)].
5.6 Exposición a Cápsulas Abiertas
Aconseje a los pacientes que no abran, mastiquen o disuelvan el contenido de las cápsulas de temozolomida. Trague las cápsulas enteras con un vaso de agua. Si una cápsula se daña, evite el contacto del contenido en polvo con la piel o las membranas mucosas. En caso de contacto con el polvo, lave el área afectada con agua de inmediato [ver
Dosificación y Administración (2.4)]. Si es necesario abrir las cápsulas de temozolomida o disolver su contenido, esto debe ser realizado por un profesional capacitado en el manejo seguro de medicamentos peligrosos utilizando el equipo y los procedimientos de seguridad apropiados.
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas clínicamente significativas se describen en otras partes del etiquetado:
- Mielosupresión
[ver
Advertencias y precauciones (5.1)]
.
- Hepatotoxicidad
[ver
Advertencias y precauciones (5.2)]
.
- Neumonía por Pneumocystis
[ver
Advertencias y precauciones (5.3)]
.
- Neoplasias malignas secundarias
[ver
Advertencias y precauciones (5.4)]
.
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no pueden compararse directamente con las tasas en los ensayos clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica.
Glioblastoma recién diagnosticado
La seguridad de temozolomida se evaluó en el estudio MK-7365-051
[ver
.
Ocurrieron reacciones adversas graves o potencialmente mortales en el 49% de los pacientes tratados con temozolomida; las más comunes fueron fatiga (13%), convulsiones (6%), cefalea (5%) y trombocitopenia (5%).
Las reacciones adversas más frecuentes (≥20%) en los pacientes tratados con temozolomida fueron alopecia, fatiga, náuseas, anorexia, cefalea, estreñimiento y vómitos.
La Tabla 3 resume las reacciones adversas en MK-7365-051.
|
Reacciones adversas |
Fase de uso concomitante |
Fase de uso de mantenimiento |
||||
|
Radioterapia y temozolomida N=288* |
Sólo radioterapia N=285 |
Temozolomida N=224 |
||||
|
Todos los grados (%) |
Grado ≥3 (%) |
Todos los grados (%) |
Grado ≥3 (%) |
Todos los grados (%) |
Grado ≥3 (%) |
|
|
Piel y tejido subcutáneo |
||||||
|
Alopecia |
69 |
0 |
63 |
0 |
55 |
0 |
|
Erupción |
19 |
1 |
15 |
0 |
13 |
1 |
|
General |
||||||
|
Fatiga |
54 |
7 |
49 |
5 |
61 |
9 |
|
Anorexia |
19 |
1 |
9 |
<1 |
27 |
1 |
|
Dolor de cabeza |
19 |
2 |
17 |
4 |
23 |
4 |
|
Sistema Gastrointestinal |
||||||
|
Náuseas |
36 |
1 |
16 |
<1 |
49 |
1 |
|
Vómitos |
20 |
<1 |
6 |
<1 |
29 |
2 |
|
Estreñimiento |
18 |
1 |
6 |
0 |
22 |
0 |
|
Diarrea |
6 |
0 |
3 |
0 |
10 |
1 |
|
Sistema Nervioso Central y Periférico |
||||||
|
Convulsiones |
6 |
3 |
7 |
3 |
11 |
3 |
*Un paciente que fue asignado al azar al grupo de solo radioterapia recibió radioterapia y temozolomida.
NOS=no especificado de otra manera.
Nota: Las reacciones adversas de Grado 5 (fatales) se incluyen en la columna de Grado ≥3.
Reacciones adversas clínicamente relevantes en <10% de los pacientes se presentan a continuación:
Sistema Nervioso Central & Periférico: deterioro de la memoria, confusión
Ocular: visión borrosa
Sistema Gastrointestinal: estomatitis, dolor abdominal
General: debilidad, mareos Sistema Inmunológico: reacción alérgica
Lesiones: lesión por radiación no especificada de otra manera
Sistema Musculoesquelético: artralgia
Plaquetas, Hemorragia y Coagulación: trombocitopenia
Psiquiátrico: insomnio
Sistema Respiratorio: tos, disnea
Otros Sentidos Especiales: alteración del gusto
Piel y Tejido Subcutáneo: piel seca, prurito, eritema
Cuando se combinaron las anomalías de laboratorio y las reacciones adversas, se observaron anomalías de neutrófilos de Grado 3 o Grado 4, incluidas las reacciones neutropénicas, en el 8% de los pacientes, y anomalías plaquetarias de Grado 3 o Grado 4, incluidas las reacciones trombocitopénicas, en el 14% de los pacientes.
Astrocitoma Anaplásico de Nuevo Diagnóstico
La seguridad de temozolomida para el tratamiento adyuvante de adultos con astrocitoma anaplásico de nuevo diagnóstico se derivó de literatura publicada
[ver
. La seguridad de temozolomida para el tratamiento adyuvante de pacientes con astrocitoma anaplásico de nuevo diagnóstico fue consistente con el perfil de seguridad conocido de temozolomida.
Astrocitoma Anaplásico Refractario
La seguridad de temozolomida se evaluó en el estudio MK-7365-006
[ver
.
Las reacciones adversas más comunes (≥20%) fueron náuseas, vómitos, dolor de cabeza, fatiga, estreñimiento y convulsiones.
Las Tablas 4 y
5 resumen las reacciones adversas y las anomalías de laboratorio hematológicas en MK-7365-006.
|
Reacciones adversas |
Temozolomida N=158 |
|
|
Todas las reacciones (%) |
Grado 3 a 4 (%) |
|
|
Sistema gastrointestinal |
||
|
Náuseas |
53 |
10 |
|
Vómitos |
42 |
6 |
|
Estreñimiento |
33 |
1 |
|
Diarrea |
16 |
2 |
|
General |
||
|
Dolor de cabeza |
41 |
6 |
|
Fatiga |
34 |
4 |
|
Astenia |
13 |
6 |
|
Fiebre |
13 |
2 |
|
Sistema nervioso central y periférico |
||
|
Convulsiones |
23 |
5 |
|
Hemiparesia |
18 |
6 |
|
Mareos |
12 |
1 |
|
Coordinación anormal |
11 |
1 |
|
Amnesia |
10 |
4 |
|
Insomnio |
10 |
0 |
|
Cardiovascular |
||
|
Edema periférico |
11 |
1 |
|
Mecanismo de resistencia |
||
|
Infección viral |
11 |
0 |
Las reacciones adversas clínicamente relevantes en <10% de los pacientes se presentan a continuación:
Sistema nervioso central y periférico: parestesia, somnolencia, parálisis, incontinencia urinaria, ataxia, disfasia, convulsiones locales, marcha anormal, confusión
Endocrino: hipercorticismo suprarrenal
Sistema gastrointestinal: dolor abdominal, anorexia
General: dolor de espalda
Metabólico: aumento de peso
Sistema musculoesquelético: mialgia
Psiquiátrico: ansiedad, depresión
Trastornos reproductivos: dolor en las mamas femeninas
Sistema respiratorio: infección del tracto respiratorio superior, faringitis, sinusitis, tos
Piel y anejos: erupción cutánea, prurito
Sistema urinario: infección del tracto urinario, aumento de la frecuencia de micción
Visión: diplopía, visión anormal*
*Este término incluye visión borrosa; déficit visual; cambios de visión; y problemas de visión.
|
|
Temozolomida*,† |
|
Disminución de linfocitos |
55 |
|
Disminución de plaquetas |
19 |
|
Disminución de neutrófilos |
14 |
|
Disminución de leucocitos |
11 |
|
Disminución de hemoglobina |
4 |
* Cambio de Grado 0 a 2 al inicio a Grado 3 o 4 durante el tratamiento.
† Rango denominador = 142, 158
Toxicidades hematológicas para gliomas avanzados
En la experiencia de ensayos clínicos con 110 a 111 mujeres y 169 a 174 hombres (dependiendo de las mediciones), las mujeres experimentaron tasas más altas de neutropenia de Grado 4 (ANC < 0.5 x 10
9/L) y trombocitopenia (< 20 x 10
9/L) que los hombres en el primer ciclo de terapia (12% vs. 5% y 9% vs. 3%, respectivamente).
En toda la base de datos de seguridad para la cual existen datos hematológicos (N=932), el 7% (4/61) y el 10% (6/63) de los pacientes > 70 años experimentaron neutropenia o trombocitopenia de Grado 4 en el primer ciclo, respectivamente. Para pacientes ≤ 70 años, el 7% (62/871) y el 6% (48/879) experimentaron neutropenia o trombocitopenia de Grado 4 en el primer ciclo, respectivamente. También ocurrieron pancitopenia, leucopenia y anemia.
6.2 Experiencia posterior a la comercialización
Las siguientes reacciones adversas se han identificado durante el uso posterior a la aprobación de temozolomida. Debido a que estas reacciones son reportadas de forma voluntaria a partir de una población de tamaño incierto, no siempre es posible estimar confiablemente su frecuencia o establecer una relación causal con la exposición al medicamento.
Dermatológico: Necrólisis epidérmica tóxica y síndrome de Stevens-Johnson.
Sistema inmunológico: Reacciones de hipersensibilidad, incluida anafilaxia. Eritema multiforme, que se resolvió después de la interrupción de las cápsulas de temozolomida y, en algunos casos, reapareció tras la readministración.
Hematopoyético: Pancitopenia prolongada, que puede resultar en anemia aplásica y desenlaces fatales.
Hepatobiliar: Hepatotoxicidad fatal y grave, elevación de enzimas hepáticas, hiperbilirrubinemia, colestasis y hepatitis.
Infecciones: Infecciones oportunistas graves, incluidos algunos casos con desenlaces fatales con organismos bacterianos, virales (primarios y reactivados), fúngicos y protozoarios.
Pulmonar: Neumonitis intersticial, neumonitis, alveolitis y fibrosis pulmonar.
Endocrino: Diabetes insípida.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de riesgos
Basado en los hallazgos de estudios en animales y su mecanismo de acción
[véase
y los hallazgos de estudios en animales, la temozolomida puede causar daño fetal cuando se administra a una mujer embarazada. Los informes de post-comercialización disponibles describen casos de abortos espontáneos y malformaciones congénitas, incluyendo polimorformaciones con anomalías en el sistema nervioso central, facial, cardíaco, esquelético y genitourinario con exposición a temozolomida durante el embarazo. Estos casos informan resultados adversos del desarrollo similares a los observados en estudios en animales. La administración de temozolomida a ratas y conejas durante el período de organogénesis causó numerosas malformaciones externas, internas y esqueléticas en dosis menores que la dosis humana máxima basada en el área de superficie corporal (véanse los datos). Se debe advertir a las mujeres embarazadas sobre el riesgo potencial para el feto.
En la población general de EE.UU., el riesgo estimado de defectos congénitos mayores y aborto involuntario en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente.
Datos
Datos de animales
Cinco días consecutivos de administración oral de temozolomida en dosis de 75 y 150 mg/m
2(0,38 y 0,75 veces la dosis humana de 200 mg/m
2) en ratas y conejas, respectivamente, durante el período de organogénesis (días de gestación 8 a 12) causaron numerosas malformaciones de los órganos externos, internos y esqueléticos en ambas especies. En conejas, temozolomida a la dosis de 150 mg/m
2(0,75 veces la dosis humana de 200 mg/m
2) causó embrioletal, como lo indica el aumento de las reabsorciones.
8.2 Lactancia
No hay datos sobre la presencia de temozolomida o sus metabolitos en la leche materna, los efectos en el niño amamantado o los efectos en la producción de leche. Debido al potencial de reacciones adversas graves, incluyendo mielosupresión por temozolomida en los niños amamantados, se debe aconsejar a las mujeres que no amamanten durante el tratamiento con temozolomida y durante 1 semana después de la última dosis.
8.3 Mujeres y hombres con potencial reproductivo
La temozolomida puede causar daño fetal cuando se administra a una mujer embarazada
[véase
Uso en poblaciones específicas (8.1)].
Prueba de embarazo
Verifique el estado de embarazo en mujeres con potencial reproductivo antes de iniciar la temozolomida
[véase
Uso en poblaciones específicas (8.1)].
Anticoncepción
Mujeres
Se debe aconsejar a las mujeres con potencial reproductivo que utilicen métodos anticonceptivos efectivos durante el tratamiento con temozolomida y durante 6 meses después de la última dosis.
Hombres
Debido al potencial de toxicidad embrionaria y los efectos genotóxicos en las células espermáticas, se debe aconsejar a los pacientes masculinos con parejas embarazadas o parejas femeninas con potencial reproductivo que utilicen condones durante el tratamiento con temozolomida y durante 3 meses después de la última dosis
[véase
Uso en poblaciones específicas (8.1),
Toxicología no clínica (13.1)].
Se debe aconsejar a los pacientes masculinos que no donen semen durante el tratamiento con temozolomida y durante 3 meses después de la última dosis.
Infertilidad
La temozolomida puede afectar la fertilidad masculina
[véase
Toxicología no clínica (13.1)]
. Datos limitados de pacientes masculinos muestran cambios en los parámetros del semen durante el tratamiento con temozolomida; sin embargo, no hay información disponible sobre la duración o reversibilidad de estos cambios.
8.4 Uso pediátrico
La seguridad y eficacia de la temozolomida no se han establecido en pacientes pediátricos. La seguridad y eficacia de las cápsulas de temozolomida se evaluaron, pero no se establecieron, en 2 estudios abiertos en pacientes pediátricos de 3 a 18 años. En un estudio, se inscribieron 29 pacientes con glioma de tronco cerebral recurrente y 34 pacientes con astrocitoma de alto grado recurrente. En un segundo estudio realizado por el Grupo de Oncología Infantil (COG), se inscribieron 122 pacientes, incluidos pacientes con meduloblastoma/PNET (29), astrocitoma de alto grado (23), astrocitoma de bajo grado (22), glioma de tronco cerebral (16), ependimoma (14), otros tumores del SNC (9) y tumores no del SNC (9). El perfil de reacciones adversas en pacientes pediátricos fue similar al de los adultos.
8.5 Uso geriátrico
En el estudio MK-7365-051, el 15% de los pacientes con glioblastoma recién diagnosticado tenían 65 años o más. Este estudio no incluyó un número suficiente de pacientes de 65 años o más para determinar diferencias en la eficacia con respecto a los pacientes más jóvenes. No se observaron diferencias generales en seguridad entre pacientes ≥65 años y pacientes más jóvenes.
El ensayo CATNON no incluyó un número suficiente de pacientes de 65 años o más para determinar diferencias en seguridad o eficacia en comparación con pacientes más jóvenes.
En el estudio MK-7365-006, el 4% de los pacientes con astrocitoma anaplásico refractario tenían 70 años o más. Este estudio no incluyó un número suficiente de pacientes de 70 años o más para determinar diferencias en la eficacia con respecto a los pacientes más jóvenes. Los pacientes de 70 años o más tuvieron una mayor incidencia de neutropenia de Grado 4 (25%) y trombocitopenia de Grado 4 (20%) en el primer ciclo de terapia que los pacientes menores de 70 años
[véase
Advertencias y precauciones (5.1),
En toda la base de datos de seguridad para la cual existen datos hematológicos (N=932), el 7% (4/61) y el 10% (6/63) de los pacientes mayores de 70 años presentaron neutropenia o trombocitopenia de Grado 4 en el primer ciclo, respectivamente. Para los pacientes ≤70 años, el 7% (62/871) y el 6% (48/879) presentaron neutropenia o trombocitopenia de Grado 4 en el primer ciclo, respectivamente. También se produjeron pancitopenia, leucopenia y anemia.
8.6 Insuficiencia renal
No se recomienda un ajuste de dosis para pacientes con una depuración de creatinina (CLcr) de 36 a 130 mL/min/m
2[véase
La dosis recomendada de cápsulas de temozolomida no se ha establecido para pacientes con insuficiencia renal grave (CLcr < 36 mL/min/m
2) o para pacientes con enfermedad renal en etapa terminal en diálisis.
8.7 Insuficiencia hepática
No se recomienda un ajuste de dosis para pacientes con insuficiencia hepática leve a moderada (Clase Child Pugh A y B)
[véase
La dosis recomendada de temozolomida no se ha establecido para pacientes con insuficiencia hepática grave (Clase Child-Pugh C).
10 SOBREDOSIS
La toxicidad limitante de la dosis fue la mielosupresión y se reportó con cualquier dosis, pero se espera que sea más severa con dosis más altas. Un paciente tomó una sobredosis de 2000 mg por día durante 5 días y las reacciones adversas reportadas fueron pancitopenia, pirexia, falla multiorgánica y muerte. Hay informes de pacientes que han tomado más de 5 días de tratamiento (hasta 64 días), con reacciones adversas reportadas que incluyen mielosupresión, que en algunos casos fue severa y prolongada, e infecciones que resultaron en muerte. En caso de sobredosis, monitorear el recuento sanguíneo completo y proporcionar medidas de apoyo según sea necesario.
11 DESCRIPCIÓN
Temozolomida es un fármaco alquilante. El nombre químico de la temozolomida es 3,4-dihidro-3-metil-4-oxoimidazo[5,1d]-
as-tetrazina-8-carboxamida. La fórmula estructural de la temozolomida es:
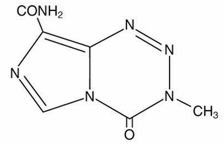
El material es un polvo de color blanco a ligeramente tostado o ligeramente rosa con una fórmula molecular de C
6H
6N
6O
2 y un peso molecular de 194,15. La molécula es estable a pH ácido (<5) y lábil a pH >7; por lo tanto, la temozolomida puede administrarse por vía oral. El profármaco, temozolomida, se hidroliza rápidamente al 5-(3-metiltriazen-1-il) imidazol-4-carboxamida (MTIC) activo a valores de pH neutro y alcalino, teniendo lugar la hidrólisis aún más rápido a pH alcalino.
Cápsulas de temozolomida, USP
Cápsulas de temozolomida, USP para uso oral que contienen 5 mg, 20 mg, 100 mg, 140 mg, 180 mg o 250 mg de temozolomida.
Los ingredientes inactivos son los siguientes:
Cápsulas de temozolomida de 5 mg: lactosa anhidra (168 mg), sílice coloidal anhidra (1 mg), glicolato sódico de almidón (16 mg), ácido tartárico (7 mg) y ácido esteárico (3 mg).
Cápsulas de temozolomida de 20 mg: lactosa anhidra (14,6 mg), sílice coloidal anhidra (0,2 mg), glicolato sódico de almidón (3,2 mg), ácido tartárico (1,4 mg) y ácido esteárico (0,6 mg).
Cápsulas de temozolomida de 100 mg: lactosa anhidra (73 mg), sílice coloidal anhidra (1 mg), glicolato sódico de almidón (16 mg), ácido tartárico (7 mg) y ácido esteárico (3 mg).
Cápsulas de temozolomida de 140 mg: lactosa anhidra (102,2 mg), sílice coloidal anhidra (1,4 mg), glicolato sódico de almidón (22,4 mg), ácido tartárico (9,8 mg) y ácido esteárico (4,2 mg).
Cápsulas de temozolomida de 180 mg: lactosa anhidra (131,4 mg), sílice coloidal anhidra (1,8 mg), glicolato sódico de almidón (28,8 mg), ácido tartárico (12,6 mg) y ácido esteárico (5,4 mg).
Cápsulas de temozolomida de 250 mg: lactosa anhidra (182,5 mg), sílice coloidal anhidra (2,5 mg), glicolato sódico de almidón (40 mg), ácido tartárico (17,5 mg) y ácido esteárico (7,5 mg).
El cuerpo de las cápsulas está hecho de gelatina y es de color blanco. El cuerpo de la cápsula de 250 mg contiene además lauril sulfato de sodio. La tapa también está hecha de gelatina y los colores varían según la concentración de dosis. El cuerpo y la tapa de la cápsula están impresos con tinta de marca farmacéutica, que contiene óxido de hierro negro, hidróxido de potasio y goma laca.
Cápsulas de temozolomida de 5 mg: La tapa verde contiene gelatina, dióxido de titanio, óxido de hierro amarillo y FD&C Azul 2.
Cápsulas de temozolomida de 20 mg: La tapa amarilla contiene gelatina, dióxido de titanio y óxido de hierro amarillo.
Cápsulas de temozolomida de 100 mg: La tapa rosa contiene gelatina, dióxido de titanio y óxido de hierro rojo.
Cápsulas de temozolomida de 140 mg: La tapa azul transparente contiene gelatina y FD&C Azul 2.
Cápsulas de temozolomida de 180 mg: La tapa granate contiene gelatina, óxido de hierro rojo, óxido de hierro amarillo y dióxido de titanio.
Cápsulas de temozolomida de 250 mg: La tapa blanca contiene gelatina, dióxido de titanio y lauril sulfato de sodio.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
La temozolomida no es directamente activa sino que sufre una conversión no enzimática rápida a pH fisiológico al compuesto reactivo 5-(3-metiltriazen-1-il)-imidazol-4-carboxamida (MTIC). Se cree que la citotoxicidad de MTIC se debe principalmente a la alquilación del ADN, principalmente en las posiciones O
6 y N
7 de la guanina, lo que causa roturas de la doble cadena de ADN y resulta en muerte celular programada.
12.2 Farmacodinámica
Se desconocen las relaciones exposición-respuesta de la temozolomida y el curso temporal de la respuesta farmacodinámica.
12.3 Farmacocinética
Después de una dosis oral única de 150 mg/m
2, la C
max media es 7,5 mcg/ml para temozolomida y 282 ng/ml para MTIC. El AUC media es 23,4 mcg·h/ml para temozolomida y 864 ng·h/ml para MTIC.
Después de una infusión intravenosa única de 90 minutos de 150 mg/m
2, la C
max media es 7,3 mcg/ml para temozolomida y 276 ng/ml para MTIC. El AUC media es 24,6 mcg·h/ml para temozolomida y 891 ng·h/ml para MTIC.
La temozolomida exhibe cinética lineal en el rango de dosificación terapéutica de 75 mg/m
2/día a 250 mg/m
2/día.
Absorción
La T
max mediana es 1 hora.
Efecto de los alimentos
La C
max y el AUC medios de temozolomida disminuyeron un 32% y un 9%, respectivamente, y la T
max mediana aumentó 2 veces (de 1 a 2,25 horas) cuando las cápsulas de temozolomida se administraron después de un desayuno alto en grasas modificado (587 calorías compuesto por 1 huevo frito, 2 tiras de tocino, 2 rebanadas de pan tostado, 2 porciones de mantequilla y 8 oz de leche entera).
Distribución
La temozolomida tiene un volumen de distribución aparente medio (CV%) de 0,4 L/kg (13%). El porcentaje medio de unión de la radioactividad total relacionada con el fármaco es del 15%.
Eliminación
El aclaramiento de temozolomida es aproximadamente 5,5 L/h/m
2 y la semivida de eliminación media es 1,8 horas.
Metabolismo
La temozolomida se hidroliza espontáneamente a pH fisiológico a la especie activa, MTIC y al metabolito ácido de temozolomida. El MTIC se hidroliza aún más a 5-amino-imidazol-4-carboxamida (AIC), que se sabe que es un intermedio en la biosíntesis de purinas y ácidos nucleicos, y a metilhidrazina, que se cree que es la especie alquilante activa. Las enzimas del citocromo P450 juegan un papel menor en el metabolismo de la temozolomida y el MTIC. En relación con el AUC de temozolomida, la exposición a MTIC y AIC es del 2,4% y el 23%, respectivamente.
Excreción
Aproximadamente el 38% de la dosis total de radioactividad administrada de temozolomida se recupera en 7 días: 38% en orina y 0,8% en heces. La mayor parte de la radioactividad recuperada en la orina es temozolomida sin cambios (6%), AIC (12%), metabolito ácido de temozolomida (2,3%), y metabolito(s) polar(es) no identificado(s) (17%).
Poblaciones específicas
No se observaron diferencias clínicamente significativas en la farmacocinética de la temozolomida en función de la edad (rango: 19 a 78 años), sexo, hábito de fumar (fumador vs. no fumador), aclaramiento de creatinina (CLcr) de 36 a 130 mL/min/m
2, o deterioro hepático leve a moderado (Child Pugh clase A y B). La farmacocinética de la temozolomida no se ha estudiado en pacientes con CLcr < 36 mL/min/m
2, enfermedad renal terminal en diálisis o deterioro hepático grave (Child Pugh clase C).
Estudios de interacción farmacológica
Estudios clínicos y enfoques basados en modelos
No se observaron diferencias clínicamente significativas en la farmacocinética de la temozolomida o el MTIC cuando se administraron junto con ranitidina.
No se predijeron diferencias clínicamente significativas en el aclaramiento de temozolomida o MTIC cuando se administraron junto con los siguientes medicamentos: ácido valproico, dexametasona, proclorperazina, fenitoína, carbamazepina, ondansetrón, antagonistas de los receptores H2 de la histamina o fenobarbital.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Temozolomida es carcinogénica en ratas a dosis inferiores a la dosis máxima recomendada en humanos. Temozolomida indujo carcinomas mamarios tanto en machos como en hembras a dosis de 0.13 a 0.63 veces la dosis humana máxima (25 a 125 mg/m
2) cuando se administró por vía oral durante 5 días consecutivos cada 28 días durante 6 ciclos. Temozolomida también indujo fibrosarcomas del corazón, ojo, vesículas seminales, glándulas salivales, cavidad abdominal, útero y próstata, carcinomas de las vesículas seminales, schwannomas del corazón, nervio óptico y glándula hardiana, y adenomas de la piel, pulmón, pituitaria y tiroides a dosis de 0.5 veces la dosis diaria máxima. También se indujeron tumores mamarios después de 3 ciclos de temozolomida a la dosis diaria máxima recomendada.
Temozolomida es un mutágeno y un clastógeno. En un ensayo de mutagenicidad bacteriana inversa (ensayo de Ames), temozolomida aumentó la frecuencia de revertantes en ausencia y presencia de activación metabólica. Temozolomida fue clastogénica en linfocitos humanos en presencia y ausencia de activación metabólica.
Temozolomida deteriora la fertilidad masculina. Temozolomida causó células sincitiales/formación de esperma inmaduro a dosis de 50 y 125 mg/m
2(0.25 y 0.63 veces la dosis humana de 200 mg/m
2) en ratas y perros, respectivamente, y atrofia testicular en perros a 125 mg/m
2.
13.2 Toxicología y/o Farmacología Animal
Los estudios de toxicología en ratas y perros identificaron una baja incidencia de hemorragia, degeneración y necrosis de la retina a dosis de temozolomida iguales o superiores a 125 mg/m
2(0.63 veces la dosis humana de 200 mg/m
2). Estos cambios se observaron con mayor frecuencia a dosis donde se observó mortalidad.
14 ESTUDIOS CLÍNICOS
14.1 Glioblastoma recién diagnosticado
La eficacia de temozolomida se evaluó en MK-7365-051 (NCT00006353), un ensayo aleatorizado (1:1), multicéntrico, abierto. Los pacientes elegibles debían tener glioblastoma recién diagnosticado. Los pacientes fueron aleatorizados para recibir radioterapia sola o temozolomida concomitante 75 mg/m
2una vez al día comenzando el primer día de radioterapia y continuando hasta el último día de radioterapia por 42 días (con un máximo de 49 días), seguido de temozolomida 150 mg/m
2o 200 mg/m
2una vez al día los Días 1 a 5 de cada ciclo de 28 días, comenzando 4 semanas después del final de la radioterapia y continuando por 6 ciclos. En ambos brazos, se administró radioterapia focal de 60 Gy/30 fracciones e incluyó radiación al lecho tumoral o sitio de resección con un margen de 2 a 3 cm. Se requirió profilaxis PCP durante la fase concomitante, independientemente del recuento de linfocitos y continuó hasta la recuperación del recuento de linfocitos a Grado 1 o menor. La principal medida de resultado de eficacia fue la supervivencia general.
Un total de 573 pacientes fueron aleatorizados, 287 a temozolomida y radioterapia y 286 a radioterapia sola. En el momento de la progresión de la enfermedad, se administró temozolomida como terapia de rescate en 161 pacientes de los 282 (57%) en el brazo de radioterapia sola y 62 pacientes de los 277 (22%) en el brazo de temozolomida y radioterapia.
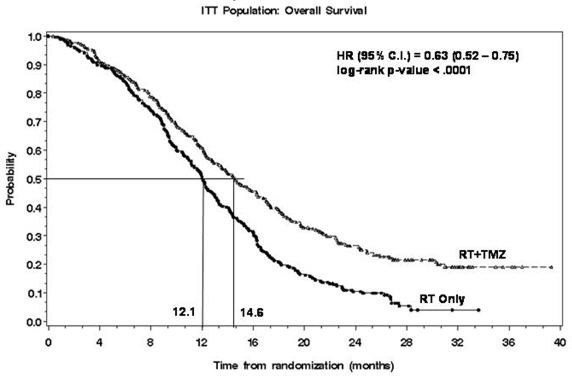
La adición de temozolomida concomitante y de mantenimiento a la radioterapia para el tratamiento de pacientes con glioblastoma recién diagnosticado mostró una mejora estadísticamente significativa en la supervivencia general en comparación con la radioterapia sola
(Figura 1). La razón de riesgo (HR) para la supervivencia general fue 0.63 (IC 95%: 0.52, 0.75) con un valor de P de log-rank <0.0001 a favor del brazo de temozolomida. La mediana de supervivencia general fue de 14.6 meses en el brazo de temozolomida y 12.1 meses para el brazo de radioterapia sola.
FIGURA 1: Curvas de Kaplan-Meier para la Supervivencia General (Población ITT) en Pacientes con Glioblastoma Recién Diagnosticado en MK-7365-051
14.2 Astrocitoma Anaplásico
Astrocitoma Anaplásico Recién Diagnosticado
La eficacia de temozolomida para el tratamiento adyuvante de astrocitoma anaplásico recién diagnosticado se derivó de estudios de temozolomida en la literatura publicada. Temozolomida se evaluó en CATNON (NCT00626990), un ensayo multicéntrico, abierto y aleatorizado, donde la principal medida de resultado de eficacia fue la supervivencia general.
Astrocitoma Anaplásico Refractario
La eficacia de temozolomida se evaluó en el Estudio MK-7365-006, un ensayo multicéntrico de un solo brazo. Los pacientes elegibles tenían astrocitoma anaplásico en la primera recaída y un estado funcional de Karnofsky (KPS) basal de 70 o superior. Los pacientes habían recibido previamente radioterapia y también podían haber recibido una nitrosourea con o sin otra quimioterapia. Cincuenta y cuatro pacientes tenían progresión de la enfermedad con terapia previa con una nitrosourea y procarbazina y su malignidad se consideró refractaria a la quimioterapia (población de astrocitoma anaplásico refractario). Las cápsulas de temozolomida se administraron los Días 1 a 5 de cada ciclo de 28 días a una dosis inicial de 150 mg/m
2/día. Si el ANC era ≥1.5 x 10
9/L y el recuento de plaquetas era ≥100 x 10
9/L en el nadir y el Día 1 del siguiente ciclo, la dosis de temozolomida se aumentó a 200 mg/m
2/día. La principal medida de resultado de eficacia fue la supervivencia libre de progresión a los 6 meses y las medidas adicionales de resultado de eficacia fueron la supervivencia general y la tasa de respuesta general.
En la población de astrocitoma anaplásico refractario (n=54), la mediana de edad fue 42 años (rango: 19 a 76); 65% eran hombres; y 72% tenía un KPS >80. El 63% de los pacientes se sometieron a cirugía distinta de una biopsia en el momento del diagnóstico inicial. De los pacientes sometidos a resección, el 73% se sometió a una resección subtotal y el 27% a una resección total. El 18% de los pacientes se sometieron a cirugía en el momento de la primera recaída. El tiempo medio desde el diagnóstico inicial hasta la primera recaída fue de 13.8 meses (rango: 4.2 meses a 6.3 años).
En la población de astrocitoma anaplásico refractario, la tasa de respuesta general (RC+RP) fue 22% (12 de 54 pacientes) y la tasa de respuesta completa fue 9% (5 de 54 pacientes). La mediana de duración de todas las respuestas fue 50 semanas (rango: 16 a 114 semanas) y la mediana de duración de las respuestas completas fue 64 semanas (rango: 52 a 114 semanas). En esta población, la supervivencia libre de progresión a los 6 meses fue 45% (IC 95%: 31%, 58%) y la supervivencia libre de progresión a los 12 meses fue 29% (IC 95%: 16%, 42%). La mediana de supervivencia libre de progresión fue 4.4 meses. La supervivencia general a los 6 meses fue 74% (IC 95%: 62%, 86%) y a los 12 meses fue 65% (IC 95%: 52%, 78%). La mediana de supervivencia general fue 15.9 meses.
15 REFERENCIAS
- “Medicamentos Peligrosos OSHA.” OSHA. http://www.osha.gov/hazardous-drugs
16 PRESENTACIÓN/ALMACENAMIENTO Y MANIPULACIÓN
Temozolomida es un medicamento peligroso. Siga los procedimientos especiales de manipulación y eliminación aplicables.
1
Cápsulas de temozolomida, USP
Las cápsulas de temozolomida, USP se suministran en frascos de vidrio ámbar con tapas de polipropileno a prueba de niños y envases de sobres resistentes a los niños que contienen las siguientes concentraciones de cápsulas:
Cápsulas de temozolomida 5 mg: tienen cuerpos blancos con tapas verdes. El cuerpo de la cápsula está impreso con ‘5’. La tapa está impresa con ‘TMZ’.
Se suministran de la siguiente manera:
Frascos de vidrio ámbar
5 count – NDC 16729-048-53
14 count – NDC 16729-048-54
Sobres (El envase contiene sobres individuales con una cápsula cada uno):
5 count – NDC 16729-048-31
14 count – NDC 16729-048-04
Cápsulas de temozolomida 20 mg: tienen cuerpos blancos con tapas amarillas. El cuerpo de la cápsula está impreso con ’20’. La tapa está impresa con ‘TMZ’.
Se suministran de la siguiente manera:
Frascos de vidrio ámbar
5 count – NDC 16729-049-53
14 count – NDC 16729-049-54
Sobres (El envase contiene sobres individuales con una cápsula cada uno):
5 count – NDC 16729-049-31
14 count – NDC 16729-049-04
Cápsulas de temozolomida 100 mg: tienen cuerpos blancos con tapas rosas. El cuerpo de la cápsula está impreso con ‘100’. La tapa está impresa con ‘TMZ’.
Se suministran de la siguiente manera:
Frascos de vidrio ámbar
5 count – NDC 16729-050-53
14 count – NDC 16729-050-54
Sobres (El envase contiene sobres individuales con una cápsula cada uno):
5 count – NDC 16729-050-31
14 count – NDC 16729-050-04
Cápsulas de temozolomida 140 mg: tienen cuerpos blancos con tapas azules transparentes. El cuerpo de la cápsula está impreso con ‘140’. La tapa está impresa con ‘TMZ’.
Se suministran de la siguiente manera:
Frascos de vidrio ámbar
5 count – NDC 16729-129-53
14 count – NDC 16729-129-54
Sobres (El envase contiene sobres individuales con una cápsula cada uno):
5 count – NDC 16729-129-31
14 count – NDC 16729-129-04
Cápsulas de temozolomida 180 mg: tienen cuerpos blancos con tapas granate. El cuerpo de la cápsula está impreso con ‘180’. La tapa está impresa con ‘TMZ’.
Se suministran de la siguiente manera:
Frascos de vidrio ámbar
5 count – NDC 16729-130-53
14 count – NDC 16729-130-54
Sobres (El envase contiene sobres individuales con una cápsula cada uno):
5 count – NDC 16729-130-31
14 count – NDC 16729-130-04
Cápsulas de temozolomida 250 mg: tienen cuerpos blancos con tapas blancas. El cuerpo de la cápsula está impreso con ‘250’. La tapa está impresa con ‘TMZ’.
Se suministran de la siguiente manera:
Frascos de vidrio ámbar
5 count – NDC 16729-051-53
Sobres (El envase contiene sobres individuales con una cápsula cada uno):
5 count – NDC 16729-051-31
Almacene las cápsulas de temozolomida, USP a 25°C (77°F) [ver Temperatura Ambiente Controlada USP]; se permiten excursiones de 15°C a 30°C (59°F a 86°F).
17 INFORMACIÓN PARA EL PACIENTE
Aconsejar al paciente que lea la información para el paciente aprobada por la FDA (Información para el paciente).
Mielosupresión
Informar a los pacientes que temozolomida puede causar bajo recuento de células sanguíneas y la necesidad de monitoreo frecuente de los recuentos de células sanguíneas. Aconsejar a los pacientes que se comuniquen con su proveedor de atención médica de inmediato si presentan sangrado, fiebre u otros signos de infección
[ver
Advertencias y precauciones (5.1)]
.
Hepatotoxicidad
Aconsejar a los pacientes sobre el mayor riesgo de hepatotoxicidad y que se comuniquen con su proveedor de atención médica de inmediato si presentan signos o síntomas de hepatotoxicidad. Informar a los pacientes que tendrán pruebas periódicas de enzimas hepáticas durante el tratamiento y después de la última dosis de temozolomida
[ver
Advertencias y precauciones (5.2)]
.
Neumonía por Pneumocystis
Aconsejar a los pacientes sobre el mayor riesgo de neumonía por Pneumocystis y que se comuniquen con su proveedor de atención médica de inmediato si presentan síntomas pulmonares nuevos o que empeoran. Informar a los pacientes que puede necesitarse profilaxis para la neumonía por Pneumocystis
[ver
Dosificación y administración (2.1),
Advertencias y precauciones (5.3)]
.
Neoplasias secundarias
Aconsejar a los pacientes sobre el mayor riesgo de síndrome mielodisplásico y neoplasias secundarias
[ver
Advertencias y precauciones (5.4)]
.
Exposición a cápsulas abiertas
Aconsejar al paciente que no abra, mastique o disuelva las cápsulas. Si las cápsulas se abren o dañan accidentalmente, aconsejar a los pacientes que tomen precauciones rigurosas con el contenido de las cápsulas para evitar la inhalación o el contacto con la piel o las membranas mucosas
[ver
Advertencias y precauciones (5.4)]
. En caso de contacto con el polvo, lavar el área afectada con agua inmediatamente
[ver
Dosificación y administración (2.4)]
.
Toxicidad embriofetal
Aconsejar a las mujeres embarazadas y a las mujeres con potencial reproductivo sobre el riesgo potencial para el feto. Aconsejar a las mujeres que informen a su proveedor de atención médica sobre un embarazo conocido o sospechado
[ver
Advertencias y precauciones (5.5),
Uso en poblaciones específicas (8.1)]
.
Aconsejar a las mujeres con potencial reproductivo que usen un método anticonceptivo eficaz durante el tratamiento con temozolomida y durante 6 meses después de la última dosis
[ver
Uso en poblaciones específicas (8.3)]
.
Aconsejar a los pacientes masculinos con parejas embarazadas o parejas femeninas con potencial reproductivo que usen preservativos durante el tratamiento con temozolomida y durante 3 meses después de la última dosis
[ver
Uso en poblaciones específicas (8.3),
Toxicología no clínica (13.1)]
.
Aconsejar a los pacientes masculinos que no donen semen durante el tratamiento con temozolomida y durante 3 meses después de la última dosis
[ver
Uso en poblaciones específicas (8.3),
Toxicología no clínica (13.1)]
.
Lactancia
Aconsejar a las mujeres que no amamanten durante el tratamiento con temozolomida y durante 1 semana después de la última dosis
[ver
Uso en poblaciones específicas (8.2)]
.
Infertilidad
Aconsejar a los hombres con potencial reproductivo que temozolomida puede afectar la fertilidad
[ver
Uso en poblaciones específicas (8.3),
Toxicología no clínica (13.1)]
.
Fabricado para:
Accord Healthcare, Inc.,
8041 Arco Corporate Drive,
Suite 200,
Raleigh, NC 27617,
EE.UU.
Fabricado por:
Intas Pharmaceuticals Limited,
Ahmedabad -380 054, India.
10 1475 5 6027033
Emitido diciembre de 2023
PROSPECTO PARA EL PACIENTE
| Esta Información para el paciente ha sido aprobada por la Administración de Alimentos y Medicamentos de los EE. UU. | Revisada: 12/2023 | |
| Información para el paciente | ||
| Cápsulas de Temozolomida
(TEM-oh-ZOE-loe-mide) |
||
|
¿Qué es la cápsula de temozolomida? La cápsula de temozolomida es un medicamento recetado utilizado para tratar a adultos con ciertos tumores cerebrales cancerosos. No se sabe si la cápsula de temozolomida es segura y eficaz en niños. |
||
|
No tome cápsulas de temozolomida si:
|
||
|
Antes de tomar o recibir cápsulas de temozolomida, informe a su proveedor de atención médica sobre todas sus condiciones médicas, incluyendo si:
Informe a su médico sobre todos los medicamentos que toma, incluyendo medicamentos recetados y no recetados, vitaminas y suplementos herbales. Conozca los medicamentos que toma. Haga una lista de ellos y muéstresela a su proveedor de atención médica y farmacéutico cuando obtenga un nuevo medicamento. |
||
|
¿Cómo debo tomar las cápsulas de temozolomida? Las cápsulas de temozolomida se pueden tomar por vía oral como cápsulas. Su proveedor de atención médica decidirá la mejor manera de tomar las cápsulas de temozolomida.
Existen 2 pautas de dosificación comunes para tomar o recibir cápsulas de temozolomida, dependiendo del tipo de tumor cerebral que tenga.
Cápsulas de temozolomida:
|
||
|
¿Cuáles son los posibles efectos secundarios de las cápsulas de temozolomida? Las cápsulas de temozolomida pueden causar efectos secundarios graves, incluyendo:
Los efectos secundarios comunes de las cápsulas de temozolomida incluyen: |
||
|
|
|
|
Las cápsulas de temozolomida pueden afectar la fertilidad en los hombres y pueden afectar su capacidad para tener hijos. Hable con su proveedor de atención médica si la fertilidad es una preocupación para usted. Estos no son todos los posibles efectos secundarios de las cápsulas de temozolomida. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede reportar efectos secundarios a la FDA al 1-800-FDA-1088. |
||
|
¿Cómo debo almacenar las cápsulas de temozolomida?
Mantenga las cápsulas de temozolomida y todos los medicamentos fuera del alcance de los niños. |
||
|
Información general sobre el uso seguro y eficaz de las cápsulas de temozolomida. A veces se recetan medicamentos para fines distintos a los enumerados en un folleto de Información para el paciente. No use las cápsulas de temozolomida para una afección para la que no fue recetada. No le dé cápsulas de temozolomida a otras personas, incluso si tienen los mismos síntomas que usted. Puede causarles daño. Puede solicitar a su farmacéutico o proveedor de atención médica información sobre las cápsulas de temozolomida que esté redactada para profesionales de la salud. |
||
|
¿Cuáles son los ingredientes de las cápsulas de temozolomida? Ingrediente activo: temozolomida. Ingredientes inactivos: lactosa anhidra, sílice coloidal anhidra, glicolato de almidón sódico, ácido tartárico, ácido esteárico. El cuerpo de las cápsulas está hecho de gelatina y es blanco. El cuerpo de la cápsula de 250 mg contiene además lauril sulfato de sodio. La tapa también está hecha de gelatina, y los colores varían según la concentración de la dosis. El cuerpo de la cápsula y la tapa están impresos con tinta de marca farmacéutica, que contiene óxido de hierro negro, hidróxido de potasio y goma laca. Cápsulas de Temozolomide 5 mg: La tapa verde contiene gelatina, dióxido de titanio, óxido de hierro amarillo y FD&C Azul 2. Cápsulas de Temozolomide 20 mg: La tapa amarilla contiene gelatina, óxido de hierro amarillo y dióxido de titanio. Cápsulas de Temozolomide 100 mg: La tapa rosada contiene gelatina, dióxido de titanio y óxido de hierro rojo. Cápsulas de Temozolomide 140 mg: La tapa azul transparente contiene gelatina y FD&C Azul 2. Cápsulas de Temozolomide 180 mg: La tapa burdeos contiene gelatina, óxido de hierro rojo, óxido de hierro amarillo y dióxido de titanio. Cápsulas de Temozolomide 250 mg: La tapa blanca contiene gelatina, dióxido de titanio y lauril sulfato de sodio. ®Las marcas enumeradas son marcas comerciales de sus respectivos propietarios.
Fabricado para:
Fabricado por: 10 1475 5 6027033
|
||
SECCIÓN SIN CLASIFICAR DEL SPL
Cápsulas de temozolomida
FARMACÉUTICO: Dispense el Prospecto para el paciente adjunto a cada paciente.
HOJA DE INFORMACIÓN PARA EL FARMACÉUTICO
|
INFORMACIÓN IMPORTANTE PARA LA DISPENSACIÓN Para cada paciente, dispense las cápsulas de temozolomida en un frasco separado o en su envase original, asegurándose de que cada envase indique la concentración por cápsula y de que los pacientes tomen el número apropiado de cápsulas de cada envase o frasco. |
¿Qué es la cápsula de temozolomida?[consulte Información de Prescripción Completa, Indicaciones y Uso (1)].
La temozolomida es un agente alquilante oral para el tratamiento del glioblastoma multiforme de nueva aparición y el astrocitoma anaplásico refractario.
¿Cómo se dosifica la cápsula de temozolomida?[consulte Información de Prescripción Completa, Dosificación Recomendada y Modificaciones de Dosis para Glioblastoma de Nueva Aparición (2.1), Dosificación Recomendada y Modificaciones de Dosis para Astrocitoma Anaplásico Refractario (2.2)].
El médico calcula la dosis diaria de cápsulas de temozolomida para un paciente determinado según el área de superficie corporal (BSA) del paciente. Redondee la dosis resultante al 5 mg más cercano. Un ejemplo de la dosificación puede ser el siguiente: la dosis diaria inicial de cápsulas de temozolomida en miligramos es el BSA multiplicado por mg/m2/día, (p. ej., un paciente con un BSA de 1,84 es 1,84 x 75 mg = 138, o 140 mg/día). Ajuste la dosis para los ciclos posteriores de acuerdo con el recuento de neutrófilos y plaquetas más bajo en el ciclo anterior y en el momento de iniciar el próximo ciclo.
¿Cómo podría modificarse la dosis de cápsulas de temozolomida para el astrocitoma anaplásico refractario?[consulte Información de Prescripción Completa, Dosificación Recomendada y Modificaciones de Dosis para Astrocitoma Anaplásico Refractario (2.2)].
La dosis inicial es 150 mg/m2 por vía oral una vez al día durante 5 días consecutivos por ciclo de tratamiento de 28 días. Aumente la dosis de cápsulas de temozolomida a 200 mg/m2/día durante 5 días consecutivos por ciclo de tratamiento de 28 días si tanto el recuento absoluto de neutrófilos nadir (ANC) como el recuento del día de dosificación (Día 29, Día 1 del próximo ciclo) son mayores o iguales a 1,5 x 109/L (1500/μL) y tanto el recuento de plaquetas nadir como el del Día 29, Día 1 del próximo ciclo son mayores o iguales a 100 x 109/L (100.000/μL). Durante el tratamiento, obtenga un hemograma completo el Día 22 (21 días después de la primera dosis) y semanalmente hasta que el ANC esté por encima de 1,5 x 109/L (1500/μL) y el recuento de plaquetas exceda 100 x 109/L (100.000/μL). No inicie el siguiente ciclo de temozolomida hasta que el ANC y el recuento de plaquetas excedan estos niveles. Si el ANC cae a menos de 1,0 x 109/L (1000/μL) o el recuento de plaquetas es menor de 50 x 109/L (50.000/μL) durante cualquier ciclo, reduzca la dosis para el siguiente ciclo en 50 mg/m2. Suspenda permanentemente las cápsulas de temozolomida en pacientes que no puedan tolerar una dosis de 100 mg/m2 por día.
Los pacientes deben continuar tomando las cápsulas de temozolomida hasta que su médico determine que su enfermedad ha progresado o hasta que se produzcan efectos secundarios o toxicidades inaceptables. En el ensayo clínico, el tratamiento podría continuar por un máximo de 2 años, pero no se conoce la duración óptima de la terapia. Los médicos pueden alterar el régimen de tratamiento para un paciente determinado.
Dosificación para pacientes con glioblastoma multiforme de nueva aparición[consulte Información de Prescripción Completa, Dosificación Recomendada y Modificaciones de Dosis para Glioblastoma de Nueva Aparición (2.1)].
Calendario de tratamiento de fase concomitante
Administre las cápsulas de temozolomida por vía oral a 75 mg/m2 diarios durante 42 días concomitantes con radioterapia focal (60 Gy administrados en 30 fracciones), seguido del mantenimiento con temozolomida por 6 ciclos. No se recomiendan reducciones de dosis; sin embargo, pueden producirse interrupciones de dosis según la tolerancia del paciente. Continúe la dosis de cápsulas de temozolomida durante el período concomitante de 42 días hasta 49 días si se cumplen todas las siguientes condiciones: recuento absoluto de neutrófilos mayor o igual a 1,5 x 109/L, recuento de plaquetas mayor o igual a 100 x 109/L y reacciones adversas no hematológicas menores o iguales al Grado 1 (excepto alopecia, náuseas y vómitos). Durante el tratamiento, obtenga un hemograma completo semanalmente. Interrumpa o suspenda la dosificación de temozolomida durante la fase concomitante de acuerdo con los criterios de toxicidad hematológica y no hematológica [consulte Tabla 1 en la Información de Prescripción Completa, Dosificación Recomendada y Modificaciones de Dosis para Glioblastoma de Nueva Aparición (2.1)]. Se requiere profilaxis de neumonía por Pneumocystis (PCP) durante la administración concomitante de cápsulas de temozolomida y radioterapia, y debe continuarse en pacientes que desarrollen linfocitopenia hasta la resolución al Grado 1 o menor.
Calendario de tratamiento de fase de mantenimiento
Cuatro semanas después de completar la fase de cápsulas de temozolomida y radioterapia, administre temozolomida por 6 ciclos adicionales de tratamiento de mantenimiento. La dosis en el Ciclo 1 (mantenimiento) es de 150 mg/m2 una vez al día durante 5 días, seguidos de 23 días sin tratamiento. Al iniciar el Ciclo 2, aumente la dosis a 200 mg/m2, si las reacciones adversas no hematológicas para el Ciclo 1 son de Grado menor o igual a 2 (excepto alopecia, náuseas y vómitos), el recuento absoluto de neutrófilos (ANC) es mayor o igual a 1,5 x 109/L, y el recuento de plaquetas es mayor o igual a 100 x 109/L. Si la dosis no se aumentó en el Ciclo 2, no aumente la dosis en ciclos posteriores. Mantenga la dosis de 200 mg/m2 por día durante los primeros 5 días de cada ciclo subsiguiente, excepto si se produce toxicidad.
Durante el tratamiento, obtenga un recuento sanguíneo completo el Día 22 (21 días después de la primera dosis) y semanalmente hasta que el RAN sea superior a 1.5 x 109/L (1500/μL) y el recuento de plaquetas exceda 100 x 109/L (100,000/μL). No inicie el próximo ciclo de cápsulas de temozolomida hasta que el RAN y el recuento de plaquetas excedan estos niveles. Base las reducciones de dosis durante el próximo ciclo en los recuentos sanguíneos más bajos y las peores reacciones adversas no hematológicas durante el ciclo previo. Aplique reducciones o interrupciones de dosis durante la fase de mantenimiento [ver Tabla 2 en la Información de Prescripción Completa, Dosificación Recomendada y Modificaciones de Dosificación para Glioblastoma Recién Diagnosticado (2.1)].
¿Cómo se toman las cápsulas de temozolomida?[Ver Información de Prescripción Completa, Preparación y Administración, cápsulas de temozolomida (2.3).]
Aconseje a los pacientes tomar la dosis diaria con un vaso lleno de agua, preferiblemente con el estómago vacío o antes de acostarse. Tomar el medicamento con el estómago vacío o antes de acostarse puede ayudar a aliviar las náuseas. Si los pacientes también están tomando antieméticos u otros medicamentos para aliviar los efectos secundarios asociados con las cápsulas de temozolomida, aconséjeles tomar estos medicamentos antes y/o después de la administración de las cápsulas de temozolomida. Aconseje a los pacientes que las cápsulas de temozolomida deben tragarse enteras y NUNCA MASTICARSE. Aconseje a los pacientes que NO DEBEN abrir o partir las cápsulas. Si las cápsulas se abren accidentalmente o se dañan, aconseje a los pacientes tomar precauciones rigurosas con el contenido de la cápsula para evitar la inhalación o el contacto con la piel o las membranas mucosas. En caso de contacto con el polvo, aconseje a los pacientes lavarse las manos. Aconseje a los pacientes mantener este medicamento fuera del alcance de los niños.
¿Qué debe evitar el paciente durante el tratamiento con cápsulas de temozolomida?[ver Información de Prescripción Completa, Uso en Poblaciones Específicas, Embarazo (8.1), Lactancia (8.2), Mujeres y Hombres con Potencial Reproductivo (8.3)]
No hay restricciones dietéticas para los pacientes que toman cápsulas de temozolomida. Las cápsulas de temozolomida pueden afectar la función testicular y causar defectos de nacimiento. Aconseje a los pacientes hombres tomar medidas adecuadas de control de la natalidad. Aconseje a las pacientes mujeres evitar quedar embarazadas mientras reciben este medicamento. Aconseje a las mujeres embarazadas sobre el riesgo potencial para el feto. Aconseje a las mujeres con potencial reproductivo usar anticonceptivos eficaces durante el tratamiento y durante al menos 6 meses después de la última dosis. Aconseje a los hombres con potencial reproductivo usar condones durante el tratamiento y durante al menos 3 meses después de la última dosis. Aconseje a los pacientes hombres no donar semen durante el tratamiento con cápsulas de temozolomida y durante al menos 3 meses después de la dosis final. No se sabe si la temozolomida se excreta en la leche materna. Debido al potencial de reacciones adversas graves en los niños lactantes, aconseje a las mujeres no amamantar mientras toman cápsulas de temozolomida y durante al menos 1 semana después de la última dosis.
¿Cuáles son los efectos secundarios de las cápsulas de temozolomida?[ver Información de Prescripción Completa, Reacciones Adversas (6).]
Alopecia, fatiga, náuseas y vómitos son los efectos secundarios más comunes asociados con las cápsulas de temozolomida. La mielosupresión no acumulativa es la toxicidad limitante de la dosis. Los pacientes deben ser evaluados periódicamente por su médico para monitorear los recuentos sanguíneos.
Otros efectos secundarios comúnmente reportados por pacientes que toman cápsulas de temozolomida son dolor de cabeza, estreñimiento, anorexia y convulsiones.
¿Cómo se suministran las cápsulas de temozolomida?[ver Información de Prescripción Completa, Presentación/Almacenamiento y Manejo (16).]
Las cápsulas de temozolomida están disponibles en concentraciones de 5 mg, 20 mg, 100 mg, 140 mg, 180 mg y 250 mg. Las cápsulas tienen un cuerpo de cápsula blanca con una tapa de color, y los colores varían según la concentración del medicamento.
| Concentración de la Cápsula de Temozolomida | Color |
| 5 mg | Tapa Verde |
| 20 mg | Tapa Amarilla |
| 100 mg | Tapa Rosa |
| 140 mg | Tapa Azul Transparente |
| 180 mg | Tapa Burdeos |
| 250 mg | Tapa Blanca |
Las concentraciones de cápsula de 5 mg, 20 mg, 100 mg, 140 mg y 180 mg están disponibles en paquetes de 5 y 14 cápsulas. La concentración de cápsula de 250 mg está disponible en paquete de 5 cápsulas.
¿Cómo se dispensan las cápsulas de temozolomida?
Dispense cada concentración de cápsulas de temozolomida en un frasco separado o en su paquete original (una concentración por un contenedor). Siga las instrucciones a continuación:
Según la dosis prescrita, determine la cantidad de cada concentración de cápsulas de temozolomida necesaria para el ciclo completo de 42 o 5 días según lo prescrito por el médico. Por ejemplo, en un ciclo de 5 días, 275 mg/día se dispensarían como cinco cápsulas de 250 mg, cinco cápsulas de 20 mg y cinco cápsulas de 5 mg. Etiquete cada contenedor con la cantidad apropiada de cápsulas a tomar cada día. Dispense al paciente, asegurándose de que cada contenedor indique la concentración (mg) por cápsula y que él o ella entienda tomar la cantidad apropiada de cápsulas de temozolomida de cada paquete o frasco para igualar la dosis diaria total prescrita por el médico.
¿Cómo se pueden solicitar las cápsulas de temozolomida?
Las cápsulas de temozolomida se pueden solicitar a su mayorista. Es importante comprender si las cápsulas de temozolomida se están utilizando como parte de un régimen de 42 días o como parte de un curso de 5 días. Recuerde solicitar suficientes cápsulas de temozolomida para el ciclo apropiado. Por ejemplo:
- un curso de 5 días de 360 mg/día requeriría que se ordenaran los siguientes: dos paquetes de 5 cápsulas de 180 mg.
- un curso de 42 días de 140 mg/día requeriría que se ordenaran los siguientes: tres paquetes de 14 cápsulas de 140 mg.
| Cápsulas de Temozolomida | Número NDC |
| Botellas de vidrio ámbar: | |
| Cápsulas de 5 mg (5 unidades) | 16729-048-53 |
| Cápsulas de 5 mg (14 unidades) | 16729-048-54 |
| Cápsulas de 20 mg (5 unidades) | 16729-049-53 |
| Cápsulas de 20 mg (14 unidades) | 16729-049-54 |
| Cápsulas de 100 mg (5 unidades) | 16729-050-53 |
| Cápsulas de 100 mg (14 unidades) | 16729-050-54 |
| Cápsulas de 140 mg (5 unidades) | 16729-129-53 |
| Cápsulas de 140 mg (14 unidades) | 16729-129-54 |
| Cápsulas de 180 mg (5 unidades) | 16729-130-53 |
| Cápsulas de 180 mg (14 unidades) | 16729-130-54 |
| Cápsulas de 250 mg (5 unidades) | 16729-051-53 |
| Paquetes de sobres (el cartón contiene sobres individuales con una cápsula cada uno): | |
| Cápsulas de 5 mg (5 unidades) | 16729-048-31 |
| Cápsulas de 5 mg (14 unidades) | 16729-048-04 |
| Cápsulas de 20 mg (5 unidades) | 16729-049-31 |
| Cápsulas de 20 mg (14 unidades) | 16729-049-04 |
| Cápsulas de 100 mg (5 unidades) | 16729-050-31 |
| Cápsulas de 100 mg (14 unidades) | 16729-050-04 |
| Cápsulas de 140 mg (5 unidades) | 16729-129-31 |
| Cápsulas de 140 mg (14 unidades) | 16729-129-04 |
| Cápsulas de 180 mg (5 unidades) | 16729-130-31 |
| Cápsulas de 180 mg (14 unidades) | 16729-130-04 |
| Cápsulas de 250 mg (5 unidades) | 16729-051-31 |
Referencias:
“OSHA Hazardous Drugs.”
OSHA.http://www.osha.gov/SLTC/hazardousdrugs/index.
Fabricado para:
Accord Healthcare, Inc.,
8041 Arco Corporate Drive,
Suite 200,
Raleigh, NC 27617,
USA.
Fabricado por:
Intas Pharmaceuticals Limited,
Ahmedabad -380 054, India.
10 1475 5 6027033
Emitido en diciembre de 2023
PANEL DE EXHIBICIÓN PRINCIPAL
PANEL DE EXHIBICIÓN PRINCIPAL
Panel de Exhibición Principal – Cápsulas de 5 mg
Frasco de Vidrio Ámbar Cartón
Panel de Exhibición Principal – Cápsulas de 20 mg
Frasco de Vidrio Ámbar Cartón
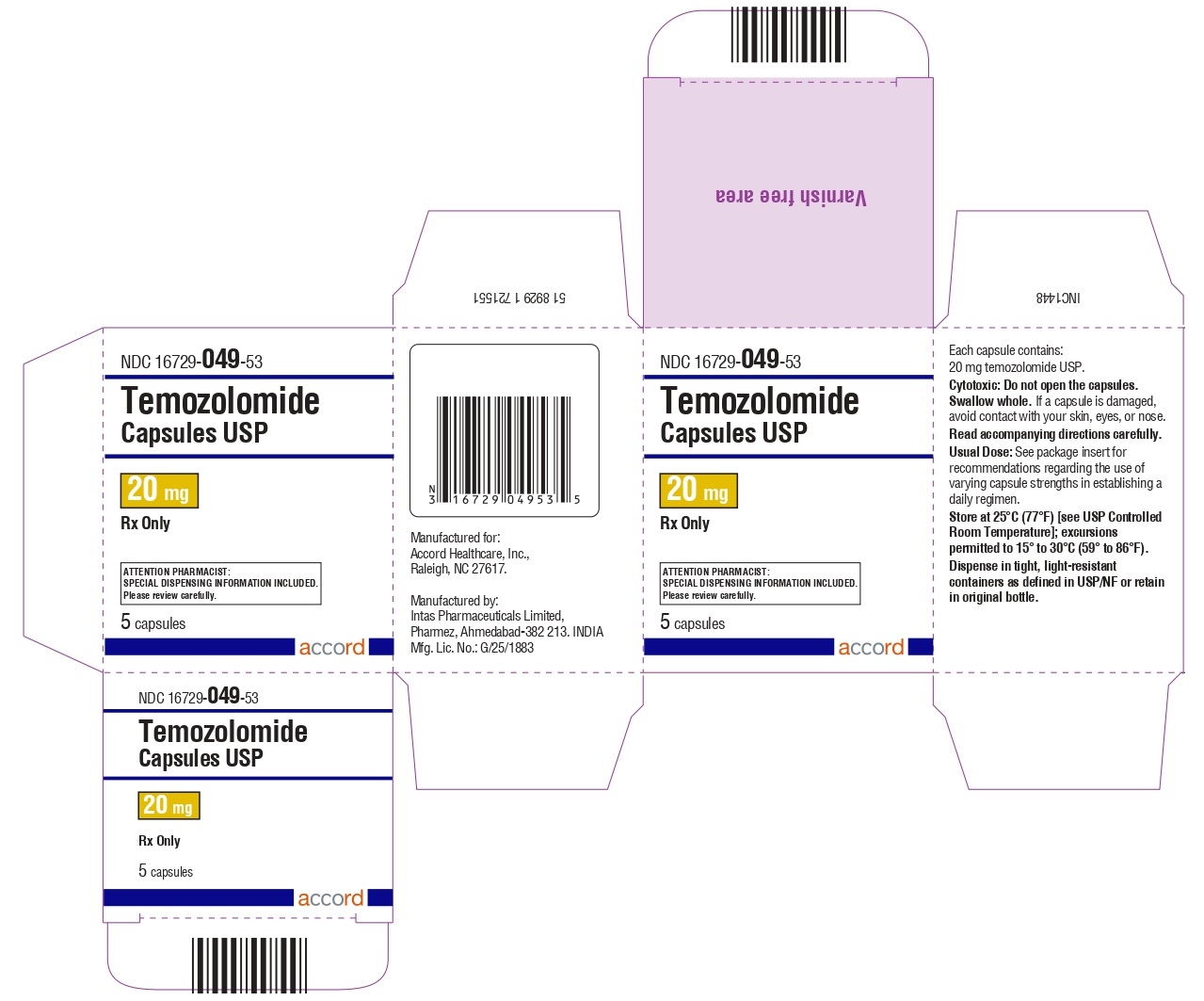
Panel de Exhibición Principal – Cápsulas de 100 mg
Frasco de Vidrio Ámbar Cartón
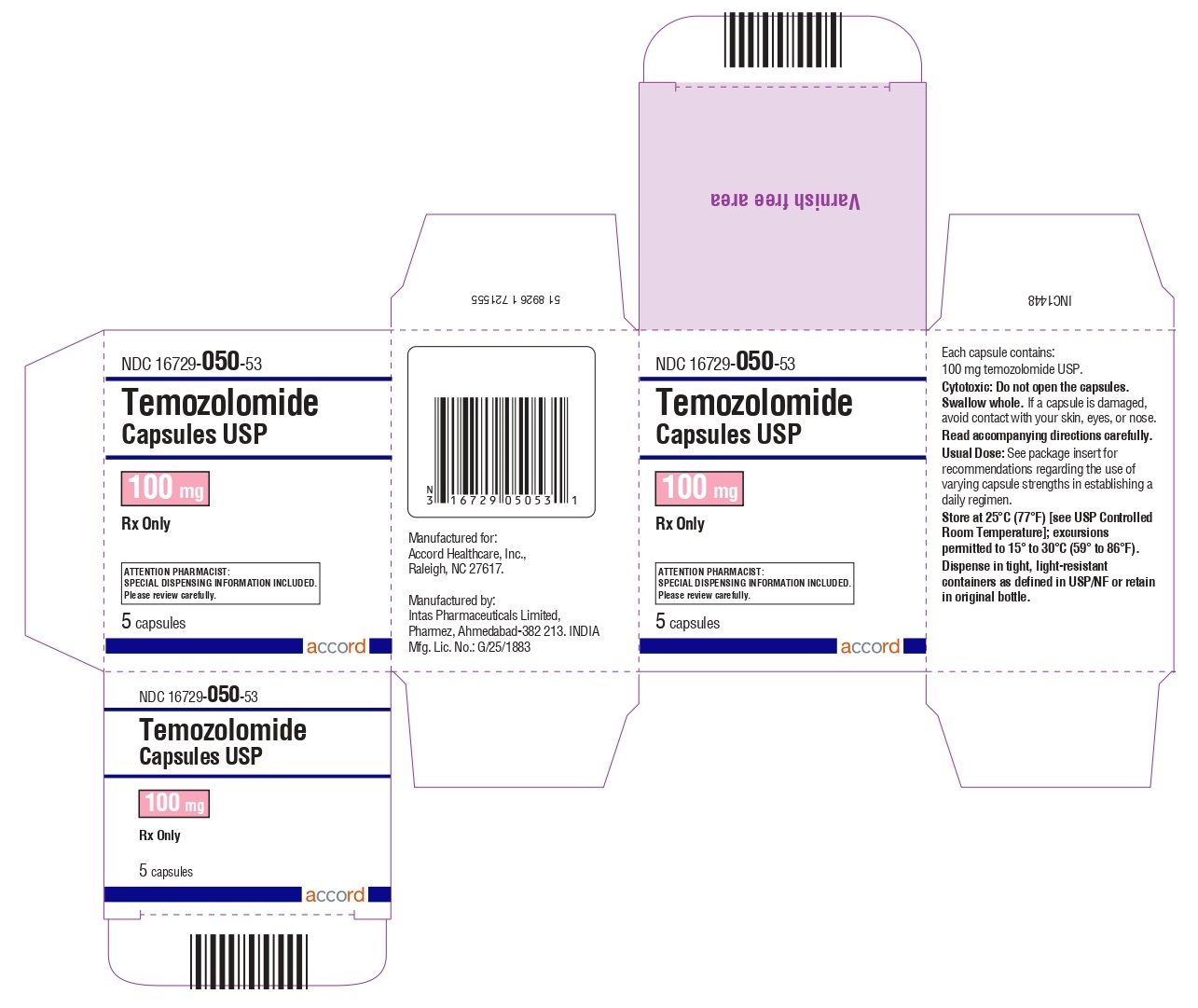
Panel de Exhibición Principal – Cápsulas de 140 mg
Frasco de Vidrio Ámbar Cartón
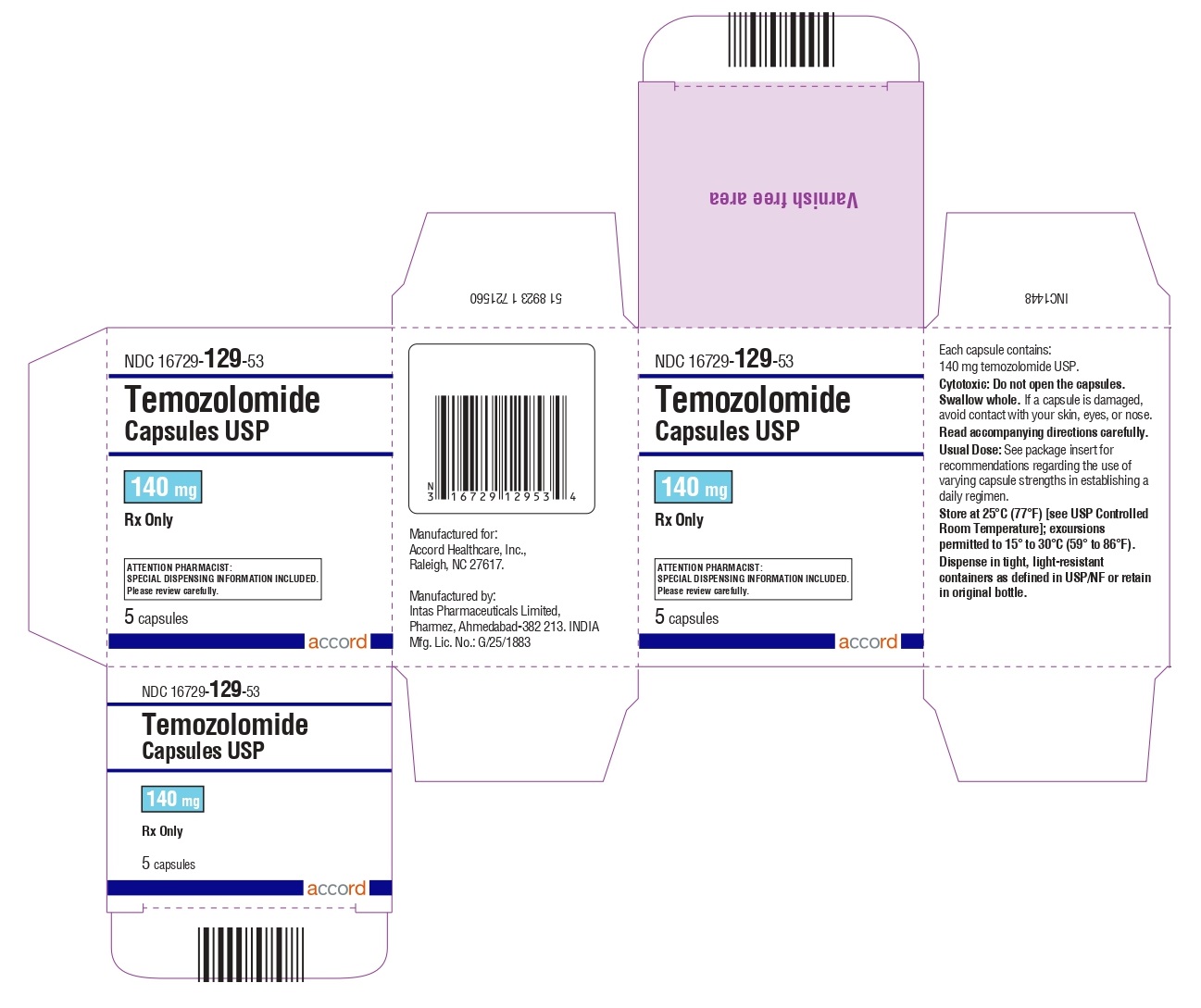
Panel de Exhibición Principal – Cápsulas de 180 mg
Frasco de Vidrio Ámbar Cartón

Panel de Exhibición Principal – Cápsulas de 250 mg
Frasco de Vidrio Ámbar Cartón
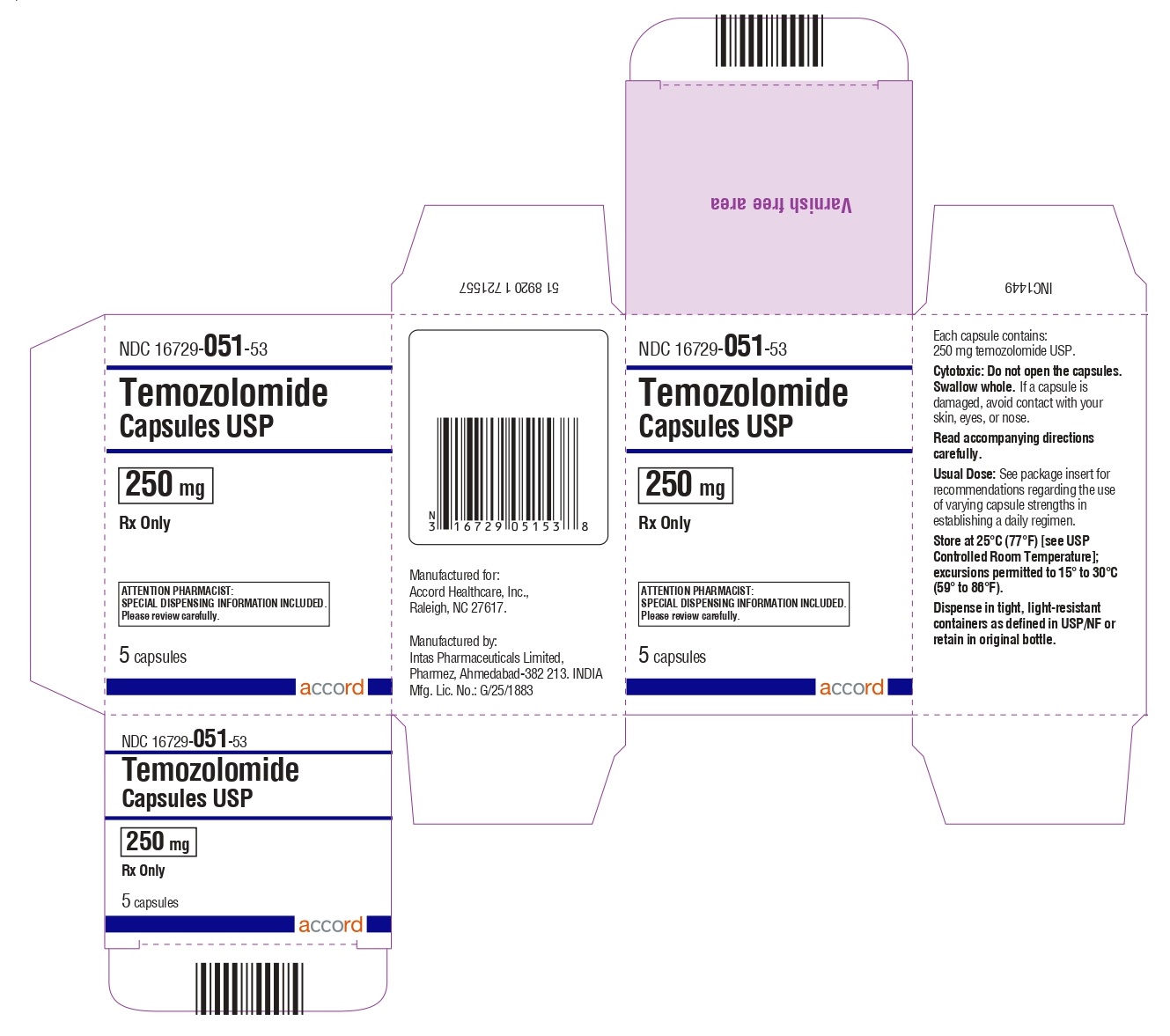
Panel de Exhibición Principal – Cápsulas de 5 mg
Caja de Envases Cartón
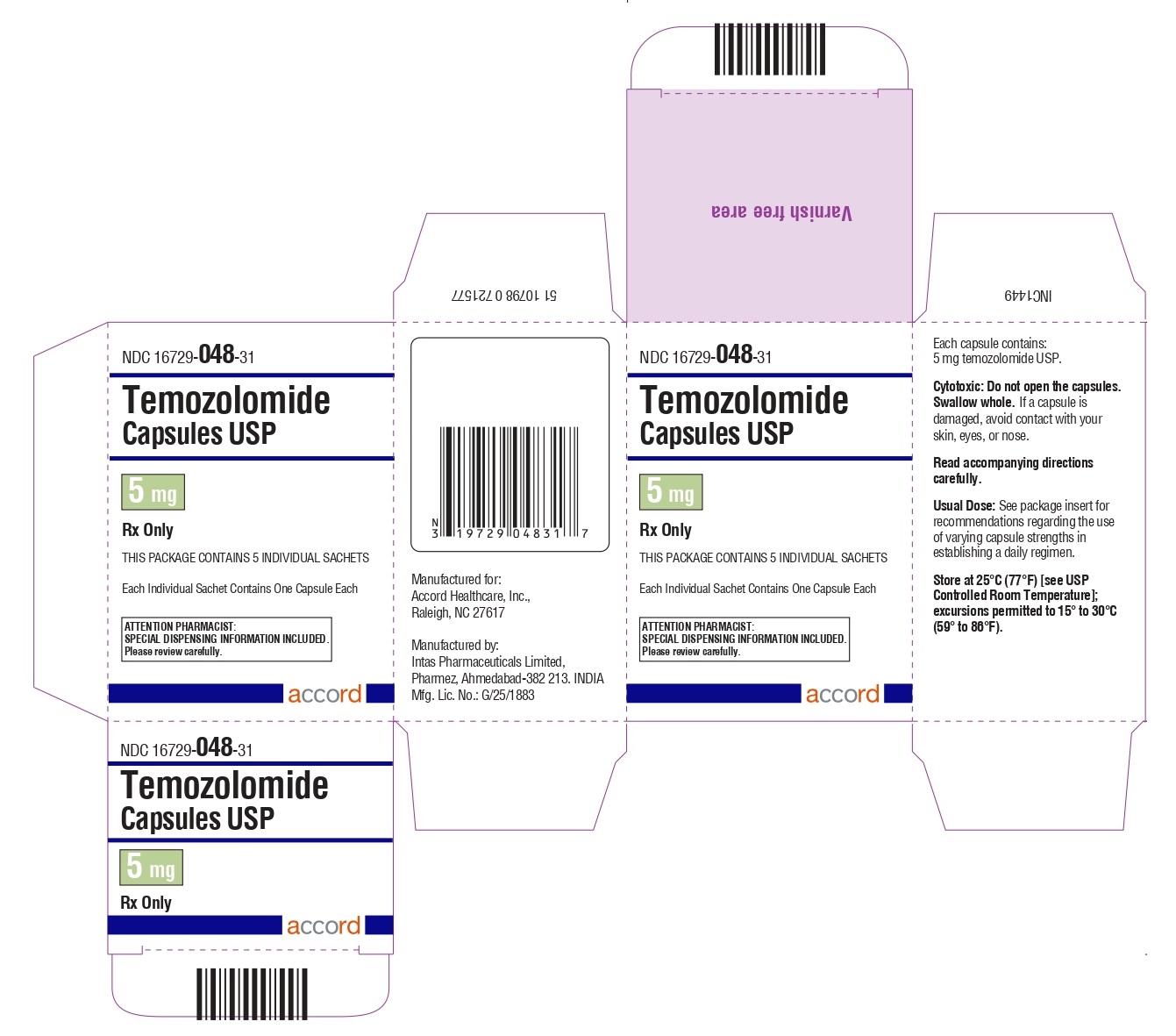
Panel de Exhibición Principal – Cápsulas de 20 mg
Caja de Envases Cartón
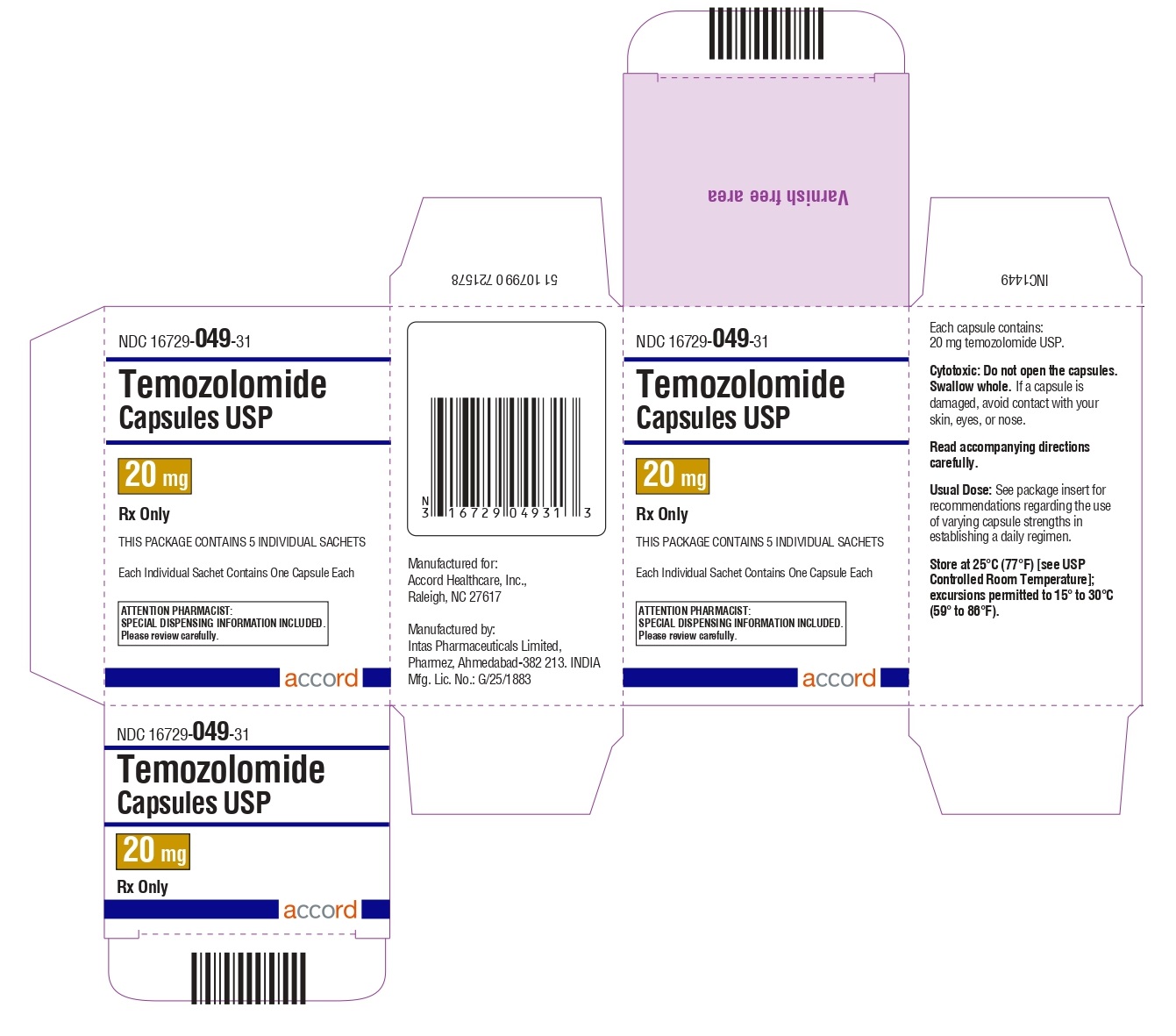
Panel de Exhibición Principal – Cápsulas de 100 mg
Caja de Envases Cartón
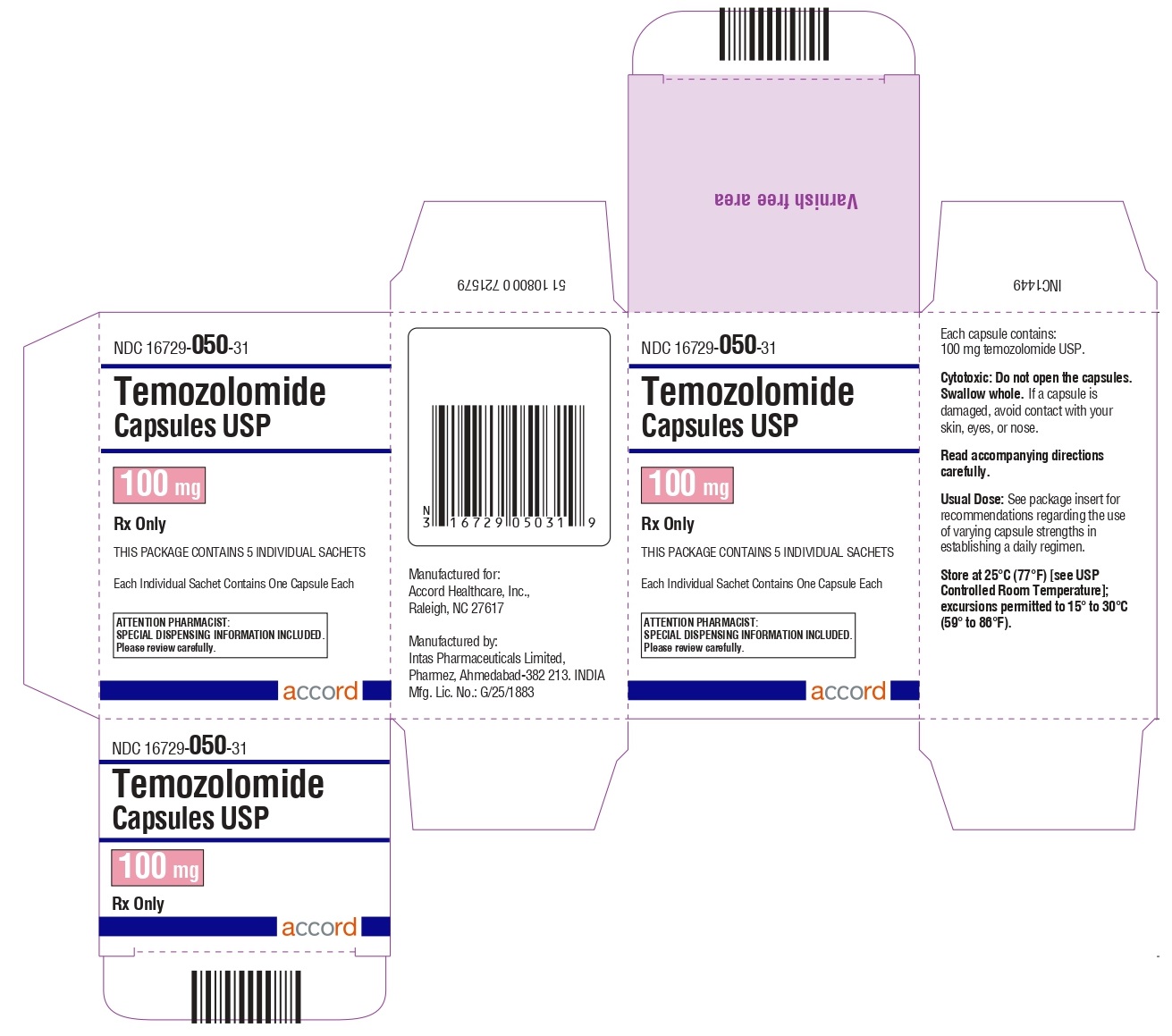
Panel de Exhibición Principal – Cápsulas de 140 mg
Caja de Envases Cartón
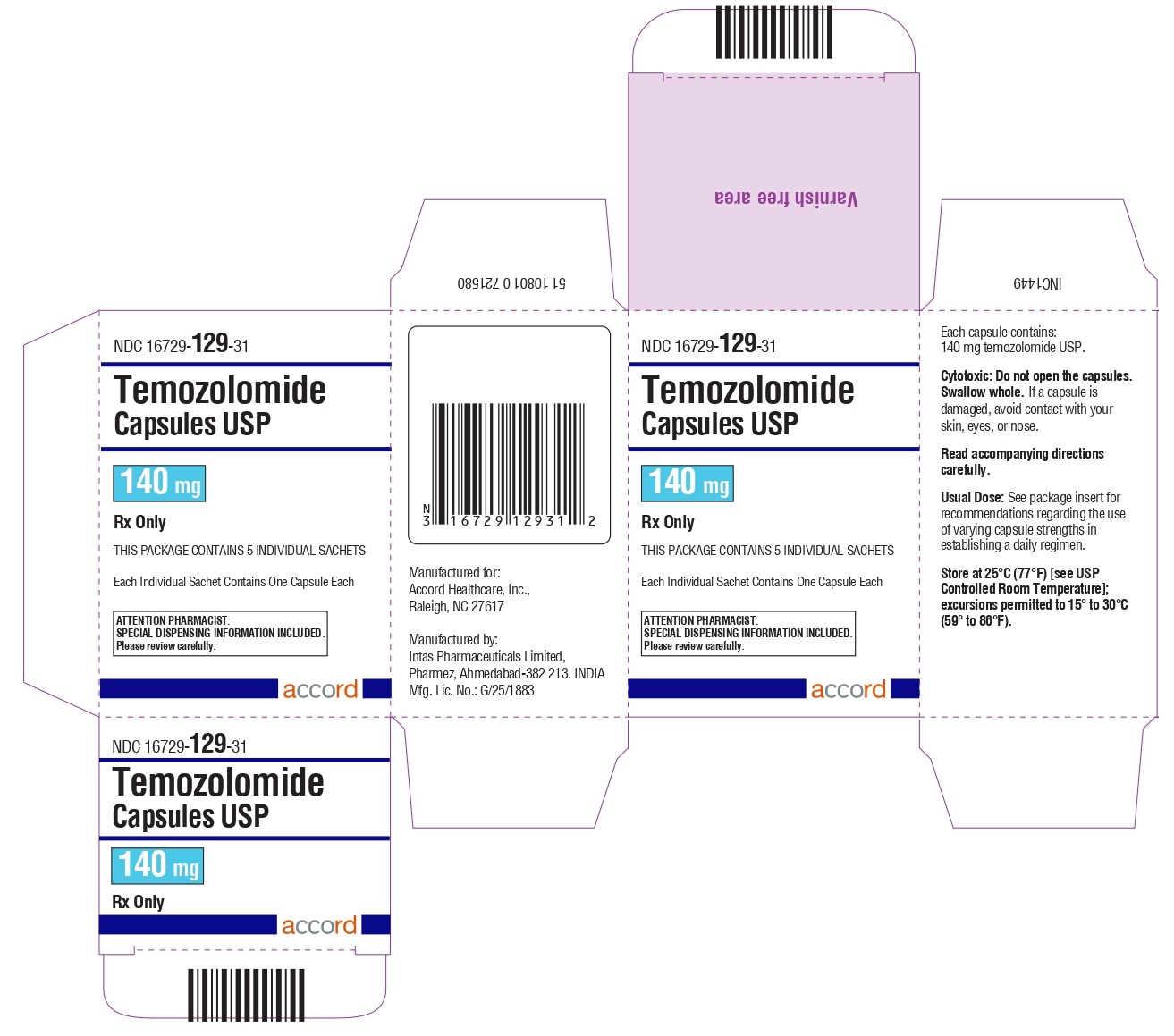
Panel de Exhibición Principal – Cápsulas de 180 mg
Caja de Envases Cartón
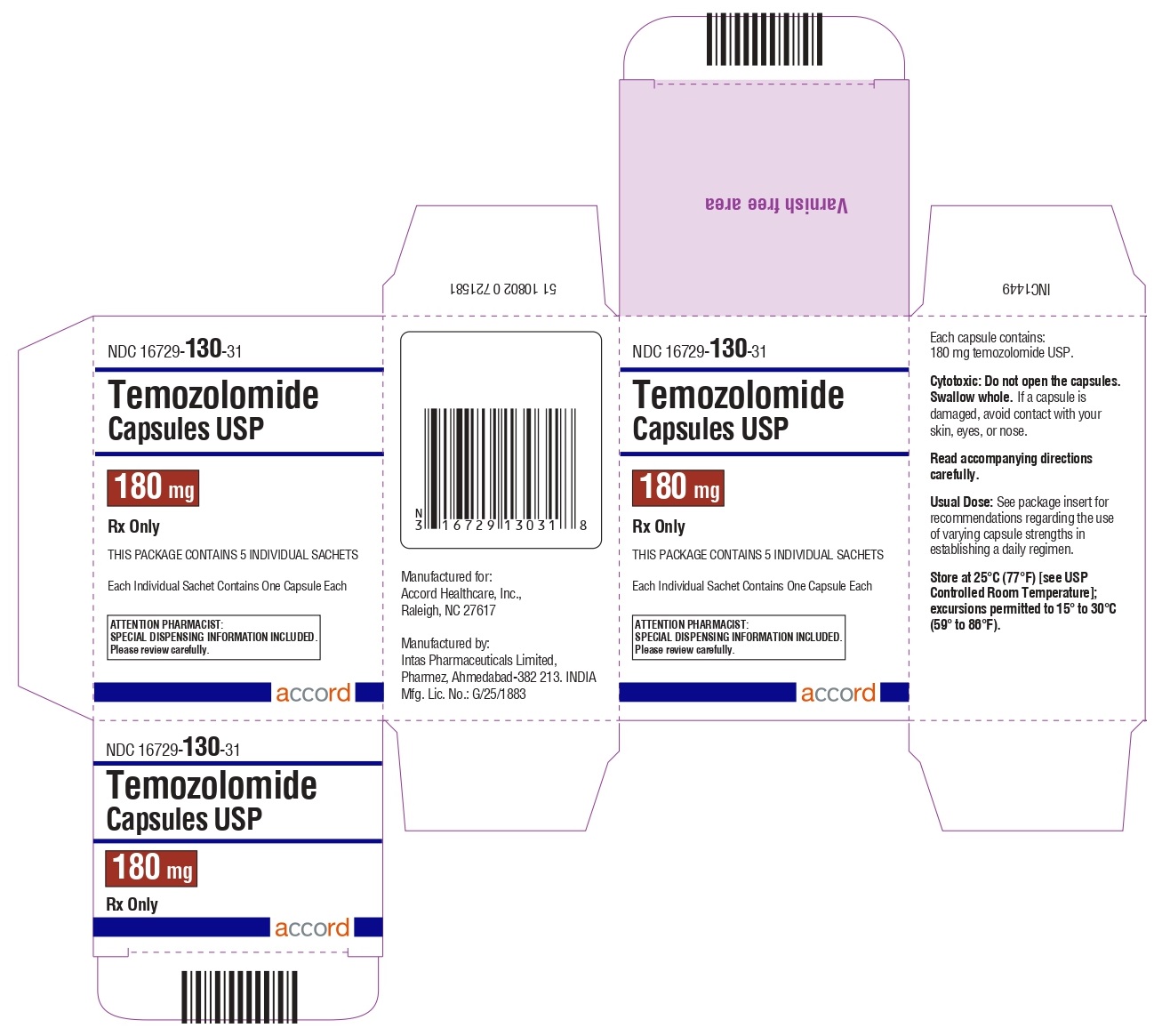
Panel de Exhibición Principal – Cápsulas de 250 mg
Caja de Envases Cartón