Fabricante de medicamentos: Eli Lilly and Company (Updated: 2024-11-13)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
TALTZ (ixekizumab) inyección, para uso subcutáneo
Aprobación inicial en EE. UU.: 2016
CAMBIOS RECIENTES IMPORTANTES
INDICACIONES Y USO
TALTZ® es un antagonista humanizado de la interleucina-17A indicado para el tratamiento de:
- pacientes de 6 años o mayores con psoriasis en placas de moderada a grave que son candidatos a terapia sistémica o fototerapia. (1.1)
- adultos con artritis psoriásica activa. (1.2)
- adultos con espondilitis anquilosante activa. (1.3)
- adultos con espondiloartritis axial no radiográfica activa con signos objetivos de inflamación. (1.4)
DOSIS Y ADMINISTRACIÓN
Administrar por inyección subcutánea.
Psoriasis en placas en adultos (2.2)
- La dosis recomendada es de 160 mg (dos inyecciones de 80 mg) en la semana 0, seguida de 80 mg en las semanas 2, 4, 6, 8, 10 y 12, luego 80 mg cada 4 semanas.
Psoriasis en placas pediátrica (2.3)
- Para pacientes que pesan más de 50 kg, la dosis recomendada es de 160 mg (dos inyecciones de 80 mg) en la semana 0, seguida de 80 mg cada 4 semanas.
- Para pacientes que pesan entre 25 y 50 kg, la dosis recomendada es de 80 mg en la semana 0, seguida de 40 mg cada 4 semanas.
- Para pacientes que pesan menos de 25 kg, la dosis recomendada es de 40 mg en la semana 0, seguida de 20 mg cada 4 semanas.
Artritis psoriásica (2.4)
- La dosis recomendada es de 160 mg por inyección subcutánea (dos inyecciones de 80 mg) en la semana 0, seguida de 80 mg cada 4 semanas.
- Para pacientes con artritis psoriásica con psoriasis en placas de moderada a grave coexistente, use el régimen de dosificación para la psoriasis en placas en adultos. (2.2)
- TALTZ se puede administrar solo o en combinación con un DMARD convencional (p. ej., metotrexato).
Espondilitis anquilosante (2.5)
- La dosis recomendada es de 160 mg por inyección subcutánea (dos inyecciones de 80 mg) en la semana 0, seguida de 80 mg cada 4 semanas.
Espondiloartritis axial no radiográfica (2.6)
- La dosis recomendada es de 80 mg por inyección subcutánea cada 4 semanas.
FORMAS FARMACÉUTICAS Y CONCENTRACIONES
Inyección: (3)
- Solución de 80 mg/mL en un autoinyector precargado de dosis única
- Solución de 80 mg/mL en una jeringa precargada de dosis única
- Solución de 40 mg/0,5 mL en una jeringa precargada de dosis única
- Solución de 20 mg/0,25 mL en una jeringa precargada de dosis única
CONTRAINDICACIONES
Reacción de hipersensibilidad grave a ixekizumab o a cualquiera de los excipientes. (4)
ADVERTENCIAS Y PRECAUCIONES
- Infecciones: Se han producido infecciones graves. Indique a los pacientes que busquen consejo médico si se presentan signos o síntomas de infección crónica o aguda clínicamente importante. Si se desarrolla una infección grave, suspenda TALTZ hasta que la infección se resuelva. (5.1)
- Tuberculosis (TB): Evalúe la TB antes de iniciar el tratamiento. (5.2)
- Hipersensibilidad: Si se produce una reacción alérgica grave, suspenda TALTZ inmediatamente e inicie la terapia adecuada. (5.3)
- Erupciones eczematosas: En la fase posterior a la comercialización, se notificaron casos de erupciones eczematosas graves en pacientes que recibían TALTZ. Es posible que sea necesario interrumpir el tratamiento para resolver la erupción eczematosa. (5.4)
- Enfermedad inflamatoria intestinal: Durante los ensayos clínicos se produjeron enfermedad de Crohn y colitis ulcerosa, incluidas exacerbaciones. Controle estrechamente al prescribir TALTZ a pacientes con enfermedad inflamatoria intestinal (EII). Suspenda TALTZ e inicie el tratamiento médico adecuado si se desarrolla EII. (5.5)
- Inmunizaciones: Evite el uso de vacunas vivas. (5.6)
REACCIONES ADVERSAS
Las reacciones adversas más comunes (≥1%) asociadas con el tratamiento con TALTZ son reacciones en el lugar de la inyección, infecciones de las vías respiratorias superiores, náuseas e infecciones por tiña. (6.1)
Para informar REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Eli Lilly and Company al 1-800-545-5979 (1-800-LillyRx) o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
Consulte 17 para obtener INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y la Guía del medicamento.
Revisado: 8/2024
Tabla de contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
1.1 Psoriasis en Placas
1.2 Artritis Psoriásica
1.3 Espondilitis Anquilosante
1.4 Espondiloartritis Axial No Radiográfica
2 POSOLOGÍA Y ADMINISTRACIÓN
2.1 Pruebas y Procedimientos Antes del Inicio del Tratamiento
2.2 Posología Recomendada en Psoriasis en Placas en Adultos
2.3 Posología Recomendada en Psoriasis en Placas Pediátrica
2.4 Posología Recomendada en Artritis Psoriásica
2.5 Posología Recomendada en Espondilitis Anquilosante
2.6 Posología Recomendada en Espondiloartritis Axial No Radiográfica
2.7 Instrucciones de Preparación y Administración
2.8 Instrucciones de Preparación Alternativas de Dosis de TALTZ para Pacientes Pediátricos con Psoriasis en Placas que Pesan 50 kg o Menos
3 FORMAS Y CONCENTRACIONES FARMACÉUTICAS
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Infecciones
5.2 Evaluación Previa al Tratamiento para Tuberculosis
5.3 Hipersensibilidad
5.4 Erupciones Eczematosas
5.5 Enfermedad Inflamatoria Intestinal
5.6 Inmunizaciones
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Inmunogenicidad
6.3 Experiencia Postcomercialización
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Psoriasis en Placas en Adultos
14.2 Psoriasis en Placas Pediátrica
14.3 Artritis Psoriásica
14.4 Espondilitis Anquilosante
14.5 Espondiloartritis Axial No Radiográfica
16 PRESENTACIÓN/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no se enumeran.
1 INDICACIONES Y USO
1.1 Psoriasis en Placas
TALTZ® está indicado para el tratamiento de pacientes de 6 años de edad y mayores con psoriasis en placas de moderada a grave que son candidatos a terapia sistémica o fototerapia.
1.2 Artritis Psoriásica
TALTZ está indicado para el tratamiento de pacientes adultos con artritis psoriásica activa.
1.3 Espondilitis Anquilosante
TALTZ está indicado para el tratamiento de pacientes adultos con espondilitis anquilosante activa.
1.4 Espondiloartritis Axial No Radiográfica
TALTZ está indicado para el tratamiento de pacientes adultos con espondiloartritis axial no radiográfica (nr-axSpA) activa con signos objetivos de inflamación.
2 DOSIS Y ADMINISTRACIÓN
2.1 Pruebas y procedimientos previos al inicio del tratamiento
Realice las siguientes evaluaciones antes de iniciar el tratamiento con TALTZ:
- Evalúe a los pacientes para detectar infección por tuberculosis (TB). No se recomienda iniciar TALTZ en pacientes con infección activa por TB. Inicie el tratamiento de la TB latente antes de iniciar TALTZ [ver Advertencias y precauciones (5.2)].
- Complete todas las vacunas apropiadas para la edad según lo recomendado por las pautas de inmunización actuales antes de iniciar el tratamiento con TALTZ [ver Advertencias y precauciones (5.6)].
2.2 Dosis recomendada en adultos con psoriasis en placas
TALTZ se administra mediante inyección subcutánea. La dosis recomendada en adultos con psoriasis en placas de moderada a grave es de 160 mg (dos inyecciones de 80 mg) en la semana 0, seguida de 80 mg en las semanas 2, 4, 6, 8, 10 y 12, luego 80 mg cada 4 semanas.
2.3 Dosis recomendada en niños con psoriasis en placas
TALTZ se administra mediante inyección subcutánea cada 4 semanas (Q4S). La dosis recomendada en pacientes pediátricos de 6 a menos de 18 años de edad con psoriasis en placas de moderada a grave se basa en las siguientes categorías de peso.
| Peso del paciente pediátrico | Dosis inicial (Semana 0) | Dosis cada 4 semanas (Q4S) a partir de entonces |
| Mayor de 50 kg | 160 mg (dos inyecciones de 80 mg) | 80 mg |
| De 25 a 50 kg | 80 mg | 40 mg |
| Menos de 25 kg | 40 mg | 20 mg |
2.4 Dosis recomendada en artritis psoriásica
La dosis recomendada es de 160 mg por inyección subcutánea (dos inyecciones de 80 mg) en la semana 0, seguida de 80 mg cada 4 semanas.
Para pacientes con artritis psoriásica y psoriasis en placas de moderada a grave coexistente, utilice el régimen de dosificación para la psoriasis en placas en adultos [ver Posología y administración (2.2)].
TALTZ puede administrarse solo o en combinación con un fármaco antirreumático modificador de la enfermedad convencional (cDMARD) (p. ej., metotrexato).
2.5 Dosis recomendada en espondilitis anquilosante
La dosis recomendada es de 160 mg por inyección subcutánea (dos inyecciones de 80 mg) en la semana 0, seguida de 80 mg cada 4 semanas.
2.6 Dosis recomendada en espondiloartritis axial no radiográfica
La dosis recomendada es de 80 mg por inyección subcutánea cada 4 semanas.
2.7 Instrucciones de preparación y administración
TALTZ debe utilizarse bajo la orientación y supervisión de un profesional sanitario. Los pacientes adultos pueden autoinyectarse o los cuidadores pueden administrar inyecciones de TALTZ después de recibir capacitación en la técnica de inyección subcutánea utilizando el autoinyector o la jeringa precargada. No se ha establecido la seguridad y eficacia de la autoadministración en niños. Por lo tanto, TALTZ debe administrarse a pacientes pediátricos por un profesional sanitario o por un cuidador que haya recibido capacitación y haya demostrado una técnica de inyección subcutánea adecuada.
Las dosis de TALTZ de 20 mg y 40 mg preparadas a partir de la jeringa precargada de TALTZ 80 mg/mL solo deben ser administradas por un profesional sanitario cualificado [ver Posología y administración (2.8)].
Las “Instrucciones de uso” de TALTZ contienen instrucciones más detalladas sobre la preparación y administración de TALTZ [ver Instrucciones de uso].
Antes de la inyección, retire el autoinyector TALTZ o la jeringa precargada TALTZ del refrigerador y deje que TALTZ alcance la temperatura ambiente (30 minutos) sin quitar la tapa de la aguja. Inspeccione visualmente TALTZ para detectar partículas y decoloración antes de la administración. TALTZ es una solución transparente e incolora a ligeramente amarilla. No lo utilice si el líquido contiene partículas visibles, está decolorado o turbio (que no sea transparente e incolora a ligeramente amarilla).
Administre cada inyección en una ubicación anatómica diferente (como la parte superior de los brazos, los muslos o cualquier cuadrante del abdomen) a la inyección anterior, y no en áreas donde la piel esté sensible, magullada, eritematosa, indurada o afectada por psoriasis. La administración de TALTZ en la parte superior del brazo puede ser realizada por un cuidador o un profesional sanitario [ver Instrucciones de uso].
TALTZ no contiene conservantes, por lo tanto, deseche cualquier producto sin usar.
Si se olvida una dosis, adminístrela lo antes posible. Después, reanude la administración a la hora programada habitual.
2.8 Instrucciones alternativas de preparación de dosis de TALTZ para pacientes pediátricos con psoriasis en placas que pesan 50 kg o menos
Si la jeringa precargada de 20 mg/0,25 mL o 40 mg/0,5 mL no está disponible, las dosis de TALTZ de 20 mg o 40 mg para pacientes pediátricos con psoriasis en placas [ver Posología y administración (2.3)] deben prepararse manualmente según los pasos que se indican a continuación utilizando únicamente la jeringa precargada de TALTZ 80 mg/mL. La preparación y administración de las dosis de 20 mg y 40 mg solo deben ser realizadas por un profesional sanitario cualificado. Para obtener instrucciones adicionales de preparación y administración, [ver Posología y administración (2.7)].
-
Reúna los siguientes materiales necesarios para la preparación:
- Jeringa desechable de 0,5 mL o 1 mL
- Aguja estéril para extracción
- Aguja estéril de calibre 27 para administración
- Frasco de vidrio estéril y transparente.
- Expulse todo el contenido de la jeringa precargada en el frasco estéril. NO agite ni remueva el frasco. No añada otros medicamentos a las soluciones que contengan TALTZ.
- Utilizando la jeringa desechable de 0,5 mL o 1 mL y la aguja estéril, extraiga la dosis prescrita del frasco (0,25 mL para 20 mg; 0,5 mL para 40 mg).
- Retire la aguja de la jeringa y sustitúyala por una aguja de calibre 27 antes de administrar TALTZ.
Almacenamiento de TALTZ preparado
Si es necesario, las dosis de TALTZ de 20 mg o 40 mg preparadas a partir de una jeringa precargada de 80 mg/mL pueden almacenarse a temperatura ambiente hasta 4 horas desde la primera punción del frasco estéril.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
TALTZ es una solución transparente e incolora a ligeramente amarilla disponible como:
- Inyección: solución de TALTZ 80 mg/mL en un autoinyector prellenado de dosis única
- Inyección: solución de TALTZ 80 mg/mL en una jeringa prellenada de dosis única
- Inyección: solución de TALTZ 40 mg/0.5 mL en una jeringa prellenada de dosis única
- Inyección: solución de TALTZ 20 mg/0.25 mL en una jeringa prellenada de dosis única
4 CONTRAINDICACIONES
TALTZ está contraindicado en pacientes con una reacción de hipersensibilidad grave previa, como anafilaxia, a ixekizumab o a cualquiera de los excipientes [ver Advertencias y precauciones (5.3)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Infecciones
TALTZ puede aumentar el riesgo de infección. En ensayos clínicos en pacientes adultos con psoriasis en placas, el grupo TALTZ tuvo una tasa de infecciones mayor que el grupo placebo (27% vs. 23%). Las infecciones del tracto respiratorio superior, la candidiasis oral, la conjuntivitis y las infecciones por tiña ocurrieron con mayor frecuencia en el grupo TALTZ que en el grupo placebo. Se observó un aumento similar en el riesgo de infección en ensayos controlados con placebo en pacientes con psoriasis pediátrica, artritis psoriásica, espondilitis anquilosante y espondiloartritis axial no radiográfica [ver Reacciones adversas (6.1)].
En la etapa posterior a la comercialización, se han notificado infecciones oportunistas bacterianas, víricas y fúngicas graves en pacientes que recibieron inhibidores de IL-17, incluido TALTZ. Indique a los pacientes tratados con TALTZ que busquen asesoramiento médico si aparecen signos o síntomas de una infección crónica o aguda clínicamente importante. Si un paciente desarrolla una infección grave o no responde a la terapia estándar, controle al paciente estrechamente y suspenda TALTZ hasta que la infección desaparezca.
5.2 Evaluación previa al tratamiento para la tuberculosis
Evalúe a los pacientes para detectar infección por tuberculosis (TB) antes de iniciar el tratamiento con TALTZ. No lo administre a pacientes con infección activa por TB. Inicie el tratamiento de la TB latente antes de administrar TALTZ. Considere la terapia anti-TB antes de iniciar TALTZ en pacientes con antecedentes de TB latente o activa en quienes no se pueda confirmar un tratamiento adecuado. Los pacientes que reciben TALTZ deben ser controlados estrechamente para detectar signos y síntomas de TB activa durante y después del tratamiento.
5.3 Hipersensibilidad
En los ensayos clínicos, se produjeron reacciones de hipersensibilidad graves, incluido angioedema y urticaria (cada ≤0,1%), en el grupo TALTZ. Se ha notificado anafilaxia, incluidos casos que llevaron a la hospitalización, en el uso posterior a la comercialización con TALTZ [ver Reacciones adversas (6.1, 6.3)]. Si se produce una reacción de hipersensibilidad grave, suspenda TALTZ inmediatamente e inicie el tratamiento adecuado.
5.4 Erupciones eczematosas
En la etapa posterior a la comercialización, se notificaron casos de erupciones eczematosas graves, incluidas erupciones similares a la dermatitis atópica, eccema dishidrótico y eritrodermia en pacientes que recibieron TALTZ; algunos casos requirieron hospitalización. El inicio de las erupciones eczematosas fue variable, desde días hasta meses después de la primera dosis de TALTZ. Es posible que deba interrumpirse el tratamiento para resolver la erupción eczematosa. Algunos pacientes con opciones de tratamiento limitadas para la psoriasis fueron tratados con éxito para el eccema mientras continuaban con TALTZ.
5.5 Enfermedad inflamatoria intestinal
Los pacientes tratados con TALTZ pueden tener un mayor riesgo de enfermedad inflamatoria intestinal. En los ensayos clínicos, la enfermedad de Crohn y la colitis ulcerosa, incluidas las exacerbaciones, ocurrieron con mayor frecuencia en el grupo TALTZ que en el grupo control con placebo [ver Reacciones adversas (6.1)]. Durante el tratamiento con TALTZ, controle la aparición o exacerbación de la enfermedad inflamatoria intestinal y, si se produce EII, suspenda TALTZ e inicie el tratamiento médico adecuado.
5.6 Inmunizaciones
Antes de iniciar el tratamiento con TALTZ, considere la posibilidad de completar todas las inmunizaciones apropiadas para la edad de acuerdo con las pautas de inmunización actuales. Evite el uso de vacunas vivas en pacientes tratados con TALTZ. No hay datos disponibles sobre la respuesta a las vacunas vivas.
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas a los medicamentos se describen con mayor detalle en otras secciones de la etiqueta:
- Infecciones [ver Advertencias y precauciones (5.1)]
- Reacciones de hipersensibilidad [ver Contraindicaciones (4) y Advertencias y precauciones (5.3)]
- Erupciones eczematosas [ver Advertencias y precauciones (5.4)]
- Enfermedad inflamatoria intestinal [ver Advertencias y precauciones (5.5)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones ampliamente variables y controladas, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no se pueden comparar directamente con las tasas en los ensayos clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica.
Psoriasis en placa en adultos
Semanas 0 a 12:
Se integraron tres ensayos controlados con placebo en sujetos con psoriasis en placa para evaluar la seguridad de TALTZ en comparación con el placebo durante un máximo de 12 semanas. Un total de 1167 sujetos (edad media 45 años; 66% hombres; 94% blancos) con psoriasis en placa recibieron TALTZ (160 mg en la semana 0, 80 mg cada 2 semanas [Q2W] durante 12 semanas) por vía subcutánea. En dos de los ensayos, la seguridad de TALTZ (uso hasta 12 semanas) también se comparó con un comparador activo, etanercept aprobado por EE. UU. [ver Estudios clínicos (14)].
En el período de 12 semanas controlado con placebo, los eventos adversos ocurrieron en el 58% del grupo TALTZ Q2W (2,5 por año-paciente de seguimiento) en comparación con el 47% del grupo placebo (2,1 por año-paciente de seguimiento). Los eventos adversos graves ocurrieron en el 2% del grupo TALTZ (0,07 por año-paciente de seguimiento) y en el 2% del grupo placebo (0,07 por año-paciente de seguimiento).
Tabla 2 resume las reacciones adversas que ocurrieron a una tasa de al menos el 1% y a una tasa mayor en el grupo TALTZ que en el grupo placebo durante el período controlado con placebo de 12 semanas de los ensayos clínicos agrupados.
|
a El grupo de infecciones del tracto respiratorio superior incluye nasofaringitis e infección por rinovirus. |
|||
|
b Etanercept aprobado por EE. UU. |
|||
| Reacciones adversas | TALTZ 80 mg Q2W (N=1167) n (%) |
Etanerceptb (N=287) n (%) |
Placebo (N=791) n (%) |
| Reacciones en el sitio de inyección | 196 (17) | 32 (11) | 26 (3) |
| Infecciones del tracto respiratorio superiora | 163 (14) | 23 (8) | 101 (13) |
| Náuseas | 23 (2) | 1 (<1) | 5 (1) |
| Infecciones por tiña | 17 (2) | 0 | 1 (<1) |
Las reacciones adversas que ocurrieron a tasas inferiores al 1% en el grupo TALTZ y con mayor frecuencia que en el grupo placebo durante el período de inducción de 12 semanas incluyeron rinitis, candidiasis oral, urticaria, gripe, conjuntivitis, enfermedad inflamatoria intestinal y angioedema.
Semanas 13 a 60:
Un total de 332 sujetos recibieron el régimen de mantenimiento recomendado de TALTZ 80 mg administrado cada 4 semanas.
Durante el período de mantenimiento (semanas 13 a 60), se produjeron eventos adversos en el 80% de los sujetos tratados con TALTZ (1,0 por año-sujeto de seguimiento) en comparación con el 58% de los sujetos tratados con placebo (1,1 por año-sujeto de seguimiento). Se informaron eventos adversos graves en el 4% de los sujetos tratados con TALTZ (0,05 por año-sujeto de seguimiento) y ninguno en los sujetos tratados con placebo.
Semanas 0 a 60:
Durante todo el período de tratamiento (semanas 0 a 60), se informaron eventos adversos en el 67% de los sujetos tratados con TALTZ (1,4 por año-sujeto de seguimiento) en comparación con el 48% de los sujetos tratados con placebo (2,0 por año-sujeto de seguimiento). Se informaron eventos adversos graves en el 3% de los sujetos tratados con TALTZ (0,06 por año-sujeto de seguimiento) y en el 2% de los sujetos tratados con placebo (0,06 por año-sujeto de seguimiento).
Reacciones adversas específicas a los medicamentos
Reacciones en el lugar de la inyección
Las reacciones más frecuentes en el lugar de la inyección fueron eritema y dolor. La mayoría de las reacciones en el lugar de la inyección fueron de intensidad leve a moderada y no provocaron la interrupción de TALTZ.
Infecciones
En el período de 12 semanas, controlado con placebo, de los ensayos clínicos en psoriasis en placas, las infecciones ocurrieron en el 27% de los sujetos tratados con TALTZ (1,2 por año-sujeto de seguimiento) en comparación con el 23% de los sujetos tratados con placebo (1,0 por año-sujeto de seguimiento). Las infecciones graves ocurrieron en el 0,4% de los sujetos tratados con TALTZ (0,02 por año-sujeto de seguimiento) y en el 0,4% de los sujetos tratados con placebo (0,02 por año-sujeto de seguimiento) [ver Advertencias y precauciones (5.1)].
Durante el período de tratamiento de mantenimiento (semanas 13 a 60), las infecciones ocurrieron en el 57% de los sujetos tratados con TALTZ (0,70 por año-sujeto de seguimiento) en comparación con el 32% de los sujetos tratados con placebo (0,61 por año-sujeto de seguimiento). Se produjeron infecciones graves en el 0,9% de los sujetos tratados con TALTZ (0,01 por año-sujeto de seguimiento) y ninguna en los sujetos tratados con placebo.
Durante todo el período de tratamiento (semanas 0 a 60), se informaron infecciones en el 38% de los sujetos tratados con TALTZ (0,83 por año-sujeto de seguimiento) en comparación con el 23% de los sujetos tratados con placebo (1,0 por año-sujeto de seguimiento). Se produjeron infecciones graves en el 0,7% de los sujetos tratados con TALTZ (0,02 por año-sujeto de seguimiento) y en el 0,4% de los sujetos tratados con placebo (0,02 por año-sujeto de seguimiento).
Enfermedad inflamatoria intestinal
En sujetos adultos con psoriasis en placas, la enfermedad de Crohn y la colitis ulcerosa, incluidas las exacerbaciones, ocurrieron con mayor frecuencia en el grupo TALTZ 80 mg Q2W (enfermedad de Crohn 0,1%, colitis ulcerosa 0,2%) que en el grupo placebo (0%) durante el período de 12 semanas, controlado con placebo, en los ensayos clínicos [ver Advertencias y precauciones (5.5)].
Evaluación de laboratorio de citopenia
Neutropenia
Durante todo el período de tratamiento (semanas 0 a 60), la neutropenia ocurrió en el 11% de los sujetos tratados con TALTZ (0,24 por año-sujeto de seguimiento) en comparación con el 3% de los sujetos tratados con placebo (0,14 por año-sujeto de seguimiento). En los sujetos tratados con TALTZ, la tasa de incidencia de neutropenia durante las semanas 13 a 60 fue menor que la tasa de incidencia durante las semanas 0 a 12.
En el período de 12 semanas, controlado con placebo, la neutropenia ≥ Grado 3 (<1,000 células/mm3) ocurrió en el 0,2% del grupo TALTZ (0,007 por año-sujeto de seguimiento) en comparación con el 0,1% del grupo placebo (0,006 por año-sujeto de seguimiento). La mayoría de los casos de neutropenia fueron de Grado 2 (2% para TALTZ 80 mg Q2W versus 0,3% para placebo; ≥1,000 a <1,500 células/mm3) o de Grado 1 (7% para TALTZ 80 mg Q2W versus 3% para placebo; ≥1,500 células/mm3 a ˂2,000 células/mm3). La neutropenia en el grupo TALTZ no se asoció con una mayor tasa de infección en comparación con el grupo placebo.
Trombocitopenia
El noventa y ocho por ciento de los casos de trombocitopenia fueron de Grado 1 (3% para TALTZ 80 mg Q2W versus 1% para placebo; ≥75,000 células/mm3 a <150,000 células/mm3). La trombocitopenia en los sujetos tratados con TALTZ no se asoció con una mayor tasa de hemorragia en comparación con los sujetos tratados con placebo.
Ensayos con comparador activo
En los dos ensayos clínicos que incluyeron un comparador activo, la tasa de eventos adversos graves durante las semanas cero a doce fue del 0,7% para etanercept aprobado en EE. UU. y del 2% para TALTZ 80 mg Q2W, y la tasa de interrupción por eventos adversos fue del 0,7% para etanercept aprobado en EE. UU. y del 2% para TALTZ 80 mg Q2W. La incidencia de infecciones fue del 18% para etanercept aprobado en EE. UU. y del 26% para TALTZ 80 mg Q2W. La tasa de infecciones graves fue del 0,3% tanto para TALTZ 80 mg Q2W como para etanercept aprobado en EE. UU.
Psoriasis en placa pediátrica
Se evaluó TALTZ en un ensayo controlado con placebo en sujetos pediátricos con psoriasis de moderada a grave de 6 a menos de 18 años de edad. Se estudió un total de 171 sujetos (115 sujetos con TALTZ y 56 sujetos con placebo). En general, el perfil de seguridad observado en sujetos pediátricos con psoriasis en placa tratados con TALTZ cada 4 semanas es consistente con el perfil de seguridad en sujetos adultos con psoriasis en placa, con la excepción de las frecuencias de conjuntivitis (2,6%), influenza (1,7%) y urticaria (1,7%).
En este ensayo clínico, la enfermedad de Crohn se presentó con mayor frecuencia en el grupo TALTZ (0,9%) que en el grupo placebo (0%) durante el período de 12 semanas controlado con placebo. La enfermedad de Crohn se presentó en un total de 4 sujetos tratados con TALTZ (2,0%) en el ensayo clínico [ver Advertencias y precauciones (5.5)].
Artritis psoriásica
TALTZ se estudió en dos ensayos controlados con placebo en pacientes con artritis psoriásica. Se estudió un total de 678 pacientes (454 pacientes con TALTZ y 224 con placebo). Un total de 229 pacientes en estos ensayos recibieron 160 mg de TALTZ en la semana 0, seguidos de 80 mg cada 4 semanas (Q4S). En general, el perfil de seguridad observado en pacientes con artritis psoriásica tratados con TALTZ Q4S es consistente con el perfil de seguridad en pacientes adultos con psoriasis en placa, con la excepción de las frecuencias de influenza (1,3%) y conjuntivitis (1,3%).
Espondilitis anquilosante
TALTZ se estudió en dos ensayos controlados con placebo en pacientes con espondilitis anquilosante. Se estudió un total de 566 pacientes (376 pacientes con TALTZ y 190 con placebo). Un total de 195 pacientes en estos ensayos recibieron 80 o 160 mg de TALTZ en la semana 0, seguidos de 80 mg cada 4 semanas (Q4S). En general, el perfil de seguridad observado en pacientes con espondilitis anquilosante tratados con TALTZ Q4S es consistente con el perfil de seguridad en pacientes adultos con psoriasis en placa.
En pacientes adultos con espondilitis anquilosante, la enfermedad de Crohn y la colitis ulcerosa, incluidas las exacerbaciones, se presentaron en 2 pacientes (1,0%) y 1 paciente (0,5%), respectivamente, en el grupo TALTZ 80 mg Q4S y en 1 paciente (0,5%) y 0%, respectivamente, en el grupo placebo durante el período de 16 semanas controlado con placebo en los ensayos clínicos. De estos pacientes, se produjeron eventos graves en 1 paciente en el grupo TALTZ 80 mg Q4S y en 1 paciente en el grupo placebo [ver Advertencias y precauciones (5.5)].
Espondiloartritis axial no radiográfica
TALTZ se estudió en un ensayo controlado con placebo en pacientes con espondiloartritis axial no radiográfica. Se estudió un total de 303 pacientes (198 pacientes con TALTZ y 105 con placebo). Un total de 96 pacientes en este ensayo recibieron 80 o 160 mg de TALTZ en la semana 0, seguidos de 80 mg cada 4 semanas (Q4S). En general, el perfil de seguridad observado en pacientes con espondiloartritis axial no radiográfica tratados con TALTZ 80 mg Q4S hasta la semana 16 es consistente con la experiencia previa de TALTZ en otras indicaciones.
6.2 Inmunogenicidad
Al igual que con todas las proteínas terapéuticas, existe la posibilidad de inmunogenicidad con TALTZ. El ensayo para detectar anticuerpos neutralizantes tiene limitaciones para detectar anticuerpos neutralizantes en presencia de ixekizumab; por lo tanto, la incidencia del desarrollo de anticuerpos neutralizantes podría subestimarse.
Población con psoriasis en placa
Para la semana 12, aproximadamente el 9% de los sujetos adultos tratados con TALTZ cada 2 semanas desarrollaron anticuerpos contra ixekizumab. Aproximadamente el 22% de los sujetos tratados con TALTZ con el régimen de dosificación recomendado desarrollaron anticuerpos contra ixekizumab durante el período de tratamiento de 60 semanas. Los efectos clínicos de los anticuerpos contra ixekizumab dependen del título de anticuerpos; los títulos de anticuerpos más altos se asociaron con una disminución de la concentración del fármaco y la respuesta clínica.
De los sujetos adultos que desarrollaron anticuerpos contra ixekizumab durante el período de tratamiento de 60 semanas, aproximadamente el 10%, lo que equivale al 2% de los sujetos tratados con TALTZ con el régimen de dosificación recomendado, tenían anticuerpos que se clasificaron como neutralizantes. Los anticuerpos neutralizantes se asociaron con concentraciones reducidas de fármacos y pérdida de eficacia.
En los sujetos pediátricos con psoriasis tratados con ixekizumab con el régimen de dosificación recomendado hasta 12 semanas, 21 sujetos (18%) desarrollaron anticuerpos contra el fármaco, 5 sujetos (4%) tuvieron anticuerpos neutralizantes confirmados asociados con bajas concentraciones del fármaco. No se pudo obtener evidencia concluyente sobre la posible asociación de anticuerpos neutralizantes y la respuesta clínica y/o eventos adversos debido al pequeño número de sujetos pediátricos en el estudio.
Población con artritis psoriásica
Para los sujetos tratados con TALTZ 80 mg cada 4 semanas hasta 52 semanas (PsA1), el 11% desarrolló anticuerpos contra el fármaco, y el 8% tuvo anticuerpos neutralizantes confirmados.
Población con espondilitis anquilosante
Para los pacientes tratados con TALTZ 80 mg cada 4 semanas hasta 16 semanas (AS1, AS2), el 5,2% desarrolló anticuerpos contra el fármaco, y el 1,5% tuvo anticuerpos neutralizantes.
Población con espondiloartritis axial no radiográfica
De los pacientes tratados con TALTZ 80 mg cada 4 semanas hasta 52 semanas (nr-axSpA1), el 8,9% desarrolló anticuerpos contra el fármaco, todos de bajo título. Ningún paciente tuvo anticuerpos neutralizantes.
La detección de la formación de anticuerpos depende en gran medida de la sensibilidad y especificidad del ensayo. Además, la incidencia observada de positividad de anticuerpos (incluidos los anticuerpos neutralizantes) en un ensayo puede verse influenciada por varios factores, como la metodología del ensayo, el manejo de la muestra, el momento de la toma de la muestra, los medicamentos concomitantes y la enfermedad subyacente. Por estas razones, la comparación de la incidencia de anticuerpos a TALTZ entre indicaciones o con la incidencia de anticuerpos a otros productos puede ser engañosa.
6.3 Experiencia post-comercialización
Las siguientes reacciones adversas se han identificado durante el uso post-aprobación de TALTZ. Debido a que las reacciones se notifican voluntariamente de una población de tamaño incierto, no siempre es posible estimar de forma fiable su frecuencia o establecer una relación causal con la exposición a TALTZ.
Trastornos del sistema inmunitario: anafilaxia [ver Contraindicaciones (4)].
Infecciones: infecciones bacterianas, víricas y fúngicas oportunistas, incluyendo meningoencefalitis criptocócica, candidiasis mucocutánea esofágica y diseminada, tuberculosis pulmonar, toxoplasmosis, reactivación del virus de la varicela zóster, colitis por citomegalovirus, aspergilosis pulmonar.
Trastornos de la piel y del tejido subcutáneo: Erupciones eccematosas (eritema, erupciones similares a la dermatitis atópica y eccema dishidrótico).
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Registro de exposición durante el embarazo
Existe un registro de exposición durante el embarazo que monitoriza los resultados del embarazo en mujeres expuestas a TALTZ durante la gestación. Se anima a las mujeres embarazadas expuestas a TALTZ a inscribirse en el Registro de Embarazo de TALTZ llamando al 1-800-284-1695. También se puede encontrar información de contacto para el registro en http://www.pregnancyregistry.lilly.com.
Resumen de riesgo
Los datos disponibles de la literatura publicada y la base de datos de farmacovigilancia con el uso de TALTZ en mujeres embarazadas son insuficientes para evaluar el riesgo asociado al fármaco de defectos congénitos importantes, aborto espontáneo u otros resultados adversos maternos o fetales.
Se sabe que la IgG humana atraviesa la barrera placentaria; por lo tanto, TALTZ puede transmitirse de la madre al feto en desarrollo. Un estudio de desarrollo embriofetal realizado en monos preñados durante la organogénesis a dosis de hasta 19 veces la dosis máxima recomendada para humanos (MRHD) no reveló evidencia de daño al feto en desarrollo. Cuando la administración se continuó hasta el parto, se observaron muertes neonatales a 1,9 veces la MRHD [ver Datos]. Se desconoce la significancia clínica de estos hallazgos no clínicos.
Se desconoce el riesgo de fondo de defectos congénitos importantes y aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de fondo de defectos congénitos, pérdida u otros resultados adversos. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente.
Datos
Datos en animales
Se realizó un estudio de desarrollo embriofetal en monos cynomolgus a los que se administró ixekizumab. No se observaron malformaciones ni toxicidad embriofetal en los fetos de monos preñados a los que se administró ixekizumab semanalmente mediante inyección subcutánea durante la organogénesis hasta cerca del parto a dosis de hasta 19 veces la MRHD (en una base de mg/kg de 50 mg/kg/semana). El ixekizumab cruzó la placenta en los monos.
En un estudio de toxicidad del desarrollo pre y postnatal, se administraron a monos cynomolgus preñados dosis subcutáneas semanales de ixekizumab de hasta 19 veces la MRHD desde el comienzo de la organogénesis hasta el parto. Se produjeron muertes neonatales en la descendencia de dos monos a los que se administró ixekizumab a 1,9 veces la MRHD (en una base de mg/kg de 5 mg/kg/semana) y dos monos a los que se administró ixekizumab a 19 veces la MRHD (en una base de mg/kg de 50 mg/kg/semana). Estas muertes neonatales se atribuyeron al parto prematuro, trauma o defecto congénito. Se desconoce la significancia clínica de estos hallazgos. No se observaron efectos relacionados con ixekizumab en el desarrollo funcional o inmunológico en los bebés sobrevivientes desde el nacimiento hasta los 6 meses de edad.
8.2 Lactancia
Resumen de riesgo
No hay datos disponibles sobre la presencia de ixekizumab en la leche materna, los efectos en el lactante o los efectos sobre la producción de leche. Se detectó ixekizumab en la leche de monos cynomolgus lactantes. Cuando un fármaco está presente en la leche animal, es probable que el fármaco esté presente en la leche materna. Se deben considerar los beneficios para el desarrollo y la salud de la lactancia materna junto con la necesidad clínica de la madre de TALTZ y cualquier efecto adverso potencial en el lactante amamantado por TALTZ o por la enfermedad materna subyacente.
8.4 Uso pediátrico
La seguridad y la eficacia de TALTZ se han establecido en sujetos pediátricos de 6 años a menos de 18 años con psoriasis en placas de moderada a grave. No se ha establecido la seguridad y la eficacia de TALTZ en otras indicaciones pediátricas ni para sujetos pediátricos menores de 6 años.
8.5 Uso en geriatría
De los 4204 sujetos adultos con psoriasis expuestos a TALTZ, un total de 301 tenían 65 años o más, y 36 sujetos tenían 75 años o más. Aunque no se observaron diferencias en la seguridad o la eficacia entre los sujetos mayores y los más jóvenes, el número de sujetos de 65 años o más no es suficiente para determinar si responden de manera diferente a los sujetos más jóvenes [ver Farmacología clínica (12.3)].
11 DESCRIPCIÓN
Ixekizumab es un anticuerpo monoclonal (mAb) humanizado de la subclase 4 de inmunoglobulina G (IgG4) con actividad neutralizante contra IL-17A. Ixekizumab se produce mediante tecnología de ADN recombinante en una línea celular de mamíferos recombinantes y se purifica utilizando tecnología estándar para bioprocesamiento. Ixekizumab se compone de dos polipéptidos de cadena ligera idénticos de 219 aminoácidos cada uno y dos polipéptidos de cadena pesada idénticos de 445 aminoácidos cada uno y tiene un peso molecular de 146.158 Daltons para la estructura proteica de la molécula.
La inyección de TALTZ es una solución estéril, sin conservantes, transparente e incolora a ligeramente amarilla, para uso subcutáneo, disponible como 80 mg de ixekizumab en un autoinyector prellenado de dosis única de 1 mL o una jeringa prellenada de dosis única, 40 mg de ixekizumab en una jeringa prellenada de dosis única de 0,5 mL, o 20 mg de ixekizumab en una jeringa prellenada de dosis única de 0,25 mL. El autoinyector prellenado y la jeringa prellenada contienen cada uno una jeringa de vidrio de 1 mL con una aguja fija de calibre 27 ½ pulgada. El autoinyector prellenado y la jeringa prellenada de TALTZ 80 mg están fabricados para administrar 80 mg de ixekizumab. La jeringa prellenada de TALTZ 40 mg está fabricada para administrar 40 mg de ixekizumab. La jeringa prellenada de TALTZ 20 mg está fabricada para administrar 20 mg de ixekizumab.
Cada autoinyector de dosis única de TALTZ 80 mg/mL o jeringa prellenada de dosis única de TALTZ 80 mg/mL se compone de ixekizumab (80 mg); Polisorbato 80, USP (0,3 mg); Sacarosa, USP (80 mg); y Agua para inyección, USP. Se puede haber añadido hidróxido de sodio, USP-NF, para ajustar el pH. La solución de TALTZ tiene un pH de 5,2 – 6,2.
Cada jeringa prellenada de dosis única de TALTZ 40 mg/0,5 mL se compone de ixekizumab (40 mg); Polisorbato 80, USP (0,15 mg); Sacarosa, USP (40 mg); y Agua para inyección, USP. Se puede haber añadido hidróxido de sodio, USP-NF, para ajustar el pH. La solución de TALTZ tiene un pH de 5,2 – 6,2.
Cada jeringa prellenada de dosis única de TALTZ 20 mg/0,25 mL se compone de ixekizumab (20 mg); Polisorbato 80, USP (0,08 mg); Sacarosa, USP (20 mg); y Agua para inyección, USP. Se puede haber añadido hidróxido de sodio, USP-NF, para ajustar el pH. La solución de TALTZ tiene un pH de 5,2 – 6,2.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Ixekizumab es un anticuerpo monoclonal humanizado IgG4 que se une selectivamente a la citocina interleucina 17A (IL-17A) e inhibe su interacción con el receptor IL-17. La IL-17A es una citocina natural que participa en las respuestas inflamatorias e inmunitarias normales. Ixekizumab inhibe la liberación de citocinas y quimiocinas proinflamatorias.
12.3 Farmacocinética
Las propiedades farmacocinéticas (PK) de ixekizumab fueron similares en las indicaciones de psoriasis en placas en adultos, artritis psoriásica, espondilitis anquilosante y espondiloartritis axial no radiográfica.
Absorción
Después de una dosis subcutánea única de 160 mg en sujetos con psoriasis en placas, ixekizumab alcanzó concentraciones séricas máximas medias (±DE) (Cmax) de 16,2 ±6,6 mcg/mL aproximadamente a los 4 días posteriores a la dosis.
Se alcanzaron concentraciones en estado estacionario en la semana 8 después de la dosis inicial de 160 mg y el régimen de dosificación de 80 mg cada 2 semanas; la concentración media ±DE en estado estacionario fue de 9,3 ±5,3 mcg/mL. Se alcanzaron concentraciones en estado estacionario aproximadamente 10 semanas después de cambiar del régimen de dosificación de 80 mg cada 2 semanas al régimen de dosificación de 80 mg cada 4 semanas en la semana 12. La concentración media ±DE en estado estacionario fue de 3,5 ±2,5 mcg/mL.
En estudios de sujetos con psoriasis en placas, la biodisponibilidad de ixekizumab osciló entre el 60% y el 81% después de la inyección subcutánea. La administración de ixekizumab mediante inyección en el muslo logró una mayor biodisponibilidad en relación con la lograda utilizando otros sitios de inyección, incluidos el brazo y el abdomen.
Distribución
El volumen de distribución medio (CV geométrico %) en estado estacionario fue de 7,11 L (29%) en sujetos con psoriasis en placas.
Eliminación
No se ha caracterizado la vía metabólica de ixekizumab. Como anticuerpo monoclonal humanizado IgG4, se espera que ixekizumab se degrade en pequeños péptidos y aminoácidos a través de vías catabólicas de la misma manera que la IgG endógena.
El aclaramiento sistémico medio fue de 0,39 L/día (37%) y la semivida media (CV geométrico %) fue de 13 días (40%) en sujetos con psoriasis en placas.
Peso
El aclaramiento y el volumen de distribución de ixekizumab aumentan a medida que aumenta el peso corporal.
Linealidad de la dosis
Ixekizumab exhibió farmacocinética proporcional a la dosis en sujetos con psoriasis en placas en un rango de dosis de 5 mg (no es la dosis recomendada) a 160 mg después de la administración subcutánea.
Poblaciones específicas
Edad:
Población geriátrica
El análisis farmacocinético poblacional indicó que la edad no influyó significativamente en el aclaramiento de ixekizumab en sujetos adultos con psoriasis en placas. Los sujetos de 65 años o más tuvieron un aclaramiento de ixekizumab similar en comparación con los sujetos menores de 65 años.
Población pediátrica
Los sujetos pediátricos con psoriasis (de 6 a menos de 18 años de edad) recibieron ixekizumab con el régimen de dosificación pediátrica recomendado durante 12 semanas. Los sujetos con un peso >50 kg y de 25 a 50 kg tuvieron una concentración media ±DE en estado estacionario de 3,8 ±2,2 mcg/mL y 3,9 ±2,4 mcg/mL en la semana 12, respectivamente. Hubo datos de PK limitados (n=2) en sujetos con un peso <25 kg en la semana 12.
Estudios de interacción medicamentosa
Los análisis de datos de PK poblacionales indicaron que el aclaramiento de ixekizumab no se vio afectado por la administración concomitante de metotrexato, ni por la exposición previa a metotrexato o adalimumab en pacientes con artritis psoriásica.
Los análisis de datos de PK poblacionales indicaron que el aclaramiento de ixekizumab no se vio afectado por la administración concomitante de corticosteroides orales, AINE o cDMARD (sulfasalazina y metotrexato) en pacientes con espondilitis anquilosante y espondiloartritis axial no radiográfica.
Sustratos del citocromo P450
No se observaron cambios clínicamente significativos en la exposición a cafeína (sustrato CYP1A2), warfarina (sustrato CYP2C9), omeprazol (sustrato CYP2C19) o midazolam (sustrato CYP3A) en sujetos con psoriasis en placas cuando se usaron concomitantemente con una dosis única de 160 mg de ixekizumab, o dosis múltiples de 80 mg cada 2 semanas. El efecto potencial de ixekizumab sobre la actividad de CYP2D6 no puede descartarse debido a la alta variabilidad en la exposición (aproximadamente ±2 veces) de dextrometorfano y su metabolito CYP2D6 dextrorfano en sujetos con psoriasis.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogenicidad, Mutagénesis, Deterioro de la Fertilidad
No se han realizado estudios en animales para evaluar el potencial carcinogénico o mutagénico de TALTZ. Además, la literatura publicada presenta resultados contradictorios sobre los posibles efectos en el riesgo de malignidad debido a la inhibición de la actividad de IL-17A, la acción farmacológica de TALTZ. Algunos estudios publicados sugieren que la IL-17A promueve directamente la invasión de células cancerosas, lo que sugiere un posible efecto beneficioso de TALTZ, mientras que otros informes indican que la IL-17A promueve el rechazo tumoral mediado por células T, lo que sugiere un posible efecto adverso de TALTZ. Sin embargo, la neutralización de IL-17A con TALTZ no se ha estudiado en estos modelos. La depleción de IL-17A con un anticuerpo neutralizante inhibió el desarrollo tumoral en ratones, lo que sugiere un posible efecto beneficioso de TALTZ. Se desconoce la relevancia de los hallazgos experimentales en modelos de ratón para el riesgo de malignidad en humanos.
No se observaron efectos sobre los parámetros de fertilidad, como los órganos reproductivos, la duración del ciclo menstrual o el análisis de esperma, en monos cynomolgus sexualmente maduros a los que se administró ixekizumab durante 13 semanas a una dosis subcutánea de 50 mg/kg/semana (19 veces la MRHD en base a mg/kg). Los monos no fueron apareados para evaluar la fertilidad.
14 ESTUDIOS CLÍNICOS
14.1 Psoriasis en placa en adultos
Tres ensayos multicéntricos, aleatorizados, doble ciego y controlados con placebo, Ensayos 1, 2 y 3 (NCT 01474512, NCT 01597245, NCT 01646177), reclutaron un total de 3866 sujetos de 18 años o más con psoriasis en placa que tenían una afectación de la superficie corporal mínima del 10%, una puntuación de Evaluación Global del Médico estática (sPGA) ≥3 en la evaluación general (grosor/induración de la placa, eritema y descamación) de la psoriasis en una escala de gravedad de 0 a 5, una puntuación del Índice de Área y Gravedad de la Psoriasis (PASI) ≥12, y que eran candidatos a fototerapia o terapia sistémica.
En los tres ensayos, los sujetos fueron aleatorizados a placebo o TALTZ (80 mg cada 2 semanas [Q2W]) durante 12 semanas, después de una dosis inicial de 160 mg. En los dos ensayos con comparador activo (Ensayos 2 y 3), los sujetos también fueron aleatorizados para recibir etanercept aprobado en EE. UU. 50 mg dos veces por semana durante 12 semanas.
Los tres ensayos evaluaron los cambios desde el inicio hasta la semana 12 en los dos criterios de valoración coprimarios: 1) PASI 75, la proporción de sujetos que lograron al menos una reducción del 75% en la puntuación compuesta de PASI que tiene en cuenta tanto el porcentaje de superficie corporal afectada como la naturaleza y gravedad de los cambios psoriásicos (induración, eritema y descamación) dentro de las regiones afectadas, y 2) sPGA de “0” (despejado) o “1” (mínimo), la proporción de sujetos con una sPGA 0 o 1 y al menos una mejora de 2 puntos.
Otros resultados evaluados incluyeron la proporción de sujetos con una puntuación sPGA de 0 (despejado), una reducción de al menos el 90% en PASI (PASI 90), una reducción del 100% en PASI (PASI 100) y una mejora de la gravedad del prurito medida por una reducción de al menos 4 puntos en una Escala Numérica de Calificación del Prurito de 11 puntos.
Los sujetos de todos los grupos de tratamiento tuvieron una puntuación PASI basal mediana que osciló entre aproximadamente 17 y 18. La puntuación sPGA basal fue grave o muy grave en el 51% de los sujetos del Ensayo 1, el 50% del Ensayo 2 y el 48% del Ensayo 3.
De todos los sujetos, el 44% había recibido fototerapia previa, el 49% había recibido terapia sistémica convencional previa y el 26% había recibido terapia biológica previa para el tratamiento de la psoriasis. De los sujetos que habían recibido terapia biológica previa, el 15% había recibido al menos un agente anti-TNF alfa y el 9% había recibido un anti-IL 12/IL23. Un total del 23% de los sujetos del estudio tenían antecedentes de artritis psoriásica.
Respuesta clínica en la semana 12
Los resultados de los Ensayos 1, 2 y 3 se presentan en la Tabla 3.
|
a Abreviaturas: N = número de pacientes en la población por intención de tratar; NRI = Imputación de no respondedores. |
||||||
|
b En la semana 0, los sujetos recibieron 160 mg de TALTZ. |
||||||
|
c Criterios de valoración coprimarios. |
||||||
|
d NRS de picor (mejora ≥4) en sujetos con NRS de picor basal ≥4. El número de sujetos ITT con puntuación basal de NRS de picor ≥4 es el siguiente: Ensayo 1, TALTZ n=391, PBO n=374; Ensayo 2, TALTZ n=303, PBO n=135; Ensayo 3, TALTZ n=320, PBO n=158. |
||||||
| Ensayo 1 | Ensayo 2 | Ensayo 3 | ||||
| TALTZ 80 mgb Q2W (N=433) n (%) |
Placebo (N=431) n (%) |
TALTZ 80 mgb Q2W (N=351) n (%) |
Placebo (N=168) n (%) |
TALTZ 80 mgb Q2W (N=385) n (%) |
Placebo (N=193) n (%) |
|
| sPGA de “0” (despejado) o “1” (mínimo)c | 354 (82) | 14 (3) | 292 (83) | 4 (2) | 310 (81) | 13 (7) |
| sPGA de “0” (limpio) | 160 (37) | 0 | 147 (42) | 1 (1) | 155 (40) | 0 |
| PASI 75c | 386 (89) | 17 (4) | 315 (90) | 4 (2) | 336 (87) | 14 (7) |
| PASI 90 | 307 (71) | 2 (1) | 248 (71) | 1 (1) | 262 (68) | 6 (3) |
| PASI 100 | 153 (35) | 0 | 142 (40) | 1 (1) | 145 (38) | 0 |
| Picor NRS (≥4 puntos de mejora)d | 336 (86) | 58 (16) | 258 (85) | 19 (14) | 264 (83) | 33 (21) |
El análisis de la edad, el sexo, la raza, el peso corporal y el tratamiento previo con un biológico no identificó diferencias en la respuesta a TALTZ entre estos subgrupos en la semana 12.
Un análisis integrado de los sitios de EE. UU. en los dos estudios con comparador activo que utilizaron etanercept aprobado en EE. UU., TALTZ demostró superioridad al etanercept aprobado en EE. UU. (50 mg dos veces por semana) en las puntuaciones sPGA y PASI durante el período de tratamiento de 12 semanas. Las tasas de respuesta respectivas para TALTZ 80 mg Q2W y etanercept aprobado en EE. UU. 50 mg dos veces por semana fueron: sPGA de 0 o 1 (73% y 27%); PASI 75 (87% y 41%); sPGA de 0 (34% y 5%); PASI 90 (64% y 18%), y PASI 100 (34% y 4%).
Mantenimiento y durabilidad de la respuesta
Para evaluar el mantenimiento y la durabilidad de la respuesta, los sujetos asignados originalmente al azar a TALTZ y que fueron respondedores en la semana 12 (es decir, sPGA de 0 o 1) en el Ensayo 1 y el Ensayo 2 fueron reasignados al azar a 48 semanas adicionales de una dosis de mantenimiento de TALTZ 80 mg Q4W (cada 4 semanas) o placebo. Los no respondedores (sPGA >1) en la semana 12 y los sujetos que recayeron (sPGA ≥3) durante el período de mantenimiento recibieron TALTZ 80 mg Q4W.
Para los respondedores en la semana 12, el porcentaje de sujetos que mantuvieron esta respuesta (sPGA 0 o 1) en la semana 60 (48 semanas después de la reasignación al azar) en los ensayos integrados (Ensayo 1 y Ensayo 2) fue mayor para los sujetos tratados con TALTZ 80 mg Q4W (75%) en comparación con los tratados con placebo (7%).
Para los respondedores en la semana 12 que fueron reasignados al azar a la suspensión del tratamiento (es decir, placebo), el tiempo medio hasta la recaída (sPGA ≥3) fue de 164 días en los ensayos integrados. Entre estos sujetos, el 66% recuperó una respuesta de al menos 0 o 1 en la sPGA dentro de las 12 semanas de reiniciar el tratamiento con TALTZ 80 mg Q4W.
Psoriasis que afecta la zona genital
Se realizó un ensayo aleatorizado, doble ciego, controlado con placebo (Ensayo 4) en 149 sujetos adultos con psoriasis en placas que tenían una afectación de la superficie corporal (ASC) mínima del 1%, una puntuación sPGA de ≥3 (psoriasis moderada), una puntuación sPGA de Genitales de ≥3 (psoriasis moderada que afecta la zona genital), que no respondieron o fueron intolerantes a al menos un tratamiento tópico utilizado para el tratamiento de la psoriasis que afecta la zona genital, y que eran candidatos a fototerapia y/o terapia sistémica.
Los sujetos tuvieron una puntuación PASI basal mediana de aproximadamente 12. La afectación de la ASC basal fue de al menos el 10% para aproximadamente el 60% de los sujetos reclutados. La puntuación sPGA basal de Genitales fue grave o muy grave en aproximadamente el 42% de los sujetos; la puntuación sPGA basal fue grave o muy grave en aproximadamente el 47% de los sujetos.
Los sujetos asignados al azar a TALTZ recibieron una dosis inicial de 160 mg seguida de 80 mg cada 2 semanas durante 12 semanas. El ensayo evaluó el criterio principal de valoración de la proporción de sujetos que lograron una respuesta “0” (clara) o “1” (mínima) en la semana 12 en la sPGA de Genitales. Otros resultados evaluados en la semana 12 incluyeron la proporción de sujetos que lograron una puntuación sPGA de “0” (clara) o “1” (mínima), la mejora de la gravedad del prurito genital medida por una reducción de al menos 4 puntos en la escala numérica de calificación (NRS) de la puntuación de la Escala de síntomas de psoriasis genital (GPSS) de 11 puntos, y el impacto percibido por el paciente de la psoriasis que afecta la zona genital en la limitación de la frecuencia de la actividad sexual (relaciones sexuales u otras actividades) medido por el cuestionario de frecuencia sexual de la psoriasis genital (GenPs-SFQ) ítem 2 (En la última semana, ¿con qué frecuencia su psoriasis genital limitó la frecuencia de su actividad sexual?). La puntuación del ítem 2 del SFQ oscila entre 0 y 4 (0=nunca, 1=rara vez, 2=a veces, 3=a menudo, 4=siempre); donde las puntuaciones más altas indican mayores limitaciones en la frecuencia de la actividad sexual en la última semana.
Los resultados del Ensayo 4 se presentan en la Tabla 4.
|
a Abreviaturas: ICN = Imputación de no respondedores; GPSS = Escala de síntomas de psoriasis genital; GenPs-SFQ = Cuestionario de frecuencia sexual de la psoriasis genital. |
||||||
|
b En la semana 0, los sujetos recibieron 160 mg de TALTZ, seguidos de 80 mg cada 2 semanas durante 12 semanas. |
||||||
| Criterios de valoración | TALTZ 80 mg Q2Wb n (%) |
Placebo n (%) |
||||
| Número de sujetos aleatorizados | N=75 | N=74 | ||||
| sPGA de Genitales “0” (clara) o “1” (mínima) | 55 (73%) | 6 (8%) | ||||
| sPGA “0” (clara) o “1” (mínima) | 55 (73%) | 2 (3%) | ||||
| Número de sujetos con GPSS basala Puntuación NRS de picor ≥4 |
N=56 | N=51 | ||||
| Picor genital GPSS (≥4 puntos de mejora) | 31 (55%) | 3 (6%) |
| Número de sujetos con puntuación basal del ítem 2 de GenPs-SFQa ≥2 |
N=37 | N=42 |
| Puntuación del ítem 2 de GenPs-SFQ “0” (nunca) o “1” (raramente) | 29 (78%) | 9 (21%) |
14.2 Psoriasis en placa pediátrica
En un ensayo aleatorizado, doble ciego, multicéntrico y controlado con placebo (IXORA-Peds, NCT03073200) se inscribieron 171 sujetos pediátricos de 6 a menos de 18 años de edad, con psoriasis en placa de moderada a grave (según la definición de una puntuación sPGA ≥3, que afectaba ≥10% del área de la superficie corporal y una puntuación PASI ≥12) que eran candidatos a fototerapia o terapia sistémica o que no estaban adecuadamente controlados con terapia tópica.
Los sujetos se asignaron aleatoriamente a placebo o TALTZ con dosificación estratificada por peso.
- <25 kg: 40 mg en la semana 0 seguida de 20 mg Q4S
- 25 kg a 50 kg: 80 mg en la semana 0 seguida de 40 mg Q4S
- >50 kg: 160 mg en la semana 0 seguida de 80 mg Q4S
La respuesta al tratamiento se evaluó a las 12 semanas de terapia y se definió por la proporción de sujetos que lograron una puntuación sPGA de “0” (clara) o “1” (casi clara) con al menos una mejora de 2 puntos desde el inicio y la proporción de sujetos que lograron una reducción en la puntuación PASI de al menos 75% (PASI 75) desde el inicio.
Otros resultados evaluados incluyeron la proporción de sujetos que lograron PASI 90, PASI 100, sPGA de “0” y una mejora de la gravedad del prurito medida por una reducción de al menos 4 puntos en una escala numérica de calificación del prurito de 11 puntos.
Los sujetos tuvieron una puntuación PASI basal mediana de 17 (rango 12-49). La puntuación sPGA basal fue grave o muy grave en el 49%. De todos los sujetos, el 22% había recibido fototerapia previa y el 32% había recibido terapia sistémica convencional previa para el tratamiento de la psoriasis.
Respuesta clínica
Los resultados de eficacia de IXORA-Peds se presentan en la Tabla 5.
|
a Abreviaturas: N = Número de sujetos en la población por intención de tratar; NRI = Imputación de no respondedores. |
||
|
b En la semana 0, los sujetos recibieron 160 mg, 80 mg o 40 mg de TALTZ, seguidos de 80 mg, 40 mg o 20 mg cada 4 semanas, según la categoría de peso, durante 12 semanas. |
||
|
c Variables principales coprimaria. |
||
|
d NRS de picor (mejora ≥4) en sujetos con NRS de picor basal ≥4. El número de sujetos ITT con puntuación basal de NRS de picor ≥4 es el siguiente: TALTZ, n = 83; PBO, n = 40. |
||
| TALTZb (N=115) n (%) |
Placebo (N=56) n (%) |
|
| Semana 12 | ||
| sPGA “0” (clara) o “1” (mínima)c | 93 (81%) | 6 (11%) |
| sPGA “0” (clara) | 60 (52%) | 1 (2%) |
| PASI 75c | 102 (89%) | 14 (25%) |
| PASI 90 | 90 (78%) | 3 (5%) |
| PASI 100 | 57 (50%) | 1 (2%) |
| NRS de picor (mejora ≥4 puntos)d | 59 (71%) | 8 (20%) |
| Semana 4 | ||
| sPGA “0” (clara) o “1” (mínima) | 55 (48%) | 4 (7%) |
| PASI 75 | 62 (54%) | 5 (9%) |
14.3 Artritis Psoriásica
La seguridad y eficacia de TALTZ se evaluaron en 679 pacientes, en 2 estudios aleatorizados, doble ciego, controlados con placebo (PsA1 y PsA2) en pacientes adultos, de 18 años o mayores con artritis psoriásica activa (al menos 3 articulaciones inflamadas y al menos 3 articulaciones dolorosas) a pesar del tratamiento con fármacos antiinflamatorios no esteroideos (AINE), corticosteroides o fármacos antirreumáticos modificadores de la enfermedad (DMARD). Los pacientes de estos estudios tenían un diagnóstico de artritis psoriásica durante al menos 6 meses en ambos estudios. Al inicio del estudio, el 60% y el 23% de los pacientes tenían entesitis y dactilitis, respectivamente. En PsA2, todos los pacientes interrumpieron el tratamiento previo con agentes anti-TNFα debido a una respuesta inadecuada o intolerancia. Además, aproximadamente el 47% de los pacientes de ambos estudios recibieron metotrexato (MTX) de forma concomitante.
El estudio PsA1 (NCT 01695239) evaluó a 417 pacientes naive a biológicos, que fueron tratados con TALTZ 160 mg en la semana 0 seguido de 80 mg cada 2 semanas (Q2W) o 4 semanas (Q4W), adalimumab 40 mg cada 2 semanas o placebo. El estudio PsA2 (NCT 02349295) evaluó a 363 pacientes con experiencia en anti-TNFα, que fueron tratados con TALTZ 160 mg en la semana 0 seguido de 80 mg cada 2 o 4 semanas, o placebo. Los pacientes que recibieron placebo fueron re-aleatorizados para recibir TALTZ (80 mg cada 2 o 4 semanas) en la semana 16 o semana 24 según el estado de respuesta. El criterio principal de valoración fue el porcentaje de pacientes que lograron una respuesta ACR20 en la semana 24.
Respuesta Clínica
En ambos estudios, los pacientes tratados con TALTZ 80 mg Q4W demostraron una mayor respuesta clínica, incluyendo ACR20, ACR50 y ACR70 en comparación con placebo en la semana 24 (Tabla 6). En PsA2, se observaron respuestas independientemente de la exposición previa a anti-TNFα.
|
a Los pacientes que cumplieron los criterios de escape (menos del 20% de mejora en el recuento de articulaciones dolorosas e inflamadas) en la semana 16 o que tenían datos faltantes en la semana 24 se consideraron no respondedores en la semana 24. |
||||||
|
b Abreviaturas: N = número de pacientes en la población por intención de tratar; NRI = Imputación de no respondedores. |
||||||
|
c En la semana 0, los pacientes recibieron 160 mg de TALTZ. |
||||||
| PsA1 – naive a anti-TNFα | PsA2 – con experiencia en anti-TNFα | |||||
| TALTZ 80 mgc Q4W (N=107) |
Placebo (N=106) | Diferencia respecto al placebo (IC del 95%) | TALTZ 80 mgc Q4W (N=122) |
Placebo (N=118) | Diferencia respecto al placebo (IC del 95%) | |
| Respuesta ACR20 | ||||||
| Semana 12 (%) | 57 | 31 | 26 (13, 39) | 50 | 22 | 28 (16, 40) |
| Semana 24 (%) | 58 | 30 | 28 (15, 41) | 53 | 20 | 34 (22, 45) |
| Respuesta ACR50 | ||||||
| Semana 12 (%) | 34 | 5 | 29 (19, 39) | 31 | 3 | 28 (19, 37) |
| Semana 24 (%) | 40 | 15 | 25 (14, 37) | 35 | 5 | 30 (21, 40) |
| Respuesta ACR70 | ||||||
| Semana 12 (%) | 15 | 0 | 15 (8, 22) | 15 | 2 | 13 (6, 20) |
| Semana 24 (%) | 23 | 6 | 18 (9, 27) | 22 | 0 | 22 (15, 30) |
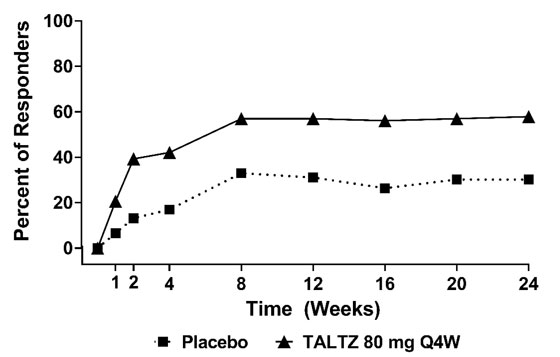
El porcentaje de pacientes que lograron una respuesta ACR20 por visita se muestra en la Figura 1.
Figura 1: Porcentaje de pacientes que lograron una respuesta ACR20a
en PsA1 hasta la semana 24
a Los pacientes que cumplieron con los criterios de escape (menos del 20% de mejora en el recuento de articulaciones dolorosas e inflamadas) en la semana 16 o que tenían datos faltantes en la semana 24 se consideraron no respondedores en la semana 24.
Las mejoras en los componentes de los criterios de respuesta ACR se muestran en la Tabla 7.
|
a En la semana 0, los sujetos recibieron 160 mg de TALTZ. |
||||||
|
b Índice de discapacidad del cuestionario de evaluación de la salud; 0 = mejor, 3 = peor, mide la capacidad del paciente para realizar lo siguiente: vestirse/arreglarse, levantarse, comer, caminar, alcanzar, agarrar, mantener la higiene y mantener la actividad diaria. |
||||||
| PsA1 | PsA2 | |||||
| TALTZ 80 mga Q4W (N=107) |
Placebo (N=106) |
TALTZ 80 mga Q4W (N=122) |
Placebo (N=118) |
|||
| Número de articulaciones inflamadas | ||||||
| Valor inicial | 11.4 | 10.6 | 13.1 | 10.3 | ||
| Cambio medio en la semana 12 | -6.2 | -3.2 | -5.8 | -2.6 | ||
| Cambio medio en la semana 16 | -6.2 | -3.0 | -7.4 | -2.6 | ||
| Número de articulaciones dolorosas | ||||||
| Valor inicial | 20.5 | 19.2 | 22.0 | 23.0 | ||
| Cambio medio en la semana 12 | -10.3 | -3.5 | -9.4 | -5.4 | ||
| Cambio medio en la semana 16 | -9.7 | -4.0 | -10.1 | -3.0 | ||
| Evaluación del dolor por el paciente | ||||||
| Valor inicial | 60.1 | 58.5 | 63.9 | 63.9 | ||
| Cambio medio en la semana 12 | -26.6 | -9.1 | -29.8 | -11.9 | ||
| Cambio medio en la semana 16 | -26.1 | -10.6 | -30.1 | -12.3 |
| Evaluación Global del Paciente | ||||
| Valor basal | 62.7 | 61.1 | 66.4 | 64.1 |
| Cambio medio en la semana 12 | -29.7 | -11.1 | -34.5 | -10.7 |
| Cambio medio en la semana 16 | -30.4 | -13.2 | -35.3 | -15.7 |
| Evaluación Global del Médico | ||||
| Valor basal | 57.6 | 55.9 | 60.3 | 58.9 |
| Cambio medio en la semana 12 | -34.0 | -16.6 | -34.4 | -15.9 |
| Cambio medio en la semana 16 | -35.5 | -16.5 | -32.9 | -9.7 |
| Índice de Discapacidad (HAQ-DI)b | ||||
| Valor basal | 1.2 | 1.2 | 1.2 | 1.2 |
| Cambio medio en la semana 12 | -0.4 | -0.1 | -0.4 | -0.1 |
| Cambio medio en la semana 16 | -0.4 | -0.1 | -0.5 | -0.1 |
| PCR (mg/L) | ||||
| Valor basal | 12.8 | 15.1 | 17.0 | 12.1 |
| Cambio medio en la semana 12 | -8.8 | -3.2 | -11.4 | -4.3 |
| Cambio medio en la semana 16 | -9.3 | -3.2 | -11.2 | -5.9 |
El tratamiento con TALTZ produjo una mejoría en la dactilitis y la entesitis en pacientes con dactilitis o entesitis preexistentes.
El tratamiento con TALTZ 80 mg cada 4 semanas produjo una mejoría en las lesiones cutáneas psoriásicas en pacientes con Artritis Psoriásica.
Respuesta radiográfica
Los cambios radiográficos se evaluaron en PsA1. La inhibición de la progresión del daño estructural se evaluó radiográficamente y se expresó como el cambio en la puntuación Sharp total modificada (mTSS) en la semana 16, en comparación con la basal. La puntuación Sharp total se modificó para la artritis psoriásica mediante la adición de las articulaciones interfalángicas distales (IFD) de la mano.
TALTZ 80 mg cada 4 semanas inhibió la progresión del daño articular estructural (mTSS) en comparación con el placebo en la semana 16. El cambio medio ajustado desde la basal en la mTSS fue de 0,13 para TALTZ 80 mg cada 4 semanas y de 0,36 para el placebo (diferencia de medias TALTZ menos placebo: -0,23, IC del 95 %: (-0,42, -0,04)).
Función física
Los pacientes tratados con TALTZ mostraron una mejoría en la función física en comparación con los pacientes tratados con placebo, según lo evaluado por el Índice de Discapacidad del Cuestionario de Evaluación de la Salud (HAQ-DI) en la semana 12 y 24. En ambos estudios, la proporción de respondedores HAQ-DI (mejora ≥0,35 en la puntuación HAQ-DI) fue mayor en los grupos de TALTZ 80 mg cada 4 semanas en comparación con el placebo en la semana 12 y 24.
Otros resultados relacionados con la salud
El estado general de salud se evaluó mediante la encuesta de salud de forma corta (SF-36). En la semana 12 en PsA1 y PsA2, los pacientes tratados con TALTZ mostraron una mayor mejoría desde la basal en la puntuación del resumen del componente físico (PCS) del SF-36 en comparación con los pacientes tratados con placebo, pero esta mejoría no fue consistente en ambos estudios para la puntuación del resumen del componente mental (MCS) del SF-36. En la semana 12, hubo evidencia consistente de efecto en los dominios de funcionamiento físico, función física, dolor corporal y salud general, pero no en los dominios de funcionamiento social, función emocional, vitalidad y salud mental.
14.4 Espondilitis anquilosante
La seguridad y la eficacia de TALTZ se evaluaron en 567 pacientes, en 2 estudios aleatorizados, doble ciego, controlados con placebo (AS1 y AS2) en pacientes adultos, de 18 años o más con espondilitis anquilosante activa. Los pacientes tenían enfermedad activa, según la definición del Índice de Actividad de la Enfermedad de Espondilitis Anquilosante de Bath (BASDAI) ≥4 a pesar del tratamiento con fármacos antiinflamatorios no esteroideos (AINE), corticosteroides o fármacos antirreumáticos modificadores de la enfermedad (DMARD). Al inicio del estudio, los pacientes habían presentado síntomas de EA durante un promedio de 17 años en ambos estudios. Al inicio del estudio, aproximadamente el 32% de los pacientes recibían un cDMARD concomitante. En AS2, todos los pacientes interrumpieron el tratamiento previo con 1 o 2 inhibidores del TNF debido a una respuesta inadecuada o intolerancia.
El estudio AS1 (NCT 02696785) evaluó a 341 pacientes sin tratamiento biológico previo, que fueron tratados con TALTZ 80 mg o 160 mg en la semana 0, seguidos de 80 mg cada 2 semanas (Q2W) o 4 semanas (Q4W), adalimumab 40 mg cada 2 semanas o con placebo. Los pacientes que recibieron placebo fueron re-aleatorizados en la semana 16 para recibir TALTZ (dosis inicial de 160 mg, seguida de 80 mg Q2W o Q4W). Los pacientes que recibieron adalimumab fueron re-aleatorizados en la semana 16 para recibir TALTZ (80 mg Q2W o Q4W). El estudio AS2 (NCT 02696798) evaluó a 316 pacientes con experiencia en inhibidores del TNF (el 90% fueron respondedores inadecuados y el 10% fueron intolerantes a los inhibidores del TNF). Todos los pacientes fueron tratados con TALTZ 80 o 160 mg en la semana 0, seguidos de 80 mg Q2W o Q4W, o con placebo. Los pacientes que recibieron placebo fueron re-aleatorizados en la semana 16 para recibir TALTZ (dosis inicial de 160 mg, seguida de 80 mg Q2W o Q4W). El criterio principal de valoración en ambos estudios fue el porcentaje de pacientes que lograron una respuesta Assessment of Spondyloarthritis International Society 40 (ASAS40) en la semana 16.
Respuesta clínica
En ambos estudios, los pacientes tratados con TALTZ 80 mg cada 4 semanas demostraron mayores mejoras en las respuestas ASAS40 y ASAS20 en comparación con el placebo en la semana 16 (Tabla 8). Se observaron respuestas independientemente de las terapias concomitantes. En AS2, se observaron respuestas independientemente de la exposición previa al inhibidor del TNF.
|
a Abreviaturas: N = número de pacientes en la población por intención de tratar; NRI = Imputación de no respondedores. |
||||||
|
b Los pacientes con datos faltantes se contaron como no respondedores. |
||||||
|
c En la semana 0, los pacientes recibieron 80 mg o 160 mg de TALTZ. |
||||||
|
d Una respuesta ASAS20 se define como una mejora ≥20% y una mejora absoluta desde la basal de ≥1 unidad (rango 0 a 10) en ≥3 de 4 dominios (Global del paciente, Dolor espinal, Función e Inflamación), y sin empeoramiento de ≥20% y ≥1 unidad (rango 0 a 10) en el dominio restante. Una respuesta ASAS40 se define como una mejora ≥40% y una mejora absoluta desde la basal de ≥2 unidades en ≥3 de 4 dominios sin ningún empeoramiento en el dominio restante. |
||||||
|
e Criterio principal de valoración. |
||||||
| AS1 – biologic-naive | AS2 – TNF-inhibitor experienced | |||||
| TALTZ 80 mg Q4Wc (N=81) |
Placebo (N=87) | Difference from placebo (95% CI) | TALTZ 80 mg Q4Wc (N=114) |
Placebo (N=104) | Difference from placebo (95% CI) | |
| Respuesta ASAS20d, % | 64 | 40 | 24 (9, 39) | 48 | 30 | 18 (6, 31) |
| Respuesta ASAS40d,e, % | 48 | 18 | 30 (16, 43) | 25 | 13 | 13 (3, 23) |
El porcentaje de pacientes que lograron una respuesta ASAS40 por visita en AS1 se muestra en la Figura 2.
Figura 2: Respuesta ASAS40 hasta la semana 16, NRIa
a Los pacientes con datos faltantes se contaron como no respondedores.
La mejora en los componentes principales de los criterios de respuesta ASAS40 y otras medidas de la actividad de la enfermedad se muestran en la Tabla 9.
|
a Abreviaturas: ASDAS = Puntuación de actividad de la enfermedad de la espondilitis anquilosante; BASDAI = Índice de actividad de la enfermedad de la espondilitis anquilosante de Bath; BASFI = Índice funcional de la espondilitis anquilosante de Bath; BASMI = Índice de metrología de la espondilitis anquilosante de Bath; hsCRP = Proteína C reactiva de alta sensibilidad. |
||||||
|
b Los cambios medios son los cambios medios de mínimos cuadrados desde el inicio en la semana 16. |
||||||
|
c En la semana 0, los pacientes recibieron 80 o 160 mg de TALTZ. |
||||||
|
d La inflamación es la media de las autoevaluaciones de rigidez informadas por el paciente (preguntas 5 y 6) en BASDAI. |
||||||
| AS1 – ingenuo a biológicos | AS2 – con experiencia en inhibidores del TNF | |||||
| TALTZ 80 mg Q4Sc (N=81) |
Placebo (N=87) |
TALTZ 80 mg Q4Sc (N=114) |
Placebo (N=104) |
|||
| Componentes ASAS | ||||||
| Evaluación global del paciente (0-10) | ||||||
| Valor inicial | 6.9 | 7.1 | 8.0 | 7.8 | ||
| Cambio medio desde el valor inicial | -2.5 | -1.4 | -2.4 | -0.7 | ||
| Dolor espinal total (0-10) | ||||||
| Valor inicial | 7.2 | 7.4 | 7.9 | 7.8 | ||
| Cambio medio desde el valor inicial | -3.2 | -1.7 | -2.4 | -1.0 | ||
| BASFI (0-10) | ||||||
| Valor inicial | 6.1 | 6.4 | 7.4 | 7.0 | ||
| Cambio medio desde el valor inicial | -2.4 | -1.2 | -1.7 | -0.6 | ||
| Inflamación (0-10)d | ||||||
| Valor inicial | 6.5 | 6.8 | 7.2 | 7.2 | ||
| Cambio medio desde el valor inicial | -3.2 | -1.3 | -2.4 | -0.7 | ||
| Otras medidas de la actividad de la enfermedad | ||||||
| Puntuación BASDAI | ||||||
| Valor inicial | 6.8 | 6.8 | 7.5 | 7.3 |
| Cambio medio respecto al valor inicial | -2.9 | -1.4 | -2.2 | -0.9 |
| BASMI | ||||
| Valor inicial | 3.9 | 4.5 | 4.7 | 4.9 |
| Cambio medio respecto al valor inicial | -0.5 | -0.1 | -0.3 | -0.0 |
| hsCRP (mg/L) | ||||
| Valor inicial | 12.2 | 16.0 | 20.2 | 16.0 |
| Cambio medio respecto al valor inicial | -5.2 | 1.4 | -11.1 | 9.7 |
Resultados relacionados con la salud
El estado general de salud y la calidad de vida se evaluaron mediante la encuesta de salud de forma breve (SF-36). En la semana 16, en AS1 y AS2, en comparación con el placebo, los pacientes tratados con TALTZ mostraron una mayor mejoría desde el inicio en la puntuación del resumen del componente físico (PCS) del SF-36 y en los dominios de funcionamiento físico, función física, dolor corporal, vitalidad y salud general, sin mejoras consistentes en el resumen del componente mental (MCS), función social, función emocional y dominios de salud mental.
14.5 Espondiloartritis axial no radiográfica
La eficacia y la seguridad de TALTZ se evaluaron en un estudio aleatorizado, doble ciego, controlado con placebo de 52 semanas (nr-axSpA1) (NCT 02757352) en pacientes ≥18 años de edad con espondiloartritis axial activa durante al menos 3 meses. Los pacientes debieron haber tenido signos objetivos de inflamación indicados por una proteína C reactiva (PCR) elevada (definida como mayor de 5 mg/L), y/o sacroilitis en imágenes de resonancia magnética (IRM), y ninguna evidencia radiográfica definitiva de daño estructural en las articulaciones sacroilíacas. Los pacientes presentaron enfermedad activa según la definición del Índice de actividad de la enfermedad de la espondilitis anquilosante de Bath (BASDAI) ≥4, y dolor espinal ≥4 en una escala de calificación numérica (NRS) de 0 a 10. Los pacientes debieron haber sido intolerantes o haber tenido una respuesta inadecuada a al menos dos AINE. Los pacientes fueron tratados con placebo o TALTZ 80 mg o 160 mg en la semana 0, seguido de 80 mg cada 2 semanas (Q2W) u 80 mg cada 4 semanas (Q4W). Se permitió el inicio y/o el ajuste de la dosis de medicamentos concomitantes (AINE, cDMARD, corticosteroides, analgésicos) a partir de la semana 16. Se permitió a los pacientes la transición al uso de TALTZ 80 mg Q2W abierto a partir de la semana 16 hasta la semana 44 a discreción del investigador.
Al inicio del estudio, los pacientes presentaron síntomas de nr-axSpA durante un promedio de 11 años. Aproximadamente el 39% de los pacientes recibieron un cDMARD concomitante.
El criterio de valoración principal fue el porcentaje de pacientes que lograron una respuesta Assessment of Spondyloarthritis International Society 40 (ASAS40) en la semana 52. La respuesta ASAS40 también se evaluó en la semana 16 como un criterio de valoración secundario principal.
Respuesta clínica
Tanto en las semanas 16 como en la 52, una mayor proporción de pacientes tratados con TALTZ 80 mg Q4W tuvieron una respuesta ASAS40 en comparación con los pacientes tratados con placebo (Tabla 10). Los componentes de los criterios de respuesta ASAS y la PCR se muestran en la Tabla 11.
|
a Abreviaturas: N = número de pacientes en la población por intención de tratar; NRI = Imputación de no respondedores. |
||||||
|
b Los pacientes que iniciaron TALTZ 80 mg Q2W abierto, o interrumpieron el tratamiento aleatorizado inicialmente y permanecieron en el estudio, o que no tenían datos de la semana 16 o la semana 52 se contaron como no respondedores. |
||||||
|
c A partir de la semana 16 y hasta la semana 44, los pacientes que los investigadores determinaron que eran respondedores inadecuados tuvieron la opción de realizar cambios en su terapia de fondo y/o pasar a TALTZ 80 mg Q2W abierto. |
||||||
|
d En la semana 0, los pacientes recibieron 80 mg o 160 mg de TALTZ. |
||||||
|
e Una respuesta ASAS40 se define como una mejoría ≥40% y una mejoría absoluta desde el inicio del estudio de ≥2 unidades en ≥3 de 4 dominios sin ningún empeoramiento en el dominio restante. |
||||||
| Semana 16 | Semana 52 | |||||
| TALTZ 80 mg Q4Wc,d (N=96) |
Placebo (N=105) | Diferencia con placebo (IC del 95%) | TALTZ 80 mg Q4Wc,d (N=96) |
Placebo (N=105) | Diferencia con placebo (IC del 95%) | |
| Respuesta ASAS40e, % | 35.4 | 19.0 | 16.4 (4.2, 28.5) | 30.2 | 13.3 | 16.9 (5.6, 28.1) |
La mejora en los componentes principales de los criterios de respuesta ASAS40 y otras medidas de la actividad de la enfermedad en la semana 16 se muestran en la Tabla 11.
|
a Abreviaturas: BASDAI = Índice de actividad de la enfermedad de la espondilitis anquilosante de Bath; BASFI = Índice funcional de la espondilitis anquilosante de Bath; BASMI = Índice de metrología de la espondilitis anquilosante de Bath; hsCRP = Proteína C reactiva de alta sensibilidad; NRI = Imputación de no respondedores. |
||
|
b En la semana 0, los pacientes recibieron 80 o 160 mg de TALTZ. |
||
|
c Los cambios medios son los cambios medios de mínimos cuadrados desde el inicio en la semana 16 utilizando un modelo mixto para medidas repetidas, ajustando para el grupo de tratamiento, la clasificación de RMN/CRP de cribado, la visita, la línea de base continua, la interacción de la visita con el tratamiento, la interacción de la línea de base continua con la visita. |
||
|
d La inflamación es la media de las autoevaluaciones de rigidez informadas por el paciente (preguntas 5 y 6) en el cuestionario BASDAI. |
||
| TALTZ 80 mg Q4Sb (N=96) |
Placebo (N=105) |
|
| Componentes ASAS | ||
| Evaluación global del paciente (0-10) | ||
| Línea de base | 7.1 | 7.4 |
| Cambio medio desde la línea de basec | -2.3 | -1.3 |
| Dolor espinal total (0-10) | ||
| Línea de base | 7.3 | 7.4 |
| Cambio medio desde la línea de basec | -2.4 | -1.5 |
| BASFI (0-10) | ||
| Línea de base | 6.4 | 6.7 |
| Cambio medio desde la línea de basec | -2.0 | -1.3 |
| Inflamación (0-10)d | ||
| Línea de base | 6.8 | 7.0 |
| Cambio medio desde la línea de basec | -2.5 | -1.5 |
| Otras medidas de la actividad de la enfermedad | ||
| Puntuación BASDAI (0-10) | ||
| Línea de base | 7.0 | 7.2 |
| Cambio medio desde la línea de basec | -2.2 | -1.5 |
| BASMI (0-10) | ||
| Línea de base | 3.2 | 3.2 |
| Cambio medio desde la línea de basec | -0.4 | -0.2 |
| hsCRP (mg/L) | ||
| Línea de base | 12.4 | 14.3 |
| Cambio medio desde la línea de basec | -8.0 | -3.0 |
El porcentaje de pacientes que lograron respuestas ASAS40 por visita se muestra en la Figura 3.
Figura 3: Respuestas ASAS40 hasta la semana 16, NRIa
a Los pacientes con datos faltantes se contaron como no respondedores.
Resultados relacionados con la salud
El estado general de salud y la calidad de vida se evaluaron mediante la encuesta de salud de forma corta (SF-36). En la semana 16, en comparación con el placebo, los pacientes con axSpA nr tratados con TALTZ 80 mg Q4W mostraron una mayor mejoría desde el inicio en la puntuación del resumen del componente físico (PCS) del SF-36 y en los dominios de funcionamiento físico, dolor corporal, vitalidad y funcionamiento social, sin mejoras consistentes en el resumen del componente mental (MCS), función física, salud general, función emocional y dominios de salud mental.
16 SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Presentación
La inyección de TALTZ es una solución estéril, sin conservantes, transparente e incolora a ligeramente amarilla, disponible en:
- un autoinyector prellenado de dosis única o una jeringa prellenada de dosis única para administrar 80 mg de ixekizumab.
- una jeringa prellenada de dosis única para administrar 40 mg de ixekizumab.
- una jeringa prellenada de dosis única para administrar 20 mg de ixekizumab.
TALTZ se presenta como:
| Tamaño del envase | Código NDC | |
| Autoinyector | ||
| Caja de 1 | 0002-1445-11 | |
| Dosis única de 80 mg | Caja de 2 | 0002-1445-27 |
| Caja de 3 | 0002-1445-09 | |
| Jeringa prellenada | ||
| Dosis única de 80 mg | Caja de 1 | 0002-7724-11 |
| Dosis única de 40 mg | Caja de 1 | 0002-8905-11 |
| Dosis única de 20 mg | Caja de 1 | 0002-8900-11 |
Almacenamiento y manipulación
TALTZ es estéril y no contiene conservantes. Deseche cualquier porción no utilizada.
- TALTZ debe protegerse de la luz hasta su uso.
- Conservar refrigerado a 2°C a 8°C (36°F a 46°F).
- Si es necesario, los pacientes/cuidadores pueden almacenar TALTZ a temperatura ambiente hasta 30°C (86°F) durante un máximo de 5 días en la caja original para protegerlo de la luz. Una vez que TALTZ se haya almacenado a temperatura ambiente, no lo vuelva a refrigerar y deséchelo, si no se usa, dentro de los 5 días.
- Anote la fecha en que TALTZ se retira por primera vez del refrigerador en los espacios provistos en la caja.
- Para el envase de 2 o 3 autoinyectores, retire un autoinyector a la vez, dejando el(los) autoinyector(es) restante(s) en la caja original en el refrigerador. Asegúrese de que el TALTZ no refrigerado esté protegido de la luz.
- No congelar. No use TALTZ si se ha congelado.
- No agitar.
- Deseche el autoinyector o la jeringa de dosis única de TALTZ después de su uso en un recipiente resistente a las perforaciones.
- No fabricado con látex de caucho natural.
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
Aconseje al paciente y/o cuidador que lean el etiquetado del paciente aprobado por la FDA (Guía de medicamentos e Instrucciones de uso) antes de que el paciente comience a usar TALTZ, y cada vez que se renueve la receta, ya que puede haber nueva información que necesiten saber.
Instrucciones de autoadministración: Proporcione orientación a los pacientes y cuidadores sobre la técnica correcta de inyección subcutánea, incluyendo la técnica aséptica, y cómo usar correctamente el autoinyector o la jeringa precargada [ver Instrucciones de uso].
Infección: Informe a los pacientes que TALTZ puede disminuir la capacidad de su sistema inmunitario para combatir infecciones, y que pueden producirse infecciones graves, incluidas infecciones oportunistas, con el uso de TALTZ. Indique a los pacientes la importancia de comunicar cualquier antecedente de infecciones al proveedor de atención médica y de ponerse en contacto con su proveedor de atención médica si desarrollan algún síntoma de infección [ver Advertencias y precauciones (5.1)].
Reacciones alérgicas: Aconseje a los pacientes que busquen atención médica inmediata si experimentan algún síntoma de reacciones de hipersensibilidad graves [ver Advertencias y precauciones (5.3)].
Erupciones eczematosas: Informe a los pacientes que pueden producirse reacciones cutáneas similares al eccema con el uso de TALTZ. Indique a los pacientes que busquen consejo médico si desarrollan signos o síntomas de eccema [ver Advertencias y precauciones (5.4)].
Embarazo: Avise a las pacientes de que existe un registro de exposición al embarazo que monitoriza los resultados del embarazo en mujeres expuestas a TALTZ durante el embarazo. Aconseje a las pacientes que se pongan en contacto con el registro en el 1-800-284-1695 para inscribirse [ver Uso en poblaciones específicas (8.1)].
Eli Lilly and Company, Indianápolis, IN 46285, EE. UU.
Número de licencia de EE. UU. 1891
Copyright © 2016, 2024, Eli Lilly and Company. Todos los derechos reservados.
TAL-0016-USPI-20240820
Guía de medicación
|
Esta Guía de Medicamentos ha sido aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos. |
Revisado: 08/2024 |
|
| Guía de Medicamentos TALTZ® (tolts) (ixekizumab) inyección, para uso subcutáneo |
||
|
¿Cuál es la información más importante que debo saber sobre TALTZ?
|
||
Antes de comenzar con TALTZ, informe a su proveedor de atención médica si usted:
|
||
|
|
|
| Después de comenzar con TALTZ, llame a su proveedor de atención médica inmediatamente si tiene cualquiera de los síntomas de infección mencionados anteriormente. No use TALTZ si tiene algún síntoma de infección a menos que su proveedor de atención médica le indique lo contrario. Consulte “¿Cuáles son los posibles efectos secundarios de TALTZ?” para obtener más información sobre los efectos secundarios. |
||
| ¿Qué es TALTZ? TALTZ es un medicamento recetado utilizado para tratar:
|
||
| No se sabe si TALTZ es seguro y eficaz en niños para afecciones distintas de la psoriasis en placas o en niños menores de 6 años de edad. | ||
| No use TALTZ si ha tenido una reacción alérgica grave a ixekizumab o a cualquiera de los otros ingredientes de TALTZ. Consulte el final de esta Guía de Medicamentos para obtener una lista completa de los ingredientes de TALTZ. |
||
Antes de usar TALTZ, informe a su proveedor de atención médica sobre todas sus condiciones médicas, incluyendo si usted:
|
||
| Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, vitaminas y suplementos herbales. | ||
| ¿Cómo debo usar TALTZ? Consulte las instrucciones detalladas de uso que vienen con su TALTZ para obtener información sobre cómo preparar e inyectar una dosis de TALTZ y cómo desechar correctamente los autoinyectores y jeringas precargadas usadas de TALTZ.
|
||
Si usted o su hijo olvidan tomar una dosis de TALTZ:
|
||
|
¿Cuáles son los posibles efectos secundarios de TALTZ?
|
||
|
|
|
|
||
|
|
|
|
||
|
||
|
|
|
| Estos no son todos los posibles efectos secundarios de TALTZ. Informe a su proveedor de atención médica sobre cualquier efecto secundario que le moleste o que no desaparezca. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088. | ||
¿Cómo debo conservar TALTZ?
|
||
| Mantenga TALTZ y todos los medicamentos fuera del alcance de los niños. | ||
| Información general sobre el uso seguro y eficaz de TALTZ. A veces, los medicamentos se recetan para fines distintos de los que se indican en una Guía de medicamentos. No use TALTZ para una afección para la que no se lo recetaron. No le dé TALTZ a otras personas, incluso si tienen los mismos síntomas que usted. Podría causarles daño. Puede pedirle a su proveedor de atención médica o farmacéutico información sobre TALTZ que esté escrita para profesionales de la salud. |
||
| ¿Cuáles son los ingredientes de TALTZ? Ingrediente activo: ixekizumab Ingredientes inactivos: Polisorbato 80, Sucrosa y Agua para inyección. Se puede haber añadido hidróxido de sodio para ajustar el pH. No fabricado con látex de caucho natural. Para obtener más información sobre TALTZ, llame al 1-800-545-5979 (1-800-LillyRx) o visite el siguiente sitio web: www.taltz.com. TALTZ® (ixekizumab) inyección es una marca registrada de Eli Lilly and Company. |
||
TALTZ 80 mg Autoinyector
| INSTRUCCIONES DE USO |
| TALTZ® [tol-t-s] (ixekizumab) inyección, para uso subcutáneo Autoinyector |
| Estas Instrucciones de Uso contienen información sobre cómo inyectar TALTZ. |
 |
| Información importante que debe conocer antes de inyectar TALTZ |
|
|
|
|
|
|
| Paso 1b | Reúna los materiales necesarios para la inyección:
|
|
Paso 1c |
 Figura A Figura A |
Inspeccione el autoinyector.
No utilice el autoinyector y deséchelo según las indicaciones de su médico o farmacéutico si:
|
Paso 1d |
Lávese las manos con agua y jabón antes de inyectarse TALTZ. |
|
Paso 1e |
 Figura B Figura B |
Puede inyectarse en el área del estómago (abdomen) o en el muslo, o en la parte posterior del brazo (véase Figura B). Para inyectarse en el brazo, necesitará que alguien le ayude.
|
Paso 1f |
Prepare su piel. Limpie el sitio de inyección con una toallita con alcohol. Deje que el sitio de inyección se seque antes de inyectarse TALTZ. |
|
| Preguntas y respuestas frecuentes. | |
| P. | ¿Qué ocurre si veo burbujas en el autoinyector de TALTZ? |
| R. | Es normal que haya burbujas de aire en el autoinyector. |
| P. | ¿Qué ocurre si hay una gota de líquido en la punta de la aguja al retirar la tapa base? |
| R. | No hay problema si ve una gota de líquido en la punta de la aguja. |
| P. | ¿Qué ocurre si desbloqueo el autoinyector y presiono el botón verde de inyección antes de girar y quitar la tapa base? |
| R. | No retire la tapa base. Deseche el autoinyector y consiga uno nuevo. |
| P. | ¿Necesito mantener presionado el botón de inyección hasta que se complete la inyección? |
| R. | No es necesario mantener presionado el botón de inyección, pero puede ayudarle a mantener el autoinyector firme y estable contra la piel. |
| P. | ¿Qué ocurre si la aguja no se retrae después de la inyección o no estoy seguro de que el autoinyector haya funcionado correctamente? |
| R. | No toque la aguja ni vuelva a colocar la tapa base. Guarde el autoinyector en un lugar seguro (por ejemplo, un recipiente doméstico como se describe en “Desecho de TALTZ”) para evitar una punción accidental con la aguja y póngase en contacto con Lilly (1-800-545-5979) para obtener instrucciones sobre cómo devolver el autoinyector. |
| P. | ¿Qué ocurre si oigo más de 2 clics durante la inyección? ¿He recibido mi dosis completa? |
| R. | Puede oír un clic suave justo antes del segundo clic fuerte. Esto es el funcionamiento normal del autoinyector. No retire el autoinyector de la piel hasta que oiga el segundo clic fuerte. |
| P. | ¿Cómo puedo saber si mi inyección está completa? |
| R. | Después de presionar el botón verde de inyección, oirá 2 clics fuertes. El segundo clic le indica que la inyección está completa. También verá el émbolo gris en la parte superior de la base transparente. |
| P. | ¿Qué ocurre si el autoinyector se deja a temperatura ambiente durante más de 30 minutos? |
| R. | Si es necesario, el autoinyector puede dejarse fuera del refrigerador a temperatura ambiente hasta 86°F (30°C) durante un máximo de 5 días si está protegido de la luz. Deseche TALTZ si no se utiliza dentro del período de 5 días a temperatura ambiente. Consulte “Conservación de TALTZ” para obtener más detalles. |
| Si tiene más preguntas sobre cómo usar el autoinyector de TALTZ: | |
| Conservación de TALTZ |
|
|
|
|
| Mantenga TALTZ y todos los medicamentos fuera del alcance de los niños. |
| Lea la información completa de prescripción y la guía de medicamentos para TALTZ que se encuentra dentro de esta caja para obtener más información sobre su medicamento. |
| Eli Lilly and Company
Indianapolis, IN 46285, USA US License Number 1891 TALTZ is a trademark of Eli Lilly and Company. Copyright © 2016, 2023, Eli Lilly and Company. All rights reserved. El autoinyector TALTZ cumple con los requisitos actuales de precisión de dosis y funcionales de ISO 11608-1 y 11608-5. Estas instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de EE. UU. |
TALTZ Jeringa precargada de 80 mg
| INSTRUCCIONES DE USO |
| TALTZ® (tol(t)s) (ixekizumab) inyección, para uso subcutáneo Jeringa precargada |
 |
| Antes de usar la jeringa precargada de TALTZ, lea y siga cuidadosamente todas las instrucciones paso a paso. |
| Información importante: |
|
|
|
|
|
| INSTRUCCIONES DE USO Antes de usar la jeringa precargada de TALTZ, lea y siga atentamente todas las instrucciones paso a paso. |
||
| Partes de la jeringa precargada de TALTZ | ||
 |
||
| 1 | Preparación | |
| 1a |
|
 |
| 1b | Reúna los materiales necesarios para la inyección:
|
|
| 1c |  |
Inspeccione la jeringa. Deje el capuchón de la aguja puesto en la jeringa hasta que esté listo para inyectarse.
No use la jeringa precargada y deséchela según las indicaciones de su médico o farmacéutico si:
|
| 1d | Lávese las manos con agua y jabón antes de inyectarse TALTZ. | |
| 1e |  |
Elija el lugar de la inyección. Puede inyectarse en el abdomen (vientre), en el muslo o en la parte posterior del brazo. Para inyectarse en el brazo, necesitará que alguien le ayude.
|
| 1f | Prepare la piel. Limpie el lugar de la inyección con una toallita con alcohol. Deje que el lugar de la inyección se seque antes de inyectarse TALTZ. | |
| 2 | Inyecte TALTZ | |
2a |
 |
Quite el capuchón de la aguja y tírelo a la basura.
|
2b |
 |
Pellizque suavemente y sujete un pliegue de piel donde se va a inyectar. |
2c |
 |
|
| 2d |  |
Empuje el émbolo.
No vuelva a colocar la tapa de la aguja en la jeringa precargada. |
| 3 | ||
3a |
 |
|
|
||
|
||
|
||
|
||
| Preguntas y respuestas frecuentes. | ||
| P. | ¿Qué pasa si veo burbujas de aire en mi jeringa precargada TALTZ? | |
| R. | Es normal tener burbujas de aire en la jeringa precargada. | |
| P. | ¿Qué pasa si hay una gota de líquido en la punta de la aguja cuando quito la tapa de la aguja? | |
| R. | Está bien ver una gota de líquido en la punta de la aguja. | |
| P. | ¿Qué pasa si no puedo empujar el émbolo? | |
| R. | Si el émbolo está atascado o dañado: | |
|
||
|
||
|
||
| P. | ¿Cómo puedo saber si mi inyección está completa? | |
| R. | Cuando su inyección esté completa: | |
|
||
|
||
| P. | ¿Qué ocurre si la jeringa precargada se deja a temperatura ambiente durante más de 30 minutos? | |
| R. | Si es necesario, la jeringa precargada puede dejarse fuera del refrigerador a temperatura ambiente hasta 86°F (30°C) durante un máximo de 5 días si se protege de la luz. Deseche TALTZ si no se usa dentro del período de 5 días a temperatura ambiente. Consulte “¿Cómo debo conservar la jeringa precargada de TALTZ?” para obtener más detalles. | |
| Si tiene más preguntas sobre cómo usar la jeringa precargada de TALTZ: | ||
| ¿Cómo debo conservar la jeringa precargada de TALTZ? | ||
|
||
|
||
|
||
|
||
| Mantenga TALTZ y todos los medicamentos fuera del alcance de los niños. | ||
| Lea la información completa de prescripción y la guía de medicamentos para TALTZ dentro de esta caja para obtener más información sobre su medicamento. | ||
| Estas instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de EE. UU. | ||
| Eli Lilly and Company
Indianapolis, IN 46285, EE. UU. Número de licencia de EE. UU. 1891 TALTZ es una marca comercial de Eli Lilly and Company. Copyright © 2016, 2021, Eli Lilly and Company. Todos los derechos reservados. TALPFS-0005-IFU-20210622 Revisado: junio de 2021 |
||
TALTZ Jeringa Prellenada 40 mg
| INSTRUCCIONES DE USO |
| TALTZ® [tol-t-s] (ixekizumab) inyección, para uso subcutáneo jeringa precargada de dosis única de 40 mg/0.5 mL |
| Estas Instrucciones de Uso contienen información sobre cómo inyectar TALTZ. |
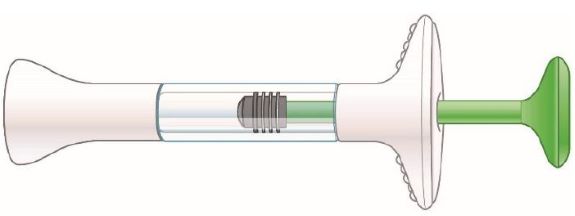 |
| Información importante que debe conocer antes de administrar la inyección de TALTZ a su hijo |
|
| Antes de usar la jeringa precargada de TALTZ, lea y siga cuidadosamente todas las instrucciones paso a paso. | ||
| Partes de la jeringa precargada de TALTZ | ||
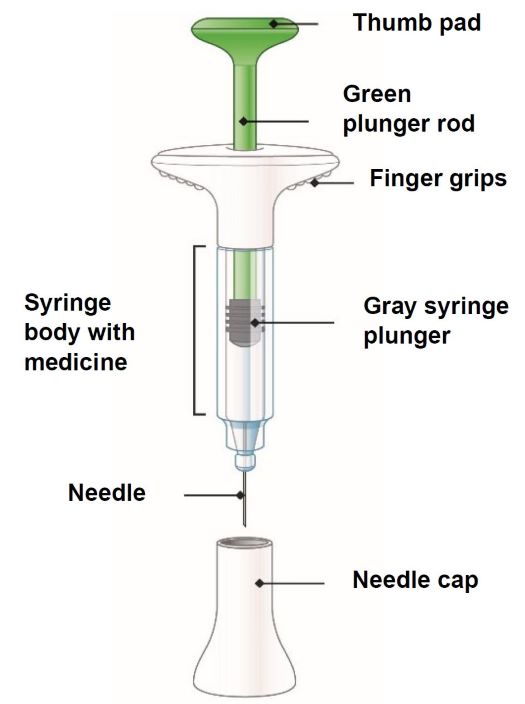 |
||
| Paso 1 | Preparación para inyectar TALTZ | |
| Paso 1a |
|
 |
| Paso 1b | Reúna los materiales necesarios para la inyección:
|
|
| Paso 1c | 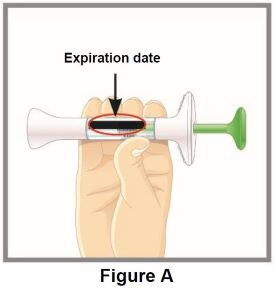 |
Inspeccione la jeringa. Deje el capuchón de la aguja puesto en la jeringa hasta que esté listo para inyectar.
No use la jeringa precargada y deséchela según las indicaciones del profesional sanitario o farmacéutico de su hijo si:
|
| Paso 1d | Lávese las manos con agua y jabón antes de inyectar TALTZ. | |
| Paso 1e |  |
Puede inyectar en el área del estómago (abdomen) o en el muslo, o en la parte posterior del brazo (ver Figura B).
|
| Paso 1f | Prepare la piel. Limpie el sitio de inyección con una toallita con alcohol. Deje que el sitio de inyección se seque antes de inyectar TALTZ. | |
| Paso 2 | Inyección de TALTZ | |
Paso 2a |
 |
Quite el capuchón de la aguja y tírelo (ver Figura C).
|
Paso 2b |
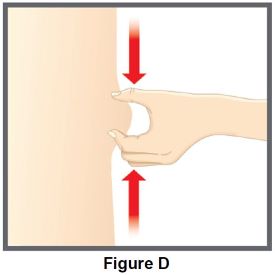 |
Pellizque suavemente y sujete un pliegue de piel donde va a inyectar (ver Figura D). |
Paso 2c |
 |
|
| Paso 2d |  |
Empuje el émbolo.
No vuelva a colocar la tapa de la aguja en la jeringa precargada. |
| Paso 3 | ||
Paso 3a |
 |
|
|
||
|
||
|
||
|
||
| Preguntas y respuestas frecuentes. | ||
| P. | ¿Qué sucede si veo burbujas de aire en la jeringa precargada de TALTZ? | |
| R. | Es normal que haya burbujas de aire en la jeringa precargada. | |
| P. | ¿Qué sucede si hay una gota de líquido en la punta de la aguja cuando quito la tapa de la aguja? | |
| R. | Está bien ver una gota de líquido en la punta de la aguja. | |
| P. | ¿Qué sucede si no puedo empujar el émbolo? | |
| R. | Si el émbolo está atascado o dañado: | |
|
||
|
||
|
||
| P. | ¿Cómo puedo saber si la inyección está completa? | |
| R. | Cuando la inyección está completa: | |
|
||
| P. | ¿Qué sucede si la jeringa permanece a temperatura ambiente durante más de 30 minutos? | |
| R. | Si es necesario, la jeringa puede dejarse fuera del refrigerador a temperatura ambiente hasta 86°F (30°C) durante un máximo de 5 días si se protege de la luz. Deseche TALTZ si no se usa dentro del período de 5 días a temperatura ambiente. Consulte “Almacenamiento de TALTZ” para obtener más detalles. | |
| Si tiene más preguntas sobre cómo usar la jeringa precargada de TALTZ: | ||
| Almacenamiento de TALTZ | ||
|
||
| Mantenga TALTZ y todos los medicamentos fuera del alcance de los niños. | ||
| Lea la Guía del medicamento para TALTZ dentro de esta caja para obtener más información sobre el medicamento. | ||
| Eli Lilly and Company
Indianapolis, IN 46285, USA US License Number 1891 TALTZ is a trademark of Eli Lilly and Company. Copyright © 2024 Eli Lilly and Company. All rights reserved. This Instructions for Use has been approved by the U.S. Food and Drug Administration. Approved: February 2024 TAL-0.5ML-PFS-0001-IFU-20240202 |
||
TALTZ Jeringa Prellenada 20 mg
| INSTRUCCIONES DE USO |
| TALTZ® [tol-t-s] (ixekizumab) inyección, para uso subcutáneo Jeringa precargada de dosis única de 20 mg/0.25 mL |
| Estas Instrucciones de uso contienen información sobre cómo inyectar TALTZ. |
 |
| Información importante que debe saber antes de administrarle la inyección de TALTZ a su hijo |
|
|
| Antes de usar la jeringa precargada de TALTZ, lea y siga atentamente todas las instrucciones paso a paso. | ||
| Partes de la jeringa precargada de TALTZ | ||
 |
||
| Paso 1 | Preparación para inyectar TALTZ | |
| Paso 1a |
|
 |
| Paso 1b | Reúna los suministros necesarios para la inyección:
|
|
| Paso 1c |  |
Inspeccione la jeringa. Deje la tapa de la aguja en la jeringa hasta que esté listo para inyectar.
No use la jeringa precargada y deséchela según las indicaciones del proveedor de atención médica o farmacéutico de su hijo si:
|
| Paso 1d | Lávese las manos con agua y jabón antes de inyectar TALTZ. | |
| Paso 1e |  |
Elija el lugar de la inyección. Puede inyectar en el área del estómago (abdomen) o en el muslo, o en la parte posterior del brazo (consulte la Figura B).
|
| Paso 1f | Prepare la piel. Limpie el lugar de la inyección con una toallita con alcohol. Deje que el lugar de la inyección se seque antes de inyectar TALTZ. | |
| Paso 2 | Inyección de TALTZ | |
Paso 2a |
 |
Retire la tapa de la aguja y deséchela (consulte la Figura C).
|
Paso 2b |
 |
Suavemente pellizque y sostenga un pliegue de piel donde inyectará (consulte la Figura D). |
Paso 2c |
 |
|
| Paso 2d | 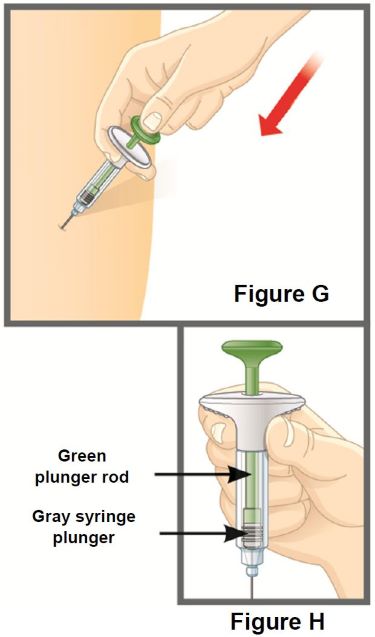 |
Presione el émbolo.
No vuelva a colocar la tapa de la aguja en la jeringa precargada. |
| Paso 3 | ||
Paso 3a |
 |
|
|
||
|
||
|
||
|
||
| Preguntas y respuestas frecuentes. | ||
| P. | ¿Qué sucede si veo burbujas de aire en la jeringa precargada de TALTZ? | |
| R. | Es normal que haya burbujas de aire en la jeringa precargada. | |
| P. | ¿Qué sucede si hay una gota de líquido en la punta de la aguja cuando retiro la tapa de la aguja? | |
| R. | Está bien ver una gota de líquido en la punta de la aguja. | |
| P. | ¿Qué sucede si no puedo presionar el émbolo? | |
| R. | Si el émbolo está atascado o dañado: | |
|
||
|
||
|
||
| P. | ¿Cómo puedo saber si la inyección está completa? | |
| R. | Cuando la inyección esté completa: | |
|
||
| Q. | ¿Qué sucede si la jeringa se deja a temperatura ambiente durante más de 30 minutos? | |
| A. | Si es necesario, la jeringa se puede dejar fuera del refrigerador a temperatura ambiente hasta 86°F (30°C) por hasta 5 días si se protege de la luz. Deseche TALTZ si no se usa dentro del período de 5 días a temperatura ambiente. Consulte “Almacenamiento de TALTZ” para obtener más detalles. | |
| Si tiene más preguntas sobre cómo usar la jeringa precargada de TALTZ: | ||
| Almacenamiento de TALTZ | ||
|
||
| Mantenga TALTZ y todos los medicamentos fuera del alcance de los niños. | ||
| Lea la Guía del Medicamento para TALTZ dentro de esta caja para obtener más información sobre el medicamento. | ||
| Eli Lilly and Company
Indianapolis, IN 46285, USA US License Number 1891 TALTZ is a trademark of Eli Lilly and Company. Copyright © 2024 Eli Lilly and Company. All rights reserved. This Instructions for Use has been approved by the U.S. Food and Drug Administration. Approved: February 2024 TAL-0.25ML-PFS-0001-IFU-20240202 |
||
CAJA DE ENVASE – Autoinyector Taltz 80 mg
taltz®
(ixekizumab)
injection
80 mg/mL
Para uso subcutáneo únicamente
1 autoinyector prellenado de dosis única
Deseche cualquier producto sin usar.
NDC 0002-1445-11
1 autoinyector prellenado de dosis única de 1 x 1 mL
Rx solamente
Entregue la Guía del medicamento adjunta a cada paciente.
Lilly
CAJA DE ENVASE – Jeringa precargada de Taltz 80 mg
taltz®
(ixekizumab)
inyección
80 mg/mL
Sólo para uso subcutáneo
1 jeringa precargada de dosis única
Deseche cualquier producto no utilizado.
NDC 0002-7724-11
1 x 1 mL Jeringa precargada de dosis única
Rx Only
Entregue la Guía de Medicamentos adjunta a cada paciente.
Lilly
CAJA DE ENVASE – Jeringa precargada de Taltz 40 mg
taltz®
(ixekizumab)
inyección
40 mg/0.5 mL
Para uso subcutáneo únicamente
1 jeringa precargada de dosis única
Deseche cualquier producto sin usar.
NDC 0002-8905-11
1 jeringa precargada de dosis única de 0.5 mL
Rx solamente
Entregue la Guía del medicamento adjunta a cada paciente.
Lilly
CAJA DE ENVASE – Jeringa precargada de Taltz 20 mg
taltz®
(ixekizumab)
inyección
20 mg/0.25 mL
Para uso subcutáneo únicamente
1 jeringa precargada de dosis única
Deseche cualquier producto sin usar.
NDC 0002-8900-11
1 jeringa precargada de dosis única de 0.25 mL
Sólo con receta médica
Entregue la Guía del medicamento adjunta a cada paciente.
Lilly