Fabricante de medicamentos: Vertex Pharmaceuticals Incorporated (Updated: 2024-02-09)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
SYMDEKO® (tezacaftor/ivacaftor) tabletas; (ivacaftor) tabletas, para uso oral
Aprobación inicial en EE. UU.: 2018
CAMBIOS RECIENTES IMPORTANTES
| Advertencias y precauciones, reacciones de hipersensibilidad, incluida la anafilaxia (5.2) | 08/2023 |
INDICACIONES Y USO
SYMDEKO es una combinación de tezacaftor e ivacaftor, indicada para el tratamiento de la fibrosis quística (FQ) en pacientes de 6 años de edad o mayores que son homocigotos para la mutación F508del o que tienen al menos una mutación en el gen del regulador de la conductancia transmembrana de la fibrosis quística (CFTR) que responde a tezacaftor/ivacaftor según los datos in vitro y/o la evidencia clínica. (12.1, 14)
Si se desconoce el genotipo del paciente, se debe utilizar una prueba de mutación de FQ aprobada por la FDA para detectar la presencia de una mutación de CFTR, seguida de una verificación con secuenciación bidireccional cuando lo recomienden las instrucciones de uso de la prueba de mutación.
DOSIFICACIÓN Y ADMINISTRACIÓN
- Pacientes pediátricos de 6 a menos de 12 años que pesan menos de 30 kg: un comprimido (que contiene tezacaftor 50 mg/ivacaftor 75 mg) por la mañana y un comprimido (que contiene ivacaftor 75 mg) por la noche, aproximadamente 12 horas de diferencia. SYMDEKO debe tomarse con alimentos que contengan grasa. (2.1, 2.2, 12.3)
- Adultos y pacientes pediátricos de 12 años de edad o mayores o pacientes pediátricos de 6 a menos de 12 años que pesan 30 kg o más: un comprimido (que contiene tezacaftor 100 mg/ivacaftor 150 mg) por la mañana y un comprimido (que contiene ivacaftor 150 mg) por la noche, aproximadamente 12 horas de diferencia. SYMDEKO debe tomarse con alimentos que contengan grasa. (2.1, 2.2, 12.3)
- Reducir la dosis en pacientes con insuficiencia hepática moderada y grave. (2.3, 8.6, 12.3)
- Consulte la información completa de prescripción para las modificaciones de la dosis debido a las interacciones medicamentosas con SYMDEKO. (2.4, 7.2, 12.3)
FORMAS DE DOSIFICACIÓN Y FUERZAS
CONTRAINDICACIONES
- Ninguna. (4)
ADVERTENCIAS Y PRECAUCIONES
- Transaminasas elevadas (ALT o AST): Las transaminasas (ALT y AST) deben evaluarse antes de iniciar SYMDEKO, cada 3 meses durante el primer año de tratamiento y anualmente a partir de entonces. En pacientes con antecedentes de elevaciones de transaminasas, se debe considerar un control más frecuente. La dosificación debe interrumpirse en pacientes con elevaciones significativas de transaminasas, por ejemplo, pacientes con ALT o AST >5 × límite superior normal (LSN), o ALT o AST >3 × LSN con bilirrubina >2 × LSN. Después de la resolución de las elevaciones de transaminasas, considere los beneficios y los riesgos de reanudar el tratamiento. (5.1, 6)
- Reacciones de hipersensibilidad: Se ha informado de anafilaxia con SYMDEKO en el entorno poscomercialización. Inicie la terapia adecuada en caso de una reacción de hipersensibilidad. (5.2)
- Uso con inductores del CYP3A: El uso concomitante con inductores fuertes del CYP3A (por ejemplo, rifampicina, hierba de San Juan) disminuye sustancialmente la exposición a ivacaftor y puede disminuir la exposición a tezacaftor, lo que puede reducir la eficacia terapéutica. Por lo tanto, no se recomienda la coadministración. (5.3, 7.1, 12.3)
- Cataratas: Se han informado opacidades/cataratas del cristalino no congénitas en pacientes pediátricos tratados con SYMDEKO. Se recomiendan exámenes de referencia y de seguimiento en pacientes pediátricos que inician el tratamiento con SYMDEKO. (5.4, 8.4)
REACCIONES ADVERSAS
Las reacciones adversas más comunes a SYMDEKO (que ocurren en ≥3% de los pacientes) fueron dolor de cabeza, náuseas, congestión sinusal y mareos. (6.1)
Para informar las REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Vertex Pharmaceuticals Incorporated al 1-877-634-8789 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES MEDICAMENTOSAS
Consulte 17 para obtener INFORMACIÓN PARA EL PACIENTE y el etiquetado del paciente aprobado por la FDA.
Revisado: 8/2023
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Información General de Dosificación
2.2 Dosificación Recomendada en Adultos, Adolescentes y Niños de 6 Años o Más
2.3 Dosificación Recomendada para Pacientes con Insuficiencia Hepática
2.4 Ajuste de la Dosificación para Pacientes que Toman Medicamentos que son Inhibidores del CYP3A
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Elevaciones de Transaminasas (AST/ALT)
5.2 Reacciones de Hipersensibilidad, Incluida la Anafilaxis
5.3 Uso Concomitante con Inductores del CYP3A
5.4 Cataratas
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Postcomercialización
7 INTERACCIONES MEDICAMENTOSAS
7.1 Inductores del CYP3A
7.2 Inhibidores del CYP3A
7.3 Ciprofloxacina
7.4 Sustratos del CYP3A
7.5 Sustratos del CYP2C9
7.6 Digoxina y Otros Sustratos de P-gp
7.7 Anticonceptivos Hormonales
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
8.6 Insuficiencia Hepática
8.7 Insuficiencia Renal
8.8 Pacientes con Disfunción Pulmonar Grave
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Ensayo en Pacientes con CF que Eran Homocigotos para la Mutación F508del en el Gen CFTR (Ensayo 1)
14.2 Ensayo en Pacientes con CF que Eran Heterocigotos para la Mutación F508del y una Segunda Mutación Predicha para Ser Responsiva a Tezacaftor/Ivacaftor (Ensayo 2)
14.3 Ensayo en Pacientes con CF que Eran Heterocigotos para la Mutación F508del y una Segunda Mutación No Predicha para Ser Responsiva a Tezacaftor/Ivacaftor (Ensayo 3)
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
1 INDICACIONES Y USO
SYMDEKO está indicado para el tratamiento de la fibrosis quística (FQ) en pacientes de 6 años de edad o mayores que son homocigotos para la mutación F508del o que tienen al menos una mutación en el gen del regulador de la conductancia transmembrana de la fibrosis quística (CFTR) que responde a tezacaftor/ivacaftor según los datos in vitro y/o la evidencia clínica [ver Farmacología clínica (12.1) y Estudios clínicos (14)].
Si se desconoce el genotipo del paciente, se debe utilizar una prueba de mutación de FQ aprobada por la FDA para detectar la presencia de una mutación CFTR, seguida de una verificación con secuenciación bidireccional cuando lo recomienden las instrucciones de uso de la prueba de mutación.
2 DOSIS Y ADMINISTRACIÓN
2.1 Información General sobre la Dosificación
Tragar las tabletas enteras.
SYMDEKO debe tomarse con alimentos que contengan grasa, como los alimentos recomendados en las pautas nutricionales estándar. Ejemplos de comidas o refrigerios que contienen grasa son aquellos preparados con mantequilla o aceites o aquellos que contienen huevos, quesos, nueces, leche entera o carnes, etc. [ver Farmacología Clínica (12.3)].
2.2 Dosificación Recomendada en Adultos, Adolescentes y Niños de 6 Años de Edad o Mayores
Los adultos, adolescentes y niños de 6 años de edad o mayores deben recibir la dosis de acuerdo con la Tabla 1. La dosis de la mañana y la de la noche deben tomarse aproximadamente con 12 horas de diferencia.
| Edad | Mañana (una tableta) |
Tarde (una tableta) |
|---|---|---|
| De 6 a <12 años que pesan <30 kg | tezacaftor 50 mg/ivacaftor 75 mg | ivacaftor 75 mg |
| De 6 a <12 años que pesan ≥30 kg | tezacaftor 100 mg/ivacaftor 150 mg | ivacaftor 150 mg |
| ≥12 años | tezacaftor 100 mg/ivacaftor 150 mg | ivacaftor 150 mg |
Información para Dosis Olvidadas:
Si han pasado 6 horas o menos desde la dosis olvidada de la mañana o la tarde, el paciente debe tomar la dosis olvidada lo antes posible y continuar con el horario original. Si han pasado más de 6 horas desde la dosis olvidada de la mañana o la tarde, el paciente no debe tomar la dosis olvidada. La próxima dosis programada se puede tomar a la hora habitual. No se debe tomar más de una dosis al mismo tiempo.
2.3 Dosificación Recomendada para Pacientes con Insuficiencia Hepática
Para el ajuste de la dosis para pacientes con insuficiencia hepática, consulte la Tabla 2.
No se han realizado estudios en pacientes con insuficiencia hepática grave (Clase C de Child-Pugh), pero se espera que la exposición a tezacaftor e ivacaftor sea mayor que en pacientes con insuficiencia hepática moderada. Por lo tanto, SYMDEKO debe utilizarse con precaución a una dosis ajustada después de sopesar los riesgos y beneficios del tratamiento en estos pacientes [ver Uso en Poblaciones Específicas (8.6), Farmacología Clínica (12.3), y Información para el Paciente (17)].
| Insuficiencia Hepática | Mañana | Tarde | |
|---|---|---|---|
| Pacientes de 6 a <12 Años que Pesan <30kg | Pacientes de 6 a <12 Años que Pesan ≥30 kg y Pacientes de ≥12 Años | Todos los Pacientes | |
| Leve (Clase A de Child-Pugh) | No se necesita ajuste de dosis | No se necesita ajuste de dosis | No se necesita ajuste de dosis |
| Moderada (Clase B de Child-Pugh) | Una tableta de tezacaftor 50 mg/ivacaftor 75 mg una vez al día | Una tableta de tezacaftor 100 mg/ivacaftor 150 mg una vez al día | No se necesita dosis de ivacaftor |
| Grave (Clase C de Child-Pugh) | Una tableta de tezacaftor 50 mg/ivacaftor 75 mg una vez al día (o con menos frecuencia) |
Una tableta de tezacaftor 100 mg/ivacaftor 150 mg una vez al día (o con menos frecuencia) |
|
2.4 Ajuste de la Dosis para Pacientes que Toman Medicamentos que son Inhibidores del CYP3A
El régimen de dosificación de SYMDEKO debe ajustarse cuando se administra conjuntamente con inhibidores moderados y fuertes del CYP3A.
Inhibidores moderados del CYP3A:
Cuando se administra conjuntamente con inhibidores moderados del CYP3A (por ejemplo, fluconazol, eritromicina), el régimen de dosificación debe ajustarse como se indica en la Tabla 3 [ver Interacciones medicamentosas (7.2), Farmacología clínica (12.3), y Información para el paciente (17)].
| Día 1 | Día 2 | Día 3 | Día 4* | |
|---|---|---|---|---|
|
||||
| Pacientes de 6 a <12 años que pesan <30 kg | ||||
| Mañana | ||||
| Tableta de tezacaftor 50 mg/ivacaftor 75 mg | ✓ | – | ✓ | – |
| Tableta de ivacaftor 75 mg | – | ✓ | – | ✓ |
| Tarde | ||||
| Tableta de ivacaftor 75 mg | – | – | – | – |
| Pacientes de 6 a <12 años que pesan ≥30 kg y pacientes de ≥12 años | ||||
| Mañana | ||||
| Tableta de tezacaftor 100 mg/ivacaftor 150 mg | ✓ | – | ✓ | – |
| Tableta de ivacaftor 150 mg | – | ✓ | – | ✓ |
| Tarde | ||||
| Tableta de ivacaftor 150 mg | – | – | – | – |
Inhibidores potentes del CYP3A:
Cuando se administra conjuntamente con inhibidores potentes del CYP3A (por ejemplo, ketoconazol, itraconazol, posaconazol, voriconazol, telitromicina y claritromicina), el régimen de dosificación debe ajustarse como se indica en la Tabla 4 [ver Interacciones medicamentosas (7.2), Farmacología clínica (12.3) y Información para el paciente (17)].
| Día 1 | Día 2 y Día 3 | Día 4* | |
|---|---|---|---|
| Pacientes de 6 a <12 años que pesan <30 kg | |||
| Mañana | |||
| Comprimidos de tezacaftor 50 mg/ivacaftor 75 mg | ✓ | – | ✓ |
| Tarde† | |||
| Comprimidos de ivacaftor 75 mg | – | – | – |
| Pacientes de 6 a <12 años que pesan ≥30 kg y pacientes de ≥12 años | |||
| Mañana | |||
| Comprimidos de tezacaftor 100 mg/ivacaftor 150 mg | ✓ | – | ✓ |
| Tarde† | |||
| Comprimidos de ivacaftor 150 mg | – | – | – |
Se debe evitar el consumo de alimentos o bebidas que contengan pomelo durante el tratamiento con SYMDEKO [ver Interacciones medicamentosas (7.2) y Información para el paciente (17)].
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Tabletas: Tezacaftor 50 mg/ivacaftor 75 mg tabletas de combinación de dosis fija co-envasadas con tabletas de ivacaftor 75 mg
- Las tabletas de tezacaftor 50 mg/ivacaftor 75 mg son blancas, en forma de cápsula y con el grabado “V50” en un lado y lisas en el otro.
- Las tabletas de ivacaftor 75 mg son de color azul claro, en forma de cápsula y con la impresión “V 75” en tinta negra en un lado y lisas en el otro.
Tabletas: Tezacaftor 100 mg/ivacaftor 150 mg tabletas de combinación de dosis fija co-envasadas con tabletas de ivacaftor 150 mg
- Las tabletas de tezacaftor 100 mg/ivacaftor 150 mg son amarillas, en forma de cápsula y con el grabado “V100” en un lado y lisas en el otro.
- Las tabletas de ivacaftor 150 mg son de color azul claro, en forma de cápsula y con la impresión “V 150” en tinta negra en un lado y lisas en el otro.
4 CONTRAINDICACIONES
Ninguna.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Elevaciones de Transaminasas (AST/ALT)
Se han observado elevaciones de transaminasas en pacientes con fibrosis quística tratados con SYMDEKO, así como con ivacaftor en monoterapia. Se recomienda la evaluación de las transaminasas (ALT y AST) para todos los pacientes antes de iniciar el tratamiento con SYMDEKO, cada 3 meses durante el primer año de tratamiento y anualmente a partir de entonces. Para los pacientes con antecedentes de elevaciones de transaminasas, se debe considerar un control más frecuente. En caso de elevaciones significativas de transaminasas, por ejemplo, pacientes con ALT o AST >5 × límite superior de lo normal (ULN), o ALT o AST >3 × ULN con bilirrubina >2 × ULN, se debe interrumpir la dosis y realizar un seguimiento estrecho de las pruebas de laboratorio hasta que las anomalías se resuelvan. Tras la resolución de las elevaciones de transaminasas, considere los beneficios y riesgos de reanudar el tratamiento [ver Reacciones adversas (6)].
5.2 Reacciones de Hipersensibilidad, Incluida la Anafilaxia
Se han notificado reacciones de hipersensibilidad, incluidos casos de anafilaxia, en la poscomercialización [ver Reacciones adversas (6.2)]. Si se desarrollan signos o síntomas de reacciones de hipersensibilidad graves durante el tratamiento, suspenda SYMDEKO e instituya una terapia adecuada. Considere los beneficios y riesgos para el paciente individual para determinar si debe reanudarse el tratamiento con SYMDEKO.
5.3 Uso Concomitante con Inductores del CYP3A
La exposición a ivacaftor se reduce significativamente y la exposición a tezacaftor puede reducirse por el uso concomitante de inductores del CYP3A, lo que puede reducir la eficacia terapéutica de SYMDEKO. Por lo tanto, no se recomienda la coadministración con inductores fuertes del CYP3A [ver Interacciones medicamentosas (7.1), Farmacología clínica (12.3) y Información para el paciente (17)].
5.4 Cataratas
Se han notificado casos de opacidades del cristalino no congénitas en pacientes pediátricos tratados con SYMDEKO, así como con ivacaftor en monoterapia. Aunque en algunos casos se presentaron otros factores de riesgo (como el uso de corticosteroides, la exposición a la radiación), no se puede excluir un posible riesgo atribuible al tratamiento con SYMDEKO. Se recomiendan los exámenes oftalmológicos de referencia y de seguimiento en pacientes pediátricos que inician el tratamiento con SYMDEKO [ver Uso en poblaciones específicas (8.4) y Información para el paciente (17)].
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas se discuten con mayor detalle en otras secciones de la etiqueta:
- Elevaciones de transaminasas [ver Advertencias y precauciones (5.1)]
- Reacciones de hipersensibilidad, incluida la anafilaxia [ver Advertencias y precauciones (5.2)]
- Cataratas [ver Advertencias y precauciones (5.4)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica clínica.
El perfil de seguridad general de SYMDEKO se basa en datos de 1001 pacientes en tres ensayos clínicos doble ciego, controlados con placebo: dos ensayos de grupos paralelos de 12 y 24 semanas de duración y un ensayo de diseño cruzado de 8 semanas de duración. Los pacientes elegibles también pudieron participar en un estudio de seguridad de extensión de etiqueta abierta (hasta 96 semanas de SYMDEKO). En los tres ensayos controlados con placebo (Ensayos 1, 2 y 3), un total de 496 pacientes con CF de 12 años o más recibieron al menos una dosis de SYMDEKO. La proporción de pacientes que interrumpieron prematuramente el fármaco del estudio debido a reacciones adversas fue del 1,6% para los pacientes tratados con SYMDEKO y del 2,0% para los pacientes tratados con placebo. Las reacciones adversas graves, ya sean consideradas o no relacionadas con el fármaco por los investigadores, que ocurrieron con mayor frecuencia en los pacientes tratados con SYMDEKO en comparación con el placebo incluyeron síndrome de obstrucción intestinal distal, 3 (0,6%) pacientes tratados con SYMDEKO frente a 0 placebo. No hubo muertes en los ensayos controlados con placebo y una muerte en el estudio de extensión de etiqueta abierta debido a insuficiencia respiratoria e infección por influenza en un paciente que había interrumpido SYMDEKO siete semanas antes.
El perfil de seguridad de SYMDEKO fue generalmente similar en todos los subgrupos de pacientes, incluido el análisis por edad, sexo, porcentaje predicho de FEV1 (ppFEV1) y regiones geográficas.
La Tabla 5 muestra las reacciones adversas que ocurren en ≥3% de los pacientes tratados con SYMDEKO que también ocurrieron a una tasa más alta que en los pacientes tratados con placebo en los ensayos controlados con placebo de 12 y 24 semanas, de grupos paralelos (Ensayos 1 y 3).
| Reacciones adversas (término preferido) | SYMDEKO N=334 n (%) |
Placebo N=343 n (%) |
|---|---|---|
| Dolor de cabeza | 49 (15) | 44 (13) |
| Náuseas | 29 (9) | 24 (7) |
| Congestión sinusal | 13 (4) | 6 (2) |
| Mareos | 12 (4) | 8 (2) |
Los datos de seguridad de los siguientes ensayos son similares a los observados en los Ensayos 1 y 3:
- un estudio cruzado aleatorizado, doble ciego, controlado con placebo de 8 semanas en 244 pacientes con CF de 12 años o más que eran heterocigotos para la mutación F508del y una segunda mutación que se predijo que respondería a tezacaftor/ivacaftor (Ensayo 2).
- un estudio de etiqueta abierta de 24 semanas en 70 pacientes con CF de 6 a menos de 12 años que eran homocigotos para la mutación F508del o heterocigotos para la mutación F508del y una segunda mutación que se predijo que respondería a tezacaftor/ivacaftor (Ensayo 4).
Anormalidades de laboratorio
Elevaciones de transaminasas
Durante los ensayos controlados con placebo en pacientes de 12 años o más, la incidencia de transaminasas máximas (ALT o AST) >8, >5 y >3 × el límite superior de lo normal (ULN) fue similar entre los pacientes tratados con SYMDEKO y los pacientes tratados con placebo; 0,2%, 1,0% y 3,4% en pacientes tratados con SYMDEKO y 0,4%, 1,0% y 3,4% en pacientes tratados con placebo. Un paciente (0,2%) con SYMDEKO y 2 pacientes (0,4%) con placebo interrumpieron permanentemente el tratamiento por elevaciones de transaminasas. Ningún paciente tratado con SYMDEKO experimentó una elevación de transaminasas >3 × ULN asociada con una bilirrubina total elevada >2 × ULN.
Durante el estudio de etiqueta abierta de 24 semanas en pacientes de 6 a menos de 12 años (Ensayo 4), la incidencia de transaminasas máximas (ALT o AST) >8, >5 y >3 × ULN fue del 1,4%, 4,3% y 10,0%, respectivamente. Ningún paciente tratado con SYMDEKO experimentó una elevación de transaminasas >3 × ULN asociada con una bilirrubina total elevada >2 × ULN o interrumpió el tratamiento con SYMDEKO debido a elevaciones de transaminasas.
6.2 Experiencia postcomercialización
Las siguientes reacciones adversas se han identificado durante el uso posterior a la aprobación de SYMDEKO. Debido a que estas reacciones se informan voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos del sistema inmunitario: anafilaxia
Piel: erupción cutánea
7 INTERACCIONES MEDICAMENTOSAS
Posibilidad de que otros medicamentos afecten a tezacaftor/ivacaftor
7.1 Inductores de CYP3A
Tezacaftor e ivacaftor son sustratos de CYP3A (ivacaftor es un sustrato sensible de CYP3A). El uso concomitante de inductores de CYP3A puede provocar exposiciones reducidas y, por lo tanto, una eficacia reducida de SYMDEKO. La administración conjunta de ivacaftor con rifampicina, un inductor potente de CYP3A, disminuyó significativamente la exposición a ivacaftor (área bajo la curva [AUC]) en un 89%. También se espera que las exposiciones a tezacaftor disminuyan significativamente durante la administración conjunta con inductores potentes de CYP3A. Por lo tanto, no se recomienda la administración conjunta de SYMDEKO con inductores potentes de CYP3A [ver Advertencias y precauciones (5.3), Farmacología clínica (12.3), y Información para el paciente (17)].
Ejemplos de inductores potentes de CYP3A incluyen:
- rifampicina, rifabutina, fenobarbital, carbamazepina, fenitoína y hierba de San Juan (Hypericum perforatum)
7.2 Inhibidores de CYP3A
La administración conjunta con itraconazol, un inhibidor potente de CYP3A, aumentó la exposición a tezacaftor (AUC) en 4,0 veces y la de ivacaftor en 15,6 veces. Cuando se administre conjuntamente con inhibidores potentes de CYP3A, se debe ajustar el régimen de dosificación de SYMDEKO [ver Dosificación y administración (2.4), Farmacología clínica (12.3), y Información para el paciente (17)].
Ejemplos de inhibidores potentes de CYP3A incluyen:
- ketoconazol, itraconazol, posaconazol y voriconazol
- telithromicina y claritromicina
La administración conjunta de fluconazol aumentó la exposición a ivacaftor (AUC) en 3,0 veces. La simulación sugirió que la administración conjunta con fluconazol, un inhibidor moderado de CYP3A, puede aumentar la exposición a tezacaftor (AUC) en aproximadamente 2,0 veces. Cuando se administre conjuntamente con inhibidores moderados de CYP3A, se debe ajustar el régimen de dosificación de SYMDEKO [ver Dosificación y administración (2.4), Farmacología clínica (12.3), y Información para el paciente (17)].
Ejemplos de inhibidores moderados de CYP3A incluyen:
- fluconazol
- eritromicina
La administración conjunta de SYMDEKO con zumo de pomelo, que contiene uno o más componentes que inhiben moderadamente CYP3A, puede aumentar la exposición a tezacaftor e ivacaftor; por lo tanto, se debe evitar el consumo de alimentos o bebidas que contengan pomelo durante el tratamiento con SYMDEKO [ver Dosificación y administración (2.4), Farmacología clínica (12.3), y Información para el paciente (17)].
7.3 Ciprofloxacino
La administración conjunta de SYMDEKO con ciprofloxacino no tuvo un efecto significativo en la exposición a tezacaftor o ivacaftor. Por lo tanto, no es necesario ajustar la dosis durante la administración concomitante de SYMDEKO con ciprofloxacino [ver Farmacología clínica (12.3)].
Posibilidad de que tezacaftor/ivacaftor afecten a otros medicamentos
7.4 Sustratos de CYP3A
La administración conjunta de SYMDEKO con midazolam (oral), un sustrato sensible de CYP3A, no afectó a la exposición a midazolam. No es necesario ajustar la dosis de los sustratos de CYP3A cuando se administren conjuntamente con SYMDEKO [ver Farmacología clínica (12.3)].
7.5 Sustratos de CYP2C9
Ivacaftor puede inhibir CYP2C9; por lo tanto, se recomienda controlar la relación internacional normalizada (INR) durante la administración conjunta de SYMDEKO con warfarina. Otros medicamentos para los que la exposición puede verse aumentada por SYMDEKO incluyen glimepirida y glipizida; estos medicamentos deben utilizarse con precaución [ver Farmacología clínica (12.3)].
7.6 Digoxina y otros sustratos de P-gp
La administración conjunta de SYMDEKO con digoxina, un sustrato sensible de P-gp, aumentó la exposición a digoxina en 1,3 veces, lo que es coherente con la inhibición débil de P-gp por ivacaftor. La administración de SYMDEKO puede aumentar la exposición sistémica de los medicamentos que son sustratos sensibles de P-gp, lo que puede aumentar o prolongar su efecto terapéutico y sus reacciones adversas. Cuando se utilice de forma concomitante con digoxina u otros sustratos de P-gp con un índice terapéutico estrecho, como ciclosporina, everolimus, sirolimus y tacrolimus, se debe tener precaución y realizar un seguimiento adecuado [ver Farmacología clínica (12.3)].
7.7 Anticonceptivos hormonales
SYMDEKO se ha estudiado con un anticonceptivo oral de etinilestradiol/noretisterona y se ha descubierto que no tiene un efecto significativo en las exposiciones del anticonceptivo hormonal. No se espera que SYMDEKO modifique la eficacia de los anticonceptivos hormonales [ver Farmacología clínica (12.3)].
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgos
Hay datos humanos limitados e incompletos de ensayos clínicos e informes postcomercialización sobre el uso de SYMDEKO o sus componentes individuales, tezacaftor e ivacaftor, en mujeres embarazadas para informar un riesgo asociado a los medicamentos. Aunque no hay estudios de reproducción animal con la administración concomitante de tezacaftor e ivacaftor, se realizaron estudios de reproducción y desarrollo separados con tezacaftor e ivacaftor en ratas y conejas embarazadas. En estudios de reproducción animal, la administración oral de tezacaftor a ratas y conejas embarazadas durante la organogénesis no demostró teratogenicidad ni efectos adversos en el desarrollo a dosis que produjeron exposiciones maternas hasta aproximadamente 3 veces la exposición a la dosis humana máxima recomendada (MRHD) en ratas y 0.2 veces la MRHD en conejas (basado en AUC sumadas para tezacaftor y el metabolito M1). La administración oral de ivacaftor a ratas y conejas embarazadas durante la organogénesis no demostró teratogenicidad ni efectos adversos en el desarrollo a dosis que produjeron exposiciones maternas hasta aproximadamente 6 y 16 veces la exposición a la MRHD, respectivamente. No se observaron efectos adversos en el desarrollo después de la administración oral de tezacaftor o ivacaftor a ratas embarazadas desde el período de organogénesis hasta la lactancia a dosis que produjeron exposiciones maternas aproximadamente 1 y 4 veces las exposiciones a la MRHD, respectivamente (ver Datos).
El riesgo de fondo de defectos de nacimiento mayores y aborto espontáneo para la población indicada es desconocido. En la población general de EE. UU., el riesgo de fondo estimado de defectos de nacimiento mayores y aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente.
Datos
Datos de animales
Tezacaftor
En un estudio de desarrollo embrio-fetal en ratas embarazadas dosificadas durante el período de organogénesis desde el día 6 hasta el 17 de gestación, el tezacaftor no fue teratógeno y no afectó el desarrollo fetal ni la supervivencia a exposiciones de hasta 3 veces la MRHD (basado en AUC sumadas para tezacaftor y el metabolito M1 a dosis orales maternas de hasta 100 mg/kg/día). En un estudio de desarrollo embrio-fetal en conejas embarazadas dosificadas durante el período de organogénesis desde el día 7 hasta el 20 de gestación, el tezacaftor no fue teratógeno y no afectó el desarrollo fetal ni la supervivencia a exposiciones de hasta 0.2 veces la MRHD (basado en AUC sumadas para tezacaftor y el metabolito M1 a dosis orales maternas de hasta 25 mg/kg/día). Se observaron pesos fetales más bajos en conejas a una dosis tóxica para la madre que produjo exposiciones aproximadamente 1 vez la MRHD (a una dosis materna de 50 mg/kg/día). En un estudio de desarrollo pre y postnatal (PPND) en ratas embarazadas dosificadas desde el día 6 de gestación hasta el día 18 de lactancia, el tezacaftor no tuvo efectos adversos en el desarrollo de las crías a una exposición de aproximadamente 1 vez la MRHD (basado en AUC sumadas para tezacaftor y el metabolito M1 a una dosis materna de 25 mg/kg/día). Se observaron disminuciones en el peso corporal fetal y retrasos en el desarrollo temprano en el desprendimiento del pabellón auricular, la apertura de los ojos y el reflejo de enderezamiento a una dosis tóxica para la madre (basado en la pérdida de peso materna) que produjo exposiciones aproximadamente 2 veces la exposición a la MRHD (basado en AUC sumadas para tezacaftor y el metabolito M1 a una dosis oral materna de 50 mg/kg/día). Se observó la transferencia placentaria de tezacaftor en ratas embarazadas.
Ivacaftor
En un estudio de desarrollo embrio-fetal en ratas embarazadas dosificadas durante el período de organogénesis desde el día 7 hasta el 17 de gestación, el ivacaftor no fue teratógeno y no afectó la supervivencia fetal a exposiciones de hasta 6 veces la MRHD (basado en AUC sumadas para ivacaftor y sus metabolitos a una dosis oral materna de 200 mg/kg/día). En un estudio de desarrollo embrio-fetal en conejas embarazadas dosificadas durante el período de organogénesis desde el día 7 hasta el 19 de gestación, el ivacaftor no fue teratógeno y no afectó el desarrollo fetal ni la supervivencia a exposiciones de hasta 16 veces la MRHD (en base a AUC de ivacaftor a dosis orales maternas de hasta 100 mg/kg/día). En un estudio de PPND en ratas embarazadas dosificadas desde el día 7 de gestación hasta el día 20 de lactancia, el ivacaftor no tuvo efectos en el parto ni en el crecimiento y desarrollo de la descendencia a exposiciones de hasta 4 veces la MRHD (basado en AUC sumadas para ivacaftor y sus metabolitos a dosis orales maternas de hasta 100 mg/kg/día). Se observaron disminuciones en el peso corporal fetal a una dosis tóxica para la madre que produjo exposiciones 6 veces la MRHD. Se observó la transferencia placentaria de ivacaftor en ratas y conejas embarazadas.
8.2 Lactancia
Resumen de Riesgos
No hay información sobre la presencia de tezacaftor o ivacaftor en la leche materna, los efectos en el lactante o los efectos en la producción de leche. Tanto el tezacaftor como el ivacaftor se excretan en la leche de ratas lactantes (ver Datos). Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de SYMDEKO y cualquier posible efecto adverso en el niño amamantado por SYMDEKO o por la condición materna subyacente.
Datos
Tezacaftor
Se demostró la excreción láctea de tezacaftor en ratas después de una dosis oral única (30 mg/kg) de 14C-tezacaftor administrada de 6 a 10 días después del parto a madres lactantes. La exposición de 14C-tezacaftor en la leche fue aproximadamente 3 veces mayor que en el plasma (basado en AUC0-72h).
Ivacaftor
Se demostró la excreción lactada de ivacaftor en ratas después de una dosis oral única (100 mg/kg) de 14C-ivacaftor administrada de 9 a 10 días después del parto a las madres lactantes. La exposición de 14C-ivacaftor en la leche fue aproximadamente 1,5 veces mayor que en el plasma (basado en AUC0-24h).
8.4 Uso pediátrico
La seguridad y eficacia de SYMDEKO para el tratamiento de la fibrosis quística se han establecido en pacientes pediátricos de 6 a menos de 18 años que son homocigotos para la mutación F508del o que tienen al menos una mutación en el gen CFTR que responde a tezacaftor/ivacaftor según los datos in vitro y/o evidencia clínica [ver Farmacología clínica (12.1) y Estudios clínicos (14)].
Los ensayos clínicos incluyeron a los siguientes pacientes con fibrosis quística:
- De 12 a menos de 18 años de edad que son homocigotos para la mutación F508del [ver Reacciones adversas (6) y Estudios clínicos (14)].
- De 12 a menos de 18 años de edad que son heterocigotos para la mutación F508del y una segunda mutación que se predice que responde a tezacaftor/ivacaftor [ver Reacciones adversas (6) y Estudios clínicos (14)].
- De 6 a menos de 12 años de edad que son homocigotos para la mutación F508del o heterocigotos para la mutación F508del y una segunda mutación que se predice que responde a tezacaftor/ivacaftor [ver Reacciones adversas (6) y Farmacología clínica (12)]
La eficacia de SYMDEKO en pacientes de 6 a menos de 12 años se extrapoló de pacientes de 12 años o más con el apoyo de análisis farmacocinéticos poblacionales que muestran niveles de exposición similares a tezacaftor e ivacaftor en pacientes de 6 a menos de 12 años y en pacientes de 12 años o más [ver Farmacología clínica (12.3)]. La seguridad de SYMDEKO en esta población se derivó de un ensayo clínico abierto de 24 semanas en 70 pacientes de 6 a menos de 12 años (edad media al inicio del estudio 8,1 años) a los que se administró tezacaftor 50 mg/ivacaftor 75 mg e ivacaftor 75 mg o tezacaftor 100 mg/ivacaftor 150 mg e ivacaftor 150 mg, 12 horas de diferencia (Ensayo 4). El perfil de seguridad para los pacientes en este ensayo fue similar al observado en los Ensayos 1 y 3 [ver Reacciones adversas (6.1)].
No se ha estudiado la seguridad y eficacia de SYMDEKO en pacientes con fibrosis quística menores de 6 años.
Datos de toxicidad en animales jóvenes
Se observaron hallazgos de cataratas en ratas jóvenes a las que se administró dosis de ivacaftor desde el día 7 hasta el 35 después del nacimiento con niveles de dosis de 10 mg/kg/día y superiores (0,25 veces la MRHD basada en la exposición sistémica de ivacaftor y sus metabolitos). Este hallazgo no se ha observado en animales mayores.
8.5 Uso geriátrico
Los ensayos clínicos de SYMDEKO no incluyeron un número suficiente de pacientes de 65 años o más para determinar si responden de manera diferente a los pacientes más jóvenes.
8.6 Insuficiencia hepática
No es necesario ajustar la dosis para pacientes con insuficiencia hepática leve (Clase A de Child-Pugh). Se recomienda una dosis reducida de SYMDEKO en pacientes con insuficiencia hepática moderada (Clase B de Child-Pugh). No hay experiencia en pacientes con insuficiencia hepática grave (Clase C de Child-Pugh), pero se espera que la exposición a tezacaftor/ivacaftor sea mayor que en pacientes con insuficiencia hepática moderada. Por lo tanto, úselo con precaución a una dosis reducida en pacientes con insuficiencia hepática grave después de sopesar los riesgos y beneficios del tratamiento [ver Dosificación y administración (2.3), Farmacología clínica (12.3), y Información para el paciente (17)].
8.7 Insuficiencia renal
SYMDEKO no se ha estudiado en pacientes con insuficiencia renal moderada o grave o en pacientes con enfermedad renal en etapa terminal. No se recomienda ajustar la dosis para insuficiencia renal leve y moderada. Se recomienda precaución en pacientes con insuficiencia renal grave o enfermedad renal en etapa terminal [Farmacología clínica (12.3)].
8.8 Pacientes con disfunción pulmonar grave
El ensayo 1 y el ensayo 2 incluyeron un total de 39 pacientes tratados con SYMDEKO con ppFEV1 <40 al inicio del estudio (rango 30-40); 23 pacientes en el ensayo 1 y 16 pacientes en el ensayo 2. Hubo 24 pacientes tratados con placebo en el ensayo 1, y 15 pacientes tratados con placebo y 13 con ivacaftor en el ensayo 2, con ppFEV1 <40 al inicio del estudio. La seguridad y eficacia en este subgrupo fueron comparables a los resultados generales observados en los ensayos 1 y 2.
10 SOBREDOSIS
No hay antídoto específico disponible para la sobredosis con SYMDEKO. El tratamiento de la sobredosis consiste en medidas generales de apoyo, incluida la monitorización de los signos vitales y la observación del estado clínico del paciente.
11 DESCRIPCIÓN
SYMDEKO se envasa en un kit que consiste en una tableta combinada de dosis fija de tezacaftor e ivacaftor y una tableta de ivacaftor. Ambas tabletas son para administración oral.
Tabletas combinadas de dosis fija de 50 mg de tezacaftor/75 mg de ivacaftor y tabletas de 75 mg de ivacaftor:
La tableta combinada de dosis fija de tezacaftor/ivacaftor está disponible como una tableta, en forma de cápsula, recubierta con película, blanca, que contiene 50 mg de tezacaftor, 75 mg de ivacaftor y los siguientes ingredientes inertes: sodio croscarmelosa, hipromelosa, acetato succinato de hipromelosa, estearato de magnesio, celulosa microcristalina y sulfato de laurilo de sodio. El recubrimiento de la película de la tableta contiene HPMC/hipromelosa 2910, celulosa hidroxipropílica, talco y dióxido de titanio.
La tableta de ivacaftor está disponible como una tableta, en forma de cápsula, recubierta con película, de color azul claro, que contiene 75 mg de ivacaftor y los siguientes ingredientes inertes: dióxido de silicio coloidal, sodio croscarmelosa, acetato succinato de hipromelosa, lactosa monohidrato, estearato de magnesio, celulosa microcristalina y sulfato de laurilo de sodio. El recubrimiento de la película de la tableta contiene cera de carnauba, FD & C Azul #2, PEG 3350, alcohol polivinílico, talco y dióxido de titanio. La tinta de impresión contiene amoníaco hidróxido, óxido de hierro negro, propilenglicol y laca.
Tabletas combinadas de dosis fija de 100 mg de tezacaftor/150 mg de ivacaftor y tabletas de 150 mg de ivacaftor:
La tableta combinada de dosis fija de tezacaftor/ivacaftor está disponible como una tableta, en forma de cápsula, recubierta con película, amarilla, que contiene 100 mg de tezacaftor, 150 mg de ivacaftor y los siguientes ingredientes inertes: sodio croscarmelosa, hipromelosa, acetato succinato de hipromelosa, estearato de magnesio, celulosa microcristalina y sulfato de laurilo de sodio. El recubrimiento de la película de la tableta contiene HPMC/hipromelosa 2910, celulosa hidroxipropílica, óxido de hierro amarillo, talco y dióxido de titanio.
La tableta de ivacaftor está disponible como una tableta, en forma de cápsula, recubierta con película, de color azul claro, que contiene 150 mg de ivacaftor y los siguientes ingredientes inertes: dióxido de silicio coloidal, sodio croscarmelosa, acetato succinato de hipromelosa, lactosa monohidrato, estearato de magnesio, celulosa microcristalina y sulfato de laurilo de sodio. El recubrimiento de la película de la tableta contiene cera de carnauba, FD & C Azul #2, PEG 3350, alcohol polivinílico, talco y dióxido de titanio. La tinta de impresión contiene amoníaco hidróxido, óxido de hierro negro, propilenglicol y laca.
Los ingredientes activos de SYMDEKO se describen a continuación.
Tezacaftor
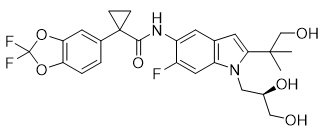
Tezacaftor es un polvo blanco a blanquecino prácticamente insoluble en agua (<5 microgramos/mL). Su nombre químico del tezacaftor es 1-(2,2-difluoro-2H-1,3-benzodioxol-5-yl)-N-{1-[(2R)-2,3-dihydroxypropyl]-6-fluoro-2-(1-hydroxy-2-methylpropan-2-yl)-1Hindol-5-yl}cyclopropane-1-carboxamide. Su fórmula molecular es C26H27N2F3O6 y su peso molecular es 520.50. Tezacaftor tiene la siguiente fórmula estructural:
Ivacaftor
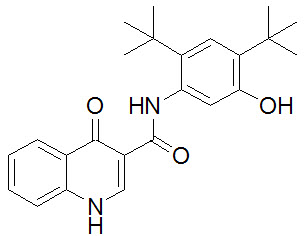
Ivacaftor es un polvo blanco a blanquecino prácticamente insoluble en agua (<0.05 microgramos/mL). Farmacológicamente es un potenciador de CFTR. Su nombre químico es N-(2,4-di-tert-butyl-5-hydroxyphenyl)-1,4-dihydro-4-oxoquinoline-3-carboxamide. Su fórmula molecular es C24H28N2O3 y su peso molecular es 392.49. Ivacaftor tiene la siguiente fórmula estructural:
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Tezacaftor facilita el procesamiento celular y el tráfico de formas mutantes selectas de CFTR (incluida F508del-CFTR) para aumentar la cantidad de proteína CFTR madura que se entrega a la superficie celular. Ivacaftor es un potenciador de CFTR que facilita el aumento del transporte de cloruro al potenciar la probabilidad de apertura del canal (o compuerta) de la proteína CFTR en la superficie celular. Para que ivacaftor funcione, la proteína CFTR debe estar presente en la superficie celular. Ivacaftor puede potenciar la proteína CFTR que se entrega a la superficie celular por tezacaftor, lo que lleva a una mayor mejora del transporte de cloruro que cualquiera de los agentes por separado. El efecto combinado de tezacaftor e ivacaftor es una mayor cantidad y función de CFTR en la superficie celular, lo que resulta en aumentos en el transporte de cloruro.
Ensayo de transporte de cloruro de CFTR en células de tiroides de rata Fischer (FRT) que expresan CFTR mutante
La respuesta de transporte de cloruro de la proteína CFTR mutante a tezacaftor/ivacaftor se determinó en estudios de electrofisiología de cámara de Ussing utilizando un panel de líneas celulares FRT transfectadas con mutaciones individuales de CFTR. Tezacaftor/ivacaftor aumentó el transporte de cloruro en células FRT que expresan mutaciones de CFTR que dan como resultado que la proteína CFTR se entregue a la superficie celular.
El umbral de respuesta de transporte de cloruro in vitro se designó como un aumento neto de al menos el 10% de lo normal sobre la línea de base porque es predictivo o se espera razonablemente que prediga el beneficio clínico. Para mutaciones individuales, la magnitud del cambio neto sobre la línea de base en el transporte de cloruro mediado por CFTR in vitro no está correlacionada con la magnitud de la respuesta clínica.
Tenga en cuenta que las mutaciones del sitio de empalme no se pueden estudiar en el ensayo FRT.
La Tabla 6 enumera las mutaciones de CFTR sensibles en función de (1) una respuesta clínica de FEV1 y/o (2) datos in vitro en células FRT, lo que indica que tezacaftor/ivacaftor aumenta el transporte de cloruro a al menos el 10% de lo normal sobre la línea de base. Las mutaciones del gen CFTR que no responden a ivacaftor solo no se espera que respondan a SYMDEKO, excepto para los homocigotos F508del.
|
|||||
| 546insCTA | E92K | G576A | L346P | R117G | S589N |
| 711+3A→G* | E116K | G576A;R668C † | L967S | R117H | S737F |
| 2789+5G→A* | E193K | G622D | L997F | R117L | S912L |
| 3272-26A→G* | E403D | G970D | L1324P | R117P | S945L * |
| 3849+10kbC→T * | E588V | G1069R | L1335P | R170H | S977F* |
| A120T | E822K | G1244E | L1480P | R258G | S1159F |
| A234D | E831X | G1249R | M152V | R334L | S1159P |
| A349V | F191V | G1349D | M265R | R334Q | S1251N |
| A455E * | F311del | H939R | M952I | R347H * | S1255P |
| A554E | F311L | H1054D | M952T | R347L | T338I |
| A1006E | F508C | H1375P | P5L | R347P | T1036N |
| A1067T | F508C;S1251N † | I148T | P67L * | R352Q * | T1053I |
| D110E | F508del ‡ | I175V | P205S | R352W | V201M |
| D110H * | F575Y | I336K | Q98R | R553Q | V232D |
| D192G | F1016S | I601F | Q237E | R668C | V562I |
| D443Y | F1052V | I618T | Q237H | R751L | V754M |
| D443Y;G576A;R668C † | F1074L | I807M | Q359R | R792G | V1153E |
| D579G * | F1099L | I980K | Q1291R | R933G | V1240G |
| D614G | G126D | I1027T | R31L | R1066H | V1293G |
| D836Y | G178E | I1139V | R74Q | R1070Q | W1282R |
| D924N | G178R | I1269N | R74W | R1070W * | Y109N |
| D979V | G194R | I1366N | R74W;D1270N † | R1162L | Y161S |
| D1152H * | G194V | K1060T | R74W;V201M † | R1283M | Y1014C |
| D1270N | G314E | L15P | R74W;V201M;D1270N † | R1283S | Y1032C |
| E56K | G551D | L206W * | R75Q | S549N | |
| E60K | G551S | L320V | R117C * | S549R | |
12.2 Farmacodinamia
Efectos sobre el cloruro en el sudor
En el ensayo 1 (pacientes de 12 años o más que eran homocigotos para la mutación F508del), la diferencia de tratamiento entre SYMDEKO y placebo en el cambio absoluto medio desde el inicio en el cloruro en el sudor hasta la semana 24 fue de -10.1 mmol/L (IC del 95%: -11.4, -8.8).
En el ensayo 2 (pacientes de 12 años o más que eran heterocigotos para la mutación F508del y una segunda mutación que se predijo que respondería a tezacaftor/ivacaftor), la diferencia de tratamiento en el cambio absoluto medio desde el inicio en el cloruro en el sudor hasta la semana 8 fue de -9.5 mmol/L (IC del 95%: -11.7, -7.3) entre SYMDEKO y placebo, y de -4.5 mmol/L (IC del 95%: -6.7, -2.3) entre ivacaftor y placebo.
En el ensayo 4 (pacientes de 6 a menos de 12 años) se observó una reducción en el cloruro en el sudor desde el inicio hasta la semana 4 y se mantuvo durante todo el período de tratamiento de 24 semanas. El cambio absoluto medio en el cloruro en el sudor desde el inicio hasta la semana 24 fue de -14.5 mmol/L (IC del 95%: -17.4, -11.6).
Electrofisiología cardíaca
A una dosis 3 veces la dosis máxima recomendada aprobada, tezacaftor no prolonga el intervalo QT en ningún grado clínicamente relevante.
En un estudio separado de ivacaftor que evaluó dosis de hasta 3 veces la dosis máxima recomendada aprobada, ivacaftor no prolonga el intervalo QT en ningún grado clínicamente relevante.
12.3 Farmacocinética
La farmacocinética de tezacaftor e ivacaftor es similar entre voluntarios adultos sanos y pacientes con fibrosis quística. Después de la administración de una dosis diaria de tezacaftor y dos dosis diarias de ivacaftor en pacientes con fibrosis quística, las concentraciones plasmáticas de tezacaftor e ivacaftor alcanzan el estado estacionario dentro de los 8 días y dentro de los 3 a 5 días, respectivamente, después de iniciar el tratamiento. En el estado estacionario, la relación de acumulación es aproximadamente 1.5 para tezacaftor y 2.2 para ivacaftor. Las exposiciones de tezacaftor (administrado solo o en combinación con ivacaftor) aumentan de manera aproximadamente proporcional a la dosis con dosis crecientes de 10 mg a 300 mg una vez al día.
Los parámetros farmacocinéticos clave para tezacaftor e ivacaftor en estado estacionario se muestran en la Tabla 7.
| Fármaco | Cmax (mcg/mL) |
t½ efectivo (h) |
AUC0-24h o AUC0-12h (mcg∙h/mL)* |
|
|---|---|---|---|---|
|
||||
| Tezacaftor 100 mg una vez al día/ivacaftor 150 mg cada 12 horas | Tezacaftor | 5.95 (1.50) | 15.0 (3.44) | 84.5 (27.8) |
| Ivacaftor | 1.17 (0.424) | 13.7 (6.06) | 11.3 (4.60) | |
Absorción
Después de una dosis única en sujetos sanos en estado de ayuno, tezacaftor se absorbió con un tiempo medio (rango) hasta la concentración máxima (tmax) de aproximadamente 4 horas (2 a 6 horas). El tmax medio (rango) de ivacaftor fue de aproximadamente 6 horas (3 a 10 horas) en estado de ayuno.
Cuando se administró una dosis única de tezacaftor/ivacaftor con alimentos que contienen grasa, la exposición a tezacaftor fue similar y la exposición a ivacaftor fue aproximadamente 3 veces mayor que cuando se tomó en ayunas.
Distribución
Tezacaftor se une aproximadamente al 99% a las proteínas plasmáticas, principalmente a la albúmina. Ivacaftor se une aproximadamente al 99% a las proteínas plasmáticas, principalmente a la alfa 1-ácido glicoproteína y la albúmina. Después de la administración oral de tezacaftor 100 mg una vez al día/ivacaftor 150 mg cada 12 horas en pacientes con CF en estado de ayuno, la media (±DE) del volumen aparente de distribución de tezacaftor e ivacaftor fue de 271 (157) L y 206 (82.9) L, respectivamente. Ni tezacaftor ni ivacaftor se reparten preferentemente en los glóbulos rojos humanos.
Eliminación
Después de la administración oral de tezacaftor 100 mg una vez al día/ivacaftor 150 mg cada 12 horas en pacientes con CF en estado de ayuno, la media (±DE) de los valores de aclaramiento aparente de tezacaftor e ivacaftor fueron de 1.31 (0.41) y 15.7 (6.38) L/h, respectivamente. Después de la dosificación en estado estacionario de tezacaftor en combinación con ivacaftor en pacientes con CF, las semividas efectivas de tezacaftor e ivacaftor fueron de aproximadamente 15 (3.44) y 13.7 (6.06) horas, respectivamente.
Metabolismo
Tezacaftor se metaboliza ampliamente en humanos. Los datos in vitro sugieren que tezacaftor se metaboliza principalmente por CYP3A4 y CYP3A5. Después de la administración oral de una dosis única de 100 mg 14C-tezacaftor a sujetos masculinos sanos, M1, M2 y M5 fueron los tres metabolitos circulantes principales de tezacaftor en humanos. M1 tiene una potencia similar a la de tezacaftor y se considera farmacológicamente activo. M2 es mucho menos farmacológicamente activo que tezacaftor o M1, y M5 no se considera farmacológicamente activo. Otro metabolito circulante menor, M3, se forma por glucuronidación directa de tezacaftor.
Ivacaftor también se metaboliza ampliamente en humanos. Los datos in vitro e in vivo indican que ivacaftor se metaboliza principalmente por CYP3A4 y CYP3A5. M1 y M6 son los dos metabolitos principales de ivacaftor en humanos. M1 tiene aproximadamente una sexta parte de la potencia de ivacaftor y se considera farmacológicamente activo. M6 no se considera farmacológicamente activo.
Excreción
Después de la administración oral de 14C-tezacaftor, la mayoría de la dosis (72%) se excretó en las heces (sin cambios o como el metabolito M2) y alrededor del 14% se recuperó en la orina (principalmente como el metabolito M2), lo que resultó en una recuperación general media del 86% hasta 21 días después de la dosis. Menos del 1% de la dosis administrada se excretó en la orina como tezacaftor sin cambios, lo que demuestra que la excreción renal no es la principal vía de eliminación de tezacaftor en humanos.
Después de la administración oral de ivacaftor solo, la mayoría de ivacaftor (87.8%) se elimina en las heces después de la conversión metabólica. Hubo una eliminación mínima de ivacaftor y sus metabolitos en la orina (solo el 6.6% de la radiactividad total se recuperó en la orina), y hubo una excreción urinaria insignificante de ivacaftor como fármaco sin cambios.
Poblaciones específicas
Según los análisis de PK poblacionales, los parámetros de exposición de PK de tezacaftor/ivacaftor en niños y adolescentes (de 6 a <18 años) son similares al rango de AUCss observado en adultos cuando se administra en combinación.
Pacientes pediátricos de 6 a menos de 12 años
| Grupo de edad | Dosis | tezacaftor AUCss mcg∙h/mL* |
ivacaftor AUCss mcg∙h/mL* |
|---|---|---|---|
| 6 a <12 años † | 71.3 (28.3) | 8.5 (3.34) | |
| 6 a <12 años (<30 kg) | tezacaftor 50 mg/ ivacaftor 75 mg | 56.7 (22.3) | 6.92 (2.07) |
| 6 a <12 años (≥30 kg) † | tezacaftor 100 mg/ ivacaftor 150 mg | 92.7 (21.9) | 10.8 (3.52) |
Pacientes pediátricos de 12 a menos de 18 años
Después de la administración oral de tabletas de SYMDEKO, tezacaftor 100 mg una vez al día/ivacaftor 150 mg cada 12 horas, el AUCss medio (±DE) para tezacaftor e ivacaftor fue de 97,1 (35,8) mcg∙h/mL y 11,4 (5,50) mcg∙h/mL, respectivamente, similar al AUCss medio en pacientes adultos que recibieron tabletas de SYMDEKO, tezacaftor 100 mg una vez al día/ivacaftor 150 mg cada 12 horas.
Pacientes con insuficiencia hepática
Después de dosis múltiples de tezacaftor e ivacaftor durante 10 días, los pacientes con función hepática moderadamente deteriorada (Clase B de Child-Pugh, puntuación de 7 a 9) tuvieron un aumento aproximado del 36% en el AUC y un aumento del 10% en la Cmax para tezacaftor, y un aumento de 1,5 veces en el AUC de ivacaftor en comparación con sujetos sanos emparejados por características demográficas. En un estudio separado, los pacientes con función hepática moderadamente deteriorada (Clase B de Child-Pugh, puntuación de 7 a 9) tuvieron una Cmax de ivacaftor similar, pero un aumento aproximado de 2,0 veces en el AUC0-∞ de ivacaftor en comparación con sujetos sanos emparejados por características demográficas.
No se han realizado estudios farmacocinéticos en pacientes con insuficiencia hepática leve (Clase A de Child-Pugh, puntuación de 5 a 6) o grave (Clase C de Child-Pugh, puntuación de 10 a 15) que recibieron SYMDEKO. Se desconoce la magnitud del aumento de la exposición en pacientes con insuficiencia hepática grave, pero se espera que sea mayor que la observada en pacientes con insuficiencia hepática moderada [ver Dosificación y administración (2.3), Uso en poblaciones específicas (8.6), y Información para el paciente (17)].
Pacientes con insuficiencia renal
SYMDEKO no se ha estudiado en pacientes con insuficiencia renal moderada o grave (aclaramiento de creatinina ≤30 mL/min) o en pacientes con enfermedad renal terminal. En un estudio farmacocinético humano con tezacaftor solo, hubo una eliminación mínima de tezacaftor y sus metabolitos en la orina (solo el 13,7% de la radiactividad total se recuperó en la orina con un 0,79% como fármaco sin cambios).
En un estudio farmacocinético humano con ivacaftor solo, hubo una eliminación mínima de ivacaftor y sus metabolitos en la orina (solo el 6,6% de la radiactividad total se recuperó en la orina).
En el análisis farmacocinético poblacional, los datos de 665 pacientes con tezacaftor o tezacaftor en combinación con ivacaftor en ensayos clínicos indicaron que la insuficiencia renal leve (N=147; eGFR de 60 a menos de 90 mL/min/1,73 m2) y la insuficiencia renal moderada (N=7; eGFR de 30 a menos de 60 mL/min/1,73 m2) no afectaron significativamente el aclaramiento de tezacaftor [ver Uso en poblaciones específicas (8.7)].
Pacientes masculinos y femeninos
Los parámetros farmacocinéticos de tezacaftor e ivacaftor son similares en hombres y mujeres.
Estudios de interacciones medicamentosas
Se realizaron estudios de interacción medicamentosa con SYMDEKO y otros medicamentos que probablemente se administren conjuntamente o medicamentos que se utilizan comúnmente como sondas para estudios de interacción farmacocinética [ver Interacciones medicamentosas (7)].
Posibilidad de que tezacaftor/ivacaftor afecte otros medicamentos
Los estudios clínicos (con rosiglitazona y desipramina – ver Tabla 9) mostraron que ivacaftor no es un inhibidor de CYP2C8 o CYP2D6. Con base en los resultados in vitro, ivacaftor tiene el potencial de inhibir CYP3A y P-gp, y también puede inhibir CYP2C9. In vitro, ivacaftor no fue un inductor de isoenzimas CYP. Ivacaftor no es un inhibidor de los transportadores OATP1B1, OATP1B3, OCT1, OCT2, OAT1 u OAT3.
Con base en los resultados in vitro, tezacaftor tiene un bajo potencial para inhibir CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 y CYP3A4. Tezacaftor tiene un bajo potencial para inducir CYP3A, pero no es un inductor de CYP1A2 y CYP2B6. Tezacaftor tiene un bajo potencial para inhibir los transportadores P-gp, BCRP, OATP1B3, OCT2, OAT1 u OAT3.
Los estudios clínicos con midazolam mostraron que SYMDEKO no es un inhibidor de CYP3A. La coadministración de SYMDEKO con digoxina, un sustrato sensible de P-gp, aumentó la exposición a digoxina en 1,3 veces. La coadministración de SYMDEKO con un anticonceptivo oral de etinilestradiol/noretisterona no tuvo un efecto significativo en las exposiciones de los anticonceptivos hormonales. La coadministración de SYMDEKO con pitavastatina, un sustrato de OATP1B1, no tuvo un efecto clínicamente relevante en la exposición a pitavastatina.
Los efectos de tezacaftor e ivacaftor (o ivacaftor solo) en la exposición de los medicamentos coadministrados se muestran en la Tabla 9 [ver Interacciones medicamentosas (7)].
Posibilidad de que otros medicamentos afecten tezacaftor/ivacaftor
Los estudios in vitro mostraron que ivacaftor y tezacaftor fueron sustratos de las enzimas CYP3A (es decir, CYP3A4 y CYP3A5). La exposición a ivacaftor y tezacaftor se reducirá por inductores de CYP3A concomitantes y aumentará por inhibidores de CYP3A concomitantes.
Los estudios in vitro mostraron que tezacaftor es un sustrato para el transportador de captación OATP1B1 y los transportadores de eflujo P-gp y BCRP. Tezacaftor no es un sustrato para OATP1B3. Los estudios in vitro mostraron que ivacaftor no es un sustrato para OATP1B1, OATP1B3 o P-gp.
Los efectos de los medicamentos coadministrados en la exposición a tezacaftor e ivacaftor (o ivacaftor solo) se muestran en la Tabla 10 [ver Dosificación y administración (2.4) y Interacciones medicamentosas (7)].
| Dosis y horario | Razón media (IC del 90%) de otros medicamentos Sin efecto=1.0 |
||||
|---|---|---|---|---|---|
| Medicamento | Dosis | TEZ/IVA o IVA | Efecto en la farmacocinética del medicamento | AUC | Cmax |
| ↑ = aumento, ↓ = disminución, ↔ = sin cambios. IC = Intervalo de confianza; TEZ = tezacaftor; IVA = ivacaftor; PK = Farmacocinética | |||||
|
|||||
| Midazolam | 2 mg dosis oral única | TEZ 100 mg/IVA 150 mg cada mañana + IVA 150 mg cada noche | ↔ Midazolam | 1.12 (1.01, 1.25) |
1.13 (1.01, 1.25) |
| Digoxina | 0.5 mg dosis única | TEZ 100 mg/IVA 150 mg cada mañana + IVA 150 mg cada noche | ↑ Digoxina | 1.30 (1.17, 1.45) |
1.32 (1.07, 1.64) |
| Anticonceptivo oral | Etinilestradiol/ Noretisterona 0.035 mg/1.0 mg una vez al día |
TEZ 100 mg/IVA 150 mg cada mañana + IVA 150 mg cada noche | ↔ Etinilestradiol | 1.12 (1.03, 1.22) |
1.15 (0.99, 1.33) |
| ↔ Noretisterona | 1.05 (0.98, 1.12) |
1.01 (0.87, 1.19) |
|||
| Pitavastatina | 2 mg dosis única | TEZ 100 mg/IVA 150 mg cada mañana + IVA 150 mg cada noche | ↑ Pitavastatina* | 1.24 (1.17, 1.31) |
0.977 (0.841, 1.14) |
| Rosiglitazona | 4 mg dosis oral única | IVA 150 mg dos veces al día | ↔ Rosiglitazona | 0.975 (0.897, 1.06) |
0.928 (0.858, 1.00) |
| Desipramina | 50 mg dosis única | IVA 150 mg dos veces al día | ↔ Desipramina | 1.04 (0.985, 1.10) |
1.00 (0.939; 1.07) |
| Dosis y horario | Razón media (IC del 90%) de Tezacaftor e Ivacaftor Sin efecto = 1.0 |
||||
|---|---|---|---|---|---|
| Medicamento | Dosis | TEZ/IVA o IVA | Efecto en la FC de TEZ/IVA | AUC | Cmax |
| ↑ = aumento, ↓ = disminución, ↔ = sin cambios. IC = Intervalo de confianza; TEZ = tezacaftor; IVA = ivacaftor; FC = Farmacocinética | |||||
|
|||||
| Itraconazol | 200 mg dos veces al día el día 1, seguido de 200 mg una vez al día | TEZ 25 mg + IVA 50 mg una vez al día | ↑ Tezacaftor | 4.02 (3.71, 4.63) |
2.83 (2.62, 3.07) |
| ↑ Ivacaftor | 15.6 (13.4, 18.1) |
8.60 (7.41, 9.98) |
|||
| Ciprofloxacina | 750 mg dos veces al día | TEZ 50 mg + IVA 150 mg dos veces al día | ↔ Tezacaftor | 1.08 (1.03, 1.13) |
1.05 (0.99, 1.11) |
| ↑ Ivacaftor* | 1.17 (1.06, 1.30) |
1.18 (1.06, 1.31) |
|||
| Anticonceptivo oral | Noretisterona/etinilestradiol 1.0 mg/0.035 mg una vez al día | TEZ 100 mg/IVA 150 mg cada mañana + IVA 150 mg cada noche | ↔ Tezacaftor | 1.01 (0.963, 1.05) |
1.01 (0.933, 1.09) |
| ↔ Ivacaftor | 1.03 (0.960, 1.11) |
1.03 (0.941, 1.14) |
|||
| Rifampicina | 600 mg una vez al día | IVA 150 mg dosis única | ↓ Ivacaftor | 0.114 (0.097, 0.136) |
0.200 (0.168, 0.239) |
| Fluconazol | 400 mg dosis única el día 1, seguido de 200 mg una vez al día | IVA 150 mg dos veces al día | ↑ Ivacaftor | 2.95 (2.27, 3.82) |
2.47 (1.93, 3.17) |
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
No se realizaron estudios de carcinogenicidad, mutagenicidad o deterioro de la fertilidad con la combinación de tezacaftor e ivacaftor, sin embargo, a continuación se describen estudios separados de tezacaftor e ivacaftor.
Tezacaftor
Se realizaron un estudio de 2 años en ratas Sprague-Dawley y un estudio de 6 meses en ratones transgénicos Tg.rasH2 para evaluar el potencial carcinogénico de tezacaftor. No se observó evidencia de tumorigénesis por tezacaftor en ratas macho y hembra a dosis orales de hasta 50 y 75 mg/kg/día (aproximadamente 2 y 3 veces la MRHD basada en la suma de las AUC de tezacaftor y sus metabolitos en machos y hembras, respectivamente). No se observó evidencia de tumorigénesis en ratones transgénicos Tg.rasH2 macho y hembra a dosis de tezacaftor de hasta 500 mg/kg/día.
Tezacaftor fue negativo para genotoxicidad en los siguientes ensayos: prueba de Ames para mutación genética bacteriana, ensayo de aberración cromosómica in vitro en células de ovario de hámster chino y prueba de micronúcleos de ratón in vivo.
No hubo efectos sobre la fertilidad masculina o femenina y el desarrollo embrionario temprano en ratas a dosis orales de tezacaftor de hasta 100 mg/kg/día (aproximadamente 3 veces la MRHD basada en la suma de las AUC de tezacaftor y el metabolito M1).
Ivacaftor
Se realizaron estudios de dos años en ratones CD-1 y ratas Sprague-Dawley para evaluar el potencial carcinogénico de ivacaftor. No se observó evidencia de tumorigénesis por ivacaftor en ratones o ratas a dosis orales de hasta 200 mg/kg/día y 50 mg/kg/día, respectivamente (aproximadamente equivalente a 2 y 9 veces la MRHD, respectivamente, basada en la suma de las AUC de ivacaftor y sus metabolitos).
Ivacaftor fue negativo para genotoxicidad en los siguientes ensayos: prueba de Ames para mutación genética bacteriana, ensayo de aberración cromosómica in vitro en células de ovario de hámster chino y prueba de micronúcleos de ratón in vivo.
Ivacaftor deterioró la fertilidad y los índices de rendimiento reproductivo en ratas macho y hembra a 200 mg/kg/día (aproximadamente 9 y 6 veces, respectivamente, la MRHD basada en la suma de las AUC de ivacaftor y sus metabolitos). Se observaron aumentos en el diestro prolongado en las hembras a 200 mg/kg/día. Ivacaftor también aumentó el número de hembras con todos los embriones no viables y disminuyó los cuerpos lúteos, las implantaciones y los embriones viables en ratas a 200 mg/kg/día (aproximadamente 6 veces la MRHD basada en la suma de las AUC de ivacaftor y sus metabolitos) cuando las presas fueron dosificadas antes y durante el embarazo temprano. Estos deterioros de la fertilidad y el rendimiento reproductivo en ratas macho y hembra a 200 mg/kg/día se atribuyeron a toxicidad severa. No se observaron efectos sobre la fertilidad masculina o femenina y los índices de rendimiento reproductivo a ≤100 mg/kg/día (aproximadamente 6 y 4 veces, respectivamente, la MRHD basada en la suma de las AUC de ivacaftor y sus metabolitos).
14 ESTUDIOS CLÍNICOS
Rango de Dosis:
La selección de dosis para el programa clínico consistió principalmente en un ensayo de múltiples cohortes, doble ciego, controlado con placebo que incluyó a 176 pacientes con CF (homocigotos para la mutación F508del) de 18 años de edad o mayores con un ppFEV1≥40 en la selección. En el estudio, 34 y 106 pacientes, respectivamente, recibieron tezacaftor en dosis únicas diarias de 10 mg, 30 mg, 100 mg o 150 mg solo o en combinación con ivacaftor 150 mg q12h, y 33 pacientes recibieron placebo. Durante el período de tratamiento de 28 días, se observaron aumentos dependientes de la dosis en el cambio medio de ppFEV1 desde el inicio con tezacaftor en combinación con ivacaftor. Tezacaftor/ivacaftor en general tuvo un efecto de tratamiento medio mayor que tezacaftor solo. No se observó ningún beneficio adicional a dosis de tezacaftor superiores a 100 mg diarios.
Eficacia:
La eficacia de SYMDEKO en pacientes con CF de 12 años de edad o mayores se evaluó en tres ensayos doble ciego, controlados con placebo (Ensayos 1, 2 y 3).
El Ensayo 1 fue un estudio de dos brazos, aleatorizado, doble ciego, controlado con placebo, de 24 semanas en pacientes con CF que eran homocigotos para la mutación F508del en el gen CFTR.
El Ensayo 2 fue un estudio de cruce de 8 semanas, aleatorizado, doble ciego, controlado con placebo, de 2 períodos y 3 tratamientos en pacientes con CF que eran heterocigotos para la mutación F508del y una segunda mutación que se predijo que respondería a tezacaftor/ivacaftor. Las mutaciones que se predijeron que responderían se seleccionaron para el estudio en función del fenotipo clínico (suficiencia pancreática), datos de biomarcadores (cloruro en sudor) y la respuesta in vitro a tezacaftor/ivacaftor [ver Estudios Clínicos (14.2)]. Los pacientes fueron aleatorizados y recibieron secuencias de tratamiento que incluyeron SYMDEKO, ivacaftor y placebo.
El Ensayo 3 fue un estudio de dos brazos, aleatorizado, doble ciego, controlado con placebo, de 12 semanas en pacientes con CF que eran heterocigotos para la mutación F508del y una segunda mutación CFTR que se predijo que no respondería a tezacaftor/ivacaftor. Las mutaciones que se predijeron que no responderían se seleccionaron para el estudio en función de la plausibilidad biológica (clase de mutación), el fenotipo clínico (insuficiencia pancreática), los datos de biomarcadores (cloruro en sudor) y las pruebas in vitro a tezacaftor y/o ivacaftor.
Los pacientes en todos los ensayos continuaron con sus terapias estándar para la CF (por ejemplo, broncodilatadores, antibióticos inhalados, dornase alfa y solución salina hipertónica) y fueron elegibles para pasar a una extensión de etiqueta abierta de 96 semanas. Los pacientes tenían un ppFEV1 en la selección entre 40-90%. Los pacientes con antecedentes de colonización con organismos asociados con un declive más rápido en el estado pulmonar, como Burkholderia cenocepacia, Burkholderia dolosa o Mycobacterium abscessus, o que tuvieron 2 o más pruebas de función hepática anormales en la selección (ALT, AST, AP, GGT ≥3 × ULN o bilirrubina total ≥2 × ULN) o AST o ALT ≥5 × ULN, fueron excluidos de los ensayos.
14.1 Ensayo en pacientes con CF que eran homocigotos para la mutación F508del en el gen CFTR (Ensayo 1)
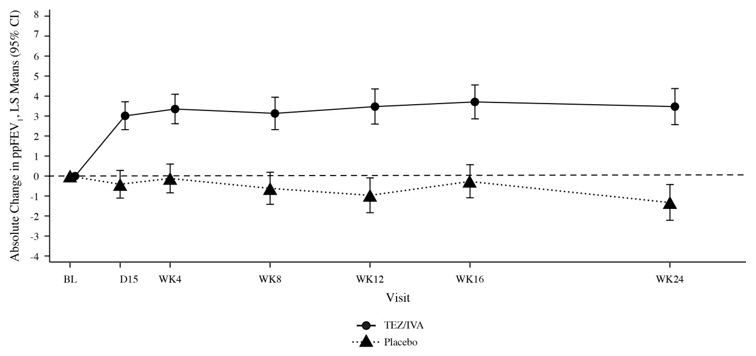
El Ensayo 1 evaluó a 504 pacientes (248 SYMDEKO, 256 placebo) con CF de 12 años de edad o mayores (edad media de 26,3 años). El ppFEV1 medio en el inicio fue del 60,0% (rango: 27,8% a 96,2%). El criterio de valoración principal de eficacia fue el cambio en la función pulmonar, determinado por el cambio absoluto desde el inicio en ppFEV1 hasta la semana 24. El tratamiento con SYMDEKO dio como resultado una mejora estadísticamente significativa en ppFEV1. La diferencia de tratamiento entre SYMDEKO y placebo para el cambio absoluto medio en ppFEV1 desde el inicio hasta la semana 24 fue de 4,0 puntos porcentuales (IC del 95%: 3,1, 4,8; P<0,0001). Estos cambios persistieron durante todo el período de tratamiento de 24 semanas (Figura 2). Se observaron mejoras en ppFEV1 independientemente de la edad, el sexo, el ppFEV1 inicial, la colonización con Pseudomonas, el uso concomitante de medicamentos estándar para la CF y la región geográfica.
Las variables clave de eficacia secundaria incluyeron el cambio relativo desde el inicio en ppFEV1 hasta la semana 24; el número de exacerbaciones pulmonares desde el inicio hasta la semana 24; el cambio absoluto en el IMC desde el inicio en la semana 24 y el cambio absoluto en la puntuación del dominio respiratorio de CFQ-R (una medida de los síntomas respiratorios relevantes para los pacientes con CF, como la tos, la producción de esputo y la dificultad para respirar) desde el inicio hasta la semana 24. A los efectos de este ensayo, una exacerbación pulmonar se definió como un cambio en la terapia antibiótica (IV, inhalada u oral) como resultado de 4 o más de 12 signos/síntomas sinopulmonares preespecificados. Ver Tabla 11 para un resumen de los resultados secundarios clave en el Ensayo 1.
| Placebo N=256 |
SYMDEKO N=248 |
||
|---|---|---|---|
| IMC: índice de masa corporal; IC: intervalo de confianza; CFQ-R: Cuestionario Revisado de Fibrosis Quística; IVA: ivacaftor; NA: no aplicable; ppFEV1: porcentaje de volumen espiratorio forzado en 1 segundo predicho; | |||
|
|||
| Cambio relativo en ppFEV1 desde el inicio hasta la semana 24 (%) | Diferencia de tratamiento (IC del 95%) | – | 6.8 (5.3, 8.3) |
| P valor | NA | P<0.0001† | |
| Número de exacerbaciones pulmonares desde el inicio hasta la semana 24 | Número de eventos (tasa de eventos por año‡) Razón de tasas (IC del 95%) |
122 (0.99) | 78 (0.64) 0.65 (0.48, 0.88) |
| P valor | NA | P=0.0054† | |
| Cambio absoluto en el IMC desde el inicio en la semana 24 (kg/m2) | Diferencia de tratamiento (IC del 95%) | – | 0.06 (-0.08, 0.19) |
| Cambio absoluto en la puntuación del dominio respiratorio de CFQ-R desde el inicio hasta la semana 24 (puntos) | Diferencia de tratamiento (IC del 95%) | – | 5.1 (3.2, 7.0) |
Figura 2: Cambio Absoluto desde la Línea Base en Porcentaje de FEV1 Predicho en Cada Visita en el Ensayo 1
14.2 Ensayo en Pacientes con CF que Eran Heterocigotos para la Mutación F508del y una Segunda Mutación Predicha para Ser Responsiva a Tezacaftor/Ivacaftor (Ensayo 2)
El Ensayo 2 evaluó a 244 pacientes con CF de 12 años de edad o mayores (edad promedio de 34.8 años). El ppFEV1 promedio en la línea base fue de 62.3% (rango: 34.6 a 93.5). De los 244 pacientes incluidos en el análisis de eficacia, 146 pacientes tenían una mutación de empalme y 98 pacientes tenían una mutación de sentido erróneo como segundo alelo. 161 pacientes recibieron SYMDEKO, 156 pacientes recibieron ivacaftor y 161 pacientes recibieron placebo. El criterio de valoración principal de eficacia fue el cambio absoluto promedio desde la línea base del estudio en el porcentaje de FEV1 predicho promediado en las semanas 4 y 8 de tratamiento. El criterio de valoración secundario clave fue el cambio absoluto en la puntuación del dominio respiratorio CFQ-R desde la línea base del estudio promediado en las semanas 4 y 8 de tratamiento. Para la población general, el tratamiento con SYMDEKO en comparación con el placebo resultó en una mejora significativa en ppFEV1 (6.8 puntos porcentuales [IC del 95%: 5.7, 7.8]; P<0.0001) y en la puntuación del dominio respiratorio CFQ-R (11.1 puntos (IC del 95%: 8.7, 13.6); P<0.0001). La diferencia de tratamiento para ppFEV1 entre los pacientes tratados con ivacaftor y placebo fue de 4.7 puntos porcentuales (IC del 95%: 3.7, 5.8; P<0.0001) y 2.1 puntos porcentuales (IC del 95%: 1.2, 2.9; P<0.0001) entre los pacientes tratados con SYMDEKO e ivacaftor, lo que fue estadísticamente significativo. Se observaron mejoras en ppFEV1 independientemente de la edad, ppFEV1 basal, sexo, clase de mutación, colonización con Pseudomonas, uso concomitante de medicamentos estándar de atención para CF y región geográfica. También se observaron mejoras estadísticamente significativas en comparación con el placebo en el subgrupo de pacientes con mutaciones de empalme y mutaciones de sentido erróneo (Tabla 12).
| Mutación (n) | Cambio Absoluto en el Porcentaje de FEV1 Predicho*† | Cambio Absoluto en la Puntuación del Dominio Respiratorio CFQ-R (Puntos)*‡ | Cambio Absoluto en Cloruro de Sudor (mmol/L)*‡ |
|---|---|---|---|
| (n=) número de pacientes analizados | |||
|
|||
| Mutaciones de empalme (n= 93 para TEZ/IVA, n=97 para PBO) Resultados mostrados como diferencia en la media (IC del 95%) del cambio desde la línea base del estudio para los pacientes tratados con SYMDEKO vs. placebo: |
|||
| 7.4 (6.0, 8.7) | 9.5 (6.3, 12.7) | -5.4 (-8.0, -2.7) | |
| Por mutación de empalme individual (n). Resultados mostrados como media (mínimo, máximo) para el cambio desde la línea base del estudio para los pacientes tratados con SYMDEKO | |||
| 2789+5G→A (25 ) | 8.6 (-1.5, 23.4) | 12.0 (-8.3, 38.9) | -3.2 (-16.5, 9.0) |
| 3272-26A→G (23) | 5.7 (-2.1, 25.9) | 5.7 (-22.2, 44.4) | -3.8 (-22.3, 16.5) |
| 3849+10kbC→T (43) | 5.8 (-7.2, 22.3) | 8.2 (-25.0, 47.2) | -5.6 (-27.0, 8.5) |
| 711+3A→G (2) | 4.3 (2.0, 6.7) | -4.2 (-5.6, -2.8) | -15.4 (-21.0, -9.8) |
| E831X§ (0) | NA | NA | NA |
| Mutaciones de sentido erróneo (n=66 para TEZ/IVA, n=63 para PBO) Resultados mostrados como diferencia en la media (IC del 95%) del cambio desde la línea base del estudio para los pacientes tratados con SYMDEKO vs. placebo: |
|||
| 5.9 (4.2, 7.5) | 13.4 (9.6, 17.3) | -16.3 (-19.7, -12.9) | |
| Por mutación de sentido erróneo individual (n). Resultados mostrados como media (mínimo, máximo) para el cambio desde el inicio del estudio para pacientes tratados con SYMDEKO | |||
| D579G (2) | 8.1 (-0.2, 16.4) | 11.1 (5.6, 16.7) | -23.1 (-24.8, -21.5) |
| D110H (1) | -1.0 (-1.0, -1.0) | -11.1 (-11.1, -11.1) | -22.5 (-22.5, -22.5) |
| D1152H (21) | 3.8 (-2.5, 12.5) | 15.2 (-8.3, 55.6) | -4.1 (-15.0, 11.5) |
| A455E (11) | 8.5 (2.6, 16.1) | 11.6 (-11.1, 44.4) | -0.3 (-8.8, 14.0) |
| L206W (4) | 3.0 (-4.5, 10.2) | 12.5 (-2.8, 38.9) | -36.1 (-44.5, -27.5) |
| P67L (11) | 9.4 (0.0, 31.9) | 11.7 (-12.5, 72.2) | -29.3 (-50.0, 0.8) |
| R1070W (2) | 6.1 (2.0, 10.1) | 29.2 (16.7, 41.7) | -13.8 (-26.8, -0.8) |
| R117C (1) | 2.9 (2.9, 2.9) | 16.7 (16.7, 16.7) | -38.8 (-38.8, -38.8) |
| R347H (2) | -0.5 (-2.8, 1.7) | 5.6 (-5.6, 16.7) | -13.8 (-19.0, -8.5) |
| R352Q (2) | 4.9 (2.6, 7.1) | 8.3 (8.3, 8.3) | -43.3 (-49.8, -36.8) |
| S945L (7) | 9.6 (0.7, 19.5) | 11.3 (-4.2, 25.0) | -29.0 (-42.5, -8.0) |
| S977F (2) | 10.1 (5.5, 14.7) | -1.4 (-8.3, 5.6) | -13.9 (-22.3, -5.5) |
En un análisis del IMC en la semana 8, un punto final exploratorio, los pacientes tratados con SYMDEKO tuvieron una mejora media de 0.2 kg/m2 (IC del 95% [0.0, 0.3]), 0.1 kg/m2 (IC del 95% [-0.1, 0.3]), y 0.3 kg/m2 (IC del 95% [0.1, 0.5]) en comparación con el placebo para las poblaciones generales, de empalme y de mutación de sentido erróneo de pacientes, respectivamente.
14.3 Ensayo en pacientes con fibrosis quística que eran heterocigotos para la mutación F508del y una segunda mutación que no se predijo que fuera sensible a tezacaftor/ivacaftor (Ensayo 3)
El ensayo 3 evaluó a 168 pacientes con fibrosis quística (83 SYMDEKO y 85 placebo) de 12 años o más (edad media de 26.1 años) que eran heterocigotos para la mutación F508del y tenían una segunda mutación CFTR que se predijo que no respondería a tezacaftor/ivacaftor. Los pacientes con fibrosis quística con la mutación F508del y una de las siguientes mutaciones en el gen CFTR fueron incluidos en el estudio (enumerados en orden decreciente de frecuencia): W1282X, G542X, N1303K, 621+1G>T, 1717-1G>A, 1898+1G>A, CFTRdele2,3, 2183delAA>G, 2184insA, R1162X, R553X, 3659delC, 3905insT, G970R, I507del, R1066C, R347P, 1154insTC, 1811+1.6kbA>G, 2184delA, 405+1G>A, E60X, G85E, L1077P, Q39X, S466X, Y1092X, 1078delT, 1248+1G>A, 1677delTA, 1812-1G>A, 2869INSG, 3120+1G>A, 394delTT, 457TAT>G, 711+1G>T, 711+5G>A, 712-1G>T, G673x, L1065P, Q220X, Q493X, R709X, V520F. La ppFEV1 media al inicio del estudio fue del 57.5% [rango: 31.0 a 96.7]. El punto final principal de eficacia fue el cambio desde el inicio del estudio en la ppFEV1 absoluta hasta la semana 12. La diferencia general en el tratamiento entre SYMDEKO y el placebo para el cambio absoluto medio en la ppFEV1 desde el inicio del estudio hasta la semana 12 fue de 1.2 puntos porcentuales (IC del 95%: -0.3, 2.6). Este estudio se terminó después del análisis intermedio planificado porque se cumplieron los criterios de inutilidad preespecificados.
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
SYMDEKO (tezacaftor 50 mg/ivacaftor 75 mg tableta de dosis fija combinada envasada junto con la tableta de ivacaftor 75 mg):
- Las tabletas de combinación de dosis fija de tezacaftor 50 mg/ivacaftor 75 mg se suministran como tabletas blancas en forma de cápsula que contienen 50 mg de tezacaftor y 75 mg de ivacaftor. Cada tableta está marcada con “V50” en un lado y lisa en el otro.
- Las tabletas de ivacaftor 75 mg se suministran como tabletas de color azul claro, recubiertas con película, en forma de cápsula que contienen 75 mg de ivacaftor. Cada tableta está impresa con los caracteres “V 75” en un lado y lisa en el otro.
- Cartón de tabletas de 56 unidades que contiene un suministro de 4 semanas (4 monederos semanales, cada uno con 14 tabletas) NDC 51167-113-01
SYMDEKO (tezacaftor 100 mg/ivacaftor 150 mg tabletas de dosis fija combinada envasadas junto con la tableta de ivacaftor 150 mg):
- Las tabletas de combinación de dosis fija de tezacaftor 100 mg/ivacaftor 150 mg se suministran como tabletas amarillas en forma de cápsula que contienen 100 mg de tezacaftor y 150 mg de ivacaftor. Cada tableta está marcada con “V100” en un lado y lisa en el otro.
- Las tabletas de ivacaftor 150 mg se suministran como tabletas de color azul claro, recubiertas con película, en forma de cápsula que contienen 150 mg de ivacaftor. Cada tableta está impresa con los caracteres “V 150” en un lado y lisa en el otro.
- Cartón de tabletas de 56 unidades que contiene un suministro de 4 semanas (4 monederos semanales, cada uno con 14 tabletas) NDC 51167-661-01
Almacenar a 68°F a 77°F (20°C a 25°C); se permiten excursiones a 59°F a 86°F (15°C a 30°C) [ver Temperatura ambiente controlada USP].
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente que lea el etiquetado del paciente aprobado por la FDA (Información para el paciente).
Elevaciones y monitoreo de transaminasas (ALT o AST)
Informe a los pacientes que se han producido elevaciones en las pruebas hepáticas en pacientes tratados con SYMDEKO o con ivacaftor solo. Las transaminasas (ALT y AST) deben evaluarse antes de iniciar SYMDEKO, cada 3 meses durante el primer año de tratamiento y anualmente a partir de entonces. Se debe considerar un monitoreo más frecuente en pacientes con antecedentes de elevaciones de transaminasas [ver Advertencias y precauciones (5.1)].
Reacciones de hipersensibilidad, incluida la anafilaxia
Las reacciones de hipersensibilidad, incluida la anafilaxia, son posibles con el uso de SYMDEKO. Informe a los pacientes sobre los signos tempranos de reacciones de hipersensibilidad, que incluyen erupción cutánea, urticaria, picazón, hinchazón facial, opresión en el pecho y sibilancias. Aconseje a los pacientes que suspendan el uso de SYMDEKO inmediatamente y que se pongan en contacto con su médico o acudan al departamento de emergencias si se presentan estos síntomas.
Interacciones medicamentosas con inductores e inhibidores del CYP3A
Pídale a los pacientes que le digan todos los medicamentos que están tomando, incluidos los suplementos herbales o las vitaminas. No se recomienda la coadministración de SYMDEKO con inductores fuertes del CYP3A (por ejemplo, rifampicina, hierba de San Juan), ya que pueden reducir la eficacia terapéutica de SYMDEKO. Se recomienda ajustar la dosis a un comprimido de tezacaftor/ivacaftor dos veces por semana, tomado aproximadamente 3 a 4 días separados, cuando se administra conjuntamente con inhibidores fuertes del CYP3A, como el ketoconazol. Aconseje al paciente que no tome la dosis vespertina de ivacaftor. Se recomienda una reducción de la dosis a un comprimido de tezacaftor/ivacaftor o ivacaftor, tomado en días alternos por la mañana, cuando se administra conjuntamente con inhibidores moderados del CYP3A, como el fluconazol. Aconseje al paciente que no tome la dosis vespertina de ivacaftor. Se debe evitar el consumo de alimentos o bebidas que contengan pomelo [ver Advertencias y precauciones (5.3), Interacciones medicamentosas (7) y Farmacología clínica (12.3)].
Cataratas
Informe a los pacientes que se ha observado una anormalidad del cristalino del ojo (catarata) en algunos niños y adolescentes que reciben SYMDEKO o con ivacaftor solo. Se deben realizar exámenes oftalmológicos de referencia y de seguimiento en pacientes pediátricos que inicien el tratamiento con SYMDEKO [ver Advertencias y precauciones (5.4)].
Uso en pacientes con insuficiencia hepática
Pregunte o evalúe si los pacientes tienen insuficiencia hepática. Ajuste la dosis en pacientes con función hepática moderadamente deteriorada (Clase B de Child-Pugh, puntuación 7-9) a un comprimido de tezacaftor/ivacaftor una vez al día por la mañana y aconseje al paciente que no tome la dosis vespertina de ivacaftor. SYMDEKO no se ha estudiado en pacientes con insuficiencia hepática grave (Clase C de Child-Pugh, puntuación 10-15); sin embargo, se espera que la exposición sea sustancialmente mayor que la observada en pacientes con insuficiencia hepática moderada. Cuando se espera que los beneficios superen los riesgos, SYMDEKO debe utilizarse con precaución en pacientes con insuficiencia hepática grave a una dosis de un comprimido de tezacaftor/ivacaftor una vez al día por la mañana o con menos frecuencia. Aconseje al paciente que no tome la dosis vespertina de ivacaftor. No se recomienda ningún ajuste de dosis para pacientes con insuficiencia hepática leve (Clase A de Child-Pugh, puntuación 5-6) [ver Dosificación y administración (2.3), Uso en poblaciones específicas (8.6) y Farmacología clínica (12.3)].
Conducir y operar maquinaria
Se ha informado de mareos en pacientes que reciben SYMDEKO, lo que podría influir en la capacidad para conducir o operar maquinaria [ver Reacciones adversas (6.1)]. Aconseje a los pacientes que no conduzcan ni operen maquinaria si experimentan mareos hasta que los síntomas desaparezcan.
Administración
Informe a los pacientes que SYMDEKO se absorbe mejor por el cuerpo cuando se toma con alimentos que contienen grasa. Una dieta típica de FC satisfará este requisito. Algunos ejemplos son los huevos, la mantequilla, la mantequilla de cacahuete, la pizza de queso, los productos lácteos enteros (como la leche entera, el queso y el yogur), etc. [ver Dosificación y administración (2.1) y Farmacología clínica (12.3)].
Se debe informar a los pacientes sobre qué hacer en caso de que se olviden de tomar una dosis de SYMDEKO o ivacaftor:
- Si han pasado 6 horas o menos desde la hora en que normalmente se toma SYMDEKO, se debe instruir a los pacientes para que tomen la dosis prescrita de SYMDEKO con alimentos que contengan grasa lo antes posible.
- Si han pasado más de 6 horas desde la hora en que normalmente se toma SYMDEKO, NO se debe tomar la dosis olvidada y el paciente debe reanudar el régimen de dosificación habitual.
- Se debe aconsejar a los pacientes que se pongan en contacto con su proveedor de atención médica si tienen alguna pregunta.
SECCIÓN NO CLASIFICADA SPL

Fabricado para
Vertex Pharmaceuticals Incorporated
50 Northern Avenue
Boston, MA 02210
SYMDEKO, VERTEX y el logotipo del triángulo VERTEX son marcas comerciales registradas de Vertex Pharmaceuticals Incorporated.
Todas las demás marcas comerciales mencionadas en este documento son propiedad de sus respectivos dueños.
©2023 Vertex Pharmaceuticals Incorporated
TODOS LOS DERECHOS RESERVADOS
INSERTO PARA EL PACIENTE
| INFORMACIÓN PARA EL PACIENTE SYMDEKO (SIM-deh-koh) (tabletas de tezacaftor/ivacaftor; tabletas de ivacaftor) para uso oral |
||||
¿Qué es SYMDEKO?
No se sabe si SYMDEKO es seguro y eficaz en niños menores de 6 años. |
||||
Antes de tomar SYMDEKO, informe a su médico sobre todas sus afecciones médicas, incluso si:
Informe a su médico sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos herbales,
Conozca los medicamentos que toma. Mantenga una lista de ellos para mostrársela a su médico y farmacéutico cuando obtenga un nuevo medicamento. |
||||
¿Cómo debo tomar SYMDEKO?
|
||||
¿Qué debo evitar mientras tomo SYMDEKO?
|
||||
| ¿Cuáles son los posibles efectos secundarios de SYMDEKO? SYMDEKO puede causar efectos secundarios graves, entre los que se incluyen:
Su médico puede hacer más pruebas de sangre para controlar el hígado con más frecuencia si ha tenido enzimas hepáticas elevadas en la sangre en el pasado. |
||||
|
|
|||
|
||||
|
|
|||
Los efectos secundarios más comunes de SYMDEKO incluyen: |
||||
|
|
|||
| Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca. Estos no son todos los posibles efectos secundarios de SYMDEKO. Llame a su médico para recibir consejo médico sobre los efectos secundarios. Puede notificar los efectos secundarios a la FDA al 1-800-FDA-1088. |
||||
¿Cómo debo almacenar SYMDEKO?
Mantener SYMDEKO y todos los medicamentos fuera del alcance de los niños. |
||||
| Información general sobre el uso seguro y eficaz de SYMDEKO. Los medicamentos a veces se recetan para fines distintos a los enumerados en un folleto de información para el paciente. No use SYMDEKO para una condición para la que no se haya recetado. No dé SYMDEKO a otras personas, incluso si tienen los mismos síntomas que usted. Puede hacerles daño. Puede pedir a su farmacéutico o médico información sobre SYMDEKO escrita para profesionales de la salud. |
||||
| ¿Cuáles son los ingredientes de SYMDEKO? Comprimidos de tezacaftor/ivacaftor: Ingredientes activos: tezacaftor e ivacaftor Ingredientes inactivos: acetato succinato de hipromelosa, sulfato de laurilo sódico, hipromelosa, celulosa microcristalina, sodio croscarmelosa, estearato de magnesio, HPMC/hipromelosa 2910, hidroxipropilcelulosa, dióxido de titanio, talco y óxido de hierro amarillo (solo en comprimidos de tezacaftor 100 mg/ivacaftor 150 mg). Comprimidos de ivacaftor: Ingredientes activos: ivacaftor Ingredientes inactivos: dióxido de silicio coloidal, sodio croscarmelosa, acetato succinato de hipromelosa, lactosa monohidrato, estearato de magnesio, celulosa microcristalina, sulfato de laurilo sódico, cera de carnauba, FD&C Blue #2, PEG 3350, alcohol polivinílico, talco, dióxido de titanio, hidróxido de amonio, óxido de hierro negro, propilenglicol y laca. |
||||
|
|
||||
| Producido para: Vertex Pharmaceuticals Incorporated; 50 Northern Avenue, Boston, MA 02210 SYMDEKO, VERTEX y el logotipo del triángulo VERTEX son marcas registradas de Vertex Pharmaceuticals Incorporated. Todas las demás marcas comerciales mencionadas aquí son propiedad de sus respectivos dueños. ©2023 Vertex Pharmaceuticals Incorporated Para más información, visite www.symdeko.com o llame al 1-877-752-5933. |
||||
| Esta Información para Pacientes ha sido aprobada por la Administración de Alimentos y Medicamentos de EE.UU. | Revisado: 08/2023 | |||
PANEL PRINCIPAL DE VISUALIZACIÓN – Caja del Kit
Rx Only
NDC 51167-661-01
symdeko®
(tezacaftor/ivacaftor) 100 mg/150 mg
y comprimidos de (ivacaftor) 150 mg
56 comprimidos
Contiene un suministro de SYMDEKO para 4 semanas
4 blísteres semanales, cada uno con 14 comprimidos:
(7 comprimidos de tezacaftor/ivacaftor y 7 comprimidos de ivacaftor)
LEVANTAR AQUÍ PARA ABRIR ▶
PANEL PRINCIPAL DE VISUALIZACIÓN – Caja de Kit – 113
Rx Only
NDC 51167-113-01
symdeko®
(tezacaftor/ivacaftor) 50 mg/75 mg
y (ivacaftor) 75 mg tabletas
56 tabletas
Contiene suministro de 4 semanas de SYMDEKO
4 tarjetas blíster semanales, cada una con 14 tabletas:
(7 tabletas de tezacaftor/ivacaftor y 7 tabletas de ivacaftor)
LEVANTAR AQUÍ PARA ABRIR ▶