Fabricante de medicamentos: Dr.Reddys Laboratories Inc (Updated: 2022-03-16)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
Cápsulas de SUNITINIB MALATE, para uso oral
Aprobación inicial en EE. UU.: 2006
ADVERTENCIA: HEPATOTOXICIDADConsulte la información de prescripción completa para ver la advertencia completa en el recuadro.La hepatotoxicidad puede ser grave y, en algunos casos, mortal. Monitorice la función hepática e interrumpa, reduzca la dosis o suspenda sunitinib malate según se recomienda [consulte Advertencias y precauciones (5.1)].
CAMBIOS IMPORTANTES RECIENTES
Dosificación y administración, Modificaciones de la dosis por reacciones adversas (2.4) 8/2021
Dosificación y administración, Modificación de la dosis por interacciones medicamentosas (2.5) 8/2021
Advertencias y precauciones, Hepatotoxicidad (5.1) 8/2021
Advertencias y precauciones, Hipertensión (5.4) 8/2021
Advertencias y precauciones, Eventos hemorrágicos y perforación viscosa (5.5) 8/2021
Advertencias y precauciones, Síndrome de leucoencefalopatía posterior reversible (5.10) 8/2021
Advertencias y precauciones, Hipoglucemia (5.12) 8/2021
Advertencias y precauciones, Osteonecrosis de la mandíbula (5.13) 8/2021
INDICACIONES Y USO
Sunitinib malate es un inhibidor de cinasa indicado para:
- tratamiento de pacientes adultos con tumor del estroma gastrointestinal (GIST) después de la progresión de la enfermedad o intolerancia a imatinib mesylate. (1.1)
- tratamiento de pacientes adultos con carcinoma de células renales (RCC) avanzado. (1.2)
- tratamiento adyuvante de pacientes adultos con alto riesgo de RCC recurrente después de una nefrectomía. (1.3)
- tratamiento de tumores neuroendocrinos pancreáticos (pNET) progresivos y bien diferenciados en pacientes adultos con enfermedad irresecable localmente avanzada o metastásica. (1.4)
DOSIS Y ADMINISTRACIÓN
GIST y RCC avanzado:
• La dosis recomendada es de 50 mg por vía oral una vez al día durante las primeras 4 semanas de cada ciclo de 6 semanas (Esquema 4/2). (2.1)
Tratamiento adyuvante de RCC:
• La dosis recomendada es de 50 mg por vía oral una vez al día durante las primeras 4 semanas de un ciclo de 6 semanas (Esquema 4/2) para un máximo de 9 ciclos. (2.2) pNET:
• La dosis recomendada es de 37.5 mg por vía oral una vez al día. (2.3)
FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Cápsulas: 12.5 mg, 25 mg, 37.5 mg, 50 mg de sunitinib (3)
CONTRAINDICACIONES
Ninguna (4)
ADVERTENCIAS Y PRECAUCIONES
- Hepatotoxicidad: Se ha observado insuficiencia hepática mortal. Monitorear las pruebas de función hepática al inicio, durante cada ciclo y según esté clínicamente indicado. Interrumpir malato de sunitinib para hepatotoxicidad Grado 3 hasta resolución a Grado ≤1 o basal y reanudar malato de sunitinib a una dosis reducida; discontinuar si no hay resolución. Discontinuar malato de sunitinib en pacientes con hepatotoxicidad Grado 4, en pacientes que tengan cambios severos posteriores en las pruebas de función hepática u otros signos y síntomas de insuficiencia hepática. (2.4, 5.1)
- Eventos Cardiovasculares: Han ocurrido isquemia miocárdica, infarto de miocardio, insuficiencia cardíaca, cardiomiopatía y disminución de la fracción de eyección del ventrículo izquierdo (FEVI) por debajo del límite inferior de lo normal, incluyendo la muerte. Monitorear signos y síntomas de insuficiencia cardíaca congestiva y considerar monitorear la FEVI al inicio y periódicamente durante el tratamiento. Discontinuar malato de sunitinib por manifestaciones clínicas de insuficiencia cardíaca congestiva. Interrumpir y/o reducir la dosis por disminución de la FEVI. (5.2)
- Prolongación del intervalo QT y Torsades de Pointes: Monitorear a los pacientes con mayor riesgo de desarrollar prolongación del intervalo QT. Considerar la monitorización de electrocardiogramas y electrolitos. (5.3)
- Hipertensión: Monitorear la presión arterial al inicio y según esté clínicamente indicado. Iniciar y/o ajustar la terapia antihipertensiva según corresponda.
- Interrumpir malato de sunitinib para hipertensión Grado 3 hasta resolución a Grado ≤1 o basal, luego reanudar malato de sunitinib a una dosis reducida. Discontinuar malato de sunitinib en pacientes que desarrollen hipertensión Grado 4. (5.4)
- Eventos Hemorrágicos: Han ocurrido hemorragia relacionada con el tumor y perforación visceral (ambos con eventos fatales). Realizar recuentos sanguíneos completos seriados y exámenes físicos. Interrumpir malato de sunitinib para eventos hemorrágicos de Grado 3 o 4 hasta resolución a Grado ≤1 o basal, luego reanudar a una dosis reducida; discontinuar si no hay resolución. (5.5).
- Síndrome de lisis tumoral (SLT): Se ha reportado SLT (algunos fatales) principalmente en pacientes con RCC y GIST. Monitorear a estos pacientes y tratar según esté clínicamente indicado. (5.6)
- Microangiopatía trombótica (MAT): Se ha reportado MAT, incluyendo púrpura trombocitopénica trombótica y síndrome urémico hemolítico, que a veces conduce a insuficiencia renal o un desenlace fatal. Discontinuar malato de sunitinib por MAT. (5.7)
- Proteinuria: Ha ocurrido insuficiencia renal o un desenlace fatal. Monitorear proteína en orina. Interrumpir el tratamiento por proteína en orina de 24 horas de 3 o más gramos. Discontinuar por episodios repetidos de proteína en orina de 24 horas de 3 o más gramos a pesar de reducciones de dosis o síndrome nefrótico. (5.8)
- Toxicidades Dermatológicas: Han ocurrido fascitis necrotizante, eritema multiforme, síndrome de Stevens-Johnson (SSJ) y necrólisis epidérmica tóxica (NET) (algunas fatales). Discontinuar malato de sunitinib por estos eventos. (5.9)
- Síndrome de Leucoencefalopatía Posterior Reversible (SLPR): Se ha reportado SLPR (algunos fatales). Monitorear signos y síntomas de SLPR. Suspender malato de sunitinib hasta la resolución. (5.10)
- Disfunción Tiroidea: Monitorear la función tiroidea al inicio, periódicamente durante el tratamiento y según esté clínicamente indicado. Iniciar y/o ajustar la terapia para la disfunción tiroidea según corresponda. (5.11)
- Hipoglucemia: Verificar los niveles de glucosa en sangre regularmente y evaluar si se requieren modificaciones en la dosis de medicamentos antidiabéticos. (5.12)
- Osteonecrosis de la Mandíbula (ONM): Suspender malato de sunitinib durante al menos 3 semanas antes de un procedimiento dental invasivo y por el desarrollo de ONM hasta la resolución completa. (5.13)
- Cicatrización de Heridas Alterada: Suspender malato de sunitinib durante al menos 3 semanas antes de una cirugía electiva. No administrar durante al menos 2 semanas después de una cirugía mayor y hasta una cicatrización adecuada de la herida. No se ha establecido la seguridad de la reanudación de malato de sunitinib después de la resolución de las complicaciones de cicatrización de heridas. (5.14)
- Toxicidad Embrio-Fetal: Puede causar daño fetal. Asesorar a los pacientes sobre el riesgo potencial para el feto y usar anticonceptivos efectivos. (5.15, 8.1, 8.3)
REACCIONES ADVERSAS
Las reacciones adversas más comunes (≥25%) son fatiga/astenia, diarrea, mucositis/estomatitis, náuseas, disminución del apetito/anorexia, vómitos, dolor abdominal, síndrome mano-pie, hipertensión, eventos hemorrágicos, disgeusia/alteración del gusto, dispepsia y trombocitopenia. (6)
Para reportar REACCIONES ADVERSAS SOSPECHADAS, contacte a Dr. Reddy’s Laboratories Inc., al 1-888-375-3784 o FDA al 1-800-FDA-1088 o www.fda.gov/medwatch
INTERACCIONES MEDICAMENTOSAS
USO EN POBLACIONES ESPECÍFICAS
Lactancia: Aconsejar no amamantar. (8.2)
Consulte la sección 17 para obtener INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y la Guía de medicación.
Revisado: 3/2022
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
ADVERTENCIA EN RECUADRO
1 INDICACIONES Y USO
1.1 Tumor del Estroma Gastrointestinal
1.2 Carcinoma de Células Renales Avanzado
1.3 Tratamiento Adyuvante del Carcinoma de Células Renales
1.4 Tumores Neuroendocrinos Pancreáticos Avanzados
2 DOSIS Y ADMINISTRACIÓN
2.1 Dosis Recomendada para GIST y RCC Avanzado
2.2 Dosis Recomendada para el Tratamiento Adyuvante de RCC
2.3 Dosis Recomendada para pNET
2.4 Modificaciones de Dosis por Reacciones Adversas
2.5 Modificación de Dosis por Interacciones Medicamentosas
2.6 Modificación de Dosis para Pacientes con Enfermedad Renal en Etapa Terminal en Hemodiálisis
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Hepatotoxicidad
5.2 Eventos Cardiovasculares
5.3 Prolongación del Intervalo QT y Torsade de Pointes
5.4 Hipertensión
5.5 Eventos Hemorrágicos y Perforación de Vísceras
5.6 Síndrome de Lisis Tumoral (TLS)
5.7 Microangiopatía Trombótica (TMA)
5.8 Proteinuria
5.9 Toxicidades Dermatológicas
5.10 Síndrome de Leucoencefalopatía Posterior Reversible (RPLS)
5.11 Disfunción Tiroidea
5.12 Hipoglucemia
5.13 Osteonecrosis de la Mandíbula (ONJ)
5.14 Alteración en la Cicatrización de Heridas
5.15 Toxicidad Embrio-Fetal
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Postcomercialización
7 INTERACCIONES MEDICAMENTOSAS
7.1 Efecto de Otros Medicamentos sobre Malato de Sunitinib
7.2 Medicamentos que Prolongan el Intervalo QT
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.3 Mujeres y Hombres con Capacidad Reproductiva
8.4 Uso Pediátrico
8.5 Uso Geriátrico
8.6 Insuficiencia Hepática
8.7 Insuficiencia Renal
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinámica
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Alteración de la Fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Tumor del Estroma Gastrointestinal
14.2 Carcinoma de Células Renales
14.3 Tumores Neuroendocrinos Pancreáticos
16 PRESENTACIÓN/ALMACENAMIENTO Y MANIPULACIÓN
17 INFORMACIÓN DE ASESORAMIENTO PARA EL PACIENTE
- *
- No se enumeran las secciones o subsecciones omitidas de la información completa de prescripción.
ADVERTENCIA RECUADRO
SECCIÓN ADVERTENCIA RECUADRO
ADVERTENCIA: HEPATOTOXICIDADLa hepatotoxicidad puede ser grave y, en algunos casos, mortal. Monitorear la función hepática e interrumpir, reducir la dosis o suspender sunitinib malate según se recomiende [ver Advertencias y Precauciones (5.1)].
1 INDICACIONES Y USO
1.1 Tumor del estroma gastrointestinal
Las cápsulas de malato de sunitinib están indicadas para el tratamiento de pacientes adultos con tumor del estroma gastrointestinal (GIST) después de la progresión de la enfermedad o intolerancia al mesilato de imatinib.
1.2 Carcinoma avanzado de células renales
Las cápsulas de malato de sunitinib están indicadas para el tratamiento de pacientes adultos con carcinoma avanzado de células renales (RCC).
1.3 Tratamiento adyuvante del carcinoma de células renales
Las cápsulas de malato de sunitinib están indicadas para el tratamiento adyuvante de pacientes adultos con alto riesgo de RCC recurrente después de una nefrectomía.
1.4 Tumores neuroendocrinos pancreáticos avanzados
Las cápsulas de malato de sunitinib están indicadas para el tratamiento de tumores neuroendocrinos pancreáticos (pNET) bien diferenciados y progresivos en pacientes adultos con enfermedad irresecable localmente avanzada o metastásica.
2 POSOLOGÍA Y ADMINISTRACIÓN
2.1 Dosis recomendada para GIST y CCR avanzado
La dosis recomendada de malato de sunitinib para tumor del estroma gastrointestinal (GIST) y carcinoma de células renales (CCR) avanzado es de 50 mg por vía oral una vez al día, en un ciclo de 4 semanas de tratamiento seguidas de 2 semanas de descanso (Ciclo 4/2) hasta progresión de la enfermedad o toxicidad inaceptable. Las cápsulas de malato de sunitinib se pueden tomar con o sin alimentos.
2.2 Dosis recomendada para el tratamiento adyuvante de CCR
La dosis recomendada de malato de sunitinib para el tratamiento adyuvante del CCR es de 50 mg por vía oral una vez al día, en un ciclo de 4 semanas de tratamiento seguidas de 2 semanas de descanso (Ciclo 4/2), durante nueve ciclos de 6 semanas. Las cápsulas de malato de sunitinib se pueden tomar con o sin alimentos.
2.3 Dosis recomendada para pNET
La dosis recomendada de malato de sunitinib para tumores neuroendocrinos pancreáticos (pNET) es de 37.5 mg por vía oral una vez al día hasta progresión de la enfermedad o toxicidad inaceptable. Las cápsulas de malato de sunitinib se pueden tomar con o sin alimentos.
2.4 Modificaciones de dosis por reacciones adversas
Para manejar las reacciones adversas, se proporcionan las modificaciones de dosis recomendadas en la Tabla 1. La Tabla 2 proporciona las reducciones de dosis recomendadas de las cápsulas de malato de sunitinib para las reacciones adversas.
Tabla 1. Reducciones de dosis recomendadas de malato de sunitinib por reacciones adversas
| Indicaciones | GIST | CCR | pNET | |
| CCR avanzado | CCR adyuvante | |||
| Primera reducción de dosis | 37.5 mg una vez al día | 37.5 mg una vez al día | 37.5 mg una vez al día | 25 mg una vez al día |
| Segunda reducción de dosis | 25 mg una vez al día | 25 mg una vez al día | NA | NA |
Tabla 2. Modificaciones de dosis recomendadas de malato de sunitinib por reacciones adversas
| Reacción adversa | Gravedad | Modificaciones de dosis para malato de sunitinib |
| Hepatotoxicidad [ver Advertencias y precauciones (5.1)] | Grado 3 | • Suspender hasta resolución a Grado 0 a 1 o basal. • Reiniciar a una dosis reducida. • Para Grado 3 recurrente, suspender permanentemente. |
| Grado 4 | • Suspender permanentemente. | |
| Eventos cardiovasculares[ver Advertencias y precauciones (5.2)] | Cardiomiopatía asintomática (fracción de eyección ventricular izquierda mayor que 20% pero menor que 50% por debajo del valor basal o por debajo del límite inferior de lo normal si no se obtuvo el valor basal) | • Suspender hasta resolución a Grado 0 a 1 o basal. • Reiniciar a dosis reducida. |
| Insuficiencia cardíaca congestiva (ICC) clínicamente manifiesta | • Suspender permanentemente. | |
| Hipertensión [ver Advertencias y precauciones (5.4)] | Grado 3 | • Suspender hasta resolución a Grado 0 a 1 o basal. • Reiniciar a una dosis reducida. |
| Grado 4 | • Suspender permanentemente. | |
| Eventos hemorrágicos [ver Advertencias y precauciones (5.5)] | Grado 3 o 4 | • Suspender hasta resolución a Grado 0 a 1 o basal. • Reiniciar a una dosis reducida o suspender según la gravedad y persistencia de la reacción adversa. |
| Microangiopatía trombótica [ver Advertencias y precauciones (5.7)] | Cualquier grado | • Suspender permanentemente. |
| Proteinuria o síndrome nefrótico [ver Advertencias y precauciones (5.8)] | Proteinuria de 3 o más gramos en 24 horas en ausencia de síndrome nefrótico | • Suspender hasta resolución a Grado 0 a 1 o basal. • Reiniciar a una dosis reducida. |
| Síndrome nefrótico o proteinuria recurrente de 3 o más gramos por 24 horas a pesar de reducción de dosis | • Suspender permanentemente. | |
| Toxicidades dermatológicas Eritema multiforme (EM), síndrome de Stevens-Johnson (SSJ), necrólisis epidérmica tóxica (NET), fascitis necrotizante [ver Advertencias y precauciones (5.9)] | Cualquier grado | • Suspender permanentemente. |
| Síndrome de leucoencefalopatía posterior reversible [ver Advertencias y precauciones (5.10)] | Cualquier grado | • Suspender permanentemente. |
| Osteonecrosis de mandíbula [ver Advertencias y precauciones (5.13)] | Cualquier grado | • No se ha establecido la seguridad de la reanudación de malato de sunitinib después de osteonecrosis. • Reiniciar a una dosis reducida o suspender según la gravedad y persistencia de la reacción adversa. |
| Cicatrización alterada de heridas [ver Advertencias y precauciones (5.14)] | Cualquier grado | • No se ha establecido la seguridad de la reanudación de malato de sunitinib después de la resolución de la cicatrización de la herida. • Reiniciar a una dosis reducida o suspender según la gravedad y persistencia de la reacción adversa. |
2.5 Modificación de dosis por interacciones farmacológicas
Inhibidores fuertes de CYP3A4
Seleccionar una medicación concomitante alternativa con potencial nulo o mínimo de inhibición enzimática. Si no se puede evitar la coadministración de malato de sunitinib con un inhibidor fuerte de CYP3A4, considerar una reducción de dosis para malato de sunitinib a una dosis mínima como sigue [ver Interacciones farmacológicas (7.1)]:
- GIST y CCR: 37.5 mg por vía oral una vez al día, en un ciclo de 4 semanas de tratamiento seguidas de 2 semanas de descanso (Ciclo 4/2)
- pNET: 25 mg por vía oral una vez al día
Inductores fuertes de CYP3A4
Seleccionar una medicación concomitante alternativa con potencial nulo o mínimo de inducción enzimática. Si no se puede evitar la coadministración de malato de sunitinib con un inductor fuerte de CYP3A4, considerar un aumento de dosis para malato de sunitinib hasta una dosis máxima como sigue:
- GIST y CCR: 87.5 mg por vía oral una vez al día, en un ciclo de 4 semanas de tratamiento seguidas de 2 semanas de descanso (Ciclo 4/2)
- pNET: 62.5 mg por vía oral una vez al día
Si se aumenta la dosis de malato de sunitinib, monitorear a los pacientes cuidadosamente por reacciones adversas [ver Interacciones farmacológicas (7.1)].
2.6 Modificación de dosis para pacientes con enfermedad renal en etapa terminal en hemodiálisis
No se requiere ajuste de la dosis inicial en pacientes con enfermedad renal en etapa terminal (ERET) en hemodiálisis. Sin embargo, dada la disminución de la exposición en comparación con los pacientes con función renal normal, las dosis posteriores pueden aumentarse gradualmente hasta 2 veces según la seguridad y tolerabilidad [ver Farmacología clínica (12.3)].
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Cápsulas, gelatina dura:
- 12.5 mg de sunitinib: tapa y cuerpo de color gris cálido, impresos con tinta de impresión blanca “SC” en la tapa y “12.5 mg” en el cuerpo.
- 25 mg de sunitinib: tapa y cuerpo de color negro, impresos con tinta de impresión blanca “SC” en la tapa y “25 mg” en el cuerpo.
- 37.5 mg de sunitinib: tapa de color negro y cuerpo de color gris, impresos con tinta de impresión blanca “SC” en la tapa y “37.5 mg” en el cuerpo.
- 50 mg de sunitinib: tapa y cuerpo de color gris, impresos con tinta de impresión blanca “SC” en la tapa y “50 mg” en el cuerpo.
4 CONTRAINDICACIONES
Ninguna.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Hepatotoxicidad
El malato de sunitinib puede causar hepatotoxicidad severa, resultando en insuficiencia hepática o muerte. En la población de seguridad combinada, la insuficiencia hepática ocurrió en <1% de los pacientes en ensayos clínicos. La insuficiencia hepática incluye ictericia, transaminasas elevadas y/o hiperbilirrubinemia en conjunto con encefalopatía, coagulopatía y/o insuficiencia renal.
Monitoree las pruebas de función hepática (alanina aminotransferasa [ALT], aspartato aminotransferasa [AST] y bilirrubina) al inicio, durante cada ciclo y según esté clínicamente indicado. Interrumpa el malato de sunitinib ante hepatotoxicidad de Grado 3 hasta que se resuelva a Grado ≤1 o nivel basal, luego reanude el malato de sunitinib a una dosis reducida.
Descontinúe el malato de sunitinib en pacientes con hepatotoxicidad de Grado 4, en pacientes sin resolución de hepatotoxicidad de Grado 3, en pacientes que posteriormente experimenten cambios severos en las pruebas de función hepática y en pacientes que tengan otros signos y síntomas de insuficiencia hepática. La seguridad en pacientes con ALT o AST >2.5 x límite superior normal (ULN) o con >5 x ULN y metástasis hepáticas no ha sido establecida.
5.2 Eventos Cardiovasculares
Se han reportado eventos cardiovasculares, incluyendo insuficiencia cardíaca, cardiomiopatía, isquemia miocárdica e infarto de miocardio, algunos de los cuales fueron fatales. En la población de seguridad combinada, el 3% de los pacientes experimentó insuficiencia cardíaca; se reportó que el 71% de los pacientes con insuficiencia cardíaca se recuperaron. Se reportó insuficiencia cardíaca fatal en <1% de los pacientes.
En el estudio de tratamiento adyuvante de RCC, 11 pacientes experimentaron disminución de la fracción de eyección de Grado 2 (fracción de eyección ventricular izquierda [LVEF] 40% a 50% y una disminución del 10% al 19% respecto al valor inicial). En 3 de estos 11 pacientes, las fracciones de eyección no regresaron a ≥50% o al valor inicial en el momento de la última medición. Ningún paciente que recibió malato de sunitinib fue diagnosticado con insuficiencia cardíaca congestiva (CHF).
Se excluyó de los estudios clínicos de malato de sunitinib a los pacientes que presentaron eventos cardíacos dentro de los 12 meses previos a la administración de malato de sunitinib, como infarto de miocardio (incluyendo angina severa/inestable), derivación arterial coronaria/periférica, CHF sintomática, accidente cerebrovascular o ataque isquémico transitorio, o embolia pulmonar. También se excluyó de algunos estudios a los pacientes con uso previo de antraciclinas o radiación cardíaca. Se desconoce si los pacientes con estas afecciones concomitantes pueden tener un mayor riesgo de desarrollar disfunción ventricular izquierda.
Considere monitorear la FEVI al inicio y periódicamente según esté clínicamente indicado. Monitoree cuidadosamente a los pacientes para detectar signos y síntomas clínicos de insuficiencia cardíaca congestiva (CHF). Descontinúe las cápsulas de malato de sunitinib en pacientes que experimenten manifestaciones clínicas de CHF. Interrumpa el malato de sunitinib y/o reduzca la dosis en pacientes sin evidencia clínica de CHF que tengan una fracción de eyección mayor al 20% pero menos del 50% por debajo del valor inicial o por debajo del límite inferior de lo normal si no se obtuvo la fracción de eyección inicial.
5.3 Prolongación del Intervalo QT y Torsades de Pointes
El malato de sunitinib puede causar prolongación del intervalo QT de manera dosis-dependiente, lo que puede llevar a un mayor riesgo de arritmias ventriculares, incluyendo Torsades de Pointes. Se observó Torsades de Pointes en <0.1% de los pacientes.
Monitoree a los pacientes que tienen un mayor riesgo de desarrollar prolongación del intervalo QT, incluyendo pacientes con antecedentes de prolongación del intervalo QT, pacientes que toman antiarrítmicos o pacientes con enfermedad cardíaca preexistente relevante, bradicardia o alteraciones electrolíticas. Considere el monitoreo periódico de electrocardiogramas y electrolitos (es decir, magnesio, potasio) durante el tratamiento con malato de sunitinib. Monitoree el intervalo QT con mayor frecuencia cuando el malato de sunitinib se administre de forma concomitante con inhibidores potentes de CYP3A4 o medicamentos conocidos por prolongar el intervalo QT. Considere reducir la dosis de malato de sunitinib [ver Dosis y Administración (2.5), Interacciones Medicamentosas (7.2)].
5.4 Hipertensión
En la población de seguridad combinada, el 29% de los pacientes experimentó hipertensión. Se reportó hipertensión de Grado 3 en el 7% de los pacientes e hipertensión de Grado 4 en el 0.2%.
Monitoree la presión arterial al inicio y según esté clínicamente indicado. Inicie y/o ajuste la terapia antihipertensiva según corresponda. En casos de hipertensión de Grado 3, retenga el malato de sunitinib hasta que se resuelva a Grado ≤1 o nivel basal, luego reanude el malato de sunitinib a una dosis reducida. Descontinúe el malato de sunitinib en pacientes que desarrollen hipertensión de Grado 4.
5.5 Eventos Hemorrágicos y Perforación Visceral
Los eventos hemorrágicos, algunos de los cuales fueron fatales, han involucrado el tracto gastrointestinal, el tracto respiratorio, el tumor, el tracto urinario y el cerebro. En la población de seguridad combinada, el 30% de los pacientes experimentó eventos hemorrágicos, incluyendo Grado 3 o 4 en el 4,2% de los pacientes. La epistaxis fue el evento hemorrágico más común y la hemorragia gastrointestinal fue el evento de Grado 3 a 5 más común.
Se observó hemorragia relacionada con el tumor en pacientes tratados con malato de sunitinib. Estos eventos pueden ocurrir repentinamente y, en el caso de tumores pulmonares, pueden presentarse como hemoptisis severa y potencialmente mortal o hemorragia pulmonar. Se observó hemorragia pulmonar, algunas con desenlace fatal, en pacientes tratados con malato de sunitinib para RCC metastásico, GIST y cáncer de pulmón metastásico. El malato de sunitinib no está aprobado para su uso en pacientes con cáncer de pulmón.
Se han reportado complicaciones gastrointestinales graves, a veces fatales, incluyendo perforación gastrointestinal, en pacientes con neoplasias intraabdominales tratados con malato de sunitinib.
Incluya hemogramas completos seriados (CBCs) y exámenes físicos con la evaluación clínica de los eventos hemorrágicos. Interrumpa el malato de sunitinib ante eventos hemorrágicos de Grado 3 o 4 hasta que se resuelvan a Grado ≤1 o nivel basal, luego reanude el malato de sunitinib a una dosis reducida.
Descontinúe el malato de sunitinib en pacientes sin resolución de eventos hemorrágicos de Grado 3 o 4.
5.6 Síndrome de Lisis Tumoral (TLS)
El Síndrome de Lisis Tumoral (TLS), algunos fatales, ocurrió en ensayos clínicos y se ha reportado en experiencia poscomercialización, principalmente en pacientes con RCC o GIST. Los pacientes generalmente en riesgo de TLS son aquellos con alta carga tumoral antes del tratamiento. Monitoree a estos pacientes para detectar TLS y manejarlos según corresponda.
5.7 Microangiopatía Trombótica (MAT)
La microangiopatía trombótica (MAT), incluyendo púrpura trombocitopénica trombótica y síndrome urémico hemolítico, que a veces conduce a insuficiencia renal o un desenlace fatal, se produjo en ensayos clínicos y en la experiencia poscomercialización de malato de sunitinib como monoterapia y administrado en combinación con bevacizumab. El malato de sunitinib no está aprobado para su uso en combinación con bevacizumab. Suspenda las cápsulas de malato de sunitinib en pacientes que desarrollen MAT. Se ha observado reversión de los efectos de la MAT después de suspender el malato de sunitinib.
5.8 Proteinuria
Se han notificado proteinuria y síndrome nefrótico. Algunos de estos casos han resultado en insuficiencia renal y desenlaces fatales. Monitoree a los pacientes para detectar el desarrollo o empeoramiento de la proteinuria. Realice análisis de orina basales y periódicos durante el tratamiento, con medición de seguimiento de la proteína en orina de 24 horas según esté clínicamente indicado. Interrumpa el malato de sunitinib y reduzca la dosis para proteínas en orina de 24 horas de 3 gramos o más. Suspenda las cápsulas de malato de sunitinib en pacientes con síndrome nefrótico o episodios repetidos de proteínas en orina de 24 horas de 3 gramos o más a pesar de las reducciones de dosis. No se ha evaluado la seguridad del tratamiento continuo con malato de sunitinib en pacientes con proteinuria de moderada a grave.
5.9 Toxicidades Dermatológicas
Se han notificado reacciones cutáneas adversas graves, incluido eritema multiforme (EM), síndrome de Stevens-Johnson (SSJ) y necrólisis epidérmica tóxica (NET), algunas de las cuales fueron mortales. Suspenda permanentemente las cápsulas de malato de sunitinib ante estas reacciones cutáneas adversas graves.
Se ha notificado fascitis necrosante, incluidos casos mortales, en pacientes tratados con malato de sunitinib, incluso del perineo y secundaria a la formación de fístulas. Suspenda las cápsulas de malato de sunitinib en pacientes que desarrollen fascitis necrosante.
5.10 Síndrome de Leucoencefalopatía Posterior Reversible (SLPR)
Se ha notificado síndrome de leucoencefalopatía posterior reversible (SLPR) en <1% de los pacientes, algunos de los cuales fueron mortales. Los pacientes pueden presentar hipertensión, dolor de cabeza, disminución del estado de alerta, alteración de la función mental y pérdida visual, incluida ceguera cortical. La resonancia magnética es necesaria para confirmar el diagnóstico.
Suspenda el malato de sunitinib en pacientes que desarrollen SLPR.
5.11 Disfunción Tiroidea
Se han notificado hipertiroidismo, algunos seguidos de hipotiroidismo, en ensayos clínicos y a través de la experiencia poscomercialización del malato de sunitinib. Monitoree la función tiroidea al inicio, periódicamente durante el tratamiento y según esté clínicamente indicado. Monitoree de cerca a los pacientes para detectar signos y síntomas de disfunción tiroidea, incluidos hipotiroidismo, hipertiroidismo y tiroiditis, durante el tratamiento con malato de sunitinib. Inicie y/o ajuste las terapias para la disfunción tiroidea según corresponda.
5.12 Hipoglucemia
El malato de sunitinib puede provocar hipoglucemia sintomática, que puede conducir a la pérdida del conocimiento o requerir hospitalización. En la población de seguridad combinada, la hipoglucemia ocurrió en el 2% de los pacientes tratados con malato de sunitinib. La hipoglucemia ha ocurrido en ensayos clínicos en el 2% de los pacientes tratados con malato de sunitinib para CCR avanzado (Estudio 3) y GIST (Estudio 1) (n=577) y en aproximadamente el 10% de los pacientes tratados con malato de sunitinib para pNET (Estudio 6) (n=83). En los pacientes tratados con malato de sunitinib para pNET, las anomalías preexistentes en la homeostasis de la glucosa no estaban presentes en todos los pacientes que experimentaron hipoglucemia. Las reducciones en los niveles de glucosa en sangre pueden ser peores en pacientes con diabetes.
Verifique los niveles de glucosa en sangre al inicio, regularmente durante el tratamiento, según esté clínicamente indicado y después de la interrupción del malato de sunitinib. En pacientes con diabetes, evalúe si es necesario ajustar las terapias antidiabéticas para minimizar el riesgo de hipoglucemia.
5.13 Osteonecrosis de la Mandíbula (ONM)
Se produjo osteonecrosis de la mandíbula (ONM) en pacientes tratados con malato de sunitinib. La exposición concomitante a otros factores de riesgo, como bisfosfonatos o enfermedad dental/procedimientos dentales invasivos, puede aumentar el riesgo de ONM. Realice un examen oral antes del inicio del malato de sunitinib y periódicamente durante la terapia con malato de sunitinib. Aconseje a los pacientes sobre buenas prácticas de higiene bucal. Suspenda el tratamiento con malato de sunitinib durante al menos 3 semanas antes de la cirugía dental programada o los procedimientos dentales invasivos, si es posible. Suspenda el malato de sunitinib para el desarrollo de ONM hasta su resolución completa. No se ha establecido la seguridad de reanudar el malato de sunitinib después de la resolución de la osteonecrosis de la mandíbula.
5.14 Cicatrización de Heridas Deteriorada
Se ha notificado cicatrización de heridas deteriorada en pacientes que recibieron malato de sunitinib [ver Reacciones Adversas (6.2)].
Suspenda el malato de sunitinib durante al menos 3 semanas antes de la cirugía electiva. No administre durante al menos 2 semanas después de una cirugía mayor y hasta una cicatrización adecuada de la herida. No se ha establecido la seguridad de reanudar el malato de sunitinib después de la resolución de las complicaciones de la cicatrización de heridas.
5.15 Toxicidad Embriofetal
Basado en los hallazgos de estudios en animales y su mecanismo de acción, el malato de sunitinib puede causar daño fetal cuando se administra a mujeres embarazadas. La administración de sunitinib a ratas y conejos embarazadas durante el período de organogénesis resultó en teratogenicidad a aproximadamente 5,5 y 0,3 veces la exposición sistémica combinada [área bajo la curva (AUC) combinada de sunitinib más su metabolito activo] en pacientes a los que se les administró la dosis diaria recomendada (DDR) de 50 mg, respectivamente.
Informe a las mujeres embarazadas del riesgo potencial para el feto. Aconseje a las mujeres en edad fértil que utilicen un método anticonceptivo eficaz durante el tratamiento con malato de sunitinib y durante 4 semanas después de la dosis final [ver Uso en Poblaciones Específicas (8.1, 8.3)].
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas clínicamente significativas se describen en otra parte del etiquetado.
- Hepatotoxicidad [ver Advertencias y Precauciones (5.1)]
- Eventos Cardiovasculares [ver Advertencias y Precauciones (5.2)]
- Prolongación del intervalo QT y Torsade de Pointes [ver Advertencias y Precauciones (5.3)]
- Hipertensión [ver Advertencias y Precauciones (5.4)]
- Eventos Hemorrágicos [ver Advertencias y Precauciones (5.5)]
- Síndrome de Lisis Tumoral [ver Advertencias y Precauciones (5.6)]
- Microangiopatía Trombótica [ver Advertencias y Precauciones (5.7)]
- Proteinuria [ver Advertencias y Precauciones (5.8)]
- Toxicidades Dermatológicas [ver Advertencias y Precauciones (5.9)]
- Síndrome de Leucoencefalopatía Posterior Reversible [ver Advertencias y Precauciones (5.10)]
- Disfunción Tiroidea [ver Advertencias y Precauciones (5.11)]
- Hipoglucemia [ver Advertencias y Precauciones (5.12)]
- Osteonecrosis de la Mandíbula [ver Advertencias y Precauciones (5.13)]
- Cicatrización de Heridas Deteriorada [ver Advertencias y Precauciones (5.14)]
6.1 Experiencia en Ensayos Clínicos
Debido a que los ensayos clínicos se realizan bajo condiciones muy variadas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica.
La población de seguridad agrupada descrita en las Advertencias y Precauciones refleja la exposición al malato de sunitinib en 7527 pacientes con GIST, RCC (avanzado y adyuvante), o pNET. En esta población de seguridad agrupada, las reacciones adversas más comunes (≥25%) fueron fatiga/astenia, diarrea, mucositis/estomatitis, náuseas, apetito disminuido/anorexia, vómitos, dolor abdominal, síndrome mano-pie, hipertensión, eventos hemorrágicos, disgeusia/alteración del gusto, dispepsia y trombocitopenia.
Tumor del Estroma Gastrointestinal
La seguridad del malato de sunitinib se evaluó en el Estudio 1, un ensayo aleatorizado, doble ciego y controlado con placebo en el que pacientes previamente tratados con GIST recibieron 50 mg diarios de malato de sunitinib en el Esquema 4/2 (n=202) o placebo (n=102). La mediana de duración del tratamiento de estudio ciego fue de 2 ciclos para los pacientes con malato de sunitinib (media: 3; rango: 1 a 9) y 1 ciclo (media; 1,8; rango: 1 a 6) para los pacientes con placebo en el momento del análisis intermedio.
La suspensión permanente debido a una reacción adversa ocurrió en el 7% de los pacientes en el brazo de malato de sunitinib. Las reducciones de dosis ocurrieron en el 11% y las interrupciones de dosis ocurrieron en el 29% de los pacientes que recibieron malato de sunitinib.
La Tabla 3 resume las reacciones adversas del Estudio 1.
Tabla 3. Reacciones Adversas Reportadas en ≥10% de los Pacientes con GIST que Recibieron Malato de Sunitinib en la Fase de Tratamiento Doble Ciego y Más Comúnmente que en los Pacientes que Recibieron Placebo* en el Estudio 1
| Reacción Adversa | GIST | |||
| Malato de Sunitinib (N=202) |
Placebo (N=102) |
|||
| Todos los Grados % | Grado 3 a 4 % | Todos los Grados % | Grado 3 a 4 % | |
| Cualquier Reacción Adversa | 94 | 56 | 97 | 51 |
| Gastrointestinal Diarrea Mucositis/estomatitis Constipación |
40 29 20 |
4 1 0 |
27 18 14 |
0 2 2 |
| Metabolismo/Nutrición Anorexiaa Astenia |
33 22 |
1 5 |
29 11 |
5 3 |
| Dermatología Decoloración de la piel Erupción Síndrome mano-pie |
30 14 14 |
0 1 4 |
23 9 10 |
0 0 3 |
| Neurología Alteración del gusto |
21 | 0 | 12 | 0 |
| Cardiovascular Hipertensión |
15 | 4 | 11 | 0 |
| Musculoesquelético Mialgia/dolor en extremidades |
14 | 1 | 9 | 1 |
* Criterios Comunes de Terminología para Eventos Adversos (CTCAE), versión 3.
Abreviaturas: GIST=tumor del estroma gastrointestinal; N=número de pacientes.
a Incluye apetito disminuido. Otras reacciones adversas clínicamente relevantes incluyeron dolor oral distinto a mucositis/estomatitis en 6%; cambios de color de cabello en 7%; alopecia en 5% de los pacientes que recibieron malato de sunitinib.
La Tabla 4 resume las anormalidades de laboratorio en el Estudio 1.
Tabla 4. Anormalidades de Laboratorio Reportadas en ≥10% de los Pacientes con GIST que Recibieron Malato de Sunitinib o Placebo en la Fase de Tratamiento Doble Ciego* en el Estudio 1
| Anomalía de laboratorio | GIST | |||
| Sunitinib Malate (N=202) | Placebo (N=102) | |||
| Todos los grados*% | Grado 3 a 4*,a% | Todos los grados*% | Grado 3 a 4*,b% | |
| Cualquier anomalía de laboratorio | 34 | 22 | ||
| Hematología Neutrófilos disminuidos Linfocitos disminuidos Plaquetas disminuidas Hemoglobina disminuida |
53 38 38 26 |
10 0 5 3 |
4 16 4 22 |
0 0 0 2 |
| Gastrointestinal AST/ALT aumentada Lipasa aumentada Fosfatasa alcalina aumentada Amilasa aumentada Bilirrubina total aumentada Bilirrubina indirecta aumentada |
39 25 24 17 16 10 |
2 10 4 5 10 |
23 17 21 12 8 4 |
1 7 4 3 0 0 |
| Renal/Metabólico Creatinina aumentada Potasio disminuido Sodio aumentado |
12 12 10 |
1 1 0 |
7 4 4 |
0 0 1 |
| Cardíaco LVEF disminuida |
11 | 1 | 3 | 0 |
*Criterios de terminología común para eventos adversos (CTCAE), versión 3
Abreviaturas: ALT=alanina aminotransferasa; AST=aspartato aminotransferasa; GIST=tumor del estroma gastrointestinal; LVEF=fracción de eyección del ventrículo izquierdo; N=número de pacientes.
a Las anomalías de laboratorio de grado 4 en pacientes que recibieron sunitinib malate incluyeron fosfatasa alcalina (1%), lipasa (2%), creatinina (1%), potasio disminuido (1%), neutrófilos (2%), hemoglobina (2%) y plaquetas (1%).
b Las anomalías de laboratorio de grado 4 en pacientes que recibieron placebo incluyeron amilasa (1%), lipasa (1%) y hemoglobina (2%).
Después de un análisis interino, el estudio se abrió y los pacientes del grupo placebo tuvieron la oportunidad de recibir sunitinib malate de etiqueta abierta [ver Estudios clínicos (14.1)]. Para 241 pacientes asignados al azar al grupo de sunitinib malate, incluidos 139 que recibieron sunitinib malate tanto en las fases doble ciego como de etiqueta abierta, la duración mediana del tratamiento con sunitinib malate fue de 6 ciclos (media: 8,5; rango: 1–44). Para los 255 pacientes que finalmente recibieron tratamiento con sunitinib malate de etiqueta abierta, la duración mediana del tratamiento fue de 6 ciclos (media: 7,8; rango: 1–37) desde el momento de la apertura.
La interrupción permanente debido a una reacción adversa ocurrió en el 20% de los pacientes que recibieron sunitinib malate. La interrupción de la dosis ocurrió en el 46% y la reducción de la dosis ocurrió en el 28% de los pacientes que recibieron sunitinib malate. Las reacciones adversas de grado 3 o 4 más frecuentes en los pacientes que recibieron sunitinib malate en la fase de etiqueta abierta fueron fatiga (10%), hipertensión (8%), astenia (5%), diarrea (5%), síndrome mano-pie (5%), náuseas (4%), dolor abdominal (3%), anorexia (3%), mucositis (2%), vómitos (2%) e hipotiroidismo (2%).
Carcinoma de células renales avanzado
La seguridad de sunitinib malate se evaluó en el Estudio 3, un ensayo doble ciego, controlado con control activo, en el que pacientes sin tratamiento previo con CCR localmente avanzado o metastásico recibieron sunitinib malate 50 mg diarios según el esquema 4/2 (n=375) o interferón alfa 9 millones de unidades internacionales (MIU) (n=360). La duración mediana del tratamiento fue de 11,1 meses (rango: 0,4 a 46,1) para el tratamiento con sunitinib malate y de 4,1 meses (rango: 0,1 a 45,6) para el tratamiento con interferón alfa.
La interrupción permanente debido a una reacción adversa ocurrió en el 20% de los pacientes en el grupo de sunitinib malate. Las interrupciones de la dosis ocurrieron en el 54% y las reducciones de la dosis ocurrieron en el 52% de los pacientes que recibieron sunitinib malate.
La Tabla 5 resume las reacciones adversas del Estudio 3.
Tabla 5. Reacciones adversas notificadas en ≥10% de los pacientes con CCR que recibieron sunitinib malate o interferón alfa* en el Estudio 3
| Reacción Adversa | CCR sin Tratamiento Previo | |||
| Malato de Sunitinib (N=375) |
Interferón Alfa (N=360) |
|||
| Todos los Grados% | Grado 3 a 4a% | Todos los Grados% | Grado 3 a 4b% | |
| Cualquier Reacción Adversa | 99 | 77 | 99 | 55 |
| Gastrointestinal | ||||
| Diarrea | 66 | 10 | 21 | <1 |
| Náuseas | 58 | 6 | 41 | 2 |
| Mucositis/estomatitis | 47 | 3 | 5 | <1 |
| Vómitos | 39 | 5 | 17 | 1 |
| Dispepsia | 34 | 2 | 4 | 0 |
| Dolor abdominalc | 30 | 5 | 12 | 1 |
| Estreñimiento | 23 | 1 | 14 | <1 |
| Boca seca | 13 | 0 | 7 | <1 |
| Dolor oral | 14 | <1 | 1 | 0 |
| Flatulencia | 14 | 0 | 2 | 0 |
| ERGE/esofagitis por reflujo | 12 | <1 | 1 | 0 |
| Glosodinia | 11 | 0 | 1 | 0 |
| Hemorroides | 10 | 0 | 2 | 0 |
| Constitucional | ||||
| Fatiga | 62 | 15 | 56 | 15 |
| Astenia | 26 | 11 | 22 | 6 |
| Fiebre | 22 | 1 | 37 | <1 |
| Disminución de peso | 16 | <1 | 17 | 1 |
| Escalofríos | 14 | 1 | 31 | 0 |
| Dolor en el pecho | 13 | 2 | 7 | 1 |
| Enfermedad similar a la influenza | 5 | 0 | 15 | <1 |
| Metabolismo/Nutrición Anorexiad |
48 | 3 | 42 | 2 |
| Neurología | ||||
| Alteración del gustoe | 47 | <1 | 15 | 0 |
| Dolor de cabeza | 23 | 1 | 19 | 0 |
| Mareos | 11 | <1 | 14 | 1 |
| Hemorragia/Sangrado Sangrado, todos los sitios |
37 | 4f | 10 | 1 |
| Cardíaco | ||||
| Hipertensión | 34 | 13 | 4 | <1 |
| Edema periférico | 24 | 2 | 5 | 1 |
| Disminución de la fracción de eyección | 16 | 3 | 5 | 2 |
| Dermatología | ||||
| Erupción cutánea | 29 | 2 | 11 | <1 |
| Síndrome mano-pie | 29 | 8 | 1 | 0 |
| Decoloración de la piel/piel amarilla | 25 | <1 | 0 | 0 |
| Piel seca | 23 | <1 | 7 | 0 |
| Cambios en el color del cabello | 20 | 0 | <1 | 0 |
| Alopecia | 14 | 0 | 9 | 0 |
| Eritema | 12 | <1 | 1 | 0 |
| Prurito | 12 | <1 | 7 | <1 |
| Musculoesquelético | ||||
| Dolor en extremidades/molestia en las extremidades | 40 | 5 | 30 | 2 |
| Artralgia | 30 | 3 | 19 | 1 |
| Dolor de espalda | 28 | 5 | 14 | 2 |
| Respiratorio | ||||
| Tos | 27 | 1 | 14 | <1 |
| Disnea | 26 | 6 | 20 | 4 |
| Nasofaringitis | 14 | 0 | 2 | 0 |
| Dolor orofaríngeo | 14 | <1 | 2 | 0 |
| Infección de las vías respiratorias superiores | 11 | <1 | 2 | 0 |
| Endocrino Hipotiroidismo |
16 | 2 | 1 | 0 |
| Psiquiátrico Insomnio Depresióng |
15 11 |
<1 0 |
10 14 |
0 1 |
*Criterios de Terminología Común para Eventos Adversos (CTCAE), versión 3.
Abreviaturas: ARs=reacciones adversas; N=número de pacientes; CCR=carcinoma de células renales.
a Las ARs de Grado 4 en pacientes que recibieron malato de sunitinib incluyeron dolor de espalda (1%), artralgia (<1%), disnea (<1%), astenia (<1%), fatiga (<1%), dolor en extremidades (<1%) y erupción cutánea (<1%).
b Las ARs de Grado 4 en pacientes que recibieron interferón alfa incluyeron disnea (1%), fatiga (1%), dolor abdominal (<1%) y depresión (<1%).
c Incluye dolor en el flanco.
d Incluye disminución del apetito.
e Incluye ageusia, hipogeusia y disgeusia.
f Incluye 1 paciente con hemorragia gástrica de Grado 5.
g Incluye estado de ánimo deprimido.
La Tabla 6 resume las anomalías de laboratorio en el Estudio 3.
Tabla 6. Anomalías de Laboratorio Reportadas en ≥10% de los Pacientes con CCR que Recibieron Malato de Sunitinib o Interferón Alfa en el Estudio 3
| Anormalidad de Laboratorio | RCC Naive al Tratamiento | |||
| Malato de Sunitinib (N=375) | Interferón Alfa (N=360) | |||
| Todos los Grados*% | Grado 3 a 4*,a% | Todos los Grados*% | Grado 3 a 4*,b% | |
| Hematología | ||||
| Hemoglobina disminuida | 79 | 8 | 69 | 5 |
| Neutrófilos disminuidos | 77 | 17 | 49 | 9 |
| Plaquetas disminuidas | 68 | 9 | 24 | 1 |
| Linfocitos disminuidos | 68 | 18 | 68 | 26 |
| Renal/Metabólico | ||||
| Aumento de creatinina | 70 | <1 | 51 | <1 |
| Aumento de creatina quinasa | 49 | 2 | 11 | 1 |
| Aumento de ácido úrico | 46 | 14 | 33 | 8 |
| Calcio disminuido | 42 | 1 | 40 | 1 |
| Fósforo disminuido | 31 | 6 | 24 | 6 |
| Albúmina disminuida | 28 | 1 | 20 | 0 |
| Aumento de glucosa | 23 | 6 | 15 | 6 |
| Sodio disminuido | 20 | 8 | 15 | 4 |
| Glucosa disminuida | 17 | 0 | 12 | <1 |
| Aumento de potasio | 16 | 3 | 17 | 4 |
| Calcio aumentado | 13 | <1 | 10 | 1 |
| Potasio disminuido | 13 | 1 | 2 | <1 |
| Sodio aumentado | 13 | 0 | 10 | 0 |
| Gastrointestinal | ||||
| Aumento de AST | 56 | 2 | 38 | 2 |
| Aumento de lipasa | 56 | 18 | 46 | 8 |
| Aumento de ALT | 51 | 3 | 40 | 2 |
| Aumento de fosfatasa alcalina | 46 | 2 | 37 | 2 |
| Aumento de amilasa | 35 | 6 | 32 | 3 |
| Aumento de bilirrubina total | 20 | 1 | 2 | 0 |
| Aumento de bilirrubina indirecta | 13 | 1 | 1 | 0 |
*Criterios de Terminología Común para Eventos Adversos (CTCAE), versión 3.
Abreviaturas: ALT=alanina aminotransferasa; AST=aspartato aminotransferasa; N=número de pacientes; RCC=carcinoma de células renales.
a Las anomalías de laboratorio de Grado 4 en pacientes con malato de sunitinib incluyeron ácido úrico (14%), lipasa (3%), neutrófilos (2%), linfocitos (2%), hemoglobina (2%), plaquetas (1%), amilasa (1%), ALT (<1%), creatina quinasa (<1%), creatinina (<1%), aumento de glucosa (<1%), disminución de calcio (<1%), fósforo (<1%), aumento de potasio (<1%) y disminución de sodio (<1%).
b Las anomalías de laboratorio de Grado 4 en pacientes con interferón alfa incluyeron ácido úrico (8%), linfocitos (2%), lipasa (1%), neutrófilos (1%), amilasa (<1%), aumento de calcio (<1%), disminución de glucosa (<1%), aumento de potasio (<1%) y hemoglobina (<1%).
Seguridad a Largo Plazo en RCC
La seguridad a largo plazo de malato de sunitinib en pacientes con RCC metastásico se analizó en 9 estudios clínicos completados realizados en los entornos de tratamiento de primera línea, refractario a bevacizumab y refractario a citoquinas. El análisis incluyó 5739 pacientes, de los cuales 807 (14%) fueron tratados durante al menos 2 años y 365 (6%) durante al menos 3 años. El tratamiento prolongado con malato de sunitinib no pareció estar asociado con nuevos tipos de reacciones adversas. No pareció haber un aumento en la incidencia anual de reacciones adversas en puntos de tiempo posteriores. El hipotiroidismo aumentó durante el segundo año de tratamiento con nuevos casos reportados hasta el año 4.
Tratamiento Adyuvante de RCC
La seguridad de malato de sunitinib se evaluó en S-TRAC, un ensayo aleatorizado, doble ciego y controlado con placebo en el que los pacientes que se habían sometido a una nefrectomía para RCC recibieron malato de sunitinib 50 mg diarios según la Pauta 4/2 (n=306) o placebo (n=304). La duración media del tratamiento fue de 12,4 meses (rango: 0,13 a 14,9) para malato de sunitinib y 12,4 meses (rango: 0,03 a 13,7) para placebo.
La interrupción permanente debido a una reacción adversa ocurrió en el 28% de los pacientes en el brazo de malato de sunitinib. Las reacciones adversas que condujeron a la interrupción permanente en más del 2% de los pacientes incluyen síndrome mano-pie y fatiga/astenia. Las interrupciones de dosis ocurrieron en el 54% y las reducciones de dosis ocurrieron en el 46% de los pacientes que recibieron malato de sunitinib.
La Tabla 7 resume las reacciones adversas en S-TRAC.
Tabla 7. Reacciones Adversas Reportadas en ≥10% de los Pacientes con RCC que Recibieron Malato de Sunitinib y Más Comúnmente que en Pacientes que Recibieron Placebo* en S-TRAC
| Reacción adversa | Tratamiento adyuvante del CCR | |||
|---|---|---|---|---|
| Malato de sunitinib (N=306) | Placebo (N=304) | |||
| Todos los grados % | Grado 3–4% |
Todos los grados % |
Grado 3–4% |
|
| Cualquier reacción adversa | 99 | 60 | 88 | 15 |
| Gastrointestinal | ||||
| Mucositis/Estomatitis† | 61 | 6 | 15 | 0 |
| Diarrea | 57 | 4 | 22 | <1 |
| Náuseas | 34 | 2 | 15 | 0 |
| Dispepsia | 27 | 1 | 7 | 0 |
| Dolor abdominal‡ | 25 | 2 | 9 | <1 |
| Vómitos | 19 | 2 | 7 | 0 |
| Estreñimiento | 12 | 0 | 11 | 0 |
| Constitucional | ||||
| Fatiga/Astenia | 57 | 8 | 34 | 2 |
| Edema localizado§ | 18 | <1 | <1 | 0 |
| Pirexia | 12 | <1 | 6 | 0 |
| Dermatología | ||||
| Síndrome mano-pie | 50 | 16 | 10 | <1 |
| Sarpullido¶ | 24 | 2 | 12 | 0 |
| Cambios en el color del cabello | 22 | 0 | 2 | 0 |
| Decoloración de la piel/Piel amarilla | 18 | 0 | 1 | 0 |
| Piel seca | 14 | 0 | 6 | 0 |
| Cardiaco | ||||
| Hipertensión# | 39 | 8 | 14 | 1 |
| Edema/Edema periférico | 10 | <1 | 7 | 0 |
| Neurología | ||||
| Alteración del gustoÞ | 38 | <1 | 6 | 0 |
| Dolor de cabeza | 19 | <1 | 12 | 0 |
| Endocrino | ||||
| Hipotiroidismo/Aumento de TSH | 24 | <1 | 4 | 0 |
| Hemorragia/Sangrado | ||||
| Eventos de sangrado, todos los sitiosS | 24 | <1 | 5 | <1 |
| Metabolismo/Nutrición | ||||
| Anorexia/Disminución del apetito | 19 | <1 | 5 | 0 |
| Musculoesquelético | ||||
| Dolor en extremidades | 15 | <1 | 7 | 0 |
| Artralgia | 11 | <1 | 10 | 0 |
*Criterios de Terminología Común para Eventos Adversos (CTCAE), versión 3. Abreviaturas: ARs=reacciones adversas; N=número de pacientes; CCR=carcinoma de células renales.
a Incluye inflamación de la mucosa, estomatitis, úlcera aftosa, ulceración de la boca, ulceración de la lengua, dolor orofaríngeo y dolor oral.
b Incluye dolor abdominal, dolor abdominal inferior y dolor abdominal superior.
c Incluye edema localizado, edema facial, edema del párpado, edema periorbitario, hinchazón de la cara y edema ocular.
d Incluye dermatitis, dermatitis psoriasiforme, sarpullido exfoliativo, sarpullido genital, sarpullido, sarpullido eritematoso, sarpullido folicular, sarpullido generalizado, sarpullido macular, sarpullido maculopapular, sarpullido papular y sarpullido prurítico.
e Incluye hipertensión, aumento de la presión arterial, aumento de la presión arterial sistólica, aumento de la presión arterial diastólica y crisis hipertensiva.
f Incluye ageusia, hipogeusia y disgeusia.
g Incluye epistaxis, sangrado gingival, hemorragia rectal, hemoptisis, hemorragia anal, hemorragia gastrointestinal superior y hematuria.
Las reacciones adversas de Grado 4 en pacientes que recibieron malato de sunitinib incluyeron síndrome mano-pie (1%), fatiga (<1%), dolor abdominal (<1%), estomatitis (<1%) y pirexia (<1%).
Las anomalías de laboratorio de Grado 3 a 4 que ocurrieron en ≥2% de los pacientes que recibieron malato de sunitinib incluyen neutropenia (13%), trombocitopenia (5%), leucopenia (3%), linfopenia (3%), aumento de alanina aminotransferasa (2%), aumento de aspartato aminotransferasa (2%), hiperglucemia (2%) e hipercalemia (2%).
Tumores neuroendocrinos pancreáticos avanzados
La seguridad del malato de sunitinib se evaluó en el Estudio 6, un ensayo aleatorizado, doble ciego y controlado con placebo en el que los pacientes con pNET progresivo recibieron 37,5 mg de malato de sunitinib una vez al día (n=83) o placebo (n=82). La mediana del número de días de tratamiento fue de 139 días (rango: 13 a 532 días) para los pacientes con malato de sunitinib y 113 días (rango: 1 a 614 días) para los pacientes con placebo. Diecinueve pacientes (23%) con malato de sunitinib y 4 pacientes (5%) con placebo estuvieron en el estudio durante >1 año.
La interrupción permanente debido a una reacción adversa ocurrió en el 22% en el brazo de malato de sunitinib. Las interrupciones de dosis ocurrieron en el 30% y las reducciones de dosis ocurrieron en el 31% de los pacientes que recibieron malato de sunitinib.
La Tabla 8 resume las reacciones adversas en el Estudio 6.
Tabla 8. Reacciones adversas notificadas en ≥10% de los pacientes con pNET que recibieron malato de sunitinib y más comúnmente que en los pacientes que recibieron placebo* en el Estudio 6
| Reacción adversa | pNET | |||
|---|---|---|---|---|
| Malato de sunitinib (N=83) | Placebo (N=82) | |||
| Todos los grados% | Grado 3–4†% | Todos los grados% | Grado 3–4% | |
| * Criterios comunes de terminología para eventos adversos (CTCAE), versión 3. Abreviaturas: N=número de pacientes; pNET=tumores neuroendocrinos pancreáticos. a Las reacciones adversas de grado 4 en pacientes con malato de sunitinib incluyeron fatiga (1%). b Incluye estomatitis aftosa, dolor gingival, gingivitis, glositis, glosodinia, ulceración oral, malestar oral, dolor oral, ulceración lingual, sequedad de la mucosa, inflamación de la mucosa y boca seca. c Incluye malestar abdominal, dolor abdominal y dolor abdominal superior. d Incluye hematemesis, hematoquecia, hematoma, hemoptisis, hemorragia, melena y metrorragia. |
||||
| Cualquier reacción adversa | 99 | 54 | 95 | 50 |
| Gastrointestinales | ||||
| Diarrea | 59 | 5 | 39 | 2 |
| Estomatitis/síndromes orales‡ | 48 | 6 | 18 | 0 |
| Náuseas | 45 | 1 | 29 | 1 |
| Dolor abdominal§ | 39 | 5 | 34 | 10 |
| Vómitos | 34 | 0 | 31 | 2 |
| Dispepsia | 15 | 0 | 6 | 0 |
| Constitucionales | ||||
| Astenia | 34 | 5 | 27 | 4 |
| Fatiga | 33 | 5 | 27 | 9 |
| Pérdida de peso | 16 | 1 | 11 | 0 |
| Dermatología | ||||
| Cambios en el color del cabello | 29 | 1 | 1 | 0 |
| Síndrome mano-pie | 23 | 6 | 2 | 0 |
| Erupción cutánea | 18 | 0 | 5 | 0 |
| Piel seca | 15 | 0 | 11 | 0 |
| Cardíaco | ||||
| Hipertensión | 27 | 10 | 5 | 1 |
| Hemorragia/Sangrado | ||||
| Eventos de sangrado | 22 | 0 | 10 | 4 |
| Epistaxis | 21 | 1 | 5 | 0 |
| Neurología | ||||
| Disgeusia | 21 | 0 | 5 | 0 |
| Dolor de cabeza | 18 | 0 | 13 | 1 |
| Psiquiátrico | ||||
| Insomnio | 18 | 0 | 12 | 0 |
| Musculoesquelético | ||||
| Artralgia | 15 | 0 | 6 | 0 |
Tabla 9. Anomalías de laboratorio reportadas en ≥ 10% de los pacientes con pNET que recibieron malato de sunitinib en el Estudio 6
| Anomalía de laboratorio | ET | |||
| Malato de sunitinib | Placebo | |||
| Todos los grados* % |
Grado 3 a 4*,a % |
Todos los grados* % |
Grado 3 a 4*,b % |
|
| Gastrointestinal | ||||
| AST aumentada | 72 | 5 | 70 | 3 |
| Fosfatasa alcalina aumentada | 63 | 10 | 70 | 11 |
| ALT aumentada | 61 | 4 | 55 | 3 |
| Bilirrubina total aumentada | 37 | 1 | 28 | 4 |
| Amilasa aumentada | 20 | 4 | 10 | 1 |
| Lipasa aumentada | 17 | 5 | 11 | 4 |
| Hematología | ||||
| Neutrófilos disminuidos | 71 | 16 | 16 | 0 |
| Hemoglobina disminuida | 65 | 0 | 55 | 1 |
| Plaquetas disminuidas | 60 | 5 | 15 | 0 |
| Linfocitos disminuidos | 56 | 7 | 35 | 4 |
| Renal/Metabólico | ||||
| Glucosa aumentada | 71 | 12 | 78 | 18 |
| Albúmina disminuida | 41 | 1 | 37 | 1 |
| Fósforo disminuido | 36 | 7 | 22 | 5 |
| Calcio disminuido | 34 | 0 | 19 | 0 |
| Sodio disminuido | 29 | 2 | 34 | 3 |
| Creatinina aumentada | 27 | 5 | 28 | 5 |
| Glucosa disminuida | 22 | 2 | 15 | 4 |
| Potasio disminuido | 21 | 4 | 14 | 0 |
| Magnesio disminuido | 19 | 0 | 10 | 0 |
| Potasio aumentado | 18 | 1 | 11 | 1 |
* El denominador utilizado para calcular la tasa varió de 52 a 82 para malato de sunitinib y de 39 a 80 para placebo en función del número de pacientes con un valor basal y al menos un valor posterior al tratamiento. Terminología común de criterios para eventos adversos (CTCAE), versión 3 Abreviaturas: ALT=alanina aminotransferasa; AST=aspartato aminotransferasa; N=número de pacientes; pNET=tumores neuroendocrinos pancreáticos.
a Las anomalías de laboratorio de grado 4 en pacientes con malato de sunitinib incluyeron creatinina (4%), lipasa (4%), glucosa disminuida (2%), glucosa aumentada (2%), neutrófilos (2%), ALT (1%), AST (1%), plaquetas (1%), potasio aumentado (1%) y bilirrubina total (1%).
b Las anomalías de laboratorio de grado 4 en pacientes con placebo incluyeron creatinina (3%), fosfatasa alcalina (1%), glucosa aumentada (1%) y lipasa (1%).
Eventos tromboembólicos venosos
En la población agrupada de seguridad, el 3,5% de los pacientes experimentaron un evento tromboembólico venoso, incluido el grado 3 a 4 en el 2,2% de los pacientes.
Función pancreática
Se observó pancreatitis en 1 paciente (1%) en el estudio de pNET, 5 pacientes (1%) en el estudio de RCC naive al tratamiento, y 1 paciente (<1%) en el estudio de tratamiento adyuvante para RCC con malato de sunitinib.
6.2 Experiencia poscomercialización
Se han identificado las siguientes reacciones adversas durante el uso posterior a la aprobación de malato de sunitinib. Debido a que estas reacciones se informan voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
- Trastornos de la sangre y del sistema linfático: hemorragia asociada con trombocitopenia*.
- Trastornos gastrointestinales: esofagitis.
- Trastornos hepatobiliares: colecistitis, particularmente colecistitis acalculosa.
- Trastornos del sistema inmunitario: reacciones de hipersensibilidad, incluido angioedema.
- Infecciones e infestaciones: infección grave (con o sin neutropenia)*. Las infecciones observadas con mayor frecuencia con malato de sunitinib incluyen infecciones respiratorias, del tracto urinario, de la piel y sepsis/shock séptico.
- Trastornos musculoesqueléticos y del tejido conectivo: formación de fístulas, a veces asociada con necrosis y/o regresión tumoral*; miopatía y/o rabdomiólisis con o sin insuficiencia renal aguda*.
- Trastornos renales y urinarios: insuficiencia y/o falla renal*.
- Trastornos respiratorios: embolia pulmonar*, derrame pleural*.
- Trastornos de la piel y del tejido subcutáneo: pioderma gangrenoso, incluyendo de-challenges positivos.
- Trastornos vasculares: aneurismas arteriales (incluida la aorta), disecciones* y ruptura*; eventos tromboembólicos arteriales*. Los eventos más frecuentes incluyeron accidente cerebrovascular, ataque isquémico transitorio e infarto cerebral.
- Trastornos generales y condiciones del sitio de administración: cicatrización deteriorada.* incluyendo algunas fatalidades
7 INTERACCIONES MEDICAMENTOSAS
7.1 Efecto de otros medicamentos sobre el malato de sunitinib
Inhibidores potentes de CYP3A4La coadministración con inhibidores potentes de CYP3A4 puede aumentar las concentraciones plasmáticas de sunitinib [ver Farmacología Clínica (12.3)]. Seleccione un medicamento concomitante alternativo sin potencial de inhibición enzimática o con un potencial mínimo. Considere una reducción de la dosis de malato de sunitinib cuando se administre conjuntamente con inhibidores potentes de CYP3A4 [ver Dosis y Administración (2.5)].
Inductores potentes de CYP3A4La coadministración con inductores potentes de CYP3A4 puede disminuir las concentraciones plasmáticas de sunitinib [ver Farmacología Clínica (12.3)]. Seleccione un medicamento concomitante alternativo sin potencial de inducción enzimática o con un potencial mínimo. Considere un aumento de la dosis de malato de sunitinib cuando deba administrarse conjuntamente con inductores de CYP3A4 [ver Dosis y Administración (2.5)].
7.2 Medicamentos que prolongan el intervalo QT
El malato de sunitinib se asocia con la prolongación del intervalo QTc [ver Advertencias y Precauciones (5.3), Farmacología Clínica (12.2)]. Monitoree el intervalo QT con ECG con mayor frecuencia en pacientes que requieren tratamiento con medicamentos concomitantes que se sabe que prolongan el intervalo QT.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de riesgosBased en estudios de reproducción animal y su mecanismo de acción, el malato de sunitinib puede causar daño fetal cuando se administra a una mujer embarazada [ver Farmacología Clínica (12.1)]. No hay datos disponibles en mujeres embarazadas para informar un riesgo asociado a la droga. En estudios de toxicología del desarrollo y reproducción en animales, la administración oral de sunitinib a ratas y conejas embarazadas durante la organogénesis resultó en teratogenicidad (embroletalidad, malformaciones craneofaciales y esqueléticas) a 5.5 y 0.3 veces el AUC combinado (la exposición sistémica combinada de sunitinib más su metabolito activo) en pacientes a los que se les administraron las dosis diarias recomendadas (RDD) de 50 mg, respectivamente (ver Datos). Aconseje a las mujeres en edad fértil del riesgo potencial para el feto.
Se desconoce el riesgo de base estimado de defectos congénitos importantes y aborto espontáneo para las poblaciones indicadas. Todos los embarazos tienen un riesgo de base de defectos congénitos, pérdida u otros resultados adversos. En la población general de EE. UU., el riesgo de base estimado de defectos congénitos importantes y abortos espontáneos en embarazos clínicamente reconocidos es del 2 al 4% y del 15 al 20%, respectivamente.
Datos
Datos en animalesEn un estudio de fertilidad femenina y desarrollo embrionario temprano, a ratas hembras se les administró sunitinib por vía oral (0.5, 1.5, 5 mg/kg/día) durante 21 días antes del apareamiento y durante 7 días después del apareamiento. Se observó embroletalidad a 5 mg/kg/día (aproximadamente 5 veces el AUC combinado en pacientes a los que se les administró la RDD de 50 mg).
En estudios de toxicidad del desarrollo embrio-fetal, se administró sunitinib por vía oral a ratas preñadas (0.3, 1.5, 3, 5 mg/kg/día) y conejas (0.5, 1, 5, 20 mg/kg/día) durante el período de organogénesis. En ratas, se observó embroletalidad y malformaciones esqueléticas de las costillas y vértebras a la dosis de 5 mg/kg/día (aproximadamente 5.5 veces el AUC combinado en pacientes a los que se les administró la RDD de 50 mg). No se observaron efectos fetales adversos en ratas a dosis ≤3 mg/kg/día (aproximadamente 2 veces el AUC combinado en pacientes a los que se les administró la RDD de 50 mg). En conejos, se observó embroletalidad a 5 mg/kg/día (aproximadamente 3 veces el AUC combinado en pacientes a los que se les administró la RDD de 50 mg), y se observaron malformaciones craneofaciales (labio leporino y paladar hendido) a ≥1 mg/kg/día (aproximadamente 0.3 veces el AUC combinado en pacientes a los que se les administró la RDD de 50 mg).
Se evaluó sunitinib (0.3, 1, 3 mg/kg/día) en un estudio de desarrollo pre y postnatal en ratas preñadas. Las ganancias de peso corporal materno se redujeron durante la gestación y la lactancia a dosis ≥1 mg/kg/día (aproximadamente 0.5 veces el AUC combinado en pacientes a los que se les administró la RDD de 50 mg). A 3 mg/kg/día (aproximadamente 2 veces el AUC combinado en pacientes a los que se les administró la RDD de 50 mg), se observaron pesos corporales neonatales reducidos al nacer y persistieron en la descendencia de ambos sexos durante el período previo al destete y en machos durante el período posterior al destete. No se observaron efectos adversos del desarrollo a dosis ≤1 mg/kg/día.
8.2 Lactancia
No hay información con respecto a la presencia de sunitinib y sus metabolitos en la leche materna. Sunitinib y sus metabolitos se excretaron en la leche de rata a concentraciones hasta 12 veces más altas que en plasma (ver Datos). Debido al potencial de reacciones adversas graves en los lactantes, aconseje a las mujeres que no amamanten durante el tratamiento con malato de sunitinib y durante al menos 4 semanas después de la última dosis.
Datos
Datos en animales
En ratas hembras lactantes a las que se les administraron 15 mg/kg, sunitinib y sus metabolitos se excretaron en la leche a concentraciones hasta 12 veces más altas que en plasma.
8.3 Mujeres y hombres con potencial reproductivo
El malato de sunitinib puede causar daño fetal cuando se administra a una mujer embarazada [ver Uso en poblaciones específicas (8.1)].
Pruebas de embarazo
Verifique el estado de embarazo de las mujeres en edad fértil antes de iniciar el tratamiento con malato de sunitinib.
Anticoncepción
MujeresAconsejar a las mujeres en edad fértil que usen anticonceptivos eficaces durante el tratamiento con malato de sunitinib y durante al menos 4 semanas después de la última dosis.
Hombres
Con base en los hallazgos de estudios de reproducción en animales, aconsejar a los hombres con parejas femeninas en edad reproductiva que usen anticonceptivos eficaces durante el tratamiento con malato de sunitinib y durante 7 semanas después de la última dosis.
Infertilidad
Con base en los hallazgos en animales, el malato de sunitinib puede afectar la fertilidad masculina y femenina [ver Toxicología no clínica (13.1)].
8.4 Uso pediátrico
No se ha establecido la seguridad y eficacia del malato de sunitinib en pacientes pediátricos. Se evaluaron la seguridad y la farmacocinética de sunitinib en un estudio abierto (NCT00387920) en pacientes pediátricos de 2 a <17 años de edad (n=29) con tumores sólidos refractarios. Además, se evaluó la eficacia, seguridad y farmacocinética de sunitinib en otro estudio abierto (NCT01462695) en pacientes pediátricos de 2 a <17 años de edad (n=27) con glioma de alto grado o ependimoma. La dosis máxima tolerada (MTD) normalizada para el área de superficie corporal (BSA) fue menor en pacientes pediátricos en comparación con los adultos. Sunitinib fue mal tolerado en pacientes pediátricos. La aparición de cardiotoxicidad limitante de la dosis llevó a una enmienda del estudio NCT00387920 para excluir a pacientes con exposición previa a antraciclinas o radiación cardíaca. No se informaron respuestas en pacientes en ninguno de los ensayos.
El clearance aparente y el volumen de distribución normalizados por BSA para sunitinib y su principal metabolito activo fueron menores en pacientes pediátricos en comparación con los adultos.
No se ha estudiado adecuadamente el efecto sobre las placas de crecimiento tibial abiertas en pacientes pediátricos que recibieron malato de sunitinib. Ver Datos de toxicidad en animales jóvenes a continuación.
Datos de toxicidad en animales jóvenes
La displasia fisaria estuvo presente en monos cinomolgos con placas de crecimiento abiertas tratados con sunitinib durante ≥3 meses (dosis de 3 meses 2, 6, 12 mg/kg/día; 8 ciclos de dosis 0.3, 1.5, 6 mg/kg/día) a dosis que fueron >0.4 veces el AUC combinado (la exposición sistémica combinada de sunitinib más su metabolito activo) en pacientes a los que se les administraron los RDD de 50 mg. El nivel sin efecto (NOEL) fue de 1.5 mg/kg/día en monos tratados intermitentemente durante 8 ciclos, pero no se identificó en monos tratados continuamente durante 3 meses. En ratas en desarrollo tratadas continuamente durante 3 meses (1.5, 5 y 15 mg/kg) o 5 ciclos (0.3, 1.5 y 6 mg/kg/día), las anomalías óseas consistieron en engrosamiento del cartílago epifisario del fémur y un aumento de la fractura de la tibia a dosis ≥5 mg/kg (aproximadamente 10 veces el AUC combinado en pacientes a los que se les administró la RDD de 50 mg). Además, se presentaron caries dentales en ratas a >5 mg/kg. La incidencia y la gravedad de la displasia fisaria fueron relacionadas con la dosis y reversibles al suspender el tratamiento; sin embargo, los hallazgos en los dientes no lo fueron. En ratas, el NOEL en huesos fue ≤2 mg/kg/día.
8.5 Uso geriátrico
De los 7527 pacientes con GIST, RCC (avanzado y adyuvante) o pNET que recibieron malato de sunitinib, el 32% tenían 65 años o más, y el 7% tenían 75 años o más. Los pacientes de 65 años o más tuvieron una mayor incidencia de reacciones adversas de Grado 3 o 4 (67%) que los pacientes más jóvenes (60%).
En el estudio GIST, 73 (30%) de los pacientes que recibieron malato de sunitinib tenían 65 años o más. En el estudio mRCC, 152 (41%) de los pacientes que recibieron malato de sunitinib tenían 65 años o más. No se observaron diferencias generales en seguridad o efectividad entre estos pacientes y los pacientes más jóvenes.
En el estudio pNET, 22 (27%) de los pacientes que recibieron malato de sunitinib tenían 65 años o más. Los estudios clínicos de malato de sunitinib no incluyeron un número suficiente de pacientes con pNET para determinar si los pacientes de 65 años o más responden de manera diferente a los pacientes más jóvenes.
8.6 Insuficiencia hepática
No se requiere ajuste de dosis en pacientes con insuficiencia hepática leve o moderada (Child-Pugh Clase A o B) [ver Farmacología Clínica (12.3)]. El malato de sunitinib no se estudió en pacientes con insuficiencia hepática grave (Child-Pugh Clase C).
8.7 Insuficiencia renal
No se recomienda ajuste de dosis en pacientes con insuficiencia renal leve (CLcr 50 a 80 mL/min), moderada (CLcr 30 a <50 mL/min) o grave (CLcr <30 mL/min) que no están en diálisis [ver Farmacología Clínica (12.3)]. No se recomienda ajuste de dosis para pacientes con enfermedad renal en etapa terminal (ESRD) en hemodiálisis [ver Farmacología Clínica (12.3)].
10 SOBREDOSIS
El tratamiento de la sobredosis con malato de sunitinib debe consistir en medidas generales de apoyo. No existe un antídoto específico para la sobredosis con malato de sunitinib. Si está indicado, la eliminación del fármaco no absorbido debe lograrse mediante émesis o lavado gástrico. Se han reportado casos de sobredosis accidental; estos casos se asociaron con reacciones adversas consistentes con el perfil de seguridad conocido del malato de sunitinib, o sin reacciones adversas. En estudios no clínicos, se observó mortalidad después de tan solo 5 dosis diarias de 500 mg/kg (3000 mg/m2) en ratas. A esta dosis, los signos de toxicidad incluyeron coordinación muscular alterada, sacudidas de la cabeza, hipoactividad, secreción ocular, piloerección y trastornos gastrointestinales. Se observó mortalidad y signos similares de toxicidad a dosis más bajas cuando se administraron durante períodos más prolongados.
11 DESCRIPCIÓN
Sunitinib es un inhibidor de kinasa presente en las cápsulas de malato de sunitinib como la sal de malato.
El malato de sunitinib se describe químicamente como (Z)-N-[2-(Dietilamino)etil]-5-[(5-fluoro-1,2-dihidro-2-oxo-3H-indol-3-ilideno)metil]-2,4-dimetil-1H-pirrol-3-carboxamida(s)-2-hidroxisuccinato La fórmula molecular es C22H27FN4O2● C4H6O5 y el peso molecular es 532.6 Daltons. La estructura química del malato de sunitinib es:
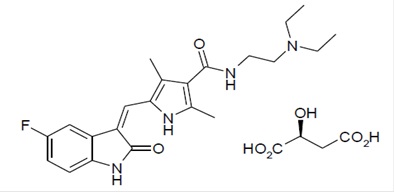
El malato de sunitinib es un polvo de color amarillo a naranja con un pKa de 8.95. La solubilidad del malato de sunitinib en medios acuosos en el rango de pH 1.2 a pH 6.8 es superior a 25 mg/mL. El logaritmo del coeficiente de distribución a pH 7 es 5.2.
Las cápsulas de malato de sunitinib para administración oral se suministran como cápsulas duras impresas que contienen 12.5 mg, 25 mg, 37.5 mg o 50 mg de sunitinib (equivalente a 16.7 mg, 33.4 mg, 50.1 mg o 66.8 mg de malato de sunitinib, respectivamente). Las cápsulas contienen los siguientes ingredientes inactivos: croscarmelosa sódica, estearato de magnesio, manitol y povidona (K-25). Las cápsulas de 12.5 mg contienen gelatina, óxido de hierro negro, óxido de hierro rojo, óxido de hierro amarillo, lauril sulfato de sodio y dióxido de titanio. Las cápsulas de 25 mg, 37.5 mg y 50 mg contienen gelatina, óxido de hierro negro, lauril sulfato de sodio y dióxido de titanio.
La tinta de impresión blanca contiene alcohol deshidratado, alcohol isopropílico, alcohol butílico, propilenglicol, goma laca, solución de amoníaco fuerte, hidróxido de potasio y dióxido de titanio.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Sunitinib es una molécula pequeña que inhibe múltiples receptores de tirosina quinasa (RTKs), algunos de los cuales están implicados en el crecimiento tumoral, la angiogénesis patológica y la progresión metastásica del cáncer. Se evaluó la actividad inhibitoria de sunitinib contra una variedad de quinasas (>80 quinasas) y se identificó como un inhibidor de los receptores del factor de crecimiento derivado de plaquetas (PDGFRα y PDGFRβ), los receptores del factor de crecimiento endotelial vascular (VEGFR1, VEGFR2 y VEGFR3), el receptor del factor de células madre (KIT), la tirosina quinasa-3 similar a Fms (FLT3), el receptor del factor estimulante de colonias tipo 1 (CSF-1R) y el receptor del factor neurotrófico derivado de la línea celular glial (RET). La inhibición de la actividad de estos RTKs por sunitinib se ha demostrado en ensayos bioquímicos y celulares, y la inhibición de la función se ha demostrado en ensayos de proliferación celular. El metabolito primario exhibe una potencia similar en comparación con sunitinib en ensayos bioquímicos y celulares.
Sunitinib inhibió la fosforilación de múltiples RTKs (PDGFRβ, VEGFR2, KIT) en xenoinjertos tumorales que expresan dianas RTK in vivo y demostró inhibición del crecimiento tumoral o regresión tumoral y/o inhibió metástasis en algunos modelos experimentales de cáncer. Sunitinib demostró la capacidad de inhibir el crecimiento de células tumorales que expresan RTKs desregulados (PDGFR, RET o KIT) in vitro y de inhibir la angiogénesis tumoral dependiente de PDGFRβ y VEGFR2 in vivo.
12.2 Farmacodinámica
Relación exposición-respuesta
Basado en análisis farmacocinéticos/farmacodinámicos poblacionales, hubo relaciones entre los cambios en diferentes criterios de valoración farmacodinámicos (es decir, criterios de valoración de seguridad y eficacia) a lo largo del tiempo y las exposiciones plasmáticas de sunitinib.
Electrofisiología cardíaca
El malato de sunitinib puede causar una prolongación del intervalo QT de manera dosis-dependiente, lo que puede conducir a un mayor riesgo de arritmias ventriculares, incluida la torsade de pointes [ver Advertencias y precauciones (5.3)].
12.3 Farmacocinética
La farmacocinética de sunitinib y malato de sunitinib se ha evaluado en sujetos sanos y en pacientes con tumores sólidos.
El AUC y la Cmax de sunitinib aumentan proporcionalmente en un rango de dosis de 25 mg a 100 mg (0,5 a 2 veces la RDD aprobada de 50 mg). La farmacocinética fue similar en sujetos sanos y en pacientes con un tumor sólido, incluidos pacientes con GIST y RCC. No se observaron cambios significativos en la farmacocinética de sunitinib o el metabolito activo primario con la administración diaria repetida o con ciclos repetidos. Con la administración diaria repetida, sunitinib se acumula de 3 a 4 veces mientras que el metabolito primario se acumula de 7 a 10 veces. Las concentraciones en estado estacionario de sunitinib y su metabolito activo primario se alcanzan dentro de 10 a 14 días. Para el día 14, las concentraciones plasmáticas combinadas de sunitinib y su metabolito activo oscilaron entre 63 y 101 ng/mL.
Absorción
Después de la administración oral de sunitinib, el tiempo hasta la concentración plasmática máxima (Tmax) osciló entre 6 y 12 horas.
Efecto de los alimentos
La administración de una dosis única de malato de sunitinib de 50 mg con una comida alta en grasas y calorías (que consiste en aproximadamente 150 calorías proteicas y 500 a 600 calorías grasas) en sujetos sanos no tuvo un efecto clínicamente significativo sobre la exposición al malato de sunitinib o metabolitos activos.
Distribución
El volumen aparente de distribución (Vd/F) para sunitinib es de 2230 L. La unión de sunitinib y su metabolito activo primario a proteínas plasmáticas humanas in vitro es del 95% y 90%, respectivamente, sin dependencia de la concentración en el rango de 100 a 4000 ng/mL.
Eliminación
Después de la administración de una dosis oral única en sujetos sanos, las vidas medias terminales de sunitinib y su metabolito activo primario son de aproximadamente 40 a 60 horas y de 80 a 110 horas, respectivamente. El aclaramiento oral total de sunitinib (CL/F) varió de 34 a 62 L/h con una variabilidad interpaciente del 40%.
Metabolismo
Sunitinib se metaboliza principalmente por CYP3A4 a su metabolito activo primario, que se metaboliza aún más por CYP3A4. El metabolito activo primario comprende del 23% al 37% de la exposición total. Después de una dosis radiomarcada, sunitinib y su metabolito activo fueron los principales compuestos identificados en plasma, representando el 92% de la radiactividad.
Excreción
Después de una dosis radiomarcada de sunitinib, aproximadamente el 61% de la dosis se recuperó en las heces y el 16% en la orina.
Sunitinib y su metabolito activo primario fueron los principales compuestos identificados en orina y heces, representando el 86% y el 74% de la radiactividad, respectivamente.
Poblaciones específicas
No se observaron diferencias clínicamente significativas en la farmacocinética de sunitinib o el metabolito activo primario según la edad (18 a 84 años), el peso corporal (34 a 168 kg), la raza (blanca, negra o asiática), el sexo, la puntuación del Eastern Cooperative Oncology Group (ECOG), insuficiencia hepática leve (Child-Pugh Clase A) o moderada (Child-Pugh Clase B).
Pacientes con insuficiencia renal
No se predijeron ni observaron diferencias clínicamente significativas en la farmacocinética de sunitinib o su metabolito activo en pacientes con insuficiencia renal leve (CLcr 50 a 80 mL/min), moderada (CLcr 30 a <50 mL/min) o severa (CLcr <30 mL/min) que no están en diálisis, en comparación con pacientes con función renal normal (CLcr >80 mL/min). Aunque sunitinib no se eliminó mediante hemodiálisis, la exposición sistémica a sunitinib fue un 47% menor en pacientes con enfermedad renal en etapa terminal (ESRD) en hemodiálisis en comparación con pacientes con función renal normal.
Estudios de interacción de medicamentos
Estudios clínicos
Efecto de los inhibidores potentes de CYP3A4 sobre sunitinib: La coadministración de una dosis única de malato de sunitinib con ketoconazol (inhibidor potente de CYP3A4) aumentó la Cmax y el AUC0-inf combinados de sunitinib y su metabolito activo en un 49% y 51%, respectivamente, en sujetos sanos.
Efecto de los inductores potentes de CYP3A4 sobre sunitinib: La coadministración de una dosis única de malato de sunitinib con rifampicina (inductor potente de CYP3A4) redujo la Cmax y el AUC0-inf combinados de sunitinib y su metabolito activo en un 23% y 46%, respectivamente, en sujetos sanos.
Estudios in vitro
Los estudios in vitro en hepatocitos y microsomas humanos indicaron que sunitinib y el metabolito activo primario no inducen CYP1A2, CYP2E1 y CYP3A4/5, ni inhiben CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4/5 y CYP4A9/11 a concentraciones clínicamente relevantes.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la fertilidad
Se ha evaluado el potencial carcinogénico de sunitinib en 2 especies: ratones transgénicos rasH2 y ratas Sprague-Dawley. Hubo hallazgos positivos similares en ambas especies. En ratones transgénicos rasH2, se observaron carcinomas gastroduodenales y/o hiperplasia de la mucosa gástrica, así como una mayor incidencia de hemangiosarcomas de fondo con dosis diarias de sunitinib de ≥25 mg/kg/día en estudios de 1 o 6 meses de duración. No se observaron cambios proliferativos en ratones transgénicos rasH2 a 8 mg/kg/día. De manera similar, en un estudio de carcinogenicidad en ratas de 2 años, la administración de sunitinib en ciclos de 28 días seguidos de períodos de 7 días sin dosis resultó en hallazgos de carcinoma duodenal con dosis tan bajas como 1 mg/kg/día [aproximadamente 0,9 veces el AUC combinado (exposición sistémica combinada de sunitinib más su metabolito activo) en pacientes a los que se les administró la RDD de 50 mg]. Con la dosis alta de 3 mg/kg/día (aproximadamente 8 veces el AUC combinado en pacientes a los que se les administró la RDD de 50 mg), aumentó la incidencia de tumores duodenales y se acompañó de hallazgos de hiperplasia de células mucosas gástricas y por una mayor incidencia de feocromocitoma e hiperplasia de la glándula suprarrenal.
Sunitinib no causó daño genético cuando se probó en ensayos in vitro [mutación bacteriana (prueba de Ames), aberración cromosómica de linfocitos humanos] y una prueba de micronúcleos de médula ósea de rata in vivo.
En un estudio de fertilidad femenina y desarrollo embrionario temprano, se administró sunitinib oral (0.5, 1.5, 5 mg/kg/día) a ratas hembras durante 21 días antes del apareamiento y durante 7 días después del apareamiento. Se observó pérdida preimplantacional en hembras a las que se les administraron 5 mg/kg/día (aproximadamente 5 veces el AUC combinado en pacientes a los que se les administró la RDD de 50 mg). No se observaron efectos adversos sobre la fertilidad con dosis ≤1.5 mg/kg/día (aproximadamente igual al AUC combinado en pacientes a los que se les administró la RDD de 50 mg). Además, se identificaron efectos sobre el sistema reproductivo femenino en un estudio de mono de dosis repetidas por vía oral de 3 meses (2, 6, 12 mg/kg/día). Se observaron cambios ováricos (disminución del desarrollo folicular) a 12 mg/kg/día (aproximadamente 5 veces el AUC combinado en pacientes a los que se les administró la RDD de 50 mg), mientras que se observaron cambios uterinos (atrofia endometrial) a ≥2 mg/kg/día (aproximadamente 0.4 veces el AUC combinado en pacientes a los que se les administró la RDD de 50 mg). Con la adición de atrofia vaginal, los efectos uterinos y ováricos se reprodujeron a 6 mg/kg/día (aproximadamente 0.8 veces el AUC combinado en pacientes a los que se les administró la RDD de 50 mg) en un estudio de mono de 9 meses (0.3, 1.5 y 6 mg/kg/día administrados diariamente durante 28 días seguidos de un respiro de 14 días).
En un estudio de fertilidad masculina, no se observaron efectos reproductivos en ratas macho a las que se les administró sunitinib oral de 1, 3 o 10 mg/kg/día durante 58 días antes del apareamiento con hembras no tratadas. La fertilidad, la cópula, los índices de concepción y la evaluación de los espermatozoides (morfología, concentración y motilidad) no se vieron afectados por sunitinib en dosis ≤10 mg/kg/día (aproximadamente ≥26 veces el AUC combinado en pacientes a los que se les administró la RDD de 50 mg).
14 ESTUDIOS CLÍNICOS
14.1 Tumor del estroma gastrointestinal
El Estudio 1 (NCT#00075218) fue un ensayo aleatorizado, doble ciego, controlado con placebo, de 2 brazos, internacional de malato de sunitinib en pacientes con GIST que tenían progresión de la enfermedad durante el tratamiento previo con mesilato de imatinib (imatinib) o que eran intolerantes al imatinib. El objetivo fue comparar el tiempo hasta la progresión del tumor (TTP) en pacientes que recibieron malato de sunitinib más el mejor cuidado de soporte versus pacientes que recibieron placebo más el mejor cuidado de soporte. Otros objetivos incluyeron supervivencia libre de progresión (PFS), tasa de respuesta objetiva (ORR) y supervivencia general (OS). Los pacientes fueron aleatorizados (2:1) para recibir 50 mg de malato de sunitinib o placebo por vía oral, una vez al día, en el cronograma 4/2 hasta la progresión de la enfermedad o el retiro del estudio por otro motivo. El tratamiento se desenmascaró en el momento de la progresión de la enfermedad. A los pacientes aleatorizados a placebo se les ofreció entonces el cruce a malato de sunitinib abierto y a los pacientes aleatorizados a malato de sunitinib se les permitió continuar el tratamiento según el criterio del investigador.
En el momento de un análisis provisional preespecificado, la población por intención de tratar (ITT) incluyó a 312 pacientes. Doscientos siete (207) pacientes fueron aleatorizados al brazo de malato de sunitinib y 105 pacientes fueron aleatorizados al brazo de placebo. La demografía fue comparable entre los grupos de malato de sunitinib y placebo con respecto a la edad (69 % frente a 72 % <65 años para malato de sunitinib frente a placebo, respectivamente), sexo (hombres: 64 % frente a 61 %), raza (blancos: 88 % ambos brazos, asiáticos: 5 % ambos brazos, negros: 4 % ambos brazos, el resto no informado) y estado funcional (ECOG 0: 44 % frente a 46 %, ECOG 1: 55 % frente a 52 % y ECOG 2: 1 % frente a 2 %). El tratamiento previo incluyó cirugía (94 % frente a 93 %) y radioterapia (8 % frente a 15 %). El resultado del tratamiento previo con imatinib también fue comparable entre los brazos con intolerancia (4 % frente a 4 %), progresión dentro de los 6 meses de iniciar el tratamiento (17 % frente a 16 %) o progresión más allá de los 6 meses (78 % frente a 80 %) equilibrado.
El análisis planificado de eficacia y seguridad provisional se realizó después de que ocurrieron 149 eventos de TTP. Hubo una ventaja estadísticamente significativa para malato de sunitinib sobre placebo en TTP, cumpliendo con el criterio de valoración principal. Los resultados de eficacia se resumen en la Tabla 10 y la curva de Kaplan-Meier para TTP se muestra en la Figura 1.
Tabla 10. Resultados de eficacia de GIST del Estudio 1 (fase de tratamiento doble ciego)
| Parámetro de eficacia | Malato de sunitinib (N=207) |
Placebo (N=105) |
Valor de p (prueba de log-rank) |
HR (IC del 95%) |
||
| Tiempo hasta la progresión del tumora[mediana, semanas (IC del 95%)] | 27.3 (16, 32.1) |
6.4 (4.4, 10) |
<0.0001* | 0.33 (0.23, 0.47) |
||
| Supervivencia libre de progresiónb [mediana, semanas (IC del 95%)] | 24.1 (11.1, 28.3) |
6 (4.4, 9.9) |
<0.0001 | 0.33(0.24, 0.47) | ||
| Tasa de respuesta objetiva (RP) [%, (IC del 95%)] | 6.8 (3.7, 11.1) |
0 | 0.006c | |||
*Una comparación se considera estadísticamente significativa si el valor de p es <0.00417 (límite de detención de O’Brien Fleming). Abreviaturas: IC = intervalo de confianza; GIST = tumor del estroma gastrointestinal; HR = razón de riesgo; N = número de pacientes; RP = respuesta parcial.
a Tiempo desde la aleatorización hasta la progresión; las muertes antes de la progresión documentada se censuraron en el momento de la última evaluación radiográfica.
b Tiempo desde la aleatorización hasta la progresión o muerte por cualquier causa.
c Prueba de chi-cuadrado de Pearson.
Figura 1. Curva de Kaplan-Meier de TTP en el Estudio 1 de GIST (población por intención de tratar)
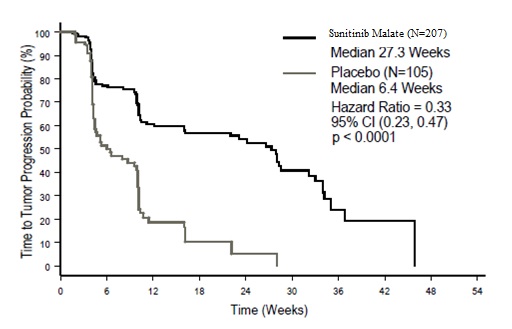
Abreviaturas: IC = intervalo de confianza; GIST = tumor del estroma gastrointestinal; N = número de pacientes; TTP = tiempo hasta la progresión del tumor.
La población ITT final inscrita en la fase de tratamiento doble ciego del estudio incluyó a 243 pacientes aleatorizados al brazo de malato de sunitinib y 118 pacientes aleatorizados al brazo de placebo. Después de que se alcanzó el criterio de valoración principal en el análisis provisional, el estudio se desenmascaró y se ofreció a los pacientes del brazo de placebo tratamiento abierto con malato de sunitinib. Noventa y nueve (99) de los pacientes inicialmente aleatorizados a placebo cruzaron para recibir malato de sunitinib en la fase de tratamiento abierto. En el análisis final de OS especificado por protocolo, la OS mediana fue de 72,7 semanas para el brazo de malato de sunitinib y 64,9 semanas para el brazo de placebo [razón de riesgo (HR)=0,876, intervalo de confianza (IC) del 95% (0,679, 1,129)].
Estudio 2
El Estudio 2 fue un estudio abierto, multicéntrico, de un solo brazo, de escalada de dosis realizado en pacientes con GIST tras la progresión o intolerancia al imatinib. Después de la identificación del régimen recomendado (50 mg una vez al día en el cronograma 4/2), 55 pacientes en este estudio recibieron la dosis de 50 mg de malato de sunitinib en el cronograma de tratamiento 4/2. Se observaron respuestas parciales (RP) en 5 de 55 pacientes (tasa de RP del 9,1%; IC del 95%: 3%, 20%).
14.2 Carcinoma de células renales
Sin tratamiento previo
El Estudio 3 (NCT#00083889) fue un estudio aleatorizado, multicéntrico, internacional que comparó malato de sunitinib en monoterapia con interferón alfa en pacientes con CCR sin tratamiento previo. El objetivo fue comparar la SLP en pacientes que recibieron malato de sunitinib versus pacientes que recibieron interferón alfa. Otros criterios de valoración incluyeron ORR, OS y seguridad. Setecientos cincuenta (750) pacientes fueron aleatorizados (1:1) para recibir 50 mg de malato de sunitinib una vez al día en el cronograma 4/2 o para recibir interferón alfa administrado por vía subcutánea a 9 millones de unidades internacionales (MUI) 3 veces por semana. Los pacientes fueron tratados hasta la progresión de la enfermedad o el retiro del estudio.
La población ITT incluyó 750 pacientes, 375 asignados aleatoriamente a malato de sunitinib y 375 asignados aleatoriamente a interferón alfa. Los datos demográficos fueron comparables entre los grupos de malato de sunitinib e interferón alfa con respecto a la edad (59% versus 67% <65 años para malato de sunitinib versus interferón alfa, respectivamente), sexo (hombres: 71% versus 72%), raza (blancos: 94% versus 91%, asiáticos: 2% versus 3%, negros: 1% versus 2%, el resto no reportado), y estado funcional (ECOG 0: 62% versus 61%, ECOG 1: 38% cada brazo, ECOG 2: 0 versus 1%). El tratamiento previo incluyó nefrectomía (91% versus 89%) y radioterapia (14% cada brazo). El sitio más común de metástasis presente en la selección fue el pulmón (78% versus 80%, respectivamente), seguido por los ganglios linfáticos (58% versus 53%, respectivamente) y hueso (30% cada brazo); la mayoría de los pacientes tenían múltiples (2 o más) sitios metastásicos al inicio (80% versus 77%, respectivamente).
Hubo una ventaja estadísticamente significativa para malato de sunitinib sobre interferón alfa en el punto final de PFS (ver Tabla 11 y Figura 2). En los factores de estratificación preespecificados de lactato deshidrogenasa (LDH) (>1.5 LSN versus ≤1.5 LSN), estado funcional ECOG (0 versus 1), y nefrectomía previa (sí versus no), el hazard ratio favoreció a malato de sunitinib sobre interferón alfa. La ORR fue mayor en el brazo de malato de sunitinib
(ver Tabla 11).
Tabla 11. Resultados de eficacia de RCC sin tratamiento previo (análisis intermedio) del Estudio 3
| Parámetro de eficacia | Malato de Sunitinib (N=375) |
Interferón Alfa (N=375) |
valor p (prueba de log-rank) |
HR (95% IC) |
| Supervivencia libre de progresióna [mediana, semanas (95% IC)] |
47.3 (42.6, 50.7) |
22 (16.4, 24) |
<0.000001b | 0.415 (0.320, 0.539) |
| Tasa de respuesta objetivaa [%, (95% IC)] |
27.5 (23, 32.3) |
5.3 (3.3, 8.1) |
<0.001c | NA |
Abreviaturas: CI=intervalo de confianza; HR=hazard ratio; N=número de pacientes; NA=no
aplicable; RCC=carcinoma de células renales.
a Evaluado por laboratorio central de radiología ciego; los escaneos de 90 pacientes no habían sido leídos al momento del análisis.
b Una comparación se considera estadísticamente significativa si el valor p es <0.0042 (límite de detención de O’Brien Fleming).
c Prueba de chi-cuadrado de Pearson.
Figura 2. Curva de Kaplan-Meier de PFS en el Estudio 3 de RCC sin tratamiento previo (Población por intención de tratar)
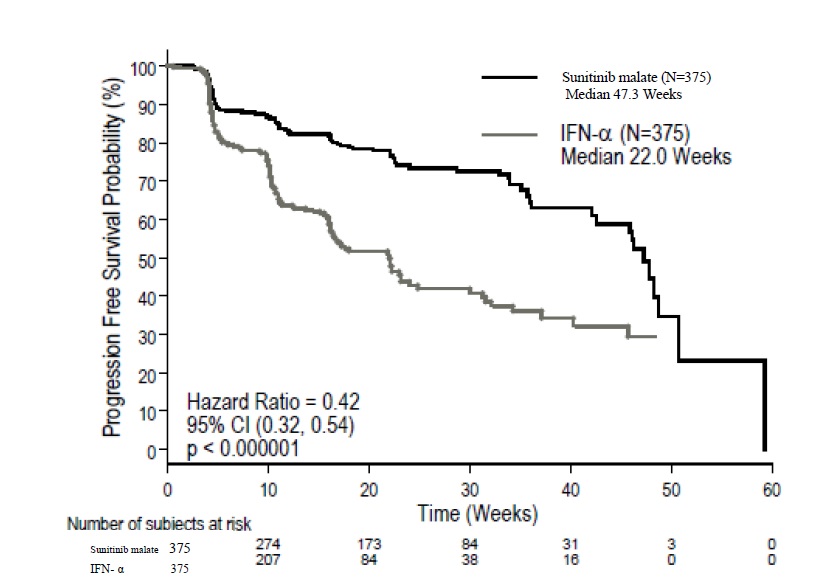
Abreviaturas: CI=intervalo de confianza; IFN-α=interferón-alfa; N=número de pacientes; PFS=supervivencia libre de progresión; RCC=carcinoma de células renales.
En el análisis final de OS especificado por protocolo, la mediana de OS fue 114.6 semanas para el brazo de malato de sunitinib y 94.9 semanas para el brazo de interferón alfa (HR=0.821; 95% IC: 0.673, 1.001). La mediana de OS para el brazo de interferón alfa incluye 25 pacientes que discontinuaron el tratamiento con interferón alfa debido a progresión de la enfermedad y cruzaron al tratamiento con malato de sunitinib, así como 121 pacientes (32%) en el brazo de interferón alfa que recibieron tratamiento contra el cáncer post-estudio con malato de sunitinib.
Refractario a citoquinas
El uso de malato de sunitinib como agente único en el tratamiento de RCC refractario a citoquinas se investigó en 2 estudios de un solo brazo, multicéntricos. Todos los pacientes inscritos en estos estudios experimentaron falla de la terapia previa basada en citoquinas. En el Estudio 4 (NCT#00077974), el fallo de la terapia previa con citoquinas se basó en evidencia radiográfica de progresión de la enfermedad definida por los criterios de evaluación de respuesta en tumores sólidos (RECIST) o los criterios de la Organización Mundial de la Salud (OMS) durante o dentro de los 9 meses posteriores a la finalización de 1 tratamiento de terapia con citoquinas (interferón alfa, interleucina-2 o interferón alfa más interleucina-2; los pacientes que fueron tratados con interferón alfa solo deben haber recibido tratamiento durante al menos 28 días). En el Estudio 5 (NCT#00054886), el fallo de la terapia previa con citoquinas se definió como progresión de la enfermedad o toxicidad inaceptable relacionada con el tratamiento. El punto final para ambos estudios fue la ORR. La duración de la respuesta (DR) también se evaluó.
Se inscribieron ciento seis (106) pacientes en el Estudio 4 y 63 pacientes en el Estudio 5. Los pacientes recibieron 50 mg de malato de sunitinib en el Esquema 4/2. La terapia continuó hasta que los pacientes cumplieron los criterios de retiro o tuvieron enfermedad progresiva. La edad inicial, el sexo, la raza y los estados de rendimiento ECOG de los pacientes fueron comparables entre los Estudios 4 y 5. Aproximadamente del 86% al 94% de los pacientes en los 2 estudios eran blancos. Los hombres comprendían el 65% de la población agrupada. La mediana de edad fue de 57 años y osciló entre 24 y 87 años en los estudios. Todos los pacientes tenían un estado funcional ECOG <2 en la visita de selección.
La malignidad inicial y el historial de tratamiento previo de los pacientes fueron comparables entre los Estudios 4 y 5. En los 2 estudios, el 95% de la población agrupada de pacientes tenía al menos algún componente de histología de células claras. Todos los pacientes del Estudio 4 debían tener un componente histológico de células claras. La mayoría de los pacientes inscritos en los estudios (97% de la población agrupada) se habían sometido a una nefrectomía; se requirió una nefrectomía previa para los pacientes inscritos en el Estudio 4. Todos los pacientes habían recibido 1 régimen de citoquinas previo. La enfermedad metastásica presente en el momento de la entrada al estudio incluía metástasis pulmonares en el 81% de los pacientes. Las metástasis hepáticas fueron más comunes en el Estudio 4 (27% versus 16% en el Estudio 5) y las metástasis óseas fueron más comunes en el Estudio 5 (51% versus 25% en el Estudio 4); el 52% de los pacientes en la población agrupada tenían al menos 3 sitios metastásicos. Los pacientes con metástasis cerebrales conocidas o enfermedad leptomeníngea fueron excluidos de ambos estudios. Los datos de ORR y DR de los Estudios 4 y 5 se proporcionan en la Tabla 10. Hubo 36 PR en el Estudio 4 según lo evaluado por un laboratorio central de radiología para una ORR del 34% (IC 95%: 25%, 43.8%). Hubo 23 PR en el Estudio 5 según lo evaluado por los investigadores para una ORR del 36,5% (IC del 95%: 24,7%, 49,6%). La mayoría (>90%) de las respuestas objetivas de la enfermedad se observaron durante los primeros 4 ciclos; la última respuesta informada se observó en el Ciclo 10. Los datos de DR del Estudio 4 son prematuros, ya que solo 9 de 36 pacientes (25%) que respondieron al tratamiento habían experimentado progresión de la enfermedad o habían muerto en el momento del corte de datos.
Tabla 12. Resultados de eficacia de RCC refractario a citoquinas de los Estudios 4 y 5
| Parámetro de eficacia | Estudio 4 (N=106) |
Estudio 5 (N=63) |
| Tasa de respuesta objetiva [%, (IC 95%)] |
34a (25, 43.8) |
36.5b (24.7, 49.6) |
| Duración de la respuesta [mediana, semanas (IC 95%)] |
NR* (42*) |
54b (34.3, 70.1) |
*Los datos no son lo suficientemente maduros para determinar el límite superior de confianza.
Abreviaturas: IC=intervalo de confianza; N=número de pacientes; NR=no alcanzado; RCC=carcinoma de células renales.
a Evaluado por un laboratorio central de radiología ciego.b
Evaluado por investigadores.
Tratamiento adyuvante
En el entorno del tratamiento adyuvante, se investigó el malato de sunitinib en S-TRAC (NCT#00375674), un ensayo multicéntrico, internacional, aleatorizado, doble ciego, controlado con placebo en pacientes con alto riesgo de RCC recurrente después de una nefrectomía. Se requirió que los pacientes tuvieran histología de células claras y alto riesgo de recurrencia definido como tumores ≥T3 y/o N+. Seiscientos quince (615) pacientes fueron aleatorizados 1:1 para recibir 50 mg de malato de sunitinib una vez al día en el esquema 4/2 o placebo. Los pacientes fueron tratados durante 9 ciclos (aproximadamente 1 año), o hasta la recurrencia de la enfermedad, toxicidad inaceptable o retiro del consentimiento.
Los datos demográficos fueron generalmente comparables entre los brazos de malato de sunitinib y placebo con respecto a la edad (mediana de edad 58 años), el sexo (73% hombres) y la raza (84% blancos, 12% asiáticos y 4% otros). En la aleatorización, la mayoría de los pacientes tenían un estado funcional ECOG de 0 (74% malato de sunitinib y 72% placebo). El resto de los pacientes tenían un estado funcional ECOG de 1; 1 paciente con malato de sunitinib tenía un estado funcional de 2.
La principal medida de resultado de eficacia fue la supervivencia libre de enfermedad (SLE) en pacientes que recibieron malato de sunitinib versus placebo según la evaluación de una revisión central independiente cegada (RCIC). La supervivencia general fue un criterio de valoración adicional. Hubo una mejora estadísticamente significativa en la SLE en los pacientes que fueron tratados con malato de sunitinib en comparación con el placebo (Tabla 13 y Figura 3). Los análisis de subgrupos preespecificados se presentan en la Tabla 14. En el momento del análisis de SLE, los datos de supervivencia global no estaban maduros, con 141/615 (23%) muertes de pacientes.
Tabla 13. Resultados de supervivencia libre de enfermedad evaluados por RCIC en RCC adyuvante (población por intención de tratar) del estudio S-TRAC
| Malato de Sunitinib N = 309 |
Placebo N = 306 |
Valor pa | HRa (IC 95%) |
|
| SLE mediana [años (IC 95%)] | 6.8 (5.8, NR) | 5.6 (3.8, 6.6) | 0.03 | 0.76 (0.59, 0.98) |
| Eventos de SLE | 113 (36.6%) | 144 (47.1%) | ||
| Tasa de SLE a 5 años | 59.3% | 51.3% | ||
a El valor p se basa en la prueba de log-rank estratificada por el grupo pronóstico del Sistema Integrado de Estadificación de la Universidad de California en Los Ángeles (UISS); el HR se basa en un modelo de riesgos proporcionales de Cox estratificado por el grupo pronóstico UISS
Abreviaturas: RCIC=revisión central independiente cegada; IC=intervalo de confianza; SLE=supervivencia libre de enfermedad; HR=hazard ratio; N=número de pacientes; RCC=carcinoma de células renales.
Tabla 14. Supervivencia libre de enfermedad por características basales de la enfermedad
| Número de eventos / Total n/N |
SLE mediana [años (IC 95%)] |
HRa (IC 95%) | |||
| Malato de Sunitinib |
Placebo | Malato de Sunitinib |
Placebo | ||
| T3 Intermediob | 35/115 | 46/112 | NR (5.2, NR) |
6.4 (4.7, NR) |
0.82 (0.53, 1.28) |
| T3 Altoc | 63/165 | 79/166 | 6.8 (5, NR) |
5.3 (2.9, NR) |
0.77 (0.55, 1.07) |
| T4/Ganglios positivosd | 15/29 | 19/28 | 3.5 (1.2, NR) |
1.7 (0.4, 3) |
0.62 (0.31, 1.23) |
Abreviaturas: IC=intervalo de confianza; SLE=supervivencia libre de enfermedad; HR=hazard ratio; N=número de pacientes; n=número de eventos;
NR=no alcanzado
a HR basado en un modelo de riesgos proporcionales de Cox
b T3 Intermedio: T3, N0 o NX, M0, cualquier grado de Fuhrman, ECOG PS 0 O T3, N0 o NX, M0, grado 1 de Fuhrman, ECOG PS > 1
c T3 Alto: T3, N0 o NX, M0, grado de Fuhrman > 2, ECOG PS > 1
d T4/Ganglios positivos: T4, N0 o NX, M0, cualquier grado de Fuhrman, cualquier ECOG PS O cualquier T, N1-2, M0, cualquier grado de Fuhrman, cualquier ECOG PS
Figura 3. Curva de Kaplan-Meier de supervivencia libre de enfermedad evaluada por RCIC (población por intención de tratar)
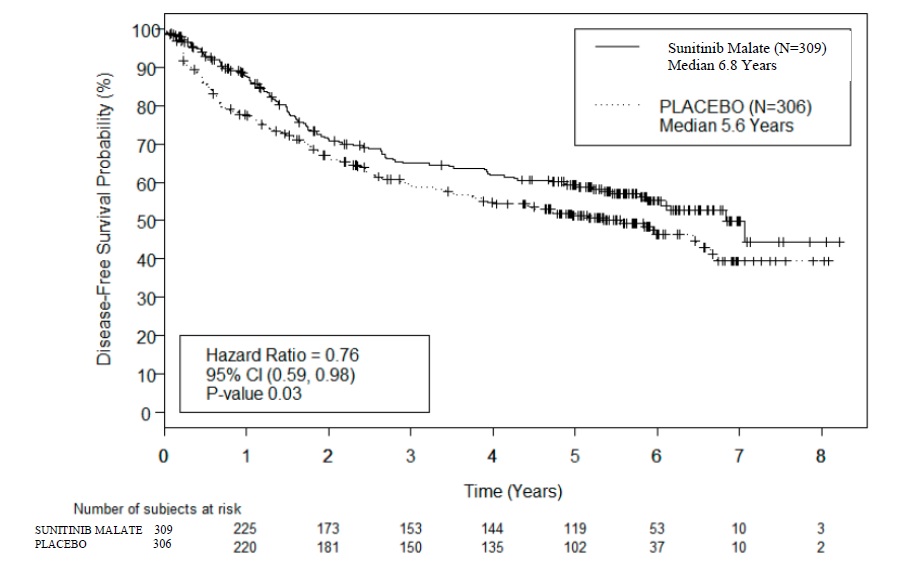
Abreviaturas: RCIC=revisión central independiente cegada; IC=intervalo de confianza; N=número de pacientes.
14.3 Tumores Neuroendocrinos Pancreáticos
El Estudio 6 (NCT#00428597) fue un estudio multicéntrico, internacional, aleatorizado, doble ciego, controlado con placebo de malato de sunitinib como agente único realizado en pacientes con pNET no resecable. Se requirió que los pacientes tuvieran una progresión de la enfermedad definida por RECIST documentada dentro de los 12 meses anteriores y fueron aleatorizados (1:1) para recibir 37,5 mg de malato de sunitinib (N=86) o placebo (N=85) una vez al día sin un período programado de descanso del tratamiento. El objetivo principal fue comparar la SLP en pacientes que recibieron malato de sunitinib versus pacientes que recibieron placebo. Otros criterios de valoración incluyeron SG, TRO y seguridad. Se permitió el uso de análogos de somatostatina en el estudio.
La demografía era comparable entre los grupos de malato de sunitinib y placebo. Además, el 49 % de los pacientes con malato de sunitinib tenían tumores no funcionantes en comparación con el 52 % de los pacientes con placebo, y el 92 % de los pacientes en ambos brazos tenían metástasis hepáticas. Un total del 66 % de los pacientes con malato de sunitinib recibieron terapia sistémica previa en comparación con el 72 % de los pacientes con placebo y el 35 % de los pacientes con malato de sunitinib habían recibido análogos de la somatostatina en comparación con el 38 % de los pacientes con placebo. Los pacientes fueron tratados hasta la progresión de la enfermedad o el retiro del estudio. Tras la progresión de la enfermedad o el cierre del estudio, se ofreció a los pacientes acceso a malato de sunitinib en un estudio de extensión separado.
Según la recomendación del Comité Independiente de Monitorización de Datos, el estudio se interrumpió prematuramente antes del análisis intermedio preestablecido. Esto puede haber llevado a una sobreestimación de la magnitud del efecto de PFS. Se observó una mejoría clínicamente significativa del malato de sunitinib sobre el placebo en la PFS tanto por el investigador como por la evaluación independiente. Se observó un hazard ratio favorable al malato de sunitinib en todos los subgrupos de características basales evaluadas. Los datos de OS no estaban maduros en el momento del análisis. Hubo 9 muertes en el brazo de malato de sunitinib y 21 muertes en el brazo de placebo. Se observó una diferencia estadísticamente significativa en la ORR a favor del malato de sunitinib sobre el placebo. Los resultados de eficacia se resumen en la Tabla 15 y la curva de Kaplan-Meier para PFS se encuentra en la Figura 4.
Tabla 15. Resultados de eficacia de pNET del Estudio 6
| Parámetro de eficacia | Malato de sunitinib (N=86) |
Placebo (N=85) |
Valor p | HR (IC del 95 %) |
| Supervivencia libre de progresión [mediana, meses (IC del 95 %)] |
10.2 (7.4, 16.9) |
5.4 (3.4, 6) |
0.000146a | 0.427(0.271, 0.673) |
| Tasa de respuesta objetiva [%, (IC del 95 %)] |
9.3 (3.2, 15.4) |
0 | 0.0066b | NA |
Abreviaturas: CI=intervalo de confianza; HR=hazard ratio; N=número de pacientes; NA=no aplica; pNET=tumores neuroendocrinos pancreáticos.
a Prueba de log-rank no estratificada de 2 caras.
b Prueba exacta de Fisher.
Figura 4. Curva de Kaplan-Meier de PFS en el Estudio 6 de pNET
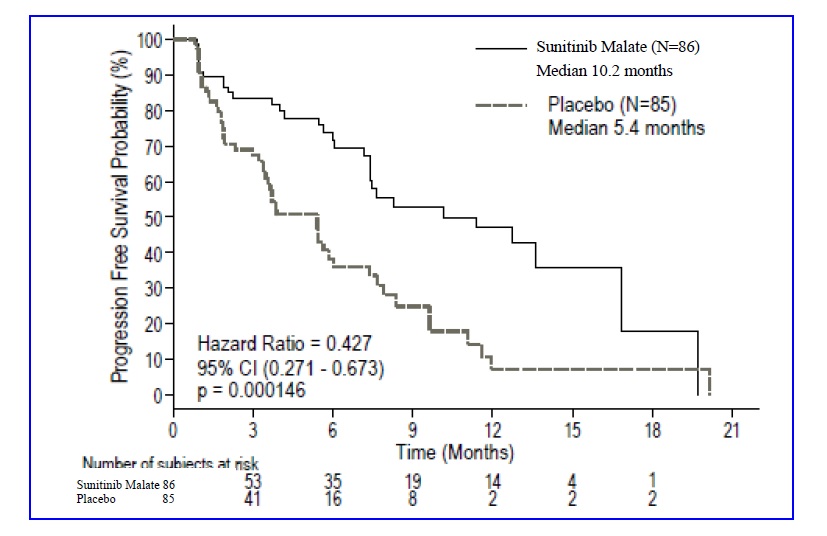
Abreviaturas: CI=intervalo de confianza; N=número de pacientes; PFS=supervivencia libre de progresión; pNET=tumores neuroendocrinos pancreáticos.
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANEJO
Las cápsulas de malato de sunitinib de 12.5 mg son gránulos de color amarillo a naranja, rellenos en cápsulas de gelatina dura con tapa de color gris cálido y cuerpo de color gris cálido, grabadas con ‘SC’ en la tapa y ‘12.5’ en el cuerpo en tinta blanca.
Frascos de 28 NDC 43598-045-63
Envases de blíster de dosis unitaria de 28 NDC 43598-045-28
Las cápsulas de malato de sunitinib de 25 mg son gránulos de color amarillo a naranja, rellenos en cápsulas de gelatina dura con tapa de color negro y cuerpo de color negro, grabadas con ‘SC’ en la tapa y ’25’ en el cuerpo en tinta blanca.
Frascos de 28 NDC 43598-046-63
Envases de blíster de dosis unitaria de 28 NDC 43598-046-28
Las cápsulas de malato de sunitinib de 37.5 mg son gránulos de color amarillo a naranja, rellenos en cápsulas de gelatina dura con tapa de color negro y cuerpo de color gris, grabadas con ‘SC’ en la tapa y ‘37.5’ en el cuerpo en tinta blanca.
Frascos de 28 NDC 43598-047-63
Envases de blíster de dosis unitaria de 28 NDC 43598-047-28
Las cápsulas de malato de sunitinib de 50 mg son gránulos de color amarillo a naranja, rellenos en cápsulas de gelatina dura con tapa de color gris y cuerpo de color gris, grabadas con ‘SC’ en la tapa y ’50’ en el cuerpo en tinta blanca.
Frascos de 28 NDC 43598-048-63
Envases de blíster de dosis unitaria de 28 NDC 43598-048-28
Almacenar a 20 °C a 25 °C (68 °F a 77 °F); se permiten excursiones a 15 °C a 30 °C (59 °F a 86 °F) [ver USP Temperatura Ambiente Controlada].
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
Aconseje al paciente que lea el etiquetado del paciente aprobado por la FDA (Guía de medicación).
Hepatotoxicidad
Informe a los pacientes sobre los signos y síntomas de hepatotoxicidad. Aconseje a los pacientes que se comuniquen con su proveedor de atención médica de inmediato si presentan signos o síntomas de hepatotoxicidad [ver Advertencias y precauciones (5.1)].
Eventos cardiovasculares
Aconseje a los pacientes que se comuniquen con su proveedor de atención médica si desarrollan síntomas de insuficiencia cardíaca [ver Advertencias y precauciones (5.2)].
Prolongación del intervalo QT y Torsade de Pointes
Informe a los pacientes sobre los signos y síntomas de la prolongación del intervalo QT. Aconseje a los pacientes que se comuniquen con su proveedor de atención médica de inmediato en caso de síncope, síntomas presincopales y palpitaciones cardíacas [ver Advertencias y precauciones (5.3)].
Hipertensión
Informe a los pacientes sobre los signos y síntomas de hipertensión. Aconseje a los pacientes que se sometan a un monitoreo rutinario de la presión arterial y que se comuniquen con su proveedor de atención médica si la presión arterial está elevada o si experimentan signos o síntomas de hipertensión [ver Advertencias y precauciones (5.4)].
Eventos hemorrágicos
Informe a los pacientes que malato de sunitinib puede causar sangrado severo. Aconseje a los pacientes que se comuniquen de inmediato con su proveedor de atención médica por sangrado o síntomas de sangrado [ver Advertencias y precauciones (5.5)].
Trastornos gastrointestinales
Informe a los pacientes que los trastornos gastrointestinales como diarrea, náuseas, vómitos y estreñimiento pueden desarrollarse durante el tratamiento con malato de sunitinib y que busquen atención médica inmediata si experimentan dolor abdominal persistente o severo porque se han informado casos de perforación y fístula gastrointestinal en pacientes que toman malato de sunitinib [ver Advertencias y precauciones (5.5), Reacciones adversas (6.1)].
Efectos dermatológicos y toxicidades
Informe a los pacientes que puede producirse despigmentación del cabello o la piel durante el tratamiento con malato de sunitinib debido al color del fármaco (amarillo). Otros posibles efectos dermatológicos pueden incluir sequedad, engrosamiento o agrietamiento de la piel, ampollas o erupción en las palmas de las manos y las plantas de los pies. Se han informado toxicidades dermatológicas graves, incluido el síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, eritema multiforme y fascitis necrotizante. Aconseje a los pacientes que informen inmediatamente a su proveedor de atención médica si se producen reacciones dermatológicas graves [ver Advertencias y precauciones (5.9), Reacciones adversas (6.1)].
Síndrome de leucoencefalopatía posterior reversible
Informe a los pacientes sobre los signos y síntomas del síndrome de leucoencefalopatía posterior reversible. Aconseje a los pacientes que se comuniquen con su proveedor de atención médica si desarrollan síntomas del síndrome de leucoencefalopatía posterior reversible [ver Advertencias y precauciones (5.10)].
Disfunción tiroidea
Informe a los pacientes que malato de sunitinib puede causar disfunción tiroidea. Aconseje al paciente que se comunique con su proveedor de atención médica si ocurren síntomas de función tiroidea anormal [ver Advertencias y precauciones (5.11)].
Hipoglucemia
Informe a los pacientes que malato de sunitinib puede causar hipoglucemia severa y puede ser más severa en pacientes con diabetes que toman medicamentos antidiabéticos. Informe a los pacientes sobre los signos, síntomas y riesgos asociados con la hipoglucemia. Aconseje a los pacientes que informen inmediatamente a su proveedor de atención médica si ocurren signos o síntomas graves de hipoglucemia [ver Advertencias y precauciones (5.12)].
Osteonecrosis de la mandíbula
Aconseje a los pacientes sobre las buenas prácticas de higiene oral y que informen a su proveedor de atención médica sobre cualquier procedimiento dental planificado. Aconseje a los pacientes que se comuniquen inmediatamente con su proveedor de atención médica para conocer los signos o síntomas asociados con la osteonecrosis de la mandíbula [ver Advertencias y precauciones (5.13)].
Deterioro de la cicatrización de heridas
Informe a los pacientes que malato de sunitinib deteriora la cicatrización de heridas. Aconseje a los pacientes que informen a su proveedor de atención médica sobre cualquier procedimiento quirúrgico planificado [ver Advertencias y precauciones (5.14)].
Medicamentos concomitantes
Aconseje a los pacientes que informen a sus proveedores de atención médica sobre todos los medicamentos concomitantes, incluidos los medicamentos de venta libre y los suplementos dietéticos [ver Interacciones farmacológicas (7)].
Toxicidad embriofetal
Informe a las mujeres embarazadas sobre el riesgo potencial para el feto. Aconseje a las mujeres en edad fértil que informen a su proveedor de atención médica sobre un embarazo conocido o sospechado [ver Advertencias y precauciones (5.15), Uso en poblaciones específicas (8.1)].
Aconseje a las mujeres en edad fértil que usen anticonceptivos eficaces durante el tratamiento y durante 4 semanas después de recibir la última dosis de malato de sunitinib [ver Uso en poblaciones específicas (8.3)].
Aconseje a los hombres con parejas femeninas en edad fértil que usen anticonceptivos eficaces durante el tratamiento y durante 7 semanas después de recibir la última dosis de malato de sunitinib [ver Uso en poblaciones específicas (8.3)].
Lactancia
Aconseje a las mujeres que no amamanten durante el tratamiento con cápsulas de malato de sunitinib y durante al menos 4 semanas después de la última dosis [ver Uso en poblaciones específicas (8.2)].
Infertilidad
Informe a los pacientes que malato de sunitinib puede afectar la fertilidad masculina y femenina [ver Uso en poblaciones específicas (8.3), Toxicología no clínica (13.1)].
Dosis olvidada
Aconseje a los pacientes que olviden una dosis de cápsulas de malato de sunitinib por menos de 12 horas que tomen la dosis olvidada de inmediato. Aconseje a los pacientes que olviden una dosis de cápsulas de malato de sunitinib por más de 12 horas que tomen la siguiente dosis programada a su hora habitual.
Rx Only
Distribuidor:
Dr. Reddy’s Laboratories Inc.,
Princeton, NJ 08540 USA
Hecho en India
Publicado: 03/2022
SECCIÓN DE GUÍA DE MEDICAMENTOS SPL
| GUÍA DE MEDICAMENTOS Cápsulas de malato de sunitinib (soo ni′ ti nib mal eyt) |
| ¿Cuál es la información más importante que debo saber sobre las cápsulas de malato de sunitinib? Las cápsulas de malato de sunitinib pueden causar efectos secundarios graves, que incluyen:
• Problemas hepáticos graves, que pueden causar la muerte. Informe a su proveedor de atención médica de inmediato si presenta cualquiera de los siguientes signos y síntomas de problemas hepáticos durante el tratamiento con cápsulas de malato de sunitinib: |
| ¿Qué es Cápsulas de Malato de Sunitinib? Las cápsulas de malato de sunitinib son un medicamento recetado que se usa para tratar: • un cáncer poco común del estómago, intestino o esófago llamado tumor del estroma gastrointestinal (GIST) y cuando: ∙ ha tomado el medicamento mesilato de imatinib y no detuvo el crecimiento del cáncer, o ∙ no puede tomar mesilato de imatinib. • cáncer de riñón avanzado (carcinoma de células renales avanzado o RCC). • adultos con cáncer de riñón que no se ha diseminado (localizado) y que tienen un alto riesgo de que el RCC vuelva a aparecer después de una cirugía de riñón. • un tipo de cáncer de páncreas llamado tumores neuroendocrinos pancreáticos (pNET), que ha progresado y no se puede tratar con cirugía. No se sabe si las cápsulas de malato de sunitinib son seguras y efectivas en niños. |
| Antes de tomar cápsulas de malato de sunitinib, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluyendo si: • tiene algún problema cardíaco • tiene presión arterial alta • tiene problemas de tiroides • tiene antecedentes de azúcar baja en la sangre o diabetes • tiene problemas de función renal (aparte del cáncer) • tiene problemas hepáticos • tiene cualquier problema de sangrado • planea someterse a una cirugía o se ha sometido a una cirugía recientemente. Debe dejar de tomar cápsulas de malato de sunitinib al menos 3 semanas antes de la cirugía planificada. Consulte “¿Cuáles son los posibles efectos secundarios de las cápsulas de malato de sunitinib?” • tiene convulsiones • tiene o ha tenido dolor en la boca, dientes o mandíbula, hinchazón o llagas dentro de la boca, entumecimiento o sensación de pesadez en la mandíbula, o aflojamiento de un diente • está embarazada o planea quedar embarazada. Las cápsulas de malato de sunitinib pueden dañar a su bebé por nacer. Mujeres que pueden quedar embarazadas: • Su proveedor de atención médica debe realizar una prueba de embarazo antes de que comience el tratamiento con cápsulas de malato de sunitinib. • Debe usar un método anticonceptivo eficaz durante el tratamiento y durante al menos 4 semanas después de su última dosis de cápsulas de malato de sunitinib. •Informe a su proveedor de atención médica de inmediato si queda embarazada o cree que está embarazada durante el tratamiento con cápsulas de malato de sunitinib. Los hombres con parejas femeninas que pueden quedar embarazadas deben usar un método anticonceptivo eficaz durante el tratamiento y durante 7 semanas después de su última dosis de cápsulas de malato de sunitinib. Las cápsulas de malato de sunitinib pueden causar problemas de fertilidad en hombres y mujeres. Informe a su proveedor de atención médica si esto es una preocupación para usted. • está amamantando o planea amamantar. No amamante durante el tratamiento con cápsulas de malato de sunitinib y durante al menos 4 semanas (1 mes) después de la última dosis. Informe a todos sus proveedores de atención médica y dentistas que está tomando cápsulas de malato de sunitinib. Deben hablar con el proveedor de atención médica que le recetó las cápsulas de malato de sunitinib antes de que se someta a cualquier cirugía o procedimiento médico o dental. |
| Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos a base de hierbas. El uso de cápsulas de malato de sunitinib con ciertos otros medicamentos puede causar efectos secundarios graves. Puede tener un mayor riesgo de problemas graves en los huesos de la mandíbula (osteonecrosis) si toma cápsulas de malato de sunitinib y un medicamento bisfosfonato. Especialmente informe a su proveedor de atención médica si está tomando o ha tomado un medicamento para la osteoporosis. Conozca los medicamentos que toma. Mantenga una lista de ellos para mostrarle a su proveedor de atención médica y farmacéutico cuando obtenga un medicamento nuevo. |
| ¿Cómo debo tomar las cápsulas de malato de sunitinib? ∙ Tome las cápsulas de malato de sunitinib exactamente como se lo indique su proveedor de atención médica. • Tome las cápsulas de malato de sunitinib 1 vez al día con o sin alimentos. Si toma cápsulas de malato de sunitinib para GIST o RCC, generalmente tomará su medicamento durante 4 semanas (28 días) y luego se detendrá durante 2 semanas (14 días). Este es 1 ciclo de tratamiento. Repetirá este ciclo durante el tiempo que su proveedor de atención médica le indique. • Si toma cápsulas de malato de sunitinib para pNET, tómelo 1 vez al día hasta que su proveedor de atención médica le indique que se detenga. • No beba jugo de toronja ni coma toronja durante su tratamiento con cápsulas de malato de sunitinib. Pueden hacer que tenga demasiadas cápsulas de malato de sunitinib en su cuerpo. • Su proveedor de atención médica puede hacer análisis de sangre antes de cada ciclo de tratamiento para verificar si tiene efectos secundarios. Si olvida una dosis de cápsulas de malato de sunitinib por menos de 12 horas, tome la dosis olvidada de inmediato. • Si olvida una dosis de cápsulas de malato de sunitinib por más de 12 horas, simplemente tome su próxima dosis a la hora habitual. No compense la dosis olvidada. Informe a su proveedor de atención médica sobre cualquier dosis olvidada. • Llame a su proveedor de atención médica de inmediato si toma demasiadas cápsulas de malato de sunitinib. |
| ¿Cuáles son los posibles efectos secundarios de las cápsulas de malato de sunitinib? Las cápsulas de malato de sunitinib pueden causar efectos secundarios graves, que incluyen: • Consulte “¿Cuál es la información más importante que debo saber sobre las cápsulas de malato de sunitinib?” •Problemas cardíacos. Los problemas cardíacos pueden incluir insuficiencia cardíaca, ataque al corazón y problemas del músculo cardíaco (miocardiopatía) que pueden causar la muerte. Informe a su proveedor de atención médica si se siente muy cansado, le falta el aire o tiene los pies y los tobillos hinchados. •Cambios anormales en el ritmo cardíaco. Los cambios en la actividad eléctrica de su corazón llamados prolongación del QT pueden causar latidos cardíacos irregulares que pueden poner en peligro la vida. Su proveedor de atención médica puede realizar electrocardiogramas y análisis de sangre (electrolitos) para detectar estos problemas durante su tratamiento con cápsulas de malato de sunitinib. Informe a su proveedor de atención médica de inmediato si se siente mareado, débil o tiene latidos cardíacos anormales durante su tratamiento con cápsulas de malato de sunitinib • se siente débil o mareado, o se desmaya ∙ siente que su corazón late de forma irregular o rápida ∙ mareos •Presión arterial alta. La presión arterial alta es común con las cápsulas de malato de sunitinib y, a veces, puede ser grave. Siga las instrucciones de su proveedor de atención médica sobre cómo controlar su presión arterial con regularidad. Llame a su atención médica proveedor de atención médica si su presión arterial es alta, o si tiene cualquiera de los siguientes signos o síntomas de presión arterial alta: •dolor de cabeza intenso |
| •Cambios anormales en el cerebro (síndrome de leucoencefalopatía posterior reversible [RPLS]). El RPLS puede causar una colección de síntomas que incluyen dolor de cabeza, confusión y pérdida de la visión. Algunas personas que han tomado cápsulas de malato de sunitinib han desarrollado RPLS que puede provocar la muerte. •Microangiopatía trombótica (MAT), incluida la púrpura trombocitopénica trombótica (PTT) y el síndrome urémico hemolítico (SUH). La MAT es una afección que involucra lesiones en los vasos sanguíneos más pequeños y coágulos de sangre que pueden ocurrir mientras se toman cápsulas de malato de sunitinib. La MAT se acompaña de una disminución de los glóbulos rojos y las células que participan en la coagulación. La MAT puede dañar los órganos de su cuerpo, como el cerebro y los riñones, y en ocasiones puede provocar la muerte. •Proteína en la orina. Algunas personas que han tomado cápsulas de malato de sunitinib han desarrollado proteína en la orina y, en algunos casos, problemas renales que pueden provocar la muerte. Su proveedor de atención médica lo controlará para detectar este problema. •Reacciones graves en la piel y la boca. El tratamiento con cápsulas de malato de sunitinib ha causado reacciones cutáneas graves que pueden provocar la muerte, que incluyen: erupción cutánea grave con ampollas o descamación de la piel. úlceras o llagas dolorosas en la piel, los labios o dentro de la boca. daño tisular (fascitis necrotizante). Si tiene signos o síntomas de reacciones cutáneas graves, deje de tomar cápsulas de malato de sunitinib y llame a su proveedor de atención médica u obtenga ayuda médica de inmediato. •Problemas de tiroides. Su proveedor de atención médica puede hacer pruebas para verificar la función de su tiroides durante el tratamiento con cápsulas de malato de sunitinib. Informe a su proveedor de atención médica si tiene alguno de los siguientes signos y síntomas durante su tratamiento con cápsulas de malato de sunitinib: o cansancio que empeora y no desaparece o frecuencia cardíaca rápida o aumento o pérdida de peso pérdida de apetito o sensación de depresión problemas con el calor o períodos menstruales irregulares o no sensación nerviosa o agitación, temblores períodos menstruales sudoración o dolor de cabeza náuseas o vómitos o pérdida de cabello diarrea •Bajo nivel de azúcar en la sangre (hipoglucemia). El bajo nivel de azúcar en la sangre puede ocurrir con las cápsulas de malato de sunitinib y puede hacer que pierda el conocimiento o que necesite ser hospitalizado. El bajo nivel de azúcar en la sangre con cápsulas de malato de sunitinib puede ser peor en personas que tienen diabetes y toman medicamentos antidiabéticos. Su proveedor de atención médica debe controlar sus niveles de azúcar en la sangre con regularidad durante el tratamiento con cápsulas de malato de sunitinib y es posible que deba ajustar la dosis de sus medicamentos antidiabéticos. Llame a su proveedor de atención médica de inmediato si tiene alguno de los siguientes signos o síntomas de bajo nivel de azúcar en la sangre durante su tratamiento con cápsulas de malato de sunitinib. •dolor de cabeza • irritabilidad •somnolencia •debilidad por hambre •latidos cardíacos rápidos mareos •sudoración confusión •sensación de nerviosismo •Problemas de los huesos de la mandíbula (osteonecrosis). Se han producido problemas graves en los huesos de la mandíbula en algunas personas que toman cápsulas de malato de sunitinib. Ciertos factores de riesgo, como tomar un medicamento con bifosfonatos o tener una enfermedad dental, pueden aumentar su riesgo de desarrollar osteonecrosis. Su proveedor de atención médica puede decirle que vea a su dentista antes de comenzar a tomar cápsulas de malato de sunitinib. Su proveedor de atención médica puede decirle que evite los procedimientos dentales, si es posible, durante su tratamiento con cápsulas de malato de sunitinib, especialmente si está recibiendo un medicamento con bifosfonatos en una vena (intravenoso). Informe a su proveedor de atención médica si planea realizarse algún procedimiento dental antes o durante el tratamiento con cápsulas de malato de sunitinib. Debe dejar de tomar cápsulas de malato de sunitinib al menos 3 semanas antes de los procedimientos dentales planificados. Su proveedor de atención médica debe decirle cuándo puede comenzar a tomar cápsulas de malato de sunitinib nuevamente después de los procedimientos dentales. •Problemas de cicatrización de heridas. Se han producido problemas de cicatrización de heridas en algunas personas que toman cápsulas de malato de sunitinib. Informe a su proveedor de atención médica si planea someterse a alguna cirugía antes o durante el tratamiento con cápsulas de malato de sunitinib. Debe dejar de tomar cápsulas de malato de sunitinib al menos 3 semanas antes de la cirugía planificada. Su proveedor de atención médica debe decirle cuándo puede comenzar a tomar cápsulas de malato de sunitinib nuevamente después de la cirugía. Su proveedor de atención médica puede suspender temporalmente, reducir su dosis o suspender permanentemente el tratamiento con malato de sunitinib, si desarrolla efectos secundarios graves. Los efectos secundarios comunes de las cápsulas de malato de sunitinib incluyen: cansancio o vómitos debilidad o dolor en el área del estómago (abdominal) diarrea o ampollas o erupción en las palmas de las dolor, hinchazón o llagas dentro de la manos y las plantas de los pies boca presión arterial alta náuseas o cambios en el sabor pérdida de apetito o recuentos bajos de plaquetas o indigestión El medicamento en las cápsulas de malato de sunitinib es amarillo y puede hacer que su piel se vea amarilla. Su piel y cabello pueden aclararse. Las cápsulas de malato de sunitinib también pueden causar otros problemas en la piel, que incluyen: sequedad, engrosamiento o agrietamiento de la piel. Estos no son todos los posibles efectos secundarios de las cápsulas de malato de sunitinib. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088. |
| ¿Cómo almaceno las cápsulas de malato de sunitinib? Almacene las cápsulas de malato de sunitinib a temperatura ambiente, entre 68°F y 77°F (20°C a 25°C). Mantenga las cápsulas de malato de sunitinib y todos los medicamentos fuera del alcance de los niños. |
| Información general sobre el uso seguro y eficaz de las cápsulas de malato de sunitinib. Los medicamentos a veces se recetan para fines distintos a los enumerados en una Guía de medicación. No use cápsulas de malato de sunitinib para una afección para la cual no fue recetado. No le dé cápsulas de malato de sunitinib a otras personas, incluso si tienen los mismos síntomas que usted tiene. Puede hacerles daño. Puede pedirle a su proveedor de atención médica o farmacéutico información sobre las cápsulas de malato de sunitinib que está escrita para heal
th profesionales. |
| ¿Cuáles son los ingredientes en las Cápsulas de Malato de Sunitinib? Ingrediente activo: malato de sunitinib Ingredientes inactivos: croscarmelosa sódica, estearato de magnesio, manitol y povidona (K-25). Cápsulas: Las cápsulas de 12.5 mg contienen gelatina, óxido de hierro negro, óxido de hierro rojo, óxido de hierro amarillo, lauril sulfato de sodio y dióxido de titanio. Las cápsulas de 25 mg, 37.5 mg y 50 mg contienen gelatina, óxido de hierro negro, lauril sulfato de sodio y dióxido de titanio. Tinta de impresión blanca: alcohol butílico, alcohol deshidratado, alcohol isopropílico, hidróxido de potasio, propilenglicol, goma laca, solución de amoniaco fuerte y dióxido de titanio. Distribuidor: Dr. Reddy’s Laboratories Inc., Para más información, contacte a Dr. Reddy’s Laboratories Inc., al 1-888-375-3784. Esta Guía de Medicación ha sido aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos Revisado: Marzo 2022 |
SECCIÓN DEL PANEL DE VISUALIZACIÓN PRINCIPAL DE LA ETIQUETA DEL PAQUETE

PANEL DE VISUALIZACIÓN PRINCIPAL

PANEL DE VISUALIZACIÓN PRINCIPAL

PANEL DE VISUALIZACIÓN PRINCIPAL


