Fabricante de medicamentos: Gilead Sciences, Inc. (Updated: 2024-12-26)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
SOVALDI® (sofosbuvir) comprimidos, para administración oral
SOVALDI® (sofosbuvir) gránulos orales
Aprobación inicial en EE. UU.: 2013
ADVERTENCIA: RIESGO DE REACTIVACIÓN DEL VIRUS DE LA HEPATITIS B EN PACIENTES COINFECCTADOS CON VHC Y VHB
Consulte la información completa de prescripción para ver la advertencia completa en recuadro.
Se ha notificado la reactivación del virus de la hepatitis B (VHB), en algunos casos con hepatitis fulminante, insuficiencia hepática y muerte. (5.1)
INDICACIONES Y USO
SOVALDI es un inhibidor de la polimerasa NS5B análogo de nucleósidos del virus de la hepatitis C (VHC) indicado para el tratamiento de:
- Pacientes adultos con infección crónica por VHC de genotipo 1, 2, 3 o 4 sin cirrosis o con cirrosis compensada como componente de un régimen de tratamiento antiviral combinado. (1)
- Pacientes pediátricos de 3 años de edad o mayores con infección crónica por VHC de genotipo 2 o 3 sin cirrosis o con cirrosis compensada en combinación con ribavirina. (1)
POSOLOGÍA Y ADMINISTRACIÓN
- Pruebas antes del inicio del tratamiento: Realice pruebas de infección por VHB en todos los pacientes midiendo el HBsAg y el anti-HBc. (2.1)
- Dosis recomendada en adultos: Un comprimido de 400 mg una vez al día, con o sin alimentos. (2.2)
- Dosis recomendada en pacientes pediátricos de 3 años de edad o mayores: La dosis recomendada de SOVALDI en pacientes pediátricos de 3 años de edad o mayores con VHC de genotipo 2 o 3 que utilizan comprimidos o gránulos orales de SOVALDI se basa en el peso. Consulte la Tabla 3 de la información completa de prescripción para obtener directrices específicas de dosificación basadas en el peso corporal. (2.3)
- Coinfección por VHC/VIH-1: Para pacientes adultos y pediátricos con coinfección por VHC/VIH-1, siga las recomendaciones de dosificación en las tablas siguientes, respectivamente. (2.2, 2.3)
- Régimen y duración del tratamiento recomendado para adultos: (2.2)
| Población de pacientes adultos | Régimen y duración | |
|---|---|---|
| Genotipo 1 o 4 | Tratamiento naive sin cirrosis o con cirrosis compensada (Child-Pugh A) |
SOVALDI + peginterferón alfa + ribavirina 12 semanas |
| Genotipo 2 | Tratamiento naive y con experiencia en tratamiento sin cirrosis o con cirrosis compensada (Child-Pugh A) |
SOVALDI + ribavirina 12 semanas |
| Genotipo 3 | Tratamiento naive y con experiencia en tratamiento sin cirrosis o con cirrosis compensada (Child-Pugh A) |
SOVALDI + ribavirina 24 semanas |
- SOVALDI en combinación con ribavirina durante 24 semanas puede considerarse para pacientes adultos con infección por genotipo 1 que no son candidatos a interferón. (2.2)
- Debe utilizarse en combinación con ribavirina para el tratamiento del VHC en pacientes adultos con carcinoma hepatocelular a la espera de un trasplante de hígado durante un máximo de 48 semanas o hasta el trasplante de hígado, lo que ocurra primero. (2.2)
- Régimen y duración del tratamiento recomendado para pacientes pediátricos de 3 años de edad o mayores: (2.3, 2.4)
| Población de pacientes pediátricos de 3 años de edad o mayores | Régimen y duración | |
|---|---|---|
| Genotipo 2 | Tratamiento naive y con experiencia en tratamiento sin cirrosis o con cirrosis compensada (Child-Pugh A) |
SOVALDI + ribavirina 12 semanas |
| Genotipo 3 | Tratamiento naive y con experiencia en tratamiento sin cirrosis o con cirrosis compensada (Child-Pugh A) |
SOVALDI + ribavirina 24 semanas |
FORMAS Y CONCENTRACIONES FARMACÉUTICAS
CONTRAINDICACIONES
- Cuando se usa en combinación con peginterferón alfa/ribavirina o ribavirina sola, todas las contraindicaciones para el peginterferón alfa y/o ribavirina también se aplican a la terapia combinada con SOVALDI. (4)
ADVERTENCIAS Y PRECAUCIONES
- Riesgo de reactivación del virus de la hepatitis B: Analice a todos los pacientes para detectar evidencia de infección por VHB actual o previa antes de iniciar el tratamiento contra la VHC. Monitoree a los pacientes coinfectados con VHC/VHB para detectar la reactivación del VHB y el brote de hepatitis durante el tratamiento contra la VHC y el seguimiento posterior al tratamiento. Inicie el manejo apropiado del paciente para la infección por VHB según lo indicado clínicamente. (5.1)
- Bradicardia con coadministración de amiodarona: Puede producirse bradicardia sintomática grave en pacientes que toman amiodarona con un régimen que contiene sofosbuvir, particularmente en pacientes que también reciben betabloqueantes, o aquellos con comorbilidades cardíacas subyacentes y/o enfermedad hepática avanzada. No se recomienda la coadministración de amiodarona con SOVALDI. En pacientes sin opciones de tratamiento alternativas viables, se recomienda la monitorización cardíaca. (5.2, 6.2, 7.1)
REACCIONES ADVERSAS
- Los eventos adversos más comunes (incidencia mayor o igual al 20%, todos los grados) observados con SOVALDI en combinación con ribavirina fueron fatiga y cefalea. Los eventos adversos más comunes observados con SOVALDI en combinación con peginterferón alfa y ribavirina fueron fatiga, cefalea, náuseas, insomnio y anemia. (6.1). El evento adverso más común observado con SOVALDI en combinación con solución oral de ribavirina en pacientes pediátricos fue la disminución del apetito. (6.1)
Para notificar REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Gilead Sciences, Inc. al 1-800-GILEAD-5 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES MEDICAMENTOSAS
- La coadministración de amiodarona con un régimen que contiene sofosbuvir puede provocar bradicardia sintomática grave. (5.2, 6.2, 7.1)
- Los medicamentos que son inductores de P-gp intestinales (p. ej., rifampicina, hierba de San Juan) pueden alterar las concentraciones de sofosbuvir. (5.3, 7, 12.3)
- Consulte la información completa de prescripción antes de usarla para posibles interacciones medicamentosas. (5.2, 5.3, 7, 12.3)
- La eliminación de la infección por VHC con antivirales de acción directa puede provocar cambios en la función hepática, lo que puede afectar el uso seguro y eficaz de los medicamentos concomitantes. Puede ser necesario un monitoreo frecuente de los parámetros de laboratorio relevantes (INR o glucosa en sangre) y ajustes de dosis de ciertos medicamentos concomitantes. (7.1)
USO EN POBLACIONES ESPECÍFICAS
Véase la sección 17 para obtener INFORMACIÓN PARA EL PACIENTE y el etiquetado del paciente aprobado por la FDA.
Revisado: 12/2024
Tabla de contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
ADVERTENCIA: RIESGO DE REACTIVACIÓN DEL VIRUS DE LA HEPATITIS B EN PACIENTES COINFECCTADOS CON VHC Y VHB
1 INDICACIONES Y USO
2 POSOLOGÍA Y ADMINISTRACIÓN
2.1 Pruebas previas al inicio del tratamiento
2.2 Posología recomendada en adultos
2.3 Posología recomendada en pacientes pediátricos de 3 años de edad o mayores con VHC genotipo 2 o 3
2.4 Preparación y administración de gránulos orales
2.5 Modificación de la posología
2.6 Interrupción de la administración
2.7 Insuficiencia renal grave y enfermedad renal terminal
3 FORMAS Y CONCENTRACIONES FARMACÉUTICAS
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Riesgo de reactivación del virus de la hepatitis B en pacientes coinfectados con VHC y VHB
5.2 Bradicardia sintomática grave cuando se administra conjuntamente con amiodarona
5.3 Riesgo de reducción del efecto terapéutico debido al uso con inductores de P-gp
5.4 Riesgos asociados con el tratamiento combinado
6 REACCIONES ADVERSAS
6.1 Experiencia en ensayos clínicos
6.2 Experiencia postcomercialización
7 INTERACCIONES FARMACOLÓGICAS
7.1 Interacciones farmacológicas potencialmente significativas
7.2 Fármacos sin interacciones clínicamente significativas con SOVALDI
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.3 Mujeres y hombres en edad fértil
8.4 Uso pediátrico
8.5 Uso geriátrico
8.6 Insuficiencia renal
8.7 Insuficiencia hepática
8.8 Pacientes con carcinoma hepatocelular en espera de trasplante de hígado
8.9 Pacientes post-trasplante de hígado
8.10 Pacientes con infección por VHC genotipo 5 o 6
10 SOBREDOSIFICACIÓN
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
12.2 Farmacodinamia
12.3 Farmacocinética
12.4 Microbiología
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Descripción de los ensayos clínicos
14.2 Ensayos clínicos en sujetos con VHC genotipo 1 o 4
14.3 Ensayos clínicos en sujetos con VHC genotipo 2 o 3
14.4 Ensayos clínicos en sujetos adultos coinfectados con VHC y VIH-1 ─ Photon-1 (Estudio 0123)
14.5 Ensayo clínico en pediatría (Estudio 1112)
16 PRESENTACIÓN/CONSERVACIÓN Y MANIPULACIÓN
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no figuran en la lista.
ADVERTENCIA EN EL RECUADRO
ADVERTENCIA: RIESGO DE REACTIVACIÓN DEL VIRUS DE LA HEPATITIS B EN PACIENTES COINFECTADOS CON VHC Y VHB
Analice a todos los pacientes para detectar evidencia de infección actual o previa por el virus de la hepatitis B (VHB) antes de iniciar el tratamiento con SOVALDI. Se ha notificado la reactivación del VHB en pacientes coinfectados con VHC/VHB que estaban recibiendo o habían completado el tratamiento con antivirales de acción directa contra el VHC y no estaban recibiendo terapia antiviral contra el VHB. Algunos casos han provocado hepatitis fulminante, insuficiencia hepática y muerte. Controle a los pacientes coinfectados con VHC/VHB para detectar brotes de hepatitis o reactivación del VHB durante el tratamiento contra el VHC y el seguimiento posterior al tratamiento. Inicie el manejo adecuado del paciente para la infección por VHB según esté clínicamente indicado [véase Advertencias y precauciones (5.1)].
1 INDICACIONES Y USO
Pacientes adultos:
SOVALDI está indicado para el tratamiento de pacientes adultos con infección crónica por el virus de la hepatitis C (VHC) como componente de un régimen de tratamiento antiviral combinado [véase Posología y administración (2.2), y Estudios clínicos (14)]:
- infección por genotipo 1 o 4 sin cirrosis o con cirrosis compensada para su uso en combinación con interferón pegilado y ribavirina
- infección por genotipo 2 o 3 sin cirrosis o con cirrosis compensada para su uso en combinación con ribavirina.
Pacientes pediátricos:
SOVALDI está indicado para el tratamiento de la infección por VHC crónica de genotipo 2 o 3 en pacientes pediátricos de 3 años de edad o mayores sin cirrosis o con cirrosis compensada para su uso en combinación con ribavirina [véase Posología y administración (2.3) y Estudios clínicos (14.5)].
2 DOSIS Y ADMINISTRACIÓN
2.1 Pruebas previas al inicio del tratamiento
Analice a todos los pacientes para detectar evidencia de infección por VHB actual o previa mediante la medición del antígeno de superficie de la hepatitis B (HBsAg) y del anticuerpo contra el core de la hepatitis B (anti-HBc) antes de iniciar el tratamiento con HCV con SOVALDI [véase Advertencias y precauciones (5.1)].
2.2 Dosis recomendada en adultos
La dosis recomendada de SOVALDI es un comprimido de 400 mg, administrado por vía oral, una vez al día con o sin alimentos [véase Farmacología clínica (12.3)].
Administre SOVALDI en combinación con ribavirina o en combinación con interferón pegilado y ribavirina para el tratamiento del VHC. El régimen de tratamiento recomendado y la duración para la terapia combinada con SOVALDI se proporcionan en la Tabla 1.
Para pacientes con coinfección por VHC/VIH-1, siga las recomendaciones de dosificación de la Tabla 1. Consulte Interacciones medicamentosas (7) para obtener recomendaciones de dosificación para los medicamentos antivirales concomitantes contra el VIH-1.
| Población de pacientes | Régimen de tratamiento y duración | |
|---|---|---|
|
||
| Genotipo 1 o 4 | Sin tratamiento previo sin cirrosis o con cirrosis compensada (Child-Pugh A) | SOVALDI + interferón alfa pegilado* + ribavirina† 12 semanas |
| Genotipo 2 | Sin tratamiento previo y con experiencia en el tratamiento‡ sin cirrosis o con cirrosis compensada (Child-Pugh A) |
SOVALDI + ribavirina† 12 semanas |
| Genotipo 3 | Sin tratamiento previo y con experiencia en el tratamiento‡ sin cirrosis o con cirrosis compensada (Child-Pugh A) |
SOVALDI + ribavirina† 24 semanas |
Pacientes con VHC de genotipo 1 que no reúnen los requisitos para recibir un régimen basado en interferón
SOVALDI en combinación con ribavirina durante 24 semanas puede considerarse una opción terapéutica para pacientes con infección de genotipo 1 que no reúnen los requisitos para recibir un régimen basado en interferón [véase Estudios clínicos (14.4)]. La decisión del tratamiento debe guiarse por una evaluación de los posibles beneficios y riesgos para cada paciente.
Pacientes con carcinoma hepatocelular a la espera de un trasplante de hígado
Administrar SOVALDI en combinación con ribavirina durante un máximo de 48 semanas o hasta el momento del trasplante de hígado, lo que ocurra primero, para prevenir la reinfección por VHC postrasplante [véase Uso en poblaciones específicas (8.8)].
2.3 Dosis recomendada en pacientes pediátricos de 3 años de edad o mayores con VHC de genotipo 2 o 3
El régimen de tratamiento, la duración y la dosis recomendada para la terapia combinada con SOVALDI se proporcionan en la Tabla 2 y la Tabla 3. La Tabla 4 proporciona la dosis de ribavirina basada en el peso cuando se usa en combinación con SOVALDI para pacientes pediátricos. Para pacientes con coinfección por VHC/VIH-1, siga las recomendaciones de dosificación en la Tabla 3 y la Tabla 4. Consulte Interacciones medicamentosas (7) para obtener recomendaciones de dosificación para medicamentos antivirales concomitantes contra el VIH-1. En pacientes pediátricos con carcinoma hepatocelular a la espera de un trasplante de hígado, administre SOVALDI en combinación con ribavirina durante un máximo de 48 semanas o hasta el momento del trasplante de hígado, lo que ocurra primero, para prevenir la reinfección por VHC postrasplante [véase Uso en poblaciones específicas (8.8)].
| Población de pacientes | Régimen de tratamiento y duración | |
|---|---|---|
| Genotipo 2 | Sin tratamiento previo y con experiencia en el tratamiento* sin cirrosis o con cirrosis compensada (Child-Pugh A) |
SOVALDI + ribavirina† 12 semanas |
| Genotipo 3 | Sin tratamiento previo y con experiencia en el tratamiento* sin cirrosis o con cirrosis compensada (Child-Pugh A) |
SOVALDI + ribavirina† 24 semanas |
La dosis recomendada de SOVALDI en pacientes pediátricos de 3 años o mayores con VHC de genotipo 2 o 3 que utilizan comprimidos de SOVALDI o gránulos orales (con o sin alimentos) se basa en el peso (Tabla 3) y debe tomarse por vía oral una vez al día en combinación con ribavirina [véase Dosificación y administración (2.4), Uso en poblaciones específicas (8.4), Farmacología clínica (12.3), y Estudios clínicos (14.5)]. Los gránulos de SOVALDI pueden ser tomados por pacientes pediátricos que no pueden tragar la formulación en comprimidos [véase Dosificación y administración (2.4)].
| Peso corporal (kg) | Dosificación de comprimidos o gránulos orales de SOVALDI | Dosis diaria de SOVALDI |
|---|---|---|
| al menos 35 | un comprimido de 400 mg una vez al día o dos comprimidos de 200 mg una vez al día o dos sobres de 200 mg de gránulos una vez al día |
400 mg por día |
| 17 a menos de 35 | un comprimido de 200 mg una vez al día o un sobre de 200 mg de gránulos una vez al día |
200 mg por día |
| menos de 17 | un sobre de 150 mg de gránulos una vez al día | 150 mg por día |
| Peso corporal (kg) | Dosis diaria oral de ribavirina* |
|---|---|
|
|
| menos de 47 | 15 mg por kg por día (dosis dividida AM y PM) |
| 47–49 | 600 mg por día (1 × 200 mg AM, 2 × 200 mg PM) |
| 50–65 | 800 mg por día (2 × 200 mg AM, 2 × 200 mg PM) |
| 66–80 | 1000 mg por día (2 × 200 mg AM, 3 × 200 mg PM) |
| más de 80 | 1200 mg por día (3 × 200 mg AM, 3 × 200 mg PM) |
2.4 Preparación y administración de gránulos orales
Consulte las instrucciones completas de uso de los gránulos orales de SOVALDI para obtener información detallada sobre la preparación y administración de los gránulos de SOVALDI.
No mastique los gránulos de SOVALDI. Si se administran gránulos de SOVALDI con alimentos, espolvoree los gránulos sobre una o más cucharadas de alimentos blandos no ácidos a temperatura ambiente o inferior. Ejemplos de alimentos no ácidos incluyen pudín, jarabe de chocolate, puré de papas y helado. Tome los gránulos de SOVALDI dentro de los 30 minutos posteriores a mezclarlos suavemente con los alimentos y trague todo el contenido sin masticar para evitar un sabor amargo residual.
2.5 Modificación de la dosis
No se recomienda la reducción de la dosis de SOVALDI.
Si un paciente presenta una reacción adversa grave que podría estar relacionada con peginterferón alfa y/o ribavirina, la dosis de peginterferón alfa y/o ribavirina debe reducirse o suspenderse, según corresponda, hasta que la reacción adversa disminuya o desaparezca. Consulte la información de prescripción de peginterferón alfa y ribavirina para obtener información adicional sobre cómo reducir y/o suspender la dosis de peginterferón alfa y/o ribavirina.
2.6 Suspensión de la dosificación
Si se suspenden permanentemente los demás agentes utilizados en combinación con SOVALDI, también debe suspenderse SOVALDI.
2.7 Insuficiencia renal grave y enfermedad renal en etapa terminal
No se puede dar ninguna recomendación de dosificación para pacientes con insuficiencia renal grave (tasa de filtración glomerular estimada [eGFR] inferior a 30 mL/min/1,73 m2) o con enfermedad renal en etapa terminal (ERET) debido a exposiciones más altas (hasta 20 veces) del metabolito predominante de sofosbuvir [véase Uso en poblaciones específicas (8.6) y Farmacología clínica (12.3)].
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
SOVALDI está disponible en comprimidos o gránulos para administración oral. Cada forma farmacéutica está disponible en dos concentraciones.
- Comprimidos de 400 mg: 400 mg de sofosbuvir: comprimido recubierto con película, de color amarillo, con forma de cápsula, con “GSI” grabado en una cara y “7977” en la otra.
- Comprimidos de 200 mg: 200 mg de sofosbuvir: comprimido recubierto con película, de color amarillo, con forma ovalada, con “GSI” grabado en una cara y “200” en la otra.
- Gránulos de 200 mg: 200 mg de sofosbuvir: gránulos de color blanco a blanquecino en sobres unidosis.
- Gránulos de 150 mg: 150 mg de sofosbuvir: gránulos de color blanco a blanquecino en sobres unidosis.
4 CONTRAINDICACIONES
Cuando SOVALDI se usa en combinación con ribavirina o peginterferón alfa/ribavirina, las contraindicaciones aplicables a esos agentes son aplicables a las terapias de combinación. Consulte la información de prescripción de peginterferón alfa y ribavirina para obtener una lista de sus contraindicaciones.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Riesgo de reactivación del virus de la hepatitis B en pacientes coinfectados con VHC y VHB
Se ha notificado reactivación del virus de la hepatitis B (VHB) en pacientes coinfectados con VHC/VHB que estaban recibiendo o habían completado el tratamiento con antivirales de acción directa contra el VHC y que no estaban recibiendo terapia antiviral contra el VHB. Algunos casos han provocado hepatitis fulminante, insuficiencia hepática y muerte. Se han notificado casos en pacientes con HBsAg positivo y también en pacientes con evidencia serológica de infección por VHB resuelta (es decir, HBsAg negativo y anti-HBc positivo). También se ha notificado reactivación del VHB en pacientes que reciben ciertos agentes inmunosupresores o quimioterapéuticos; el riesgo de reactivación del VHB asociado con el tratamiento con antivirales de acción directa contra el VHC puede aumentar en estos pacientes.
La reactivación del VHB se caracteriza por un aumento brusco de la replicación del VHB que se manifiesta como un rápido aumento del nivel de ADN del VHB en suero. En pacientes con infección por VHB resuelta, puede producirse la reaparición del HBsAg. La reactivación de la replicación del VHB puede ir acompañada de hepatitis, es decir, aumentos de los niveles de aminotransferasas y, en casos graves, aumentos de los niveles de bilirrubina, insuficiencia hepática y muerte.
Analice a todos los pacientes para detectar evidencia de infección por VHB actual o previa mediante la medición de HBsAg y anti-HBc antes de iniciar el tratamiento con VHC con SOVALDI. En pacientes con evidencia serológica de infección por VHB, controle los signos clínicos y de laboratorio de brote de hepatitis o reactivación del VHB durante el tratamiento con VHC con SOVALDI y durante el seguimiento posterior al tratamiento. Inicie el manejo adecuado del paciente para la infección por VHB según lo indicado clínicamente.
5.2 Bradicardia sintomática grave cuando se administra conjuntamente con amiodarona
Se han notificado casos postcomercialización de bradicardia sintomática y casos que requieren intervención con marcapasos cuando se administra amiodarona conjuntamente con un régimen que contiene sofosbuvir. Se notificó un paro cardíaco fatal en un paciente que tomaba amiodarona al que se le administró conjuntamente un régimen que contenía sofosbuvir (HARVONI [ledipasvir/sofosbuvir]). La bradicardia generalmente se ha producido en cuestión de horas o días, pero se han observado casos hasta 2 semanas después de iniciar el tratamiento con VHC. Los pacientes que también toman betabloqueantes, o aquellos con comorbilidades cardíacas subyacentes y/o enfermedad hepática avanzada pueden tener un mayor riesgo de bradicardia sintomática con la administración conjunta de amiodarona. La bradicardia generalmente se resolvió después de la interrupción del tratamiento con VHC. Se desconoce el mecanismo de este efecto.
No se recomienda la administración conjunta de amiodarona con SOVALDI. Para los pacientes que toman amiodarona y no tienen otras opciones de tratamiento alternativas viables y que recibirán SOVALDI de forma conjunta:
- Informe a los pacientes sobre el riesgo de bradicardia sintomática grave
- Se recomienda la monitorización cardíaca en un entorno hospitalario durante las primeras 48 horas de administración conjunta, después de lo cual se debe realizar una monitorización ambulatoria o automonitorización de la frecuencia cardíaca diariamente durante al menos las dos primeras semanas de tratamiento.
Los pacientes que están tomando SOVALDI y necesitan comenzar la terapia con amiodarona debido a que no existen otras opciones de tratamiento alternativas viables deben someterse a una monitorización cardíaca similar a la descrita anteriormente.
Debido a la larga semivida de la amiodarona, los pacientes que interrumpen la amiodarona justo antes de comenzar con SOVALDI también deben someterse a una monitorización cardíaca similar a la descrita anteriormente.
Los pacientes que presenten signos o síntomas de bradicardia deben buscar atención médica inmediatamente. Los síntomas pueden incluir desmayo o casi desmayo, mareos o aturdimiento, malestar, debilidad, cansancio excesivo, dificultad para respirar, dolores en el pecho, confusión o problemas de memoria [ver Reacciones adversas (6.2), Interacciones medicamentosas (7.1)].
5.3 Riesgo de reducción del efecto terapéutico debido al uso con inductores de P-gp
Los fármacos que son inductores de P-gp en el intestino (por ejemplo, rifampicina, hierba de San Juan) pueden disminuir significativamente las concentraciones plasmáticas de sofosbuvir y pueden provocar una reducción del efecto terapéutico de SOVALDI. No se recomienda el uso de rifampicina y hierba de San Juan con SOVALDI [ver Interacciones medicamentosas (7.1)].
5.4 Riesgos asociados con el tratamiento combinado
Debido a que SOVALDI se usa en combinación con otros fármacos antivirales para el tratamiento de la infección por VHC, consulte la información de prescripción de estos fármacos utilizados en combinación con SOVALDI. Las advertencias y precauciones relacionadas con estos fármacos también se aplican a su uso en el tratamiento combinado con SOVALDI.
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas graves se describen a continuación y en otras partes del etiquetado:
- Bradicardia sintomática grave cuando se administra concomitantemente con amiodarona [ver Advertencias y precauciones (5.2)].
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica.
Cuando SOVALDI se administra con ribavirina o peginterferón alfa/ribavirina, consulte la información de prescripción respectiva para obtener una descripción de las reacciones adversas asociadas con su uso.
Reacciones adversas en sujetos adultos
La evaluación de seguridad de SOVALDI se basó en datos combinados de ensayos clínicos de Fase 3 (tanto controlados como no controlados), que incluyen:
- 650 sujetos que recibieron terapia combinada con SOVALDI + ribavirina (RBV) durante 12 semanas,
- 98 sujetos que recibieron terapia combinada con SOVALDI + ribavirina durante 16 semanas,
- 250 sujetos que recibieron terapia combinada con SOVALDI + ribavirina durante 24 semanas,
- 327 sujetos que recibieron terapia combinada con SOVALDI + peginterferón (Peg-IFN) alfa + ribavirina durante 12 semanas,
- 243 sujetos que recibieron peginterferón alfa + ribavirina durante 24 semanas, y
- 71 sujetos que recibieron placebo (PBO) durante 12 semanas [ver Estudios clínicos (14)].
La proporción de sujetos que interrumpieron permanentemente el tratamiento debido a eventos adversos fue del 4% para los sujetos que recibieron placebo, del 1% para los sujetos que recibieron SOVALDI + ribavirina durante 12 semanas, menos del 1% para los sujetos que recibieron SOVALDI + ribavirina durante 24 semanas, del 11% para los sujetos que recibieron peginterferón alfa + ribavirina durante 24 semanas y del 2% para los sujetos que recibieron SOVALDI + peginterferón alfa + ribavirina durante 12 semanas.
Los eventos adversos observados en al menos el 15% de los sujetos en los ensayos clínicos de Fase 3 descritos anteriormente se proporcionan en la Tabla 5. Se muestra una tabulación lado a lado para simplificar la presentación; no se debe realizar una comparación directa entre los ensayos debido a los diferentes diseños de los ensayos.
Los eventos adversos más comunes (al menos el 20%) para la terapia combinada con SOVALDI + ribavirina fueron fatiga y dolor de cabeza. Los eventos adversos más comunes (al menos el 20%) para la terapia combinada con SOVALDI + peginterferón alfa + ribavirina fueron fatiga, dolor de cabeza, náuseas, insomnio y anemia.
| Regímenes sin interferón | Regímenes con interferón | ||||||
|---|---|---|---|---|---|---|---|
| PBO 12 semanas |
SOVALDI + RBV* 12 semanas |
SOVALDI + RBV* 24 semanas |
Peg-IFN alfa + RBV† 24 semanas |
SOVALDI + Peg-IFN alfa + RBV* 12 semanas |
|||
| N=71 | N=650 | N=250 | N=243 | N=327 | |||
| Fatiga | 24% | 38% | 30% | 55% | 59% | ||
| Dolor de cabeza | 20% | 24% | 30% | 44% | 36% | ||
| Náuseas | 18% | 22% | 13% | 29% | 34% | ||
| Insomnio | 4% | 15% | 16% | 29% | 25% | ||
| Prurito | 8% | 11% | 27% | 17% | 17% | ||
| Anemia | 0% | 10% | 6% | 12% | 21% | ||
| Astenia | 3% | 6% | 21% | 3% | 5% | ||
| Rash | 8% | 8% | 9% | 18% | 18% |
| Disminución del apetito | 10% | 6% | 6% | 18% | 18% |
| Escalofríos | 1% | 2% | 2% | 18% | 17% |
| Síntomas gripales | 3% | 3% | 6% | 18% | 16% |
| Pirexia | 0% | 4% | 4% | 14% | 18% |
| Diarrea | 6% | 9% | 12% | 17% | 12% |
| Neutropenia | 0% | <1% | <1% | 12% | 17% |
| Mialgia | 0% | 6% | 9% | 16% | 14% |
| Irritabilidad | 1% | 10% | 10% | 16% | 13% |
Con la excepción de la anemia y la neutropenia, la mayoría de los eventos presentados en la Tabla 5 ocurrieron con una gravedad de grado 1 en los regímenes que contenían SOVALDI.
Reacciones adversas menos frecuentes notificadas en ensayos clínicos (menos del 1%): Las siguientes reacciones adversas ocurrieron en menos del 1% de los sujetos que recibieron SOVALDI en un régimen de combinación en cualquier ensayo. Estos eventos se han incluido debido a su gravedad o a la evaluación de la posible relación causal.
Efectos hematológicos: pancitopenia (particularmente en sujetos que recibieron interferón pegilado concomitante).
Trastornos psiquiátricos: depresión grave (particularmente en sujetos con antecedentes preexistentes de enfermedad psiquiátrica), incluida la ideación suicida y el suicidio.
Anormalidades de laboratorio:
Los cambios en los parámetros hematológicos seleccionados se describen en la Tabla 6. Se muestra una tabulación lado a lado para simplificar la presentación; no se debe realizar una comparación directa entre los ensayos debido a los diferentes diseños de los ensayos.
| Parámetros hematológicos | Regímenes sin interferón | Regímenes con interferón | |||
|---|---|---|---|---|---|
| PBO 12 semanas |
SOVALDI + RBV* 12 semanas |
SOVALDI + RBV* 24 semanas |
Peg-IFN + RBV† 24 semanas |
SOVALDI + Peg-IFN + RBV* 12 semanas |
|
| N=71 | N=647 | N=250 | N=242 | N=327 | |
| Hemoglobina (g/dL) | |||||
| <10 | 0 | 8% | 6% | 14% | 23% |
| <8.5 | 0 | 1% | <1% | 2% | 2% |
| Neutrófilos (×109/L) | |||||
| ≥0.5 – <0.75 | 1% | <1% | 0 | 12% | 15% |
| <0.5 | 0 | <1% | 0 | 2% | 5% |
| Plaquetas (×109/L) | |||||
| ≥25 – <50 | 3% | <1% | 1% | 7% | <1% |
| <25 | 0 | 0 | 0 | 0 | 0 |
Elevaciones de Bilirrubina
No se observó elevación de bilirrubina total de más de 2,5 × LSN en ninguno de los sujetos del grupo de 12 semanas de SOVALDI + peginterferón alfa + ribavirina y en el 1 %, 3 % y 3 % de los sujetos de los grupos de 24 semanas de peginterferón alfa + ribavirina, 12 semanas de SOVALDI + ribavirina y 24 semanas de SOVALDI + ribavirina, respectivamente. Los niveles de bilirrubina alcanzaron su punto máximo durante las primeras 1 o 2 semanas de tratamiento y posteriormente disminuyeron y volvieron a los niveles basales en la semana 4 posterior al tratamiento. Estas elevaciones de bilirrubina no se asociaron con elevaciones de transaminasas.
Elevaciones de Creatina Kinasa
La creatina kinasa se evaluó en los ensayos FISSION y NEUTRINO. Se observó una elevación aislada y asintomática de creatina kinasa superior o igual a 10 × LSN en menos del 1 %, 1 % y 2 % de los sujetos de los grupos de 24 semanas de peginterferón alfa + ribavirina, 12 semanas de SOVALDI + peginterferón alfa + ribavirina y 12 semanas de SOVALDI + ribavirina, respectivamente.
Elevaciones de Lipasa
Se observó una elevación aislada y asintomática de lipasa superior a 3 × LSN en menos del 1 %, 2 %, 2 % y 2 % de los sujetos de los grupos de 12 semanas de SOVALDI + peginterferón alfa + ribavirina, 12 semanas de SOVALDI + ribavirina, 24 semanas de SOVALDI + ribavirina y 24 semanas de peginterferón alfa + ribavirina, respectivamente.
Pacientes con coinfección por VHC/VIH-1
Se evaluó el uso de SOVALDI en combinación con ribavirina en 223 sujetos coinfectados por VHC/VIH-1 [véase Estudios clínicos (14.4)]. El perfil de seguridad en los sujetos coinfectados por VHC/VIH-1 fue similar al observado en los sujetos monoinfectados por VHC. Se observó bilirrubina total elevada (grado 3 o 4) en 30/32 (94 %) de los sujetos que recibieron atazanavir como parte del régimen antirretroviral. Ninguno de los sujetos presentó aumentos concomitantes de transaminasas. Entre los sujetos que no tomaban atazanavir, se observó bilirrubina total elevada de grado 3 o 4 en 2 (1,5 %) sujetos, similar a la tasa observada con los sujetos monoinfectados por VHC que recibieron SOVALDI + ribavirina en los ensayos de fase 3.
Reacciones adversas en sujetos pediátricos de 3 años de edad o más
La evaluación de seguridad de SOVALDI en sujetos pediátricos de 3 años de edad o más se basa en datos de 106 sujetos que fueron tratados con SOVALDI más ribavirina durante 12 semanas (sujetos de genotipo 2) o 24 semanas (sujetos de genotipo 3) en un ensayo clínico de fase 2, abierto. Las reacciones adversas observadas fueron consistentes con las observadas en los estudios clínicos de SOVALDI más ribavirina en adultos. Entre los sujetos pediátricos de 3 años a < 12 años de edad que tomaron SOVALDI en combinación con solución oral de ribavirina, se observó disminución del apetito en el 13 % (7/54) de los sujetos [véase Estudios clínicos 14.5)].
En un estudio de seguimiento de 5 años, 88 de los 106 sujetos del ensayo clínico abierto de fase 2 (Estudio 1112) fueron seguidos durante una duración mediana (Q1, Q3) de 239 (179, 244) semanas. No se observaron efectos notables en el crecimiento, evaluados mediante cambios desde el inicio hasta el final del estudio, para la altura, el peso, los percentiles de IMC y las puntuaciones Z para ningún grupo de edad. No se observaron efectos notables en el desarrollo de las características sexuales secundarias de los sujetos, evaluados mediante cambios desde el inicio hasta el final del estudio en las etapas puberales de Tanner [véase Uso en poblaciones específicas (8.4)].
6.2 Experiencia postcomercialización
Las siguientes reacciones adversas se han identificado durante el uso posterior a la aprobación de SOVALDI. Debido a que las reacciones posteriores a la comercialización se notifican voluntariamente a partir de una población de tamaño incierto, no siempre es posible estimar de forma fiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos cardíacos
Se ha notificado bradicardia sintomática grave en pacientes que toman amiodarona y que inician el tratamiento con un régimen que contiene sofosbuvir [véase Advertencias y precauciones (5.2), Interacciones medicamentosas (7.1)].
7 INTERACCIONES MEDICAMENTOSAS
7.1 Interacciones Medicamentosas Potencialmente Significativas
Sofosbuvir es un sustrato del transportador de fármacos P-gp y de la proteína de resistencia al cáncer de mama (BCRP), mientras que el metabolito circulante predominante GS-331007 no lo es. Los fármacos que son inductores de P-gp en el intestino (p. ej., rifampicina o hierba de San Juan) pueden disminuir la concentración plasmática de sofosbuvir, lo que lleva a una reducción del efecto terapéutico de SOVALDI, y por lo tanto, no se recomienda el uso concomitante con SOVALDI [ver Advertencias y precauciones (5.3)].
La eliminación de la infección por VHC con antivirales de acción directa puede provocar cambios en la función hepática, lo que puede afectar el uso seguro y eficaz de los medicamentos concomitantes. Por ejemplo, se ha notificado un control alterado de la glucosa en sangre que provoca hipoglucemia sintomática grave en pacientes diabéticos en notificaciones de casos posteriores a la comercialización y en estudios epidemiológicos publicados. El manejo de la hipoglucemia en estos casos requirió la interrupción o la modificación de la dosis de los medicamentos concomitantes utilizados para el tratamiento de la diabetes.
Se recomienda la monitorización frecuente de los parámetros de laboratorio relevantes (p. ej., índice internacional normalizado [INR] en pacientes que toman warfarina, niveles de glucosa en sangre en pacientes diabéticos) o las concentraciones de medicamentos concomitantes, como los sustratos del citocromo P450 con un índice terapéutico estrecho (p. ej., ciertos inmunosupresores) para garantizar un uso seguro y eficaz. Pueden ser necesarios ajustes de la dosis de los medicamentos concomitantes.
La información sobre las posibles interacciones medicamentosas con SOVALDI se resume en la Tabla 7. La tabla no es exhaustiva [ver Advertencias y precauciones (5.2, 5.3) y Farmacología clínica (12.3)].
| Clase de fármaco concomitante: Nombre del fármaco | Efecto sobre la concentración† | Comentario clínico |
|---|---|---|
| Antiarrítmicos: amiodarona |
Efecto sobre las concentraciones de amiodarona y sofosbuvir desconocido | La administración conjunta de amiodarona con un régimen que contiene sofosbuvir puede provocar bradicardia sintomática grave. Se desconoce el mecanismo de este efecto. No se recomienda la administración conjunta de amiodarona con SOVALDI; si se requiere la administración conjunta, se recomienda la monitorización cardíaca [ver Advertencias y precauciones (5.2), Reacciones adversas (6.2)]. |
| Anticonvulsivos: Carbamazepina fenitoína fenobarbital oxcarbazepina |
↓ sofosbuvir ↓ GS-331007 |
Se espera que la administración conjunta de SOVALDI con carbamazepina, fenitoína, fenobarbital u oxcarbazepina disminuya la concentración de sofosbuvir, lo que lleva a una reducción del efecto terapéutico de SOVALDI. No se recomienda la administración conjunta. |
| Antimicebacterianos: Rifabutina rifampicina rifapentina |
↓ sofosbuvir ↓ GS-331007 |
Se espera que la administración conjunta de SOVALDI con rifabutina o rifapentina disminuya la concentración de sofosbuvir, lo que lleva a una reducción del efecto terapéutico de SOVALDI. No se recomienda la administración conjunta. No se recomienda la administración conjunta de SOVALDI con rifampicina, un inductor intestinal de P-gp [ver Advertencias y precauciones (5.3)]. |
| Suplementos herbales: Hierba de San Juan (Hypericum perforatum) |
↓ sofosbuvir ↓ GS-331007 |
No se recomienda la administración conjunta de SOVALDI con hierba de San Juan, un inductor intestinal de P-gp [ver Advertencias y precauciones (5.3)]. |
| Inhibidores de la proteasa del VIH: tipranavir/ritonavir |
↓ sofosbuvir ↓ GS-331007 |
Se espera que la administración conjunta de SOVALDI con tipranavir/ritonavir disminuya la concentración de sofosbuvir, lo que lleva a una reducción del efecto terapéutico de SOVALDI. No se recomienda la administración conjunta. |
7.2 Fármacos sin interacciones clínicamente significativas con SOVALDI
Según los estudios de interacción medicamentosa realizados con SOVALDI, no se han observado ni se esperan interacciones medicamentosas clínicamente significativas cuando SOVALDI se combina con los siguientes fármacos [ver Farmacología clínica (12.3)]: ciclosporina, darunavir/ritonavir, efavirenz, emtricitabina, metadona, anticonceptivos orales, raltegravir, rilpivirina, tacrolimus o tenofovir disoproxilo fumarato.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de riesgo
Si SOVALDI se administra con ribavirina o peginterferón alfa y ribavirina, el régimen de combinación está contraindicado en mujeres embarazadas y en hombres cuyas parejas femeninas estén embarazadas. Consulte la información de prescripción de ribavirina y/o peginterferón alfa para obtener más información sobre los riesgos asociados con el uso de ribavirina y peginterferón alfa durante el embarazo.
No hay datos humanos adecuados disponibles para establecer si SOVALDI representa o no un riesgo para los resultados del embarazo. En estudios de reproducción en animales, no se observó evidencia de resultados de desarrollo adversos con sofosbuvir a exposiciones mayores que las de los humanos a la dosis humana recomendada (DHR) [ver Datos]. Durante la organogénesis en ratas y conejos, las exposiciones sistémicas (AUC) al metabolito circulante predominante de sofosbuvir (GS-331007) fueron ≥5 (ratas) y 12 (conejos) veces la exposición en humanos a la DHR. En el estudio de desarrollo pre/posnatal en ratas, la exposición sistémica materna (AUC) a GS-331007 fue ≥6 veces la exposición en humanos a la DHR.
Se desconoce el riesgo de fondo de defectos congénitos importantes y aborto espontáneo para la población indicada. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2–4 % y del 15–20 %, respectivamente.
Datos
Datos en animales
Sofosbuvir se administró por vía oral a ratas embarazadas (hasta 500 mg/kg/día) y conejas (hasta 300 mg/kg/día) en los días de gestación 6 a 18 y 6 a 19, respectivamente, y también a ratas (dosis orales de hasta 500 mg/kg/día) en el día de gestación 6 hasta el día 20 de lactancia/posparto. No se observaron efectos significativos en el desarrollo embriofetal (ratas y conejos) o pre/posnatal (ratas) en las dosis más altas probadas. Las exposiciones sistémicas (AUC) al metabolito circulante predominante de sofosbuvir (GS-331007) fueron ≥5 (ratas) y 12 (conejos) veces la exposición en humanos a la DHR, con exposiciones que aumentaron durante la gestación de aproximadamente 5 a 10 (ratas) y 12 a 28 (conejos) veces la exposición en humanos a la DHR.
8.2 Lactancia
Resumen de riesgo
No se sabe si sofosbuvir o sus metabolitos están presentes en la leche materna, afectan la producción de leche materna o tienen efectos en el lactante. El metabolito circulante predominante de sofosbuvir (GS-331007) fue el componente principal observado en la leche de ratas lactantes, sin afectar a las crías lactantes [ver Datos].
Se deben considerar los beneficios para el desarrollo y la salud de la lactancia materna junto con la necesidad clínica de la madre de SOVALDI y cualquier efecto adverso potencial en el niño amamantado por SOVALDI o por la enfermedad materna subyacente.
Si SOVALDI se administra con ribavirina, la información para la madre lactante sobre ribavirina también se aplica a este régimen de combinación. Consulte la información de prescripción de ribavirina para obtener más información sobre su uso durante la lactancia.
Datos
Datos en animales
No se observaron efectos de sofosbuvir en el crecimiento y el desarrollo postnatal en las crías lactantes a la dosis más alta probada en ratas. La exposición sistémica materna (AUC) al metabolito circulante predominante de sofosbuvir (GS-331007) fue aproximadamente 12 veces la exposición en humanos a la DHR, con una exposición de aproximadamente el 2 % de la exposición materna observada en las crías lactantes en el día 10 de lactancia. En un estudio de lactancia, los metabolitos de sofosbuvir (principalmente GS-331007) se excretaron en la leche de ratas lactantes después de la administración de una dosis oral única de sofosbuvir (20 mg/kg) en el día 2 de lactancia, con concentraciones en la leche de aproximadamente el 10 % de las concentraciones plasmáticas maternas observadas 1 hora después de la dosis.
8.3 Mujeres y hombres en edad fértil
Si SOVALDI se administra con ribavirina o peginterferón y ribavirina, la información sobre ribavirina y peginterferón con respecto a las pruebas de embarazo, la anticoncepción y la infertilidad también se aplica a estos regímenes de combinación. Consulte la información de prescripción de ribavirina y/o peginterferón para obtener información adicional.
8.4 Uso pediátrico
Se ha establecido la seguridad, la farmacocinética y la eficacia de SOVALDI en pacientes pediátricos de 3 años de edad o más con infección de genotipo 2 y 3. SOVALDI se evaluó en un ensayo clínico abierto (Estudio 1112), que incluyó 106 sujetos (31 genotipo 2; 75 genotipo 3) de 3 años de edad o más. La seguridad, la farmacocinética y la eficacia fueron comparables a las observadas en adultos [ver Dosis y administración (2.3), Reacciones adversas (6.1), Farmacología clínica (12.3), y Estudios clínicos (14.5)].
La seguridad y la eficacia de SOVALDI en pacientes pediátricos de 3 años de edad o más con cirrosis compensada se apoya en exposiciones comparables de sofosbuvir y GS-331007 entre: 1) adultos y pacientes pediátricos sin cirrosis y 2) adultos sin cirrosis y adultos con cirrosis compensada. Por lo tanto, se esperaría una eficacia similar para los pacientes pediátricos con cirrosis compensada que para los adultos con cirrosis compensada.
No se ha establecido la seguridad y la eficacia de SOVALDI en pacientes pediátricos menores de 3 años de edad con VHC genotipo 2 o 3. No se ha establecido la seguridad y la eficacia de SOVALDI en pacientes pediátricos con VHC genotipo 1 o 4.
En un estudio de seguimiento de 5 años, se evaluaron los efectos a largo plazo de SOVALDI en el crecimiento pediátrico en 88 sujetos pediátricos de 3 años de edad o más tratados con SOVALDI en el Estudio 1112. No se observaron efectos notables en el crecimiento desde el inicio hasta el final del estudio [ver Reacciones adversas (6.1)]. Todos los sujetos que habían logrado SVR12 mantuvieron la SVR hasta el final del estudio.
8.5 Uso en geriatría
SOVALDI se administró a 90 sujetos de 65 años o más. Las tasas de respuesta observadas para los sujetos mayores de 65 años fueron similares a las de los sujetos más jóvenes en todos los grupos de tratamiento. No se requiere ajuste de la dosis de SOVALDI en pacientes geriátricos [ver Farmacología clínica (12.3)].
8.6 Insuficiencia renal
No se requiere ajuste de la dosis de SOVALDI para pacientes con insuficiencia renal leve o moderada. No se ha establecido la seguridad y eficacia de SOVALDI en pacientes con insuficiencia renal grave (eGFR inferior a 30 mL/min/1.73m2) o enfermedad renal terminal (ERT) que requieren hemodiálisis. No se puede dar ninguna recomendación de dosificación para pacientes con insuficiencia renal grave o ERT [ver Posología y administración (2.7) y Farmacología clínica (12.3)]. Consulte también la información de prescripción de ribavirina y peginterferón alfa para pacientes con CrCl inferior a 50 mL/min.
8.7 Insuficiencia hepática
No se requiere ajuste de la dosis de SOVALDI para pacientes con insuficiencia hepática leve, moderada o grave (Child-Pugh Clase A, B o C) [ver Farmacología clínica (12.3)]. No se ha establecido la seguridad y eficacia de SOVALDI en pacientes con cirrosis descompensada. Consulte la información de prescripción de peginterferón alfa para contraindicaciones en la descompensación hepática.
8.8 Pacientes con carcinoma hepatocelular a la espera de trasplante de hígado
SOVALDI se estudió en sujetos adultos infectados por VHC con carcinoma hepatocelular antes de someterse a un trasplante de hígado en un ensayo clínico abierto que evaluaba la seguridad y eficacia de SOVALDI y ribavirina administrados antes del trasplante para prevenir la reinfección por VHC después del trasplante. El criterio principal de valoración del ensayo fue la respuesta virológica postrasplante (pTVR), definida como ARN del VHC inferior al límite inferior de cuantificación (LLOQ) a las 12 semanas postrasplante. Los sujetos infectados por VHC, independientemente del genotipo, con carcinoma hepatocelular (CHC) que cumplían los criterios MILÁN (definidos como la presencia de un tumor de 5 cm o menos de diámetro en pacientes con carcinomas hepatocelulares únicos y no más de tres nódulos tumorales, cada uno de 3 cm o menos de diámetro en pacientes con tumores múltiples y sin manifestaciones extrahepáticas del cáncer o evidencia de invasión vascular del tumor) recibieron 400 mg de SOVALDI y ribavirina de 1000 a 1200 mg diarios según el peso durante 24-48 semanas o hasta el momento del trasplante de hígado, lo que ocurriera primero. Se realizó un análisis provisional en 61 sujetos que recibieron SOVALDI y ribavirina; 45 sujetos tenían el genotipo 1 del VHC; 44 sujetos tenían una puntuación CPT basal inferior a 7 y todos los sujetos tenían una puntuación MELD basal no ajustada de hasta 14. De estos 61 sujetos, 41 se sometieron a un trasplante de hígado después de hasta 48 semanas de tratamiento con SOVALDI y ribavirina; 37 tenían ARN del VHC inferior a LLOQ en el momento del trasplante. De los 37 sujetos, la tasa de respuesta virológica postrasplante (pTVR) es del 64% (23/36) en los 36 sujetos evaluables que han alcanzado el punto temporal de las 12 semanas postrasplante. El perfil de seguridad de SOVALDI y ribavirina en sujetos infectados por VHC antes del trasplante de hígado fue comparable al observado en los sujetos tratados con SOVALDI y ribavirina en los ensayos clínicos de fase 3.
8.9 Pacientes postrasplante de hígado
No se ha establecido la seguridad y eficacia de SOVALDI en pacientes postrasplante de hígado.
8.10 Pacientes con infección por VHC de genotipo 5 o 6
Los datos disponibles sobre sujetos con infección por VHC de genotipo 5 o 6 son insuficientes para las recomendaciones de dosificación.
10 SOBREDOSIS
La dosis más alta documentada de sofosbuvir fue una dosis única de 1200 mg de sofosbuvir (tres veces la dosis recomendada) administrada a 59 sujetos sanos. En ese ensayo, no se observaron efectos adversos a este nivel de dosis, y los eventos adversos fueron similares en frecuencia y gravedad a los informados en los grupos de tratamiento con placebo y sofosbuvir 400 mg. Se desconocen los efectos de dosis más altas.
No hay antídoto específico disponible para la sobredosis con SOVALDI. Si se produce una sobredosis, el paciente debe ser monitorizado para detectar evidencia de toxicidad. El tratamiento de la sobredosis con SOVALDI consiste en medidas generales de apoyo, incluyendo la monitorización de los signos vitales, así como la observación del estado clínico del paciente. Una sesión de hemodiálisis de 4 horas eliminó el 18% de la dosis administrada.
11 DESCRIPCIÓN
SOVALDI (sofosbuvir) es un inhibidor análogo nucleósido de la polimerasa NS5B del VHC.
El nombre IUPAC para sofosbuvir es (S)-isopropil 2-((S)-(((2R,3R,4R,5R)-5-(2,4-dioxo-3,4-dihidropirimidin-1(2H)-il)-4-fluoro-3-hidroxi-4-metiltetrahidrofurano-2-il)metoxi)-(fenoxi)fosforilamino)propanoato. Tiene una fórmula molecular de C22H29FN3O9P y un peso molecular de 529,45. Tiene la siguiente fórmula estructural:

Sofosbuvir es un sólido cristalino blanco a blanquecino con una solubilidad de ≥ 2 mg/mL en el rango de pH de 2–7,7 a 37 °C y es ligeramente soluble en agua.
Los comprimidos de SOVALDI, 200 mg o 400 mg, son para administración oral. Cada comprimido contiene 200 mg o 400 mg de sofosbuvir. Los comprimidos incluyen los siguientes excipientes inactivos: dióxido de silicio coloidal, croscarmelosa sódica, estearato de magnesio, manitol y celulosa microcristalina. Los comprimidos están recubiertos con un material de recubrimiento que contiene los siguientes excipientes inactivos: polietilenglicol, alcohol polivinílico, talco, dióxido de titanio y óxido de hierro amarillo.
Los pellets de SOVALDI, 150 mg o 200 mg, son para administración oral, suministrados como pellets blancos a blanquecinos en sobres unidosis. Cada sobre unidosis contiene 150 mg o 200 mg de sofosbuvir. Los pellets incluyen los siguientes excipientes inactivos: copolímero de metacrilato de amino, dióxido de silicio coloidal, croscarmelosa sódica, hidroxipropilcelulosa, hipromelosa, lactosa monohidrato, celulosa microcristalina, polietilenglicol, dióxido de silicio, laurilsulfato de sodio, fumarato de sodio estearilo, ácido esteárico y talco.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Sofosbuvir es un agente antiviral de acción directa contra el virus de la hepatitis C [véase Microbiología (12.4)].
12.2 Farmacodinamia
Electrofisiología cardíaca
El efecto de sofosbuvir 400 y 1200 mg (tres veces la dosis recomendada) sobre el intervalo QTc se evaluó en un ensayo cruzado de QT completo aleatorizado, de dosis única, controlado con placebo y activo (moxifloxacino 400 mg) de cuatro períodos en 59 sujetos sanos. A una dosis tres veces superior a la dosis máxima recomendada, SOVALDI no prolonga el QTc en ninguna medida clínicamente relevante.
12.3 Farmacocinética
Absorción
Las propiedades farmacocinéticas de sofosbuvir y el metabolito circulante predominante GS-331007 se han evaluado en sujetos adultos sanos y en sujetos con hepatitis C crónica. Tras la administración oral de SOVALDI, sofosbuvir se absorbió con una concentración plasmática máxima observada a aproximadamente 0,5–2 horas después de la dosis, independientemente del nivel de dosis. La concentración plasmática máxima de GS-331007 se observó entre 2 y 4 horas después de la dosis. Según el análisis farmacocinético poblacional en sujetos con infección por VHC de genotipo 1 a 6 a los que se administró ribavirina (con o sin interferón pegilado), la media geométrica del AUC0–24 en estado estacionario fue de 969 ng∙hr/mL para sofosbuvir (N=838) y de 6790 ng∙hr/mL para GS-331007 (N=1695). En relación con los sujetos sanos a los que se administró sofosbuvir solo (N=272), el AUC0–24 de sofosbuvir fue un 60% mayor; y el AUC0–24 de GS-331007 fue un 39% menor, respectivamente, en sujetos infectados por VHC. Los AUC de sofosbuvir y GS-331007 son casi proporcionales a la dosis en el rango de dosis de 200 mg a 1200 mg.
Efecto de los alimentos
En relación con las condiciones de ayuno, la administración de una dosis única de SOVALDI con una comida estándar rica en grasas no afectó sustancialmente la Cmax o el AUC0–inf de sofosbuvir. La exposición a GS-331007 no se alteró en presencia de una comida rica en grasas. Por lo tanto, SOVALDI se puede administrar independientemente de las comidas.
Distribución
Sofosbuvir se une aproximadamente en un 61–65% a las proteínas plasmáticas humanas y la unión es independiente de la concentración del fármaco en el rango de 1 microgramo/mL a 20 microgramo/mL. La unión a proteínas de GS-331007 fue mínima en plasma humano. Después de una dosis única de 400 mg de [14C]-sofosbuvir en sujetos sanos, la relación sangre/plasma de la radiactividad de 14C fue de aproximadamente 0,7.
Metabolismo
Sofosbuvir se metaboliza extensamente en el hígado para formar el análogo de nucleósido trifosfato farmacológicamente activo GS-461203. La vía de activación metabólica implica la hidrólisis secuencial del grupo éster carboxilo catalizada por la catepsina A humana (CatA) o la carboxilesterasa 1 (CES1) y la escisión del fosforamidato por la proteína de unión a nucleótidos de tríada de histidina 1 (HINT1), seguida de la fosforilación por la vía de biosíntesis de nucleótidos de pirimidina. La desfosforilación da lugar a la formación del metabolito nucleósido GS-331007 que no puede ser re fosforilado eficientemente y carece de actividad anti-VHC in vitro.
Después de una dosis oral única de 400 mg de [14C]-sofosbuvir, sofosbuvir y GS-331007 representaron aproximadamente el 4% y más del 90% de la exposición sistémica del material relacionado con el fármaco (suma del AUC ajustado al peso molecular de sofosbuvir y sus metabolitos), respectivamente.
Eliminación
Tras una dosis oral única de 400 mg de [14C]-sofosbuvir, la recuperación total media de la dosis fue superior al 92%, que consistió en aproximadamente el 80%, el 14% y el 2,5% recuperados en orina, heces y aire espirado, respectivamente. La mayor parte de la dosis de sofosbuvir recuperada en orina fue GS-331007 (78%), mientras que el 3,5% se recuperó como sofosbuvir. Estos datos indican que el aclaramiento renal es la principal vía de eliminación de GS-331007. Las semividas terminales medianas de sofosbuvir y GS-331007 fueron de 0,4 y 27 horas, respectivamente.
Poblaciones específicas
Raza
El análisis farmacocinético poblacional en sujetos infectados por VHC indicó que la raza no tuvo ningún efecto clínicamente relevante en la exposición a sofosbuvir y GS-331007.
Género
No se han observado diferencias farmacocinéticas clínicamente relevantes entre hombres y mujeres para sofosbuvir y GS-331007.
Pacientes pediátricos
La farmacocinética de sofosbuvir y GS-331007 se determinó en sujetos pediátricos infectados por VHC de genotipo 2 o 3 de 3 años de edad o más que recibieron una dosis diaria de SOVALDI como se describe en la Tabla 8. Las exposiciones en sujetos pediátricos fueron similares a las observadas en adultos.
| Grupo de peso | Dosis | Parámetro PK | Media geométrica (%CV) | |
|---|---|---|---|---|
| Sofosbuvir | GS-331007 | |||
| ≥35 kg† | 400 mg | AUCtau (ng∙hr/mL) | 1060 (50.6) | 7570 (32.8) |
| Cmax (ng/mL) | 472 (53.0) | 572 (40.7) | ||
| 17 a <35 kg‡ | 200 mg | AUCtau (ng∙hr/mL) | 891 (36.1) | 10400 (31.6) |
| Cmax (ng/mL) | 438 (26.4) | 866 (27.1) | ||
| <17 kg§ | 150 mg | AUCtau (ng∙hr/mL) | 851 (41.7) | 9060 (37.6) |
| Cmax (ng/mL) | 418 (26.8) | 767 (28.3) | ||
No se ha establecido la farmacocinética de sofosbuvir y GS-331007 en pacientes pediátricos menores de 3 años de edad [ver Uso en poblaciones específicas (8.4) y Estudios clínicos (14.5)].
Pacientes geriátricos
El análisis farmacocinético poblacional en pacientes infectados por VHC mostró que dentro del rango de edad (19 a 75 años) analizado, la edad no tuvo un efecto clínicamente relevante en la exposición a sofosbuvir y GS-331007 [ver Uso en poblaciones específicas (8.5)].
Pacientes con insuficiencia renal
La farmacocinética de sofosbuvir se estudió en sujetos negativos para VHC con insuficiencia renal leve (eGFR entre 50 y menos de 80 mL/min/1.73m2), moderada (eGFR entre 30 y menos de 50 mL/min/1.73m2), grave (eGFR menor de 30 mL/min/1.73m2) y sujetos con enfermedad renal en etapa terminal (ERET) que requieren hemodiálisis después de una dosis única de 400 mg de sofosbuvir. En relación con los sujetos con función renal normal (eGFR mayor de 80 mL/min/1.73m2), el AUC0–inf de sofosbuvir fue 61%, 107% y 171% mayor en insuficiencia renal leve, moderada y grave, mientras que el AUC0–inf de GS-331007 fue 55%, 88% y 451% mayor, respectivamente. En sujetos con ERET, en relación con los sujetos con función renal normal, el AUC0–inf de sofosbuvir y GS-331007 fue 28% y 1280% mayor cuando sofosbuvir se administró 1 hora antes de la hemodiálisis en comparación con 60% y 2070% mayor cuando sofosbuvir se administró 1 hora después de la hemodiálisis, respectivamente. Una sesión de hemodiálisis de 4 horas eliminó aproximadamente el 18% de la dosis administrada. No se requiere ajuste de dosis para pacientes con insuficiencia renal leve o moderada. No se ha establecido la seguridad y eficacia de SOVALDI en pacientes con insuficiencia renal grave o ERET. No se puede dar ninguna recomendación de dosificación para pacientes con insuficiencia renal grave o ERET [ver Dosificación y administración (2.6) y Uso en poblaciones específicas (8.6)].
Pacientes con insuficiencia hepática
La farmacocinética de sofosbuvir se estudió después de la administración de 400 mg de sofosbuvir durante 7 días en sujetos infectados por VHC con insuficiencia hepática moderada y grave (Child-Pugh clase B y C). En relación con los sujetos con función hepática normal, el AUC0–24 de sofosbuvir fue 126% y 143% mayor en insuficiencia hepática moderada y grave, mientras que el AUC0–24 de GS-331007 fue 18% y 9% mayor, respectivamente. El análisis farmacocinético poblacional en sujetos infectados por VHC indicó que la cirrosis no tuvo un efecto clínicamente relevante en la exposición a sofosbuvir y GS-331007. No se recomienda ningún ajuste de dosis de SOVALDI para pacientes con insuficiencia hepática leve, moderada o grave [ver Uso en poblaciones específicas (8.7)].
Evaluación de interacciones medicamentosas
Sofosbuvir es un sustrato del transportador de fármacos P-gp y de la proteína de resistencia al cáncer de mama (BCRP), mientras que GS-331007 no lo es. Los fármacos que son inductores de P-gp en el intestino (p. ej., rifampicina o hierba de San Juan) pueden disminuir la concentración plasmática de sofosbuvir, lo que lleva a una reducción del efecto terapéutico de SOVALDI, y por lo tanto no se recomienda el uso concomitante con SOVALDI [ver Advertencias y precauciones (5.3) y Interacciones medicamentosas (7.1)].
La administración conjunta de SOVALDI con fármacos que inhiben P-gp y/o BCRP puede aumentar la concentración plasmática de sofosbuvir sin aumentar la concentración plasmática de GS-331007; por consiguiente, SOVALDI puede administrarse conjuntamente con inhibidores de P-gp y/o BCRP. Sofosbuvir y GS-331007 no son inhibidores de P-gp y BCRP y, por lo tanto, no se espera que aumenten las exposiciones de fármacos que son sustratos de estos transportadores.
La vía metabólica de activación intracelular de sofosbuvir está mediada por vías de hidrolasa y fosforilación de nucleótidos de afinidad generalmente baja y alta capacidad que es poco probable que se vean afectadas por fármacos concomitantes.
Los efectos de los fármacos coadministrados en la exposición a sofosbuvir y GS-331007 se muestran en la Tabla 9. Los efectos de sofosbuvir en la exposición a los fármacos coadministrados se muestran en la Tabla 10 [ver Interacciones medicamentosas (7.1), 7.2)].
| Fármaco coadministrado | Dosis del fármaco coadministrado (mg) | Dosis de sofosbuvir (mg) | N | Razón media (IC del 90%) de la farmacocinética de sofosbuvir y GS-331007 con/sin fármaco coadministrado Sin efecto=1.00 |
|||
|---|---|---|---|---|---|---|---|
| Cmax | AUC | Cmin | |||||
| NA = no disponible/no aplicable | |||||||
| Ciclosporina | 600 dosis única | 400 dosis única | 19 | sofosbuvir | 2.54 (1.87, 3.45) |
4.53 (3.26, 6.30) |
NA |
| GS-331007 | 0.60 (0.53, 0.69) |
1.04 (0.90, 1.20) |
NA | ||||
| Darunavir (potenciado con ritonavir) |
800/100 una vez al día | 400 dosis única | 18 | sofosbuvir | 1.45 (1.10, 1.92) |
1.34 (1.12, 1.59) |
NA |
| GS-331007 | 0.97 (0.90, 1.05) |
1.24 (1.18, 1.30) |
NA | ||||
| Efavirenz† | 600 una vez al día | 400 dosis única | 16 | sofosbuvir | 0.81 (0.60, 1.10) |
0.94 (0.76, 1.16) |
NA |
| Emtricitabina† | 200 una vez al día | ||||||
| Tenofovir disoproxil fumarato† | 300 una vez al día | GS-331007 | 0.77 (0.70, 0.84) |
0.84 (0.76, 0.92) | NA | ||
| Metadona | 30 a 130 una vez al día | 400 una vez al día | 14 | sofosbuvir | 0.95‡ (0.68, 1.33) |
1.30‡ (1.00, 1.69) |
NA |
| GS-331007 | 0.73‡ (0.65, 0.83) |
1.04‡ (0.89, 1.22) |
NA | ||||
| Rilpivirina | 25 una vez al día | 400 dosis única | 17 | sofosbuvir | 1.21 (0.90, 1.62) |
1.09 (0.94, 1.27) |
NA |
| GS-331007 | 1.06 (0.99, 1.14) |
1.01 (0.97, 1.04) |
NA | ||||
| Tacrolimus | 5 dosis única | 400 dosis única | 16 | sofosbuvir | 0.97 (0.65, 1.43) |
1.13 (0.81, 1.57) |
NA |
| GS-331007 | 0.97 (0.83, 1.14) |
1.00 (0.87, 1.13) |
NA | ||||
No se observó ningún efecto sobre los parámetros farmacocinéticos de sofosbuvir y GS-331007 con raltegravir.
| Fármaco coadministrado | Dosis del fármaco coadministrado (mg) | Dosis de Sofosbuvir (mg) | N | Razón media (IC del 90%) de la farmacocinética del fármaco coadministrado con/sin Sofosbuvir Sin efecto=1.00 |
||
|---|---|---|---|---|---|---|
| Cmax | AUC | Cmin | ||||
| NA = no disponible/no aplicable | ||||||
| Norelgestromina | norgestimato 0.18/0.215/0.25/ etinilestradiol 0.025 una vez al día | 400 una vez al día | 15 | 1.07 (0.94, 1.22) |
1.06 (0.92, 1.21) |
1.07 (0.89, 1.28) |
| Norgestrel | 1.18 (0.99, 1.41) |
1.19 (0.98, 1.45) |
1.23 (1.00, 1.51) |
|||
| Etinilestradiol | 1.15 (0.97, 1.36) |
1.09 (0.94, 1.26) |
0.99 (0.80, 1.23) |
|||
| Raltegravir | 400 dos veces al día | 400 dosis única | 19 | 0.57 (0.44, 0.75) |
0.73 (0.59, 0.91) |
0.95 (0.81, 1.12) |
| Tacrolimus | 5 dosis única | 400 dosis única | 16 | 0.73 (0.59, 0.90) |
1.09 (0.84, 1.40) |
NA |
| Tenofovir disoproxil fumarato† | 300 una vez al día | 400 dosis única | 16 | 1.25 (1.08, 1.45) |
0.98 (0.91, 1.05) |
0.99 (0.91, 1.07) |
No se observó ningún efecto sobre los parámetros farmacocinéticos de los siguientes medicamentos coadministrados con sofosbuvir: ciclosporina, darunavir/ritonavir, efavirenz, emtricitabina, metadona o rilpivirina.
12.4 Microbiología
Mecanismo de acción
Sofosbuvir es un inhibidor de la ARN polimerasa ARN-dependiente NS5B del VHC, esencial para la replicación viral. Sofosbuvir es un profármaco nucleósido que sufre un metabolismo intracelular para formar el análogo de uridina trifosfato (GS-461203) farmacológicamente activo, que puede incorporarse al ARN del VHC por la polimerasa NS5B y actúa como un terminador de cadena. En un ensayo bioquímico, GS-461203 inhibió la actividad de la polimerasa de la NS5B recombinante del genotipo 1b, 2a, 3a y 4a del VHC con valores de IC50 que oscilan entre 0,7 y 2,6 micromolares. GS-461203 no es un inhibidor de las polimerasas de ADN y ARN humanas ni un inhibidor de la ARN polimerasa mitocondrial.
Actividad antiviral
En ensayos con replicones del VHC, los valores de EC50 de sofosbuvir contra replicones de longitud completa de los genotipos 1a, 1b, 2a, 3a y 4a, y replicones quiméricos 1b que codifican NS5B de los genotipos 2b, 5a o 6a oscilaron entre 0,014 y 0,11 micromolares. El valor de EC50 mediana de sofosbuvir contra replicones quiméricos que codifican secuencias NS5B de aislados clínicos fue de 0,062 micromolares para el genotipo 1a (rango 0,029–0,128 micromolares; N=67), 0,102 micromolares para el genotipo 1b (rango 0,045–0,170 micromolares; N=29), 0,029 micromolares para el genotipo 2 (rango 0,014–0,081 micromolares; N=15) y 0,081 micromolares para el genotipo 3a (rango 0,024–0,181 micromolares; N=106). En ensayos con virus infecciosos, los valores de EC50 de sofosbuvir contra los genotipos 1a y 2a fueron de 0,03 y 0,02 micromolares, respectivamente. La presencia de un 40 % de suero humano no tuvo ningún efecto sobre la actividad anti-VHC de sofosbuvir. La evaluación de sofosbuvir en combinación con interferón alfa o ribavirina no mostró ningún efecto antagónico en la reducción de los niveles de ARN del VHC en las células replicón.
Resistencia
En cultivo celular
Se han seleccionado replicones del VHC con susceptibilidad reducida a sofosbuvir en cultivo celular para múltiples genotipos, incluidos 1b, 2a, 2b, 3a, 4a, 5a y 6a. La susceptibilidad reducida a sofosbuvir se asoció con la sustitución NS5B primaria S282T en todos los genotipos de replicón examinados. Se desarrolló una sustitución M289L junto con la sustitución S282T en los replicones de los genotipos 2a, 5 y 6. La mutagénesis dirigida por sitio de la sustitución S282T en replicones de 8 genotipos confirió una susceptibilidad reducida de 2 a 18 veces a sofosbuvir y redujo la capacidad de replicación viral en un 89 % a un 99 % en comparación con el tipo salvaje correspondiente. En ensayos bioquímicos, la polimerasa NS5B recombinante de los genotipos 1b, 2a, 3a y 4a que expresaban la sustitución S282T mostraron una susceptibilidad reducida a GS-461203 en comparación con los tipos salvajes respectivos.
En ensayos clínicos
En un análisis agrupado de 982 sujetos que recibieron SOVALDI en ensayos de fase 3, 224 sujetos tenían datos genotípicos NS5B posteriores a la línea de base de la secuenciación de nucleótidos de próxima generación (punto de corte del ensayo del 1 %).
Se detectaron sustituciones emergentes al tratamiento L159F (n=6) y V321A (n=5) en muestras posteriores a la línea de base de sujetos infectados con GT3a en los ensayos de fase 3. No se observó ningún cambio detectable en la susceptibilidad fenotípica a sofosbuvir de los aislados de sujetos con sustituciones L159F o V321A. La sustitución de resistencia asociada a sofosbuvir S282T no se detectó en la línea de base ni en los aislados de fracaso de los ensayos de fase 3. Sin embargo, se detectó una sustitución S282T en un sujeto de genotipo 2b que recayó en la semana 4 después del tratamiento después de 12 semanas de monoterapia con sofosbuvir en el ensayo de fase 2 P7977-0523 [ELECTRON]. El aislado de este sujeto mostró una susceptibilidad reducida a sofosbuvir de 13,5 veces de media. Para este sujeto, la sustitución S282T ya no era detectable en la semana 12 después del tratamiento mediante secuenciación de próxima generación con un punto de corte del ensayo del 1 %.
En el ensayo realizado en sujetos con carcinoma hepatocelular a la espera de un trasplante de hígado, donde los sujetos recibieron hasta 48 semanas de sofosbuvir y ribavirina, la sustitución L159F surgió en múltiples sujetos con VHC GT1a o GT2b que experimentaron un fracaso virológico (irrupción y recaída). Además, la presencia de las sustituciones L159F y/o C316N en la línea de base se asoció con la irrupción y la recaída de sofosbuvir después del trasplante en múltiples sujetos infectados con VHC GT1b. Además, las sustituciones S282R y L320F se detectaron durante el tratamiento mediante secuenciación de próxima generación en un sujeto infectado con VHC GT1a con una respuesta parcial al tratamiento.
Se desconoce la importancia clínica de estas sustituciones.
Resistencia cruzada
Los replicones del VHC que expresaban la sustitución de resistencia asociada a sofosbuvir S282T fueron susceptibles a los inhibidores de NS5A y a la ribavirina. Los replicones del VHC que expresaban las sustituciones asociadas a ribavirina T390I y F415Y fueron susceptibles a sofosbuvir. Sofosbuvir fue activo contra los replicones del VHC con variantes resistentes a inhibidores de la proteasa NS3/4A, inhibidores no nucleósidos de NS5B e inhibidores de NS5A.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Carcinogénesis y Mutagénesis
Uso con Ribavirina y/o Peginterferón alfa: Consulte la información de prescripción de ribavirina y/o peginterferón alfa para obtener información sobre carcinogénesis y mutagénesis.
Sofosbuvir no fue genotóxico en una batería de ensayos in vitro o in vivo, incluyendo mutagenicidad bacteriana, aberración cromosómica utilizando linfocitos de sangre periférica humana y ensayos de micronúcleos en ratón in vivo.
Se realizaron estudios de carcinogenicidad de dos años en ratones y ratas con sofosbuvir. A los ratones se les administraron dosis de hasta 200 mg/kg/día en machos y 600 mg/kg/día en hembras, mientras que a las ratas se les administraron dosis de hasta 750 mg/kg/día en machos y hembras. No se observó un aumento en la incidencia de neoplasias relacionadas con el fármaco en las dosis más altas probadas en ratones y ratas, lo que resultó en una exposición al AUC del metabolito circulante predominante GS-331007 de aproximadamente 7 y 30 veces (en ratones) y 13 y 17 veces (en ratas), en machos y hembras respectivamente, la exposición en humanos a la dosis clínica recomendada.
Deterioro de la Fertilidad
Uso con Ribavirina y/o Peginterferón alfa: Consulte la información de prescripción de ribavirina y/o peginterferón alfa para obtener información sobre el deterioro de la fertilidad.
Sofosbuvir no tuvo efectos sobre la viabilidad embriofetal ni sobre la fertilidad cuando se evaluó en ratas. En la dosis más alta probada, la exposición al AUC del metabolito circulante predominante GS-331007 fue aproximadamente 8 veces la exposición en humanos a la dosis clínica recomendada.
14 ESTUDIOS CLÍNICOS
14.1 Descripción de los ensayos clínicos
La seguridad y eficacia de SOVALDI se evaluaron en cinco ensayos de Fase 3 en un total de 1724 sujetos monoinfectados con VHC con genotipos 1 a 6 del virus de la hepatitis C crónica, un ensayo de Fase 3 en 223 sujetos coinfectados con VHC/VIH-1 con genotipo 1, 2 o 3 del VHC, y un ensayo en 106 sujetos pediátricos de 3 años de edad o más con genotipo 2 o 3 del VHC, como se resume en la Tabla 11 [véase Estudios Clínicos (14.2, 14.3, 14.4, y 14.5)].
| Ensayo | Población | Brazos de estudio (Número de sujetos tratados) |
|---|---|---|
| NEUTRINO * (NCT01641640) |
Tratamiento naive (TN) (GT1, 4, 5 o 6) | SOVALDI+Peg-IFN alfa+RBV 12 semanas (327) |
| FISSION * (NCT01497366) |
TN (GT2 o 3) | SOVALDI+RBV 12 semanas (256) Peg-IFN alfa+RBV 24 semanas (243) |
| POSITRON † (NCT01542788) |
Sujetos intolerantes al interferón, inelegibles o no dispuestos (GT2 o 3) | SOVALDI+RBV 12 semanas (207) Placebo 12 semanas (71) |
| FUSION † (NCT01604850) |
Recaídas previas con interferón o no respondedores (GT2 o 3) | SOVALDI+RBV 12 semanas (103) SOVALDI+RBV 16 semanas (98) |
| VALENCE † (NCT01682720) |
TN o recaídas previas con interferón o no respondedores (GT2 o 3) | SOVALDI+RBV 12 semanas para GT2 (73) SOVALDI+RBV 12 semanas para GT3 (11) SOVALDI+RBV 24 semanas para GT3 (250) Placebo durante 12 semanas (85) |
| PHOTON-1 * (NCT01667731) |
|
SOVALDI+RBV 24 semanas para GT1 (114) SOVALDI+RBV 12 semanas para GT2 o 3 TN (68) SOVALDI+RBV 24 semanas para GT2 o 3 recaídas previas con interferón o no respondedores (41) |
| 1112 (NCT02175758)* |
Sujetos pediátricos GT2 o GT3 de 3 años de edad o mayores | SOVALDI+RBV 12 semanas para GT2 (31) SOVALDI+RBV 24 semanas para GT3 (75) |
Los sujetos de los ensayos en adultos no tenían cirrosis o tenían cirrosis compensada. SOVALDI se administró a una dosis de 400 mg una vez al día. La dosis de ribavirina (RBV) para los sujetos adultos se basó en el peso a 1000–1200 mg diarios administrados en dos dosis divididas cuando se usó en combinación con SOVALDI, y la dosis de peginterferón alfa 2a, cuando corresponda, fue de 180 microgramos por semana. La duración del tratamiento fue fija en cada ensayo y no se guio por los niveles de ARN del VHC de los sujetos (sin algoritmo guiado por la respuesta). Los valores de ARN del VHC en plasma se midieron durante los ensayos clínicos utilizando la prueba COBAS TaqMan HCV (versión 2.0), para su uso con el sistema High Pure. El ensayo tuvo un límite inferior de cuantificación (LLOQ) de 25 UI por mL. La respuesta virológica sostenida (SVR12) fue el criterio de valoración principal, que se definió como ARN del VHC inferior a LLOQ a las 12 semanas después del final del tratamiento.
14.2 Ensayos clínicos en sujetos con VHC de genotipo 1 o 4
Adultos sin tratamiento previo ─ NEUTRINO (Estudio 110)
NEUTRINO fue un ensayo de un solo brazo, abierto, que evaluó 12 semanas de tratamiento con SOVALDI en combinación con peginterferón alfa 2a y ribavirina en sujetos sin tratamiento previo con infección por VHC de genotipo 1, 4, 5 o 6 en comparación con un control histórico preespecificado.
Los sujetos tratados (N=327) tenían una edad media de 54 años (rango: 19 a 70); el 64% de los sujetos eran hombres; el 79% eran blancos, el 17% eran negros; el 14% eran hispanos o latinos; el índice de masa corporal medio fue de 29 kg/m2 (rango: 18 a 56 kg/m2); el 78% tenía un ARN del VHC basal superior a 6 log10 UI por mL; el 17% tenía cirrosis; el 89% tenía el genotipo 1 del VHC; el 9% tenía el genotipo 4 del VHC y el 2% tenía el genotipo 5 o 6 del VHC. La Tabla 12 presenta la SVR12 para el grupo de tratamiento de SOVALDI + peginterferón alfa + ribavirina en sujetos con VHC de genotipo 1 o 4. Los datos disponibles sobre sujetos con VHC de genotipo 5 o 6 tratados con SOVALDI + peginterferón alfa + ribavirina durante 12 semanas fueron insuficientes para las recomendaciones de dosificación; por lo tanto, estos resultados no se presentan en la Tabla 12 [ver Uso en poblaciones específicas (8.10)].
| SOVALDI + Peg-IFN alfa + RBV 12 semanas | |
|---|---|
| N=320 | |
|
|
| SVR general | 90% (289/320) |
| Genotipo 1* | 90% (262/292) |
| Genotipo 1a | 92% (206/225) |
| Genotipo 1b | 83% (55/66) |
| Genotipo 4 | 96% (27/28) |
| Resultado para sujetos sin SVR | |
| Fallo virológico durante el tratamiento | 0/320 |
| Recaída† | 9% (28/319) |
| Otros‡ | 1% (3/320) |
La SVR12 para subgrupos seleccionados se presenta en la Tabla 13.
| SOVALDI + Peg-IFN alfa + RBV 12 semanas | |
|---|---|
| Cirrosis | |
| No | 93% (247/267) |
| Sí | 79% (42/53) |
| Raza | |
| Negra | 87% (47/54) |
| No negra | 91% (242/266) |
| Múltiples factores basales | |
| Genotipo 1, fibrosis Metavir F3/F4, IL28B no C/C, ARN del VHC >800 000 UI/mL | 71% (37/52) |
Las tasas de SVR12 fueron del 99% (89/90) en sujetos con VHC de genotipo 1 o 4 y alelo C/C de IL28B basal y del 87% (200/230) en sujetos con VHC de genotipo 1 o 4 y alelos de IL28B no C/C basales.
Se estima que la SVR12 en pacientes que previamente fracasaron en el tratamiento con interferón pegilado y ribavirina se aproximará a la SVR12 observada en los sujetos de NEUTRINO con múltiples factores basales tradicionalmente asociados con una menor respuesta al tratamiento basado en interferón (Tabla 13).
La tasa de SVR12 en el ensayo NEUTRINO en sujetos con genotipo 1 con alelos de IL28B no C/C, ARN del VHC superior a 800.000 UI/ml y fibrosis Metavir F3/F4 fue del 71% (37/52).
14.3 Ensayos clínicos en sujetos con VHC de genotipo 2 o 3
Adultos sin tratamiento previo ─ FISSION (Estudio 1231)
FISSION fue un ensayo aleatorizado, abierto, controlado con activo que evaluó 12 semanas de tratamiento con SOVALDI y ribavirina en comparación con 24 semanas de tratamiento con peginterferón alfa 2a y ribavirina en sujetos sin tratamiento previo con VHC de genotipo 2 y 3. La dosis de ribavirina utilizada en los brazos de SOVALDI + ribavirina y peginterferón alfa 2a + ribavirina fueron de 1000–1200 mg por día basadas en el peso y 800 mg por día independientemente del peso, respectivamente. Los sujetos fueron aleatorizados en una proporción de 1:1 y estratificados por cirrosis (presencia vs. ausencia), genotipo del VHC (2 vs. 3) y nivel basal de ARN del VHC (menos de 6 log10 UI/ml vs. al menos 6 log10 UI/ml). Los sujetos con VHC de genotipo 2 o 3 se inscribieron en una proporción de aproximadamente 1:3.
Los sujetos tratados (N=499) tenían una edad media de 50 años (rango: 19 a 77); el 66% de los sujetos eran hombres; el 87% eran blancos, el 3% eran negros; el 14% eran hispanos o latinos; el índice de masa corporal medio fue de 28 kg/m2 (rango: 17 a 52 kg/m2); el 57% tenía niveles basales de ARN del VHC superiores a 6 log10 UI por ml; el 20% tenía cirrosis; el 72% tenía genotipo 3 del VHC. La Tabla 14 presenta la SVR12 para los grupos de tratamiento de SOVALDI + ribavirina y peginterferón alfa + ribavirina en sujetos con VHC de genotipo 2. La SVR12 para los sujetos de genotipo 3 tratados con SOVALDI + ribavirina durante 12 semanas fue subóptima; por lo tanto, estos resultados no se presentan en la Tabla 14.
| SOVALDI + RBV 12 semanas | Peg-IFN alfa + RBV 24 semanas | |
|---|---|---|
| N=73* | N=67* | |
|
||
| SVR12 | 95% (69/73) | 78% (52/67) |
| Resultado para sujetos sin SVR12 | ||
| Fallo virológico durante el tratamiento | 0/73 | 4% (3/67) |
| Recaída† | 5% (4/73) | 15% (9/62) |
| Otros‡ | 0/73 | 4% (3/67) |
Las tasas de SVR12 para sujetos infectados con VHC de genotipo 2 con cirrosis basal se presentan en la Tabla 15.
| SOVALDI + RBV 12 semanas |
Peg-IFN alfa + RBV 24 semanas |
|
|---|---|---|
| N=73 | N=67 | |
| Cirrosis | ||
| No | 97% (59/61) | 81% (44/54) |
| Sí | 83% (10/12) | 62% (8/13) |
Adultos Intolerantes, Inelegibles o Reacios al Interferón ─ POSITRON (Estudio 0107)
POSITRON fue un ensayo aleatorizado, doble ciego, controlado con placebo que evaluó 12 semanas de tratamiento con SOVALDI y ribavirina (N=207) en comparación con placebo (N=71) en sujetos intolerantes, inelegibles o reacios al interferón. Los sujetos fueron aleatorizados en una proporción de 3:1 y estratificados por cirrosis (presencia vs. ausencia).
Los sujetos tratados (N=278) tenían una edad media de 54 años (rango: 21 a 75); el 54% de los sujetos eran hombres; el 91% eran blancos, el 5% eran negros; el 11% eran hispanos o latinos; el índice de masa corporal medio fue de 28 kg/m2 (rango: 18 a 53 kg/m2); el 70% tenía niveles de ARN del VHC basales superiores a 6 log10 UI por mL; el 16% tenía cirrosis; el 49% tenía el genotipo 3 del VHC. Las proporciones de sujetos que eran intolerantes, inelegibles o reacios al interferón fueron del 9%, 44% y 47%, respectivamente. La mayoría de los sujetos no habían recibido tratamiento previo para el VHC (81%). La Tabla 16 presenta la Tasa de Respuesta Virológica Sosténida a las 12 semanas (SVR12) para los grupos de tratamiento de SOVALDI + ribavirina y placebo en sujetos con VHC genotipo 2. La SVR12 para los sujetos con genotipo 3 tratados con SOVALDI + ribavirina durante 12 semanas fue subóptima; por lo tanto, estos resultados no se presentan en la Tabla 16.
| SOVALDI + RBV 12 semanas | Placebo 12 semanas | |
|---|---|---|
| N=109 | N= 34 | |
| SVR12 | 93% (101/109) | 0/34 |
| Resultado para sujetos sin SVR12 | ||
| Fallo virológico durante el tratamiento | 0/109 | 97% (33/34) |
| Recaída* | 5% (5/107) | 0/0 |
| Otros† | 3% (3/109) | 3% (1/34) |
La Tabla 17 presenta el análisis de subgrupos para la cirrosis y la clasificación del interferón en sujetos con VHC genotipo 2.
| SOVALDI + RBV 12 semanas | |
|---|---|
| N=109 | |
| Cirrosis | |
| No | 92% (85/92) |
| Sí | 94% (16/17) |
| Clasificación del Interferón | |
| Inelegibles | 88% (36/41) |
| Intolerantes | 100% (9/9) |
| Reacios | 95% (56/59) |
Adultos previamente tratados ─ FUSION (Estudio 0108)
FUSION fue un ensayo aleatorizado, doble ciego que evaluó 12 o 16 semanas de tratamiento con SOVALDI y ribavirina en sujetos que no lograron SVR con tratamiento previo basado en interferón (recaídas y no respondedores). Los sujetos se asignaron al azar en una proporción 1:1 y se estratificaron por cirrosis (presencia vs. ausencia) y genotipo de VHC (2 vs. 3).
Los sujetos tratados (N=201) tenían una edad media de 56 años (rango: 24 a 70); el 70% de los sujetos eran hombres; el 87% eran blancos; el 3% eran negros; el 9% eran hispanos o latinos; el índice de masa corporal medio fue de 29 kg/m2 (rango: 19 a 44 kg/m2); el 73% tenía niveles basales de ARN del VHC superiores a 6 log10 UI por mL; el 34% tenía cirrosis; el 63% tenía el genotipo 3 del VHC; el 75% fueron recaídas previas. La Tabla 18 presenta la SVR12 para los grupos de tratamiento de SOVALDI + ribavirina durante 12 semanas en sujetos con VHC genotipo 2. No se demostró que el tratamiento de 16 semanas en sujetos con VHC genotipo 2 aumentara la SVR12 observada con 12 semanas de tratamiento. La SVR12 para los sujetos de genotipo 3 tratados con SOVALDI + ribavirina durante 12 o 16 semanas fue subóptima; por lo tanto, estos resultados no se presentan en la Tabla 18.
| SOVALDI + RBV 12 semanas |
|
|---|---|
| N=39* | |
|
|
| SVR12 | 82% (32/39) |
| Resultado para sujetos sin SVR12 | |
| Fallo virológico durante el tratamiento | 0/39 |
| Recaída† | 18% (7/39) |
| Otros‡ | 0/39 |
La Tabla 19 presenta el análisis de subgrupos para la cirrosis y la respuesta al tratamiento previo del VHC en sujetos con VHC genotipo 2.
| SOVALDI + RBV 12 semanas | |
|---|---|
| N=39 | |
| Cirrosis | |
| No | 90% (26/29) |
| Sí | 60% (6/10) |
| Respuesta al tratamiento previo del VHC | |
| Recaída/ irrupción | 86% (25/29) |
| No respondedor | 70% (7/10) |
Adultos sin tratamiento previo y tratados previamente ─ VALENCE (Estudio 0133)
El ensayo VALENCE evaluó SOVALDI en combinación con ribavirina basada en el peso para el tratamiento de la infección por VHC de genotipo 2 o 3 en sujetos sin tratamiento previo o en sujetos que no lograron SVR con tratamiento previo basado en interferón, incluidos sujetos con cirrosis compensada. El diseño original del ensayo fue una aleatorización de 4 a 1 a SOVALDI + ribavirina durante 12 semanas o placebo. Sobre la base de los datos emergentes, este ensayo se descifró y todos los sujetos infectados con VHC de genotipo 2 continuaron con el tratamiento planificado original y recibieron SOVALDI + ribavirina durante 12 semanas, y la duración del tratamiento con SOVALDI + ribavirina en sujetos infectados con VHC de genotipo 3 se extendió a 24 semanas. Once sujetos de genotipo 3 ya habían completado SOVALDI + ribavirina durante 12 semanas en el momento de la enmienda.
Los sujetos tratados (N=419) tenían una edad media de 51 años (rango: 19 a 74); el 60% de los sujetos eran hombres; el índice de masa corporal medio fue de 26 kg/m2 (rango: 17 a 44 kg/m2); el nivel medio de ARN del VHC basal fue de 6,4 log10 UI por mL; el 78% tenía el genotipo 3 del VHC; el 58% de los sujetos tenían experiencia en tratamiento y el 65% de esos sujetos experimentaron una recaída/ruptura del tratamiento previo contra el VHC.
La Tabla 20 presenta la SVR12 para los grupos de tratamiento de SOVALDI + ribavirina durante 12 semanas y 24 semanas.
| Genotipo 2 SOVALDI + RBV 12 semanas | Genotipo 3 SOVALDI + RBV 24 semanas | |
|---|---|---|
| N=73 | N=250 | |
|
||
| SVR general | 93% (68/73) | 84% (210/250) |
| Resultado para sujetos sin SVR | ||
| Fallo virológico durante el tratamiento | 0% (0/73) | <1% (1/250) |
| Recaída† | 7% (5/73) | 14% (34/249) |
| Sin tratamiento previo | 3% (1/32) | 5% (5/105) |
| Con tratamiento previo | 10% (4/41) | 20% (29/144) |
| Otros‡ | 0% (0/73) | 2% (5/250) |
La Tabla 21 presenta el análisis de subgrupos por genotipo para la cirrosis y la experiencia previa en el tratamiento del VHC.
| Genotipo 2 SOVALDI + RBV 12 semanas | Genotipo 3 SOVALDI + RBV 24 semanas | |
|---|---|---|
| N=73 | N=250 | |
| Sin tratamiento previo | 97% (31/32) | 93% (98/105) |
| Sin cirrosis | 97% (29/30) | 93% (86/92) |
| Con cirrosis | 100% (2/2) | 92% (12/13) |
| Con tratamiento previo | 90% (37/41) | 77% (112/145) |
| Sin cirrosis | 91% (30/33) | 85% (85/100) |
| Con cirrosis | 88% (7/8) | 60% (27/45) |
14.4 Ensayos clínicos en adultos coinfectados con VHC y VIH-1 ─ Photon-1 (Estudio 0123)
SOVALDI se estudió en un ensayo clínico abierto (Estudio PHOTON-1) que evaluó la seguridad y eficacia de 12 o 24 semanas de tratamiento con SOVALDI y ribavirina en adultos con hepatitis C crónica de genotipo 1, 2 o 3 coinfectados con VIH-1. Los sujetos de genotipo 2 y 3 fueron naive o con experiencia previa en tratamiento con VHC, mientras que los sujetos de genotipo 1 fueron todos naive al tratamiento. Los sujetos recibieron 400 mg de SOVALDI y ribavirina basada en el peso (1000 mg para sujetos que pesan menos de 75 kg o 1200 mg para sujetos que pesan al menos 75 kg) diariamente durante 12 o 24 semanas según el genotipo y el historial de tratamiento previo. Los sujetos no estaban en terapia antirretroviral con un recuento de células CD4+ superior a 500 células/mm3 o tenían VIH-1 suprimido virológicamente con un recuento de células CD4+ superior a 200 células/mm3. Los datos de eficacia a las 12 semanas posteriores al tratamiento están disponibles para 210 sujetos (véase Tabla 22).
| Genotipo 1 de VHC | Genotipo 2 de VHC | Genotipo 3 de VHC | |
|---|---|---|---|
| SOVALDI + RBV 24 semanas TN (N=114) |
SOVALDI + RBV 12 semanas TN (N=26) |
SOVALDI + RBV 24 semanas TE (N=13) |
|
| TN = Naive al tratamiento; TE = Con experiencia previa en tratamiento | |||
|
|||
| General | 76% (87/114) | 88% (23/26) | 92% (12/13) |
| Resultado para los sujetos sin SVR12 | |||
| Fallo virológico durante el tratamiento | 1% (1/114) | 4% (1/26) | 0/13 |
| Recaída† | 22% (25/113) | 0/25 | 8% (1/13) |
| Otros‡ | 1% (1/114) | 8% (2/26) | 0/13 |
En sujetos con infección por VHC genotipo 1, la tasa de SVR12 fue del 82 % (74/90) en sujetos con infección por genotipo 1a y del 54 % (13/24) en sujetos con infección por genotipo 1b, siendo la recaída la causa de la mayoría de los fallos del tratamiento. Las tasas de SVR12 en sujetos con infección por VHC genotipo 1 fueron del 80 % (24/30) en sujetos con alelo C/C de IL28B basal y del 75 % (62/83) en sujetos con alelos no C/C de IL28B basal.
En los 223 sujetos con VHC con coinfección por VIH-1, el porcentaje de células CD4+ no cambió durante el tratamiento. Se observaron disminuciones de la mediana del recuento de células CD4+ de 85 células/mm3 y 84 células/mm3 al final del tratamiento con SOVALDI + ribavirina durante 12 o 24 semanas, respectivamente. El rebote del VIH-1 durante el tratamiento con SOVALDI + ribavirina se produjo en 2 sujetos (0,9 %) en terapia antirretroviral.
14.5 Ensayo clínico en pediatría (Estudio 1112)
La eficacia de SOVALDI en sujetos pediátricos infectados por VHC de 3 años de edad o más se evaluó en 106 sujetos con genotipo 2 (N = 31) o genotipo 3 (N = 75) del VHC en un ensayo clínico de fase 2, abierto. Los sujetos con infección por VHC genotipo 2 o 3 en el ensayo fueron tratados con SOVALDI y ribavirina basada en el peso durante 12 o 24 semanas, respectivamente [véase Posología y administración (2.3)].
Sujetos de 12 años a <18 años de edad: SOVALDI se evaluó en 52 sujetos de 12 años a <18 años de edad con infección por VHC genotipo 2 (N = 13) o genotipo 3 (N = 39). La mediana de edad fue de 15 años (rango: 12 a 17); el 40 % de los sujetos fueron mujeres; el 90 % fueron blancos, el 4 % fueron negros y el 2 % fueron asiáticos; el 4 % fueron hispanos/latinos; la media del índice de masa corporal fue de 22 kg/m2 (rango: 16 a 32 kg/m2); la media del peso fue de 60 kg (rango: 30 a 101 kg); el 17 % tenían experiencia previa en tratamiento; el 65 % tenían niveles basales de ARN del VHC superiores o iguales a 800 000 UI/ml; y ningún sujeto tenía cirrosis conocida. La mayoría de los sujetos (71 %) se habían infectado a través de la transmisión vertical.
La tasa de SVR12 fue del 100 % [13/13] en los sujetos con genotipo 2 y del 97 % [38/39] en los sujetos con genotipo 3. Ningún sujeto experimentó fracaso virológico durante el tratamiento o recaída.
Sujetos de 6 años a <12 años de edad: SOVALDI se evaluó en 41 sujetos de 6 años a <12 años de edad con infección por VHC genotipo 2 (N = 13) o genotipo 3 (N = 28). La mediana de edad fue de 9 años (rango: 6 a 11); el 73 % de los sujetos fueron mujeres; el 71 % fueron blancos y el 20 % fueron asiáticos; el 15 % fueron hispanos/latinos; la media del índice de masa corporal fue de 19 kg/m2 (rango: 13 a 32 kg/m2); la media del peso fue de 34 kg (rango: 15 a 80 kg); el 98 % no habían recibido tratamiento previo; el 46 % tenían niveles basales de ARN del VHC superiores o iguales a 800 000 UI/ml; y ningún sujeto tenía cirrosis conocida. La mayoría de los sujetos (98 %) se habían infectado a través de la transmisión vertical.
La tasa de SVR12 fue del 100 % (13/13) en los sujetos con genotipo 2 y del 100 % (28/28) en los sujetos con genotipo 3. Ningún sujeto experimentó fracaso virológico durante el tratamiento o recaída.
Sujetos de 3 años a <6 años de edad: SOVALDI se evaluó en 13 sujetos de 3 años a <6 años de edad con infección por VHC genotipo 2 (N = 5) o genotipo 3 (N = 8). La mediana de edad fue de 4 años (rango: 3 a 5); el 77 % de los sujetos fueron mujeres; el 69 % fueron blancos, el 8 % fueron negros y el 8 % fueron asiáticos; el 8 % fueron hispanos/latinos; la media del índice de masa corporal fue de 15 kg/m2 (rango: 13 a 17 kg/m2); la media del peso fue de 17 kg (rango: 13 a 19 kg); el 100 % no habían recibido tratamiento previo; el 23 % tenían niveles basales de ARN del VHC superiores o iguales a 800 000 UI/ml; y ningún sujeto tenía cirrosis conocida. La mayoría de los sujetos (85 %) se habían infectado a través de la transmisión vertical.
La tasa de SVR12 fue del 80 % (4/5) en los sujetos con genotipo 2 y del 100 % (8/8) en los sujetos con genotipo 3. Ningún sujeto experimentó fracaso virológico durante el tratamiento o recaída. Un sujeto interrumpió prematuramente el tratamiento del estudio debido a un evento adverso.
16 SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Tabletas
Las tabletas SOVALDI de 400 mg son tabletas recubiertas con película, amarillas, en forma de cápsula, que contienen 400 mg de sofosbuvir con la inscripción “GSI” en una cara y “7977” en la otra. Cada frasco contiene 28 tabletas (NDC 61958-1501-1), un desecante de gel de sílice y una bobina de poliéster con un cierre a prueba de niños.
Las tabletas SOVALDI de 200 mg son tabletas recubiertas con película, amarillas, de forma ovalada, que contienen 200 mg de sofosbuvir con la inscripción “GSI” en una cara y “200” en la otra. Cada frasco contiene 28 tabletas (NDC 61958-1503-1) y una bobina de poliéster con un cierre a prueba de niños.
Almacenar por debajo de 30 °C (86 °F).
- Dispensar solo en el envase original
- No usar si el sello sobre la abertura del frasco está roto o falta
Gránulos orales
Los gránulos de SOVALDI de 150 mg son gránulos de color blanco a blanquecino que se suministran en paquetes de dosis unitaria en cajas. Cada caja contiene 28 paquetes (NDC 61958-1504-1)
Los gránulos de SOVALDI de 200 mg son gránulos de color blanco a blanquecino que se suministran en paquetes de dosis unitaria en cajas. Cada caja contiene 28 paquetes (NDC 61958-1505-1)
- Almacenar por debajo de 30 °C (86 °F).
- No usar si el sello de seguridad de la caja o del paquete está roto o dañado.
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
Aconseje al paciente que lea el etiquetado del paciente aprobado por la FDA (Información para el paciente e Instrucciones de uso).
Riesgo de reactivación del virus de la hepatitis B en pacientes coinfectados con VHC y VHB
Informe a los pacientes que la reactivación del VHB puede ocurrir en pacientes coinfectados con VHB durante o después del tratamiento de la infección por VHC. Aconseje a los pacientes que informen a su proveedor de atención médica si tienen antecedentes de infección por VHB [ver Advertencias y precauciones (5.1)].
Bradicardia sintomática grave cuando se administra conjuntamente con amiodarona
Aconseje a los pacientes que busquen evaluación médica inmediata para los síntomas de bradicardia, como desmayo o casi desmayo, mareos o aturdimiento, malestar, debilidad, cansancio excesivo, dificultad para respirar, dolor en el pecho, confusión o problemas de memoria [ver Advertencias y precauciones (5.2), Reacciones adversas (6.2), y Interacciones medicamentosas (7.1)].
Embarazo
Aconseje a las pacientes que eviten el embarazo durante el tratamiento combinado con SOVALDI y ribavirina o SOVALDI y peginterferón y ribavirina. Informe a las pacientes que notifiquen a su proveedor de atención médica inmediatamente en caso de embarazo [ver Uso en poblaciones específicas (8.1)].
Interacciones medicamentosas
Avise a los pacientes que SOVALDI puede interactuar con algunos medicamentos; por lo tanto, se debe aconsejar a los pacientes que informen el uso de cualquier medicamento recetado, medicamento de venta libre o productos herbales a su proveedor de atención médica [ver Advertencias y precauciones (5.3) y Interacciones medicamentosas (7.1)].
Transmisión del virus de la hepatitis C
Informe a los pacientes que se desconoce el efecto del tratamiento de la infección por hepatitis C en la transmisión, y que se deben tomar las precauciones adecuadas para prevenir la transmisión del virus de la hepatitis C durante el tratamiento o en caso de fracaso del tratamiento.
Administración
Aconseje a los pacientes que tomen SOVALDI todos los días a la hora programada regularmente, con o sin alimentos. Informe a los pacientes que es importante no omitir ni saltarse las dosis y que tomen SOVALDI durante el tiempo que recomiende el médico.
Para los gránulos orales de SOVALDI, aconseje a los pacientes o cuidadores que lean y sigan las Instrucciones de uso para preparar la dosis correcta.
Información importante sobre la administración conjunta con ribavirina o peginterferón y ribavirina
Aconseje a los pacientes que el régimen recomendado para pacientes con infección por VHC de genotipo 1 o 4 es SOVALDI administrado en combinación con peginterferón alfa y ribavirina, y el régimen recomendado para pacientes con infección por VHC de genotipo 2 o 3 es SOVALDI administrado en combinación con ribavirina. Si se suspende permanentemente el peginterferón y/o la ribavirina, también se debe suspender SOVALDI.
SECCIÓN NO CLASIFICADA DE SPL
Fabricado y distribuido por:
Gilead Sciences, Inc.
Foster City, CA 94404
SOVALDI y HARVONI son marcas comerciales de Gilead Sciences, Inc., o sus compañías relacionadas. Todas las demás marcas comerciales mencionadas en este documento son propiedad de sus respectivos dueños.
©2024 Gilead Sciences, Inc. Todos los derechos reservados.
204671-GS-0011
PROSPECTO PARA EL PACIENTE
| Esta información para el paciente ha sido aprobada por la Administración de Alimentos y Medicamentos de los EE. UU. | Revisado: 03/2020 | |||
| Información para el paciente | ||||
| SOVALDI® (soh-VAHL-dee) (sofosbuvir) comprimidos |
SOVALDI® (soh-VAHL-dee) (sofosbuvir) gránulos orales |
|||
| Importante: SOVALDI se usa en combinación con otros medicamentos antivirales. Cuando tome SOVALDI con ribavirina o en combinación con peginterferón alfa y ribavirina, también debe leer esas Guías de Medicamentos. La información de este folleto informativo para el paciente habla sobre SOVALDI cuando se usa con ribavirina y en combinación con peginterferón alfa y ribavirina. | ||||
| ¿Cuál es la información más importante que debo saber sobre SOVALDI? SOVALDI puede causar efectos secundarios graves, que incluyen:
Para obtener más información sobre los efectos secundarios, consulte la sección “¿Cuáles son los posibles efectos secundarios de SOVALDI?“ |
||||
| ¿Qué es SOVALDI? SOVALDI es un medicamento recetado que se usa con otros medicamentos antivirales para tratar a adultos con virus de la hepatitis C (VHC) crónica (que dura mucho tiempo):
SOVALDI se usa para tratar a niños de 3 años o más con infección por VHC de genotipo 2 o 3 crónica sin cirrosis o con cirrosis compensada en combinación con ribavirina. |
||||
Antes de tomar SOVALDI, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si:
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos herbales. SOVALDI y otros medicamentos pueden afectarse mutuamente. Esto puede hacer que tenga demasiado o muy poco SOVALDI u otros medicamentos en su cuerpo. Esto puede afectar la forma en que funcionan SOVALDI o sus otros medicamentos, o puede causar efectos secundarios.
|
||||
¿Cómo debo tomar SOVALDI?
|
||||
| ¿Cómo debo administrar los gránulos orales de SOVALDI a mi hijo? Consulte las Instrucciones de uso detalladas para obtener información sobre cómo administrar o tomar una dosis de gránulos orales de SOVALDI.
|
||||
| ¿Cuáles son los posibles efectos secundarios de SOVALDI? SOVALDI puede causar efectos secundarios graves, que incluyen:
|
||||
|
|
|
||
| Los efectos secundarios más comunes de SOVALDI cuando se usa en combinación con ribavirina incluyen: | ||||
|
|
|||
| Los efectos secundarios más comunes de SOVALDI cuando se usa en combinación con peginterferón alfa y ribavirina incluyen: | ||||
|
|
|
||
| Estos no son todos los posibles efectos secundarios de SOVALDI. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088. |
||||
¿Cómo debo guardar SOVALDI?
Mantenga SOVALDI y todos los medicamentos fuera del alcance de los niños. |
||||
| Información general sobre el uso seguro y eficaz de SOVALDI. A veces, los medicamentos se recetan para fines distintos de los que figuran en un prospecto de información para el paciente. No use SOVALDI para una afección para la que no se le recetó. No le dé SOVALDI a otras personas, incluso si tienen los mismos síntomas que usted. Podría perjudicarlos. Puede solicitar a su proveedor de atención médica o farmacéutico información sobre SOVALDI que esté escrita para profesionales de la salud. Para obtener más información, llame al 1-800-445-3235 o visite www.SOVALDI.com. |
||||
| ¿Cuáles son los ingredientes de SOVALDI? Ingrediente activo: sofosbuvir Ingredientes inactivos, Tabletas: dióxido de silicio coloidal, croscarmelosa sódica, estearato de magnesio, manitol y celulosa microcristalina. El recubrimiento pelicular de la tableta contiene polietilenglicol, alcohol polivinílico, talco, dióxido de titanio y óxido de hierro amarillo. Ingredientes inactivos, Gránulos orales: copolímero de metacrilato de amino, dióxido de silicio coloidal, croscarmelosa sódica, hidroxipropilcelulosa, hipromelosa, monohidrato de lactosa, celulosa microcristalina, polietilenglicol, dióxido de silicio, laurilsulfato de sodio, fumarato de sodio estearilo, ácido esteárico y talco. Gilead Sciences, Inc., Foster City, CA 94404 Para obtener más información, llame al 1-800-445-3235 o visite www.SOVALDI.com. SOVALDI es una marca comercial de Gilead Sciences, Inc., o sus empresas relacionadas. Todas las demás marcas comerciales mencionadas en este documento son propiedad de sus respectivos dueños. ©2024 Gilead Sciences, Inc. Todos los derechos reservados. 204671-GS-011 |
||||
INSTRUCCIONES DE USO
SOVALDI® (soh-VAHL-dee)
(sofosbuvir)
gránulos, para administración oral
Lea la información para el paciente que viene con los gránulos orales de SOVALDI para obtener información importante sobre SOVALDI.
Estas instrucciones de uso contienen información sobre cómo tomar los gránulos orales de SOVALDI. Asegúrese de comprender y seguir las instrucciones. Si tiene alguna pregunta, consulte a su proveedor de atención médica o farmacéutico.
Información importante que debe conocer antes de tomar gránulos orales de SOVALDI
- Solo para administración oral (tomar por vía oral con o sin alimentos).
- No abra el (los) sobre(s) de gránulos orales de SOVALDI hasta que esté listo para usarlos.
- Los gránulos orales de SOVALDI son gránulos de color blanco a blanquecino que se suministran en sobres de un solo uso en cajas. Cada caja contiene 28 sobres.
- No use gránulos orales de SOVALDI si el sello de seguridad de la caja o el sello del sobre de gránulos está roto o dañado.
| Preparación de una dosis de gránulos orales de SOVALDI para tomar con alimentos: |
Antes de preparar una dosis de gránulos orales de SOVALDI para tomar con alimentos, reúna los siguientes materiales:
- Sobre(s) diario(s) de gránulos orales de SOVALDI, según lo recetado por su proveedor de atención médica
- Una o más cucharadas de alimentos blandos no ácidos, como pudín, jarabe de chocolate, puré de papas o helado
- Tazón
- Cuchara
- Tijeras (opcional)
Paso 1: Agregue primero una o más cucharadas de alimentos blandos no ácidos al tazón.
| Paso 2: Sostenga el sobre de gránulos orales de SOVALDI con la línea de corte hacia arriba (vea Figura A). | Paso 3: Agite suavemente el sobre para asentar los gránulos en el fondo del sobre (vea Figura B). | |
| Figura A | Figura B |
Paso 4: Corte el sobre a lo largo de la línea de corte con tijeras (vea Figura C), o doble el sobre hacia atrás en la línea de desgarro (vea Figura D) y desgarre (vea Figura E).
Paso 5: Vierta cuidadosamente el contenido completo del número prescrito de sobre(s) de gránulos orales de SOVALDI sobre los alimentos en el tazón y mezcle suavemente con una cuchara (vea Figura F). Asegúrese de que no queden gránulos orales de SOVALDI en el (los) sobre(s).
Paso 6: Tome la mezcla de gránulos orales de SOVALDI y alimentos dentro de los 30 minutos sin masticar para evitar un sabor amargo. Asegúrese de tomar todos los gránulos orales de SOVALDI.
| Preparación de una dosis de gránulos orales de SOVALDI para tomar sin alimentos: |
Antes de preparar una dosis de gránulos orales de SOVALDI para tomar sin alimentos, reúna los siguientes materiales:
- Paquete(s) diario(s) de gránulos orales de SOVALDI, según lo recetado por su proveedor de atención médica
- Tijeras (opcional)
- Agua (opcional)
| Paso 1: Sostenga el paquete de gránulos orales de SOVALDI con la línea de corte hacia arriba (vea Figura G). | Paso 2: Agite suavemente el paquete para que los gránulos se asienten en el fondo del paquete (vea Figura H). | |
| Figura G | Figura H |
Paso 3: Corte el paquete a lo largo de la línea de corte con tijeras (vea Figura I), o doble el paquete hacia atrás en la línea de desgarro (vea Figura J) y desgarre (vea Figura K).
Paso 4: Vierta el contenido completo del paquete de gránulos orales de SOVALDI directamente en la boca y tráguelo sin masticar para evitar un sabor amargo (vea Figura L). Se puede tomar agua después de tragar los gránulos, si es necesario. Asegúrese de que no queden gránulos orales de SOVALDI en el paquete. Si su proveedor de atención médica le recetó más de un paquete de gránulos orales de SOVALDI, repita los pasos 1 al 4.
Almacenamiento de los gránulos orales de SOVALDI
- Almacene los gránulos de SOVALDI a menos de 86 °F (30 °C).
- Mantenga los gránulos orales de SOVALDI y todos los medicamentos fuera del alcance de los niños.
Desecho de los gránulos orales de SOVALDI
- Deseche cualquier porción sin usar. No almacene ni reutilice ningún resto de la mezcla de SOVALDI (gránulos mezclados con alimentos).
Para obtener más información, llame al 1-800-445-3235 o visite www.SOVALDI.com.
Fabricado para y distribuido por: Gilead Sciences, Inc., Foster City, CA 94404
SOVALDI es una marca comercial de Gilead Sciences, Inc., o sus empresas relacionadas.
© 2024 Gilead Sciences, Inc. Todos los derechos reservados.
204671-GS-011
Estas instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de EE. UU.
Emitido: marzo de 2020
ETIQUETA PRINCIPAL DEL ENVASE – Frasco de tabletas de 400 mg
NDC 61958-1501-1
28 comprimidos
Sovaldi®
(sofosbuvir) comprimidos
400 mg
Tome 1 comprimido una vez al día
Nota para el farmacéutico:
No cubra el recuadro de ALERTA con la etiqueta de la farmacia.
ALERTA: Infórmese sobre los medicamentos que
NO se deben tomar con Sovaldi
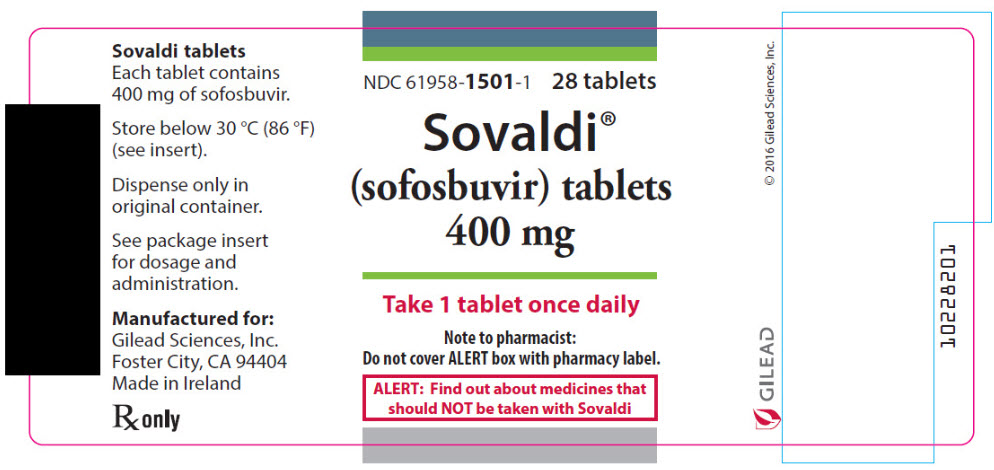

PRINCIPAL PANEL DE PRESENTACIÓN – Botella de comprimidos de 200 mg
NDC 61958-1503-1
28 comprimidos
Sovaldi®
(sofosbuvir) comprimidos
200 mg
Tome 1 comprimido una vez al día
Nota para el farmacéutico:
No cubra el recuadro de ALERTA con la etiqueta de la farmacia.
ALERTA: Infórmese sobre los medicamentos que
NO se deben tomar con Sovaldi

PRINCIPAL PANEL DE PRESENTACIÓN – Cartón de 150 mg de paquete de gránulos
NDC 61958-1504-1
28 sobres
Sovaldi®
(sofosbuvir) gránulos orales
150 mg por sobre
Rx solamente
Nota para el farmacéutico: No cubra el recuadro de ALERTA con la etiqueta de la farmacia.
ALERTA: Infórmese sobre los medicamentos que NO se deben tomar con Sovaldi

PRINCIPAL PANEL DE PRESENTACIÓN – Cartón de 200 mg de comprimidos
NDC 61958-1505-1
28 sobres
Sovaldi®
(sofosbuvir) gránulos orales
200 mg por sobre
Rx solamente
Nota para el farmacéutico: No cubrir el recuadro de ALERTA con la etiqueta de la farmacia.
ALERTA: Infórmese sobre los medicamentos que NO se deben tomar con Sovaldi