Fabricante de medicamentos: Dr. Reddys Laboratories Inc. (Updated: 2021-12-20)
ASPECTOS DESTACADOS DE INFORMACIÓN DE PRESCRIPCIÓN
Tabletas de SAPROPTERIN DIHYDROCHLORIDE, para uso oral
Polvo de SAPROPTERIN DIHYDROCHLORIDE para solución oral
Aprobación inicial en EE. UU.: 2007
CAMBIOS IMPORTANTES RECIENTES
Advertencias y Precauciones
Inflamación de la Mucosa Gastrointestinal Superior (5.2) 12/2019
INDICACIONES Y USO
Sapropterin dihydrochloride es un activador de fenilalanina hidroxilasa indicado para reducir los niveles de fenilalanina (Phe) en sangre en pacientes adultos y pediátricos de un mes de edad o más con hiperfenilalaninemia (HPA) debido a fenilcetonuria (PKU) sensible a tetrahidrobiopterina (BH4). Sapropterin dihydrochloride debe usarse junto con una dieta restringida en Phe. (1)
DOSIS Y ADMINISTRACIÓN
Todos los pacientes con PKU que estén siendo tratados con sapropterin dihydrochloride también deben ser tratados con una dieta restringida en Phe, incluida la restricción de proteínas y Phe en la dieta. (2.1)
Dosis inicial
- Pacientes pediátricos de 1 mes a 6 años: La dosis inicial recomendada de sapropterin dihydrochloride es de 10 mg/kg tomada una vez al día. (2.1)
- Pacientes de 7 años o más: La dosis inicial recomendada de sapropterin dihydrochloride es de 10 a 20 mg/kg tomada una vez al día. (2.1)
Ajuste de dosis
- Las dosis de sapropterin dihydrochloride pueden ajustarse en el rango de 5 a 20 mg/kg tomadas una vez al día. (2.1)
- Monitorear la Phe en sangre regularmente, especialmente en pacientes pediátricos. (2.1, 5.3)
Preparación y administración
- Tomar con una comida. (2.2)
- Tragar las tabletas enteras o después de mezclar en una pequeña cantidad de alimentos blandos o disolver en el líquido recomendado. Tragar la solución oral después de mezclar el polvo en una pequeña cantidad de alimentos blandos o disolver en los líquidos recomendados. Ver la información completa de prescripción para obtener información completa sobre la mezcla con alimentos o líquidos. (2.2)
FORMAS FARMACÉUTICAS Y CONCENTRACIONES
- Tabletas: 100 mg de sapropterin dihydrochloride. (3)
- Polvo para solución oral: 100 mg y 500 mg de sapropterin dihydrochloride. (3)
CONTRAINDICACIONES
Ninguna. (4)
ADVERTENCIAS Y PRECAUCIONES
-
Reacciones de hipersensibilidad, incluida anafilaxia: No se recomienda sapropterin dihydrochloride en pacientes con antecedentes de anafilaxia a
sapropterin dihydrochloride; interrumpir el tratamiento en pacientes que experimenten anafilaxia e iniciar el tratamiento médico adecuado.
Continuar con las restricciones dietéticas de Phe. (5.1)
-
Inflamación de la Mucosa Gastrointestinal Superior: Monitorear a los pacientes en busca de signos y síntomas de estas afecciones, incluidas esofagitis y gastritis. (5.2)
-
Hipofenilalaninemia: Los pacientes pediátricos menores de 7 años tratados con dosis de sapropterin dihydrochloride de 20 mg/kg por día tienen un mayor riesgo de niveles bajos de Phe en sangre en comparación con los pacientes de 7 años o más. (5.3)
-
Monitorización de los niveles de Phe en sangre durante el tratamiento: Asegurar un control adecuado de Phe en sangre y un equilibrio nutricional durante el tratamiento con sapropterin dihydrochloride. Se recomienda una monitorización frecuente de la sangre, especialmente en pacientes pediátricos. (5.4, 2.1)
-
Falta de respuesta bioquímica al tratamiento con sapropterin dihydrochloride: La respuesta al tratamiento con sapropterin dihydrochloride no se puede predeterminar mediante pruebas de laboratorio (p. ej., moleculares) y solo se puede determinar mediante un ensayo terapéutico de sapropterin dihydrochloride. (5.5, 2.1)
REACCIONES ADVERSAS
Las reacciones adversas más comunes (≥4%) son: dolor de cabeza, rinorrea, dolor faringolaríngeo, diarrea, vómitos, tos y congestión nasal. (6.1)
Para informar REACCIONES ADVERSAS SOSPECHADAS, comuníquese al 1-800-983-4587 o a la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES FARMACOLÓGICAS
-
Inhibidores de la síntesis de folato (por ejemplo, metotrexato, ácido valproico, fenobarbital, trimetoprima): Pueden disminuir los niveles endógenos de BH4; monitorear los niveles de Phe en sangre con mayor frecuencia y ajustar la dosis de sapropterin dihydrochloride según sea necesario. (7)
-
Medicamentos que afectan la vasodilatación mediada por óxido nítrico (por ejemplo, inhibidores de PDE-5): Potencial de vasodilatación; monitorear la presión arterial. (7)
Ver sección 17 para INFORMACIÓN DE ORIENTACIÓN AL PACIENTE y etiquetado para el paciente aprobado por la FDA.
Revisado: 9/2020
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
2 DOSIS Y ADMINISTRACIÓN
2.1 Dosis
2.2 Instrucciones de Preparación
y Administración
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de Hipersensibilidad Incluyendo Anafilaxia
5.2 Inflamación de la Mucosa Gastrointestinal Superior
5.3 Hipofenilalaninemia
5.4 Monitoreo de los Niveles de Phe en Sangre Durante el Tratamiento
5.5 Falta de Respuesta Bioquímica a Sapropterin Dihydrochloride
5.6 Interacción
con Levodopa
5.7 Hiperactividad
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Poscomercialización
7 INTERACCIONES MEDICAMENTOSAS
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinámica
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14 ESTUDIOS CLÍNICOS
16 PRESENTACIÓN/ALMACENAMIENTO Y MANIPULACIÓN
17 INFORMACIÓN DE ASESORAMIENTO PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
1 INDICACIONES Y USO
Los comprimidos de sapropterin dihydrochloride están indicados para reducir los niveles de fenilalanina (Phe) en sangre en pacientes adultos y pediátricos de un mes de edad y mayores con hiperfenilalaninemia (HPA) debido a fenilcetonuria (PKU) que responde a tetrahidrobiopterina (BH4). Sapropterin dihydrochloride se debe usar junto con una dieta restringida en Phe.
2 POSOLOGÍA Y ADMINISTRACIÓN
2.1 Posología
El tratamiento con dihidrocloruro de sapropterina debe estar dirigido por médicos con conocimientos en el manejo de la PKU.
Todos los pacientes con PKU que están siendo tratados con dihidrocloruro de sapropterina también deben ser tratados con una dieta restringida en Phe, incluida la restricción de proteínas y Phe en la dieta.
Dosis inicial
Pacientes pediátricos de 1 mes a 6 años: La dosis inicial recomendada de dihidrocloruro de sapropterina es de 10 mg/kg tomada una vez al día.
Pacientes de 7 años en adelante: La dosis inicial recomendada de dihidrocloruro de sapropterina es de 10 a 20 mg/kg tomada una vez al día.
Ajuste de dosis (período de evaluación)
La ingesta existente de proteínas y Phe en la dieta no debe modificarse durante el período de evaluación.
Si se usa una dosis inicial de 10 mg/kg por día, la respuesta al tratamiento se determina por el cambio en la Phe en sangre después del tratamiento con dihidrocloruro de sapropterina a 10 mg/kg por día durante un período de hasta 1 mes. Los niveles de Phe en sangre deben controlarse después de 1 semana de tratamiento con dihidrocloruro de sapropterina y periódicamente durante hasta un mes. Si la Phe en sangre no disminuye desde el inicio con 10 mg/kg por día, la dosis puede aumentarse a 20 mg/kg por día. Los pacientes cuya Phe en sangre no disminuye después de 1 mes de tratamiento a 20 mg/kg por día no muestran una respuesta bioquímica y el tratamiento con dihidrocloruro de sapropterina debe discontinuarse en estos pacientes.
Si se usa una dosis inicial de 20 mg/kg por día, la respuesta al tratamiento se determina por el cambio en la Phe en sangre después del tratamiento con dihidrocloruro de sapropterina a 20 mg/kg por día durante un período de 1 mes. Los niveles de Phe en sangre deben controlarse después de 1 semana de tratamiento con dihidrocloruro de sapropterina y periódicamente durante el primer mes. El tratamiento debe suspenderse en pacientes que no muestran una respuesta bioquímica (la Phe en sangre no disminuye) después de 1 mes de tratamiento a 20 mg/kg por día [ver Advertencias y precauciones (5.4)].
Una vez que se ha establecido la capacidad de respuesta al dihidrocloruro de sapropterina, la dosis puede ajustarse dentro del rango de 5 a 20 mg/kg por día de acuerdo con la respuesta bioquímica al tratamiento (Phe en sangre). Se recomienda la monitorización periódica de la Phe en sangre para evaluar el control de la Phe en sangre, especialmente en pacientes pediátricos [ver Advertencias y precauciones (5.3)].
2.2 Instrucciones de preparación y administración
Tome los comprimidos de dihidrocloruro de sapropterina por vía oral con una comida, preferiblemente a la misma hora todos los días [ver Farmacología clínica (12.3)]. Si se olvida una dosis, se debe tomar lo antes posible, pero no se deben tomar dos dosis el mismo día.
Comprimidos de dihidrocloruro de sapropterina
Los comprimidos de dihidrocloruro de sapropterina se pueden tragar enteros o disueltos en 120 a 240 ml de agua o jugo de manzana y tomarse por vía oral dentro de los 15 minutos posteriores a la disolución. Puede llevar unos minutos que los comprimidos se disuelvan. Para que los comprimidos se disuelvan más rápido, se pueden revolver o triturar. Es posible que los comprimidos no se disuelvan por completo. Los pacientes pueden ver pequeños trozos flotando en la parte superior del agua o del jugo de manzana. Esto es normal y seguro para que los pacientes lo traguen. Si después de beber el medicamento los pacientes aún ven trozos del comprimido en el recipiente, se puede agregar más agua o jugo de manzana para asegurarse de que se consuma todo el medicamento. Los comprimidos de dihidrocloruro de sapropterina también se pueden triturar y luego mezclar en una pequeña cantidad de alimentos blandos, como puré de manzana o pudín.
Polvo de dihidrocloruro de sapropterina para solución oral
Pacientes que pesan más de 10 kg
El polvo de dihidrocloruro de sapropterina para solución oral debe disolverse en 120 a 240 ml de agua o jugo de manzana y tomarse por vía oral dentro de los 30 minutos posteriores a la disolución. El polvo de dihidrocloruro de sapropterina para solución oral también se puede revolver en una pequeña cantidad de alimentos blandos, como puré de manzana o pudín. Vacíe el contenido del(los) sobre(s) en agua, jugo de manzana o una pequeña cantidad de alimentos blandos y mezcle bien. El polvo debe disolverse por completo.
Pacientes que pesan 10 kg o menos (usar sobres de 100 mg)
Para los bebés que pesan 10 kg o menos, el polvo de dihidrocloruro de sapropterina para solución oral se puede disolver en tan solo 5 ml de agua o jugo de manzana y una porción de esta solución correspondiente a una dosis de 10 mg/kg se puede administrar por vía oral mediante una jeringa de dosificación oral. La Tabla 1 proporciona información de dosificación para bebés con la dosis inicial recomendada de 10 mg/kg por día. Consulte la Tabla 2 para obtener información sobre la dosificación a 20 mg/kg por día si se necesita un ajuste de la dosis.
Tabla 1: Tabla de dosificación de 10 mg/kg por día para bebés que pesan 10 kg o menos
| Peso del paciente (kg) | Dosis inicial: 10 mg/kg por día* | |||
| Dosis (mg) | Polvo de dihidrocloruro de sapropterina para solución oralSobres de 100 mgdisueltos† | Volumen de dilución (ml)‡ | Volumen de dosis administrada (ml)§ | |
| 1 | 10 | 1 | 10 | 1 |
| 2 | 20 | 1 | 10 | 2 |
| 3 | 30 | 1 | 10 | 3 |
| 4 | 40 | 1 | 10 | 4 |
| 5 | 50 | 1 | 10 | 5 |
| 6 | 60 | 1 | 5 | 3 |
| 7 | 70 | 1 | 5 | 3.5 |
| 8 | 80 | 1 | 5 | 4 |
| 9 | 90 | 1 | 5 | 4.5 |
| 10 | 100 | 1 | 5 | 5 |
*La dosis inicial para bebés es de 10 mg/kg por día. La información de dosificación para 20 mg/kg por día se proporciona en la Tabla 2.
†Polvo para solución oral proporcionado en sobres de un solo uso que contienen 100 mg de dihidrocloruro de sapropterina por sobre.
‡Volumen de agua o jugo de manzana para disolver el polvo de dihidrocloruro de sapropterina para solución oral.
§Deseche el resto de la mezcla después de extraer el volumen a administrar.
Tabla 2: Tabla de dosificación de 20 mg/kg por día para bebés que pesan 10 kg o menos
| Peso del paciente (kg) | 20 mg/kg por día | |||
| Dosis (mg) | Polvo de dihidrocloruro de sapropterina para solución oral Sobres de 100 mg*disueltos | Volumen de dilución (ml)† | Volumen de dosis administrada (ml)§ | |
| 1 | 20 | 1 | 5 | 1 |
| 2 | 40 | 1 | 5 | 2 |
| 3 | 60 | 1 | 5 | 3 |
| 4 | 80 | 1 | 5 | 4 |
| 5 | 100 | 1 | 5 | 5 |
| 6 | 120 | 2 | 5 | 3 |
| 7 | 140 | 2 | 5 | 3.5 |
| 8 | 160 | 2 | 5 | 4 |
| 9 | 180 | 2 | 5 | 4.5 |
| 10 | 200 | 2 | 5 | 5 |
*Polvo para solución oral proporcionado en sobres de un solo uso que contienen 100 mg de dihidrocloruro de sapropterina por sobre.
†Volumen de agua o jugo de manzana para disolver el polvo de dihidrocloruro de sapropterina para solución oral.
§Deseche el resto de la mezcla después de extraer el volumen a administrar.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Los comprimidos de sapropterin dihydrochloride son para uso oral. Cada comprimido contiene 100 mg de sapropterin dihydrochloride. Los comprimidos son redondos, de color blanco a amarillo claro, moteados y grabados con “177”.
El polvo de sapropterin dihydrochloride para solución oral está disponible en un paquete de dosis unitaria que contiene 100 mg de sapropterin dihydrochloride y en un paquete de dosis unitaria que contiene 500 mg de sapropterin dihydrochloride. El polvo es de color blanco a amarillo.
4 CONTRAINDICACIONES
Ninguna.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de hipersensibilidad incluyendo anafilaxia
Sapropterin dihydrochloride no está recomendado en pacientes con antecedentes de anafilaxia a sapropterin dihydrochloride. Han ocurrido reacciones de hipersensibilidad, incluyendo anafilaxia y erupción [ver Reacciones adversas (6.2)]. Los signos de anafilaxia incluyen sibilancias, disnea, tos, hipotensión, rubor, náuseas y erupción. Discontinuar el tratamiento con sapropterin dihydrochloride en pacientes que experimenten anafilaxia e iniciar un tratamiento médico apropiado. Continuar con la restricción dietética de proteínas y Phe en pacientes que experimenten anafilaxia.
5.2 Inflamación de la mucosa gastrointestinal superior
Se han reportado reacciones adversas gastrointestinales (GI) sugestivas de inflamación de la mucosa GI superior con sapropterin dihydrochloride. Las reacciones adversas graves incluyeron esofagitis y gastritis [ver Reacciones adversas (6.2)]. Si no se tratan, estas podrían conducir a secuelas graves, incluyendo estenosis esofágica, úlcera esofágica, úlcera gástrica y sangrado, y dichas complicaciones se han reportado en pacientes que reciben sapropterin dihydrochloride. Monitorear a los pacientes para detectar signos y síntomas de inflamación de la mucosa GI superior.
5.3 Hipofenilalaninemia
En ensayos clínicos de sapropterin dihydrochloride, algunos pacientes con PKU experimentaron hipofenilalaninemia (niveles bajos de Phe en sangre) durante el tratamiento con sapropterin dihydrochloride. En un estudio clínico de pacientes pediátricos menores de 7 años tratados con sapropterin dihydrochloride 20 mg/kg por día, la incidencia de hipofenilalaninemia fue mayor que en ensayos clínicos de pacientes mayores [ver Reacciones adversas (6.1)].
5.4 Monitoreo de los niveles de Phe en sangre durante el tratamiento
Las elevaciones prolongadas de los niveles de Phe en sangre en pacientes con PKU pueden resultar en daño neurológico grave, incluyendo discapacidad intelectual severa, retraso del desarrollo, microcefalia, retraso del habla, convulsiones y anomalías de comportamiento. Por el contrario, los niveles prolongados de Phe en sangre que son demasiado bajos se han asociado con catabolismo y degradación de proteínas endógenas, lo que se ha asociado con resultados adversos del desarrollo. Se requiere un manejo activo de la ingesta dietética de Phe mientras se toma sapropterin dihydrochloride para garantizar un control adecuado del nivel de Phe y un equilibrio nutricional. Monitorear los niveles de Phe en sangre durante el tratamiento para garantizar un control adecuado del nivel de Phe en sangre. Se recomienda un monitoreo frecuente de la sangre en la población pediátrica [ver Dosificación y administración (2.1)].
5.5 Falta de respuesta bioquímica a sapropterin dihydrochloride
Algunos pacientes con PKU no muestran una respuesta bioquímica (reducción de Phe en sangre) con el tratamiento con sapropterin dihydrochloride. En dos ensayos clínicos con una dosis de sapropterin dihydrochloride de 20 mg/kg por día, del 56% al 75% de los pacientes pediátricos con PKU mostraron una respuesta bioquímica a sapropterin dihydrochloride, y en un ensayo clínico con una dosis de 10 mg/kg por día, el 20% de los pacientes adultos y pediátricos con PKU mostraron una respuesta bioquímica a sapropterin dihydrochloride [ver Estudios clínicos (14)].
En general, la respuesta bioquímica al tratamiento con sapropterin dihydrochloride no se puede predeterminar mediante pruebas de laboratorio (por ejemplo, pruebas moleculares) y debe determinarse mediante un ensayo terapéutico (evaluación) de la respuesta a sapropterin dihydrochloride [ver Dosificación y administración (2.1)].
5.6 Interacción con levodopa
En un programa de vigilancia de seguridad poscomercialización de 10 años para una indicación no relacionada con PKU utilizando otro producto de sapropterin, 3 pacientes con trastornos neurológicos subyacentes experimentaron convulsiones, exacerbación de convulsiones, sobreestimulación e irritabilidad durante la coadministración de levodopa y sapropterin. Monitorear a los pacientes que están recibiendo levodopa para detectar cambios en el estado neurológico durante el tratamiento con sapropterin dihydrochloride [ver Interacciones farmacológicas (7)].
5.7 Hiperactividad
En el programa de vigilancia de seguridad poscomercialización de sapropterin dihydrochloride, 2 pacientes con PKU experimentaron hiperactividad cuando fueron tratados con sapropterin dihydrochloride [ver Reacciones adversas (6.2)]. Monitorear a los pacientes para detectar hiperactividad.
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
Debido a que los ensayos clínicos se realizan bajo condiciones ampliamente variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no pueden compararse directamente con las tasas de los ensayos clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica clínica.
Estudios Clínicos de PKU
La seguridad del diclorhidrato de sapropterina se evaluó en 7 estudios clínicos en pacientes con PKU (de 1 mes a 50 años de edad) [ver Estudios Clínicos (14)].
En los Estudios 1 a 4 (estudios controlados y no controlados), 579 pacientes con PKU de 4 a 49 años de edad recibieron diclorhidrato de sapropterina en dosis que oscilaron entre 5 y 20 mg/kg por día durante períodos de tratamiento que oscilaron entre 1 y 164 semanas. La población de pacientes se distribuyó uniformemente en cuanto al género y aproximadamente el 95% de los pacientes eran caucásicos. Las reacciones adversas más comunes (≥4% de los pacientes) fueron dolor de cabeza, rinorrea, dolor faringolaríngeo, diarrea, vómitos, tos y congestión nasal.
Los datos descritos en la Tabla 3 reflejan la exposición de 74 pacientes con PKU al diclorhidrato de sapropterina en dosis de 10 a 20 mg/kg por día durante 6 a 10 semanas en dos ensayos clínicos doble ciego, controlados con placebo (Estudios 2 y 4).
La Tabla 3 enumera las reacciones adversas que ocurrieron en al menos el 4% de los pacientes tratados con diclorhidrato de sapropterina en los ensayos clínicos doble ciego, controlados con placebo descritos anteriormente.
Tabla 3: Resumen de las Reacciones Adversas que Ocurrieron en ≥4% de los Pacientes en Estudios Clínicos Controlados con Placebo con Diclorhidrato de Sapropterina
|
Término Preferido de MedDRA |
Tratamiento |
|
|
Diclorhidrato de Sapropterina (N=74) |
Placebo (N=59) |
|
|
No. Pacientes (%) |
No. Pacientes (%) |
|
|
Dolor de cabeza |
11 (15) |
8 (14) |
|
Rinorrea |
8 (11) |
0 |
|
Dolor faringolaríngeo |
7(10) |
1 (2) |
|
Diarrea |
6 (8) |
3 (5) |
|
Vómitos |
6 (8) |
4 (7) |
|
Tos |
5 (7) |
3 (5) |
|
Congestión nasal |
3 (4) |
0 |
En ensayos clínicos abiertos no controlados (Estudios 1 y 3), todos los pacientes recibieron diclorhidrato de sapropterina en dosis de 5 a 20 mg/kg por día y las reacciones adversas fueron similares en tipo y frecuencia a las reportadas en los ensayos clínicos doble ciego controlados con placebo [ver Estudios Clínicos (14)].
En el Estudio 5, 65 pacientes pediátricos con PKU de 1 mes a 6 años de edad recibieron 20 mg/kg por día de diclorhidrato de sapropterina durante 6 meses. Las reacciones adversas en estos pacientes fueron similares en frecuencia y tipo a las observadas en otros ensayos clínicos con diclorhidrato de sapropterina, excepto por una mayor incidencia de niveles bajos de Phe. El veinticinco por ciento (16 de 65) de los pacientes desarrollaron niveles de Phe por debajo de lo normal para la edad [ver Advertencias y Precauciones (5.3), Uso Pediátrico (8.4) y Estudios Clínicos (14)].
En el Estudio 6, un estudio de extensión abierto a largo plazo de 111 pacientes de 4 a 50 años de edad que recibieron diclorhidrato de sapropterina en dosis que oscilaron entre 5 y 20 mg/kg por día, las reacciones adversas fueron similares en tipo y frecuencia a las reportadas en los estudios clínicos previos. Cincuenta y cinco pacientes recibieron diclorhidrato de sapropterina tanto en tabletas disueltas como intactas. No hubo diferencias notables en la incidencia o gravedad de las reacciones adversas entre los dos métodos de administración. La exposición media (± DE) a sapropterina para toda la población del estudio fue de 659 ± 221 días (máximo 953 días).
En el Estudio 7, 27 pacientes pediátricos con PKU de 0 a 4 años de edad recibieron 10 mg/kg por día o 20 mg/kg por día de diclorhidrato de sapropterina. Las reacciones adversas fueron similares en tipo y frecuencia a las observadas en otros ensayos clínicos, con la adición de rinitis, que se reportó en 2 sujetos (7,4%).
Experiencia de Seguridad de Estudios Clínicos para Indicaciones No Relacionadas con PKU
Aproximadamente 800 sujetos sanos y pacientes con trastornos distintos de PKU, algunos de los cuales tenían trastornos neurológicos o enfermedad cardiovascular subyacentes, han recibido una formulación diferente del mismo ingrediente activo (sapropterina) en aproximadamente 19 ensayos clínicos controlados y no controlados. En estos ensayos clínicos, a los sujetos se les administró sapropterina en dosis que oscilaban entre 1 y 100 mg/kg por día durante períodos de exposición de 1 día a 2 años. Las reacciones adversas graves y severas (independientemente de la causalidad) durante la administración de sapropterina fueron convulsiones, exacerbación de convulsiones [ver Advertencias y precauciones (5.3)], mareos, hemorragia gastrointestinal, hemorragia postoperatoria, dolor de cabeza, irritabilidad, infarto de miocardio, sobreestimulación e insuficiencia respiratoria. Las reacciones adversas comunes fueron dolor de cabeza, edema periférico, artralgia, poliuria, agitación, mareos, náuseas, faringitis, dolor abdominal, dolor abdominal superior e infección del tracto respiratorio superior.
6.2 Experiencia poscomercialización
Las siguientes reacciones adversas se han informado durante el uso posterior a la aprobación del diclorhidrato de sapropterina. Debido a que estas reacciones se informan voluntariamente a partir de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Reacciones de hipersensibilidad, incluidas anafilaxia y erupción cutánea: La mayoría de las reacciones de hipersensibilidad ocurrieron dentro de varios días después de iniciar el tratamiento [ver Advertencias y precauciones (5.1)].
Reacciones gastrointestinales: esofagitis, gastritis, dolor orofaríngeo, faringitis, dolor esofágico, dolor abdominal, dispepsia, náuseas y vómitos [ver Advertencias y precauciones (5.2)].
Hiperactividad: Se han informado dos casos. En un caso, el paciente recibió una sobredosis accidental de diclorhidrato de sapropterina [ver Advertencias y precauciones (5.6), Sobredosis (10)].
7 INTERACCIONES MEDICAMENTOSAS
La Tabla 4 incluye medicamentos con interacciones farmacológicas clínicamente importantes cuando se administran con sapropterin dihydrochloride e instrucciones para prevenirlos o manejarlos.
Tabla 4: Interacciones Medicamentosas Clínicamente Relevantes
| Levodopa | |
| Impacto Clínico | Sapropterin dihydrochloride puede aumentar la disponibilidad de tirosina, un precursor de levodopa. Se han reportado eventos neurológicos post-comercialización en pacientes que recibieron sapropterin y levodopa concomitantemente para una indicación no PKU [ver Advertencias y Precauciones (5.5)] |
| Intervención | Monitorear a los pacientes por un cambio en el estado neurológico. |
| Inhibidores de la Síntesis de Folato (por ejemplo, metotrexato, ácido valproico, fenobarbital, trimetoprima) | |
| Impacto Clínico | Datos no clínicos in vitro e in vivo sugieren que los medicamentos que inhiben la síntesis de folato pueden disminuir la biodisponibilidad de BH4 endógena al inhibir la enzima dihidrofolato reductasa, que está involucrada en el reciclaje (regeneración) de BH4. Esta reducción en los niveles netos de BH4 puede aumentar los niveles de Phe. |
| Intervención | Considere monitorear los niveles de Phe en sangre con mayor frecuencia durante la administración concomitante. Puede ser necesario un aumento de la dosis de Sapropterin Dihydrochloride para lograr una respuesta bioquímica. |
| Medicamentos que Afectan la Vasorelajación Mediada por Óxido Nítrico (por ejemplo, inhibidores de PDE-5 como sildenafil, vardenafil o tadalafil) | |
| Impacto Clínico | Tanto sapropterin dihydrochloride como los inhibidores de PDE-5 pueden inducir vasorelajación. Podría ocurrir una reducción en la presión arterial; sin embargo, el uso combinado de estos medicamentos no ha sido evaluado en humanos. |
| Intervención | Monitorear la presión arterial. |
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Registro de exposición durante el embarazo
Se ha establecido un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a sapropterin dihydrochloride durante el embarazo. Para obtener más información sobre el programa de registro, llame al 1-800-983-4587.
Resumen de riesgos
Los datos disponibles del registro de embarazos no han informado una asociación entre sapropterin dihydrochloride y defectos congénitos importantes, aborto espontáneo o resultados adversos maternos o fetales cuando se usó sapropterin dihydrochloride durante el embarazo (ver Datos).
Un estudio de desarrollo embriofetal con sapropterin dihydrochloride en ratas que utilizó dosis orales de hasta 3 veces la dosis máxima recomendada en humanos (MRHD) administrada durante el período de organogénesis no mostró efectos. En un estudio en conejos que utilizó la administración oral de sapropterin dihydrochloride durante el período de organogénesis, se observó un defecto raro, holoprosencefalia, a 10 veces la MRHD.
Todos los embarazos tienen un riesgo basal de defectos congénitos importantes, pérdida del embarazo u otros resultados adversos del embarazo. En la población general de los EE. UU., el riesgo basal estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 al 4 % y del 15 al 20 %, respectivamente. El riesgo basal estimado de defectos congénitos importantes y aborto espontáneo en mujeres embarazadas con PKU que mantienen concentraciones de fenilalanina en sangre superiores a 600 micromol/L durante el embarazo es mayor que el riesgo basal correspondiente para mujeres embarazadas sin PKU.
Consideraciones clínicas
Riesgo materno y/o embriofetal asociado a la enfermedad
Las concentraciones de fenilalanina en sangre no controladas antes y durante el embarazo se asocian con un mayor riesgo de resultados adversos del embarazo y efectos adversos fetales. Para reducir el riesgo de efectos adversos fetales inducidos por hiperfenilalaninemia, las concentraciones de fenilalanina en sangre deben mantenerse entre 120 y 360 micromol/L durante el embarazo y durante los 3 meses previos a la concepción [ver Dosis y administración (2.1)].
Datos
Datos en humanos
PKU materna no controlada
Los datos disponibles del Estudio Colaborativo de Fenilcetonuria Materna sobre 468 embarazos y 331 nacidos vivos en mujeres afectadas por PKU demostraron que los niveles de Phe no controlados por encima de 600 micromol/L están asociados con una incidencia muy alta de anomalías neurológicas, cardíacas, de dismorfismo facial y de crecimiento. El control de la fenilalanina en sangre durante el embarazo es esencial para reducir la incidencia de efectos teratogénicos inducidos por Phe.
Datos del registro de embarazos
Los datos de 62 nacidos vivos informaron 3 anomalías al nacer (un caso cada uno de microcefalia, paladar hendido y frenillo lingual). Estos resultados se asociaron con niveles de Phe superiores a 360 micromol/L durante el embarazo.
Datos en animales
No se observaron efectos sobre el desarrollo embriofetal en un estudio de reproducción en ratas que utilizaron dosis orales de hasta 400 mg/kg por día de sapropterin dihydrochloride (aproximadamente 3 veces la MRHD de 20 mg/kg por día, según el área de superficie corporal) administradas durante el período de organogénesis. Sin embargo, en un estudio de reproducción en conejos, la administración oral de una dosis máxima de 600 mg/kg por día (aproximadamente 10 veces la MRHD, según el área de superficie corporal) durante el período de organogénesis se asoció con un aumento no estadísticamente significativo en la incidencia de holoprosencefalia en dos camadas tratadas con dosis altas (4 fetos), en comparación con una camada tratada con control (1 feto).
8.2 Lactancia
Resumen de riesgos
No hay datos suficientes para evaluar la presencia de sapropterin en la leche materna y no hay datos sobre los efectos en la producción de leche. En los registros de embarazo posteriores a la comercialización, se identificó un total de 16 mujeres de ambos registros que amamantaron durante un promedio de 3.5 meses. No se informaron problemas de seguridad relacionados con la lactancia en los bebés de madres que amamantaron durante el tratamiento materno con sapropterin dihydrochloride. Sapropterin está presente en la leche de ratas lactantes después de la administración intravenosa, pero no después de la administración oral.
Se deben considerar los beneficios para el desarrollo y la salud de la lactancia materna junto con la necesidad clínica de la madre de sapropterin dihydrochloride y cualquier posible efecto adverso en el niño amamantado por sapropterin dihydrochloride o por la afección materna subyacente.
8.4 Uso pediátrico
Pacientes pediátricos con PKU, de 1 mes a 16 años, han sido tratados con sapropterin dihydrochloride en ensayos clínicos [ver Estudios clínicos (14)].
La eficacia y seguridad de sapropterin dihydrochloride no se han establecido en recién nacidos. La seguridad de sapropterin dihydrochloride se ha establecido en niños menores de 4 años en ensayos de 6 meses de duración y en niños de 4 años o más en ensayos de hasta 3 años de duración [ver Reacciones adversas (6.1)].
En niños de 1 mes o más, la eficacia de sapropterin dihydrochloride se ha demostrado en ensayos de 6 semanas o menos de duración [ver Estudios clínicos (14)].
En un estudio multicéntrico, abierto, de un solo brazo, 57 pacientes de 1 mes a 6 años que se definieron como respondedores a sapropterin dihydrochloride después de 4 semanas de tratamiento con sapropterin dihydrochloride y restricción dietética de Phe fueron tratados durante 6 meses con sapropterin dihydrochloride a 20 mg/kg por día. La efectividad de sapropterin dihydrochloride solo en la reducción de los niveles de Phe en sangre más allá de las 4 semanas no se pudo determinar debido a los cambios concurrentes en la ingesta dietética de Phe durante el estudio. Los valores medios (±DE) de Phe en sangre a lo largo del tiempo para pacientes de 1 mes a <2 años y de 2 a <7 años se muestran en la Figura 1.
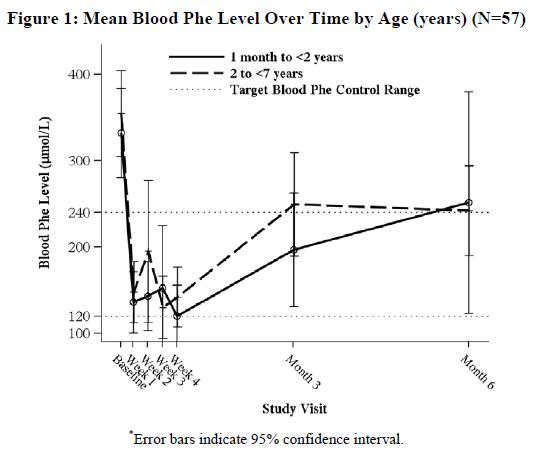
8.5 Uso geriátrico
Los estudios clínicos de sapropterin dihydrochloride en pacientes con PKU no incluyeron pacientes de 65 años o más. Se desconoce si estos pacientes responden de manera diferente a los pacientes más jóvenes.
10 SOBREDOSIS
Se han reportado dos sobredosis no intencionales con sapropterina dihidrocloruro. Un paciente adulto en un ensayo clínico de sapropterina dihidrocloruro recibió una dosis única de sapropterina dihidrocloruro de 4,500 mg (36 mg/kg) en lugar de 2,600 mg (20 mg/kg). El paciente reportó un leve dolor de cabeza y mareo inmediatamente después de tomar la dosis; ambos síntomas se resolvieron dentro de 1 hora sin intervención del tratamiento. No hubo anormalidades asociadas en las pruebas de laboratorio. El paciente suspendió la terapia durante 24 horas y luego reinició la sapropterina dihidrocloruro sin reportes de signos o síntomas anormales. En poscomercialización, un paciente pediátrico recibió dosis de sapropterina dihidrocloruro de 45 mg/kg por día en lugar de 20 mg/kg por día. El paciente reportó hiperactividad que comenzó en un momento no especificado después de la sobredosis y se resolvió después de que la dosis de sapropterina dihidrocloruro se redujo a 20 mg/kg por día.
En un estudio clínico para evaluar los efectos de la sapropterina dihidrocloruro sobre la repolarización cardíaca, se administró una dosis única supraterapéutica de 100 mg/kg (5 veces la dosis máxima recomendada) a 54 adultos sanos. No se reportaron reacciones adversas graves durante el estudio. Las únicas reacciones adversas reportadas en más de 1 sujeto que recibió la dosis supraterapéutica fueron dolor abdominal superior (6%) y mareos (4%). Se observó un acortamiento dependiente de la dosis del intervalo QT [ver Farmacología Clínica (12.2)].
Se debe aconsejar a los pacientes que notifiquen a sus médicos en casos de sobredosis.
11 DESCRIPCIÓN
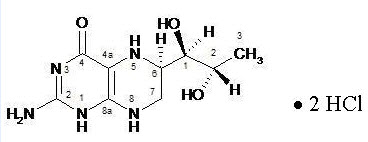
Sapropterin dihydrochloride tabletas es un activador de la fenilalanina hidroxilasa (o activador de PAH) administrado por vía oral. Sapropterin dihydrochloride, el ingrediente farmacéutico activo en las tabletas de sapropterin dihydrochloride y en el polvo de sapropterin dehydrochloride para solución oral, es una preparación sintética de la sal dihidrocloruro de la tetrahidrobiopterina natural (BH4). Sapropterin dihydrochloride son cristales o polvo cristalino de color blanquecino a amarillo claro.
El nombre químico de sapropterin dihydrochloride es (6R)-2-amino-6-[(1R,2S)-1,2-dihidroxipropil]-5,6,7,8-tetrahidro-4(1H)-pteridinona dihidrocloruro y su fórmula molecular es C9H15N5O3·2HCl con un peso molecular de 314.17.
Sapropterin dihydrochloride tiene la siguiente fórmula estructural:
Sapropterin dihydrochloride se suministra en tabletas y polvo para solución oral que contienen 100 mg de sapropterin dihydrochloride (equivalente a 76.8 mg de base de sapropterina). Sapropterin dihydrochloride también se suministra como polvo para solución oral que contiene 500 mg de sapropterin dihydrochloride (equivalente a 384 mg de base de sapropterina).
Las tabletas son redondas, de color blanquecino a amarillo claro, con manchas y grabadas con “177”. Cada tableta contiene los siguientes ingredientes inactivos: ácido ascórbico (USP), crospovidona (NF), fosfato de calcio dibásico (USP), D-manitol (USP), riboflavina (USP) y fumarato de estearilo sódico (NF).
El polvo de sapropterin dihydrochloride para solución oral es de color blanquecino a amarillo. Cada paquete de dosis unitaria contiene los siguientes ingredientes inactivos: ácido ascórbico (USP), D-manitol (USP), citrato de potasio (USP) y sucralosa (NF).
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
El dihidrocloruro de sapropterina es una forma sintética de BH4, el cofactor de la enzima fenilalanina hidroxilasa (PAH). La PAH hidroxila la Phe a través de una reacción oxidativa para formar tirosina. En pacientes con PKU, la actividad de la PAH está ausente o es deficiente. El tratamiento con BH4 puede activar la actividad residual de la enzima PAH, mejorar el metabolismo oxidativo normal de la Phe y disminuir los niveles de Phe en algunos pacientes.
12.2 Farmacodinámica
En pacientes con PKU que responden al tratamiento con BH4, los niveles de Phe en sangre disminuyen dentro de las 24 horas posteriores a una sola administración de dihidrocloruro de sapropterina, aunque el efecto máximo sobre el nivel de Phe puede tardar hasta un mes, dependiendo del paciente. Una sola dosis diaria de dihidrocloruro de sapropterina es adecuada para mantener niveles estables de Phe en sangre durante un período de 24 horas. Se evaluaron doce pacientes con niveles de Phe en sangre que oscilaban entre 516 y 986 micromol/L (media 747 ± 153 micromol/L) con monitorización de los niveles de Phe en sangre durante 24 horas después de una dosis matutina diaria de 10 mg/kg por día. El nivel de Phe en sangre se mantuvo estable durante un período de observación de 24 horas. No se observaron aumentos sustanciales en los niveles de Phe en sangre después de la ingesta de alimentos durante todo el período de 24 horas.
La relación dosis-respuesta del dihidrocloruro de sapropterina se estudió en un estudio abierto de titulación forzada a dosis de 5 mg/kg por día, luego 20 mg/kg por día y luego 10 mg/kg por día (Estudio 3) [ver Estudios clínicos (14.1)]. Los niveles individuales de Phe en sangre fueron muy variables entre los pacientes. El nivel medio de Phe en sangre observado al final de cada período de dosificación de 2 semanas disminuyó a medida que aumentó la dosis de dihidrocloruro de sapropterina, lo que demuestra una relación inversa entre la dosis de dihidrocloruro de sapropterina y los niveles medios de Phe en sangre.
Electrofisiología cardíaca
Se realizó un estudio exhaustivo de QTc en 56 adultos sanos. Este estudio cruzado aleatorizado, controlado con placebo y con control activo se realizó para determinar si una sola dosis supraterapéutica (100 mg/kg) de dihidrocloruro de sapropterina o una sola dosis terapéutica (20 mg/kg) de dihidrocloruro de sapropterina tenían un efecto sobre la repolarización cardíaca. En este estudio, el dihidrocloruro de sapropterina se administró después de disolver los comprimidos en agua en condiciones posprandiales. Este estudio demostró un acortamiento del intervalo QT dependiente de la dosis. El cambio medio máximo con respecto al valor inicial del intervalo QTc con sustracción de placebo fue -3,69 y -8,32 ms (límite inferior del IC del 90%: -5,3 y -10,6 ms) a 20 y 100 mg/kg, respectivamente.
12.3 Farmacocinética
Los estudios en sujetos sanos han demostrado una absorción comparable de sapropterina cuando los comprimidos se disuelven en agua o jugo de naranja y se toman en condiciones de ayuno. La administración de comprimidos disueltos después de una comida rica en grasas/calorías resultó en aumentos medios en Cmax del 84% y AUC del 87% (disuelto en agua). Sin embargo, hubo una amplia variabilidad en los valores individuales de los sujetos para Cmax y AUC en los diferentes modos de administración y condiciones de comida. En los ensayos clínicos de dihidrocloruro de sapropterina, el fármaco se administró por la mañana como un comprimido disuelto sin tener en cuenta las comidas. La vida media de eliminación media en pacientes con PKU fue de aproximadamente 6,7 horas (rango de 3,9 a 17 horas), comparable con los valores observados en sujetos sanos (rango de 3,0 a 5,3 horas).
Un estudio en adultos sanos con 10 mg/kg de dihidrocloruro de sapropterina demostró que la absorción a través de la administración de comprimidos intactos fue un 40% mayor que a través de la administración de comprimidos disueltos en condiciones de ayuno basándose en AUC0-t. La administración de comprimidos intactos en condiciones posprandiales resultó en un aumento de aproximadamente el 43% en la extensión de la absorción en comparación con las condiciones de ayuno basándose en AUC0-t
[ver Dosificación y administración (2.2)].
El análisis farmacocinético poblacional de sapropterina, que incluyó pacientes de 1 mes a 49 años de edad, mostró que el peso corporal es la única covariable que afecta sustancialmente el aclaramiento o el volumen de distribución (ver Tabla 5). La farmacocinética en pacientes >49 años de edad no se ha estudiado.
Tabla 5. Aclaramiento plasmático aparente por edad
|
Parámetro |
0 a <1 año* (N=10) |
1 a <6 años* (N=57) |
6 a <12 años† (N=23) |
12 a <18 años† (N=24) |
≥18 años† (N=42) |
|
CL/F (L/hr/kg) Media ± DE (Mediana) |
81,5 ± 92,4 |
50,7 ± 20,1 |
51,7 ± 21,9 |
39,2 ± 9,3 |
37,9 ± 20,2 |
*Evaluado a una dosis de 20 mg/kg por día
†Evaluado a dosis de 5, 10 o 20 mg/kg por día
Metabolismo
La sapropterina es una forma sintética de tetrahidrobiopterina (BH4) y se espera que sea metabolizada y reciclada por las mismas enzimas endógenas. La BH4 endógena in vivo se convierte en dihidrobiopterina quinoide y se metaboliza a dihidrobiopterina y biopterina. Las enzimas dihidrofolato reductasa y dihidropteridina reductasa son responsables del metabolismo y reciclaje de BH4.
Estudios de interacción farmacológica
Estudios clínicos
En sujetos sanos, la administración de una sola dosis de dihidrocloruro de sapropterina a la dosis terapéutica máxima de 20 mg/kg no tuvo efecto sobre la farmacocinética de una sola dosis de digoxina (sustrato de P-gp) administrada concomitantemente.
Estudios in vitro donde el potencial de interacción farmacológica no se evaluó más clínicamente
El potencial de sapropterina para inducir o inhibir las enzimas del citocromo P450 se evaluó en estudios in vitro que mostraron que la sapropterina no inhibió CYP 1A2, 2B6, 2C8, 2C9, 2C19, 2D6 o 3A4/5, ni indujo CYP 1A2, 2B6 o 3A4/5.
La sapropterina in vitro no inhibió los transportadores OAT1, OAT3, OCT2, MATE1 y MATE2-K. El potencial de sapropterina para inhibir OATP1B1 y OATP1B3 no se ha estudiado adecuadamente. In vitro, la sapropterina inhibe la proteína de resistencia al cáncer de mama (BCRP), pero el potencial de un aumento clínicamente significativo en la exposición sistémica de los sustratos de BCRP por dihidrocloruro de sapropterina parece ser bajo.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Se realizó un estudio de carcinogenicidad de 2 años en ratas F-344 y un estudio de carcinogenicidad de 78 semanas en ratones CD-1. En el estudio de carcinogenicidad oral de 104 semanas en ratas, se usaron dosis de dihidrocloruro de sapropterina de 25, 80 y 250 mg/kg por día (0.2, 0.7 y 2 veces la dosis máxima recomendada en humanos de 20 mg/kg por día, respectivamente, según el área de superficie corporal). En el estudio de carcinogenicidad oral de 78 semanas en ratones, se usaron dosis de dihidrocloruro de sapropterina de 25, 80 y 250 mg/kg por día (0.1, 0.3 y 2 veces la dosis recomendada en humanos, respectivamente, según el área de superficie corporal). En el estudio de carcinogenicidad de 2 años en ratas, hubo un aumento estadísticamente significativo en la incidencia de feocromocitoma suprarrenal benigno en ratas macho tratadas con la dosis de 250 mg/kg por día (aproximadamente 2 veces la dosis máxima recomendada en humanos, según el área de superficie corporal), en comparación con las ratas tratadas con vehículo. El estudio de carcinogenicidad en ratones no mostró evidencia de un efecto carcinogénico, pero el estudio no fue ideal debido a su duración de 78 en lugar de 104 semanas.
El dihidrocloruro de sapropterina fue genotóxico en la prueba de Ames in vitro a concentraciones de 625 mcg (TA98) y 5000 mcg (TA100) por placa, sin activación metabólica. Sin embargo, no se observó genotoxicidad en la prueba de Ames in vitro con activación metabólica. El dihidrocloruro de sapropterina fue genotóxico en el ensayo de aberración cromosómica in vitro en células de pulmón de hámster chino a concentraciones de 0.25 y 0.5 mM. El dihidrocloruro de sapropterina no fue mutagénico en el ensayo de micronúcleos in vivo en ratones a dosis de hasta 2,000 mg/kg por día (aproximadamente 8 veces la dosis máxima recomendada en humanos de 20 mg/kg por día, según el área de superficie corporal). Se encontró que el dihidrocloruro de sapropterina, a dosis orales de hasta 400 mg/kg por día (aproximadamente 3 veces la dosis máxima recomendada en humanos, según el área de superficie corporal) no tuvo efecto sobre la fertilidad y la función reproductiva de ratas macho y hembra.
14 ESTUDIOS CLÍNICOS
La eficacia de sapropterin dihydrochloride se evaluó en cinco estudios clínicos en pacientes con PKU.
El Estudio 1 fue un ensayo clínico multicéntrico, abierto y no controlado de 489 pacientes con PKU, de 8 a 48 años (media de 22 años), que tenían niveles basales de Phe en sangre ≥ 450 micromol/L y que no seguían dietas restringidas en Phe. Todos los pacientes recibieron tratamiento con sapropterin dihydrochloride 10 mg/kg por día durante 8 días. Para los fines de este estudio, la respuesta al tratamiento con sapropterin dihydrochloride se definió como una disminución ≥ 30% en la Phe sanguínea desde el inicio. En el Día 8, se identificaron 96 pacientes (20%) como respondedores.
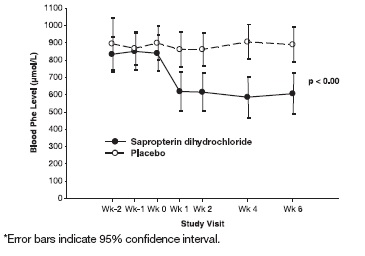
El Estudio 2 fue un estudio multicéntrico, doble ciego, controlado con placebo de 88 pacientes con PKU que respondieron a sapropterin dihydrochloride en el Estudio 1. Después de un período de lavado del Estudio 1, los pacientes fueron aleatorizados por igual a sapropterin dihydrochloride 10 mg/kg por día (N=41) o placebo (N=47) durante 6 semanas. La eficacia se evaluó mediante el cambio medio en el nivel de Phe en sangre desde el inicio hasta la Semana 6 en el grupo tratado con sapropterin dihydrochloride en comparación con el cambio medio en el grupo placebo.
Los resultados mostraron que al inicio, el nivel medio (±SD) de Phe en sangre era 843 (±300) micromol/L en el grupo tratado con sapropterin dihydrochloride y 888 (±323) micromol/L en el grupo placebo. En la Semana 6, el grupo tratado con sapropterin dihydrochloride tenía un nivel medio (±SD) de Phe en sangre de 607 (±377) micromol/L, y el grupo placebo tenía un nivel medio de Phe en sangre de 891 (±348) micromol/L. En la Semana 6, los grupos tratados con sapropterin dihydrochloride y placebo tuvieron cambios medios en el nivel de Phe en sangre de –239 y 6 micromol/L, respectivamente (cambios porcentuales medios de –29% (±32) y 3% (±33), respectivamente). La diferencia entre los grupos fue estadísticamente significativa (p < 0,001) (Tabla 6).
Tabla 6: Resultados de Phe en Sangre en el Estudio 2
|
Sapropterin (N=41) |
Placebo (N=47) |
|
|
Nivel Basal de Phe en Sangre* (micromol/L) |
||
|
Media (±SD) |
843 (±300) |
888 (±323) |
|
Percentiles (25th, 75th) |
620, 990 |
618, 1141 |
|
Nivel de Phe en Sangre en la Semana 6 (micromol/L) |
||
|
Media (±SD) |
607 (±377) |
891 (±348) |
|
Percentiles (25th, 75th) |
307, 812 |
619, 1143 |
|
Cambio Medio en Phe en Sangre del Inicio a la Semana 6 (micromol/L) |
||
|
Media Ajustada (±SE)† |
-239 (±38) |
6 (±36) |
|
Percentiles (25th, 75th) |
-397, -92 |
-96, 93 |
|
Cambio Porcentual Medio en Phe en Sangre del Inicio a la Semana 6 |
||
|
Media (±SD) |
– 29 (±32) |
3 (±33) |
|
Percentiles (25th, 75th) |
-61, -11 |
-13, 12 |
*Los niveles basales medios mostrados en esta tabla representan la media de 3 niveles de pretratamiento (Sem -2, Sem -1 y Sem 0). El tratamiento con sapropterin dihydrochloride en tabletas o placebo comenzó en la Sem 0.
†valor p < 0,001, media ajustada y error estándar de un modelo ANCOVA con el cambio en el nivel de Phe en sangre desde el inicio hasta la Semana 6 como variable de respuesta, y tanto el grupo de tratamiento como el nivel de Phe en sangre basal como covariables.
El cambio en la Phe sanguínea se observó en el grupo tratado con sapropterin dihydrochloride en la Semana 1 y se mantuvo hasta la Semana 6 (Figura 2).
Figura 2: Nivel Medio de Fenilalanina (Phe) en Sangre a lo Largo del Tiempo*
El Estudio 3 fue un estudio multicéntrico, abierto, de extensión en el que 80 pacientes que respondieron al tratamiento con sapropterin dihydrochloride en el Estudio 1 y completaron el Estudio 2 se sometieron a 6 semanas de titulación forzada de dosis con 3 dosis diferentes de sapropterin dihydrochloride. Los tratamientos consistieron en 3 ciclos consecutivos de 2 semanas de sapropterin dihydrochloride a dosis de 5, luego 20 y luego 10 mg/kg por día. El nivel de Phe en sangre se controló después de 2 semanas de tratamiento en cada nivel de dosis. Al inicio, la Phe media (±SD) en sangre fue de 844 (±398) micromol/L. Al final del tratamiento con 5, 10 y 20 mg/kg por día, los niveles medios (±SD) de Phe en sangre fueron 744 (±384) micromol/L, 640 (±382) micromol/L y 581 (±399) micromol/L, respectivamente (Tabla 7).
Tabla 7: Resultados de Phe en Sangre de la Titulación Forzada de Dosis en el Estudio 3
|
Nivel de Dosis de Sapropterin Dihydrochloride (mg/kg por día) |
Número de Pacientes |
Nivel medio de Phe en sangre (±DE) micromol/L) |
Cambios medios (±DE) en el nivel de Phe en sangre desde la Semana 0 (micromol/L) |
|
Línea basal (Sin tratamiento) |
80 |
844 (±398) |
— |
|
5 |
80 |
744 (±384) |
‑100 (±295) |
|
10 |
80 |
640 (±382) |
‑204 (±303) |
|
20 |
80 |
581 (±399) |
-263 (±318) |
El Estudio 4 fue un estudio multicéntrico de 90 pacientes pediátricos con PKU, de 4 a 12 años de edad, que estaban con dietas restringidas en Phe y que tenían niveles de Phe en sangre ≤480 micromol/L en la evaluación inicial. Todos los pacientes fueron tratados con sapropterin dihydrochloride 20 mg/kg por día de etiqueta abierta durante 8 días. La respuesta a sapropterin dihydrochloride se definió como una disminución ≥30% de Phe en sangre desde el inicio hasta el Día 8. En el Día 8, 50 pacientes (56%) tuvieron una disminución ≥30% de Phe en sangre.
El Estudio 5 fue un ensayo multicéntrico, abierto, de un solo brazo, en 93 pacientes pediátricos con PKU, de 1 mes a 6 años de edad, que tenían niveles de Phe mayores o iguales a 360 micromol/L en la evaluación inicial. Todos los pacientes fueron tratados con sapropterin dihydrochloride a 20 mg/kg por día y se mantuvieron con una dieta restringida en Phe. En la Semana 4, 57 pacientes (61%) fueron identificados como respondedores (definido como una disminución ≥30% de Phe en sangre desde el inicio) (ver Figura 1 sección 8.4).
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Tabletas de dihidrocloruro de sapropterina
100 mg de dihidrocloruro de sapropterina, son redondas, de color blanquecino a amarillo claro, moteadas y grabadas con “177”. Las tabletas se suministran de la siguiente manera:
NDC 43598-749-04 Frasco de 120 tabletas
Dr. Reddy’s comercializa únicamente tabletas de dihidrocloruro de sapropterina.
Almacenamiento
Almacene las tabletas de dihidrocloruro de sapropterina a una temperatura entre 20 ºC y 25 ºC (68 ºF a 77 ºF); se permiten excursiones entre 15 ºC y 30 ºC (59 ºF a 86 ºF) [ver USP Temperatura ambiente controlada]. Mantenga el envase bien cerrado. Proteja de la humedad.
Almacene el polvo de dihidrocloruro de sapropterina para solución oral a una temperatura entre 20 ºC y 25 ºC (68 ºF a 77 ºF); se permiten excursiones entre 15 ºC y 30 ºC (59 ºF a 86 ºF) [ver USP Temperatura ambiente controlada]. Proteja de la humedad.
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
Aconseje al paciente o cuidador que lea el etiquetado para el paciente aprobado por la FDA (Información para el paciente e Instrucciones de uso).
Reacciones de hipersensibilidad, incluida la anafilaxia
Aconseje a los pacientes y cuidadores que interrumpan el dihidrocloruro de sapropterina y se comuniquen con el proveedor de atención médica del paciente de inmediato si experimentan síntomas de anafilaxia, que incluyen (pero no se limitan a) sibilancias, disnea, tos, hipotensión, enrojecimiento, náuseas y erupción cutánea. Continúe con el manejo nutricional, incluida la restricción de proteínas y Phe en la dieta [ver Advertencias y precauciones (5.1)].
Inflamación de la mucosa gastrointestinal superior
Aconseje a los pacientes y cuidadores que se comuniquen con su proveedor de atención médica si el paciente experimenta signos y síntomas que sugieran inflamación de la mucosa GI superior, incluidas náuseas, vómitos, disfagia, dispepsia, pérdida de apetito; dolor orofaríngeo, esofágico o abdominal superior [ver Advertencias y precauciones (5.3)].
Hipofenilalaninemia [ver Advertencias y precauciones (5.3)]
Informe a los pacientes y cuidadores que el dihidrocloruro de sapropterina puede causar hipofenilalaninemia (niveles bajos de Phe en sangre), especialmente en pacientes pediátricos menores de 7 años.
Monitorización de los niveles de Phe en sangre[ver Advertencias y precauciones (5.4)]
Aconseje a los pacientes y cuidadores que la monitorización frecuente de Phe en sangre es importante para garantizar que los niveles de Phe en sangre estén en el rango deseable y que deben mantener la restricción de proteínas y Phe en la dieta mientras estén en tratamiento con dihidrocloruro de sapropterina.
La hiperfenilalaninemia prolongada (niveles altos de Phe en sangre) en pacientes con PKU puede provocar daños neurológicos graves, incluidos discapacidad intelectual, retraso del desarrollo, microcefalia, retraso del habla, convulsiones y anomalías del comportamiento.
Falta de respuesta bioquímica al dihidrocloruro de sapropterina
Algunos pacientes no muestran una respuesta bioquímica (reducción de Phe en sangre) cuando se tratan con dihidrocloruro de sapropterina. Aconseje a los pacientes y cuidadores que interrumpan el tratamiento con dihidrocloruro de sapropterina si el paciente no muestra una respuesta bioquímica adecuada en la Phe en sangre después de un mes de tratamiento con dihidrocloruro de sapropterina 20 mg/kg por día [ver Dosis y administración (2.1), Advertencias y precauciones (5.4)].
Interacción con levodopa
Informe a los pacientes y cuidadores que los pacientes con trastornos neurológicos subyacentes que toman dihidrocloruro de sapropterina en combinación con levodopa pueden experimentar convulsiones, exacerbación de las convulsiones, sobreestimulación o irritabilidad. Informe a los pacientes y cuidadores que se comuniquen con su proveedor de atención médica si el paciente tiene un cambio en el estado neurológico durante el tratamiento con dihidrocloruro de sapropterina [ver Advertencias y precauciones (5.5)].
Hiperactividad
Informe a los pacientes y cuidadores que el dihidrocloruro de sapropterina puede causar hiperactividad y que se comuniquen con su proveedor de atención médica si el paciente experimenta hiperactividad, inquietud, nerviosismo o habla excesiva [ver Advertencias y precauciones (5.6)].
Dosificación y monitorización[ver Dosis y administración (2.1)]
Aconseje a los pacientes y cuidadores lo siguiente:
-
El dihidrocloruro de sapropterina debe usarse junto con una dieta específica para PKU, incluida la restricción de proteínas y Phe en la dieta.
-
La ingesta de proteínas y Phe en la dieta no debe modificarse durante el período de evaluación del dihidrocloruro de sapropterina al evaluar la respuesta bioquímica.
-
El paciente debe ser evaluado para detectar cambios en la Phe en sangre después de ser tratado con dihidrocloruro de sapropterina a la(s) dosis recomendada(s) para la edad para determinar si tiene una respuesta bioquímica y que los niveles de Phe en sangre y la ingesta de Phe en la dieta deben evaluarse con frecuencia durante el primer mes de tratamiento con dihidrocloruro de sapropterina.
-
La monitorización de los niveles de Phe en sangre es importante durante el tratamiento con dihidrocloruro de sapropterina.
Preparación y administración [ver Dosis y administración (2.2)]
Aconseje a los pacientes y cuidadores:
-
Los comprimidos de dihidrocloruro de sapropterina se pueden tragar enteros, disolver en agua o jugo de manzana, o triturar y mezclar con una pequeña cantidad de alimentos blandos como puré de manzana o pudín.
-
El polvo de dihidrocloruro de sapropterina para solución oral debe disolverse en agua o jugo de manzana o mezclarse en una pequeña cantidad de alimentos blandos como puré de manzana o pudín.
-
Tome el dihidrocloruro de sapropterina con una comida, preferiblemente a la misma hora todos los días.
Embarazo
Informe a las pacientes que existe un registro de productos para pacientes con PKU para recopilar datos sobre mujeres con PKU que quedan embarazadas mientras reciben tratamiento con dihidrocloruro de sapropterina [ver Uso en poblaciones específicas (8.1)].
Distribuido por:
Dr. Reddy’s Laboratories, Inc.
Princeton, NJ 085409 USA
INFORMACIÓN PARA EL PACIENTE
| INFORMACIÓN PARA EL PACIENTE Tabletas de dihidrocloruro de sapropterina (SAP-roe-PTER-in) Polvo de dihidrocloruro de sapropterina (SAP-roe-PTER-in) para solución oral |
|
| ¿Qué es el dihidrocloruro de sapropterina? El dihidrocloruro de sapropterina es un medicamento recetado que se usa para disminuir los niveles de fenilalanina (Phe) en sangre, en adultos y niños de un mes de edad o mayores con cierto tipo de fenilcetonuria (PKU). El dihidrocloruro de sapropterina se utiliza junto con una dieta restringida en Phe. |
|
| ¿Qué debo decirle a mi médico antes de tomar dihidrocloruro de sapropterina?
Antes de tomar dihidrocloruro de sapropterina, informe a su médico sobre todas sus afecciones médicas, incluyendo si usted:
Informe a su médico sobre todos los medicamentos que toma, incluidos medicamentos recetados y de venta libre, vitaminas, suplementos a base de hierbas y dietéticos. El dihidrocloruro de sapropterina y otros medicamentos pueden interactuar entre sí. Especialmente informe a su médico si toma:
Informe a su médico si no está seguro si su medicamento es uno de los enumerados anteriormente. Conozca los medicamentos que toma. Mantenga una lista de ellos para mostrarle a su médico y farmacéutico cuando obtenga un nuevo medicamento. |
|
|
¿Cómo debo tomar el dihidrocloruro de sapropterina?
|
|
| ¿Cuáles son los posibles efectos secundarios del dihidrocloruro de sapropterina?
El dihidrocloruro de sapropterina puede causar efectos secundarios graves, que incluyen:
|
|
|
|
Los efectos secundarios más comunes de sapropterin dihydrochloride son:
Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca. Estos no son todos los posibles efectos secundarios de sapropterin dihydrochloride. Para obtener más información, consulte a su médico o farmacéutico. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088. |
|
|
¿Cómo debo almacenar sapropterin dihydrochloride?
Mantenga las tabletas de sapropterin dihydrochloride y todos los medicamentos fuera del alcance de los niños. |
|
| Información general sobre el uso seguro y eficaz de sapropterin dihydrochloride. A veces los medicamentos se recetan para fines distintos a los enumerados en un folleto de información para el paciente. No use sapropterin dihydrochloride para una afección para la que no fue recetado. No le dé sapropterin dihydrochloride a otras personas, incluso si tienen los mismos síntomas que usted. Puede hacerles daño. Puede pedirle a su farmacéutico o médico información sobre sapropterin dihydrochloride que está escrita para profesionales de la salud. |
|
| ¿Cuáles son los ingredientes de sapropterin dihydrochloride?
Ingrediente activo: sapropterin dihydrochloride. Ingredientes inactivos de la tableta de sapropterin dihydrochloride: ácido ascórbico, crospovidona, fosfato dibásico de calcio, D-manitol, riboflavina y fumarato sódico de estearilo. Ingredientes inactivos del polvo para solución oral de sapropterin dihydrochloride: ácido ascórbico, D-manitol, citrato de potasio y sucralosa. Dr. Reddy’s solo comercializa tabletas de sapropterin dihydrochloride. Distribuido por: Para obtener más información, llame al 1-800-983-4587. |
|
Esta Información para el Paciente ha sido aprobada por la Administración de Alimentos y Medicamentos de los EE. UU.
Publicado: 09/2020
INSTRUCCIONES DE USO
Tabletas de Dihidrocloruro de Sapropterina (SAP-roe-PTER-in)
Polvo de Dihidrocloruro de Sapropterina (SAP-roe-PTER-in) para Solución Oral
Lea estas Instrucciones de Uso antes de comenzar a tomar dihidrocloruro de sapropterina y cada vez que renueve su receta. Puede haber información nueva. Esta información no reemplaza el hablar con su proveedor de atención médica sobre su tratamiento. Hable con su médico si tiene alguna pregunta sobre la dosis correcta de dihidrocloruro de sapropterina que debe tomar o cómo mezclarla.
Información importante:
- el dihidrocloruro de sapropterina viene en forma de tableta o en un paquete que contiene polvo.
- Tome el dihidrocloruro de sapropterina exactamente como le indique su médico. Su médico debe decirle cuánto dihidrocloruro de sapropterina debe tomar y cuándo tomarlo.
- Su médico puede cambiar su dosis de dihidrocloruro de sapropterina dependiendo de cómo responda al tratamiento, o según el peso de su bebé.
- Si su bebé pesa 22 libras o menos, siga la sección llamada “Instrucciones para administrar polvo de dihidrocloruro de sapropterina para solución oral (paquetes de 100 mg de dihidrocloruro de sapropterina) a bebés que pesan 22 libras o menos“.
- Tome las tabletas de dihidrocloruro de sapropterina 1 vez al día con una comida. Es mejor tomar el dihidrocloruro de sapropterina a la misma hora cada día.
Instrucciones para tomar tabletas de dihidrocloruro de sapropterina:
Las tabletas de dihidrocloruro de sapropterina se pueden tragar enteras o disolver en agua o jugo de manzana. También puede triturar las tabletas y mezclarlas en una pequeña cantidad de alimentos blandos, como puré de manzana o pudín.
Para disolver las tabletas de dihidrocloruro de sapropterina:
- Mezcle tabletas de dihidrocloruro de sapropterina en 4 onzas a 8 onzas (½ taza a 1 taza) de agua o jugo de manzana. Puede tomar unos minutos para que las tabletas se disuelvan. Para hacer que las tabletas se disuelvan más rápido, puede revolverlas o triturarlas.
- Puede que las tabletas no se disuelvan por completo. Puede ver pequeños trozos flotando sobre el agua o el jugo de manzana. Esto es normal y seguro de tragar.
- Beba dentro de los 15 minutos.
- Después de beber su medicamento, si aún ve pequeños trozos de la tableta, agregue más agua o jugo de manzana y beba para asegurarse de tomar todo su medicamento.
Instrucciones para tomar el polvo de dihidrocloruro de sapropterina para solución oral:
Para bebés que pesan 22 libras o menos, consulte la sección a continuación llamada “Instrucciones para administrar polvo de dihidrocloruro de sapropterina para solución oral (paquetes de 100 mg de dihidrocloruro de sapropterina) a bebés que pesan 22 libras o menos.”
El polvo de dihidrocloruro de sapropterina para solución oral debe disolverse en agua o jugo de manzana. El polvo para solución oral también puede mezclarse en una pequeña cantidad de alimentos blandos, como puré de manzana o pudín.
Para disolver el polvo de dihidrocloruro de sapropterina para solución oral:
• Asegúrese de saber qué dosis de dihidrocloruro de sapropterina le ha recetado su médico y si debe usar paquetes de 100 mg de dihidrocloruro de sapropterina, paquetes de 500 mg de dihidrocloruro de sapropterina o ambos tipos de paquetes para preparar su dosis.
• Abra los paquetes de polvo de dihidrocloruro de sapropterina para solución oral doblando y rasgando, o cortando en la línea punteada en la esquina superior derecha del paquete. Abra los paquetes solo cuando esté listo para usarlos.
• Vacíe el contenido del paquete(s) en 4 onzas a 8 onzas (1/2 taza a 1 taza) de agua o jugo de manzana.
• Beba dentro de los 30 minutos.
Instrucciones para administrar polvo de dihidrocloruro de sapropterina para solución oral (paquetes de 100 mg de dihidrocloruro de sapropterina) a bebés que pesan 22 libras o menos:
• La dosis de dihidrocloruro de sapropterina se basa en el peso corporal.
Esto cambiará a medida que su bebé crezca. Su médico le dirá:
- el número de paquetes de 100 mg de dihidrocloruro de sapropterina necesarios para una dosis
- la cantidad de agua o jugo de manzana necesaria para mezclar una dosis de dihidrocloruro de sapropterina
- la cantidad de la mezcla (polvo y agua o jugo de manzana) que deberá darle a su bebé su dosis prescrita de medicamento.
• Dele a su bebé la cantidad prescrita de la mezcla (polvo y agua o jugo de manzana) dentro de los 30 minutos posteriores a la mezcla. Si no puede darle la dosis a su bebé dentro de los 30 minutos posteriores a la mezcla, deseche el medicamento no utilizado. Tendrá que mezclar una nueva dosis.
Suministros necesarios para mezclar y administrar la dosis de polvo de dihidrocloruro de sapropterina para solución oral de su bebé:
• el número de paquetes de 100 mg de dihidrocloruro de sapropterina necesarios para una dosis
• una pequeña taza de agua o jugo de manzana
• una taza de medicina de 30 mL para mezclar
• cuchara pequeña o utensilio limpio para mezclar
• jeringa de dosificación oral de 10 mL
• tijeras (opcional)
Pídale a su farmacéutico una taza de medicina de 30 mL para mezclar y una jeringa de dosificación oral si no tiene estos suministros.
Paso 1: Encuentre una superficie de trabajo limpia y plana.
Paso 2: Coloque una pequeña taza de agua o jugo de manzana, la jeringa de dosificación oral y una taza de medicina vacía en su superficie de trabajo limpia y plana (ver Figura A).
Figura A
Paso 3: Vierta 5 mL o 10 mL de agua o jugo de manzana de la taza pequeña a la taza de medicina, según las instrucciones de su médico. Verifique para asegurarse de que la cantidad de líquido se alinee con la cantidad que su médico le indique (ver Figura B).
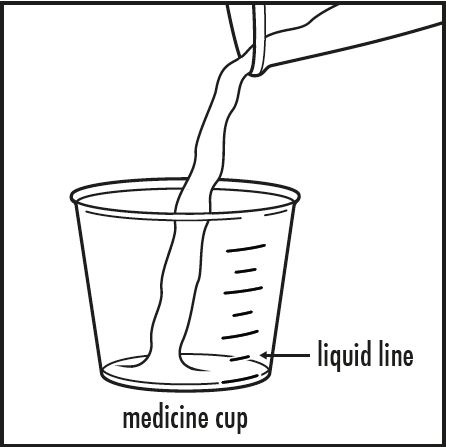
Figura B
Paso 4: Verifique la etiqueta en los paquetes de dihidrocloruro de sapropterina. Si el paquete está marcado como dihidrocloruro de sapropterina de 100 mg, vacíe todo el contenido del paquete de dihidrocloruro de sapropterina en la taza de medicina (ver Figura C).
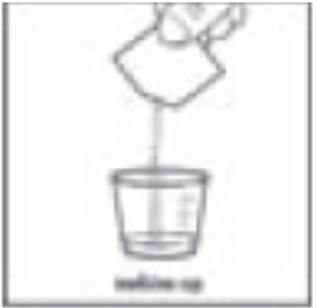
Figura C
Paso 5: Revuelva la mezcla con la cuchara pequeña u otro utensilio limpio hasta que todo el polvo se disuelva completamente (ver Figura D).
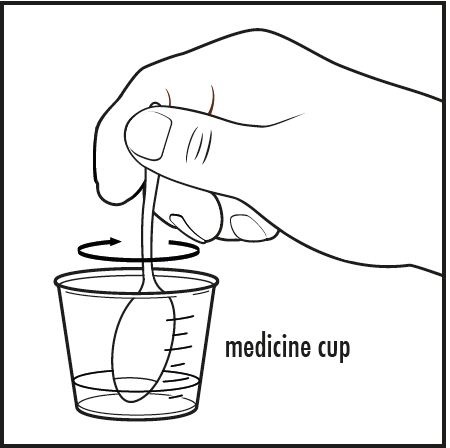
Figura D
Paso 6: Para darle una dosis de dihidrocloruro de sapropterina a su bebé: Coloque la punta de la jeringa de dosificación oral en el líquido dentro de la taza de medicina. Tire del émbolo hacia atrás y extraiga la cantidad de la mezcla prescrita por su médico (ver Figura E).
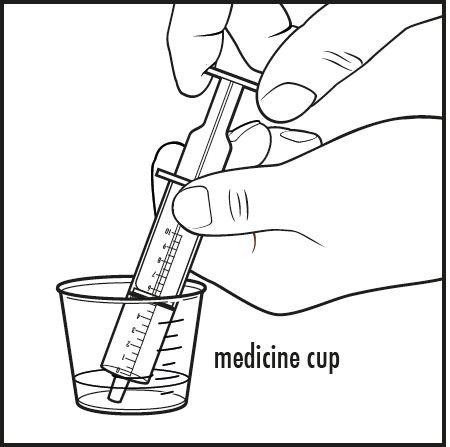
Figura E
Paso 7: Saque la jeringa de dosificación oral de la taza de medicina. Con cuidado, gire la jeringa de dosificación oral para que la punta apunte hacia arriba. Verifique para asegurarse de que la cantidad de medicamento en la jeringa de dosificación oral se alinee con la cantidad de mezcla prescrita por su médico (ver Figura F).
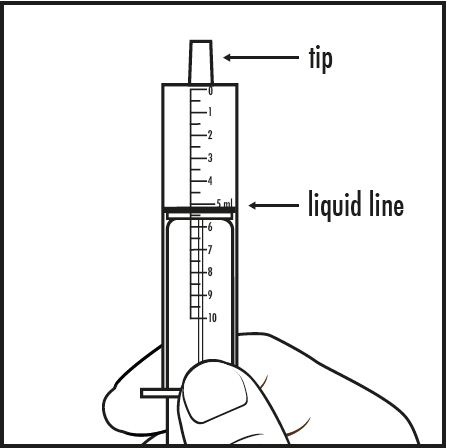
Figura F
Paso 8: Coloque la punta de la jeringa de dosificación oral en la boca de su bebé. Apunte la punta de la jeringa de dosificación oral hacia cualquiera de las mejillas (ver Figura G). Presione el émbolo lentamente, una pequeña cantidad a la vez, hasta que se administre toda la mezcla en la jeringa de dosificación oral.
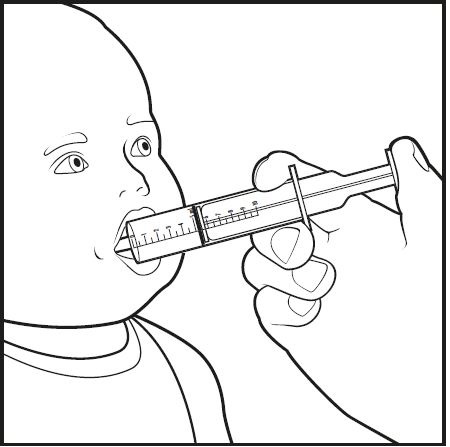
Figura G
Paso 9: Deseche cualquier mezcla restante. Retire el émbolo del cilindro de la jeringa de dosificación oral. Lave la jeringa de dosificación oral y la taza de medicina con agua tibia y deje secar al aire. Cuando la jeringa de dosificación oral esté seca, vuelva a colocar el émbolo en el cilindro. Guarde la jeringa de dosificación oral y la taza de medicina para el próximo uso.
¿Cómo debo almacenar el dihidrocloruro de sapropterina?
- Almacene el dihidrocloruro de sapropterina a temperatura ambiente entre 68 °F y 77 °F (20 °C a 25 °C).
- Mantenga las tabletas de dihidrocloruro de sapropterina en el frasco original con la tapa bien cerrada.
- Proteja de la humedad.
Mantenga el dihidrocloruro de sapropterina y todos los medicamentos fuera del alcance de los niños.
Dr. Reddy’s solo comercializa tabletas de dihidrocloruro de sapropterina.
Estas Instrucciones de Uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los EE. UU.
Distribuido por:
Dr. Reddy’s Laboratories, Inc.
Princeton, NJ 08540 EE. UU.
Emitido: 09/2020
SECCIÓN DEL PANEL DE VISUALIZACIÓN PRINCIPAL DE LA ETIQUETA DEL PAQUETE
Contenedor: 120 comprimidos

PANEL DE VISUALIZACIÓN PRINCIPAL
Caja de Envase: 1 frasco en 1 caja


