Fabricante de medicamentos: Apotex Corp. (Updated: 2024-02-28)
INFORMACIÓN DESTACADA DE PRESCRIPCIÓN
Tabletas de PAZOPANIB, para uso oral
Aprobación inicial en los EE.UU.: 2009
ADVERTENCIA: HEPATOTOXICIDAD
Ver información de prescripción completa para la advertencia recuadrada completa.
Se ha observado hepatotoxicidad grave y fatal en ensayos clínicos. Monitoree la función hepática e interrumpa, reduzca o descontinúe la dosificación según se recomiende. (5.1)
INDICACIONES Y USO
Las tabletas de pazopanib son un inhibidor de kinasa indicado para el tratamiento de adultos con:
- carcinoma de células renales avanzado (RCC). (1.1)
- sarcoma de tejidos blandos avanzada (STS) que han recibido quimioterapia previa. (1.2)
Limitaciones de uso: No se ha demostrado la eficacia de las tabletas de pazopanib para el tratamiento de pacientes con sarcoma de tejidos blandos adipocíticos o tumores del estroma gastrointestinal.
DOSIFICACIÓN Y ADMINISTRACIÓN
FORMAS FARMACÉUTICAS Y CONCENTRACIONES
Tabletas: 200 mg (3)
CONTRAINDICACIONES
Ninguna. (4)
ADVERTENCIAS Y PRECAUCIONES
- Toxicidad hepática: Se ha producido hepatotoxicidad grave y mortal. Monitoree las pruebas de función hepática al inicio, regularmente durante el tratamiento y según lo indiquen las condiciones clínicas. Suspenda las tabletas de pazopanib y reanude con una dosis reducida con una monitorización semanal continua durante 8 semanas, o suspenda permanentemente con monitorización semanal hasta la resolución según la gravedad de la hepatotoxicidad. (2.2, 5.1)
- Prolongación del intervalo QT y Torsades de Pointes: Monitoree a los pacientes que tienen un riesgo significativo de desarrollar prolongación del intervalo QT. Monitoree los electrocardiogramas (ECG) y los electrolitos al inicio y según lo indiquen las condiciones clínicas. Corrija la hipopotasemia, la hipomagnesemia y la hipocalcemia antes de iniciar las tabletas de pazopanib y durante el tratamiento. (5.2, 12.2)
- Disfunción cardíaca: Se han producido casos de disfunción cardíaca, incluida la disminución de la fracción de eyección del ventrículo izquierdo (FEVI) e insuficiencia cardíaca congestiva. Monitoree la presión arterial y manéjela según corresponda. Vigile los signos o síntomas clínicos de insuficiencia cardíaca congestiva. Realice una evaluación basal y periódica de la FEVI en pacientes con riesgo de disfunción cardíaca. Suspenda o discontinúe permanentemente las tabletas de pazopanib según la gravedad de la disfunción cardíaca. (2.2, 5.3)
- Eventos hemorrágicos: Se han producido eventos hemorrágicos mortales. Las tabletas de pazopanib no se han estudiado en pacientes que tienen antecedentes de hemoptisis, hemorragia cerebral o hemorragia gastrointestinal clínicamente significativa en los últimos 6 meses. Suspenda las tabletas de pazopanib y reanude con una dosis reducida o discontinúe permanentemente según la gravedad de los eventos hemorrágicos. (2.2, 5.4)
- Eventos tromboembólicos arteriales: Se han observado eventos tromboembólicos arteriales que pueden ser mortales. Las tabletas de pazopanib no se han estudiado en pacientes que han tenido un evento tromboembólico arterial en los últimos 6 meses. Discontinúe permanentemente las tabletas de pazopanib en caso de un evento tromboembólico arterial. (2.2, 5.5)
- Eventos tromboembólicos venosos: Se han observado eventos tromboembólicos venosos (ETV), incluidos émbolos pulmonares (EP) mortales. Vigile los signos y síntomas de ETV y EP. Suspenda las tabletas de pazopanib y luego reanude con la misma dosis o discontinúe permanentemente según la gravedad del ETV. (2.2, 5.6)
- Microangiopatía trombótica: Se ha observado microangiopatía trombótica (MAT), incluida la púrpura trombótica trombocitopénica (PTT) y el síndrome urémico hemolítico (SUH). Discontinúe permanentemente las tabletas de pazopanib si se produce una MAT. (2.2, 5.7)
- Perforación y fístula gastrointestinal: Se han producido eventos de perforación mortales. Vigile los signos y síntomas de perforación o fístula gastrointestinal. Suspenda las tabletas de pazopanib en caso de fístula gastrointestinal de Grado 2 o 3 y reanude según el criterio médico. Discontinúe permanentemente las tabletas de pazopanib en caso de perforación gastrointestinal o fístula gastrointestinal de Grado 4. (2.2, 5.8)
- Enfermedad pulmonar intersticial/neumonitis: Puede ser mortal. Monitoree a los pacientes en busca de síntomas pulmonares. Discontinúe permanentemente las tabletas de pazopanib en pacientes que desarrollen enfermedad pulmonar intersticial (EPI) o neumonitis. (2.2, 5.9)
- Síndrome de leucoencefalopatía posterior reversible: Puede ser mortal. Discontinúe permanentemente las tabletas de pazopanib en pacientes que desarrollen síndrome de leucoencefalopatía posterior reversible (SLPR). (2.2, 5.10)
- Hipertensión: Se ha observado hipertensión, incluida crisis hipertensiva. No inicie las tabletas de pazopanib en pacientes con hipertensión no controlada. Optimice la presión arterial antes de iniciar las tabletas de pazopanib. Monitoree la presión arterial según lo indiquen las condiciones clínicas e inicie y ajuste el tratamiento antihipertensivo según corresponda. Suspenda y luego reduzca la dosis de las tabletas de pazopanib o discontinúe permanentemente según la gravedad de la hipertensión. (2.2, 5.11)
- Riesgo de alteración de la cicatrización de heridas: Suspenda las tabletas de pazopanib durante al menos 1 semana antes de una cirugía electiva. No administre durante al menos 2 semanas después de una cirugía mayor y hasta que se produzca una adecuada cicatrización de la herida. No se ha establecido la seguridad de la reanudación de las tabletas de pazopanib después de la resolución de las complicaciones de la cicatrización de heridas. (5.12)
- Hipotiroidismo: Monitoree las pruebas de función tiroidea al inicio, durante el tratamiento y según lo indiquen las condiciones clínicas, y maneje el hipotiroidismo según corresponda. (5.13)
- Proteinuria: Realice un análisis de orina basal y periódico durante el tratamiento con seguimiento de la medición de la proteína en orina de 24 horas según lo indiquen las condiciones clínicas. Suspenda las tabletas de pazopanib, luego reanude con una dosis reducida o discontinúe permanentemente según la gravedad de la proteinuria. Discontinúe permanentemente en pacientes con síndrome nefrótico. (2.2, 5.14)
- Síndrome de lisis tumoral: Se han reportado casos de síndrome de lisis tumoral (SLT) (algunos mortales) en pacientes con carcinoma de células renales (CCR) y sarcoma de tejidos blandos (STB). Monitoree de cerca a los pacientes en riesgo y trate según lo indiquen las condiciones clínicas. (5.15)
- Infección: Se han reportado infecciones graves (con o sin neutropenia), algunas con desenlace mortal. Vigile los signos y síntomas de infección. Instituya un tratamiento antiinfeccioso apropiado sin demora. Considere la interrupción o discontinuación de las tabletas de pazopanib. (5.16)
- Toxicidad embrio-fetal: Puede causar daño fetal. Advierta a las pacientes con potencial reproductivo sobre el riesgo potencial para el feto y recomiende el uso de anticoncepción efectiva. (5.19, 8.1, 8.3)
REACCIONES ADVERSAS
- Las reacciones adversas más comunes en pacientes con CCR (≥ 20%) son diarrea, hipertensión, cambios en el color del cabello (despigmentación), náuseas, anorexia y vómitos. (6.1)
- Las reacciones adversas más comunes en pacientes con TPS (≥ 20%) son fatiga, diarrea, náuseas, disminución de peso, hipertensión, disminución del apetito, vómitos, dolor tumoral, cambios en el color del cabello, dolor musculoesquelético, cefalea, disgeusia, disnea e hipopigmentación cutánea. (6.1)
Para reportar SOSPECHAS DE REACCIONES ADVERSAS, comuníquese con Apotex Corp. al 1-800-706-5575 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES FARMACOLÓGICAS
- Inhibidores potentes del CYP3A4: Evite la coadministración de tabletas de pazopanib con inhibidores potentes del CYP3A4. Si no se puede evitar la coadministración, reduzca la dosis de tabletas de pazopanib. (2.4, 7.1)
- Inductores potentes del CYP3A4: Considere un medicamento concomitante alternativo sin potencial de inducción enzimática o mínimo. No se recomiendan las tabletas de pazopanib si no se puede evitar el uso crónico de inductores potentes del CYP3A4. (2.4, 7.1)
- Sustratos del CYP: No se recomienda la coadministración de tabletas de pazopanib con agentes de ventana terapéutica estrecha metabolizados por CYP3A4, CYP2D6 o CYP2C8. (7.2)
- Uso concomitante con simvastatina: El uso concomitante de tabletas de pazopanib con simvastatina aumenta el riesgo de elevaciones de alanina aminotransferasa (ALT). Se recomienda un aumento en el monitoreo semanal de la función hepática. Suspenda las tabletas de pazopanib y reanude con una dosis reducida, o suspenda permanentemente según la gravedad de la hepatotoxicidad. (7.3)
- Uso concomitante con agentes reductores de la acidez gástrica: Evite el uso concomitante de tabletas de pazopanib con agentes reductores de la acidez gástrica. Considere el uso de antiácidos de acción corta en lugar de inhibidores de la bomba de protones (IBP) y antagonistas de los receptores H2. Separe la administración de antiácidos y pazopanib por varias horas. (2.4, 7.4)
USO EN POBLACIONES ESPECÍFICAS
Lactancia: Aconsejar no amamantar. (8.2)
Consulte la sección 17 para INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y la Guía del Medicamento.
Revisado: 2/2024
Tabla de contenidos
INFORMACIÓN DE PRESCRIPCIÓN COMPLETA: CONTENIDOS*
1 INDICACIONES Y USO
1.1 Carcinoma de células renales
1.2 Sarcoma de tejido blando
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosificación recomendada
2.2 Modificaciones de la dosis por reacciones adversas
2.3 Modificaciones de la dosis por insuficiencia hepática
2.4 Modificaciones de la dosis por interacciones farmacológicas
3 FORMAS FARMACÉUTICAS Y CONCENTRACIONES
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Toxicidad hepática
5.2 Prolongación del QT y Torsades de Pointes
5.3 Disfunción cardíaca
5.4 Eventos hemorrágicos
5.5 Eventos tromboembólicos arteriales
5.6 Eventos tromboembólicos venosos
5.7 Microangiopatía trombótica
5.8 Perforación gastrointestinal y fístula
5.9 Enfermedad pulmonar intersticial/neumonitis
5.10 Síndrome de encefalopatía reversible posterior
5.11 Hipertensión
5.12 Riesgo de cicatrización deficiente
5.13 Hipotiroidismo
5.14 Proteinuria
5.15 Síndrome de lisis tumoral
5.16 Infección
5.17 Aumento de la toxicidad con otra terapia contra el cáncer
5.18 Mayor toxicidad en órganos en desarrollo
5.19 Toxicidad embrio-fetal
6 REACCIONES ADVERSAS
6.1 Experiencia en ensayos clínicos
6.2 Experiencia poscomercialización
7 INTERACCIONES FARMACOLÓGICAS
7.1 Efecto de otros medicamentos sobre las tabletas de pazopanib
7.2 Efectos de las tabletas de pazopanib sobre otros medicamentos
7.3 Uso concomitante con simvastatina
7.4 Uso concomitante con agentes reductores de la acidez gástrica
7.5 Medicamentos que prolongan el intervalo QT
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.3 Mujeres y hombres con potencial reproductivo
8.4 Uso pediátrico
8.5 Uso geriátrico
8.6 Insuficiencia renal
8.7 Insuficiencia hepática
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
12.2 Farmacodinámica
12.3 Farmacocinética
12.5 Farmacogenómica
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis, alteración de la fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Carcinoma de células renales
14.2 Sarcoma de tejido blando
16 PRESENTACIÓN/ALMACENAMIENTO Y MANIPULACIÓN
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información de prescripción completa no se enumeran.
ADVERTENCIA EN RECUADRO
ADVERTENCIA: HEPATOTOXICIDAD
Se ha observado hepatotoxicidad grave y fatal en ensayos clínicos. Monitoree la función hepática e interrumpa, reduzca o descontinúe la dosificación según se recomienda [ver Advertencias y precauciones (5.1)].
1 INDICACIONES Y USO
1.1 Carcinoma de Células Renales
Las tabletas de pazopanib están indicadas para el tratamiento de adultos con carcinoma de células renales (RCC) avanzado.
1.2 Sarcoma de Tejidos Blandos
Las tabletas de pazopanib están indicadas para el tratamiento de adultos con sarcoma de tejidos blandos (STS) avanzado que han recibido quimioterapia previa.
Limitaciones de uso: No se ha demostrado la eficacia de las tabletas de pazopanib para el tratamiento de pacientes con STS adipocítico o tumores del estroma gastrointestinal.
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosificación recomendada
La dosificación recomendada de las tabletas de pazopanib es de 800 mg (cuatro tabletas de 200 mg) por vía oral una vez al día sin alimentos (al menos 1 hora antes o 2 horas después de una comida) hasta la progresión de la enfermedad o toxicidad inaceptable [ver Farmacología clínica (12.3)]. La dosificación debe modificarse en caso de insuficiencia hepática y en pacientes que tomen ciertos medicamentos concomitantes [ver Dosificación y administración (2.3, 2.4)].
Trague las tabletas enteras. No triture las tabletas debido al potencial de aumento de la tasa de absorción, lo que puede afectar la exposición sistémica [ver Farmacología clínica (12.3)].
Si se omite una dosis, no debe tomarse si faltan <12 horas para la siguiente dosis.
2.2 Modificaciones de la dosificación por reacciones adversas
La Tabla 1 resume las reducciones de dosis recomendadas.
Tabla 1. Reducciones de dosis recomendadas de las tabletas de pazopanib por reacciones adversas
| Reducción de dosis | Para carcinoma de células renales | Para sarcoma de tejidos blandos |
| Primera | 400 mg por vía oral una vez al día | 600 mg por vía oral una vez al día |
| Segunda | 200 mg por vía oral una vez al día | 400 mg por vía oral una vez al día |
Suspenda permanentemente las tabletas de pazopanib en pacientes que no puedan tolerar la segunda reducción de dosis.
La Tabla 2 resume las modificaciones de la dosificación recomendadas por reacciones adversas.
Tabla 2. Modificaciones de la dosificación recomendadas de las tabletas de pazopanib por reacciones adversas
| Reacción Adversa | Gravedada | Modificación de la Dosis |
| Toxicidad Hepática [ver Advertencias y Precauciones (5.1)] | Elevaciones de ALT aisladas entre 3 x LSN y 8 x LSN | Continuar y monitorear la función hepática semanalmente hasta que la ALT regrese al Grado 1 o al valor basal. |
| Elevaciones de ALT aisladas de > 8 x LSN | Suspender hasta mejoría al Grado 1 o al valor basal. Si se considera que el beneficio potencial de reanudar el tratamiento con comprimidos de pazopanib supera el riesgo de hepatotoxicidad, reanudar a una dosis reducida de no más de 400 mg una vez al día y medir las pruebas de función hepática semanalmente durante 8 semanas. Suspender permanentemente si las elevaciones de ALT > 3 x LSN recurren a pesar de las reducciones de dosis. | |
| Elevaciones de ALT > 3 x LSN ocurren simultáneamente con elevaciones de bilirrubina > 2 x LSN | Suspender permanentemente y continuar monitoreando hasta la resolución. Los pacientes con solo una hiperbilirrubinemia indirecta (no conjugada) leve, conocida como síndrome de Gilbert, y elevaciones de ALT > 3 x LSN deben manejarse según las recomendaciones descritas para elevaciones de ALT aisladas. | |
| Disfunción Sistólica del Ventrículo Izquierdo [ver Advertencias y Precauciones (5.3)] | Sintomática o Grado 3 | Suspender hasta mejoría al Grado < 3. Reanudar el tratamiento según el criterio médico. |
| Grado 4 | Suspender permanentemente. | |
| Eventos Hemorrágicos [ver Advertencias y Precauciones (5.4)] | Grado 2 | Suspender hasta mejoría al Grado ≤ 1. Reanudar a dosis reducida (ver Tabla 1). Suspender permanentemente si el Grado 2 recurre después de la interrupción y reducción de la dosis. |
| Grado 3 o 4 | Suspender permanentemente. | |
| Eventos Tromboembólicos Arteriales [ver Advertencias y Precauciones (5.5)] | Cualquier grado | Suspender permanentemente. |
| Eventos Tromboembólicos Venosos [ver Advertencias y Precauciones (5.6)] | Grado 3 | Suspender los comprimidos de pazopanib y reanudar a la misma dosis si se maneja con la terapia apropiada durante al menos una semana. |
| Grado 4 | Suspender permanentemente. | |
| Microangiopatía Trombótica [ver Advertencias y Precauciones (5.7) ] | Cualquier grado | Suspender permanentemente. |
| Perforación Gastrointestinal [ver Advertencias y Precauciones (5.8)] | Cualquier grado | Suspender permanentemente. |
| Fístula Gastrointestinal [ver Advertencias y Precauciones (5.8)] | Grado 2 o 3 | Suspender y reanudar según el criterio médico. |
| Grado 4 | Suspender permanentemente. | |
| Enfermedad Pulmonar Intersticial / Neumonitis [ver Advertencias y Precauciones (5.9)] | Cualquier grado | Suspender permanentemente. |
| Síndrome de Encefalopatía Posterior Reversible [ver Advertencias y Precauciones (5.10)] | Cualquier grado | Suspender permanentemente. |
| Hipertensión [ver Advertencias y Precauciones (5.11)] | Grado 2 o 3 | Reducir la dosis (ver Tabla 1) e iniciar o ajustar la terapia antihipertensiva. Suspender permanentemente si la hipertensión permanece en Grado 3 a pesar de las reducciones de dosis y el ajuste de la terapia antihipertensiva. |
| Grado 4 o crisis hipertensiva | Suspender permanentemente. | |
| Proteinuria [ver Advertencias y Precauciones (5.14)] | Proteína en orina de 24 horas ≥ 3 gramos Síndrome nefrótico confirmado | Suspender hasta mejoría al Grado ≤ 1. Reanudar a dosis reducida (ver Tabla 1). Suspender permanentemente si la proteína en orina de 24 horas ≥ 3 gramos no mejora o recurre a pesar de las reducciones de dosis. Suspender permanentemente. |
Abreviaturas: ALT, alanina aminotransferasa; LSN, límite superior normal.
aCriterios Terminológicos Comunes para Eventos Adversos del Instituto Nacional del Cáncer, versión 5.
2.3 Modificaciones de dosis por insuficiencia hepática
Insuficiencia hepática moderada y grave
En pacientes con insuficiencia hepática moderada [bilirrubina total > 1,5 a 3 x límite superior normal (LSN) y cualquier valor de alanina aminotransferasa (ALT)], considerar alternativas a los comprimidos de pazopanib.
Si se usan los comprimidos de pazopanib en pacientes con insuficiencia hepática moderada, reducir la dosis de los comprimidos de pazopanib a 200 mg por vía oral una vez al día.
Los comprimidos de pazopanib no se recomiendan en pacientes con insuficiencia hepática grave (bilirrubina total > 3 x LSN y cualquier valor de ALT) [ver Uso en Poblaciones Específicas (8.7)).
2.4 Modificaciones de dosis por interacciones farmacológicas
Inhibidores potentes del CYP3A4
Evitar el uso concomitante de inhibidores potentes del CYP3A4 mediante el uso de un medicamento concomitante alternativo sin potencial o mínimo potencial para inhibir el CYP3A4. Si está justificada la administración concomitante de un inhibidor potente del CYP3A4, reducir la dosis de los comprimidos de pazopanib a 400 mg [ver Interacciones Farmacológicas (7.1)].
Inductores potentes del CYP3A4
Evitar el uso concomitante de inductores potentes del CYP3A4 mediante el uso de un medicamento concomitante alternativo sin potencial o mínimo potencial inductor enzimático. Los comprimidos de pazopanib no se recomiendan en pacientes que no puedan evitar el uso crónico de inductores potentes del CYP3A4 [ver Interacciones Farmacológicas (7.1)].
Agentes reductores de la acidez gástrica
Evite el uso concomitante de agentes reductores de ácido gástrico. Si el uso concomitante de un agente reductor de ácido gástrico no se puede evitar, considere un antiácido de acción corta en lugar de inhibidores de la bomba de protones (IBP) y antagonistas de los receptores H2. Separe la dosificación de antiácidos de acción corta y las tabletas de pazopanib por varias horas [ver Interacciones farmacológicas (7.4), Farmacología clínica (12.3)].
3 FORMAS FARMACÉUTICAS Y CONCENTRACIONES
Tabletas: 200 mg, gris, forma de cápsula, tableta biconvexa recubierta con película. Grabado “P200” en un lado, “APO” en el otro lado.
4 CONTRAINDICACIONES
Ninguna.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Toxicidad hepática
La hepatotoxicidad, manifestada como aumentos en la alanina aminotransferasa (ALT), aspartato aminotransferasa (AST) y bilirrubina, ocurrió en pacientes que recibieron tabletas de pazopanib. Esta hepatotoxicidad puede ser severa y fatal. Los pacientes mayores de 65 años tienen un mayor riesgo de hepatotoxicidad [ver Uso en poblaciones específicas (8.5)]. Las elevaciones de transaminasas ocurren al inicio del tratamiento; el 92% de todas las elevaciones de transaminasas de cualquier grado ocurrieron en las primeras 18 semanas.
En el ensayo aleatorizado de CCR (VEG105192), ALT > 3 x LSN ocurrió en el 18% y ALT > 10 x LSN ocurrió en el 4% de los 290 pacientes que recibieron tabletas de pazopanib. La elevación concurrente de ALT > 3 x LSN y bilirrubina > 2 x LSN en ausencia de fosfatasa alcalina significativa > 3 x LSN ocurrió en el 2%. En los ensayos de monoterapia, 2 pacientes fallecieron con progresión de la enfermedad e insuficiencia hepática.
En el ensayo aleatorizado de STS (VEG110727), ALT > 3 x LSN ocurrió en el 18% y ALT > 8 x LSN ocurrió en el 5% de los 240 pacientes que recibieron tabletas de pazopanib. La elevación concurrente de ALT > 3 x LSN y bilirrubina > 2 x LSN en ausencia de fosfatasa alcalina significativa > 3 x LSN ocurrió en el 2%. Un paciente falleció por insuficiencia hepática.
Monitoree las pruebas de función hepática al inicio; en las Semanas 3, 5, 7 y 9; en el Mes 3 y Mes 4; y luego periódicamente según se indique clínicamente. Aumente al monitoreo semanal para pacientes con ALT elevada hasta que la ALT regrese al Grado 1 o al valor basal. Suspenda las tabletas de pazopanib y reanude con una dosis reducida con monitoreo semanal continuo durante 8 semanas, o suspenda permanentemente con monitoreo semanal hasta la resolución según la gravedad de la hepatotoxicidad [ver Dosificación y administración (2.2)].
Síndrome de Gilbert
Las tabletas de pazopanib son un inhibidor de la uridina difosfato (UDP)-glucuronosiltransferasa 1A1 (UGT1A1). Puede ocurrir una hiperbilirrubinemia indirecta (no conjugada) leve en pacientes con síndrome de Gilbert [ver Farmacología clínica (12.5)]. En pacientes con solo una hiperbilirrubinemia indirecta leve conocida como síndrome de Gilbert, maneje la elevación de ALT > 3 x LSN según las recomendaciones descritas para elevaciones aisladas de ALT [ver Dosificación y administración (2.2)].
Uso concomitante de simvastatina
El uso concomitante de tabletas de pazopanib y simvastatina aumenta el riesgo de elevaciones de ALT [ver Interacciones medicamentosas (7.3)]. No hay suficientes datos disponibles para evaluar el riesgo de la administración concomitante de otras estatinas y tabletas de pazopanib.
5.2 Prolongación del QT y torsades de pointes
En los ensayos de CCR, 558/586 pacientes fueron sujetos de monitoreo de electrocardiograma (ECG) de rutina y se identificó una prolongación del QT ≥ 500 mseg en el 2% de estos 558 pacientes. En los ensayos de monoterapia, se produjo torsades de pointes en < 1% de 977 pacientes que recibieron tabletas de pazopanib.
En los ensayos aleatorizados de CCR (VEG105192) y STS (VEG110727), el 1% (3/290) y el 0.4% (1/240) de los pacientes, respectivamente, que recibieron tabletas de pazopanib tuvieron valores post-basales entre 500 a 549 mseg. Los datos de QT post-basales solo se recolectaron en el ensayo de STS si se informaron anomalías en el ECG como una reacción adversa.
Monitoree a los pacientes que tienen un riesgo significativo de desarrollar prolongación del QTc, incluyendo pacientes con antecedentes de prolongación del intervalo QT, en pacientes que toman antiarrítmicos u otros medicamentos que pueden prolongar el intervalo QT, y aquellos con enfermedad cardíaca preexistente relevante [ver Interacciones medicamentosas (7.5)]. Monitoree el ECG y los electrolitos (por ejemplo, calcio, magnesio, potasio) al inicio y según se indique clínicamente. Corrija la hipopotasemia, hipomagnesemia e hipocalcemia antes de iniciar las tabletas de pazopanib y durante el tratamiento.
5.3 Disfunción cardíaca
Se produjo disfunción cardíaca, incluyendo disminución de la fracción de eyección ventricular izquierda (FEVI) e insuficiencia cardíaca congestiva, en pacientes que recibieron tabletas de pazopanib.
En los ensayos de CCR, se observó disfunción cardíaca en el 0.6% de 586 pacientes sin monitoreo de rutina de FEVI durante el estudio. En el ensayo aleatorizado de CCR (VEG105192), la disfunción miocárdica se definió como síntomas de disfunción cardíaca o una disminución absoluta de FEVI ≥15% en comparación con el valor basal o una disminución de FEVI de ≥10% en comparación con el valor basal que también está por debajo del límite inferior normal. En un ensayo de CCR (COMPARZ), ocurrió disfunción miocárdica en el 13% de los 362 pacientes con pazopanib que tuvieron mediciones de FEVI basales y posteriores. La insuficiencia cardíaca congestiva ocurrió en el 0.5% de los pacientes.
En el ensayo aleatorizado de STS (VEG110727), ocurrió disfunción miocárdica en el 11% de los 142 pacientes que tuvieron mediciones de FEVI basales y posteriores. El 1% (3/240) de los pacientes que recibieron tabletas de pazopanib presentó insuficiencia cardíaca congestiva, que no se resolvió en un paciente. Catorce de los 16 pacientes con disfunción miocárdica tratados con pazopanib presentaban hipertensión concurrente que puede haber exacerbado la disfunción cardíaca en pacientes en riesgo (por ejemplo, aquellos con exposición previa a antraciclinas) posiblemente por el aumento de la poscarga cardíaca.
Monitoree la presión arterial y manéjela según corresponda [ver Advertencias y precauciones (5.11)]. Monitoree los signos o síntomas clínicos de insuficiencia cardíaca congestiva. Realice una evaluación basal y periódica de la FEVI en pacientes en riesgo de disfunción cardíaca, incluida la exposición previa a antraciclinas. Suspenda o interrumpa permanentemente las tabletas de pazopanib según la gravedad de la disfunción cardíaca [ver Dosificación y administración (2.2)].
5.4 Eventos hemorrágicos
En los ensayos de CCR, ocurrió hemorragia fatal en el 0.9% de 586 pacientes, y se observó hemorragia cerebral/intracraneal en < 1% (2/586) de los pacientes tratados con tabletas de pazopanib.
En el ensayo aleatorizado RCC (VEG105192), el 13% de 290 pacientes tratados con tabletas de pazopanib experimentaron al menos 1 evento hemorrágico. Los eventos hemorrágicos más comunes fueron hematuria (4%), epistaxis (2%), hemoptisis (2%) y hemorragia rectal (1%). Nueve de 37 pacientes tratados con tabletas de pazopanib que tuvieron eventos hemorrágicos experimentaron eventos graves, incluyendo hemorragia pulmonar, gastrointestinal y genitourinaria. El 1% de los pacientes tratados con tabletas de pazopanib murieron por hemorragia.
En el ensayo aleatorizado STS (VEG110727), el 22% de 240 pacientes tratados con tabletas de pazopanib experimentaron al menos 1 evento hemorrágico. Los eventos hemorrágicos más comunes fueron epistaxis (8%), hemorragia bucal (3%) y hemorragia anal (2%). Los eventos hemorrágicos de Grado 4 ocurrieron en el 1% de los pacientes e incluyeron hemorragia intracraneal, hemorragia subaracnoidea y hemorragia peritoneal.
Las tabletas de pazopanib no se han estudiado en pacientes que tienen antecedentes de hemoptisis, hemorragia cerebral o hemorragia gastrointestinal clínicamente significativa en los últimos 6 meses. Suspenda las tabletas de pazopanib y reanude con una dosis reducida o suspenda permanentemente según la gravedad de los eventos hemorrágicos [ver Dosificación y Administración (2.2)].
5.5 Eventos Tromboembólicos Arteriales
En los ensayos RCC, ocurrieron eventos tromboembólicos arteriales fatales en el 0,3% de 586 pacientes. En el ensayo aleatorizado RCC (VEG105192), el 2% de 290 pacientes que recibieron tabletas de pazopanib experimentaron infarto de miocardio o isquemia, el 0,3% tuvo un accidente cerebrovascular y el 1% tuvo un ataque isquémico transitorio.
En el ensayo aleatorizado STS (VEG110727), el 2% de 240 pacientes que recibieron tabletas de pazopanib experimentaron un infarto de miocardio o isquemia y el 0,4% tuvo un accidente cerebrovascular.
Las tabletas de pazopanib no se han estudiado en pacientes que hayan tenido un evento tromboembólico arterial dentro de los 6 meses previos. Suspenda permanentemente las tabletas de pazopanib en caso de un evento tromboembólico arterial [ver Dosificación y Administración (2.2)].
5.6 Eventos Tromboembólicos Venosos
Ocurrieron eventos tromboembólicos venosos (VTEs), incluyendo trombosis venosa y embolia pulmonar (EP) fatal, en pacientes que recibieron tabletas de pazopanib.
En el ensayo aleatorizado RCC (VEG105192), los VTEs ocurrieron en el 1% de 290 pacientes que recibieron tabletas de pazopanib. En el ensayo aleatorizado STS (VEG110727), se reportaron VTEs en el 5% de 240 pacientes que recibieron tabletas de pazopanib. Ocurrió EP fatal en el 1% (2/240).
Monitoree los signos y síntomas de VTE y EP. Suspenda las tabletas de pazopanib y luego reanude con la misma dosis o suspenda permanentemente según la gravedad del VTE [ver Dosificación y Administración (2.2)].
5.7 Microangiopatía Trombótica
La microangiopatía trombótica (TMA), incluyendo la purpura trombocitopénica trombótica (PTT) y el síndrome urémico hemolítico (SUH), ocurrió en ensayos clínicos de tabletas de pazopanib como monoterapia, en combinación con bevacizumab y en combinación con topotecán. Las tabletas de pazopanib no están indicadas para su uso en combinación con otros agentes. Seis de los 7 casos de TMA ocurrieron dentro de los 90 días posteriores al inicio de las tabletas de pazopanib. Se observó mejoría de la TMA después de suspender el tratamiento.
Monitoree los signos y síntomas de TMA. Suspenda permanentemente las tabletas de pazopanib en pacientes que desarrollen TMA. Maneje según lo indiquen clínicamente.
5.8 Perforación Gastrointestinal y Fístula
En los ensayos RCC y STS, ocurrió perforación gastrointestinal o fístula en el 0,9% de 586 pacientes y el 1% de 382 pacientes que recibieron tabletas de pazopanib, respectivamente. Ocurrieron perforaciones fatales en el 0,3% (2/586) de estos pacientes en los ensayos RCC y en el 0,3% (1/382) de estos pacientes en los ensayos STS.
Monitoree los signos y síntomas de perforación gastrointestinal o fístula. Suspenda las tabletas de pazopanib en caso de fístula gastrointestinal de Grado 2 o 3 y reanude según el criterio médico. Suspenda permanentemente las tabletas de pazopanib en caso de perforación gastrointestinal o fístula gastrointestinal de Grado 4 [ver Dosificación y Administración (2.2)].
5.9 Enfermedad Pulmonar Intersticial/Neumonitis
Se ha reportado enfermedad pulmonar intersticial (ILD)/neumonitis, que puede ser fatal, con las tabletas de pazopanib en los ensayos clínicos. La ILD/neumonitis ocurrió en el 0,1% de los pacientes tratados con tabletas de pazopanib. Monitoree a los pacientes por síntomas pulmonares indicativos de ILD/neumonitis.
Suspenda permanentemente las tabletas de pazopanib en pacientes que desarrollen ILD o neumonitis [ver Dosificación y Administración (2.2)].
5.10 Síndrome de Encefalopatía Reversible Posterior
Se ha reportado el Síndrome de Encefalopatía Reversible Posterior (PRES) en pacientes que recibieron tabletas de pazopanib y puede ser fatal. PRES es un trastorno neurológico que puede presentarse con dolor de cabeza, convulsiones, letargo, confusión, ceguera y otras alteraciones visuales y neurológicas. Puede estar presente hipertensión de leve a grave.
Confirme el diagnóstico de PRES mediante resonancia magnética.
Suspenda permanentemente las tabletas de pazopanib en pacientes que desarrollen PRES.
5.11 Hipertensión
Se observó hipertensión (presión arterial sistólica ≥ 150 mmHg o presión arterial diastólica ≥ 100 mmHg) y crisis hipertensiva en pacientes tratados con tabletas de pazopanib.
Aproximadamente el 40% de los pacientes que recibieron tabletas de pazopanib experimentaron hipertensión, con Grado 3 ocurriendo en el 4% al 7% de los pacientes [ver Reacciones Adversas (6.1)]. Alrededor del 40% de los casos ocurrieron al Día 9 y alrededor del 90% de los casos ocurrieron en las primeras 18 semanas en los ensayos clínicos. Aproximadamente el 1% de los pacientes requirieron la suspensión permanente de las tabletas de pazopanib debido a la hipertensión.
No inicie los comprimidos de pazopanib en pacientes con hipertensión no controlada. Optimice la presión arterial antes de iniciar los comprimidos de pazopanib. Monitoree la presión arterial según lo indique clínicamente e inicie y ajuste la terapia antihipertensiva según corresponda. Suspenda y luego reduzca la dosis de los comprimidos de pazopanib o suspéndalos permanentemente según la gravedad de la hipertensión [ver Dosificación y Administración (2.2)].
5.12 Riesgo de deterioro de la cicatrización de heridas
Las complicaciones por deterioro de la cicatrización de heridas pueden ocurrir en pacientes que reciben medicamentos que inhiben la vía de señalización del factor de crecimiento endotelial vascular (VEGF). Por lo tanto, los comprimidos de pazopanib tienen el potencial de afectar adversamente la cicatrización de heridas.
Suspenda los comprimidos de pazopanib al menos 1 semana antes de una cirugía electiva. No administre durante al menos 2 semanas después de una cirugía mayor y hasta que haya una cicatrización adecuada de la herida. No se ha establecido la seguridad de reanudar los comprimidos de pazopanib después de la resolución de las complicaciones de cicatrización de heridas.
5.13 Hipotiroidismo
El hipotiroidismo, confirmado por un aumento simultáneo de la TSH y una disminución de la T4, ocurrió en el 7% de 290 pacientes que recibieron comprimidos de pazopanib en el ensayo aleatorizado de CCR (VEG105192) y en el 5% de 240 pacientes que recibieron comprimidos de pazopanib en el ensayo aleatorizado de STS (VEG110727). El hipotiroidismo ocurrió en el 4% de los 586 pacientes en los ensayos de CCR y en el 5% de los 382 pacientes en los ensayos de STS.
Monitoree las pruebas de la tiroides al inicio, durante el tratamiento y según lo indique clínicamente y maneje el hipotiroidismo según corresponda.
5.14 Proteinuria
En el ensayo aleatorizado de CCR (VEG105192), la proteinuria ocurrió en el 9% de 290 pacientes que recibieron comprimidos de pazopanib. En 2 pacientes, la proteinuria condujo a la suspensión de los comprimidos de pazopanib.
En el ensayo aleatorizado de STS (VEG110727), la proteinuria ocurrió en el 1% de 240 pacientes y el síndrome nefrótico ocurrió en 1 paciente. Se suspendió el tratamiento en el paciente con síndrome nefrótico.
Realice un análisis de orina de referencia y periódico durante el tratamiento con seguimiento de medición de proteínas en orina de 24 horas según lo indique clínicamente. Suspenda los comprimidos de pazopanib, luego reanúdelos a una dosis reducida o suspéndalos permanentemente según la gravedad de la proteinuria. Suspenda permanentemente en pacientes con síndrome nefrótico [ver Dosificación y Administración (2.2)].
5.15 Síndrome de lisis tumoral
Se han reportado casos de síndrome de lisis tumoral (SLT), incluidos casos fatales, en pacientes con CCR y STS tratados con comprimidos de pazopanib [ver Reacciones adversas (6.2)]. Los pacientes pueden estar en riesgo de SLT si tienen tumores de crecimiento rápido, una carga tumoral alta, disfunción renal o deshidratación. Monitoree de cerca a los pacientes en riesgo, considere la profilaxis apropiada y trate según lo indique clínicamente.
5.16 Infección
Se han reportado infecciones graves (con o sin neutropenia), incluidas algunas con desenlace fatal. Monitoree a los pacientes para detectar signos y síntomas de infección. Instituya una terapia anti-infecciosa apropiada de inmediato y considere la interrupción o suspensión de los comprimidos de pazopanib en caso de infecciones graves.
5.17 Aumento de la toxicidad con otra terapia contra el cáncer
Los comprimidos de pazopanib no están indicados para su uso en combinación con otros agentes. Los ensayos clínicos de los comprimidos de pazopanib en combinación con pemetrexed y lapatinib se terminaron temprano debido a una mayor toxicidad y mortalidad. Las toxicidades fatales observadas incluyeron hemorragia pulmonar, hemorragia gastrointestinal y muerte súbita. No se ha establecido una dosis segura y efectiva en combinación con estos regímenes.
5.18 Mayor toxicidad en órganos en desarrollo
No se ha establecido la seguridad y eficacia de los comprimidos de pazopanib en pacientes pediátricos. Los comprimidos de pazopanib no están indicados para su uso en pacientes pediátricos. Según su mecanismo de acción, el pazopanib puede tener efectos graves en el crecimiento y la maduración de órganos en pacientes menores de 2 años [ver Uso en poblaciones específicas (8.4)].
5.19 Toxicidad embrio-fetal
Según los hallazgos de estudios en animales y su mecanismo de acción, los comprimidos de pazopanib pueden causar daño fetal cuando se administran a una mujer embarazada. La administración de pazopanib a ratas y conejos embarazadas durante el período de organogénesis resultó en toxicidad materna, teratogenicidad y aborto a exposiciones sistémicas más bajas que las observadas en la dosis máxima recomendada en humanos (DMRH) de 800 mg (según el área bajo la curva [ABC]).
Advierta a las mujeres embarazadas sobre el riesgo potencial para el feto. Aconseje a las mujeres con potencial reproductivo que usen métodos anticonceptivos efectivos durante el tratamiento con comprimidos de pazopanib y durante al menos 2 semanas después de la dosis final. Aconseje a los hombres (incluidos aquellos que se hayan sometido a una vasectomía) con parejas de sexo femenino con potencial reproductivo que usen preservativos durante el tratamiento con comprimidos de pazopanib y durante al menos 2 semanas después de la última dosis [ver Uso en poblaciones específicas (8.1, 8.3)].
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas clínicamente significativas se encuentran en otras secciones de la etiqueta:
- Toxicidad hepática [ver Advertencias y Precauciones (5.1)]
- Prolongación del QT y Torsades de Pointes [ver Advertencias y Precauciones (5.2)]
- Disfunción cardíaca [ver Advertencias y Precauciones (5.3)]
- Eventos hemorrágicos [ver Advertencias y Precauciones (5.4)]
- Eventos tromboembólicos arteriales [ver Advertencias y Precauciones (5.5)]
- Eventos tromboembólicos venosos [ver Advertencias y Precauciones (5.6)]
- Microangiopatía trombótica (TMA) [ver Advertencias y Precauciones (5.7)]
- Perforación gastrointestinal y fístula [ver Advertencias y Precauciones (5.8)]
- Enfermedad pulmonar intersticial (ILD)/Neumonitis [ver Advertencias y Precauciones (5.9)]
- Síndrome de encefalopatía posterior reversible (PRES) [ver Advertencias y Precauciones (5.10)]
- Hipertensión [ver Advertencias y Precauciones (5.11)]
- Hipotiroidismo [ver Advertencias y Precauciones (5.13)]
- Proteinuria [ver Advertencias y Precauciones (5.14)]
- Síndrome de lisis tumoral [ver Advertencias y Precauciones (5.15)]
- Infección [ver Advertencias y Precauciones (5.16)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no pueden compararse directamente con las tasas de los ensayos clínicos de otro medicamento y es posible que no reflejen las tasas observadas en la práctica.
Los datos descritos en la sección ADVERTENCIAS Y PRECAUCIONES reflejan la exposición de 977 pacientes que recibieron tabletas de pazopanib como agente único, incluyendo 586 pacientes tratados con pazopanib con CCR. Con una duración media de tratamiento de 7.4 meses (rango, 0.1 a 27.6) en estos 977 pacientes, las reacciones adversas más comunes (≥ 20%) en estos 586 pacientes fueron diarrea, hipertensión, cambio de color del cabello, náuseas, fatiga, anorexia y vómitos.
Los datos descritos en ADVERTENCIAS Y PRECAUCIONES también reflejan la exposición de 382 pacientes con sarcoma de tejidos blandos avanzados que recibieron tabletas de pazopanib como agente único, con una duración media de tratamiento de 3.6 meses (rango, 0 a 53). Las reacciones adversas más comunes (≥ 20%) en estos 382 pacientes fueron fatiga, diarrea, náuseas, disminución de peso, hipertensión, disminución del apetito, vómitos, dolor tumoral, cambios de color del cabello, dolor musculoesquelético, cefalea, disgeusia, disnea e hipopigmentación de la piel.
Carcinoma de células renales
La seguridad de las tabletas de pazopanib se evaluó en 290 pacientes con CCR que participaron en VEG105192, un ensayo aleatorizado, doble ciego, controlado con placebo [ver Estudios Clínicos (14.1)]. La duración media del tratamiento fue de 7.4 meses (rango, 0 a 23) para los pacientes que recibieron tabletas de pazopanib.
El cuarenta y dos por ciento de los pacientes con pazopanib requirieron una interrupción de la dosis y el 36% requirieron una reducción de la dosis.
La Tabla 3 presenta las reacciones adversas en VEG105192.
Tabla 3. Reacciones adversas (≥ 10%) en pacientes con CCR que recibieron tabletas de pazopanib en VEG105192
| Reacciones adversas | Tabletas de pazopanib (N = 290) |
Placebo (N = 145) |
||||
| Todos los gradosa | Grado 3 | Grado 4 | Todos los gradosa | Grado 3 | Grado 4 | |
| % | % | % | % | % | % | |
| Diarrea | 52 | 3 | < 1 | 9 | < 1 | 0 |
| Hipertensión | 40 | 4 | 0 | 10 | < 1 | 0 |
| Cambios de color del cabello | 38 | < 1 | 0 | 3 | 0 | 0 |
| Náuseas | 26 | < 1 | 0 | 9 | 0 | 0 |
| Anorexia | 22 | 2 | 0 | 10 | < 1 | 0 |
| Vómitos | 21 | 2 | < 1 | 8 | 2 | 0 |
| Fatiga | 19 | 2 | 0 | 8 | 1 | 1 |
| Astenia | 14 | 3 | 0 | 8 | 0 | 0 |
| Dolor abdominal | 11 | 2 | 0 | 1 | 0 | 0 |
| Cefalea | 10 | 0 | 0 | 5 | 0 | 0 |
Abreviatura: CCR, carcinoma de células renales.a Criterios Terminológicos Comunes para Eventos Adversos del Instituto Nacional del Cáncer, versión 3.
Otras reacciones adversas observadas con más frecuencia en pacientes tratados con tabletas de pazopanib que con placebo y que ocurrieron en < 10% (cualquier grado) fueron alopecia (8% versus < 1%), dolor en el pecho (5% versus 1%), disgeusia (8% versus < 1%), dispepsia (5% versus < 1%), disfonía (4% versus < 1%), edema facial (1% versus 0%), eritrodisestesia palmoplantar (6% versus < 1%), proteinuria (9% versus 0%), erupción cutánea (8% versus 3%), despigmentación de la piel (3% versus 0%) y disminución de peso (9% versus 3%).
La Tabla 4 presenta las anormalidades de laboratorio en VEG105192.
Tabla 4. Anormalidades de laboratorio seleccionadas (> 10%) en pacientes con CCR que recibieron tabletas de pazopanib con una diferencia entre brazos de ≥ 5% en comparación con placebo en VEG105192
| Parámetros | Tabletas de pazopanib (N = 290) |
Placebo (N = 145) |
||||
| Todos los gradosa | Grado 3 | Grado 4 | Todos los gradosa | Grado 3 | Grado 4 | |
| % | % | % | % | % | % | |
| Química | ||||||
| ALT aumentada | 53 | 10 | 2 | 22 | 1 | 0 |
| AST aumentada | 53 | 7 | < 1 | 19 | < 1 | 0 |
| Glucosa aumentada | 41 | < 1 | 0 | 33 | 1 | 0 |
| Bilirrubina total aumentada | 36 | 3 | < 1 | 10 | 1 | < 1 |
| Fósforo disminuido | 34 | 4 | 0 | 11 | 0 | 0 |
| Sodio disminuido | 31 | 4 | 1 | 24 | 4 | 0 |
| Magnesio disminuido | 26 | < 1 | 1 | 14 | 0 | 0 |
| Glucosa disminuida | 17 | 0 | < 1 | 3 | 0 | 0 |
| Hematológica | ||||||
| Leucopenia | 37 | 0 | 0 | 6 | 0 | 0 |
| Neutropenia | 34 | 1 | < 1 | 6 | 0 | 0 |
| Trombocitopenia | 32 | < 1 | < 1 | 5 | 0 | < 1 |
| Linfocitopenia | 31 | 4 | < 1 | 24 | 1 | 0 |
Abreviaturas: ALT, alanina aminotransferasa; AST, aspartato aminotransferasa; CCR, cáncer de células renales.
a Criterios terminológicos comunes para eventos adversos del Instituto Nacional del Cáncer, versión 3.
Otras reacciones adversas de otros ensayos clínicos en pacientes con CCR que recibieron tabletas de pazopanib incluyen artralgia y espasmos musculares.
Sarcoma de tejidos blandos
La seguridad de las tabletas de pazopanib se evaluó en 240 pacientes que participaron en VEG110727, un ensayo aleatorizado, doble ciego, controlado con placebo [ver Estudios Clínicos (14.2)]. La duración media del tratamiento fue de 4.5 meses (rango, 0 a 24) para los pacientes que recibieron tabletas de pazopanib.
El cincuenta y ocho por ciento de los pacientes con tabletas de pazopanib requirieron una interrupción de la dosis y el 38% requirieron una reducción de la dosis. El diecisiete por ciento de los pacientes que recibieron tabletas de pazopanib discontinuaron la terapia debido a reacciones adversas.
La Tabla 5 presenta las reacciones adversas en VEG110727.
Tabla 5. Reacciones adversas (≥ 10%) en pacientes con STS que recibieron tabletas de pazopanib en VEG110727
| Reacciones adversas | Tabletas de Pazopanib (N = 240) |
Placebo (N = 123) |
||||
| TodosGradosa | Grado 3 | Grado 4 | TodosGradosa | Grado 3 | Grado 4 | |
| % | % | % | % | % | % | |
| Fatiga | 65 | 13 | 1 | 48 | 4 | 1 |
| Diarrea | 59 | 5 | 0 | 15 | 1 | 0 |
| Náuseas | 56 | 3 | 0 | 22 | 2 | 0 |
| Disminución de peso | 48 | 4 | 0 | 15 | 0 | 0 |
| Hipertensión | 42 | 7 | 0 | 6 | 0 | 0 |
| Disminución del apetito | 40 | 6 | 0 | 19 | 0 | 0 |
| Cambios en el color del cabello | 39 | 0 | 0 | 2 | 0 | 0 |
| Vómitos | 33 | 3 | 0 | 11 | 1 | 0 |
| Dolor tumoral | 29 | 8 | 0 | 21 | 7 | 2 |
| Disgeusia | 28 | 0 | 0 | 3 | 0 | 0 |
| Cefalea | 23 | 1 | 0 | 8 | 0 | 0 |
| Dolor musculoesquelético | 23 | 2 | 0 | 20 | 2 | 0 |
| Mialgia | 23 | 2 | 0 | 9 | 0 | 0 |
| Dolor gastrointestinal | 23 | 3 | 0 | 9 | 4 | 0 |
| Disnea | 20 | 5 | < 1 | 17 | 5 | 1 |
| Erupción exfoliativa | 18 | < 1 | 0 | 9 | 0 | 0 |
| Tos | 17 | < 1 | 0 | 12 | < 1 | 0 |
| Edema periférico | 14 | 2 | 0 | 9 | 2 | 0 |
| Mucositis | 12 | 2 | 0 | 2 | 0 | 0 |
| Alopecia | 12 | 0 | 0 | 1 | 0 | 0 |
| Mareos | 11 | 1 | 0 | 4 | 0 | 0 |
| Trastorno de la pielb | 11 | 2 | 0 | 1 | 0 | 0 |
| Hipopigmentación de la piel | 11 | 0 | 0 | 0 | 0 | 0 |
| Estomatitis | 11 | < 1 | 0 | 3 | 0 | 0 |
| Dolor en el pecho | 10 | 2 | 0 | 6 | 0 | 0 |
Abreviatura: STS, sarcoma de tejidos blandos.
aNational Cancer Institute Common Terminology Criteria for Adverse Events, versión 3.
b27 de los 28 casos de trastorno de la piel fueron eritrodisestesia palmoplantar.
Otras reacciones adversas observadas con más frecuencia en pacientes tratados con tabletas de pazopanib que ocurrieron en ≥ 5% de los pacientes y con una incidencia de más del 2% de diferencia con el placebo incluyeron insomnio (9% versus 6%), hipotiroidismo (8% versus 0%), disfonía (8% versus 2%), epistaxis (8% versus 2%), disfunción ventricular izquierda (8% versus 4%), dispepsia (7% versus 2%), piel seca (6% versus < 1%), escalofríos (5% versus 1%), visión borrosa (5% versus 2%) y trastorno de las uñas (5% versus 0%).
La Tabla 6 presenta las anormalidades de laboratorio en VEG110727.
Tabla 6. Anormalidades de laboratorio seleccionadas (> 10%) en pacientes con STS que recibieron tabletas de pazopanib con una diferencia entre los brazos de ≥ 5% en comparación con el placebo en VEG110727
| Parámetros | Tabletas de Pazopanib (N = 240) |
Placebo (N = 123) |
||||
| Todos Gradosa | Grado 3 | Grado 4 | Todos Gradosa | Grado 3 | Grado 4 | |
| % | % | % | % | % | % | |
| Química | ||||||
| AST aumentada | 51 | 5 | 3 | 22 | 2 | 0 |
| ALT aumentada | 46 | 8 | 2 | 18 | 2 | 1 |
| Glucosa aumentada | 45 | < 1 | 0 | 35 | 2 | 0 |
| Albúmina disminuida | 34 | 1 | 0 | 21 | 0 | 0 |
| Fosfatasa alcalina aumentada | 32 | 3 | 0 | 23 | 1 | 0 |
| Sodio disminuido | 31 | 4 | 0 | 20 | 3 | 0 |
| Bilirrubina total aumentada | 29 | 1 | 0 | 7 | 2 | 0 |
| Potasio aumentado | 16 | 1 | 0 | 11 | 0 | 0 |
| Hematológico | ||||||
| Leucopenia | 44 | 1 | 0 | 15 | 0 | 0 |
| Linfocitopenia | 43 | 10 | 0 | 36 | 9 | 2 |
| Trombocitopenia | 36 | 3 | 1 | 6 | 0 | 0 |
| Neutropenia | 33 | 4 | 0 | 7 | 0 | 0 |
Abreviaturas: ALT, alanina aminotransferasa; AST, aspartato aminotransferasa; STS, sarcoma de tejidos blandos.
aNational Cancer Institute Common Terminology Criteria for Adverse Events, versión 3.
Otras reacciones adversas clínicamente relevantes
Elevaciones de lipasa
En un ensayo de un solo brazo de CCR (VEG102616), se observó lipasa elevada en el 27% de los 181 pacientes con datos de laboratorio disponibles. La lipasa elevada como reacción adversa se informó en el 4% de los 225 pacientes, incluido el 2,7% (6/225) con Grado 3 y el 0,4% (1/225) con Grado 4. En los ensayos de CCR, se observó pancreatitis clínica en <1% de 586 pacientes.
Neumotórax
Dos de 290 pacientes (0,7%) tratados con comprimidos de pazopanib en el ensayo aleatorizado de CCR (VEG105192) y 8 de 240 pacientes (3,3%) tratados con comprimidos de pazopanib en el ensayo aleatorizado de STS (VEG110727) desarrollaron un neumotórax.
Bradicardia
En el ensayo aleatorizado de CCR (VEG105192), se observó bradicardia según los signos vitales (<60 latidos por minuto) en el 19% de los 280 pacientes tratados con comprimidos de pazopanib. La bradicardia se informó como una reacción adversa en el 2% de los 290 pacientes.
En el ensayo aleatorizado de STS (VEG110727), se observó bradicardia según los signos vitales (<60 latidos por minuto) en el 19% de los 238 pacientes tratados con comprimidos de pazopanib. La bradicardia se informó como una reacción adversa en el 2% de los 240 pacientes.
Reacciones Adversas en Pacientes de Asia Oriental
En un análisis de datos agrupados de ensayos clínicos (N = 1.938) con comprimidos de pazopanib, se observaron con mayor frecuencia neutropenia (12% versus 2%), trombocitopenia (6% versus <1%) y eritrodisestesia palmoplantar (6% versus 2%) de Grado 3 y Grado 4 en pacientes de ascendencia de Asia Oriental que en pacientes de ascendencia no asiática oriental.
6.2 Experiencia Posterior a la Comercialización
Las siguientes reacciones adversas han sido identificadas durante el uso posterior a la aprobación de los comprimidos de pazopanib. Debido a que estas reacciones se reportan voluntariamente en una población de tamaño incierto, no siempre es posible estimar de manera confiable la frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos Sanguíneos y Linfáticos: Policitemia
Trastornos Oculares: Desprendimiento/desgarro de retina
Trastornos Gastrointestinales: Pancreatitis
Trastorno Metabólico y Nutricional: Síndrome de lisis tumoral (incluyendo casos fatales)
Trastornos Vasculares: Aneurismas arteriales (incluyendo aórticos), disecciones y ruptura (incluyendo casos fatales)
7 INTERACCIONES DE MEDICAMENTOS
7.1 Efecto de Otros Medicamentos sobre las Tabletas de Pazopanib
Inhibidores Potentes del CYP3A4
La coadministración de pazopanib con inhibidores potentes del CYP3A4 aumenta las concentraciones de pazopanib [ver Farmacología Clínica (12.3)]. Evite la coadministración de las tabletas de pazopanib con inhibidores potentes del CYP3A4 y considere un medicamento concomitante alternativo sin potencial de inhibición enzimática o mínimo. Si no se puede evitar la coadministración de un inhibidor potente del CYP3A4, reduzca la dosis de las tabletas de pazopanib [ver Dosificación y Administración (2.4)].
Inductores Potentes del CYP3A4
La coadministración de inductores potentes del CYP3A4 puede disminuir las concentraciones plasmáticas de pazopanib. Considere un medicamento concomitante alternativo sin potencial de inducción enzimática o mínimo. No se recomiendan las tabletas de pazopanib si no se puede evitar el uso crónico de inductores potentes del CYP3A4 [ver Dosificación y Administración (2.4)].
Transportadores
La coadministración de inhibidores potentes de P-gp o BCRP puede aumentar las concentraciones de pazopanib. Evite el uso concomitante de las tabletas de pazopanib con inhibidores potentes de P-gp o BCRP. Considere la selección de productos medicinales concomitantes alternativos sin potencial para inhibir P-gp o BCRP o con un potencial mínimo.
7.2 Efectos de las Tabletas de Pazopanib sobre Otros Medicamentos
Sustratos del CYP
La coadministración de las tabletas de pazopanib con agentes con ventanas terapéuticas estrechas que son metabolizados por CYP3A4, CYP2D6 o CYP2C8 puede resultar en la inhibición del metabolismo de estos productos y crear el potencial de reacciones adversas graves. No se recomienda el uso concomitante de las tabletas de pazopanib con agentes con ventanas terapéuticas estrechas que son metabolizados por CYP3A4, CYP2D6 o CYP2C8 [ver Farmacología Clínica (12.3)].
7.3 Uso Concomitante con Simvastatina
El uso concomitante de las tabletas de pazopanib con simvastatina aumenta la incidencia de elevaciones de ALT. En los ensayos clínicos de las tabletas de pazopanib como agente único, se informó ALT > 3 x LSN en 126/895 (14%) de los pacientes que no usaron estatinas en comparación con 11/41 (27%) de los pacientes que tuvieron uso concomitante de simvastatina. Si un paciente que recibe simvastatina concomitante desarrolla elevaciones de ALT, aumente el monitoreo semanal de la función hepática según lo recomendado. Suspenda las tabletas de pazopanib y reanude con dosis reducida, o interrumpa permanentemente según la gravedad de la hepatotoxicidad [ver Dosificación y Administración (2.2), Advertencias y Precauciones (5.1)]. No hay datos suficientes para evaluar el riesgo de la administración concomitante de estatinas alternativas y las tabletas de pazopanib.
7.4 Uso Concomitante con Agentes Reductores de la Acidez Gástrica
El uso concomitante de las tabletas de pazopanib con esomeprazol, un IBP, disminuyó la exposición al pazopanib. Evite el uso concomitante de las tabletas de pazopanib con agentes reductores de la acidez gástrica. Si no se puede evitar la administración concomitante con un agente reductor de la acidez gástrica, considere antiacidosacidez de acción corta en lugar de IBP y antagonistas de los receptores H2. Separe la dosificación de antiacidosacidez de acción corta y pazopanib por varias horas para evitar una reducción en la exposición al pazopanib [ver Dosificación y Administración (2.4), Farmacología Clínica (12.3)].
7.5 Medicamentos que Prolongan el Intervalo QT
El pazopanib se asocia con la prolongación del intervalo QTc [ver Advertencias y Precauciones (5.2), Farmacología Clínica (12.2)]. Evite la coadministración de las tabletas de pazopanib con medicamentos conocidos por prolongar el intervalo QT/QTc.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de riesgos
Según los estudios de reproducción en animales y su mecanismo de acción [ver Farmacología Clínica (12.1)], las tabletas de pazopanib pueden causar daño fetal cuando se administran a una mujer embarazada. No existen datos disponibles sobre el uso de tabletas de pazopanib en mujeres embarazadas para evaluar el riesgo asociado al fármaco. En los estudios de toxicología del desarrollo y la reproducción en animales, la administración oral de pazopanib a ratas y conejas preñadas durante la organogénesis resultó en teratogenicidad y aborto a exposiciones sistémicas más bajas que las observadas con la DRHM de 800 mg/día (basado en el AUC) (ver Datos). Se debe advertir a las mujeres embarazadas sobre el riesgo potencial para el feto.
El riesgo estimado de defectos congénitos mayores y abortos espontáneos para la población indicada es desconocido. Todos los embarazos conllevan un riesgo de base de defectos congénitos, pérdida u otros resultados adversos. En la población general de EE. UU., el riesgo estimado de defectos congénitos mayores en embarazos clínicamente reconocidos y de abortos espontáneos es del 2% al 4% y del 15% al 20%, respectivamente.
Datos
Datos de animales
En un estudio de fertilidad femenina y desarrollo embrionario temprano, se administraron dosis orales de pazopanib a ratas hembras al menos 15 días antes del apareamiento y durante 6 días después del apareamiento, lo que resultó en un aumento de la pérdida pre-implantación y reabsorciones tempranas a dosis iguales o superiores a 30 mg/kg/día (aproximadamente 0,4 veces el AUC en la DRHM de 800 mg/día). Se observó reabsorción total de la camada a 300 mg/kg/día (aproximadamente 0,8 veces el AUC en la DRHM de 800 mg/día). Se observó pérdida postimplantación, embrioletal y disminución del peso fetal en hembras a las que se administraron dosis iguales o superiores a 10 mg/kg/día (aproximadamente 0,3 veces el AUC en la DRHM de 800 mg/día).
En estudios de toxicidad embriofetal en ratas y conejas, se administró pazopanib oral a los animales preñados durante la organogénesis. En ratas, dosis iguales o superiores a 3 mg/kg/día (aproximadamente 0,1 veces el AUC en la DRHM de 800 mg/día) resultaron en efectos teratogénicos, incluyendo malformaciones cardiovasculares (arteria subclavia retroesofágica, arteria innominada ausente, cambios en el arco aórtico), osificación incompleta o ausente, aumento de la pérdida postimplantación, letalidad embrionaria y reducción del peso fetal. En conejas, se observó toxicidad materna, aumento de la pérdida postimplantación y abortos a dosis iguales o superiores a 30 mg/kg/día (aproximadamente 0,007 veces el AUC en la DRHM de 800 mg/día). Además, se observó una pérdida severa de peso corporal materno y pérdida total de la camada al 100% a dosis iguales o superiores a 100 mg/kg/día (0,02 veces el AUC en la DRHM de 800 mg/día), mientras que el peso fetal se redujo a dosis iguales o superiores a 3 mg/kg/día (AUC no calculado).
8.2 Lactancia
Resumen de riesgos
No hay datos sobre la presencia de pazopanib o sus metabolitos en la leche humana o sus efectos en el lactante o la producción de leche. Debido al potencial de reacciones adversas graves en lactantes, se debe aconsejar a las mujeres que no amamanten durante el tratamiento con tabletas de pazopanib y durante 2 semanas después de la última dosis.
8.3 Mujeres y hombres con potencial reproductivo
Las tabletas de pazopanib pueden causar daño fetal cuando se administran a una mujer embarazada [ver Uso en Poblaciones Específicas (8.1)].
Prueba de embarazo
Verificar el estado de embarazo de las mujeres con potencial reproductivo antes de iniciar el tratamiento con tabletas de pazopanib.
Anticoncepción
Mujeres
Aconsejar a las mujeres con potencial reproductivo que usen un método anticonceptivo eficaz durante el tratamiento con tabletas de pazopanib y durante al menos 2 semanas después de la última dosis.
Hombres
Aconsejar a los hombres (incluidos aquellos a los que se les ha practicado una vasectomía) con parejas femeninas con potencial reproductivo que usen preservativos durante el tratamiento con tabletas de pazopanib y durante al menos 2 semanas después de la última dosis.
Infertilidad
Según los hallazgos de estudios en animales, las tabletas de pazopanib pueden afectar la fertilidad en mujeres y hombres con potencial reproductivo mientras reciben el tratamiento [ver Toxicología No Clínica (13.1)].
8.4 Uso pediátrico
La seguridad y eficacia de las tabletas de pazopanib en pacientes pediátricos no se han establecido.
Las tabletas de pazopanib no están indicadas para su uso en pacientes pediátricos [ver Advertencias y Precauciones (5.18)]. Según su mecanismo de acción, el pazopanib puede tener efectos graves sobre el crecimiento y la maduración de los órganos durante el desarrollo postnatal temprano. La administración de pazopanib a ratas jóvenes < 21 días resultó en toxicidad para los pulmones, hígado, corazón y riñones, y en la muerte a dosis significativamente más bajas que la dosis recomendada clínicamente o las dosis toleradas en animales mayores (ver Datos de toxicidad en animales jóvenes).
La seguridad y eficacia de las tabletas de pazopanib o una formulación no aprobada de pazopanib se investigaron, pero no se establecieron en dos estudios abiertos: un estudio en 37 pacientes pediátricos de 2 a < 17 años con tumores sólidos recurrentes o refractarios [NCT00929903] y un estudio en 46 pacientes pediátricos de 1 año a < 17 años con tumores sólidos refractarios, incluyendo sarcoma [NCT01956669]. No se observó una actividad antitumoral significativa en estos estudios.
Datos de toxicidad en animales jóvenes
En ratas, el destete ocurre en el Día 21 posparto, lo que equivale aproximadamente a una edad pediátrica humana de 2 años. En un estudio de toxicidad en animales jóvenes realizado en ratas, cuando los animales fueron dosificados desde el Día 9 hasta el Día 14 después del parto (antes del destete), el pazopanib causó un crecimiento/maduración anormal de los órganos en el riñón, pulmón, hígado y corazón a aproximadamente 0,1 veces el AUC en adultos con la DRHM de 800 mg/día de pazopanib. A aproximadamente 0,4 veces el AUC en adultos con la DRHM de 800 mg/día, la administración de pazopanib resultó en mortalidad.
En estudios de toxicología de dosis repetidas en ratas, incluyendo la administración durante 4, 13 y 26 semanas, se observaron toxicidades en huesos, dientes y lechos ungueales con dosis iguales o superiores a 3 mg/kg/día (aproximadamente 0,07 veces el AUC a la MRHD de 800 mg/día). Las dosis de 300 mg/kg/día (aproximadamente 0,8 veces el AUC a la MRHD de 800 mg/día) no se toleraron en estudios de 13 y 26 semanas y fue necesario reducir las dosis debido a la pérdida de peso corporal y la morbilidad. Se observó hipertrofia de las placas de crecimiento epifisario, anomalías ungueales (incluyendo uñas rotas, demasiado largas o ausentes) y anomalías dentales en los dientes incisivos en crecimiento (incluyendo dientes excesivamente largos, frágiles, rotos y ausentes, y degeneración y adelgazamiento de la dentina y el esmalte) en ratas con dosis iguales o superiores a 30 mg/kg/día (aproximadamente 0,35 veces el AUC a la MRHD de 800 mg/día) a las 26 semanas, notándose clínicamente los primeros signos de alteraciones dentales y en los lechos ungueales después de 4 a 6 semanas. Se observaron hallazgos similares en estudios de dosis repetidas en ratas jóvenes a las que se administró pazopanib desde el día 21 posparto (después del destete). En los animales destetados, la aparición de cambios en los dientes y huesos se produjo antes y con mayor severidad que en los animales mayores. Hubo evidencia de degeneración dental y disminución del crecimiento óseo con dosis iguales o superiores a 30 mg/kg (aproximadamente 0,1 a 0,2 veces el AUC a la MRHD de 800 mg/día). La exposición al pazopanib en las ratas jóvenes fue menor que en los animales adultos que recibieron las mismas dosis, según los valores de AUC comparativos. Con dosis de pazopanib aproximadamente 0,5 a 0,7 veces el AUC a la MRHD de 800 mg/día, la disminución del crecimiento óseo en ratas jóvenes persistió incluso después de finalizar el período de dosificación. Finalmente, a pesar de las exposiciones al pazopanib menores que las reportadas en animales adultos o humanos adultos, las ratas jóvenes a las que se administró 300 mg/kg/dosis de pazopanib requirieron reducción de dosis dentro de las 4 semanas posteriores al inicio de la dosificación debido a una toxicidad significativa, aunque los animales adultos pudieron tolerar esta misma dosis durante al menos 3 veces más tiempo [ver Advertencias y precauciones (5.18)].
8.5 Uso geriátrico
En ensayos clínicos agrupados con comprimidos de pazopanib, el 30% de los 2.080 pacientes tenían ≥ 65 años. Más pacientes ≥ 65 años presentaron elevaciones de ALT > 3 x LSN en comparación con los pacientes < 65 años (23% versus 18%) [ver Advertencias y precauciones (5.1)].
En los ensayos de CCR, el 33% de los 586 pacientes tenían ≥ 65 años. No se observaron diferencias generales en la seguridad o eficacia de los comprimidos de pazopanib entre estos pacientes y los más jóvenes.
En los ensayos de STS, el 24% de los 382 pacientes tenían ≥ 65 años. Los pacientes ≥ 65 años presentaron una mayor incidencia de fatiga de grado 3 o 4 (19% versus 12% para pacientes < 65 años), hipertensión (10% versus 6%), disminución del apetito (11% versus 2%), elevaciones de ALT (3% versus 2%) y elevaciones de AST (4% versus 1%). En el ensayo aleatorizado de STS (VEG110727), no se observaron diferencias generales en la eficacia de los comprimidos de pazopanib entre los pacientes ≥ 65 años y los más jóvenes.
8.6 Insuficiencia renal
No se recomienda un ajuste de dosis para pacientes con insuficiencia renal. Los comprimidos de pazopanib no se han estudiado en pacientes con insuficiencia renal grave o en pacientes en diálisis peritoneal o hemodiálisis.
8.7 Insuficiencia hepática
No se requiere ajuste de dosis en pacientes con insuficiencia hepática leve (bilirrubina total ≤ LSN y ALT > LSN o bilirrubina > 1 a 1,5 x LSN y cualquier valor de ALT). No se recomiendan los comprimidos de pazopanib en pacientes con insuficiencia hepática moderada (bilirrubina total > 1,5 a 3 x LSN y cualquier valor de ALT) y grave (bilirrubina total > 3 x LSN y cualquier valor de ALT) [ver Dosificación y administración (2.3), Farmacología clínica (12.3)].
10 SOBREDOSIS
Se observó toxicidad limitante de la dosis (fatiga de Grado 3) e hipertensión de Grado 3 en 1 de 3 pacientes con dosis de 2,000 mg diarios (2.5 veces la dosis recomendada) y 1,000 mg diarios (1.25 veces la dosis recomendada), respectivamente.
Proporcionar medidas de apoyo general para manejar una sobredosis. No se espera que la hemodiálisis mejore la eliminación de las tabletas de pazopanib porque pazopanib no se excreta significativamente por vía renal y está altamente unido a las proteínas plasmáticas.
11 DESCRIPCIÓN
Pazopanib es un inhibidor de la quinasa. Pazopanib se presenta como sal de clorhidrato, con el nombre químico 5-[[4-[(2,3-Dimetil-2H-indazol-6-il)metilamino]pirimidin-2-il]amino]-2-metilbencenosulfonamida monohidrocloruro. Tiene la fórmula molecular C21H23N7O2S·HCl y un peso molecular de 473,98 g/mol. El clorhidrato de pazopanib tiene la siguiente estructura química:
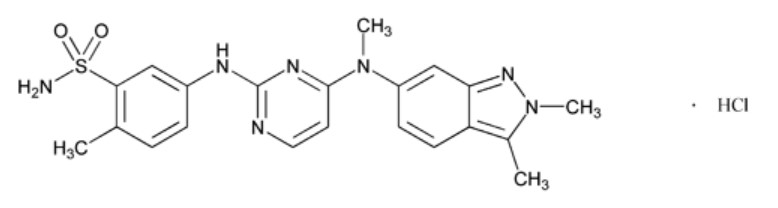
El clorhidrato de pazopanib es un sólido de color blanco a amarillo pálido. Es muy ligeramente soluble en soluciones acuosas, siendo prácticamente insoluble por encima de pH 4.
Los comprimidos de pazopanib son para uso oral. Cada comprimido de 200 mg de pazopanib contiene 200 mg de pazopanib equivalente a 216,7 mg de clorhidrato de pazopanib. Los ingredientes inactivos de los comprimidos de pazopanib son: Núcleo del comprimido: estearato de magnesio, celulosa microcristalina, povidona y glicolato sódico de almidón. Recubrimiento: Recubrimiento pelicular gris: hidroxipropilcelulosa, hidroxipropilmetilcelulosa, óxido de hierro negro, polietilenglicol 8000 y dióxido de titanio.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Pazopanib es un inhibidor multi-tirosina quinasa del receptor del factor de crecimiento endotelial vascular (VEGFR)-1, VEGFR-2, VEGFR-3, receptor del factor de crecimiento derivado de plaquetas (PDGFR)-α y -β, receptor del factor de crecimiento de fibroblastos (FGFR)-1 y -3, receptor de citoquinas (Kit), quinasa T-celular inducible por la interleucina-2 (Itk), quinasa específica de linfocitos (Lck), y receptor de tirosina quinasa de glucoproteína transmembrana (c-Fms). In vitro, pazopanib inhibió la autofosforilación inducida por ligando de los receptores VEGFR-2, Kit y PDGFR-β. In vivo, pazopanib inhibió la fosforilación de VEGFR-2 inducida por VEGF en pulmones de ratón, la angiogénesis en un modelo de ratón y el crecimiento de algunos xenoinjertos de tumor humano en ratones.
12.2 Farmacodinamia
Se han observado aumentos en la presión arterial que están relacionados con las concentraciones en el valle en el estado estacionario de pazopanib en plasma.
Electrofisiología cardíaca
El potencial de prolongación del QT de pazopanib se evaluó en un ensayo aleatorizado, enmascarado, paralelo (N = 96) utilizando moxifloxacino como control positivo. Se administraron tabletas de pazopanib 800 mg por vía oral en condiciones de ayuno los días 2 a 8, y 1.600 mg el día 9 después de una comida para aumentar la exposición a pazopanib y sus metabolitos. No se detectaron cambios importantes (es decir, > 20 msec) en el intervalo QTc después de la exposición a pazopanib en este ensayo de QT. El ensayo no pudo excluir cambios pequeños (< 10 msec) en el intervalo QTc, porque la sensibilidad del ensayo por debajo de este umbral (< 10 msec) no se estableció en este ensayo [ver Advertencias y precauciones (5.2)].
12.3 Farmacocinética
La dosis recomendada de 800 mg una vez al día da como resultado un AUC medio de 1.037 mcg•h/mL y una Cmax de 58,1 mcg/mL. No hubo un aumento constante en el AUC o la Cmax con dosis de pazopanib superiores a 800 mg.
La administración de una tableta triturada de 400 mg aumentó el AUC0-72h en un 46% y la Cmax aproximadamente 2 veces y disminuyó la Tmax aproximadamente 2 horas en comparación con la administración de la tableta entera [ver Dosificación y administración (2.1)].
Absorción
El tiempo medio para alcanzar las concentraciones máximas fue de 2 a 4 horas después de una dosis.
Efecto de los alimentos
La exposición sistémica a pazopanib aumenta cuando se administra con alimentos. La administración de pazopanib con una comida alta en grasa (aproximadamente 50% de grasa) o baja en grasa (aproximadamente 5% de grasa) da como resultado un aumento aproximado de 2 veces en el AUC y la Cmax.
Distribución
La unión de pazopanib a la proteína plasmática humana in vivo fue > 99% sin dependencia de la concentración en el rango de 10 a 100 mcg/mL. Los estudios in vitro sugieren que pazopanib es un sustrato para P-gp y BCRP.
Eliminación
Pazopanib tiene una semivida media de 31 horas después de la administración de la dosis recomendada de 800 mg.
Metabolismo
Los estudios in vitro demostraron que pazopanib es metabolizado por CYP3A4 con una contribución menor de CYP1A2 y CYP2C8.
Excreción
La eliminación es principalmente por las heces y la eliminación renal representa < 4% de la dosis administrada.
Poblaciones específicas
Pacientes con insuficiencia hepática
La Tabla 7 presenta una comparación de los valores medianos de Cmax en el estado estacionario y la AUC0-24h mediana para pacientes con insuficiencia hepática normal, leve, moderada y grave.
La Cmax mediana en estado estacionario y la AUC0-24h mediana de pazopanib después de una dosis de 800 mg una vez al día en pacientes con insuficiencia leve estuvieron en un rango similar a la Cmax mediana en estado estacionario y la AUC0-24h mediana en pacientes sin insuficiencia hepática.
La dosis máxima tolerada de pazopanib en pacientes con insuficiencia hepática moderada fue 200 mg una vez al día. La Cmax mediana en estado estacionario y la AUC0-24h mediana fueron aproximadamente el 43% y el 29%, respectivamente, de los valores medianos correspondientes después de la administración de 800 mg una vez al día en pacientes sin insuficiencia hepática.
La Cmax mediana en estado estacionario y la AUC0-24h mediana fueron aproximadamente el 18% y el 15%, respectivamente, de los valores medianos correspondientes después de la administración de 800 mg una vez al día en pacientes sin insuficiencia hepática.
Tabla 7. Parámetros farmacocinéticos de pazopanib en pacientes con insuficiencia hepática
| Sin insuficiencia hepática | Insuficiencia hepática leve(bilirrubina total ≤ LSN y ALT > LSNobilirrubina total > 1 a 1,5 x LSN y cualquier valor de ALT) | Insuficiencia hepática moderada(bilirrubina total > 1,5 a 3 x LSN y cualquier valor de ALT) | Insuficiencia hepática grave(bilirrubina total > 3 x LSN y cualquier valor de ALT) | |
| Dosis | 800 mg una vez al día | 800 mg una vez al día | 200 mg una vez al día | 200 mg una vez al día |
| Cmax mediana en estado estacionario(rango) mcg/mL | 52 (17 a 86) | 34 (11 a 104) | 22 (4,2 a 33) | 9,4 (2,4 a 24) |
| AUC0-24h mediana(rango)mcg•h/mL | 888 (346 a 1482) | 774 (215 a 2034) | 257 (66 a 488) | 131 (47 a 473) |
Abreviaturas: ALT, alanina aminotransferasa; AUC, área bajo la curva; Cmax, concentración máxima; LSN, límite superior normal.
Estudios de interacción farmacológica
Estudios clínicos
Inhibidor fuerte del CYP3A4: La coadministración de múltiples dosis de 400 mg de tabletas orales de pazopanib con múltiples dosis de 400 mg de ketoconazol oral (inhibidor fuerte de CYP3A4/P-gp) resultó en un aumento de 1,7 veces en el AUC0-24h y un aumento de 1,5 veces en la Cmax de pazopanib [ver Dosificación y Administración (2.4), Interacciones Medicamentosas (7.1)].
Inhibidor débil del CYP3A4: La coadministración de 1.500 mg de lapatinib, un sustrato e inhibidor débil del CYP3A4, P-gp y BCRP, con 800 mg de tabletas de pazopanib resultó en un aumento de aproximadamente 50% a 60% en el AUC0-24h media y Cmax de pazopanib.
Sustratos del CYP1A2, CYP2C9 y CYP2C19: Estudios clínicos, utilizando 800 mg de tabletas de pazopanib una vez al día, han demostrado que el pazopanib no tiene un efecto clínicamente relevante sobre la farmacocinética de la cafeína (sustrato de prueba de CYP1A2), warfarina (sustrato de prueba de CYP2C9) u omeprazol (sustrato de prueba de CYP2C19) en pacientes con cáncer.
Sustratos del CYP3A4, CYP2D6 y CYP2C8: La coadministración de tabletas de pazopanib resultó en un aumento de aproximadamente 30% en el AUC media y Cmax de midazolam (sustrato de prueba de CYP3A4) y aumentos del 33% al 64% en la relación de concentraciones de dextrometorfano a dextrorfano en la orina después de la administración oral de dextrometorfano (sustrato de prueba de CYP2D6). La coadministración de 800 mg de tabletas de pazopanib una vez al día y 80 mg/m2 de paclitaxel (sustrato de CYP3A4 y CYP2C8) una vez por semana resultó en un aumento medio del 26% y 31% en el AUC y Cmax de paclitaxel, respectivamente [ver Interacciones Medicamentosas (7.2)].
Agentes reductores de ácido gástrico: La coadministración de tabletas de pazopanib con esomeprazol, un IBP, disminuyó la exposición de pazopanib en aproximadamente 40% (AUC y Cmax) [ver Dosificación y Administración (2.4), Interacciones Medicamentosas (7.4)].
Estudios In Vitro
Los estudios in vitro con microsomas de hígado humano mostraron que el pazopanib inhibió las actividades de las enzimas CYP 1A2, 3A4, 2B6, 2C8, 2C9, 2C19, 2D6 y 2E1. Se demostró la posible inducción de CYP3A4 humano en un ensayo de receptor X de pregnano (PXR) humano in vitro.
Los estudios in vitro también mostraron que el pazopanib inhibe UGT1A1 y el polipéptido transportador de aniones orgánicos (OATP1B1) con IC50 de 1,2 y 0,79 mcM, respectivamente.
12.5 Farmacogenómica
El pazopanib puede aumentar los niveles séricos de bilirrubina total [ver Advertencias y Precauciones (5.1)]. Los estudios in vitro mostraron que el pazopanib inhibe UGT1A1, que glucuronida la bilirrubina para su eliminación. Un análisis farmacogenético agrupado de 236 pacientes blancos que recibieron tabletas de pazopanib mostró que el genotipo (TA)7/(TA)7 (UGT1A1*28/*28) (susceptibilidad genética subyacente al síndrome de Gilbert) se asoció con un aumento estadísticamente significativo en la incidencia de hiperbilirrubinemia en relación con los genotipos (TA)6/(TA)6 y (TA)6/(TA)7.
En un análisis farmacogenético agrupado de datos de 31 estudios clínicos de pazopanib administrado como monoterapia o en combinación con otros agentes, ALT > 3 x LSN (Grado 2) ocurrió en 32% (42/133) de los portadores del alelo HLA-B*57:01 y en 19% (397/2.101) de los no portadores y ALT > 5 x LSN (Grado 3) ocurrió en 19% (25/133) de los portadores del alelo HLA-B*57:01 y en 10% (213/2.101) de los no portadores. En este conjunto de datos, el 6% (133/2.234) de los pacientes eran portadores del alelo HLA-B*57:01 [ver Advertencias y Precauciones (5.1)].
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Se evaluó el potencial carcinogénico del pazopanib en ratones CD-1 y ratas Sprague-Dawley. La administración de pazopanib a ratones durante 2 años no produjo un aumento de la incidencia de neoplasias a dosis de hasta 100 mg/kg/día (aproximadamente 1,4 veces el ABC a la DRHM de 800 mg/día). La administración de pazopanib a ratas durante 2 años resultó en hallazgos de adenocarcinoma duodenal en machos a 30 mg/kg/día (aproximadamente 0,3 veces el ABC a la DRHM de 800 mg/día) y en hembras a dosis iguales o superiores a 10 mg/kg/día (aproximadamente 0,3 veces el ABC a la DRHM de 800 mg/día). La relevancia para humanos de estos hallazgos neoplásicos no está clara.
El pazopanib no indujo mutaciones en el ensayo de mutagénesis microbiana (Ames) y no fue clastogénico tanto en el ensayo citogenético in vitro utilizando linfocitos humanos primarios como en el ensayo in vivo de micronúcleos en ratas.
En un estudio oral de fertilidad femenina y desarrollo embrionario temprano, se administró pazopanib a ratas hembras al menos 15 días antes del apareamiento y durante 6 días después del apareamiento. El pazopanib afectó la fertilidad en ratas hembras. Se observó una reducción de la fertilidad, incluyendo un aumento de la pérdida pre-implantación y reabsorciones tempranas, a dosis iguales o superiores a 30 mg/kg/día (aproximadamente 0,4 veces el ABC a la DRHM de 800 mg/día). Se observaron una disminución de los cuerpos lúteos y un aumento de los quistes en ratones a los que se administraron dosis iguales o superiores a 100 mg/kg/día durante 13 semanas, y se observó atrofia ovárica en ratas a las que se administraron dosis iguales o superiores a 300 mg/kg/día durante 26 semanas (aproximadamente 1,3 y 0,85 veces el ABC a la DRHM de 800 mg/día). También se observó una disminución de los cuerpos lúteos en monos a los que se administraron 500 mg/kg/día durante hasta 34 semanas (aproximadamente 0,4 veces el ABC a la DRHM de 800 mg/día).
El pazopanib no afectó el apareamiento ni la fertilidad en ratas machos. Sin embargo, hubo reducciones en las tasas de producción de espermatozoides y las concentraciones de espermatozoides testiculares a dosis iguales o superiores a 3 mg/kg/día, concentraciones de espermatozoides epidídimos a dosis iguales o superiores a 30 mg/kg/día, y motilidad espermática a dosis iguales o superiores a 100 mg/kg/día después de 15 semanas de dosificación. Después de 15 y 26 semanas de dosificación, hubo una disminución del peso testicular y epididimario a dosis iguales o superiores a 30 mg/kg/día (aproximadamente 0,35 veces el ABC a la DRHM de 800 mg/día); también se observó atrofia y degeneración de los testículos con aspermia, hipospermia y cambio cribiforme en el epidídimo a esta dosis en los estudios de toxicidad de 6 meses en ratas macho.
14 ESTUDIOS CLÍNICOS
16 PRESENTACIÓN / ALMACENAMIENTO Y MANIPULACIÓN
Las tabletas de pazopanib de 200 mg se suministran en forma de tabletas recubiertas con película biconvexas, grises y en forma de cápsula. Grabadas con “P200” en un lado y “APO” en el otro:
Botellas de 120 tabletas: NDC 60505-4779-7
Botellas de 500 tabletas: NDC 60505-4779-5
Almacenar a 20°C a 25°C (68°F a 77°F); se permiten desviaciones de 15°C a 30°C (59°F a 86°F) [ver Temperatura Ambiente Controlada USP].
17 INFORMACIÓN PARA EL PACIENTE
Aconsejar al paciente que lea la información para el paciente aprobada por la FDA (Guía de medicamentos).
- Toxicidad hepática: Informar a los pacientes que se realizarán análisis de laboratorio periódicos. Aconsejar a los pacientes que informen a su profesional de la salud de inmediato sobre signos y síntomas de disfunción hepática [ver Advertencias y precauciones (5.1)].
- Prolongación del QT y Torsades de Pointes: Informar a los pacientes que se puede realizar un monitoreo de ECG. Aconsejar a los pacientes que informen a sus médicos sobre los medicamentos concomitantes [ver Advertencias y precauciones (5.2)].
- Enfermedad pulmonar intersticial/neumonitis: Aconsejar a los pacientes que informen sobre signos o síntomas pulmonares indicativos de enfermedad pulmonar intersticial (ILD) o neumonitis [ver Advertencias y precauciones (5.9)].
- Disfunción cardíaca: Aconsejar a los pacientes que informen sobre hipertensión o signos y síntomas de insuficiencia cardíaca congestiva [ver Advertencias y precauciones (5.3)].
- Eventos hemorrágicos: Aconsejar a los pacientes que informen sobre hemorragias inusuales [ver Advertencias y precauciones (5.4)].
- Eventos tromboembólicos arteriales: Aconsejar a los pacientes que informen sobre signos o síntomas de una trombosis arterial [ver Advertencias y precauciones (5.5)].
- Neumotórax y eventos tromboembólicos venosos: Aconsejar a los pacientes que informen sobre la aparición de disnea, dolor torácico o edema localizado en las extremidades [ver Advertencias y precauciones (5.6), Reacciones adversas (6.1)].
- Síndrome de Encefalopatía Posterior Reversible: Aconsejar a los pacientes que informen a su médico si tienen un empeoramiento de la función neurológica consistente con PRES (cefalea, convulsiones, letargo, confusión, ceguera y otros trastornos visuales y neurológicos) [ver Advertencias y precauciones (5.10)].
- Hipertensión: Aconsejar a los pacientes que controlen la presión arterial al inicio del tratamiento y con frecuencia después e informen sobre aumentos de la presión arterial o síntomas, como visión borrosa, confusión, cefalea grave, o náuseas y vómitos [ver Advertencias y precauciones (5.11)].
- Perforación gastrointestinal y fístula: Aconsejar a los pacientes que informen sobre signos y síntomas de una perforación o fístula gastrointestinal [ver Advertencias y precauciones (5.8)].
- Riesgo de alteración de la cicatrización de heridas: Aconsejar a los pacientes que los comprimidos de pazopanib pueden alterar la cicatrización de heridas. Aconsejar a los pacientes que informen a su profesional de la salud sobre cualquier procedimiento quirúrgico programado [ver Advertencias y precauciones (5.12)].
- Hipotiroidismo y proteinuria: Informar a los pacientes que se realizarán pruebas de función tiroidea y análisis de orina durante el tratamiento [ver Advertencias y precauciones (5.13, 5.14)].
- Síndrome de lisis tumoral: Aconsejar a los pacientes que se pongan en contacto con su profesional de la salud de inmediato para informar sobre cualquier signo y síntoma de SLT, como arritmia cardíaca anormal, convulsiones, confusión, calambres o espasmos musculares, o una disminución en la producción de orina [ver Advertencias y precauciones (5.15)].
- Infección: Aconsejar a los pacientes que informen de inmediato sobre cualquier signo o síntoma de infección [ver Advertencias y precauciones (5.16)].
- Toxicidad embrionaria y fetal: Aconsejar a las pacientes que informen a su profesional de la salud sobre un embarazo conocido o sospechado durante el tratamiento con comprimidos de pazopanib. Informar a las pacientes sobre el riesgo para el feto y la posible pérdida del embarazo [ver Advertencias y precauciones (5.19), Uso en poblaciones específicas (8.1)]. Aconsejar a las mujeres con potencial de reproducción que usen métodos anticonceptivos efectivos durante el tratamiento y durante al menos 2 semanas después de la última dosis de comprimidos de pazopanib. Aconsejar a los pacientes masculinos con parejas de sexo femenino con potencial de reproducción que usen preservativos durante el tratamiento con comprimidos de pazopanib y durante al menos 2 semanas después de la última dosis [ver Advertencias y precauciones (5.19), Uso en poblaciones específicas (8.3)].
- Lactancia: Aconsejar a las mujeres que no amamanten durante el tratamiento con comprimidos de pazopanib y durante 2 semanas después de la última dosis [ver Uso en poblaciones específicas (8.2)].
- Infertilidad: Aconsejar a hombres y mujeres con potencial de reproducción que los comprimidos de pazopanib pueden afectar la fertilidad [ver Uso en poblaciones específicas (8.3)].
- Reacciones adversas gastrointestinales: Aconsejar a los pacientes sobre cómo manejar náuseas, vómitos y diarrea y notificar a su profesional de la salud si se presentan vómitos o diarrea de moderados a graves o si hay una disminución en la ingesta oral [ver Reacciones adversas (6.1)].
- Despigmentación: Aconsejar a los pacientes que puede ocurrir despigmentación del cabello o la piel durante el tratamiento con comprimidos de pazopanib [ver Reacciones adversas (6.1)].
- Interacciones farmacológicas: Aconsejar a los pacientes que informen a sus profesionales de la salud sobre todos los medicamentos concomitantes, vitaminas o suplementos dietéticos y a base de hierbas [ver Interacciones farmacológicas (7)].
- Dosificación y administración: Aconsejar a los pacientes que tomen los comprimidos de pazopanib sin alimentos (al menos 1 hora antes o 2 horas después de una comida) [ver Dosificación y administración (2.1)].
Dispensar con la Guía de medicamentos disponible en www1.apotex.com/products/us
APOTEX INC.
COMPRIMIDOS DE PAZOPANIB
200 mg
| Fabricado por: Apotex Inc. Toronto, Ontario Canadá M9L 1T9 |
Fabricado para: Apotex Corp. Weston, Florida EE.UU., 33326 |
Revisión: 3
GUÍA DE MEDICAMENTOS
Pazopanib (paz oh′ pa nib) Tabletas
Guía de medicación disponible en www1.apotex.com/products/us
¿Cuál es la información más importante que debo saber sobre las tabletas de pazopanib?
Las tabletas de pazopanib pueden causar problemas hepáticos graves, incluyendo la muerte. Su proveedor de atención médica le hará análisis de sangre para revisar su hígado antes de que comience y mientras tome las tabletas de pazopanib.
Informe a su proveedor de atención médica de inmediato si presenta alguno de estos signos de problemas hepáticos durante el tratamiento con las tabletas de pazopanib:
| coloración amarillenta de la piel o de las partes blancas de los ojos (ictericia) | pérdida de apetito |
| orina oscura | dolor en el lado derecho del área del estómago (abdomen) |
| cansancio | formación de moretones fácilmente |
| náuseas o vómitos |
Es posible que su proveedor de atención médica necesite prescribirle una dosis más baja de las tabletas de pazopanib o indicarle que deje de tomar las tabletas de pazopanib si desarrolla problemas hepáticos durante el tratamiento.
¿Qué son las tabletas de pazopanib?
Las tabletas de pazopanib son un medicamento de venta con receta usado para tratar a adultos con:
- cáncer de células renales avanzado (RCC)
- sarcoma de tejidos blandos avanzada (STS) que han recibido quimioterapia en el pasado
No se sabe si las tabletas de pazopanib son efectivas para tratar ciertos tipos de sarcomas de tejidos blandos o ciertos tumores gastrointestinales.
No se sabe si las tabletas de pazopanib son seguras y efectivas en niños menores de 18 años.
¿Qué debo decirle a mi proveedor de atención médica antes de tomar las tabletas de pazopanib?
Antes de tomar las tabletas de pazopanib, informe a su proveedor de atención médica sobre todas sus condiciones médicas, incluyendo si:
- tiene o tuvo problemas hepáticos. Es posible que necesite una dosis más baja de las tabletas de pazopanib, o su proveedor de atención médica puede recetarle un medicamento diferente para tratar su cáncer de células renales avanzado o sarcoma de tejidos blandos avanzada.
- tiene presión arterial alta
- tiene problemas cardíacos o latidos irregulares, incluyendo prolongación del QT
- tiene antecedentes de un accidente cerebrovascular
- tiene dolores de cabeza, convulsiones o problemas de visión
- ha tosido sangre en los últimos 6 meses
- ha tenido sangrado del estómago o los intestinos en los últimos 6 meses
- tiene antecedentes de una perforación (desgarro) en el estómago o los intestinos, o una conexión anormal entre dos partes de su tracto gastrointestinal (fístula)
- ha tenido coágulos sanguíneos en una vena o en el pulmón
- tiene problemas de tiroides
- ha tenido una cirugía reciente o va a someterse a una cirugía. Debe dejar de tomar las tabletas de pazopanib al menos 1 semana antes de la cirugía programada, ya que las tabletas de pazopanib pueden afectar la cicatrización después de la cirugía. No tome las tabletas de pazopanib durante al menos 2 semanas después de una cirugía mayor y hasta que su herida haya cicatrizado adecuadamente. Su proveedor de atención médica le indicará cuándo puede comenzar a tomar las tabletas de pazopanib nuevamente después de la cirugía.
- tiene problemas con la función renal
- está embarazada o planea quedar embarazada. Las tabletas de pazopanib pueden dañar a su bebé por nacer. Su proveedor de atención médica debe verificar si está embarazada antes de que comience a tomar las tabletas de pazopanib. No debe quedar embarazada mientras tome las tabletas de pazopanib. Debe usar un método anticonceptivo efectivo durante el tratamiento con las tabletas de pazopanib y durante al menos 2 semanas después de su dosis final de las tabletas de pazopanib. Hable con su proveedor de atención médica sobre los tipos de anticonceptivos que pueden ser adecuados para usted durante este tiempo.
- es un hombre (incluyendo los que se han sometido a una vasectomía) con una pareja sexual que está embarazada, cree que podría estar embarazada o que podría quedar embarazada (incluyendo aquellas que usan otros métodos anticonceptivos). Debe usar condones durante las relaciones sexuales durante el tratamiento con las tabletas de pazopanib y durante al menos 2 semanas después de la última dosis de las tabletas de pazopanib.
- está amamantando o planea amamantar. No se sabe si las tabletas de pazopanib pasan a la leche materna. No amamante durante el tratamiento con las tabletas de pazopanib y durante 2 semanas después de la dosis final.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos de venta con receta y sin receta, vitaminas y suplementos a base de hierbas. Las tabletas de pazopanib pueden afectar la forma en que funcionan otros medicamentos y otros medicamentos pueden afectar la forma en que funcionan las tabletas de pazopanib.
Especialmente, informe a su proveedor de atención médica si:
- toma medicamentos que pueden afectar la forma en que funcionan sus enzimas hepáticas, tales como:
- ciertos antibióticos (usados para tratar infecciones)
- ciertos medicamentos utilizados para tratar la depresión
- ciertos medicamentos utilizados para tratar el VIH-1
- medicamentos utilizados para tratar latidos irregulares
- toma un medicamento que contiene simvastatina para tratar los niveles altos de colesterol
- toma medicamentos que reducen el ácido estomacal (p. ej., esomeprazol)
- toma jugo de toronja
Pregúntele a su proveedor de atención médica si no está seguro de si su medicamento es uno de los mencionados anteriormente.
Conozca los medicamentos que toma. Haga una lista de ellos y muéstresela a su proveedor de atención médica y farmacéutico cuando reciba un nuevo medicamento.
¿Cómo debo tomar las tabletas de pazopanib?
- Tome las tabletas de pazopanib exactamente como se lo indique su proveedor de atención médica. Su proveedor de atención médica le indicará cuánto pazopanib debe tomar.
- Su proveedor de atención médica puede cambiar su dosis.
- Tome las tabletas de pazopanib con el estómago vacío, al menos 1 hora antes o 2 horas después de comer.
- Trague las tabletas de pazopanib enteras. No triture las tabletas de pazopanib. Puede aumentar la cantidad de pazopanib en su cuerpo.
- No coma toronja ni tome jugo de toronja durante el tratamiento con las tabletas de pazopanib. Los productos de toronja pueden aumentar la cantidad de pazopanib en su cuerpo.
- Si olvida una dosis, tómela tan pronto como lo recuerde. No la tome si está cerca (dentro de las 12 horas) de su próxima dosis. Simplemente tome la próxima dosis a la hora habitual. No tome más de 1 dosis de las tabletas de pazopanib a la vez.
- Su proveedor de atención médica analizará su orina, sangre y corazón antes de que comience y mientras tome las tabletas de pazopanib.
¿Cuáles son los posibles efectos secundarios de las tabletas de pazopanib?
Las tabletas de pazopanib pueden causar efectos secundarios graves, incluyendo:
- Consulte “¿Cuál es la información más importante que debo saber sobre las tabletas de pazopanib?”
- latidos irregulares o rápidos del corazón o desmayos
- insuficiencia cardíaca. Es una condición en la que su corazón no bombea tan bien como debería y puede provocarle falta de aire.
- problemas de sangrado. Estos problemas de sangrado pueden ser graves y causar la muerte. Los síntomas pueden incluir: sangrado inusual, moretones o heridas que no sanan.
- ataque cardíaco o accidente cerebrovascular. Puede ocurrir un ataque cardíaco o un accidente cerebrovascular con las tabletas de pazopanib y pueden causar la muerte. Los síntomas pueden incluir: dolor u opresión en el pecho, dolor en los brazos, espalda, cuello o mandíbula, falta de aire, entumecimiento o debilidad en un lado del cuerpo, dificultad para hablar, dolor de cabeza o mareos.
- coágulos sanguíneos. Se pueden formar coágulos sanguíneos en una vena, especialmente en las piernas (trombosis venosa profunda o TVP). Un fragmento de un coágulo puede viajar a los pulmones (embolia pulmonar). Esto puede poner en riesgo la vida y causar la muerte. Los síntomas pueden incluir: nuevo dolor en el pecho, dificultad para respirar o falta de aire que comienza repentinamente, dolor en las piernas e hinchazón de los brazos y manos, o piernas y pies, un brazo o pierna fría o pálida.
- microangiopatía trombótica (MAT), incluida la púrpura trombocitopénica trombótica (PTT) y el síndrome urémico hemolítico (SUH). La MAT es una condición que involucra coágulos sanguíneos que puede ocurrir mientras toma tabletas de pazopanib. La MAT va acompañada de una disminución de los glóbulos rojos y las células que intervienen en la coagulación. La MAT puede dañar órganos, como el cerebro y los riñones.
-
desgarro en su estómago o pared intestinal (perforación) o una conexión anormal entre dos partes de su tracto gastrointestinal (fístula).
Los síntomas pueden incluir: dolor, hinchazón en el área del estómago, vómitos con sangre y heces negras y pegajosas.
- problemas pulmonares. Las tabletas de pazopanib pueden causar problemas pulmonares que podrían conducir a la muerte. Informe de inmediato a su proveedor de atención médica si tiene una tos que no desaparece o falta de aire.
- Síndrome de Encefalopatía Reversible Posterior (PRES). PRES es una condición que puede ocurrir mientras toma tabletas de pazopanib y que puede causar la muerte. Los síntomas pueden incluir: dolores de cabeza, convulsiones, falta de energía, confusión, presión arterial alta, pérdida del habla, ceguera o cambios en la visión y problemas de pensamiento.
- presión arterial alta. Puede ocurrir presión arterial alta con las tabletas de pazopanib, incluso un aumento repentino y grave de la presión arterial que puede poner en riesgo la vida. Estos aumentos de la presión arterial generalmente ocurren en los primeros meses de tratamiento. Su presión arterial debe estar bien controlada antes de comenzar a tomar las tabletas de pazopanib. Su proveedor de atención médica debe comenzar a controlar su presión arterial dentro de 1 semana después de que comience a tomar pazopanib y con frecuencia durante el tratamiento para asegurarse de que su presión arterial esté bien controlada. Haga que alguien llame a su proveedor de atención médica u obtenga ayuda médica de inmediato si presenta síntomas de un aumento grave de la presión arterial, que incluyen: dolor intenso en el pecho, dolor de cabeza intenso, visión borrosa, confusión, náuseas y vómitos, ansiedad intensa, falta de aire, convulsiones o si se desmaya (pierde el conocimiento).
- problemas de la tiroides. Su proveedor de atención médica debe revisarlo para detectar esto durante el tratamiento con tabletas de pazopanib.
- Síndrome de lisis tumoral (SLT). El SLT es una condición que puede ocurrir durante el tratamiento con tabletas de pazopanib y que puede causar la muerte. El SLT es causado por una descomposición rápida de las células cancerosas. Su proveedor de atención médica puede realizarle un análisis de sangre para detectar el SLT. Llame a su proveedor de atención médica u obtenga ayuda médica de emergencia de inmediato si presenta cualquiera de estos síntomas durante el tratamiento con tabletas de pazopanib: latidos irregulares del corazón, convulsiones, confusión, calambres o espasmos musculares o una disminución en la producción de orina.
- proteína en la orina. Su proveedor de atención médica lo revisará para detectar este problema. Si hay demasiada proteína en su orina, su proveedor de atención médica puede indicarle que deje de tomar las tabletas de pazopanib.
- infecciones graves. Pueden ocurrir infecciones graves con las tabletas de pazopanib y pueden causar la muerte. Los síntomas de una infección pueden incluir: fiebre, síntomas de resfriado como secreción nasal o dolor de garganta que no desaparecen, síntomas de gripe como tos, cansancio y dolores corporales, dolor al orinar, cortes, rasguños o heridas que estén rojos, calientes, hinchados o dolorosos.
- pulmón colapsado (neumotórax). Puede ocurrir un pulmón colapsado con las tabletas de pazopanib. El aire puede quedar atrapado en el espacio entre su pulmón y la pared torácica. Esto puede provocarle falta de aire.
Llame a su proveedor de atención médica de inmediato si presenta cualquiera de los síntomas mencionados anteriormente.
Los efectos secundarios más comunes en las personas que toman tabletas de pazopanib incluyen:
- diarrea
- náuseas o vómitos
- cambio en el color del cabello
- pérdida de apetito
Otros efectos secundarios comunes en personas con sarcoma de tejidos blandos avanzado que toman tabletas de pazopanib incluyen:
- sentirse cansado
- dolor de cabeza
- disminución de peso
- cambios en el gusto
- dolor por el tumor
- dificultad para respirar
- dolor muscular o óseo
- cambio en el color de la piel
- dolor de estómago
Estos no son todos los posibles efectos secundarios de las tabletas de pazopanib. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar las tabletas de pazopanib?
Almacene las tabletas de pazopanib a temperatura ambiente entre 20°C y 25°C (68°F y 77°F).
Mantenga las tabletas de pazopanib y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de las tabletas de pazopanib.
A veces se recetan medicamentos para fines distintos a los enumerados en una Guía de Medicamentos. No use las tabletas de pazopanib para una condición para la cual no fue recetada. No le dé tabletas de pazopanib a otras personas, incluso si tienen los mismos síntomas que usted. Puede dañarlos.
Puede pedir a su farmacéutico o proveedor de atención médica información sobre las tabletas de pazopanib que esté escrita para profesionales de la salud.
¿Cuáles son los ingredientes de las tabletas de pazopanib?
Ingrediente activo: pazopanib.
Ingredientes inactivos: Núcleo de la tableta: estearato de magnesio, celulosa microcristalina, povidona y glicolato de almidón sódico.
Recubrimiento: hidroxipropilcelulosa, hidroxipropilmetilcelulosa, óxido de hierro negro, polietilenglicol 8000 y dióxido de titanio.
Para más información, visite www.apotex.com o llame al 1-800-706-5575.
Esta Guía de Medicamentos ha sido aprobada por la Administración de Alimentos y Medicamentos de los EE.UU.
APOTEX INC.
TABLETAS DE PAZOPANIB
200 mg
| Fabricado por: Apotex Inc. Toronto, Ontario Canadá M9L 1T9 |
Fabricado para: Apotex Corp. Weston, Florida EE.UU., 33326 |
Revisado: febrero de 2024
Revisión: 3
PAQUETE ETIQUETA PRINCIPAL VISUALIZACIÓN – 200mg
Apotex Corp.
NDC 60505-4779-7
Pazopanib Tabletas
200 mg
Sólo Rx
120 recuento

ETIQUETA DE PAQUETE EXHIBICIÓN PRINCIPAL – 200mg
Apotex Corp.
NDC 60505-4779-5
Tabletas de Pazopanib
200 mg
Sólo Rx
500 count


