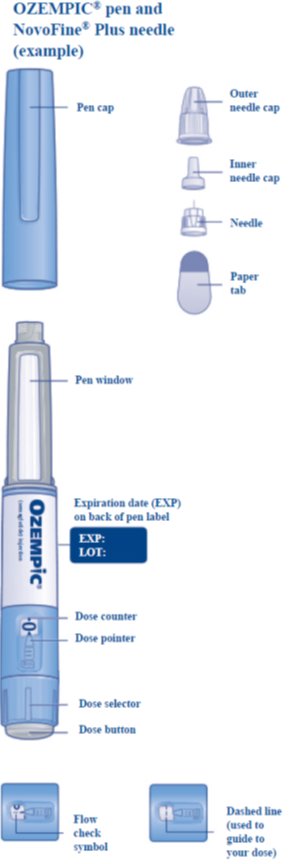
OZEMPIC- semaglutide injection, solution
Fabricante de medicamentos: Novo Nordisk (Updated: 2024-11-01)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
Estos puntos destacados no incluyen toda la información necesaria para usar OZEMPIC® de forma segura y eficaz. Consulte la información de prescripción completa para OZEMPIC.
OZEMPIC (semaglutida) inyección, para uso subcutáneo
Aprobación inicial en EE. UU.: 2017
ADVERTENCIA: RIESGO DE TUMORES DE CÉLULAS C DE TIROIDES
Consulte la información de prescripción completa para ver el recuadro de advertencia completo.
- •
-
En roedores, la semaglutida causa tumores de células C de tiroides. Se desconoce si OZEMPIC causa tumores de células C de tiroides, incluido el carcinoma medular de tiroides (CMT), en humanos, ya que no se ha determinado la relevancia humana de los tumores de células C de tiroides de roedores inducidos por semaglutida (5.1, 13.1).
- •
-
OZEMPIC está contraindicado en pacientes con antecedentes personales o familiares de CMT o en pacientes con síndrome de neoplasia endocrina múltiple tipo 2 (MEN 2). Aconseje a los pacientes sobre el riesgo potencial de CMT y los síntomas de los tumores de tiroides (4, 5.1).
CAMBIOS RECIENTES IMPORTANTES
Advertencias y precauciones, pulmonar durante la anestesia general o la sedación profunda (5.9) 11/2024
INDICACIONES Y USO
OZEMPIC es un agonista del receptor del péptido 1 similar al glucagón (GLP-1) indicado como:
- •
- un complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos con diabetes mellitus tipo 2 (1).
- •
- para reducir el riesgo de eventos cardiovasculares adversos mayores en adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular establecida (1).
Limitaciones de uso:
- •
- No se ha estudiado en pacientes con antecedentes de pancreatitis. Considere otra terapia antidiabética (1, 5.2).
- •
- No es para el tratamiento de la diabetes mellitus tipo 1 (1).
DOSIFICACIÓN Y ADMINISTRACIÓN
- •
- Administrar una vez por semana a cualquier hora del día, con o sin comidas (2.1).
- •
- Comenzar con 0.25 mg una vez por semana. Después de 4 semanas, aumentar la dosis a 0.5 mg una vez por semana (2.2).
- •
- Si se necesita un control glucémico adicional, aumentar la dosis a 1 mg una vez por semana después de al menos 4 semanas con la dosis de 0.5 mg (2.2).
- •
- Si se necesita un control glucémico adicional, aumentar la dosis a 2 mg una vez por semana después de al menos 4 semanas con la dosis de 1 mg (2.2).
- •
- Si se olvida una dosis, administrarla dentro de los 5 días posteriores a la dosis olvidada (2.2).
- •
- Inyectar por vía subcutánea en el abdomen, el muslo o la parte superior del brazo (2.2).
FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
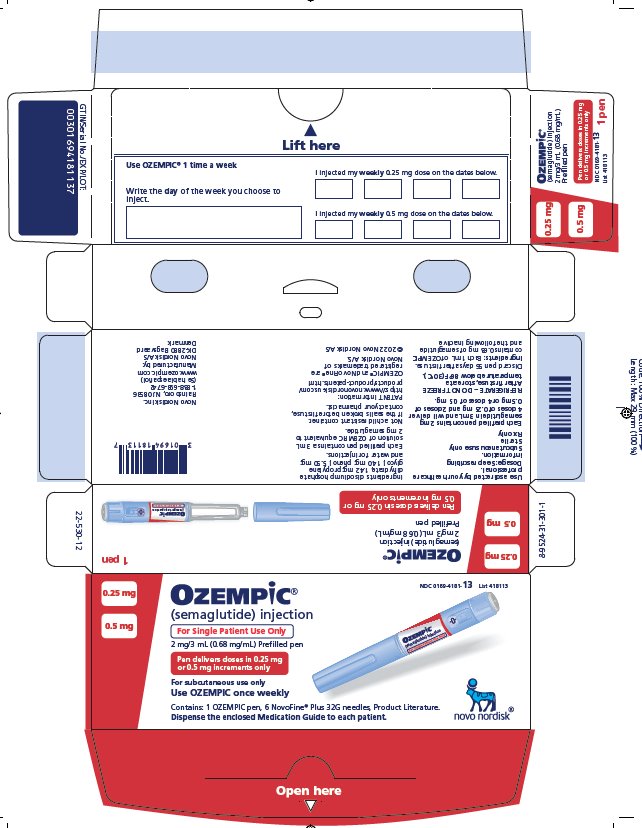
Inyección: 2 mg/3 mL (0.68 mg/mL) disponible en:
- •
- Pluma de un solo paciente que administra 0.25 mg o 0.5 mg por inyección (3)
Inyección: 4 mg/3 mL (1.34 mg/mL) disponible en:
- •
- Pluma de un solo paciente que administra 1 mg por inyección (3)
Inyección: 8 mg/3 mL (2.68 mg/mL) disponible en:
- •
- Pluma de un solo uso para un paciente que administra 2 mg por inyección (3)
CONTRAINDICACIONES
- •
- Antecedentes personales o familiares de MTC o en pacientes con MEN 2 (4).
- •
- Reacción de hipersensibilidad grave a semaglutida o a cualquiera de los excipientes de OZEMPIC (4).
ADVERTENCIAS Y PRECAUCIONES
- •
-
Pancreatitis: Se ha reportado en ensayos clínicos. Suspenda el medicamento inmediatamente si se sospecha pancreatitis. No reinicie si se confirma la pancreatitis (5.2).
- •
-
Complicaciones de la retinopatía diabética: Se ha reportado en un ensayo clínico. Los pacientes con antecedentes de retinopatía diabética deben ser monitoreados (5.3).
- •
-
Nunca comparta una pluma de OZEMPIC entre pacientes, incluso si se cambia la aguja (5.4).
- •
-
Hipoglucemia: El uso concomitante con un secretagogo de insulina o insulina puede aumentar el riesgo de hipoglucemia, incluyendo hipoglucemia grave. Puede ser necesario reducir la dosis del secretagogo de insulina o insulina (5.5).
- •
-
Lesión renal aguda: Monitoree la función renal en pacientes con insuficiencia renal que reporten reacciones gastrointestinales adversas graves (5.6).
- •
-
Reacciones de hipersensibilidad: Se han reportado reacciones de hipersensibilidad graves (p. ej., anafilaxia y angioedema). Suspenda OZEMPIC si se sospecha y busque atención médica de inmediato (5.7).
- •
-
Enfermedad aguda de la vesícula biliar: Si se sospecha colelitiasis o colecistitis, están indicados estudios de la vesícula biliar (5.8).
- •
-
Aspiración pulmonar durante anestesia general o sedación profunda: Se ha reportado en pacientes que reciben agonistas del receptor de GLP-1 sometidos a cirugías o procedimientos electivos. Indique a los pacientes que informen a los profesionales de la salud sobre cualquier cirugía o procedimiento planificado. (5.9).
REACCIONES ADVERSAS
Las reacciones adversas más comunes, reportadas en ≥5% de los pacientes tratados con OZEMPIC son: náuseas, vómitos, diarrea, dolor abdominal y estreñimiento (6.1).
Para reportar REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Novo Nordisk Inc., al 1-888-693-6742 o con la FDA al 1-800-FDA-1088 o http://www.fda.gov/medwatch
INTERACCIONES CON OTROS MEDICAMENTOS
Medicamentos orales: OZEMPIC retrasa el vaciado gástrico. Puede afectar la absorción de medicamentos orales administrados concomitantemente. Usar con precaución (7.2).
USO EN POBLACIONES ESPECÍFICAS
Mujeres y hombres con potencial reproductivo: Suspenda OZEMPIC en mujeres al menos 2 meses antes de un embarazo planificado debido al largo período de eliminación de semaglutida (8.3).
Consulte 17 para obtener INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y la Guía del Medicamento.
Revisado: 11/2024
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
ADVERTENCIA EN EL RECUADRO
ADVERTENCIA: RIESGO DE TUMORES DE CÉLULAS C TIROIDEAS
- •
-
En roedores, la semaglutida causa tumores de células C tiroideas dependientes de la dosis y de la duración del tratamiento a exposiciones clínicamente relevantes. Se desconoce si OZEMPIC causa tumores de células C tiroideas, incluido el carcinoma medular de tiroides (CMT), en humanos, ya que no se ha determinado la relevancia para los humanos de los tumores de células C tiroideas en roedores inducidos por semaglutida [ver Advertencias y precauciones (5.1) y Toxicología no clínica (13.1)].
- •
-
OZEMPIC está contraindicado en pacientes con antecedentes personales o familiares de CMT o en pacientes con síndrome de neoplasia endocrina múltiple tipo 2 (MEN 2) [ver Contraindicaciones (4)]. Se debe informar a los pacientes sobre el riesgo potencial de CMT con el uso de OZEMPIC y se les debe informar sobre los síntomas de los tumores tiroideos (por ejemplo, una masa en el cuello, disfagia, disnea, ronquera persistente). El control rutinario de la calcitonina sérica o el uso de la ecografía tiroidea tienen un valor incierto para la detección precoz del CMT en pacientes tratados con OZEMPIC [ver Contraindicaciones (4) y Advertencias y precauciones (5.1)].
1 INDICACIONES Y USO
OZEMPIC está indicado:
- •
- como complemento de la dieta y el ejercicio para mejorar el control glucémico en adultos con diabetes mellitus tipo 2.
- •
- para reducir el riesgo de eventos cardiovasculares adversos mayores (muerte cardiovascular, infarto de miocardio no fatal o accidente cerebrovascular no fatal) en adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular establecida.
Limitaciones de uso
- •
- OZEMPIC no se ha estudiado en pacientes con antecedentes de pancreatitis. Considere otras terapias antidiabéticas en pacientes con antecedentes de pancreatitis [ver Advertencias y precauciones (5.2)].
- •
- OZEMPIC no está indicado para su uso en pacientes con diabetes mellitus tipo 1.
2 DOSIS Y ADMINISTRACIÓN
2.1 Instrucciones Importantes de Administración
- •
- Inspeccione visualmente OZEMPIC antes de usar. Debe tener un aspecto transparente e incoloro. No use OZEMPIC si observa partículas o coloración.
- •
- Administre OZEMPIC una vez por semana, el mismo día de cada semana, a cualquier hora del día, con o sin alimentos.
- •
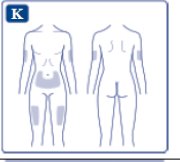
- Inyecte OZEMPIC por vía subcutánea en el abdomen, el muslo o la parte superior del brazo. Indique a los pacientes que utilicen un sitio de inyección diferente cada semana cuando se inyecten en la misma zona del cuerpo.
- •
- Cuando se use OZEMPIC con insulina, indique a los pacientes que la administren como inyecciones separadas y que nunca mezclen los productos. Es aceptable inyectar OZEMPIC e insulina en la misma zona del cuerpo, pero las inyecciones no deben ser adyacentes.
2.2 Dosis Recomendada
- •
- Inicie OZEMPIC con una dosis de 0,25 mg inyectada por vía subcutánea una vez por semana durante 4 semanas. La dosis de 0,25 mg está destinada al inicio del tratamiento y no es eficaz para el control glucémico.
- •
- Después de 4 semanas con la dosis de 0,25 mg, aumente la dosis a 0,5 mg una vez por semana.
- •
- Si se necesita un control glucémico adicional después de al menos 4 semanas con la dosis de 0,5 mg, la dosis puede aumentarse a 1 mg una vez por semana.
- •
- Si se necesita un control glucémico adicional después de al menos 4 semanas con la dosis de 1 mg, la dosis puede aumentarse a 2 mg una vez por semana. La dosis máxima recomendada es de 2 mg una vez por semana.
- •
- El día de administración semanal puede cambiarse si es necesario, siempre que el tiempo entre dos dosis sea de al menos 2 días (>48 horas).
- •
- Si se olvida una dosis, administre OZEMPIC lo antes posible dentro de los 5 días posteriores a la dosis olvidada. Si han pasado más de 5 días, omita la dosis olvidada y administre la siguiente dosis el día programado regularmente. En cada caso, los pacientes pueden reanudar su régimen de dosificación regular una vez por semana.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Inyección: solución transparente e incolora disponible en 3 plumas precargadas, desechables, de un solo uso para paciente:
La concentración de 2 mg/1.5 mL (1.34 mg/mL) no está actualmente comercializada por Novo Nordisk Inc.
4 CONTRAINDICACIONES
OZEMPIC está contraindicado en pacientes con:
- •
- Antecedentes personales o familiares de CMT o en pacientes con NEM 2 [ver Advertencias y precauciones (5.1)].
- •
- Una reacción de hipersensibilidad grave a la semaglutida o a cualquiera de los excipientes de OZEMPIC. Se han notificado reacciones de hipersensibilidad graves, incluida la anafilaxia y el angioedema, con OZEMPIC [ver Advertencias y precauciones (5.7)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Riesgo de tumores de células C de tiroides
En ratones y ratas, semaglutida causó un aumento dependiente de la dosis y de la duración del tratamiento en la incidencia de tumores de células C de tiroides (adenomas y carcinomas) después de la exposición de por vida a exposiciones plasmáticas clínicamente relevantes [ver Toxicología no clínica (13.1)]. Se desconoce si OZEMPIC causa tumores de células C de tiroides, incluido MTC, en humanos, ya que no se ha determinado la relevancia humana de los tumores de células C de tiroides de roedores inducidos por semaglutida.
Se han notificado casos de MTC en pacientes tratados con liraglutida, otro agonista del receptor de GLP-1, en el período posterior a la comercialización; los datos de estos informes son insuficientes para establecer o excluir una relación causal entre el MTC y el uso de agonistas del receptor de GLP-1 en humanos.
OZEMPIC está contraindicado en pacientes con antecedentes personales o familiares de MTC o en pacientes con MEN 2. Aconseje a los pacientes sobre el riesgo potencial de MTC con el uso de OZEMPIC e infórmeles sobre los síntomas de los tumores de tiroides (p. ej., una masa en el cuello, disfagia, disnea, ronquera persistente).
El monitoreo de rutina de calcitonina sérica o el uso de ultrasonido de tiroides tiene un valor incierto para la detección temprana de MTC en pacientes tratados con OZEMPIC. Dicho monitoreo puede aumentar el riesgo de procedimientos innecesarios, debido a la baja especificidad de la prueba para la calcitonina sérica y una alta incidencia de enfermedad tiroidea. Un valor de calcitonina sérica significativamente elevado puede indicar MTC y los pacientes con MTC generalmente tienen valores de calcitonina >50 ng/L. Si se mide la calcitonina sérica y se encuentra elevada, se debe evaluar más a fondo al paciente. Los pacientes con nódulos tiroideos observados en el examen físico o en las imágenes del cuello también deben ser evaluados más a fondo.
5.2 Pancreatitis
En ensayos de control glucémico, se confirmó pancreatitis aguda por adjudicación en 7 pacientes tratados con OZEMPIC (0.3 casos por 100 pacientes-año) versus 3 en pacientes tratados con comparador (0.2 casos por 100 pacientes-año). Se confirmó un caso de pancreatitis crónica en un paciente tratado con OZEMPIC. En un ensayo de 2 años, la pancreatitis aguda se confirmó por adjudicación en 8 pacientes tratados con OZEMPIC (0.27 casos por 100 pacientes-año) y 10 pacientes tratados con placebo (0.33 casos por 100 pacientes-año), ambos con un tratamiento estándar de atención.
Después del inicio de OZEMPIC, observe cuidadosamente a los pacientes para detectar signos y síntomas de pancreatitis (incluido dolor abdominal intenso persistente, que a veces se irradia a la espalda y que puede o no estar acompañado de vómitos). Si se sospecha pancreatitis, se debe suspender OZEMPIC e iniciar el tratamiento adecuado; si se confirma, no se debe reiniciar OZEMPIC.
5.3 Complicaciones de la retinopatía diabética
En un ensayo de 2 años que incluyó a pacientes con diabetes tipo 2 y alto riesgo cardiovascular, se produjeron más eventos de complicaciones de retinopatía diabética en pacientes tratados con OZEMPIC (3.0%) en comparación con placebo (1.8%). El aumento del riesgo absoluto de complicaciones de la retinopatía diabética fue mayor entre los pacientes con antecedentes de retinopatía diabética al inicio del estudio (OZEMPIC 8.2%, placebo 5.2%) que entre los pacientes sin antecedentes conocidos de retinopatía diabética (OZEMPIC 0.7%, placebo 0.4%).
La rápida mejoría en el control de la glucosa se ha asociado con un empeoramiento temporal de la retinopatía diabética. No se ha estudiado el efecto del control glucémico a largo plazo con semaglutida sobre las complicaciones de la retinopatía diabética. Los pacientes con antecedentes de retinopatía diabética deben ser monitoreados para detectar la progresión de la retinopatía diabética.
5.4 Nunca comparta una pluma OZEMPIC entre pacientes
Las plumas OZEMPIC nunca deben compartirse entre pacientes, incluso si se cambia la aguja. Compartir la pluma representa un riesgo de transmisión de patógenos transmitidos por la sangre.
5.5 Hipoglucemia con el uso concomitante de secretagogos de insulina o insulina
Los pacientes que reciben OZEMPIC en combinación con un secretagogo de insulina (p. ej., sulfonilurea) o insulina pueden tener un mayor riesgo de hipoglucemia, incluida la hipoglucemia grave [ver Reacciones adversas (6.1) e Interacciones medicamentosas (7)].
El riesgo de hipoglucemia puede reducirse mediante una reducción en la dosis de sulfonilurea (u otro secretagogo de insulina administrado concomitantemente) o insulina. Informe a los pacientes que usan estos medicamentos concomitantes sobre el riesgo de hipoglucemia y edúquelos sobre los signos y síntomas de la hipoglucemia.
5.6 Lesión renal aguda
Ha habido informes posteriores a la comercialización de lesión renal aguda y empeoramiento de la insuficiencia renal crónica, que a veces puede requerir hemodiálisis, en pacientes tratados con agonistas del receptor de GLP-1. Algunos de estos eventos se han informado en pacientes sin enfermedad renal subyacente conocida. La mayoría de los eventos informados ocurrieron en pacientes que habían experimentado náuseas, vómitos, diarrea o deshidratación. Controle la función renal al iniciar o aumentar las dosis de OZEMPIC en pacientes que informan reacciones gastrointestinales adversas graves.
5.7 Reacciones de hipersensibilidad
Se han notificado reacciones de hipersensibilidad graves (p. ej., anafilaxia, angioedema) en pacientes tratados con OZEMPIC. Si se producen reacciones de hipersensibilidad, suspenda el uso de OZEMPIC; trate de inmediato según el estándar de atención y controle hasta que los signos y síntomas se resuelvan. No lo use en pacientes con hipersensibilidad previa a OZEMPIC [ver Contraindicaciones (4) y Reacciones adversas (6.3)].
Se han notificado anafilaxia y angioedema con otros agonistas del receptor GLP-1. Use precaución en pacientes con antecedentes de angioedema o anafilaxia con otro agonista del receptor GLP-1, ya que se desconoce si dichos pacientes estarán predispuestos a la anafilaxia con OZEMPIC.
5.8 Enfermedad aguda de la vesícula biliar
Se han notificado acontecimientos agudos de enfermedad de la vesícula biliar, como colelitiasis o colecistitis, en ensayos con agonistas del receptor GLP-1 y después de la comercialización. En ensayos controlados con placebo, se notificó colelitiasis en el 1,5 % y el 0,4 % de los pacientes tratados con OZEMPIC 0,5 mg y 1 mg, respectivamente. No se notificó colelitiasis en pacientes tratados con placebo. Si se sospecha colelitiasis, están indicados los estudios de la vesícula biliar y el seguimiento clínico adecuado.
5.9 Aspiración pulmonar durante anestesia general o sedación profunda
OZEMPIC retrasa el vaciado gástrico [véase Farmacología clínica (12.2)]. Se han notificado casos poco frecuentes después de la comercialización de aspiración pulmonar en pacientes que recibían agonistas del receptor GLP-1 sometidos a cirugías o procedimientos electivos que requerían anestesia general o sedación profunda y que tenían contenido gástrico residual a pesar del cumplimiento de las recomendaciones de ayuno preoperatorio.
Los datos disponibles son insuficientes para establecer recomendaciones para mitigar el riesgo de aspiración pulmonar durante la anestesia general o la sedación profunda en pacientes que toman OZEMPIC, incluyendo si la modificación de las recomendaciones de ayuno preoperatorio o la interrupción temporal de OZEMPIC podrían reducir la incidencia de contenido gástrico retenido. Indique a los pacientes que informen a los profesionales sanitarios antes de cualquier cirugía o procedimiento planificado si están tomando OZEMPIC.
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas graves se describen a continuación u en otra parte de la información de prescripción:
- •
- Riesgo de tumores de células C de la tiroides [ver Advertencias y Precauciones (5.1)]
- •
- Pancreatitis [ver Advertencias y Precauciones (5.2)]
- •
- Complicaciones de la retinopatía diabética [ver Advertencias y Precauciones (5.3)]
- •
- Hipoglucemia con uso concomitante de secretagogos de insulina o insulina [ver Advertencias y Precauciones (5.5)]
- •
- Lesión renal aguda [ver Advertencias y Precauciones (5.6)]
- •
- Reacciones de hipersensibilidad [ver Advertencias y Precauciones (5.7)]
- •
- Enfermedad de la vesícula biliar aguda [ver Advertencias y Precauciones (5.8)]
- •
-
Aspiración pulmonar durante la anestesia general o sedación profunda [ver Advertencias y Precauciones [(5.9)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variadas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica.
Conjunto de ensayos controlados con placebo
Los datos de la Tabla 1 se derivan de 2 ensayos controlados con placebo (1 ensayo de monoterapia y 1 ensayo en combinación con insulina basal) en pacientes con diabetes tipo 2 [ver Estudios Clínicos (14)]. Estos datos reflejan la exposición de 521 pacientes a OZEMPIC y una duración media de exposición a OZEMPIC de 32,9 semanas. En todos los brazos de tratamiento, la edad media de los pacientes era de 56 años, el 3,4% tenían 75 años o más y el 55% eran hombres. En estos ensayos, el 71% eran blancos, el 7% eran negros o afroamericanos y el 19% eran asiáticos; el 21% se identificó como de etnia hispana o latina. Al inicio, los pacientes tenían diabetes tipo 2 durante un promedio de 8,8 años y tenían un promedio de HbA1c de 8,2%. Al inicio, el 8,9% de la población informó tener retinopatía. La función renal estimada al inicio era normal (eGFR ≥90 mL/min/1,73m2) en el 57,2%, levemente alterada (eGFR 60 a 90 mL/min/1,73m2) en el 35,9% y moderadamente alterada (eGFR 30 a 60 mL/min/1,73m2) en el 6,9% de los pacientes.
Conjunto de ensayos controlados con placebo y activos
La ocurrencia de reacciones adversas también se evaluó en un grupo más grande de pacientes con diabetes tipo 2
que participaron en 7 ensayos de control glucémico controlados con placebo y activos [ver Estudios Clínicos (14)] incluidos dos ensayos en pacientes japoneses que evaluaron el uso de OZEMPIC como monoterapia y como terapia adicional a medicamentos orales o insulina. En este conjunto, un total de 3150 pacientes con diabetes tipo 2 fueron tratados con OZEMPIC durante una duración media de 44,9 semanas. En todos los brazos de tratamiento, la edad media de los pacientes era de 57 años, el 3,2% tenían 75 años o más y el 57% eran hombres. En estos ensayos, el 60% eran blancos, el 6% eran negros o afroamericanos y el 31% eran asiáticos; el 16% se identificó como de etnia hispana o latina. Al inicio, los pacientes tenían diabetes tipo 2 durante un promedio de 8,2 años y tenían un promedio de HbA1c de 8,2%. Al inicio, el 7,8% de la población informó tener retinopatía. La función renal estimada al inicio era normal (eGFR ≥90 mL/min/1,73m2) en el 63,1%, levemente alterada (eGFR 60 a 90 mL/min/1,73m2) en el 34,3% y moderadamente alterada (eGFR 30 a 60 mL/min/1,73m2) en el 2,5% de los pacientes.
Reacciones adversas comunes
La Tabla 1 muestra las reacciones adversas comunes, excluyendo la hipoglucemia, asociadas con el uso de OZEMPIC en el conjunto de ensayos controlados con placebo. Estas reacciones adversas ocurrieron con más frecuencia en OZEMPIC que en el placebo y ocurrieron en al menos el 5% de los pacientes tratados con OZEMPIC.
Tabla 1. Reacciones adversas en ensayos controlados con placebo reportadas en ≥5% de los pacientes con diabetes mellitus tipo 2 tratados con OZEMPIC
|
Diarrea
|
1.9
|
8.5
|
8.8
|
|
Dolor abdominal
|
4.6
|
7.3
|
5.7
|
|
Estreñimiento
|
1.5
|
5.0
|
3.1
|
En el conjunto de ensayos controlados con placebo y con fármaco activo y en el ensayo de resultados cardiovasculares de 2 años, los tipos y la frecuencia de las reacciones adversas comunes, excluyendo la hipoglucemia, fueron similares a los enumerados en la Tabla 1.
En un ensayo clínico con 959 pacientes tratados con OZEMPIC 1 mg u OZEMPIC 2 mg una vez por semana como complemento a la metformina con o sin tratamiento con sulfonilurea durante 40 semanas, no se identificaron nuevas señales de seguridad.
Reacciones Adversas Gastrointestinales
En el conjunto de ensayos controlados con placebo, las reacciones adversas gastrointestinales ocurrieron con mayor frecuencia entre los pacientes que recibieron OZEMPIC que con placebo (placebo 15.3%, OZEMPIC 0.5 mg 32.7%, OZEMPIC 1 mg 36.4%). La mayoría de los informes de náuseas, vómitos y/o diarrea ocurrieron durante el aumento de la dosis. Más pacientes que recibieron OZEMPIC 0.5 mg (3.1%) y OZEMPIC 1 mg (3.8%) interrumpieron el tratamiento debido a reacciones adversas gastrointestinales que los pacientes que recibieron placebo (0.4%).
En el ensayo con OZEMPIC 1 mg y 2 mg, las reacciones adversas gastrointestinales ocurrieron con mayor frecuencia entre los pacientes que recibieron OZEMPIC 2 mg (34.0%) vs OZEMPIC 1 mg (30.8%).
-
- Además de las reacciones en la Tabla 1, las siguientes reacciones adversas gastrointestinales con una frecuencia de <5% se asociaron con OZEMPIC (frecuencias enumeradas, respectivamente, como: placebo; 0.5 mg; 1 mg): dispepsia (1.9%, 3.5%, 2.7%), eructos (0%, 2.7%, 1.1%), flatulencia (0.8%, 0.4%, 1.5%), enfermedad por reflujo gastroesofágico (0%, 1.9%, 1.5%) y gastritis (0.8%, 0.8%, 0.4%).
Otras Reacciones Adversas
Hipoglucemia
La Tabla 2 resume la incidencia de eventos relacionados con la hipoglucemia según varias definiciones en los ensayos controlados con placebo.
Tabla 2. Reacciones Adversas de Hipoglucemia en Ensayos Controlados con Placebo en Pacientes con Diabetes Mellitus Tipo 2
La hipoglucemia fue más frecuente cuando se usó OZEMPIC en combinación con una sulfonilurea [véase Advertencias y precauciones (5.5) y Estudios clínicos (14)]. Se produjo hipoglucemia grave en el 0,8 % y el 1,2 % de los pacientes cuando se coadministró OZEMPIC 0,5 mg y 1 mg, respectivamente, con una sulfonilurea. Se produjo hipoglucemia sintomática documentada en el 17,3 % y el 24,4 % de los pacientes cuando se coadministró OZEMPIC 0,5 mg y 1 mg, respectivamente, con una sulfonilurea. Se produjo hipoglucemia sintomática grave o confirmada por glucosa en sangre en el 6,5 % y el 10,4 % de los pacientes cuando se coadministró OZEMPIC 0,5 mg y 1 mg, respectivamente, con una sulfonilurea.
Reacciones en el lugar de inyección
En los ensayos controlados con placebo, se informaron reacciones en el lugar de inyección (p. ej., molestias en el lugar de inyección, eritema) en el 0,2 % de los pacientes tratados con OZEMPIC.
Aumento de amilasa y lipasa
En los ensayos controlados con placebo, los pacientes expuestos a OZEMPIC tuvieron un aumento medio desde el valor basal de la amilasa del 13 % y de la lipasa del 22 %. Estos cambios no se observaron en los pacientes tratados con placebo.
Colelitiasis
En los ensayos controlados con placebo, se informó colelitiasis en el 1,5 % y el 0,4 % de los pacientes tratados con OZEMPIC 0,5 mg y 1 mg, respectivamente. No se informó colelitiasis en los pacientes tratados con placebo.
Aumento de la frecuencia cardíaca
En los ensayos controlados con placebo, OZEMPIC 0,5 mg y 1 mg provocaron un aumento medio de la frecuencia cardíaca de 2 a 3 latidos por minuto. Hubo una disminución media de la frecuencia cardíaca de 0,3 latidos por minuto en los pacientes tratados con placebo.
Fatiga, disgeusia y mareos
Otras reacciones adversas con una frecuencia de >0,4 % asociadas con OZEMPIC incluyen fatiga, disgeusia y mareos.
6.2 Inmunogenicidad
De acuerdo con las propiedades potencialmente inmunogénicas de los productos farmacéuticos proteicos y peptídicos, los pacientes tratados con OZEMPIC pueden desarrollar anticuerpos anti-semaglutida. La detección de la formación de anticuerpos depende en gran medida de la sensibilidad y la especificidad del ensayo. Además, la incidencia observada de positividad de anticuerpos (incluidos los anticuerpos neutralizantes) en un ensayo puede verse influenciada por varios factores, como la metodología del ensayo, el manejo de las muestras, el momento de la recolección de las muestras, los medicamentos concomitantes y la enfermedad subyacente. Por estas razones, la incidencia de anticuerpos contra la semaglutida en los estudios que se describen a continuación no se puede comparar directamente con la incidencia de anticuerpos en otros estudios o con otros productos.
En los ensayos de control glucémico controlados con placebo y activos, 32 (1,0 %) pacientes tratados con OZEMPIC desarrollaron anticuerpos anti-fármaco (AAF) contra el principio activo de OZEMPIC (es decir, semaglutida). De los 32 pacientes tratados con semaglutida que desarrollaron AAF contra la semaglutida, 19 pacientes (0,6 % de la población general) desarrollaron anticuerpos que reaccionan de forma cruzada con el GLP-1 nativo. La actividad neutralizante in vitro de los anticuerpos es incierta en este momento.
6.3 Experiencia postcomercialización
Las siguientes reacciones adversas se han notificado durante el uso posterior a la aprobación de la semaglutida, el principio activo de OZEMPIC. Debido a que estas reacciones se notifican voluntariamente a partir de una población de tamaño incierto, no siempre es posible estimar su frecuencia de forma fiable o establecer una relación causal con la exposición al fármaco.
Trastornos gastrointestinales: Íleo
Hipersensibilidad: anafilaxia, angioedema, erupción cutánea, urticaria.
Hepatobiliar: colecistitis, colecistectomía
Pulmonar: Se ha producido aspiración pulmonar en pacientes que reciben agonistas del receptor GLP-1 que se someten a cirugías o procedimientos electivos que requieren anestesia general o sedación profunda.
7 INTERACCIONES MEDICAMENTOSAS
7.1 Uso concomitante con un secretagogo de insulina (p. ej., sulfonilurea) o con insulina
OZEMPIC estimula la liberación de insulina en presencia de concentraciones elevadas de glucosa en sangre. Los pacientes que reciben OZEMPIC en combinación con un secretagogo de insulina (p. ej., sulfonilurea) o insulina pueden tener un mayor riesgo de hipoglucemia, incluida la hipoglucemia grave.
Al iniciar OZEMPIC, considere reducir la dosis de secretagogo de insulina administrado concomitantemente (como sulfonilureas) o insulina para reducir el riesgo de hipoglucemia [ver Advertencias y precauciones (5.5) y Reacciones adversas (6)].
7.2 Medicamentos orales
OZEMPIC causa un retraso del vaciado gástrico y, por lo tanto, tiene el potencial de afectar la absorción de medicamentos orales administrados concomitantemente. En ensayos de farmacología clínica, semaglutida no afectó la absorción de medicamentos administrados por vía oral en ningún grado clínicamente relevante [ver Farmacología clínica (12.3)]. No obstante, se debe tener precaución cuando se administran medicamentos orales concomitantemente con OZEMPIC.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgo
Hay datos limitados sobre el uso de semaglutida en mujeres embarazadas para informar sobre un riesgo asociado al fármaco para resultados de desarrollo adversos. Existen consideraciones clínicas con respecto a los riesgos de la diabetes mal controlada en el embarazo (ver Consideraciones Clínicas). Con base en estudios de reproducción en animales, puede haber riesgos potenciales para el feto por la exposición a semaglutida durante el embarazo. OZEMPIC debe usarse durante el embarazo solo si el beneficio potencial justifica el riesgo potencial para el feto.
En ratas embarazadas a las que se administró semaglutida durante la organogénesis, se produjeron mortalidad embriofetal, anomalías estructurales y alteraciones del crecimiento a la exposición clínica materna basada en el AUC. En conejos y monos cynomolgus a los que se administró semaglutida durante la organogénesis, se observaron pérdidas en el embarazo temprano o anomalías estructurales a la exposición clínica (conejo) y ≥2 veces la dosis máxima recomendada en humanos (MRHD) (mono). Estos hallazgos coincidieron con una marcada pérdida de peso corporal materno en ambas especies animales (ver Datos).
En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 al 4 % y del 15 al 20 %, respectivamente. El riesgo de fondo estimado de defectos congénitos importantes es del 6 al 10 % en mujeres con diabetes pregestacional con una HbA1c >7 pericóncepcional y se ha informado que es tan alto como del 20 al 25 % en mujeres con una HbA1c >10 pericóncepcional. Se desconoce el riesgo de fondo estimado de aborto espontáneo para la población indicada.
Consideraciones Clínicas
Riesgo Materno y/o Embriofetal Asociado a la Enfermedad
La hipoglucemia y la hiperglucemia ocurren con más frecuencia durante el embarazo en pacientes con diabetes pregestacional. La diabetes mal controlada durante el embarazo aumenta el riesgo materno de cetoacidosis diabética, preeclampsia, abortos espontáneos, parto prematuro y complicaciones del parto. La diabetes mal controlada aumenta el riesgo fetal de defectos congénitos importantes, muerte fetal y morbilidad relacionada con la macrosomía.
Datos
Datos en animales
En un estudio combinado de fertilidad y desarrollo embriofetal en ratas, se administraron dosis subcutáneas de 0,01, 0,03 y 0,09 mg/kg/día (0,06, 0,2 y 0,6 veces la MRHD) a los machos durante 4 semanas antes y durante el apareamiento y a las hembras durante 2 semanas antes del apareamiento y durante la organogénesis hasta el día 17 de gestación. En los animales progenitores, se observaron reducciones farmacológicamente mediadas en el aumento de peso corporal y el consumo de alimentos en todos los niveles de dosis. En la descendencia, se observó un crecimiento reducido y fetos con anomalías viscerales (vasos sanguíneos del corazón) y esqueléticas (huesos craneales, vértebras, costillas) a la exposición humana.
En un estudio de desarrollo embriofetal en conejas embarazadas, se administraron dosis subcutáneas de 0,0010, 0,0025 o 0,0075 mg/kg/día (0,02, 0,2 y 1,2 veces la MRHD) durante toda la organogénesis desde el día 6 hasta el 19 de gestación. Se observaron reducciones farmacológicamente mediadas en el aumento de peso corporal materno y el consumo de alimentos en todos los niveles de dosis. Se observaron pérdidas en el embarazo temprano y un aumento en la incidencia de anomalías fetales viscerales menores (riñón, hígado) y esqueléticas (esternón) a ≥0,0025 mg/kg/día, a exposiciones clínicamente relevantes.
En un estudio de desarrollo embriofetal en monos cynomolgus embarazadas, se administraron dosis subcutáneas de 0,015, 0,075 y 0,15 mg/kg dos veces por semana (0,5, 3 y 8 veces la MRHD) durante toda la organogénesis, desde el día 16 hasta el 50 de gestación. La pérdida de peso corporal materna inicial marcada farmacológicamente mediada y las reducciones en el aumento de peso corporal y el consumo de alimentos coincidieron con la aparición de anomalías esporádicas (vértebras, esternón, costillas) a ≥0,075 mg/kg dos veces por semana (≥3 veces la exposición humana).
En un estudio de desarrollo pre y postnatal en monos cynomolgus embarazadas, se administraron dosis subcutáneas de 0,015, 0,075 y 0,15 mg/kg dos veces por semana (0,3, 2 y 4 veces la MRHD) desde el día 16 de gestación hasta el 140. La pérdida de peso corporal materna inicial marcada farmacológicamente mediada y las reducciones en el aumento de peso corporal y el consumo de alimentos coincidieron con un aumento en las pérdidas en el embarazo temprano y llevaron al parto de una descendencia ligeramente más pequeña a ≥0,075 mg/kg dos veces por semana (≥2 veces la exposición humana).
8.2 Lactancia
Resumen de Riesgo
No hay datos sobre la presencia de semaglutida en la leche materna, los efectos en el lactante o los efectos sobre la producción de leche. La semaglutida estuvo presente en la leche de ratas lactantes; sin embargo, debido a las diferencias específicas de la especie en la fisiología de la lactancia, la relevancia clínica de estos datos no está clara (ver Datos). Se deben considerar los beneficios para el desarrollo y la salud de la lactancia materna junto con la necesidad clínica de la madre de OZEMPIC y cualquier efecto adverso potencial en el lactante amamantado por OZEMPIC o por la afección materna subyacente.
Datos
En ratas lactantes, se detectó semaglutida en la leche en niveles 3-12 veces más bajos que en el plasma materno.
8.3 Mujeres y Hombres en Edad Reproductiva
Suspenda OZEMPIC en mujeres al menos 2 meses antes de un embarazo planificado debido al largo período de eliminación de semaglutida [ver Uso en Poblaciones Específicas (8.1)].
8.4 Uso Pediátrico
No se ha establecido la seguridad y eficacia de OZEMPIC en pacientes pediátricos (menores de 18 años).
8.5 Uso en Geriatría
En el conjunto de ensayos de control glucémico controlados con placebo y activo, 744 (23,6%) pacientes tratados con OZEMPIC tenían 65 años o más y 102 pacientes tratados con OZEMPIC (3,2%) tenían 75 años o más. En SUSTAIN 6, el ensayo de resultados cardiovasculares, 788 (48,0%) pacientes tratados con OZEMPIC tenían 65 años o más y 157 pacientes tratados con OZEMPIC (9,6%) tenían 75 años o más.
No se detectaron diferencias generales en seguridad o eficacia entre estos pacientes y los pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos individuos mayores.
8.6 Insuficiencia Renal
No se recomienda ningún ajuste de dosis de OZEMPIC para pacientes con insuficiencia renal. En sujetos con insuficiencia renal, incluida la enfermedad renal en etapa terminal (ERET), no se observó ningún cambio clínicamente relevante en la farmacocinética (FC) de la semaglutida [ver Farmacología Clínica (12.3)].
8.7 Insuficiencia Hepática
No se recomienda ningún ajuste de dosis de OZEMPIC para pacientes con insuficiencia hepática. En un estudio en sujetos con diferentes grados de insuficiencia hepática, no se observó ningún cambio clínicamente relevante en la farmacocinética (FC) de la semaglutida [ver Farmacología Clínica (12.3)].
10 SOBREDOSIS
En caso de sobredosis, se debe iniciar un tratamiento de soporte adecuado de acuerdo con los signos y síntomas clínicos del paciente. Considere contactar con la línea de ayuda contra envenenamiento (1-800-222-1222) o un toxicólogo médico para obtener recomendaciones adicionales sobre el manejo de la sobredosis. Puede ser necesario un período prolongado de observación y tratamiento de estos síntomas, teniendo en cuenta la larga semivida de OZEMPIC de aproximadamente 1 semana.
11 DESCRIPCIÓN
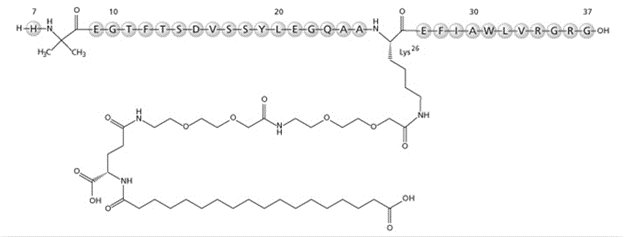
OZEMPIC (semaglutida) inyección, para uso subcutáneo, contiene semaglutida, un agonista del receptor GLP-1 humano (o análogo GLP-1). El esqueleto peptídico se produce mediante fermentación de levadura. El principal mecanismo de prolongación de la semaglutida es la unión a la albúmina, facilitada por la modificación de la lisina en la posición 26 con un espaciador hidrofílico y un diácido graso C18. Además, la semaglutida se modifica en la posición 8 para proporcionar estabilización contra la degradación por la enzima dipeptidil peptidasa 4 (DPP-4). Se realizó una modificación menor en la posición 34 para asegurar la unión de un solo diácido graso. La fórmula molecular es C187H291N45O59 y el peso molecular es 4113.58 g/mol.
Fórmula estructural:
OZEMPIC es una solución estéril, acuosa, transparente e incolora. Cada pluma de un solo paciente prellenada de 3 mL contiene 2 mg (0,68 mg/mL), 4 mg (1,34 mg/mL) u 8 mg (2,68 mg/mL) de semaglutida. Cada 1 mL de solución de OZEMPIC también contiene los siguientes ingredientes inactivos: dihidrato de fosfato disódico, 1,42 mg; propilenglicol, 14,0 mg; fenol, 5,50 mg; y agua para inyecciones. OZEMPIC tiene un pH de aproximadamente 7,4. Se puede agregar ácido clorhídrico o hidróxido de sodio para ajustar el pH. La concentración de 2 mg/1,5 mL (1,34 mg/mL) no está actualmente comercializada por Novo Nordisk Inc.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
La semaglutida es un análogo del GLP-1 con un 94% de homología de secuencia con el GLP-1 humano. La semaglutida actúa como un agonista del receptor GLP-1 que se une selectivamente y activa el receptor GLP-1, el objetivo del GLP-1 nativo.
El GLP-1 es una hormona fisiológica que tiene múltiples acciones sobre la glucosa, mediadas por los receptores GLP-1.
El principal mecanismo de prolongación que resulta en la larga semivida de la semaglutida es la unión a la albúmina, lo que resulta en una disminución del aclaramiento renal y protección contra la degradación metabólica. Además, la semaglutida se estabiliza contra la degradación por la enzima DPP-4.
La semaglutida reduce la glucosa en sangre a través de un mecanismo en el que estimula la secreción de insulina y disminuye la secreción de glucagón, ambos de manera glucosa-dependiente. Por lo tanto, cuando la glucosa en sangre es alta, se estimula la secreción de insulina y se inhibe la secreción de glucagón. El mecanismo de reducción de la glucosa en sangre también implica un retraso menor en el vaciado gástrico en la fase posprandial temprana.
12.2 Farmacodinamia
La semaglutida disminuye la glucosa en sangre en ayunas y posprandial y reduce el peso corporal. Todas las evaluaciones farmacodinámicas se realizaron después de 12 semanas de tratamiento (incluida la escalada de dosis) en estado estacionario con semaglutida 1 mg.
Glucosa en ayunas y posprandial
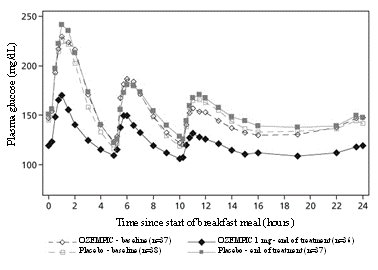
La semaglutida reduce las concentraciones de glucosa en ayunas y posprandial. En pacientes con diabetes tipo 2, el tratamiento con semaglutida 1 mg resultó en reducciones de glucosa en términos de cambio absoluto con respecto al valor inicial y reducción relativa en comparación con placebo de 29 mg/dL (22%) para la glucosa en ayunas, 74 mg/dL (36%) para la glucosa posprandial a las 2 horas y 30 mg/dL (22%) para la concentración media de glucosa en 24 horas (ver Figura 1).
Figura 1. Perfiles de glucosa plasmática media de 24 horas (comidas estandarizadas) en pacientes con diabetes tipo 2 antes (valor inicial) y después de 12 semanas de tratamiento con semaglutida o placebo
Secreción de insulina
Tanto la secreción de insulina de primera como de segunda fase aumentan en pacientes con diabetes tipo 2 tratados con OZEMPIC en comparación con placebo.
Secreción de glucagón
La semaglutida disminuye las concentraciones de glucagón en ayunas y posprandiales. En pacientes con diabetes tipo 2, el tratamiento con semaglutida resultó en las siguientes reducciones relativas en el glucagón en comparación con placebo: glucagón en ayunas (8%), respuesta de glucagón posprandial (14-15%) y concentración media de glucagón en 24 horas (12%).
Secreción de insulina y glucagón dependiente de la glucosa
La semaglutida disminuye las concentraciones altas de glucosa en sangre al estimular la secreción de insulina y disminuir la secreción de glucagón de manera glucosa-dependiente. Con semaglutida, la tasa de secreción de insulina en pacientes con diabetes tipo 2 fue similar a la de sujetos sanos (ver Figura 2).
Figura 2. Tasa media de secreción de insulina versus concentración de glucosa en pacientes con diabetes tipo 2 durante la infusión de glucosa graduada antes (valor inicial) y después de 12 semanas de tratamiento con semaglutida o placebo y en sujetos sanos no tratados
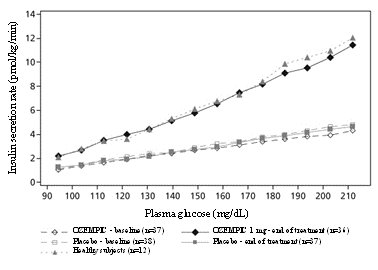
Durante la hipoglucemia inducida, la semaglutida no alteró las respuestas contrarreguladoras del aumento del glucagón en comparación con el placebo y no afectó la disminución del péptido C en pacientes con diabetes tipo 2.
Vaciado gástrico
La semaglutida provoca un retraso en el vaciado gástrico posprandial temprano, reduciendo así la velocidad a la que la glucosa aparece en la circulación posprandial.
Electrofisiología cardíaca (QTc)
El efecto de la semaglutida sobre la repolarización cardíaca se probó en un ensayo completo de QTc. La semaglutida no prolonga los intervalos QTc a dosis de hasta 1,5 mg en estado estacionario.
12.3 Farmacocinética
Absorción
La biodisponibilidad absoluta de la semaglutida es del 89%. La concentración máxima de semaglutida se alcanza de 1 a 3 días después de la dosis.
Se logra una exposición similar con la administración subcutánea de semaglutida en el abdomen, el muslo o la parte superior del brazo.
En pacientes con diabetes tipo 2, la exposición a la semaglutida aumenta de manera proporcional a la dosis para dosis semanales de 0,5 mg, 1 mg y 2 mg. La exposición en estado estacionario se alcanza después de 4-5 semanas de administración semanal. En pacientes con diabetes tipo 2, las concentraciones en estado estacionario estimadas por PK poblacional media después de la administración subcutánea semanal de 0,5 mg y 1 mg de semaglutida fueron aproximadamente 65,0 ng/mL y 123,0 ng/mL, respectivamente. En el ensayo que comparó semaglutida 1 mg y 2 mg, las concentraciones medias en estado estacionario fueron 111,1 ng/mL y 222,1 ng/mL, respectivamente.
Distribución
El volumen de distribución aparente medio de la semaglutida después de la administración subcutánea en pacientes con diabetes tipo 2 es de aproximadamente 12,5 L. La semaglutida se une extensamente a la albúmina plasmática (>99%).
Eliminación
El aclaramiento aparente de la semaglutida en pacientes con diabetes tipo 2 es de aproximadamente 0,05 L/h. Con una semivida de eliminación de aproximadamente 1 semana, la semaglutida estará presente en la circulación durante aproximadamente 5 semanas después de la última dosis.
Metabolismo
La principal vía de eliminación de la semaglutida es el metabolismo después de la escisión proteolítica del esqueleto peptídico y la β-oxidación secuencial de la cadena lateral del ácido graso.
Excreción
Las principales vías de excreción del material relacionado con la semaglutida son la orina y las heces. Aproximadamente el 3% de la dosis se excreta en la orina como semaglutida intacta.
Poblaciones específicas
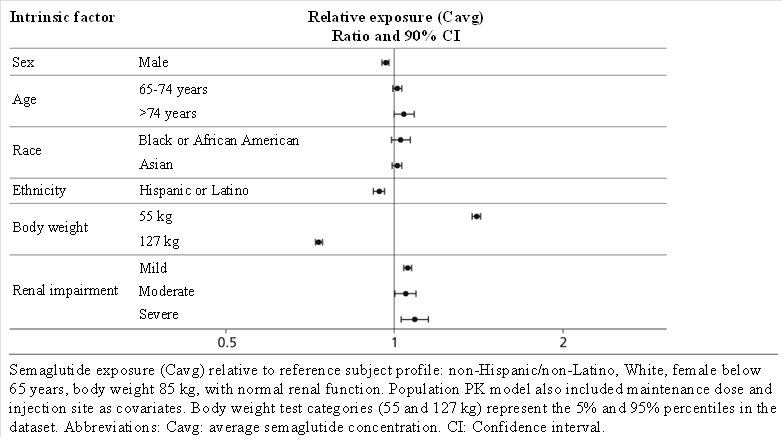
Según un análisis farmacocinético poblacional, la edad, el sexo, la raza y el origen étnico, y la insuficiencia renal no tienen un efecto clínicamente significativo en la farmacocinética de semaglutida. La exposición a semaglutida disminuye con un aumento en el peso corporal. Sin embargo, las dosis de semaglutida de 0.5 mg y 1 mg proporcionan una exposición sistémica adecuada en el rango de peso corporal de 40-198 kg evaluado en los ensayos clínicos. Los efectos de los factores intrínsecos en la farmacocinética de semaglutida se muestran en la Figura 3.
Figura 3. Impacto de los factores intrínsecos en la exposición a semaglutida
Pacientes con insuficiencia renal – La insuficiencia renal no afecta la farmacocinética de semaglutida de forma clínicamente relevante. Esto se demostró en un estudio con una dosis única de 0.5 mg de semaglutida en pacientes con diferentes grados de insuficiencia renal (leve, moderada, grave, ESRD) en comparación con sujetos con función renal normal. Esto también se demostró para sujetos con diabetes tipo 2 e insuficiencia renal según los datos de estudios clínicos (Figura 3).
Pacientes con insuficiencia hepática – La insuficiencia hepática no tiene ningún impacto en la exposición a semaglutida. La farmacocinética de semaglutida se evaluó en pacientes con diferentes grados de insuficiencia hepática (leve, moderada, grave) en comparación con sujetos con función hepática normal en un estudio con una dosis única de 0.5 mg de semaglutida.
Pacientes pediátricos– Semaglutida no se ha estudiado en pacientes pediátricos.
Estudios de interacción farmacológica
Estudios in vitro han demostrado un potencial muy bajo de semaglutida para inhibir o inducir enzimas CYP, y para inhibir transportadores de fármacos.
El retraso del vaciamiento gástrico con semaglutida puede influir en la absorción de medicamentos orales administrados concomitantemente [ver Interacciones farmacológicas (7.2)]. El efecto potencial de semaglutida sobre la absorción de medicamentos orales coadministrados se estudió en ensayos con una exposición de 1 mg de semaglutida en estado estacionario.
No se observó ninguna interacción fármaco-fármaco clínicamente relevante con semaglutida (Figura 4) según los medicamentos evaluados; por lo tanto, no se requiere ajuste de dosis cuando se coadministra con semaglutida. En un estudio separado, no se observó ningún efecto aparente sobre la velocidad de vaciamiento gástrico con 2.4 mg de semaglutida.
Figura 4. Impacto de semaglutida en la exposición a medicamentos orales coadministrados
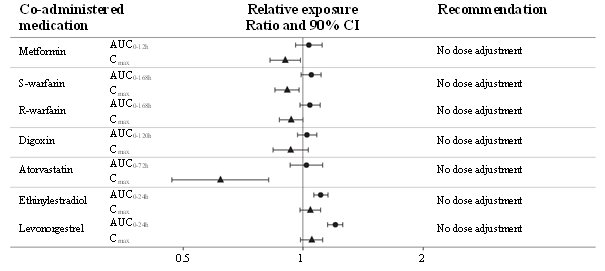
Exposición relativa en términos de AUC y Cmáx para cada medicamento cuando se administra con semaglutida en comparación con sin semaglutida. La metformina y el anticonceptivo oral (etinilestradiol/levonorgestrel) se evaluaron en estado estacionario. La warfarina (S-warfarina/R-warfarina), la digoxina y la atorvastatina se evaluaron después de una dosis única.
Abreviaturas: AUC: área bajo la curva. Cmáx: concentración máxima. CI: intervalo de confianza.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
En un estudio de carcinogenicidad de 2 años en ratones CD-1, se administraron dosis subcutáneas de 0.3, 1 y 3 mg/kg/día [2, 11 y 30 veces la dosis máxima recomendada en humanos (DMRH) de 2 mg/semana, según el AUC] a los machos, y 0.1, 0.3 y 1 mg/kg/día (1, 2 y 7 veces la DMRH) a las hembras. Se observó un aumento estadísticamente significativo en los adenomas de células C tiroideas y un aumento numérico en los carcinomas de células C en machos y hembras con exposiciones clínicamente relevantes.
-
- En un estudio de carcinogenicidad de 2 años en ratas Sprague Dawley, se administraron dosis subcutáneas de 0.0025, 0.01, 0.025 y 0.1 mg/kg/día (por debajo de la cuantificación, 0.2, 0.5 y 3 veces la exposición a la DMRH). Se observó un aumento estadísticamente significativo en los adenomas de células C tiroideas en machos y hembras en todos los niveles de dosis, y un aumento estadísticamente significativo en los carcinomas de células C tiroideas en machos a ≥0.01 mg/kg/día, con exposiciones clínicamente relevantes.
Se desconoce la relevancia en humanos de los tumores de células C tiroideas en ratas y no se pudo determinar mediante estudios clínicos o estudios no clínicos [ver Recuadro de advertencia y Advertencias y precauciones (5.1)].
Semaglutida no fue mutagénica ni clastogénica en una batería estándar de pruebas de genotoxicidad (mutagenicidad bacteriana (Ames), aberración cromosómica en linfocitos humanos, micronúcleo de médula ósea de rata).
En un estudio combinado de fertilidad y desarrollo embriofetal en ratas, se administraron dosis subcutáneas de 0.01, 0.03 y 0.09 mg/kg/día (0.06, 0.2 y 0.6 veces la DMRH) a ratas macho y hembra. Los machos recibieron dosis durante 4 semanas antes del apareamiento, y las hembras recibieron dosis durante 2 semanas antes del apareamiento y durante la organogénesis hasta el día 17 de gestación. No se observaron efectos sobre la fertilidad masculina. En las hembras, se observó un aumento en la duración del ciclo estral en todos los niveles de dosis, junto con una pequeña reducción en el número de cuerpos lúteos a ≥0.03 mg/kg/día. Es probable que estos efectos sean una respuesta adaptativa secundaria al efecto farmacológico de la semaglutida sobre el consumo de alimentos y el peso corporal.
14 ESTUDIOS CLÍNICOS
14.1 Resumen de los Estudios Clínicos
OZEMPIC ha sido estudiado como monoterapia y en combinación con metformina, metformina y sulfonilureas, metformina y/o tiazolidinedionas, y insulina basal en pacientes con diabetes mellitus tipo 2. La eficacia de OZEMPIC se comparó con placebo, sitagliptina, exenatida de liberación prolongada (ER) e insulina glargina.
La mayoría de los ensayos evaluaron el uso de OZEMPIC 0.5 mg y 1 mg, con la excepción del ensayo que comparó OZEMPIC y exenatida ER, donde solo se estudió la dosis de 1 mg. Un ensayo evaluó el uso de OZEMPIC 2 mg una vez por semana.
En pacientes con diabetes mellitus tipo 2, OZEMPIC produjo una reducción clínicamente relevante desde la línea de base en HbA1c en comparación con placebo.
La eficacia de OZEMPIC no se vio afectada por la edad, el género, la raza, la etnia, el IMC en la línea de base, el peso corporal (kg) en la línea de base, la duración de la diabetes y el nivel de deterioro de la función renal.
14.2 Uso de OZEMPIC como Monoterapia en Pacientes con Diabetes Mellitus Tipo 2
En un ensayo doble ciego de 30 semanas (NCT02054897), 388 pacientes con diabetes mellitus tipo 2 no controlados adecuadamente con dieta y ejercicio fueron aleatorizados a OZEMPIC 0.5 mg o OZEMPIC 1 mg una vez por semana o placebo. Los pacientes tenían una media de edad de 54 años y el 54% eran hombres. La duración media de la diabetes tipo 2 fue de 4.2 años y el IMC medio fue de 33 kg/m2. En general, el 64% eran blancos, el 8% eran negros o afroamericanos y el 21% eran asiáticos; el 30% se identificó como de etnia hispana o latina.
La monoterapia con OZEMPIC 0.5 mg y 1 mg una vez por semana durante 30 semanas resultó en una reducción estadísticamente significativa en HbA1c en comparación con placebo (ver Tabla 3).
Tabla 3. Resultados en la Semana 30 en un Ensayo de OZEMPIC como Monoterapia en Pacientes Adultos con Diabetes Mellitus Tipo 2 No Controlados Adecuadamente con Dieta y Ejercicio
aLa población intencion-a-tratar incluye a todos los pacientes aleatorizados y expuestos. En la semana 30, el punto final primario de HbA1c faltaba en el 10%, 7% y 7% de los pacientes y durante el ensayo, el medicamento de rescate fue iniciado por el 20%, 5% y 4% de los pacientes aleatorizados a placebo, OZEMPIC 0.5 mg y OZEMPIC 1 mg, respectivamente. Los datos faltantes se imputaron utilizando una imputación múltiple basada en los abandonos recuperados.
bAnálisis intencion-a-tratar utilizando ANCOVA ajustado por el valor basal y el país.
cp<0.0001 (bidireccional) para superioridad, ajustado por multiplicidad.
El peso corporal basal medio fue de 89.1 kg, 89.8 kg, 96.9 kg en los grupos de placebo, OZEMPIC 0.5 mg y OZEMPIC 1 mg, respectivamente. Los cambios medios desde el basal hasta la semana 30 fueron -1.2 kg, -3.8 kg y -4.7 kg en los grupos de placebo, OZEMPIC 0.5 mg y OZEMPIC 1 mg, respectivamente. La diferencia con respecto al placebo (IC del 95%) para OZEMPIC 0.5 mg fue -2.6 kg (-3.8, -1.5), y para OZEMPIC 1 mg fue -3.5 kg (-4.8, -2.2).
14.3 Uso de terapia combinada de OZEMPIC en pacientes con diabetes mellitus tipo 2
Combinación con metformina y/o tiazolidinedionas
En un ensayo doble ciego de 56 semanas (NCT01930188), 1231 pacientes con diabetes mellitus tipo 2 fueron aleatorizados a OZEMPIC 0.5 mg una vez por semana, OZEMPIC 1 mg una vez por semana o sitagliptina 100 mg una vez al día, todos en combinación con metformina (94%) y/o tiazolidinedionas (6%). Los pacientes tenían una edad media de 55 años y el 51% eran hombres. La duración media de la diabetes tipo 2 era de 6.6 años y el IMC medio era de 32 kg/m2. En general, el 68% eran blancos, el 5% eran negros o afroamericanos y el 25% eran asiáticos; el 17% se identificó como de etnia hispana o latina.
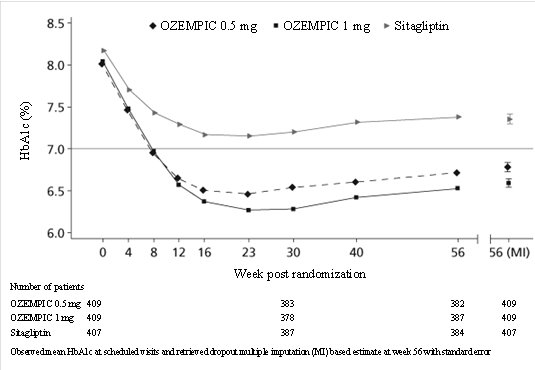
El tratamiento con OZEMPIC 0.5 mg y 1 mg una vez por semana durante 56 semanas resultó en una reducción estadísticamente significativa de HbA1c en comparación con la sitagliptina (ver Tabla 4 y Figura 5).
Tabla 4. Resultados en la semana 56 en un ensayo de OZEMPIC en comparación con Sitagliptina en pacientes adultos con diabetes mellitus tipo 2 en combinación con Metformina y/o Tiazolidinedionas
aLa población intencionada a tratar incluye a todos los pacientes aleatorizados y expuestos. En la semana 56, el punto final primario de HbA1c faltaba para el 7%, el 5% y el 6% de los pacientes, y durante el ensayo, el medicamento de rescate fue iniciado por el 5%, el 2% y el 19% de los pacientes aleatorizados a OZEMPIC 0.5 mg, OZEMPIC 1 mg y sitagliptina, respectivamente. Los datos faltantes se imputaron utilizando una imputación múltiple basada en los abandonos recuperados.
bAnálisis intencionado a tratar utilizando ANCOVA ajustado para el valor basal y el país.
cp<0.0001 (bidireccional) para la superioridad, ajustado para la multiplicidad.
El peso corporal basal medio fue de 89.9 kg, 89.2 kg, 89.3 kg en los brazos de OZEMPIC 0.5 mg, OZEMPIC 1 mg y sitagliptina, respectivamente. Los cambios medios desde el basal hasta la semana 56 fueron -4.2 kg, -5.5 kg y -1.7 kg para los brazos de OZEMPIC 0.5 mg, OZEMPIC 1 mg y sitagliptina, respectivamente. La diferencia con respecto a sitagliptina (IC 95%) para OZEMPIC 0.5 mg fue -2.5 kg (-3.2, -1.8), y para OZEMPIC 1 mg fue -3.8 kg (-4.5, -3.1).
Figura 5. Media de HbA1c (%) a lo largo del tiempo – desde el basal hasta la semana 56
Combinación con metformina o metformina con sulfonilurea
En un ensayo abierto de 56 semanas (NCT01885208), 813 pacientes con diabetes mellitus tipo 2 que recibían metformina sola (49%), metformina con sulfonilurea (45%) u otro (6%) fueron aleatorizados a OZEMPIC 1 mg una vez por semana o exenatida 2 mg una vez por semana. Los pacientes tenían una edad media de 57 años y el 55% eran hombres. La duración media de la diabetes tipo 2 era de 9 años, y el IMC medio era de 34 kg/m2. En general, el 84% eran blancos, el 7% eran negros o afroamericanos y el 2% eran asiáticos; el 24% se identificó como de etnia hispana o latina.
El tratamiento con OZEMPIC 1 mg una vez por semana durante 56 semanas resultó en una reducción estadísticamente significativa en HbA1c en comparación con exenatida 2 mg una vez por semana (ver Tabla 5).
Tabla 5. Resultados en la semana 56 en un ensayo de OZEMPIC en comparación con Exenatida 2 mg una vez por semana en pacientes adultos con diabetes mellitus tipo 2 en combinación con metformina o metformina con sulfonilurea
aLa población intencionada a tratar incluye a todos los pacientes aleatorizados y expuestos. En la semana 56, el punto final primario de HbA1c faltaba para el 9% y el 11% de los pacientes y durante el ensayo, el medicamento de rescate fue iniciado por el 5% y el 10% de los pacientes aleatorizados a OZEMPIC 1 mg y exenatida ER 2 mg, respectivamente. Los datos faltantes se imputaron utilizando imputación múltiple basada en los abandonos recuperados.
bAnálisis intencionado a tratar utilizando ANCOVA ajustado para el valor basal y el país.
cp<0.0001 (bidireccional) para la superioridad, ajustado por multiplicidad.
El peso corporal basal promedio fue de 96.2 kg y 95.4 kg en los brazos de OZEMPIC 1 mg y exenatida ER, respectivamente. Los cambios promedio desde el basal hasta la semana 56 fueron de -4.8 kg y -2.0 kg en los brazos de OZEMPIC 1 mg y exenatida ER, respectivamente. La diferencia de exenatida ER (IC 95%) para OZEMPIC 1 mg fue de -2.9 kg (-3.6, -2.1).
Combinación con metformina o metformina con sulfonilurea
En un ensayo abierto de 30 semanas (NCT02128932), 1089 pacientes con diabetes mellitus tipo 2 fueron aleatorizados a OZEMPIC 0.5 mg una vez por semana, OZEMPIC 1 mg una vez por semana o insulina glargina una vez al día con un fondo de metformina (48%) o metformina y sulfonilurea (51%). Los pacientes tenían una edad promedio de 57 años y el 53% eran hombres. La duración promedio de la diabetes tipo 2 fue de 8.6 años y el IMC promedio fue de 33 kg/m2. En general, el 77% eran blancos, el 9% eran negros o afroamericanos y el 11% eran asiáticos; el 20% se identificó como de etnia hispana o latina.
A los pacientes asignados a insulina glargina se les dio un valor basal promedio de HbA1c de 8.1% y se inició con una dosis de 10 U una vez al día. Los ajustes de la dosis de insulina glargina se realizaron durante todo el período del ensayo basándose en la glucosa plasmática en ayunas autoevaluada antes del desayuno, con un objetivo de 71 a <100 mg/dL. Además, los investigadores podían ajustar la insulina glargina a su discreción entre las visitas del estudio. Sólo el 26% de los pacientes habían alcanzado el objetivo en el punto final primario en la semana 30, momento en el que la dosis media diaria de insulina era de 29 U por día.
El tratamiento con OZEMPIC 0.5 mg y 1 mg una vez por semana durante 30 semanas resultó en una reducción estadísticamente significativa en HbA1c en comparación con la titulación de insulina glargina implementada en este protocolo de estudio (ver Tabla 6).
Tabla 6. Resultados en la semana 30 en un ensayo de OZEMPIC en comparación con Insulina Glargina en Pacientes Adultos con Diabetes Mellitus Tipo 2 en Combinación con Metformina o Metformina con Sulfonilurea
aLa población intencionada a tratar incluye a todos los pacientes aleatorizados y expuestos. En la semana 30, el punto final primario de HbA1c faltaba para el 8%, el 6% y el 6% de los pacientes, y durante el ensayo, el medicamento de rescate fue iniciado por el 4%, el 3% y el 1% de los pacientes aleatorizados a OZEMPIC 0.5 mg, OZEMPIC 1 mg e insulina glargina, respectivamente. Los datos faltantes se imputaron utilizando una imputación múltiple basada en los abandonos recuperados.
bAnálisis intencionado a tratar utilizando ANCOVA ajustado para el valor basal, el país y los factores de estratificación.
cp<0.0001 (2 lados) para la superioridad, ajustado por multiplicidad.
La media del peso corporal basal fue de 93.7 kg, 94.0 kg, 92.6 kg en los brazos de OZEMPIC 0.5 mg, OZEMPIC 1 mg e insulina glargina, respectivamente. Los cambios medios desde el basal hasta la semana 30 fueron -3.2 kg, -4.7 kg y 0.9 kg en los brazos de OZEMPIC 0.5 mg, OZEMPIC 1 mg e insulina glargina, respectivamente. La diferencia con respecto a la insulina glargina (95% IC) para OZEMPIC 0.5 mg fue -4.1 kg (-4.9, -3.3) y para OZEMPIC 1 mg fue -5.6 kg
(-6.4, -4.8).
Combinación con metformina o metformina con sulfonilurea
En un ensayo doble ciego de 40 semanas (NCT03989232), 961 pacientes con diabetes tipo 2 que actualmente estaban siendo tratados con metformina con o sin tratamiento con sulfonilurea fueron aleatorizados a OZEMPIC 2 mg o OZEMPIC 1 mg una vez por semana. Los pacientes tenían una media de edad de 58.0 años y el 58.6% eran hombres. La duración media de la diabetes tipo 2 fue de 9.5 años y la media del IMC fue de 34.6 kg/m2. En la aleatorización, el 53.3% de los pacientes estaban siendo tratados con sulfonilurea y metformina. En general, el 88.1% eran blancos, el 4.5% eran negros o afroamericanos y el 7.2% eran asiáticos; el 11.6% se identificaron como de etnia hispana o latina. El tratamiento con OZEMPIC 2 mg una vez por semana durante 40 semanas resultó en una reducción estadísticamente significativa en HbA1c en comparación con OZEMPIC 1 mg (ver Tabla 7).
Los pacientes fueron estratificados por región (Japón/fuera de Japón) en la aleatorización.
Tabla 7. Resultados en la Semana 40 en un Ensayo de OZEMPIC 2 mg Comparado con OZEMPIC 1 mg en Pacientes Adultos con Diabetes Mellitus Tipo 2 en Combinación con Metformina o Metformina con Sulfonilurea
a La población de intención de tratar incluye a todos los sujetos aleatorizados. En la semana 40, el punto final primario de HbA1c faltaba para el 3% y el 5% de los pacientes aleatorizados a OZEMPIC 1 mg y OZEMPIC 2 mg, respectivamente. Los datos faltantes se imputaron utilizando una imputación múltiple basada en los abandonos recuperados. Para el cálculo de las proporciones, los valores imputados se dicotomizan y el denominador es el número de todos los sujetos aleatorizados.
b Análisis de intención de tratar utilizando ANCOVA ajustado por el valor basal y el factor de estratificación.
c p < 0.01 (bidireccional) para la superioridad, ajustado por la multiplicidad.
El peso corporal basal medio fue de 98.6 kg y 100.1 kg en los brazos de OZEMPIC 1 mg y OZEMPIC 2 mg, respectivamente. Los cambios medios desde el basal hasta la semana 40 fueron -5.6 kg y -6.4 kg en los brazos de OZEMPIC 1 mg y OZEMPIC 2 mg, respectivamente. La diferencia entre los brazos de tratamiento en el cambio de peso corporal desde el basal en la semana 40 no fue estadísticamente significativa.
Combinación con insulina basal
En un ensayo doble ciego de 30 semanas (NCT02305381), 397 pacientes con diabetes mellitus tipo 2 no controlada adecuadamente con insulina basal, con o sin metformina, fueron aleatorizados a OZEMPIC 0.5 mg una vez por semana, OZEMPIC 1 mg una vez por semana o placebo. Los pacientes con HbA1c ≤ 8.0% en la selección redujeron su dosis de insulina en un 20% al inicio del ensayo para reducir el riesgo de hipoglucemia. Los pacientes tenían una edad media de 59 años y el 56% eran hombres. La duración media de la diabetes tipo 2 era de 13 años y el IMC medio era de 32 kg/m2. En general, el 78% eran blancos, el 5% eran negros o afroamericanos y el 17% eran asiáticos; el 12% se identificó como de etnia hispana o latina.
El tratamiento con OZEMPIC resultó en una reducción estadísticamente significativa de HbA1c después de 30 semanas de tratamiento en comparación con el placebo (ver Tabla 8).
Tabla 8. Resultados en la Semana 30 en un Ensayo de OZEMPIC en Pacientes Adultos con Diabetes Mellitus Tipo 2 en Combinación con Insulina Basal con o sin Metformina
aLa población de intención de tratar incluye a todos los pacientes aleatorizados y expuestos. En la semana 30, el punto final primario de HbA1c faltaba para el 7%, 5% y 5% de los pacientes y durante el ensayo, el medicamento de rescate fue iniciado por el 14%, 2% y 1% de los pacientes aleatorizados a placebo, OZEMPIC 0.5 mg y OZEMPIC 1 mg, respectivamente. Los datos faltantes se imputaron utilizando imputación múltiple basada en los pacientes que abandonaron el estudio y cuyos datos se recuperaron.
bAnálisis de intención de tratar utilizando ANCOVA ajustado por el valor basal, el país y los factores de estratificación.
cp<0.0001 (bidireccional) para la superioridad, ajustado por la multiplicidad.
El peso corporal basal medio fue de 89.9 kg, 92.7 kg y 92.5 kg en los grupos de placebo, OZEMPIC 0.5 mg y OZEMPIC 1 mg, respectivamente. Los cambios medios desde el basal hasta la semana 30 fueron -1.2 kg, -3.5 kg y -6.0 kg en los grupos de placebo, OZEMPIC 0.5 mg y OZEMPIC 1 mg, respectivamente. La diferencia con respecto al placebo (IC del 95%) para OZEMPIC 0.5 mg fue -2.2 kg (-3.4, -1.1), y para OZEMPIC 1 mg fue -4.7 kg (-5.8, -3.6).
14.4 Ensayo de Resultados Cardiovasculares de OZEMPIC en Pacientes con Diabetes Mellitus Tipo 2 y Enfermedad Cardiovascular
SUSTAIN 6 (NCT01720446) fue un ensayo cardiovascular de resultados, multicéntrico, multinacional, controlado con placebo, doble ciego. En este ensayo, 3.297 pacientes con diabetes tipo 2 inadecuadamente controlada y enfermedad cardiovascular aterosclerótica fueron aleatorizados a OZEMPIC (0.5 mg o 1 mg) una vez a la semana o placebo durante un tiempo de observación mínimo de 2 años. El ensayo comparó el riesgo de Evento Cardiovascular Adverso Mayor (MACE) entre semaglutida y placebo cuando se agregaron y se usaron concomitantemente con los tratamientos estándar de cuidado para la diabetes y la enfermedad cardiovascular. El punto final primario, MACE, fue el tiempo hasta la primera ocurrencia de un resultado compuesto de tres partes que incluyó muerte cardiovascular, infarto de miocardio no fatal y accidente cerebrovascular no fatal.
Los pacientes elegibles para ingresar al ensayo eran; mayores de 50 años y tenían enfermedad cardiovascular, cerebrovascular, enfermedad arterial periférica, enfermedad renal crónica o insuficiencia cardíaca NYHA clase II y III establecida y estable, o mayores de 60 años y tenían otros factores de riesgo especificados para la enfermedad cardiovascular. En total, 1.940 pacientes (58.8%) tenían enfermedad cardiovascular establecida sin enfermedad renal crónica, 353 (10.7%) tenían solo enfermedad renal crónica y 442 (13.4%) tenían tanto enfermedad cardiovascular como enfermedad renal; 562 pacientes (17%) tenían factores de riesgo cardiovascular sin enfermedad cardiovascular establecida o enfermedad renal crónica. En el ensayo, 453 pacientes (13.7%) tenían enfermedad arterial periférica. La edad media en el basal fue de 65 años y el 61% eran hombres. La duración media de la diabetes fue de 13.9 años y el IMC medio fue de 33 kg/m2. En general, el 83% eran blancos, el 7% eran negros o afroamericanos y el 8% eran asiáticos; el 16% se identificó como de etnia hispana o latina. Las enfermedades concomitantes de los pacientes en este ensayo incluyeron, pero no se limitaron a, insuficiencia cardíaca (24%), hipertensión (93%), historia de accidente cerebrovascular isquémico (12%) y historia de infarto de miocardio (33%). En total, el 98.0% de los pacientes completó el ensayo y el estado vital era conocido al final del ensayo para el 99.6%.
Para el análisis primario, se utilizó un modelo de riesgos proporcionales de Cox para probar la no inferioridad de OZEMPIC frente a placebo para el tiempo hasta el primer MACE utilizando un margen de riesgo de 1.3. El plan de análisis estadístico especificó previamente que las dosis de 0.5 mg y 1 mg se combinarían. El error de tipo 1 se controló en múltiples pruebas utilizando una estrategia de pruebas jerárquicas.
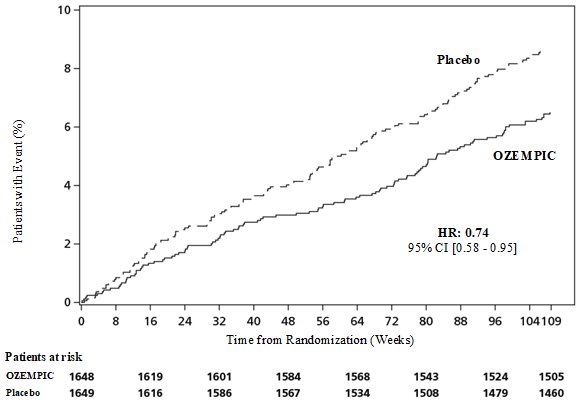
OZEMPIC redujo significativamente la ocurrencia de MACE. La razón de riesgo estimada para el tiempo hasta el primer MACE fue 0.74 (IC del 95%: 0.58, 0.95). Consulte la Figura 6 y la Tabla 9.
Figura 6. Kaplan-Meier: Tiempo hasta la Primera Ocurrencia de un MACE en el Ensayo SUSTAIN 6
El efecto del tratamiento para el punto final primario compuesto y sus componentes en el ensayo SUSTAIN 6 se muestra en la Tabla 9.
Tabla 9. Efecto del Tratamiento para MACE y sus Componentes, Tiempo de Observación Medio del Estudio de 2.1 Años
|
Muerte cardiovascular
|
46 (2.8)
|
44 (2.7)
|
0.98 (0.65, 1.48)
|
|
Infarto de miocardio fatal o no fatal
|
67 (4.1)
|
54 (3.3)
|
0.81 (0.57, 1.16)
|
|
Accidente cerebrovascular fatal o no fatal
|
46 (2.8)
|
30 (1.8)
|
0.65 (0.41, 1.03)
|
a Modelos de riesgos proporcionales de Cox con el tratamiento como factor y estratificados por evidencia de enfermedad cardiovascular, tratamiento con insulina y deterioro renal.
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
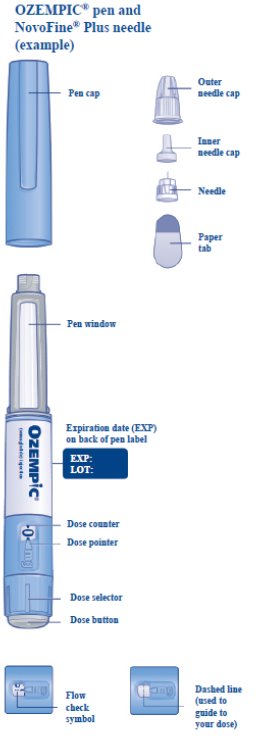
Cómo se Suministra
Inyección: solución transparente e incolora de 0.68 mg/mL, 1.34 mg/mL o 2.68 mg/mL de semaglutide disponible en plumas precargadas, desechables y de un solo paciente en las siguientes configuraciones de empaque:
La concentración de 2 mg/1.5 mL (1.34 mg/mL) (NDC 0169-4132-12) no se comercializa actualmente por Novo Nordisk Inc.
Cada pluma de OZEMPIC es para uso de un solo paciente. Una pluma de OZEMPIC nunca debe compartirse entre pacientes, incluso si se cambia la aguja [ver Advertencias y precauciones (5.4)].
Almacenamiento Recomendado
Antes del primer uso, OZEMPIC debe almacenarse en un refrigerador entre 2ºC y 8ºC (36ºF a 46ºF) (Tabla 10). No lo almacene en el congelador ni directamente junto al elemento de enfriamiento del refrigerador. No congele OZEMPIC y no lo use si se ha congelado.
Después del primer uso de la pluma de OZEMPIC, la pluma se puede almacenar durante 56 días a temperatura ambiente controlada (15°C a 30°C; 59°F a 86°F) o en un refrigerador (2°C a 8°C; 36°F a 46°F). No congelar. Mantenga la tapa de la pluma puesta cuando no esté en uso. OZEMPIC debe protegerse del calor excesivo y la luz solar.
Siempre retire y deseche de forma segura la aguja después de cada inyección y guarde la pluma de OZEMPIC sin una aguja de inyección conectada. Siempre use una aguja nueva para cada inyección.
Las condiciones de almacenamiento se resumen en la Tabla 10:
-
-
Tabla 10. Condiciones de Almacenamiento Recomendadas para la Pluma de OZEMPIC
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente que lea el etiquetado del paciente aprobado por la FDA (Guía de medicamentos e Instrucciones de uso).
Riesgo de tumores de células C tiroideas
Informe a los pacientes que la semaglutida causa tumores de células C tiroideas en roedores y que no se ha determinado la relevancia de este hallazgo en humanos. Aconseje a los pacientes que informen a su médico sobre los síntomas de tumores tiroideos (por ejemplo, un bulto en el cuello, ronquera, disfagia o disnea) [ver Advertencia en recuadro y Advertencias y precauciones (5.1)].
Pancreatitis
Informe a los pacientes sobre el riesgo potencial de pancreatitis. Indique a los pacientes que interrumpan OZEMPIC de inmediato y se pongan en contacto con su médico si se sospecha pancreatitis (dolor abdominal intenso que puede irradiarse a la espalda, y que puede o no ir acompañado de vómitos) [ver Advertencias y precauciones (5.2)].
Complicaciones de la retinopatía diabética
Informe a los pacientes que se pongan en contacto con su médico si experimentan cambios en la visión durante el tratamiento con OZEMPIC [ver Advertencias y precauciones (5.3)].
Nunca comparta un bolígrafo OZEMPIC entre pacientes
Avise a los pacientes que nunca deben compartir un bolígrafo OZEMPIC con otra persona, incluso si se cambia la aguja, ya que hacerlo conlleva un riesgo de transmisión de patógenos transmitidos por la sangre [ver Advertencias y precauciones (5.4)].
Hipoglucemia con el uso concomitante de secretagogos de insulina o insulina
Informe a los pacientes que el riesgo de hipoglucemia aumenta cuando se usa OZEMPIC con un secretagogo de insulina (como una sulfonilurea) o insulina. Eduque a los pacientes sobre los signos y síntomas de la hipoglucemia [ver Advertencias y precauciones (5.5)].
Lesión renal aguda
Avise a los pacientes tratados con OZEMPIC sobre el riesgo potencial de deshidratación debido a reacciones adversas gastrointestinales y tome precauciones para evitar la depleción de líquidos. Informe a los pacientes sobre el riesgo potencial de empeoramiento de la función renal y explique los signos y síntomas asociados del deterioro renal, así como la posibilidad de diálisis como intervención médica si se produce una lesión renal aguda [ver Advertencias y precauciones (5.6)].
Reacciones de hipersensibilidad
Informe a los pacientes que se han notificado reacciones de hipersensibilidad graves durante el uso posterior a la comercialización de OZEMPIC. Avise a los pacientes sobre los síntomas de las reacciones de hipersensibilidad e indíqueles que dejen de tomar OZEMPIC y busquen consejo médico de inmediato si se producen dichos síntomas [ver Advertencias y precauciones (5.7)].
Enfermedad aguda de la vesícula biliar
Informe a los pacientes sobre el riesgo potencial de colelitiasis o colecistitis. Indique a los pacientes que se pongan en contacto con su médico si se sospecha colelitiasis o colecistitis para un seguimiento clínico adecuado [ver Advertencias y precauciones (5.8)].
Aspiración pulmonar durante anestesia general o sedación profunda
Informe a los pacientes que OZEMPIC puede hacer que su estómago se vacíe más lentamente, lo que puede provocar complicaciones con la anestesia o la sedación profunda durante cirugías o procedimientos planificados. Indique a los pacientes que informen a los proveedores de atención médica antes de cualquier cirugía o procedimiento planificado si están tomando OZEMPIC [ver Advertencias y precauciones (5.9)].
Embarazo
Avise a una mujer embarazada del riesgo potencial para un feto. Aconseje a las mujeres que informen a su proveedor de atención médica si están embarazadas o tienen la intención de quedar embarazadas [ver Uso en poblaciones específicas (8.1), (8.3)].
Dosis olvidadas
Informe a los pacientes que si se olvida una dosis, debe administrarse lo antes posible dentro de los 5 días posteriores a la dosis olvidada. Si han pasado más de 5 días, se debe omitir la dosis olvidada y se debe administrar la siguiente dosis el día programado regularmente. En cada caso, informe a los pacientes que reanuden su régimen de dosificación regular una vez por semana [ver Dosificación y administración (2.2)].
Fabricado por:
Novo Nordisk A/S
DK-2880 Bagsvaerd
Dinamarca
Para obtener información sobre OZEMPIC, comuníquese con:
Novo Nordisk Inc.
800 Scudders Mill Road
Plainsboro, NJ 08536
1-888-693-6742
Versión: 10
OZEMPIC® y NovoFine® son marcas comerciales registradas de Novo Nordisk A/S.
INFORMACIÓN DE PATENTES: http://www.novonordisk-us.com/products/product-patents.html
© 2024 Novo Nordisk
Guía de medicación








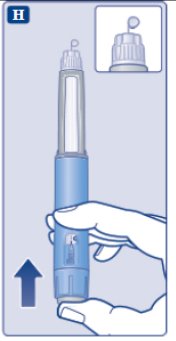

 le guiará
le guiará 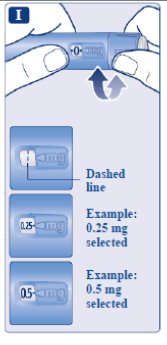

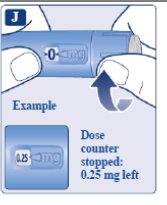
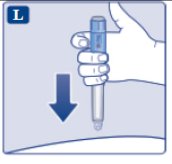
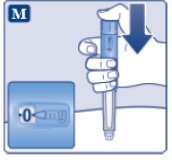
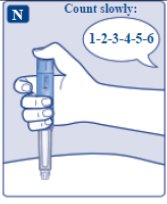








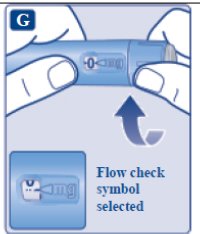
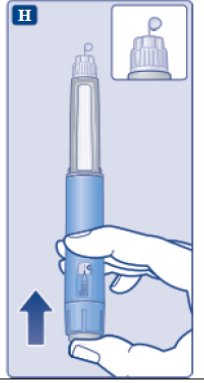

 le guiará hasta 1 mg.
le guiará hasta 1 mg.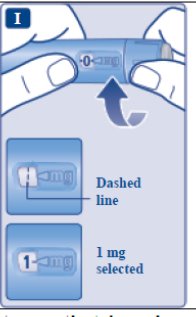


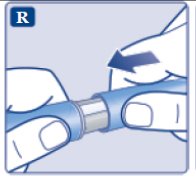
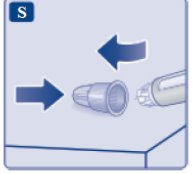





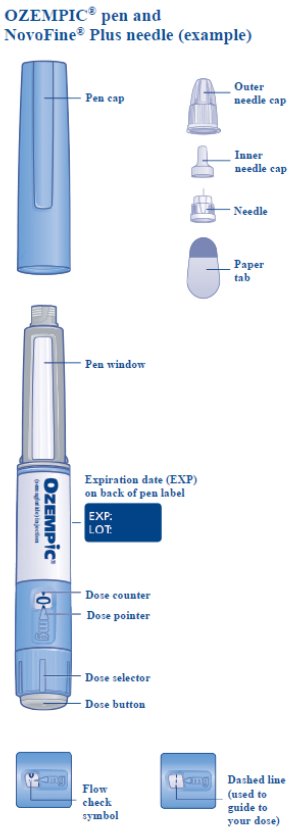
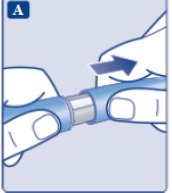
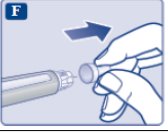


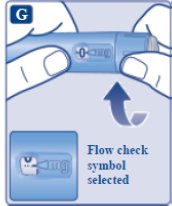
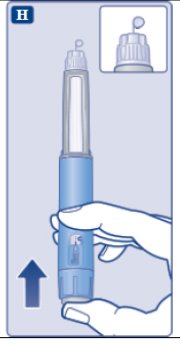

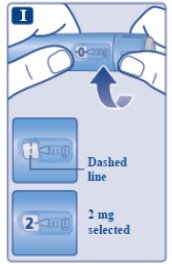
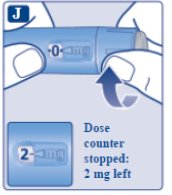
 le guiará hasta los 2 mg.
le guiará hasta los 2 mg.