Fabricante de medicamentos: Novo Nordisk (Updated: 2020-07-10)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
NOVOSEVEN RT (Factor VIIa de coagulación, recombinante)
polvo liofilizado para solución, para administración intravenosa
Aprobación inicial en EE. UU.: 1999
ADVERTENCIA: TROMBOSIS
Consulte la información completa de prescripción para obtener la advertencia completa en recuadro
- •
- Se han notificado eventos trombóticos arteriales y venosos graves después de la administración de NOVOSEVEN RT. (5.1)
- •
- Comente los riesgos y explique los signos y síntomas de los eventos trombóticos y tromboembólicos a los pacientes que recibirán NOVOSEVEN RT
- •
- Controle a los pacientes en busca de signos o síntomas de activación del sistema de coagulación y de trombosis. (5.1)
INDICACIONES Y USO
NOVOSEVEN RT, Factor VIIa de coagulación (recombinante) está indicado para:
- •
- Tratamiento de episodios de sangrado y manejo perioperatorio en adultos y niños con hemofilia A o B con inhibidores, deficiencia congénita del Factor VII (FVII) y trombastenia de Glanzmann con refractariedad a las transfusiones de plaquetas, con o sin anticuerpos a las plaquetas (1)
- •
- Tratamiento de episodios de sangrado y manejo perioperatorio en adultos con hemofilia adquirida (1)
DOSIFICACIÓN Y ADMINISTRACIÓN
Solo para inyección intravenosa
Episodios de sangrado (2.1)
|
Indicación |
Recomendación de dosificación |
|
Hemofilia A o B congénita con inhibidores |
|
|
Hemofilia adquirida |
|
|
Deficiencia congénita del Factor VII |
|
|
Trombastenia de Glanzmann |
|
Manejo perioperatorio (2.1)
|
Indicación |
Recomendación de dosificación |
|
Hemofilia A o B congénita con inhibidores |
Menor:
Mayor:
|
|
Hemofilia adquirida |
|
|
Deficiencia congénita del Factor VII |
|
|
Trombastenia de Glanzmann |
|
FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Disponible como polvo liofilizado en viales de dosis única de 1, 2, 5 u 8 mg de factor VIIa recombinante (FVIIa). Después de la reconstitución con el volumen especificado de diluyente de histidina, la solución final contiene 1 mg por mL (1000 microgramos por mL) de FVIIa recombinante (3)
CONTRAINDICACIONES
Ninguna conocida (4)
ADVERTENCIAS Y PRECAUCIONES
- •
- Las reacciones de hipersensibilidad, incluida la anafilaxia, pueden ocurrir con NOVOSEVEN RT. Suspenda la infusión y administre el tratamiento adecuado si aparecen los síntomas (5.2)
- •
- Puede aparecer anticuerpos contra el FVII en pacientes con deficiencia de FVII. Controle a los pacientes con deficiencia de factor VII para el tiempo de protrombina (TP) y la actividad coagulante del FVII, y para la formación de anticuerpos contra NOVOSEVEN RT (5.3)
REACCIONES ADVERSAS
Las reacciones adversas más comunes y graves en los ensayos clínicos son los eventos trombóticos. Las reacciones adversas trombóticas después de la administración de NOVOSEVEN en los ensayos clínicos ocurrieron en el 4% de los pacientes con hemofilia adquirida y el 0,2% de los episodios de sangrado en pacientes con hemofilia congénita (6)
Para informar sobre REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Novo Nordisk Inc. al 1-877-668-6777 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES MEDICAMENTOSAS
Ver 17 para INFORMACIÓN PARA EL PACIENTE y el etiquetado del paciente aprobado por la FDA.
Revisado: 7/2020
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
ADVERTENCIA: TROMBOSIS
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis
2.2 Reconstitución
2.3 Administración
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Trombosis
5.2 Reacciones de hipersensibilidad
5.3 Formación de anticuerpos en pacientes con deficiencia del factor VII
5.4 Pruebas de laboratorio
6 REACCIONES ADVERSAS
6.1 Experiencia en ensayos clínicos
6.2 Experiencia posterior a la comercialización
7 INTERACCIONES FARMACOLÓGICAS
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso pediátrico
8.5 Uso geriátrico
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad
13.2 Toxicología animal y/o farmacología
14 ESTUDIOS CLÍNICOS
14.1 Hemofilia A o B con inhibidores
14.2 Deficiencia congénita del factor VII
14.3 Hemofilia adquirida
14.4 Trombastenia de Glanzmann
15 REFERENCIAS
16 CÓMO SUMINISTRARLO/ALMACENAMIENTO Y MANIPULACIÓN
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información de prescripción completa no se enumeran.
ADVERTENCIA RECUADRADA
ADVERTENCIA: TROMBOSIS
- •
- Se han notificado eventos trombóticos arteriales y venosos graves después de la administración de NOVOSEVEN RT. [Ver Advertencias y precauciones (5.1)]
- •
- Comente los riesgos y explique los signos y síntomas de los eventos trombóticos y tromboembólicos a los pacientes que recibirán NOVOSEVEN RT. [Ver Advertencias y precauciones (5.1)]
- •
- Controle a los pacientes para detectar signos o síntomas de activación del sistema de coagulación y trombosis. [Ver Advertencias y precauciones (5.1)]
1 INDICACIONES Y USO
NOVOSEVEN RT, Factor de Coagulación VIIa (Recombinante), está indicado para:
- •
- Tratamiento de episodios hemorrágicos y manejo perioperatorio en adultos y niños con hemofilia A o B con inhibidores, deficiencia congénita del Factor VII (FVII) y trombastenia de Glanzmann con refractariedad a las transfusiones de plaquetas, con o sin anticuerpos contra las plaquetas.
- •
- Tratamiento de episodios hemorrágicos y manejo perioperatorio en adultos con hemofilia adquirida.
2 DOSIS Y ADMINISTRACIÓN
Solo para administración intravenosa
2.1 Dosis
- •
- Utilice la evaluación de la hemostasia para determinar la eficacia de NOVOSEVEN RT y para proporcionar una base para la modificación del esquema de tratamiento con NOVOSEVEN RT.
- •
- Los parámetros de coagulación no necesariamente se correlacionan con ni predicen la eficacia de NOVOSEVEN RT.
Tratamiento de episodios de sangrado agudo
La dosificación de NOVOSEVEN RT para el tratamiento de episodios de sangrado agudo se proporciona en la Tabla 1.
Tabla 1: Dosificación para el tratamiento de episodios de sangrado agudo
| Dosis* y Frecuencia |
Duración del tratamiento | Información adicional |
|---|---|---|
|
||
|
Hemofilia A o B congénita con inhibidores |
||
|
Hemostático 90 mcg/kg cada dos horas, ajustable según la gravedad del sangrado Post-hemostático 90 mcg/kg cada 3-6 horas para hemorragias graves |
Hasta que se logre la hemostasia o hasta que se considere que el tratamiento es inadecuado Después de lograr la hemostasia para mantener el tapón hemostático |
No se ha estudiado la duración adecuada de la dosificación post-hemostática |
|
Hemofilia adquirida |
||
|
70-90 mcg/kg cada 2-3 horas |
Hasta que se logre la hemostasia |
|
|
Deficiencia congénita del factor VII |
||
|
15-30 mcg/kg cada 4-6 horas |
Hasta que se logre la hemostasia |
Se ha logrado un tratamiento eficaz con dosis tan bajas como 10 microgramos por kg de peso corporal. Ajuste la dosis y la frecuencia de las inyecciones a cada paciente individual |
|
Trombastenia de Glanzmann |
||
|
90 mcg/kg cada 2-6 horas |
En episodios de sangrado graves que requieren tratamiento hemostático sistémico hasta que se logre la hemostasia |
Las transfusiones de plaquetas son el tratamiento principal en pacientes con trombastenia de Glanzmann sin refractariedad a las plaquetas o en pacientes sin anticuerpos específicos contra las plaquetas |
Hemofilia A o B congénita con inhibidores
- •
- La dosis y el intervalo de administración pueden ajustarse a cada paciente en función de la gravedad de la hemorragia.1
- •
- Para los pacientes tratados por hemorragias articulares o musculares, se llegó a una decisión sobre el resultado para la mayoría de los pacientes en el plazo de ocho dosis, aunque se necesitaron más dosis para las hemorragias graves. La mayoría de los pacientes que notificaron reacciones adversas recibieron más de doce dosis. Vigile y minimice la duración de cualquier dosis posterior a la hemostasia.
Manejo perioperatorio
La dosificación de NOVOSEVEN RT para la prevención de hemorragias en intervenciones quirúrgicas o procedimientos invasivos (manejo perioperatorio) se proporciona en la Tabla 2.
Tabla 2: Dosificación para el manejo perioperatorio
| Tipo de cirugía | Dosis y frecuencia | Información adicional |
|---|---|---|
|
||
|
Hemofilia A o B congénita con inhibidores |
||
|
Menor |
Inicial: Posquirúrgico: 90 mcg/kg cada 2 horas durante 48 horas y luego cada 2-6 horas hasta que se produzca la cicatrización |
|
|
Mayor |
Inicial: 90 mcg/kg inmediatamente antes de la cirugía y repetir cada 2 horas durante la duración de la misma Posquirúrgico: 90 mcg/kg cada 2 horas durante 5 días y luego cada 4 horas o mediante perfusión continua a 50 mcg/kg/hora hasta que se produzca la cicatrización |
Se pueden administrar dosis adicionales en bolo |
|
Hemofilia adquirida |
||
|
Menor o mayor |
70-90 mcg/kg inmediatamente antes de la cirugía y repetir cada 2-3 horas durante la duración de la misma y hasta que se consiga la hemostasia* |
|
|
Déficit congénito de factor VII |
||
|
Menor o mayor |
15-30 mcg/kg inmediatamente antes de la cirugía y repetir cada 4-6 horas durante la duración de la misma y hasta que se consiga la hemostasia* Ajustar la dosis y la frecuencia de las inyecciones a cada paciente |
Dosis tan bajas como 10 microgramos por kg de peso corporal pueden ser eficaces |
|
Trombastenia de Glanzmann |
||
|
Menor o mayor |
Inicial: 90 mcg/kg inmediatamente antes de la cirugía y repetir cada 2 horas durante la duración del procedimiento* Posquirúrgico: 90 mcg/kg cada 2-6 horas para prevenir la hemorragia postoperatoria* |
Se pueden utilizar dosis más altas de 100-140 microgramos por kg para pacientes quirúrgicos que presenten refractariedad clínica con o sin anticuerpos específicos contra las plaquetas |
2.2 Reconstitución
- •
- Siga los procedimientos a continuación para la preparación y reconstitución de NOVOSEVEN RT. En caso de preguntas sobre la reconstitución, comuníquese con Novo Nordisk al 1-877-NOVO-777.
- •
- Calcule la dosis de NOVOSEVEN RT y seleccione el paquete de NOVOSEVEN RT apropiado provisto con un vial de diluyente de histidina o una jeringa precargada de diluyente de histidina.
- •
- Reconstituir únicamente con el diluyente de histidina provisto con NOVOSEVEN RT.
Paquete de NOVOSEVEN RT que contiene 1 vial de polvo de NOVOSEVEN RT y 1 vial de diluyente de histidina:
- 1.
- Siempre use técnica aséptica.
- 2.
- Lleve NOVOSEVEN RT (polvo blanco, liofilizado) y el volumen especificado de histidina (diluyente) a temperatura ambiente, pero no superior a 37 °C (98,6 °F). El volumen especificado de diluyente correspondiente a la cantidad de NOVOSEVEN RT es el siguiente:
1 mg (1000 microgramos) vial + 1.1 mL Diluyente de histidina
2 mg (2000 microgramos) vial + 2.1 mL Diluyente de histidina
5 mg (5000 microgramos) vial + 5.2 mL Diluyente de histidina
8 mg (8000 microgramos) vial + 8.1 mL Diluyente de histidina - 3.
- Retire las tapas de los viales de NOVOSEVEN RT para exponer la parte central del tapón de goma. Limpie los tapones de goma con un hisopo de alcohol y deje secar antes de usar.
- 4.
- Retire el émbolo de una jeringa estéril (unida a una aguja estéril) y admita aire en la jeringa. Se recomienda usar agujas de jeringa de tamaño de calibre 20-26.
- 5.
- Inserte la aguja de la jeringa en el vial de diluyente de histidina. Inyecte aire en el vial y retire la cantidad requerida para la reconstitución.
- 6.
- Inserte la aguja de la jeringa que contiene el diluyente en el vial de NOVOSEVEN RT a través del centro del tapón de goma, dirigiendo la aguja hacia el lateral para que el chorro de líquido corra por la pared del vial (el vial de NOVOSEVEN RT no contiene vacío). No inyecte el diluyente directamente sobre el polvo de NOVOSEVEN RT.
- 7.
- Gire suavemente el vial hasta que todo el material esté disuelto. La solución reconstituida es una solución clara e incolora que puede almacenarse ya sea a temperatura ambiente o refrigerada durante hasta 3 horas después de la reconstitución. Después de la reconstitución con el volumen especificado de diluyente, cada vial contiene aproximadamente 1 mg por mL NOVOSEVEN RT (1000 microgramos por mL).
Paquete de NOVOSEVEN RT que contiene 1 vial de polvo de NOVOSEVEN RT y 1 jeringa precargada de diluyente de histidina con adaptador de vial para reconstitución sin aguja:
- 1.
- Siempre use técnica aséptica.
- 2.
- Lleve NOVOSEVEN RT (polvo blanco, liofilizado) y el volumen especificado de histidina ( diluyente) a temperatura ambiente, pero no superior a 37 °C (98.6 °F). El volumen especificado de diluyente correspondiente a la cantidad de NOVOSEVEN RT es el siguiente:
1 mg (1000 microgramos) vial + 1 mL Diluyente de histidina en la jeringa precargada
2 mg (2000 microgramos) vial + 2 mL Diluyente de histidina en la jeringa precargada
5 mg (5000 microgramos) vial + 5 mL Diluyente de histidina en la jeringa precargada
8 mg (8000 microgramos) vial + 8 mL Diluyente de histidina en la jeringa precargada - 3.
- Retire la tapa del vial de NOVOSEVEN RT. Limpie el tapón de goma con un hisopo de alcohol y deje secar antes de usar.
- 4.
- Despegue el papel protector del adaptador de vial. No retire el adaptador de vial del paquete.
- 5.
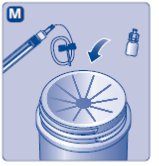
- Coloque el vial de NOVOSEVEN RT en una superficie plana. Mientras sostiene el paquete del adaptador de vial, coloque el adaptador de vial sobre el vial de NOVOSEVEN RT y presione fuertemente sobre el paquete hasta que el punto del adaptador de vial penetre el tapón de goma.
- 6.
- Adjunte el varilla del émbolo a la jeringa. Gire la varilla del émbolo en sentido horario en el émbolo dentro de la jeringa precargada de diluyente hasta que sienta resistencia. Retire la tapa de la jeringa de diluyente precargada y atorníllela al adaptador de vial.
- 7.
- Empuje el varilla del émbolo para inyectar lentamente todo el diluyente en el vial. Mantenga la varilla del émbolo presionada y gire suavemente el vial hasta que el polvo esté disuelto. La solución reconstituida es una solución clara e incolora que puede almacenarse completamente ensamblada ya sea a temperatura ambiente o refrigerada durante hasta 3 horas después de la reconstitución. Después de la reconstitución con el volumen especificado de diluyente, cada vial contiene aproximadamente 1 mg por mL NOVOSEVEN RT (1000 microgramos por mL).
2.3 Administración
Solo para inyección intravenosa
- •
- Inspeccione visualmente NOVOSEVEN RT reconstituido en busca de partículas y decoloración antes de la administración, siempre que la solución y el recipiente lo permitan. No use si se observa partículas o decoloración.
- •
- No congele NOVOSEVEN RT reconstituido ni lo almacene en jeringas.
- •
- Administre en un plazo de 3 horas después de la reconstitución.
- •
- No mezcle con otras soluciones de infusión.
- •
- Descarte cualquier solución no utilizada.
Ejecute los siguientes procedimientos inmediatamente antes de la administración:
Paquete de NOVOSEVEN RT que contiene 1 vial de polvo de NOVOSEVEN RT y 1 vial de diluyente de histidina:
- 1. Siempre use técnica aséptica.
- 2. Retire el émbolo de una jeringa estéril (unida a una aguja estéril) y admita aire en la jeringa.
- 3. Inserte una aguja en el vial de NOVOSEVEN RT reconstituido. Inyecte aire en el vial y luego retire
- la cantidad apropiada de NOVOSEVEN RT reconstituido en la jeringa.
- 4. Retire y deseche la aguja de la jeringa.
Paquete de NOVOSEVEN RT que contiene 1 vial de polvo de NOVOSEVEN RT y 1 jeringa precargada de diluyente de histidina con adaptador de vial para reconstitución sin aguja:
- 1. Utilice siempre la técnica aséptica.
- 2. Invierta el vial de NOVOSEVEN RT. Detenga el empuje de la varilla del émbolo y permita que se mueva hacia atrás por sí solo mientras que
Precaución:
- •
- La jeringa prellenada con diluyente es de vidrio con un diámetro interno de la punta de 0,037 pulgadas y es compatible con un conector estándar Luer-lock.
- •
- Algunos conectores sin aguja para catéteres intravenosos no son compatibles con las jeringas de vidrio de diluyente (por ejemplo, ciertos conectores con punta interna, como Clave® /MicroClave®, InVision-Plus®, InVision-Plus CS®, InVision-Plus® Junior®, Bionector®) y su uso puede dañar el conector y afectar la administración. Para administrar el producto a través de conectores sin aguja incompatibles, extraiga el producto reconstituído en una jeringa plástica estándar esteril de 10 mL Luer-lock.
- •
- Si ha encontrado algún problema al conectar la jeringa prellenada con diluyente de histidina a cualquier dispositivo compatible con Luer lock, comuníquese con Novo Nordisk al (877) 668-6777.
Administre NOVOSEVEN RT por bolo de infusión mediante los siguientes procedimientos:
- 1. Administre como una inyección de bolo lento durante 2 a 5 minutos, dependiendo de la dosis administrada.
- 2. Si la línea necesita ser enjuagada antes o después de la administración de NOVOSEVEN RT, utilice Inyección de Cloruro de Sodio al 0,9%, USP.
- 3. Descarte cualquier NOVOSEVEN RT reconstituído no utilizado después de 3 horas.
Administre NOVOSEVEN RT por infusión continua para el manejo perioperatorio mediante los siguientes procedimientos:
- 1.
- Administre como una infusión continua a 50 mcg/kg/hr utilizando una bomba de infusión.
- 2.
- Si la línea necesita ser enjuagada antes o después de la administración de NOVOSEVEN RT, utilice Inyección de Cloruro de Sodio al 0,9%, USP.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
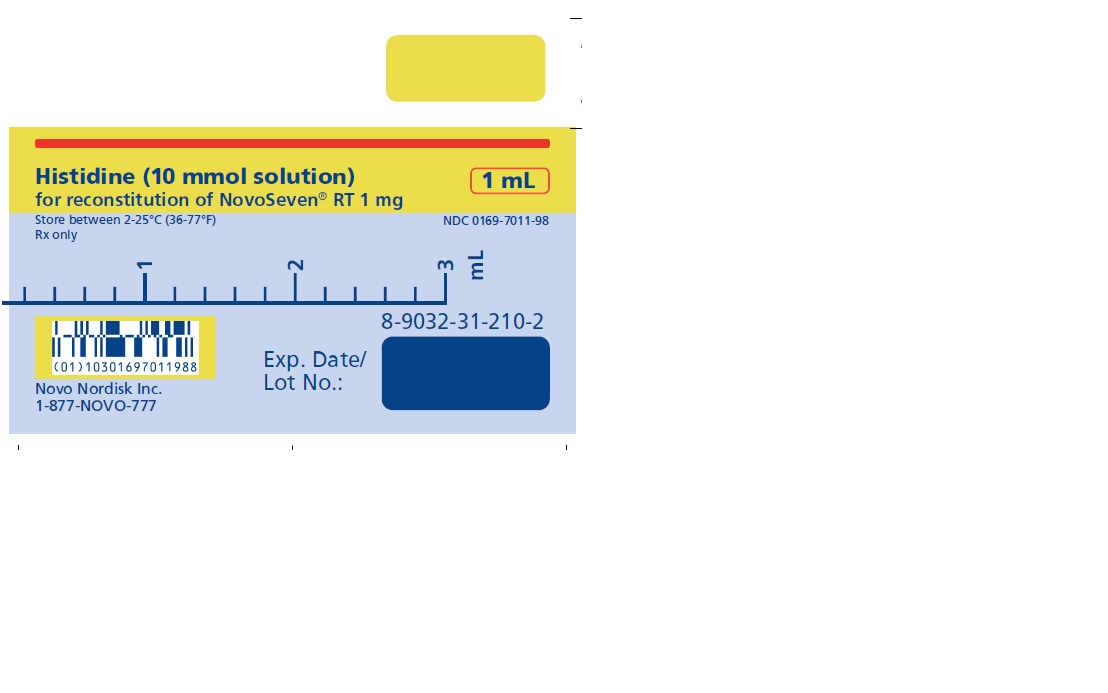
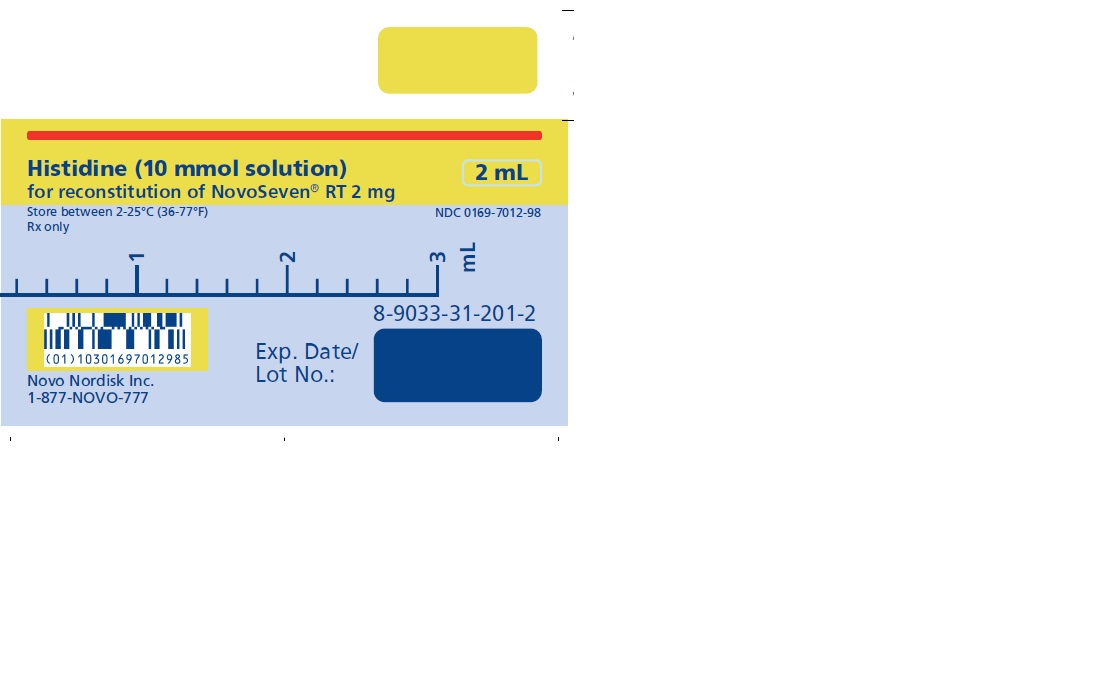
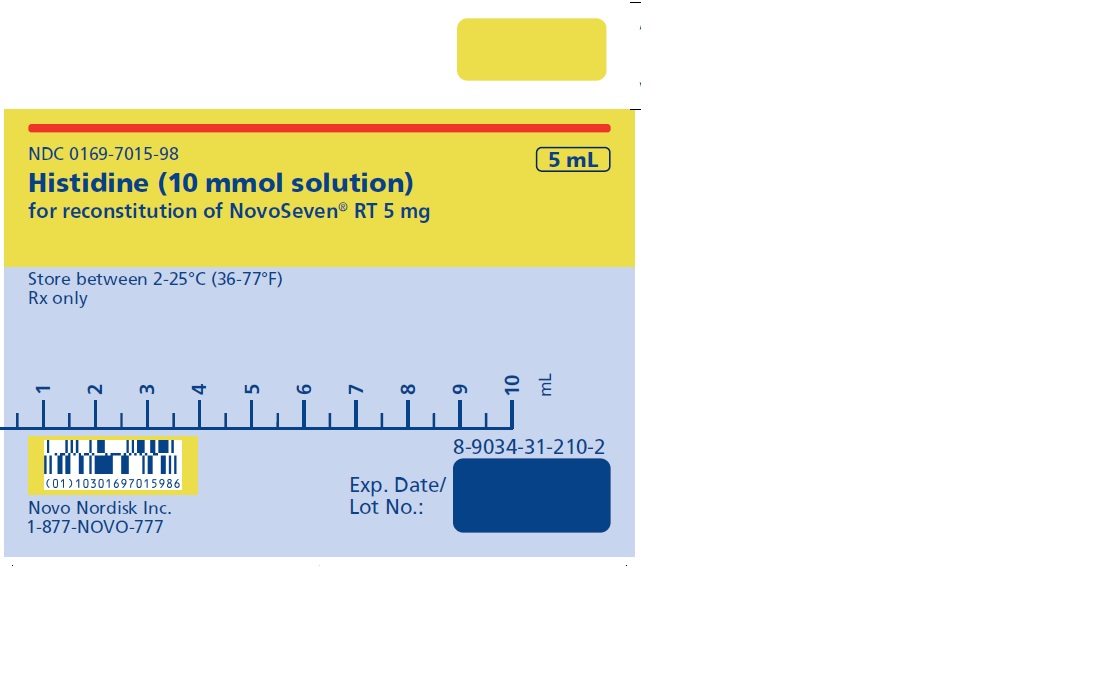
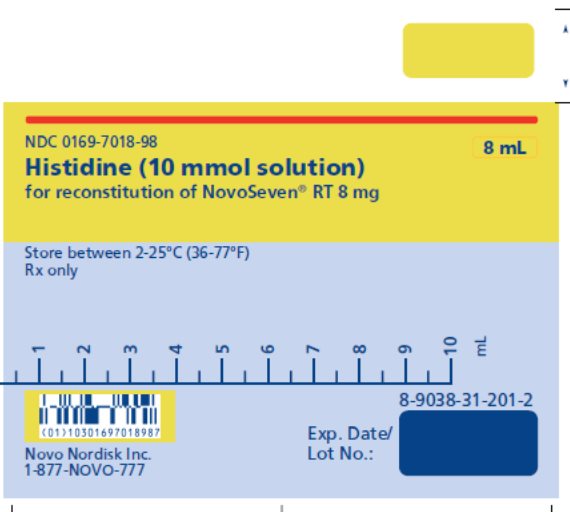
NOVOSEVEN RT se encuentra disponible como un polvo liofilizado blanco en viales de dosis única que contienen 1 mg (1000 microgramos), 2 mg (2000 microgramos), 5 mg (5000 microgramos) o 8 mg (8000 microgramos) de factor VIIa de coagulación recombinante (rFVIIa) por vial.
El diluyente para la reconstitución de NOVOSEVEN RT es una solución de 10 mmol de L-histidina en agua para inyección. Es una solución clara e incolora provista en un vial o en una jeringa de diluyente prellenada y se denomina diluyente de histidina.
Después de la reconstitución con el diluyente de histidina, la solución final contiene aproximadamente 1 mg por mL de NOVOSEVEN RT (1000 microgramos por mL).
4 CONTRAINDICACIONES
Ninguna conocida.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Trombosis
- •
- Se han reportado eventos trombóticos arteriales y venosos graves en ensayos clínicos y vigilancia postcomercialización.
- •
- Los pacientes con hemofilia congénita que reciben tratamiento concomitante con aPCC (concentrados de complejo de protrombina activados), pacientes de edad avanzada, particularmente con hemofilia adquirida y que reciben otros agentes hemostáticos, o pacientes con antecedentes de enfermedad cardíaca, vascular o predispuestos a eventos trombóticos pueden tener un mayor riesgo de desarrollar eventos trombóticos [Ver Reacciones adversas (6.1) e Interacciones medicamentosas (7)].
- •
- Monitorear a los pacientes que reciben NOVOSEVEN RT para el desarrollo de signos o síntomas de activación del sistema de coagulación o trombosis. Cuando haya confirmación de laboratorio de coagulación intravascular o presencia de trombosis clínica, reducir la dosis de NOVOSEVEN RT o suspender el tratamiento, dependiendo de la condición del paciente.
5.2 Reacciones de hipersensibilidad
Las reacciones de hipersensibilidad, incluida la anafilaxia, pueden ocurrir con NOVOSEVEN RT. Los pacientes con hipersensibilidad conocida a proteínas de ratón, hámster o bovino pueden tener un mayor riesgo de reacciones de hipersensibilidad. Suspenda la infusión y administre el tratamiento adecuado cuando ocurran reacciones de hipersensibilidad.
5.3 Formación de anticuerpos en pacientes con deficiencia de factor VII
Los pacientes con deficiencia de factor VII deben ser monitoreados para el tiempo de protrombina (PT) y la actividad coagulante del factor VII antes y después de la administración de NOVOSEVEN RT. Si la actividad del factor VIIa no alcanza el nivel esperado, o el tiempo de protrombina no se corrige, o el sangrado no se controla después del tratamiento con las dosis recomendadas, se puede sospechar la formación de anticuerpos y se debe realizar un análisis para detectar anticuerpos.
5.4 Pruebas de laboratorio
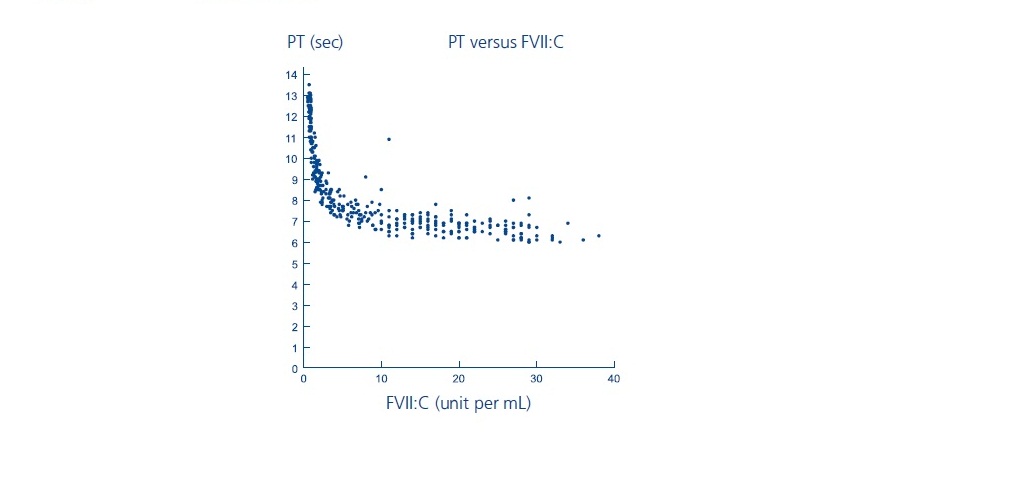
Los parámetros de coagulación de laboratorio (PT/INR, aPTT, FVII:C) no han mostrado una correlación directa con el logro de la hemostasia. Los ensayos de tiempo de protrombina (PT/INR), tiempo de tromboplastina parcial activado (aPTT) y actividad de coagulación del factor VII plasmático (FVII:C), pueden dar resultados diferentes con diferentes reactivos. Se ha demostrado que el tratamiento con NOVOSEVEN produce las siguientes características:
- PT: Como se muestra a continuación, en pacientes con hemofilia A/B con inhibidores, el PT se acortó a un plateau de aproximadamente 7 segundos a un nivel de FVII:C de aproximadamente 5 unidades por mL. Para niveles de FVII:C > 5 unidades por mL, no hay más cambios en PT. La relevancia clínica del acortamiento del tiempo de protrombina después de la administración de NOVOSEVEN RT es desconocida.
- INR: NOVOSEVEN ha demostrado la capacidad de normalizar el INR. Sin embargo, no se ha demostrado que los valores de INR predigan directamente los resultados del sangrado, ni ha sido posible demostrar el impacto de NOVOSEVEN en los tiempos/volumen de sangrado en modelos de sangrado inducido clínicamente en voluntarios sanos que habían recibido Warfarina, cuando los parámetros de laboratorio (PT/INR, aPTT, tromboelastograma) se han normalizado.
- aPTT: Si bien la administración de NOVOSEVEN acorta el aPTT prolongado en pacientes con hemofilia A/B con inhibidores, la normalización generalmente no se ha observado en las dosis que se ha demostrado que inducen una mejora clínica. Los datos indican que la mejora clínica se asoció con un acortamiento del aPTT de 15 a 20 segundos.
FVIIa:C: Los niveles de FVIIa:C se midieron dos horas después de la administración de NOVOSEVEN de 35 microgramos por kg de peso corporal y 90 microgramos por kg de peso corporal después de dos días de dosificación a intervalos de dos horas. Los niveles promedio en estado estable fueron 11 y 28 unidades por mL para los dos niveles de dosis, respectivamente.
6 REACCIONES ADVERSAS
Las reacciones adversas más comunes y graves en los ensayos clínicos son los eventos trombóticos. Las reacciones adversas trombóticas después de la administración de NOVOSEVEN en los ensayos clínicos ocurrieron en el 4% de los pacientes con hemofilia adquirida y el 0.2% de los episodios de sangrado en pacientes con hemofilia congénita.
6.1 Experiencia en ensayos clínicos
Debido a que los estudios clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un producto farmacéutico no se pueden comparar directamente con las tasas en los ensayos clínicos de otro medicamento, y pueden no reflejar las tasas observadas en la práctica.
Las reacciones adversas que se describen a continuación se han notificado a partir de ensayos clínicos y datos recopilados en registros.
Pacientes con hemofilia A o B con inhibidores
En dos estudios para pacientes con hemofilia A o B con inhibidores tratados por episodios de sangrado (N=298), se notificaron reacciones adversas en ≥2% de los pacientes que fueron tratados con NOVOSEVEN para 1,939 episodios de sangrado (ver Tabla 3 a continuación).
Tabla 3: Reacciones adversas notificadas en ≥2% de los 298 pacientes con hemofilia A o B con inhibidores
|
Sistema corporal Reacciones |
# de reacciones adversas (n=1,939 tratamientos) |
# de pacientes (n=298 pacientes) |
|
Cuerpo como un todo |
||
|
Fiebre |
16 |
13 |
|
Plaquetas, sangrado y coagulación |
||
|
Fibrinógeno plasmático disminuido |
10 |
5 |
|
Cardiovascular |
||
|
Hipertensión |
9 |
6 |
Las reacciones adversas graves incluyeron trombosis, dolor, tromboflebitis profunda, embolia pulmonar, disminución de la respuesta terapéutica, trastorno cerebrovascular, angina de pecho, DIC, shock anafiláctico y función hepática anormal. Las reacciones adversas graves de DIC y respuesta terapéutica disminuida tuvieron un desenlace fatal.
En dos ensayos clínicos que evaluaron la seguridad y eficacia de la administración de NOVOSEVEN en el entorno perioperatorio en pacientes con hemofilia A o B con inhibidores (N=51), se notificaron las siguientes reacciones adversas graves: hemartrosis aguda postoperatoria (n=1), reacción adversa de trombosis de la yugular interna (n=1), disminución de la respuesta terapéutica (n=4).
Inmunogenicidad
No ha habido informes confirmados de anticuerpos inhibitorios contra NOVOSEVEN o FVII en pacientes con hemofilia A o B congénita con aloanticuerpos.
La incidencia de formación de anticuerpos depende de la sensibilidad y especificidad del ensayo. Además, la incidencia observada de positividad de anticuerpos (incluidos los anticuerpos neutralizantes) en un ensayo puede verse influenciada por varios factores, incluida la metodología del ensayo, el manejo de las muestras, el momento de la recolección de las muestras, los medicamentos concomitantes y la enfermedad subyacente. Por estas razones, la comparación de la incidencia de anticuerpos a NOVOSEVEN RT con la incidencia de anticuerpos a otros productos puede ser engañosa.
Deficiencia congénita del factor VII
Los datos recopilados de los programas de uso compasivo/de emergencia, la literatura publicada, un estudio de farmacocinética y el registro de la Hemophilia and Thrombosis Research Society2 (HTRS) mostraron que 75 pacientes con deficiencia del factor VII habían recibido NOVOSEVEN: 70 pacientes para 124 episodios de sangrado, cirugías o profilaxis; 5 pacientes en el ensayo de farmacocinética. Se notificaron las siguientes reacciones adversas: hipertensión intracraneal (n=1), anticuerpo IgG contra rFVIIa y FVII (n=1), flebitis localizada (n=1).
Inmunogenicidad
En 75 pacientes con deficiencia del factor FVII tratados con NOVOSEVEN RT, un paciente desarrolló anticuerpos IgG contra rFVIIa y FVII. Los pacientes con deficiencia del factor VII tratados con NOVOSEVEN RT deben ser monitoreados para detectar anticuerpos contra el factor VII.
La incidencia de formación de anticuerpos depende de la sensibilidad y especificidad del ensayo. Además, la incidencia observada de positividad de anticuerpos (incluidos los anticuerpos neutralizantes) en un ensayo puede verse influenciada por varios factores, incluida la metodología del ensayo, el manejo de las muestras, el momento de la recolección de las muestras, los medicamentos concomitantes y la enfermedad subyacente. Por estas razones, la comparación de la incidencia de anticuerpos a NOVOSEVEN RT con la incidencia de anticuerpos a otros productos puede ser engañosa.
Hemofilia adquirida
Los datos recopilados de cuatro programas de uso compasivo, el registro de HTRS y la literatura publicada mostraron que 139 pacientes con hemofilia adquirida recibieron NOVOSEVEN para 204 episodios de sangrado, cirugías y lesiones traumáticas. De estos 139 pacientes, 6 pacientes experimentaron 8 reacciones adversas graves. Las reacciones adversas graves incluyeron shock (n=1), accidente cerebrovascular (n=1) y eventos tromboembólicos (n=6) que incluyeron oclusión de la arteria cerebral, isquemia cerebral, angina de pecho, infarto de miocardio, embolia pulmonar y trombosis venosa profunda. Tres de las reacciones adversas graves tuvieron un desenlace fatal.
Trombastenia de Glanzmann
Los datos recopilados del Registro de Trombastenia de Glanzmann (GTR) y el registro de HTRS mostraron que 140 pacientes con trombastenia de Glanzmann recibieron NOVOSEVEN RT para 518 episodios de sangrado, cirugías o lesiones traumáticas. Se notificaron las siguientes reacciones adversas: trombosis venosa profunda (n=1), dolor de cabeza (n=2), fiebre (n=2), náuseas (n=1) y disnea (n=1).
6.2 Experiencia postcomercialización
Las reacciones adversas notificadas durante el período postcomercialización fueron similares en naturaleza a las observadas durante los ensayos clínicos e incluyen informes de eventos adversos tromboembólicos.
7 INTERACCIONES MEDICAMENTOSAS
- •
- Evite el uso simultáneo de concentrados de complejo de protrombina activados.
- •
- No mezcle NOVOSEVEN RT con soluciones de infusión.
- •
- Puede ocurrir trombosis si NOVOSEVEN RT se administra concomitantemente con el Factor de Coagulación XIII. [Ver Advertencias y Precauciones (5.1) y Toxicología no clínica (13.2)]
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgos
No existen estudios adecuados y bien controlados que utilicen NOVOSEVEN RT en mujeres embarazadas para determinar si existe un riesgo asociado al fármaco.
El tratamiento de ratas y conejos con NOVOSEVEN en estudios de reproducción se ha asociado con mortalidad a dosis de hasta 6 mg por kg de peso corporal y 5 mg por kg de peso corporal, respectivamente. A 6 mg por kg de peso corporal en ratas, la tasa de aborto fue de 0 de 25 camadas; en conejos a 5 mg por kg de peso corporal, la tasa de aborto fue de 2 de 25 camadas. Veintitrés de 25 ratas hembras que recibieron 6 mg por kg de peso corporal de NOVOSEVEN dieron a luz con éxito, sin embargo, dos de las 23 camadas murieron durante el período temprano de lactancia. No se observó evidencia de teratogenicidad después de la dosificación con NOVOSEVEN.
En la población general de los EE. UU., el riesgo de fondo estimado de defectos de nacimiento mayores y aborto espontáneo en embarazos clínicamente reconocidos es del 2-4% y del 15-20%, respectivamente.
8.2 Lactancia
Resumen de Riesgos
No hay información sobre la presencia de NOVOSEVEN RT en la leche materna, el efecto en el lactante y los efectos sobre la producción de leche. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de NOVOSEVEN RT y cualquier posible efecto adverso en el lactante de NOVOSEVEN RT o de la condición materna subyacente.
8.4 Uso Pediátrico
Se realizaron ensayos clínicos que reclutaron pacientes pediátricos con una dosificación determinada de acuerdo con el peso corporal y no de acuerdo con la edad.
Hemofilia A o B con Inhibidores
Durante la fase de investigación del desarrollo del producto, NOVOSEVEN se utilizó en 16 niños de 0 a <2 años para 151 episodios de sangrado, 27 niños de 2 a <6 años para 140 episodios de sangrado, 43 niños de 6 a <12 para 375 episodios de sangrado y 30 niños de 12 a 16 años para 446 episodios de sangrado.
En un ensayo doble ciego, aleatorizado y de comparación de dos niveles de dosis de NOVOSEVEN en el tratamiento de hemorragias articulares, musculares y mucocutáneas en pacientes con hemofilia A y B con y sin inhibidores, 20 niños de 0 a <12 años y 8 niños de 12 a 16 años fueron tratados con NOVOSEVEN en dosis de 35 o 70 microgramos por kg de dosis. El tratamiento se evaluó como efectivo (alivio definido del dolor/sensibilidad según lo informado por el paciente y/o una disminución medible del tamaño de la hemorragia y/o detención del sangrado dentro de las 8 horas [calificado como excelente = 51%], dentro de las 8-14 horas [calificado como efectivo = 18%] o después de 14 horas [calificado como parcialmente efectivo = 25%]) en el 94% de los pacientes.
NOVOSEVEN se utilizó en dos ensayos en cirugía. En una comparación de dosis, 22 niños de 0 a 16 años fueron tratados con NOVOSEVEN. Se logró una hemostasia intraoperatoria efectiva (definida como sangrado que se había detenido por completo o había disminuido sustancialmente [calificado como efectivo = 86%] o sangrado que se redujo pero continuó [calificado como parcialmente efectivo = 9%]) en 21/22 (95%) pacientes. Se logró una hemostasia efectiva en 10/10 (100%) pacientes en el grupo de dosis de 90 mcg/kg y 10/12 (83%) en el grupo de dosis de 35 mcg/kg a las 48 horas; se logró una hemostasia efectiva en 10/10 (100%) en el grupo de dosis de 90 mcg/kg y 9/12 (75%) en el grupo de dosis de 35 mcg/kg a los 5 días.
En el ensayo de cirugía que compara la bolo (BI) y la infusión continua (CI), participaron 6 niños de 10 a 15 años, 3 en cada grupo. Ambos regímenes fueron 100% efectivos (definidos como sangrado que se ha detenido por completo o disminuido sustancialmente) intraoperatoriamente, durante las primeras 24 horas y al día 5. Al final del período de estudio (día 10 postoperatorio o suspensión del tratamiento), la hemostasia en dos pacientes en el grupo BI se calificó como efectiva y la hemostasia en un paciente se calificó como ineficaz (definida como sangrado que es igual o ha empeorado). La hemostasia en los tres pacientes del grupo CI se calificó como efectiva.
Las reacciones adversas a los medicamentos en pacientes pediátricos fueron similares a las reportadas previamente en ensayos clínicos con NOVOSEVEN, incluido un evento trombótico en un niño de 4 años con trombosis de la vena yugular interna después de la colocación de un puerto-a-catéter que se resolvió.
Deficiencia congénita del factor VII
En la literatura publicada, ensayos de uso compasivo y registros sobre el uso de NOVOSEVEN en la deficiencia congénita del factor VII, NOVOSEVEN se utilizó en 24 niños de 0 a <12 años y 7 niños de 12 a 16 años para 38 episodios de sangrado, 16 cirugías y 8 regímenes de profilaxis. El tratamiento fue efectivo en el 95% de los episodios de sangrado (5% no calificados) y el 100% de las cirugías. No se informaron eventos trombóticos. Un niño de siete meses expuesto a NOVOSEVEN y varios productos plasmáticos desarrolló anticuerpos contra FVII y rFVIIa [ver Reacciones adversas (6.1) y Sobredosis (10)].
Trombastenia de Glanzmann
En el Registro de Trombastenia de Glanzmann, NOVOSEVEN se utilizó en 43 niños de 0 a 12 años para 157 episodios de sangrado y en 15 niños de 0 a 12 años para 19 procedimientos quirúrgicos. NOVOSEVEN también se utilizó en 8 niños de >12 a 16 años para 17 episodios de sangrado y en 3 niños de >12 a 16 años para 3 procedimientos quirúrgicos. La eficacia de los regímenes que incluyen NOVOSEVEN fue evaluada por adjudicadores independientes como 93.6% y 100% para los episodios de sangrado en niños de 0 a 12 años y >12 a 16 años, respectivamente. La eficacia en los procedimientos quirúrgicos se evaluó como 100% para todos los procedimientos quirúrgicos en niños de 0 a 16 años. No se informaron reacciones adversas en niños con trombastenia de Glanzmann.
[Ver Estudios clínicos (14)]
8.5 Uso Geriátrico
Los estudios clínicos de NOVOSEVEN RT en deficiencias congénitas del factor y trombastenia de Glanzmann no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes.
10 SOBREDOSIS
Las toxicidades limitantes de la dosis de NOVOSEVEN RT no se han investigado en ensayos clínicos. Los siguientes son ejemplos de sobredosis accidental.
- •
- Una recién nacida con deficiencia congénita del factor VII recibió una sobredosis de NOVOSEVEN (dosis única: 800 microgramos por kg de peso corporal). Tras la administración adicional de NOVOSEVEN y varios productos plasmáticos, se detectaron anticuerpos contra rFVIIa, pero no se informaron complicaciones trombóticas.
- •
- Un hombre con deficiencia del factor VII (83 años de edad, 111.1 kg) recibió dos dosis de 324 microgramos por kg de peso corporal (10-20 veces la dosis recomendada) y experimentó un evento trombótico (ictus occipital).
- •
- Un paciente con hemofilia B (16 años de edad, 68 kg) recibió una dosis única de 352 microgramos por kg de peso corporal y un paciente con hemofilia A (2 años de edad, 14.6 kg) recibió dosis que oscilaron entre 246 microgramos por kg de peso corporal y 986 microgramos por kg de peso corporal durante cinco días consecutivos. No se informaron complicaciones en ninguno de los casos.
11 DESCRIPCIÓN
NOVOSEVEN RT, Factor de Coagulación VIIa (Recombinante) es un polvo liofilizado estéril, blanco, de factor de coagulación VIIa humano recombinante (rFVIIa) para reconstitución para inyección intravenosa. El producto se suministra en viales de dosis única que contienen lo siguiente:
|
Contenido |
Vial de 1 mg |
Vial de 2 mg |
Vial de 5 mg |
Vial de 8 mg |
|
rFVIIa |
1000 microgramos |
2000 microgramos |
5000 microgramos |
8000 microgramos |
|
cloruro de sodio* |
2.34 mg |
4.68 mg |
11.7 mg |
18.72 mg |
|
cloruro de calcio dihidratado* |
1.47 mg |
2.94 mg |
7.35 mg |
11.76 mg |
|
Glicilglicina |
1.32 mg |
2.64 mg |
6.60 mg |
10.56 mg |
|
polisorbato 80 |
0.07 mg |
0.14 mg |
0.35 mg |
0.56 mg |
|
Manitol |
25 mg |
50 mg |
125 mg |
200 mg |
|
Sacarosa |
10 mg |
20 mg |
50 mg |
80 mg |
|
Metionina |
0.5 mg |
1.0 mg |
2.5 mg |
4 mg |
|
*por mg de rFVIIa: 0.4 mEq de sodio, 0.01 mEq de calcio |
||||
NOVOSEVEN RT también contiene cantidades traza de proteínas derivadas de los procesos de fabricación y purificación, como IgG de ratón (máximo de 1.2 ng/mg), IgG de bovino (máximo de 30 ng/mg) y proteína de células BHK y medios (máximo de 19 ng/mg).
El diluyente para la reconstitución de NOVOSEVEN RT es una solución de 10 mmol de histidina en agua para inyección y se suministra como una solución transparente incolora en un vial o jeringa de diluyente prellenada. Después de la reconstitución con el volumen apropiado de diluyente de histidina, cada vial contiene aproximadamente 1 mg/mL de NOVOSEVEN RT (correspondiente a 1000 microgramos/mL). La solución reconstituida es una solución transparente incolora con un pH de aproximadamente 6.0 y no contiene conservantes.
El Factor de Coagulación VIIa recombinante (rFVIIa), el ingrediente activo de NOVOSEVEN RT, es una glucoproteína dependiente de la vitamina K que consta de 406 residuos de aminoácidos con una masa molecular aproximada de 50 kDa). Es estructuralmente similar al factor de coagulación VIIa humano endógeno.
El gen para el factor de coagulación VII humano (FVII) se clona y expresa en células de riñón de hámster bebé (células BHK). El FVII recombinante se secreta en el medio de cultivo (que contiene suero de ternera recién nacido) en su forma de cadena única y luego se convierte proteolíticamente por autocatálisis a la forma activa de dos cadenas, rFVIIa, durante un proceso de purificación cromatográfica. Se ha demostrado que el proceso de purificación elimina los virus exógenos (MuLV, SV40, virus de la viruela, reovirus, BEV, virus IBR). No se utiliza suero humano ni otras proteínas en la producción o formulación de NOVOSEVEN RT.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
NOVOSEVEN RT es Factor VIIa recombinante y, cuando se compleja con el factor tisular, puede activar el Factor X de coagulación a Factor Xa, así como el Factor IX de coagulación a Factor IXa. El Factor Xa, en complejo con otros factores, luego convierte la protrombina en trombina, lo que lleva a la formación de un tapón hemostático al convertir el fibrinógeno en fibrina e induciendo así la hemostasia local. Este proceso también puede ocurrir en la superficie de las plaquetas activadas.
12.2 Farmacodinamia
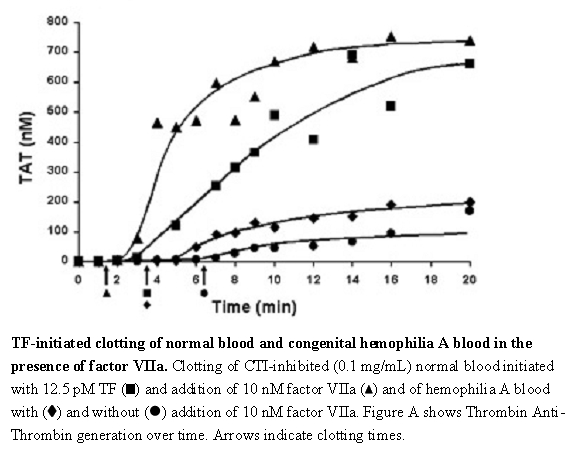
El efecto de NOVOSEVEN RT sobre la coagulación en pacientes con o sin hemofilia se ha evaluado en diferentes sistemas modelo. En un modelo in vitro de coagulación sanguínea iniciada por el factor tisular (Figura A),3 la adición de rFVIIa aumentó tanto la velocidad como el nivel de generación de trombina en sangre normal y hemofílica A, con un efecto demostrado a concentraciones de rFVIIa tan bajas como 10 nM. En este modelo, la sangre humana fresca se trató con inhibidor de tripsina de maíz (CTI) para bloquear la vía de contacto de la coagulación sanguínea. Se agregó factor tisular (TF) para iniciar la coagulación en presencia y ausencia de rFVIIa para ambos tipos de sangre.
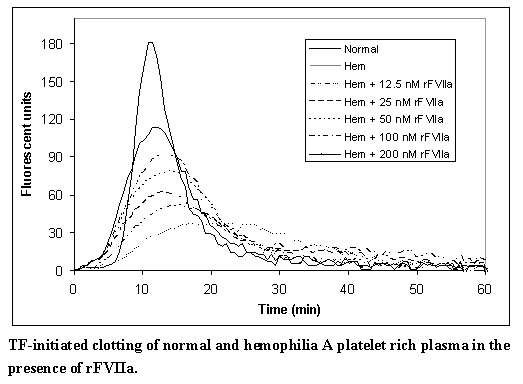
En un modelo separado, y en línea con informes previos,4 las dosis crecientes de rFVIIa en plasma hemofílico demuestran un aumento dependiente de la dosis en la generación de trombina (Figura B). En este modelo, el plasma normal rico en plaquetas y el plasma hemofílico se ajustaron con plasma autólogo a 200.000 plaquetas/microlitro. La coagulación se inició mediante la adición de factor tisular y CaCl2. La generación de trombina se midió en presencia de un sustrato de trombina y varias concentraciones agregadas de rFVIIa.
Figura A
Figura B
12.3 Farmacocinética
Sujetos sanos
La farmacocinética de NOVOSEVEN se investigó en 35 sujetos sanos (17 caucásicos, 18 japoneses, 16 hombres, 19 mujeres) en un estudio de escalada de dosis. Los sujetos recibieron dosis de 40, 80 y 160 microgramos por kg de NOVOSEVEN.5 No se observó ningún efecto del sexo o la etnia en la farmacocinética de NOVOSEVEN. El rango de los parámetros de PK medios en todos los grupos de dosis se muestra en la Tabla 4.
Los productos NOVOSEVEN® y NOVOSEVEN® RT se encontraron que eran farmacocinéticamente equivalentes en un estudio de 22 pacientes que recibieron dosis únicas de ambas formulaciones.6 Los parámetros de PK medios para NOVOSEVEN® RT se muestran en la Tabla 4.
Hemofilia A o B
La farmacocinética de dosis única de NOVOSEVEN (17,5, 35 y 70 microgramos por kg) se estudió en 15 sujetos con hemofilia A o B en estado de no sangrado y sangrado.7 Los parámetros de PK medianos (estado de no sangrado) se muestran en la Tabla 4.
En un estudio farmacocinético de dosis única en bolo, 6 adultos varones (90 microgramos por kg) y 12 pacientes pediátricos varones (2-12 años) (cruce, 90 y 180 microgramos por kg) con hemofilia A grave (10 de 18 sujetos tenían inhibidores al factor VIII) recibieron NOVOSEVEN.8 En comparación con los adultos, el aclaramiento normalizado por peso corporal de NOVOSEVEN en niños de 2 a 5 años y de 6 a 12 años fue mayor en un 82% y un 42%, respectivamente. Los parámetros farmacocinéticos para niños con hemofilia se muestran en la Tabla 5.
Deficiencia congénita del Factor VII
La farmacocinética de dosis única de NOVOSEVEN en 5 pacientes con deficiencia congénita grave del Factor VII (<1%), a dosis de 15 y 30 microgramos por kg de peso corporal, no mostró diferencias significativas entre las dos dosis. Los parámetros de PK medios para las dos dosis se muestran en la Tabla 4.
Tabla 4: Parámetros farmacocinéticos de dosis única en sujetos sanos, pacientes con hemofilia A y B y pacientes con deficiencia de FVII (Media (DE))
|
Sujetos sanos |
Hemofilia A o B |
Deficiencia de FVII9 |
|||
|
Formulación |
rFVIIa |
rFVIIa-25C |
rFVIIa |
rFVIIa |
rFVIIa |
|
Edades |
20-45 |
22-44 |
15-63 |
30-45 |
20-43 |
|
Dosis (mcg/kg) |
40, 80, 160 |
90 |
17.5, 35, 70 |
90 |
30 |
|
AUC |
71.46, 76.91* |
113.26 (17.36)d |
53.31 (20.27)** |
2.45 (0.73) |
23.70 (7.23)d |
|
CL (mL/h) |
1953-2516 |
3077 (438) |
NA |
2767 (385) |
NA |
|
CL (mL/h/kg) |
33-37 |
40.43 (6.23) |
33.84 (11.72) |
37.6 (13.1) |
67.7 (17.9) |
|
t½ (h) |
3.9-6.0 |
3.54 (0.28) |
2.72 (0.54) |
3.2 (0.3) |
2.62 (0.63) |
|
Vss (mL/kg) |
130-165 |
122.96 (20.42) |
108.86 (37.15) |
121 (30) |
230 (70) |
|
MRT (h) |
3.66-4.98 |
3.05 (0.27) |
3.33 (0.64) |
3.31 (0.38) |
3.46 (0.64) |
|
IR ([U/dL]/[U/kg]) |
0.89-1.04 |
1.18 (0.16)c |
NA |
0.94 (0.16) |
0.53 (0.2)c |
- *Basado en la dosis de 80 mcg/kg
** Basado en la dosis de 70 mcg/kg
NA: No disponible
AUC: Área bajo la curva desde el tiempo 0 hasta el infinito; CL: Depuración; t ½: Vida media terminal; Vss: Volumen de distribución en estado estacionario; MRT: Tiempo medio de residencia; IR: Recuperación incremental; rFVIIa: NOVOSEVEN® formulación original; rFVIIa-25C: NOVOSEVEN® RT
a: Los resultados son para hombres y mujeres. La columna presenta rangos sobre etnia y género.
b: El estudio demostró bioequivalencia de rFVIIa y rFVIIa-25C (NOVOSEVEN® RT) - c: Ensayo de FVIIa utilizado: unidades en UI
- d: AUC en h*UI/mL
- e: Incluye pacientes con y sin inhibidores
Tabla 5: Parámetros farmacocinéticos de dosis única en pacientes con hemofilia A con y sin inhibidores (Media (DE))
|
Hemofilia A |
||||||
|
Formulación/ estado del inhibidor/ grupo de edad |
rFVIIa, sin inhibidores, edad ≤5 años (n=3)8 |
rFVIIa, con inhibidores edad ≤5 años (n=2)8 |
rFVIIa, sin inhibidores edad 6-12 años (n=3)8 |
rFVIIa, con inhibidores edad 6-12 años (n=4)8 |
rFVIIa, sin inhibidores Adultos (n=2)8 |
rFVIIa, con inhibidores Adultos (n=4)8 |
|
Edades (años) |
2-5 |
4 |
7-10 |
7-12 |
30-32 |
32-45 |
|
Peso (kg) |
14-17 |
22-26 |
25-38 |
25-68 |
72-97 |
54-89 |
|
Dosis (mcg/kg) |
90, 180 |
90, 180 |
90, 180 |
90, 180 |
90 |
90 |
|
AUC (h*U/ mL) |
1.26 (0.09)* |
1.51 (0.25)* |
1.68 (0.24)* |
1.64 (0.31)* |
2.92 (0.80) |
2.13 (0.62) |
|
CL (mL/h) |
1131 (114) |
1387 (75) |
1878 (499) |
1668 (510) |
2477 (162) |
2960 (378) |
|
CL (mL/h/kg) |
73 (8) |
61 (9) |
55 (7) |
52 (12) |
30 (8) |
43 (15) |
|
t½ (h) |
2.6 (0.9) |
1.9 (0.6) |
3.0 (1.1) |
3.0 (0.5) |
3.3 (0.3) |
3.2 (0.3) |
|
Vss (mL/kg) |
191 (44) |
145 (1) |
173 (39) |
149 (22) |
108 (18) |
130 (37) |
|
MRT (h) |
2.6 (0.5) |
2.4 (0.4) |
3.1 (0.5) |
2.9 (0.3) |
3.62 (0.40) |
3.09 (0.20) |
|
IR ([IU/dL]/[U/kg]) |
0.59 (0.06) |
0.75 (0.12) |
0.75 (0.35) |
0.76 (0.20) |
1.01 (0.08) |
0.89 (0.20) |
- *Basado en la dosis de 90 mcg/kg
- AUC: Área bajo la curva desde el tiempo 0 hasta el infinito; CL: Depuración; t ½: Vida media terminal; Vss: Volumen de distribución en estado estacionario; MRT: Tiempo medio de residencia; IR: Recuperación incremental; rFVIIa: (NOVOSEVEN® formulación original)
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Dos estudios de mutagenicidad no han dado indicación de potencial carcinogénico para NOVOSEVEN. La actividad clastogénica de NOVOSEVEN se evaluó tanto en estudios in vitro (i.e., cultivo de linfocitos humanos) como en estudios in vivo (i.e., prueba de micronúcleos en ratones). Ninguno de estos estudios indicó actividad clastogénica de NOVOSEVEN. No se han realizado otros estudios de mutación genética con NOVOSEVEN RT (e.g., prueba de Ames). No se han realizado estudios de carcinogenicidad crónica con NOVOSEVEN RT.
Un estudio reproductivo en ratas macho y hembra a niveles de dosis de hasta 3.0 mg por kg por día no tuvo ningún efecto en el rendimiento del apareamiento, la fertilidad o las características de la camada.
El tratamiento de ratas y conejos con NOVOSEVEN en estudios de reproducción se ha asociado con la mortalidad a dosis de hasta 6 mg por kg y 5 mg por kg. A 6 mg por kg en ratas, la tasa de aborto fue de 0 de 25 camadas; en conejos a 5 mg por kg, la tasa de aborto fue de 2 de 25 camadas. Veintitrés de las 25 ratas hembras que recibieron 6 mg por kg de NOVOSEVEN dieron a luz con éxito, sin embargo, dos de las 23 camadas murieron durante el período temprano de lactancia. No se observó evidencia de teratogenicidad después de la dosificación con NOVOSEVEN.
13.2 Toxicología y/o Farmacología Animal
En un modelo de farmacología de seguridad cardiovascular en monos que evalúa la combinación de dosis excesivas de Factor de Coagulación XIII A-Subunidad (Recombinante) (585 UI/kg, 17 veces la dosis humana esperada) en combinación con rFVIIa (1000 mcg/kg, 11 veces la dosis humana esperada), uno de los doce monos murió 4 horas después del tratamiento debido a trombosis. Los factores de riesgo procoagulantes, incluidos 6 catéteres permanentes por mono y la inducción de anestesia, pueden haber complicado los resultados del estudio. No está claro si la mortalidad estuvo relacionada con la sobredosis de uno o ambos productos, o una interacción específica entre ellos. No se han realizado estudios no clínicos y clínicos con la combinación de rFXIII y NOVOSEVEN RT a las dosis humanas recomendadas.
14 ESTUDIOS CLÍNICOS
14.1 Hemofilia A o B con Inhibidores
El mayor número de pacientes (N=483) que recibieron NOVOSEVEN durante la fase de investigación del desarrollo del producto fueron en un estudio de protocolo abierto 10,11,12 que comenzó la inscripción en 1988, poco después de la finalización del estudio farmacocinético. Estos pacientes incluyeron personas con hemofilia tipos A o B (con o sin inhibidores), personas con inhibidores adquiridos al Factor VIII o Factor IX, y algunos pacientes deficientes en FVII. Las situaciones clínicas fueron diversas e incluyeron hemorragias musculares/articulares, hemorragias mucocutáneas, profilaxis quirúrgica, hemorragias intracerebrales y otras situaciones de emergencia.
Un ensayo aleatorizado, doble ciego, de comparación de dos niveles de dosis de NOVOSEVEN en el tratamiento de hemorragias articulares, musculares y mucocutáneas en pacientes con hemofilia A y B con y sin inhibidores se llevó a cabo en 78 pacientes que recibieron NOVOSEVEN en centros de tratamiento dentro de las 4 a 18 horas después de experimentar una hemorragia. Treinta y cinco pacientes fueron tratados con la dosis de 35 microgramos por kg (59 episodios de hemorragia articular, 15 musculares y 5 mucocutáneas) y 43 pacientes fueron tratados con la dosis de 70 microgramos por kg (85 episodios de hemorragia articular y 14 musculares). La dosificación se repitió a intervalos de 2,5 horas, pero osciló hasta cuatro horas para algunos pacientes. La eficacia se evaluó a las 12 ± 2 horas o al final del tratamiento, lo que ocurriera primero. Con base en una evaluación subjetiva por parte del investigador, las tasas de eficacia respectivas para los grupos de 35 y 70 microgramos por kg fueron: excelente (alivio definido del dolor/sensibilidad según lo informado por el paciente y/o una disminución medible del tamaño de la hemorragia y/o detención de la hemorragia dentro de las 8 horas) 59% y 60%, eficaz (alivio definido del dolor/sensibilidad según lo informado por el paciente y/o una disminución medible del tamaño de la hemorragia y/o detención de la hemorragia dentro de las 8-14 horas) 12% y 11%, y parcialmente eficaz (alivio definido del dolor/sensibilidad según lo informado por el paciente y/o una disminución medible del tamaño de la hemorragia y/o detención de la hemorragia después de 14 horas) 17% y 20%. El número promedio de inyecciones requeridas para lograr la hemostasia fue de 2,8 y 3,2 para los grupos de 35 y 70 microgramos por kg, respectivamente.
Se realizaron dos ensayos clínicos para evaluar la seguridad y eficacia de la administración de NOVOSEVEN durante y después de la cirugía en pacientes con hemofilia A o B con inhibidores. Uno de los estudios fue un ensayo clínico de grupos paralelos, aleatorizado, doble ciego (28 pacientes con hemofilia A o B e inhibidores y un paciente con inhibidor adquirido a FVIII, que se sometieron a procedimientos quirúrgicos mayores o menores).14 Los pacientes recibieron NOVOSEVEN intravenoso en bolo (ya sea 35 microgramos por kg, N=15; o 90 microgramos por kg, N=14) antes de la cirugía, intraoperatoriamente según sea necesario, luego cada 2 horas durante las siguientes 48 horas comenzando al cierre de la herida. Se administraron dosis adicionales cada 2 a 6 horas hasta un máximo de 3 días adicionales para mantener la hemostasia. Después de un máximo de 5 días de tratamiento doble ciego, la terapia podría continuar de forma abierta si fuera necesario (90 microgramos por kg de NOVOSEVEN cada 2-6 horas) (Tabla 6). La eficacia se evaluó durante el período intraoperatorio y posoperatoriamente desde el momento del cierre de la herida (Hora 0) hasta el Día 5.
Tabla 6: Dosificación por categoría de cirugía
| Cirugía Mayor | Cirugía Menor | |||||||
|---|---|---|---|---|---|---|---|---|
|
||||||||
|
35 μg/kg* (n = 5) |
90 μg/kg (n = 6) |
35 μg/kg (n = 10) |
90 μg/kg (n = 8) |
|||||
|
15 (2-26) |
9.5 (8-17) |
4 (3-6) |
6 (3-13) |
||||
|
135 (11-186) |
81 (71-128) |
29.5 (24-44) |
39.5 (26-98) |
||||
|
656 (31-839) |
569 (107-698) |
45.5 (14-171) |
|
||||
Se logró la hemostasia intraoperatoria en 28/29 (97%) pacientes. Se logró una hemostasia satisfactoria en 14/14 (100%) pacientes en el grupo de dosis de 90 mcg/kg y 11/15 (73%) en el grupo de dosis de 35 mcg/kg a las 48 horas; se logró una hemostasia satisfactoria en 13/14 (93%) en el grupo de dosis de 90 mcg/kg y 11/15 (73%) en el grupo de dosis de 35 mcg/kg a los 5 días. Veintitrés pacientes completaron con éxito todo el estudio, incluidos 13/14 (93%) que lograron una hemostasia exitosa hasta la finalización del estudio (hasta el día 26) en el grupo de dosis de 90 mcg/kg.
Se llevó a cabo otro ensayo abierto, aleatorizado y paralelo para comparar la seguridad y eficacia de la administración de NOVOSEVEN por inyección intravenosa en bolo (BI) (N=12) y por infusión intravenosa continua (CI) (N=12) en 23 pacientes con hemofilia A o B con inhibidores y un paciente con hemofilia adquirida que se sometieron a una cirugía mayor electiva. La Tabla 7 proporciona una descripción general de la dosificación por grupo de tratamiento para BI y CI.
Tabla 7: Dosificación por grupo de tratamiento
| Inyección en bolo | Infusión continua | ||
|---|---|---|---|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a Incluye a un paciente con hemofilia adquirida
b Incluye la dosificación durante el período de seguimiento después del período de estudio de 10 días.
La hemostasia intraoperatoria se informó como eficaz en todos los pacientes tratados con BI y CI. El régimen BI fue 100% eficaz durante las primeras 24 horas y 92% eficaz al día 5. El régimen CI fue 83% eficaz durante las primeras 24 horas y 83% eficaz al día 5. Al final del período de estudio (día 10 postoperatorio o suspensión de la terapia), la eficacia hemostática en los brazos BI y CI fue 9/12 (75%) y 10/12 (83%), respectivamente.
14.2 Deficiencia congénita del factor VII
Los datos se recogieron de la literatura publicada, ensayos de uso compasivo y registros de 70 pacientes con deficiencia del factor VII tratados con NOVOSEVEN para 124 episodios hemorrágicos, cirugías o regímenes profilácticos. Treinta y dos de estos pacientes se inscribieron en ensayos de emergencia y uso compasivo realizados por Novo Nordisk (43 episodios de hemorragia no quirúrgica, 26 cirugías); 35 se informaron en la literatura publicada (20 cirugías, 10 episodios de hemorragia no quirúrgica, 4 casos de cesárea o parto vaginal, y 10 casos de profilaxis a largo plazo, y 1 caso de terapia según demanda); y 3 eran de un registro mantenido por la Sociedad de Investigación de hemofilia y trombosis (9 episodios hemorrágicos, 1 cirugía). Las dosis oscilaron de 6 a 98 microgramos por kg administrados cada 2 – 12 horas (excepto en la profilaxis, donde las dosis se administraron desde 2 veces por día hasta 2 veces por semana). Los pacientes fueron tratados con un promedio de 1 a 10 dosis. El tratamiento fue eficaz (la hemorragia se detuvo o el tratamiento fue clasificado como eficaz por el médico) en el 93% de los episodios (90% para los pacientes del ensayo, 98% para los pacientes publicados, 90% para los pacientes del registro HTRS).
14.3 Hemofilia adquirida
Los datos se recogieron de cuatro estudios en un programa de uso compasivo realizado por Novo Nordisk y el registro de la Sociedad de Investigación de hemofilia y trombosis (HTRS). Los estudios no estaban diseñados para seleccionar dosis o comparar la eficacia de primera línea o la eficacia cuando se usaba después del fracaso de otros agentes hemostáticos (tratamiento de salvamento). Un total de 70 pacientes con hemofilia adquirida fueron tratados con NOVOSEVEN para 113 episodios hemorrágicos, cirugías o lesiones traumáticas. Sesenta y uno de estos pacientes provenían del programa de uso compasivo con 100 episodios hemorrágicos (68 episodios de hemorragia no quirúrgica y 32 episodios quirúrgicos) y 9 pacientes provenían del registro HTRS con 13 episodios hemorrágicos (8 episiodios no quirúrgicos, 3 episiodios quirúrgicos y 2 episodios clasificados como otros). El uso concomitante de otros agentes hemostáticos ocurrió en 29/70 (41%); 13 (19%) recibieron más de un agente hemostático. Los agentes hemostáticos más comunes utilizados fueron antifibrinolíticos, factor VIII y concentrados de complejo protrombínico activado.
La dosis media de NOVOSEVEN administrada fue de 90 microgramos por kg (rango: 31 a 197 microgramos por kg); el número medio de inyecciones por día fue 6 (rango: 1 a 10 inyecciones por día). La eficacia general (es decir, resultados eficaces y parcialmente eficaces) fue 87/112 (78%); con 77/100 (77%) eficacia en los programas de uso compasivo y 10/12 (83%) eficacia en el registro HTRS. En los programas de uso compasivo, la eficacia global para el tratamiento de primera línea fue 38/44 (86%) en comparación con 39/56 (70%) cuando se usó como tratamiento de salvamento (Tabla 8).
Tabla 8: Eficacia de NOVOSEVEN en los Programas de Uso Compasivo y el Registro HTRS
|
Resultadoa |
|
|
Eficaz |
|
|
Parcial |
|
|
Ineficaz |
|
|
Desconocido |
|
|
N.º de Episodios Hemorrágicos |
|
a Resultado evaluado al final del tratamiento, la última observación llevada adelante.
b Un paciente en el registro HTRS fue excluido del análisis de eficacia ya que NOVOSEVEN se utilizó para mantener la hemostasia después de que el sangrado hubiera sido controlado.
14.4 Trombastenia de Glanzmann
Los datos se recolectaron del Registro de Trombastenia de Glanzmann (GTR), del registro de la Sociedad de Investigación de la Hemostasia y Trombosis (HTRS) y de la literatura publicada. El GTR era observacional y, por lo tanto, no estaba diseñado para seleccionar dosis. El GTR capturó datos de 218 pacientes con trombastenia de Glanzmann y 1073 eventos hemorrágicos y quirúrgicos. Un comité de arbitraje independiente evaluó la refractariedad clínica y el estado de anticuerpos basado en datos históricos de los investigadores, patrones de tratamiento y respuestas de tratamiento cuando solo se utilizaron plaquetas. Los árbitros definieron la refractariedad clínica como la falta de respuesta plaquetaria. Los pacientes con aparente respuesta a solo las plaquetas no se consideraron refractarios, aunque fueran codificados como tales por los investigadores. El estado de anticuerpos incluía GPIIb/IIIa, HLA y anticuerpos específicos de plaquetas no especificados. La eficacia se evaluó en una escala de dos puntos (evaluación clínica del éxito o fracaso del régimen de tratamiento en su conjunto, ciego y no ciego al resultado codificado por el investigador) en 190 pacientes con 755 episodios que requerían terapia hemostática sistémica (151 pacientes con 564 episodios de sangrado severo, 90 pacientes con 192 cirugías, un episodio fue clasificado como ambos). De estos, un total de 92 pacientes fueron tratados con NOVOSEVEN RT para 266 episodios de sangrado y 77 pacientes tratados para 160 procedimientos quirúrgicos. Un gran número de episodios de sangrado fueron tratados con NOVOSEVEN RT solo (109/266 (41%) eventos).
La dosis mediana de NOVOSEVEN RT administrada para episodios de sangrado y procedimientos quirúrgicos fue de 90 microgramos por kg y el intervalo mediano entre dosis fue de 3 horas.
Para todos los sujetos, el uso concomitante de otros agentes hemostáticos ocurrió en 157/266 (59%) episodios de sangrado y 94/160 (59%) procedimientos quirúrgicos.
La mayoría de los episodios de sangrado tratados con NOVOSEVEN RT fueron en pacientes pediátricos (65% ; niños y adolescentes, 0-16 años).
De los 266 episodios de sangrado tratados con NOVOSEVEN RT, los tipos más comunes de episodios de sangrado fueron: epistaxis (116, 43,6 %), sangrado de las encías (48, 18,0 %), menorragia (36, 13,5 %), asociada a la extracción de dientes/dental (29, 10,9 %) y gastrointestinal (23, 8,6 %).
De los pacientes tratados con NOVOSEVEN RT para procedimientos quirúrgicos, el 86 % eran adultos (> 16 años). La cirugía mayor se definió como cualquier procedimiento quirúrgico invasivo en el que se accedió a la cavidad corporal, se cruzó la barrera mesenquimal, se abrió el plano facial, se extrajo un órgano o se alteró la anatomía normal quirúrgicamente. La cirugía menor se definió como cualquier procedimiento quirúrgico invasivo en el que solo se manipularon la piel, las membranas mucosas o el tejido conectivo superficial. Los procedimientos quirúrgicos tratados con NOVOSEVEN RT incluyeron procedimientos menores (134/160 ; 83,8 %) y mayores (26/160, 16,3 %). Los procedimientos dentales fueron los más comunes (106, 66,3 %), seguidos de endoscopia (12, 7,5 %), procedimientos nasales (8, 5,0 %), escisión (7, 4,4 %), cirugía gastrointestinal (7, 4,4 %) y procedimientos ortopédicos (6, 3,8 %). La mayoría de las cirugías fueron electivas (147, 91,9 %), con unas pocas de emergencia (7, 4,4 %) o no especificadas (6).
En general, el tratamiento con NOVOSEVEN RT tuvo éxito en el 94,4 % de los episodios de sangrado (Tabla 9) y en el 99,4 % de los procedimientos quirúrgicos (Tabla 10). La eficacia evaluada por árbitros fue consistente entre los regímenes de tratamiento, los tipos de sangrado y cirugía, la edad y el estado de refractariedad/anticuerpo. El tratamiento con NOVOSEVEN RT tuvo éxito en pacientes con refractariedad clínica con o sin anticuerpos específicos de plaquetas en el 94,9 % de los episodios de sangrado y en el 98,6 % de los procedimientos quirúrgicos. En pacientes sin refractariedad o anticuerpos específicos de plaquetas, el tratamiento con NOVOSEVEN RT fue comparable al tratamiento con plaquetas.
Tabla 9: Evaluación por árbitro de la eficacia – Episodios de sangrado para datos GTR
|
Nº de pacientesc |
Nº de episodios |
Éxito |
Fracaso |
Datos insuficientes |
Sin consenso |
||
|
Todos NOVOSEVEN* |
92 |
266 |
251 (94,4 ) |
4 (1,5 ) |
6 (2,3 ) |
5 (1,9 ) |
|
|
Según el régimen de tratamiento |
|||||||
|
NOVOSEVEN solo |
44 |
109 |
101 (92,7 ) |
2 (1,8 ) |
4 (3,7 ) |
2 (1,8 ) |
|
|
NOVOSEVEN ± Plaquetas ± Otros agentes hemostáticos |
69 |
157 |
150 (95,5 ) |
2 (1,3 ) |
2 (1,3 ) |
3 (1,9 ) |
|
|
Según el grupo de anticuerpos/refractariedad |
|||||||
|
Refractariedad ± Anticuerpos específicos de plaquetasa,d |
31 |
79 |
75 (94,9 ) |
2 (2,5 ) |
2 (2,5 ) |
0 (0,0 ) |
|
|
Anticuerpos específicos de plaquetasa,d |
8 |
10 |
10 (100.0) |
0 (0.0) |
0 (0.0) |
NA |
|
|
Ninguno o desconocidob,d |
57 |
177 |
166 (93.8) |
2 (1.1) |
4 (2.3) |
5 (2.8) |
|
*Todos los regímenes de tratamiento que incluyeron tratamiento con NOVOSEVEN
a incluye GPIIb/IIIa, HLA y anticuerpos específicos de plaquetas no especificados
b Se asume que no se informaron anticuerpos específicos de plaquetas o refractariedad o el estado de anticuerpo y refractariedad es desconocido
c Los números de pacientes no son aditivos. Los pacientes pueden tener episodios con diferentes regímenes de tratamiento y tener más de un estado de anticuerpo/refractariedad
d El tratamiento solo fue NOVOSEVEN en 26/79 episodios con refractariedad con o sin anticuerpos, 2/10 episodios con anticuerpos específicos de plaquetas solamente y 81/177 episodios con ninguno o desconocido. El resto recibió NOVOSEVEN con plaquetas y/o agentes antifibrinolíticos.
Tabla 10: Evaluación del juez de la eficacia – Procedimientos quirúrgicos para datos de GTR
|
Grupos de tratamiento |
Número de pacientesc |
Número de procedimientos |
Éxito |
Datos insuficientesd |
|
Todo NOVOSEVEN* |
77 |
160 |
159 (99.4) |
1 (0.6) |
|
Por régimen de tratamiento |
||||
|
NOVOSEVEN solamente |
35 |
66 |
65 (98.5) |
1 (1.5) |
|
NOVOSEVEN ± Plaquetas ± Otros agentes hemostáticos |
57 |
94 |
94 (100.0) |
0 (0.0) |
|
Por grupo de anticuerpo/refractariedad |
||||
|
Refractariedad ± Anticuerpos específicos de plaquetasa,e |
33 |
70 |
69 (98.6) |
|
|
Anticuerpos específicos de plaquetasa,e |
11 |
24 |
24 (100.0) |
|
|
Ninguno o desconocidob,e |
36 |
66 |
66 (100) |
|
*Todos los regímenes de tratamiento que incluyeron tratamiento con NOVOSEVEN
a incluye GPIIb/IIIa, HLA y anticuerpos específicos de plaquetas no especificados
b Se asume que no se informaron anticuerpos específicos de plaquetas o refractariedad o el estado de anticuerpo y refractariedad es desconocido
c Los números de pacientes no son aditivos. Los pacientes pueden tener episodios con diferentes regímenes de tratamiento y tener más de un estado de anticuerpo/refractariedad
d No se informaron fallos o falta de consenso
e El tratamiento solo fue NOVOSEVEN en 22/70 episodios con refractariedad con o sin anticuerpos, 13/24 episodios con anticuerpos específicos de plaquetas solamente y 31/66 episodios con ninguno o desconocido. El resto recibió NOVOSEVEN con plaquetas y/o agentes antifibrinolíticos.
En HTRS, hubo 7 pacientes que fueron tratados con NOVOSEVEN RT en 23 episodios de sangrado. Se administraron agentes hemostáticos concomitantes en 11 episodios (antifibrinolíticos en 10 episodios). El tratamiento se informó como eficaz en 21 de 23 (91.3%) episodios. En los otros 2 episodios, el sangrado se informó como más lento o sin mejora, sin embargo en ninguno de los episodios se informó un tratamiento adicional. No se informaron procedimientos quirúrgicos en el registro HTRS.
15 REFERENCIAS
- 1. Hedner, U.: Dosis y monitoreo del tratamiento con NOVOSEVEN®, Haemostasis 1996; 26 (suppl 1): 102-108.
- 2. Parameswaran, R., et al.: Efecto de la dosis y eficacia de rFVIIa en el tratamiento de pacientes con hemofilia con inhibidores: análisis del Registro de la Sociedad de Investigación de Hemofilia y Trombosis, Haemophilia 2005; 11: 100-106.
- 3. Butenas, S., et al.: Mecanismo de la coagulación dependiente del factor VIIa en la sangre de personas con hemofilia, Blood 2002; 99: 923-930. Figura A Derechos de autor de la Sociedad Americana de Hematología, utilizada con permiso.
- 4. Allen, G.A., et al.: Efecto del nivel de factor X en la generación de trombina y el efecto procoagulante del factor VII activado en un modelo de coagulación basado en células, Blood Coagulation and Fibrinolysis 2000; 11 (suppl 1): 3-7.
- 5. Fridberg M.J., et al.: Estudio de la farmacocinética y seguridad del factor VII activado recombinante en sujetos caucásicos y japoneses sanos, Blood Coagulation and Fibrinolysis 2005; 16 (4): 259-266.
- 6. Bysted B.V., et al.: Ensayo aleatorizado doble ciego que demuestra la bioequivalencia de la formulación actual de factor VII activado recombinante y una nueva formulación estable a 25ºC, Haemophilia 2007; 13, 527-532.
- 7. Lindley, C.M., et al.: Farmacocinética y farmacodinamia del factor VIIa recombinante, Clinical Pharmacology & Therapeutics 1994; 55 (6): 638-648.
- 8. Villar, A., et al.: Farmacocinética del factor VIIa activado recombinante (NOVOSEVEN®) en niños vs. adultos con hemofilia A, Haemophilia 2004; 10 (4):352-359.
- 9. Berretinni M.: Evaluación farmacocinética del factor VII activado recombinante en pacientes con deficiencia hereditaria del factor VII. Haematologica 2001; 86:640-645.
- 10. Lusher, J., et al.: Experiencia clínica con el factor VIIa recombinante, Blood Coagulation and Fibrinolysis 1998; 9: 119-128.
- 11. Bech, M.R.: Factor VIIa recombinante en episodios de sangrado en articulaciones y músculos, Haemostasis 1996; 26 (suppl 1): 135-138.
- 12. Lusher, J.M.: Factor VIIa recombinante (NOVOSEVEN®) en el tratamiento de sangrado interno en pacientes con inhibidores del factor VIII y IX, Haemostasis 1996; 26 (suppl 1): 124-130.
- 13. Lusher, J.M., et al.: Comparación aleatorizada y doble ciego de dos niveles de dosis de factor VIIa recombinante en el tratamiento de hemorragias articulares, musculares y mucocutáneas en personas con hemofilia A y B, con y sin inhibidor, Haemophilia 1998; 4: 790-798.
- 14. Shapiro A.D., et al: Ensayo prospectivo y aleatorizado de dos dosis de rFVIIa (NOVOSEVEN®) en pacientes con hemofilia con inhibidores sometidos a cirugía, Thrombosis and Haemostasis 1998; 80: 773-778.
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Cómo se suministra
NOVOSEVEN RT, Factor VII de la coagulación (recombinante), se presenta como un polvo liofilizado blanco estable a temperatura ambiente en frascos de dosis individuales, un frasco unitario por caja. El diluyente para la reconstitución de NOVOSEVEN RT es una solución de 10 mmol de L-histidina en agua para inyección y se suministra como una solución incolora y clara, y se denomina diluyente de histidina. El diluyente de histidina se proporciona en frasco o en jeringa de diluyente prellenada.
La cantidad de rFVIIa en miligramos y en microgramos se indica en la etiqueta.
Paquete de NOVOSEVEN RT que contiene 1 frasco de dosis única de polvo de NOVOSEVEN RT y 1 frasco de diluyente de histidina:
|
Presentación |
Número NDC de la caja |
Componentes |
|
1 mg por frasco (1000 microgramos/frasco) |
NDC 0169 7010 01 |
|
|
2 mg por frasco (2000 microgramos/frasco) |
NDC 0169 7020 01 |
|
|
5 mg por frasco (5000 microgramos/frasco) |
NDC 0169 7050 01 |
|
|
8 mg por frasco (8000 microgramos/frasco) |
NDC 0169 7040 01 |
|
Paquete de NOVOSEVEN RT con MixPro® que contiene 1 frasco de dosis única de polvo de NOVOSEVEN RT y 1 jeringa prellenada de diluyente de histidina con adaptador estéril de frasco que sirve como un sistema de reconstitución alternativo sin aguja:
|
Presentación |
Número NDC de la caja |
Componentes |
|
1 mg por frasco (1000 microgramos/frasco) |
NDC 0169 7201 01 |
|
|
2 mg por frasco (2000 microgramos/frasco) |
NDC 0169 7202 01 |
|
|
5 mg por frasco (5000 microgramos/frasco) |
NDC 0169 7205 01 |
|
|
8 mg por frasco (8000 microgramos/frasco) |
NDC 0169 7208 01 |
|
Los frascos de NOVOSEVEN RT y diluyente de histidina están hechos de vidrio cerrados con un tapón de caucho clorobutilo no fabricado con látex de caucho natural y cubiertos con una tapa de aluminio. Las jeringas prellenadas de diluyente están hechas de vidrio, con un émbolo de caucho bromobutilo siliconizado no fabricado con látex de caucho natural. Los frascos cerrados y las jeringas prellenadas de diluyente están equipados con una tapa de seguridad antiintrusión que está hecha de polipropileno. Se proporciona un adaptador de frasco con un filtro de 25 micrómetros con la jeringa de diluyente prellenada.
Almacenamiento y manipulación
Antes de la reconstitución, almacene el polvo de NOVOSEVEN RT y el diluyente de histidina entre 2 y 25 °C (36 y 77 °F). No congele. Almacene protegido de la luz. No use tras la fecha de caducidad.
Después de la reconstitución, almacene NOVOSEVEN RT a temperatura ambiente o refrigerado durante un máximo de 3 horas. No congele NOVOSEVEN RT reconstituido ni almacene en jeringas.
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente:
- •
- Lea el prospecto aprobado por la FDA (Instrucciones de Uso).
- •
- Sobre los primeros signos de reacciones de hipersensibilidad, incluyendo ronchas, urticaria, opresión en el pecho, sibilancias, hipotensión y anafilaxis.
- •
- Sobre los signos de trombosis, incluyendo hinchazón y dolor nuevos en las extremidades o abdomen, dolor de pecho nuevo, falta de aire, pérdida de sensación o fuerza motora, o cambios en la conciencia o el habla.
- •
- Buscar ayuda médica de inmediato si ocurre alguno de los signos o síntomas mencionados anteriormente.
- •
- Seguir las recomendaciones en el prospecto aprobado por la FDA sobre la eliminación adecuada de objetos punzantes.
Versión: Julio de 2020-V20
Información de PATENTE: http://novonordisk-us.com/products/product-patents.html
Novo Nordisk® es una marca registrada de Novo Nordisk A/S.
NOVOSEVEN® es una marca registrada de Novo Nordisk Health Care AG.
MixPro® es una marca registrada de Novo Nordisk A/S.
Clave® y MicroClave® son marcas registradas de ICU Medical Inc.
InVision-Plus®, InVision-Plus CS®, InVision-Plus® Junior® son marcas registradas de RyMed Technologies, Inc.
Bionector® es una marca registrada de Vygon.
© 2020 Novo Nordisk
Para obtener información, comuníquese con:
Novo Nordisk Inc.
800 Scudders Mill Road
Plainsboro, NJ 08536, USA
1-877-NOVO-777
Fabricado por:
Novo Nordisk A/S
2880 Bagsvaerd, Dinamarca
Número de licencia: 1261
INSERTO PARA EL PACIENTE
Etiquetado aprobado por la FDA para pacientes
Instrucciones de uso
NovoSeven RT
Factor VIIa de coagulación (recombinante)
Instrucciones sobre cómo Utilizar NovoSeven® RT
LEA ESTAS INSTRUCCIONES CON CUIDADO ANTES DE USAR NOVOSEVEN® RT.
NovoSeven® RT se suministra en forma de polvo. Antes de la inyección (administración) debe mezclarse (reconstituirse) con el diluyente líquido suministrado en la jeringa. El diluyente líquido es una solución de histidina. La NovoSeven® RT mezclada debe inyectarse en su vena (inyección intravenosa). El equipo de este paquete está diseñado para mezclar e inyectar NovoSeven® RT.
También necesitará un conjunto de perfusión (tubo y aguja mariposa), hisopos de alcohol estériles, compresas de gasa y vendajes.
No utilice el equipo sin un entrenamiento adecuado de su médico o enfermera.
Siempre utilice una técnica limpia y libre de gérmenes (aséptica). Es importante que se lave las manos y asegúrese de que el área a su alrededor esté limpia.
No abra el equipo hasta que esté listo para usarlo.
El equipo es de uso único.
Vial de una dosis. Deseche la porción no utilizada.
Contenido
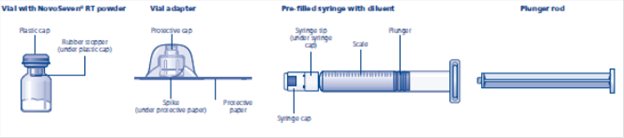
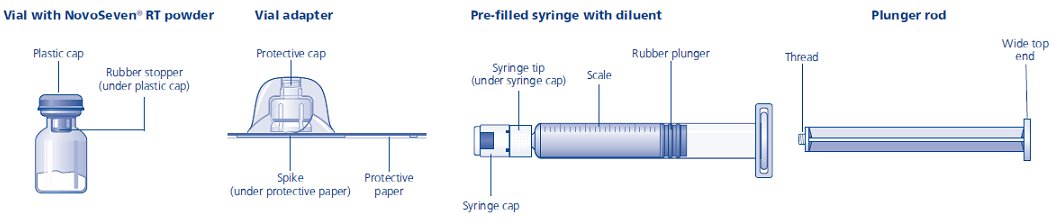
El paquete contiene:
• Vial con polvo de NovoSeven® RT
• Adaptador de vial
• Jeringa precargada con diluyente
• Varilla de émbolo (colocada debajo de la jeringa)
- Resumen
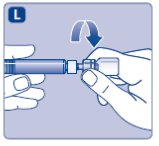
1. Prepare el vial y la jeringa
- •
- Saque el número de paquetes de NovoSeven® RT que necesita. Compruebe la fecha de caducidad.
- •
- Revise el nombre y el color del paquete, para asegurarse de que contiene el producto correcto.
- •
- Lávese las manos y séquelas correctamente usando una toalla limpia o deje que se sequen al aire.
- •
- Saque el vial, el adaptador de vial y la jeringa precargada del cartón. Deje la varilla del émbolo sin tocar en el cartón.
- •
- Lleve el vial y la jeringa precargada a temperatura ambiente (no superior a 98.6°F (37°C)). Puede hacerlo sosteniéndolos en las manos hasta que se sientan tan calientes como sus manos.
- •
- Quitar la tapa de plástico del vial. Si la tapa de plástico está suelta o faltante, no use el vial.
- •
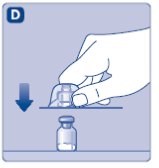
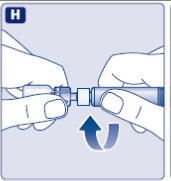
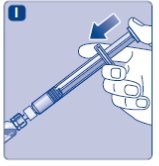
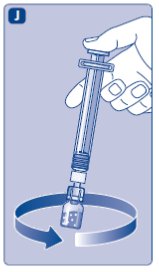
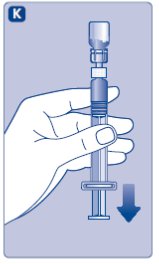
- Limpie el tapón de goma del vial con un hisopo de alcohol estéril y deje que se seque por unos segundos antes de usar. No toque el tapón de goma después de limpiarlo.
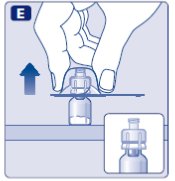
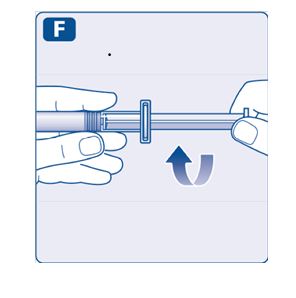
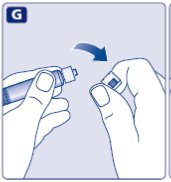
No utilice el equipo si se ha caído o está dañado. Utilice un paquete nuevo en su lugar.
No utilice el equipo si ha caducado. Utilice un paquete nuevo en su lugar. La fecha de caducidad está impresa en el cartón exterior, en el vial, en el adaptador de vial y en la jeringa precargada.
No deseche ninguno de los artículos hasta después de haber inyectado la solución mezclada.
2. Fije el adaptador de vial
- •
- Quitar el papel de protección del adaptador de vial.
- No saque el adaptador de vial de la tapa de protección.
- Si el papel de protección no está completamente sellado o está roto, no use el adaptador de vial.
- •
- Coloque el vial en una superficie plana y sólida.
- •
- Voltee la tapa de protección, y encaje el adaptador de vial en el vial.
- No toque el pico del adaptador de vial.
- Una vez fijado, no retire el adaptador de vial del vial.
- •
- Apriete ligeramente la tapa de protección con el pulgar y el índice tal como se muestra.
- Retire la tapa de protección del adaptador de vial.
- No levante el adaptador de vial del vial al retirar la tapa de protección.
3. Fije la varilla de émbolo y la jeringa
- •
- Sostenga la varilla de émbolo por el extremo ancho superior y sáquela del cartón. Tenga cuidado de no tocar los lados o el hilo de la varilla de émbolo. Siga sosteniendo la varilla de émbolo por el extremo ancho superior.
- •
- Inmediatamente conecte la varilla de émbolo a la jeringa girándola en el sentido de las agujas del reloj en el émbolo de goma dentro de la jeringa precargada hasta que se sienta resistencia.
- •
- Retire la tapa de la jeringa de la jeringa precargada doblando hacia abajo hasta que se rompa la perforación.
- No toque la punta de la jeringa debajo de la tapa de la jeringa.
- Si la tapa de la jeringa está suelta o faltante, no use la jeringa precargada.
- •
- Atornille firmemente la jeringa precargada en el adaptador de vial hasta que se sienta resistencia.
Evite tocar los lados de la varilla del émbolo en cualquier momento.
4. Mezclar el polvo con el diluyente
- •
- Sostener la jeringa prellenada ligeramente inclinada con el frasco boca abajo.
- •
- Empujar el émbolo para inyectar todo el diluyente en el frasco.
- •
- Mantener el émbolo presionado hacia abajo y girar el frasco suavemente hasta que todo el polvo se disuelva.
- No agitar el frasco ya que esto provocará espuma.
- •
- Comprobar la solución mezclada. Debe ser clara e incolora. Si se observan partículas visibles o decoloración, no la use. Use un nuevo paquete en su lugar.
NovoSeven ® RT se recomienda utilizar inmediatamente después de ser mezclado.
Si no puede utilizar la solución de NovoSeven ® RT mezclada de inmediato, puede conservarse en el frasco, aún con el adaptador de frasco y la jeringa adjuntos, a temperatura ambiente o refrigerada por no más de 3 horas.
No congelar la solución de NovoSeven ® RT mezclada ni almacenarla en jeringas.
Mantener la solución de NovoSeven ® RT mezclada lejos de la luz directa.
Si la dosis que necesita requiere más de un frasco, repita el paso A al J con frascos adicionales, adaptadores de frasco y jeringas prellenadas hasta que haya alcanzado la dosis requerida.
- •
- Mantener el émbolo empujado completamente hacia dentro.
- •
- Girar la jeringa con el frasco boca arriba.
- •
- Dejar de empujar el émbolo y dejar que se mueva hacia atrás por sí solo mientras la solución mezclada llena la jeringa.
- •
- Jalar el émbolo ligeramente hacia abajo para extraer la solución mezclada en la jeringa. En caso de que solo necesite una parte de la dosis completa, utilice la escala en la jeringa para ver cuánta solución mezclada extrae, según lo indicado por su médico o enfermera.
- •
- Mientras sostiene el frasco boca arriba, golpee suavemente la jeringa para permitir que cualquier burbuja de aire suba a la parte superior.
- •
- Empujar el émbolo lentamente hasta que todas las burbujas de aire se hayan ido.
- •
- Desatornillar el adaptador del frasco con el frasco.
Precaución: La jeringa prellenada con diluyente de histidina está fabricada de vidrio con un diámetro interno de punta de 0.037 pulgadas y es compatible con un conector Luer-lock estándar.
Algunos conectores sin aguja para catéteres intravenosos no son compatibles con las jeringas de diluyente de vidrio (por ejemplo, ciertos conectores con una punta interna, como Clave ® / MicroClave ®, InVision-Plus ®, InVision-Plus CS ®, InVision-Plus ® Junior ®, Bionector ®), y su uso puede dañar el conector y afectar la administración. Para administrar el producto a través de conectores sin aguja incompatibles, extraiga el producto reconstituido en una jeringa plástica estéril Luer-lock estándar de 10 mL.
Si ha tenido algún problema al conectar la jeringa prellenada de diluyente de histidina a cualquier dispositivo compatible con Luer-lock, comuníquese con Novo Nordisk al (877) 668-6777.
5. Inyectar la solución mezclada
NovoSeven ® RT ahora está listo para inyectar en su vena.
- •
- No mezclar NovoSeven ® RT con ninguna otra infusión intravenosa o medicamento.
- •
- Inyectar la solución mezclada lentamente durante 2 a 5 minutos según las indicaciones de su médico o enfermera.
Inyectar la solución a través de un dispositivo de acceso venoso central (CVAD), como un catéter venoso central o puerto subcutáneo:
- •
- Utilizar una técnica limpia y libre de gérmenes (aséptica). Siga las instrucciones de uso adecuado para su conector y dispositivo de acceso venoso central en consulta con su médico o enfermera.
- •
- Inyectar en un CVAD puede requerir el uso de una jeringa plástica estéril de 10 mL para la extracción de la solución mezclada e inyección.
- •
- Si es necesario, utilice Inyección de Cloruro de Sodio al 0.9 %, USP, para enjuagar la línea del CVAD antes o después de la inyección de NovoSeven ® RT.
La etiqueta despegable que se encuentra en el frasco de NovoSeven ® RT se puede utilizar para registrar el número de lote.
Desecho
- •
- Después de la inyección, deseche de forma segura la jeringa con el conjunto de infusión, el frasco con el adaptador del frasco, cualquier NovoSeven ® RT no utilizado y otros materiales de desecho tal como le indique su médico o enfermera.
- No lo tire con la basura doméstica ordinaria.
No desensamble el frasco y el adaptador del frasco antes del desecho.
No reutilice el equipo.
Para obtener la Información completa de Prescripción, lea el otro inserto incluido en este paquete.
Revisado: 07/2020
Información de Patentes: http://novonordisk-us.com/products/product-patents.html
Novo Nordisk ® es una marca registrada de Novo Nordisk A/S.
NovoSeven ® es una marca registrada de Novo Nordisk Health Care AG.
Clave ® y MicroClave ® son marcas registradas de ICU Medical Inc.
InVision-Plus ®, InVision-Plus CS ®, InVision-Plus ® Junior ® son marcas registradas de RyMed Technologies, Inc.
Bionector ® es una marca registrada de Vygon.
© 2020 Novo Nordisk
Fabricado por:
Novo Nordisk A/S
2880 Bagsvaerd, Dinamarca
Número de Licencia: 1261
Versión: 20200710-v8
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel de visualización principal 1 mg
NDC 0169 7010 01
Lista: 701001
NovoSeven® RT
Factor VII de la coagulación
(Recombinante)
Estable a temperatura ambiente
1 mg
Únicamente para administración intravenosa
Sólo para uso humano
Vial de dosis única
Administrar dentro de las 3 horas de reconstitución
No contiene conservantes
Sólo con receta
Novo Nordisk®
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel principal de visualización 2mg
NDC 0169 7020 01
Lista: 702001
NovoSeven® RT
Factor VIIa de coagulación
(Recombinante)
Estable a temperatura ambiente
2 mg
Únicamente para administración intravenosa
Únicamente para uso humano
Vial de dosis única
Administrar dentro de 3 horas después de la reconstitución
No contiene conservantes
Sólo con receta
novo nordisk®
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel de visualización principal 5 mg
NDC 0169 7050 01
Lista: 705001
NovoSeven® RT
Factor VIIa de coagulación
(Recombinante)
Estable a temperatura ambiente
5 mg
Para administración intravenosa únicamente
Solamente para uso humano
Frasco de dosis única
Administrar en un plazo de 3 horas tras la reconstitución
No contiene conservantes
Rx solamente
novo nordisk®
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel principal de visualización 8 mg
NDC 0169 7040 01
Lista: 704001
NovoSeven® RT
Factor VIIa de la coagulación
(Recombinante)
Estable a temperatura ambiente
8 mg
Únicamente para administración intravenosa
Únicamente para uso humano
Frasco de dosis única
Administrar en un plazo de 3 horas después de la reconstitución
No contiene conservantes
Sólo con receta
novo nordisk®
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel principal de visualización 1 mg
NDC 0169-7201-01
- Lista: 720101 1 mg
- NovoSeven® RT
- Factor VIIa de la coagulación (Recombinante)
Estable a temperatura ambiente
Para administración intravenosa en bolo. Sólo para uso humano.
Vial de una dosis. Administrar dentro de las 3 horas de la reconstitución. Desechar la porción no utilizada.
No contiene conservantes.
Sólo bajo receta
- Incluye MixPro®
- Un adaptador de vial y una jeringa precargada con diluyente
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel principal de visualización 2 mg
NDC 0169-7202-01
- Lista: 720201 2 mg
- NovoSeven® RT
- Factor VIIa de coagulación (Recombinante)
Estable a temperatura ambiente
Para administración intravenosa en bolo. Solo para uso humano.
Frasco de dosis única. Administrar dentro de las 3 horas después de la reconstitución. Desechar la porción no utilizada.
No contiene conservante.
Únicamente con receta
Incluye MixPro®
Un adaptador de frasco y una jeringa precargada de diluyente
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel principal de visualización 5 mg
NDC 0169-7205-01
- Lista: 720501 5 mg
- NovoSeven® RT
- Factor VIIa de coagulación (Recombinante)
Estable a temperatura ambiente
Para administración intravenosa en bolo. Solo para uso humano.
Vial de dosis única. Administrar dentro de las 3 horas de reconstitución. Desechar la porción no utilizada.
No contiene conservantes.
Solo con receta
Incluye MixPro®
Un adaptador de vial y una jeringa precargada con diluyente 
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel principal de visualización 8 mg
NDC 0169-7208-01
- Lista: 720801 8 mg
- NovoSeven® RT
- Factor VIIa de coagulación (recombinante)
Estable a temperatura ambiente
Para administración intravenosa en bolo. Solo para uso humano.
Vial de dosis única. Administrar en un plazo de 3 horas post-reconstitución. Desechar la parte no utilizada.
No contiene conservantes.
Sólo con receta
Incluye MixPro®
Un adaptador de vial y una jeringa precargada con diluyente
Panel de visualización principal 1,1 mL Etiqueta de histidina
Panel principal de visualización 2,1 mL Etiqueta de histidina
Panel principal de visualización 5.2 mL Etiqueta de histidina
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel principal de visualización 1 mL de etiqueta de histidina
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel de visualización principal 2 mL etiqueta de histidina
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel de visualización principal 5 mL Histidina
Panel de visualización principal 8 mL Histidina
Panel de visualización principal 1 mg. Vial
Panel principal de presentación 2 mg. Vial
Panel de visualización principal Frasco de 5 mg.
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel de visualización principal Vial de 1 mg
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel principal de presentación 2 mg. Vial
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel principal de visualización 5 mg. Vial
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel de visualización principal Vial de 8 mg