Fabricante de medicamentos: Bayer HealthCare LLC (Updated: 2019-12-20)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
KOGENATE FS (Antihemophilic Factor [Recombinant], Formulated with Sucrose)
For Intravenous Use, Lyophilized Powder for Reconstitution with Vial Adapter
Initial U.S. Approval: 1993
INDICACIONES Y USO
Kogenate FS es un factor antihemofílico (recombinante) indicado para:
- •
- El tratamiento a demanda y el control de los episodios hemorrágicos en adultos y niños con hemofilia A.
- •
- El manejo perioperatorio de la hemorragia en adultos y niños con hemofilia A.
- •
- La profilaxis de rutina para reducir la frecuencia de los episodios hemorrágicos en niños con hemofilia A y para reducir el riesgo de daño articular en niños sin daño articular preexistente.
- •
- La profilaxis de rutina para reducir la frecuencia de los episodios hemorrágicos en adultos con hemofilia A.
Kogenate FS no está indicado para el tratamiento de la enfermedad de von Willebrand (1).
DOSIFICACIÓN Y ADMINISTRACIÓN
Solo para uso intravenoso.
- •
- Cada vial de Kogenate FS contiene la cantidad etiquetada de factor VIII recombinante en unidades internacionales (UI, unidad).
Control de episodios hemorrágicos y manejo perioperatorio (2.1):
- •
- Dosis (unidades) = peso corporal (kg) x aumento deseado de factor VIII (UI/dL o % de lo normal) x 0.5 (UI/kg por UI/dL).
- •
- Ajuste las dosis a la respuesta clínica del paciente.
- •
- Determine la frecuencia del tratamiento en función del tipo de episodio hemorrágico.
Para la profilaxis de rutina en adultos: 25 unidades por kg tres veces por semana (2.1).
Para la profilaxis de rutina en niños: 25 unidades por kg en días alternos (2.1).
FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Disponible como polvo liofilizado en viales de un solo uso que contienen nominalmente 250, 500, 1000, 2000 y 3000 UI (3). Kogenate FS se suministra con un adaptador de vial estéril con filtro de 15 micrómetros y una jeringa de diluyente precargada, que juntos sirven como un sistema alternativo de reconstitución sin aguja.
CONTRAINDICACIONES
No utilizar en pacientes que hayan tenido reacciones de hipersensibilidad potencialmente mortales, incluyendo anafilaxia a la proteína de ratón o hámster u otros componentes del producto (4).
ADVERTENCIAS Y PRECAUCIONES
- •
- Son posibles las reacciones de hipersensibilidad, incluida la anafilaxia. Si se presentan síntomas, suspenda el tratamiento con Kogenate FS y administre el tratamiento adecuado (5.1).
- •
- Se puede producir el desarrollo de anticuerpos neutralizantes de la actividad en pacientes que reciben productos que contienen factor VIII, incluido Kogenate FS. Si no se alcanzan los niveles esperados de actividad del factor VIII en plasma, o si no se controla la hemorragia con la dosis esperada, realice un ensayo que mida la concentración de inhibidor del factor VIII (5.2).
- •
- Cuando la coagulación se normaliza mediante el tratamiento con factor VIII, el desarrollo de factores de riesgo cardiovascular puede ser el mismo que el riesgo para los pacientes no hemofílicos (5.3).
- •
- Controle los niveles plasmáticos de factor VIII durante las infusiones cuando esté indicado (5.4).
REACCIONES ADVERSAS
Las reacciones adversas más comunes (≥4%) en los ensayos clínicos son la formación de inhibidores (anticuerpos neutralizantes) en pacientes previamente no tratados y mínimamente tratados (PUP y MTP), reacciones de hipersensibilidad asociadas a la piel (p. ej., erupción cutánea, prurito, urticaria), reacciones en el lugar de la infusión (p. ej., inflamación, dolor) e infecciones asociadas al dispositivo de acceso venoso central (DAVC) (6).
Para reportar REACCIONES ADVERSAS SOSPECHOSAS, contacte a Bayer HealthCare al 1-888-842-2937 o a la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch
USO EN POBLACIONES ESPECÍFICAS
- •
- Uso pediátrico: Puede producirse una mayor eliminación del factor VIII en niños (4.4-16 años). Puede ser necesario ajustar la dosis (8.4).
See 17 for PATIENT COUNSELING INFORMATION and FDA-approved patient labeling.
Revisado: 12/2019
Tabla de Contenido
INFORMACIÓN DE PRESCRIPCIÓN COMPLETA: CONTENIDO*
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis
2.2 Preparación y Reconstitución
2.3 Administración
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de Hipersensibilidad
5.2 Anticuerpos Neutralizantes
5.3 Factores de Riesgo Cardiovascular
5.4 Monitoreo de Pruebas de Laboratorio
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Posterior a la Comercialización
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
13.2 Toxicología y/o Farmacología Animal
14 ESTUDIOS CLÍNICOS
15 REFERENCIAS
16 CÓMO SUMINISTRARLO/ALMACENAMIENTO Y MANIPULACIÓN
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información de prescripción completa no están listadas.
1 INDICACIONES Y USO
Kogenate® FS es un factor antihemofílico recombinante indicado para:
- •
- Tratamiento a demanda y control de episodios hemorrágicos en adultos y niños con hemofilia A.
- •
- Manejo perioperatorio de hemorragias en adultos y niños con hemofilia A.
- •
- Profilaxis de rutina para reducir la frecuencia de episodios hemorrágicos en niños con hemofilia A y para reducir el riesgo de daño articular en niños sin daño articular preexistente.
- •
- Profilaxis de rutina para reducir la frecuencia de episodios hemorrágicos en adultos con hemofilia A.
Kogenate FS no está indicado para el tratamiento de la enfermedad de von Willebrand.
2 DOSIS Y ADMINISTRACIÓN
Para uso intravenoso después de la reconstitución únicamente.
2.1 Dosis
- •
- La dosis y la duración del tratamiento dependen de la gravedad de la deficiencia del factor VIII, la ubicación y la extensión del sangrado, y la condición clínica del paciente.1 El control cuidadoso de la terapia de reemplazo es especialmente importante en casos de cirugía mayor o episodios de sangrado potencialmente mortales.
- •
- Cada vial de Kogenate FS tiene la potencia del factor VIII recombinante (rFVIII) en unidades internacionales (UI, unidad) indicada en la etiqueta. Una UI (unidad), según lo definido por el estándar de la Organización Mundial de la Salud para el factor de coagulación VIII sanguíneo, humano, es aproximadamente igual al nivel de actividad del factor VIII que se encuentra en 1 mL de plasma humano fresco agrupado.
- •
- El aumento máximo esperado in vivo en el nivel de factor VIII expresado como UI/dL (o % normal) se puede estimar utilizando las siguientes fórmulas:
Dosis (unidades) = peso corporal (kg) x aumento deseado del factor VIII (UI/dL o % de lo normal) x 0.5 (UI/kg por UI/dL)
o
UI/dL (o % normal) = Dosis total (UI)/peso corporal (kg) x 2 [UI/dL]/[UI/kg]
- •
- Titule la dosis a la respuesta clínica del paciente. Los pacientes pueden variar en sus respuestas farmacocinéticas (por ejemplo, vida media, recuperación in vivo) y clínicas a Kogenate FS.2,3,4 Aunque la dosis se puede estimar mediante los cálculos anteriores, se recomienda encarecidamente que se realicen pruebas de laboratorio apropiadas, incluidos los análisis de actividad del factor VIII en serie, [ver Advertencias y precauciones (5.3) y Farmacología clínica (12.3)].
Tratamiento a demanda yControl de episodios de sangrado
Se proporciona una guía para la dosificación de Kogenate FS para el tratamiento a demanda y el control de los episodios de sangrado en Tabla 1. El objetivo del tratamiento es mantener un nivel de actividad del factor VIII en plasma en o por encima de los niveles plasmáticos (en % de lo normal o en UI/dL) descritos en Tabla 1.
|
Tipo de episodios de sangrado |
Nivel de factor VIII requerido |
Dosis (UI/kg) |
Frecuencia de las dosis (horas) |
Duración de la terapia (días) |
|
Menor Hemartrosis temprana, sangrado muscular o oral menor. |
20 – 40 |
10 – 20 |
Repita la dosis si hay evidencia de sangrado adicional. |
Hasta que el sangrado se resuelva |
|
Moderado Sangrado en los músculos, sangrado en la cavidad oral, hemartrosis definidas y trauma conocido. |
30 – 60 |
15 – 30 |
12 – 24 |
Hasta que el sangrado se resuelva |
|
Mayor Sangrado gastrointestinal. Sangrado intracraneal, intraabdominal o intratorácico, sangrado del sistema nervioso central, sangrado en los espacios retrofaríngeo o retroperitoneal, o vaina iliopsoas. Fracturas. Trauma en la cabeza. |
80 – 100 |
Inicial: 40 – 50 Repetir: 20 – 25 |
8 – 12 |
Hasta que el sangrado se resuelva |
Manejo Perioperatorio del Sangrado
Se proporciona una guía para la dosificación de Kogenate FS durante la cirugía (manejo perioperatorio del sangrado) en Tabla 2. El objetivo del tratamiento es mantener un nivel de actividad del factor VIII plasmático en o por encima del nivel plasmático (en % de lo normal o en UI/dL) descrito en Tabla 2.
|
Tipo de Cirugía |
Nivel de Factor VIII Requerido |
Dosis (UI/kg) |
Frecuencia de Dosis (horas) |
Duración de la Terapia (días) |
|
Menor Incluyendo extracción de dientes |
30 – 60 |
15 – 30 |
12 – 24 |
Hasta que el sangrado se resuelva. |
|
Mayor Ejemplos incluyen amigdalectomía, herniotomía inguinal, sinovectomía, reemplazo total de rodilla, craneotomía, osteosíntesis, trauma. |
100 |
50 Preoperatoriamente para alcanzar el 100% de actividad. |
6 – 12 para mantener la actividad de FVIII en el rango deseado |
Hasta que la cicatrización esté completa. |
2.2 Preparación y reconstitución
Kogenate FS se administra por inyección intravenosa después de la reconstitución. Los pacientes deben seguir los procedimientos específicos de reconstitución y administración proporcionados por sus médicos.
Reconstituya y administre Kogenate FS con los componentes proporcionados con cada paquete. Si se abre o daña algún componente del paquete, no utilice este componente.
La reconstitución del producto, la administración y la manipulación del equipo de administración y las agujas deben realizarse con precaución porque la punción percutánea con una aguja contaminada con sangre puede transmitir virus infecciosos, incluidos el VIH (SIDA) y la hepatitis. Coloque las agujas en un contenedor para objetos punzantes después de un solo uso. Deseche todo el equipo, incluido cualquier producto Kogenate FS reconstituido, en un contenedor adecuado. Busque atención médica inmediata si se produce una lesión.
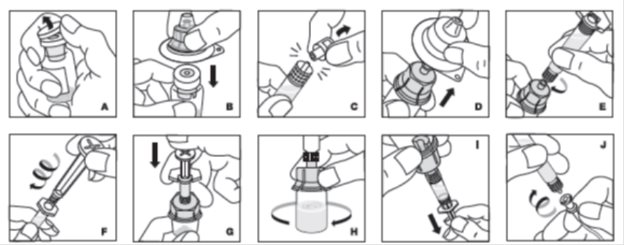
Los procedimientos que se indican a continuación se proporcionan como directrices generales para la reconstitución de Kogenate FS proporcionado con un adaptador de vial estéril con filtro de 15 micrómetros y una jeringa de diluyente prellenada, que en conjunto sirven como un sistema alternativo de reconstitución sin agujas.
- •
- Trabaje en una superficie limpia y lávese las manos a fondo con agua y jabón antes de realizar los procedimientos.
- •
- Reconstituya Kogenate FS con los componentes proporcionados con cada paquete. Si se abre o daña algún componente del paquete, no utilice este componente.
- •
- Filtre el producto reconstituido antes de la administración para eliminar posibles partículas en la solución. El filtrado se puede lograr utilizando el adaptador del vial.
Transferencia y reconstitución al vacío
- •
- Prepare el producto en condiciones asépticas.
- •
- Caliente tanto el vial sin abrir como la jeringa en sus manos hasta que alcancen una temperatura agradable (no exceda los 37 °C o 99 °F).
- •
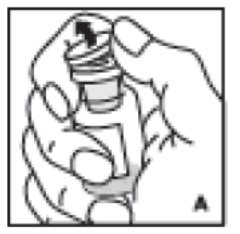
- Retire la tapa protectora del vial (A). Limpie asépticamente el tapón de goma con alcohol, teniendo cuidado de no manipular el tapón de goma.
- •
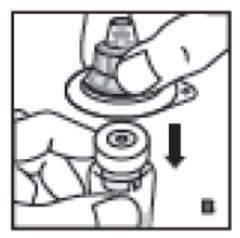
- Coloque el vial del producto sobre una superficie firme y antideslizante. Retire la cubierta de papel de la carcasa de plástico del adaptador del vial. No retire el adaptador de la carcasa de plástico. Sosteniendo la carcasa del adaptador, colóquela sobre el vial del producto y presione firmemente hacia abajo (B). El adaptador se encajará sobre la tapa del vial. No retire la carcasa del adaptador en este paso.
- •
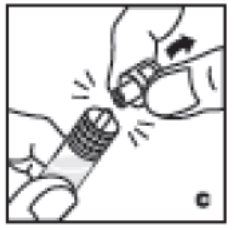
- Sosteniendo la jeringa por el barril, rompa la tapa de la jeringa de la punta (C). No toque la punta de la jeringa con la mano ni con ninguna superficie. Deje la jeringa a un lado para su uso posterior.
- •
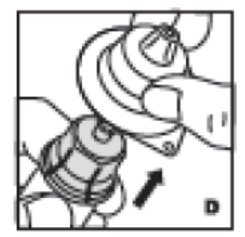
- Ahora retire y deseche la carcasa del adaptador (D).
- •
- Conecte la jeringa prellenada al adaptador de vial roscado girando en el sentido de las agujas del reloj (E).
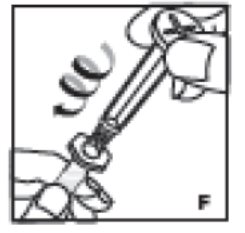
- •
- Agarre la varilla del émbolo por la placa superior y retírela del cartón. Evite tocar los lados y las roscas de la varilla del émbolo. Conecte inmediatamente la varilla del émbolo girándola firmemente en el sentido de las agujas del reloj en el tapón de goma roscado de la jeringa (F).
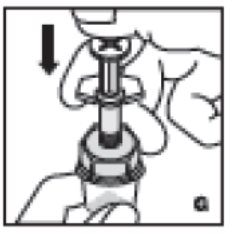
- •
- Inyecte el diluyente presionando lentamente la varilla del émbolo hacia abajo (G).
- •
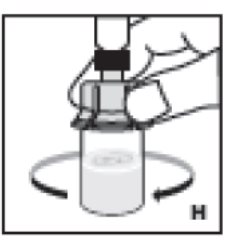
- Gire el vial suavemente hasta que todo el material se disuelva (H). No agite el vial. Asegúrese de que el polvo esté completamente disuelto. No utilice soluciones que contengan partículas visibles o que estén turbias.
- •
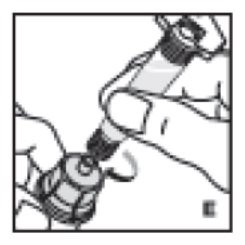
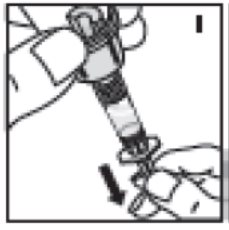
- Retire la solución en la jeringa sujetando el vial en posición vertical por encima del adaptador del vial y la jeringa (I) y luego extraiga la varilla del émbolo lenta y suavemente. Asegúrese de que todo el contenido del vial se extraiga en la jeringa.
- •
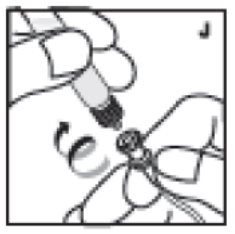
- Con la varilla del émbolo en su lugar, retire la jeringa del adaptador del vial (este último debe permanecer conectado al vial). Conecte la jeringa al equipo de administración proporcionado e inyecte por vía intravenosa (J).
- •
- Si el mismo paciente va a recibir más de un frasco, reconstituya cada frasco con la jeringa de diluyente proporcionada y luego combine las soluciones en una jeringa más grande (no proporcionada) y administre como de costumbre.
2.3 Administración
Para uso intravenoso después de la reconstitución únicamente.
- •
- Inspeccione Kogenate FS visualmente para detectar partículas y decoloración antes de la administración, siempre que la solución y el contenedor lo permitan. No utilice Kogenate FS si observa alguna partícula o turbidez en la solución.
- •
- Almacene Kogenate FS reconstituido a temperatura ambiente antes de la administración, pero administre dentro de las 3 horas.
- •
- Administre Kogenate FS utilizando el equipo de administración proporcionado durante un período de 1 a 15 minutos. Adapte la velocidad de administración a la respuesta de cada paciente individual. Determine la frecuencia cardíaca antes y durante la administración de Kogenate FS. Si hay un aumento significativo de la frecuencia cardíaca, reduzca la velocidad de administración o detenga temporalmente la infusión permitiendo que los síntomas desaparezcan rápidamente.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Kogenate FS está disponible como polvo liofilizado en viales de vidrio de un solo uso que contienen nominalmente 250, 500, 1000, 2000 y 3000 Unidades Internacionales (UI, unidad).
Cada vial de Kogenate FS está etiquetado con la actividad del factor antihemofílico recombinante expresada en Unidades Internacionales por vial. Esta asignación de potencia emplea un estándar de concentrado de factor VIII que se refiere a un Estándar Internacional de la OMS para concentrados de factor VIII, y se evalúa mediante una metodología adecuada para garantizar la precisión de los resultados.
4 CONTRAINDICACIONES
Kogenate FS está contraindicado en pacientes que han tenido reacciones de hipersensibilidad que ponen en peligro la vida, incluyendo anafilaxia a proteína de ratón o hámster u otros componentes del producto (sacarosa, glicina, histidina, sodio, cloruro de calcio, polisorbato 80, imidazol, tri-n-butil fosfato y cobre).
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de Hipersensibilidad
Se han reportado reacciones de hipersensibilidad, incluyendo anafilaxis con Kogenate FS. Los síntomas reportados incluyeron hinchazón facial, rubor, urticaria, disminución de la presión arterial, náuseas, erupción cutánea, inquietud, dificultad para respirar, taquicardia, opresión en el pecho, hormigueo, urticaria y vómitos.
Kogenate FS contiene cantidades traza de inmunoglobulina G de ratón (MuIgG) y proteínas de hámster (BHK) [ver Descripción (11)]. Los pacientes tratados con este producto pueden desarrollar hipersensibilidad a estas proteínas de mamíferos no humanos.
Suspenda Kogenate FS si se presentan síntomas y busque atención médica de emergencia inmediata.
5.2 Anticuerpos Neutralizantes
Se han reportado anticuerpos neutralizantes (inhibidores) después de la administración de Kogenate FS, predominantemente en pacientes previamente no tratados (PUP) [ver Reacciones Adversas (6)]. Monitoree cuidadosamente a los pacientes para el desarrollo de inhibidores del factor VIII, utilizando observaciones clínicas apropiadas y pruebas de laboratorio.6 Si no se alcanzan los niveles esperados de actividad del factor VIII en plasma, o si el sangrado no se controla con una dosis esperada, realice un ensayo que mida la concentración del inhibidor del factor VIII [ver Advertencias y Precauciones (5.4)].
5.3 Factores de Riesgo Cardiovascular
Los pacientes hemofílicos con factores de riesgo cardiovascular o enfermedades pueden tener el mismo riesgo de desarrollar eventos cardiovasculares que los pacientes no hemofílicos cuando la coagulación se ha normalizado mediante el tratamiento con factor VIII.
5.4 Monitoreo de Pruebas de Laboratorio
- •
- Monitoree los niveles de actividad del factor VIII en plasma mediante el ensayo de coagulación de un solo paso para confirmar que se han alcanzado y mantenido los niveles adecuados de factor VIII, cuando esté clínicamente indicado [ver Dosificación y Administración (2)].
- •
- Monitoree el desarrollo de inhibidores del factor VIII. Realice un ensayo para determinar si está presente el inhibidor del factor VIII. Si no se alcanzan los niveles esperados de actividad del factor VIII en plasma o si el sangrado no se controla con la dosis esperada de Kogenate FS, utilice Unidades de Bethesda (BU) para titular los inhibidores.
- •
- Si el inhibidor es menor de 10 BU por mL, la administración de concentrado adicional de Kogenate FS puede neutralizar el inhibidor y puede permitir una respuesta hemostática adecuada.
- •
- Si los títulos de inhibidores son superiores a 10 BU por mL, es posible que no se logre una hemostasia adecuada. El título del inhibidor puede aumentar después de la infusión de Kogenate FS como resultado de una respuesta anamnésica al factor VIII. El tratamiento a demanda y el control del sangrado en estos pacientes requiere el uso de enfoques y agentes terapéuticos alternativos.
6 REACCIONES ADVERSAS
Las reacciones adversas graves observadas con Kogenate FS son reacciones de hipersensibilidad sistémica, incluidas reacciones broncoespásticas y/o hipotensión y anafilaxia, y el desarrollo de inhibidores de alto título que requieren tratamientos alternativos al factor VIII.
Las reacciones adversas más comunes (≥ 4%) observadas en los ensayos clínicos fueron la formación de inhibidores en pacientes previamente no tratados (PUP) y pacientes mínimamente tratados (MTP), reacciones de hipersensibilidad relacionadas con la piel (p. ej., erupción cutánea, prurito), reacciones en el sitio de infusión (p. ej., inflamación, dolor) e infecciones asociadas con dispositivos de acceso venoso central (CVAD).
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica clínica.
Pacientes previamente tratados (PTP)
Durante los estudios clínicos de etiqueta abierta realizados en 73 PTP, se informaron 24 reacciones adversas en el curso de 24 936 infusiones.
Las reacciones adversas informadas por ≥ 4% de los pacientes se enumeran en la Tabla 3 a continuación.
|
MedDRA Primary SOC |
Término preferido |
N = 73 RA (%) |
|
Trastornos de la piel y del tejido subcutáneo |
Erupción cutánea, prurito |
6 (8.2%) |
|
Trastornos generales y condiciones del sitio de administración |
Reacciones en el sitio de infusión |
3 (4.1%) |
|
SOC = Clase de órgano del sistema |
||
Pacientes previamente no tratados (PUP) y pacientes mínimamente tratados (MTP)
En estudios clínicos con PUP y MTP pediátricos, se informaron 29 reacciones adversas en el curso de 9 389 infusiones.
Las reacciones adversas informadas por ≥ 4% de los pacientes se enumeran en la Tabla 4 a continuación.
|
||
|
MedDRA Primary SOC |
Término preferido |
N = 61 RA (%) |
|
Trastornos de la piel y del tejido subcutáneo |
Erupción cutánea, prurito, urticaria |
10 (16%) |
|
Trastornos de la sangre y del sistema linfático |
Inhibición del factor VIII (anticuerpos neutralizantes) |
9 (15%)* |
|
Trastornos generales y condiciones del sitio de administración |
Reacciones en el sitio de infusión |
4 (7%) |
|
SOC = Clase de órgano del sistema |
||
Pacientes mínimamente tratados (PMT) en el estudio de resultados articulares
En el estudio de resultados articulares con PMT pediátricos tratados con profilaxis rutinaria o tratamiento episódico mejorado durante 5,5 años, 46 de los 65 pacientes aleatorizados experimentaron eventos adversos durante la duración del estudio.
|
|||
|
SOC primario MedDRA |
Término preferido |
Brazo de profilaxis
N = 32 |
Brazo episódico mejorado
N = 33 |
|
Procedimientos quirúrgicos y médicos |
Cateterización venosa central, Extracción del catéter |
19 (59%) |
18 (55%)* |
|
Infecciones e infestaciones |
Infección de la vía central |
6 (19%) |
6 (18%) |
|
Trastornos generales y afecciones en el lugar de administración |
Pirexia |
1 (3%) |
4 (12%) |
|
SOC = Clase de órgano y sistema |
|||
Inmunogenicidad
En los estudios clínicos con 73 PTP (definidos como más de 100 días de exposición), un paciente tenía un inhibidor preexistente. En los otros 72 pacientes, seguidos durante más de 4 años, no se observaron inhibidores de novo.
En los estudios clínicos con PUP pediátricos y PMT, se observó el desarrollo de inhibidores en 9 de 60 pacientes (15%), 6 tenían un título alto1 (> 5 BU) y 3 tenían inhibidores de bajo título. Los inhibidores se detectaron en un número mediano de 7 días de exposición (rango 2 a 16 días de exposición).
En el estudio de resultados articulares con Kogenate FS,5 el desarrollo de inhibidores de novo se observó en 8 de 64 pacientes con valores basales negativos (12,5%), 2 pacientes desarrollaron un título alto1 (> 5 BU) y fueron retirados del estudio. Seis pacientes desarrollaron inhibidores de bajo título. Los inhibidores se detectaron en un número mediano de 44 días de exposición (rango 5 a 151 días de exposición).
Los datos sobre inhibidores en PUP se han recogido en varios registros posteriores al comercialización [ver Experiencia Postcomercialización (6.2)].
La detección de la formación de anticuerpos depende de la sensibilidad y especificidad del ensayo. Además, la incidencia observada de positividad de anticuerpos (incluyendo anticuerpos neutralizantes) en un ensayo puede verse influenciada por varios factores como la metodología del ensayo, el manejo de la muestra, el momento de la recogida de la muestra, los tratamientos concomitantes y la enfermedad subyacente. Por estas razones, la comparación de la incidencia de anticuerpos contra Kogenate FS con la incidencia de anticuerpos contra otros productos puede ser engañosa.
6.2 Experiencia postcomercialización
Debido a que las reacciones adversas se notifican voluntariamente de una población de tamaño incierto, no siempre es posible estimar con fiabilidad su frecuencia o establecer una relación causal con la exposición al fármaco. La siguiente reacción adversa ha sido identificada durante el uso posterior a la aprobación de Kogenate FS:
Sistema sensorial – Disgeusia
Inmunogenicidad – Registros postcomercialización
Los datos del estudio Research of Determinants of Inhibitor Development (RODIN)7, el registro nacional francés (FranceCoag)8 y el registro de la Organización de Médicos de los Centros de Hemofilia del Reino Unido (UKHCDO)9 informaron de una tasa de desarrollo de inhibidores en PUP para Kogenate FS del 38%, 50% y 35%, respectivamente, que es comparable a las tasas de inhibidores previamente informadas10 para productos de FVIII. Estos estudios de registro muestran una tendencia hacia un mayor riesgo de desarrollo de inhibidores en PUP, en comparación con el producto de referencia de FVIII. Una encuesta de los centros de hemofilia canadienses11 (2005 a 2012) y datos disponibles del registro europeo de seguridad en hemofilia (EUHASS)12 desde 2009 hasta 2013, informó de una tasa de desarrollo de inhibidores en PUP para Kogenate FS del 42% y 31%, respectivamente, sin que se observaran diferencias estadísticamente significativas entre los productos de FVIII.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgos
No hay datos sobre el uso de Kogenate FS en mujeres embarazadas para informar sobre el riesgo asociado al fármaco. No se han realizado estudios de reproducción en animales con Kogenate FS. Tampoco se sabe si Kogenate FS puede causar daño fetal cuando se administra a una mujer embarazada o afectar la capacidad reproductiva. En la población general de los EE. UU., el riesgo de fondo estimado de defectos de nacimiento mayores y aborto espontáneo en embarazos clínicamente reconocidos es del 2-4% y del 15-20%, respectivamente.
8.2 Lactancia
Resumen de Riesgos
No hay información sobre la presencia de Kogenate FS en la leche materna, los efectos en el lactante amamantado o los efectos en la producción de leche. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de Kogenate FS y cualquier posible efecto adverso en el niño amamantado por Kogenate FS o por la condición materna subyacente.
8.4 Uso Pediátrico
Se han realizado estudios de seguridad y eficacia en pacientes pediátricos previamente no tratados y mínimamente tratados. Los niños, en comparación con los adultos, presentan valores de aclaramiento de factor VIII más altos y, por lo tanto, una vida media más corta y una recuperación del factor VIII más baja. Esto puede deberse a diferencias en la composición corporal.13 Tenga en cuenta esta diferencia en el aclaramiento al dosificar o seguir los niveles de factor VIII en la población pediátrica [ver Farmacología Clínica (12.3)].
Se ha demostrado que el tratamiento profiláctico de rutina en niños de 0 a 2,5 años sin daño articular preexistente reduce el sangrado articular espontáneo y el riesgo de daño articular. Estos datos se pueden extrapolar a edades >2,5–16 años para niños que no tienen daño articular existente [ver Estudios Clínicos (14)].
8.5 Uso Geriátrico
Los estudios clínicos con Kogenate FS no incluyeron pacientes de 65 años o más. La selección de la dosis para un paciente de edad avanzada debe ser individualizada.
11 DESCRIPCIÓN
Kogenate FS Factor VIII Antihemofílico (Recombinante) es un factor de coagulación VIII producido por tecnología de ADN recombinante. Se produce en células de riñón de hámster bebé (BHK) en las que se ha introducido el gen del factor VIII humano.14 El medio de cultivo celular contiene solución de proteína plasmática humana (HPPS) e insulina recombinante, pero no contiene proteínas derivadas de fuentes animales. Kogenate FS es una glicoproteína purificada que consta de múltiples péptidos, incluida una subunidad de 80 kD y varias extensiones de la subunidad de 90 kD. Tiene la misma actividad biológica que el factor VIII derivado del plasma humano. No se añaden proteínas humanas o animales, como la albúmina, durante los procesos de purificación y formulación de Kogenate FS.
El proceso de purificación incluye un paso de inactivación viral con solvente/detergente además del uso de los métodos de purificación de cromatografía de intercambio iónico, cromatografía de inmunoafinidad con anticuerpos monoclonales, junto con otros pasos cromatográficos diseñados para purificar el factor VIII recombinante y eliminar sustancias contaminantes.
Además, el proceso de fabricación se investigó para determinar su capacidad de disminuir la infectividad de un agente experimental de encefalopatía espongiforme transmisible (TSE), considerado como un modelo para los agentes vCJD y CJD.15-19 Se ha demostrado que varios de los pasos individuales de preparación de materia prima y producción en el proceso de fabricación de Kogenate FS disminuyen la infectividad de TSE de ese agente modelo experimental. Estos pasos de reducción de TSE incluyen el paso de separación de la fracción II+III para HPPS (6,0 log10) y un paso de cromatografía de intercambio aniónico (3,6 log10).
Kogenate FS se formula con los siguientes estabilizadores (ver Tabla 6) en el contenedor final y luego se liofiliza. El producto final no contiene ningún conservante. Es una preparación en polvo estéril, no pirogénica, para inyección intravenosa. La administración intravenosa de sacarosa contenida en Kogenate FS no afectará los niveles de glucosa en sangre.
|
Estabilizador |
250 UI, 500 UI, 1000 UI |
2000 UI, 3000 UI |
|
Sacarosa |
0,9–1,3% |
0,9–1,2% |
|
Glicina |
21–25 mg/mL |
20–24 mg/mL |
|
Histidina |
18–23 mmol/L |
17–22 mmol/L |
Tabla 7 enumera los ingredientes inactivos/excipientes también contenidos en el producto final.
|
Ingrediente inactivo/excipiente |
250 UI, 500 UI, 1000 UI |
2000 UI, 3000 UI |
|
Sodio |
27–36 mEq/L |
26–34 mEq/L |
|
Calcio |
2,0–3,0 mmol/L |
1,9–2,9 mmol/L |
|
Cloruro |
32–40 mEq/L |
31–38 mEq/L |
|
Polisorbato 80 |
64–96 µg/mL |
64–96 µg/mL |
|
Sacarosa |
28 mg/vial |
52 mg/vial |
|
Imidazol, fosfato de tri-n-butilo y cobre |
Cantidades traza |
Cantidades traza |
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Kogenate FS reemplaza temporalmente el factor VIII de coagulación faltante que se necesita para una hemostasia efectiva.
12.2 Farmacodinamia
El tiempo de tromboplastina parcial activado (aPTT) está prolongado en pacientes con hemofilia. La determinación de aPTT es un ensayo in vitro convencional para la actividad biológica del factor VIII. El tratamiento con Kogenate FS normaliza el aPTT durante el período de dosificación efectiva.
12.3 Farmacocinética
Las propiedades farmacocinéticas de Kogenate FS se investigaron en dos estudios separados en pacientes adultos y pediátricos previamente tratados (PTPs).
Los estudios farmacocinéticos con Kogenate FS se realizaron en 20 PTP (edades de 12 a 33 años) con hemofilia A grave. Los parámetros farmacocinéticos para Kogenate FS se midieron en un ensayo clínico aleatorizado, cruzado con el producto predecesor KOGENATE utilizando una administración de dosis única de 50 UI por kg. Después de 24 semanas, se administró la misma dosis de Kogenate FS a los mismos pacientes. Los datos de recuperación y vida media para Kogenate FS no cambiaron después de 24 semanas de tratamiento continuo con eficacia sostenida y sin evidencia de inhibición del factor VIII (ver Tabla 8).
|
Parámetro |
Kogenate FS |
KOGENATE |
|
|
PK inicial |
PK en la semana 24 |
Referencia |
|
|
AUC (IU•h/dL) |
1588.05 ± 344.32 |
1487.08 ± 381.73 |
1879.02 ± 412.32 |
|
Cmax (IU/dL) |
114.95 ± 20.19 |
109.42 ± 20.09 |
127.40 ± 33.21 |
|
Vida media (hr) |
13.74 ± 1.82 |
14.60 ± 4.38 |
14.07 ± 2.62 |
|
Recuperación in vivo |
2.20 ± 0.34 |
2.11 ± 0.37 |
2.43 ± 0.60 |
La farmacocinética de Kogenate FS se investigó en PTP pediátricos (4.4–18.1 años de edad, edad promedio 12).13 Los parámetros farmacocinéticos en niños en comparación con adultos muestran diferencias en un aclaramiento más alto, una recuperación in vivo incremental más baja del factor VIII y una vida media del factor VIII más corta. Los parámetros farmacocinéticos se representan en Tabla 9.
|
Parámetro |
Media (rango) |
|
AUC (IU•h/dL) |
1320.0 |
|
Aclaramiento (mL/h•kg) |
4.1 |
|
Vida media (hr) |
10.7 (7.8–15.3) |
|
Recuperación in vivo (IU/dL / IU/kg) |
1.9 (1.25–2.76) |
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogenesis, Mutagenesis, Impairment of Fertility
No se han realizado estudios con Kogenate FS para evaluar su potencial mutagénico o carcinogénico y el deterioro de la fertilidad. Por inferencia, se esperaría que el producto KOGENATE predecesor y Kogenate FS tuvieran un potencial mutagénico y carcinogénico equivalente.
El producto predecesor no demostró mutaciones inversas o aberraciones cromosómicas a dosis sustancialmente mayores que la dosis clínica máxima esperada. La evaluación In vivo con el producto predecesor en animales utilizando dosis que oscilan entre 10 y 40 veces el máximo clínico esperado también indicó que el producto predecesor no poseía potencial mutagénico. No se han realizado investigaciones a largo plazo del potencial carcinogénico en animales debido a la respuesta inmune a las proteínas heterólogas en todas las especies de mamíferos no humanos.
13.2 Animal Toxicology and/or Pharmacology
Los estudios preclínicos que evaluaron Kogenate FS en hemofilia A con ratones, ratas, conejos y perros demostraron una restauración segura y eficaz de la hemostasia. Las dosis varias veces superiores a la dosis clínica recomendada (en relación con el peso corporal) no demostraron ningún efecto tóxico agudo o subagudo para Kogenate FS en animales de laboratorio.
Se ha demostrado que Kogenate FS es comparable al producto KOGENATE predecesor con respecto a sus propiedades bioquímicas y fisicoquímicas, así como a su farmacología y toxicología no clínicas in vivo.
14 ESTUDIOS CLÍNICOS
Estudios clínicos en pacientes previamente tratados (PPT)
Un total de 73 pacientes con hemofilia A grave (≤ 2 % de FVIII), de entre 12 y 59 años de edad, que habían sido tratados previamente con otros productos de FVIII recombinantes o derivados del plasma, fueron tratados hasta por 54 meses en estudios abiertos con Kogenate FS. Durante los estudios se trataron un total de 5684 episodios hemorrágicos; el 92.7 % de las hemorragias se trataron con una (79.7 %) o dos (13.0 %) infusiones. Los pacientes podían ser tratados a demanda o como profilaxis. El tratamiento profiláctico programado regularmente representó el 76 % de todas las infusiones (regímenes de tratamiento de 2 a 3 infusiones por semana).
Un total de 30 pacientes recibieron Kogenate FS para 41 procedimientos quirúrgicos durante los estudios de PPT. Hubo tipos de cirugía tanto menor como mayor, 16 y 25 respectivamente. La eficacia fue medida por el cirujano tratante con base en una comparación de la pérdida de sangre estimada por experiencia con pacientes no hemofílicos sometidos a procedimientos similares. El cirujano o el médico tratante asignaron una calificación al resultado hemostático de acuerdo con 4 categorías: “excelente (pérdida de sangre menor a la esperada)”, “buena (pérdida de sangre como se esperaba)”, “moderada (pérdida de sangre mayor a la esperada)” o “nula (sangrado incontrolado)”. La hemostasia se calificó como satisfactoria (“excelente” o “buena”) en todos los casos.
Estudio clínico en pacientes no tratados previamente (PNTP) y pacientes mínimamente tratados (PMT)
Kogenate FS se ha utilizado en el tratamiento de episodios hemorrágicos en PNTP y PMT pediátricos con hemofilia A grave (< 2 % de FVIII). Hubo 37 PNTP y 24 PMT (definidos como aquellos con un número de días de exposición igual o inferior a 4) tratados con un total de 9419 infusiones de Kogenate FS durante un período de seguimiento de hasta 3.1 años. Se trataron un total de 1047 episodios hemorrágicos; las hemorragias se trataron con una (73 %) o dos (15 %) infusiones.
Se realizaron un total de 27 procedimientos quirúrgicos en 22 pacientes durante el estudio de PNTP y PMT. Hubo tipos de cirugía tanto menor como mayor, 21 y 6 respectivamente. El cirujano tratante midió la eficacia y asignó una calificación al resultado hemostático de acuerdo con 4 categorías, como se describió anteriormente para los PPT. La hemostasia se calificó como satisfactoria (“excelente” o “buena”) en todos los casos.
Profilaxis en adultos para la reducción de la frecuencia de hemorragias
En un estudio clínico prospectivo, aleatorizado, controlado, de grupos paralelos, abierto, multicéntrico, de 3 años de duración, sobre el efecto de la profilaxis sistemática con Kogenate FS en comparación con el uso a demanda sobre la frecuencia de hemorragias en adultos y adolescentes, se incluyeron 84 pacientes PPT con hemofilia A grave (nivel de FVIII < 1 UI/dl), de entre 15 y 50 años de edad. Los pacientes se emparejaron al inicio del estudio en función de sus características demográficas y de la enfermedad. La mediana del número de hemorragias en el año anterior a la inscripción fue de 18.
Los pacientes fueron aleatorizados 1:1 a profilaxis (25 unidades por kg tres veces a la semana) o al uso a demanda de Kogenate FS. Se permitió el aumento de la dosis de profilaxis en 5 unidades por kg/infusión después de los años 1 y 2, hasta un máximo de 35 unidades por kg/infusión.
La frecuencia de hemorragias se analizó en la población por intención de tratar después de una mediana de seguimiento de 1.4 años. Los pacientes que recibieron profilaxis experimentaron significativamente menos hemorragias (p < 0.0001) en comparación con los pacientes tratados a demanda, independientemente de los subgrupos basales examinados, incluyendo la edad, el historial de hemorragias y la presencia o ausencia de articulaciones diana. La razón de la frecuencia media de hemorragias fue de 15.2 (IC del 95 %: 8.5, 27.2; p < 0.0001) para la demanda frente a la profilaxis, lo que indica que los pacientes que recibieron tratamiento a demanda experimentaron una media de 15.2 veces más hemorragias en comparación con los pacientes tratados con profilaxis. Las tasas medias anualizadas de hemorragias (hemorragias/sujeto/año) fueron de 37 en el grupo de demanda frente a 2 en el grupo de profilaxis. La mediana de la tasa anualizada de hemorragias (hemorragias/sujeto/año) en el grupo de demanda fue de 33 frente a cero en el grupo de profilaxis. La mayoría de las hemorragias se produjeron en las articulaciones: la mediana de la tasa de hemorragias articulares (hemorragias articulares/sujeto/año) fue de 24 en el grupo de demanda frente a cero en el grupo de profilaxis. La tasa media anualizada de hemorragias articulares fue de 29 en el grupo de demanda frente a 2 en el grupo de profilaxis.
Veintidós de los 42 (52 %) sujetos con profilaxis no experimentaron ninguna hemorragia, y 12 de los 42 (29 %) sujetos con profilaxis experimentaron solo 1 o 2 hemorragias durante el período de seguimiento.
Entre los pacientes con profilaxis, el número medio de infusiones/semana fue de 2.8, y la mediana de la dosis por infusión de profilaxis fue de 26 unidades por kg.
Profilaxis pediátrica para la reducción del riesgo de daño articular
Se observó a un total de 65 niños menores de 30 meses de edad con hemofilia A grave (nivel de FVIII ≤ 2 UI/dl) y con ≤ 2 hemorragias en cada articulación índice e imágenes articulares basales normales, durante un máximo de 5.5 años en un estudio clínico prospectivo, aleatorizado, controlado, abierto, multicéntrico.5 Los pacientes recibieron 25 UI por kg en días alternos (profilaxis primaria; n = 32) o al menos 3 dosis por un total mínimo de 80 UI por kg en el momento de un episodio hemorrágico (episódico intensificado; n = 33). El daño articular se evaluó mediante resonancia magnética (RM) o radiografía, así como la frecuencia de los episodios hemorrágicos. El daño articular detectado por RM o radiografía en los tobillos, las rodillas y los codos (es decir, las articulaciones índice) fue significativamente menor (p = 0.002) en los sujetos que recibieron tratamiento profiláctico (7 %) que en los sujetos que recibieron tratamiento episódico (42 %). Esto corresponde a un riesgo relativo de daño articular 6.29 veces mayor para los sujetos tratados con terapia episódica intensificada en comparación con la profilaxis. La tasa media de hemorragias de las articulaciones índice para los sujetos con terapia episódica fue de 4.89 hemorragias por año, frente a 0.63 hemorragias por año observadas en el grupo de profilaxis. Tres de los 33 (9.1 %) sujetos del grupo episódico experimentaron hemorragias recurrentes potencialmente mortales (intracraneales, gastrointestinales) en comparación con ningún sujeto del grupo de profilaxis. Por articulación, las articulaciones del grupo de profilaxis regular tenían 8 veces más probabilidades de permanecer libres de daños que las del grupo episódico. El daño articular se observó con mayor frecuencia en las articulaciones del tobillo y se detectó con mayor frecuencia mediante RM que mediante radiografía. Los tobillos fueron también la articulación índice que demostró la mayor frecuencia de episodios hemorrágicos en este estudio (tobillo izquierdo, media de 2.7 hemorragias; tobillo derecho, media de 2.6 hemorragias).
Como se muestra en la Tabla 10 a continuación, la incidencia de daño articular fue significativamente menor en el grupo de profilaxis en comparación con el grupo de tratamiento episódico cuando se evaluó mediante RM, o bien mediante RM o radiografía, utilizando criterios predefinidos (descritos a continuación) para establecer el daño articular. Sin embargo, no hubo diferencias estadísticamente significativas entre los dos grupos cuando el daño articular se evaluó solo mediante radiografía.
Para evaluar el daño articular, se puntuaron las resonancias magnéticas utilizando una escala desarrollada por Nuss et al.,20 y las radiografías se puntuaron utilizando el método de Pettersson et al.21 Ambas escalas han sido validadas en varios ensayos clínicos y se utilizan de forma rutinaria para la evaluación del daño articular en hemofílicos. El daño articular se definió como daño óseo y/o cartilaginoso, incluidos quistes subcondrales, erosiones y pérdida de cartílago con estrechamiento del espacio articular. Esto correspondía a una puntuación total en la resonancia magnética de ≥ 7 o una puntuación en la radiografía de ≥1 en cualquiera de las siguientes categorías: quistes subcondrales, erosiones de las superficies articulares o estrechamiento de los espacios articulares. Las imágenes fueron leídas por separado por dos radiólogos independientes de forma centralizada. Cualquier lectura discrepante fue leída por un tercer radiólogo independiente que no conocía los resultados de la lectura inicial. La lectura concordante de dos de los tres lectores se utilizó para el análisis.
|
Evaluación del Punto Final |
Profilaxis |
Terapia Episódica |
valor p |
||
|
Incidencia (%) |
Riesgo Relativo (IC del 95%) |
Incidencia (%) |
Riesgo Relativo (IC del 95%) |
||
|
MRI |
2/27 (7%) |
0.17 (0.04, 0.67) |
13/29 (45%) |
6.05 (1.50, 24.38) |
0.002 |
|
Radiografía |
1/28 (4%) |
0.19 (0.02, 1.55) |
5/27 (19%) |
5.19 (0.65, 41.54) |
0.101 |
|
MRI o Radiografía |
2/30 (7%) |
0.16 (0.04, 0.65) |
13/31 (42%) |
6.29 (1.55, 25.55) |
0.002 |
El riesgo relativo es el riesgo de daño a una o más articulaciones índice en la terapia dada en comparación con la otra terapia.
El valor p es de la prueba exacta de Fisher de 2 colas que compara la incidencia de daño articular entre los grupos de tratamiento.
15 REFERENCIAS
1. White GC, Rosendaal F, Aledort LM, Lusher JM, Rothschild C, Ingerslev J, for the Factor VIII and Factor IX Subcommittee of the Scientific and Standardization Committee of the International Society on Thrombosis and Haemostasis. Definitions in hemophilia. Thromb Haemost 85:560-75, 2001.
2. Abildgaard CF, Simone JV, Corrigan JJ, et al: Treatment of hemophilia with glycine-precipitated Factor VIII. N Engl J Med 275(9):471–5, 1966.
3. Schwartz RS, Abildgaard CF, Aledort LM, et al: Human recombinant DNA-derived antihemophilic factor (factor VIII) in the treatment of hemophilia A. Recombinant Factor VIII Study Group. N Engl J Med 323(26):1800-5, 1990.
4. White GC 2nd, Courter S, Bray GL, et al: A multicenter study of recombinant factor VIII (Recombinate) in previously treated patients with hemophilia A. The Recombinate Previously Treated Patient Study Group. Thromb Haemost 77(4):660-667, 1997.
5. Manco-Johnson MJ, Abshire TC, Shapiro AD, Riske B, Hacker MR, Kilcoyne R, et al. Prophylaxis versus episodic treatment to prevent joint disease in boys with severe hemophilia. N Engl J Med 2007;357(6):535-44.
6. Kasper CK: Complications of hemophilia A treatment: factor VIII inhibitors. Ann NY Acad Sci 614:97-105, 1991.
7. Gouw SC, van den Berg HM, et al: Intensity of factor VIII treatment and inhibitor development in children with severe hemophilia A: the RODIN study. Blood 121(20): 4046-4055, 2013.
8. Calvez T, Chambost H, et al: Recombinant factor VIII products and inhibitor development in previously untreated boys with severe hemophilia A. Blood 124(23): 3398-3408, 2014.
9. Collins PW, Palmer BP, et al: Factor VIII brand and the incidence of factor VIII inhibitors in previously untreated UK children with severe hemophilia A, 2000-2011. Blood 124(23): 3389-3397, 2014.
10. Franchini M, Coppola A, et al: Systematic Review of the Role of FVIII Concentrates in Inhibitor Development in Previously Untreated Patients with Severe Hemophilia A: A 2013 Update. Semin Throm Hemost (39): 752-766, 2013.
11. Vezina C, Carcao M, et al: Incidence and risk factors for inhibitor development in previously untreated severe haemophilia A patients born between 2005 and 2010. Haemophilia 20(6): 771-776, 2014.
12. Fisher K, Lassila, R, et al. Inhibitor development in haemophilia according to concentrate: Four-year results from the European HAemophilia Safety Surveillance (EUHASS) project. Thromb Haemost 113.4, 2015.
13. Barnes C, Lillicrap D, Pazmino-Canizares J, et al: Farmacocinética del factor VIII recombinante (Kogenate-FS®) en niños y causas de la variabilidad farmacocinética entre pacientes. Haemophilia 12 (Suppl. 4): 40-49, 2006.
14. Lawn RM, Vehar GA: The molecular genetics of hemophilia. Sci Am 254(3):48–54, 1986.
15. Stenland CJ, et al: Partición de las formas humanas y ovinas de la proteína priónica patógena durante la purificación de proteínas terapéuticas del plasma humano. Transfusion 42(11):1497-500, 2002.
16. Lee DC, Miller JL, Petteway SR: Seguridad de los patógenos en los procesos de fabricación de productos biológicos: especial atención a KOGENATE® Bayer. Haemophilia 8(Suppl. 2):6-9, 2002.
17. Lee DC, Stenland CJ, Miller JL, et al: Una relación directa entre la partición de la proteína priónica patógena y la infectividad por encefalopatía espongiforme transmisible durante la purificación de proteínas plasmáticas. Transfusion 41(4):449-55, 2001.
18. Cai K, Miller JL, Stenland CJ, et al: Precipitación de la proteína priónica dependiente del solvente. Biochim Biophys Acta 1597(1):28-35, 2002.
19. Trejo SR, Hotta JA, Lebing W, et al: Evaluación de la reducción de virus y priones en un nuevo proceso de fabricación de inmunoglobulina intravenosa. Vox Sang 84(3):176-87, 2003.
20. Nuss R, Kilcoyne RF, Geraghty S, et al: Hallazgos de la RM en articulaciones hemofílicas tratadas con radiosinoviortesis con desarrollo de una escala de RM del daño articular. Haemophilia 6:162-169, 2000.
21. Pettersson H, Ahlberg A, Nilsson IM: Una clasificación radiológica de la artropatía hemofílica. Clin Orthop Relat Res 149:153-159, 1980.
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Presentación
Kogenate FS con adaptador de vial, con filtro de 15 micrómetros y una jeringa de diluyente prellenada, que en conjunto sirven como un sistema alternativo de reconstitución sin aguja, se suministra en los siguientes tamaños de viales de vidrio de un solo uso. También se proporciona una jeringa de diluyente prellenada que contiene Agua estéril para inyección, USP, un adaptador de vial estéril para reconstitución y un equipo de administración.
|
Número NDC del kit |
Actividad aproximada de FVIII (UI) |
Diluyente (mL) |
|
0026-3782-25 |
250 |
2.5 |
|
0026-3783-35 |
500 |
2.5 |
|
0026-3785-55 |
1000 |
2.5 |
|
0026-3786-65 |
2000 |
5.0 |
|
0026-3787-75 |
3000 |
5.0 |
La actividad real del factor VIII en UI se indica en la etiqueta de cada vial de Kogenate FS. Utilice la potencia real indicada en la etiqueta del vial para calcular la dosis.
Almacenamiento y manipulación
El vial del producto y la jeringa de diluyente no están hechos con látex de caucho natural.
Producto envasado para la venta
- •
- Almacene Kogenate FS a +2°C a +8°C (36°F a 46°F) durante un máximo de 30 meses a partir de la fecha de fabricación. Dentro de este período, Kogenate FS puede almacenarse durante un período de hasta 12 meses a temperaturas de hasta +25°C o 77°F.
- •
- Anote la fecha de inicio del almacenamiento a temperatura ambiente en la caja del producto sin abrir. Una vez almacenado a temperatura ambiente, no vuelva a colocar el producto en el refrigerador. La vida útil expira entonces después del almacenamiento a temperatura ambiente, o después de la fecha de caducidad en el vial del producto, lo que ocurra primero.
- •
- No utilice Kogenate FS después de la fecha de caducidad indicada en el vial.
- •
- No congelar.
- •
- Proteger de la exposición extrema a la luz y almacenar el polvo liofilizado en la caja antes de su uso.
Producto después de la reconstitución
- •
- Después de la reconstitución, almacene la solución de Kogenate FS a temperatura ambiente y administre dentro de las 3 horas.
- •
- Utilice el equipo de administración proporcionado.
17 INFORMACIÓN PARA EL PACIENTE
- •
- Aconseje al paciente que lea el etiquetado del paciente aprobado por la FDA (Información para el paciente e Instrucciones de uso).
- •
- Aconseje a los pacientes que informen a su médico o proveedor de atención médica sobre cualquier reacción adversa o problema que ocurra después de la administración de Kogenate FS.
- •
- Se han reportado reacciones de hipersensibilidad de tipo alérgico con Kogenate FS. Advierta a los pacientes sobre los signos tempranos de reacciones de hipersensibilidad [incluidas urticaria (erupción con picazón), urticaria generalizada, opresión en el pecho, sibilancias, hipotensión] y anafilaxia. Aconseje a los pacientes que suspendan el uso del producto si se presentan estos síntomas y busquen tratamiento de emergencia inmediato con medidas de reanimación como la administración de epinefrina y oxígeno.
- •
- La formación de inhibidores puede ocurrir en cualquier momento en el tratamiento de un paciente con hemofilia A. Aconseje a los pacientes que se pongan en contacto con su médico o centro de tratamiento para recibir tratamiento y/o evaluación adicionales, si experimentan una falta de respuesta clínica a la terapia de reemplazo del factor VIII, ya que esto puede ser una manifestación de un inhibidor.
- •
- Aconseje a los pacientes que consulten con su proveedor de atención médica antes de viajar. Mientras viaja, aconseje a los pacientes que traigan un suministro adecuado de Kogenate FS en función de su régimen actual de tratamiento.
Etiquetado del Paciente Aprobado por la FDA
Información para el paciente
Kogenate FS (kō-jen-ate)
Factor Antihemofílico (Recombinante)
Formulado con Sucrosa
Este folleto resume información importante sobre Kogenate FS con adaptador de vial. Léalo cuidadosamente antes de usar este medicamento. Esta información no reemplaza la conversación con su proveedor de atención médica y no incluye toda la información importante sobre Kogenate FS. Si tiene alguna pregunta después de leer esto, consulte a su proveedor de atención médica.
No intente autoinfundirse a menos que su proveedor de atención médica o centro de hemofilia le haya enseñado cómo hacerlo.
¿Qué es Kogenate FS?
Kogenate FS es un medicamento que se utiliza para reemplazar el factor de coagulación (factor VIII o factor antihemofílico) que falta en las personas con hemofilia A (también llamada hemofilia “clásica”). La hemofilia A es un trastorno hemorrágico hereditario que impide que la sangre coagule normalmente.
Kogenate FS se utiliza para tratar y controlar el sangrado en adultos y niños con hemofilia A. Su proveedor de atención médica puede administrarle Kogenate FS cuando se someta a una cirugía. Kogenate FS puede reducir la cantidad de episodios de sangrado cuando se usa regularmente (profilaxis). Kogenate FS puede reducir el riesgo de daño articular en los niños.
Kogenate FS no se utiliza para tratar la enfermedad de von Willebrand.
¿Quién no debe usar Kogenate FS?
No debe usar Kogenate FS si
- •
- es alérgico a los roedores (como ratones y hámsters).
- •
- es alérgico a cualquier ingrediente de Kogenate FS.
¿Qué debo decirle a mi proveedor de atención médica antes de usar Kogenate FS?
Informe a su proveedor de atención médica sobre todas sus afecciones médicas.
Informe a su proveedor de atención médica y farmacéutico sobre todos los medicamentos que toma, incluidos todos los medicamentos recetados y de venta libre, como los medicamentos de venta libre, los suplementos o los remedios herbales.
Informe a su proveedor de atención médica si le han dicho que tiene una enfermedad cardíaca o si está en riesgo de padecerla.
Informe a su proveedor de atención médica si le han dicho que tiene inhibidores del factor VIII (porque Kogenate FS puede no funcionar para usted).
Informe a su proveedor de atención médica si está embarazada o planea quedar embarazada. No se sabe si Kogenate FS puede dañar a su bebé nonato.
Informe a su proveedor de atención médica si está amamantando. No se sabe si Kogenate FS pasa a la leche.
¿Cuáles son los posibles efectos secundarios de Kogenate FS?
Podría tener una reacción alérgica a Kogenate FS. Llame a su proveedor de atención médica de inmediato y suspenda el tratamiento si presenta
- •
- erupción cutánea o urticaria
- •
- picazón
- •
- opresión en el pecho o la garganta
- •
- dificultad para respirar
- •
- mareos, aturdimiento
- •
- náuseas
- •
- disminución de la presión arterial
Su cuerpo también puede producir anticuerpos, llamados “inhibidores”, contra Kogenate FS, lo que puede impedir que Kogenate FS funcione correctamente. Consulte con su proveedor de atención médica para asegurarse de que lo controlan cuidadosamente con análisis de sangre para detectar el desarrollo de inhibidores del factor VIII.
Otros efectos secundarios comunes de Kogenate FS son
- •
- Reacciones locales en el sitio de inyección (dolor, hinchazón, irritación en el sitio de infusión)
- •
- Infecciones por dispositivo de inyección implantado
Informe a su proveedor de atención médica sobre cualquier efecto secundario que le moleste o que no desaparezca.
Encontrar venas para las inyecciones puede ser difícil en los niños pequeños. Cuando se requieren inyecciones frecuentes, el proveedor de atención médica de su hijo puede proponer colocar un dispositivo quirúrgicamente debajo de la piel para facilitar el acceso al torrente sanguíneo. Estos dispositivos pueden provocar infecciones.
Estos no son todos los posibles efectos secundarios de Kogenate FS. Puede pedirle a su proveedor de atención médica información que esté escrita para profesionales de la salud.
¿Cómo guardo Kogenate FS?
No congele Kogenate FS.
Almacene Kogenate FS a +2°C a +8°C (36°F a 46°F) durante un máximo de 30 meses a partir de la fecha de fabricación. Dentro de este período, Kogenate FS puede almacenarse durante un período de hasta 12 meses a temperaturas de hasta +25°C o 77°F.
Anote claramente la fecha de inicio del almacenamiento a temperatura ambiente en la caja del producto sin abrir. Una vez almacenado a temperatura ambiente, no vuelva a colocar el producto en el refrigerador. El producto caduca después del almacenamiento a temperatura ambiente, o después de la fecha de caducidad en el vial del producto, lo que ocurra primero. Almacene los viales en su caja original y protéjalos de la exposición extrema a la luz.
El producto reconstituido (después de mezclar los productos secos con el diluyente húmedo) debe utilizarse en un plazo de 3 horas y no puede almacenarse.
Deseche cualquier Kogenate FS no utilizado después de la fecha de caducidad.
No utilice Kogenate FS reconstituido si no está claro a ligeramente turbio e incoloro.
¿Qué más debo saber sobre Kogenate FS y la hemofilia A?
Los medicamentos a veces se recetan para fines distintos de los que se enumeran aquí. No utilice Kogenate FS para una afección para la que no esté prescrito. No comparta Kogenate FS con otras personas, incluso si tienen los mismos síntomas que usted.
Este folleto resume la información más importante sobre Kogenate FS. Si desea obtener más información, hable con su proveedor de atención médica. Puede pedirle a su proveedor de atención médica o farmacéutico información sobre Kogenate FS que esté escrita para profesionales de la salud.
Instrucciones de uso
¿Cómo debo tomar Kogenate FS?
No intente autoinfundirse a menos que su proveedor de atención médica o centro de hemofilia le haya enseñado cómo hacerlo.
Consulte las instrucciones paso a paso para reconstituir Kogenate FS al final de este folleto y el folleto específico de instrucciones de infusión proporcionado.
Siempre debe seguir las instrucciones específicas que le dé su proveedor de atención médica. Los pasos que se enumeran a continuación son pautas generales para usar Kogenate FS. Si no está seguro de los procedimientos, llame a su proveedor de atención médica antes de usar.
Llame a su proveedor de atención médica de inmediato si el sangrado no se controla después de usar Kogenate FS.
Su proveedor de atención médica le recetará la dosis que debe tomar.
Es posible que su proveedor de atención médica deba hacerle análisis de sangre de vez en cuando.
Hable con su proveedor de atención médica antes de viajar. Debe planificar llevar suficiente Kogenate FS para su tratamiento durante este tiempo.
Maneje Kogenate FS con cuidado. Deseche todos los materiales, incluido cualquier producto Kogenate FS reconstituido sobrante, en un contenedor adecuado.
Reconstitución y uso de Kogenate FS
Siempre trabaje en una superficie limpia y lávese las manos antes de realizar el siguiente procedimiento. Utilice únicamente los componentes para la reconstitución y la administración que se proporcionan con cada paquete de Kogenate FS. Si un paquete está abierto o dañado, no utilice este componente. Si no se pueden utilizar estos componentes, póngase en contacto con su profesional sanitario. Si tiene alguna pregunta sobre Kogenate FS, póngase en contacto con Bayer al 1-888-84-BAYER (1-888-842-2937).
1. Caliente el diluyente sin abrir y el concentrado a una temperatura que no supere los 37 °C o 99 °F.
2. Retire la tapa protectora del vial (A). Limpie asépticamente el tapón de goma con alcohol, teniendo cuidado de no tocar el tapón de goma.
3. Coloque el vial del producto sobre una superficie firme y antideslizante. Retire la cubierta de papel de la carcasa de plástico del adaptador del vial. No retire el adaptador de la carcasa de plástico. Sosteniendo la carcasa del adaptador, colóquela sobre el vial del producto y presione firmemente hacia abajo (B). El adaptador se encajará sobre la tapa del vial. No retire la carcasa del adaptador en este paso.
4. Sosteniendo la jeringa por el barril, rompa la tapa de la jeringa de la punta (C). No toque la punta de la jeringa con la mano ni con ninguna superficie. Deje la jeringa a un lado para su uso posterior.
5. Ahora retire y deseche la carcasa del adaptador (D).
6. Conecte la jeringa precargada al adaptador roscado del vial girando en el sentido de las agujas del reloj (E).
7. Agarre la varilla del émbolo por la placa superior. Evite tocar los lados y las roscas de la varilla del émbolo. Conecte inmediatamente la varilla del émbolo girándola firmemente en el sentido de las agujas del reloj en el tapón de goma roscado de la jeringa (F).
8. Inyecte el diluyente presionando lentamente la varilla del émbolo hacia abajo (G).
9. Agite suavemente el vial hasta que todo el material se disuelva (H). No agite el vial. Asegúrese de que el polvo esté completamente disuelto. No utilice soluciones que contengan partículas visibles o que estén turbias.
10. Retire la solución en la jeringa sujetando el vial en posición vertical por encima del adaptador del vial y la jeringa (I) y luego extraiga la varilla del émbolo lenta y suavemente. Asegúrese de que todo el contenido del vial se extraiga en la jeringa.
11. Con la varilla del émbolo en su lugar, retire la jeringa del adaptador del vial (este último debe permanecer conectado al vial). Conecte la jeringa al equipo de administración proporcionado e inyecte por vía intravenosa (J). NOTA: siga las instrucciones del equipo de infusión proporcionado.
12. Si el mismo paciente va a recibir más de un frasco, reconstituya cada frasco con la jeringa de diluyente proporcionada y luego combine las soluciones en una jeringa más grande (no proporcionada) y administre como de costumbre.
Velocidad de administración
La dosis completa de Kogenate FS suele poder infundirse en un plazo de 1 a 15 minutos. Sin embargo, su profesional sanitario determinará la velocidad de administración que sea mejor para usted.
Recursos de Bayer disponibles para el paciente:
Para la notificación de reacciones adversas, póngase en contacto con:
Bayer Medical Communications 1-888-84-BAYER (1-888-842-2937)
Póngase en contacto con Bayer para recibir más información sobre el producto:
Servicio de atención al cliente de Kogenate FS 1-888-606-3780
Línea de ayuda de reembolso de Bayer 1-800-288-8374
Para obtener más información, visite www.kogenatefs.com
Bayer HealthCare LLC
Whippany, NJ 07981 USA
Licencia de EE. UU. No. 8
(Titular de la licencia: Bayer Corporation)
Los siguientes son ejemplos representativos del etiquetado de Kogenate FS. Consulte la sección “Presentación” para obtener una lista completa de todos los componentes.
PANEL DE VISUALIZACIÓN PRINCIPAL
Kogenate FS con Adaptador de Vial Caja 250 UI
NDC 0026-3782-25
Kogenate FS
Factor Antihemofílico
(Recombinante)
Formulado con Sucrosa
con Adaptador de Vial
Factor VIII Recombinante
Con Adaptador de Vial para Reconstitución sin Aguja
2.5 mL
Bayer HealthCare
PANEL DE VISUALIZACIÓN PRINCIPAL
Kogenate FS con Adaptador de Vial Caja 500 UI
NDC 0026-3783-35
Kogenate FS
Factor Antihemofílico
(Recombinante)
Formulado con Sucrosa
con Adaptador de Vial
Factor VIII Recombinante
Con Adaptador de Vial para Reconstitución sin Aguja
2.5 mL
Bayer HealthCare
PANEL DE VISUALIZACIÓN PRINCIPAL
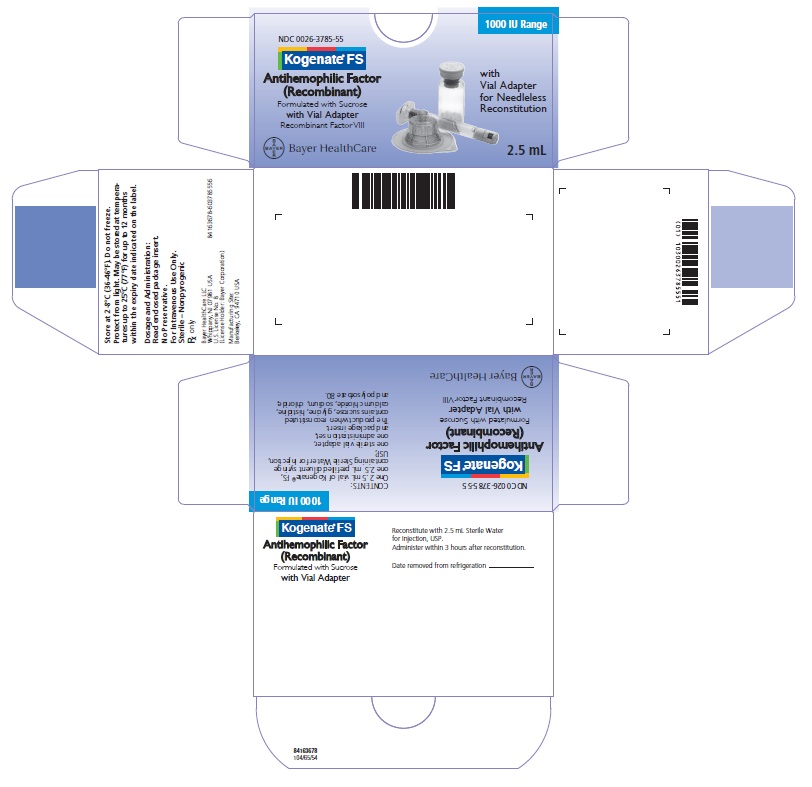
Kogenate FS con Adaptador de Vial Caja 1000 UI
NDC 0026-3785-55
Kogenate FS
Factor Antihemofílico
(Recombinante)
Formulado con Sucrosa
con Adaptador de Vial
Factor VIII Recombinante
Con Adaptador de Vial para Reconstitución sin Aguja
2.5 mL
Bayer HealthCare
PANEL DE VISUALIZACIÓN PRINCIPAL
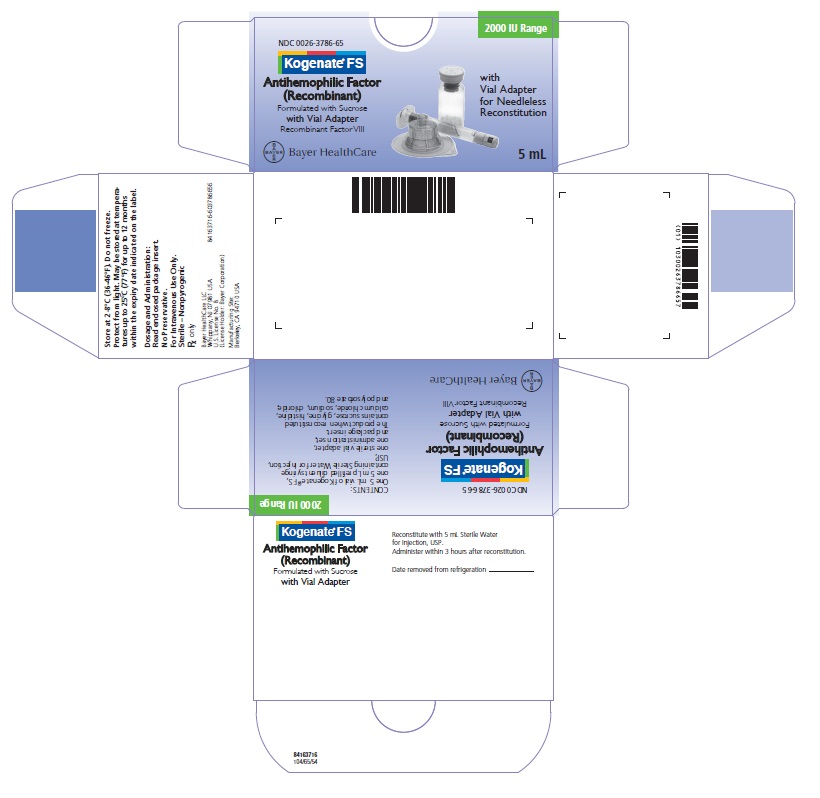
Kogenate FS con Adaptador de Vial Caja 2000 UI
NDC 0026-3786-65
Kogenate FS
Factor Antihemofílico
(Recombinante)
Formulado con Sucrosa
con Adaptador de Vial
Factor VIII Recombinante
Con Adaptador de Vial para Reconstitución sin Aguja
5 mL
Bayer HealthCare
PANEL DE VISUALIZACIÓN PRINCIPAL
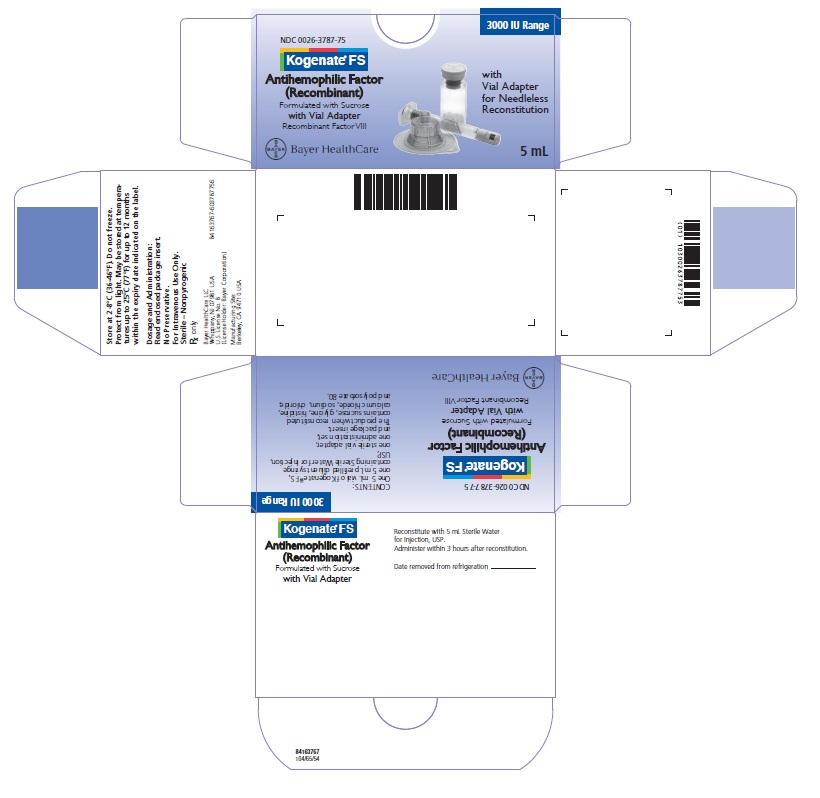
Kogenate FS con Cartón Adaptador de Vial 3000 UI
NDC 0026-3787-75
Kogenate FS
Antihemophilic Factor
(Recombinant)
Formulado con Sacarosa
con Adaptador de Vial
Factor VIII Recombinante
Con Adaptador de Vial para Reconstitución sin Aguja
5 mL
Bayer HealthCare