Fabricante de medicamentos: Boehringer Ingelheim Pharmaceuticals, Inc. (Updated: 2024-10-15)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
JARDIANCE® (comprimidos de empagliflozina), para administración oral
Aprobación inicial en EE. UU.: 2014
CAMBIOS MAYORES RECIENTES
| Indicaciones y uso (1) | 9/2023 |
| Dosificación y administración (2.2) | 9/2023 |
| Dosificación y administración (2.3) | 6/2023 |
| Dosificación y administración (2.4) | 9/2023 |
| Advertencias y precauciones (5.1) | 9/2023 |
| Advertencias y precauciones (5.4) | 6/2023 |
| Advertencias y precauciones (5.7) | 9/2023 |
INDICACIONES Y USO
JARDIANCE es un inhibidor del cotransportador de sodio-glucosa 2 (SGLT2) indicado:
- Para reducir el riesgo de muerte cardiovascular y hospitalización por insuficiencia cardíaca en adultos con insuficiencia cardíaca. (1)
- Para reducir el riesgo de disminución sostenida del eGFR, enfermedad renal en etapa terminal, muerte cardiovascular y hospitalización en adultos con enfermedad renal crónica en riesgo de progresión. (1)
- Para reducir el riesgo de muerte cardiovascular en adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular establecida. (1)
- Como complemento a la dieta y el ejercicio para mejorar el control glucémico en adultos y pacientes pediátricos de 10 años o más con diabetes mellitus tipo 2. (1)
Limitaciones de uso:
- No se recomienda su uso para mejorar el control glucémico en pacientes con diabetes mellitus tipo 1. Puede aumentar el riesgo de cetoacidosis diabética en estos pacientes. (1)
- No se recomienda su uso para mejorar el control glucémico en pacientes con diabetes mellitus tipo 2 con un eGFR inferior a 30 mL/min/1,73 m2. (1)
- No se recomienda para el tratamiento de la enfermedad renal crónica en pacientes con enfermedad renal poliquística o pacientes que requieren o tienen antecedentes recientes de terapia inmunosupresora intravenosa o más de 45 mg de prednisona o equivalente para la enfermedad renal. No se espera que JARDIANCE sea eficaz en estas poblaciones. (1)
DOSIFICACIÓN Y ADMINISTRACIÓN
- Evaluar la función renal antes de iniciar y según esté clínicamente indicado. Evaluar el estado de volumen y corregir la depleción de volumen antes de iniciar. (2.1)
- La dosis recomendada es de 10 mg por vía oral una vez al día por la mañana, con o sin alimentos. (2.2)
- Para un control glucémico adicional, la dosis puede aumentarse a 25 mg por vía oral una vez al día en pacientes que toleran JARDIANCE. (2.2)
- Suspender JARDIANCE durante al menos 3 días, si es posible, antes de una cirugía mayor o procedimientos asociados con ayuno prolongado. (2.4)
FORMAS Y FUERZAS DE DOSIFICACIÓN
Tabletas: 10 mg, 25 mg (3)
CONTRAINDICACIONES
- Hipersensibilidad a empagliflozina o a cualquiera de los excipientes de JARDIANCE. (4)
ADVERTENCIAS Y PRECAUCIONES
- Cetoacidosis diabética en pacientes con diabetes mellitus tipo 1 y otras cetoacidosis: Considerar el control de cetonas en pacientes con diabetes mellitus tipo 1 y considerar el control de cetonas en otros con riesgo de cetoacidosis, según esté indicado. Evaluar la cetoacidosis independientemente de los niveles de glucosa en sangre presentados y suspender JARDIANCE si se sospecha cetoacidosis. Supervisar a los pacientes para la resolución de la cetoacidosis antes de reiniciar. (5.1)
- Depleción de volumen: Antes de iniciar JARDIANCE, evaluar el estado de volumen y la función renal en pacientes con función renal deteriorada, pacientes de edad avanzada o pacientes que toman diuréticos de asa. Supervisar los signos y síntomas durante la terapia. (5.2)
- Urosepsis y pielonefritis: Evaluar a los pacientes para detectar signos y síntomas de infecciones del tracto urinario y tratarlos con prontitud, si está indicado. (5.3)
- Hipoglucemia: Los pacientes adultos que toman un secretagogo de insulina o insulina pueden tener un mayor riesgo de hipoglucemia. En pacientes pediátricos de 10 años o más, el riesgo de hipoglucemia fue mayor independientemente del uso de insulina. Considerar la reducción de la dosis del secretagogo de insulina o la insulina para reducir el riesgo de hipoglucemia al iniciar JARDIANCE. (5.4)
- Fascitis necrosante del perineo (gangrena de Fournier): Se han producido casos graves y potencialmente mortales tanto en mujeres como en hombres. Evaluar a los pacientes que presenten dolor o sensibilidad, eritema o hinchazón en el área genital o perineal, junto con fiebre o malestar general. Si se sospecha, instituir un tratamiento inmediato. (5.5)
- Infecciones micóticas genitales: Supervisar y tratar según sea apropiado. (5.6)
- Amputación de miembros inferiores: Supervisar a los pacientes para detectar infecciones o úlceras de los miembros inferiores e instituir el tratamiento adecuado (5.7)
- Reacciones de hipersensibilidad: Se han producido reacciones de hipersensibilidad graves (por ejemplo, angioedema) con JARDIANCE. Si se producen reacciones de hipersensibilidad, suspender JARDIANCE, tratar con prontitud y supervisar hasta que los signos y síntomas desaparezcan. (5.8)
REACCIONES ADVERSAS
Las reacciones adversas más frecuentes (5% o más de incidencia) fueron infecciones del tracto urinario e infecciones micóticas genitales femeninas (6.1)
Para informar sobre REACCIONES ADVERSAS SOSPECHOSAS, póngase en contacto con Boehringer Ingelheim Pharmaceuticals, Inc. al 1-800-542-6257 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES MEDICAMENTOSAS
Consulte la información completa de prescripción para obtener información sobre las interacciones medicamentosas y la interferencia de JARDIANCE con las pruebas de laboratorio. (7)
USO EN POBLACIONES ESPECÍFICAS
- Embarazo: Advertir a las mujeres sobre el riesgo potencial para el feto, especialmente durante el segundo y tercer trimestre. (8.1)
- Lactancia: No recomendado durante la lactancia. (8.2)
- Pacientes geriátricos: Mayor incidencia de reacciones adversas relacionadas con la depleción de volumen y la reducción de la función renal. (8.5)
- Insuficiencia renal: Mayor incidencia de reacciones adversas relacionadas con la reducción de la función renal. (8.6)
Ver 17 para INFORMACIÓN PARA EL PACIENTE y Guía de Medicamentos.
Revisado: 9/2023
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Pruebas previas al inicio de JARDIANCE
2.2 Dosis recomendada
2.3 Recomendaciones con respecto a la dosis olvidada
2.4 Interrupción temporal para cirugía
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Cetoacidosis diabética en pacientes con diabetes mellitus tipo 1 y otras cetoacidosis
5.2 Depleción de volumen
5.3 Urosepsis y pielonefritis
5.4 Hipoglucemia
5.5 Fascitis necrosante del perineo (gangrena de Fournier)
5.6 Infecciones micóticas genitales
5.7 Amputación de miembro inferior
5.8 Reacciones de hipersensibilidad
6 REACCIONES ADVERSAS
6.1 Experiencia en ensayos clínicos
6.2 Experiencia postcomercialización
7 INTERACCIONES MEDICAMENTOSAS
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso pediátrico
8.5 Uso geriátrico
8.6 Insuficiencia renal
8.7 Insuficiencia hepática
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Ensayos de control glucémico en adultos con diabetes mellitus tipo 2
14.2 Ensayo de control glucémico en pacientes pediátricos de 10 a 17 años con diabetes mellitus tipo 2
14.3 Resultados cardiovasculares en adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular aterosclerótica
14.4 Ensayos de insuficiencia cardíaca en adultos
14.5 Ensayo de enfermedad renal crónica en adultos
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
1 INDICACIONES Y USO
JARDIANCE está indicado:
- para reducir el riesgo de muerte cardiovascular y hospitalización por insuficiencia cardíaca en adultos con insuficiencia cardíaca.
- para reducir el riesgo de disminución sostenida del eGFR, enfermedad renal en etapa terminal, muerte cardiovascular y hospitalización en adultos con enfermedad renal crónica en riesgo de progresión.
- para reducir el riesgo de muerte cardiovascular en adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular establecida.
- como complemento a la dieta y el ejercicio para mejorar el control glucémico en adultos y pacientes pediátricos de 10 años o más con diabetes mellitus tipo 2.
Limitaciones de uso
No se recomienda el uso de JARDIANCE para mejorar el control glucémico en pacientes con diabetes mellitus tipo 1. Puede aumentar el riesgo de cetoacidosis diabética en estos pacientes [ver Advertencias y precauciones (5.1)].
No se recomienda el uso de JARDIANCE para mejorar el control glucémico en pacientes con diabetes mellitus tipo 2 con un eGFR inferior a 30 mL/min/1,73 m2. Es probable que JARDIANCE sea ineficaz en este contexto en función de su mecanismo de acción.
No se recomienda JARDIANCE para el tratamiento de la enfermedad renal crónica en pacientes con enfermedad renal poliquística o pacientes que requieren o tienen antecedentes recientes de terapia inmunosupresora intravenosa o más de 45 mg de prednisona o equivalente para la enfermedad renal [ver Estudios clínicos (14.5)]. No se espera que JARDIANCE sea eficaz en estas poblaciones.
2 DOSIS Y ADMINISTRACIÓN
2.1 Pruebas previas al inicio de JARDIANCE
- Evaluar la función renal antes de iniciar JARDIANCE y según esté clínicamente indicado [ver Advertencias y precauciones (5.2)].
- No se recomienda su uso para el control glucémico en pacientes con un eGFR inferior a 30 mL/min/1,73 m2 [ver Uso en poblaciones específicas (8.6)].
- Evaluar el estado de volumen. En pacientes con depleción de volumen, corregir esta condición antes de iniciar JARDIANCE [ver Advertencias y precauciones (5.2) y Uso en poblaciones específicas (8.5, 8.6)].
2.2 Dosis recomendada
La Tabla 1 presenta la dosis recomendada de JARDIANCE en pacientes adultos y pediátricos de 10 años de edad o mayores.
| Población | Indicación | Dosis recomendada |
|---|---|---|
| Adultos | Reducir el riesgo de muerte cardiovascular y hospitalización en pacientes con insuficiencia cardíaca |
|
| Reducir el riesgo de disminución sostenida del eGFR, enfermedad renal en estadio terminal, muerte cardiovascular y hospitalización en adultos con enfermedad renal crónica en riesgo de progresión. | ||
| Reducir el riesgo de muerte cardiovascular en pacientes con diabetes mellitus tipo 2 con enfermedad cardiovascular establecida | ||
| Control glucémico en diabetes mellitus tipo 2 |
|
|
| Pacientes pediátricos de 10 años de edad o mayores | Control glucémico en diabetes mellitus tipo 2 |
|
2.3 Recomendaciones con respecto a la dosis olvidada
- Si se olvida una dosis, indique a los pacientes que la tomen lo antes posible.
- No duplique la siguiente dosis.
2.4 Interrupción temporal para cirugía
Suspenda JARDIANCE durante al menos 3 días, si es posible, antes de una cirugía mayor o procedimientos asociados con ayuno prolongado. Reanude JARDIANCE cuando el paciente esté clínicamente estable y haya reanudado la ingesta oral [ver Advertencias y precauciones (5.1) y Farmacología clínica (12.2)].
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Tabletas de JARDIANCE disponibles como:
- 10 mg tabletas recubiertas con película de color amarillo pálido, redondas, biconvexas y con bordes biselados, grabadas con “S 10” en un lado y el símbolo de la compañía Boehringer Ingelheim en el otro lado.
- 25 mg tabletas recubiertas con película de color amarillo pálido, ovaladas, biconvexas, grabadas con “S 25” en un lado y el símbolo de la compañía Boehringer Ingelheim en el otro lado.
4 CONTRAINDICACIONES
JARDIANCE está contraindicado en pacientes:
- con hipersensibilidad a empagliflozina o a cualquiera de los excipientes de JARDIANCE, se han producido reacciones como angioedema [ver Advertencias y precauciones (5.8)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Cetoacidosis diabética en pacientes con diabetes mellitus tipo 1 y otras cetoacidosis
En pacientes con diabetes mellitus tipo 1, JARDIANCE aumenta significativamente el riesgo de cetoacidosis diabética, un evento potencialmente mortal, más allá de la tasa de fondo. En ensayos controlados con placebo en pacientes con diabetes mellitus tipo 1, el riesgo de cetoacidosis aumentó marcadamente en los pacientes que recibieron inhibidores del cotransportador 2 de sodio-glucosa (SGLT2) en comparación con los pacientes que recibieron placebo y se ha producido cetoacidosis fatal con JARDIANCE. JARDIANCE no está indicado para el control glucémico en pacientes con diabetes mellitus tipo 1.
La diabetes mellitus tipo 2 y los trastornos pancreáticos (por ejemplo, antecedentes de pancreatitis o cirugía pancreática) también son factores de riesgo de cetoacidosis. Se han notificado casos de cetoacidosis fatal en pacientes con diabetes mellitus tipo 2 que utilizan inhibidores de SGLT2, incluido JARDIANCE, después de su comercialización.
Las condiciones precipitantes de la cetoacidosis diabética u otras cetoacidosis incluyen la subinsulinización debido a la reducción de la dosis de insulina o las dosis perdidas de insulina, la enfermedad febril aguda, la reducción de la ingesta calórica, la dieta cetogénica, la cirugía, la depleción de volumen y el abuso del alcohol.
Los signos y síntomas son consistentes con la deshidratación y la acidosis metabólica grave e incluyen náuseas, vómitos, dolor abdominal, malestar general y dificultad para respirar. Los niveles de glucosa en sangre en la presentación pueden estar por debajo de los que normalmente se esperan para la cetoacidosis diabética (por ejemplo, menos de 250 mg/dL). La cetoacidosis y la glucosuria pueden persistir más tiempo de lo que normalmente se espera. La excreción urinaria de glucosa persiste durante 3 días después de suspender JARDIANCE [ver Farmacología clínica (12.2)]; sin embargo, se han notificado casos de cetoacidosis y/o glucosuria que duran más de 6 días y algunos hasta 2 semanas después de la suspensión de los inhibidores de SGLT2.
Considere la monitorización de cetonas en pacientes con diabetes mellitus tipo 1 y considere la monitorización de cetonas en otros con riesgo de cetoacidosis si lo indica la situación clínica. Evalúe la cetoacidosis independientemente de los niveles de glucosa en sangre que se presenten en los pacientes que presenten signos y síntomas compatibles con acidosis metabólica grave. Si se sospecha cetoacidosis, suspenda JARDIANCE, evalúe y trate la cetoacidosis de inmediato, si se confirma. Controle a los pacientes para que la cetoacidosis se resuelva antes de reiniciar JARDIANCE.
Retenga JARDIANCE, si es posible, en situaciones clínicas temporales que podrían predisponer a los pacientes a la cetoacidosis. Reanude JARDIANCE cuando el paciente esté clínicamente estable y haya reanudado la ingesta oral [ver Dosis y administración (2.4)].
Eduque a todos los pacientes sobre los signos y síntomas de la cetoacidosis e instruya a los pacientes para que suspendan JARDIANCE y busquen atención médica de inmediato si se presentan signos y síntomas.
5.2 Depleción de volumen
JARDIANCE puede causar depleción del volumen intravascular que a veces puede manifestarse como hipotensión sintomática o cambios transitorios agudos en la creatinina [ver Reacciones adversas (6.1)]. Se han notificado casos de lesión renal aguda, algunos de los cuales han requerido hospitalización y diálisis, en pacientes con diabetes mellitus tipo 2 que reciben inhibidores de SGLT2, incluido JARDIANCE, después de su comercialización. Los pacientes con función renal deteriorada (TFG inferior a 60 mL/min/1,73 m2), los pacientes de edad avanzada o los pacientes que toman diuréticos de asa pueden tener un mayor riesgo de depleción de volumen o hipotensión. Antes de iniciar JARDIANCE en pacientes con una o más de estas características, evalúe el estado de volumen y la función renal. En pacientes con depleción de volumen, corrija esta condición antes de iniciar JARDIANCE. Controle los signos y síntomas de depleción de volumen y la función renal después de iniciar el tratamiento.
5.3 Urosepsis y pielonefritis
Se han notificado casos de infecciones graves del tracto urinario, incluida la urosepsis y la pielonefritis que requieren hospitalización, en pacientes que reciben JARDIANCE. El tratamiento con JARDIANCE aumenta el riesgo de infecciones del tracto urinario. Evalúe a los pacientes para detectar signos y síntomas de infecciones del tracto urinario y trate de inmediato, si está indicado [ver Reacciones adversas (6)].
5.4 Hipoglucemia
Se sabe que la insulina y los secretagogos de insulina causan hipoglucemia. En pacientes adultos, el riesgo de hipoglucemia puede aumentar cuando JARDIANCE se utiliza en combinación con secretagogos de insulina (por ejemplo, sulfonilurea) o insulina. En pacientes pediátricos de 10 años o más, el riesgo de hipoglucemia fue mayor con JARDIANCE independientemente del uso de insulina [ver Reacciones adversas (6.1)].
El riesgo de hipoglucemia puede reducirse mediante una reducción de la dosis de sulfonilurea (u otros secretagogos de insulina administrados de forma concomitante) o insulina. Informe a los pacientes que utilizan estos medicamentos concomitantes y a los pacientes pediátricos del riesgo de hipoglucemia y edúquelos sobre los signos y síntomas de la hipoglucemia.
5.5 Fascitis necrosante del perineo (gangrena de Fournier)
Se han identificado casos de fascitis necrosante del perineo (gangrena de Fournier), una infección necrosante rara pero grave y potencialmente mortal que requiere intervención quirúrgica urgente, en pacientes con diabetes mellitus que reciben inhibidores de SGLT2, incluido JARDIANCE. Se han notificado casos tanto en mujeres como en hombres. Los resultados graves han incluido hospitalización, múltiples cirugías y muerte.
Los pacientes tratados con JARDIANCE que presenten dolor o sensibilidad, eritema o hinchazón en el área genital o perineal, junto con fiebre o malestar general, deben ser evaluados para detectar fascitis necrosante. Si se sospecha, inicie el tratamiento inmediatamente con antibióticos de amplio espectro y, si es necesario, desbridamiento quirúrgico. Suspenda JARDIANCE, controle estrechamente los niveles de glucosa en sangre y proporcione una terapia alternativa adecuada para el control glucémico.
5.6 Infecciones micóticas genitales
JARDIANCE aumenta el riesgo de infecciones micóticas genitales [ver Reacciones adversas (6.1)]. Los pacientes con antecedentes de infecciones micóticas genitales crónicas o recurrentes tuvieron más probabilidades de desarrollar infecciones micóticas genitales. Monitorear y tratar según sea apropiado.
5.7 Amputación de miembros inferiores
En algunos estudios clínicos con inhibidores de SGLT2 se ha observado un desequilibrio en la incidencia de amputación de miembros inferiores. En cuatro ensayos de resultados de JARDIANCE, las tasas de eventos de amputación de miembros inferiores fueron de 4.3 y 5.0 eventos por 1,000 años-paciente en el grupo placebo y el grupo de dosis de JARDIANCE 10 mg o 25 mg, respectivamente, con un HR de 1.05 (IC del 95%) (0.81, 1.36).
En un ensayo de resultados cardio-renales a largo plazo [ver Estudios clínicos 14.5], en pacientes con enfermedad renal crónica, se informó la aparición de amputaciones de miembros inferiores con tasas de eventos de 2.9 y 4.3 eventos por 1000 años-paciente en los brazos de tratamiento con placebo y JARDIANCE 10 mg, respectivamente. La amputación del dedo del pie y el mediopié fueron las más frecuentes (21 de 28 pacientes tratados con JARDIANCE 10 mg con amputaciones de miembros inferiores), y algunas involucraron por encima y por debajo de la rodilla. Algunos pacientes tuvieron múltiples amputaciones.
La enfermedad arterial periférica y la infección del pie diabético (incluida la osteomielitis) fueron los eventos médicos precipitantes más comunes que llevaron a la necesidad de una amputación. El riesgo de amputación fue mayor en pacientes con antecedentes de pie diabético, enfermedad arterial periférica (incluida la amputación previa) o diabetes.
Aconseje a los pacientes sobre la importancia del cuidado preventivo rutinario del pie. Monitoree a los pacientes que reciben JARDIANCE para detectar signos y síntomas de infección del pie diabético (incluida la osteomielitis), dolor o sensibilidad nuevos, llagas o úlceras que involucren los miembros inferiores, e instituya el tratamiento adecuado.
5.8 Reacciones de hipersensibilidad
Ha habido informes postcomercialización de reacciones de hipersensibilidad graves (por ejemplo, angioedema) en pacientes tratados con JARDIANCE. Si ocurre una reacción de hipersensibilidad, suspenda JARDIANCE; trate de inmediato según el estándar de atención y controle hasta que los signos y síntomas desaparezcan. JARDIANCE está contraindicado en pacientes con hipersensibilidad a empagliflozina o a cualquiera de los excipientes de JARDIANCE [ver Contraindicaciones (4)].
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas importantes se describen a continuación y en otras partes del etiquetado:
- Cetoacidosis diabética en pacientes con diabetes mellitus tipo 1 y otras cetoacidosis [ver Advertencias y precauciones (5.1)]
- Depleción de volumen [ver Advertencias y precauciones (5.2)]
- Urosepsis y pielonefritis [ver Advertencias y precauciones (5.3)]
- Hipoglucemia [ver Advertencias y precauciones (5.4)]
- Fascitis necrosante del perineo (gangrena de Fournier) [ver Advertencias y precauciones (5.5)]
- Infecciones micóticas genitales [ver Advertencias y precauciones (5.6)]
- Reacciones de hipersensibilidad [ver Advertencias y precauciones (5.8)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica.
JARDIANCE se ha evaluado en ensayos clínicos en pacientes adultos y pediátricos de 10 a 17 años con diabetes mellitus tipo 2, en adultos con insuficiencia cardíaca y en adultos con enfermedad renal crónica. El perfil de seguridad general de JARDIANCE fue generalmente consistente en todas las indicaciones estudiadas.
Ensayos clínicos en adultos con diabetes mellitus tipo 2
Los datos de la Tabla 2 se derivan de un conjunto de cuatro ensayos controlados con placebo de 24 semanas y datos de 18 semanas de un ensayo controlado con placebo con insulina en pacientes adultos con diabetes mellitus tipo 2. JARDIANCE se utilizó como monoterapia en un ensayo y como terapia complementaria en cuatro ensayos [ver Estudios clínicos (14.1)].
Estos datos reflejan la exposición de 1.976 pacientes adultos a JARDIANCE con una duración media de exposición de aproximadamente 23 semanas. Los pacientes recibieron placebo (N=995), JARDIANCE 10 mg (N=999) o JARDIANCE 25 mg (N=977) una vez al día. La edad media de la población fue de 56 años y el 3% tenía más de 75 años. Más de la mitad (55%) de la población era masculina; el 46% era blanca, el 50% era asiática y el 3% era negra o afroamericana. En la línea de base, el 57% de la población tenía diabetes mellitus durante más de 5 años y tenía una hemoglobina A1c (HbA1c) media del 8%. Las complicaciones microvasculares establecidas de la diabetes mellitus en la línea de base incluyeron nefropatía diabética (7%), retinopatía (8%) o neuropatía (16%). La función renal basal fue normal o levemente deteriorada en el 91% de los pacientes y moderadamente deteriorada en el 9% de los pacientes (tasa de filtración glomerular estimada media de 86,8 mL/min/1,73 m2).
La Tabla 2 muestra las reacciones adversas (excluyendo la hipoglucemia) que no estaban presentes en la línea de base, ocurrieron con más frecuencia en los pacientes tratados con JARDIANCE que con placebo y ocurrieron en más del 2% de los pacientes tratados con JARDIANCE.
| Reacciones adversas | Placebo (%) N=995 |
JARDIANCE 10 mg (%) N=999 |
JARDIANCE 25 mg (%) N=977 |
|---|---|---|---|
| aAgrupación de eventos adversos predefinidos, que incluyen, entre otros, infección del tracto urinario, bacteriuria asintomática, cistitis bLas infecciones micóticas genitales femeninas incluyen las siguientes reacciones adversas: infección micótica vulvovaginal, infección vaginal, vulvitis, candidiasis vulvovaginal, infección genital, candidiasis genital, infección genital por hongos, infección del tracto genitourinario, vulvovaginitis, cervicitis, infección urogenital por hongos, vaginitis bacteriana. Los porcentajes se calcularon con el número de sujetos femeninos en cada grupo como denominador: placebo (N=481), JARDIANCE 10 mg (N=443), JARDIANCE 25 mg (N=420). cAgrupación de eventos adversos predefinidos, que incluyen, entre otros, poliuria, polaquiuria y nicturia dLas infecciones micóticas genitales masculinas incluyen las siguientes reacciones adversas: balanitis, balanitis, infecciones genitales por hongos, infección del tracto genitourinario, balanitis por cándida, absceso escrotal, infección peniana. Los porcentajes se calcularon con el número de sujetos masculinos en cada grupo como denominador: placebo (N=514), JARDIANCE 10 mg (N=556), JARDIANCE 25 mg (N=557). |
|||
| Infección del tracto urinarioa | 7.6 | 9.3 | 7.6 |
| Infecciones micóticas genitales femeninasb | 1.5 | 5.4 | 6.4 |
| Infección de las vías respiratorias altas | 3.8 | 3.1 | 4.0 |
| Aumento de la micciónc | 1.0 | 3.4 | 3.2 |
| Dislipidemia | 3.4 | 3.9 | 2.9 |
| Artralgia | 2.2 | 2.4 | 2.3 |
| Infecciones micóticas genitales masculinasd | 0.4 | 3.1 | 1.6 |
| Náuseas | 1.4 | 2.3 | 1.1 |
Se informó sed (incluida la polidipsia) en el 0%, 1.7% y 1.5% para placebo, JARDIANCE 10 mg y JARDIANCE 25 mg, respectivamente.
Depleción de volumen
JARDIANCE causa una diuresis osmótica, que puede conducir a una contracción del volumen intravascular y reacciones adversas relacionadas con la depleción de volumen. En el conjunto de cinco ensayos clínicos controlados con placebo en adultos, las reacciones adversas relacionadas con la depleción de volumen (por ejemplo, presión arterial (ambulatoria) disminuida, presión arterial sistólica disminuida, deshidratación, hipotensión, hipovolemia, hipotensión ortostática y síncope) fueron reportadas por el 0.3%, 0.5% y 0.3% de los pacientes tratados con placebo, JARDIANCE 10 mg y JARDIANCE 25 mg, respectivamente. JARDIANCE puede aumentar el riesgo de hipotensión en pacientes con riesgo de contracción de volumen [ver Uso en poblaciones específicas (8.5, 8.6)].
Aumento de la micción
En el conjunto de cinco ensayos clínicos controlados con placebo en adultos, las reacciones adversas de aumento de la micción (por ejemplo, poliuria, polaquiuria y nicturia) ocurrieron con más frecuencia con JARDIANCE que con placebo (ver Tabla 2). Específicamente, la nicturia fue reportada por el 0.4%, 0.3% y 0.8% de los pacientes tratados con placebo, JARDIANCE 10 mg y JARDIANCE 25 mg, respectivamente.
Hipoglucemia en ensayos clínicos para el control glucémico en adultos con diabetes mellitus tipo 2
La incidencia de hipoglucemia en adultos por ensayo se muestra en la Tabla 3. La incidencia de hipoglucemia aumentó cuando JARDIANCE se administró con insulina o sulfonilurea.
| aEventos hipoglucémicos generales: glucosa plasmática o capilar menor o igual a 70 mg/dL bEventos hipoglucémicos graves: que requieren asistencia independientemente de la glucosa en sangre cConjunto tratado (pacientes que recibieron al menos una dosis del fármaco del ensayo) dLa dosis de insulina no se pudo ajustar durante el período de tratamiento inicial de 18 semanas |
|||
| Monoterapia (24 semanas) | Placebo (n=229) |
JARDIANCE 10 mg (n=224) | JARDIANCE 25 mg (n=223) |
| General (%) | 0.4 | 0.4 | 0.4 |
| Grave (%) | 0 | 0 | 0 |
| En combinación con metformina (24 semanas) | Placebo + Metformina (n=206) |
JARDIANCE 10 mg + Metformina (n=217) |
JARDIANCE 25 mg + Metformina (n=214) |
| General (%) | 0.5 | 1.8 | 1.4 |
| Grave (%) | 0 | 0 | 0 |
| En combinación con metformina + sulfonilurea (24 semanas) |
Placebo (n=225) | JARDIANCE 10 mg + Metformina + Sulfonilurea (n=224) | JARDIANCE 25 mg + Metformina + Sulfonilurea (n=217) |
| General (%) | 8.4 | 16.1 | 11.5 |
| Grave (%) | 0 | 0 | 0 |
| En combinación con pioglitazona +/- metformina (24 semanas) |
Placebo (n=165) | JARDIANCE 10 mg + Pioglitazona +/- Metformina (n=165) |
JARDIANCE 25 mg + Pioglitazona +/- Metformina (n=168) |
| General (%) | 1.8 | 1.2 | 2.4 |
| Grave (%) | 0 | 0 | 0 |
| En combinación con insulina basal +/- metformina (18 semanasd) |
Placebo (n=170) | JARDIANCE 10 mg (n=169) |
JARDIANCE 25 mg (n=155) |
| General (%) | 20.6 | 19.5 | 28.4 |
| Grave (%) | 0 | 0 | 1.3 |
| En combinación con insulina MDI +/-Metformina (18 semanasd) |
Placebo (n=188) | JARDIANCE 10 mg (n=186) |
JARDIANCE 25 mg (n=189) |
| General (%) | 37.2 | 39.8 | 41.3 |
| Grave (%) | 0.5 | 0.5 | 0.5 |
Otras reacciones adversas en ensayos clínicos para el control glucémico en adultos con diabetes mellitus tipo 2
-
Infecciones micóticas genitales: En el grupo de cinco ensayos clínicos controlados con placebo en adultos, la incidencia de infecciones micóticas genitales (por ejemplo, infección micótica vaginal, infección vaginal, infección genital por hongos, candidiasis vulvovaginal y vulvitis) aumentó en pacientes tratados con JARDIANCE en comparación con placebo, ocurriendo en el 0,9%, 4,1% y 3,7% de los pacientes aleatorizados a placebo, JARDIANCE 10 mg y JARDIANCE 25 mg, respectivamente. La interrupción del ensayo debido a la infección genital ocurrió en el 0% de los pacientes tratados con placebo y en el 0,2% de los pacientes tratados con JARDIANCE 10 mg o 25 mg.
Las infecciones micóticas genitales ocurrieron con más frecuencia en pacientes femeninas que en masculinos (ver Tabla 2).
La fimosis ocurrió con más frecuencia en pacientes masculinos tratados con JARDIANCE 10 mg (menos del 0,1%) y JARDIANCE 25 mg (0,1%) que en placebo (0%). -
Infecciones del tracto urinario: En el grupo de cinco ensayos clínicos controlados con placebo en adultos, la incidencia de infecciones del tracto urinario (por ejemplo, infección del tracto urinario, bacteriuria asintomática y cistitis) aumentó en pacientes tratados con JARDIANCE en comparación con placebo (ver Tabla 2). Los pacientes con un historial de infecciones del tracto urinario crónicas o recurrentes tuvieron más probabilidades de sufrir una infección del tracto urinario. La tasa de interrupción del tratamiento debido a infecciones del tracto urinario fue del 0,1%, 0,2% y 0,1% para placebo, JARDIANCE 10 mg y JARDIANCE 25 mg, respectivamente.
Las infecciones del tracto urinario ocurrieron con más frecuencia en pacientes femeninas. La incidencia de infecciones del tracto urinario en pacientes femeninas aleatorizadas a placebo, JARDIANCE 10 mg y JARDIANCE 25 mg fue del 16,6%, 18,4% y 17,0%, respectivamente. La incidencia de infecciones del tracto urinario en pacientes masculinos aleatorizados a placebo, JARDIANCE 10 mg y JARDIANCE 25 mg fue del 3,2%, 3,6% y 4,1%, respectivamente [ver Uso en poblaciones específicas (8.5)].
Ensayo clínico en pacientes pediátricos de 10 a 17 años con diabetes mellitus tipo 2
JARDIANCE se administró a 52 pacientes en un ensayo de 157 pacientes pediátricos de 10 a 17 años con diabetes mellitus tipo 2 con una exposición media a JARDIANCE de 23,8 semanas [ver Estudios clínicos (14.2)]. Las terapias de fondo como complemento a la dieta y el ejercicio incluyeron metformina (51%), una combinación de metformina e insulina (40,1%), insulina (3,2%) o ninguna (5,7%). El promedio de HbA1c en la línea de base fue del 8,0% y la duración media de la diabetes mellitus tipo 2 fue de 2,1 años. La edad media fue de 14,5 años (rango: 10-17 años) y el 51,6% tenían 15 años o más. Aproximadamente, el 50% eran blancos, el 6% eran asiáticos, el 31% eran negros o afroamericanos y el 38% eran de etnia hispana o latina. El promedio de IMC fue de 36,0 kg/m2 y el promedio del puntaje Z del IMC fue de 3,0. Aproximadamente el 25% de la población del ensayo tenía microalbuminuria o macroalbuminuria.
El riesgo de hipoglucemia fue mayor en pacientes pediátricos tratados con JARDIANCE independientemente del uso concomitante de insulina. La hipoglucemia, definida como una glucosa en sangre <54 mg/dL, ocurrió en 10 (19,2%) pacientes y en 4 (7,5%) pacientes tratados con JARDIANCE y placebo, respectivamente. No ocurrieron eventos de hipoglucemia severa (la hipoglucemia severa se definió como un evento que requirió la asistencia de otra persona para administrar activamente carbohidratos, glucagón u otras acciones correctivas).
Ensayos clínicos en adultos con insuficiencia cardíaca
No se identificaron nuevas reacciones adversas en los ensayos EMPEROR-Reduced o EMPEROR-Preserved de insuficiencia cardíaca.
Ensayo clínico en adultos con enfermedad renal crónica
El perfil de seguridad en pacientes con enfermedad renal crónica fue generalmente consistente con el observado en las indicaciones estudiadas. En un ensayo de resultados cardio-renales a largo plazo [ver Estudios clínicos 14.5], en pacientes con enfermedad renal crónica, se informó la ocurrencia de amputaciones de miembro inferior con tasas de eventos de 2,9 y 4,3 eventos por 1.000 pacientes-años en los brazos de tratamiento de placebo y JARDIANCE 10 mg, respectivamente [ver Advertencias y precauciones (5.7)].
Anomalías en las pruebas de laboratorio en ensayos clínicos
Aumentos en la creatinina sérica y disminuciones en el eGFR
El inicio de JARDIANCE causa un aumento en la creatinina sérica y una disminución en el eGFR en las semanas posteriores al inicio del tratamiento y luego estos cambios se estabilizan. En un ensayo en adultos con insuficiencia renal moderada, se observaron cambios medios más grandes. En un ensayo de resultados cardiovasculares a largo plazo, el aumento en la creatinina sérica y la disminución en el eGFR generalmente no superaron 0,1 mg/dL y -9,0 mL/min/1,73 m2, respectivamente, en la semana 4 y se invirtieron después de la interrupción del tratamiento, lo que sugiere que los cambios hemodinámicos agudos pueden desempeñar un papel en los cambios en la función renal observados con JARDIANCE.
Aumento en el colesterol de lipoproteína de baja densidad (LDL-C)
Se observaron aumentos relacionados con la dosis en el colesterol de lipoproteína de baja densidad (LDL-C) en adultos tratados con JARDIANCE. El LDL-C aumentó en un 2,3%, 4,6% y 6,5% en pacientes tratados con placebo, JARDIANCE 10 mg y JARDIANCE 25 mg, respectivamente. El rango de los niveles medios basales de LDL-C fue de 90,3 a 90,6 mg/dL en los grupos de tratamiento.
Aumento en el hematocrito
En un conjunto de cuatro ensayos controlados con placebo en adultos, la mediana del hematocrito disminuyó un 1,3% en el placebo y aumentó un 2,8% en los pacientes tratados con JARDIANCE 10 mg y un 2,8% en los pacientes tratados con JARDIANCE 25 mg. Al final del tratamiento, el 0,6%, el 2,7% y el 3,5% de los pacientes con hematocritos inicialmente dentro del rango de referencia tenían valores por encima del límite superior del rango de referencia con placebo, JARDIANCE 10 mg y JARDIANCE 25 mg, respectivamente.
6.2 Experiencia postcomercialización
Se han identificado reacciones adversas adicionales durante el uso de JARDIANCE después de la aprobación. Debido a que estas reacciones se notifican voluntariamente de una población de tamaño incierto, generalmente no es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos gastrointestinales: Estreñimiento
Infecciones: Fascitis necrosante del perineo (gangrena de Fournier), urosepsis y pielonefritis
Trastornos del metabolismo y la nutrición: Cetoacidosis
Trastornos renales y urinarios: Lesión renal aguda
Trastornos de la piel y del tejido subcutáneo: Angioedema, reacciones cutáneas (p. ej., erupción cutánea, urticaria)
7 INTERACCIONES MEDICAMENTOSAS
Consulte la Tabla 4 para ver las interacciones clínicamente relevantes con JARDIANCE.
| Diuréticos | |
|---|---|
| Impacto clínico | La administración conjunta de empagliflozin con diuréticos provocó un aumento del volumen de orina y de la frecuencia de las micciones, lo que podría aumentar el potencial de depleción de volumen. |
| Intervención | Antes de iniciar el tratamiento con JARDIANCE, evalúe el estado del volumen y la función renal. En pacientes con depleción de volumen, corrija esta condición antes de iniciar el tratamiento con JARDIANCE. Controle los signos y síntomas de la depleción de volumen y la función renal después de iniciar el tratamiento. |
| Insulina o secretagogos de insulina | |
| Impacto clínico | El riesgo de hipoglucemia aumenta cuando se utiliza JARDIANCE en combinación con secretagogos de insulina (p. ej., sulfonilurea) o insulina. |
| Intervención | La administración conjunta de JARDIANCE con un secretagogo de insulina (p. ej., sulfonilurea) o insulina puede requerir dosis más bajas del secretagogo de insulina o de la insulina para reducir el riesgo de hipoglucemia. |
| Litio | |
| Impacto clínico | El uso concomitante de un inhibidor de SGLT2 con litio puede disminuir las concentraciones séricas de litio. |
| Intervención | Controle la concentración sérica de litio con mayor frecuencia durante el inicio del tratamiento con JARDIANCE y los cambios de dosis. |
| Prueba de glucosa en orina positiva | |
| Impacto clínico | Los inhibidores de SGLT2 aumentan la excreción urinaria de glucosa y darán lugar a resultados positivos en las pruebas de glucosa en orina. |
| Intervención | No se recomienda el control glucémico con pruebas de glucosa en orina en pacientes que toman inhibidores de SGLT2. Utilice métodos alternativos para controlar el control glucémico. |
| Interferencia con el ensayo de 1,5-anhidroglucitol (1,5-AG) | |
| Impacto clínico | Las mediciones de 1,5-AG no son fiables para evaluar el control glucémico en pacientes que toman inhibidores de SGLT2. |
| Intervención | No se recomienda el control glucémico con el ensayo de 1,5-AG. Utilice métodos alternativos para controlar el control glucémico. |
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de riesgos
Según los datos de los animales que muestran efectos renales adversos, JARDIANCE no se recomienda durante los segundos y terceros trimestres del embarazo.
Los datos limitados disponibles con JARDIANCE en mujeres embarazadas no son suficientes para determinar un riesgo asociado al fármaco de defectos congénitos mayores y abortos espontáneos. Existen riesgos para la madre y el feto asociados con la diabetes mal controlada durante el embarazo [véase Consideraciones clínicas].
En estudios en animales, se observaron cambios renales adversos en ratas cuando se administró empagliflozina durante un período de desarrollo renal correspondiente a los últimos dos trimestres del embarazo humano. Las dosis de aproximadamente 13 veces la dosis clínica máxima causaron dilataciones de la pelvis renal y los túbulos que fueron reversibles [véase Datos].
El riesgo de fondo estimado de defectos congénitos mayores es del 6% al 10% en mujeres con diabetes pregestacional con una HbA1c > 7 y se ha informado que puede ser tan alto como del 20% al 25% en mujeres con HbA1c > 10. El riesgo de fondo estimado de aborto espontáneo en la población indicada es desconocido. En la población general de EE. UU., el riesgo de fondo estimado de defectos congénitos mayores y abortos espontáneos en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente.
Consideraciones clínicas
Riesgos maternos y/o del embrión/feto asociados a la enfermedad
La diabetes mal controlada durante el embarazo aumenta el riesgo materno de cetoacidosis diabética, preeclampsia, abortos espontáneos, parto prematuro y complicaciones en el parto. La diabetes mal controlada aumenta el riesgo fetal de defectos congénitos mayores, muerte fetal y morbilidad relacionada con macrosomía.
Datos
Datos de animales
La administración de empagliflozina directamente a ratas jóvenes desde el día postnatal (PND) 21 hasta el PND 90 en dosis de 1, 10, 30 y 100 mg/kg/día causó un aumento en el peso renal y dilatación de los túbulos y pelvis renales a 100 mg/kg/día, que se aproxima 13 veces a la dosis clínica máxima de 25 mg, basada en el AUC. Estos hallazgos no se observaron después de un período de recuperación sin fármaco de 13 semanas. Estos resultados ocurrieron con la exposición al fármaco durante los períodos de desarrollo renal en ratas que corresponden al segundo y tercer trimestre tardío del desarrollo renal humano.
En estudios de desarrollo embriofetal en ratas y conejos, se administró empagliflozina durante intervalos que coinciden con el primer trimestre del período de organogénesis en humanos. Las dosis de hasta 300 mg/kg/día, que se aproximan 48 veces (ratas) y 128 veces (conejos) a la dosis clínica máxima de 25 mg (basada en el AUC), no resultaron en efectos adversos en el desarrollo. En ratas, en dosis más altas de empagliflozina que causaron toxicidad materna, aumentaron las malformaciones de los huesos de las extremidades en los fetos a 700 mg/kg/día o 154 veces la dosis clínica máxima de 25 mg. La empagliflozina cruza la placenta y llega a los tejidos fetales en ratas. En el conejo, dosis más altas de empagliflozina resultaron en toxicidad materna y fetal a 700 mg/kg/día, o 139 veces la dosis clínica máxima de 25 mg.
En estudios de desarrollo pre y postnatal en ratas embarazadas, se administró empagliflozina desde el día 6 de gestación hasta el día 20 de lactancia (destete) a dosis de hasta 100 mg/kg/día (aproximadamente 16 veces la dosis clínica máxima de 25 mg) sin toxicidad materna. Se observó un peso corporal reducido en la descendencia en dosis mayores o iguales a 30 mg/kg/día (aproximadamente 4 veces la dosis clínica máxima de 25 mg).
8.2 Lactancia
Resumen de riesgos
Hay información limitada sobre la presencia de JARDIANCE en la leche humana, los efectos de JARDIANCE en el lactante amamantado o los efectos en la producción de leche. La empagliflozina está presente en la leche de ratas lactantes [véase Datos]. Dado que la maduración renal humana ocurre in utero y durante los primeros 2 años de vida cuando puede ocurrir la exposición durante la lactancia, puede haber riesgo para el riñón en desarrollo humano.
Debido al potencial de reacciones adversas graves en un lactante amamantado, incluyendo el potencial de que la empagliflozina afecte el desarrollo renal postnatal, aconsejar a las pacientes que el uso de JARDIANCE no se recomienda mientras estén amamantando.
Datos
La empagliflozina estaba presente a un nivel bajo en los tejidos fetales de ratas después de una dosis oral única a las madres en el día 18 de gestación. En la leche de ratas, la relación media leche/plasma osciló entre 0,634 y 5, y fue mayor que uno de 2 a 24 horas después de la dosis. La relación media máxima leche/plasma de 5 se produjo a las 8 horas después de la dosis, lo que sugiere la acumulación de empagliflozina en la leche. Las ratas jóvenes expuestas directamente a la empagliflozina mostraron un riesgo para el riñón en desarrollo (dilataciones de la pelvis y los túbulos renales) durante la maduración.
8.4 Uso pediátrico
Se ha establecido la seguridad y eficacia de JARDIANCE como complemento de la dieta y el ejercicio para mejorar el control glucémico en pacientes pediátricos de 10 años o mayores con diabetes mellitus tipo 2. El uso de JARDIANCE para esta indicación está respaldado por la evidencia de un ensayo clínico doble ciego, controlado con placebo, de 26 semanas de duración, con un período de extensión de seguridad de tratamiento activo doble ciego de hasta 52 semanas en 157 pacientes pediátricos de 10 a 17 años con diabetes mellitus tipo 2 y un estudio farmacocinético pediátrico [véase Farmacología clínica (12.3) y Estudios clínicos (14.2)]. El perfil de seguridad de los pacientes pediátricos tratados con JARDIANCE fue similar al observado en adultos con diabetes mellitus tipo 2, con la excepción del riesgo de hipoglucemia, que fue mayor en los pacientes pediátricos tratados con JARDIANCE, independientemente del uso concomitante de insulina [véase Advertencias y precauciones (5.4) y Reacciones adversas (6.1)].
No se ha establecido la seguridad y eficacia de JARDIANCE en pacientes pediátricos menores de 10 años como complemento de la dieta y el ejercicio para mejorar el control glucémico en la diabetes mellitus tipo 2.
No se ha establecido la seguridad y eficacia de JARDIANCE en pacientes pediátricos para reducir el riesgo de:
- muerte cardiovascular y hospitalización por insuficiencia cardíaca en pacientes con insuficiencia cardíaca.
- descenso sostenido de la eGFR, enfermedad renal terminal, muerte cardiovascular y hospitalización en pacientes con enfermedad renal crónica con riesgo de progresión.
- muerte cardiovascular en pacientes con diabetes mellitus tipo 2 y enfermedad cardiovascular establecida.
8.5 Uso geriátrico
En los ensayos de control glucémico en pacientes con diabetes mellitus tipo 2, un total de 2721 (32 %) pacientes tratados con JARDIANCE tenían 65 años o más, y 491 (6 %) tenían 75 años o más. Se espera que JARDIANCE tenga una eficacia glucémica disminuida en pacientes de edad avanzada con insuficiencia renal [véase Uso en poblaciones específicas (8.6)]. El riesgo de reacciones adversas relacionadas con la depleción de volumen aumentó en los pacientes de 75 años o más al 2.1 %, 2.3 % y 4.4 % para placebo, JARDIANCE 10 mg y JARDIANCE 25 mg. El riesgo de infecciones del tracto urinario aumentó en los pacientes de 75 años o más al 10.5 %, 15.7 % y 15.1 % en los pacientes asignados aleatoriamente a placebo, JARDIANCE 10 mg y JARDIANCE 25 mg, respectivamente [véase Advertencias y precauciones (5.2) y Reacciones adversas (6.1)].
En los ensayos EMPEROR-Reduced, EMPEROR-Preserved y EMPA-KIDNEY, no se han observado diferencias generales en la seguridad y eficacia entre los pacientes de 65 años o más y los pacientes adultos más jóvenes. EMPEROR-Reduced incluyó a 1188 (64 %) pacientes tratados con JARDIANCE de 65 años o más, y 503 (27 %) pacientes de 75 años o más. EMPEROR-Preserved incluyó a 2402 (80 %) pacientes tratados con JARDIANCE de 65 años o más, y 1281 (43 %) pacientes de 75 años o más. EMPA-KIDNEY incluyó a 2089 (32 %) pacientes tratados con JARDIANCE de 65 años o más, y 1518 (23 %) pacientes de 75 años o más.
8.6 Insuficiencia renal
La eficacia y seguridad de JARDIANCE para el control glucémico se evaluaron en un ensayo con pacientes adultos con diabetes mellitus tipo 2 con insuficiencia renal leve y moderada (eGFR de 30 a menos de 90 ml/min/1.73 m2) [véase Estudios clínicos (14.1)]. En este ensayo, 195 pacientes adultos expuestos a JARDIANCE tenían una eGFR entre 60 y 90 ml/min/1.73 m2, 91 pacientes adultos expuestos a JARDIANCE tenían una eGFR entre 45 y 60 ml/min/1.73 m2 y 97 pacientes expuestos a JARDIANCE tenían una eGFR entre 30 y 45 ml/min/1.73 m2. El beneficio de reducción de la glucosa de JARDIANCE 25 mg disminuyó en pacientes adultos con empeoramiento de la función renal. Los riesgos de insuficiencia renal, reacciones adversas relacionadas con la depleción de volumen y reacciones adversas relacionadas con la infección del tracto urinario aumentaron con el empeoramiento de la función renal [véase Advertencias y precauciones (5.2)]. No se recomienda el uso de JARDIANCE para el control glucémico en pacientes sin enfermedad cardiovascular establecida o factores de riesgo cardiovascular cuando la eGFR es inferior a 30 ml/min/1.73 m2.
JARDIANCE se evaluó en 7020 pacientes adultos con diabetes tipo 2 y enfermedad cardiovascular establecida (eGFR mayor o igual a 30 ml/min/1.73 m2) en el ensayo EMPA-REG OUTCOME, en un total de 9718 pacientes con insuficiencia cardíaca (eGFR mayor o igual a 20 ml/min/1.73 m2) en los ensayos EMPEROR-Reduced y EMPEROR-Preserved, y en 6609 pacientes adultos con enfermedad renal crónica (eGFR de 20 a 90 ml/min/1.73 m2) en el estudio EMPA-KIDNEY. El perfil de seguridad en los subgrupos de eGFR en estos ensayos fue consistente con el perfil de seguridad conocido [véase Reacciones adversas (6.1) y Estudios clínicos (14.3, 14.4, 14.5)].
Los ensayos de eficacia y seguridad con JARDIANCE no incluyeron a pacientes adultos con una eGFR inferior a 20 ml/min/1.73 m2 o en diálisis. Una vez incluidos, los pacientes adultos de los ensayos EMPA-REG OUTCOME, EMPEROR-Reduced, EMPEROR-Preserved y EMPA-KIDNEY no estaban obligados a interrumpir el tratamiento por empeoramiento de la eGFR a menos de 20 ml/min/1.73 m2 o por el inicio de la diálisis [véase Estudios clínicos (14.3, 14.4, 14.5)].
8.7 Insuficiencia hepática
JARDIANCE puede utilizarse en pacientes con insuficiencia hepática [véase Farmacología clínica (12.3)].
10 SOBREDOSIS
En caso de sobredosis con JARDIANCE, considere comunicarse con la línea de ayuda para envenenamiento (1-800-222-1222) o con un toxicólogo médico para obtener recomendaciones adicionales sobre el manejo de la sobredosis. No se ha estudiado la eliminación de empagliflozina por hemodiálisis.
11 DESCRIPCIÓN
Las tabletas de JARDIANCE para administración oral contienen empagliflozina, un inhibidor del SGLT2.
El nombre químico de la empagliflozina es D-Glucitol, 1,5-anhidro-1-C- [4-cloro-3- [[4- [[(3S) – tetrahidro-3-furanil] oxi] fenil] metil] fenil] -, (1S).
Su fórmula molecular es C23H27ClO7 y el peso molecular es 450,91. La fórmula estructural es:
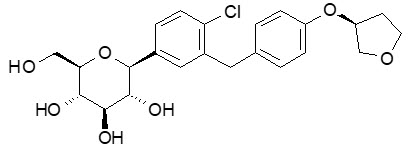
La empagliflozina es un polvo blanco a amarillento, no higroscópico. Es muy poco soluble en agua, escasamente soluble en metanol, ligeramente soluble en etanol y acetonitrilo, soluble en 50% acetonitrilo / agua y prácticamente insoluble en tolueno.
Cada tableta recubierta con película de JARDIANCE contiene 10 mg o 25 mg de empagliflozina (base libre) y los siguientes ingredientes inactivos: dióxido de silicio coloidal, croscarmelosa sódica, hidroxipropilcelulosa, lactosa monohidrato, estearato de magnesio y celulosa microcristalina. Además, el recubrimiento de la película contiene los siguientes ingredientes inactivos: hipromelosa, polietilenglicol, talco, dióxido de titanio y óxido férrico amarillo.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Empagliflozina es un inhibidor de SGLT2, el transportador predominante responsable de la reabsorción de glucosa del filtrado glomerular de vuelta a la circulación. Al inhibir SGLT2, empagliflozina reduce la reabsorción renal de la glucosa filtrada y disminuye el umbral renal para la glucosa, lo que aumenta la excreción urinaria de glucosa.
Empagliflozina también reduce la reabsorción de sodio y aumenta la entrega de sodio al túbulo distal. Esto puede influir en varias funciones fisiológicas, incluyendo, pero no limitado a, aumentar la retroalimentación tubuloglomerular y reducir la presión intraglomerular, disminuir la precarga y la poscarga del corazón y disminuir la actividad simpática.
12.2 Farmacodinamia
Excreción urinaria de glucosa
En pacientes con diabetes mellitus tipo 2, la excreción urinaria de glucosa aumentó inmediatamente después de una dosis de empagliflozina y se mantuvo al final de un período de tratamiento de 4 semanas, promediando aproximadamente 64 gramos por día con 10 mg de empagliflozina y 78 gramos por día con 25 mg de empagliflozina una vez al día [ver Estudios clínicos (14)]. Los datos de dosis únicas orales de empagliflozina en sujetos sanos indican que, en promedio, la elevación en la excreción urinaria de glucosa se acerca a la línea de base en aproximadamente 3 días para las dosis de 10 mg y 25 mg.
Volumen urinario
En un estudio de 5 días, el aumento medio del volumen de orina de 24 horas desde la línea de base fue de 341 mL en el día 1 y 135 mL en el día 5 del tratamiento con empagliflozina 25 mg una vez al día.
Electrofisiología cardíaca
En un estudio aleatorizado, controlado con placebo, con comparador activo y cruzado, se administraron a 30 sujetos sanos una dosis única oral de empagliflozina 25 mg, empagliflozina 200 mg (8 veces la dosis máxima), moxifloxacina y placebo. No se observó ningún aumento en el QTc con empagliflozina de 25 mg o 200 mg.
12.3 Farmacocinética
La farmacocinética de empagliflozina se ha caracterizado en voluntarios sanos y pacientes con diabetes mellitus tipo 2 y no se observaron diferencias clínicamente relevantes entre las dos poblaciones. El AUC y Cmax plasmáticos medios en estado estacionario fueron de 1.870 nmol∙h/L y 259 nmol/L, respectivamente, con el tratamiento con 10 mg de empagliflozina una vez al día, y de 4.740 nmol∙h/L y 687 nmol/L, respectivamente, con el tratamiento con 25 mg de empagliflozina una vez al día. La exposición sistémica a empagliflozina aumentó de forma proporcional a la dosis en el rango de dosis terapéutico. Empagliflozina no parece tener características farmacocinéticas dependientes del tiempo. Después de la dosificación una vez al día, se observó una acumulación de hasta el 22%, con respecto al AUC plasmático, en estado estacionario.
Absorción
Después de la administración oral, las concentraciones plasmáticas máximas de empagliflozina se alcanzaron a las 1,5 horas después de la dosis. La administración de 25 mg de empagliflozina después de la ingesta de una comida rica en grasas y calorías dio como resultado una exposición ligeramente menor; el AUC disminuyó aproximadamente un 16% y la Cmax disminuyó aproximadamente un 37%, en comparación con la condición de ayuno. El efecto observado de los alimentos en la farmacocinética de empagliflozina no se consideró clínicamente relevante y empagliflozina puede administrarse con o sin alimentos.
Distribución
El volumen de distribución aparente en estado estacionario se estimó en 73,8 L según un análisis farmacocinético poblacional. Después de la administración de una solución oral de [14C]-empagliflozina a sujetos sanos, la partición de los glóbulos rojos fue aproximadamente del 36,8% y la unión a proteínas plasmáticas fue del 86,2%.
Eliminación
La vida media de eliminación terminal aparente de empagliflozina se estimó en 12,4 h y el aclaramiento oral aparente fue de 10,6 L/h según el análisis farmacocinético poblacional.
Metabolismo
No se detectaron metabolitos principales de empagliflozina en el plasma humano y los metabolitos más abundantes fueron tres conjugados de glucurónido (2-O-, 3-O- y 6-O-glucurónido). La exposición sistémica de cada metabolito fue inferior al 10% del material total relacionado con el fármaco. Los estudios in vitro sugirieron que la ruta principal de metabolismo de empagliflozina en humanos es la glucuronidación por las uridina 5′-difosfato-glucuronosiltransferasas UGT2B7, UGT1A3, UGT1A8 y UGT1A9.
Excreción
Después de la administración de una solución oral de [14C]-empagliflozina a sujetos sanos, aproximadamente el 95,6% de la radiactividad relacionada con el fármaco se eliminó en las heces (41,2%) o en la orina (54,4%). La mayoría de la radiactividad relacionada con el fármaco recuperada en las heces fue fármaco original sin cambios y aproximadamente la mitad de la radiactividad relacionada con el fármaco excretada en la orina fue fármaco original sin cambios.
Poblaciones específicas
Pacientes pediátricos
La farmacocinética y la farmacodinamia de empagliflozina se investigaron en pacientes pediátricos de 10 a 17 años con diabetes mellitus tipo 2. La administración oral de empagliflozina a 10 mg y 25 mg dio como resultado una exposición dentro del rango observado en pacientes adultos.
Efectos de la edad, el índice de masa corporal, el sexo y la raza
La edad, el índice de masa corporal (IMC), el sexo y la raza (asiáticos frente a principalmente blancos) no tienen un efecto clínicamente significativo en la farmacocinética de la empagliflozina.
Pacientes con insuficiencia hepática
En pacientes adultos con insuficiencia hepática leve, moderada y grave según la clasificación de Child-Pugh, el AUC de empagliflozina aumentó aproximadamente un 23%, un 47% y un 75%, y la Cmax aumentó aproximadamente un 4%, un 23% y un 48%, respectivamente, en comparación con los sujetos con función hepática normal.
Pacientes con insuficiencia renal
En pacientes adultos con diabetes mellitus tipo 2 con insuficiencia renal leve (eGFR: 60 a menos de 90 mL/min/1,73 m2), moderada (eGFR: 30 a menos de 60 mL/min/1,73 m2) y grave (eGFR: menos de 30 mL/min/1,73 m2) y pacientes en diálisis debido a insuficiencia renal, el AUC de empagliflozina aumentó aproximadamente un 18%, un 20%, un 66% y un 48%, respectivamente, en comparación con los sujetos con función renal normal. Los niveles plasmáticos máximos de empagliflozina fueron similares en pacientes con insuficiencia renal moderada y pacientes en diálisis debido a insuficiencia renal en comparación con los sujetos con función renal normal. Los niveles plasmáticos máximos de empagliflozina fueron aproximadamente un 20% más altos en pacientes con insuficiencia renal leve y grave en comparación con los pacientes con función renal normal. El análisis farmacocinético poblacional mostró que la depuración oral aparente de empagliflozina disminuyó, con una disminución en el eGFR que condujo a un aumento en la exposición al fármaco. Sin embargo, la fracción de empagliflozina que se excretó sin cambios en la orina y la excreción de glucosa urinaria disminuyeron con la disminución del eGFR.
Estudios de interacción medicamentosa
In vitro Evaluación de interacciones medicamentosas
La empagliflozina no inhibe, inactiva ni induce las isoformas del CYP450. Los datos in vitro sugieren que la ruta principal de metabolismo de la empagliflozina en humanos es la glucuronidación por las uridina 5′-difosfato-glucuronosiltransferasas UGT1A3, UGT1A8, UGT1A9 y UGT2B7. La empagliflozina no inhibe UGT1A1, UGT1A3, UGT1A8, UGT1A9 o UGT2B7. Por lo tanto, no se anticipa ningún efecto de la empagliflozina sobre los fármacos administrados concomitantemente que son sustratos de las principales isoformas del CYP450 o UGT1A1, UGT1A3, UGT1A8, UGT1A9 o UGT2B7. No se ha evaluado el efecto de la inducción de UGT (por ejemplo, inducción por rifampicina o cualquier otro inductor de la enzima UGT) sobre la exposición a la empagliflozina.
La empagliflozina es un sustrato de la glicoproteína P (P-gp) y la proteína de resistencia al cáncer de mama (BCRP), pero no inhibe estos transportadores de eflujo a dosis terapéuticas. Con base en estudios in vitro, es poco probable que la empagliflozina cause interacciones con fármacos que son sustratos de la P-gp. La empagliflozina es un sustrato de los transportadores de captación humanos OAT3, OATP1B1 y OATP1B3, pero no OAT1 y OCT2. La empagliflozina no inhibe ninguno de estos transportadores de captación humanos a concentraciones plasmáticas clínicamente relevantes y, por lo tanto, no se anticipa ningún efecto de la empagliflozina sobre los fármacos administrados concomitantemente que son sustratos de estos transportadores de captación.
In vivo Evaluación de interacciones medicamentosas
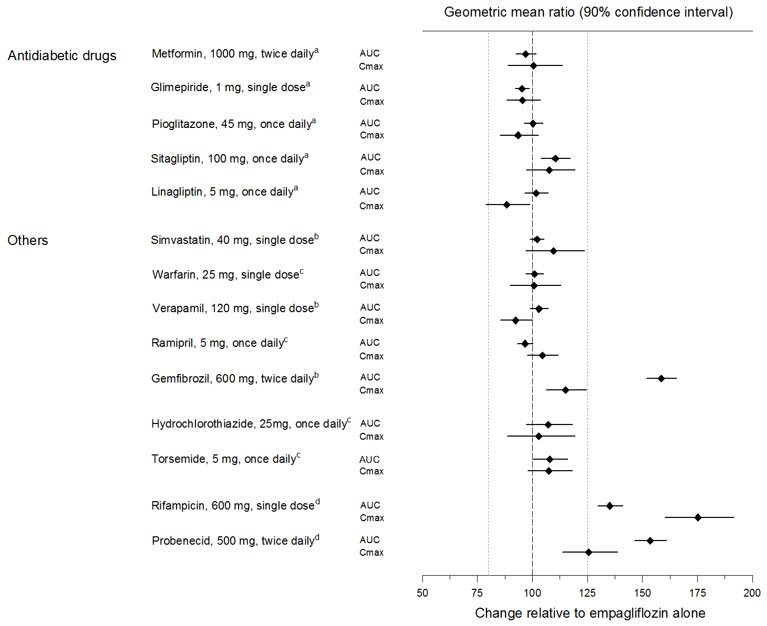
La farmacocinética de la empagliflozina fue similar con y sin la coadministración de metformina, glimepirida, pioglitazona, sitagliptina, linagliptina, warfarina, verapamilo, ramipril y simvastatina en voluntarios sanos y con o sin la coadministración de hidroclorotiazida y torsemida en pacientes con diabetes mellitus tipo 2 (ver Figura 1). En sujetos con función renal normal, la coadministración de empagliflozina con probenecid dio como resultado una disminución del 30% en la fracción de empagliflozina excretada en la orina sin ningún efecto en la excreción de glucosa urinaria de 24 horas. Se desconoce la relevancia de esta observación para los pacientes con insuficiencia renal.
| aempagliflozina, 50 mg, una vez al día; bempagliflozina, 25 mg, dosis única; cempagliflozina, 25 mg, una vez al día; dempagliflozina, 10 mg, dosis única |
 |
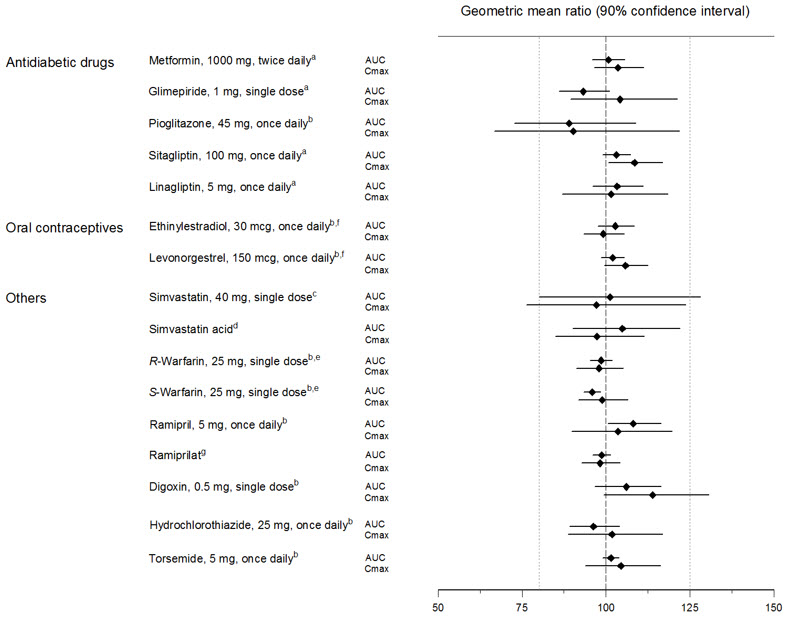
Empagliflozina no tuvo un efecto clínicamente relevante en la farmacocinética de metformina, glimepirida, pioglitazona, sitagliptina, linagliptina, warfarina, digoxina, ramipril, simvastatina, hidroclorotiazida, torsemida y anticonceptivos orales cuando se administró conjuntamente en voluntarios sanos (ver Figura 2).
| aempagliflozina, 50 mg, una vez al día; bempagliflozina, 25 mg, una vez al día; cempagliflozina, 25 mg, dosis única; dadministrado como simvastatina; eadministrado como mezcla racémica de warfarina; fadministrado como Microgynon®; gadministrado como ramipril |
 |
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Carcinogénesis
La carcinogénesis se evaluó en estudios de 2 años realizados en ratones CD-1 y ratas Wistar. Empagliflozina no aumentó la incidencia de tumores en ratas hembras dosificadas a 100, 300 o 700 mg/kg/día (hasta 72 veces la exposición de la dosis clínica máxima de 25 mg). En ratas machos, los hemangiomas del ganglio linfático mesentérico aumentaron significativamente a 700 mg/kg/día o aproximadamente 42 veces la exposición de una dosis clínica de 25 mg. Empagliflozina no aumentó la incidencia de tumores en ratones hembras dosificados a 100, 300 o 1,000 mg/kg/día (hasta 62 veces la exposición de una dosis clínica de 25 mg). Se observaron adenomas y carcinomas del túbulo renal en ratones machos a 1,000 mg/kg/día, lo que es aproximadamente 45 veces la exposición de la dosis clínica máxima de 25 mg. Estos tumores pueden estar asociados con una vía metabólica predominantemente presente en el riñón del ratón macho.
14 ESTUDIOS CLÍNICOS
14.1 Ensayos de control glucémico en adultos con diabetes mellitus tipo 2
JARDIANCE se ha estudiado como monoterapia y en combinación con metformina, sulfonilurea, pioglitazona, linagliptina e insulina. JARDIANCE también se ha estudiado en pacientes con diabetes mellitus tipo 2 con insuficiencia renal leve o moderada.
En pacientes adultos con diabetes mellitus tipo 2, el tratamiento con JARDIANCE redujo la hemoglobina A1c (HbA1c), en comparación con placebo. La reducción en HbA1c para JARDIANCE en comparación con placebo se observó en todos los subgrupos, incluidos el sexo, la raza, la región geográfica, el IMC basal y la duración de la enfermedad.
Monoterapia
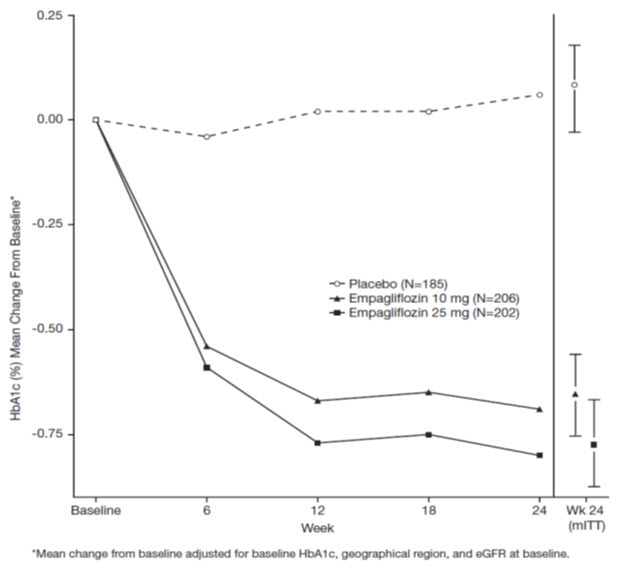
Un total de 986 pacientes con diabetes mellitus tipo 2 participaron en un ensayo doble ciego controlado con placebo para evaluar la eficacia de la monoterapia con JARDIANCE.
Los pacientes sin tratamiento previo con diabetes mellitus tipo 2 mal controlada ingresaron a un período de inclusión abierto con placebo durante 2 semanas. Al final del período de inclusión, los pacientes que permanecieron mal controlados y tenían una HbA1c entre 7% y 10% fueron aleatorizados a placebo, JARDIANCE 10 mg, JARDIANCE 25 mg o un comparador de referencia.
En la semana 24, el tratamiento con JARDIANCE 10 mg o 25 mg diarios proporcionó reducciones estadísticamente significativas en HbA1c (valor p <0,0001), glucosa plasmática en ayunas (FPG) y peso corporal en comparación con placebo (ver Tabla 5 y Figura 3).
| JARDIANCE 10 mg N=224 |
JARDIANCE 25 mg N=224 |
Placebo N=228 |
|
|---|---|---|---|
| aPoblación modificada de intención de tratar. Se utilizó la última observación en el ensayo (LOCF) para imputar los datos faltantes en la semana 24. En la semana 24, se imputó el 9,4%, el 9,4% y el 30,7% para los pacientes aleatorizados a JARDIANCE 10 mg, JARDIANCE 25 mg y placebo, respectivamente. bValor p derivado de ANCOVA <0,0001 (HbA1c: el modelo ANCOVA incluye HbA1c basal, tratamiento, función renal y región. Peso corporal y FPG: se utilizó el mismo modelo que para HbA1c, pero además se incluyó el peso corporal basal/FPG basal, respectivamente). cFPG (mg/dL); para JARDIANCE 10 mg, n=223, para JARDIANCE 25 mg, n=223 y para placebo, n=226 |
|||
| HbA1c (%)a | |||
| Basal (media) | 7,9 | 7,9 | 7,9 |
| Cambio desde el basal (media ajustada) | -0,7 | -0,8 | 0,1 |
| Diferencia con respecto al placebo (media ajustada) (IC del 97,5%) | -0,7b (-0,9, -0,6) | -0,9b (-1,0, -0,7) | — |
| Pacientes [n (%)] que alcanzan HbA1c <7% | 72 (35%) | 88 (44%) | 25 (12%) |
| FPG (mg/dL)c | |||
| Basal (media) | 153 | 153 | 155 |
| Cambio desde el basal (media ajustada) | -19 | -25 | 12 |
| Diferencia con respecto al placebo (media ajustada) (IC del 95%) | -31 (-37, -26) | -36 (-42, -31) | — |
| Peso corporal | |||
| Basal (media) en kg | 78 | 78 | 78 |
| % de cambio desde el basal (media ajustada) | -2,8 | -3,2 | -0,4 |
| Diferencia con respecto al placebo (media ajustada) (IC del 95%) | -2,5b (-3,1, -1,9) | -2,8b (-3,4, -2,2) | — |
 |
A la semana 24, la presión arterial sistólica se redujo de manera estadísticamente significativa en comparación con el placebo en -2,6 mmHg (ajustado por placebo, valor p = 0,0231) en los pacientes aleatorizados a 10 mg de JARDIANCE y en -3,4 mmHg (corregido por placebo, valor p = 0,0028) en los pacientes aleatorizados a 25 mg de JARDIANCE.
Terapia de combinación adicional con metformina
Un total de 637 pacientes con diabetes mellitus tipo 2 participaron en un ensayo doble ciego controlado con placebo para evaluar la eficacia de JARDIANCE en combinación con metformina.
Los pacientes con diabetes mellitus tipo 2 inadecuadamente controlados con al menos 1.500 mg de metformina por día ingresaron a un período de inclusión abierto de 2 semanas con placebo. Al final del período de inclusión, los pacientes que permanecieron inadecuadamente controlados y tenían una HbA1c entre 7% y 10% fueron aleatorizados a placebo, JARDIANCE 10 mg o JARDIANCE 25 mg.
A la semana 24, el tratamiento con JARDIANCE 10 mg o 25 mg diarios proporcionó reducciones estadísticamente significativas en HbA1c (valor p <0,0001), FPG y peso corporal en comparación con el placebo (ver Tabla 6).
| JARDIANCE 10 mg N=217 |
JARDIANCE 25 mg N=213 |
Placebo N=207 |
|
|---|---|---|---|
| aPoblación modificada de intención de tratar. Se utilizó la última observación en el ensayo (LOCF) para imputar los datos faltantes a la semana 24. A la semana 24, se imputó el 9,7%, el 14,1% y el 24,6% para los pacientes aleatorizados a JARDIANCE 10 mg, JARDIANCE 25 mg y placebo, respectivamente. bValor p de ANCOVA <0,0001 (HbA1c: el modelo de ANCOVA incluye HbA1c basal, tratamiento, función renal y región. Peso corporal y FPG: se utilizó el mismo modelo que para HbA1c, pero además se incluyó el peso corporal basal/FPG basal, respectivamente). cFPG (mg/dL); para JARDIANCE 10 mg, n=216, para JARDIANCE 25 mg, n=213 y para placebo, n=207 |
|||
| HbA1c (%)a | |||
| Basal (media) | 7,9 | 7,9 | 7,9 |
| Cambio desde el basal (media ajustada) | -0,7 | -0,8 | -0,1 |
| Diferencia del placebo + metformina (media ajustada) (IC del 95%) | -0,6b (-0,7, -0,4) | -0,6b (-0,8, -0,5) | — |
| Pacientes [n (%)] que alcanzan HbA1c <7% | 75 (38%) | 74 (39%) | 23 (13%) |
| FPG (mg/dL)c | |||
| Basal (media) | 155 | 149 | 156 |
| Cambio desde el basal (media ajustada) | -20 | -22 | 6 |
| Diferencia del placebo + metformina (media ajustada) | -26 | -29 | — |
| Peso corporal | |||
| Media basal en kg | 82 | 82 | 80 |
| % de cambio desde el basal (media ajustada) | -2,5 | -2,9 | -0,5 |
| Diferencia del placebo (media ajustada) (IC del 95%) | -2,0b (-2,6, -1,4) | -2,5b (-3,1, -1,9) | — |
En la semana 24, la presión arterial sistólica se redujo estadísticamente de manera significativa en comparación con el placebo en -4,1 mmHg (corregido por placebo, valor p <0,0001) para JARDIANCE 10 mg y -4,8 mmHg (corregido por placebo, valor p <0,0001) para JARDIANCE 25 mg.
Terapia de combinación inicial con metformina
Un total de 1.364 pacientes con diabetes mellitus tipo 2 participaron en un ensayo doble ciego, aleatorizado y controlado con activo para evaluar la eficacia de JARDIANCE en combinación con metformina como terapia inicial en comparación con los componentes individuales correspondientes.
Los pacientes sin tratamiento previo con diabetes mellitus tipo 2 inadecuadamente controlada ingresaron a un período de inclusión abierto con placebo durante 2 semanas. Al final del período de inclusión, los pacientes que permanecieron inadecuadamente controlados y tenían una HbA1c entre 7% y 10,5% fueron aleatorizados a uno de los 8 brazos de tratamiento activo: JARDIANCE 10 mg o 25 mg; metformina 1.000 mg o 2.000 mg; JARDIANCE 10 mg en combinación con 1.000 mg o 2.000 mg de metformina; o JARDIANCE 25 mg en combinación con 1.000 mg o 2.000 mg de metformina.
En la semana 24, la terapia inicial de JARDIANCE en combinación con metformina proporcionó reducciones estadísticamente significativas en HbA1c (valor p <0,01) en comparación con los componentes individuales (ver Tabla 7).
| JARDIANCE 10 mg + Metformina 1.000 mga N=161 |
JARDIANCE 10 mg + Metformina 2.000 mga N=167 |
JARDIANCE 25 mg + Metformina 1.000 mga N=165 |
JARDIANCE 25 mg + Metformina 2.000 mga N=169 |
JARDIANCE 10 mg N=169 |
JARDIANCE 25 mg N=163 |
Metformina 1.000 mga N=167 |
Metformina 2.000 mga N=162 |
|
|---|---|---|---|---|---|---|---|---|
| aDosis diaria total de metformina, administrada en dos dosis igualmente divididas por día. bValor p ≤0,0062 (población de intención de tratar modificada [caso observado] modelo MMRM incluyó tratamiento, función renal, región, visita, interacción visita por tratamiento y HbA1c basal). cValor p ≤0,0056 (población de intención de tratar modificada [caso observado] modelo MMRM incluyó tratamiento, función renal, región, visita, interacción visita por tratamiento y HbA1c basal). |
||||||||
| HbA1c (%) | ||||||||
| Basal (media) | 8,7 | 8,7 | 8,8 | 8,7 | 8,6 | 8,9 | 8,7 | 8,6 |
| Cambio desde el basal (media ajustada) | -2,0 | -2,1 | -1,9 | -2,1 | -1,4 | -1,4 | -1,2 | -1,8 |
| Comparación vs JARDIANCE (media ajustada) (IC del 95%) | -0,6b (-0,9, -0,4) |
-0,7b (-1,0, -0,5) |
-0,6c (-0,8, -0,3) |
-0,7c (-1,0, -0,5) |
— | — | — | — |
| Comparación vs metformina (media ajustada) (IC del 95%) | -0,8b (-1,0, -0,6) |
-0,3b (-0,6, -0,1) |
-0,8c (-1,0, -0,5) |
-0,3c (-0,6, -0,1) |
— | — | — | — |
Terapia de combinación adicional con metformina y sulfonilurea
Un total de 666 pacientes con diabetes mellitus tipo 2 participaron en un ensayo doble ciego controlado con placebo para evaluar la eficacia de JARDIANCE en combinación con metformina más una sulfonilurea.
Los pacientes con diabetes mellitus tipo 2 inadecuadamente controlada con al menos 1.500 mg por día de metformina y con una sulfonilurea, ingresaron a un período de inclusión abierto de 2 semanas con placebo. Al final del período de inclusión, los pacientes que permanecieron inadecuadamente controlados y tenían una HbA1c entre 7% y 10% fueron aleatorizados a placebo, JARDIANCE 10 mg o JARDIANCE 25 mg.
El tratamiento con JARDIANCE 10 mg o 25 mg diarios proporcionó reducciones estadísticamente significativas en HbA1c (valor p <0,0001), FPG y peso corporal en comparación con placebo (ver Tabla 8).
| JARDIANCE 10 mg N=225 |
JARDIANCE 25 mg N=216 |
Placebo N=225 |
|
|---|---|---|---|
| aPoblación modificada de intención de tratar. La última observación en el ensayo (LOCF) se utilizó para imputar los datos faltantes en la semana 24. En la semana 24, se imputó el 17,8%, el 16,7% y el 25,3% para los pacientes aleatorizados a JARDIANCE 10 mg, JARDIANCE 25 mg y placebo, respectivamente. bValor p de ANCOVA <0,0001 (HbA1c: el modelo de ANCOVA incluye HbA1c basal, tratamiento, función renal y región. Peso corporal y FPG: se utilizó el mismo modelo que para HbA1c, pero además se incluyó el peso corporal basal/FPG basal, respectivamente). cFPG (mg/dL); para JARDIANCE 10 mg, n=225, para JARDIANCE 25 mg, n=215, para placebo, n=224 |
|||
| HbA1c (%)a | |||
| Basal (media) | 8.1 | 8.1 | 8.2 |
| Cambio desde el basal (media ajustada) | -0.8 | -0.8 | -0.2 |
| Diferencia con respecto al placebo (media ajustada) (IC del 95%) | -0.6b (-0.8, -0.5) | -0.6b (-0.7, -0.4) | — |
| Pacientes [n (%)] que alcanzan HbA1c <7% | 55 (26%) | 65 (32%) | 20 (9%) |
| FPG (mg/dL)c | |||
| Basal (media) | 151 | 156 | 152 |
| Cambio desde el basal (media ajustada) | -23 | -23 | 6 |
| Diferencia con respecto al placebo (media ajustada) | -29 | -29 | — |
| Peso corporal | |||
| Media basal en kg | 77 | 78 | 76 |
| % de cambio desde el basal (media ajustada) | -2.9 | -3.2 | -0.5 |
| Diferencia con respecto al placebo (media ajustada) (IC del 95%) | -2.4b (-3.0, -1.8) | -2.7b (-3.3, -2.1) | — |
En combinación con linagliptina como complemento a la terapia con metformina
Un total de 686 pacientes con diabetes mellitus tipo 2 participaron en un ensayo doble ciego, controlado con activo, para evaluar la eficacia de JARDIANCE 10 mg o 25 mg en combinación con linagliptina 5 mg en comparación con los componentes individuales.
Los pacientes con diabetes mellitus tipo 2 inadecuadamente controlados con al menos 1,500 mg de metformina por día ingresaron a un período de inclusión con placebo de un solo ciego durante 2 semanas. Al final del período de inclusión, los pacientes que permanecieron inadecuadamente controlados y tenían una HbA1c entre 7% y 10.5% fueron asignados aleatoriamente 1:1:1:1:1 a uno de los 5 brazos de tratamiento activo de JARDIANCE 10 mg o 25 mg, linagliptina 5 mg, o linagliptina 5 mg en combinación con 10 mg o 25 mg JARDIANCE como una tableta de combinación de dosis fija.
En la semana 24, JARDIANCE 10 mg o 25 mg utilizados en combinación con linagliptina 5 mg proporcionaron una mejora estadísticamente significativa en HbA1c (valor p <0.0001) y FPG (valor p <0.001) en comparación con los componentes individuales en pacientes que habían estado inadecuadamente controlados con metformina. El tratamiento con JARDIANCE/linagliptina 25 mg/5 mg o JARDIANCE/linagliptina 10 mg/5 mg diariamente también resultó en una reducción estadísticamente significativa del peso corporal en comparación con linagliptina 5 mg (valor p <0.0001). No hubo una diferencia estadísticamente significativa en el peso corporal en comparación con JARDIANCE solo.
Ensayo controlado con activo versus glimepirida en combinación con metformina
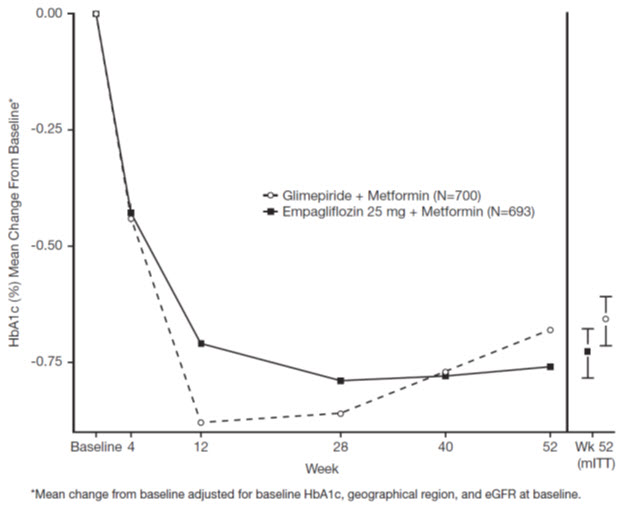
La eficacia de JARDIANCE se evaluó en un ensayo doble ciego, controlado con glimepirida, en 1,545 pacientes con diabetes mellitus tipo 2 con control glucémico insuficiente a pesar de la terapia con metformina.
Los pacientes con control glucémico inadecuado y una HbA1c entre 7% y 10% después de un período de inclusión de 2 semanas fueron asignados aleatoriamente a glimepirida o JARDIANCE 25 mg.
En la semana 52, JARDIANCE 25 mg y glimepirida disminuyeron HbA1c y FPG (ver Tabla 9, Figura 4). La diferencia en el tamaño del efecto observado entre JARDIANCE 25 mg y glimepirida excluyó el margen de no inferioridad preespecificado del 0.3%. La dosis diaria media de glimepirida fue de 2.7 mg y la dosis máxima aprobada en los Estados Unidos es de 8 mg por día.
| JARDIANCE 25 mg N=765 |
Glimepirida N=780 |
|
|---|---|---|
| aPoblación modificada de intención de tratar. La última observación en el ensayo (LOCF) se utilizó para imputar los datos que faltaban en la semana 52. En la semana 52, los datos se imputaron para el 15.3% y el 21.9% de los pacientes asignados aleatoriamente a JARDIANCE 25 mg y glimepirida, respectivamente. bNo inferior, valor p del modelo ANCOVA <0.0001 (HbA1c: el modelo ANCOVA incluye HbA1c basal, tratamiento, función renal y región) cValor p del modelo ANCOVA <0.0001 (Peso corporal y FPG: se utilizó el mismo modelo que para HbA1c, pero además se incluyó el peso corporal basal/FPG basal, respectivamente). dFPG (mg/dL); para JARDIANCE 25 mg, n=764, para glimepirida, n=779 |
||
| HbA1c (%)a | ||
| Basal (media) | 7.9 | 7.9 |
| Cambio desde el basal (media ajustada) | -0.7 | -0.7 |
| Diferencia de glimepirida (media ajustada) (IC del 97.5%) | -0.07b (-0.15, 0.01) | — |
| FPG (mg/dL)d | ||
| Basal (media) | 150 | 150 |
| Cambio desde el basal (media ajustada) | -19 | -9 |
| Diferencia de glimepirida (media ajustada) | -11 | — |
| Peso corporal | ||
| Media basal en kg | 82.5 | 83 |
| % de cambio desde el basal (media ajustada) | -3.9 | 2.0 |
| Diferencia de glimepirida (media ajustada) (IC del 95%) | -5.9c (-6.3, -5.5) | — |
 |
En la semana 52, el cambio medio ajustado desde el inicio en la presión arterial sistólica fue de -3,6 mmHg, en comparación con 2,2 mmHg para glimepirida. Las diferencias entre los grupos de tratamiento para la presión arterial sistólica fueron estadísticamente significativas (valor p <0,0001).
En la semana 104, el cambio medio ajustado desde el inicio en HbA1c fue de -0,75% para JARDIANCE 25 mg y -0,66% para glimepirida. La diferencia media ajustada del tratamiento fue de -0,09% con un intervalo de confianza del 97,5% de (-0,32%, 0,15%), excluyendo el margen de no inferioridad preespecificado de 0,3%. La dosis diaria media de glimepirida fue de 2,7 mg y la dosis máxima aprobada en los Estados Unidos es de 8 mg por día. El análisis de la semana 104 incluyó datos con y sin medicación de rescate glucémico concomitante, así como datos fuera del tratamiento. Los datos faltantes para los pacientes que no proporcionaron ninguna información en la visita se imputaron en función de los datos observados fuera del tratamiento. En este análisis de imputación múltiple, se imputó el 13,9% de los datos para JARDIANCE 25 mg y el 12,9% para glimepirida.
En la semana 104, JARDIANCE 25 mg diarios dieron como resultado una diferencia estadísticamente significativa en el cambio desde el inicio para el peso corporal en comparación con glimepirida (-3,1 kg para JARDIANCE 25 mg frente a +1,3 kg para glimepirida; ANCOVA-LOCF, valor p <0,0001).
Terapia de combinación adicional con pioglitazona con o sin metformina
Un total de 498 pacientes con diabetes mellitus tipo 2 participaron en un ensayo doble ciego controlado con placebo para evaluar la eficacia de JARDIANCE en combinación con pioglitazona, con o sin metformina.
Los pacientes con diabetes mellitus tipo 2 inadecuadamente controlada con metformina a una dosis de al menos 1.500 mg por día y pioglitazona a una dosis de al menos 30 mg por día se colocaron en un período de inclusión abierto con placebo durante 2 semanas. Los pacientes con control glucémico inadecuado y una HbA1c entre 7% y 10% después del período de inclusión se asignaron aleatoriamente a placebo, JARDIANCE 10 mg o JARDIANCE 25 mg.
El tratamiento con JARDIANCE 10 mg o 25 mg diarios dio como resultado reducciones estadísticamente significativas en HbA1c (valor p <0,0001), FPG y peso corporal en comparación con placebo (ver Tabla 10).
| JARDIANCE 10 mg N=165 |
JARDIANCE 25 mg N=168 |
Placebo N=165 |
|
|---|---|---|---|
| aPoblación modificada de intención de tratar. Se utilizó la última observación en el ensayo (LOCF) para imputar los datos faltantes en la semana 24. En la semana 24, se imputó el 10,9%, el 8,3% y el 20,6% para los pacientes asignados aleatoriamente a JARDIANCE 10 mg, JARDIANCE 25 mg y placebo, respectivamente. bValor p de ANCOVA <0,0001 (HbA1c: el modelo de ANCOVA incluye HbA1c basal, tratamiento, función renal y medicación de fondo. Peso corporal y FPG: se utilizó el mismo modelo que para HbA1c, pero incluyendo además el peso corporal basal/FPG basal, respectivamente). cFPG (mg/dL); para JARDIANCE 10 mg, n=163 |
|||
| HbA1c (%)a | |||
| Basal (media) | 8,1 | 8,1 | 8,2 |
| Cambio desde el inicio (media ajustada) | -0,6 | -0,7 | -0,1 |
| Diferencia con respecto al placebo + pioglitazona (media ajustada) (IC del 95%) | -0,5b (-0,7, -0,3) | -0,6b (-0,8, -0,4) | — |
| Pacientes [n (%)] que alcanzan HbA1c <7% | 36 (24%) | 48 (30%) | 12 (8%) |
| FPG (mg/dL)c | |||
| Basal (media) | 152 | 152 | 152 |
| Cambio desde el inicio (media ajustada) | -17 | -22 | 7 |
| Diferencia con respecto al placebo + pioglitazona (media ajustada) (IC del 97,5%) | -23b (-31,8, -15,2) | -28b (-36,7, -20,2) | — |
| Peso corporal | |||
| Media basal en kg | 78 | 79 | 78 |
| % de cambio desde el inicio (media ajustada) | -2,0 | -1,8 | 0,6 |
| Diferencia con respecto al placebo (media ajustada) (IC del 95%) | -2,6b (-3,4, -1,8) | -2,4b (-3,2, -1,6) | — |
Combinación adicional con insulina con o sin metformina y/o sulfonilureas
Un total de 494 pacientes con diabetes mellitus tipo 2 inadecuadamente controlada con insulina, o insulina en combinación con medicamentos orales participaron en un ensayo doble ciego, controlado con placebo para evaluar la eficacia de JARDIANCE como terapia adicional a la insulina durante 78 semanas.
Los pacientes ingresaron a un período de inclusión de 2 semanas con placebo con insulina basal (por ejemplo, insulina glargina, insulina detemir o insulina NPH) con o sin terapia de fondo con metformina y/o sulfonilurea. Después del período de inclusión, los pacientes con control glucémico inadecuado fueron asignados aleatoriamente a la adición de JARDIANCE 10 mg, JARDIANCE 25 mg o placebo. Los pacientes se mantuvieron con una dosis estable de insulina antes de la inscripción, durante el período de inclusión y durante las primeras 18 semanas de tratamiento. Para las 60 semanas restantes, la insulina podría ajustarse. La dosis diaria total media de insulina al inicio del estudio para JARDIANCE 10 mg, 25 mg y placebo fue de 45 UI, 48 UI y 48 UI, respectivamente.
JARDIANCE utilizado en combinación con insulina (con o sin metformina y/o sulfonilurea) proporcionó reducciones estadísticamente significativas en HbA1c y FPG en comparación con placebo después de 18 y 78 semanas de tratamiento (ver Tabla 11). JARDIANCE 10 mg o 25 mg diarios también resultó en una reducción del porcentaje de peso corporal estadísticamente significativamente mayor en comparación con el placebo.
| 18 semanas (sin ajuste de insulina) |
78 semanas (dosis de insulina ajustable después de 18 semanas) |
|||||
|---|---|---|---|---|---|---|
| JARDIANCE 10 mg N=169 |
JARDIANCE 25 mg N=155 |
Placebo N=170 |
JARDIANCE 10 mg N=169 |
JARDIANCE 25 mg N=155 |
Placebo N=170 |
|
| aPoblación modificada de intención de tratar. La última observación en el ensayo (LOCF) se utilizó para imputar los datos faltantes en la semana 18 y 78. En la semana 18, se imputó el 21.3%, 30.3% y 21.8% para los pacientes aleatorizados a JARDIANCE 10 mg, JARDIANCE 25 mg y placebo, respectivamente. En la semana 78, se imputó el 32.5%, 38.1% y 42.4% para los pacientes aleatorizados a JARDIANCE 10 mg, JARDIANCE 25 mg y placebo, respectivamente. bValor p de ANCOVA <0.0001 (HbA1c: el modelo ANCOVA incluye HbA1c basal, tratamiento y región; FPG: el modelo MMRM incluye FPG basal, HbA1c basal, tratamiento, región, visita e interacción visita por tratamiento. Peso corporal: el modelo MMRM incluye peso corporal basal, HbA1c basal, tratamiento, región, visita e interacción visita por tratamiento. cValor p=0.0049 dValor p=0.0052 eValor p=0.0463 |
||||||
| HbA1c (%)a | ||||||
| Línea de base (media) | 8.3 | 8.3 | 8.2 | 8.3 | 8.3 | 8.2 |
| Cambio desde la línea de base (media ajustada) | -0.6 | -0.7 | 0 | -0.4 | -0.6 | 0.1 |
| Diferencia con respecto al placebo (media ajustada) (IC del 97.5%) | -0.6b (-0.8, -0.4) |
-0.7b (-0.9, -0.5) |
— | -0.5b (-0.7, -0.3) |
-0.7b (-0.9, -0.5) |
— |
| Pacientes (%) que alcanzan HbA1c <7% | 18.0 | 19.5 | 5.5 | 12.0 | 17.5 | 6.7 |
| FPG (mg/dL) | ||||||
| Línea de base (media) | 138 | 146 | 142 | 138 | 146 | 142 |
| Cambio desde la línea de base (media ajustada, EE) | -17.9 (3.2) | -19.1 (3.3) | 10.4 (3.1) | -10.1 (3.2) | -15.2 (3.4) | 2.8 (3.2) |
| Diferencia del placebo (media ajustada) (IC del 95%) | -28.2b (-37.0, -19.5) |
-29.5b (-38.4, -20.6) |
— | -12.9c (-21.9, 3.9) |
-17.9b (-27.0, -8.8) |
— |
| Peso corporal | ||||||
| Media basal en kg | 92 | 95 | 90 | 92 | 95 | 90 |
| % de cambio desde la línea de base (media ajustada) | -1.8 | -1.4 | -0.1 | -2.4 | -2.4 | 0.7 |
| Diferencia del placebo (media ajustada) (IC del 95%) | -1.7d (-3.0, -0.5) |
-1.3e (-2.5, -0.0) |
— | -3.0b (-4.4, -1.7) |
-3.0b (-4.4, -1.6) |
— |
Combinación adicional con insulina MDI con o sin metformina
Un total de 563 pacientes con diabetes mellitus tipo 2 inadecuadamente controlada con múltiples inyecciones diarias (MDI) de insulina (dosis diaria total >60 UI), sola o en combinación con metformina, participaron en un ensayo doble ciego controlado con placebo para evaluar la eficacia de JARDIANCE como terapia adicional a la insulina MDI durante 18 semanas.
Los pacientes ingresaron a un período de inclusión de 2 semanas con placebo en insulina MDI con o sin terapia de fondo con metformina. Después del período de inclusión, los pacientes con control glucémico inadecuado se asignaron aleatoriamente a la adición de JARDIANCE 10 mg, JARDIANCE 25 mg o placebo. Los pacientes se mantuvieron con una dosis estable de insulina antes de la inscripción, durante el período de inclusión y durante las primeras 18 semanas de tratamiento. La dosis diaria total media de insulina en la línea de base para JARDIANCE 10 mg, JARDIANCE 25 mg y placebo fue de 88.6 UI, 90.4 UI y 89.9 UI, respectivamente.
JARDIANCE 10 mg o 25 mg diarios utilizados en combinación con insulina MDI (con o sin metformina) proporcionaron reducciones estadísticamente significativas en HbA1c en comparación con el placebo después de 18 semanas de tratamiento (ver Tabla 12).
| JARDIANCE 10 mg N=186 |
JARDIANCE 25 mg N=189 |
Placebo N=188 |
|
|---|---|---|---|
| aPoblación modificada por intención de tratar. Se utilizó la última observación en el ensayo (LOCF) para imputar los datos faltantes en la semana 18. En la semana 18, se imputó el 23.7%, el 22.8% y el 23.4% para los pacientes aleatorizados a JARDIANCE 10 mg, JARDIANCE 25 mg y placebo, respectivamente. bValor p de ANCOVA <0.0001 (HbA1c: el modelo ANCOVA incluye HbA1c basal, tratamiento, función renal, región geográfica y medicación de fondo). |
|||
| HbA1c (%)a | |||
| Línea de base (media) | 8.4 | 8.3 | 8.3 |
| Cambio desde la línea de base (media ajustada) | -0.9 | -1.0 | -0.5 |
| Diferencia del placebo (media ajustada) (IC del 95%) | -0.4b (-0.6, -0.3) | -0.5b (-0.7, -0.4) | — |
Durante un período de extensión con tratamiento de hasta 52 semanas, la insulina podría ajustarse para alcanzar los niveles objetivo de glucosa definidos. El cambio desde el inicio en HbA1c se mantuvo de 18 a 52 semanas con JARDIANCE 10 mg y 25 mg. Después de 52 semanas, JARDIANCE 10 mg o 25 mg diarios resultaron en una reducción del porcentaje de peso corporal estadísticamente mayor en comparación con el placebo (valor p <0,0001). El cambio medio en el peso corporal desde el inicio fue de -1,95 kg para JARDIANCE 10 mg y -2,04 kg para JARDIANCE 25 mg.
Deterioro renal
Un total de 738 pacientes con diabetes mellitus tipo 2 y un eGFR basal inferior a 90 mL/min/1,73 m2 participaron en un ensayo aleatorizado, doble ciego, controlado con placebo, de grupos paralelos para evaluar la eficacia de JARDIANCE en pacientes con diabetes mellitus tipo 2 y deterioro renal. La población del ensayo comprendió 290 pacientes con deterioro renal leve (eGFR de 60 a menos de 90 mL/min/1,73 m2), 374 pacientes con deterioro renal moderado (eGFR de 30 a menos de 60 mL/min/1,73 m2) y 74 con deterioro renal grave (eGFR inferior a 30 mL/min/1,73 m2). Un total de 194 pacientes con deterioro renal moderado tenían un eGFR basal de 30 a menos de 45 mL/min/1,73 m2 y 180 pacientes tenían un eGFR basal de 45 a menos de 60 mL/min/1,73 m2.
En la semana 24, JARDIANCE 25 mg proporcionó una reducción estadísticamente significativa en HbA1c en relación con el placebo en pacientes con deterioro renal leve a moderado (ver Tabla 13). También se observó una reducción estadísticamente significativa en relación con el placebo con JARDIANCE 25 mg en pacientes con deterioro renal leve [-0,7 (IC del 95%: -0,9, -0,5)] o moderado [-0,4 (IC del 95%: -0,6, -0,3)] y con JARDIANCE 10 mg en pacientes con deterioro renal leve [-0,5 (IC del 95%: -0,7, -0,3)].
La eficacia de reducción de la glucosa de JARDIANCE 25 mg disminuyó con la disminución del nivel de función renal en el rango leve a moderado. Los cambios medios de HbA1c de mínimos cuadrados a las 24 semanas fueron -0,6%, -0,5% y -0,2% para aquellos con un eGFR basal de 60 a menos de 90 mL/min/1,73 m2, 45 a menos de 60 mL/min/1,73 m2 y 30 a menos de 45 mL/min/1,73 m2, respectivamente [ver Dosificación y administración (2) y Uso en poblaciones específicas (8.6)]. Para el placebo, los cambios medios de HbA1c de mínimos cuadrados a las 24 semanas fueron 0,1%, -0,1% y 0,2% para los pacientes con un eGFR basal de 60 a menos de 90 mL/min/1,73 m2, 45 a menos de 60 mL/min/1,73 m2 y 30 a menos de 45 mL/min/1,73 m2, respectivamente.
| Deterioro leve y moderadob | |
|---|---|
| JARDIANCE 25 mg | |
| avalor p <0,0001 (HbA1c: el modelo ANCOVA incluye HbA1c basal, tratamiento, función renal y medicación de fondo) beGFR de 30 a menos de 90 mL/min/1,73 m2 – Población modificada de intención de tratar. La última observación en el ensayo (LOCF) se utilizó para imputar los datos faltantes en la semana 24. En la semana 24, se imputó el 24,6% y el 26,2% para los pacientes aleatorizados a JARDIANCE 25 mg y placebo, respectivamente. |
|
| HbA1c | |
| Número de pacientes | n=284 |
| Comparación con placebo (media ajustada) (IC del 95%) | -0,5a (-0,6, -0,4) |
Para pacientes con insuficiencia renal grave, los análisis de los cambios en HbA1c y FPG no mostraron un efecto terapéutico discernible de JARDIANCE 25 mg en comparación con el placebo [ver Indicaciones y Uso (1), Dosis y Administración (2.1, 2.2) y Uso en Poblaciones Específicas (8.6)].
14.2 Ensayo de Control Glucémico en Pacientes Pediátricos de 10 a 17 Años con Diabetes Mellitus Tipo 2
DINAMO (NCT03429543) fue un ensayo de 26 semanas, doble ciego, aleatorizado, controlado con placebo, en grupo paralelo, con un período de extensión de seguridad de tratamiento activo doble ciego de hasta 52 semanas para evaluar la eficacia de JARDIANCE. El ensayo incluyó a pacientes pediátricos de 10 a 17 años con diabetes mellitus tipo 2 mal controlada (HbA1c de 6.5 a 10.5%). Se inscribieron pacientes tratados con metformina (al menos 1.000 mg diarios o la dosis máxima tolerada), con o sin terapia de insulina, y aquellos con un historial de intolerancia a la terapia con metformina. Los pacientes fueron aleatorizados en 3 grupos de tratamiento (JARDIANCE 10 mg, un inhibidor de dipeptidil peptidasa-4 (DPP-4) o placebo), durante 26 semanas. Los pacientes del grupo JARDIANCE 10 mg que no lograron un HbA1c <7.0% en la Semana 12 se sometieron a una segunda aleatorización en la Semana 14 para permanecer en la dosis de 10 mg o aumentar a 25 mg. Los pacientes en placebo se re-aleatorizaron en la Semana 26 a una de las dosis de JARDIANCE (10 mg o 25 mg) o un inhibidor de DPP-4.
Un total de 157 pacientes fueron tratados con JARDIANCE (10 mg o 25 mg; N = 52), un inhibidor de DPP-4 (N = 52) o placebo (N = 53). Las terapias de fondo como complemento a la dieta y el ejercicio incluyeron metformina (51%), una combinación de metformina e insulina (40.1%), insulina (3.2%) o ninguna (5.7%). El HbA1c promedio al inicio fue de 8.0% y la duración promedio de la diabetes mellitus tipo 2 fue de 2.1 años. La edad promedio fue de 14.5 años (rango: 10-17 años) y el 51.6% tenían 15 años o más. Aproximadamente, el 50% eran blancos, el 6% eran asiáticos, el 31% eran negros o afroamericanos y el 38% eran de etnia hispana o latina. El IMC promedio fue de 36.0 kg/m2 y el puntaje Z del IMC promedio fue de 3.0. Los pacientes con un eGFR menor de 60 mL/min/1.73 m2 no se inscribieron en el ensayo. Aproximadamente el 25% de la población del estudio tenía microalbuminuria o macroalbuminuria.
En la Semana 26, el tratamiento con JARDIANCE fue superior en la reducción del HbA1c desde el inicio en comparación con el placebo (ver Tabla 14).
| JARDIANCE 10 mg y 25 mg |
Placebo | |
|---|---|---|
| aConjunto de intención de tratar modificado (Todos los pacientes aleatorizados y tratados con medición inicial). bImputaciones múltiples utilizando el enfoque de lavado de placebo con 500 iteraciones para datos faltantes. Imputado para HbA1c (Jardiance N = 5 (9.6 %), Placebo N = 3 (5.7%)), para FPG (Jardiance N = 4 (8.3%), Placebo N = 2 (3.8%)). cMedia cuadrática mínima del análisis de covarianza (ANCOVA) ajustada para el valor inicial y el estrato de edad inicial (< 15 años vs 15 a < 18 años). dNo evaluado para significancia estadística, no forma parte del procedimiento de prueba secuencial. ep-valor = 0.0116 (bidireccional) |
||
| HbA1c (%)b | ||
| Número de pacientes | n = 52 | n = 53 |
| Inicial (media) | 8.0 | 8.1 |
| Cambio desde el inicioc | -0.2 | 0.7 |
| Diferencia con el placeboc (95% IC) | -0.8e (-1.5, -0.2) | — |
| FPG (mg/dL)b,d | ||
| Número de pacientes | n = 48 | n = 52 |
| Inicial (media) | 154 | 159 |
| Cambio desde el inicioc | -19 | 17 |
| Diferencia con el placeboc (95% IC) | -36 (-60.7, -10.7) | — |
14.3 Resultados cardiovasculares en adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular aterosclerótica
El efecto de JARDIANCE en el riesgo cardiovascular (CV) en pacientes adultos con diabetes mellitus tipo 2 y enfermedad cardiovascular aterosclerótica establecida y estable fue evaluado en el ensayo EMPA-REG OUTCOME, un ensayo multicéntrico, multinacional, aleatorizado, doble ciego en paralelo. El ensayo comparó el riesgo de experimentar un evento cardiovascular adverso mayor (MACE) entre JARDIANCE y placebo cuando estos se agregaron y se usaron concomitantemente con los tratamientos estándar de atención para la diabetes mellitus y la enfermedad cardiovascular aterosclerótica. Los medicamentos antidiabéticos concomitantes debían mantenerse estables durante las primeras 12 semanas del ensayo. Después de eso, las terapias antidiabéticas y ateroscleróticas podrían ajustarse, a discreción de los investigadores, para garantizar que los participantes fueran tratados de acuerdo con la atención estándar para estas enfermedades.
Un total de 7.020 pacientes fueron tratados (JARDIANCE 10 mg = 2.345; JARDIANCE 25 mg = 2.342; placebo = 2.333) y seguidos durante una mediana de 3,1 años. Aproximadamente el 72% de la población del ensayo era blanca, el 22% era asiática y el 5% era negra. La edad media era de 63 años y aproximadamente el 72% eran hombres.
Todos los pacientes en el ensayo tenían diabetes mellitus tipo 2 inadecuadamente controlada en la línea de base (HbA1c mayor o igual a 7%). El HbA1c medio en la línea de base era del 8,1% y el 57% de los participantes tenían diabetes mellitus durante más de 10 años. Aproximadamente el 31%, el 22% y el 20% informaron un historial pasado de neuropatía, retinopatía y nefropatía a los investigadores, respectivamente, y la eGFR media era de 74 mL/min/1,73 m2.
En la línea de base, los pacientes fueron tratados con uno (~ 30%) o más (~ 70%) de los medicamentos antidiabéticos, incluyendo metformina (74%), insulina (48%) y sulfonilurea (43%).
Todos los pacientes tenían enfermedad cardiovascular aterosclerótica establecida en la línea de base, incluyendo uno (82%) o más (18%) de los siguientes: un historial documentado de enfermedad de la arteria coronaria (76%), accidente cerebrovascular (23%) o enfermedad arterial periférica (21%). En la línea de base, la presión arterial sistólica media era de 136 mmHg, la presión arterial diastólica media era de 76 mmHg, el LDL medio era de 86 mg/dL, el HDL medio era de 44 mg/dL y la relación media de albúmina urinaria a creatinina (UACR) era de 175 mg/g. En la línea de base, aproximadamente el 81% de los pacientes fueron tratados con inhibidores del sistema renina-angiotensina, el 65% con betabloqueantes, el 43% con diuréticos, el 77% con estatinas y el 86% con agentes antiplaquetarios (principalmente aspirina).
El punto final primario en EMPA-REG OUTCOME era el tiempo hasta la primera aparición de un evento cardiaco adverso mayor (MACE). Un evento cardiaco adverso mayor se definió como la aparición de una muerte cardiovascular o un infarto de miocardio no fatal (MI) o un accidente cerebrovascular no fatal. El plan de análisis estadístico había especificado previamente que las dosis de 10 y 25 mg se combinarían. Se utilizó un modelo de riesgos proporcionales de Cox para probar la no inferioridad contra el margen de riesgo preespecificado de 1,3 para la razón de riesgos de MACE y la superioridad en MACE si se demostraba la no inferioridad. El error de tipo 1 se controló en múltiples pruebas utilizando una estrategia de pruebas jerárquicas.
JARDIANCE redujo significativamente el riesgo de la primera aparición del punto final compuesto primario de muerte cardiovascular, infarto de miocardio no fatal o accidente cerebrovascular no fatal (HR: 0,86; 95% CI: 0,74, 0,99). El efecto del tratamiento se debió a una reducción significativa en el riesgo de muerte cardiovascular en sujetos aleatorizados a empagliflozina (HR: 0,62; 95% CI: 0,49, 0,77), sin cambios en el riesgo de infarto de miocardio no fatal o accidente cerebrovascular no fatal (ver Tabla 15 y Figuras 5 y 6). Los resultados para las dosis de 10 mg y 25 mg de empagliflozina fueron consistentes con los resultados para los grupos de dosis combinados.
| Placebo N=2.333 |
JARDIANCE N=4.687 |
Ratio de riesgos vs placebo (95% CI) |
|
|---|---|---|---|
| aConjunto tratado (pacientes que habían recibido al menos una dosis del fármaco del ensayo) bValor p para la superioridad (2 lados) 0,04 cNúmero total de eventos |
|||
| Composición de muerte cardiovascular, infarto de miocardio no fatal, accidente cerebrovascular no fatal (tiempo hasta la primera aparición)b | 282 (12,1%) | 490 (10,5%) | 0,86 (0,74, 0,99) |
| Infarto de miocardio no fatalc | 121 (5,2%) | 213 (4,5%) | 0,87 (0,70, 1,09) |
| Accidente cerebrovascular no fatalc | 60 (2,6%) | 150 (3,2%) | 1,24 (0,92, 1,67) |
| Muerte cardiovascularc | 137 (5,9%) | 172 (3,7%) | 0,62 (0,49, 0,77) |
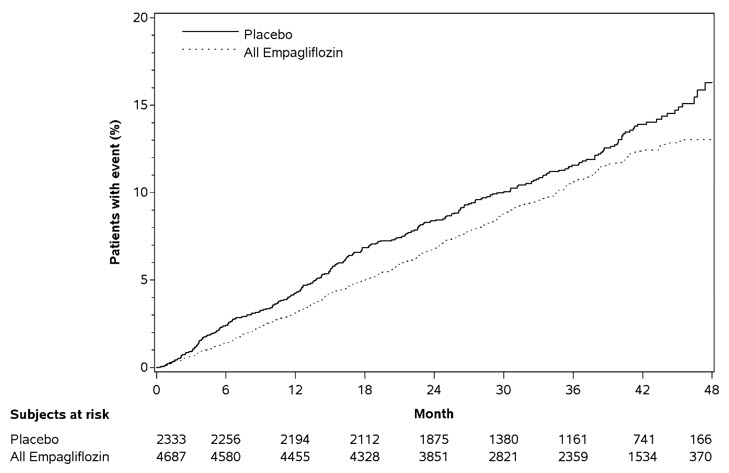 |
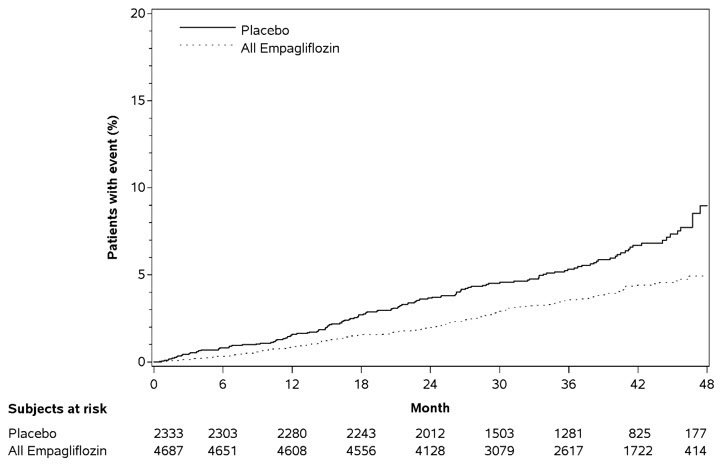 |
La eficacia de JARDIANCE en la muerte CV fue generalmente consistente en los principales subgrupos demográficos y de enfermedad.
Se obtuvo el estado vital del 99,2% de los sujetos en el ensayo. Se registraron un total de 463 muertes durante el ensayo EMPA-REG OUTCOME. La mayoría de estas muertes se clasificaron como muertes CV. Las muertes no CV solo representaron una pequeña proporción de las muertes y se equilibraron entre los grupos de tratamiento (2,1% en pacientes tratados con JARDIANCE y 2,4% de los pacientes tratados con placebo).
14.4 Ensayos de insuficiencia cardíaca en adultos
EMPEROR-Reduced (NCT03057977) fue un ensayo doble ciego realizado en adultos con insuficiencia cardíaca crónica (clase funcional de la Asociación del Corazón de Nueva York [NYHA] II-IV) con fracción de eyección ventricular izquierda (LVEF) ≤ 40% para evaluar la eficacia de JARDIANCE como complemento a la terapia estándar de insuficiencia cardíaca.
De 3.730 pacientes, 1.863 fueron aleatorizados a JARDIANCE 10 mg y 1.867 a placebo y se les dio seguimiento durante una mediana de 16 meses. La edad media de la población del ensayo fue de 67 años (rango: 25 a 94 años) y el 76% eran hombres, el 24% mujeres y el 27% tenían 75 años o más. Aproximadamente el 71% de la población del ensayo era blanca, el 18% asiática y el 7% negra o afroamericana. En la línea de base, el 50% de los pacientes tenía diabetes mellitus tipo 2.
En la aleatorización, el 75% de los pacientes eran de clase NYHA II, el 24% de clase III y el 0,5% de clase IV. La LVEF media era del 28%. En la línea de base, el eGFR medio era de 62 mL/min/1.73 m2 y la proporción mediana de albúmina urinaria a creatinina (UACR) era de 22 mg/g. Aproximadamente la mitad de los pacientes (52%) tenía eGFR igual o superior a 60 mL/min/1.73 m2, el 24% tenía eGFR de 45 a menos de 60 mL/min/1.73 m2, el 19% tenía eGFR de 30 a menos de 45 mL/min/1.73 m2 y el 5% tenía eGFR de 20 a menos de 30 mL/min/1.73 m2.
En la línea de base, el 88% de los pacientes estaba tratado con inhibidores de la enzima convertidora de angiotensina (ACE), bloqueadores de los receptores de angiotensina (ARB) o inhibidores de los receptores de angiotensina-neprilisina (ARNI), el 95% con betabloqueantes, el 71% con antagonistas de los receptores de mineralocorticoides (MRA) y el 95% con diuréticos.
El punto final primario era el tiempo hasta el primer evento de muerte cardiovascular (CV) o hospitalización por insuficiencia cardíaca (HHF). La HHF primaria y recurrente se evaluó como un punto final secundario clave.
JARDIANCE fue superior en la reducción del riesgo del punto final compuesto primario de muerte cardiovascular o hospitalización por insuficiencia cardíaca en comparación con el placebo, principalmente a través de una reducción en la hospitalización por insuficiencia cardíaca. JARDIANCE redujo el riesgo de HHF primaria y recurrente (ver Tabla 16 y Figuras 7 y 8).
| Placebo N=1.867 |
JARDIANCE 10 mg N=1.863 |
Ratio de riesgo vs placebo (95% CI) |
p-valor | |
|---|---|---|---|---|
| Número de pacientes (%) | ||||
| aTiempo hasta el primer evento bIncluye muertes después de la hospitalización cModelo de fragilidad conjunto que tiene en cuenta la muerte CV |
||||
| Muerte CV o HHFa | 462 (24,7%) | 361 (19,4%) | 0,75 (0,65, 0,86) | <0,0001 |
| Muerte CVa,b | 202 (10,8%) | 187 (10,0%) | 0,92 (0,75, 1,12) | |
| HHFa | 342 (18,3%) | 246 (13,2%) | 0,69 (0,59, 0,81) | |
| Número de eventos | ||||
| HHF primaria y recurrentec | 553 | 388 | 0,70 (0,58, 0,85) | 0,0003 |
Figura 7 Tiempo hasta la primera aparición del punto final compuesto primario de muerte CV o hospitalización por insuficiencia cardíaca
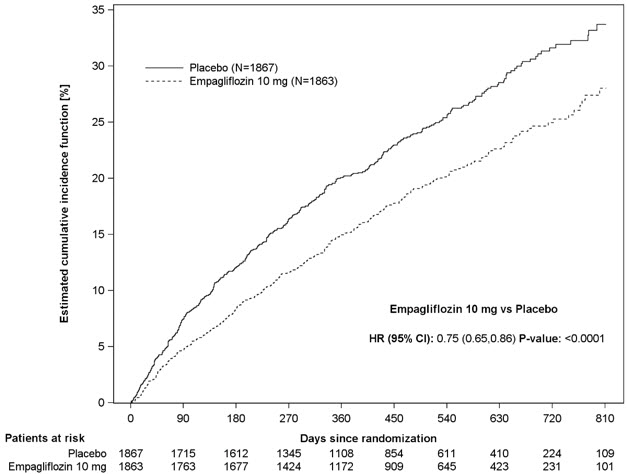
Figura 8 Tiempo hasta el evento de hospitalización por insuficiencia cardíaca (primaria y recurrente)
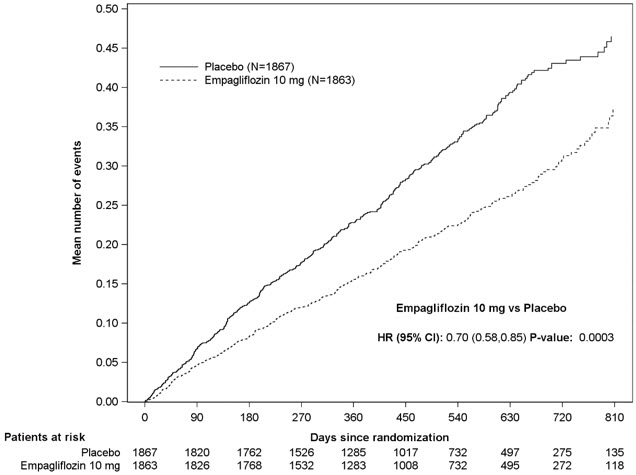
Los resultados del compuesto primario fueron generalmente consistentes en los subgrupos preespecificados (ver Figura 9).
Figura 9 Efectos del tratamiento para el punto final compuesto primario (muerte CV y hospitalización por insuficiencia cardíaca) Análisis de subgrupos (EMPEROR-Reduced)
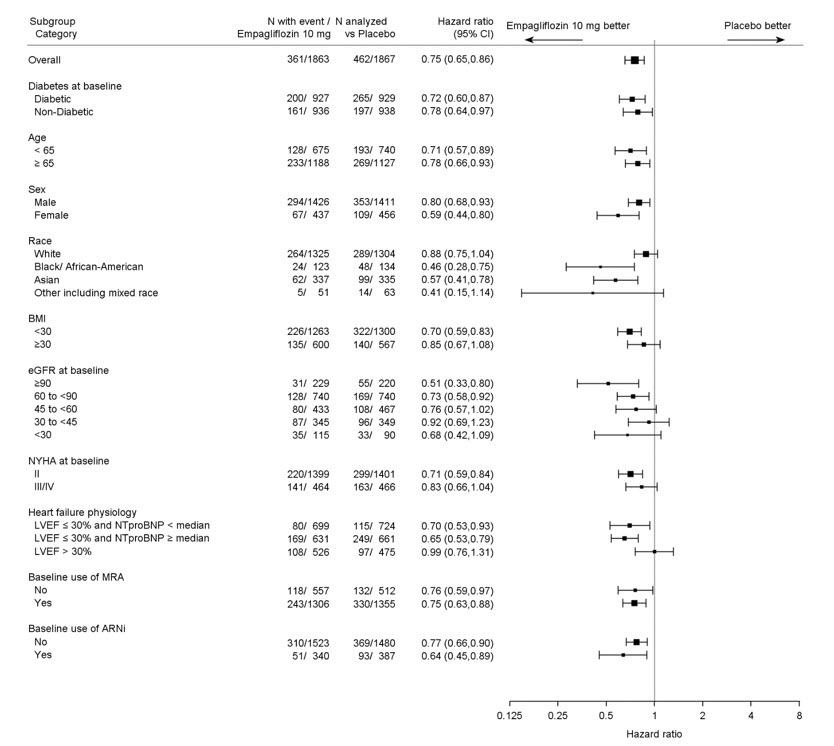
LVEF >30%: Incluye tanto por encima como por debajo de la mediana NT-proBNP. Para ser elegibles para la inclusión, los pacientes con un LVEF >30% requerían cumplir un umbral de NT-proBNP más alto que aquellos con LVEF ≤30%, a menos que tuvieran además un historial de HHF en los últimos 12 meses.
EMPEROR-Preserved (NCT03057951) fue un ensayo doble ciego realizado en adultos con insuficiencia cardíaca crónica NYHA Clase II-IV con LVEF >40% para evaluar la eficacia de JARDIANCE como complemento a la terapia estándar de cuidado.
De 5.988 pacientes, 2.997 fueron aleatorizados a JARDIANCE 10 mg y 2.991 al placebo y fueron seguidos durante una mediana de 26 meses. La edad media de la población del ensayo fue de 72 años (rango: 22 a 100 años) y el 55% eran hombres, el 45% eran mujeres y el 43% tenían 75 años o más. Aproximadamente el 76% de la población del ensayo era blanca, el 14% asiática y el 4% negra o afroamericana.
En la aleatorización, el 82% de los pacientes eran de clase NYHA II, el 18% eran de clase III y el 0,3% eran de clase IV. La población del ensayo EMPEROR-Preserved incluía pacientes con un LVEF <50% (33,1%), con un LVEF 50 a <60% (34,4%) y un LVEF ≥60% (32,5%). En la línea de base, la media de eGFR fue de 61 mL/min/1,73 m2 y la mediana de la relación de albúmina urinaria a creatinina (UACR) fue de 21 mg/g. Aproximadamente la mitad de los pacientes (50%) tenía eGFR igual o superior a 60 mL/min/1,73 m2, el 26% tenía eGFR de 45 a menos de 60 mL/min/1,73 m2, el 19% tenía eGFR de 30 a menos de 45 mL/min/1,73 m2 y el 5% tenía eGFR de 20 a menos de 30 mL/min/1,73 m2.
En la línea de base, el 81% de los pacientes estaban tratados con inhibidores de la ECA, ARB o ARNI, el 86% con betabloqueantes, el 38% con MRA y el 86% con diuréticos.
El punto final primario fue el tiempo hasta el primer evento de muerte CV o HHF. La HHF primaria y recurrente se evaluó como un punto final secundario clave.
JARDIANCE fue superior en la reducción del riesgo del punto final compuesto primario en comparación con el placebo, principalmente a través de una reducción en la hospitalización por insuficiencia cardíaca. JARDIANCE redujo el riesgo de HHF primaria y recurrente (ver Tabla 17 y Figuras 10 y 11).
| Placebo N=2.991 |
JARDIANCE 10 mg N=2.997 |
Ratio de riesgo vs placebo (95% CI) |
Valor p | |
|---|---|---|---|---|
| Número de pacientes (%) | ||||
| aTiempo hasta el primer evento bIncluye muertes posteriores a la hospitalización cModelo de fragilidad conjunta que tiene en cuenta la muerte CV |
||||
| Muerte CV o HHFa | 511 (17,1%) | 415 (13,8%) | 0,79 (0,69, 0,90) | 0,0003 |
| Muerte CVa,b | 244 (8,2%) | 219 (7,3%) | 0,91 (0,76, 1,09) | |
| HHFa | 352 (11,8%) | 259 (8,6%) | 0,71 (0,60, 0,83) | |
| Número de eventos | ||||
| HHF primaria y recurrentec | 541 | 407 | 0,73 (0,61, 0,88) | 0,0009 |
Figura 10 Tiempo hasta la primera aparición del criterio de valoración compuesto primario de muerte CV u hospitalización por insuficiencia cardíaca
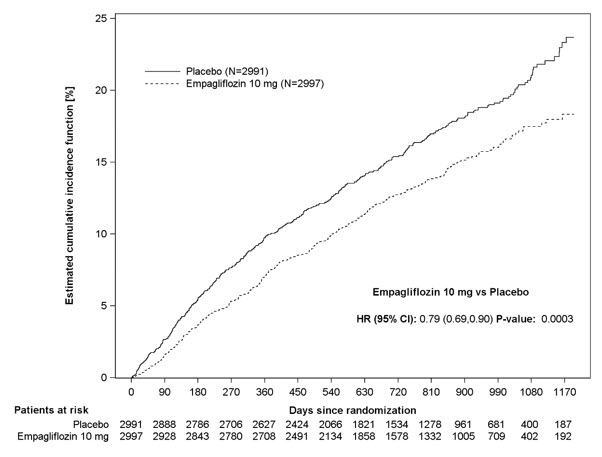
Figura 11 Tiempo hasta el evento de hospitalización por insuficiencia cardíaca (primera y recurrente)
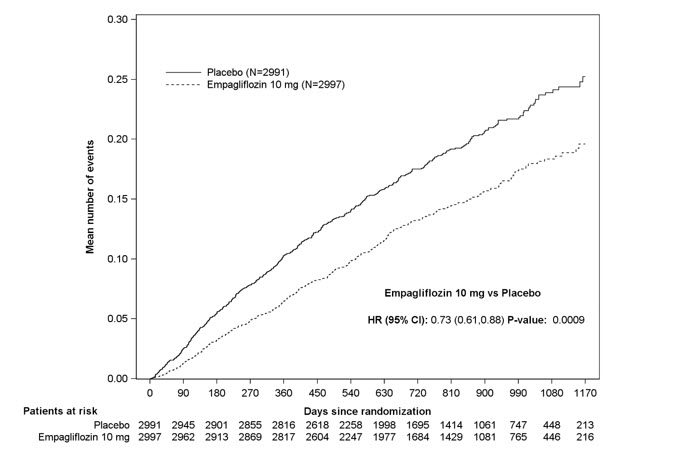
Los resultados del criterio de valoración compuesto primario fueron consistentes en todos los subgrupos preespecificados (ver Figura 12).
Figura 12 Efectos del tratamiento para el criterio de valoración compuesto primario (muerte CV u hospitalización por insuficiencia cardíaca) Análisis de subgrupos (EMPEROR-Preserved)
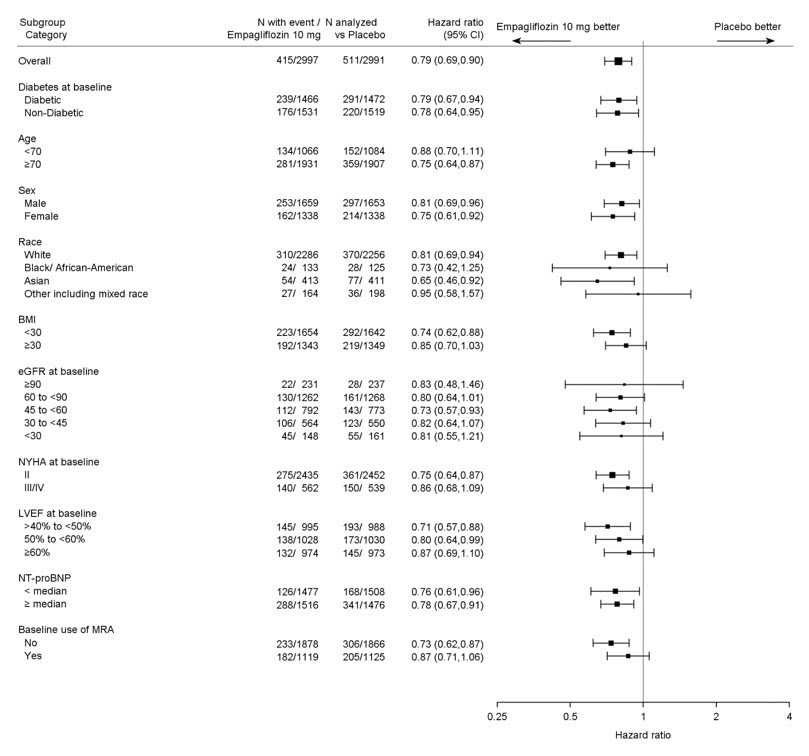
14.5 Ensayo de enfermedad renal crónica en adultos
EMPA-KIDNEY (NCT03594110) fue un ensayo aleatorizado, doble ciego, controlado con placebo realizado en adultos con enfermedad renal crónica (eGFR ≥20 a <45 mL/min/1.73 m2; o eGFR ≥45 a <90 mL/min/1.73 m2 con relación albúmina en orina a creatinina [UACR] ≥200 mg/g). El ensayo excluyó a pacientes con enfermedad renal poliquística o pacientes que requirieron terapia inmunosupresora intravenosa en los tres meses anteriores o >45 mg de prednisona (o equivalente) en el momento de la selección. El objetivo principal del ensayo fue evaluar los efectos de la empagliflozina como complemento a la terapia estándar de atención, incluida la terapia con inhibidores de la RAS cuando sea apropiado, sobre el tiempo hasta la progresión de la enfermedad renal o la muerte cardiovascular.
Un total de 6.609 pacientes, fueron aleatorizados por igual a JARDIANCE 10 mg o placebo y fueron seguidos durante una mediana de 24 meses.
La edad media de la población del estudio fue de 63 años (rango: 18 a 94 años) y el 67% eran hombres. Aproximadamente el 58% de la población del estudio era blanca, el 36% asiática y el 4% negra o afroamericana. Aproximadamente el 44% de los pacientes tenían diabetes mellitus tipo 2.
En la línea de base, la eGFR media fue de 37 mL/min/1.73 m2, el 21% de los pacientes tenían una eGFR igual o superior a 45 mL/min/1.73 m2, el 44% tenían una eGFR de 30 a menos de 45 mL/min/1.73 m2, y el 35% tenían una eGFR inferior a 30 mL/min/1.73 m2. La UACR mediana fue de 329 mg/g, el 20% de los pacientes tenían una UACR <30 mg/g, el 28% tenían una UACR de 30 a ≤300 mg/g, y el 52% tenían una UACR >300 mg/g. Aproximadamente el 1% de los pacientes tenían diabetes tipo 1 en la línea de base. Las etiologías más comunes de la ERC fueron la nefropatía diabética/enfermedad renal diabética (31%), la enfermedad glomerular (25%), la enfermedad hipertensiva/renovascular (22%) y otras/desconocidas (22%).
En la línea de base, el 85% de los pacientes fueron tratados con inhibidor de la ECA o ARB, el 64% con estatinas y el 34% con agentes antiplaquetarios.
JARDIANCE fue superior al placebo en la reducción del riesgo del criterio de valoración compuesto primario de disminución sostenida ≥40% de la eGFR, eGFR sostenida <10 mL/min/1.73 m2, progresión a enfermedad renal en estadio terminal, o muerte CV o renal. El efecto del tratamiento reflejó una reducción en una disminución sostenida ≥40% de la eGFR, eGFR sostenida <10 mL/min/1.73 m2, progresión a enfermedad renal en estadio terminal y muerte CV. Hubo pocas muertes renales durante el ensayo. JARDIANCE también redujo el riesgo de hospitalización primera y recurrente (ver Tabla 18 y Figura 13); la información recopilada sobre el motivo de la hospitalización fue insuficiente para caracterizar mejor el beneficio.
| Placebo N=3,305 |
JARDIANCE 10 mg N=3,304 |
Razón de riesgo vs placebo (IC del 95%) |
Valor p | |
|---|---|---|---|---|
| CV=Cardiovascular, eGFR=Tasa de filtración glomerular estimada, ESKD=Enfermedad renal en estadio terminal | ||||
| aESKD se define como el inicio de la diálisis de mantenimiento o la recepción de un trasplante de riñón. | ||||
| bHubo muy pocos eventos de muerte renal para calcular una razón de riesgo confiable. | ||||
| cLa información recopilada sobre el motivo de la hospitalización fue insuficiente para caracterizar mejor el beneficio. | ||||
| Número de pacientes (%) | ||||
| Compuesto de disminución sostenida ≥40% de la eGFR, eGFR sostenida <10 mL/min/1.73 m2, ESKDa, o muerte CV o renal (tiempo hasta la primera aparición) | 558 (16.9) | 432 (13.1) | 0.72 (0.64, 0.82) | <0.0001 |
| Disminución sostenida ≥40% de la eGFR | 474 (14.3) | 359 (10.9) | 0.70 (0.61, 0.81) | |
| ESKDa o eGFR sostenida <10 mL/min/1.73 m2 | 221 (6.7) | 157 (4.8) | 0.69 (0.56, 0.84) | |
| Muerte renalb | 4 (0.1) | 4 (0.1) | ||
| Muerte CV | 69 (2.1) | 59 (1.8) | 0.84 (0.60, 1.19) | |
| Número de eventos | ||||
| Primera y recurrente hospitalización c | 1,895 | 1,611 | 0.86 (0.78, 0.95) | 0.0025 |
Figura 13 Tiempo hasta la primera aparición del criterio de valoración compuesto primario, disminución sostenida ≥40% de la TFG, TFG sostenida <10 mL/min/1.73 m2, ERC o muerte renal, o muerte CV
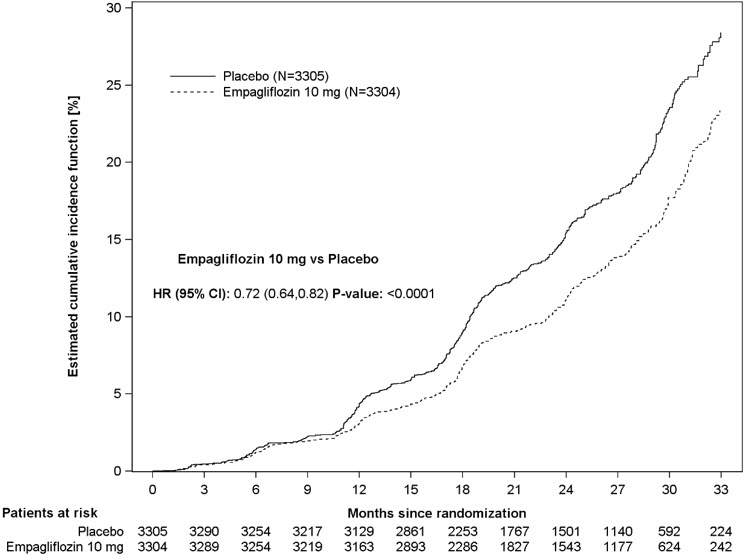
Los resultados del criterio de valoración compuesto primario fueron generalmente consistentes en todos los subgrupos preespecificados examinados, incluidas las categorías de TFG, la causa subyacente de la enfermedad renal, el estado de diabetes o el uso de fondo de inhibidores del RAS (ver Figura 14). El beneficio del tratamiento con JARDIANCE en el criterio de valoración compuesto primario no fue evidente en pacientes con niveles muy bajos de albuminuria, sin embargo, hubo pocos eventos en estos pacientes.
Figura 14 Efectos del tratamiento para el criterio de valoración compuesto primario (disminución sostenida ≥40% de la TFG, TFG sostenida <10 mL/min/1.73 m2, ERC o muerte renal, o muerte CV) Análisis de subgrupos (EMPA-KIDNEY)
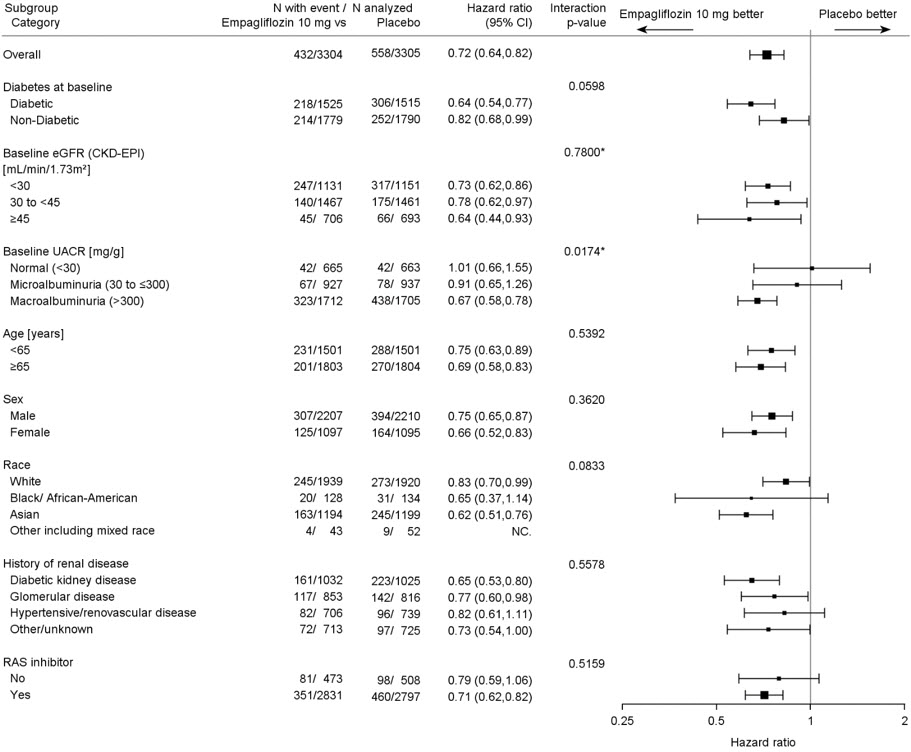
*=Prueba de tendencia
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Las tabletas de JARDIANCE están disponibles de la siguiente manera:
Tabletas de 10 mg: tabletas recubiertas con película de color amarillo pálido, redondas, biconvexas y con bordes biselados, grabadas con “S 10” en un lado y el símbolo de la compañía Boehringer Ingelheim en el otro lado.
Frascos de 30 (NDC 0597-0152-30)
Frascos de 90 (NDC 0597-0152-90)
Cajas que contienen 3 blísteres de 10 tabletas cada uno (3 × 10) (NDC 0597-0152-37), envase institucional.
Tabletas de 25 mg: tabletas recubiertas con película de color amarillo pálido, ovaladas, biconvexas, grabadas con “S 25” en un lado y el símbolo de la compañía Boehringer Ingelheim en el otro lado.
Frascos de 30 (NDC 0597-0153-30)
Frascos de 90 (NDC 0597-0153-90)
Cajas que contienen 3 blísteres de 10 tabletas cada uno (3 × 10) (NDC 0597-0153-37), envase institucional.
Dispense en un recipiente bien cerrado como se define en la USP.
Almacenamiento
Almacenar a 20°C a 25°C (68°F a 77°F); se permiten excursiones a 15°C a 30°C (59°F a 86°F) [ver USP Temperatura ambiente controlada].
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente que lea el etiquetado del paciente aprobado por la FDA (Guía de medicamentos).
Cetoacidosis diabética en pacientes con diabetes mellitus tipo 1 y otras cetoacidosis
En pacientes con diabetes mellitus tipo 1, infórmeles que el uso de JARDIANCE puede aumentar su riesgo de cetoacidosis diabética potencialmente mortal y que se ha producido cetoacidosis fatal. Para todos los demás pacientes, infórmeles que JARDIANCE puede causar cetoacidosis potencialmente fatal y que la diabetes mellitus tipo 2 y los trastornos pancreáticos (por ejemplo, antecedentes de pancreatitis o cirugía pancreática) son factores de riesgo.
Eduque a todos los pacientes sobre los factores precipitantes (como la reducción de la dosis de insulina o las dosis de insulina perdidas, la infección, la reducción de la ingesta calórica, la dieta cetogénica, la cirugía, la deshidratación y el abuso del alcohol) y los síntomas de la cetoacidosis (incluidas las náuseas, los vómitos, el dolor abdominal, la fatiga y la respiración dificultosa). Informe a los pacientes que la glucosa en sangre puede ser normal incluso en presencia de cetoacidosis.
Aconseje a los pacientes que se les puede pedir que controlen las cetonas. Si se presentan síntomas de cetoacidosis, indique a los pacientes que suspendan JARDIANCE y busquen atención médica de inmediato [ver Advertencias y precauciones (5.1)].
Depleción de volumen
Informe a los pacientes que puede producirse hipotensión sintomática con JARDIANCE y aconsejeles que se pongan en contacto con su proveedor de atención médica si experimentan tales síntomas [ver Advertencias y precauciones (5.2)]. Informe a los pacientes que la deshidratación puede aumentar el riesgo de hipotensión y que deben mantener una ingesta adecuada de líquidos.
Infecciones graves del tracto urinario
Informe a los pacientes sobre la posibilidad de infecciones del tracto urinario, que pueden ser graves. Proporcióneles información sobre los síntomas de las infecciones del tracto urinario. Aconsejeles que busquen atención médica si se presentan tales síntomas [ver Advertencias y precauciones (5.3)].
Hipoglucemia
Informe a los pacientes que se ha notificado hipoglucemia cuando JARDIANCE se utiliza con secretagogos de insulina o insulina. La hipoglucemia puede ocurrir en pacientes pediátricos independientemente del tratamiento antidiabético concomitante. Eduque a los pacientes o cuidadores sobre los signos y síntomas de la hipoglucemia [ver Advertencias y precauciones (5.4)].
Fascitis necrosante del perineo (gangrena de Fournier)
Informe a los pacientes que se han producido infecciones necrosantes del perineo (gangrena de Fournier) con JARDIANCE. Aconseje a los pacientes que busquen atención médica de inmediato si desarrollan dolor o sensibilidad, enrojecimiento o hinchazón de los genitales o del área desde los genitales hasta el recto, junto con fiebre superior a 100.4 ° F o malestar general [ver Advertencias y precauciones (5.5)].
Infecciones micóticas genitales en mujeres (por ejemplo, vulvovaginitis)
Informe a las pacientes que pueden producirse infecciones vaginales por hongos y proporcióneles información sobre los signos y síntomas de las infecciones vaginales por hongos. Aconsejeles sobre las opciones de tratamiento y cuándo buscar atención médica [ver Advertencias y precauciones (5.6)].
Infecciones micóticas genitales en hombres (por ejemplo, balanitis o balanopostitis)
Informe a los pacientes masculinos que puede producirse una infección por hongos del pene (por ejemplo, balanitis o balanopostitis), especialmente en hombres no circuncidados y pacientes con infecciones crónicas y recurrentes. Proporcióneles información sobre los signos y síntomas de la balanitis y la balanopostitis (erupción o enrojecimiento del glande o prepucio del pene). Aconsejeles sobre las opciones de tratamiento y cuándo buscar atención médica [ver Advertencias y precauciones (5.6)].
Amputación de miembro inferior
Aconseje a los pacientes sobre la importancia del cuidado preventivo rutinario de los pies. Indique a los pacientes que controlen si hay dolor o sensibilidad nuevos, llagas o úlceras, o infecciones que involucren la pierna o el pie y que busquen atención médica de inmediato si se desarrollan tales signos o síntomas [ver Advertencias y precauciones (5.7)].
Reacciones de hipersensibilidad
Informe a los pacientes que se han notificado reacciones de hipersensibilidad graves, como urticaria y angioedema, con JARDIANCE. Aconseje a los pacientes que informen inmediatamente cualquier reacción cutánea o angioedema y que suspendan el medicamento hasta que hayan consultado con el proveedor de atención médica que lo recetó [ver Advertencias y precauciones (5.8)].
Pruebas de laboratorio
Informe a los pacientes que se espera que la glucosa elevada en el análisis de orina cuando se toma JARDIANCE [ver Interacciones medicamentosas (7)].
Embarazo
Aconseje a las pacientes embarazadas y a las pacientes con potencial reproductivo sobre el riesgo potencial para el feto con el tratamiento con JARDIANCE [ver Uso en poblaciones específicas (8.1)]. Indique a los pacientes que informen a su proveedor de atención médica sobre los embarazos lo antes posible.
Lactancia
Aconseje a los pacientes que no se recomienda la lactancia durante el tratamiento con JARDIANCE [ver Uso en poblaciones específicas (8.2)].
Dosis olvidada
Indique a los pacientes que tomen JARDIANCE solo según lo prescrito. Si se olvida una dosis, debe tomarse tan pronto como el paciente lo recuerde. Aconseje a los pacientes que no dupliquen su próxima dosis [ver Dosificación y administración (2.3)].
SECCIÓN NO CLASIFICADA DE SPL
Distribuido por:
Boehringer Ingelheim Pharmaceuticals, Inc.
Ridgefield, CT 06877 USA
Comercializado por:
Boehringer Ingelheim Pharmaceuticals, Inc.
Ridgefield, CT 06877 USA
y
Eli Lilly and Company
Indianapolis, IN 46285 USA
Licenciado de:
Boehringer Ingelheim International GmbH, Ingelheim, Alemania
JARDIANCE es una marca registrada de y utilizada bajo licencia de Boehringer Ingelheim International GmbH.
Boehringer Ingelheim Pharmaceuticals, Inc. es propietaria o utiliza las marcas comerciales EMPA-REG OUTCOME®, EMPEROR-Reduced®, EMPEROR-Preserved®, y EMPA-KIDNEY® bajo licencia.
Las otras marcas enumeradas son marcas comerciales de sus respectivos propietarios y no son marcas comerciales de Boehringer Ingelheim Pharmaceuticals, Inc.
Copyright © 2023 Boehringer Ingelheim International GmbH
TODOS LOS DERECHOS RESERVADOS
COL8914OI212023
SPL8934K
Guía de medicación
| Esta Guía del Medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos. | Revisado: Septiembre 2023 | |||
| GUÍA DEL MEDICAMENTO JARDIANCE® (jar DEE ans) (tabletas de empagliflozina) para uso oral |
||||
| ¿Cuál es la información más importante que debo saber sobre JARDIANCE? JARDIANCE puede causar efectos secundarios graves, que incluyen:
|
||||
|
|
|||
|
||||
|
|
|||
| Hable con su proveedor de atención médica sobre qué hacer si presenta síntomas de una infección por hongos vaginal o del pene. Su proveedor de atención médica puede sugerirle que use un medicamento antifúngico de venta libre. Hable con su proveedor de atención médica de inmediato si usa un medicamento antifúngico de venta libre y sus síntomas no desaparecen. | ||||
| ¿Qué es JARDIANCE? JARDIANCE es un medicamento recetado que se usa para:
JARDIANCE no está indicado para bajar el azúcar en la sangre (glucosa) en personas con diabetes tipo 1. Puede aumentar su riesgo de cetoacidosis diabética (aumento de cetonas en la sangre o la orina). |
||||
| ¿Quién no debe tomar JARDIANCE? No tome JARDIANCE si usted:
|
||||
| ¿Qué debo decirle a mi proveedor de atención médica antes de tomar JARDIANCE? Antes de tomar JARDIANCE, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si usted:
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos herbales. |
||||
¿Cómo debo tomar JARDIANCE?
|
||||
| ¿Cuáles son los posibles efectos secundarios de JARDIANCE? JARDIANCE puede causar efectos secundarios graves, que incluyen:
|
||||
|
|
|
|
|
|
||||
|
|
|
||
Los efectos secundarios más comunes de JARDIANCE incluyen:
Estos no son todos los posibles efectos secundarios de JARDIANCE. Para obtener más información, consulte con su proveedor de atención médica o farmacéutico. |
||||
¿Cómo debo guardar JARDIANCE?
|
||||
| Información general sobre el uso seguro y eficaz de JARDIANCE. Los medicamentos a veces se recetan para fines distintos de los que se enumeran en una Guía de medicamentos. No use JARDIANCE para una condición para la que no esté prescrito. No le dé JARDIANCE a otras personas, incluso si tienen los mismos síntomas que usted. Puede hacerles daño. Puede pedirle a su farmacéutico o proveedor de atención médica información sobre JARDIANCE que esté escrita para profesionales de la salud. |
||||
| ¿Cuáles son los ingredientes de JARDIANCE? Ingrediente activo: empagliflozina Ingredientes inactivos: dióxido de silicio coloidal, croscarmelosa sódica, hidroxipropilcelulosa, lactosa monohidratada, estearato de magnesio y celulosa microcristalina. Además, la cubierta de la película contiene los siguientes ingredientes inactivos: hipromelosa, polietilenglicol, talco, dióxido de titanio y óxido férrico amarillo. Distribuido por: Boehringer Ingelheim Pharmaceuticals, Inc.; Ridgefield, CT 06877 EE. UU. Comercializado por: Boehringer Ingelheim Pharmaceuticals, Inc.; Ridgefield, CT 06877 EE. UU. y Eli Lilly and Company, Indianápolis, IN 46285 EE. UU. Licenciado de: Boehringer Ingelheim International GmbH, Ingelheim, Alemania JARDIANCE es una marca registrada de y utilizada bajo licencia de Boehringer Ingelheim International GmbH. Boehringer Ingelheim Pharmaceuticals, Inc. posee o utiliza las marcas comerciales EMPA-REG OUTCOME®, EMPEROR-Reduced®, EMPEROR-Preserved® y EMPA-KIDNEY® bajo licencia. Las otras marcas enumeradas son marcas comerciales de sus respectivos propietarios y no son marcas comerciales de Boehringer Ingelheim Pharmaceuticals, Inc. Copyright © 2023 Boehringer Ingelheim International GmbH TODOS LOS DERECHOS RESERVADOS COL8914OI212023 Para obtener más información sobre JARDIANCE, incluida la información de prescripción actual y la Guía de medicamentos, visite www.jardiance.com, escanee el código o llame a Boehringer Ingelheim Pharmaceuticals, Inc. al 1-800-542-6257.
|
||||
PANEL PRINCIPAL DE VISUALIZACIÓN – Caja de Cartón con Blíster de Tabletas de 10 mg
NDC 0597-0152-37
DISPENSE WITH ENCLOSED MEDICATION GUIDE
Jardiance®
(empagliflozin tablets)
10 mg
Este paquete de dosis unitaria no es a prueba de niños. Si se dispensa
para uso ambulatorio, se debe utilizar un envase a prueba de niños.
Rx only
30 tabletas
3 blísters. Cada blíster contiene 10 tabletas.
Boehringer
Ingelheim
Lilly
PANEL PRINCIPAL DE EXHIBICIÓN – Caja con blíster de tabletas de 25 mg
NDC 0597-0153-37
DISPENSE WITH ENCLOSED MEDICATION GUIDE
Jardiance®
(empagliflozin tablets)
25 mg
Este paquete de dosis unitaria no es a prueba de niños. Si se dispensa
para uso ambulatorio, se debe utilizar un recipiente a prueba de niños.
Rx only
30 tabletas
3 tarjetas blíster. Cada tarjeta contiene 10 tabletas.
Boehringer
Ingelheim
Lilly