Fabricante de medicamentos: CSL Behring Lengnau AG (Updated: 2023-06-30)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
IDELVION [Coagulation Factor IX (Recombinant), Albumin Fusion Protein]
Polvo liofilizado para solución inyectable intravenosa
Aprobación inicial en EE. UU.: 2016
INDICACIONES Y USO
IDELVION, Factor de coagulación IX (recombinante), proteína de fusión de albúmina (rIX-FP), un concentrado de factor de coagulación IX derivado de ADN recombinante, está indicado en niños y adultos con hemofilia B (deficiencia congénita de factor IX) para:
- Tratamiento a demanda y control de episodios hemorrágicos
- Manejo perioperatorio de hemorragias
- Profilaxis de rutina para reducir la frecuencia de episodios hemorrágicos
Limitaciones de uso:
IDELVION no está indicado para la inducción de tolerancia inmunitaria en pacientes con hemofilia B. (1)
DOSIFICACIÓN Y ADMINISTRACIÓN
Para uso intravenoso después de la reconstitución solamente.
- Cada vial de dosis única de IDELVION está etiquetado con la potencia real del factor IX en unidades internacionales (UI). (2.1)
- Se espera que una UI de IDELVION por kg de peso corporal aumente la actividad circulante del factor IX de la siguiente manera:
- Administrar por vía intravenosa. No exceda la velocidad de infusión de 10 mL por minuto. (2.3)
Tratamiento a demanda y control de episodios hemorrágicos y manejo perioperatorio:
- La dosis y la duración del tratamiento con IDELVION dependen de la gravedad de la deficiencia del factor IX, la ubicación y la extensión de la hemorragia, y el estado clínico, la edad y la recuperación del factor IX del paciente. (2.1)
- Determine la dosis inicial utilizando la siguiente fórmula:
Dosis requerida (UI) = Peso corporal (kg) × Aumento deseado del factor IX (% de lo normal o UI/dL) × (recíproco de la recuperación (UI/kg por UI/dL)) (2.1) - Ajuste la dosis en función del estado clínico y la respuesta del paciente. (2.1)
Profilaxis de rutina:
FORMAS FARMACÉUTICAS Y CONCENTRACIONES
IDELVION está disponible como polvo liofilizado en viales de dosis única que contienen nominalmente 250, 500, 1000, 2000 o 3500 UI. (3)
CONTRAINDICACIONES
No lo use en pacientes que hayan tenido reacciones de hipersensibilidad potencialmente mortales a IDELVION o a sus componentes, incluidas las proteínas de hámster. (4)
ADVERTENCIAS Y PRECAUCIONES
- Se ha informado de hipersensibilidad. Si se presentan síntomas de reacciones de hipersensibilidad, incluida la anafilaxia, suspenda el uso de IDELVION y administre el tratamiento adecuado. (5.1)
- Se ha informado de la formación de anticuerpos neutralizantes (inhibidores) contra el factor IX con IDELVION. Si no se alcanza la recuperación plasmática esperada del factor IX en el plasma del paciente, o si la hemorragia no se controla con una dosis adecuada, realice un ensayo que mida la concentración del inhibidor del factor IX. (5.2, 5.5)
- Puede producirse tromboembolismo (p. ej., embolia pulmonar, trombosis venosa y trombosis arterial) cuando se utilizan productos que contienen factor IX. (5.3)
- Se ha notificado síndrome nefrótico tras la inducción de tolerancia inmunitaria con productos que contienen factor IX en pacientes con hemofilia B con inhibidores del factor IX y antecedentes de reacciones alérgicas al factor IX. (5.4)
- Los resultados del ensayo de actividad del factor IX pueden variar según el tipo de reactivo de tiempo de tromboplastina parcial activada que se utilice. (5.5)
REACCIONES ADVERSAS
Las reacciones adversas más comunes (incidencia ≥1%) notificadas en los ensayos clínicos fueron dolor de cabeza, mareos, hipersensibilidad y erupción cutánea. (6)
Para notificar REACCIONES ADVERSAS SOSPECHOSAS, póngase en contacto con el Departamento de Farmacovigilancia de CSL Behring en el teléfono 1-866-915-6958 o con la FDA en el teléfono 1-800-FDA-1088 o en el sitio web www.fda.gov/medwatch.
USO EN POBLACIONES ESPECÍFICAS
Pediatría: Puede ser necesaria una dosis mayor por kilogramo de peso corporal o una administración más frecuente. (8.4)
Consulte 17 para obtener INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y el etiquetado para pacientes aprobado por la FDA.
Revisado: 6/2023
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosificación
2.2 Preparación y Reconstitución
2.3 Administración
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de Hipersensibilidad
5.2 Anticuerpos Neutralizantes
5.3 Complicaciones Tromboembólicas
5.4 Síndrome Nefrótico
5.5 Monitoreo de Pruebas de Laboratorio
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Inmunogenicidad
6.3 Experiencia Postcomercialización
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14 ESTUDIOS CLÍNICOS
15 REFERENCIAS
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
1 INDICACIONES Y USO
IDELVION®, Factor IX de la Coagulación (Recombinante), Proteína de Fusión de Albúmina (rIX-FP), un concentrado de Factor IX de la coagulación derivado de ADN recombinante, está indicado en niños y adultos con Hemofilia B (deficiencia congénita de Factor IX) para:
- Tratamiento a demanda y control de episodios de sangrado
- Manejo perioperatorio del sangrado
- Profilaxis de rutina para reducir la frecuencia de episodios de sangrado
Limitaciones de Uso:
IDELVION no está indicado para la inducción de tolerancia inmunitaria en pacientes con Hemofilia B.
2 DOSIS Y ADMINISTRACIÓN
Para uso intravenoso después de la reconstitución únicamente.
2.1 Dosificación
- Cada vial de dosis única de IDELVION contiene la potencia del Factor IX recombinante en unidades internacionales (UI) que se indica en la caja y la etiqueta del vial.
- La dosis y la duración del tratamiento con IDELVION dependen de la gravedad de la deficiencia de Factor IX, la ubicación y la extensión del sangrado, y el estado clínico del paciente, la edad y la recuperación del Factor IX.
- El cálculo de la dosis requerida de IDELVION se basa en el hallazgo empírico de que se espera que una UI de IDELVION por kg de peso corporal aumente el nivel circulante de Factor IX en 1,3 UI/dL en pacientes ≥12 años de edad y en 1 UI/dL en pacientes <12 años de edad. La dosis requerida de IDELVION para el tratamiento de episodios de sangrado se determina utilizando la siguiente fórmula:
Unidades requeridas (UI) = Peso corporal (kg) × Aumento deseado del Factor IX (% de lo normal o UI/dL) × (recíproco de la recuperación (UI/kg por UI/dL)) O Aumento del Factor IX UI/dL (o % de lo normal) = Dosis (UI) × Recuperación (UI/dL por UI/kg)/peso corporal (kg) - Ajuste la dosis en función del estado clínico y la respuesta del paciente individual.
Tratamiento a demanda y control de episodios de sangrado
En la Tabla 1 se proporciona una guía para la dosificación de IDELVION para el tratamiento a demanda y el control de episodios de sangrado. La dosificación debe tener como objetivo mantener un nivel de actividad del Factor IX en plasma en o por encima de los niveles plasmáticos (en % de lo normal o UI/dL) que se describen en la Tabla 1.
| Tipo de episodio de sangrado | Actividad del Factor IX circulante requerida [% o (UI/dL)] |
Frecuencia de dosificación (horas) | Duración de la terapia (días)* |
|---|---|---|---|
|
|||
| Menor o moderado Hemartrosis no complicada, sangrado muscular (excepto iliopsoas) o sangrado oral |
30-60 | 48-72 | Al menos 1 día, hasta que el sangrado se detenga y se logre la curación. Una sola dosis debería ser suficiente para la mayoría de los sangrados. |
| Mayor Hemorragia que amenaza la vida o la extremidad, sangrado muscular profundo, incluido iliopsoas, intracraneal, retrofaríngeo |
60-100 | 48-72 | 7-14 días, hasta que el sangrado se detenga y se logre la curación. Dosis de mantenimiento semanal. |
Manejo perioperatorio del sangrado
En la Tabla 2 se proporciona una guía para la dosificación de IDELVION para el manejo perioperatorio del sangrado.
| Tipo de cirugía | Actividad del Factor IX circulante requerida [% o (UI/dL)] |
Frecuencia de dosificación (horas) | Duración de la terapia (días)* |
|---|---|---|---|
|
|||
| Menor (incluida la extracción dental no complicada) |
50-80 | 48-72 | Al menos 1 día, o hasta que se logre la curación. Una sola dosis debería ser suficiente para la mayoría de las cirugías menores. |
| Mayor (incluidas intracraneal, faríngea, retrofaríngea, retroperitoneal) |
60-100 (nivel inicial) |
48-72 | 7-14 días, o hasta que el sangrado se detenga y se logre la curación. Repita la dosis cada 48-72 horas durante la primera semana o hasta que se logre la curación. Dosis de mantenimiento 1-2 veces por semana. |
Profilaxis de rutina
Para pacientes ≥12 años de edad, la dosis recomendada es de 25-40 UI de IDELVION por kg de peso corporal cada 7 días. Los pacientes que están bien controlados con un régimen de 7 días pueden cambiar a un intervalo de 14 días a 50-75 UI de IDELVION por kg de peso corporal [ver Estudios clínicos (14)].
Para pacientes <12 años de edad, la dosis recomendada es de 40-55 UI de IDELVION por kg de peso corporal cada 7 días.
- Un régimen puede ajustarse aún más individualmente a una dosificación menos o más frecuente en adultos.
2.2 Preparación y reconstitución
Los procedimientos a continuación se proporcionan como pautas generales para la preparación y reconstitución de IDELVION.
- Siempre trabaje en una superficie limpia y lávese las manos antes de realizar los siguientes procedimientos.
- Utilice una técnica aséptica durante el procedimiento de reconstitución.
- Reconstituya IDELVION utilizando el diluyente (Agua estéril para inyección) y el dispositivo de transferencia (Mix2Vial) proporcionados en el kit.
- Para administrar, también necesitará una jeringa y una aguja adecuada (no proporcionadas).
- Asegúrese de que los viales de IDELVION y el Agua estéril para inyección estén a temperatura ambiente antes de mezclar.
- La reconstitución se realiza como se describe a continuación.
Instrucciones de reconstitución de IDELVION
- Coloque el vial de IDELVION, el vial de diluyente y el juego de transferencia Mix2Vial® en una superficie plana.
- Retire las tapas abatibles de los viales de IDELVION y Agua estéril para inyección (diluyente).
- Limpie los tapones con la torunda de alcohol estéril proporcionada y deje que se sequen antes de abrir el paquete del juego de transferencia Mix2Vial.
- Abra el paquete del juego de transferencia Mix2Vial pelando la tapa (Fig. 1). No retire el dispositivo del paquete.
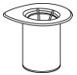
Fig. 1 - Coloque el vial de diluyente en una superficie plana y sostenga el vial con firmeza. Agarre el juego de transferencia Mix2Vial junto con el paquete transparente y empuje la espiga de plástico en el extremo azul del juego de transferencia Mix2Vial firmemente a través del centro del tapón del vial de diluyente (Fig. 2).
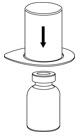
Fig. 2 - Retire cuidadosamente el paquete transparente del juego de transferencia Mix2Vial. No retire el juego de transferencia Mix2Vial ni toque el extremo expuesto del dispositivo (Fig. 3).
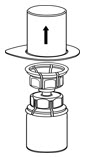
Fig. 3 - Con el vial de IDELVION colocado firmemente en una superficie plana, invierta el vial de diluyente con el juego de transferencia Mix2Vial conectado y empuje la espiga de plástico del adaptador transparente firmemente a través del centro del tapón del vial de IDELVION (Fig. 4). El diluyente se transferirá automáticamente al vial de IDELVION.
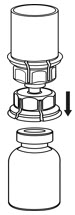
Fig. 4 - Con el diluyente y el vial de IDELVION aún conectados al juego de transferencia Mix2Vial, gire suavemente el vial de IDELVION para asegurarse de que el polvo esté completamente disuelto (Fig. 5). No agite el vial.
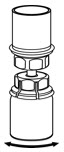
Fig. 5 - Con una mano, agarre el lado de IDELVION del juego de transferencia Mix2Vial y con la otra mano agarre el lado azul del diluyente del juego de transferencia Mix2Vial, y desenrosque el juego en dos piezas (Fig. 6).
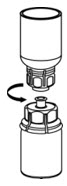
Fig. 6 - Aspire aire en una jeringa estéril vacía. Mientras el vial de IDELVION está en posición vertical, enrosque la jeringa al juego de transferencia Mix2Vial. Inyecte aire en el vial de IDELVION.
- Mientras mantiene el émbolo de la jeringa presionado, invierta el sistema boca abajo y aspire el concentrado en la jeringa tirando del émbolo lentamente (Fig. 7).
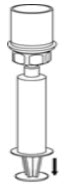
Fig. 7 - Desconecte la jeringa llena desenroscándola del juego de transferencia Mix2Vial (Fig. 8). La solución reconstituida debe ser una solución transparente o de color amarillo a incolora. No la use si observa partículas o decoloración.
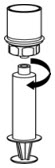
Fig. 8 - Usar inmediatamente o dentro de 4 horas después de la reconstitución. Guardar la solución reconstituida a temperatura ambiente. No refrigerar.
- Si la dosis requiere más de un frasco, utilizar un set de transferencia Mix2Vial y un frasco de Agua Estéril para Inyección (diluyente) separado y sin usar para cada frasco del producto. Repetir los pasos 10-12 para mezclar los contenidos de los frascos en una jeringa.
2.3 Administración
Sólo para inyección intravenosa.
- No mezclar ni administrar IDELVION en el mismo tubo o recipiente que otros productos medicinales.
- Inspeccionar visualmente la solución final en busca de partículas y decoloración antes de la administración, siempre que la solución y el recipiente lo permitan. No usar si se observan partículas o decoloración.
- Adjuntar la jeringa que contiene la solución reconstituida de IDELVION a un conjunto de infusión estéril y administrar por inyección intravenosa. Ajustar la velocidad de infusión al nivel de comodidad de cada paciente, sin exceder 10 mL por minuto.
- Administrar IDELVION a temperatura ambiente y dentro de 4 horas de la reconstitución. Desechar cualquier producto no utilizado.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
IDELVION es un polvo liofilizado de color amarillo pálido a blanco suministrado en viales de dosis única que contiene nominalmente 250, 500, 1000, 2000 o 3500 UI de potencia del factor IX. La potencia real del factor IX está etiquetada en cada vial y caja.
4 CONTRAINDICACIONES
IDELVION está contraindicado en pacientes que han tenido reacciones de hipersensibilidad potencialmente mortales a IDELVION o sus componentes, incluidas las proteínas de hámster [ver Advertencias y precauciones (5.1)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de hipersensibilidad
Se han producido reacciones de hipersensibilidad. Los signos tempranos de reacciones de hipersensibilidad, que pueden progresar a anafilaxia, incluyen angioedema, opresión en el pecho, hipotensión, urticaria generalizada, sibilancias y disnea. Si se presentan síntomas de hipersensibilidad o anafilaxia, suspenda inmediatamente la administración e inicie el tratamiento adecuado.
IDELVION contiene cantidades traza de proteínas de ovario de hámster chino (CHO). Los pacientes tratados con este producto pueden desarrollar hipersensibilidad a estas proteínas de mamíferos no humanos.
5.2 Anticuerpos neutralizantes
Se ha informado la formación de anticuerpos neutralizantes (inhibidores) al Factor IX con IDELVION [ver Reacciones adversas (6.3)]. Monitoree a todos los pacientes tratados con IDELVION para el desarrollo de anticuerpos neutralizantes (inhibidores) mediante observaciones clínicas apropiadas o pruebas de laboratorio. Realice un ensayo que mida la concentración del inhibidor del Factor IX si no se alcanzan los niveles esperados de actividad del Factor IX en plasma, o si el sangrado no se controla con una dosis adecuada.
Los pacientes con inhibidores del Factor IX tienen un mayor riesgo de reacciones de hipersensibilidad graves o anafilaxia si se vuelven a exponer al Factor IX. Evalúe a los pacientes que experimentan reacciones alérgicas para detectar la presencia de un inhibidor y controle de cerca a los pacientes con inhibidores para detectar signos y síntomas de reacciones de hipersensibilidad aguda, particularmente durante las primeras fases de exposición al producto [ver Advertencias y precauciones (5.1)].
5.3 Complicaciones tromboembólicas
La tromboembolia (por ejemplo, embolia pulmonar, trombosis venosa y trombosis arterial) puede ocurrir cuando se utilizan productos que contienen Factor IX. Debido al riesgo potencial de tromboembolia con el uso de productos del Factor IX, controle los signos tempranos de tromboembolia y coagulopatía consuntiva cuando administre IDELVION a pacientes con enfermedad hepática, fibrinólisis, estado perioperatorio o factores de riesgo para eventos tromboembólicos o coagulación intravascular diseminada.
5.4 Síndrome nefrótico
Se ha informado el síndrome nefrótico después de intentos de inducción de tolerancia inmunitaria en pacientes con hemofilia B con inhibidores del Factor IX y antecedentes de reacciones alérgicas. La seguridad y eficacia del uso de IDELVION para la inducción de tolerancia inmunitaria no se han establecido.
5.5 Monitoreo de pruebas de laboratorio
- Monitoree los niveles plasmáticos del Factor IX mediante un ensayo de coagulación de un solo paso para confirmar que se han logrado y mantenido niveles adecuados del Factor IX [ver Dosificación y administración (2.1)]. Los resultados del ensayo de actividad del Factor IX pueden variar según el tipo de reactivo de tiempo de tromboplastina parcial activado (aPTT) utilizado en el sistema de ensayo.1 Por ejemplo, los reactivos de aPTT basados en caolín junto con otros reactivos diseñados para exhibir baja respuesta al anticoagulante lúpico2 han demostrado que producen una recuperación aproximadamente un 50% menor de lo esperado en función de la potencia etiquetada.
- De acuerdo con hallazgos similares para otros productos de Factor IX recombinante, se produjo una sobreestimación de la actividad del Factor IX en muestras enriquecidas de IDELVION (sobreestimación media del 32%) a niveles bajos de Factor IX con reactivos de aPTT de uso común.3
- Monitoree a los pacientes para detectar el desarrollo de inhibidores si no se alcanzan los niveles plasmáticos esperados de actividad del Factor IX, o si el sangrado no se controla con la dosis recomendada de IDELVION. Los ensayos utilizados para determinar si está presente un inhibidor del Factor IX deben titularse en Unidades de Bethesda (BU).
6 REACCIONES ADVERSAS
Las reacciones adversas más comunes (incidencia ≥1%) reportadas en los ensayos clínicos fueron dolor de cabeza, mareos, hipersensibilidad y erupción cutánea.
6.1 Experiencia en Ensayos Clínicos
Debido a que los ensayos clínicos se realizan bajo condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no se pueden comparar directamente con las tasas en los ensayos clínicos de otro medicamento y es posible que no reflejen las tasas observadas en la práctica clínica.
En cinco ensayos clínicos multicéntricos, prospectivos y abiertos con IDELVION, 114 pacientes previamente tratados (PPT; expuestos a un producto que contiene Factor IX durante ≥100 días de exposición [ED]) recibieron al menos una infusión de IDELVION como parte del tratamiento a demanda de episodios de sangrado, manejo perioperatorio de procedimientos quirúrgicos, dentales u otros procedimientos invasivos mayores y menores, profilaxis de rutina o evaluación farmacocinética. Veintisiete niños eran <12 años de edad, 9 adolescentes tenían de 12 a <18 años de edad y 78 adultos tenían ≥18 a ≤65 años de edad. Se administraron un total de 16,326 inyecciones durante una mediana de 1,543.5 días (rango: 25 a 2,565 días).
Las reacciones adversas que ocurrieron en >0.5% de los sujetos se enumeran en la Tabla 3.
| Sistema de Clasificación de Órganos Estándar MedDRA |
Reacción Adversa | Número de sujetos n (%), (N=114) |
|---|---|---|
| Trastornos del sistema nervioso | Dolor de cabeza | 2 (1.8) |
| Mareos | 2 (1.8) | |
| Trastornos del sistema inmunitario | Hipersensibilidad | 1 (0.9) |
| Trastornos de la piel y del tejido subcutáneo | Erupción cutánea | 1 (0.9) |
| Eccema | 1 (0.9) |
La seguridad de IDELVION también se evaluó en un estudio completado con 12 pacientes no tratados previamente (PNP). La mediana del número de ED fue de 50 (rango: 22 a 146) por sujeto, un total de 8 sujetos lograron al menos 50 ED, de los cuales 3 sujetos lograron ≥100 ED.
Se notificaron reacciones adversas a medicamentos en 2 de los 12 sujetos tratados con IDELVION. Un sujeto (8.3%) en el estudio PNP desarrolló un alto título de inhibidores del factor IX (título máximo 188 BU/mL) y el mismo sujeto (8.3%) desarrolló hipersensibilidad. Un sujeto adicional (8.3%) en el estudio PNP desarrolló erupción cutánea.
6.2 Inmunogenicidad
Todos los sujetos fueron monitoreados para detectar anticuerpos inhibitorios y de unión a rIX-FP (específicamente rFIX, pdFIX y albúmina), y anticuerpos de unión a proteínas de células huésped CHO en los siguientes puntos de tiempo: en el cribado, a las 2-4 semanas, 12 semanas después de la primera infusión de IDELVION, cada 3 meses a partir de entonces (cada 6 meses para anticuerpos de unión en niños). Ningún sujeto desarrolló anticuerpos no neutralizantes contra el factor IX, ni anticuerpos contra la albúmina y la proteína CHO en ninguno de los puntos de tiempo después de la infusión de IDELVION. Se notificó un caso de desarrollo de inhibidores del factor IX en el estudio clínico que evaluó a pacientes no tratados previamente. No se han observado anticuerpos contra el factor IX en los ensayos clínicos de IDELVION que incluyeron a pacientes previamente tratados.
La detección de la formación de anticuerpos depende en gran medida de la sensibilidad y especificidad del ensayo. Además, la incidencia observada de positividad de anticuerpos (incluidos los anticuerpos neutralizantes) en un ensayo puede verse influenciada por varios factores, como la metodología del ensayo, la manipulación de la muestra, el momento de la toma de la muestra, los medicamentos concomitantes y la enfermedad subyacente. Por estas razones, puede ser engañoso comparar la incidencia de anticuerpos contra IDELVION en los estudios descritos anteriormente con la incidencia de anticuerpos en otros estudios o con otros productos.
6.3 Experiencia posterior a la comercialización
Se ha identificado la siguiente reacción adversa durante el uso posterior a la aprobación de IDELVION. Debido a que estas reacciones se notifican voluntariamente a partir de una población de tamaño incierto, no siempre es posible estimar de forma fiable su frecuencia o establecer una relación causal con la exposición al medicamento.
Trastornos de la sangre y del sistema linfático: Desarrollo de inhibidores del factor IX
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgos
No hay datos sobre el uso de IDELVION en mujeres embarazadas para informar sobre el riesgo asociado al fármaco. No se han realizado estudios de reproducción animal utilizando IDELVION. Se desconoce si IDELVION puede causar daño fetal o afectar la capacidad de reproducción cuando se administra a una mujer embarazada. En la población general de los EE. UU., el riesgo de fondo estimado de defectos de nacimiento mayores y aborto espontáneo en embarazos clínicamente reconocidos es del 2-4% y del 15-20%, respectivamente.
8.2 Lactancia
Resumen de Riesgos
No hay información sobre la excreción de IDELVION en la leche materna, el efecto en el lactante o los efectos sobre la producción de leche. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de IDELVION y cualquier posible efecto adverso en el lactante de IDELVION o de la condición materna subyacente.
8.4 Uso Pediátrico
En estudios clínicos que incluyeron 34 pacientes previamente tratados (PPT) <18 años, la administración profiláctica con IDELVION cada 7 días fue exitosa en la prevención de episodios de sangrado espontáneo que requieren tratamiento [ver Estudios Clínicos (14)]. De estos, 7 sujetos tenían ≥12 y <18 años; 5 de estos sujetos cambiaron a una administración profiláctica de 10 o 14 días con IDELVION. No hubo diferencias aparentes en el perfil de seguridad en sujetos <18 años en comparación con adultos [ver Reacciones Adversas (6.1)].
En comparación con los adultos, la recuperación incremental de rIX-FP pareció ser ligeramente menor y el aclaramiento ajustado al peso corporal pareció ser mayor. Los niños pueden tener un aclaramiento ajustado al peso corporal de Factor IX más alto, una vida media más corta y una recuperación más baja. Puede ser necesaria una dosis más alta por kilogramo de peso corporal o una dosificación más frecuente en estos pacientes [ver Dosificación y Administración (2.1) y Farmacología Clínica (12.3)].
8.5 Uso Geriátrico
Los estudios clínicos de IDELVION no incluyeron sujetos mayores de 65 años para determinar si responden de manera diferente a los sujetos más jóvenes.
11 DESCRIPCIÓN
IDELVION, Factor IX de la Coagulación (Recombinante), Proteína de Fusión de Albúmina (rIX-FP) es un polvo liofilizado estéril, no pirogénico, que se reconstituye con Agua Estéril para Inyección (sWFI) para administración intravenosa. IDELVION está disponible en viales de dosis única que contienen nominalmente 250, 500, 1000, 2000 o 3500 UI de Factor IX formulado con citrato de sodio, polisorbato 80, manitol y sacarosa. La cantidad real de actividad del Factor IX en UI está etiquetada en cada vial. Después de la reconstitución del polvo liofilizado, todas las concentraciones de dosis producen una solución transparente, de color amarillo a incolora. IDELVION no contiene conservantes.
El ingrediente activo en IDELVION, proteína de fusión de albúmina del Factor IX de la coagulación humano recombinante, es una proteína purificada producida por tecnología de ADN recombinante. Se genera mediante la fusión genética de albúmina recombinante al Factor IX de la coagulación recombinante. La fusión genética del ADNc de la albúmina humana al ADNc del Factor IX de la coagulación humana permite que el producto del gen se exprese como una sola proteína recombinante designada como rIX-FP. La porción del Factor IX de IDELVION es idéntica a la forma alélica Thr148 del Factor IX derivado del plasma humano. El enlace escindido entre las porciones del Factor IX y la albúmina se deriva del péptido de activación endógeno en el Factor IX nativo. rIX-FP permanece intacto en la circulación hasta que el Factor IX se activa, momento en el que la albúmina se escinde del Factor IX, liberando el Factor IX activado (FIXa) cuando se necesita para la coagulación.
IDELVION se fabrica sin la adición de proteínas derivadas de materiales de origen humano o animal. IDELVION es una glucoproteína que consta de 1018 aminoácidos secretados por una línea celular de ovario de hámster chino (CHO) modificada genéticamente. La línea celular CHO secreta rIX-FP en un medio de cultivo celular definido y la proteína rIX-FP se purifica mediante un proceso que no requiere el uso de un reactivo de anticuerpo monoclonal. El proceso de fabricación incorpora tres pasos validados de eliminación de virus, incluida la inactivación de virus mediante tratamiento con solvente/detergente y la eliminación de virus mediante filtración.
La potencia expresada en Unidades Internacionales se determina utilizando un ensayo de coagulación de un solo paso basado en aPTT in vitro contra el estándar de referencia de fabricación de CSL Behring. Este estándar de potencia interno se ha calibrado contra el Estándar Internacional de la Organización Mundial de la Salud (OMS) para el concentrado de Factor IX mediante un ensayo de coagulación de un solo paso utilizando reactivos basados en sílice sintética y fosfolípidos sintéticos.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
IDELVION es una proteína recombinante que reemplaza temporalmente el Factor IX de coagulación faltante necesario para una hemostasia efectiva. IDELVION está compuesto por Factor IX de coagulación recombinante genéticamente fusionado y albúmina recombinante. La fusión con albúmina recombinante extiende la vida media del Factor IX [ver Descripción (11) y Farmacología clínica (12.3)].
12.2 Farmacodinamia
La administración de IDELVION aumenta los niveles plasmáticos de Factor IX y puede corregir temporalmente el defecto de coagulación en los pacientes.
12.3 Farmacocinética
Adultos ≥18 años
Los perfiles farmacocinéticos (PK) de IDELVION se evaluaron después de inyecciones intravenosas de dosis únicas de 25, 50 o 75 UI/kg. Los parámetros PK se basaron en la actividad del Factor IX plasmático medida por el ensayo de coagulación de un solo paso. Se recolectaron muestras de sangre para el análisis PK antes de la dosificación y hasta 336 horas (14 días) después de la dosificación.
La Tabla 4 proporciona los parámetros farmacocinéticos después de una dosis única de 25 UI/kg, 50 UI/kg o 75 UI/kg de IDELVION.
| Parámetros PK | rIX-FP 25 (UI/kg) (N=7) |
rIX-FP 50 (UI/kg) (N=47) |
rIX-FP 75 (UI/kg) (N=8) |
|---|---|---|---|
| IR = recuperación incremental registrada 30 minutos después de la inyección; AUC = área bajo la curva tiempo de actividad del Factor IX; t1/2 = vida media; MRT = tiempo de residencia medio; CL = aclaramiento ajustado al peso corporal; Vss = volumen de distribución en estado estacionario ajustado al peso corporal. | |||
|
|||
| IR (UI/dL)/(UI/kg) | 1.65 (11) | 1.30 (24) | 1.08 (20) |
| Cmax (UI/dL) | 41.1 (13) | 66.6 (27) | 82.0 (20) |
| AUC0-inf (h*UI/dL) | 4658 (36) | 7482 (28) | 9345 (20) |
| t1/2 (horas) | 118 (38) | 104 (25) | 104 (18) |
| MRT (horas) | 153 (24) | 143 (23) | 145 (14) |
| CL (mL/h/kg) | 0.57 (31) | 0.73 (27) | 0.84 (20) |
| Vss (dL/kg) | 0.86 (32) | 1.02 (28) | 1.20 (23) |
| Tiempo hasta el 1% de actividad del Factor IX (días)* | 22 (25) | 23 (19) | 25 (13) |
| Tiempo hasta el 3% de actividad del Factor IX (días)* | 14 (19) | 17 (19) | 18 (13) |
| Tiempo hasta el 5% de actividad del Factor IX (días)* | 10 (25) | 13 (20) | 15 (13) |
Los parámetros farmacocinéticos de IDELVION tras la administración de dosis únicas o repetidas durante un máximo de 30 semanas fueron similares.
Sujetos <18 años
Los parámetros farmacocinéticos de IDELVION se evaluaron en 5 adolescentes (de 12 a <18 años de edad) y 27 niños (de 0 a <12 años de edad) en estudios abiertos, multicéntricos, tras una inyección intravenosa de 50 UI/kg de IDELVION. Las muestras farmacocinéticas se recogieron antes de la administración y en múltiples puntos de tiempo hasta 336 horas (14 días) después de la administración.
La Tabla 5 resume los parámetros farmacocinéticos calculados a partir de los datos pediátricos de 32 sujetos, de 0 a <18 años de edad. Los parámetros estimados se basaron en el perfil de actividad del Factor IX plasmático en función del tiempo. En comparación con los adultos, la recuperación incremental es menor (del 15% al 27%) y el aclaramiento ajustado al peso corporal es mayor (del 45% al 62%) en los niños.
| Parámetros farmacocinéticos | De 0 a <6 años (N=12) |
De 6 a <12 años (N=15) |
De 12 a <18 años (N=5) |
|---|---|---|---|
| IR = recuperación incremental registrada 30 minutos después de la inyección; AUC = área bajo la curva tiempo-actividad del Factor IX; t1/2 = semivida; MRT = tiempo medio de residencia; CL = aclaramiento ajustado al peso corporal; Vss = volumen de distribución en estado estacionario ajustado al peso corporal. | |||
|
|||
| IR (UI/dL)/(UI/kg) | 0.95 (22) | 1.06 (23) | 1.11 (28) |
| Cmax (UI/dL) | 48.3 (19) | 52.9 (23) | 55.3 (28) |
| AUC0-inf (h*UI/dL) | 4583 (33) | 5123 (31) | 5347 (48) |
| t1/2 (horas) | 90 (13) | 93 (21) | 87 (36) |
| MRT (horas) | 123 (14) | 129 (19) | 119 (31) |
| CL (mL/h/kg) | 1.18 (28) | 1.06 (29) | 1.08 (39) |
| Vss (dL/kg) | 1.42 (24) | 1.32 (20) | 1.16 (14) |
| Tiempo hasta el 1% de actividad del Factor IX (días) * | 17 (29) | 20 (22) | 19 (37) |
| Tiempo hasta el 3% de actividad del Factor IX (días) * | 12 (32) | 14 (22) | 13 (38) |
| Tiempo hasta el 5% de actividad del Factor IX (días) * | 9 (32) | 11 (26) | 11 (38) |
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
No se han realizado estudios no clínicos para evaluar el potencial carcinogénico de IDELVION.
No se observaron patologías macroscópicas o microscópicas en los órganos reproductivos de los animales a los que se administró diariamente durante 28 días con 6,7 veces la dosis clínica profiláctica máxima recomendada de 75 UI/kg de IDELVION. No se realizaron estudios en animales con respecto al deterioro de la fertilidad después de la administración de IDELVION.
14 ESTUDIOS CLÍNICOS
La seguridad y eficacia de IDELVION se evaluaron en un estudio clínico prospectivo, abierto, multicéntrico de 63 pacientes masculinos previamente tratados (PTPs) con hemofilia B (≤2% de actividad del Factor IX endógeno) que recibieron al menos una infusión de IDELVION como parte del tratamiento a demanda y control de episodios hemorrágicos, manejo perioperatorio de procedimientos quirúrgicos, dentales u otros invasivos mayores y menores, profilaxis de rutina una vez cada 7, 10 o 14 días, o evaluación farmacocinética. Los sujetos tenían entre 12 y 61 años; incluidos 7 sujetos adolescentes de 12 a 17 años. Los sujetos fueron tratados durante un máximo de 27 meses.
Tratamiento a demanda y control de episodios hemorrágicos
Se trataron un total de 358 eventos hemorrágicos con IDELVION. De ellos, 204 (57%) eventos hemorrágicos fueron espontáneos, 140 (39%) eventos fueron traumáticos y 14 (4%) eventos fueron desconocidos. Además, un total de 267 (75%) episodios fueron eventos hemorrágicos en las articulaciones.
La eficacia general del tratamiento se evaluó para cada episodio hemorrágico por el investigador en función de una escala de 4 puntos de excelente, buena, moderada o mala/sin respuesta. La eficacia de IDELVION para el tratamiento a demanda y el control de los episodios hemorrágicos se resume en la Tabla 6.
| Número de episodios hemorrágicos que requieren tratamiento (n = 358) | |
|---|---|
|
|
| Número de inyecciones para tratar episodios hemorrágicos | |
| 1 inyección, n (%) | 335 (94) |
| 2 inyecciones, n (%) | 18 (5) |
| >2 inyecciones, n (%) | 5 (1.4) |
| Evaluación de la eficacia* | |
| Excelente o Bueno, n (%) | 337 (94) |
| Moderado, n (%) | 9 (2.5) |
| Pobre/sin respuesta, n (%) | 1 (0.3) |
Manejo Perioperatorio del Sangrado
En los dos estudios de eficacia y el estudio de extensión, un total de 20 sujetos (de 5 a 59 años de edad) recibieron IDELVION para el manejo perioperatorio de 29 procedimientos quirúrgicos. La dosis se individualizó en función de la farmacocinética del sujeto y la respuesta clínica al tratamiento. Estos incluyeron cirugías ortopédicas (n=14), una mastectomía con liposucción (n=1), una hemorroidectomía (n=2), rinoplastia, resección submucosa y turbinectomía inferior (n=1), circuncisión (n=3), extracciones dentales (n=5), embolización de varicocele escrotal (n=1), escisión de nevo pigmentado (n=1) y resección endoscópica de la mucosa (n=1).
Se utilizó un solo bolo preoperatorio en el 97% (n=28) de las cirugías. La eficacia hemostática se calificó como excelente o buena para todas las cirugías en todos los puntos de tiempo para los que se informó la respuesta hemostática, excepto para una evaluación que se calificó como moderada en la evaluación de las 48 horas. Durante el período postoperatorio de 14 días, los pacientes recibieron entre 0 y 11 infusiones y el consumo de FIX estuvo entre 0 y 444.1 UI/kg. Seis pacientes que se sometieron a cirugía fueron dados de alta del sitio de tratamiento quirúrgico el mismo día.
Profilaxis de Rutina
De los 63 sujetos tratados con IDELVION, veintitrés PTP recibieron IDELVION solo para el tratamiento de episodios de sangrado durante los primeros 6 meses del estudio. Diecinueve de estos PTP cambiaron a profilaxis semanal con una duración mediana adicional de 10 meses.
Con base en el análisis de los 19 sujetos tratados con IDELVION para terapia a demanda y profilaxis semanal, la tasa anualizada mediana de sangrado espontáneo (AsBR) durante el tratamiento de profilaxis fue de 0.7 (rango: 0 a 4.2), en comparación con 15.4 (rango: 2 a 39.5) durante el tratamiento a demanda. Con base en el modelo de Poisson, el tratamiento de profilaxis con IDELVION resultó en una reducción del 93% en la tasa anualizada de sangrado espontáneo.
La tasa anualizada mediana de sangrado (ABR total – espontáneo y traumático) durante el tratamiento de profilaxis fue de 1.6; (rango: 0 a 21.1), en comparación con 19.2; (rango: 2 a 46.1) durante el tratamiento a demanda. Con base en el modelo de Poisson, el tratamiento de profilaxis con IDELVION resultó en una reducción del 88% en la tasa anualizada de sangrado.
| Etiología del Episodio de Sangrado | A demanda (n=19)* | Profilaxis semanal (n=19)* |
Porcentaje de reducción con profilaxis (n=19)* |
|---|---|---|---|
| IQR=rango intercuartílico, definido para el percentil 25th y el percentil 75th; SD=desviación estándar; Los sujetos evaluables para la eficacia son los sujetos que recibieron al menos una dosis de tratamiento a demanda y una dosis de tratamiento de profilaxis. | |||
| Espontáneo | |||
| Media (SD) | 14.6 (8.42) | 0.9 (1.17) | 93.5 (8.03) |
| Mediana | 15.4 | 0.7 | 95.9 |
| IQR | 8.0, 18.0 | 0, 1.6 | 89.0, 100 |
| Rango | 2.0, 39.5 | 0, 4.2 | 75.2, 100 |
| Total† | |||
| Media (SD) | 20.8 (9.19) | 2.9 (4.79) | 88.0 (14.06) |
| Mediana | 19.2 | 1.6 | 90.9 |
| IQR | 16.7, 25.8 | 0, 4.3 | 81.2, 100 |
| Rango | 2.0, 46.1 | 0, 21.1 | 54.3, 100 |
Cuarenta sujetos recibieron profilaxis rutinaria semanal. Treinta y siete sujetos completaron 6 meses de profilaxis una vez por semana. De estos, 21 sujetos cambiaron a un intervalo de 14 días con 50-75 UI/kg de IDELVION con una duración mediana de 12,7 meses. Antes de cambiar, estos 21 sujetos estaban bien controlados con IDELVION (no requirieron ajustes de dosis ni experimentaron sangrado espontáneo 1 mes antes del cambio y se mantuvieron en una dosis de profilaxis de ≤40 UI/kg cada 7 días).
Las AsBR medianas para los 21 sujetos tratados con profilaxis semanal y de 14 días fueron cero (rango: 0 a 4,5) y cero (rango: 0 a 7,3), respectivamente (resumido en la Tabla 8). Además, las AsBR medianas para los 7 sujetos tratados con profilaxis semanal y de 10 días fueron cero (rango: 0 a 0) y cero (rango: 0 a 0,9), respectivamente.
| Etiología del episodio de sangrado | Profilaxis semanal (n=21)* |
Profilaxis de 14 días (n=21)* |
|---|---|---|
| IQR = rango intercuartílico; SD = desviación estándar | ||
|
||
| Espontáneo | ||
| Media (SD) | 0,28 (1,01) | 1,07 (2,1) |
| Mediana | 0 | 0 |
| IQR | 0, 0 | 0, 1 |
| Rango | 0, 4,5 | 0, 7,3 |
Profilaxis rutinaria y control del sangrado en PTP <12 años
La seguridad, la eficacia y la farmacocinética de IDELVION se han evaluado en pacientes pediátricos previamente tratados (PTP) de uno (1) a <12 años de edad. Un total de 27 varones, 12 pacientes <6 años de edad y 15 pacientes entre 6 y <12 años de edad, recibieron IDELVION para la profilaxis y el control de los episodios de sangrado. Los 27 sujetos recibieron tratamiento de profilaxis semanal con IDELVION durante un tiempo medio en el estudio de 13,1 meses (rango: 9, 18 meses).
El régimen semanal rutinario con rIX-FP fue eficaz en la profilaxis de los episodios de sangrado. La mediana (Q1, Q3) ABR (total de episodios de sangrado, incluidos los no tratados) y la tasa anualizada de sangrado espontáneo (AsBR) durante el tratamiento de profilaxis en la población de eficacia fueron de 3,41 [1,18,7,44] y 0 [0, 1,34] episodios de sangrado/sujeto/año, respectivamente. La ABR media fue de 4,55 episodios de sangrado/año/sujeto y la AsBR media fue de 0,79 en base al total de episodios de sangrado tratados y no tratados. Las articulaciones diana (definidas como 3 o más sangrados espontáneos en una sola articulación dentro de un período consecutivo de 6 meses) reportadas en 3 sujetos antes de la entrada al estudio se resolvieron durante el estudio. Todos los sujetos mantuvieron un régimen de profilaxis rutinaria semanal durante todo el estudio.
De los 106 episodios de sangrado, la mayoría (94;89%) se trató con una sola inyección, 103 (97%) se trataron con 1-2 inyecciones. La eficacia hemostática en la resolución de un sangrado se calificó como excelente o buena en el 96% de todos los episodios de sangrado tratados.
15 REFERENCIAS
- Wilmot HV, Hogwood J, Gray E. Factor IX recombinante: discrepancias entre el ensayo de coagulación de un solo paso y los ensayos cromogénicos. Haemophilia 2014, 1-7.
- Fritsma GA, Dembitzer FR, Randhawa A, et al. Recomendaciones para la selección y utilización apropiadas del reactivo de tiempo de tromboplastina parcial activado. Am J Clin Pathol 2012;137:904-908.
- Sommer JM, Buyue Y, Bardan S, Peters RT, Jiang H, Kamphaus G, Gray E, Pierce GF. Estudio de campo comparativo: impacto de la variabilidad del ensayo de laboratorio en la evaluación de la actividad de la proteína de fusión rFIXFc (factor IX recombinante Fc). Thrombosis and Haemostasis 2014, 112(5):932-40.
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
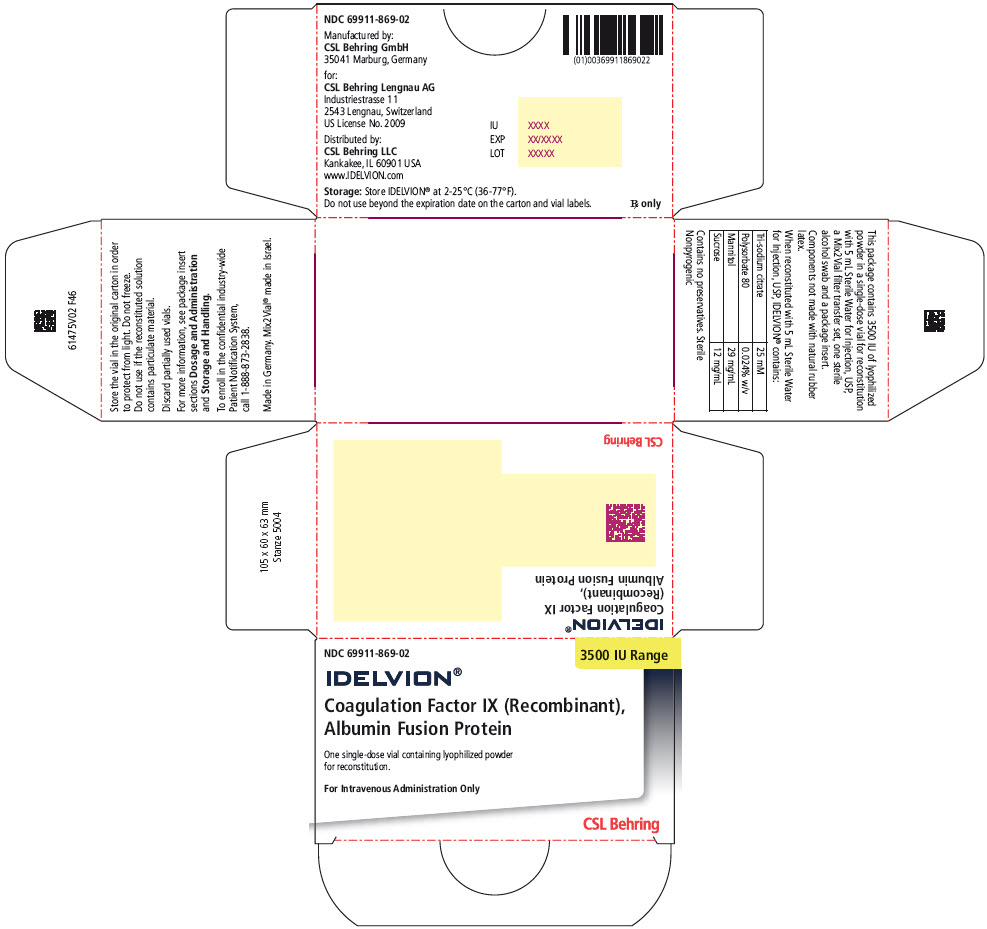
IDELVION se suministra como un polvo liofilizado en viales de dosis única que contienen la cantidad etiquetada de actividad del Factor IX, expresada en unidades internacionales (UI).
IDELVION se envasa con 2,5 mL (para la reconstitución de viales de 250, 500 o 1000 UI) o 5 mL (para la reconstitución de viales de 2000 o 3500 UI) de Agua estéril para inyección, USP, un juego de transferencia de filtro Mix2Vial y una torunda de alcohol estéril. Los componentes no están hechos con látex de caucho natural.
| Fuerza nominal (Unidades internacionales) |
Tamaño de llenado Indicador de color |
Kit NDC |
|---|---|---|
| 250 | Naranja | 69911-864-02 |
| 500 | Azul | 69911-865-02 |
| 1000 | Verde | 69911-866-02 |
| 2000 | Morado | 69911-867-02 |
| 3500 | Amarillo | 69911-869-02 |
Almacenamiento y manipulación
- Almacene IDELVION en su envase para protegerlo de la luz.
- Almacene el envase de IDELVION en el refrigerador o a temperatura ambiente de 2-25 °C (36 a 77 °F). No congelar.
- No utilice IDELVION o el diluyente de Agua estéril para inyección después de la fecha de caducidad impresa en las etiquetas del cartón y del vial.
17 INFORMACIÓN PARA EL PACIENTE
- Aconseje a los pacientes que lean el etiquetado del paciente aprobado por la FDA (Información para el paciente e Instrucciones de uso).
- Aconseje a los pacientes que informen a su proveedor de atención médica sobre cualquier reacción adversa o problema después de la administración de IDELVION.
- Informe a los pacientes sobre los signos y síntomas tempranos de hipersensibilidad o reacciones alérgicas (incluidos urticaria, urticaria generalizada, opresión en el pecho, sibilancias e hipotensión). Indique a los pacientes que suspendan el uso de IDELVION y que se pongan en contacto con su proveedor de atención médica y/o busquen atención médica de emergencia inmediata si se presentan estos síntomas [ver Advertencias y precauciones (5.1)].
- Aconseje a los pacientes que se pongan en contacto con su proveedor de atención médica o centro de tratamiento de hemofilia para recibir tratamiento adicional y/o evaluación si experimentan una falta de respuesta clínica a la terapia de reemplazo del Factor IX, ya que en algunos casos esto puede ser una manifestación de un inhibidor [ver Advertencias y precauciones (5.2)].
SECCIÓN NO CLASIFICADA SPL
Fabricado por:
CSL Behring GmbH
35041 Marburg, Alemania
para:
CSL Behring Lengnau AG
Biotech Innovation Park
2543 Lengnau, Suiza
Licencia de EE. UU. No. 2009
Distribuido por:
CSL Behring LLC
Kankakee, IL 60901 EE. UU.
IDELVION® se fabrica bajo licencia de Novozymes Biopharma A/S, Bagsvaerd, Dinamarca.
Mix2Vial® es una marca registrada de West Pharma. Services IL, Ltd., una subsidiaria de West Pharmaceutical Services, Inc.
Etiquetado del Paciente Aprobado por la FDA
IDELVION® (eye del’ vee on),
Coagulation Factor IX (Recombinant), Albumin Fusion Protein
Este folleto resume información importante sobre IDELVION. Léalo detenidamente antes de usar IDELVION. Esta información no reemplaza la conversación con su proveedor de atención médica y no incluye toda la información importante sobre IDELVION. Si tiene alguna pregunta después de leer esto, consulte a su proveedor de atención médica.
¿Qué es IDELVION?
IDELVION, Coagulation Factor IX (Recombinant), Albumin Fusion Protein es un medicamento inyectable que se utiliza para reemplazar el factor de coagulación (Factor IX) que falta en personas con hemofilia B (también llamada deficiencia congénita de Factor IX o enfermedad de Christmas). La hemofilia B es un trastorno hemorrágico hereditario que evita que la sangre coagule normalmente. IDELVION se utiliza en niños y adultos con hemofilia B para controlar y prevenir episodios de sangrado. Su proveedor de atención médica puede administrarle IDELVION cuando se someta a una cirugía. IDELVION puede reducir la cantidad de episodios de sangrado cuando se usa regularmente (profilaxis).
¿Quién no debe usar IDELVION?
No debe usar IDELVION si:
- ha tenido reacciones de hipersensibilidad potencialmente mortales a IDELVION
- es alérgico a las proteínas del hámster
- es alérgico a cualquier ingrediente de IDELVION
Informe a su proveedor de atención médica si ha tenido una reacción alérgica a cualquier producto del Factor IX antes de usar IDELVION.
Informe a su proveedor de atención médica si está embarazada o amamantando porque IDELVION puede no ser adecuado para usted.
¿Qué debo decirle a mi proveedor de atención médica antes de usar IDELVION?
Debe informar a su proveedor de atención médica si:
- tiene o ha tenido algún problema médico
- toma algún medicamento, incluidos los medicamentos recetados y de venta libre, como los medicamentos de venta libre, los suplementos o los remedios herbales
- tiene alguna alergia, incluidas las alergias a las proteínas del hámster
- está amamantando. No se sabe si IDELVION pasa a la leche materna y si puede dañar a su bebé.
- está embarazada o planea quedar embarazada. No se sabe si IDELVION puede dañar a su bebé por nacer.
- le han dicho que tiene inhibidores del Factor IX (porque IDELVION puede no funcionar para usted).
¿Cómo debo administrar IDELVION?
- IDELVION se administra directamente en el torrente sanguíneo.
- IDELVION debe administrarse según lo ordenado por su proveedor de atención médica.
- Su proveedor de atención médica o el centro de tratamiento de la hemofilia deben capacitarlo sobre cómo realizar las inyecciones. Muchas personas con hemofilia B aprenden a inyectarse IDELVION por sí mismas o con la ayuda de un familiar. Consulte la guía paso a paso (Instrucciones de uso) que se proporciona al final de este folleto para obtener instrucciones sobre cómo mezclar e infundir IDELVION.
- Su proveedor de atención médica le dirá cuánta IDELVION debe usar en función de su peso, la gravedad de su hemofilia B y dónde está sangrando.
- Es posible que deba hacerse análisis de sangre después de recibir IDELVION para asegurarse de que su nivel de Factor IX en sangre sea lo suficientemente alto como para coagular su sangre.
- Llame a su proveedor de atención médica de inmediato si su sangrado no se detiene después de tomar IDELVION.
¿Cuáles son los posibles efectos secundarios de IDELVION?
Se han reportado reacciones alérgicas e hipersensibilidad con IDELVION. Llame a su proveedor de atención médica de inmediato y suspenda el tratamiento si tiene erupción o urticaria, picazón, opresión en el pecho o la garganta, dificultad para respirar, mareos, aturdimiento, náuseas o disminución de la presión arterial.
Su cuerpo puede producir anticuerpos, llamados inhibidores, contra el Factor IX que pueden impedir que IDELVION funcione correctamente. Es posible que su proveedor de atención médica deba analizar su sangre para detectar inhibidores de vez en cuando.
IDELVION puede aumentar el riesgo de formación de coágulos sanguíneos anormales en su cuerpo, especialmente si tiene factores de riesgo para desarrollar coágulos sanguíneos. Llame a su proveedor de atención médica si tiene dolor en el pecho, dificultad para respirar, sensibilidad o hinchazón en las piernas.
Los efectos secundarios más comunes de IDELVION son dolor de cabeza y mareos.
Este no es el único efecto secundario posible con IDELVION. Para obtener más información, hable con su proveedor de atención médica o farmacéutico. Informe a su proveedor de atención médica sobre cualquier efecto secundario que le moleste o que no desaparezca.
¿Cuáles son las concentraciones de dosis de IDELVION?
IDELVION viene en cinco concentraciones de dosis diferentes: 250, 500, 1000, 2000 o 3500 UI. La concentración real de IDELVION está impresa en la caja y la etiqueta del vial. El etiquetado de las cinco concentraciones de dosis está codificado por colores como se proporciona en la Tabla 1 a continuación.
| Indicador de color del tamaño de llenado | Concentración nominal |
|---|---|
| Naranja | 250 UI |
| Azul | 500 UI |
| Verde | 1000 UI |
| Morado | 2000 UI |
| Amarillo | 3500 UI |
Siempre verifique la concentración de dosis real impresa en la etiqueta para asegurarse de que está utilizando la concentración prescrita por su proveedor de atención médica.
¿Cómo debo almacenar IDELVION?
- Guarde el vial en la caja original para protegerlo de la luz.
- Almacene a 2-25 °C (36-77 °F). No congelar.
- No use IDELVION después de la fecha de vencimiento impresa en la etiqueta.
- El producto reconstituido (después de mezclar el producto seco con el diluyente) debe usarse dentro de las 4 horas y no se puede almacenar ni refrigerar. Deseche cualquier IDELVION que quede en el vial al final de su infusión.
¿Qué más debo saber sobre IDELVION?
- No use IDELVION para una condición para la que no está prescrito.
- No comparta IDELVION con otras personas, incluso si tienen los mismos síntomas que usted.
INSTRUCCIONES DE USO
Para uso intravenoso después de la reconstitución únicamente.
No intente realizar una inyección intravenosa a menos que haya sido instruido sobre cómo hacerlo por su proveedor de atención médica o centro de hemofilia.
Siga siempre las instrucciones específicas que le dé su proveedor de atención médica. Los pasos que se enumeran a continuación son pautas generales para el uso de IDELVION. Si no está seguro de las instrucciones, llame a su proveedor de atención médica antes de usar IDELVION. Llame a su proveedor de atención médica de inmediato si el sangrado no se controla después de usar IDELVION. Su proveedor de atención médica le recetará la dosis que debe tomar. Es posible que deba hacerse análisis de sangre de vez en cuando. Hable con su proveedor de atención médica antes de viajar. Deseche toda la solución no utilizada, el vial (es) vacío y otros suministros médicos usados en un contenedor de residuos médicos adecuado.
- Trabaje siempre en una superficie limpia y plana y lávese las manos antes de realizar los procedimientos de mezcla (reconstitución).
- Mezcle (reconstituya) IDELVION usando el diluyente (Agua estéril para inyección) y el dispositivo de transferencia (Mix2Vial) proporcionados en el kit.
- Para administrar una inyección, también necesitará una jeringa y una aguja adecuada (no proporcionadas).
- Si un paquete está abierto o dañado, no lo use y comuníquese con su proveedor de atención médica.
- No use IDELVION después de la fecha de vencimiento que figura en la etiqueta del vial y la caja.
- Observe la solución mezclada (reconstituida). No use IDELVION si la solución reconstituida está turbia, contiene partículas o está descolorida.
- Cada vial de IDELVION es solo para una sola dosis. No contiene conservantes. Deseche los viales parcialmente utilizados.
- Asegúrese de que los viales de IDELVION y el Agua estéril para inyección estén a temperatura ambiente antes de mezclar.
- Siga las instrucciones de reconstitución como se describe a continuación.
Instrucciones de reconstitución de IDELVION
- Coloque el vial de IDELVION, el vial de diluyente y el juego de transferencia Mix2Vial® en una superficie plana.
- Retire las tapas abatibles de los viales de IDELVION y Agua estéril para inyección (diluyente).
- Limpie los tapones con la torunda de alcohol estéril proporcionada y deje que se sequen antes de abrir el paquete del juego de transferencia Mix2Vial.
- Abra el paquete del juego de transferencia Mix2Vial pelando la tapa (Fig. 1). No retire el dispositivo del paquete.
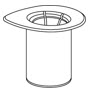
Fig. 1 - Coloque el vial de diluyente en una superficie plana y sostenga el vial con firmeza. Agarre el juego de transferencia Mix2Vial junto con el paquete transparente y empuje la espiga de plástico en el extremo azul del juego de transferencia Mix2Vial firmemente a través del centro del tapón del vial de diluyente (Fig. 2).
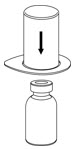
Fig. 2 - Retire con cuidado el paquete transparente del juego de transferencia Mix2Vial. No retire el juego de transferencia Mix2Vial ni toque el extremo expuesto del dispositivo (Fig. 3).
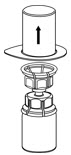
Fig. 3 - Con el vial de IDELVION colocado firmemente en una superficie plana, invierta el vial de diluyente con el juego de transferencia Mix2Vial conectado y empuje la espiga de plástico del adaptador transparente firmemente a través del centro del tapón del vial de IDELVION (Fig. 4). El diluyente se transferirá automáticamente al vial de IDELVION.
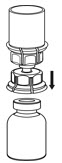
Fig. 4 - Con el diluyente y el vial de IDELVION aún conectados al juego de transferencia Mix2Vial, gire suavemente el vial de IDELVION para asegurarse de que el polvo esté completamente disuelto (Fig. 5). No agite el vial.
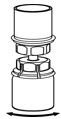
Fig. 5 - Con una mano, agarre el lado de IDELVION del juego de transferencia Mix2Vial y con la otra mano agarre el lado azul del diluyente del juego de transferencia Mix2Vial, y desenrosque el juego en dos piezas (Fig. 6).
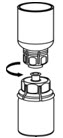
Fig. 6 - Aspire aire en una jeringa estéril vacía. Mientras el vial de IDELVION está en posición vertical, enrosque la jeringa al juego de transferencia Mix2Vial. Inyecte aire en el vial de IDELVION.
- Mientras mantiene el émbolo de la jeringa presionado, invierta el sistema boca abajo y aspire el concentrado en la jeringa tirando del émbolo lentamente (Fig. 7).
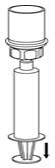
Fig. 7 - Desconecte la jeringa llena desenroscándola del juego de transferencia Mix2Vial (Fig. 8). La solución reconstituida debe ser una solución transparente o de color amarillo a incolora. No lo use si observa partículas o decoloración.
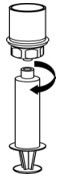
Fig. 8 - Use inmediatamente o dentro de las 4 horas de la reconstitución. Mantenga la solución a temperatura ambiente. No refrigerar después de la reconstitución.
- Si la dosis requiere más de un vial, utilice un juego de transferencia Mix2Vial separado y sin usar y un vial de Agua estéril para inyección (diluyente) para cada vial de producto. Repita los pasos 10-12 para juntar el contenido de los viales en una jeringa.
- Registrar el tratamiento: Retire la parte despegable de la etiqueta de cada vial utilizado y adhiérala al diario/libro de registro del tratamiento del paciente.
Administración (inyección intravenosa)
- No mezcle IDELVION en el mismo tubo o contenedor con otros productos medicinales.
- Conecte la jeringa que contiene la solución reconstituida de IDELVION a un equipo de infusión estéril y administre una inyección según las indicaciones de su proveedor de atención médica o centro de tratamiento de hemofilia.
- Administrar por vía intravenosa. No exceda la velocidad de infusión de 10 mL por minuto.
Recursos disponibles para el paciente en CSL Behring:
Para reportar reacciones adversas, comuníquese con:
Departamento de Farmacovigilancia de CSL Behring al 1-866-915-6958Comuníquese con CSL Behring para recibir más información sobre el producto:
Línea de atención al paciente al 1-800-676-4266Para obtener más información, visite www.IDELVION.com
Fabricado por:
CSL Behring GmbH
35041 Marburg, Alemaniapara:
CSL Behring Lengnau AG
Biotech Innovation Park
2543 Lengnau, Suiza
Licencia de EE. UU. No. 2009Distribuido por:
CSL Behring LLC
Kankakee, IL 60901 EE. UU.IDELVION® se fabrica bajo licencia de Novozymes Biopharma A/S, Bagsvaerd, Dinamarca.
Mix2Vial® es una marca registrada de West Pharma. Services IL, Ltd., una subsidiaria de West Pharmaceutical Services, Inc.
Revisado: 6/2023
Panel de visualización principal – Kit de cartón de rango de 250 IU
NDC 69911-864-02
Rango de 250 UI
IDELVION®
Factor IX de coagulación (recombinante),
Proteína de fusión con albúminaUn vial de uso único que contiene polvo liofilizado
para reconstituição.Sólo para administración intravenosa
CSL Behring

PANEL DE DISPLAY PRINCIPAL – Kit de caja para el rango de 500 UI
NDC 69911-865-02
Rango 500 UI
IDELVION®
Factor IX de coagulación (recombinante),
Proteína de fusión con albúminaUn vial de uso único que contiene polvo liofilizado
para reconstitución.Solo para administración intravenosa
CSL Behring

PANEL PRINCIPAL DE DESPLIEGUE – Kit de cartón de rango de 1000 UI
NDC 69911-866-02
1000 UI Rango
IDELVION®
Factor IX de coagulación (recombinante),
Proteína de fusión de albúminaUn vial de uso único que contiene polvo liofilizado
para reconstitución.Solo para administración intravenosa
CSL Behring

Panel de visualización principal – Kit en cartón con rango de 2000 UI
NDC 69911-867-02
2000 UI Rango
IDELVION®
Factor IX de coagulación (recombinante),
Proteína de fusión con albúminaUn vial de uso único que contiene polvo liofilizado
para reconstitución.Solo para administración intravenosa
CSL Behring

PANEL DE EXHIBICIÓN PRINCIPAL – Kit Cartón de 3500 UI de Rango
NDC 69911-869-02
3500 UI Rango
IDELVION®
Factor IX de Coagulación (Recombinante),
Proteína de Fusión con AlbúminaUn vial de uso único que contiene polvo liofilizado
para reconstitución.Para administración intravenosa solamente
CSL Behring
 Tags: F10
Tags: F10

