Fabricante de medicamentos: CSL Behring GmbH (Updated: 2020-08-17)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
HUMATE-P de forma segura y eficaz. Consulte la información completa de prescripción para HUMATE-P.
HUMATE-P [Complejo de factor antihemofílico/von Willebrand (humano)]
Polvo liofilizado para reconstitución para uso intravenoso solamente.
Primera aprobación en EE. UU.: 1986
INDICACIONES Y USOS
HUMATE-P es un Complejo de Factor Antihemofílico/von Willebrand (VWF) (humano) indicado para:
- Hemofilia A – Tratamiento y prevención de hemorragias en adultos. (1.1)
- Enfermedad de Von Willebrand (VWD) – en adultos y pacientes pediátricos en el (1) Tratamiento de episodios hemorrágicos espontáneos e inducidos por trauma, y (2) Prevención de hemorragia excesiva durante y después de la cirugía. Esto se aplica a pacientes con VWD severa, así como a pacientes con VWD leve a moderada en los que se sabe o se sospecha que el uso de desmopresina es insuficiente. (1.2) HUMATE-P no está indicado para la profilaxis de episodios hemorrágicos espontáneos en VWD.
DOSIFICACIÓN Y ADMINISTRACIÓN
Solo para uso intravenoso.
Hemofilia A
- Una Unidad Internacional (IU) de actividad del factor VIII (FVIII) por kg de peso corporal aumenta el nivel circulante de FVIII en aproximadamente 2.0 IU/dL. Individualizar la dosis en función del peso del paciente, tipo y gravedad de la hemorragia, nivel de FVIII y presencia de inhibidores. (2.1)
VWD
- Tratamiento de episodios hemorrágicos – 40-80 IU de VWF: Ristocetina Cofactor (RCo) por kg de peso corporal (BW) cada 8-12 horas. (2.2)
- Prevención de hemorragia excesiva durante y después de la cirugía en todos los tipos de VWD. (2.3)
| Tipo de cirugía (ver Tabla 3 para la dosificación quirúrgica completa) |
Cálculo de la dosis de carga La dosis inicial de mantenimiento debe ser la mitad de la dosis de carga (ver Tabla 4 para las recomendaciones de monitorización). |
|
|---|---|---|
|
||
| Cirugía mayor (2.3) | Δ* VWF: RCo × BW (kg) IVR† |
= IU VWF: RCo requeridas |
| Cirugía menor / Oral‡ (2.3) | Δ* VWF: RCo × BW (kg) IVR |
= IU VWF: RCo requeridas |
| Cirugía de urgencia (2.3) | Administrar una dosis de 50-60 IU VWF: RCo/kg BW | |
FORMAS Y POTENCIAS DE DOSIFICACIÓN
HUMATE-P está disponible como un polvo liofilizado en frascos de dosis unitaria que contiene la cantidad etiquetada de VWF: RCo y la actividad de FVIII expresada en IU. La relación promedio de VWF: RCo a FVIII es 2.4: 1. Las potencias aproximadas se muestran a continuación: (3 )
| VWF: RCo/frasco | FVIII/frasco | Diluente |
|---|---|---|
| 600 IU | 250 IU | 5 mL |
| 1200 IU | 500 IU | 10 mL |
| 2400 IU | 1000 IU | 15 mL |
CONTRAindicaciones
Reacción anafiláctica o sistémica grave a factor antihemofílico o preparaciones de VWF. (4)
ADVERTENCIAS Y PRECAUCIONES
- Los pacientes con VWD que reciben HUMATE-P pueden correr el riesgo de desarrollar eventos tromboembólicos. (5.1)
- Monitorizar la hemólisis intravascular y la disminución de los valores de hematocrito en los pacientes con grupos sanguíneos A, B y AB que estén recibiendo dosis grandes o frecuentes. (5.2)
- Monitorizar los niveles de VWF:RCo y FVIII en pacientes con VWD, especialmente aquellos que se someten a cirugía. (5.3)
- Los productos hechos de sangre humana pueden contener agentes infecciosos (por ejemplo, virus, el agente de la enfermedad variante de Creutzfeldt-Jakob (vCJD) y, en teoría, el agente de la enfermedad de Creutzfeldt-Jakob (CJD). (5.4)
REACCIONES ADVERSAS
Las reacciones adversas más comunes observadas en más del 5% de los sujetos después de recibir HUMATE-P son las reacciones alérgicas-anafilácticas (por ejemplo, urticaria, opresión en el pecho, erupción cutánea, prurito, edema) y, en pacientes que se someten a cirugía, sangrado en la herida postoperatoria y en el sitio de inyección, y epistaxis. (6)
Para reportar REACCIONES ADVERSAS SOSPECHOSAS, contacte a la farmacovigilancia de CSL Behring al 1-866-915-6958 o a la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
USO EN POBLACIONES ESPECÍFICAS
- Embarazo: No hay datos humanos o animales. Utilizar solo si es claramente necesario. (8.1)
- La eficacia hemostática de HUMATE-P se ha estudiado en 34 sujetos pediátricos con VWD. (8.4) Basado en los datos de un subconjunto de estos sujetos, la edad no tuvo efecto en la farmacocinética de VWF:RCo. (12.3)
Ver 17 para la INFORMACIÓN DE ASESORAMIENTO AL PACIENTE.
Revisado: 6/2020
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDOS *
1 INDICACIONES Y USO
1.1 Hemofilia A
1.2 Enfermedad de Von Willebrand (VWD)
2 DOSIS Y ADMINISTRACIÓN
2.1 Terapia para la Hemofilia A
2.2 Tratamiento de Episodios de Sangrado en VWD
2.3 Prevención de Sangrado Excesivo Durante y Después de la Cirugía en VWD
2.4 Reconstitucion
2.5 Administración
3 FORMAS Y FUERZAS DE DOSIS
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Eventos Tromboembólicos (Pacientes con VWD)
5.2 Monitoreo de Hemólisis Intravascular
5.3 Monitoreo de los Niveles de VWF:RCo y FVIII
5.4 Transmisión de Agentes Infecciosos
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Postcomercialización
7 INTERACCIONES MEDICAMENTOSAS
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Trabajo de Parto y Parto
8.3 Madres que Amamantan
8.4 Uso Pediátrico
8.5 Uso Geriatría
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.3 Farmacocinética
14 ESTUDIOS CLÍNICOS
14.1 Tratamiento de Episodios de Sangrado en VWD
14.2 Prevención de Sangrado Excesivo Durante y Después de la Cirugía en VWD
14.3 Estudios de Transmisión de Virus
15 REFERENCIAS
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
1 INDICACIONES Y USO
1.1 Hemofilia A
HUMATE-P, Complejo factor antihemofílico/von Willebrand (humano), se indica para el tratamiento y la prevención del sangrado en adultos con hemofilia A (hemofilia clásica).
1.2 Enfermedad de Von Willebrand (EVW)
HUMATE-P también se indica en pacientes adultos y pediátricos con enfermedad de Von Willebrand (EVW) para:
- (1)
- el tratamiento de episodios de sangrado espontáneo e inducido por trauma, y
- (2)
- la prevención de sangrado excesivo durante y después de la cirugía. Esto se aplica a pacientes con EVW grave así como a pacientes con EVW leve a moderada en los que el uso de desmopresina (DDAVP) se sabe o se sospecha que es inadecuado.
Los ensayos clínicos controlados para evaluar la seguridad y la eficacia de la dosificación profiláctica con HUMATE-P para prevenir el sangrado espontáneo no se han realizado en sujetos con EVW [ver Estudios clínicos (14)].
2 DOSIS Y ADMINISTRACIÓN
2.1 Tratamiento de la hemofilia A
Una Unidad Internacional (UI) de actividad del factor VIII (FVIII) por kg de peso corporal aumentará el nivel de FVIII circulante en aproximadamente 2,0 Unidades Internacionales (UI)/dL. La dosis debe individualizarse en función del peso del paciente, el tipo y gravedad de la hemorragia, el nivel de FVIII y la presencia de inhibidores. Se debe juzgar la idoneidad del tratamiento a partir de los efectos clínicos y, en todos los casos, se deben ajustar las dosis según el criterio clínico y el monitoreo frecuente del nivel de FVIII del paciente. La Tabla 1 proporciona recomendaciones de dosificación para el tratamiento de la hemofilia A en adultos.
| Evento hemorrágico | Dosis (UI FVIII:C/kg de peso corporal) |
|---|---|
| UI = Unidades Internacionales. | |
Hemorragia leve:
|
Dosis de carga 15 UI FVIII:C/kg para alcanzar un nivel plasmático de FVIII:C de aproximadamente el 30 % de lo normal; una infusión puede ser suficiente. Si es necesario, se puede administrar la mitad de la dosis de carga una vez o dos veces al día durante 1-2 días. |
Hemorragia moderada:
|
Dosis de carga 25 UI FVIII:C/kg para alcanzar un nivel plasmático de FVIII:C de aproximadamente el 50 % de lo normal, seguida de 15 UI FVIII:C/kg cada 8-12 horas durante los primeros 1-2 días para mantener el nivel plasmático de FVIII:C en el 30 % de lo normal. Continuar la misma dosis una vez o dos veces al día durante hasta 7 días o hasta que se produzca una cicatrización adecuada de la herida. |
Hemorragia que pone en peligro la vida:
|
Inicialmente 40-50 UI FVIII:C/kg, seguida de 20-25 UI FVIII:C/kg cada 8 horas para mantener el nivel plasmático de FVIII:C en el 80-100 % de lo normal durante 7 días. Continuar la misma dosis una vez o dos veces al día durante otros 7 días para mantener el nivel de FVIII:C en el 30-50 % de lo normal. |
2.2 Tratamiento de episodios hemorrágicos en la enfermedad de von Willebrand (VWD)
Administrar de 40 a 80 Unidades Internacionales (UI) de VWF:RCo (correspondiente a 17 a 33 Unidades Internacionales (UI) de FVIII en HUMATE-P) por kg de peso corporal cada 8 a 12 horas. Ajustar la dosis en función de la extensión y la ubicación de la hemorragia. Se deben administrar dosis repetidas durante el tiempo que sea necesario en función del monitoreo de las medidas clínicas y de laboratorio adecuadas [véase Advertencias y Precauciones (5.2, 5.3)]. Los niveles esperados de VWF:RCo se basan en una recuperación in vivo esperada (IVR) de 2,0 Unidades Internacionales (UI)/dL por Unidad Internacional (UI)/kg de VWF:RCo administrada. Se espera que la administración de 1 Unidad Internacional (UI) de FVIII por kg de peso corporal lleve a un aumento en el nivel circulante de VWF:RCo de aproximadamente 5 Unidades Internacionales (UI)/dL. La Tabla 2 proporciona recomendaciones de dosificación para pacientes adultos y pediátricos [véase Uso en poblaciones específicas (8.4)].2
| Tipo de VWD | Gravedad de la hemorragia | Dosis (UI* VWF:RCo/kg de peso corporal) |
|---|---|---|
| Tipo 1 VWD – Leve (actividad basal de VWF:RCo generalmente >30%) |
Hemorragia leve (p. ej., epistaxis, hemorragia oral, menorrhagia) |
Generalmente tratable con desmopresina. |
| Hemorragia leve (cuando se sepa o se sospeche que la desmopresina es insuficiente) Hemorragia grave† (p. ej., epistaxis severa o refractaria, hemorragia gastrointestinal, trauma en el SNC, hemorragia traumática) |
Dosis de carga 40-60 UI/kg. Luego 40-50 UI/kg cada 8-12 horas durante 3 días para mantener el nivel valle de VWF:RCo >50%. Luego 40-50 UI/kg al día durante hasta 7 días. |
|
| Tipo 1 VWD – Moderada o grave (VWF:RCo basal generalmente <30%) | Hemorragia leve (p. ej., epistaxis, hemorragia oral, menorrhagia) |
40-50 UI/kg (1 o 2 dosis). |
| Hemorragia grave (p. ej., epistaxis severa o refractaria, hemorragia gastrointestinal, trauma en el SNC, hemartrosis, hemorragia traumática) |
Dosis de carga 50-75 UI/kg. Luego 40-60 UI/kg cada 8-12 horas durante 3 días para mantener el nivel valle de VWF:RCo >50%. Luego 40-60 UI/kg al día durante hasta 7 días. |
|
| Tipo 2 VWD (todas las variantes) y Tipo 3 VWD | Hemorragia leve (indicaciones clínicas anteriores) |
40-50 UI/kg (1 o 2 dosis). |
| Hemorragia grave (indicaciones clínicas anteriores) |
Dosis de carga 60-80 UI/kg. Luego 40-60 UI/kg cada 8-12 horas durante 3 días para mantener el nivel valle de VWF:RCo >50%. Luego 40-60 UI/kg al día durante hasta 7 días. |
|
2.3 Prevención del sangrado excesivo durante y después de la cirugía en la enfermedad de von Willebrand (VWD)
La siguiente información proporciona pautas para calcular las dosis de carga y de mantenimiento de HUMATE-P en pacientes que se someten a cirugía. Sin embargo, en el caso de cirugía de emergencia, administrar una dosis de carga de 50 a 60 Unidades Internacionales (IU) de VWF:RCo/kg de peso corporal y, posteriormente, monitorear estrechamente los niveles de factor de coagulación en el valle del paciente.
Medir el IVR incremental y evaluar los niveles plasmáticos de VWF:RCo y FVIII:C en todos los pacientes antes de la cirugía cuando sea posible.
Para determinar el IVR:
- Medir el nivel basal de VWF:RCo en plasma.
- Infundir una dosis calculada [Unidades Internacionales (IU)/kg] del producto de VWF:RCo por vía intravenosa en “tiempo 0”.
- En “tiempo +30 minutos”, medir el nivel de VWF:RCo en plasma.
Usar la siguiente fórmula para calcular el IVR:
IVR = (VWF:RCo del plasmatiempo + 30 minutos – VWF:RCo del plasmabasal Unidades Internacionales (IU)/dL)
Dosis calculada (Unidades Internacionales (IU)/kg)
Por ejemplo, suponiendo un VWF:RCo basal de 30 Unidades Internacionales (IU)/dL en “tiempo 0”, una dosis calculada de 60 Unidades Internacionales (IU)/kg y un VWF:RCo de 120 Unidades Internacionales (IU)/dL en “tiempo + 30 minutos”, el IVR sería 1.5 Unidades Internacionales (IU)/dL por Unidad Internacional (IU)/kg de VWF:RCo administrada.
Dosis de carga
La Tabla 3 proporciona pautas para calcular la dosis de carga en adultos y pacientes pediátricos basándose en el nivel de VWF:RCo en plasma en el pico objetivo, el nivel de VWF:RCo basal, el peso corporal en kilogramos y el IVR. Cuando no se disponga de valores individuales de recuperación, se puede utilizar una dosis de carga estandarizada basándose en un IVR de VWF:RCo asumido de 2.0 Unidades Internacionales (IU)/dL por Unidad Internacional (IU)/kg de VWF:RCo administrada.
| Tipo de cirugía | Nivel de VWF:RCo Pico objetivo en plasma |
Nivel de FVIII:C Pico objetivo en plasma |
Cálculo de la dosis de carga (a administrar 1 a 2 horas antes de la cirugía) |
|
|---|---|---|---|---|
| IU = Unidades Internacionales. BW = peso corporal. |
||||
|
||||
| Mayor | 100 IU/dL | 80-100 IU/dL | Δ* VWF:RCo × BW (kg) IVR† |
= IU de VWF:RCo requeridas |
| Si no se dispone del IVR, suponer un IVR de 2.0 IU/dL por IU/kg y calcular la dosis de carga de la siguiente manera: (100 – VWF:RCo en plasma basal) × BW (kg)/2.0 |
||||
| Menor/Oral‡ | 50-60 IU/dL | 40-50 IU/dL | Δ* VWF:RCo × BW (kg) IVR |
= IU de VWF:RCo requeridas |
| Emergencia | 100 IU/dL | 80-100 IU/dL | Administrar una dosis de 50-60 IU de VWF:RCo/kg de peso corporal. | |
Por ejemplo, la dosis de carga de HUMATE-P requerida suponiendo un nivel objetivo de VWF:RCo de 100 Unidades Internacionales (IU)/dL, un nivel basal de VWF:RCo de 20 Unidades Internacionales (IU)/dL, un IVR de 2.0 Unidades Internacionales (IU)/dL por Unidades Internacionales (IU)/kg y un peso corporal de 70 kg sería 2.800 Unidades Internacionales (IU) de VWF:RCo, calculadas de la siguiente manera:
| IU = Unidades Internacionales. | |
| (100 IU/dL – 20 IU/dL) × 70 kg | = 2.800 IU de VWF:RCo requeridas |
| 2.0 (IU/dL)/(IU/kg) | |
Alcanzar un nivel plasmático objetivo pico de FVIII:C de 80 a 100 Unidades Internacionales (IU) FVIII:C/dL para cirugías mayores y de 40 a 50 Unidades Internacionales (IU) FVIII:C/dL para cirugías menores o cirugías orales puede requerir una dosis adicional de HUMATE-P. Debido a que la relación de VWF:RCo a actividad FVIII:C en HUMATE-P es 2.4:1, cualquier dosificación adicional aumentará el VWF:RCo proporcionalmente más que el FVIII:C. Asumiendo un IRV incremental de 2.0 Unidades Internacionales (IU) VWF:RCo/dL por Unidad Internacional (IU)/kg infundido, la dosificación adicional para aumentar el FVIII:C en el plasma también aumentará el VWF:RCo en plasma en aproximadamente 5 Unidades Internacionales (IU)/dL por cada Unidad Internacional (IU)/kg de FVIII administrada.
Dosis de mantenimiento
La dosis inicial de mantenimiento de HUMATE-P para la prevención del sangrado excesivo durante y después de la cirugía debe ser la mitad de la dosis de carga, independientemente de la dosis adicional requerida para alcanzar los objetivos de FVIII:C. Las dosis de mantenimiento posteriores deben basarse en los niveles de VWF:RCo y FVIII del paciente. La Tabla 4 proporciona recomendaciones para los niveles plasmáticos del valle objetivo (basándose en el tipo de cirugía y el número de días posteriores a la cirugía) y la duración mínima del tratamiento para las dosis de mantenimiento posteriores. Estas recomendaciones se aplican tanto a pacientes adultos como pediátricos.
| Tipo de Cirugía | VWF:RCo Nivel plasmático del valle objetivo* |
FVIII:C Nivel plasmático del valle objetivo* |
Duración mínima del tratamiento | ||
|---|---|---|---|---|---|
| Hasta 3 días después de la cirugía | Después del día 3 | Hasta 3 días después de la cirugía | Después del día 3 | ||
| IU = Unidades Internacionales. | |||||
|
|||||
| Mayor | >50 IU/dL | >30 IU/dL | >50 IU/dL | >30 IU/dL | 72 horas |
| Menor | ≥30 IU/dL | – | – | >30 IU/dL | 48 horas |
| Oral† | ≥30 IU/dL | – | – | >30 IU/dL | 8-12 horas‡ |
Según las medias de vida medias farmacocinéticas individuales, la frecuencia de las dosis de mantenimiento generalmente es cada 8 o 12 horas; los pacientes con medias de vida más cortas pueden requerir la dosificación cada 6 horas. En ausencia de datos farmacocinéticos, se recomienda que el HUMATE-P se administre inicialmente cada 8 horas, con ajustes posteriores determinados monitoreando los niveles del factor de coagulación en el valle. Cuando se juzgan que los niveles hemostáticos son insuficientes o que los niveles en el valle están fuera del rango recomendado, considere modificar el intervalo de administración y/o la dosis.
Es aconsejable monitorizar los niveles de VWF:RCo y FVIII:C en el valle al menos una vez al día con el fin de ajustar la dosificación de HUMATE-P según sea necesario para evitar el exceso de acumulación de factores de coagulación. La duración del tratamiento generalmente depende del tipo de cirugía realizada, pero debe evaluarse para cada paciente en función de su respuesta hemostática [ver Estudios Clínicos (14.2)].
2.4 Reconstitución
- Prepárese y administre utilizando técnicas asépticas.
- Use el juego de transferencia de filtro Mix2Vial® provisto con HUMATE-P [ver Cómo se suministra / Almacenamiento y manipulación (16)] o una aguja de dos extremos comercialmente disponible y una punta de filtro con ventilación.
- Use jeringas desechables de plástico con HUMATE-P. Las soluciones de proteínas de este tipo tienden a adherirse a la superficie de vidrio esmerilado de las jeringas de vidrio completo.
- Reconstituya HUMATE-P a temperatura ambiente de la siguiente manera:
- Asegúrese de que el frasco de HUMATE-P y el frasco de diluyente estén a temperatura ambiente.
- Coloque el frasco de HUMATE-P, el frasco de diluyente y el juego de transferencia Mix2Vial sobre una superficie plana.
- Retire las tapas de volteo de los frascos de HUMATE-P y diluyente. Limpie las tapas con un hisopo de alcohol y deje que se sequen antes de abrir el paquete del juego de transferencia Mix2Vial.
- Abra el paquete del juego de transferencia Mix2Vial despegando la tapa (Fig. 1). Deje el juego de transferencia Mix2Vial en el paquete transparente.
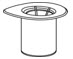
Fig. 1 - Coloque el frasco de diluyente sobre una superficie plana y sostenga el frasco fuertemente. Agarre el juego de transferencia Mix2Vial junto con el paquete transparente e introdúzcase con firmeza la punta de plástico en el extremo azul del juego de transferencia Mix2Vial a través del centro del tapón del frasco de diluyente (Fig. 2).
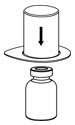
Fig. 2 - Retire con cuidado el paquete transparente del juego de transferencia Mix2Vial. Asegúrese de que solo tire del paquete transparente, no del juego de transferencia Mix2Vial (Fig. 3).
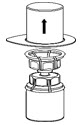
Fig. 3 - Con el frasco de HUMATE-P colocado firmemente sobre una superficie plana, invierta el frasco de diluyente con el juego de transferencia Mix2Vial adjunto e introdúzcase con firmeza la punta de plástico del adaptador transparente a través del centro del tapón del frasco de HUMATE-P (Fig. 4). El diluyente se transferirá automáticamente al frasco de HUMATE-P.
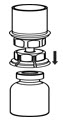
Fig. 4 - Con el frasco de diluyente y el frasco de HUMATE-P todavía unidos al juego de transferencia Mix2Vial, mezcle suavemente el frasco de HUMATE-P para asegurarse de que el HUMATE-P esté totalmente disuelto (Fig. 5). No agite el frasco.
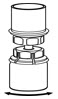
Fig. 5 - Con una mano agarre el lado de HUMATE-P del juego de transferencia Mix2Vial y con la otra mano agarre el lado azul del diluyente del juego de transferencia Mix2Vial, y desenrosque el conjunto en dos piezas (Fig. 6).
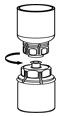
Fig. 6 - Inyecte aire en una jeringa estéril vacía. Mientras el frasco de HUMATE-P esté en posición vertical, atornille la jeringa al juego de transferencia Mix2Vial. Inyecte aire en el frasco de HUMATE-P. Mientras mantiene presionado el émbolo de la jeringa, invierta el sistema boca abajo y extraiga el concentrado en la jeringa tirando lentamente del émbolo hacia atrás (Fig. 7).
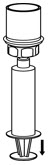
Fig. 7 - Ahora que el concentrado se ha transferido a la jeringa, agarre firmemente el cilindro de la jeringa (manteniendo el émbolo de la jeringa hacia abajo) y desenrosque la jeringa del juego de transferencia Mix2Vial (Fig. 8). Adjunte la jeringa a un conjunto de administración intravenosa apropiado.
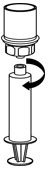
Fig. 8 - Si el paciente necesita más de un vial, mezcle el contenido de varios viales en una jeringa. Utilice un Mix2Vial sin usar por separado para cada vial del producto.
2.5 Administración
HUMATE-P es solo para uso intravenoso.
- La solución debe ser clara o ligeramente opalescente. Después de filtrar/tomar, se debe inspeccionar visualmente el producto reconstituido en busca de partículas y decoloración antes de la administración. Aunque se sigan precisamente las instrucciones de uso del procedimiento de reconstitucionalización, no es raro que queden unos pocos copos o partículas. El filtro incluido en el dispositivo Mix2Vial elimina esas partículas por completo. La filtración no influye en los cálculos de dosificación. No utilice soluciones visiblemente turbias o soluciones que aún contengan copos o partículas después de la filtración.
- No refrigere HUMATE-P después de reconstitucionalizarse. Administrar en un plazo de 3 horas después de la reconstitution.
- Infunda lentamente la solución (máximo 4 mL/minuto) con un equipo de administración intravenoso adecuado.
- Descarte el equipo de administración y cualquier HUMATE-P sin usar después de su uso.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
HUMATE-P está disponible como un polvo estéril y liofilizado para administración intravenosa después de la reconstitución. Cada frasco de dosis única de HUMATE-P contiene la cantidad etiquetada de VWF:RCo y la actividad de FVIII expresada en Unidades Internacionales (UI). La relación promedio de VWF:RCo a FVIII es 2,4:1.
Las potencias aproximadas se muestran a continuación; revise cada caja/frasco por la potencia real antes de la reconstitución:
| VWF:RCo/frasco | FVIII/frasco | Diluyente |
|---|---|---|
| UI = Unidades Internacionales. | ||
| 600 UI | 250 UI | 5 mL |
| 1200 UI | 500 UI | 10 mL |
| 2400 UI | 1000 UI | 15 mL |
4 CONTRAINDICACIONES
HUMATE-P está contraindicado en individuos que hayan tenido una reacción anafiláctica o sistémica severa a preparaciones de factor antihemofílico o factor de von Willebrand.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Eventos tromboembólicos (Pacientes con VWD)
Se han reportado eventos tromboembólicos en pacientes con VWD que reciben terapia de reemplazo con Factor Antihemofílico/Complejo de Factor de von Willebrand, especialmente en casos con factores de riesgo conocidos para la trombosis.3,4 Informes iniciales indican que puede haber una mayor incidencia en mujeres. También se ha asociado niveles altos endógenos de FVIII con la trombosis, pero no se ha establecido una relación causal. Tenga precaución y considere medidas antitrombóticas en todos los pacientes con VWD en riesgo que estén recibiendo terapia de reemplazo de factores de coagulación.
5.2 Monitoreo de la hemólisis intravascular
HUMATE-P contiene isoaglutininas de grupo sanguíneo (anti-A y anti-B). Cuando las dosis son muy grandes o deben repetirse con frecuencia (por ejemplo, cuando hay inhibidores presentes o cuando se requiere cuidado pre y postoperatorio), monitorear a los pacientes de los grupos sanguíneos A, B y AB en busca de signos de hemólisis intravascular y disminución de los valores de hematocrito y tratar adecuadamente.
5.3 Monitoreo de los niveles de VWF:RCo y FVIII
Monitorear los niveles de VWF:RCo y FVIII en pacientes con VWD que reciben HUMATE-P utilizando pruebas de coagulación estándar, especialmente en casos de cirugía. Se recomienda monitorear los niveles de VWF:RCo y FVIII:C al menos una vez al día para ajustar la dosis de HUMATE-P según sea necesario y evitar la acumulación excesiva de factores de coagulación [ver Dosificación y administración (2.2, 2.3)].
5.4 Transmisión de agentes infecciosos
Debido a que HUMATE-P se elabora a partir de sangre humana, puede llevar el riesgo de transmitir agentes infecciosos, como virus, el agente de la enfermedad de Creutzfeldt-Jakob variante (vCJD) y, teóricamente, el agente de la enfermedad de Creutzfeldt-Jakob (CJD) [ver Descripción (11) y Información para el paciente (17)]. El riesgo de que estos productos transmitan un agente infeccioso se ha reducido mediante la selección de donantes de plasma que hayan estado expuestos previamente a ciertos virus, mediante pruebas para detectar la presencia de ciertas infecciones virales actuales y mediante la inactivación y/o eliminación de ciertos virus durante la fabricación [ver Descripción (11)].
A pesar de estas medidas, estos productos aún pueden transmitir enfermedades. También existe la posibilidad de que haya agentes infecciosos desconocidos presentes en estos productos. Por lo tanto, el riesgo de transmisión de agentes infecciosos no se puede eliminar por completo. Informe todas las infecciones que un médico considere que posiblemente hayan sido transmitidas por este producto a CSL Behring Farmacovigilancia al 1-866-915-6958 o a la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
Algunos virus, como el virus del parvovirus B19 (B19V) o la hepatitis A (HAV), son particularmente difíciles de eliminar o inactivar. El B19V puede afectar más gravemente a las mujeres embarazadas y a las personas con inmunocompromiso.
Aunque la gran mayoría de los casos de B19V y HAV son adquiridos en la comunidad, se han reportado casos de estas infecciones asociados al uso de algunos productos derivados del plasma. Por lo tanto, los médicos deben estar alerta a los posibles síntomas de las infecciones por B19V y HAV [ver Información para el paciente (17)].
Los síntomas del B19V pueden incluir fiebre leve, erupción cutánea, artralgia y artritis simétrica y transitoria no destructiva. El diagnóstico se establece a menudo mediante la medición de anticuerpos específicos de B19V IgM e IgG. Los síntomas de la HAV incluyen fiebre leve, anorexia, náuseas, vómitos, fatiga e ictericia. El diagnóstico se puede establecer mediante la medición de anticuerpos IgM específicos.
Los médicos deben considerar seriamente la administración de vacunas contra la hepatitis A y la hepatitis B a las personas que reciben derivados del plasma. El médico debe evaluar los posibles riesgos y beneficios de la vacunación y discutirlos con el paciente.
6 REACCIONES ADVERSAS
La reacción adversa más grave observada en pacientes que recibieron HUMATE-P es la anafilaxis. También se han observado eventos tromboembólicos en pacientes que recibieron HUMATE-P para el tratamiento de la enfermedad de von Willebrand [ver Advertencias y Precauciones (5.1)]. Se han obtenido informes de eventos tromboembólicos en pacientes con enfermedad de von Willebrand y otros factores de riesgo trombótico que recibieron terapia de reemplazo de factores de coagulación de informes espontáneos, literatura publicada y un estudio clínico europeo. En algunos casos, puede producirse la formación de inhibidores de los factores de coagulación. Sin embargo, no se observó la formación de inhibidores en ninguno de los estudios clínicos.
En pacientes que recibieron HUMATE-P en estudios clínicos para el tratamiento de la enfermedad de von Willebrand, las reacciones adversas más comúnmente reportadas observadas en más del 5% de los sujetos son reacciones alérgicas-anafilácticas (incluyendo urticaria, opresión en el pecho, erupción cutánea, prurito y edema). Para pacientes sometidos a cirugía, las reacciones adversas más comunes son el sangrado postoperatorio en la herida y en el sitio de inyección, y epistaxis.
6.1 Experiencia en Ensayos Clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variadas, las tasas de reacción adversa observadas no pueden compararse directamente con las tasas en otros ensayos clínicos y pueden no reflejar las tasas observadas en la práctica.
Tratamiento de Episodios de Sangrado en la Enfermedad de von Willebrand
Se reportaron síntomas alérgicos, incluyendo reacción alérgica, urticaria, opresión en el pecho, erupción cutánea, prurito y edema, en 6 de 97 (6%) sujetos en un estudio retrospectivo canadiense [ver Estudios Clínicos (14.1)]. Cuatro de 97 (4%) sujetos experimentaron siete eventos adversos que se consideraron que tenían una relación posible o probable con HUMATE-P. Estos incluyeron escalofríos, flebitis, vasodilatación, parestesia, prurito, erupción cutánea y urticaria. Todos fueron de intensidad leve, con la excepción de un caso moderado de prurito.
En un estudio prospectivo, de etiqueta abierta de seguridad y eficacia de HUMATE-P en sujetos con enfermedad de von Willebrand con hemorragia grave que pone en riesgo la vida o la extremidad, o sometidos a cirugía de emergencia, siete de 71 (10%) sujetos experimentaron nueve reacciones adversas. Estos fueron un episodio cada uno de vasodilatación leve y prurito leve; dos episodios de parestesia leve; y un episodio cada uno de edema periférico moderado y dolor en las extremidades y pseudotrombocitopenia severa (aglutinación de plaquetas con un falsamente bajo conteo). HUMATE-P se suspendió en el sujeto que experimentó el edema periférico y el dolor en las extremidades.
Prevención de Hemorragia Excesiva Durante y Después de la Cirugía en la Enfermedad de von Willebrand
Entre los 63 sujetos con enfermedad de von Willebrand que recibieron HUMATE-P para prevenir la hemorragia excesiva durante y después de la cirugía, incluyendo un sujeto que se sometió a una colonoscopia sin la polipectomía planificada, los eventos adversos más comunes fueron hemorragia postoperatoria (35 eventos en 19 sujetos con cinco sujetos que experimentaron sangrado en hasta tres sitios diferentes), náusea postoperatoria (15 sujetos) y dolor postoperatorio (11 sujetos). La Tabla 6 presenta los eventos adversos hemorrágicos postoperatorios.
| Evento Adverso | Categoría de Procedimiento Quirúrgico | Número de Sujetos/Eventos | Inicio* (Número de Eventos) |
Gravedad (Número de Eventos) |
|||
|---|---|---|---|---|---|---|---|
| Durante | Después | Leve | Moderada | Grave | |||
|
|||||||
| Sangrado en la herida / sitio de inyección | Mayor | 8/11 | 7 | 4 | 9 | – | 2 |
| Menor | 2/2 | 2 | – | 1 | 1 | – | |
| Oral | 2/6 | – | 6 | 3 | 3 | – | |
| Epistaxis | Mayor | 4/4 | 2 | 2 | 3 | 1 | – |
| Menor | 1/1 | 1 | – | 1 | – | – | |
| Hemorragia cerebral/hematoma subdural | Importante | 1/2 | 2† | – | – | 2 | – |
| Hemorragia gastrointestinal | Importante | 1/3 | 3‡ | – | – | 2 | 1 |
| Menorragia | Importante | 1/1 | 1§ | – | – | 1 | – |
| Hemorragia en la ingle | Oral | 1/1 | – | 1 | 1 | – | – |
| Hemorragia del oído | Importante | 1/1 | 1 | – | 1 | – | – |
| Hemoptisis | Importante | 1/1 | 1 | – | 1 | – | – |
| Hematuria | Importante | 1/1 | 1 | – | 1 | – | – |
| Hemorragia en el hombro | Importante | 1/1 | 1 | – | 1 | – | – |
La Tabla 7 enumera los eventos adversos no hemorrágicos reportados en al menos dos sujetos, independientemente de la causalidad, y los eventos adversos que posiblemente estuvieran relacionados con HUMATE-P. Un embolismo pulmonar considerado posiblemente relacionado con HUMATE-P se produjo en un sujeto de edad avanzada que se sometió a una reemplazamiento bilateral de rodilla.
| Sistema Corporal | Evento Adverso (EA) | Número de Sujetos con un EA Posiblemente Relacionado con HUMATE-P | Número de Sujetos con un EA Independientemente de la Causalidad* |
|---|---|---|---|
| Cuerpo en general | Dolor | – | 11 |
| Fiebre | – | 4 | |
| Dolor abdominal | – | 3 | |
| Infección | – | 3 | |
| Cirugía | – | 3 | |
| Dolor de espalda | – | 2 | |
| Edema facial | – | 2 | |
| Cardiovascular | Dolor en el pecho | – | 3 |
| Embolismo pulmonar† | 1 | 1 | |
| Tromboflebitis† | 1 | 1 | |
| Digestivo | Náuseas | 1 | 15 |
| Estreñimiento | – | 7 | |
| Vómitos | 1 | 3 | |
| Dolor de garganta | – | 2 | |
| Sistema hemático y linfático | Anemia/disminución de la hemoglobina | – | 2 |
| Metabólico/nutricional | Aumento de SGPT | 1 | 1 |
| Nervioso | Mareo | 1 | 5 |
| Dolor de cabeza | 1 | 4 | |
| Aumento de la sudoración | – | 3 | |
| Insomnio | – | 2 | |
| Piel y apéndices | Picazón | – | 3 |
| Erupciones cutáneas | 1 | 1 | |
| Urogenital | Retención urinaria | – | 4 |
| Infección del tracto urinario | – | 2 | |
Ocho sujetos experimentaron 10 eventos adversos graves postoperatorios: uno con hematoma subdural y hemorragia intracerebral después de una cirugía intracraneal relacionada con una anormalidad cerebrovascular subyacente; uno con dos episodios de sangrado gastrointestinal después de un bypass gastrojejunal; y uno cada uno de sepsis, edema facial, infección, menorragia que requirió histerectomía tras histeroscopia y dilatación y curettaje, pielonefritis y embolismo pulmonar.
6.2 Experiencia poscomercialización
Las siguientes reacciones adversas han sido identificadas durante el uso posterior a la aprobación de HUMATE-P. Dado que estas reacciones se reportan voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera fiable su frecuencia o establecer una relación causal con la exposición a HUMATE-P.
Las reacciones adversas reportadas en pacientes que recibieron HUMATE-P para el tratamiento de la enfermedad de Von Willebrand (VWD) o de la hemofilia A son reacciones alérgicas-anafilácticas (incluyendo urticaria, opresión torácica, erupciones cutáneas, picazón, edema y shock), desarrollo de inhibidores de FVIII y hemólisis. Otras reacciones adversas reportadas para la VWD son complicaciones tromboembólicas, escalofríos y fiebre, e hipervolemia.
7 INTERACCIONES MEDICAMENTOSAS
No se han reportado.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
No se han realizado estudios de reproducción animal con HUMATE-P. Tampoco se sabe si HUMATE-P puede causar daño fetal cuando se administra a una mujer embarazada o si puede afectar la capacidad reproductiva. HUMATE-P solo debe administrarse a una mujer embarazada si es claramente necesario.
8.2 Trabajo de parto y parto
No se sabe si HUMATE-P puede causar daño a la madre o al feto cuando se administra durante el trabajo de parto y el parto. HUMATE-P solo debe administrarse durante el trabajo de parto y el parto si es claramente necesario.
8.3 Madres lactantes
No se sabe si este medicamento se excreta en la leche humana. Debido a que muchos medicamentos se excretan en la leche humana, se debe tener precaución cuando se administre HUMATE-P a una mujer lactante.
8.4 Uso pediátrico
Hemofilia A
No se han realizado estudios adecuados y bien controlados con evaluación a largo plazo del daño articular en sujetos pediátricos. El daño articular puede resultar de un tratamiento subóptimo de las hemartrosis.
VWD
La seguridad y eficacia de HUMATE-P para el tratamiento de VWD se demostró en 26 sujetos pediátricos, incluidos lactantes, niños y adolescentes, pero no se ha evaluado en recién nacidos. La seguridad de HUMATE-P para la prevención de sangrado excesivo durante y después de la cirugía se demostró en ocho sujetos pediátricos (de 3 a 15 años) con VWD. De los 34 sujetos pediátricos estudiados para el tratamiento de episodios de sangrado en VWD o la prevención de sangrado excesivo durante y después de la cirugía, cuatro eran lactantes (de 1 mes a menos de 2 años de edad), 23 eran niños (de 2 a 12 años) y siete eran adolescentes (de 13 a 15 años).
Como en adultos, los pacientes pediátricos deben dosificarse en función del peso corporal (kg) [ver Dosificación y Administración (2.2, 2.3)].
8.5 Uso geriátrico
Los estudios clínicos de HUMATE-P no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. Como para todos los pacientes, la dosificación para pacientes geriátricos debe ser adecuada a su situación general.
11 DESCRIPCIÓN
HUMATE-P, Factor VIII/Complejo de Factor von Willebrand (humano), es un concentrado purificado, estéril y liofilizado de Factor VIII (FVIII) y Factor von Willebrand (VWF) (humano) para administración intravenosa en el tratamiento de pacientes con hemofilia clásica (hemofilia A) y VWD [ver Farmacología clínica (12)].
HUMATE-P se purifica de la fracción insoluble en frío del plasma humano colectado. El plasma humano colectado utilizado para producir HUMATE-P proviene de instalaciones con licencia en los Estados Unidos (EE.UU.). Todo el plasma fuente utilizado en la fabricación de HUMATE-P se prueba mediante Pruebas de Ácido Nucleico (NAT) con licencia de la FDA para el virus de la hepatitis C (VHC), el virus de la inmunodeficiencia humana-1 (VIH-1), el virus de la hepatitis A (VHA) y el virus de la hepatitis B (VHB) y se encuentra no reactivo (negativo).
Cada frasco de HUMATE-P contiene la cantidad indicada en la etiqueta del Factor von Willebrand: Cofactor de Ristocetina (VWF:RCo) y la actividad de FVIII expresada en Unidades Internacionales (UI) [ver Formas de dosificación y potencias (3)], según se define por la norma internacional actual establecida por la Organización Mundial de la Salud. Una Unidad Internacional (UI) de VWF:RCo o FVIII es aproximadamente igual a la cantidad de VWF:RCo o FVIII en 1,0 mL de plasma humano fresco colectado. La relación media de VWF:RCo a FVIII es 2,4:1. El contenido de fibrinógeno en HUMATE-P es menor o igual a 0,2 mg/mL. HUMATE-P contiene isoaglutininas de grupos sanguíneos anti-A y anti-B [ver Advertencias y Precauciones (5.2)].
Cuando se reconstituye con el volumen de Agua Estéril para Inyección, USP suministrado, cada mL de HUMATE-P contiene 72 a 224 Unidades Internacionales (UI) de actividad de VWF:RCo1, 40 a 80 Unidades Internacionales (UI) de actividad de FVIII, 15 a 33 mg de glicina, 3,5 a 9,3 mg de citrato sódico, 2 a 5,3 mg de cloruro sódico, 8 a 16 mg de Albúmina (Humana), 2 a 4 mg de otras proteínas y 10 a 20 mg de proteínas totales. HUMATE-P no contiene conservantes.
El procedimiento de fabricación de HUMATE-P incluye múltiples etapas de procesamiento que reducen el riesgo de transmisión viral. La capacidad de inactivación/eliminación de virus consta de cuatro etapas:
- Cripoprecipitación
- Adsorción de Al(OH)3, precipitación con glicina y precipitación con NaCl, estudiadas en combinación
- Tratamiento térmico a 60 °C durante 10 horas en solución acuosa
- Liofilización
Las reducciones acumuladas totales de virus oscilan entre 6,0 y ≥ 11,7 log10, como se muestra en la Tabla 8.
| Etapa de fabricación | Factor de reducción de virus (log10) | ||||||
|---|---|---|---|---|---|---|---|
| Virus envoltados | Virus no envoltados | ||||||
| VIH-1 | VBDV | PRV | WNV | VHA | CPV | B19V | |
| VIH-1, virus de la inmunodeficiencia humana tipo 1, modelo para VIH-1 y VIH-2 VBDV, virus de la diarrea viral bovina, modelo para VHC PRV, virus de la pseudorrabia, modelo para virus de DNA grandes envoltados WNV, virus del Nilo Occidental VHA, virus de la hepatitis A CPV, parvovirus canino, modelo para B19V B19V, parvovirus humano B19 ND, no determinado NA, no aplicable |
|||||||
|
|||||||
| Cripoprecipitación | ND | ND | 1,6 | ND | ND | 1,9 | ND |
| Adsorción de Al(OH)3 /Precipitación con Glicina/Precipitación con NaCl | 3,8 | 2,8 | 3,9 | ND | 2,3 | 3,0 | ND |
| Tratamiento térmico* | ≥6,4 | ≥8,9 | 4,7 | ≥7,8 | 4,2 | 1,1 | ≥3,9† |
| Liofilización | ND | ND | ND | ND | 1,3 | ND | ND |
| Reducción acumulativa de virus [log10] | ≥10,2 | ≥11,7 | 10,2 | NA | 7,8 | 6,0 | NA |
- 1
- Esto se correlaciona con una relación media de actividad de VWF:RCo a FVIII de 2,4:1, que se utiliza para calcular los valores nominales de la actividad de VWF:RCo y es la actividad media de VWF:RCo.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Los componentes activos de HUMATE-P están constituidos por dos proteínas diferentes no unidas covalentemente (FVIII y VWF). FVIII es un cofactor esencial en la activación del factor X, que conduce en última instancia a la formación de trombina y, posteriormente, fibrin. VWF promueve la agregación plaquetaria y la adhesión plaquetaria en el endotelio vascular dañado; las plaquetas activadas interactúan con las proteínas de coagulación para formar un coágulo. VWF también actúa como una proteína transportadora estabilizadora de la proteína procoagulante FVIII. 5,6 La actividad de VWF se mide como VWF:RCo.
12.3 Farmacocinética
Hemofilia A
Después de la infusión de HUMATE-P, un aumento rápido del FVIII:C en el plasma es seguido por una disminución rápida en la actividad y, posteriormente, por una tasa más lenta de disminución de la actividad. Los estudios con HUMATE-P en sujetos con hemofilia A han demostrado una mediana de vida media de 12,2 (rango: 8,4 a 17,4) horas.
VWD
La farmacocinética de HUMATE-P se estudió en 41 sujetos en un estudio estadounidense y en 28 sujetos en un estudio europeo [véase Estudios clínicos (14.2)]. En ambos estudios, los sujetos fueron evaluados en el estado no hemorrágico antes de un procedimiento quirúrgico. La Tabla 9 resume la farmacocinética de HUMATE-P basada en estos estudios. Se observó una amplia variabilidad interindividual en los valores farmacocinéticos obtenidos de estos estudios.
| Estudio estadounidense | Estudio europeo | |
|---|---|---|
| IU = Unidades Internacionales. BW = peso corporal. |
||
| Número de sujetos | 41 | 28 |
| Tipo 1 VWD | 16 | 10 |
| Tipo 2A VWD | 2 | 10 |
| Tipo 2B VWD | 4 | — |
| Tipo 2M VWD | 6 | 1 |
| Tipo 3 VWD | 13 | 7 |
| Dosificación de HUMATE-P | 60 IU VWF:RCo/kg BW | 80 IU VWF:RCo/kg BW |
| Vida media terminal mediana de VWF:RCo (rango) | 11 horas* (3,5 – 33,6) |
10 horas† (2,8 – 28,3) |
| Depuración mediana (rango) | 3,1 mL/hora/kg (1 – 16,6) |
4,8 mL/hora/kg (2,1 – 53) |
| Volumen de distribución en estado estacionario (rango) | 53 mL/kg (29 – 141) |
59 mL/kg (32 – 290) |
| Mediana IVR para la actividad de VWF:RCo (rango) | 2,4 IU/dL por IU/kg (1,1 – 4,2) |
1,9 IU/dL por IU/kg (0,6 – 4,5) |
HUMATE-P ha sido demostrado en varios estudios que contiene multiméricos de alto peso molecular de VWF. La presencia de una composición multimérica de VWF en HUMATE-P es similar a la encontrada en el plasma normal y este componente se considera importante para corregir el defecto de coagulación en pacientes con VWD. 7,8
Los patrones multiméricos de HUMATE-P en el estudio estadounidense se midieron en 13 sujetos con VWD tipo 3; 11 tenían multiméricos ausentes o apenas detectables al inicio. De esos 11 sujetos, todos tenían algunos multiméricos de alto peso molecular presentes 24 horas después de la infusión de HUMATE -P. En el estudio europeo, la infusión de HUMATE-P corrigió el defecto del patrón multimérico en sujetos con VWD tipos 2A y 3. Los multiméricos de alto peso molecular fueron detectables hasta al menos 8 horas después de la infusión.
Basándose en la evaluación de un tamaño de muestra pequeño, parece que la edad, el sexo y el tipo de VWD no tienen impacto en la farmacocinética de VWF:RCo.
14 ESTUDIOS CLÍNICOS
No se han realizado estudios clínicos controlados para evaluar la seguridad y eficacia de la dosificación profiláctica con HUMATE-P para prevenir hemorragias espontáneas en sujetos con VWD. Actualmente no hay datos suficientes disponibles para evaluar o basar las recomendaciones de dosificación en este entorno.
14.1 Tratamiento de episodios hemorrágicos en VWD
La eficacia clínica de HUMATE-P en el control de hemorragias en sujetos con VWD fue determinada por una revisión retrospectiva de datos de seguridad clínica y eficacia obtenidos de 97 sujetos canadienses con VWD que recibieron el producto bajo un Programa de Liberación de Medicamento de Emergencia. El esquema de dosificación y la duración de la terapia fueron determinados por el médico.
Hubo 514 solicitudes de uso del producto para cirugía, hemorragia o profilaxis en los 97 sujetos. De estos, HUMATE-P no se utilizó en 151 casos, y la información de seguridad y/o eficacia de seguimiento estuvo disponible para 303 (83%) de las 363 solicitudes restantes. En muchos casos, HUMATE-P de una sola solicitud se utilizó para varios cursos de tratamiento en un sujeto. Por lo tanto, hay más cursos de tratamiento reportados que solicitudes.
HUMATE-P se administró a 97 sujetos en 530 cursos de tratamiento: 73 para cirugía, 344 para el tratamiento de hemorragias y 20 para la profilaxis de hemorragias. La mayoría de los 93 “otros” usos involucraron procedimientos dentales, procedimientos de diagnóstico, profilaxis antes de un procedimiento o dosis de prueba.
La Tabla 10 resume la información de dosificación (todos los sujetos) para los episodios hemorrágicos.
| Tipo/Localización del Episodio Hemorrágico | ||||||
|---|---|---|---|---|---|---|
| Sistema Digestivo | Nariz+Boca +Faringe |
Sistema Integumentario | Sistema Genital Femenino | Musculo-esquelético | ||
| SD, desviación estándar. | ||||||
| Número de sujetos | 14 | 29 | 11 | 4 | 22 | |
| Dosis de carga | Dosis media (SD)* | 62,1 (31,1) | 66,9 (24,3) | 73,4 (37,7) | 88,5 (28,3) | 50,2 (24,9) |
| Número de perfusiones† | 37 | 127 | 22 | 7 | 107 | |
| Dosis de mantenimiento | Dosis media (SD)* | 61,5 (38,0) | 67,5 (22,4) | 56,5 (63,3) | 74,5 (17,7) | 63,8 (28,8) |
| Número de perfusiones† | 250 | 55 | 4 | 15 | 121 | |
| Número de días de tratamiento por episodio hemorrágico | Media (SD) Número de eventos |
4,6 (3,6) 49 |
1,4 (1,2) 130 |
1,1 (0,4) 22 |
2,8 (2,9) 9 |
2,0 (1,9) 108 |
| Número de perfusiones por día de tratamiento | ||||||
| Número de sujetos | 14 | 29 | 11 | 4 | 22 | |
| Día 1‡ | Media (SD) Número de eventos |
1,2 (0,4) 49 |
1,1 (0,2) 130 |
1,0 (0,2) 22 |
1,0 (0,0) 9 |
1,0 (0,1) 108 |
| Número de sujetos | 13 | 9 | 3 | 1 | 15 | |
| Día 2 | Media (SD) Número de eventos |
1,2 (0,6) 41 |
1,3 (0,5) 12 |
1,0 (0,0) 3 |
1,0 (-) 1 |
1,2 (0,5) 26 |
| Número de sujetos | 12 | 6 | – | 2 | 10 | |
| Día 3 | Media (DE) Número de eventos |
1,5 (0,8) 25 |
1,4 (0,7) 9 |
– – |
1,0 (0,0) 3 |
1,2 (0,4) 18 |
14.2 Prevención de hemorragia excesiva durante y después de la cirugía en la enfermedad de von Willebrand (VWD)
Dos estudios clínicos prospectivos, abiertos, no controlados y multicéntricos, uno en los EE. UU. y otro en Europa, investigaron la seguridad y la eficacia hemostática de HUMATE-P en sujetos con VWD sometidos a cirugía.
• Estudio clínico estadounidense – El objetivo principal de este estudio era demostrar la seguridad y la eficacia hemostática de HUMATE-P en la prevención de hemorragia excesiva en sujetos adultos y pediátricos con VWD sometidos a cirugía. Los 35 sujetos (21 mujeres y 14 hombres) tenían edades que oscilaban entre los 3 y los 75 años (media 32,9); siete tenían 15 años o menos y dos tenían 65 años o más. Doce sujetos tenían tipo 1 de VWD, dos tenían tipo 2A, tres tenían tipo 2B, cinco tenían tipo 2M y 13 tenían tipo 3. Veintiocho de los procedimientos quirúrgicos se clasificaron como mayores (por ejemplo, reemplazo de articulaciones ortopédicas, cirugía intracraneal, extracciones dentales múltiples, colecistectomía laparoscópica), cuatro como menores (por ejemplo, colocación de dispositivo de acceso intravenoso) y tres sujetos tenían cirugía oral2. Siete de los 13 sujetos con tipo 3 de VWD se sometieron a cirugía mayor.
Los primeros 15 sujetos recibieron una dosis de carga de HUMATE-P correspondiente a 1,5 veces la “dosis completa” (definida como la dosis prevista para alcanzar un nivel pico de VWF:RCo de 100 Unidades Internacionales (UI)/dL determinado por el IRV calculado de cada sujeto y el nivel basal de VWF:RCo); la dosis de carga no varió con el tipo de cirugía realizada (es decir, mayor, menor o oral). Los 20 sujetos restantes recibieron dosis basadas en evaluaciones farmacocinéticas individuales y niveles pico objetivo de VWF:RCo de 80 a 100 Unidades Internacionales (UI)/dL para la cirugía mayor y 50 a 60 Unidades Internacionales (UI)/dL para la cirugía menor o oral, respectivamente. Todos los 35 sujetos recibieron dosis iniciales de mantenimiento correspondientes a 0,5 veces la dosis completa a intervalos de 6, 8 o 12 horas después de la cirugía según sus respectivas semividas de VWF:RCo; las dosis de mantenimiento posteriores se ajustaron en función de las mediciones regulares de los niveles del valle de VWF:RCo y FVIII:C. La mediana de la duración del tratamiento fue de 1 día (rango: 1 a 2 días) para la cirugía oral, 5 días (rango: 3 a 7 días) para la cirugía menor y 5,5 días (rango: 2 a 26 días) para la cirugía mayor.
- 2
- La cirugía oral se define como la extracción de menos de tres dientes, si los dientes no son molares y no hay afectación ósea. La extracción de más de un diente del juicio impactado se considera cirugía mayor debido a la dificultad esperada de la cirugía y la pérdida de sangre esperada, particularmente en sujetos con tipo 2A o tipo 3 de VWD. La extracción de más de dos dientes se considera cirugía mayor en todos los pacientes.
• Estudio clínico europeo – El objetivo principal de este estudio era evaluar la capacidad de HUMATE-P para corregir eficazmente el defecto de coagulación en sujetos con VWD sometidos a cirugía electiva, demostrado por un aumento en VWF:RCo y FVIII, un acortamiento del tiempo de sangrado prolongado y la prevención y/o cesación de hemorragia excesiva. Este estudio no tenía una hipótesis establecida previamente para evaluar la eficacia hemostática. Los 27 sujetos (18 mujeres y nueve hombres) tenían edades que oscilaban entre los 5 y los 81 años (edad mediana: 46 años); uno tenía 5 años y cinco tenían más de 65 años. Diez sujetos tenían tipo 1 de VWD, nueve tenían tipo 2A, uno tenía tipo 2M y siete tenían tipo 3. Dieciséis de los procedimientos quirúrgicos se clasificaron como mayores (reemplazo de articulaciones ortopédicas, histerectomía, extracciones dentales múltiples, anexectomía laparoscópica, colecistectomía laparoscópica, y excisión de carcinoma basocelular). Seis de los siete sujetos con tipo 3 de VWD se sometieron a cirugía mayor.
La dosificación se individualizó en función de una evaluación farmacocinética realizada antes de la cirugía. La mediana de la duración del tratamiento fue de 3,5 días (rango: 1 a 17 días) para la cirugía menor y 9 días (rango: 1 a 17 días) para la cirugía mayor.
En ambos estudios, las evaluaciones de la eficacia hemostática de HUMATE-P en la prevención de hemorragia excesiva se realizaron al final de la cirugía, 24 horas después de la última infusión de HUMATE-P y al final del estudio (14 días después de la cirugía).
La Tabla 11 resume las evaluaciones de eficacia hemostática al final de la cirugía en los sujetos que participaron en el estudio estadounidense o europeo.
| Número de sujetos | Evaluaciones de eficacia hemostática al final de la cirugía | ||
|---|---|---|---|
| Efectiva (Excelente / Buena)* |
Intervalo de confianza (IC) al 95% para la proporción efectiva† | ||
| Estudio estadounidense | 35 | 32 (91,4%) | 78,5 – 97,6% |
| Estudio europeo | 26‡ | 25 (96%) | 82 – 99,8% |
La Tabla 12 resume las evaluaciones globales de la eficacia hemostática en los sujetos que participaron en el estudio estadounidense o europeo. HUMATE-P fue eficaz en evitar sangrados excesivos durante y después de la cirugía.
| Número de Sujetos | Evaluaciones Globales de la Hemostasia | ||
|---|---|---|---|
| Eficaz ( Excelente / Bueno)* |
IC del 95% para la Proporción Eficaz† | ||
|
|||
| Estudio estadounidense‡ | 35 | 35 (100%) | 91.3-100% |
| Estudio europeo§ | 27 | 26 (96.3%) | 82.5-99.8% |
En el estudio estadounidense, todas las evaluaciones de la eficacia fueron revisadas por un Comité Independiente de Monitoreo de Seguridad de Datos (DSMB). El DSMB estuvo de acuerdo con las evaluaciones de la eficacia hemostática global de los investigadores para todos menos dos sujetos (ninguno de los cuales tenía VWD tipo 3). Sobre esta base, el DSMB juzgó la eficacia hemostática como “eficaz” en 33 (94.3%) (IC del 95%: 81.1% a 99.0%) de los 35 sujetos.
En el estudio estadounidense, la pérdida de sangre estimada mediana real no excedió la pérdida de sangre mediana esperada, independientemente del tipo de cirugía. La Tabla 13 muestra la pérdida mediana esperada y estimada real de sangre durante la cirugía en el estudio estadounidense.
| Pérdida de Sangre Estimada | Cirugía Oral (n = 3) |
Cirugía Menor (n = 4) |
Cirugía Mayor (n = 28) |
Total (n = 35) |
|---|---|---|---|---|
| Esperada – Mediana (rango) mL | 10 (5 – 50) | 8 (0 – 15) | 50 (0 – 300)* | 20 (0 – 300)* |
| Real – Mediana (rango) mL | 3 (0 – 15) | 3 (0 – 10) | 26 (0 – 300)† | 18 (0 – 300)† |
En el estudio estadounidense, cuatro sujetos recibieron transfusiones, tres debido a eventos adversos y uno debido a anemia preexistente. En el estudio europeo, un sujeto recibió transfusiones para tratar la anemia preexistente.