Fabricante de medicamentos: Apotex Corp. (Updated: 2024-04-22)
INFORMACIÓN DESTACADA DE LA PRESCRIPCIÓN
GEFITINIB tabletas, para uso oral
Aprobación inicial en EE.UU.: 2015
INDICACIONES Y USO
Las tabletas de gefitinib son un inhibidor de la tirosina quinasa indicado para el tratamiento de primera línea de pacientes con cáncer de pulmón no microcítico metastásico (CPNM) cuyos tumores tienen deleciones en el exón 19 o mutaciones de sustitución en el exón 21 (L858R) del receptor del factor de crecimiento epidérmico (EGFR) detectadas por una prueba aprobada por la FDA. (1)
Limitación de uso: No se ha establecido la seguridad y eficacia de las tabletas de gefitinib en pacientes cuyos tumores tienen mutaciones de EGFR distintas a las deleciones en el exón 19 o las mutaciones de sustitución en el exón 21 (L858R). (1)
DOSIFICACIÓN Y ADMINISTRACIÓN
La dosis recomendada es de 250 mg por vía oral, una vez al día, con o sin alimentos. (2.2)
FORMAS FARMACÉUTICAS Y CONCENTRACIONES
Tabletas: 250 mg. (3)
CONTRAINDICACIONES
Ninguna. (4)
ADVERTENCIAS Y PRECAUCIONES
- •
- Enfermedad pulmonar intersticial (EPI): La EPI ocurrió en pacientes que tomaban tabletas de gefitinib. Suspenda las tabletas de gefitinib si empeoran los síntomas respiratorios. Descontinúe las tabletas de gefitinib si se confirma la EPI. (2.4, 5.1)
- •
- Hepatotoxicidad: Obtenga pruebas periódicas de función hepática. Suspenda las tabletas de gefitinib para elevaciones de ALT y/o AST de Grado 2 o superior. Descontinúe en caso de insuficiencia hepática grave. (2.4, 5.2)
- •
- Perforación gastrointestinal: Descontinúe las tabletas de gefitinib en caso de perforación gastrointestinal. (2.4, 5.3)
- •
- Diarrea: Suspenda las tabletas de gefitinib para diarrea de Grado 3 o superior. (2.4, 5.4)
- •
- Trastornos oculares incluyendo queratitis: Suspenda las tabletas de gefitinib ante signos y síntomas de trastornos oculares graves o que empeoren, incluyendo queratitis. Descontinúe en caso de queratitis ulcerativa persistente. (2.4, 5.5)
- •
- Trastornos cutáneos ampollosos y exfoliativos: Suspenda las tabletas de gefitinib para reacciones cutáneas de Grado 3 o superior o condiciones exfoliativas. (2.4, 5.6)
- •
- Toxicidad embrionaria y fetal: Puede causar daño fetal. Aconseje sobre el posible riesgo para el feto y el uso de anticoncepción efectiva. (5.7, 8.1, 8.3)
REACCIONES ADVERSAS
Las reacciones adversas al medicamento (RAM) más comúnmente reportadas, en más del 20% de los pacientes y mayor que el placebo, fueron reacciones cutáneas y diarrea. (6.1)
Para reportar SUPUESTAS REACCIONES ADVERSAS, contacte a Apotex Inc. al 1-800-706-5575 o a la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES FARMACOLÓGICAS
- •
- Inductor de CYP3A4: Aumente las tabletas de gefitinib a 500 mg diarios en pacientes que reciben un inductor fuerte de CYP3A4. (2.4, 7.1)
- •
- Inhibidor de CYP3A4: Monitoree las reacciones adversas si se usa concomitantemente con las tabletas de gefitinib. (7.1)
- •
- Medicamentos que afectan el pH gástrico: Evite el uso concomitante de las tabletas de gefitinib con inhibidores de la bomba de protones, si es posible. (7.1)
- •
- Hemorragia en pacientes que toman warfarina: Monitoree los cambios en el tiempo de protrombina o INR. (7.2)
USO EN POBLACIONES ESPECÍFICAS
- •
- Lactancia: Descontinúe la lactancia materna. (8.2)
Consulte la sección 17 para INFORMACIÓN DE ASESORAMIENTO AL PACIENTE e información al paciente aprobada por la FDA.
Revisado: 8/2023
Tabla de Contenido
INFORMACIÓN DE PRESCRIPCIÓN COMPLETA: CONTENIDO *
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Selección de Pacientes
2.2 Dosis Recomendada
2.3 Administración a Pacientes que Tienen Dificultad para Tragar Sólidos
2.4 Modificación de la Dosis
3 FORMAS FARMACÉUTICAS Y CONCENTRACIONES
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Enfermedad Pulmonar Intersticial (ILD)
5.2 Hepatotoxicidad
5.3 Perforación Gastrointestinal
5.4 Diarrea Grave o Persistente
5.5 Trastornos Oculares incluyendo Queratitis
5.6 Trastornos Cutáneos Ampollosos y Exfoliativos
5.7 Toxicidad Embrio-fetal
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Poscomercialización
7 INTERACCIONES FARMACOLÓGICAS
7.1 Fármacos que Afectan la Exposición a Gefitinib
7.2 Hemorragia en Pacientes que toman Warfarina
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.3 Mujeres y Hombres con Potencial Reproductivo
8.4 Uso Pediátrico
8.5 Uso Geriátrico
8.6 Insuficiencia Renal
8.7 Insuficiencia Hepática
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Alteración de la Fertilidad
14 ESTUDIOS CLÍNICOS
16 PRESENTACIÓN/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL ASESORAMIENTO DEL PACIENTE
- *
- No se enumeran las secciones o subsecciones omitidas de la información de prescripción completa.
1 INDICACIONES Y USO
Las tabletas de gefitinib están indicadas para el tratamiento de primera línea de pacientes con cáncer de pulmón no microcítico metastásico (CPNM) cuyos tumores tienen deleciones en el exón 19 del receptor del factor de crecimiento epidérmico (EGFR) o mutaciones de sustitución en el exón 21 (L858R) según la detección por una prueba aprobada por la FDA [ver Estudios Clínicos (14)].
Limitación de uso: No se ha establecido la seguridad y eficacia de las tabletas de gefitinib en pacientes con CPNM metastásico cuyos tumores tienen mutaciones de EGFR distintas a las deleciones del exón 19 o mutaciones de sustitución en el exón 21 (L858R) [ver Estudios Clínicos (14)].
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Selección del paciente
Seleccione a los pacientes para el tratamiento de primera línea del cáncer de pulmón no microcítico (CPNM) metastásico con las tabletas de gefitinib basándose en la presencia de deleciones en el exón 19 de EGFR o mutaciones L858R en el exón 21 en las muestras de tumor o plasma [véase Indicaciones y Uso (1), Estudios clínicos (14)]. Si estas mutaciones no se detectan en una muestra de plasma, pruebe el tejido tumoral si es posible.
La información sobre las pruebas aprobadas por la FDA para la detección de mutaciones de EGFR en el CPNM está disponible en: http://www.fda.gov/CompanionDiagnostics.
2.2 Dosis recomendada
La dosis recomendada de las tabletas de gefitinib es de 250 mg por vía oral una vez al día con o sin alimentos hasta la progresión de la enfermedad o toxicidad inaceptable.
No tome una dosis omitida dentro de las 12 horas previas a la siguiente dosis.
2.3 Administración a pacientes que tienen dificultad para tragar sólidos
Sumerja las tabletas de gefitinib en 4 a 8 onzas de agua, dejando caer la tableta en el agua y revolviendo durante aproximadamente 15 minutos. Beba el líquido inmediatamente o adminístrelo a través de una sonda nasogástrica. Enjuague el recipiente con 4 a 8 onzas de agua y beba o administre de inmediato a través de la sonda nasogástrica.
2.4 Modificación de la dosis
Modificaciones de dosis por reacciones adversas a medicamentos
Suspenda las tabletas de gefitinib (hasta por 14 días) por cualquiera de los siguientes:
- •
- Inicio agudo o empeoramiento de los síntomas pulmonares (disnea, tos, fiebre) [véase Advertencias y Precauciones (5.1)]
- •
- Elevaciones de ALT y/o AST de Grado 2 o superior del CTCAE del NCI [véase Advertencias y Precauciones (5.2)]
- •
- Diarrea de Grado 3 o superior del CTCAE del NCI [véase Advertencias y Precauciones (5.4)]
- •
- Signos y síntomas de trastornos oculares graves o que empeoran, incluida la queratitis [véase Advertencias y Precauciones (5.5)]
- •
- Reacciones cutáneas de Grado 3 o superior del CTCAE del NCI [véase Advertencias y Precauciones (5.6)]
Reanude el tratamiento con las tabletas de gefitinib cuando la reacción adversa se resuelva por completo o mejore a Grado 1 del CTCAE del NCI.
Suspenda permanentemente las tabletas de gefitinib por:
- •
- Enfermedad pulmonar intersticial (EPI) confirmada [véase Advertencias y Precauciones (5.1)]
- •
- Insuficiencia hepática grave [véase Advertencias y Precauciones (5.2)]
- •
- Perforación gastrointestinal [véase Advertencias y Precauciones (5.3)]
- •
- Queratitis ulcerativa persistente [véase Advertencias y Precauciones (5.5)]
Modificaciones de dosis por interacciones farmacológicas
Inductores potentes del CYP3A4
Aumente las tabletas de gefitinib a 500 mg diarios en ausencia de reacción adversa grave al medicamento y reanude las tabletas de gefitinib a 250 mg siete días después de la interrupción del inductor potente del CYP3A4 [véase Interacciones farmacológicas (7), Farmacología clínica (12.3)].
3 FORMAS DOSIFICADAS Y CONCENTRACIONES
Tabletas de 250 mg: Tableta redonda, biconvexa y recubierta de color marrón rojizo. Con la inscripción “APO” sobre “250” en un lado, y el otro lado liso.
4 CONTRAINDICACIONES
Ninguna.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Enfermedad Pulmonar Intersticial (ILD)
ILD o reacciones adversas a los medicamentos similares a ILD (p. ej., infiltración pulmonar, neumonitis, síndrome de dificultad respiratoria aguda o fibrosis pulmonar) ocurrieron en el 1.3% de los 2462 pacientes que recibieron gefitinib en los ensayos clínicos; de estos, el 0.7% fueron de Grado 3 o superior y 3 casos fueron fatales.
Suspenda las tabletas de gefitinib e investigue de inmediato la posible ILD en cualquier paciente que presente un empeoramiento de los síntomas respiratorios como disnea, tos y fiebre. Descontinúe permanentemente las tabletas de gefitinib si se confirma la ILD [ver Dosificación y Administración (2.4), Reacciones Adversas (6.1)].
5.2 Hepatotoxicidad
En los pacientes que recibieron gefitinib en los ensayos clínicos, el 11.4% de los pacientes tuvieron un aumento de la alanina aminotransferasa (ALT), el 7.9% de los pacientes tuvieron un aumento de la aspartato aminotransferasa (AST) y el 2.7% de los pacientes tuvieron un aumento de la bilirrubina. Las anormalidades en las pruebas de función hepática de Grado 3 o superiores ocurrieron en el 5.1% (ALT), 3.0% (AST) y 0.7% (bilirrubina) de los pacientes. La incidencia de hepatotoxicidad fatal fue del 0.04%.
Obtenga pruebas periódicas de la función hepática. Suspenda las tabletas de gefitinib en pacientes con deterioro de la función hepática y descontinúe en pacientes con insuficiencia hepática grave [ver Dosificación y Administración (2.4), Reacciones Adversas (6.1), Uso en Poblaciones Específicas (8.7)].
5.3 Perforación Gastrointestinal
La perforación gastrointestinal ocurrió en tres (0.1%) de los 2462 pacientes tratados con gefitinib en los ensayos clínicos [ver Reacciones Adversas (6.1)]. Descontinúe permanentemente las tabletas de gefitinib en pacientes que desarrollen perforación gastrointestinal [ver Dosificación y Administración (2.4)].
5.4 Diarrea Grave o Persistente
La diarrea de Grado 3 o 4 ocurrió en el 3% de los 2462 pacientes tratados con gefitinib en los ensayos clínicos. Suspenda las tabletas de gefitinib por diarrea grave o persistente (hasta 14 días) [ver Dosificación y Administración (2.4), Reacciones Adversas (6.1)].
5.5 Trastornos Oculares incluyendo Queratitis
Los trastornos oculares [queratitis (0.1%), erosión corneal y crecimiento anormal de las pestañas (0.2%), conjuntivitis, blefaritis y ojo seco (6.7%)] ocurrieron en los 2462 pacientes tratados con gefitinib en los ensayos clínicos. La incidencia de trastornos oculares de Grado 3 fue del 0.1% [ver Reacciones Adversas (6.1)]. Interrumpa o descontinúe las tabletas de gefitinib por trastornos oculares graves o que empeoren [ver Dosificación y Administración (2.4)].
5.6 Trastornos Cutáneos Ampollosos y Exfoliativos
Se han reportado condiciones ampollosas incluyendo necrólisis epidérmica tóxica, síndrome de Stevens Johnson y eritema multiforme por el tratamiento con gefitinib. Se han reportado eritema multiforme y dermatitis ampollosa en dos pacientes (0.08%) en los ensayos clínicos de NSCLC (Estudio 2, Estudio 3 y Estudio 4). El tratamiento con tabletas de gefitinib debe interrumpirse o descontinuarse si el paciente desarrolla condiciones ampollosas, con ampollas o exfoliativas graves.
5.7 Toxicidad Embrio-fetal
Según su mecanismo de acción y los datos de los estudios de reproducción animal, las tabletas de gefitinib pueden causar daño fetal cuando se administran a una mujer embarazada. En los estudios de reproducción animal, la administración oral de gefitinib desde la organogénesis hasta el destete resultó en fetotoxicidad y muerte neonatal a dosis por debajo de la dosis humana recomendada. Advierta a las mujeres embarazadas sobre el riesgo potencial para el feto. Aconseje a las mujeres con potencial reproductivo que utilicen anticonceptivos efectivos durante el tratamiento con tabletas de gefitinib y durante al menos dos semanas después de completar la terapia [ver Uso en Poblaciones Específicas (8.1, 8.3)].
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas al medicamento se analizan con más detalle en otras secciones del etiquetado:
- •
- Enfermedad pulmonar intersticial [ver Advertencias y precauciones (5.1)]
- •
- Hepatotoxicidad [ver Advertencias y precauciones (5.2)]
- •
- Perforación gastrointestinal [ver Advertencias y precauciones (5.3)]
- •
- Diarrea severa o persistente [ver Advertencias y precauciones (5.4)]
- •
- Trastornos oculares incluyendo queratitis [ver Advertencias y precauciones (5.5)]
- •
- Trastornos cutáneos ampollosos y exfoliativos [ver Advertencia y precauciones (5.6)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones muy variadas, las tasas de reacción adversa observadas en los ensayos clínicos de un medicamento no pueden compararse directamente con las tasas en los ensayos clínicos de otro medicamento y es posible que no reflejen las tasas observadas en la práctica.
La seguridad de las tabletas de gefitinib se basa en los datos de 2462 pacientes con CPNM que recibieron gefitinib 250 mg en monoterapia diaria en tres estudios clínicos aleatorizados (Estudio 2, Estudio 3 y Estudio 4). Se excluyó de estos estudios a los pacientes con antecedentes de enfermedad pulmonar intersticial, enfermedad intersticial inducida por fármacos, neumonitis por radiación que requirió tratamiento con esteroides o cualquier evidencia de enfermedad pulmonar intersticial clínicamente activa.
Estudios controlados:
El Estudio 2 fue un ensayo aleatorizado, multicéntrico, abierto en el que 1217 pacientes fueron aleatorizados para recibir tratamiento de primera línea para CPNM metastásico; 607 pacientes recibieron gefitinib 250 mg diarios y 589 pacientes recibieron carboplatino/paclitaxel. La duración mediana del tratamiento con gefitinib fue de 5.9 meses. Las características de la población del estudio fueron: edad mediana 57 años, edad menor de 65 años (73%), mujeres (79%), asiáticos (100%), histología de adenocarcinoma de CPNM (100%), nunca fumadores (94%), ex-fumadores leves (6%), ECOG PS 0 o 1 (90%).
El Estudio 3 fue un ensayo aleatorizado, multicéntrico, doble ciego, controlado con placebo en el que 1692 pacientes fueron aleatorizados para recibir tratamiento de segunda o tercera línea para CPNM metastásico; de los cuales 1126 pacientes recibieron gefitinib 250 mg diarios y 562 pacientes recibieron placebo. La duración mediana del tratamiento con gefitinib fue de 2.9 meses. Las características de la población del estudio fueron: edad mediana 62 años, edad menor de 65 años (60%), mujeres (33%), caucásicos (75%), asiáticos (21%), histología de adenocarcinoma de CPNM (48%), nunca fumadores (22%), ECOG PS 0 o 1 (65%), PS 2 (29%), PS 3 (5%) y dos o más terapias previas (51%).
El Estudio 4 fue un ensayo aleatorizado, multicéntrico, abierto en el que 1466 pacientes fueron aleatorizados para recibir tratamiento de segunda línea para CPNM metastásico; 729 pacientes recibieron gefitinib 250 mg diarios y 715 pacientes recibieron docetaxel. La duración mediana del tratamiento con tabletas de gefitinib fue de 2.4 meses. Las características de la población del estudio fueron: edad mediana 61 años, edad menor de 65 años (61%), mujeres (36%), caucásicos (79%), asiáticos (21%), histología de adenocarcinoma de CPNM (54%), nunca fumadores (20%), ECOG PS 0 o 1 (88%) y dos o más terapias previas (16%).
La base de datos de seguridad agrupada de los tres ensayos aleatorizados se utilizó para evaluar las reacciones adversas graves e infrecuentes al medicamento. Las reacciones adversas comunes se evaluaron en el Estudio 3. Las reacciones adversas más frecuentes en el Estudio 3 (incidencia >20% y mayor que el placebo) reportadas en pacientes tratados con gefitinib fueron reacciones cutáneas (47%) y diarrea (29%). Las reacciones adversas fatales más frecuentes en pacientes tratados con gefitinib fueron insuficiencia respiratoria (0.9%), neumonía (0.8%) y embolia pulmonar (0.5%).
Aproximadamente el 5% de los pacientes tratados con gefitinib y el 2.3% de los pacientes tratados con placebo discontinuaron el tratamiento debido a un evento adverso. Las reacciones adversas más frecuentes que llevaron a la discontinuación en pacientes tratados con gefitinib fueron náuseas (0.5%), vómitos (0.5%) y diarrea (0.4%).
Tabla 1 – Reacciones adversas seleccionadas al medicamento que ocurren con una tasa de incidencia ≥5% y un aumento de >2% en pacientes tratados con gefitinib en el Estudio 3
| Reacción adversa | Porcentaje (%) de pacientes | |||
| Gefitinib (N=1126) | Placebo (N=562) | |||
| Todos los grados | Grado 3 y 4 | Todos los grados | Grado 3 y 4 | |
| Trastornos de la piel y del tejido subcutáneo | ||||
| Reacciones cutáneas1 | 47% | 2% | 17% | 0.4% |
| Trastornos de las uñas2 | 5% | 0.1% | 0.7% | 0% |
| Trastornos gastrointestinales | ||||
| Diarrea3 | 29% | 3% | 10% | 1% |
| Vómitos | 14% | 1.2% | 10% | 0.4% |
| Estomatitis4 | 7% | 0.3% | 4% | 0.2% |
| Trastornos del metabolismo y de la nutrición | ||||
| Disminución del apetito | 17% | 2.3% | 14% | 2% |
| Trastornos oculares | ||||
| Conjuntivitis/blefaritis/ojo seco5 | 6% | 0% | 3.2% | 0% |
1 Incluye Acné, Acné pustular, Dermatitis, Dermatitis acneiforme, Dermatitis exfoliativa, Erupción medicamentosa, Piel seca, Eritema, Erupción exfoliativa, Foliculitis, Prurito, Prurito generalizado, Exantema, Exantema eritematoso, Exantema generalizado, Exantema macular, Exantema máculo-papular, Exantema papular, Exantema pruriginoso, Exantema pustular, Exantema vesicular, Exfoliación de la piel, Toxicidad cutánea, Xerodermia
2 Incluye Uña incarnada, Infección del lecho ungueal, Trastorno ungueal, Infección ungueal, Onicoclasiaungueal, Onicolisis, Paroniquia
3 Incluye Diarrea, Heces blandas, Movimientos intestinales frecuentes
4 Incluye estomatitis aftosa, queilitis, glosodinia, ulceración de la boca, inflamación de la mucosa, ampollas en la mucosa oral, estomatitis, trastorno de la lengua, ulceración de la lengua
5 Incluye blefaritis, hiperemia conjuntival, conjuntivitis, ojo seco, irritación ocular, prurito ocular, hinchazón ocular, irritación del párpado, edema del párpado, prurito de los párpados
Tabla 2 – Reacciones adversas de laboratorio de aparición emergente que ocurrieron con mayor frecuencia en pacientes tratados con gefitinib en el Estudio 3
| Reacción adversa | Gefitinib | Placebo | ||
| Todos los grados % | Grado 3 y 4 % | Todos los grados % | Grado 3 y 4 % | |
| Aumento de alanina aminotransferasa1 | 38 %2 | 2,4 % | 23 %2 | 1,4 %4 |
| Aumento de aspartato aminotransferasa1 | 40 %3 | 2 % | 25 %3 | 1,3 %5 |
| Proteinuria | 35 % | 4,7 % | 31 % | 3,3 % |
1 Se permitió a los pacientes ingresar al estudio clínico con valores de laboratorio de ALT o AST grado 1 o 2 CTCAE
2 El 14 % de los pacientes con gefitinib y el 10 % de los pacientes con placebo tenían ALT grado 1 o 2 CTC al inicio
3 El 15 % de los pacientes con gefitinib y el 12 % de los pacientes con placebo tenían AST grado 1 o 2 CTC al inicio
4 El 0,2 % de los pacientes con placebo tenían grado 3 CTC al inicio
5 El 0,4 % de los pacientes con placebo tenían grado 3 CTC al inicio
Las siguientes reacciones adversas se han reportado con gefitinib en estudios de CPNM (Estudio 2, Estudio 3 y Estudio 4) y no se enumeran en otra parte de la Sección 6: náuseas (18 %), astenia (17 %), pirexia (9 %), alopecia (4,7 %), hemorragia (incluyendo epistaxis y hematuria) (4,3 %), boca seca (2 %), deshidratación (1,8 %), elevaciones de creatinina en sangre (1,5 %), reacciones alérgicas incluyendo angioedema y urticaria (1,1 %), síndrome de eritrodisestesia palmo-plantar (0,2 %) y pancreatitis (0,1 %).
6.2 Experiencia posterior a la comercialización
Las siguientes reacciones adversas se han identificado durante el uso posterior a la aprobación de gefitinib. Debido a que estas reacciones se reportan voluntariamente en una población de tamaño incierto, no siempre es posible estimar de manera fiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos renales y urinarios: cistitis, cistitis hemorrágica
Trastornos de la piel y del tejido subcutáneo: vasculitis cutánea
7 INTERACCIONES FARMACOLÓGICAS
7.1 Medicamentos que afectan la exposición a gefitinib
Inductor de CYP3A4
Los medicamentos que son inductores potentes de CYP3A4 aumentan el metabolismo del gefitinib y disminuyen las concentraciones plasmáticas de gefitinib. Aumente las tabletas de gefitinib a 500 mg diarios en pacientes que reciben un inductor potente de CYP3A4 (por ejemplo, rifampicina, fenitoína o antidepresivos tricíclicos) y reanude las tabletas de gefitinib a 250 mg 7 días después de la interrupción del inductor potente [ver Dosificación y administración (2.4), Farmacología clínica (12.3)].
Inhibidor de CYP3A4
Los medicamentos que son inhibidores potentes de CYP3A4 (por ejemplo, ketoconazol e itraconazol) disminuyen el metabolismo del gefitinib y aumentan las concentraciones plasmáticas de gefitinib. Monitoree las reacciones adversas cuando administre inhibidores potentes de CYP3A4 con tabletas de gefitinib.
Medicamentos que afectan el pH gástrico
Los medicamentos que elevan el pH gástrico (por ejemplo, inhibidores de la bomba de protones, antagonistas de los receptores H2 de la histamina y antiácidos) pueden reducir las concentraciones plasmáticas de gefitinib. Evite el uso concomitante de tabletas de gefitinib con inhibidores de la bomba de protones, si es posible. Si se requiere tratamiento con un inhibidor de la bomba de protones, tome las tabletas de gefitinib 12 horas después de la última dosis o 12 horas antes de la siguiente dosis del inhibidor de la bomba de protones. Tome las tabletas de gefitinib 6 horas después o 6 horas antes de un antagonista de los receptores H2 o un antiácido [ver Farmacología clínica (12.3)].
7.2 Hemorragia en pacientes que toman warfarina
Se han reportado elevaciones del Índice Internacional Normalizado (INR) y/o hemorragia en algunos pacientes que toman warfarina mientras reciben terapia con gefitinib. Los pacientes que toman warfarina deben ser monitoreados regularmente por cambios en el tiempo de protrombina o el INR.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de riesgos
Basándose en su mecanismo de acción y datos en animales, las tabletas de gefitinib pueden causar daño fetal cuando se administran a una mujer embarazada. En estudios de reproducción animal, la administración oral de gefitinib desde la organogénesis hasta el destete resultó en fetotoxicidad y muerte neonatal en dosis inferiores a la dosis humana recomendada (ver Datos en animales). Aconsejar a las mujeres embarazadas sobre el peligro potencial para un feto o el riesgo potencial de pérdida del embarazo.
El riesgo de base de defectos de nacimiento mayores y aborto espontáneo para la población indicada es desconocido; sin embargo, el riesgo de base en la población general de EE. UU. de defectos de nacimiento mayores es del 2 al 4% y el de aborto espontáneo es del 15 al 20% de los embarazos reconocidos clínicamente.
Datos
Datos en animales
Un estudio de dosis única en ratas mostró que el gefitinib atraviesa la placenta después de una dosis oral de 5 mg/kg (30 mg/m2, alrededor de 0.2 veces la dosis humana recomendada en mg/m2). Cuando se trataron ratas embarazadas con 5 mg/kg desde el inicio de la organogénesis hasta el final del destete, hubo una reducción en el número de crías nacidas vivas. Este efecto fue más severo a 20 mg/kg (aproximadamente la dosis humana clínica en mg/m2) y fue acompañado por una alta mortalidad neonatal poco después del parto. En conejos, una dosis de 20 mg/kg/día (240 mg/m2, aproximadamente el doble de la dosis recomendada en humanos en mg/m2) causó reducción del peso fetal.
8.2 Lactancia
Resumen de riesgos
No se sabe si el gefitinib se excreta en la leche humana. Los estudios en animales indican que el gefitinib y sus metabolitos están presentes en la leche de rata a una concentración más alta que en el plasma materno. Debido al potencial de reacciones adversas graves en lactantes que reciben lactancia materna por el gefitinib, se debe aconsejar a las mujeres que suspendan la lactancia durante el tratamiento con tabletas de gefitinib.
Datos
Datos en animales
Los niveles de gefitinib y sus metabolitos fueron de 11 a 19 veces más altos en la leche que en la sangre, después de la exposición oral de ratas lactantes a una dosis de 5 mg/kg.
8.3 Mujeres y hombres con potencial reproductivo
Anticoncepción
Basándose en su mecanismo de acción y datos en animales, las tabletas de gefitinib pueden causar daño fetal cuando se administran a una mujer embarazada [ver Uso en poblaciones específicas (8.1)]. Aconsejar a las mujeres con potencial reproductivo que usen anticoncepción efectiva durante el tratamiento con tabletas de gefitinib y durante al menos dos semanas después de completar la terapia.
Infertilidad
Las tabletas de gefitinib pueden resultar en una fertilidad reducida en mujeres con potencial reproductivo [ver Toxicología no clínica (13.1)].
8.4 Uso pediátrico
La seguridad y efectividad del gefitinib en pacientes pediátricos no han sido establecidas.
8.5 Uso geriátrico
De los 823 pacientes inscritos en dos ensayos clínicos aleatorizados, controlados activos, 374 pacientes (45%) tenían 65 años o más, y 93 pacientes (11%) tenían 75 años o más. No se observaron diferencias generales en seguridad entre los pacientes de 65 años o más y los menores de 65 años. No hay información suficiente para evaluar las diferencias de eficacia entre pacientes mayores y más jóvenes.
8.6 Insuficiencia renal
Menos del cuatro por ciento (<4%) del gefitinib y sus metabolitos se excretan por vía renal. No se realizaron estudios clínicos con gefitinib en pacientes con insuficiencia renal grave.
8.7 Insuficiencia hepática
La exposición sistémica al gefitinib se comparó en pacientes con insuficiencia hepática leve, moderada o grave debido a cirrosis (según la clasificación de Child-Pugh) y sujetos sanos con función hepática normal (N=10/grupo). La exposición sistémica media (AUC0-∞) aumentó un 40% en pacientes con insuficiencia leve, 263% en pacientes con insuficiencia moderada y 166% en pacientes con insuficiencia hepática grave. Monitorear las reacciones adversas cuando se administren tabletas de gefitinib a pacientes con insuficiencia hepática moderada y grave.
En un estudio que comparó a 13 pacientes con metástasis hepáticas e insuficiencia hepática moderada (suma de los grados CTC basales de AST/SGOT, ALP y bilirrubina de 3 a 5) con 14 pacientes con metástasis hepáticas y función hepática normal, la exposición sistémica al gefitinib fue similar [ver Advertencias y precauciones (5.2)].
10 SOBREDOSIS
Veintitrés pacientes fueron tratados semanalmente con dosis de 1500 mg a 3500 mg, y la exposición a gefitinib no aumentó con el aumento de la dosis. Los eventos adversos fueron en su mayoría de leves a moderados en gravedad, y fueron consistentes con el perfil de seguridad conocido de gefitinib. En caso de sospecha de sobredosis, interrumpa las tabletas de gefitinib, instituya cuidados de apoyo y observe hasta la estabilización clínica. No hay medidas/tratamientos específicos que deban tomarse después de una sobredosis de tabletas de gefitinib.
11 DESCRIPCIÓN
Gefitinib es un inhibidor de la quinasa.
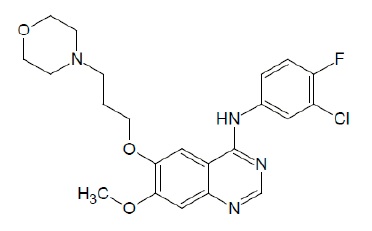
El nombre químico del gefitinib es 4-Quinazolinamina N-(3-cloro-4-fluorofenilo)-7-metoxi-6-[3-(4-morfolinil) propoxi] y la siguiente fórmula estructural:
Gefitinib tiene la fórmula molecular C22H24ClFN4O3, una masa molecular relativa de 446.91 daltones y es un polvo blanco a blanco apagado. Gefitinib es una base libre. La molécula tiene pKas de 5.4 y 7.2. Gefitinib se puede definir como escasamente soluble a pH 1, pero es prácticamente insoluble por encima de pH 7, disminuyendo su solubilidad bruscamente entre pH 4 y pH 6. En disolventes no acuosos, el gefitinib es libremente soluble en ácido acético glacial y dimetilsulfóxido, soluble en piridina, moderadamente soluble en tetrahidrofurano, y ligeramente soluble en metanol, etanol (99.5%), acetato de etilo, propan-2-ol y acetonitrilo.
Las tabletas de gefitinib están disponibles como tabletas recubiertas, redondas, biconvexas de color marrón rojizo que contienen 250 mg de gefitinib, para administración oral. Los ingredientes inactivos del núcleo de la tableta de gefitinib son copolímero de aminometacrilato, dióxido de silicio coloidal, crospovidona y estearato de magnesio. El recubrimiento de la tableta está compuesto por óxido rojo de hierro, polietilenglicol, alcohol polivinílico, talco y dióxido de titanio.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
El receptor del factor de crecimiento epidérmico (EGFR) se expresa en la superficie celular tanto de células normales como cancerosas y juega un papel en los procesos de crecimiento y proliferación celular. Se ha identificado que algunas mutaciones activadoras de EGFR (deleción del exón 19 o mutación puntual L858R en el exón 21) dentro de las células de CPNM contribuyen a la promoción del crecimiento de células tumorales, el bloqueo de la apoptosis, el aumento de la producción de factores angiogénicos y la facilitación de los procesos de metástasis.
El gefitinib inhibe reversiblemente la actividad quinasa del EGFR de tipo silvestre y de ciertas mutaciones activadoras, previniendo la autofosforilación de residuos de tirosina asociados con el receptor, inhibiendo así la señalización corriente abajo adicional y bloqueando la proliferación dependiente de EGFR.
La afinidad de unión del gefitinib por las mutaciones de deleción del exón 19 o de mutación puntual L858R del exón 21 de EGFR es mayor que su afinidad por el EGFR de tipo silvestre. El gefitinib también inhibe la señalización mediada por IGF y PDGF a concentraciones clínicamente relevantes; la inhibición de otros receptores de tirosina quinasa no se ha caracterizado completamente.
12.3 Farmacocinética
Absorción y Distribución
La biodisponibilidad oral media del gefitinib es del 60%, con niveles plasmáticos máximos que se alcanzan de 3 a 7 horas después de la dosis. Los alimentos no alteran la biodisponibilidad del gefitinib en una extensión clínicamente significativa. Las tabletas de gefitinib pueden administrarse con o sin alimentos. El gefitinib se distribuye ampliamente por todo el cuerpo con un volumen de distribución medio en estado estacionario de 1400 L tras la administración intravenosa. In vitro la unión del gefitinib a las proteínas plasmáticas humanas (albúmina sérica y α1-glicoproteína ácida) es del 90%, independiente de las concentraciones del fármaco. El gefitinib es un sustrato de la proteína transportadora de membrana P-glicoproteína (P-gp), pero es poco probable que influya en la absorción de gefitinib ya que la P-gp se satura a concentraciones más altas.
Metabolismo y Eliminación
El gefitinib se metaboliza extensamente en el hígado en humanos, predominantemente por el CYP3A4. Se han identificado tres sitios de biotransformación: metabolismo del grupo N-propoximorfolino, desmetilación del sustituyente metoxi en la quinazolina y defluorinación oxidativa del grupo fenilo halogenado. Se han identificado cinco metabolitos en extractos fecales y el componente activo principal fue O-desmetil gefitinib producido por el metabolismo del CYP2D6 y representó el 14% de la dosis.
Se identificaron ocho metabolitos en plasma humano. Solo O-desmetil gefitinib tiene una exposición comparable al gefitinib. Aunque este metabolito tiene una actividad EGFR-TK similar al gefitinib en el ensayo de enzima aislado, tenía solo 1/14 de la potencia del gefitinib en uno de los ensayos basados en células.
El gefitinib se elimina principalmente por el hígado, con un aclaramiento plasmático total y una semivida de eliminación de 48 horas después de la administración intravenosa. La variabilidad interindividual (coeficiente de variación) para el AUC en sujetos sanos fue del 67%. La administración oral diaria de gefitinib a pacientes con cáncer resultó en una acumulación dos veces mayor en comparación con la administración de una dosis única. Se alcanzan concentraciones plasmáticas en estado estacionario dentro de los 10 días después de la dosificación diaria. La excreción de gefitinib y sus metabolitos es predominantemente por las heces (86%), representando la eliminación renal menos del 4% de la dosis administrada.
Poblaciones Específicas
Edad, género, peso corporal, etnia o función renal: Los análisis farmacocinéticos poblacionales sugieren que la edad, el peso corporal, la etnia (poblaciones incluidas) o el aclaramiento de creatinina del paciente (por encima de 20 ml/min) no tiene un efecto clínicamente significativo sobre la concentración valle predicha en estado estacionario de gefitinib. Los análisis farmacocinéticos poblacionales del Estudio 1 mostraron que las mujeres tenían un 27% más de exposición que los hombres; sin embargo, esta diferencia no se identificó en los análisis de otros estudios clínicos de gefitinib. No se recomienda un ajuste de dosis basado en el género del paciente.
Insuficiencia Hepática: La exposición sistémica del gefitinib se comparó entre pacientes con insuficiencia hepática leve, moderada o grave debido a cirrosis (según la clasificación de Child-Pugh) y sujetos sanos con función hepática normal (N=10/grupo). El AUC0-∞ media sistémica aumentó un 40% en pacientes con insuficiencia leve, 263% en pacientes con insuficiencia moderada y 166% en pacientes con insuficiencia hepática grave. En un estudio que comparó a 13 pacientes con metástasis hepáticas e insuficiencia hepática moderada con 14 pacientes con metástasis hepáticas y función hepática normal, la exposición sistémica al gefitinib fue similar [ver Advertencias y Precauciones (5.2), Uso en Poblaciones Específicas (8.7)].
Metabolizador pobre de CYP2D6: El CYP2D6 metaboliza el gefitinib a O-desmetil gefitinib in vitro. En metabolizadores pobres sanos de CYP2D6, la concentración de O-desmetil gefitinib no fue medible y la exposición media al gefitinib fue 2 veces mayor en comparación con los metabolizadores extensivos. Este aumento en la exposición en metabolizadores pobres de CYP2D6 puede ser clínicamente importante porque algunas reacciones adversas al medicamento están relacionadas con una mayor exposición al gefitinib. No se recomienda un ajuste de dosis en pacientes con un genotipo conocido de metabolizador pobre de CYP2D6, pero estos pacientes deben ser monitoreados de cerca para detectar reacciones adversas. No se ha evaluado el impacto de los medicamentos inhibidores del CYP2D6 en la farmacocinética del gefitinib. Sin embargo, deben tomarse precauciones similares cuando se administren inhibidores del CYP2D6 con gefitinib debido a la posibilidad de un aumento de la exposición en estos pacientes.
Un análisis exploratorio de exposición-respuesta mostró un aumento en la incidencia de enfermedad pulmonar intersticial (ILD) con un aumento superior a 2 veces en la exposición al gefitinib [ver Advertencias y Precauciones (5.1)].
Interacciones Medicamentosas
Inductor potente de CYP3A4:
La administración concomitante de rifampicina (600 mg QD durante 16 días), un potente inductor del CYP3A4, con gefitinib (dosis única de 500 mg el Día 10 de la administración de gefitinib) redujo el AUC media del gefitinib en un 83% [ver Dosificación y Administración (2.4), Interacciones Medicamentosas (7)].
Inhibidor de CYP3A4:
La administración concomitante de itraconazol (200 mg QD durante 12 días), un inhibidor de CYP3A4, con gefitinib (dosis única de 250 mg el Día 4 de la administración de itraconazol) a sujetos sanos masculinos, aumentó el AUC media de gefitinib en un 80% [ver Interacciones Medicamentosas (7)].
Medicamentos que afectan el pH gástrico:
La coadministración de dosis altas de ranitidina con bicarbonato de sodio (para mantener el pH gástrico por encima de 5,0) a sujetos sanos disminuyó el AUC media de gefitinib en un 47% [ver Interacciones Medicamentosas (7)].
En estudios con microsomas hepáticos humanos, el gefitinib no tuvo efecto inhibidor sobre las actividades CYP1A2, CYP2C9 y CYP3A4 en concentraciones que variaban de 2 a 5000 ng/ml. En la concentración más alta estudiada (5000 ng/ml), el gefitinib inhibió el CYP2C19 en un 24% y el CYP2D6 en un 43%.
La exposición al metoprolol, un sustrato del CYP2D6, aumentó un 30% cuando se administró en el Día 15 de la dosificación con gefitinib (500 mg diarios durante 28 días) en pacientes con tumores sólidos.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
El gefitinib se ha probado para genotoxicidad en una serie de ensayos in vitro (mutación bacteriana, linfoma de ratón y linfocito humano) y una prueba de micronúcleos in vivo en ratas. Bajo las condiciones de estos ensayos, el gefitinib no causó daño genético.
En un estudio de carcinogenicidad de dos años en ratones, la administración de gefitinib a una dosis de 270 mg/m2/día (aproximadamente el doble de la dosis diaria recomendada de 250 mg sobre una base de mg/m2; dosis reducida de 375 mg/m2/día desde la semana 22) causó adenomas hepatocelulares en hembras. En un estudio de carcinogenicidad de dos años en ratas, la administración de gefitinib a 60 mg/m2/día (aproximadamente 0,4 veces la dosis clínica diaria recomendada sobre una base de mg/m2) causó adenomas hepatocelulares y hemangiomas/hemangiosarcomas de los ganglios linfáticos mesentéricos en ratas hembras. La relevancia clínica de estos hallazgos es desconocida.
En un estudio dedicado de fertilidad en ratas a dosis ≥120 mg/m2 (aproximadamente igual a la dosis humana recomendada de gefitinib sobre una base de mg/m2), los animales presentaron un aumento en la incidencia de ciclo estral irregular, disminución de los cuerpos lúteos y disminuciones en los implantes uterinos y embriones vivos por camada.
14 ESTUDIOS CLÍNICOS
Cáncer de pulmón de células no pequeñas (CPCP)
Estudio 1
La eficacia y seguridad de gefitinib para el tratamiento de primera línea de pacientes con CPCP metastásico que contiene deleciones en el exón 19 del EGFR o mutaciones de sustitución L858R se demostró en un estudio clínico multicéntrico, de un solo brazo, abierto (Estudio 1). Un total de 106 pacientes naive al tratamiento con CPCP metastásico EGFR mutado positivo recibieron gefitinib a una dosis de 250 mg una vez al día hasta progresión de la enfermedad o toxicidad intolerable. La principal medida de eficacia fue la tasa de respuesta objetiva (TRO) según RECIST v1.1 evaluada tanto por una Revisión Central Independiente Ciega (RCIC) como por los investigadores. La duración de la respuesta (DR) fue una medida adicional. Los pacientes elegibles debían tener una deleción en el exón 19 del EGFR o la mutación de sustitución L858R, L861Q o G719X, y no la mutación T790M o S768I o la inserción en el exón 20 en muestras de tumores determinadas prospectivamente por un ensayo clínico. Las muestras de tumor de 87 pacientes se analizaron retrospectivamente usando el kit therascreen® EGFR RGQ PCR.
Las características de la población del estudio fueron: edad mediana 65 años, edad 75 años o más (25%), edad menor de 65 años (49%), raza blanca (100%), mujeres (71%), nunca fumadores (64%), PS de la OMS 0 (45%), PS de la OMS 1 (48%), PS de la OMS 2 (7%) e histología de adenocarcinoma (97%). Sesenta pacientes tenían deleciones en el exón 19 (65%), 29 pacientes tenían la sustitución L858R (31%), mientras que dos pacientes tenían tumores con la mutación de sustitución L861Q o G719X.
La duración mediana del tratamiento fue de 8,0 meses. Los resultados de eficacia del Estudio 1 se resumen a continuación.
Tabla 3 – Resultados de eficacia en el Estudio 1
| Parámetro de eficacia | Evaluación por RCIC1 (n=106)2 |
Evaluación por el investigador (n=106) |
| Tasa de respuesta objetiva3 (IC 95%) |
50% (41, 59) |
70% (61, 78) |
| Tasa de respuesta completa | 0,9% | 1,9% |
| Tasa de respuesta parcial | 49% | 68% |
| Duración mediana de la respuesta (meses) (IC 95%) |
6 (5,6, 11,1) |
8,3 (7,6, 11,3) |
1RCIC, Revisión Central Independiente Ciega
217 pacientes sin lesiones diana al inicio según la RCIC se consideraron no respondedores
3Determinada por RECIST v 1.1
Las tasas de respuesta fueron similares en pacientes cuyos tumores tenían deleciones en el exón 19 del EGFR y mutaciones de sustitución L858R en el exón 21. Se observaron dos respuestas parciales en los dos pacientes cuyos tumores tenían la mutación de sustitución G719X con una duración de la respuesta de al menos 2,8 meses y 5,6 meses, respectivamente. Uno de los dos pacientes cuyos tumores tenían la mutación de sustitución L861Q también logró una respuesta parcial con una duración de la respuesta de al menos 2,8 meses.
Estudio 2
Los resultados del Estudio 1 fueron respaldados por un análisis exploratorio de un subgrupo de un ensayo aleatorizado, multicéntrico, abierto (Estudio 2) realizado en pacientes con CPCP de histología adenocarcinoma metastásico que recibían tratamiento de primera línea. Los pacientes fueron aleatorizados (1:1) para recibir gefitinib 250 mg por vía oral una vez al día o hasta 6 ciclos de carboplatino/paclitaxel. Los criterios de valoración de la eficacia incluyeron la supervivencia libre de progresión (SLP) y la tasa de respuesta objetiva (TRO) evaluadas por RCIC.
La población del subgrupo consistió en 186 de 1217 pacientes (15%) determinados como EGFR positivos por el mismo ensayo clínico utilizado en el Estudio 1 y que tenían exploraciones radiográficas disponibles para una evaluación retrospectiva por RCIC. En este subgrupo, hubo 88 pacientes tratados con gefitinib y 98 pacientes tratados con carboplatino/paclitaxel.
Las características demográficas y basales de este subgrupo fueron una edad mediana de 59 años, edad de 75 años o más (7%), edad menor de 65 (70%), asiáticos (100%), mujeres (83%), nunca fumadores (96%), histología de adenocarcinoma (100%) y PS 0 a 1 (94%).
La duración mediana del tratamiento para los pacientes tratados con gefitinib fue de 9,8 meses. El cociente de riesgos instantáneos (HR) para la SLP favoreció a los pacientes tratados con gefitinib [HR de 0,54 (IC 95%: 0,38, 0,79)] con una mediana de SLP de 10,9 meses para los pacientes tratados con gefitinib y 7,4 meses para los pacientes tratados con carboplatino/paclitaxel según la evaluación de la RCIC. Además, la tasa de respuesta objetiva fue del 67% (IC 95%: 56, 77) para los pacientes tratados con gefitinib y del 41% (IC 95%: 31, 51) para los pacientes tratados con carboplatino/paclitaxel según la evaluación de la RCIC. La duración mediana de la respuesta fue de 9,6 meses para los pacientes tratados con gefitinib y 5,5 meses para los pacientes tratados con carboplatino/paclitaxel.
16 PRESENTACIÓN Y ALMACENAMIENTO
Las tabletas de gefitinib están disponibles en tabletas de 250 mg.
Las tabletas de gefitinib de 250 mg son rojo-marrones, redondas, biconvexas y recubiertas. Grabadas con “APO” sobre “250” en un lado, lisos en el otro lado.
Las tabletas de gefitinib se suministran como:
Frasco de 30 tabletas NDC 60505-4512-3
Almacenar a 20°C a 25°C (68°F a 77°F); se permiten desviaciones de 15°C a 30°C (59°F a 86°F) [ver Temperatura Ambiente Controlada USP].
17 INFORMACIÓN PARA EL PACIENTE
Aconsejar al paciente que lea la información para el paciente aprobada por la FDA (Información para el paciente).
Enfermedad Pulmonar Intersticial: Aconsejar a los pacientes que se comuniquen de inmediato con su proveedor de atención médica en caso de aparición o empeoramiento de los síntomas pulmonares, como disnea, tos y fiebre [ver Advertencias y precauciones (5.1)].
Hepatotoxicidad: Informar a los pacientes que deberán someterse a pruebas de laboratorio para monitorear la función hepática. Aconsejar a los pacientes que se comuniquen con su proveedor de atención médica para reportar cualquier nuevo síntoma que indique toxicidad hepática [ver Advertencias y precauciones (5.2)].
Perforación Gastrointestinal: Aconsejar a los pacientes que las tabletas de gefitinib pueden aumentar el riesgo de perforación gastrointestinal y que busquen atención médica inmediata en caso de dolor abdominal grave [ver Advertencias y precauciones (5.3)].
Diarrea Grave o Persistente: Aconsejar a los pacientes que se comuniquen con su proveedor de atención médica en caso de diarrea grave o persistente [ver Advertencias y precauciones (5.4)].
Trastornos Oculares incluyendo Queratitis: Aconsejar a los pacientes que se comuniquen de inmediato con su proveedor de atención médica si desarrollan síntomas oculares, lagrimeo, sensibilidad a la luz, visión borrosa, dolor ocular, enrojecimiento ocular o cambios en la visión [ver Advertencias y precauciones (5.5)]
Trastornos Cutáneos Bulosos y Exfoliativos: Aconsejar a los pacientes que las tabletas de gefitinib pueden aumentar el riesgo de trastornos cutáneos bulosos y exfoliativos y que busquen atención médica de inmediato en caso de reacciones cutáneas graves [ver Advertencias y precauciones (5.6)].
Toxicidad Embrio-fetal: Aconsejar a las mujeres embarazadas sobre el posible riesgo para el feto o el posible riesgo de pérdida del embarazo [ver Advertencias y precauciones (5.7), Uso en poblaciones específicas (8.1)]. Aconsejar a las mujeres con potencial reproductivo que utilicen métodos anticonceptivos efectivos durante el tratamiento con tabletas de gefitinib y por al menos dos semanas después de completar la terapia [ver Uso en poblaciones específicas (8.3)].
Lactancia: Aconsejar a las mujeres que interrumpan la lactancia durante el tratamiento con tabletas de gefitinib [ver Uso en poblaciones específicas (8.2)].
Todas las marcas registradas en este documento son propiedad de sus respectivos dueños.
APOTEX INC.
TABLETAS DE GEFITINIB
250 mg
| Fabricado por: | Fabricado para: |
| Apotex Inc. | Apotex Corp. |
| Toronto, Ontario | Weston, Florida |
| Canadá M9L 1T9 | USA 33326 |
Rev. 7
Información para el Paciente
Tabletas de Gefitinib
(gue-fi-ti-nib)
¿Qué son las tabletas de gefitinib?
Las tabletas de gefitinib son un medicamento recetado utilizado para tratar a personas con cáncer de pulmón de células no pequeñas (NSCLC, por sus siglas en inglés) que se ha diseminado a otras partes del cuerpo y:
- •
- que tienen ciertos tipos de genes anormales del receptor del factor de crecimiento epidérmico (EGFR), y
- •
- que no han recibido tratamiento previo para el cáncer
Su proveedor de atención médica realizará una prueba para asegurarse de que las tabletas de gefitinib son las adecuadas para usted.
No se sabe si las tabletas de gefitinib son seguras y eficaces en personas con NSCLC que tienen otros tipos de genes EGFR.
No se sabe si las tabletas de gefitinib son seguras y eficaces en niños.
Antes de tomar las tabletas de gefitinib, informe a su proveedor de atención médica sobre todas sus condiciones médicas, incluyendo si usted:
- •
- tiene problemas pulmonares o respiratorios
- •
- alguna vez tuvo problemas hepáticos
- •
- tiene problemas de visión u oculares
- •
- está embarazada o planea quedar embarazada. Las tabletas de gefitinib pueden dañar a su bebé por nacer.
- •
- Las mujeres que puedan quedar embarazadas deben usar un método anticonceptivo efectivo durante el tratamiento con tabletas de gefitinib y durante al menos 2 semanas después de la última dosis de tabletas de gefitinib. Debe evitar quedar embarazada durante el tratamiento con gefitinib.
- •
- Informe a su proveedor de atención médica de inmediato si queda embarazada durante el tratamiento con tabletas de gefitinib.
- •
- está amamantando o planea amamantar. No se sabe si el gefitinib pasa a la leche materna. No amamante durante el tratamiento con tabletas de gefitinib. Hable con su proveedor de atención médica sobre la mejor manera de alimentar a su bebé durante este tiempo.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, vitaminas o suplementos herbales.
Si toma un inhibidor de la bomba de protones (IBP), bloqueador H2 o un medicamento antiácido, hable con su proveedor de atención médica sobre el mejor momento para tomarlo durante el tratamiento con tabletas de gefitinib.
Si toma un anticoagulante llamado warfarina, su proveedor de atención médica debe realizar análisis de sangre regularmente para controlar la velocidad de coagulación de su sangre durante el tratamiento con tabletas de gefitinib.
¿Cómo debo tomar las tabletas de gefitinib?
- •
- Tome las tabletas de gefitinib exactamente como su proveedor de atención médica le indique.
- •
- Su proveedor de atención médica puede cambiar su dosis, suspender temporalmente o suspender permanentemente el tratamiento con tabletas de gefitinib si tiene efectos secundarios.
- •
- Tome las tabletas de gefitinib 1 vez al día.
- •
- Puede tomar las tabletas de gefitinib con o sin alimentos.
- •
- Si olvida una dosis de tabletas de gefitinib, tómela tan pronto como lo recuerde. Si faltan menos de 12 horas para su próxima dosis, omita la dosis olvidada. Tome su próxima dosis a la hora habitual.
- •
- Si toma demasiadas tabletas de gefitinib, llame a su proveedor de atención médica o acuda a la sala de emergencias más cercana de inmediato.
- •
-
Si no puede tragar las tabletas de gefitinib enteras:
- •
- coloque su dosis de tabletas de gefitinib en un recipiente con 4 a 8 onzas (120 a 240 ml) de agua y revuelva durante aproximadamente 15 minutos
- •
- beba la mezcla de inmediato
- •
- coloque otras 4 a 8 onzas (120 a 240 ml) de agua en el mismo recipiente y bébala de inmediato
¿Cuáles son los posibles efectos secundarios de las tabletas de gefitinib?
Las tabletas de gefitinib pueden causar efectos secundarios graves, incluyendo:
- •
- problemas pulmonares o respiratorios. Las tabletas de gefitinib pueden causar inflamación en los pulmones que puede llevar a la muerte. Los síntomas pueden ser similares a los del cáncer de pulmón. Informe a su proveedor de atención médica de inmediato si tiene algún problema pulmonar nuevo o que empeore, o cualquier combinación de los siguientes síntomas: dificultad para respirar o falta de aire, tos o fiebre.
- •
-
problemas hepáticos. Las tabletas de gefitinib pueden causar inflamación del hígado que puede llevar a la muerte. Informe a su proveedor de atención médica de inmediato si tiene algún síntoma de problemas hepáticos, que pueden incluir:
- •
- color amarillento de la piel o la parte blanca de los ojos (ictericia)
- •
- orina de color oscuro o marrón (color té)
- •
- heces de color claro
- •
- disminución del apetito
- •
- dolor en el lado derecho del estómago (abdomen)
Su proveedor de atención médica realizará análisis de sangre para controlar la función hepática durante su tratamiento con tabletas de gefitinib.
- •
- una rotura en la pared del estómago o los intestinos (perforación). Obtenga ayuda médica de emergencia de inmediato si tiene un dolor abdominal intenso.
- •
- diarrea. La diarrea es común con las tabletas de gefitinib y, en ocasiones, puede ser grave. Informe a su proveedor de atención médica de inmediato si tiene diarrea grave o diarrea que no desaparece.
- •
- problemas oculares. Informe a su proveedor de atención médica si tiene ojos llorosos, sensibilidad a la luz, visión borrosa, dolor ocular, enrojecimiento ocular o cambios en la visión.
- •
- reacciones cutáneas. El enrojecimiento de la piel, sarpullido, picazón y acné son comunes con las tabletas de gefitinib. Esto puede ocurrir en cualquier parte de su cuerpo. Obtenga ayuda médica de inmediato si desarrolla reacciones cutáneas graves como descamación o ampollas en la piel.
Las tabletas de gefitinib pueden causar problemas de fertilidad en mujeres. Hable con su proveedor de atención médica si planea quedar embarazada.
Informe a su proveedor de atención médica si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de las tabletas de gefitinib. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios.
Puede reportar efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar las tabletas de gefitinib?
Almacene las tabletas de gefitinib a una temperatura entre 68°F y 77°F (20°C y 25°C).
Mantenga las tabletas de gefitinib y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de las tabletas de gefitinib.
A veces se prescriben medicamentos para propósitos distintos a los enumerados en el folleto de Información para el Paciente. No use las tabletas de gefitinib para una afección para la cual no fue recetada. No le dé tabletas de gefitinib a otras personas, incluso si tienen los mismos síntomas que usted. Puede causarles daño. Puede solicitar a su proveedor de atención médica o farmacéutico información sobre las tabletas de gefitinib que esté escrita para profesionales de la salud.
Para obtener más información, visite www.apotex.com o llame al 1-800-706-5575.
¿Cuáles son los ingredientes en las tabletas de gefitinib?
Ingrediente activo: gefitinib
Ingredientes inactivos: copolímero de aminometacrilato, dióxido de silicio coloidal, crospovidona y estearato de magnesio
El recubrimiento de la tableta contiene: óxido de hierro rojo, polietilenglicol, alcohol polivinílico, talco y dióxido de titanio.
Esta información para el paciente ha sido aprobada por la Administración de Alimentos y Medicamentos (FDA) de los EE. UU.
Todas las marcas registradas en este documento son propiedad de sus respectivos propietarios.
APOTEX INC.
Tabletas de GEFITINIB
250 mg
| Fabricado por: | Fabricado para: |
| Apotex Inc. | Apotex Corp. |
| Toronto, Ontario | Weston, Florida |
| Canadá M9L 1T9 | EE. UU. 33326 |
Revisado: Agosto 2023
Rev. 7
Panel Principal de Visualización
Muestra representativa del etiquetado (consulte la sección PRESENTACIÓN de la lista completa):
APOTEX CORP.
NDC 60505-4512-3
Tabletas de Gefitinib
250 mg 30 unidades
Sólo con receta