Fabricante de medicamentos: Merck Sharp & Dohme LLC (Updated: 2024-09-05)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
GARDASIL®9
(Vacuna contra el virus del papiloma humano 9-valente, recombinante)
Suspensión para inyección intramuscular
Aprobación inicial en EE. UU.: 2014
INDICACIONES Y USO
GARDASIL 9 es una vacuna indicada en niñas y mujeres de 9 a 45 años de edad para la prevención de las siguientes enfermedades:
- Cáncer de cuello uterino, vulvar, vaginal, anal, orofaríngeo y otros cánceres de cabeza y cuello causados por los tipos 16, 18, 31, 33, 45, 52 y 58 del virus del papiloma humano (VPH). (1.1)
- Verrugas genitales (condilomas acuminados) causadas por los tipos 6 y 11 del VPH. (1.1)
Y las siguientes lesiones precancerosas o displásicas causadas por los tipos 6, 11, 16, 18, 31, 33, 45, 52 y 58 del VPH:
- Neoplasia intraepitelial cervical (NIC) de grado 2/3 y adenocarcinoma cervical in situ (AIS). (1.1)
- Neoplasia intraepitelial cervical (NIC) de grado 1. (1.1)
- Neoplasia intraepitelial vulvar (NIV) de grado 2 y grado 3. (1.1)
- Neoplasia intraepitelial vaginal (NIVag) de grado 2 y grado 3. (1.1)
- Neoplasia intraepitelial anal (NIA) de grados 1, 2 y 3. (1.1)
GARDASIL 9 está indicado en niños y hombres de 9 a 45 años de edad para la prevención de las siguientes enfermedades:
- Cáncer anal, orofaríngeo y otros cánceres de cabeza y cuello causados por los tipos 16, 18, 31, 33, 45, 52 y 58 del VPH. (1.2)
- Verrugas genitales (condilomas acuminados) causadas por los tipos 6 y 11 del VPH. (1.2)
Y las siguientes lesiones precancerosas o displásicas causadas por los tipos 6, 11, 16, 18, 31, 33, 45, 52 y 58 del VPH:
- Neoplasia intraepitelial anal (NIA) de grados 1, 2 y 3. (1.2)
La indicación de cáncer orofaríngeo y de cabeza y cuello está aprobada bajo aprobación acelerada en función de la eficacia para prevenir la enfermedad anogenital relacionada con el VPH. La aprobación continua para esta indicación puede estar supeditada a la verificación y descripción del beneficio clínico en un ensayo confirmatorio (1).
Limitaciones de uso y eficacia:
- La vacunación con GARDASIL 9 no elimina la necesidad de que los vacunados se sometan a exámenes de detección de cáncer de cuello uterino, vulvar, vaginal, anal, orofaríngeo y otros cánceres de cabeza y cuello según lo recomendado por un profesional de la salud. (1.3, 17)
- No se ha demostrado que GARDASIL 9 proporcione protección contra enfermedades causadas por:
- Tipos de VPH no cubiertos por la vacuna
- Tipos de VPH a los que una persona ha estado expuesta previamente a través de la actividad sexual. (1.3)
- No todos los cánceres de vulva, vagina, ano, orofaringe y otros cánceres de cabeza y cuello son causados por el VPH, y GARDASIL 9 solo protege contra aquellos cánceres de vulva, vagina, ano, orofaringe y otros cánceres de cabeza y cuello causados por los tipos 16, 18, 31, 33, 45, 52 y 58 del VPH. (1.3)
- GARDASIL 9 no es un tratamiento para lesiones genitales externas; cáncer de cuello uterino, vulvar, vaginal, anal, orofaríngeo y otros cánceres de cabeza y cuello; NIC; NIV; NIVag; o NIA. (1.3)
- La vacunación con GARDASIL 9 puede no dar lugar a protección en todos los vacunados. (1.3)
DOSIFICACIÓN Y ADMINISTRACIÓN
Solo para administración intramuscular. (2)
Cada dosis de GARDASIL 9 es de 0,5 ml
Administre GARDASIL 9 de la siguiente manera: (2.1)
| Edad | Régimen | Programa |
|---|---|---|
| De 9 a 14 años | 2 dosis | 0, 6 a 12 meses* |
| 3 dosis | 0, 2, 6 meses | |
| De 15 a 45 años | 3 dosis | 0, 2, 6 meses |
FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
CONTRAINDICACIONES
ADVERTENCIAS Y PRECAUCIONES
Debido a que los vacunados pueden desarrollar síncope, a veces con caídas y lesiones, se recomienda la observación durante 15 minutos después de la administración. Se ha notificado síncope, a veces asociado con movimientos tónico-clónicos y otra actividad similar a una convulsión, después de la vacunación contra el VPH. Cuando el síncope se asocia con movimientos tónico-clónicos, la actividad suele ser transitoria y normalmente responde a la restauración de la perfusión cerebral manteniendo una posición supina o de Trendelenburg. (5.1)
REACCIONES ADVERSAS
Las reacciones adversas locales y sistémicas más frecuentes (≥10%) notificadas:
- En niñas y mujeres de 16 a 26 años de edad: dolor en el lugar de la inyección (89,9%), hinchazón en el lugar de la inyección (40,0%), eritema en el lugar de la inyección (34,0%) y dolor de cabeza (14,6%). (6.1)
- En niñas de 9 a 15 años de edad: dolor en el lugar de la inyección (89,3%), hinchazón en el lugar de la inyección (47,8%), eritema en el lugar de la inyección (34,1%) y dolor de cabeza (11,4%). (6.1)
- En mujeres de 27 a 45 años de edad: dolor en el lugar de la inyección (82,8%), hinchazón en el lugar de la inyección (23,3%), eritema en el lugar de la inyección (16,9%) y dolor de cabeza (13,6%) (6.1)
- En niños y hombres de 16 a 26 años de edad: dolor en el lugar de la inyección (63,4%), hinchazón en el lugar de la inyección (20,2%) y eritema en el lugar de la inyección (20,7%). (6.1)
- En niños de 9 a 15 años de edad: dolor en el lugar de la inyección (71,5%), hinchazón en el lugar de la inyección (26,9%) y eritema en el lugar de la inyección (24,9%). (6.1)
Para notificar REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Merck Sharp & Dohme LLC al 1-877-888-4231 o VAERS al 1-800-822-7967 o www.vaers.hhs.gov .
Ver 17 para INFORMACIÓN PARA EL PACIENTE y el etiquetado del paciente aprobado por la FDA.
Revisado: 3/2024
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
1.1 Niñas y Mujeres
1.2 Niños y Hombres
1.3 Limitaciones de Uso y Eficacia
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosificación
2.2 Método de Administración
2.3 Administración de GARDASIL 9 en Individuos que Han Sido Previamente Vacunados con GARDASIL®
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Síncope
5.2 Manejo de Reacciones Alérgicas
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Postcomercialización
7 INTERACCIONES MEDICAMENTOSAS
7.1 Uso con Medicamentos Inmunosupresores Sistémicos
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
8.6 Individuos Inmunocomprometidos
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Datos de Eficacia y Efectividad para GARDASIL
14.2 Ensayos Clínicos para GARDASIL 9
14.3 Eficacia – Tipos de VPH 31, 33, 45, 52 y 58 en Niñas y Mujeres de 16 a 26 Años de Edad
14.4 Seguimiento a Largo Plazo de Individuos Vacunados con GARDASIL 9
14.5 Efectividad en la Prevención de Cánceres Orofaríngeos y de Cabeza y Cuello Relacionados con el VPH
14.6 Inmunogenicidad de un Régimen de 3 Dosis
14.7 Respuestas Inmunitarias a GARDASIL 9 Usando un Régimen de 2 Dosis en Individuos de 9 a 14 Años de Edad
14.8 Estudios con Menactra y Adacel
15 REFERENCIAS
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están listadas.
1 INDICACIONES Y USO
1.1 Niñas y Mujeres
GARDASIL®9 es una vacuna indicada en niñas y mujeres de 9 a 45 años de edad para la prevención de las siguientes enfermedades:
- Cáncer de cuello uterino, vulvar, vaginal, anal, orofaríngeo y otros cánceres de cabeza y cuello causados por el virus del papiloma humano (VPH) tipos 16, 18, 31, 33, 45, 52 y 58
- Verrugas genitales (condilomas acuminados) causadas por los tipos 6 y 11 del VPH
Y las siguientes lesiones precancerosas o displásicas causadas por los tipos 6, 11, 16, 18, 31, 33, 45, 52 y 58 del VPH:
- Neoplasia intraepitelial cervical (NIC) grado 2/3 y adenocarcinoma cervical in situ (AIS)
- Neoplasia intraepitelial cervical (NIC) grado 1
- Neoplasia intraepitelial vulvar (NIV) grado 2 y grado 3
- Neoplasia intraepitelial vaginal (NIVA) grado 2 y grado 3
- Neoplasia intraepitelial anal (NIA) grados 1, 2 y 3
1.2 Niños y Hombres
GARDASIL 9 está indicado en niños y hombres de 9 a 45 años de edad para la prevención de las siguientes enfermedades:
- Cáncer anal, orofaríngeo y otros cánceres de cabeza y cuello causados por los tipos 16, 18, 31, 33, 45, 52 y 58 del VPH
- Verrugas genitales (condilomas acuminados) causadas por los tipos 6 y 11 del VPH
Y las siguientes lesiones precancerosas o displásicas causadas por los tipos 6, 11, 16, 18, 31, 33, 45, 52 y 58 del VPH:
- Neoplasia intraepitelial anal (NIA) grados 1, 2 y 3
La indicación de cáncer orofaríngeo y de cabeza y cuello está aprobada bajo aprobación acelerada en base a la eficacia en la prevención de la enfermedad anogenital relacionada con el VPH [ver Estudios Clínicos (14.5)]. La aprobación continua para esta indicación puede estar sujeta a la verificación y descripción del beneficio clínico en un ensayo confirmatorio.
1.3 Limitaciones de Uso y Eficacia
- La vacunación con GARDASIL 9 no elimina la necesidad de que los receptores de la vacuna se sometan a exámenes de detección de cáncer de cuello uterino, vulvar, vaginal, anal, orofaríngeo y otros cánceres de cabeza y cuello según lo recomendado por un profesional de la salud.
- No se ha demostrado que GARDASIL 9 proporcione protección contra enfermedades causadas por:
- Tipos de VPH no cubiertos por la vacuna [ver Descripción (11)],
- Tipos de VPH a los que una persona ha estado expuesta previamente a través de la actividad sexual.
- No todos los cánceres de vulva, vagina, ano, orofaringe y otros cánceres de cabeza y cuello son causados por el VPH, y GARDASIL 9 solo protege contra aquellos cánceres de vulva, vagina, ano, orofaringe y otros cánceres de cabeza y cuello causados por los tipos 16, 18, 31, 33, 45, 52 y 58 del VPH.
- GARDASIL 9 no es un tratamiento para lesiones genitales externas; cáncer de cuello uterino, vulvar, vaginal, anal, orofaríngeo y otros cánceres de cabeza y cuello; NIC; NIV; NIVA; o NIA.
- La vacunación con GARDASIL 9 puede no resultar en protección en todos los receptores de la vacuna.
2 DOSIS Y ADMINISTRACIÓN
Para uso intramuscular únicamente
2.1 Dosificación
Cada dosis de GARDASIL 9 es de 0.5 mL.
Administre GARDASIL 9 de la siguiente manera:
| Edad | Régimen | Calendario |
|---|---|---|
|
||
| De 9 a 14 años | 2 dosis | 0, 6 a 12 meses* |
| 3 dosis | 0, 2, 6 meses | |
| De 15 a 45 años | 3 dosis | 0, 2, 6 meses |
2.2 Método de administración
- No diluya ni mezcle GARDASIL 9 con otras vacunas.
- Agite bien inmediatamente antes de usar para mantener la suspensión de la vacuna.
- Los productos farmacéuticos parenterales deben inspeccionarse visualmente para detectar partículas y decoloración antes de la administración, siempre que la solución y el contenedor lo permitan. No use el producto si hay partículas presentes o si parece descolorido. Después de una agitación completa, GARDASIL 9 es un líquido blanco turbio.
- Administre por vía intramuscular en el área deltoidea o anterolateral del muslo.
- Observe a los pacientes durante 15 minutos después de la administración [ver Advertencias y precauciones (5)].
Uso de vial de dosis única
Retire la dosis de 0.5 mL de vacuna del vial de dosis única utilizando una aguja y jeringa estériles y use inmediatamente. Deseche el vial después de su uso.
Uso de jeringa precargada
Este paquete no contiene una aguja. Agite bien antes de usar. Conecte una aguja girando en el sentido de las agujas del reloj hasta que la aguja encaje de forma segura en la jeringa. Administre la dosis completa según el protocolo estándar. Deseche la jeringa después de su uso.
2.3 Administración de GARDASIL 9 en individuos que han sido previamente vacunados con GARDASIL®
La seguridad y la inmunogenicidad se evaluaron en individuos que completaron una serie de vacunación de tres dosis con GARDASIL 9 y que previamente habían completado una serie de vacunación de tres dosis con GARDASIL [ver Reacciones adversas (6.1) y Estudios clínicos (14.6)]. No se realizaron estudios utilizando un régimen mixto de vacunas contra el VPH para evaluar la intercambiabilidad de GARDASIL 9.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
GARDASIL 9 es una suspensión para administración intramuscular disponible en viales de dosis única de 0.5 mL y jeringas precargadas. [Ver Descripción (11)] para la lista completa de ingredientes.
4 CONTRAINDICACIONES
Hipersensibilidad, incluidas reacciones alérgicas graves a la levadura (un componente de la vacuna), o después de una dosis previa de GARDASIL 9 o GARDASIL [ver Descripción (11)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Síncope
Debido a que los vacunados pueden desarrollar síncope, a veces resultando en caídas con lesiones, se recomienda la observación durante 15 minutos después de la administración. Se ha informado síncope, a veces asociado con movimientos tónico-clónicos y otra actividad similar a una convulsión, después de la vacunación contra el VPH. Cuando el síncope se asocia con movimientos tónico-clónicos, la actividad suele ser transitoria y normalmente responde a la restauración de la perfusión cerebral manteniendo una posición supina o de Trendelenburg.
5.2 Manejo de reacciones alérgicas
El tratamiento médico apropiado y la supervisión deben estar disponibles de inmediato en caso de reacciones anafilácticas después de la administración de GARDASIL 9.
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variadas, las tasas de reacciones adversas observadas en los ensayos clínicos de una vacuna no se pueden comparar directamente con las tasas en los ensayos clínicos de otra vacuna y puede que no reflejen las tasas observadas en la práctica.
La seguridad de GARDASIL 9 se evaluó en siete estudios clínicos que incluyeron 15.703 individuos que recibieron al menos una dosis de GARDASIL 9 y tuvieron seguimiento de seguridad. El Estudio 1 y el Estudio 3 también incluyeron 7.378 individuos que recibieron al menos una dosis de GARDASIL como control y tuvieron seguimiento de seguridad. Las vacunas se administraron el día de la inscripción y las dosis posteriores se administraron aproximadamente dos y seis meses después. La seguridad se evaluó mediante vigilancia asistida por tarjeta de informe de vacunación (VRC) durante 14 días después de cada inyección de GARDASIL 9 o GARDASIL.
Los individuos que fueron monitoreados mediante vigilancia asistida por VRC incluyeron 9.097 niñas y mujeres de 16 a 26 años de edad, 1.394 niños y hombres de 16 a 26 años de edad y 5.212 niñas y niños de 9 a 15 años de edad (3.436 niñas y 1.776 niños) al momento de la inscripción que recibieron GARDASIL 9; y 7.078 niñas y mujeres de 16 a 26 años de edad y 300 niñas de 9 a 15 años de edad al momento de la inscripción que recibieron GARDASIL. La distribución racial de la población de seguridad integrada para GARDASIL 9 fue similar entre niñas y mujeres de 16 a 26 años de edad (56,8% blancas; 25,2% de otras razas o multirraciales; 14,1% asiáticas; 3,9% negras), niñas y niños de 9 a 15 años de edad (62,0% blancas; 19,2% de otras razas o multirraciales; 13,5% asiáticas; 5,4% negras) y niños y hombres de 16 a 26 años de edad (62,1% blancas; 22,6% de otras razas o multirraciales; 9,8% asiáticas; 5,5% negras). La seguridad de GARDASIL 9 se comparó directamente con la seguridad de GARDASIL en dos estudios (Estudio 1 y Estudio 3) para los cuales la distribución racial general de las cohortes de GARDASIL (57,0% blancas; 26,3% de otras razas o multirraciales; 13,6% asiáticas; 3,2% negras) fue similar a la de las cohortes de GARDASIL 9.
La seguridad de GARDASIL 9 en mujeres de 27 a 45 años de edad se evaluó en un ensayo clínico que comparó a 640 mujeres de 27 a 45 años de edad y 570 niñas y mujeres de 16 a 26 años de edad. La distribución racial fue similar entre mujeres de 27 a 45 años de edad (97,7% blancas, 1,6% asiáticas, 0,3% de otras o multirraciales, 0,5% negras) y niñas y mujeres de 16 a 26 años de edad (94,6% blancas, 3,0% asiáticas, 1,6% de otras o multirraciales, 0,9% negras).
La seguridad de GARDASIL 9 en hombres de 27 a 45 años de edad se infiere de los datos de seguridad de GARDASIL 9 en niños y hombres de 9 a 26 años de edad y niñas y mujeres de 9 a 45 años de edad y GARDASIL en individuos de 9 a 45 años de edad.
Reacciones Adversas en el Sitio de Inyección y Sistemáticas
Durante los estudios clínicos, las reacciones en el sitio de inyección (dolor, hinchazón y eritema) y la temperatura oral se solicitaron mediante vigilancia asistida por VRC durante cinco días después de cada inyección de GARDASIL 9. Las tasas y la gravedad de estas reacciones adversas solicitadas que ocurrieron dentro de los cinco días siguientes a cada dosis de GARDASIL 9 en comparación con GARDASIL en el Estudio 1 (niñas y mujeres de 16 a 26 años de edad) y el Estudio 3 (niñas de 9 a 15 años de edad) se presentan en la Tabla 1. Entre los sujetos que recibieron GARDASIL 9, las tasas de dolor en el sitio de inyección fueron aproximadamente iguales en los tres períodos de informe. Las tasas de hinchazón en el sitio de inyección y eritema en el sitio de inyección aumentaron después de cada dosis sucesiva de GARDASIL 9. Los receptores de GARDASIL 9 tuvieron tasas numéricamente más altas de reacciones en el sitio de inyección en comparación con los receptores de GARDASIL.
| GARDASIL 9 | GARDASIL | |||||||
|---|---|---|---|---|---|---|---|---|
| Después de la dosis 1 | Después de la dosis 2 | Después de la dosis 3 | Después de cualquier dosis | Después de la dosis 1 | Después de la dosis 2 | Después de la dosis 3 | Después de cualquier dosis | |
| Los datos para niñas y mujeres de 16 a 26 años de edad provienen del Estudio 1 (NCT00543543), y los datos para niñas de 9 a 15 años de edad provienen del Estudio 3 (NCT01304498). | ||||||||
| N=número de sujetos vacunados con seguimiento de seguridad | ||||||||
| n=número de sujetos con datos de temperatura | ||||||||
| Dolor, Cualquiera=mild, moderado, severo o intensidad desconocida | ||||||||
| Dolor, Severo=incapacitante con incapacidad para trabajar o realizar la actividad habitual | ||||||||
| Hinchazón, Cualquiera=cualquier tamaño o tamaño desconocido | ||||||||
| Hinchazón, Severo=tamaño máximo mayor a 2 pulgadas | ||||||||
| Eritema, Cualquiera=cualquier tamaño o tamaño desconocido | ||||||||
| Eritema, Severo=tamaño máximo mayor a 2 pulgadas | ||||||||
| Niñas y Mujeres de 16 a 26 Años de Edad | ||||||||
| Reacciones adversas en el sitio de inyección | N=7069 | N=6997 | N=6909 | N=7071 | N=7076 | N=6992 | N=6909 | N=7078 |
| Dolor, Cualquiera | 70.7 | 73.5 | 71.6 | 89.9 | 58.2 | 62.2 | 62.6 | 83.5 |
| Dolor, Severo | 0.7 | 1.7 | 2.6 | 4.3 | 0.4 | 1.0 | 1.7 | 2.6 |
| Hinchazón, Cualquiera | 12.5 | 23.3 | 28.3 | 40.0 | 9.3 | 14.6 | 18.7 | 28.8 |
| Hinchazón, Severa | 0.6 | 1.5 | 2.5 | 3.8 | 0.3 | 0.5 | 1.0 | 1.5 |
| Eritema, Cualquiera | 10.6 | 18.0 | 22.6 | 34.0 | 8.1 | 12.9 | 15.6 | 25.6 |
| Eritema, Severo | 0.2 | 0.5 | 1.1 | 1.6 | 0.2 | 0.2 | 0.4 | 0.8 |
| Reacciones adversas sistémicas | n=6995 | n=6913 | n=6743 | n=7022 | n=7003 | n=6914 | n=6725 | n=7024 |
| Temperatura ≥100°F | 1.7 | 2.6 | 2.7 | 6.0 | 1.7 | 2.4 | 2.5 | 5.9 |
| Temperatura ≥102°F | 0.3 | 0.3 | 0.4 | 1.0 | 0.2 | 0.3 | 0.3 | 0.8 |
| Niñas de 9 a 15 años de edad | ||||||||
| Reacciones adversas en el sitio de inyección | N=300 | N=297 | N=296 | N=299 | N=299 | N=299 | N=294 | N=300 |
| Dolor, Cualquiera | 71.7 | 71.0 | 74.3 | 89.3 | 66.2 | 66.2 | 69.4 | 88.3 |
| Dolor, Severo | 0.7 | 2.0 | 3.0 | 5.7 | 0.7 | 1.3 | 1.7 | 3.3 |
| Swelling, Any | 14.0 | 23.9 | 36.1 | 47.8 | 10.4 | 17.7 | 25.2 | 36.0 |
| Swelling, Severe | 0.3 | 2.4 | 3.7 | 6.0 | 0.7 | 2.7 | 4.1 | 6.3 |
| Erythema, Any | 7.0 | 15.5 | 21.3 | 34.1 | 9.7 | 14.4 | 18.4 | 29.3 |
| Erythema, Severe | 0 | 0.3 | 1.4 | 1.7 | 0 | 0.3 | 1.7 | 2.0 |
| Systemic Adverse Reactions | n=300 | n=294 | n=295 | n=299 | n=299 | n=297 | n=291 | n=300 |
| Temperature ≥100°F | 2.3 | 1.7 | 3.0 | 6.7 | 1.7 | 1.7 | 0 | 3.3 |
| Temperature ≥102°F | 0 | 0.3 | 1.0 | 1.3 | 0.3 | 0.3 | 0 | 0.7 |
Las reacciones adversas no solicitadas en el sitio de inyección y sistémicas (evaluadas como relacionadas con la vacuna por el investigador) observadas entre los receptores de GARDASIL 9 o GARDASIL en los estudios 1 y 3 con una frecuencia de al menos 1% se muestran en la Tabla 2. Pocas personas dejaron de participar en el estudio debido a experiencias adversas después de recibir cualquiera de las vacunas (GARDASIL 9 = 0,1% vs. GARDASIL <0,1%).
| Niñas y mujeres de 16 a 26 años de edad | Niñas de 9 a 15 años de edad | |||
|---|---|---|---|---|
| GARDASIL 9 N=7071 |
GARDASIL N=7078 |
GARDASIL 9 N=299 |
GARDASIL N=300 |
|
| Los datos para las niñas y mujeres de 16 a 26 años de edad son del Estudio 1 (NCT00543543), y los datos para las niñas de 9 a 15 años de edad son del Estudio 3 (NCT01304498). | ||||
| N=número de sujetos vacunados con seguimiento de seguridad | ||||
| Reacciones adversas en el sitio de inyección (de 1 a 5 días después de la vacunación, cualquier dosis) | ||||
| Prurito | 5.5 | 4.0 | 4.0 | 2.7 |
| Moretones | 1.9 | 1.9 | 0 | 0 |
| Hematoma | 0.9 | 0.6 | 3.7 | 4.7 |
| Masa | 1.3 | 0.6 | 0 | 0 |
| Hemorragia | 1.0 | 0.7 | 1.0 | 2.0 |
| Induración | 0.8 | 0.2 | 2.0 | 1.0 |
| Calor | 0.8 | 0.5 | 0.7 | 1.7 |
| Reacción | 0.6 | 0.6 | 0.3 | 1.0 |
| Reacciones adversas sistémicas (de 1 a 15 días después de la vacunación, cualquier dosis) | ||||
| Dolor de cabeza | 14.6 | 13.7 | 11.4 | 11.3 |
| Fiebre | 5.0 | 4.3 | 5.0 | 2.7 |
| Náuseas | 4.4 | 3.7 | 3.0 | 3.7 |
| Mareos | 3.0 | 2.8 | 0.7 | 0.7 |
| Fatiga | 2.3 | 2.1 | 0 | 2.7 |
| Diarrea | 1.2 | 1.0 | 0.3 | 0 |
| Dolor orofaríngeo | 1.0 | 0.6 | 2.7 | 0.7 |
| Mialgia | 1.0 | 0.7 | 0.7 | 0.7 |
| Dolor abdominal superior | 0.7 | 0.8 | 1.7 | 1.3 |
| Infección de las vías respiratorias superiores | 0.1 | 0.1 | 0.3 | 1.0 |
En un ensayo clínico no controlado con 639 niños y 1.878 niñas de 9 a 15 años de edad (Estudio 2), las tasas y la gravedad de las reacciones adversas solicitadas después de cada dosis de GARDASIL 9 fueron similares entre niños y niñas. Las tasas de reacciones adversas solicitadas y no solicitadas en el sitio de inyección y sistémicas en niños de 9 a 15 años de edad fueron similares a las de las niñas de 9 a 15 años de edad. Las reacciones adversas solicitadas y no solicitadas informadas por los niños en este estudio se muestran en la Tabla 3.
En otro ensayo clínico no controlado con 1.394 niños y hombres y 1.075 niñas y mujeres de 16 a 26 años de edad (Estudio 7), las tasas de reacciones adversas solicitadas y no solicitadas después de cada dosis de GARDASIL 9 entre las niñas y mujeres de 16 a 26 años de edad fueron similares a las informadas en el Estudio 1. Las tasas de reacciones adversas solicitadas y no solicitadas informadas por los niños y hombres de 16 a 26 años de edad en este estudio se muestran en la Tabla 3.
En un ensayo clínico no controlado con 640 mujeres de 27 a 45 años de edad y 570 niñas y mujeres de 16 a 26 años de edad (Estudio 9), las tasas de reacciones adversas solicitadas y no solicitadas después de cada dosis de GARDASIL 9 entre las niñas y mujeres de 16 a 26 años de edad fueron similares a las informadas en el Estudio 1. Las tasas de reacciones adversas solicitadas y no solicitadas informadas por las mujeres de 27 a 45 años de edad en este estudio se muestran en la Tabla 3.
| GARDASIL 9 | |
|---|---|
| Los datos para GARDASIL 9 niños de 9 a 15 años de edad son del Estudio 2 (NCT00943722). Los datos para niños y hombres de 16 a 26 años de edad para GARDASIL 9 son del Estudio 7 (NCT01651949). Los datos para mujeres de 27 a 45 años de edad son del Estudio 9 (NCT03158220). | |
| N=número de sujetos vacunados con seguimiento de seguridad | |
| Dolor, Cualquiera=leve, moderado, severo o intensidad desconocida | |
| Dolor, Severo=incapacitante con incapacidad para trabajar o realizar la actividad habitual | |
| Hinchazón, Cualquiera=cualquier tamaño o tamaño desconocido | |
| Hinchazón, Severa=tamaño máximo mayor de 2 pulgadas | |
| Eritema, Cualquiera=cualquier tamaño o tamaño desconocido | |
| Eritema, Severo=tamaño máximo mayor de 2 pulgadas | |
| Niños y hombres de 16 a 26 años de edad | N=1394 |
| Reacciones adversas solicitadas (1-5 días después de la vacunación, cualquier dosis) | |
| Dolor en el sitio de inyección, Cualquiera | 63.4 |
| Dolor en el sitio de inyección, Severo | 0.6 |
| Eritema en el sitio de inyección, Cualquiera | 20.7 |
| Eritema en el sitio de inyección, Severo | 0.4 |
| Hinchazón en el sitio de inyección, Cualquiera | 20.2 |
| Hinchazón en el sitio de inyección, Severa | 1.1 |
| Temperatura oral ≥100.0°F† | 4.4 |
| Temperatura oral ≥102°F | 0.6 |
| Reacciones adversas no solicitadas en el sitio de inyección (1-5 días después de la vacunación, cualquier dosis) | |
| Hipersensibilidad en el sitio de inyección | 1.0 |
| Prurito en el sitio de inyección | 1.0 |
| Reacciones adversas sistémicas no solicitadas (1-15 días después de la vacunación, cualquier dosis) | |
| Dolor de cabeza | 7.3 |
| Pirexia | 2.4 |
| Fatiga | 1.4 |
| Mareos | 1.1 |
| Náuseas | 1.0 |
| Niños de 9 a 15 años de edad | N=639 |
| Reacciones adversas solicitadas (1-5 días después de la vacunación, cualquier dosis) | |
| Dolor en el sitio de la inyección, cualquier | 71.5 |
| Dolor en el sitio de la inyección, severo | 0.5 |
| Eritema en el sitio de la inyección, cualquier | 24.9 |
| Eritema en el sitio de la inyección, severo | 1.9 |
| Hinchazón en el sitio de la inyección, cualquier | 26.9 |
| Hinchazón en el sitio de la inyección, severo | 5.2 |
| Temperatura oral ≥100.0°F† | 10.4 |
| Temperatura oral ≥102°F | 1.4 |
| Reacciones adversas no solicitadas en el sitio de la inyección (1-5 días después de la vacunación, cualquier dosis) | |
| Hematoma en el sitio de la inyección | 1.3 |
| Induración en el sitio de la inyección | 1.1 |
| Reacciones adversas sistémicas no solicitadas (1-15 días después de la vacunación, cualquier dosis) | |
| Dolor de cabeza | 9.4 |
| Pirexia | 8.9 |
| Náuseas | 1.3 |
| Mujeres de 27 a 45 años de edad | N=640 |
| Reacciones adversas solicitadas (1-5 días después de la vacunación, cualquier dosis) | |
| Dolor en el sitio de la inyección, cualquier | 82.8 |
| Dolor en el sitio de la inyección, severo | 1.9 |
| Eritema en el sitio de la inyección, cualquier | 16.9 |
| Eritema en el sitio de la inyección, severo | 0.5 |
| Hinchazón en el sitio de la inyección, cualquier | 23.3 |
| Hinchazón en el sitio de la inyección, severo | 1.9 |
| Temperatura oral ≥100.0°F† | 2.5 |
| Temperatura oral ≥102°F | 0.3 |
| Reacciones adversas no solicitadas en el sitio de la inyección (1-5 días después de la vacunación, cualquier dosis) | |
| Prurito en el sitio de la inyección | 1.6 |
| Hematoma en el sitio de la inyección | 1.3 |
| Reacciones adversas sistémicas no solicitadas (1-15 días después de la vacunación, cualquier dosis) | |
| Dolor de cabeza | 13.6 |
| Fatiga | 3.4 |
| Pirexia | 1.7 |
| Náuseas | 1.7 |
| Dolor orofaríngeo | 1.1 |
Eventos adversos graves en estudios clínicos
Los eventos adversos graves se recopilaron durante todo el período de estudio (rango de un mes a 48 meses después de la última dosis) para los siete estudios clínicos de GARDASIL 9. De las 15,705 personas a las que se administró GARDASIL 9 y que tuvieron seguimiento de seguridad, 354 informaron un evento adverso grave; lo que representa el 2.3% de la población. Como comparación, de las 7,378 personas a las que se administró GARDASIL y que tuvieron seguimiento de seguridad, 185 informaron un evento adverso grave; lo que representa el 2.5% de la población. Cuatro receptores de GARDASIL 9 informaron al menos un evento adverso grave que se determinó que estaba relacionado con la vacuna. Las reacciones adversas graves relacionadas con la vacuna fueron pirexia, alergia a la vacuna, crisis asmática y dolor de cabeza.
Muertes en toda la población del estudio
En los estudios clínicos, ocurrieron diez muertes (cinco en cada uno de los grupos GARDASIL 9 y GARDASIL); ninguna fue evaluada como relacionada con la vacuna. Las causas de muerte en el grupo GARDASIL 9 incluyeron un accidente automovilístico, un suicidio, un caso de leucemia linfocítica aguda, un caso de shock séptico hipovolémico y una muerte súbita inexplicable 678 días después de la última dosis de GARDASIL 9. Las causas de muerte en el grupo de control de GARDASIL incluyeron un accidente automovilístico, un accidente de avión, una hemorragia cerebral, una herida de bala y un adenocarcinoma de estómago.
Trastornos autoinmunitarios sistémicos
En todos los ensayos clínicos con GARDASIL 9, los sujetos fueron evaluados para detectar nuevas afecciones médicas que podrían ser indicativas de un trastorno autoinmunitario sistémico. En total, el 2.2% (351/15,703) de los receptores de GARDASIL 9 y el 3.3% (240/7,378) de los receptores de GARDASIL informaron nuevas afecciones médicas que podrían ser indicativas de trastornos autoinmunitarios sistémicos, que fueron similares a las tasas informadas después de GARDASIL, control de AAHS o placebo salino en ensayos clínicos históricos.
Experiencia en ensayos clínicos para GARDASIL 9 en personas que han sido vacunadas previamente con GARDASIL
Un estudio clínico (Estudio 4) evaluó la seguridad de GARDASIL 9 en niñas y mujeres de 12 a 26 años que habían sido vacunadas previamente con tres dosis de GARDASIL. El intervalo de tiempo entre la última inyección de GARDASIL y la primera inyección de GARDASIL 9 varió de aproximadamente 12 a 36 meses. A las personas se les administró GARDASIL 9 o placebo salino y la seguridad se evaluó mediante vigilancia asistida por VRC durante 14 días después de cada inyección de GARDASIL 9 o placebo salino en estas personas. Las personas que fueron monitoreadas incluyeron 608 personas que recibieron GARDASIL 9 y 305 personas que recibieron placebo salino. Pocas (0.5%) personas que recibieron GARDASIL 9 dejaron de participar debido a reacciones adversas. Las experiencias adversas relacionadas con la vacuna que se observaron entre los receptores de GARDASIL 9 con una frecuencia de al menos 1.0% y también con una frecuencia mayor que la observada entre los receptores de placebo salino se muestran en la Tabla 4. En general, el perfil de seguridad fue similar entre las personas vacunadas con GARDASIL 9 que habían sido vacunadas previamente con GARDASIL y las que no habían sido vacunadas contra el VPH, con la excepción de tasas numéricamente más altas de hinchazón y eritema en el sitio de inyección entre las personas que habían sido vacunadas previamente con GARDASIL (Tablas 1 y 4).
| GARDASIL 9 N=608 |
Placebo salino N=305 |
|
|---|---|---|
| Los datos para GARDASIL 9 y placebo salino son del Estudio 4 (NCT01047345). | ||
| N=número de sujetos vacunados con seguimiento de seguridad | ||
| Reacciones adversas solicitadas (1-5 días después de la vacunación, cualquier dosis) | ||
| Dolor en el sitio de inyección | 90.3 | 38.0 |
| Eritema en el sitio de inyección | 42.3 | 8.5 |
| Hinchazón en el sitio de inyección | 49.0 | 5.9 |
| Temperatura oral ≥100.0°F† | 6.5 | 3.0 |
| Reacciones adversas no solicitadas en el sitio de inyección (1-5 días después de la vacunación, cualquier dosis) | ||
| Prurito en el sitio de inyección | 7.7 | 1.3 |
| Hematoma en el sitio de inyección | 4.8 | 2.3 |
| Reacción en el sitio de inyección | 1.3 | 0.3 |
| Masa en el sitio de inyección | 1.2 | 0.7 |
| Reacciones adversas sistémicas no solicitadas (1-15 días después de la vacunación, cualquier dosis) | ||
| Dolor de cabeza | 19.6 | 18.0 |
| Fiebre | 5.1 | 1.6 |
| Náuseas | 3.9 | 2.0 |
| Mareos | 3.0 | 1.6 |
| Dolor abdominal superior | 1.5 | 0.7 |
| Influenza | 1.2 | 1.0 |
Seguridad en el uso concomitante con Menactra y Adacel
En el Estudio 5, la seguridad de GARDASIL 9 cuando se administra de forma concomitante con Menactra [Vacuna conjugada de toxoide diftérico polisacárido meningocócico (grupos A, C, Y y W-135)] y Adacel [Toxoide tetánico, toxoide diftérico reducido y vacuna acelular contra la tos ferina adsorbida (Tdap)] se evaluó en un estudio aleatorizado de 1.241 niños (n = 620) y niñas (n = 621) con una edad media de 12.2 años [ver Estudios clínicos (14.8)].
De los 1.237 niños y niñas vacunados, 1.220 tuvieron seguimiento de seguridad para las reacciones adversas en el sitio de inyección. Las tasas de reacciones adversas en el sitio de inyección fueron similares entre el grupo concomitante y el grupo no concomitante (vacunación con GARDASIL 9 separada de la vacunación con Menactra y Adacel por 1 mes) con la excepción de una mayor tasa de hinchazón reportada en el sitio de inyección para GARDASIL 9 en el grupo concomitante (14.4%) en comparación con el grupo no concomitante (9.4%). La mayoría de las reacciones adversas de hinchazón en el sitio de inyección se informaron como de intensidad leve a moderada.
6.2 Experiencia postcomercialización
Las experiencias adversas postcomercialización se informaron voluntariamente de una población de tamaño incierto, por lo tanto, no es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición a la vacuna.
El perfil de seguridad de GARDASIL 9 y GARDASIL es similar. La experiencia de seguridad postcomercialización con GARDASIL es relevante para GARDASIL 9 ya que las vacunas se fabrican de manera similar y contienen las mismas proteínas L1 del VPH de cuatro de los mismos tipos de VPH.
GARDASIL 9
Además de las reacciones adversas informadas en los estudios clínicos, las siguientes experiencias adversas se han informado espontáneamente durante el uso posterior a la aprobación de GARDASIL 9:
Trastornos gastrointestinales: Vómitos
Trastornos de la piel y del tejido subcutáneo: Urticaria
GARDASIL
Además, las siguientes experiencias adversas postcomercialización se han informado espontáneamente para GARDASIL:
Trastornos de la sangre y del sistema linfático: Anemia hemolítica autoinmune, púrpura trombocitopénica idiopática, linfadenopatía.
Trastornos respiratorios, torácicos y mediastínicos: Embolia pulmonar.
Trastornos gastrointestinales: Pancreatitis.
Trastornos generales y condiciones del sitio de administración: Astenia, escalofríos, muerte, malestar.
Trastornos del sistema inmunitario: Enfermedades autoinmunitarias, reacciones de hipersensibilidad, incluidas reacciones anafilácticas/anafilactoides, broncoespasmo.
Trastornos musculoesqueléticos y del tejido conjuntivo: Artralgia, mialgia.
Trastornos del sistema nervioso: Encefalomielitis diseminada aguda, síndrome de Guillain-Barré, enfermedad de la motoneurona, parálisis, convulsiones, mielitis transversa.
Infecciones e infestaciones: Celulitis.
Trastornos vasculares: Trombosis venosa profunda.
7 INTERACCIONES MEDICAMENTOSAS
7.1 Uso con medicamentos inmunosupresores sistémicos
Las terapias inmunosupresoras, incluida la irradiación, los antimetabolitos, los agentes alquilantes, los fármacos citotóxicos y los corticosteroides (utilizados en dosis superiores a las fisiológicas), pueden reducir las respuestas inmunitarias a las vacunas [ver Uso en poblaciones específicas (8.6)].
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de riesgos
Todos los embarazos conllevan un riesgo de defectos de nacimiento, pérdida o otros resultados adversos. En la población general de los EE. UU., el riesgo estimado de fondo de defectos de nacimiento mayores y abortos espontáneos en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente. No existen estudios adecuados y bien controlados de GARDASIL 9 en mujeres embarazadas. Los datos de GARDASIL son pertinentes a GARDASIL 9 porque ambas vacunas se fabrican utilizando el mismo proceso y tienen composiciones superpuestas. Se evaluaron datos de estudios previos a la licencia en los que 55 y 62 embarazos con resultados conocidos estaban asociados con mujeres expuestas involuntariamente a GARDASIL y GARDASIL 9, respectivamente. Los datos del registro de exposición durante el embarazo están disponibles de 1640 y 69 mujeres inscritas prospectivamente con resultados de embarazo conocidos que fueron vacunadas con GARDASIL y GARDASIL 9, respectivamente. Los datos disponibles no sugieren un mayor riesgo de defectos de nacimiento mayores y abortos espontáneos en mujeres que recibieron GARDASIL o GARDASIL 9.
En un estudio de toxicidad del desarrollo, se administró 0,5 mL de una formulación de la vacuna que contenía entre 1 y 1,5 veces cada uno de los 9 tipos de antígenos del VPH a ratas hembras antes del apareamiento y durante la gestación. En un segundo estudio, a los animales se les administró una dosis humana única (0,5 mL) de GARDASIL 9 antes del apareamiento, durante la gestación y durante la lactancia. Estos estudios en animales no revelaron evidencia de daño al feto debido a GARDASIL 9 [ver Datos].
Datos
Datos humanos
En estudios clínicos previos a la licencia de GARDASIL 9, las mujeres se sometieron a pruebas de embarazo inmediatamente antes de la administración de cada dosis de GARDASIL 9 o la vacuna de control (GARDASIL). A las sujetas que se determinó que estaban embarazadas se les indicó que pospusieran la vacunación hasta el final de su embarazo. A pesar de este régimen de cribado del embarazo, algunas sujetas fueron vacunadas muy temprano en el embarazo antes de que el gonadotropina coriónica humana (HCG) fuera detectable. Se realizó un análisis para evaluar los resultados del embarazo en embarazos con inicio dentro de los 30 días antes o después de la vacunación con GARDASIL 9 o GARDASIL. Entre dichos embarazos, hubo 62 y 55 con resultados conocidos (excluyendo embarazos ectópicos y terminaciones electivas) para GARDASIL 9 y GARDASIL, respectivamente, incluidos 44 y 48 nacidos vivos, respectivamente. Las tasas de embarazos que resultaron en un aborto espontáneo fueron del 27,4% (17/62) y del 12,7% (7/55) en sujetas que recibieron GARDASIL 9 o GARDASIL, respectivamente. Las tasas de nacidos vivos con defectos de nacimiento mayores fueron del 0% (0/44) y del 2,1% (1/48) en sujetas que recibieron GARDASIL 9 o GARDASIL, respectivamente.
Un registro de embarazo de seis años para GARDASIL 9 inscribió a 185 mujeres que estuvieron expuestas a GARDASIL 9 dentro de un mes antes del último período menstrual (LMP) o en cualquier momento durante el embarazo, 180 de las cuales fueron seguidas prospectivamente. Después de excluir las terminaciones electivas (n = 1), los embarazos ectópicos (n = 0) y las que se perdieron en el seguimiento (n = 110), hubo 69 embarazos (incluyendo un embarazo gemelar) con resultados conocidos. De los 69 embarazos, 5 fueron en mujeres expuestas dos veces durante el embarazo. Por lo tanto, hubo 74 exposiciones a GARDASIL 9 durante el embarazo: 3 ocurrieron durante los 30 días previos al LMP, 34 durante el primer trimestre, 13 durante el segundo trimestre, 19 durante el tercer trimestre y 5 en un trimestre desconocido. Los resultados adversos del embarazo incluyeron 3 abortos espontáneos (todos en exposiciones durante el primer trimestre del embarazo) y 3 defectos de nacimiento mayores (uno cada uno para la exposición durante los 30 días previos al LMP, primer trimestre y segundo trimestre). Las mujeres que estuvieron expuestas dos veces durante el embarazo tuvieron 0 abortos espontáneos y 0 defectos de nacimiento mayores. Estos datos no sugieren un mayor riesgo de defectos de nacimiento mayores y abortos espontáneos en mujeres que recibieron GARDASIL 9.
Un registro de embarazo de cinco años inscribió a 2.942 mujeres que estuvieron expuestas a GARDASIL dentro de un mes antes del LMP o en cualquier momento durante el embarazo, 2.566 de las cuales fueron seguidas prospectivamente. Después de excluir las terminaciones electivas (n = 107), los embarazos ectópicos (n = 5) y las que se perdieron en el seguimiento (n = 814), hubo 1.640 embarazos con resultados conocidos. Las tasas de abortos espontáneos y defectos de nacimiento mayores fueron del 6,8% de los embarazos (111/1.640) y del 2,4% de los recién nacidos vivos (37/1.527), respectivamente. Estas tasas de resultados evaluados en la población prospectiva fueron consistentes con las tasas de fondo estimadas.
En dos estudios postcomercialización de GARDASIL (uno realizado en los EE. UU. y el otro en países nórdicos), se evaluaron retrospectivamente los resultados del embarazo entre las sujetas que recibieron GARDASIL durante el embarazo. Entre los 1.740 embarazos incluidos en la base de datos del estudio de los EE. UU., los resultados estaban disponibles para evaluar las tasas de defectos de nacimiento mayores y abortos espontáneos. Entre los 499 embarazos incluidos en la base de datos del estudio nórdico, los resultados estaban disponibles para evaluar las tasas de defectos de nacimiento mayores. En ambos estudios, las tasas de resultados evaluados no sugirieron un mayor riesgo con la administración de GARDASIL durante el embarazo.
Datos de animales
Se realizaron estudios de toxicidad del desarrollo en ratas hembras. En un estudio, a los animales se les administró 0,5 mL de una formulación de la vacuna que contenía entre 1 y 1,5 veces cada uno de los 9 tipos de antígenos del VPH 5 y 2 semanas antes del apareamiento y el día 6 de la gestación. En un segundo estudio, a los animales se les administró una dosis humana única (0,5 mL) de GARDASIL 9, 5 y 2 semanas antes del apareamiento, el día 6 de la gestación y el día 7 de la lactancia. No se observaron efectos adversos en el desarrollo pre y postdestete. No hubo malformaciones fetales o variaciones relacionadas con la vacuna, ni efectos en la fertilidad femenina.
8.2 Lactancia
Resumen de riesgos
Los datos disponibles no son suficientes para evaluar los efectos de GARDASIL 9 en el lactante amamantado o en la producción/ excreción de la leche. Se deben considerar los beneficios del desarrollo y la salud de la lactancia junto con la necesidad clínica de la madre de GARDASIL 9 y cualquier efecto adverso potencial en el niño amamantado por GARDASIL 9 o por la condición materna subyacente. Para las vacunas preventivas, la condición materna subyacente es la susceptibilidad a la enfermedad prevenida por la vacuna.
8.4 Uso pediátrico
La seguridad y la eficacia no se han establecido en pacientes pediátricos menores de 9 años de edad.
8.5 Uso geriátrico
La seguridad y la eficacia de GARDASIL 9 no se han evaluado en una población geriátrica, definida como individuos de 65 años o más.
8.6 Individuos inmunocomprometidos
La respuesta inmunológica a GARDASIL 9 puede disminuir en individuos inmunocomprometidos [ver Interacciones farmacológicas (7.1)].
11 DESCRIPCIÓN
GARDASIL 9, Vacuna contra el Virus del Papiloma Humano 9-valente, Recombinante, es una vacuna recombinante 9-valente no infecciosa preparada a partir de las partículas víricas similares (VLP) purificadas de la proteína mayor de la cápside (L1) de los tipos de VPH 6, 11, 16, 18, 31, 33, 45, 52 y 58. Las proteínas L1 se producen mediante fermentaciones separadas utilizando Saccharomyces cerevisiae recombinante y se autoensamblan en VLP. El proceso de fermentación implica el crecimiento de S. cerevisiae en medios de fermentación químicamente definidos que incluyen vitaminas, aminoácidos, sales minerales y carbohidratos. Las VLP se liberan de las células de levadura mediante la disrupción celular y se purifican mediante una serie de métodos químicos y físicos. Las VLP purificadas se adsorben en un adyuvante preformado que contiene aluminio (sulfato de hidroxi fosfato de aluminio amorfo o AAHS). La vacuna VLP de VPH 9-valente es una suspensión líquida estéril que se prepara combinando las VLP adsorbidas de cada tipo de VPH y cantidades adicionales del adyuvante que contiene aluminio y el tampón de purificación final.
GARDASIL 9 es una suspensión estéril para administración intramuscular. Cada dosis de 0,5 ml contiene aproximadamente 30 mcg de proteína L1 del VPH tipo 6, 40 mcg de proteína L1 del VPH tipo 11, 60 mcg de proteína L1 del VPH tipo 16, 40 mcg de proteína L1 del VPH tipo 18, 20 mcg de proteína L1 del VPH tipo 31, 20 mcg de proteína L1 del VPH tipo 33, 20 mcg de proteína L1 del VPH tipo 45, 20 mcg de proteína L1 del VPH tipo 52 y 20 mcg de proteína L1 del VPH tipo 58.
Cada dosis de 0,5 ml de la vacuna también contiene aproximadamente 500 mcg de aluminio (proporcionado como AAHS), 9,56 mg de cloruro de sodio, 0,78 mg de L-histidina, 50 mcg de polisorbato 80, 35 mcg de borato de sodio, <7 mcg de proteína de levadura y agua para inyección. El producto no contiene conservantes ni antibióticos.
Después de una agitación completa, GARDASIL 9 es un líquido blanco y turbio.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
El VPH solo infecta a los seres humanos. Los estudios en animales con papilomavirus animales análogos sugieren que la eficacia de las vacunas con VLP de L1 puede implicar el desarrollo de respuestas inmunitarias humorales. Se cree que la eficacia de GARDASIL 9 contra las enfermedades anogenitales relacionadas con los tipos de VPH de la vacuna en los seres humanos está mediada por las respuestas inmunitarias humorales inducidas por la vacuna, aunque se desconoce el mecanismo exacto de protección.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogenesis, Mutagenesis, Impairment of Fertility
GARDASIL 9 no ha sido evaluado para el potencial de causar carcinogenicidad, genotoxicidad o deterioro de la fertilidad masculina.
14 ESTUDIOS CLÍNICOS
En estos estudios, seropositivo se define como un título de anticuerpos anti-VPH mayor o igual que el punto de corte de serostatus preestablecido para un tipo de VPH dado. Seronegativo se define como un título de anticuerpos anti-VPH menor que el punto de corte de serostatus preestablecido para un tipo de VPH dado. El punto de corte de serostatus es el nivel de título de anticuerpos por encima del límite inferior de cuantificación del ensayo que distingue de manera confiable las muestras de suero clasificadas por la probabilidad clínica de infección por VPH y el estado positivo o negativo por versiones anteriores del ensayo inmunoenzimático competitivo Luminex (cLIA). Los límites inferiores de cuantificación y los puntos de corte de serostatus para cada uno de los 9 tipos de VPH de la vacuna se muestran en la Tabla 5 a continuación. PCR positivo se define como ADN detectado para un tipo de VPH dado. PCR negativo se define como ADN no detectado para un tipo de VPH dado. El límite inferior de detección para los ensayos de PCR de VPH multiplexados varió de 5 a 34 copias por prueba en los 9 tipos de VPH de la vacuna.
| Tipo de VPH | Límite inferior de cuantificación cLIA (mMU*/mL) | Punto de corte de serostatus cLIA (mMU*/mL) |
|---|---|---|
|
||
| VPH 6 | 16 | 30 |
| VPH 11 | 6 | 16 |
| VPH 16 | 12 | 20 |
| VPH 18 | 8 | 24 |
| VPH 31 | 4 | 10 |
| VPH 33 | 4 | 8 |
| VPH 45 | 3 | 8 |
| VPH 52 | 3 | 8 |
| VPH 58 | 4 | 8 |
14.1 Datos de eficacia y efectividad para GARDASIL
La eficacia y la efectividad de GARDASIL son relevantes para GARDASIL 9 ya que las vacunas se fabrican de manera similar y contienen cuatro de las mismas VLP de L1 de VPH.
Individuos de 16 a 26 años de edad
La eficacia de GARDASIL se evaluó en cinco ensayos clínicos controlados con AAHS, doble ciego y aleatorizados que evaluaron a 24.596 individuos de 16 a 26 años de edad (20.541 niñas y mujeres y 4.055 niños y hombres). Los resultados de estos ensayos se muestran en la Tabla 6 a continuación.
| Puntos finales de la enfermedad | GARDASIL | Control AAHS | % Eficacia (IC del 95%) | ||
|---|---|---|---|---|---|
| N | Número de casos | N | Número de casos | ||
| N=Número de individuos con al menos una visita de seguimiento después del mes 7 | |||||
| IC=Intervalo de confianza | |||||
| Nota 1: Las estimaciones puntuales y los intervalos de confianza se ajustan al tiempo de seguimiento de la persona. | |||||
| Nota 2: La Tabla 6 no incluye casos debidos a tipos de VPH no cubiertos por la vacuna. | |||||
| AAHS = Sulfato de hidroxi fosfato de aluminio amorfo, CIN = Neoplasia intraepitelial cervical, VIN = Neoplasia intraepitelial vulvar, VaIN=Neoplasia intraepitelial vaginal, PIN=Neoplasia intraepitelial peniana, AIN=Neoplasia intraepitelial anal, AIS=Adenocarcinoma In Situ | |||||
|
|||||
| Niñas y mujeres de 16 a 26 años de edad† | |||||
| CIN 2/3 o AIS relacionado con VPH 16 o 18 | 8493 | 2 | 8464 | 112 | 98.2 (93.5, 99.8) |
| VIN 2/3 relacionado con VPH 16 o 18 | 7772 | 0 | 7744 | 10 | 100.0 (55.5, 100.0) |
| VaIN 2/3 relacionado con VPH 16 o 18 | 7772 | 0 | 7744 | 9 | 100.0 (49.5, 100.0) |
| CIN (CIN 1, CIN 2/3) o AIS relacionado con VPH 6, 11, 16 o 18 | 7864 | 9 | 7865 | 225 | 96.0 (92.3, 98.2) |
| Verrugas genitales relacionadas con VPH 6, 11, 16 o 18 | 7900 | 2 | 7902 | 193 | 99.0 (96.2, 99.9) |
| Verrugas genitales relacionadas con VPH 6 y 11 | 6932 | 2 | 6856 | 189 | 99.0 (96.2, 99.9) |
| Niños y hombres de 16 a 26 años de edad | |||||
| Lesiones genitales externas relacionadas con VPH 6, 11, 16 o 18 | |||||
| Lesiones genitales externas | 1394 | 3 | 1404 | 32 | 90.6 (70.1, 98.2) |
| Condiloma | 1394 | 3 | 1404 | 28 | 89.3 (65.3, 97.9) |
| PIN 1/2/3 | 1394 | 0 | 1404 | 4 | 100.0 (-52.1, 100.0) |
| HPV 6-, 11-, 16-, o 18-related Endpoint | |||||
| AIN 1/2/3 | 194 | 5 | 208 | 24 | 77.5 (39.6, 93.3) |
| AIN 2/3 | 194 | 3 | 208 | 13 | 74.9 (8.8, 95.4) |
| AIN 1 Condyloma Acuminatum Non-acuminate |
194 194 194 |
4 0 4 |
208 208 208 |
16 6 11 |
73.0 (16.3, 93.4) 100.0 (8.2, 100.0) 60.4 (-33.5, 90.8) |
En un estudio de extensión en mujeres de 16 a 26 años de edad al momento de la inscripción, la eficacia profiláctica de GARDASIL hasta el mes 60 contra la enfermedad cervical y genital general relacionada con el VPH 6, 11, 16 y 18 fue del 100% (IC del 95%: 12.3%, 100%) en comparación con el control AAHS.
Un estudio de extensión en niñas y mujeres de 16 a 23 años de edad utilizó registros nacionales de atención médica en Dinamarca, Islandia, Noruega y Suecia para monitorear los casos finales de CIN (de cualquier grado), AIS, cáncer cervical, cáncer vulvar o cáncer vaginal relacionados con el VPH 6, 11, 16 o 18 entre 2.650 niñas y mujeres de 16 a 23 años de edad al momento de la inscripción que fueron asignadas aleatoriamente a la vacunación con GARDASIL. Un análisis intermedio de la población de eficacia según el protocolo incluyó 1.902 sujetos que completaron la serie de vacunación con GARDASIL dentro de un año, eran seronegativos para el tipo de VPH relevante hasta 1 mes después de la dosis 3, no tenían violaciones del protocolo y tenían datos de seguimiento disponibles. El seguimiento promedio desde la primera dosis de la vacuna fue de 6,7 años con un rango de 2,8 a 8,4 años. Al momento del análisis intermedio, no se observaron casos de CIN (de cualquier grado), AIS, cáncer cervical, cáncer vulvar o cáncer vaginal relacionados con el VPH 6, 11, 16 o 18 durante un total de 5.765 personas-año en riesgo.
Niñas y niños de 9 a 15 años de edad
Un estudio de extensión de 614 niñas y 565 niños de 9 a 15 años de edad al momento de la inscripción que fueron asignados aleatoriamente a la vacunación con GARDASIL siguió activamente a los sujetos para detectar casos finales de infección persistente relacionada con el VPH 6, 11, 16 o 18, CIN (de cualquier grado), AIS, VIN, VaIN, cáncer cervical, cáncer vulvar, cáncer vaginal y lesiones genitales externas desde el inicio de la actividad sexual o los 16 años en adelante. Un análisis intermedio de la población de eficacia según el protocolo incluyó 246 niñas y 168 niños que completaron la serie de vacunación con GARDASIL dentro de un año, eran seronegativos para el tipo de VPH relevante al inicio de la serie de vacunación y no habían iniciado la actividad sexual antes de recibir la tercera dosis de GARDASIL. El seguimiento promedio desde la primera dosis de la vacuna fue de 7,2 años con un rango de 0,5 a 8,5 años. Al momento del análisis intermedio, no se observaron casos de infección persistente de al menos 12 meses de duración ni casos de CIN (de cualquier grado), AIS, VIN, VaIN, cáncer cervical, cáncer vulvar, cáncer vaginal o lesiones genitales externas relacionados con el VPH 6, 11, 16 o 18 durante un total de 1.105 personas-año en riesgo. Hubo 4 casos de infección persistente relacionada con el VPH 6, 11, 16 o 18 de al menos 6 meses de duración, incluidos 3 casos relacionados con el VPH 16 y 1 caso relacionado con el VPH 6, ninguno de los cuales persistió hasta los 12 meses de duración.
Individuos de 27 a 45 años de edad
Un ensayo clínico evaluó la eficacia de GARDASIL en 3.253 mujeres de 27 a 45 años de edad, basado en un punto final combinado de infección persistente relacionada con el VPH 6, 11, 16 o 18, verrugas genitales, lesiones displásicas vulvares y vaginales de cualquier grado, CIN de cualquier grado, AIS y cáncer cervical. Estas mujeres fueron asignadas aleatoriamente 1:1 para recibir GARDASIL o control AAHS. El ensayo clínico se llevó a cabo en dos fases: un estudio base y una extensión de estudio a largo plazo. La población de eficacia según el protocolo (PPE) recibió las tres vacunas dentro de un año de la inscripción, no tuvo desviaciones importantes del protocolo del estudio, era ingenua (PCR negativa y seronegativa) para el tipo (s) de VPH relevante (s) (tipos 6, 11, 16 y 18) antes de la dosis 1 y permaneció PCR negativa para el tipo (s) de VPH relevante (s) hasta un mes después de la dosis 3 (mes 7).
En el estudio base (duración promedio de seguimiento de 3,5 años después de la dosis 3), la eficacia de GARDASIL contra la incidencia combinada de infección persistente relacionada con el VPH 6, 11, 16 y 18, verrugas genitales, VIN, VaIN, cáncer vulvar, cáncer vaginal, displasia cervical (CIN de cualquier grado), AIS y cáncer cervical en la población PPE fue del 87,7% (IC del 95%: 75,4%, 94,6%). La estimación de eficacia para el punto final combinado se debió principalmente a la prevención de la infección persistente. La eficacia de GARDASIL contra la incidencia combinada de verrugas genitales o displasia cervical relacionadas con el VPH 6, 11, 16 y 18 fue del 95,0% (IC del 95%: 68,7%, 99,9%) en la población PPE. Si bien no se demostró una eficacia estadísticamente significativa para GARDASIL en el estudio base para la prevención de neoplasia intraepitelial cervical de grados 2 y 3 (CIN 2/3), adenocarcinoma in situ (AIS) o cáncer cervical relacionado con los tipos de VPH 16 y 18, hubo 1 caso de CIN 2/3 observado en el grupo GARDASIL y 5 casos en el grupo placebo. El caso de CIN 2 en el grupo GARDASIL dio positivo en la prueba de PCR para el VPH 16 y el VPH 51.
En la extensión a largo plazo de este estudio, los sujetos de Colombia (n = 600) asignados aleatoriamente al grupo GARDASIL en el estudio base fueron monitoreados para detectar verrugas genitales o displasia cervical relacionadas con el VPH 6, 11, 16 y 18. El seguimiento promedio después de la dosis 3 fue de 8,9 años con un rango de 0,1 a 10,1 años durante un total de 3.518 personas-año. Durante la fase de extensión a largo plazo, no se observaron casos de CIN (de cualquier grado) o verrugas genitales relacionadas con el VPH 6, 11, 16 o 18 en la población PPE.
La eficacia de GARDASIL en hombres de 27 a 45 años de edad se deduce de los datos de eficacia en mujeres de 27 a 45 años de edad, como se describió anteriormente, y está respaldada por datos de inmunogenicidad de un ensayo clínico en el que 150 hombres de 27 a 45 años de edad recibieron un régimen de 3 dosis de GARDASIL (0, 2, 6 meses). Un análisis entre estudios de poblaciones de inmunogenicidad según el protocolo comparó las GMT de anticuerpos contra el VPH 6, 11, 16 y 18 del mes 7 de estos hombres de 27 a 45 años de edad (Estudio A) con las de niños y hombres de 16 a 26 años de edad (Estudio B) en quienes se había establecido la eficacia de GARDASIL (ver Tabla 6). Las razones de GMT (Estudio A/Estudio B) para el VPH 6, 11, 16 y 18 fueron 0,82 (IC del 95%: 0,65, 1,03), 0,79 (IC del 95%: 0,66, 0,93), 0,91 (IC del 95%: 0,72, 1,13) y 0,74 (IC del 95%: 0,59, 0,92), respectivamente.
14.2 Ensayos clínicos para GARDASIL 9
La eficacia y/o inmunogenicidad del régimen de 3 dosis de GARDASIL 9 se evaluó en siete ensayos clínicos. El estudio 1 evaluó la eficacia de GARDASIL 9 para prevenir la enfermedad cervical, vulvar y vaginal relacionada con el VPH utilizando GARDASIL como comparador.
El análisis de la eficacia de GARDASIL 9 se evaluó en la población de eficacia por protocolo (PPE) de niñas y mujeres de 16 a 26 años, que recibieron las tres vacunaciones dentro de un año de la inscripción, no tuvieron desviaciones importantes del protocolo del estudio y eran naïve en cuanto al tipo(s) de VPH relevante(s) por serología y PCR de muestras cervicovaginales antes de la primera dosis y que permanecieron PCR negativas para el tipo(s) de VPH relevante(s) hasta un mes después de la tercera dosis (Mes 7). En general, aproximadamente el 52% de las sujetas eran negativas a todos los tipos de VPH de la vacuna tanto por PCR como por serología en el Día 1.
El análisis primario de la eficacia contra los Tipos 31, 33, 45, 52 y 58 de VPH se basa en un punto final combinado de Neoplasia Intraepitelial Cervical (CIN) 2, CIN 3, Adenocarcinoma in situ (AIS), carcinoma cervical invasivo, Neoplasia Intraepitelial Vulvar (VIN) 2/3, Neoplasia Intraepitelial Vaginal (VaIN) 2/3, cáncer vulvar o cáncer vaginal. Otros puntos finales evaluados incluyen enfermedad cervical, vulvar y vaginal de cualquier grado, infección persistente, anormalidades citológicas y procedimientos invasivos. Para todos los puntos finales, la eficacia contra los Tipos 31, 33, 45, 52 y 58 de VPH en GARDASIL 9 se evaluó en comparación con GARDASIL. La eficacia de GARDASIL 9 contra lesiones anales causadas por los Tipos 31, 33, 45, 52 y 58 de VPH no se evaluó debido a la baja incidencia. La efectividad de GARDASIL 9 contra lesiones anales se infería de la eficacia de GARDASIL contra lesiones anales causadas por los tipos 6, 11, 16 y 18 de VPH en hombres y las respuestas de anticuerpos provocadas por GARDASIL 9 contra los tipos de VPH cubiertos por la vacuna.
La efectividad contra la enfermedad causada por los Tipos 6, 11, 16 y 18 de VPH se evaluó mediante la comparación de los títulos medios geométricos (GMTs) de anticuerpos específicos por tipo después de la vacunación con GARDASIL 9 con los después de la vacunación con GARDASIL (Estudio 1 y Estudio 3). La efectividad de GARDASIL 9 en niñas y niños de 9 a 15 años y en niños y hombres de 16 a 26 años se infería basándose en una comparación de los GMTs de anticuerpos específicos por tipo con los de niñas y mujeres de 16 a 26 años después de la vacunación con GARDASIL 9. Los análisis de inmunogenicidad se realizaron en la población de inmunogenicidad por protocolo (PPI) que constaba de individuos que recibieron las tres vacunaciones dentro de rangos de días predefinidos, no tuvieron desviaciones importantes del protocolo del estudio, cumplieron con el rango de días predefinido para la recogida de suero para la evaluación de la respuesta de anticuerpos y eran naïve [PCR negativa (en niñas y mujeres de 16 a 26 años de edad; Estudios 1 y 2) y seronegativa (Estudios 1, 2, 3, 5, 7 y 8)] en cuanto al tipo(s) de VPH relevante(s) antes de la primera dosis y entre las niñas y mujeres de 16 a 26 años (Estudios 1 y 2) permanecieron PCR negativas para el tipo(s) de VPH relevante(s) hasta el Mes 7. Los rangos de días predefinidos para las vacunaciones eran relativos al Día 1 (primera dosis). Para el esquema de 3 dosis, la segunda dosis fue a los 2 meses (± 3 semanas) y la tercera dosis fue a los 6 meses (± 4 semanas). Para el esquema de 2 dosis, la segunda dosis fue a los 6 o 12 meses (± 4 semanas). El rango de días predefinido para la recogida de suero para la evaluación de la respuesta de anticuerpos fue de 21 a 49 días después de la última dosis.
El Estudio 1 evaluó la inmunogenicidad de GARDASIL 9 y la eficacia para prevenir la infección y la enfermedad causada por los tipos 6, 11, 16, 18, 31, 33, 45, 52 y 58 de VPH en niñas y mujeres de 16 a 26 años. El Estudio 2 evaluó la inmunogenicidad de GARDASIL 9 en niñas y niños de 9 a 15 años y en mujeres de 16 a 26 años. El Estudio 3 evaluó la inmunogenicidad de GARDASIL 9 en comparación con GARDASIL en niñas de 9 a 15 años. El Estudio 4 evaluó la administración de GARDASIL 9 a niñas y mujeres de 12 a 26 años previamente vacunadas con GARDASIL. El Estudio 5 evaluó GARDASIL 9 administrado concomitantemente con Menactra y Adacel en niñas y niños de 11 a 15 años. En conjunto, estos cinco ensayos clínicos evaluaron a 12.233 individuos que recibieron GARDASIL 9 (8.048 niñas y mujeres de 16 a 26 años en la inscripción con una edad media de 21,8 años; 2.927 niñas de 9 a 15 años en la inscripción con una edad media de 11,9 años; y 1.258 niños de 9 a 15 años en la inscripción con una edad media de 11,9 años. El Estudio 7 evaluó la inmunogenicidad de GARDASIL 9 en niños y hombres, incluidos 1.106 que se identificaron como hombres heterosexuales (HM) y 313 que se identificaron como hombres que tienen relaciones sexuales con hombres (MSM), de 16 a 26 años en la inscripción (edades medias de 20,8 años y 22,2 años, respectivamente) y 1.101 niñas y mujeres de 16 a 26 años en la inscripción (edad media de 21,3 años). El Estudio 9 evaluó la inmunogenicidad de GARDASIL 9 en 640 mujeres de 27 a 45 años y 570 niñas y mujeres de 16 a 26 años (edades medias de 35,8 años y 21,6 años, respectivamente).
La distribución racial de las niñas y mujeres de 16 a 26 años en los ensayos clínicos fue la siguiente: 56,8% blancas; 25,2% otras; 14,1% asiáticas; y 3,9% negras. La distribución racial de las niñas de 9 a 15 años en los ensayos clínicos fue la siguiente: 60,3% blancas; 19,3% otras; 13,5% asiáticas; y 7,0% negras. La distribución racial de los niños de 9 a 15 años en los ensayos clínicos fue la siguiente: 46,6% blancas; 34,3% otras; 13,3% asiáticas; y 5,9% negras. La distribución racial de los niños y hombres de 16 a 26 años en los ensayos clínicos fue la siguiente: 62,1% blancas; 22,6% otras; 9,8% asiáticas; y 5,5% negras.
En el Estudio 9, la distribución racial de las mujeres de 27 a 45 años fue la siguiente: 97,7% blancas, 1,6% asiáticas, 0,3% otras o multirraciales y 0,5% negras. La distribución racial de las niñas y mujeres de 16 a 26 años en este estudio fue la siguiente: 94,6% blancas, 3,0% asiáticas, 1,6% otras o multirraciales y 0,9% negras.
Un ensayo clínico (Estudio 8) evaluó el régimen de 2 dosis de GARDASIL 9. El Estudio 8 evaluó la inmunogenicidad de 2 dosis de GARDASIL 9 en niñas y niños de 9 a 14 años y 3 dosis de GARDASIL 9 en niñas de 9 a 14 años y mujeres de 16 a 26 años; (N = 1.518; 753 niñas; 451 niños y 314 mujeres). La edad media de las niñas y niños de 9 a 14 años era de 11,5 años; la edad media de las niñas y mujeres de 16 a 26 años era de 21,0 años. En el Estudio 8, la distribución racial fue la siguiente: 61,1% blancas; 16,3% asiáticas; 13,3% otras; y 8,9% negras.
14.3 Eficacia – Tipos 31, 33, 45, 52 y 58 de VPH en Niñas y Mujeres de 16 a 26 Años de Edad
Estudios que respaldan la eficacia de GARDASIL 9 contra los Tipos 31, 33, 45, 52 y 58 de VPH
La eficacia de GARDASIL 9 en niñas y mujeres de 16 a 26 años se evaluó en un ensayo clínico aleatorizado, doble ciego, controlado con comparador activo (Estudio 1) que incluyó un total de 14.204 mujeres (GARDASIL 9 = 7.099; GARDASIL = 7.105) que fueron inscritas y vacunadas sin pre-selección para la presencia de infección por VPH. Los sujetos fueron seguidos con una duración media de 40 meses (rango de 0 a 64 meses) después de la última vacunación.
La evaluación de eficacia primaria se llevó a cabo en la población PPE basada en un punto final clínico compuesto de cáncer cervical, cáncer vulvar, cáncer vaginal, CIN 2/3 o AIS, VIN 2/3 y VaIN 2/3 relacionados con VPH 31, 33, 45, 52 y 58. La eficacia se evaluó además con los puntos finales clínicos de CIN 1 relacionado con VPH 31, 33, 45, 52 y 58, enfermedad vulvar y vaginal de cualquier grado e infección persistente. Además, el estudio también evaluó el impacto de GARDASIL 9 en las tasas de pruebas de Papanicolaou (Pap) anormales relacionadas con VPH 31, 33, 45, 52 y 58, biopsia cervical y genital externa y terapia definitiva [incluida la escisión electroquirúrgica en asa (LEEP) y la conización]. La eficacia para todos los puntos finales se midió a partir de la visita del mes 7.
GARDASIL 9 previno la infección persistente y la enfermedad relacionadas con VPH 31, 33, 45, 52 y 58 y también redujo la incidencia de anormalidades en la prueba de Pap relacionadas con VPH 31, 33, 45, 52 y 58, biopsia cervical y genital externa y terapia definitiva (Tabla 7).
| Punto final de la enfermedad | GARDASIL 9 N†=7099 |
GARDASIL N†=7105 |
Eficacia de GARDASIL 9 % (IC del 95%) |
||
|---|---|---|---|---|---|
| n‡ | Número de casos | n‡ | Número de casos | ||
| IC=Intervalo de confianza | |||||
| CIN=Neoplasia intraepitelial cervical, VIN=Neoplasia intraepitelial vulvar, VaIN=Neoplasia intraepitelial vaginal, AIS=Adenocarcinoma In Situ, ASC-US=Células escamosas atípicas de significado indeterminado | |||||
| HR=Alto riesgo | |||||
|
|||||
| CIN 2/3, AIS, cáncer cervical, VIN 2/3, VaIN 2/3, cáncer vulvar y cáncer vaginal relacionados con VPH 31, 33, 45, 52, 58 | 6016 | 1 | 6017 | 30 | 96.7 (80.9, 99.8) |
| CIN 1 relacionado con VPH 31, 33, 45, 52, 58 | 5948 | 1 | 5943 | 69 | 98.6 (92.4, 99.9) |
| CIN 2/3 o AIS relacionado con VPH 31, 33, 45, 52, 58 | 5948 | 1 | 5943 | 27 | 96.3 (79.5, 99.8) |
| Enfermedad vulvar o vaginal relacionada con VPH 31, 33, 45, 52, 58 | 6009 | 1 | 6012 | 16 | 93.8 (61.5, 99.7) |
| Infección persistente relacionada con VPH 31, 33, 45, 52, 58 ≥6 meses§ | 5939 | 26 | 5953 | 642 | 96.2 (94.4, 97.5) |
| Infección persistente relacionada con HPV 31-, 33-, 45-, 52-, 58- ≥12 meses¶ | 5939 | 15 | 5953 | 375 | 96.1 (93.7, 97.9) |
| ASC-US HR-HPV positivo o peor anormalidad de Pap relacionada con HPV 31-, 33-, 45-, 52-, 58-# | 5881 | 35 | 5882 | 462 | 92.6 (89.7, 94.8) |
| Biopsia relacionada con HPV 31-, 33-, 45-, 52-, 58- | 6016 | 7 | 6017 | 222 | 96.9 (93.6, 98.6) |
| Terapia definitiva relacionada con HPV 31-, 33-, 45-, 52-, 58-Þ | 6012 | 4 | 6014 | 32 | 87.5 (65.7, 96.0) |
14.4 Seguimiento a largo plazo de individuos vacunados con GARDASIL 9
En un estudio de extensión de individuos en el Estudio 2, 971 niñas y 301 niños de 9 a 15 años de edad al momento de la inscripción que recibieron un régimen de 3 dosis de GARDASIL 9 fueron seguidos activamente a partir de los 16 años para casos de infección persistente y enfermedad relacionados con HPV 6, 11, 16, 18, 31, 33, 45, 52 y 58. Para las niñas, los criterios de valoración de la enfermedad evaluados incluyeron CIN (de cualquier grado), AIS, VIN, VaIN, verrugas genitales externas, cáncer cervical, cáncer vulvar y cáncer vaginal relacionados con HPV 6, 11, 16, 18, 31, 33, 45, 52 y 58. Para los niños, los criterios de valoración de la enfermedad evaluados incluyeron PIN, verrugas genitales externas, cáncer de pene, cáncer perineal y cáncer perianal relacionados con HPV 6, 11, 16, 18, 31, 33, 45, 52 y 58.
El análisis de la población según el protocolo incluyó a 872 niñas y 262 niños que completaron la serie de vacunación con GARDASIL 9 dentro de un año, fueron seronegativos al tipo de HPV relevante al inicio de la serie de vacunación y no habían iniciado la actividad sexual antes de recibir la tercera dosis de GARDASIL 9. La mediana de seguimiento desde la última dosis de la vacuna fue de 10,0 años con un rango de 3,0 a 11,0 años en niñas de 9 a 15 años de edad y 9,9 años con un rango de 3,0 a 10,6 años en niños de 9 a 15 años de edad.
En las niñas, no se observaron casos de CIN 2/3, AIS, VIN, VaIN, verrugas genitales externas, cáncer cervical, cáncer vulvar o cáncer vaginal relacionados con HPV 6, 11, 16, 18, 31, 33, 45, 52 y 58 durante un total de 4.576,1 personas-año en riesgo. Se observó un caso de CIN1 que dio positivo para HPV 16, 39 y 59 por PCR. En los niños, no se observaron casos de PIN, verrugas genitales externas, cáncer de pene, cáncer perineal o cáncer perianal relacionados con HPV 6, 11, 16, 18, 31, 33, 45, 52 y 58 durante un total de 1.278,6 personas-año en riesgo.
Las tasas de incidencia de infecciones persistentes relacionadas con los tipos de HPV de la vacuna de al menos 6 meses de duración en niñas y niños observadas durante el estudio fueron de 52,4 (IC del 95%: 33,6, 78,0) y 54,6 (IC del 95%: 21,9, 112,4) casos por 10.000 personas-año, respectivamente, y dentro del rango de las tasas de incidencia informadas en cohortes vacunadas de edad similar según los resultados de estudios de eficacia previos de GARDASIL 9, (que fueron 36,6 y 21,5 por 10.000 personas-año para infecciones persistentes relacionadas con HPV 6, 11, 16 y 18, respectivamente, en mujeres en el Estudio 1) y GARDASIL (que fueron 30 y 59 por 10.000 personas-año, para infecciones persistentes relacionadas con HPV 6, 11, 16 y 18 en estudios de GARDASIL en mujeres y hombres, respectivamente).
14.5 Eficacia en la prevención de cánceres orofaríngeos y de cabeza y cuello relacionados con el VPH
La eficacia de GARDASIL 9 contra los cánceres orofaríngeos y de cabeza y cuello causados por los tipos de VPH 16, 18, 31, 33, 45, 52 y 58, se basa en la eficacia de GARDASIL y GARDASIL 9 para prevenir la enfermedad anogenital causada por los tipos de VPH cubiertos por la vacuna [ver Estudios clínicos (14.1, 14.2, 14.3)].
14.6 Inmunogenicidad de un régimen de 3 dosis
No se ha determinado el título mínimo de anticuerpos anti-VPH que confiere eficacia protectora.
Se utilizaron inmunoensayos específicos de tipo (es decir, cLIA) con estándares específicos de tipo para evaluar la inmunogenicidad a cada tipo de VPH de la vacuna. Estos ensayos midieron los anticuerpos contra epítopos neutralizantes para cada tipo de VPH. Las escalas de estos ensayos son únicas para cada tipo de VPH; por lo tanto, las comparaciones entre tipos y con otros ensayos no son apropiadas. La inmunogenicidad se midió mediante (1) el porcentaje de individuos que fueron seropositivos para anticuerpos contra el tipo de VPH de la vacuna relevante, y (2) el título medio geométrico (GMT).
Estudios que respaldan la eficacia de GARDASIL 9 contra los tipos de VPH 6, 11, 16 y 18
La eficacia de GARDASIL 9 contra la infección persistente y la enfermedad relacionada con los tipos de VPH 6, 11, 16 o 18 se infirió de las comparaciones de no inferioridad en el Estudio 1 (niñas y mujeres de 16 a 26 años de edad) y el Estudio 3 (niñas de 9 a 15 años de edad) de los GMT después de la vacunación con GARDASIL 9 con los que siguieron a la vacunación con GARDASIL. Un bajo número de casos de criterios de valoración de eficacia relacionados con los tipos de VPH 6, 11, 16 y 18 en ambos grupos de vacunación impidió una evaluación significativa de la eficacia utilizando los criterios de valoración de la enfermedad asociados con estos tipos de VPH. Los análisis primarios se realizaron en la población según el protocolo, que incluyó sujetos que recibieron las tres vacunas dentro de un año de la inscripción, no tuvieron desviaciones importantes del protocolo del estudio y fueron HPV-naïve. Los individuos HPV-naïve se definieron como seronegativos al tipo(s) de VPH relevante(s) antes de la dosis 1 y entre las mujeres de 16 a 26 años de edad en el Estudio 1 PCR negativo al tipo(s) de VPH relevante(s) en muestras cervicovaginales antes de la dosis 1 hasta el mes 7.
Los GMT anti-HPV 6, 11, 16 y 18 en el mes 7 para GARDASIL 9 entre las niñas de 9 a 15 años de edad y las mujeres jóvenes de 16 a 26 años de edad no fueron inferiores a los de las poblaciones correspondientes para GARDASIL (Tabla 8). Al menos el 99,7% de los individuos incluidos en los análisis para cada tipo de VPH se volvieron seropositivos en el mes 7.
| Población | GARDASIL 9 | GARDASIL | GARDASIL 9/ GARDASIL |
|||
|---|---|---|---|---|---|---|
| N† (n‡) |
GMT mMU§/mL |
N† (n‡) |
GMT mMU§/mL |
GMT Ratio |
(95% CI)¶ | |
| CI=Confidence Interval | ||||||
| GMT=Geometric Mean Titer | ||||||
| cLIA=competitive Luminex Immunoassay | ||||||
|
||||||
| Anti-HPV 6 | ||||||
| Niñas de 9 a 15 años | 300 (273) |
1679.4 | 300 (261) |
1565.9 | 1.07 | (0.93, 1.23) |
| Niñas y mujeres de 16 a 26 años | 6792 (3993) |
893.1 | 6795 (3975) |
875.2 | 1.02 | (0.99, 1.06) |
| Anti-HPV 11 | ||||||
| Niñas de 9 a 15 años | 300 (273) |
1315.6 | 300 (261) |
1417.3 | 0.93 | (0.80, 1.08) |
| Niñas y mujeres de 16 a 26 años | 6792 (3995) |
666.3 | 6795 (3982) |
830.0 | 0.80 | (0.77, 0.83) |
| Anti-HPV 16 | ||||||
| Niñas de 9 a 15 años | 300 (276) |
6739.5 | 300 (270) |
6887.4 | 0.97 | (0.85, 1.11) |
| Niñas y mujeres de 16 a 26 años | 6792 (4032) |
3131.1 | 6795 (4062) |
3156.6 | 0.99 | (0.96, 1.03) |
| Anti-HPV 18 | ||||||
| Niñas de 9 a 15 años | 300 (276) |
1956.6 | 300 (269) |
1795.6 | 1.08 | (0.91, 1.29) |
| Niñas y mujeres de 16 a 26 años | 6792 (4539) |
804.6 | 6795 (4541) |
678.7 | 1.19 | (1.14, 1.23) |
Estudio que respalda la eficacia de GARDASIL 9 contra los tipos de VPH de la vacuna en niñas y niños de 9 a 15 años
La eficacia de GARDASIL 9 contra la infección persistente y la enfermedad relacionada con los tipos de VPH de la vacuna en niñas y niños de 9 a 15 años se infirió de la comparación de no inferioridad realizada en la población PPI en el Estudio 2 de GMT después de la vacunación con GARDASIL 9 entre niñas y niños de 9 a 15 años con aquellos entre niñas y mujeres de 16 a 26 años. Los GMT anti-VPH en el mes 7 entre niñas y niños de 9 a 15 años no fueron inferiores a los GMT anti-VPH entre niñas y mujeres de 16 a 26 años (Tabla 9).
| Población | N† | n‡ | GMT mMU§/mL |
Relación GMT en relación con las niñas y mujeres de 16 a 26 años (IC del 95%)¶ |
|---|---|---|---|---|
| cLIA=Ensayo inmunológico competitivo Luminex | ||||
| IC=Intervalo de confianza | ||||
| GMT=Título medio geométrico | ||||
|
||||
| Anti-VPH 6 | ||||
| Niñas de 9 a 15 años | 630 | 503 | 1703.1 | 1.89 (1.68, 2.12) |
| Niños de 9 a 15 años | 641 | 537 | 2083.4 | 2.31 (2.06, 2.60) |
| Niñas y mujeres de 16 a 26 años | 463 | 328 | 900.8 | 1 |
| Anti-VPH 11 | ||||
| Niñas de 9 a 15 años | 630 | 503 | 1291.5 | 1.83 (1.63, 2.05) |
| Niños de 9 a 15 años | 641 | 537 | 1486.3 | 2.10 (1.88, 2.36) |
| Niñas y mujeres de 16 a 26 años | 463 | 332 | 706.6 | 1 |
| Anti-VPH 16 | ||||
| Niñas de 9 a 15 años | 630 | 513 | 6933.9 | 1.97 (1.75, 2.21) |
| Niños de 9 a 15 años | 641 | 546 | 8683.0 | 2.46 (2.20, 2.76) |
| Niñas y mujeres de 16 a 26 años | 463 | 329 | 3522.6 | 1 |
| Anti-VPH 18 | ||||
| Niñas de 9 a 15 años | 630 | 516 | 2148.3 | 2.43 (2.12, 2.79) |
| Niños de 9 a 15 años | 641 | 544 | 2855.4 | 3.23 (2.83, 3.70) |
| Niñas y mujeres de 16 a 26 años | 463 | 345 | 882.7 | 1 |
| Anti-HPV 31 | ||||
| Niñas de 9 a 15 años | 630 | 506 | 1894.7 | 2.51 (2.21, 2.86) |
| Niños de 9 a 15 años | 641 | 543 | 2255.3 | 2.99 (2.63, 3.40) |
| Niñas y mujeres de 16 a 26 años | 463 | 340 | 753.9 | 1 |
| Anti-HPV 33 | ||||
| Niñas de 9 a 15 años | 630 | 518 | 985.8 | 2.11 (1.88, 2.37) |
| Niños de 9 a 15 años | 641 | 544 | 1207.4 | 2.59 (2.31, 2.90) |
| Niñas y mujeres de 16 a 26 años | 463 | 354 | 466.8 | 1 |
| Anti-HPV 45 | ||||
| Niñas de 9 a 15 años | 630 | 518 | 707.7 | 2.60 (2.25, 3.00) |
| Niños de 9 a 15 años | 641 | 547 | 912.1 | 3.35 (2.90, 3.87) |
| Niñas y mujeres de 16 a 26 años | 463 | 368 | 272.2 | 1 |
| Anti-HPV 52 | ||||
| Niñas de 9 a 15 años | 630 | 517 | 962.2 | 2.21 (1.96, 2.49) |
| Niños de 9 a 15 años | 641 | 545 | 1055.5 | 2.52 (2.22, 2.84) |
| Niñas y mujeres de 16 a 26 años | 463 | 337 | 419.6 | 1 |
| Anti-HPV 58 | ||||
| Niñas de 9 a 15 años | 630 | 516 | 1288.0 | 2.18 (1.94, 2.46) |
| Niños de 9 a 15 años | 641 | 544 | 1593.3 | 2.70 (2.40, 3.03) |
| Niñas y mujeres de 16 a 26 años | 463 | 332 | 590.5 | 1 |
Estudio que respalda la eficacia de GARDASIL 9 contra los tipos de VPH de la vacuna en niños y hombres de 16 a 26 años
La eficacia de GARDASIL 9 contra la infección persistente y la enfermedad relacionada con los tipos de VPH de la vacuna en niños y hombres de 16 a 26 años se infirió de la comparación de no inferioridad realizada en la población PPI en el Estudio 7 de GMT después de la vacunación con GARDASIL 9 entre HM de 16 a 26 años con aquellos entre niñas y mujeres de 16 a 26 años. Los GMT anti-VPH en el mes 7 entre HM de 16 a 26 años no fueron inferiores a los GMT anti-VPH entre niñas y mujeres de 16 a 26 años (Tabla 10). El Estudio 7 también incluyó a 313 MSM VIH negativos de 16 a 26 años. En el mes 7, las razones de GMT anti-VPH para MSM en relación con HM oscilaron entre 0,6 y 0,8, dependiendo del tipo de VPH. Las razones de GMT para MSM en relación con HM fueron generalmente similares a las observadas previamente en ensayos clínicos con GARDASIL.
| Población | N† | n‡ | GMT mMU§/mL |
Razón de GMT en relación con las niñas y mujeres de 16 a 26 años (IC del 95%)¶ |
|---|---|---|---|---|
| cLIA=ensayo inmunológico competitivo Luminex | ||||
| IC=intervalo de confianza | ||||
| GMT=título medio geométrico | ||||
|
||||
| Anti-VPH 6 | ||||
| HM de 16 a 26 años | 1103 | 847 | 782.0 | 1.11 (1.02, 1.21) |
| Niñas y mujeres de 16 a 26 años | 1099 | 708 | 703.9 | 1 |
| Anti-VPH 11 | ||||
| HM de 16 a 26 años | 1103 | 851 | 616.7 | 1.09 (1.00, 1.19) |
| Niñas y mujeres de 16 a 26 años | 1099 | 712 | 564.9 | 1 |
| Anti-VPH 16 | ||||
| HM de 16 a 26 años | 1103 | 899 | 3346.0 | 1.20 (1.10, 1.30) |
| Niñas y mujeres de 16 a 26 años | 1099 | 781 | 2788.3 | 1 |
| Anti-VPH 18 | ||||
| HM de 16 a 26 años | 1103 | 906 | 808.2 | 1.19 (1.08, 1.31) |
| Niñas y mujeres de 16 a 26 años | 1099 | 831 | 679.8 | 1 |
| Anti-VPH 31 | ||||
| 16- through 26-year-old HM | 1103 | 908 | 708.5 | 1.24 (1.13, 1.37) |
| 16- through 26-year-old girls and women | 1099 | 826 | 570.1 | 1 |
| Anti-HPV 33 | ||||
| 16- through 26-year-old HM | 1103 | 901 | 384.8 | 1.19 (1.10, 1.30) |
| 16- through 26-year-old girls and women | 1099 | 853 | 322.0 | 1 |
| Anti-HPV 45 | ||||
| 16- through 26-year-old HM | 1103 | 909 | 235.6 | 1.27 (1.14, 1.41) |
| 16- through 26-year-old girls and women | 1099 | 871 | 185.7 | 1 |
| Anti-HPV 52 | ||||
| 16- through 26-year-old HM | 1103 | 907 | 386.8 | 1.15 (1.05, 1.26) |
| 16- through 26-year-old girls and women | 1099 | 849 | 335.2 | 1 |
| Anti-HPV 58 | ||||
| 16- through 26-year-old HM | 1103 | 897 | 509.8 | 1.25 (1.14, 1.36) |
| 16- through 26-year-old girls and women | 1099 | 839 | 409.3 | 1 |
Estudio que respalda la eficacia de GARDASIL 9 contra los tipos de VPH de la vacuna en mujeres de 27 a 45 años
La eficacia de GARDASIL 9 contra la infección persistente y la enfermedad relacionada con los tipos de VPH de la vacuna en mujeres de 27 a 45 años se respaldó mediante comparaciones de inmunopuentes realizadas en la población de PPI en el Estudio 9. En el Estudio 9, las razones GMT de las respuestas anti-VPH en el mes 7 entre las mujeres de 27 a 45 años en relación con las respuestas anti-VPH entre las niñas y mujeres de 16 a 26 años cumplieron con los criterios de éxito de tener el límite inferior del 95 % IC de las razones GMT mayor que 0,50 para VPH 16, 18, 31, 33, 45, 52 y 58 (Tabla 11).
| Población | N† | n‡ | GMT mMU§/mL |
Razón GMT en relación con las niñas y mujeres de 16 a 26 años (95 % IC)¶ |
|---|---|---|---|---|
| cLIA=Ensayo inmunológico competitivo de Luminex | ||||
| IC=Intervalo de confianza | ||||
| GMT=Títulos medios geométricos | ||||
|
||||
| Anti-VPH 6 | ||||
| Mujeres de 27 a 45 años | 640 | 448 | 638.4 | N.D# |
| Niñas y mujeres de 16 a 26 años | 570 | 421 | 787.8 | N.D# |
| Anti-VPH 11 | ||||
| Mujeres de 27 a 45 años | 640 | 448 | 453.5 | N.D# |
| Niñas y mujeres de 16 a 26 años | 570 | 421 | 598.7 | N.D# |
| Anti-VPH 16 | ||||
| Mujeres de 27 a 45 años | 640 | 448 | 2,147.5 | 0.70 (0.63, 0.77) |
| Niñas y mujeres de 16 a 26 años | 570 | 436 | 3,075.8 | 1 |
| Anti-VPH 18 | ||||
| Mujeres de 27 a 45 años | 640 | 471 | 532.1 | 0.71 (0.64, 0.80) |
| Niñas y mujeres de 16 a 26 años | 570 | 421 | 744.5 | 1 |
| Anti-HPV 31 | ||||
| Mujeres de 27 a 45 años | 640 | 488 | 395.7 | 0.66 (0.60, 0.74) |
| Niñas y mujeres de 16 a 26 años | 570 | 447 | 596.1 | 1 |
| Anti-HPV 33 | ||||
| Mujeres de 27 a 45 años | 640 | 493 | 259.0 | 0.73 (0.67, 0.80) |
| Niñas y mujeres de 16 a 26 años | 570 | 457 | 354.5 | 1 |
| Anti-HPV 45 | ||||
| Mujeres de 27 a 45 años | 640 | 515 | 145.6 | 0.68 (0.60, 0.76) |
| Niñas y mujeres de 16 a 26 años | 570 | 470 | 214.9 | 1 |
| Anti-HPV 52 | ||||
| Mujeres de 27 a 45 años | 640 | 496 | 244.7 | 0.71 (0.64, 0.78) |
| Niñas y mujeres de 16 a 26 años | 570 | 456 | 346.5 | 1 |
| Anti-HPV 58 | ||||
| Mujeres de 27 a 45 años | 640 | 478 | 296.4 | 0.69 (0.63, 0.76) |
| Niñas y mujeres de 16 a 26 años | 570 | 451 | 428.0 | 1 |
Respuesta Inmunitaria a GARDASIL 9 en Todos los Ensayos Clínicos
En todos los ensayos clínicos, al menos el 99,2% de las personas incluidas en los análisis para cada uno de los nueve tipos de VPH de la vacuna se volvieron seropositivas para el mes 7. Los GMT anti-VPH en el mes 7 entre las niñas y los niños de 9 a 15 años y los niños y hombres de 16 a 26 años fueron comparables a las respuestas anti-VPH entre las niñas y mujeres de 16 a 26 años en la base de datos combinada de estudios de inmunogenicidad para GARDASIL 9.
Persistencia de la Respuesta Inmunitaria a GARDASIL 9
En un estudio de extensión de individuos en el Estudio 2, entre niñas y niños de 9 a 15 años de edad al momento de la inscripción (rango de 494 a 525 sujetos con datos evaluables en todos los tipos de VPH) y seguidos durante 10 años después de la dosis 3, los GMT anti-VPH 6, 11, 16, 18, 31, 33, 45, 52 y 58 medidos por cLIA disminuyeron en comparación con los valores correspondientes a un mes después de la dosis 3. La proporción de sujetos seropositivos varió del 99,6% al 100% a un mes después de la dosis 3 y del 81,3% al 97,7% a los 10 años después de la dosis 3, según el tipo de VPH.
Administración de GARDASIL 9 a Individuos Previamente Vacunados con GARDASIL
El Estudio 4 evaluó la inmunogenicidad de 3 dosis de GARDASIL 9 en 921 niñas y mujeres (de 12 a 26 años de edad) que habían sido previamente vacunadas con 3 dosis de GARDASIL. Antes de la inscripción en el estudio, más del 99% de los sujetos habían recibido tres inyecciones de GARDASIL dentro de un período de un año. El intervalo de tiempo entre la última inyección de GARDASIL y la primera inyección de GARDASIL 9 varió de aproximadamente 12 a 36 meses.
La seropositividad a los tipos de VPH 6, 11, 16, 18, 31, 33, 45, 52 y 58 en la población según el protocolo varió del 98,3 al 100% para el mes 7 en los individuos que recibieron GARDASIL 9. Los GMT anti-VPH 31, 33, 45, 52 y 58 para la población previamente vacunada con GARDASIL fueron del 25 al 63% de los GMT en las poblaciones combinadas de los Estudios 1, 2, 3 y 5, que no habían recibido previamente GARDASIL, aunque se desconoce la relevancia clínica de estas diferencias. La eficacia de GARDASIL 9 para prevenir la infección y la enfermedad relacionada con los tipos de VPH 31, 33, 45, 52 y 58 en individuos previamente vacunados con GARDASIL no se ha evaluado.
Uso Concomitante de Anticonceptivos Hormonales
Entre 7.269 mujeres receptoras de GARDASIL 9 (de 16 a 26 años de edad), el 60,2% usó anticonceptivos hormonales durante el período de vacunación de los estudios clínicos 1 y 2. El uso de anticonceptivos hormonales no pareció afectar el tipo de respuestas inmunitarias específicas a GARDASIL 9.
14.7 Respuestas Inmunitarias a GARDASIL 9 Usando un Régimen de 2 Dosis en Individuos de 9 a 14 Años de Edad
La eficacia de GARDASIL 9 contra la infección persistente y la enfermedad relacionada con los tipos de VPH de la vacuna en niñas y niños de 9 a 14 años que recibieron un régimen de 2 dosis se infirió de la comparación de no inferioridad realizada en la población de PPI en el Estudio 8 de los GMT después de la vacunación con GARDASIL 9 entre niñas y niños de 9 a 14 años que recibieron un régimen de 2 dosis (a los 0, 6 meses o 0, 12 meses) con aquellos entre las niñas y mujeres de 16 a 26 años que recibieron un régimen de 3 dosis (a los 0, 2, 6 meses). Los GMT anti-VPH a un mes después de la última dosis entre las niñas y los niños de 9 a 14 años que recibieron 2 dosis de GARDASIL 9 no fueron inferiores a los GMT anti-VPH entre las niñas y mujeres de 16 a 26 años que recibieron 3 dosis de GARDASIL 9 (Tabla 12).
Un mes después de la última dosis del régimen asignado, entre el 97,9% y el 100% de los sujetos de todos los grupos se volvieron seropositivos para anticuerpos contra los 9 tipos de VPH de la vacuna (Tabla 12).
En el mismo estudio, en niñas y niños de 9 a 14 años, los GMT a un mes después de la última dosis de la vacuna fueron numéricamente más bajos para algunos tipos de vacuna después de un programa de 2 dosis que en las niñas de 9 a 14 años después de un programa de 3 dosis (tipos de VPH 18, 31, 45 y 52 después de 0, 6 meses y tipo de VPH 45 después de 0, 12 meses; Tabla 12). Se desconoce la relevancia clínica de estos hallazgos.
La duración de la inmunidad de un programa de 2 dosis de GARDASIL 9 no se ha establecido.
| Población (Régimen) | N | n | GMT mMU‡/mL |
Relación GMT en relación con el régimen de 3 dosis en niñas y mujeres de 16 a 26 años (IC del 95%) |
|---|---|---|---|---|
| N = Número de individuos aleatorizados al grupo de vacunación respectivo que recibieron al menos 1 inyección | ||||
| n = Número de individuos que contribuyen al análisis | ||||
| IC=Intervalo de Confianza | ||||
| cLIA=Ensayo Inmunoenzimático Competitivo Luminex | ||||
| GMT=Título Medio Geométrico | ||||
|
||||
| Anti-VPH 6 | ||||
| Niñas de 9 a 14 años (0, 6)† | 301 | 258 | 1657.9 | 2.15 (1.83, 2.53)§ |
| Niños de 9 a 14 años (0, 6)† | 301 | 263 | 1557.4 | 2.02 (1.73, 2.36)§ |
| Niñas y niños de 9 a 14 años (0, 12)† | 300 | 257 | 2678.8 | 3.47 (2.93, 4.11)§ |
| Niñas de 9 a 14 años (0, 2, 6)† | 300 | 254 | 1496.1 | 1.94 (1.65, 2.29)¶ |
| Mujeres de 16 a 26 años (0, 2, 6)† | 314 | 238 | 770.9 | 1 |
| Anti-VPH 11 | ||||
| Niñas de 9 a 14 años (0, 6)† | 301 | 258 | 1388.9 | 2.39 (2.03, 2.82)§ |
| Niños de 9 a 14 años (0, 6)† | 301 | 264 | 1423.9 | 2.45 (2.09, 2.88)§ |
| Niñas y niños de 9 a 14 años (0, 12)† | 300 | 257 | 2941.8 | 5.07 (4.32, 5.94)§ |
| Niñas de 9 a 14 años (0, 2, 6)† | 300 | 254 | 1306.3 | 2.25 (1.90, 2.66)¶ |
| Mujeres de 16 a 26 años (0, 2, 6)† | 314 | 238 | 580.5 | 1 |
| Anti-VPH 16 | ||||
| Niñas de 9 a 14 años (0, 6)† | 301 | 272 | 8004.9 | 2.54 (2.14, 3.00)§ |
| Niños de 9 a 14 años (0, 6)† | 301 | 273 | 8474.8 | 2.69 (2.29, 3.15)§ |
| Niñas y niños de 9 a 14 años (0, 12)† | 300 | 264 | 14329.3 | 4.54 (3.84, 5.37)§ |
| Niñas de 9 a 14 años (0, 2, 6)† | 300 | 269 | 6996.0 | 2.22 (1.89, 2.61)¶ |
| Mujeres de 16 a 26 años (0, 2, 6)† | 314 | 249 | 3154.0 | 1 |
| Anti-HPV 18 | ||||
| Niñas de 9 a 14 años (0, 6)† | 301 | 272 | 1872.8 | 2.46 (2.05, 2.96)§ |
| Niños de 9 a 14 años (0, 6)† | 301 | 272 | 1860.9 | 2.44 (2.04, 2.92)§ |
| Niñas y niños de 9 a 14 años (0, 12)† | 300 | 266 | 2810.4 | 3.69 (3.06, 4.45)§ |
| Niñas de 9 a 14 años (0, 2, 6)† | 300 | 270 | 2049.3 | 2.69 (2.24, 3.24)¶ |
| Mujeres de 16 a 26 años (0, 2, 6)† | 314 | 267 | 761.5 | 1 |
| Anti-HPV 31 | ||||
| Niñas de 9 a 14 años (0, 6)† | 301 | 272 | 1436.3 | 2.51 (2.10, 3.00)§ |
| Niños de 9 a 14 años (0, 6)† | 301 | 271 | 1498.2 | 2.62 (2.20, 3.12)§ |
| Niñas y niños de 9 a 14 años (0, 12)† | 300 | 268 | 2117.5 | 3.70 (3.08, 4.45)§ |
| Niñas de 9 a 14 años (0, 2, 6)† | 300 | 271 | 1748.3 | 3.06 (2.54, 3.67)¶ |
| Mujeres de 16 a 26 años (0, 2, 6)† | 314 | 264 | 572.1 | 1 |
| Anti-HPV 33 | ||||
| Niñas de 9 a 14 años (0, 6)† | 301 | 273 | 1030.0 | 2.96 (2.50, 3.50)§ |
| Niños de 9 a 14 años (0, 6)† | 301 | 271 | 1040.0 | 2.99 (2.55, 3.50)§ |
| Niñas y niños de 9 a 14 años (0, 12)† | 300 | 269 | 2197.5 | 6.31 (5.36, 7.43)§ |
| Niñas de 9 a 14 años (0, 2, 6)† | 300 | 275 | 796.4 | 2.29 (1.95, 2.68) ¶ |
| Mujeres de 16 a 26 años (0, 2, 6)† | 314 | 279 | 348.1 | 1 |
| Anti-HPV 45 | ||||
| Niñas de 9 a 14 años (0, 6)† | 301 | 274 | 357.6 | 1.67 (1.38, 2.03)§ |
| Niños de 9 a 14 años (0, 6)† | 301 | 273 | 352.3 | 1.65 (1.37, 1.99)§ |
| Niñas y niños de 9 a 14 años (0, 12)† | 300 | 268 | 417.7 | 1.96 (1.61, 2.37)§ |
| Niñas de 9 a 14 años (0, 2, 6)† | 300 | 275 | 661.7 | 3.10 (2.54, 3.77)¶ |
| Mujeres de 16 a 26 años (0, 2, 6)† | 314 | 280 | 213.6 | 1 |
| Anti-HPV 52 | ||||
| Niñas de 9 a 14 años (0, 6)† | 301 | 272 | 581.1 | 1.60 (1.36, 1.87)§ |
| Niños de 9 a 14 años (0, 6)† | 301 | 273 | 640.4 | 1.76 (1.51, 2.05)§ |
| Niñas y niños de 9 a 14 años (0, 12)† | 300 | 268 | 1123.4 | 3.08 (2.64, 3.61)§ |
| Niñas de 9 a 14 años (0, 2, 6)† | 300 | 275 | 909.9 | 2.50 (2.12, 2.95)¶ |
| Mujeres de 16 a 26 años (0, 2, 6)† | 314 | 271 | 364.2 | 1 |
| Anti-HPV 58 | ||||
| Niñas de 9 a 14 años (0, 6)† | 301 | 270 | 1251.2 | 2.55 (2.15, 3.01)§ |
| Niños de 9 a 14 años (0, 6)† | 301 | 270 | 1325.7 | 2.70 (2.30, 3.16)§ |
| Niñas y niños de 9 a 14 años (0, 12)† | 300 | 265 | 2444.6 | 4.98 (4.23, 5.86)§ |
| Niñas de 9 a 14 años (0, 2, 6)† | 300 | 273 | 1229.3 | 2.50 (2.11, 2.97)¶ |
| Mujeres de 16 a 26 años (0, 2, 6)† | 314 | 261 | 491.1 | 1 |
14.8 Estudios con Menactra y Adacel
En el Estudio 5, se evaluó la seguridad e inmunogenicidad de la coadministración de GARDASIL 9 con Menactra [Vacuna conjugada de toxoide diftérico con polisacárido meningocócico (Grupos A, C, Y y W-135)] y Adacel [Toxoide tetánico, toxoide diftérico reducido y vacuna acelular contra la tos ferina adsorbida (Tdap)] (misma visita, inyecciones en sitios separados) en 1.237 niños y niñas de 11 a 15 años de edad al momento de la inscripción.
Un grupo recibió GARDASIL 9 en una extremidad y tanto Menactra como Adacel, como inyecciones separadas, en la extremidad opuesta de forma concomitante en el Día 1 (n = 619). El segundo grupo recibió la primera dosis de GARDASIL 9 en el Día 1 en una extremidad y luego Menactra y Adacel, como inyecciones separadas, en el Mes 1 en la extremidad opuesta (n = 618). Los sujetos de ambos grupos de vacunación recibieron la segunda dosis de GARDASIL 9 en el Mes 2 y la tercera dosis en el Mes 6. La inmunogenicidad se evaluó para todas las vacunas un mes después de la vacunación (una dosis para Menactra y Adacel y tres dosis para GARDASIL 9).
Las evaluaciones de las respuestas inmunitarias posteriores a la vacunación incluyeron GMT de anticuerpos específicos de tipo para cada uno de los tipos de VPH de la vacuna a las cuatro semanas posteriores a la última dosis de GARDASIL 9; GMT para anticuerpos anti-hemaglutinina filamentosa, anti-pertactina y anti-fimbriales a las cuatro semanas posteriores a Adacel; porcentaje de sujetos con concentraciones de anticuerpos anti-toxina tetánica y anti-toxina diftérica ≥0.1 UI/mL a las cuatro semanas posteriores a Adacel; y porcentaje de sujetos con un aumento ≥4 veces desde el nivel basal previo a la vacunación en los títulos de anticuerpos contra N. meningitidis serogrupos A, C, Y y W-135 a las cuatro semanas posteriores a Menactra. Con base en estas medidas, la administración concomitante de GARDASIL 9 con Menactra y Adacel no interfirió con las respuestas de anticuerpos a ninguna de las vacunas en comparación con la administración no concomitante de GARDASIL 9 con Menactra y Adacel.
15 REFERENCIAS
- Estudio 1 NCT00543543
- Estudio 2 NCT00943722
- Estudio 3 NCT01304498
- Estudio 4 NCT01047345
- Estudio 5 NCT00988884
- Estudio 6 NCT01073293
- Estudio 7 NCT01651949
- Estudio 8 NCT01984697
- Estudio A NCT01432574
- Estudio B NCT00090285
- Estudio 9 NCT03158220
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
GARDASIL 9 se suministra en viales y jeringas.
Caja de diez viales de dosis única de 0.5 mL. NDC 0006-4119-03
Caja de diez jeringas Luer Lock precargadas de dosis única de 0.5 mL con tapas para la punta. NDC 0006-4121-02
Conservar en refrigerador a una temperatura de 2 a 8 °C (36 a 46 °F). No congelar. Proteger de la luz.
GARDASIL 9 debe administrarse tan pronto como sea posible después de sacarlo del refrigerador. GARDASIL 9 puede administrarse siempre que el tiempo total (acumulativo de múltiples excursiones) fuera del refrigerador (a temperaturas entre 8 °C y 25 °C) no supere las 72 horas. También se permiten múltiples excursiones acumulativas entre 0 °C y 2 °C, siempre que el tiempo total entre 0 °C y 2 °C no supere las 72 horas. Sin embargo, estas no son recomendaciones de almacenamiento.
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente que lea el etiquetado del paciente aprobado por la FDA (Información para el paciente).
Informe al paciente, padre o tutor:
- La vacunación no elimina la necesidad de que las mujeres continúen sometiéndose a las pruebas de detección del cáncer cervical recomendadas. Las mujeres que reciben GARDASIL 9 deben continuar sometiéndose a las pruebas de detección del cáncer cervical según el estándar de atención.
- Los receptores de GARDASIL 9 no deben interrumpir las pruebas de detección del cáncer anal si un profesional de la salud las ha recomendado.
- No se ha demostrado que GARDASIL 9 proporcione protección contra enfermedades de tipos de VPH vacunados y no vacunados a los que una persona ha estado expuesta previamente a través de la actividad sexual.
- Dado que se ha informado de síncope después de la vacunación contra el VPH, a veces con resultado de caída con lesiones, se recomienda la observación durante 15 minutos después de la administración.
- La información sobre la vacuna debe proporcionarse con cada vacunación al paciente, padre o tutor.
- Proporcione información sobre los beneficios y riesgos asociados con la vacunación.
- La seguridad y eficacia de GARDASIL 9 no se han establecido en mujeres embarazadas.
- Es importante completar la serie completa de vacunación a menos que esté contraindicada.
- Informe de cualquier reacción adversa a su profesional de la salud.
SECCIÓN NO CLASIFICADA DE SPL
Manuf. and Dist. by: Merck Sharp & Dohme LLC
Rahway, NJ 07065, USA
For patent information: www.msd.com/research/patent
Las marcas comerciales que se muestran en este documento son propiedad de sus respectivas empresas.
Copyright © 2006-2024 Merck & Co., Inc., Rahway, NJ, USA, y sus afiliadas.
Todos los derechos reservados.
uspi-v503-i-2403r016
Información para el paciente sobre GARDASIL®9 (se pronuncia “gard-Ah-sill nīn”) (Vacuna contra el Virus del Papiloma Humano 9-valente, Recombinante)
Lea esta información con atención antes de recibir GARDASIL®9. Usted o su hijo (la persona que recibirá GARDASIL 9) necesitará 2 o 3 dosis de la vacuna, dependiendo de su edad. Es importante leer esta información antes de recibir cada dosis. Esta información no reemplaza hablar con su profesional de la salud sobre GARDASIL 9.
¿Qué es GARDASIL 9?
GARDASIL 9 es una vacuna (inyección/pinchazo) que se administra a personas de 9 a 45 años de edad para ayudar a proteger contra enfermedades causadas por algunos tipos de virus del papiloma humano (VPH).
¿Contra qué enfermedades puede ayudar a proteger GARDASIL 9?
En niñas y mujeres de 9 a 45 años de edad, GARDASIL 9 ayuda a proteger contra:
- Cáncer de cuello uterino
- Cánceres vulvar y vaginal
- Cáncer anal
- Ciertos cánceres de cabeza y cuello, como cánceres de garganta y parte posterior de la boca
- Lesiones precancerosas cervicales, vulvares, vaginales y anales
- Verrugas genitales
En niños y hombres de 9 a 45 años de edad, GARDASIL 9 ayuda a proteger contra:
- Cáncer anal
- Ciertos cánceres de cabeza y cuello, como cánceres de garganta y parte posterior de la boca
- Lesiones precancerosas anales
- Verrugas genitales
Estas enfermedades pueden tener muchas causas, incluidos los tipos de VPH 6, 11, 16, 18, 31, 33, 45, 52 y 58. GARDASIL 9 solo protege contra enfermedades causadas por estos nueve tipos de VPH.
Las personas no pueden contraer el VPH ni ninguna de estas enfermedades por GARDASIL 9.
¿Qué información importante sobre GARDASIL 9 debo saber?
GARDASIL 9:
- No elimina la necesidad de exámenes de detección de cáncer de cuello uterino, vulvar, vaginal, anal y ciertos cánceres de cabeza y cuello, como cánceres de garganta y parte posterior de la boca, según lo recomendado por un profesional de la salud; las mujeres deben seguir haciéndose exámenes de detección de cáncer de cuello uterino de forma rutinaria.
- No protege a la persona que recibe GARDASIL 9 de una enfermedad que es causada por otros tipos de VPH, otros virus o bacterias.
- No trata la infección por VPH.
- No protege a la persona que recibe GARDASIL 9 de los tipos de VPH que ya puede tener.
GARDASIL 9 puede no proteger completamente a cada persona que lo recibe.
¿Quién no debe recibir GARDASIL 9?
Cualquier persona con una reacción alérgica a:
- Una dosis previa de GARDASIL 9
- Una dosis previa de GARDASIL®
- Levadura (reacción alérgica grave)
- Amorphous aluminum hydroxyphosphate sulfate
- Polysorbate 80
¿Qué debo decirle al profesional de la salud antes de recibir GARDASIL 9?
Dígale al profesional de la salud si usted o su hijo (la persona que recibirá GARDASIL 9):
- Está embarazada o planea quedar embarazada.
- Tiene problemas inmunitarios, como VIH o cáncer.
- Toma medicamentos que afectan el sistema inmunitario.
- Tiene fiebre superior a 100 °F (37.8 °C).
- Puede haber tenido una reacción alérgica a una dosis previa de GARDASIL 9 o GARDASIL.
- Toma algún medicamento, incluso los que puedes comprar sin receta.
El profesional de la salud le ayudará a decidir si usted o su hijo deben recibir la vacuna.
¿Cómo se administra GARDASIL 9?
GARDASIL 9 es una inyección que generalmente se administra en el músculo del brazo. GARDASIL 9 puede administrarse en 2 o 3 inyecciones.
| Para personas que son | Necesitará | Administrado como |
|---|---|---|
|
||
| De 9 a 14 años de edad | 2 inyecciones* | Dosis 1: primera inyección Dosis 2: segunda inyección administrada entre 6 y 12 meses después de la primera inyección |
| o 3 inyecciones† | Dosis 1: primera inyección Dosis 2: segunda inyección administrada 2 meses después de la primera inyección Dosis 3: tercera inyección administrada 6 meses después de la primera inyección |
|
| De 15 a 45 años de edad | 3 inyecciones | Dosis 1: primera inyección Dosis 2: segunda inyección administrada 2 meses después de la primera inyección Dosis 3: tercera inyección administrada 6 meses después de la primera inyección |
Asegúrese de que usted o su hijo reciban todas las dosis recomendadas por su profesional de la salud para que usted o su hijo obtengan la mejor protección. Si la persona que recibe GARDASIL 9 se pierde una dosis, dígale al profesional de la salud y ellos decidirán cuándo administrar la dosis omitida. Es importante que siga las instrucciones de su profesional de la salud con respecto a las visitas de regreso para las dosis de seguimiento.
El desmayo puede ocurrir después de recibir una vacuna contra el VPH. A veces, las personas que se desmayan pueden caerse y hacerse daño. Por esta razón, el profesional de la salud puede pedirle a la persona que recibe GARDASIL 9 que se siente o se acueste durante 15 minutos después de recibir la vacuna. Algunas personas que se desmayan pueden temblar o ponerse rígidas. El profesional de la salud puede necesitar tratar a la persona que recibe GARDASIL 9.
¿Puedo recibir GARDASIL 9 si ya he recibido GARDASIL?
Si ya ha recibido GARDASIL, hable con su profesional de la salud para ver si GARDASIL 9 es adecuado para usted.
¿Puedo recibir GARDASIL 9 con otras vacunas?
GARDASIL 9 se puede administrar al mismo tiempo que:
- Menactra [Vacuna conjugada de toxoide diftérico polisacárido meningocócico (grupos A, C, Y y W-135)]
- Adacel [Toxoide tetánico, toxoide diftérico reducido y vacuna acelular contra la tos ferina adsorbida (Tdap)]
¿Cuáles son los posibles efectos secundarios de GARDASIL 9?
Los efectos secundarios más comunes que se observan con GARDASIL 9 son:
- dolor, hinchazón, enrojecimiento, picazón, moretones, sangrado y un bulto donde recibió la inyección
- dolor de cabeza
- fiebre
- náuseas
- mareos
- cansancio
- diarrea
- dolor abdominal
- dolor de garganta
Los estudios muestran que hubo más hinchazón donde se administró la inyección cuando GARDASIL 9 se administró al mismo tiempo que Menactra y/o Adacel.
Informe al profesional de la salud si tiene alguno de estos problemas porque pueden ser signos de una reacción alérgica:
- dificultad para respirar
- sibilancias (broncoespasmo)
- urticaria
- erupción
Los efectos secundarios adicionales que se han informado durante el uso general de GARDASIL 9 se muestran a continuación. Los efectos secundarios informados durante el uso general de GARDASIL también se muestran a continuación. Los efectos secundarios de GARDASIL se informan ya que pueden ser relevantes para GARDASIL 9, ya que las vacunas son similares en composición.
GARDASIL 9
- vómitos
- urticaria
Además, estos efectos secundarios se han observado con el uso general de GARDASIL.
GARDASIL
- ganglios linfáticos inflamados (cuello, axila o ingle)
- dolor en las articulaciones
- cansancio inusual, debilidad o confusión
- escalofríos
- sensación general de malestar
- dolor en las piernas
- falta de aliento
- dolor en el pecho
- dolores musculares
- debilidad muscular
- convulsión
- malestar estomacal
- sangrado o moretones más fácilmente de lo normal
- infección de la piel
Debe comunicarse con su profesional de la salud de inmediato si experimenta algún síntoma que le moleste.
Para obtener una lista más completa de efectos secundarios, consulte al profesional de la salud.
Llame a su profesional de la salud para obtener asesoramiento médico sobre los efectos secundarios. También puede informar cualquier efecto secundario a su médico o directamente al Sistema de informes de eventos adversos de vacunas (VAERS). El número gratuito de VAERS es 1-800-822-7967 o informe en línea a www.vaers.hhs.gov .
GARDASIL 9 no se estudió en mujeres que sabían que estaban embarazadas. Informe al médico o profesional de la salud si usted o su hijo (la persona que recibe GARDASIL 9) está embarazada o planea quedar embarazada.
¿Qué contiene GARDASIL 9?
GARDASIL 9 contiene:
- Proteínas de los tipos de VPH 6, 11, 16, 18, 31, 33, 45, 52 y 58
- Hidroxi fosfato sulfato de aluminio amorfo
- Proteína de levadura
- Cloruro de sodio
- L-histidina
- Polisorbato 80
- Borato de sodio
- Agua
Este documento es un resumen de información sobre GARDASIL 9.
Para obtener más información sobre GARDASIL 9, hable con el profesional de la salud o visite www.GARDASIL9.com .
SECCIÓN NO CLASIFICADA DE SPL
Manuf. and Dist. by: Merck Sharp & Dohme LLC
Rahway, NJ 07065, USA
For patent information: www.msd.com/research/patent
Las marcas comerciales que se muestran en este documento son propiedad de sus respectivas empresas.
Copyright © 2006-2024 Merck & Co., Inc., Rahway, NJ, USA, y sus afiliadas.
Todos los derechos reservados.
Revisado: 03/2024
usppi-v503-i-2403r007
PANEL PRINCIPAL DE VISUALIZACIÓN – Vial de 0.5 mL Caja
NDC 0006-4119-03
10 Viales de 0.5-mL de dosis única
REFRIGERAR
Vacuna contra el virus del papiloma humano 9-valente, recombinante
GARDASIL® 9
Suspensión para inyección intramuscular
Cada dosis de 0.5-mL contiene proteína L1 del virus del papiloma humano de cada tipo adsorbida en un adyuvante de sulfato de hidroxi fosfato de aluminio amorfo como sigue:
Tipo 6 (30 mcg), Tipo 11 (40 mcg), Tipo 16 (60 mcg), Tipo 18 (40 mcg), Tipo 31 (20 mcg), Tipo 33 (20 mcg),
Tipo 45 (20 mcg), Tipo 52 (20 mcg), Tipo 58 (20 mcg).
La vacuna se prepara a partir de cultivos de fermentación de una cepa recombinante de levadura Saccharomyces cerevisiae
que contiene los genes para la proteína L1 del virus del papiloma humano de cada tipo (6, 11, 16, 18, 31, 33, 45, 52, 58).
No contiene conservantes ni antibióticos.
Sólo con receta médica
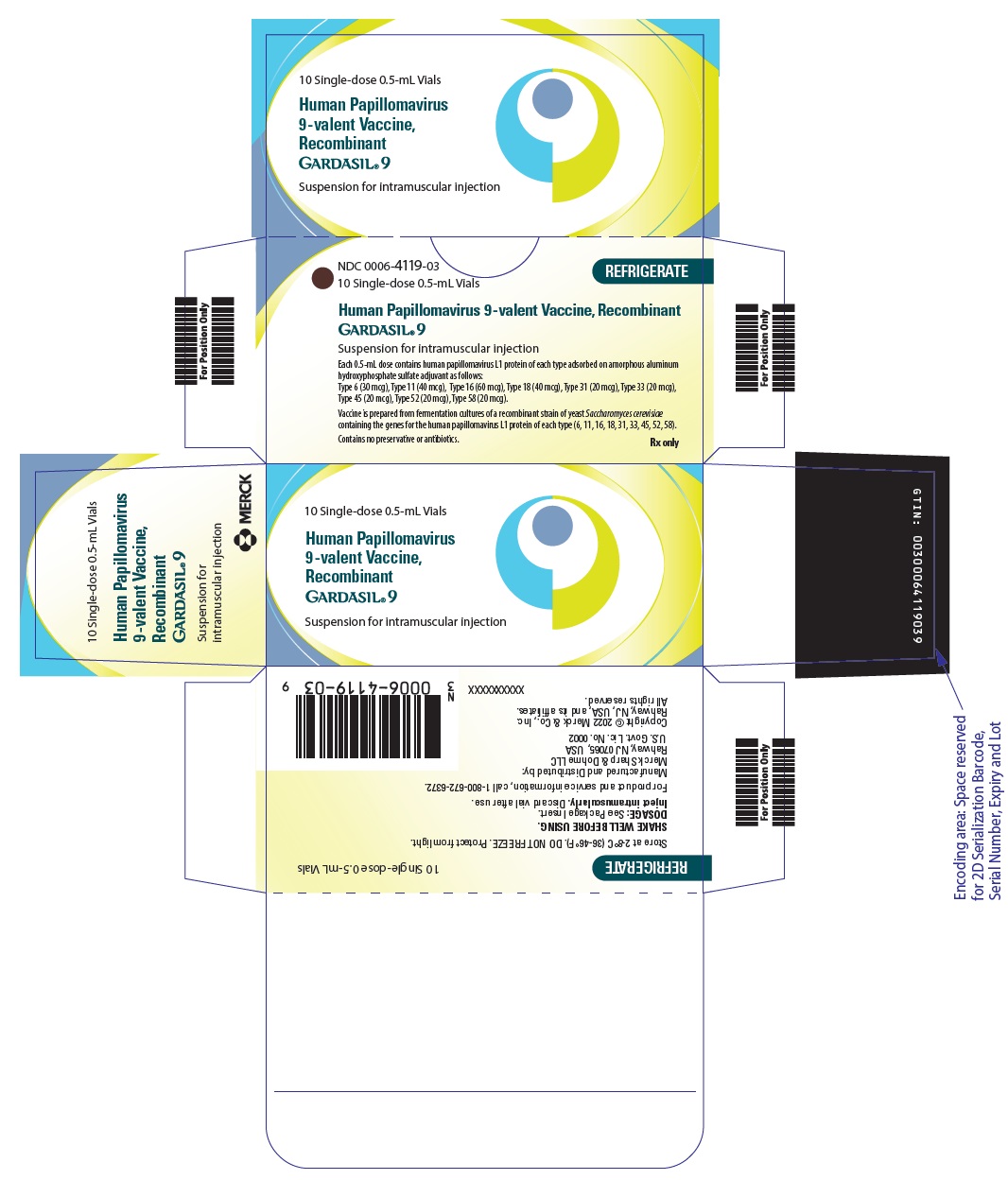
PANEL PRINCIPAL DE VISUALIZACIÓN – Jeringa de 0.5 mL Caja
NDC 0006-4121-02
10 Jeringas de 0.5 mL de dosis única
REFRIGERAR
Virus del Papiloma Humano
Vacuna 9-valente, Recombinante
GARDASIL® 9
Suspensión para inyección intramuscular
Cada dosis de 0.5 mL contiene proteína L1 del virus del papiloma humano de cada tipo
adsorbida en un adyuvante de hidroxi fosfato de aluminio amorfo sulfato
como sigue:
Tipo 6 (30 mcg), Tipo 11 (40 mcg), Tipo 16 (60 mcg), Tipo 18 (40 mcg),
Tipo 31 (20 mcg), Tipo 33 (20 mcg), Tipo 45 (20 mcg), Tipo 52 (20 mcg),
Tipo 58 (20 mcg).
La vacuna se prepara a partir de cultivos de fermentación de una cepa recombinante de levadura
Saccharomyces cerevisiae que contiene los genes para la proteína L1 del virus del papiloma humano
de cada tipo (6, 11, 16, 18, 31, 33, 45, 52, 58).
No contiene conservantes ni antibióticos.
Sólo con receta médica


