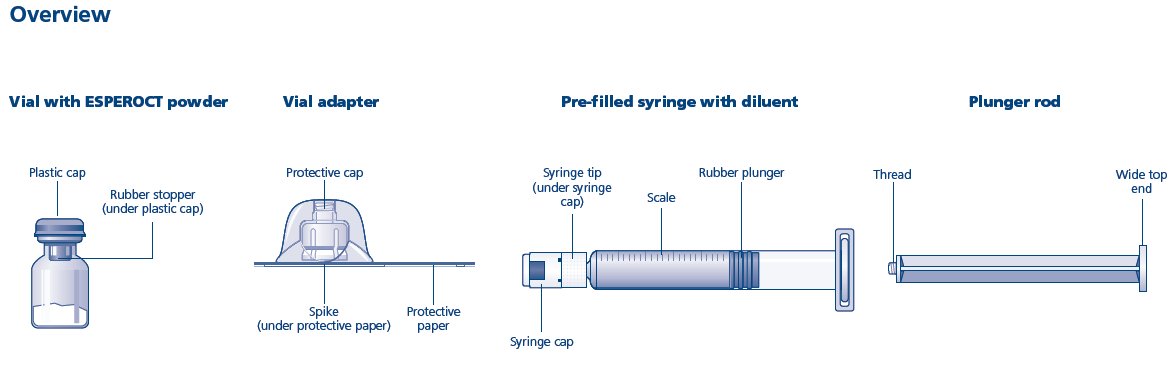
Fabricante de medicamentos: Novo Nordisk (Updated: 2024-07-01)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
ESPEROCT [factor antihemofílico (recombinante),
glicopegilado-exei]
polvo liofilizado para solución, para uso intravenoso
Aprobación inicial en EE. UU.: 2019
CAMBIOS IMPORTANTES RECIENTES
Advertencias y precauciones (5.3) …………………………….02/2024
INDICACIONES Y USO
ESPEROCT [factor antihemofílico (recombinante), glicopegylated-exei] es un concentrado de Factor VIII de coagulación indicado para su uso en adultos y niños con hemofilia A para:
- •
- Tratamiento a demanda y control de episodios hemorrágicos
- •
- Manejo perioperatorio del sangrado
- •
- Profilaxis de rutina para reducir la frecuencia de los episodios hemorrágicos (1)
Limitación de uso
ESPEROCT no está indicado para el tratamiento de la enfermedad de von Willebrand. (1)
DOSIFICACIÓN Y ADMINISTRACIÓN
Para perfusión intravenosa únicamente después de la reconstitución.
- •
- La etiqueta de cada vial de ESPEROCT indica la actividad real del Factor VIII en unidades internacionales (UI). (2.1)
- •
- Tratamiento a demanda/control de episodios hemorrágicos: En adolescentes/adultos, 40 UI/kg de peso corporal para hemorragias leves/moderadas y 50 UI/kg de peso corporal para hemorragias graves; niños (<12 años), 65 UI/kg de peso corporal para hemorragias leves/moderadas/graves. (2.1)
- •
- Manejo perioperatorio: Para cirugía menor/mayor: En adolescentes/adultos: dosis preoperatoria de 50 UI/kg de peso corporal; en niños (<12 años), dosis preoperatoria de 65 UI/kg de peso corporal. La frecuencia de administración la determina el médico tratante. (2.1)
- •
- Profilaxis de rutina: En adolescentes/adultos, 50 UI/kg cada 4 días; en niños (<12 años), 65 UI/kg dos veces por semana. Un régimen puede ajustarse individualmente a una dosificación menos o más frecuente en función de los episodios hemorrágicos. (2.1)
- •
- ESPEROCT también puede dosificarse para lograr un nivel objetivo específico de actividad del Factor VIII, dependiendo de la gravedad de la hemofilia, para el tratamiento a demanda/control de episodios hemorrágicos o el manejo perioperatorio. Para lograr un nivel objetivo específico de actividad del Factor VIII, utilice la siguiente fórmula:
- Dosis (UI) = Peso corporal (kg) x Aumento deseado del Factor VIII (UI/dl o % normal) x 0.5 (UI/kg por UI/dl). (2.1)
FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
ESPEROCT está disponible como polvo liofilizado en viales de dosis única de concentraciones de 500, 1000, 1500, 2000, 3000, 4000 y 5000 UI por vial. (3)
CONTRAINDICACIONES
No lo use en pacientes que tengan hipersensibilidad conocida a ESPEROCT o a sus componentes, incluidas las proteínas de hámster. (4)
ADVERTENCIAS Y PRECAUCIONES
- •
- Pueden producirse reacciones de hipersensibilidad, incluida la anafilaxia. Si se produce una reacción de hipersensibilidad, suspenda la administración de ESPEROCT y administre el tratamiento adecuado. (5.1)
- •
- Se ha producido el desarrollo de anticuerpos neutralizantes (inhibidores). Si no se controla la hemorragia con la dosis recomendada de ESPEROCT, o si no se alcanzan los niveles esperados de actividad del Factor VIII en plasma, realice un ensayo que mida la concentración del inhibidor del Factor VIII. (5.2, 5.4)
- •
- Se ha observado una disminución temporal en la recuperación incremental del Factor VIII después de la infusión de ESPEROCT en pacientes pediátricos no tratados previamente (PUP). (5.3)
REACCIONES ADVERSAS
Las reacciones adversas notificadas con mayor frecuencia (≥ 1%) fueron erupción cutánea, enrojecimiento, picor y reacciones en el lugar de la inyección. (6)
Las reacciones adversas adicionales notificadas con frecuencia (≥ 1%) en los PUP incluyeron la inhibición del Factor VIII y la hipersensibilidad. (6)
Para informar de SOSPECHAS DE REACCIONES ADVERSAS, póngase en contacto con Novo Nordisk Inc. al 1-800-727-6500 o con la FDA al 1-800-FDA-1088 o en www.fda.gov/medwatch.
USO EN POBLACIONES ESPECÍFICAS
Uso pediátrico: En los niños se observa un mayor aclaramiento (basado en el peso corporal en kg), una vida media más corta y una menor recuperación incremental. Es posible que se necesiten dosis más altas y frecuentes. (8.4)
Consulte el punto 17 para obtener INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y el etiquetado del paciente aprobado por la FDA.
Revisado: 7/2024
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis
2.2 Preparación y Reconstitución
2.3 Administración
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de Hipersensibilidad
5.2 Anticuerpos Neutralizantes
5.3 Disminución de la Recuperación Incremental en Pacientes Previamente No Tratados
5.4 Monitoreo de Pruebas de Laboratorio
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Inmunogenicidad
6.3 Experiencia Postcomercialización
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
13.2 Toxicología y/o Farmacología Animal
14 ESTUDIOS CLÍNICOS
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están listadas.
1 INDICACIONES Y USO
ESPEROCT [antihemophilic factor (recombinant), glycopegylated-exei] es un concentrado de Factor VIII de coagulación derivado de ADN recombinante indicado para su uso en adultos y niños con hemofilia A para:
- •
- Tratamiento a demanda y control de episodios de sangrado
- •
- Manejo perioperatorio del sangrado
- •
- Profilaxis de rutina para reducir la frecuencia de episodios de sangrado
Limitación de uso:
ESPEROCT no está indicado para el tratamiento de la enfermedad de von Willebrand.
2 DOSIS Y ADMINISTRACIÓN
Para perfusión intravenosa después de la reconstitución únicamente.
2.1 Dosis
- •
- La dosis y la duración del tratamiento dependen de la gravedad de la deficiencia del Factor VIII, de la localización y la extensión de la hemorragia, y del estado clínico del paciente. Es necesario un control cuidadoso de la terapia de reemplazo en casos de cirugía mayor o episodios de hemorragia potencialmente mortales.
- •
- Cada vial de ESPEROCT contiene la cantidad etiquetada de Factor VIII recombinante en unidades internacionales (UI). Una UI de actividad del Factor VIII corresponde a la cantidad de Factor VIII en un mililitro de plasma humano normal. El cálculo de la dosis requerida de Factor VIII se basa en el hallazgo empírico de que una UI de Factor VIII por kg de peso corporal aumenta la actividad del Factor VIII en plasma en dos UI/dL.
Tratamiento a demanda y control de los episodios hemorrágicos
La Tabla 1 puede utilizarse como guía para la dosificación de ESPEROCT para el tratamiento de episodios hemorrágicos.
- Tabla 1: Dosificación de ESPEROCT para controlar los episodios hemorrágicos
| Tipo de hemorragia | Adolescentes/Adultos ≥12 años Dosis (UI/kg) |
Niños <12 años Dosis (UI/kg) |
Dosis adicionales |
|---|---|---|---|
|
Leve Hemartrosis temprana, hemorragia muscular leve o hemorragia oral |
40 |
65 |
Una dosis debería ser suficiente |
|
Moderada Hemartrosis más extensa, hemorragia muscular o hematoma |
40 |
65 |
Se puede administrar una dosis adicional después de 24 horas |
|
Grave Hemorragias potencialmente mortales o que ponen en peligro las extremidades, hemorragia gastrointestinal, hemorragia intracraneal, intraabdominal o intratorácica, fracturas |
50 |
65 |
Se pueden administrar dosis adicionales aproximadamente cada 24 horas |
Manejo perioperatorio
El nivel de dosis y los intervalos de dosificación para la cirugía dependen del procedimiento y de la práctica local. En la Tabla 2 a continuación, se proporciona una guía para la dosificación con ESPEROCT durante la cirugía (manejo perioperatorio).
- Tabla 2: Dosificación para el manejo perioperatorio con ESPEROCT
|
Tipo de cirugía |
Adolescentes/Adultos ≥12 años Dosis preoperatoria (UI/kg) |
Niños <12 años Dosis preoperatoria (UI/kg) |
Dosis adicionales |
|
Menor Incluida la extracción dental |
50 |
65 |
Se pueden administrar dosis adicionales después de 24 horas si es necesario |
|
Mayor Craneal, intraabdominal, intratorácica o artroplastia |
50 |
65 |
Se pueden administrar dosis adicionales aproximadamente cada 24 horas durante la primera semana y luego aproximadamente cada 48 horas hasta que se haya producido la cicatrización de la herida |
Profilaxis de rutina
Adultos y adolescentes (≥ 12 años): La dosis inicial recomendada es de 50 UI de ESPEROCT por kg de peso corporal cada 4 días. Este régimen puede ajustarse individualmente a una dosificación menos o más frecuente en función de los episodios hemorrágicos.
Niños (< 12 años): Una dosis de 65 UI de ESPEROCT por kg de peso corporal dos veces por semana. Este régimen puede ajustarse individualmente a una dosificación menos o más frecuente en función de los episodios hemorrágicos.
- •
- ESPEROCT también puede dosificarse para alcanzar un nivel objetivo específico de actividad del Factor VIII, dependiendo de la gravedad de la hemofilia, para el tratamiento a demanda/control de los episodios hemorrágicos o el manejo perioperatorio. Para alcanzar un nivel objetivo específico de actividad del Factor VIII, utilice la siguiente fórmula:
- Dosis (UI) = Peso corporal (kg) × Aumento deseado del Factor VIII (UI/dL o % normal) × 0,5
- •
- Base la dosis y la frecuencia de ESPEROCT en la respuesta clínica individual. Los pacientes pueden variar en sus respuestas farmacocinéticas y clínicas.
- •
- Si se realiza un seguimiento de la actividad del Factor VIII, utilice un ensayo cromogénico o de coagulación de una sola fase apropiado para su uso con ESPEROCT [ver Advertencias y precauciones (5.3)].
2.2 Preparación y reconstitución
- •
- Lávese siempre las manos y asegúrese de que la zona esté limpia antes de realizar los procedimientos de reconstitución.
- •
- Utilice una técnica aséptica durante los procedimientos de reconstitución.
- •
- Si la dosis requiere más de un vial de ESPEROCT por infusión, reconstituya cada vial de acuerdo con las siguientes instrucciones.
Reconstitución
- 1.
- Lleve el vial de ESPEROCT y la jeringa precargada con diluyente a temperatura ambiente.
- 2.
- Retire la tapa de plástico del vial de ESPEROCT.
- 3.
- Limpie el tapón de goma del vial con una toallita con alcohol estéril y deje que se seque antes de utilizarlo.
- 4.
- Retire el papel protector del adaptador del vial. No retire el adaptador del vial de la tapa protectora.
- 5.
- Coloque el vial de ESPEROCT sobre una superficie plana y sólida. Mientras sujeta la tapa protectora, coloque el adaptador del vial sobre el vial de ESPEROCT y presione firmemente la tapa protectora hasta que la punta del adaptador del vial penetre en el tapón de goma.
- 6.
- Retire con cuidado la tapa protectora del adaptador del vial.
- 7.
- Sujete el émbolo como se muestra en el diagrama. Fije el émbolo a la jeringa sujetándolo por el extremo superior ancho. Gire el émbolo en el sentido de las agujas del reloj dentro del émbolo de goma de la jeringa precargada con diluyente hasta que sienta resistencia.
- 8.
- Rompa la tapa de la jeringa precargada con diluyente tirando de la perforación de la tapa.
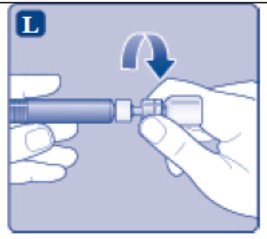
- 9.
- Conecte la jeringa precargada con diluyente al adaptador del vial girándola en el sentido de las agujas del reloj hasta que quede fijada.
- 10.
- Empuje el émbolo para inyectar lentamente todo el diluyente en el vial.
- 11.
- Sin retirar la jeringa, haga girar suavemente el vial de ESPEROCT hasta que todo el polvo se haya disuelto. Evite agitar el vial y que la solución haga espuma.
2.3 Administración
Solo para infusión intravenosa.
- •
- Los productos farmacéuticos parenterales deben inspeccionarse visualmente para detectar cualquier partícula extraña y decoloración antes de su administración, siempre que la solución y el envase lo permitan. La solución debe ser transparente y no debe contener partículas. No la use si observa partículas extrañas o decoloración.
- •
- No administre ESPEROCT en el mismo tubo o envase con otros medicamentos.
- •
- Administre la solución de ESPEROCT inmediatamente. Si no es posible, guarde la solución en el vial con el adaptador de vial y la jeringa colocados. Use ESPEROCT en un plazo de 4 horas cuando se almacene a ≤86 °F (30 °C) o en un plazo de 24 horas cuando se almacene en un refrigerador a una temperatura de entre 36 °F y 46 °F (entre 2 °C y 8 °C).
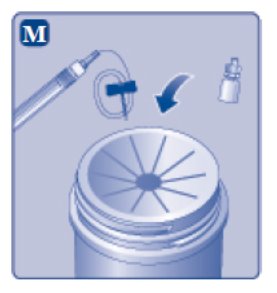
- 1.
- Invierta el vial de ESPEROCT y extraiga lentamente la solución con la jeringa.
- 2.
- Separe la jeringa del adaptador del vial girando la jeringa hacia la izquierda.
- 3.
- Conecte la jeringa al extremo Luer de un equipo de aguja para infusión.
- 4.
- Infunda ESPEROCT reconstituido por vía intravenosa lentamente durante aproximadamente 2 minutos.
- 5.
- Después de la infusión, deseche de forma segura la jeringa con el equipo de infusión, el vial con el adaptador de vial, cualquier cantidad de ESPEROCT no utilizada y otros materiales de desecho.
Precaución: La jeringa precargada con diluyente está hecha de vidrio con un diámetro de punta interna de 0.037 pulgadas y es compatible con un conector Luer-lock estándar.
Algunos conectores sin aguja para catéteres intravenosos son incompatibles con las jeringas de vidrio para diluyente (por ejemplo, ciertos conectores con una punta interna, como Clave®/MicroClave®, InVision-Plus®, InVision-Plus CS®, Invision-Plus Junior®, Bionector®), y su uso puede dañar el conector y afectar a la administración. Para administrar ESPEROCT a través de conectores sin aguja incompatibles, extraiga el producto reconstituido en una jeringa de plástico Luer-lock estéril estándar de 10 ml.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
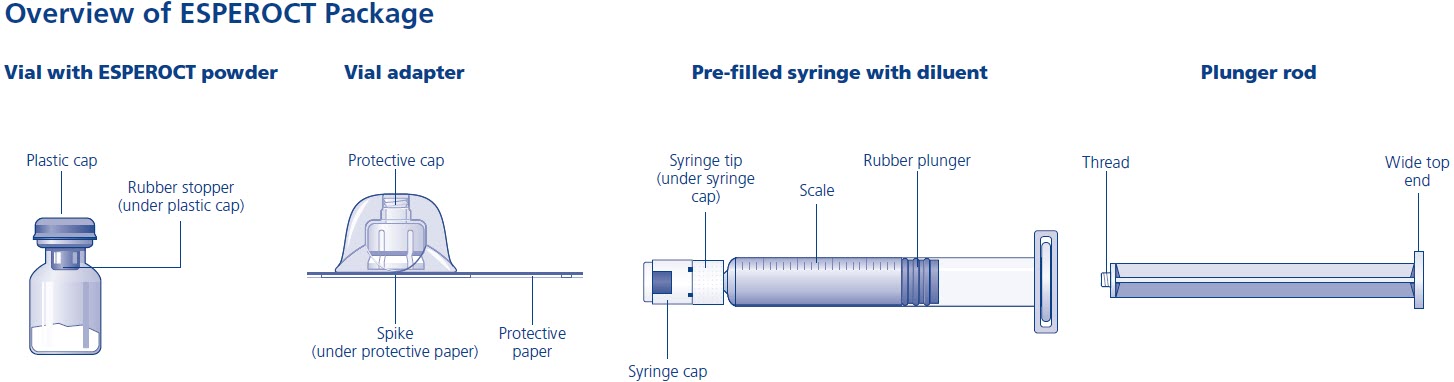
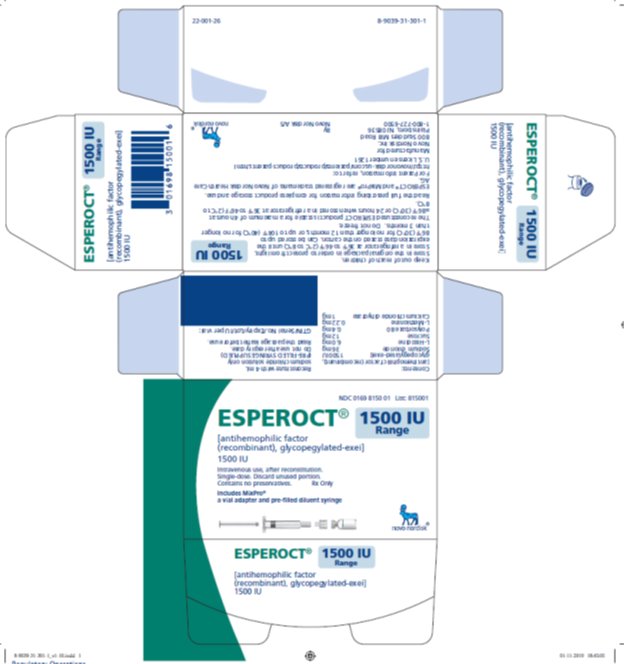
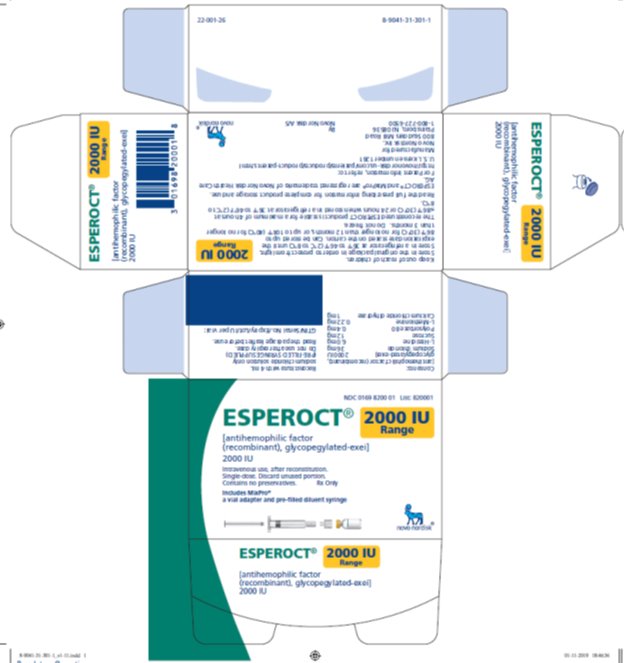
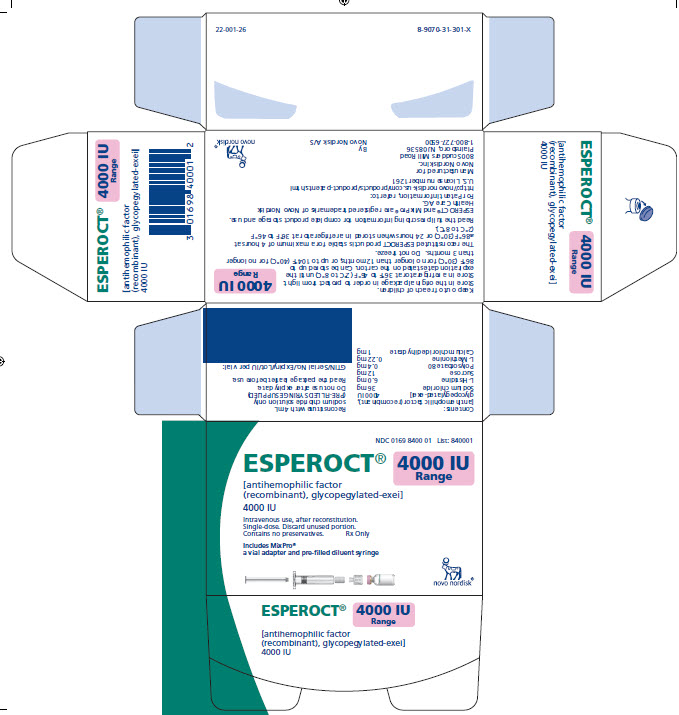
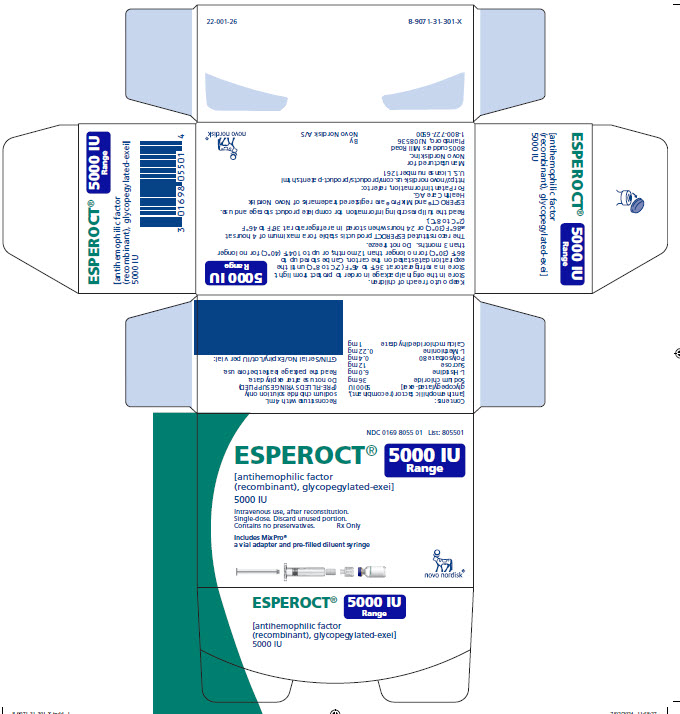
ESPEROCT está disponible como un polvo liofilizado blanco a blanquecino estéril suministrado en viales de dosis única que contienen nominalmente 500, 1000, 1500, 2000, 3000, 4000 o 5000 UI. La actividad real de FVIII se imprime en cada vial y caja de ESPEROCT.
Después de la reconstitución con 4 mL de diluyente salino, la solución reconstituida contiene aproximadamente 125, 250, 375, 500, 750, 1000 o 1250 UI por mL de ESPEROCT, respectivamente.
4 CONTRAINDICACIONES
ESPEROCT está contraindicado en pacientes con hipersensibilidad conocida a ESPEROCT o sus componentes (incluidas las proteínas de hámster) [ver Advertencias y precauciones (5.1) y Descripción (11)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de Hipersensibilidad
Las reacciones de hipersensibilidad de tipo alérgico, incluida la anafilaxia, son posibles con ESPEROCT. El producto contiene trazas de proteínas de hámster, que en algunos pacientes pueden causar reacciones alérgicas [ver Descripción (11)]. Los signos tempranos de reacciones alérgicas, que pueden progresar a anafilaxia, pueden incluir angioedema, opresión en el pecho, dificultad para respirar, sibilancias, erupción cutánea, urticaria y picazón. Observe a los pacientes en busca de signos y síntomas de reacciones de hipersensibilidad aguda, particularmente durante las primeras fases de exposición al producto. Suspenda el uso de ESPEROCT si se producen reacciones de tipo alérgico o anafiláctico e inicie el tratamiento adecuado.
5.2 Anticuerpos Neutralizantes
Se ha producido la formación de anticuerpos neutralizantes (inhibidores) al Factor VIII después de la administración de ESPEROCT. Monitoree a los pacientes para detectar el desarrollo de inhibidores del Factor VIII mediante observaciones clínicas y pruebas de laboratorio apropiadas. Si no se alcanzan los niveles esperados de actividad del Factor VIII en plasma, o si el sangrado no se controla después de la administración de ESPEROCT, sospeche la presencia de un inhibidor (anticuerpo neutralizante) [ver Advertencias y precauciones (5.3)].
5.3 Disminución de la Recuperación Incremental en Pacientes Previamente No Tratados
La recuperación incremental (IR) se define como el aumento de la actividad del Factor VIII en plasma por IU/kg de ESPEROCT. Se observó una disminución de la IR, definida como tener al menos 2 observaciones consecutivas de valores bajos de IR (<0.6 (IU/dL)/(IU/kg) después del tratamiento con ESPEROCT, en un ensayo de PUP menores de 6 años de edad dentro de los primeros 5 días de exposición (ED) a ESPEROCT. Se observó una disminución de la IR en 17 de 59 (28.8%) sujetos sin inhibición del Factor VIII. Esto puede estar asociado con altos títulos de anticuerpos de unión anti-PEG. La disminución de la IR fue temporal y regresó a ≥ 0.6 (IU/dL)/(IU/kg) entre 15 y 70 ED si se continuó con ESPEROCT.
Como parte de un análisis de subgrupos post hoc, se evaluó la tendencia al sangrado en los 17 sujetos que experimentaron una disminución temporal de la IR. La duración media del tratamiento fue de 0.48 años, después de lo cual la IR se normalizó en los sujetos que continuaron el tratamiento (N=13). Durante el período de disminución de la IR, 14 de los 17 sujetos experimentaron un total de 30 sangrados mientras estaban en profilaxis, de los cuales 7 (23.3%) fueron espontáneos. Para los sujetos sin inhibidores, sin disminución de la IR, se reportaron 36 (18.1%) de los 199 episodios de sangrado totales (duración media del tratamiento de 3.71 años) como espontáneos. Los sujetos con disminución de la IR pueden tener una mayor tendencia al sangrado durante el período de disminución de la IR [ver Reacciones adversas (6.2)].
Si el sangrado no se controla con la dosis recomendada de ESPEROCT y/o no se alcanzan los niveles esperados de actividad del Factor VIII en plasma y no se detectan inhibidores del Factor VIII, considere ajustar la dosis, la frecuencia de dosificación o suspender el producto.
5.4 Monitoreo de Pruebas de Laboratorio
Si se realiza el monitoreo del Factor VIII, use un ensayo cromogénico o de coagulación de un solo paso apropiado para su uso con ESPEROCT [ver Dosificación y administración (2)].
Los niveles de actividad del Factor VIII pueden verse afectados por el tipo de reactivo de tiempo de tromboplastina parcial activado (aPTT) utilizado en el ensayo. Algunos reactivos de aPTT basados en sílice pueden subestimar la actividad de ESPEROCT hasta en un 60%; otros reactivos pueden sobreestimar la actividad en un 20%. Si no hay disponible localmente un ensayo de coagulación de un solo paso o cromogénico apropiado, utilice un laboratorio de referencia.
Si el sangrado no se controla con la dosis recomendada de ESPEROCT o si no se alcanzan los niveles esperados de actividad del Factor VIII en plasma, realice un ensayo de Bethesda para determinar si hay inhibidores del Factor VIII presentes.
6 REACCIONES ADVERSAS
Las reacciones adversas más frecuentes (incidencia ≥1%) en pacientes previamente tratados (PPT) y pacientes previamente no tratados (PPN) en los ensayos clínicos fueron erupción cutánea, enrojecimiento, picazón (prurito) y reacciones en el sitio de inyección. Las reacciones adversas adicionales frecuentes (incidencia ≥1%) en PPN incluyeron inhibición del Factor VIII (30%) e hipersensibilidad a los medicamentos (2.5%).
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no se pueden comparar directamente con las tasas en los ensayos clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica clínica.
La seguridad de ESPEROCT se ha evaluado en 270 sujetos (202 adolescentes/adultos y 68 niños) en cinco estudios clínicos prospectivos, multicéntricos en pacientes previamente tratados (PPT) y 81 sujetos (< 6 años de edad) en un estudio clínico abierto, multicéntrico en pacientes previamente no tratados (PPN) con hemofilia A grave (<1% de actividad endógena del Factor VIII) y sin antecedentes de inhibidores. Todos los sujetos recibieron al menos una dosis de ESPEROCT. Un paciente previamente tratado se definió como un sujeto con un historial de al menos 150 días de exposición a otros productos del Factor VIII (sujetos adolescentes/adultos) o 50 días de exposición a otros productos del Factor VIII (sujetos pediátricos). Un paciente previamente no tratado se definió como un sujeto con un diagnóstico de hemofilia A grave (nivel de actividad del FVIII < 1%) basado en registros médicos o resultados de laboratorio central sin uso previo de productos de coagulación que contengan Factor VIII purificado (se aceptan 5 días de exposición previa a componentes sanguíneos). La exposición total de PPT y PPN a ESPEROCT fue de 80,425 días de exposición correspondientes a 889 años-paciente de tratamiento y 18,184 días de exposición correspondientes a 234 años-paciente de tratamiento, respectivamente.
Durante los ensayos clínicos en PPT, las reacciones adversas ocurrieron a una tasa de 0.10 eventos por año-paciente de exposición. Las reacciones adversas más frecuentes fueron erupción cutánea (5.2%), reacción en el sitio de inyección (2.6%), enrojecimiento (1.9%) y picazón (prurito) (1.5%).
Durante el ensayo clínico en PPN, las reacciones adversas ocurrieron a una tasa de 0.25 eventos por año-paciente de exposición. Las reacciones adversas más frecuentes fueron inhibición del Factor VIII (30%), reacción en el sitio de inyección (2.5%), hipersensibilidad a los medicamentos (2.5%), enrojecimiento (1.2%) y erupción cutánea (1.2%).
6.2 Inmunogenicidad
En los ensayos clínicos con PPT y PPN, los sujetos fueron monitoreados para detectar anticuerpos neutralizantes contra el Factor VIII (inhibidor del Factor VIII) y anticuerpos de unión al Factor VIII o ESPEROCT, polietilenglicol (PEG) o proteína de la célula huésped de ovario de hámster chino (CHO). Tabla 3 resume el número de sujetos con anticuerpos contra el fármaco en PPT y PPN.
Pacientes previamente tratados (PPT)
De los 270 sujetos en los ensayos de PPT, 1 (0.4%) sujeto desarrolló anticuerpos neutralizantes confirmados contra el Factor VIII (13.5 Unidades de Bethesda). Además, 2 (0.7%) sujetos tuvieron resultados transitorios de prueba de anticuerpos contra el FVIII de bajo título (<5 Unidades de Bethesda) en una sola ocasión. Se detectaron anticuerpos anti-PEG sin consecuencia clínica en 43 (15.9%) PPT, 32 (11.9%) de los cuales tenían anticuerpos anti-PEG preexistentes. Nueve (3.3%) sujetos desarrollaron anticuerpos contra la proteína de la célula huésped CHO sin consecuencia clínica [ver Advertencias y precauciones (5.2)].
Pacientes previamente no tratados (PPN)
En un ensayo clínico en PPN < 6 años de edad, de los 80 sujetos tratados (excluyendo 1 sujeto con inhibidores preexistentes del Factor VIII), 21 (26.3%) sujetos desarrollaron inhibidores del Factor VIII (≥ 0.6 Unidades de Bethesda). De 70 sujetos con al menos 10 días de exposición a ESPEROCT o inhibidores del Factor VIII previamente confirmados, 21 (30%) sujetos desarrollaron inhibidores, 11 (15.7%) de los cuales desarrollaron inhibidores de alto título (≥ 5 Unidades de Bethesda) y 10 (14.3%) de los cuales desarrollaron inhibidores de bajo título (< 5 Unidades de Bethesda). De un total de 21 sujetos con inhibidores, dos (2) sujetos con inhibidor del FVIII de alto título abandonaron el ensayo. Seis (6) de los sujetos restantes (3 con alto título y 3 con bajo título) fueron cambiados a terapia de inducción de tolerancia inmunitaria y completaron el tratamiento. Dos (2) sujetos con inhibidor de alto título permanecieron positivos para el inhibidor hasta el final del ensayo [ver Advertencias y precauciones (5.2)].
De los 80 sujetos tratados, los anticuerpos de unión al Factor VIII o ESPEROCT, anti-PEG IgM, anti-PEG IgG y anticuerpos contra la proteína de la célula huésped CHO se desarrollaron en 42 (52.5%), 22 (27.5%), 50 (62.5%) y 7 (8.8%) sujetos, respectivamente, excepto los sujetos que tenían anticuerpos preexistentes. Se observó una mayor incidencia de anticuerpos no neutralizantes que se unen al Factor VIII o ESPEROCT en sujetos con inhibidores del FVIII (20/21, 95.2%) en comparación con sujetos sin inhibidores (22/59, 37.3%), mientras que el desarrollo de anticuerpos anti-PEG IgM e IgG no fue significativamente diferente entre los sujetos con inhibidores y sin inhibidores.
Tabla 3: Incidencias de anticuerpos contra el fármaco en PPT y PPN
| PPT (todas las edades) (N=270) n (%) |
PPN (< 6 años de edad) (N=80) n (%) |
|
|---|---|---|
|
Anticuerpos neutralizantes contra el FVIII |
||
|
Inhibidor confirmado (≥ 0.6 BU) |
1 (0.4) |
21 (26.3) |
|
Inhibidor de alto título (≥ 5 BU) |
1 (0.4) |
11 (13.8) |
|
Inhibidor de bajo título (< 5 BU) |
0 |
10 (12.5) |
|
Anticuerpos de unión ESPEROCT/FVIII |
||
|
Conversión a anticuerpos positivos |
4 (1.5) |
42 (52.5) |
|
Anticuerpos preexistentes |
2 (0.7) |
1 (1.3) |
|
Anticuerpos anti-PEG IgM |
||
|
Conversión a anticuerpos positivos |
11 (4.1) |
22 (27.5) |
|
Anticuerpos preexistentes |
32 (11.9) |
16 (20) |
|
Anticuerpos anti-PEG IgG |
||
|
Conversión a anticuerpos positivos |
NA |
50 (62.5) |
|
Anticuerpos preexistentes |
NA |
14 (17.5) |
|
Anticuerpos anti-proteína de la célula huésped CHO |
||
|
Conversión a anticuerpos positivos |
9 (3.3) |
7 (8.8) |
|
Anticuerpos preexistentes |
2 (0.7) |
2 (2.5) |
Nota: “Conversión a anticuerpos positivos” se refiere solo a los pacientes que no se detectaron con anticuerpos positivos en la línea de base pero desarrollaron anticuerpos después de la línea de base. “Anticuerpos preexistentes” se refiere a los pacientes que se detectaron con anticuerpos positivos en la línea de base.
NA: No analizado
En los PUP, los títulos altos de anticuerpos anti-PEG IgG se asociaron con una baja recuperación incremental del Factor VIII (IR). En el ensayo PUP, se identificó una disminución de la IR del Factor VIII, definida como al menos 2 mediciones consecutivas de <0.6 (UI/dL)/(UI/kg) a los 30 minutos posteriores a la dosis, después de la exposición a ESPEROCT (5 ED) en 17 de 59 (28.8%) sujetos sin inhibidores detectables del Factor VIII, lo que se observó con títulos elevados de anticuerpos anti-PEG IgG. A medida que se continuó el tratamiento con ESPEROCT, los títulos de anticuerpos anti-PEG IgG disminuyeron y la IR volvió a ≥ 0.6 (UI/dL)/(UI/kg) entre 15 y 70 ED a ESPEROCT. Un análisis de subgrupos post hoc indicó que los sujetos con IR disminuida pueden tener una mayor tendencia al sangrado durante el período de IR disminuida [ver Advertencias y precauciones (5.3)].
La detección de anticuerpos depende en gran medida de la sensibilidad y especificidad del ensayo. Además, la incidencia observada de positividad de anticuerpos (incluidos los anticuerpos neutralizantes) en un ensayo puede verse influenciada por varios factores, incluida la metodología del ensayo, el manejo de las muestras, el momento de la recolección de las muestras, los medicamentos concomitantes y la enfermedad subyacente.
6.3 Experiencia postcomercialización
Las siguientes reacciones adversas se han identificado durante la posaprobación de ESPEROCT. Debido a que estas reacciones se informan voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Disminución de la actividad del Factor VIII: Se han reportado casos de disminución de la actividad del Factor VIII en ausencia de inhibidores detectables del Factor VIII en pacientes previamente tratados (PTP) al cambiar a ESPEROCT de otros productos del Factor VIII.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
- Resumen de Riesgo
No hay datos sobre el uso de ESPEROCT en mujeres embarazadas para determinar si existe un riesgo asociado al fármaco. No se han realizado estudios de reproducción animal con ESPEROCT. Se desconoce si ESPEROCT puede causar daño fetal cuando se administra a una mujer embarazada o puede afectar la fertilidad.
En la población general de los EE. UU., el riesgo de fondo estimado de defectos de nacimiento mayores y aborto espontáneo en embarazos clínicamente reconocidos es del 2 al 4% y del 15 al 20%, respectivamente.
8.2 Lactancia
Resumen de Riesgo
No hay información sobre la presencia de ESPEROCT en la leche materna, el efecto en el lactante y los efectos sobre la producción de leche. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de ESPEROCT y cualquier posible efecto adverso en el lactante por ESPEROCT o por la condición materna subyacente.
8.4 Uso pediátrico
La seguridad y eficacia de ESPEROCT se han establecido para pacientes pediátricos para el tratamiento y control de episodios hemorrágicos, manejo perioperatorio y uso de profilaxis de rutina.
La seguridad y eficacia se evaluaron en 93 PTP menores de 18 años de edad [ver Reacciones adversas (6) y Estudios clínicos (14)]. De los PTP, 34 (36.6%) tenían entre 1 y menos de 6 años de edad; 34 (36.6%) tenían entre 6 y menos de 12 años de edad; y 25 (27%) tenían entre 12 y menos de 18 años de edad. Los parámetros farmacocinéticos se evaluaron en 27 PTP que fueron tratados con ESPEROCT [ver Farmacología clínica (12.3)].
No se observó ninguna diferencia en el perfil de seguridad de ESPEROCT entre los sujetos pediátricos tratados previamente y los sujetos adultos. Los estudios farmacocinéticos en niños menores de 12 años demostraron un aclaramiento más alto, una vida media más corta y una recuperación incremental más baja del Factor VIII en comparación con los adultos, pero los parámetros farmacocinéticos son comparables entre los niños pequeños (1–<6 años) y los niños mayores (6–<12 años). Debido a que el aclaramiento (por kg de peso corporal) es más alto en los niños (<12 años), puede ser necesaria una dosis más alta y una dosificación más frecuente en esta población [ver Farmacología clínica (12.3)].
La seguridad, incluida la inmunogenicidad, se evaluó en 81 PUP menores de 6 años de edad que recibieron al menos una dosis de ESPEROCT [ver Reacciones adversas (6.1, 6.2)].
8.5 Uso geriátrico
Los estudios clínicos de ESPEROCT no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. Otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los pacientes ancianos y los pacientes más jóvenes. En general, la selección de la dosis para un paciente anciano debe ser cautelosa, generalmente comenzando en el extremo inferior del rango de dosificación, lo que refleja la mayor frecuencia de disminución de la función hepática, renal o cardíaca, y de enfermedades concomitantes y otras terapias farmacológicas.
11 DESCRIPCIÓN
ESPEROCT es un polvo liofilizado estéril, sin conservantes y no pirogénico para inyección intravenosa después de la reconstitución con el diluyente salino proporcionado. El ingrediente activo en ESPEROCT es un análogo recombinante del factor VIII (FVIII) de coagulación humano conjugado con una molécula de polietilenglicol (PEG) de 40 kDa. ESPEROCT está formulado con los siguientes excipientes: cloruro de sodio, L-histidina, sacarosa, polisorbato 80, L-metionina y cloruro de calcio.
La actividad del FVIII en ESPEROCT se determina utilizando el ensayo cromogénico descrito en la Farmacopea Europea. La asignación de actividad emplea un material de referencia de FVIII que es trazable al estándar internacional actual de la Organización Mundial de la Salud (OMS) para el concentrado de FVIII, y evaluado mediante metodologías apropiadas para garantizar la precisión de los resultados. ESPEROCT está disponible en viales de dosis única que contienen nominalmente 500, 1000, 1500, 2000, 3000, 4000 o 5000 UI de FVIII. Cada vial de ESPEROCT está etiquetado con la actividad real del FVIII. Después de la reconstitución con el diluyente suministrado (solución salina al 0,9%), cada mL de la solución contiene aproximadamente 125, 250, 375, 500, 750, 1000 o 1250 UI de FVIII, respectivamente.
La proteína FVIII en ESPEROCT se produce en células ováricas de hámster chino (CHO) utilizando tecnología de ADN recombinante, y contiene un dominio B truncado, que está O-glucosilado. La parte polipeptídica de la molécula tiene una masa molecular de 166 kDa (calculada excluyendo las modificaciones postraduccionales) y representa un heterodímero de una cadena pesada y una cadena ligera, que se mantienen unidas por interacciones no covalentes. La proteína FVIII recombinante se purifica utilizando una serie de pasos cromatográficos, uno de los cuales es la cromatografía de afinidad, con el uso de un anticuerpo monoclonal para aislar selectivamente el rFVIII del medio de cultivo celular. La molécula de PEG de 40 kDa se conjuga con la porción O-glucano del dominio B utilizando una reacción enzimática para producir un FVIII glucopegilado (FVIII-PEG). El proceso de purificación incluye dos pasos de eliminación viral, a saber, el tratamiento con detergente para la inactivación de virus envueltos y la filtración de 20 nm para la eliminación de virus envueltos y no envueltos. No se utilizan aditivos de origen humano o animal durante el proceso de fabricación y formulación de ESPEROCT.
En la circulación sanguínea, cuando el FVIII-PEG es activado por la trombina, la porción del dominio B con la porción de PEG unida se escinde, y el FVIII activado resultante (FVIIIa) es similar en estructura y función al FVIIIa nativo.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
ESPEROCT, una forma glicopeguilada de factor antihemofílico recombinante, reemplaza temporalmente el factor de coagulación VIII faltante necesario para una hemostasia efectiva en pacientes con hemofilia A congénita. El factor VIII en ESPEROCT está conjugado a una molécula de polietilenglicol de 40 kDa que aumenta la vida media y disminuye la eliminación en comparación con la molécula no peguilada.
12.2 Farmacodinamia
La administración de ESPEROCT aumenta los niveles plasmáticos de factor VIII y puede corregir temporalmente el defecto de coagulación en pacientes con hemofilia A, como se refleja en una disminución del tiempo de tromboplastina parcial activado (aPTT).
12.3 Farmacocinética
Todos los estudios farmacocinéticos con ESPEROCT se realizaron en sujetos previamente tratados con hemofilia A grave (factor VIII<1%). En total, se evaluaron 129 perfiles farmacocinéticos de dosis única de ESPEROCT en 86 sujetos (incluidos 24 sujetos pediátricos, de 1 a <12 años).
Tabla 4 muestra datos para sujetos que recibieron una dosis única de 50 UI/kg. Las muestras de plasma se analizaron utilizando el ensayo de coagulación de un solo paso. Hubo una tendencia de aumento de la recuperación incremental y el AUC, y disminución de la eliminación, con la edad.
Tabla 4: Parámetros farmacocinéticos de dosis única de ESPEROCT 50 UI/kg, por edad, utilizando el ensayo de coagulación de un solo paso (media geométrica (CV%))
| Parámetro farmacocinético No. de sujetos |
1 a <6 años N=12 |
6 a <12 años N=10 |
12 a <18 años N=3 |
>18 años N=42 |
|---|---|---|---|---|
|
No. de perfiles |
12 |
10 |
5 |
78 |
|
IR (UI/dL) por (UI/kg)a |
1.82 (32) |
1.67 (22) |
2.45 (16) |
2.53 (24) |
|
Recuperación de FVIII (UI/dL)a |
103.2 (27) |
98.7 (18) |
117.7 (14) |
130.4 (26) |
|
t1/2 (horas) |
14.7 (27) |
13.8 (32) |
17.4 (39) |
21.7 (33) |
|
AUCinf (UI*hora/dL) |
2305 (42) |
2197 (38) |
3063 (40) |
4110 (38) |
|
CL (mL/hora/kg) |
2.4 (42) |
2.7 (42) |
1.6 (39) |
1.2 (34) |
|
Vss (mL/kg) |
44.2 (25) |
47.3 (28) |
36.4 (12) |
37.3 (26) |
|
MRT (horas) |
18.1 (27) |
17.8 (35) |
23.4 (43) |
27.4 (28)b |
Los parámetros de PK se presentan en la media geométrica.
Abreviaturas: IR = Recuperación incremental; t1/2 = Vida media terminal; AUC = Área bajo la curva de tiempo de actividad del FVIII; CL = Depuración; Vss = Volumen de distribución en estado estacionario; MRT = Tiempo medio de residencia; CV% = Coeficiente de variación
a IR y la recuperación de FVIII se evaluaron 30 minutos después de la dosificación de 50 UI/kg para pacientes ≥12 años y 60 minutos después de la dosificación de 50 UI/kg (primera muestra) para niños <12 años.
b Cálculo basado en 64 perfiles.
En la evaluación de PK de dosis única en sujetos adultos, cuyo índice de masa corporal (IMC) osciló entre 17-35 kg/m2, se observaron diferencias para los individuos que tenían sobrepeso (IMC 25 – <30 kg/m2) y obesidad (IMC 30 – <35 kg/m2). La recuperación incremental aumentó aproximadamente un 17% y un 41%, el AUC aumentó aproximadamente un 10% y un 27%, y la depuración disminuyó aproximadamente un 8% y un 23%, respectivamente, todo en comparación con los sujetos con IMC <25 kg/m2. No hay datos suficientes para recomendar ajustes de dosis específicos para pacientes con sobrepeso y obesos. La dosis puede ajustarse según sea necesario a discreción del médico.
Los niveles de actividad del Factor VIII plasmático pre-dosis (valle) y post-dosis (pico) observados en estado estacionario durante el tratamiento profiláctico con ESPEROCT se presentan en Tabla 5 por régimen de dosis y rango de edad.
Tabla 5: Actividad del FVIII plasmático en estado estacionario en el valle y el pico por edad y régimen de dosis, ensayo cromogénico (media geométrica [IC del 95%])
| Régimen de dosis | 60 UI/kg dos veces por semana** (50–75 UI/kg) |
50 UI/kg Q4D* | 75 UI/kg Q7D* | |||
|---|---|---|---|---|---|---|
|
Rango de edad No. pacientes |
<6 años N=31 |
6 a <12 años N=34 |
12 a <18 años N=23 |
≥18 años N=143 |
12 a <18 años N=6 |
≥18 años N=29 |
|
Valle, UI/dL |
1.2 (0.8; 1.6) |
2.0 (1.5; 2.7) |
2.7 (1.8; 4.0) |
3.0 (2.6; 3.5) |
0.6 (0.2; 1.6) |
1.3 (0.9; 2.0) |
|
Pico, UI/dL |
125.0 (118.7; 131.6) |
143.3 (136.8; 150.2) |
125.1 (116.0; 135.0) |
137.9 (133.9; 142.2) |
198.0 (166.8; 235.2) |
197.9 (184.9; 212.7) |
*Datos incluidos en el análisis: adolescentes/adultos Fase principal hasta la Visita 8 (final de la Fase principal) 50 UI/kg Q4D, y extensión 1 para 75 UI/kg Q7D. Solo las mediciones recogidas en estado estacionario para el tratamiento profiláctico dado se incluyen en los análisis.
**Datos incluidos en el análisis: Fase principal pediátrica 60 UI/kg (50 a 75 UI/kg) dos veces por semana. Solo las mediciones recogidas en estado estacionario para el tratamiento profiláctico dado se incluyen en los análisis.
Tiempo de actividad del Factor VIII por encima del 5%
Los perfiles de actividad del Factor VIII en estado estacionario se estimaron utilizando un modelo de un compartimento con eliminación de primer orden con parámetros de PK de aclaramiento (CL) y volumen de distribución (Tabla 6). Las predicciones farmacocinéticas mostraron que en todos los grupos de edad, los pacientes tratados dos veces por semana (intervalo de dosificación alternando entre 3 y 4 días) o Q4D estarán por encima del 5% de la actividad del Factor VIII (es decir, en el rango de hemofilia leve) durante la mayor parte del tiempo (del 72 al 95% del tiempo). Los pacientes tratados con 50 UI/kg cada 4 días estarán por encima del 1% de la actividad del Factor VIII el 100% del intervalo de dosificación. Se predice que los pacientes tratados con 75 UI/kg cada 7 días estarán por encima del 5% durante el 57% del tiempo y por encima del 1% durante el 83% del tiempo.
Tabla 6: Estimación de la actividad máxima y mínima del FVIII en estado estacionario y tiempo hasta el 5% de la actividad del FVIII para ESPEROCT
| Régimen de dosis Rango de edad |
60 UI/kg (50–75 UI/kg) dos veces por semana <12 años |
50 UI/kg dos veces por semana ≥12 años |
50 UI/kg Q4D ≥12 años |
75 UI/kg Q7D ≥12 años |
|---|---|---|---|---|
|
Actividad máxima del FVIII (%) |
110/112* |
133/138* |
132 |
194 |
|
Actividad mínima del FVIII (%) |
2.8/0.8* |
8.6/3.6* |
3.5 |
0.3 |
|
Tiempo hasta el 5% de la actividad del FVIII (días) |
2.5/2.5* |
3.6/3.6* |
3.6 |
4.0 |
|
% de tiempo en el intervalo de dosificación por encima del 5% de la actividad del FVIII |
72 |
95 |
90 |
57 |
*Los valores dos veces por semana se muestran como 3 días/4 días. Solo se utilizan datos de 50 UI/kg para el análisis.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
No se han realizado estudios de carcinogénesis, mutagénesis y deterioro de la fertilidad en animales.
13.2 Toxicología y/o Farmacología Animal
No se observaron efectos adversos en ratas inmunodeficientes inyectadas por vía intravenosa con ESPEROCT (50-1200 UI/kg/inyección), una vez cada 4 días durante 52 semanas. No se detectó evidencia de acumulación de polietilenglicol mediante tinción inmunohistoquímica del tejido cerebral, incluido el plexo coroideo.
14 ESTUDIOS CLÍNICOS
La seguridad y eficacia de ESPEROCT se han evaluado en cinco ensayos multinacionales, abiertos, en sujetos masculinos con hemofilia A grave (<1% de actividad endógena del Factor VIII). Un ensayo se randomizó posteriormente parcialmente para evaluar dos regímenes de profilaxis diferentes. Todos los sujetos habían sido tratados previamente, lo que se definió como haber recibido otros productos del Factor VIII durante ≥150 días de exposición para adolescentes y adultos, y ≥50 días de exposición para sujetos pediátricos. Los criterios de exclusión clave en todos los ensayos incluyeron hipersensibilidad conocida o sospechada a los productos del ensayo o relacionados y antecedentes conocidos de inhibidores del Factor VIII o inhibidor actual ≥0,6 unidades de Bethesda (BU).
La evaluación de la eficacia incluyó 254 sujetos, que recibieron al menos una dosis de ESPEROCT, en los siguientes ensayos:
- •
- Ensayo en adolescentes/adultos: Este ensayo incluyó 186 sujetos, 161 adultos (de 18 a 65 años) y 25 adolescentes (de 12 a <18 años); consistió en una Fase Principal y una Fase de Extensión opcional. Durante la Fase Principal, 175 sujetos recibieron el régimen de profilaxis que consistió en 50 UI/kg cada 4 días (Q4D), mientras que 12 adultos optaron por ser tratados a demanda. (Un sujeto cambió de tratamiento a demanda a profilaxis y se cuenta en ambos grupos). Trece (7%) de los 175 adultos en el brazo de profilaxis modificaron su régimen de dosificación a dosificación Q3-4D para facilitar su uso. Todos los sujetos recibieron al menos una dosis de ESPEROCT y son evaluables para seguridad y eficacia. Un total de 165 sujetos (91%) completaron la Fase Principal de este ensayo.
- o
- Extensión: Esta extensión comparó dos regímenes de dosis: 75 UI/kg cada 7 días (Q7D) y 50 UI/kg Q4D. La randomización estaba abierta a los sujetos que experimentaron 2 o menos sangrados durante los últimos 6 meses en la Fase Principal.
- •
- Ensayo pediátrico: Este ensayo de PTP incluyó 68 sujetos que se dividieron equitativamente con 34 en cada grupo de edad, de 0 a <6 y de 6 a <12 años de edad. Todos los sujetos recibieron el mismo régimen de profilaxis de aproximadamente 65 UI/kg (50–75 UI/kg) dos veces por semana. Un total de 63 sujetos (93%) completaron la Fase Principal.
- •
- Ensayo de cirugía: En el ensayo de cirugía, 33 adolescentes/adultos previamente tratados se sometieron a 45 cirugías mayores. El nivel de dosis de ESPEROCT se eligió de manera que se dirigiera la actividad del FVIII al menos como lo recomendado por las directrices de la Federación Mundial de Hemofilia (FMH). Todos los sujetos volvieron al ensayo de adolescentes/adultos después de que se completaran las evaluaciones del ensayo de cirugía.
Tratamiento a demanda y control de los episodios de sangrado
Se informaron 1506 sangrados en 171 de 254 sujetos en todos los ensayos clínicos completados, y los tipos de sangrado más comunes fueron articulares (65,2%), musculares (14,5%) y subcutáneos (8,9%). Tabla 7 resume la eficacia en el control de los episodios de sangrado por edad.
Las dosis utilizadas para el tratamiento de los episodios de sangrado dependían de la edad, el régimen de tratamiento y la gravedad del sangrado.
De los 1407 episodios de sangrado leves y moderados en todos los sujetos en el estudio de adolescentes/adultos, la dosis mediana utilizada fue de 42 UI/kg. Para los sujetos que estaban en el brazo a demanda, la dosis inicial mediana fue de 28 UI/kg y el 88,4% de los sangrados se trataron con éxito con una sola dosis. En los sujetos que recibían profilaxis de rutina, la dosis inicial mediana fue de 52 UI/kg, y el 76,4% de los sangrados se trataron con éxito con una sola dosis. De los 15 sangrados graves, 12 (80%) requirieron más de una dosis con una dosis mediana total de 111 UI/kg.
En el estudio pediátrico, 70 sangrados leves/moderados en niños <12 años que recibían profilaxis de rutina se trataron con una dosis inicial mediana de 64 UI/kg por inyección, con un 63% tratados con una sola inyección. Cuando fue necesario, se utilizaron dosis medianas adicionales de 62 UI/kg a intervalos de aproximadamente 24 horas. La dosis total mediana fue de 70 UI/kg por sangrado.
Tabla 7: Resumen de la eficacia en el control de los episodios de sangrado por edad
| Rango de edad # de sujetos |
<6 años N=34 |
6 a <12 años N=34 |
12 a <18 años N=25 |
≥ 18 años N=161 |
Total N=254 |
|
|---|---|---|---|---|---|---|
|
# de sangrados |
30 |
40 |
112 |
1324 |
1506 |
|
|
# de inyecciones |
1 a 2 |
76,7% |
82,5% |
88,4% |
95,5% |
94,3% |
|
> 2 |
23.3% |
17.5% |
11.6% |
4.5% |
5.7% |
|
|
Response to first treatment |
Excellent/ |
80.0% |
77.5% |
75.0% |
88.7% |
87.3% |
|
Moderate |
13.3% |
17.5% |
17.9% |
10.3% |
11.1 % |
Definición de respuesta hemostática:
Excelente: Alivio del dolor abrupto y/o mejora inequívoca en los signos objetivos de sangrado dentro de aproximadamente 8 horas después de una sola inyección.
Bueno: Alivio del dolor definido y/o mejora en los signos de sangrado dentro de aproximadamente 8 horas después de una inyección, pero posiblemente requiriendo más de una inyección para la resolución completa.
Moderado: Efecto beneficioso probable o leve dentro de aproximadamente 8 horas después de la primera inyección; generalmente requiere más de una inyección.
Manejo perioperatorio
El análisis de eficacia de ESPEROCT en el manejo perioperatorio incluyó 45 procedimientos quirúrgicos mayores realizados en 33 sujetos adolescentes y adultos. Los procedimientos incluyeron 15 reemplazos de articulaciones, 9 intervenciones ortopédicas artroscópicas, 17 otras intervenciones ortopédicas y 4 cirugías no ortopédicas.
La evaluación clínica de la respuesta hemostática durante la cirugía mayor se evaluó utilizando una escala de 4 puntos de excelente, bueno, moderado o ninguno. El efecto hemostático de ESPEROCT se calificó como “excelente” o “bueno” en 43 de 45 cirugías (95.6%), mientras que el efecto se calificó como “moderado” en 2 cirugías (4.4%). Ninguna cirugía tuvo un resultado calificado como “ninguno” o “faltante”.
La dosis preoperatoria mediana para adultos y adolescentes que se someten a cirugías mayores fue de 52 UI/kg, y la dosis total mediana fue de 702 UI/kg. Durante los días postoperatorios 1-6, la dosis mediana fue de 32 UI/kg a intervalos de aproximadamente 24 horas. Durante los días postoperatorios 7-14, la dosis mediana fue de 36 UI/kg a intervalos de aproximadamente 28 horas. El número de dosis y la duración del tratamiento variaron según el procedimiento.
Profilaxis de rutina en adolescentes/adultos
La eficacia de ESPEROCT en la profilaxis de rutina con dosificación Q4D se demostró para la población adulta/adolescente (ver Tabla 8). En la parte de extensión del estudio, no se estableció el éxito del tratamiento del brazo Q7D. Durante la Fase Principal del ensayo de adolescentes/adultos, 186 sujetos tuvieron un total de 159 años de exposición. La tasa de sangrado anualizada (ABR) mediana para los sangrados tratados en adultos y adolescentes tratados cada 4 días fue de 1.2 (IQR: 0.0:4.3), y la ABR media fue de 3.0 (SD: 4.7). Al incluir todos los sangrados (tratados y no tratados), la ABR mediana fue de 1.2 (IQR: 0.0; 4.7) y la ABR media fue de 3.3 (SD: 4.9).
Tabla 8: Eficacia en la profilaxis de adolescentes/adultos, ABR medianas y medias por edad, régimen de tratamiento y tipo de sangrado
| Profilaxis | A demanda | |||
|---|---|---|---|---|
| Rango de edad | 12 a 17 años | 18 a 70 años | 12 a 70 años | 18 a 70 años |
| # de sujetos | 25 | 150 | 175 | 12 |
|
Duración media del tratamiento (años) |
0.85 |
0.81 |
0.82 |
1.33 |
|
Sangrados tratados # de sujetos con sangrados (%) # de sujetos sin sangrados (%) # de sangrados ABR mediana (IQR) ABR media (SD) |
19 (76) 6 (24) 67 2.2 (0.9;4.7) 3.5 (3.9) |
86 (57) 64 (43) 369 1.2 (0.0;3.7) 2.9 (4.8) |
105 (60) 70 (40) 436 1.2 (0.0;4.3) 3.0 (4.7) |
12 (100) 0 532 30.9 (18.6;38.5) 31.9 (19.1) |
|
Todos los sangrados (tratados y no tratados) # de sujetos con sangrados (%) # de sujetos sin sangrados (%) # de sangrados* ABR mediana (IQR) ABR media (SD) |
19 (76) 6 (24) 72 2.2 (0.9;6.0) 3.7 (4.1) |
88 (59) 62 (41) 386 1.2 (0.0;4.3) 3.2 (5.1) |
107 (61) 68 (39) 458 1.2 (0.0;4.7) 3.3 (4.9) |
12 (100) 0 536 31.3 (18.6;38.9) 32.2 (19.1) |
|
Hemorragias espontáneas tratadas # de sujetos con hemorragias (%) # de sujetos sin hemorragias (%) AsBR mediana (IQR) AsBR media (SD) |
11 (44) 14 (56) 30 0.0 (0.0;1.5) 1.4 (2.4) |
65 (43) 85 (57) 221 0.0 (0.0;1.9) 1.8 (3.7) |
76 (43) 99 (57) 0.0 (0.0;1.8) 1.7 (3.5) |
12 (100) 0 415 19.4 (12.1;31.0) 24.5 (17.3) |
|
Hemorragias traumáticas tratadas # de sujetos sin hemorragias (%) # de hemorragias AtBR media (SD) |
16 (64) 9 (36) 37 1.3 (0.0;2.6) 2.1 (2.9) |
57 (38) 93 (62) 146 0.0 (0.0;1.4) 1.1 (2.2) |
73 (42) 102 (58) 183 1.2 (2.3) |
10 (83) 2 (17) 110 6.1 (6.2) |
|
Hemorragias articulares tratadas # de sujetos sin hemorragias (%) # de hemorragias AjBR media (SD) |
16 (64) 9 (36) 37 1.2 (0.0;2.8) 1.8 (2.2) |
74 (49) 76 (51) 288 0.0 (0.0;2.8) 2.3 (4.3) |
90 (51) 85 (49) 325 0.9 (0.0;2.8) 2.2 (4.1) |
12 (100) 0 309 19.7 (15.1) |
ABR = tasa de hemorragia anualizada; IQR = rango intercuartílico, percentil 25 a percentil 75; SD = desviación estándar; AsBR = tasa de hemorragia espontánea anualizada; AtBR = tasa de hemorragia traumática anualizada; AjBR = tasa de hemorragia articular anualizada.
*Refleja todas las hemorragias notificadas por los pacientes, incluidas aquellas en las que no se administró ESPEROCT
Profilaxis de rutina en niños <12 años de edad
En general, 68 niños menores de 12 años recibieron tratamiento profiláctico con ESPEROCT a una dosis promedio de aproximadamente 65 UI/kg dos veces por semana. El efecto profiláctico de ESPEROCT se demostró con una tasa de ABR mediana de 2.0 (IQR: 0.0; 2.8) y 2.0 (IQR: 0.0; 4.2) para las hemorragias tratadas y todas las hemorragias, respectivamente (ver Tabla 9). La ABR media (SD) para las hemorragias tratadas y todas las hemorragias fue de 3.1 (7.1) y 4.4 (8.7), respectivamente. De los 68 niños, 22 (32%) no experimentaron ningún episodio de hemorragia y 29 (43%) no experimentaron ningún episodio de hemorragia que requiriera tratamiento durante la Fase Principal del ensayo. De los 13 sujetos con 17 articulaciones objetivo documentadas al inicio, 10 sujetos (77%) y 14 articulaciones objetivo (82%) no tuvieron ninguna hemorragia durante la Fase Principal del ensayo.
Tabla 9: Eficacia en la profilaxis pediátrica, ABR mediana y media por edad y tipo de hemorragia
| Régimen de profilaxis | |||
|---|---|---|---|
| Rango de edad | < 6 años** | 6 a < 12 años | 0 a < 12 años |
| # de sujetos | N=34 | N=34 | N=68 |
|
Duración media del tratamiento (años) |
0.46 |
0.51 |
0.48 |
|
Hemorragias tratadas # de sujetos con hemorragias (%) # de sujetos sin hemorragias (%) # de hemorragias ABR mediana (IQR) ABR media (SD) |
19 (56) 15 (44) 30 1.9 (0.0;2.1) 3.9 (9.7) |
20 (59) 14 (41) 40 2.0 (0.0;3.9) 2.3 (2.9) |
39 (57) 29 (43) 70 2.0 (0.0;2.8) 3.1 (7.1) |
|
Todas las hemorragias (tratadas y no tratadas) # de sujetos con hemorragias (%) # de sujetos sin hemorragias (%) # de hemorragias* ABR mediana (IQR) ABR media (SD) |
20 (59) 14 (41) 41 2.0 (0.0;4.0) 5.0 (11.9) |
26 (77) 8 (24) 65 2.0 (1.9;6.0) 3.8 (3.6) |
46 (68) 22 (32) 106 2.0 (0.0;4.2) 4.4 (8.7) |
|
Hemorragias espontáneas tratadas # de sujetos con hemorragias (%) # de sujetos sin hemorragias (%) # de hemorragias AsBR mediana (IQR) AsBR media (SD) |
6 (18) 28 (82) 9 0.0 (0.0;0.0) 2.1 (7.3) |
7 (21) 27 (79) 10 0.0 (0.0; 0.0) 0.6 (1.5) |
13 (19) 55 (81) 19 0.0 (0.0; 0.0) 1.3 (5.3) |
|
Hemorragias traumáticas tratadas # de sujetos con hemorragias (%) # de sujetos sin hemorragias (%) # de hemorragias AtBR mediana (IQR) AtBR media (SD) |
15 (44) 19 (56) 20 0.0 (0.0; 2.0) 1.7 (4.0) |
17 (50) 17 (50) 30 0.9 (0.0;2.0) 1.7 (2.5) |
32 (47) 36 (53) 50 0.0 (0.0;2.0) 1.7 (3.3) |
|
Hemorragias articulares tratadas # de sujetos con hemorragias (%) # de sujetos sin hemorragias (%) # de hemorragias AjBR mediana (IQR) AjBR media (SD) |
7 (21) 27 (79) 10 0.0 (0.0;0.0) 1.5 (6.3) |
12 (35) 22 (65) 24 0.0 (0.0;2.0) 1.4 (2.4) |
19 (28) 49 (72) 34 0.0 (0.0;2.0) 1.5 (4.7) |
ABR = tasa de hemorragia anualizada; IQR = rango intercuartílico, percentil 25 a percentil 75; SD = desviación estándar; AsBR = tasa de hemorragia espontánea anualizada; AtBR = tasa de hemorragia traumática anualizada; AjBR = tasa de hemorragia articular anualizada
*Refleja todas las hemorragias notificadas por los pacientes, incluidas aquellas en las que no se administró ESPEROCT
**Las ABR medias elevadas se deben a los sujetos que se retiraron del estudio, cuyas tasas de hemorragia se extrapolaron a un año**
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Cómo se suministra
- •
- ESPEROCT se suministra en paquetes que constan de un vial de dosis única que contiene nominalmente 500, 1000, 1500, 2000, 3000, 4000 o 5000 UI de actividad del Factor VIII; una jeringa de diluyente prellenada MixPro® que contiene solución salina al 0.9%; y un adaptador de vial estéril con un filtro de 25 micrómetros, que sirve como un dispositivo de reconstitución sin aguja.
- •
- La actividad real del Factor VIII en UI se indica en cada cartón y etiqueta de vial de ESPEROCT.
Tabla 10: Presentaciones de ESPEROCT
| Concentración nominal de dosis | Color de la tapa Indicador |
Número NDC del cartón | Componentes |
|---|---|---|---|
|
500 UI |
Rojo |
NDC 0169 8500 01 |
|
|
1000 UI |
Verde |
NDC 0169 8100 01 |
|
|
1500 UI |
Gris |
NDC 0169 8150 01 |
|
|
2000 UI |
Amarillo |
NDC 0169 8200 01 |
|
|
3000 UI |
Negro |
NDC 0169 8300 01 |
|
|
4000 UI |
Rosa claro |
NDC 0169 8400 01 |
|
|
5000 UI |
Azul oscuro |
NDC 0169 8055 01 |
|
UI = Unidades Internacionales
- •
- Los viales de ESPEROCT están hechos de vidrio, cerrados con un tapón de goma clorobutilo (no hecho con látex de goma natural), y sellados con una tapa de aluminio.
- •
- Las jeringas de diluyente prellenadas están hechas de vidrio con un émbolo de goma bromobutilo siliconizado (no hecho con látex de goma).
- •
- Los viales cerrados y las jeringas de diluyente prellenadas están equipados con una tapa a prueba de manipulaciones que se rompe, hecha de polipropileno.
Almacenamiento y Manejo
- •
- Almacene ESPEROCT en el paquete original para proteger el vial de ESPEROCT de la luz.
- •
- Almacene ESPEROCT en forma de polvo bajo refrigeración a 36°F a 46°F (2°C a 8°C) durante un máximo de 30 meses desde la fecha de fabricación hasta la fecha de caducidad indicada en la etiqueta. Durante la vida útil de 30 meses, ESPEROCT puede mantenerse a temperatura ambiente:
- o
- hasta 86°F (30°C) por no más de 12 meses, o
- o
- hasta 104°F (40°C) por no más de 3 meses
- •
- Registre la fecha en el cartón cuando el producto fue retirado del refrigerador. No devuelva el producto al refrigerador.
- •
- No congele ESPEROCT.
- •
- Utilice ESPEROCT dentro de las 4 horas posteriores a la reconstitución cuando se almacene a ≤86°F (30°C) o dentro de las 24 horas cuando se almacene en el refrigerador. Almacene el producto reconstituido en el vial.
- •
- Deseche cualquier producto reconstituido no utilizado.
17 INFORMACIÓN PARA EL PACIENTE
Aconseje a los pacientes:
- •
- Que lean el etiquetado del paciente aprobado por la FDA (Información para el paciente e Instrucciones de uso).
- •
- Que las reacciones de hipersensibilidad de tipo alérgico o la anafilaxia son posibles con el uso de ESPEROCT. Informe a los pacientes sobre los signos tempranos de reacciones de hipersensibilidad, que incluyen erupción cutánea, urticaria, picazón, hinchazón facial, opresión en el pecho y sibilancias. Aconseje a los pacientes que suspendan el uso de ESPEROCT inmediatamente y que se pongan en contacto con su médico y/o busquen atención médica de emergencia de inmediato si se presentan estos síntomas.
- •
- Que se pongan en contacto con su médico o centro de tratamiento para recibir tratamiento y/o evaluación adicionales si experimentan una falta de respuesta clínica a la terapia de reemplazo del Factor VIII, ya que esto puede ser una manifestación de un inhibidor.
Versión: 5
Número de licencia: 1261
ESPEROCT® y MixPro® son marcas registradas de Novo Nordisk Health Care AG.
Información de patentes: http://novonordisk-us.com/products/product-patents.html
Clave® y MicroClave® son marcas registradas de ICU Medical Inc.
InVision-Plus®, InVision-Plus CS®, Invision-Plus® Junior® son marcas registradas de RyMed Technologies, Inc. Bionector® es una marca registrada de Vygon.
© 2024 Novo Nordisk
Para obtener información, comuníquese con:
Novo Nordisk Inc.
800 Scudders Mill Road
Plainsboro, NJ 08536, USA
1-800-727-6500
Fabricado por:
Novo Nordisk A/S
Novo Allé, DK-2880 Bagsvaerd
INSERTO PARA EL PACIENTE
INFORMACIÓN PARA EL PACIENTE
ESPEROCT® (es’per okt)
[factor antihemofílico (recombinante), glicopegilado-exei]
Lea la información para el paciente y las instrucciones de uso que vienen con ESPEROCT antes de comenzar a tomar este medicamento y cada vez que reciba una nueva receta. Puede haber nueva información.
Esta información para el paciente no reemplaza hablar con su proveedor de atención médica sobre su condición médica o tratamiento. Si tiene preguntas sobre ESPEROCT después de leer esta información, consulte a su proveedor de atención médica.
¿Cuál es la información más importante que necesito saber sobre ESPEROCT?
No intente hacer una infusión usted mismo a menos que su proveedor de atención médica o centro de tratamiento de hemofilia le haya enseñado cómo hacerlo.
Debe seguir cuidadosamente las instrucciones de su proveedor de atención médica con respecto a la dosis y el horario para infundir ESPEROCT para que su tratamiento funcione mejor para usted.
¿Qué es ESPEROCT?
ESPEROCT es un medicamento inyectable que se utiliza para reemplazar el factor de coagulación VIII que falta en los pacientes con hemofilia A. La hemofilia A es un trastorno hemorrágico hereditario en todos los grupos de edad que evita que la sangre coagule normalmente.
ESPEROCT se utiliza para tratar y prevenir o reducir el número de episodios de sangrado en personas con hemofilia A.
Su proveedor de atención médica puede administrarle ESPEROCT cuando se someta a una cirugía.
¿Quién no debe usar ESPEROCT?
No debe usar ESPEROCT si usted
- •
- es alérgico al factor VIII o a cualquiera de los demás ingredientes de ESPEROCT
- •
- si es alérgico a las proteínas del hámster
Si no está seguro, hable con su proveedor de atención médica antes de usar este medicamento.
Informe a su proveedor de atención médica si está embarazada o amamantando porque ESPEROCT podría no ser adecuado para usted.
¿Qué debo decirle a mi proveedor de atención médica antes de usar ESPEROCT?
Debe informar a su proveedor de atención médica si usted:
- •
- Tiene o ha tenido alguna condición médica.
- •
- Toma algún medicamento, incluidos los medicamentos de venta libre y los suplementos dietéticos.
- •
- Está amamantando.
- •
- Está embarazada o planea quedar embarazada.
- •
- Le han dicho que tiene inhibidores del factor VIII.
¿Cómo debo usar ESPEROCT?
El tratamiento con ESPEROCT debe iniciarlo un proveedor de atención médica que tenga experiencia en el cuidado de pacientes con hemofilia A.
ESPEROCT se administra como una infusión en la vena.
Puede infundir ESPEROCT en un centro de tratamiento de hemofilia, en el consultorio de su proveedor de atención médica o en su casa. Su centro de tratamiento de hemofilia o proveedor de atención médica debe capacitarlo sobre cómo hacer infusiones. Muchas personas con hemofilia A aprenden a infundirse el medicamento por sí mismas o con la ayuda de un familiar.
Su proveedor de atención médica le dirá cuánta ESPEROCT debe usar en función de su peso, la gravedad de su hemofilia A y dónde está sangrando. Su dosis se calculará en unidades internacionales, UI.
Llame a su proveedor de atención médica de inmediato si su sangrado no se detiene después de tomar ESPEROCT.
Si su sangrado no se controla adecuadamente, podría deberse al desarrollo de inhibidores del factor VIII. Su proveedor de atención médica debe verificar esto. Es posible que necesite una dosis más alta de ESPEROCT o incluso un producto diferente para controlar el sangrado. No aumente la dosis total de ESPEROCT para controlar su sangrado sin consultar a su proveedor de atención médica.
Uso en niños
ESPEROCT se puede usar en niños. Su proveedor de atención médica decidirá la dosis de ESPEROCT que recibirá.
Si olvida usar ESPEROCT
Si olvida una dosis, infunda la dosis olvidada cuando descubra el error. No infunda una dosis doble para compensar una dosis olvidada. Continúe con las próximas infusiones según lo programado y continúe como le indique su proveedor de atención médica.
Si deja de usar ESPEROCT
No deje de usar ESPEROCT sin consultar a su proveedor de atención médica.
Si tiene alguna otra pregunta sobre el uso de este producto, consulte a su proveedor de atención médica.
¿Qué pasa si tomo demasiado ESPEROCT?
Siempre tome ESPEROCT exactamente como le haya indicado su proveedor de atención médica. Debe consultar con su proveedor de atención médica si no está seguro. Si infunde más ESPEROCT de lo recomendado, informe a su proveedor de atención médica lo antes posible.
¿Cuáles son los posibles efectos secundarios de ESPEROCT?
Los efectos secundarios comunes incluyen:
- •
- erupción cutánea o picazón
- •
- hinchazón, dolor, erupción cutánea o enrojecimiento en el lugar de la infusión
Otros posibles efectos secundarios:
Puede tener una reacción alérgica a los productos del factor de coagulación VIII. Llame a su proveedor de atención médica de inmediato u obtenga tratamiento de emergencia de inmediato si presenta algún signo de una reacción alérgica, como: urticaria, opresión en el pecho, sibilancias, mareos, dificultad para respirar y/o hinchazón de la cara.
Su cuerpo también puede producir anticuerpos llamados “inhibidores” contra ESPEROCT, lo que puede evitar que ESPEROCT funcione correctamente. Su proveedor de atención médica puede necesitar analizar su sangre para detectar inhibidores de vez en cuando.
Estos no son todos los posibles efectos secundarios de ESPEROCT. Consulte a su proveedor de atención médica para obtener más información. Se le anima a informar los efectos secundarios a la FDA al 1-800-FDA-1088.
Informe a su proveedor de atención médica sobre cualquier efecto secundario que le moleste o que no desaparezca.
¿Cuáles son las concentraciones de dosis de ESPEROCT?
ESPEROCT viene en siete concentraciones de dosis diferentes. El número real de unidades internacionales (UI) de factor VIII en el vial estará impreso en la etiqueta y en la caja. Las siete concentraciones diferentes son las siguientes:
|
Indicador de color de la tapa |
Concentración Nominal |
|
Rojo |
500 UI por vial |
|
Verde |
1000 UI por vial |
|
Gris |
1500 UI por vial |
|
Amarillo |
2000 UI por vial |
|
Negro |
3000 UI por vial |
|
Rosa Claro |
4000 UI por vial |
|
Azul Oscuro |
5000 UI por vial |
Siempre verifique la concentración real del medicamento impresa en la etiqueta para asegurarse de que está utilizando la concentración prescrita por su proveedor de atención médica.
¿Cómo debo almacenar ESPEROCT?
Antes de la reconstitución (mezclar el polvo seco en el vial con el diluyente):
Proteger de la luz. No congelar ESPEROCT.
ESPEROCT se puede almacenar en refrigeración a 36°F a 46°F (2°C a 8°C) hasta por 30 meses hasta la fecha de vencimiento indicada en la etiqueta. Durante la vida útil de 30 meses, ESPEROCT se puede mantener a temperatura ambiente, no superior a 86°F (30°C) hasta por 12 meses, o hasta 104°F (40°C) durante no más de 3 meses.
-
-
Si decide almacenar ESPEROCT a temperatura ambiente:
- •
- Anote la fecha en que se retiró el producto del refrigerador.
- •
- No vuelva a colocar el producto en el refrigerador.
- •
- No lo use después de 12 meses si se almacena hasta 86°F (30°C) o después de 3 meses si se almacena hasta 104°F (40°C) o la fecha de vencimiento que figura en el vial, lo que ocurra primero.
No use este medicamento después de la fecha de vencimiento que figura en la caja exterior y en el vial. La fecha de vencimiento se refiere al último día de ese mes.
Después de la reconstitución:
El ESPEROCT reconstituido (el producto final una vez que el polvo se mezcla con el diluyente) debe aparecer claro e incoloro sin partículas visibles.
El ESPEROCT reconstituido debe usarse inmediatamente.
Si no puede usar el ESPEROCT reconstituido inmediatamente, debe usarse dentro de las 4 horas si se almacena a 86ºF (30°C) o menos, o dentro de las 24 horas si se almacena en un refrigerador a 36°F a 46°F (2°C a 8°C). Almacene el producto reconstituido en el vial.
Mantenga este medicamento fuera de la vista y del alcance de los niños.
¿Qué más debo saber sobre ESPEROCT y la hemofilia A?
Los medicamentos a veces se recetan para fines distintos de los que se enumeran aquí. No use ESPEROCT para una afección para la que no esté prescrito. No comparta ESPEROCT con otras personas, incluso si tienen los mismos síntomas que usted.
Para obtener más información sobre ESPEROCT, llame a Novo Nordisk al 1-800-727-6500.
¿Cuáles son los ingredientes de ESPEROCT?
Ingredientes activos: análogo recombinante del factor de coagulación VIII humano (FVIII) conjugado con una molécula de polietilenglicol (PEG) de 40 kDa
Ingredientes inactivos: cloruro de sodio, L-histidina, sacarosa, polisorbato 80, L-metionina y cloruro de calcio
ESPEROCT® es una marca comercial de Novo Nordisk Health Care AG.
Para obtener información sobre patentes, consulte: http://novonordisk-us.com/products/product-patents.html.
© 2024 Novo Nordisk
Fabricado por: Novo Nordisk A/S, Novo Allé DK-2880 Bagsvaerd, Dinamarca
Para obtener información sobre ESPEROCT, comuníquese con:
Novo Nordisk Inc., 800 Scudders Mill Road, Plainsboro, NJ 08536, EE. UU.
Esta información para el paciente ha sido aprobada por la Administración de Alimentos y Medicamentos de los EE. UU. Revisado: 07/2024
Instrucciones de uso
Instrucciones sobre cómo usar ESPEROCT® [factor antihemofílico (recombinante), glicopegilado-exei] MixPro®
LEA ESTAS INSTRUCCIONES DETENIDAMENTE ANTES DE USAR ESPEROCT.
ESPEROCT se suministra como un polvo. Antes de la infusión (administración), debe mezclarse (reconstituirse) con el diluyente líquido suministrado en la jeringa. El diluyente líquido es una solución de cloruro de sodio. El ESPEROCT mezclado debe infundirse en su vena (infusión intravenosa). El equipo de este paquete está diseñado para mezclar e infundir ESPEROCT.
También necesitará un equipo de infusión (aguja mariposa con tubo), torundas de alcohol estériles, gasas y vendas.
No utilice el equipo sin la capacitación adecuada de su médico o enfermero.
Siempre lávese las manos y asegúrese de que el área que lo rodea esté limpia.
Cuando prepara e infunde medicamentos directamente en las venas, es importante utilizar una técnica limpia y libre de gérmenes (aséptica). Una técnica inadecuada puede introducir gérmenes que pueden infectar la sangre.
No abra el equipo hasta que esté listo para usarlo.
No utilice el equipo si se ha caído o si está dañado. Use un paquete nuevo en su lugar.
No utilice el equipo si está vencido. Use un paquete nuevo en su lugar.La fecha de vencimiento está impresa en la caja exterior y en el vial, el adaptador del vial y la jeringa precargada.
No utilice el equipo si sospecha que está contaminado. Use un paquete nuevo en su lugar.
No deseche ninguno de los artículos hasta después de haber infundido la solución mezclada.
El equipo es para un solo uso.
Contenedor de dosis única. Deseche la porción no utilizada.
Contenido
El paquete contiene:
• Vial con polvo ESPEROCT
• Adaptador de vial
• Jeringa precargada con diluyente
• Barra de émbolo (colocada debajo de la jeringa)
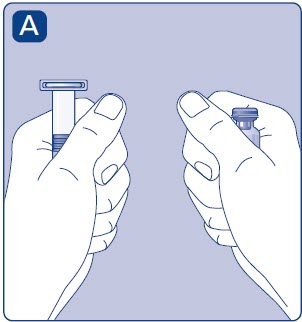
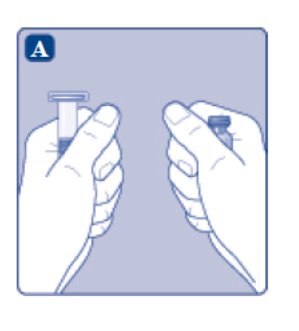
1. Prepare el vial y la jeringa
- •
- Saque el número de paquetes de ESPEROCT que necesita.
- •
- Compruebe la fecha de caducidad.
- •
- Compruebe el nombre, la concentración y el color del paquete, para asegurarse de que contiene el producto correcto.
- •
- Lávese las manos y séquelas bien con una toalla limpia o al aire.
- •
- Saque el vial, el adaptador del vial y la jeringa precargada de la caja. Deje la varilla del émbolo sin tocar en la caja.
- •
- Lleve el vial y la jeringa precargada a temperatura ambiente. Puede hacerlo sosteniéndolos en sus manos hasta que se sientan tan calientes como sus manos.
- •
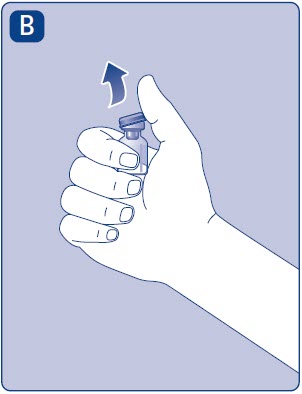
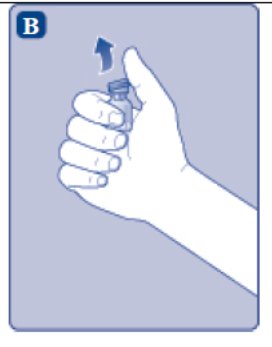
- Retire la tapa de plástico del vial. Si la tapa de plástico está suelta o falta, no utilice el vial.
- •
- Limpie el tapón de goma con una torunda de alcohol estéril y déjela secar al aire durante unos segundos antes de usarla para asegurarse de que esté lo más libre de gérmenes posible.
- •
- No toque el tapón de goma con los dedos ya que esto puede transferirgérmenes.
2. Conecte el adaptador del vial
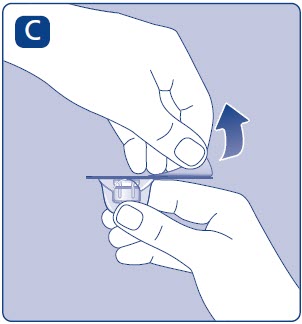
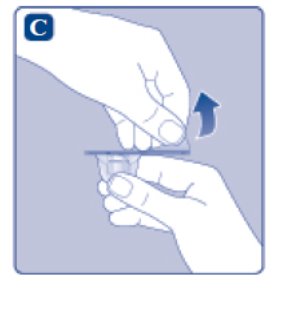
- •
- Retire el papel protector del adaptador del vial.
- No saque el adaptador del vial de la tapa protectora con los dedos. Si toca la punta del adaptador del vial, los gérmenes de sus dedos pueden transferirse.
- Si el papel protector no está completamente sellado o si está roto, no utilice el adaptador del vial.
- •
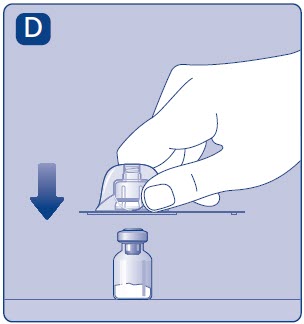
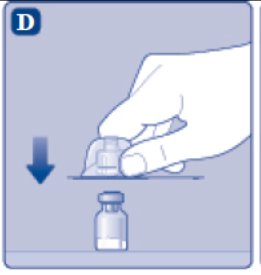
- Coloque el vial sobre una superficie plana y sólida.
- •
- Gire la tapa protectora, y encaje el adaptador del vial en el vial.
- Una vez conectado, no retire el adaptador del vial del vial.
- •
- Retire con cuidado la tapa protectora del adaptador del vial.
- No levante el adaptador del vial del vial al retirar la tapa protectora.
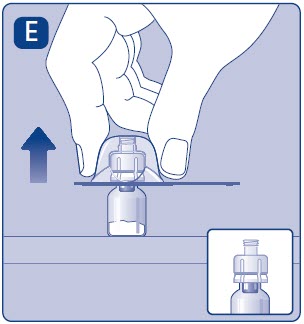
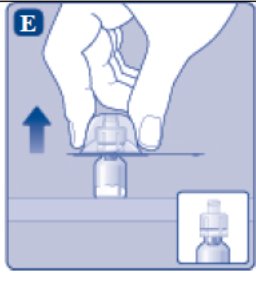
3. Conecte la varilla del émbolo y la jeringa
- •
- Agarre la varilla del émbolo por el extremo superior ancho y sáquela de la caja. No toque los lados ni la rosca de la varilla del émbolo. Si toca los lados o la rosca, los gérmenes de sus dedos pueden transferirse.
- •
- Inmediatamente conecte la varilla del émbolo a la jeringa girándola en el sentido de las agujas del reloj en el émbolo de goma dentro de la jeringa precargada hasta que se sienta resistencia.
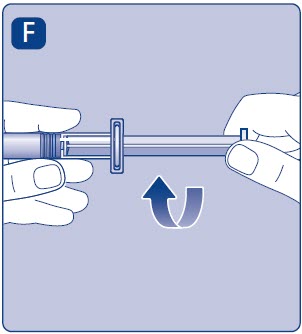
- •
- Retire la tapa de la jeringa de la jeringa precargada doblándola hacia abajo hasta que se rompa la perforación.
- No toque la punta de la jeringa debajo de la tapa de la jeringa. Si toca la punta de la jeringa, los gérmenes de sus dedos pueden transferirse.
- Si la tapa de la jeringa está suelta o falta, no utilice la jeringa precargada.
- •
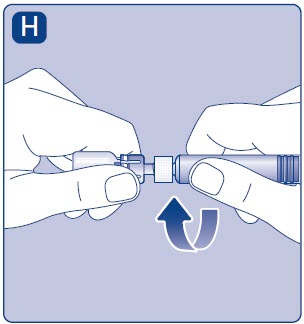
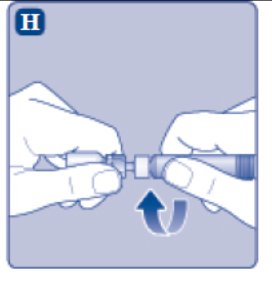
- Enrosque la jeringa precargada de forma segura en el adaptador del vial hasta que se sienta resistencia.
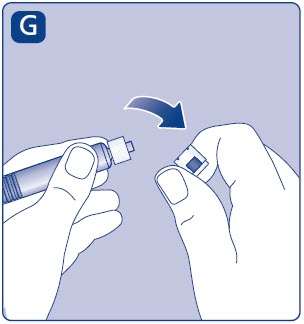
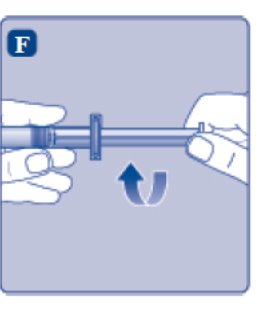
4. Mezcle el polvo con el diluyente
- •
- Mantenga la jeringa precargada ligeramente inclinada con el vial apuntando hacia abajo.
- •
- Empuje la varilla del émbolo para inyectar todo el diluyente en el vial.
- •
- Mantenga la varilla del émbolo presionada hacia abajo y gire el vial suavemente hasta que todo el polvo se disuelva.
- No agite el vial, ya que esto provocará espuma.
- •
- Compruebe la solución mezclada. Debe ser transparente e incolora. Si observa partículas visibles o decoloración, no la utilice. Utilice un nuevo paquete en su lugar.
Se recomienda utilizar ESPEROCT inmediatamente después de mezclarlo.
Si no puede utilizar la solución de ESPEROCT mezclada inmediatamente, debe utilizarse en un plazo de 4 horas si se almacena a ≤86°F (30°C) o en un plazo de 24 horas si se almacena en un refrigerador a 36°F a 46°F (2°C a 8°C). Almacene el producto reconstituido en el vial.
No congele la solución de ESPEROCT mezclada ni la almacene en jeringas.
Mantenga la solución de ESPEROCT reconstituida fuera de la luz directa.
Si su dosis requiere más de un vial, repita el paso A a J con viales adicionales, adaptadores de viales y jeringas precargadas hasta que haya alcanzado la dosis requerida.
- •
- Mantenga la varilla del émbolo completamente presionada.
- •
- Gire la jeringa con el vial boca abajo.
- •
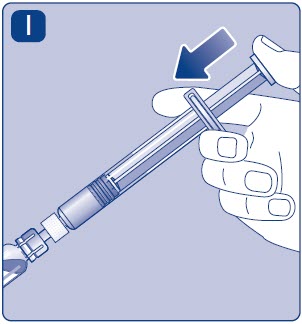
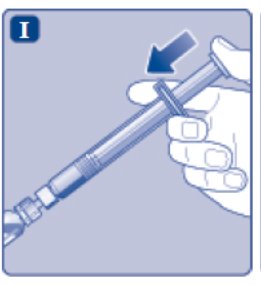
- Deje de presionar la varilla del émbolo y déjela volver por sí sola mientras la solución mezclada llena la jeringa.
- •
- Tire ligeramente de la varilla del émbolo hacia abajo para aspirar la solución mezclada en la jeringa.
- •
- En caso de que solo necesite parte del vial completo, use la escala de la jeringa para ver cuánta solución mezclada retira, según las instrucciones de su médico o enfermero.
- •
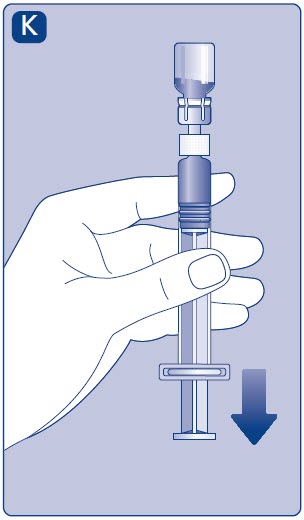
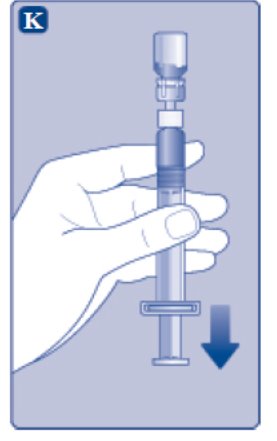
- Mientras mantiene el vial boca abajo, golpee suavemente la jeringa para que las burbujas de aire suban a la superficie.
- •
- Presione la varilla del émbolo lentamente hasta que desaparezcan todas las burbujas de aire.
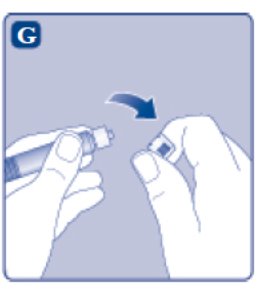
- •
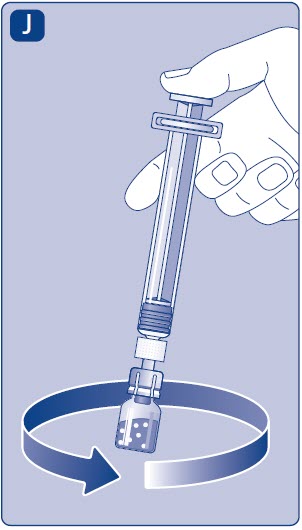
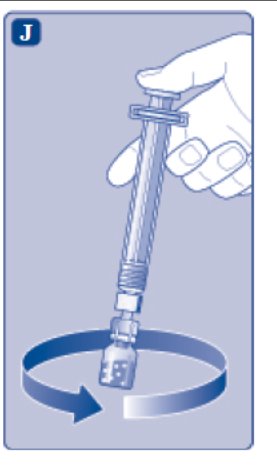
- Desenrosque el adaptador del vial con el vial.
No toque la punta de la jeringa. Si toca la punta de la jeringa, los gérmenes de sus dedos pueden transferirse.
Precaución: La jeringa precargada con diluyente está hecha de vidrio con un diámetro de punta interno de 0.037 pulgadas, y es compatible con un conector Luer-lock estándar.
Algunos conectores sin aguja para catéteres intravenosos son incompatibles con las jeringas de diluyente de vidrio (por ejemplo, ciertos conectores con una espiga interna, como Clave® /MicroClave®, InVision-Plus®, InVision-Plus CS®, Invision-Plus® Junior®, Bionector®).
Para administrar ESPEROCT a través de conectores sin aguja incompatibles, retire el producto reconstituido en una jeringa de plástico estéril Luer-lock estándar de 10 mL.
Si ha encontrado algún problema al conectar la jeringa precargada de cloruro de sodio a cualquier dispositivo compatible con Luer‐lock, comuníquese con Novo Nordisk al (800) 727-6500.
5. Infunda la solución mezclada
ESPEROCT está ahora listo para infundirse en su vena.
- •
- No mezcle ESPEROCT con ninguna otra infusión intravenosa o medicamentos.
- •
- Infunda la solución mezclada lentamente durante 1 a 3 minutos, según las instrucciones de su médico o enfermero.
Infundir la solución a través de un dispositivo de acceso venoso central (CVAD) como un catéter venoso central o un puerto subcutáneo:
- •
- Utilice una técnica limpia y libre de gérmenes (aséptica). Siga las instrucciones para el uso adecuado de su conector y dispositivo de acceso venoso central en consulta con su médico o enfermero.
- •
- La infusión en un CVAD puede requerir el uso de una jeringa de plástico estéril de 10 mL para la extracción de la solución mezclada y la infusión.
- •
- Si es necesario, use Inyección de Cloruro de Sodio al 0.9%, USP para irrigar la línea del CVAD antes o después de la infusión de ESPEROCT.
La etiqueta despegable que se encuentra en el vial de ESPEROCT se puede utilizar para registrar el número de lote.
Eliminación
- •
- Después de la infusión, elimine de forma segura toda la solución de ESPEROCT no utilizada, la jeringa con el equipo de infusión, el vial con el adaptador del vial y otros materiales de desecho en un contenedor adecuado para desechar los residuos médicos.
No lo tire a la basura doméstica.
No desmonte el vial y el adaptador del vial antes de desecharlo.
No reutilice el equipo.
Información importante
Comuníquese con su proveedor de atención médica o el centro local de tratamiento de hemofilia si experimenta algún problema.
Para obtener información completa sobre la prescripción, lea el otro inserto incluido en este paquete.
ESPEROCT® y MixPro® son marcas comerciales de Novo Nordisk Health Care AG.
Para obtener información sobre patentes, consulte: http://novonordisk-us.com/patients/products/product-patents.html
© 2019 Novo Nordisk
Fabricado por:
Novo Nordisk A/S
DK-2880 Bagsvaerd, Dinamarca
Para obtener información sobre ESPEROCT, comuníquese con:
Novo Nordisk Inc.
800 Scudders Mill Road
Plainsboro, NJ 08536, USA
Licencia No: 1261
Revisado: 10/2019
PANEL DE VISUALIZACIÓN PRINCIPAL DEL PAQUETE/ETIQUETA
Cartón de 500 UI
NDC 0169 8500 01 List: 850001
- ESPEROCT®Rango de 500 UI
[factor antihemofílico (recombinante), glicopegilado-exei]
500 UI
Uso intravenoso, después de la reconstitución.
Monodosis. Deseche la porción no utilizada
No contiene conservantes.
Rx Only
Incluye MixPro®
un adaptador de vial y una jeringa de diluyente prellenada
Caja de 1000 UI
NDC 0169 8100 01 List: 810001
- ESPEROCT®1000 IU Range
[antihemophilic factor (recombinant), glycopegylated-exei]
1000 IU
Uso intravenoso, después de la reconstitución.
Dosis única. Deseche la porción no utilizada
No contiene conservantes.
Rx Only
Incluye MixPro®
un adaptador de vial y una jeringa de diluyente precargada
Caja de 1500 UI
NDC 0169 8150 01 List: 815001
- ESPEROCT®1500 IU Range
[antihemophilic factor (recombinant), glycopegylated-exei]
1500 IU
Uso intravenoso, después de la reconstitución.
Dosis única. Deseche la porción no utilizada
No contiene conservantes.
Rx Only
Incluye MixPro®
un adaptador de vial y una jeringa de diluyente precargada
Envase de 2000 UI
NDC 0169 8200 01
List: 820001
- ESPEROCT®2000 IU Range
[antihemophilic factor (recombinant), glycopegylated-exei]
2000 IU
Uso intravenoso, después de la reconstitución.
Monodosis. Deseche la porción no utilizada
No contiene conservantes.
Rx Only
Incluye MixPro®
un adaptador de vial y una jeringa de diluyente precargada
Caja de 3000 UI
NDC 0169 8300 01
List: 830001
- ESPEROCT®3000 IU Range
[antihemophilic factor (recombinant), glycopegylated-exei]
3000 IU
Uso intravenoso, después de la reconstitución.
Dosis única. Deseche la porción no utilizada
No contiene conservantes.
Rx Only
Incluye MixPro®
un adaptador de vial y una jeringa de diluyente precargada
Caja de 4000 UI
- NDC 0169-8400-01 List: 840001
ESPEROCT®
Rango de 4000 UI
[factor antihemofílico
(recombinante), glicopegilado-exei]
4000 UI- Uso intravenoso, después de la reconstitución.
Monodosis. Deseche la porción no utilizada.
No contiene conservantes. Solo con receta médica
Incluye MixPro®
un adaptador de vial y una jeringa de diluyente precargadaCaja de 5000 UI
- NDC 0169-8055-01 List: 805501
ESPEROCT®
5000 UI Rango
[antihemophilic factor
(recombinant), glycopegylated-exei]5000 UI
- Uso intravenoso, después de la reconstitución.
Dosis única. Deseche la porción no utilizada.
No contiene conservantes. Rx Only
Incluye MixPro®
un adaptador de vial y una jeringa de diluyente precargadaTags: F10