Fabricante de medicamentos: Immunex Corporation (Updated: 2024-11-04)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
ENBREL® (etanercept) inyección, para uso subcutáneo
ENBREL® (etanercept) para inyección, para uso subcutáneo
Aprobación inicial en EE. UU.: 1998
ADVERTENCIA: INFECCIONES GRAVES Y MALIGNIDADES
Consulte la información completa de prescripción para obtener la advertencia completa en recuadro.
INFECCIONES GRAVES
- Aumento del riesgo de infecciones graves que requieren hospitalización o la muerte, incluida la tuberculosis (TB), la sepsis bacteriana, las infecciones fúngicas invasivas (como la histoplasmosis) y las infecciones debidas a otros patógenos oportunistas. (5.1)
- Enbrel debe suspenderse si un paciente desarrolla una infección grave o sepsis durante el tratamiento. (5.1)
- Realice una prueba para detectar TB latente; si es positiva, comience el tratamiento para la TB antes de comenzar con Enbrel. (5.1)
- Controle a todos los pacientes para detectar TB activa durante el tratamiento, incluso si la prueba inicial de TB latente es negativa. (5.1)
MALIGNIDADES
- Se han notificado linfoma y otras malignidades, algunas fatales, en niños y adolescentes tratados con bloqueadores del TNF, incluido Enbrel. (5.3)
CAMBIOS MAYORES RECIENTES
INDICACIONES Y USO
DOSIS Y ADMINISTRACIÓN
Enbrel se administra mediante inyección subcutánea.
| Población de pacientes | Dosis y frecuencia recomendadas |
|---|---|
| AR y PsA en adultos (2.3) | 50 mg una vez por semana con o sin metotrexato (MTX) |
| AS (2.3) | 50 mg una vez por semana |
| PsO en adultos (2.3) | 50 mg dos veces por semana durante 3 meses, seguido de 50 mg una vez por semana |
| pJIA, PsO pediátrica y JPsA (2.4) | 0,8 mg/kg semanal, con un máximo de 50 mg por semana |
FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
- Inyección: solución de 25 mg/0.5 mL y 50 mg/mL en una jeringa precargada de dosis única (3)
- Inyección: solución de 50 mg/mL en un autoinyector SureClick® precargado de dosis única (3)
- Inyección: solución de 25 mg/0.5 mL en un vial de dosis única (3)
- Para inyección: polvo liofilizado de 25 mg en un vial de dosis múltiple para reconstitución (3)
- Inyección: solución de 50 mg/mL en un cartucho precargado de dosis única Enbrel Mini® para uso exclusivo con el autoinyector reutilizable AutoTouch® (3)
CONTRAINDICACIONES
Enbrel está contraindicado en pacientes con sepsis. (4)
ADVERTENCIAS Y PRECAUCIONES
- No inicie Enbrel durante una infección activa. Si se desarrolla una infección, controle cuidadosamente y suspenda Enbrel si la infección se vuelve grave. (5.1)
- Considere la terapia antifúngica empírica para pacientes con riesgo de infecciones fúngicas invasivas que desarrollan una enfermedad sistémica grave con Enbrel (aquellos que residen o viajan a regiones donde las micosis son endémicas). (5.1)
- Puede ocurrir enfermedad desmielinizante, exacerbación o aparición de nueva. (5.2)
- Se han observado casos de linfoma en pacientes que reciben agentes bloqueadores del TNF. (5.3)
- Puede ocurrir insuficiencia cardíaca congestiva, empeoramiento o aparición de nueva. (5.4)
- Avise a los pacientes que busquen atención médica inmediata si desarrollan síntomas de pancitopenia o anemia aplásica, y considere suspender Enbrel. (5.5)
- Controle a los pacientes previamente infectados con el virus de la hepatitis B para detectar la reactivación durante y varios meses después de la terapia. Si ocurre reactivación, considere suspender Enbrel y comenzar la terapia antiviral. (5.6)
- Puede ocurrir anafilaxia o reacciones alérgicas graves. (5.7)
- Suspenda Enbrel si se desarrolla síndrome similar al lupus o hepatitis autoinmune. (5.9)
REACCIONES ADVERSAS
Reacciones adversas más comunes (incidencia > 5%): infecciones y reacciones en el sitio de inyección. (6.1)
Para informar sobre REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Amgen Inc. al 1-800-77-AMGEN (1-800-772-6436) o la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES MEDICAMENTOSAS
Ver 17 para INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y Guía de medicamentos.
Revisado: 9/2024
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
ADVERTENCIA: INFECCIONES GRAVES Y MALIGNIDADES
1 INDICACIONES Y USO
1.1 Artritis Reumatoide
1.2 Artritis Idiopática Juvenil Poliarticular
1.3 Artritis Psoriásica
1.4 Espondilitis Anquilosante
1.5 Psoriasis en Placas
1.6 Artritis Psoriásica Juvenil
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Pruebas y Procedimientos Antes del Inicio del Tratamiento
2.2 Instrucciones Importantes de Administración
2.3 Dosis Recomendada en Pacientes Adultos con Artritis Reumatoide, Espondilitis Anquilosante, Artritis Psoriásica y Psoriasis en Placas
2.4 Dosis Recomendada para Pacientes Pediátricos con Artritis Idiopática Juvenil Poliarticular, Psoriasis en Placas y Artritis Psoriásica Juvenil
2.5 Instrucciones de Preparación para Enbrel
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Infecciones Graves
5.2 Reacciones Neurológicas
5.3 Malignidades
5.4 Inicio Nuevo o Empeoramiento de la Insuficiencia Cardíaca
5.5 Reacciones Hematológicas
5.6 Reactivación de la Hepatitis B
5.7 Reacciones Alérgicas
5.8 Inmunizaciones
5.9 Autoinmunidad
5.10 Inmunosupresión
5.11 No se Recomienda para el Uso en Pacientes con Granulomatosis con Poliangiitis que Reciben Inmunosupresores
5.12 No se Recomienda para el Uso con Anakinra o Abatacept
5.13 Aumento de la Mortalidad en Pacientes con Hepatitis Alcohólica Moderada a Grave
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Inmunogenicidad
6.3 Experiencia Postcomercialización
7 INTERACCIONES MEDICAMENTOSAS
7.1 Vacunas
7.2 Productos Biológicos Inmunomoduladores
7.3 Ciclofosfamida
7.4 Sulfasalazina
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
8.6 Uso en Pacientes con Diabetes
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Artritis Reumatoide en Adultos
14.2 Artritis Idiopática Juvenil (AIJ) Poliarticular
14.3 Artritis Psoriásica
14.4 Espondilitis Anquilosante
14.5 Psoriasis en Placas en Adultos
14.6 Psoriasis en Placas Pediátrica
15 REFERENCIAS
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
ADVERTENCIA EN EL RECUADRO
ADVERTENCIA: INFECCIONES GRAVES Y MALIGNIDADES
INFECCIONES GRAVES
Los pacientes tratados con Enbrel tienen un mayor riesgo de desarrollar infecciones graves que pueden llevar a la hospitalización o la muerte [ver Advertencias y precauciones (5.1) y Reacciones adversas (6)]. La mayoría de los pacientes que desarrollaron estas infecciones estaban tomando inmunosupresores concomitantes como metotrexato o corticosteroides.
Enbrel debe suspenderse si un paciente desarrolla una infección grave o sepsis.
Las infecciones notificadas incluyen:
- Tuberculosis activa, incluida la reactivación de la tuberculosis latente. Los pacientes con tuberculosis con frecuencia han presentado enfermedad diseminada o extrapulmonar. Realice pruebas a los pacientes para detectar tuberculosis latente antes de usar Enbrel y durante la terapia. Inicie el tratamiento para la infección latente antes de usar Enbrel.
- Infecciones fúngicas invasivas, incluidas histoplasmosis, coccidioidomicosis, candidiasis, aspergilosis, blastomicosis y neumocistosis. Los pacientes con histoplasmosis u otras infecciones fúngicas invasivas pueden presentar enfermedad diseminada, en lugar de localizada. Las pruebas de antígenos y anticuerpos para histoplasmosis pueden ser negativas en algunos pacientes con infección activa. Considere la terapia antifúngica empírica en pacientes con riesgo de infecciones fúngicas invasivas que desarrollan enfermedad sistémica grave.
- Infecciones bacterianas, virales y otras debido a patógenos oportunistas, incluidas Legionella y Listeria.
Los riesgos y beneficios del tratamiento con Enbrel deben considerarse cuidadosamente antes de iniciar la terapia en pacientes con infección crónica o recurrente.
Controle de cerca a los pacientes para detectar el desarrollo de signos y síntomas de infección durante y después del tratamiento con Enbrel, incluido el posible desarrollo de tuberculosis en pacientes que dieron negativo en la prueba de infección latente por tuberculosis antes de iniciar la terapia.
MALIGNIDADES
Se han notificado linfoma y otras malignidades, algunas fatales, en niños y adolescentes tratados con bloqueadores del TNF, incluido Enbrel.
1 INDICACIONES Y USO
1.1 Artritis Reumatoide
Enbrel está indicado para reducir los signos y síntomas, inducir una respuesta clínica mayor, inhibir la progresión del daño estructural y mejorar la función física en pacientes con artritis reumatoide (AR) activa de moderada a grave. Enbrel se puede iniciar en combinación con metotrexato (MTX) o utilizarse solo.
1.2 Artritis Idiopática Juvenil Poliarticular
Enbrel está indicado para reducir los signos y síntomas de la artritis idiopática juvenil poliarticular (pJIA) activa de moderada a grave en pacientes de 2 años de edad o mayores.
1.3 Artritis Psoriásica
Enbrel está indicado para reducir los signos y síntomas, inhibir la progresión del daño estructural de la artritis activa y mejorar la función física en pacientes adultos con artritis psoriásica (PsA). Enbrel se puede utilizar con o sin metotrexato.
1.4 Espondilitis Anquilosante
Enbrel está indicado para reducir los signos y síntomas en pacientes con espondilitis anquilosante (AS) activa.
1.5 Psoriasis en Placas
Enbrel está indicado para el tratamiento de pacientes de 4 años o mayores con psoriasis en placas crónica de moderada a grave que son candidatos a terapia sistémica o fototerapia.
1.6 Artritis Psoriásica Juvenil
Enbrel está indicado para el tratamiento de la artritis psoriásica juvenil (JPsA) activa en pacientes pediátricos de 2 años de edad o mayores.
2 DOSIS Y ADMINISTRACIÓN
2.1 Pruebas y procedimientos antes de iniciar el tratamiento
Realice las siguientes evaluaciones y procedimientos antes de iniciar el tratamiento con Enbrel:
- Antes de iniciar Enbrel y periódicamente durante la terapia, evalúe a los pacientes para detectar tuberculosis activa y realice pruebas para detectar infección latente [ver Advertencias y precauciones (5.1)].
- Complete todas las vacunas apropiadas para la edad, según lo recomendado por las pautas de inmunización actuales, antes de iniciar el tratamiento con Enbrel [ver Advertencias y precauciones (5.8)].
2.2 Instrucciones importantes de administración
La administración de una jeringa precargada de dosis única de Enbrel de 50 mg, un autoinyector precargado de dosis única de Enbrel SureClick o un cartucho precargado de dosis única de Enbrel Mini (para uso solo con el autoinyector reutilizable AutoTouch) proporciona una dosis equivalente a dos jeringas precargadas de dosis única de Enbrel de 25 mg, dos viales de dosis única de 25 mg o dos viales de dosis múltiple de Enbrel liofilizado, cuando los viales de dosis múltiple se reconstituyen y administran según lo recomendado.
2.3 Dosis recomendada en pacientes adultos con artritis reumatoide, espondilitis anquilosante, artritis psoriásica y psoriasis en placas
Enbrel se administra mediante inyección subcutánea (Tabla 1).
| Población de pacientes | Dosis recomendada |
|---|---|
| AR, EA y AP en adultos | 50 mg semanales |
| PsO en adultos | Dosis inicial: 50 mg dos veces por semana durante 3 meses Dosis de mantenimiento: 50 mg una vez por semana |
Consulte el folleto de “Instrucciones de uso” de Enbrel (etanercept) para obtener información detallada sobre la selección del sitio de inyección y la administración de la dosis [ver Dosis y administración (2.3) y Información para el paciente (17)].
Pacientes adultos con artritis reumatoide, espondilitis anquilosante y artritis psoriásica
El metotrexato, los glucocorticoides, los salicilatos, los fármacos antiinflamatorios no esteroideos (AINE) o los analgésicos pueden continuarse durante el tratamiento con Enbrel.
Basándose en un estudio de 50 mg de Enbrel dos veces por semana en pacientes con AR que sugirió una mayor incidencia de reacciones adversas pero tasas de respuesta similares del Colegio Estadounidense de Reumatología (ACR), no se recomiendan dosis superiores a 50 mg por semana.
Pacientes adultos con psoriasis en placas
Además de la dosis inicial recomendada de 50 mg dos veces por semana, se demostró que las dosis iniciales de 25 mg o 50 mg por semana eran eficaces. La proporción de respondedores estuvo relacionada con la dosis de Enbrel [ver Estudios clínicos (14.5)].
2.4 Dosis recomendada para pacientes pediátricos con artritis idiopática juvenil poliarticular, psoriasis en placas y artritis psoriásica juvenil
La dosis recomendada basada en el peso para pacientes pediátricos se administra mediante inyección subcutánea (Tabla 2).
| Peso corporal | Dosis recomendada |
|---|---|
| 63 kg (138 libras) o más | 50 mg semanales |
| Menos de 63 kg (138 libras) | 0,8 mg/kg semanales |
Para lograr dosis pediátricas distintas de 25 mg o 50 mg, use la solución de Enbrel en un vial de dosis única o polvo liofilizado reconstituido en un vial de dosis múltiple.
Las dosis de Enbrel superiores a las descritas en la Tabla 2 no se han estudiado en pacientes pediátricos.
En pacientes con AJI, los glucocorticoides, los AINE o los analgésicos pueden continuarse durante el tratamiento con Enbrel.
2.5 Instrucciones de preparación para Enbrel
Enbrel está destinado a ser utilizado bajo la guía y supervisión de un médico. Los pacientes pueden autoinyectarse cuando se considere apropiado y si reciben seguimiento médico, según sea necesario. Los pacientes no deben autoadministrarse hasta que reciban una capacitación adecuada sobre cómo preparar y administrar la dosis correcta. Administre las inyecciones por vía subcutánea en el muslo, el abdomen o la zona externa de la parte superior del brazo.
Los dispositivos Enbrel no están hechos con látex de caucho natural.
El folleto de “Instrucciones de uso” de Enbrel (etanercept) para cada presentación contiene instrucciones más detalladas sobre la selección del sitio de inyección y la preparación de Enbrel.
Preparación de la jeringa precargada de dosis única de Enbrel
Para una inyección más cómoda, deje las jeringas precargadas de Enbrel a temperatura ambiente durante unos 15 a 30 minutos antes de inyectar. NO retire la cubierta de la aguja mientras permite que la jeringa precargada alcance la temperatura ambiente.
Inspeccione visualmente la presencia de partículas y decoloración antes de la administración. Puede haber pequeñas partículas blancas de proteína en la solución. Esto no es inusual para las soluciones proteicas. La solución no debe utilizarse si está decolorada o turbia, o si hay partículas extrañas presentes.
Cuando utilice la jeringa precargada de dosis única de Enbrel, compruebe si la cantidad de líquido en la jeringa precargada se encuentra entre las dos líneas indicadoras de nivel de llenado púrpura de la jeringa. Si la jeringa no tiene la cantidad correcta de líquido, NO UTILICE ESA JERINGA.
Preparación del autoinyector SureClick de dosis única de Enbrel
Deje el autoinyector a temperatura ambiente durante al menos 30 minutos antes de inyectar. NO retire la cubierta de la aguja mientras permite que la jeringa precargada alcance la temperatura ambiente.
Inspeccione visualmente la presencia de partículas y decoloración antes de la administración. Puede haber pequeñas partículas blancas de proteína en la solución. Esto no es inusual para las soluciones proteicas. La solución no debe utilizarse si está decolorada o turbia, o si hay partículas extrañas presentes.
Preparación del vial de dosis única de Enbrel
Para una inyección más cómoda, deje el vial (los viales) de Enbrel a temperatura ambiente durante al menos 30 minutos antes de inyectar. NO retire la tapa del vial mientras permite que el vial alcance la temperatura ambiente.
Inspeccione visualmente la presencia de partículas y decoloración antes de la administración. Puede haber pequeñas partículas blancas de proteína en la solución. Esto no es inusual para las soluciones proteicas. La solución no debe utilizarse si está decolorada o turbia, o si hay partículas extrañas presentes.
Cuando utilice el vial de dosis única de Enbrel, administre la dosis correcta de solución utilizando los siguientes materiales recomendados:
- Una jeringa Luer-Lock de 1 mL.
- Una aguja de extracción con conexión Luer-Lock, estéril, de calibre 22, longitud de 1 ½ pulgada.
- Una aguja de inyección con conexión Luer-Lock, estéril, de calibre 27, longitud de ½ pulgada.
Es posible que se necesiten dos viales para administrar la dosis total prescrita. Utilice la misma jeringa para cada vial. El vial no contiene conservantes; por lo tanto, deseche las porciones no utilizadas.
Preparación del polvo liofilizado de Enbrel en un vial de dosis múltiple
El polvo liofilizado de Enbrel debe reconstituirse asépticamente con 1 mL del Agua Estéril para Inyección Bacteriostática, USP (0,9% de alcohol bencílico) suministrada, dando una solución de 1 mL que contiene 25 mg de Enbrel.
Se suministra un adaptador de vial para su uso al reconstituir el polvo liofilizado. Sin embargo, el adaptador de vial no debe utilizarse si se van a extraer dosis múltiples del vial. Si el vial se va a utilizar para dosis múltiples, se debe utilizar una aguja de calibre 25 para reconstituir y extraer Enbrel, y la etiqueta “Fecha de mezcla:” suministrada debe colocarse en el vial y la fecha de reconstitución debe introducirse. La solución reconstituida debe refrigerarse a 36°F a 46°F (2°C a 8°C) y utilizarse en un plazo de 14 días. Deseche la solución reconstituida después de 14 días porque la estabilidad y la esterilidad del producto no pueden garantizarse después de 14 días. NO almacene la solución reconstituida de Enbrel a temperatura ambiente.
Para una inyección más cómoda, deje la bandeja de dosis de Enbrel a temperatura ambiente durante unos 15 a 30 minutos antes de inyectar.
Si utiliza el adaptador de vial, gire el adaptador de vial sobre la jeringa de diluyente. A continuación, coloque el adaptador de vial sobre el vial de Enbrel e inserte el adaptador de vial en el tapón del vial. Empuje hacia abajo el émbolo para inyectar el diluyente en el vial de Enbrel. Si utiliza una aguja de calibre 25 para reconstituir y extraer Enbrel, el diluyente debe inyectarse muy lentamente en el vial de Enbrel. Es normal que se produzca cierta espuma. Con la jeringa de diluyente en su lugar, agite suavemente el contenido del vial de Enbrel durante la disolución. Para evitar una espuma excesiva, no agite ni agite vigorosamente.
Generalmente, la disolución de Enbrel tarda menos de 10 minutos. No utilice la solución si está decolorada o turbia, o si quedan partículas.
Extraiga la dosis correcta de solución reconstituida en la jeringa. Puede quedar algo de espuma o burbujas en el vial. Retire la jeringa del adaptador de vial o retire la aguja de calibre 25 de la jeringa. Conecte una aguja de calibre 27 para inyectar Enbrel.
El contenido de un vial de solución de Enbrel no debe mezclarse ni transferirse al contenido de otro vial de Enbrel. No deben añadirse otros medicamentos a las soluciones que contengan Enbrel, y no reconstituya Enbrel con otros diluyentes. No filtre la solución reconstituida durante la preparación o la administración.
Preparación del cartucho prellenado de dosis única Enbrel Mini® utilizando el autoinyector reutilizable AutoTouch®
Deje el cartucho prellenado de dosis única Enbrel Mini a temperatura ambiente durante al menos 30 minutos antes de inyectarlo. NO retire la tapa morada mientras permite que el cartucho alcance la temperatura ambiente.
Los productos farmacéuticos parenterales deben inspeccionarse visualmente para detectar partículas y decoloración antes de la administración. Puede haber pequeñas partículas blancas de proteína en la solución. Esto no es inusual para las soluciones proteicas. La solución no debe utilizarse si está descolorida o turbia, o si hay partículas extrañas presentes.
Para utilizar el autoinyector reutilizable AutoTouch, abra la puerta presionando el botón de la puerta e insertando el cartucho prellenado de dosis única Enbrel Mini en AutoTouch. Cuando se inserta correctamente, el cartucho prellenado de dosis única Enbrel Mini se deslizará libremente y completamente en la puerta. Cierre la puerta y el autoinyector reutilizable AutoTouch estará listo para la inyección.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
- Inyección: 25 mg/0.5 mL y 50 mg/mL solución transparente e incolora en una jeringa precargada de dosis única
- Inyección: 50 mg/mL solución transparente e incolora en un autoinyector SureClick precargado de dosis única
- Inyección: 25 mg/0.5 mL solución transparente e incolora en un vial de dosis única
- Para inyección: 25 mg de polvo liofilizado en un vial de dosis múltiple para reconstitución
- Inyección: 50 mg/mL solución transparente e incolora en un cartucho precargado de dosis única Enbrel Mini para uso exclusivo con el autoinyector reutilizable AutoTouch
4 CONTRAINDICACIONES
Enbrel está contraindicado en pacientes con sepsis.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Infecciones graves
Los pacientes tratados con Enbrel tienen un mayor riesgo de desarrollar infecciones graves que afectan a varios sistemas y sitios de órganos que pueden provocar hospitalización o muerte.
Se han notificado infecciones oportunistas debidas a bacterias, micobacterias, hongos invasivos, virus, parásitos u otros patógenos oportunistas, incluida la aspergilosis, blastomicosis, candidiasis, coccidioidomicosis, histoplasmosis, legionelosis, listeriosis, neumocistosis y tuberculosis con los bloqueadores del TNF. Los pacientes con frecuencia han presentado enfermedad diseminada en lugar de localizada.
No se debe iniciar el tratamiento con Enbrel en pacientes con una infección activa, incluidas las infecciones localizadas clínicamente importantes. Los pacientes mayores de 65 años, los pacientes con afecciones concomitantes y/o los pacientes que toman inmunosupresores concomitantes (como corticosteroides o metotrexato) pueden tener un mayor riesgo de infección. Los riesgos y beneficios del tratamiento deben considerarse antes de iniciar la terapia en pacientes:
- Con infección crónica o recurrente;
- Que han estado expuestos a la tuberculosis;
- Con antecedentes de una infección oportunista;
- Que han residido o viajado a áreas de tuberculosis endémica o micosis endémicas, como histoplasmosis, coccidioidomicosis o blastomicosis; o
- Con afecciones subyacentes que pueden predisponerlos a la infección, como diabetes avanzada o mal controlada [ver Reacciones adversas (6.1)].
Los pacientes deben ser monitoreados de cerca para detectar el desarrollo de signos y síntomas de infección durante y después del tratamiento con Enbrel.
Enbrel debe suspenderse si un paciente desarrolla una infección grave o sepsis. Un paciente que desarrolla una nueva infección durante el tratamiento con Enbrel debe ser monitoreado de cerca, someterse a una evaluación diagnóstica rápida y completa apropiada para un paciente inmunocomprometido, y debe iniciarse una terapia antimicrobiana apropiada.
Tuberculosis
Se han observado casos de reactivación de la tuberculosis o nuevas infecciones por tuberculosis en pacientes que reciben Enbrel, incluidos pacientes que previamente recibieron tratamiento para la tuberculosis latente o activa. Los datos de ensayos clínicos y estudios preclínicos sugieren que el riesgo de reactivación de la infección latente por tuberculosis es menor con Enbrel que con los anticuerpos monoclonales bloqueadores del TNF. No obstante, se han notificado casos de reactivación de la tuberculosis posteriores a la comercialización para los bloqueadores del TNF, incluido Enbrel. La tuberculosis se ha desarrollado en pacientes que dieron negativo en la prueba de tuberculosis latente antes de iniciar la terapia. Los pacientes deben ser evaluados para detectar factores de riesgo de tuberculosis y deben realizarse pruebas para detectar la infección latente antes de iniciar Enbrel y periódicamente durante la terapia. Las pruebas para la infección latente por tuberculosis pueden ser falsamente negativas mientras se está en terapia con Enbrel.
El tratamiento de la infección latente por tuberculosis antes de la terapia con agentes bloqueadores del TNF ha demostrado reducir el riesgo de reactivación de la tuberculosis durante la terapia. La induración de 5 mm o más con la prueba cutánea de tuberculina debe considerarse un resultado positivo de la prueba al evaluar si se necesita tratamiento para la tuberculosis latente antes de iniciar Enbrel, incluso para pacientes previamente vacunados con Bacillus Calmette-Guerin (BCG).
También se debe considerar la terapia antituberculosa antes de iniciar Enbrel en pacientes con antecedentes de tuberculosis latente o activa en quienes no se puede confirmar un curso de tratamiento adecuado, y para pacientes con una prueba negativa para la tuberculosis latente pero que tienen factores de riesgo de infección por tuberculosis. Se recomienda consultar con un médico con experiencia en el tratamiento de la tuberculosis para ayudar a decidir si es apropiado iniciar la terapia antituberculosa para un paciente individual.
La tuberculosis debe considerarse seriamente en pacientes que desarrollan una nueva infección durante el tratamiento con Enbrel, especialmente en pacientes que previamente o recientemente han viajado a países con una alta prevalencia de tuberculosis, o que han tenido contacto cercano con una persona con tuberculosis activa.
Infecciones fúngicas invasivas
Se han notificado casos de infecciones fúngicas graves y, a veces, mortales, incluida la histoplasmosis, con los bloqueadores del TNF, incluido Enbrel. Para los pacientes que residen o viajan a regiones donde las micosis son endémicas, se debe sospechar una infección fúngica invasiva si desarrollan una enfermedad sistémica grave. Se debe considerar la terapia antifúngica empírica apropiada mientras se realiza una evaluación diagnóstica. Las pruebas de antígeno y anticuerpos para la histoplasmosis pueden ser negativas en algunos pacientes con infección activa. Cuando sea factible, la decisión de administrar terapia antifúngica empírica en estos pacientes debe tomarse en consulta con un médico con experiencia en el diagnóstico y tratamiento de infecciones fúngicas invasivas y debe tener en cuenta tanto el riesgo de infección fúngica grave como los riesgos de la terapia antifúngica. En 38 ensayos clínicos de Enbrel y 4 estudios de cohortes en todas las indicaciones aprobadas que representan 27,169 años-paciente de exposición (17,696 pacientes) de los Estados Unidos y Canadá, no se notificaron infecciones por histoplasmosis entre los pacientes tratados con Enbrel.
5.2 Reacciones neurológicas
El tratamiento con agentes bloqueadores del TNF, incluido Enbrel, se ha asociado con casos raros (< 0.1%) de aparición de nuevos trastornos desmielinizantes del sistema nervioso central o exacerbación de los mismos, algunos de los cuales se presentan con cambios en el estado mental y algunos asociados con discapacidad permanente, y con trastornos desmielinizantes del sistema nervioso periférico. Se han notificado casos de mielitis transversa, neuritis óptica, esclerosis múltiple, síndromes de Guillain-Barré, otras neuropatías desmielinizantes periféricas y aparición de nuevos trastornos convulsivos o exacerbación de los mismos en la experiencia posterior a la comercialización con la terapia con Enbrel. Los prescriptores deben tener precaución al considerar el uso de Enbrel en pacientes con trastornos desmielinizantes preexistentes o de reciente aparición del sistema nervioso central o periférico [ver Experiencia posterior a la comercialización (6.3)].
5.3 Neoplasias
Linfomas
En las porciones controladas de los ensayos clínicos de agentes bloqueadores del TNF, se han observado más casos de linfoma entre los pacientes que recibieron un bloqueador del TNF en comparación con los pacientes control. Durante las porciones controladas de los ensayos de Enbrel en pacientes adultos con AR, AS y PsA, se observaron 2 linfomas entre 3306 pacientes tratados con Enbrel en comparación con 0 entre 1521 pacientes control (la duración del tratamiento controlado varió de 3 a 36 meses).
Entre 6543 pacientes adultos de reumatología (AR, PsA, AS) tratados con Enbrel en porciones controladas y no controladas de ensayos clínicos, que representan aproximadamente 12,845 años-paciente de terapia, la tasa observada de linfoma fue de 0.10 casos por cada 100 años-paciente. Esto fue 3 veces más alto que la tasa de linfoma esperada en la población general de EE. UU. según la base de datos de Vigilancia, Epidemiología y Resultados Finales (SEER). Se ha informado una tasa aumentada de linfoma hasta varias veces en la población de pacientes con AR, y puede aumentar aún más en pacientes con actividad de la enfermedad más grave.
Entre 4410 pacientes adultos con PsO tratados con Enbrel en ensayos clínicos de hasta 36 meses, que representan aproximadamente 4278 años-paciente de terapia, la tasa observada de linfoma fue de 0.05 casos por cada 100 años-paciente, lo que es comparable a la tasa en la población general. No se observaron casos en pacientes tratados con Enbrel o placebo durante las porciones controladas de estos ensayos.
Leucemia
Se han notificado casos de leucemia aguda y crónica en asociación con el uso de bloqueadores del TNF posterior a la comercialización en la artritis reumatoide y otras indicaciones. Incluso en ausencia de terapia con bloqueadores del TNF, los pacientes con artritis reumatoide pueden tener un riesgo más alto (aproximadamente 2 veces) que la población general para el desarrollo de leucemia.
Durante las porciones controladas de los ensayos de Enbrel, se observaron 2 casos de leucemia entre 5445 (0.06 casos por cada 100 años-paciente) pacientes tratados con Enbrel en comparación con 0 entre 2890 (0%) pacientes control (la duración del tratamiento controlado varió de 3 a 48 meses).
Entre 15,401 pacientes tratados con Enbrel en porciones controladas y abiertas de ensayos clínicos que representan aproximadamente 23,325 años-paciente de terapia, la tasa observada de leucemia fue de 0.03 casos por cada 100 años-paciente.
Otras Neoplasias
Hay información disponible de 10,953 pacientes adultos con 17,123 años-paciente y 696 pacientes pediátricos con 1282 años-paciente de experiencia en 45 estudios clínicos de Enbrel.
Para las neoplasias distintas del linfoma y el cáncer de piel no melanoma, no hubo diferencia en las tasas ajustadas a la exposición entre los brazos de Enbrel y control en las porciones controladas de los estudios clínicos para todas las indicaciones. El análisis de la tasa de neoplasia en las porciones combinadas controladas y no controladas de los estudios ha demostrado que los tipos y las tasas son similares a lo que se espera en la población general de EE. UU. según la base de datos SEER y sugiere que no hay un aumento en las tasas con el tiempo. Se desconoce si el tratamiento con Enbrel podría influir en el desarrollo y el curso de las neoplasias en adultos.
Melanoma y Cáncer de Piel No Melanoma (CPNM)
Se ha informado melanoma y cáncer de piel no melanoma en pacientes tratados con antagonistas del TNF, incluido el etanercept.
Entre 15,401 pacientes tratados con Enbrel en porciones controladas y abiertas de ensayos clínicos que representan aproximadamente 23,325 años-paciente de terapia, la tasa observada de melanoma fue de 0.043 casos por cada 100 años-paciente.
Entre 3306 pacientes adultos de reumatología (AR, PsA, AS) tratados con Enbrel en ensayos clínicos controlados que representan aproximadamente 2669 años-paciente de terapia, la tasa observada de CPNM fue de 0.41 casos por cada 100 años-paciente en comparación con 0.37 casos por cada 100 años-paciente entre 1521 pacientes tratados con control que representan 1077 años-paciente. Entre 1245 pacientes adultos con PsO tratados con Enbrel en ensayos clínicos controlados, que representan aproximadamente 283 años-paciente de terapia, la tasa observada de CPNM fue de 3.54 casos por cada 100 años-paciente en comparación con 1.28 casos por cada 100 años-paciente entre 720 pacientes tratados con control que representan 156 años-paciente.
Se han notificado casos posteriores a la comercialización de carcinoma de células de Merkel con muy poca frecuencia en pacientes tratados con Enbrel.
Se deben considerar los exámenes periódicos de la piel para todos los pacientes con mayor riesgo de cáncer de piel.
Pacientes pediátricos
Se han notificado neoplasias, algunas fatales, entre niños, adolescentes y adultos jóvenes que recibieron tratamiento con agentes bloqueadores del TNF (inicio de la terapia a los ≤ 18 años de edad), incluido Enbrel. Aproximadamente la mitad de los casos fueron linfomas, incluidos el linfoma de Hodgkin y el linfoma no Hodgkin. Los otros casos representaron una variedad de neoplasias diferentes e incluyeron neoplasias raras generalmente asociadas con la inmunosupresión y neoplasias que generalmente no se observan en niños y adolescentes. Las neoplasias ocurrieron después de una mediana de 30 meses de terapia (rango de 1 a 84 meses). La mayoría de los pacientes estaban recibiendo inmunosupresores concomitantes. Estos casos se notificaron después de la comercialización y se derivan de una variedad de fuentes, incluidos los registros y los informes espontáneos posteriores a la comercialización.
En ensayos clínicos de 1140 pacientes pediátricos que representan 1927.2 años-paciente de terapia, no se han notificado neoplasias, incluido el linfoma o el CPNM.
5.4 Aparición o empeoramiento de la insuficiencia cardíaca
Dos ensayos clínicos que evaluaban el uso de Enbrel en el tratamiento de la insuficiencia cardíaca se interrumpieron prematuramente debido a la falta de eficacia. Uno de estos estudios sugirió una mayor mortalidad en los pacientes tratados con Enbrel en comparación con el placebo [ver Reacciones adversas (6.2)]. Se han notificado casos postcomercialización de empeoramiento de la insuficiencia cardíaca congestiva (ICC), con y sin factores precipitantes identificables, en pacientes que toman Enbrel. También se han notificado casos raros (< 0,1%) de aparición de nueva ICC, incluida la ICC en pacientes sin enfermedad cardiovascular preexistente conocida. Algunos de estos pacientes tenían menos de 50 años. Los médicos deben tener precaución al usar Enbrel en pacientes que también tienen insuficiencia cardíaca y controlar cuidadosamente a los pacientes.
5.5 Reacciones hematológicas
Se han notificado casos raros (< 0,1%) de pancitopenia, incluidos casos muy raros (< 0,01%) de anemia aplásica, algunos con desenlace fatal, en pacientes tratados con Enbrel. La relación causal con el tratamiento con Enbrel no está clara. Aunque no se ha identificado ningún grupo de alto riesgo, se debe tener precaución en los pacientes tratados con Enbrel que tengan antecedentes de anomalías hematológicas significativas. Se debe aconsejar a todos los pacientes que busquen atención médica inmediata si desarrollan signos y síntomas sugestivos de discrasias sanguíneas o infección (p. ej., fiebre persistente, hematomas, hemorragia, palidez) mientras toman Enbrel. Se debe considerar la interrupción del tratamiento con Enbrel en pacientes con anomalías hematológicas significativas confirmadas.
El dos por ciento de los pacientes tratados simultáneamente con Enbrel y anakinra desarrollaron neutropenia (ANC < 1 × 109/L). Mientras estuvo neutropénico, un paciente desarrolló celulitis que se resolvió con terapia antibiótica.
5.6 Reactivación de la hepatitis B
Se ha notificado la reactivación de la hepatitis B en pacientes que previamente estaban infectados con el virus de la hepatitis B (VHB) y habían recibido agentes bloqueadores del TNF concomitantes, incluidos casos muy raros (< 0,01%) con Enbrel. En algunos casos, la reactivación de la hepatitis B que ocurre junto con la terapia con bloqueadores del TNF ha sido fatal. La mayoría de estos informes se han producido en pacientes que reciben concomitantemente otros medicamentos que suprimen el sistema inmunitario, lo que también puede contribuir a la reactivación de la hepatitis B. Los pacientes con riesgo de infección por VHB deben evaluarse para detectar evidencia previa de infección por VHB antes de iniciar el tratamiento con bloqueadores del TNF. Los médicos deben tener precaución al recetar bloqueadores del TNF en pacientes previamente infectados con VHB. No hay datos suficientes disponibles sobre la seguridad o la eficacia del tratamiento de pacientes portadores del VHB con terapia antiviral junto con la terapia con bloqueadores del TNF para prevenir la reactivación del VHB. Los pacientes previamente infectados con VHB que requieran tratamiento con Enbrel deben controlarse estrechamente para detectar signos clínicos y de laboratorio de infección activa por VHB durante todo el tratamiento y durante varios meses después de la finalización del tratamiento. En los pacientes que desarrollan reactivación del VHB, se debe considerar la interrupción de Enbrel e iniciar una terapia antiviral con el tratamiento de apoyo adecuado. No se conoce la seguridad de reanudar el tratamiento con Enbrel después de que se controle la reactivación del VHB. Por lo tanto, los médicos deben sopesar los riesgos y beneficios al considerar la reanudación del tratamiento en esta situación.
5.7 Reacciones alérgicas
Se han notificado reacciones alérgicas asociadas con la administración de Enbrel durante los ensayos clínicos en < 2% de los pacientes. Si se produce una reacción anafiláctica u otra reacción alérgica grave, interrumpa la administración de Enbrel e inicie inmediatamente el tratamiento adecuado.
5.8 Inmunizaciones
Evite la administración concomitante de vacunas vivas con Enbrel. Se recomienda que los pacientes, si es posible, se pongan al día con todas las inmunizaciones de acuerdo con las pautas de inmunización actuales antes de iniciar el tratamiento con Enbrel [ver Interacciones medicamentosas (7.1) y Uso en poblaciones específicas (8.4)].
5.9 Autoinmunidad
El tratamiento con Enbrel puede provocar la formación de autoanticuerpos [ver Reacciones adversas (6.1)] y, en raras ocasiones (< 0,1%), el desarrollo de un síndrome similar al lupus o hepatitis autoinmune [ver Reacciones adversas (6.2)], que pueden resolverse después de la retirada de Enbrel. Si un paciente desarrolla síntomas y hallazgos sugestivos de un síndrome similar al lupus o hepatitis autoinmune después del tratamiento con Enbrel, interrumpa el tratamiento y evalúe al paciente.
5.10 Inmunosupresión
El TNF media la inflamación y modula las respuestas inmunitarias celulares. Los agentes bloqueadores del TNF, incluido Enbrel, afectan las defensas del huésped contra las infecciones. El efecto de la inhibición del TNF sobre el desarrollo y el curso de las neoplasias malignas no se comprende completamente. En un estudio de 49 pacientes con AR tratados con Enbrel, no hubo evidencia de depresión de la hipersensibilidad de tipo retardado, depresión de los niveles de inmunoglobulina o cambio en la enumeración de las poblaciones de células efectoras [ver Advertencias y precauciones (5.1, 5.3) y Reacciones adversas (6.1)].
5.11 No se recomienda su uso en pacientes con granulomatosis con poliangiitis que reciben inmunosupresores
No se recomienda el uso de Enbrel en pacientes con granulomatosis con poliangiitis que reciben agentes inmunosupresores. En un estudio de pacientes con granulomatosis con poliangiitis, la adición de Enbrel a la terapia estándar (incluida la ciclofosfamida) se asoció con una mayor incidencia de neoplasias malignas sólidas no cutáneas y no se asoció con una mejoría de los resultados clínicos en comparación con la terapia estándar sola [ver Interacciones medicamentosas (7.3)].
5.12 No se recomienda su uso con anakinra o abatacept
No se recomienda el uso de Enbrel con anakinra o abatacept [ver Interacciones medicamentosas (7.2)].
5.13 Aumento de la mortalidad en pacientes con hepatitis alcohólica de moderada a grave
En un estudio de 48 pacientes hospitalizados tratados con Enbrel o placebo por hepatitis alcohólica de moderada a grave, la tasa de mortalidad en los pacientes tratados con Enbrel fue similar a la de los pacientes tratados con placebo a los 1 mes, pero significativamente mayor después de los 6 meses. Los médicos deben tener precaución al usar Enbrel en pacientes con hepatitis alcohólica de moderada a grave.
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas graves se analizan con mayor detalle en otras secciones de la etiqueta:
- Infecciones graves [ver Advertencias y precauciones (5.1)]
- Reacciones neurológicas [ver Advertencias y precauciones (5.2)]
- Neoplasias malignas [ver Advertencias y precauciones (5.3)]
- Pacientes con insuficiencia cardíaca [ver Advertencias y precauciones (5.4)]
- Reacciones hematológicas [ver Advertencias y precauciones (5.5)]
- Reactivación de la hepatitis B [ver Advertencias y precauciones (5.6)]
- Reacciones alérgicas [ver Advertencias y precauciones (5.7)]
- Autoinmunidad [ver Advertencias y precauciones (5.9)]
- Inmunosupresión [ver Advertencias y precauciones (5.10)]
6.1 Experiencia en ensayos clínicos
En los estudios clínicos y la experiencia postcomercialización, las reacciones adversas más graves con Enbrel fueron infecciones, eventos neurológicos, insuficiencia cardíaca y eventos hematológicos [ver Advertencias y precauciones (5)]. Las reacciones adversas más comunes con Enbrel fueron infecciones y reacciones en el sitio de inyección.
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y es posible que no predigan las tasas observadas en la práctica clínica.
Reacciones adversas en pacientes adultos con artritis reumatoide, artritis psoriásica, espondilitis anquilosante o psoriasis en placas
Los datos descritos a continuación reflejan la exposición a Enbrel en 2219 pacientes adultos con AR seguidos durante un máximo de 80 meses, en 182 pacientes con APs durante un máximo de 24 meses, en 138 pacientes con EA durante un máximo de 6 meses y en 1204 pacientes adultos con PsO durante un máximo de 18 meses.
En los ensayos controlados, la proporción de pacientes tratados con Enbrel que interrumpieron el tratamiento debido a eventos adversos fue aproximadamente del 4% en las indicaciones estudiadas.
Reacciones adversas en pacientes pediátricos
En general, las reacciones adversas en pacientes pediátricos fueron similares en frecuencia y tipo a las observadas en pacientes adultos [ver Advertencias y precauciones (5), Uso en poblaciones específicas (8.4), y Estudios clínicos (14.2, 14.6)].
En un estudio clínico de 48 semanas en 211 niños de 4 a 17 años con PsO pediátrica, las reacciones adversas notificadas fueron similares a las observadas en estudios previos en adultos con PsO. El perfil de seguridad a largo plazo durante un máximo de 264 semanas adicionales se evaluó en un estudio de extensión de etiqueta abierta y no se identificaron nuevas señales de seguridad.
En estudios clínicos de etiqueta abierta de niños con AII, las reacciones adversas notificadas en aquellos de 2 a 4 años fueron similares a las reacciones adversas notificadas en niños mayores.
Infecciones
Se han observado infecciones, incluidas infecciones virales, bacterianas y fúngicas, en pacientes adultos y pediátricos. Las infecciones se han observado en todos los sistemas corporales y se han notificado en pacientes que reciben Enbrel solo o en combinación con otros agentes inmunosupresores.
En las partes controladas de los ensayos, los tipos y la gravedad de la infección fueron similares entre Enbrel y el grupo de control respectivo (placebo o MTX para pacientes con AR y APs) en pacientes con AR, APs, EA y PsO. Las tasas de infecciones en pacientes con AR y PsO adultos se proporcionan en la Tabla 3 y la Tabla 4, respectivamente. Las infecciones consistieron principalmente en infección del tracto respiratorio superior, sinusitis e influenza.
En las partes controladas de los ensayos en AR, APs, EA y PsO, las tasas de infección grave fueron similares (0.8% en placebo, 3.6% en MTX y 1.4% en los grupos tratados con Enbrel/Enbrel + MTX). En los ensayos clínicos en indicaciones reumatológicas, las infecciones graves experimentadas por los pacientes han incluido, pero no se limitan a, neumonía, celulitis, artritis séptica, bronquitis, gastroenteritis, pielonefritis, sepsis, absceso y osteomielitis. En los ensayos clínicos en pacientes adultos con PsO, las infecciones graves experimentadas por los pacientes han incluido, pero no se limitan a, neumonía, celulitis, gastroenteritis, absceso y osteomielitis. La tasa de infecciones graves no aumentó en los ensayos de extensión de etiqueta abierta y fue similar a la observada en los pacientes tratados con Enbrel y placebo de los ensayos controlados.
En 66 ensayos clínicos globales de 17,505 pacientes (21,015 años-paciente de terapia), se observó tuberculosis en aproximadamente el 0.02% de los pacientes. En 17,696 pacientes (27,169 años-paciente de terapia) de 38 ensayos clínicos y 4 estudios de cohorte en los EE. UU. y Canadá, se observó tuberculosis en aproximadamente el 0.006% de los pacientes. Estos estudios incluyen informes de tuberculosis pulmonar y extrapulmonar [ver Advertencias y precauciones (5.1)].
Los tipos de infecciones notificadas en pacientes pediátricos con PsO y AII fueron generalmente leves y consistentes con las que se observan comúnmente en la población pediátrica general. Dos pacientes con AII desarrollaron infección por varicela y signos y síntomas de meningitis aséptica, que se resolvieron sin secuelas.
Reacciones en el sitio de inyección
En los ensayos controlados con placebo en indicaciones reumatológicas, aproximadamente el 37% de los pacientes tratados con Enbrel desarrollaron reacciones en el sitio de inyección. En los ensayos controlados en pacientes con PsO, el 15% de los pacientes adultos y el 7% de los pacientes pediátricos tratados con Enbrel desarrollaron reacciones en el sitio de inyección durante los primeros 3 meses de tratamiento. Todas las reacciones en el sitio de inyección se describieron como leves a moderadas (eritema, picazón, dolor, hinchazón, sangrado, moretones) y generalmente no requirieron la interrupción del medicamento. Las reacciones en el sitio de inyección generalmente ocurrieron en el primer mes y posteriormente disminuyeron en frecuencia. La duración media de las reacciones en el sitio de inyección fue de 3 a 5 días. El siete por ciento de los pacientes experimentaron enrojecimiento en un sitio de inyección anterior cuando se administraron inyecciones posteriores.
Otras reacciones adversas
La Tabla 3 resume las reacciones adversas notificadas en pacientes adultos con AR. Los tipos de reacciones adversas observadas en pacientes con PsA o AS fueron similares a los tipos de reacciones adversas observadas en pacientes con AR.
| Controlado con placebo* (Estudios I, II y un estudio de fase 2) |
Controlado con activo† (Estudio III) |
|||
|---|---|---|---|---|
| Placebo (N = 152) |
Enbrel‡ (N = 349) |
MTX (N = 217) |
Enbrel‡ (N = 415) |
|
| Reacción adversa | Porcentaje de pacientes | Porcentaje de pacientes | ||
|
||||
| Infección§ (total) | 39 | 50 | 86 | 81 |
| Infecciones respiratorias superiores¶ | 30 | 38 | 70 | 65 |
| Infecciones no respiratorias superiores | 15 | 21 | 59 | 54 |
| Reacciones en el sitio de inyección | 11 | 37 | 18 | 43 |
| Diarrea | 9 | 8 | 16 | 16 |
| Erupción | 2 | 3 | 19 | 13 |
| Prurito | 1 | 2 | 5 | 5 |
| Pirexia | – | 3 | 4 | 2 |
| Urticaria | 1 | – | 4 | 2 |
| Hipersensibilidad | – | – | 1 | 1 |
En los ensayos de PsO en adultos controlados con placebo, los porcentajes de pacientes que informaron reacciones adversas en el grupo de dosis de 50 mg dos veces por semana fueron similares a los observados en el grupo de dosis de 25 mg dos veces por semana o en el grupo placebo.
La Tabla 4 resume las reacciones adversas notificadas en pacientes adultos con PsO de los Estudios I y II.
| Placebo (N = 359) |
Enbrel* (N = 876) |
|
|---|---|---|
| Reacción adversa | Porcentaje de pacientes | |
|
||
| Infección† (total) | 28 | 27 |
| Infecciones no respiratorias superiores | 14 | 12 |
| Infecciones respiratorias superiores‡ | 17 | 17 |
| Reacciones en el lugar de la inyección | 6 | 15 |
| Diarrea | 2 | 3 |
| Erupción | 1 | 1 |
| Prurito | 2 | 1 |
| Urticaria | – | 1 |
| Hipersensibilidad | – | 1 |
| Pirexia | 1 | – |
6.2 Inmunogenicidad
Al igual que con todas las proteínas terapéuticas, existe la posibilidad de inmunogenicidad. La detección de la formación de anticuerpos depende en gran medida de la sensibilidad y la especificidad del ensayo. Además, la incidencia observada de positividad de anticuerpos (incluidos los anticuerpos neutralizantes) en un ensayo puede verse influenciada por varios factores, incluida la metodología del ensayo, el manejo de las muestras, el momento de la recolección de las muestras, los medicamentos concomitantes y la enfermedad subyacente. Por estas razones, la comparación de la incidencia de anticuerpos a etanercept en los estudios descritos a continuación con la incidencia de anticuerpos en otros estudios o con otros productos puede ser engañosa.
Inmunogenicidad
Los pacientes con AR, PsA, AS o PsO se analizaron en múltiples puntos de tiempo para detectar anticuerpos contra etanercept. Los anticuerpos contra la porción del receptor del TNF u otros componentes proteicos del producto farmacéutico Enbrel se detectaron al menos una vez en suero de aproximadamente el 6% de los pacientes adultos con AR, PsA, AS o PsO. Todos estos anticuerpos fueron no neutralizantes. Los resultados de los pacientes con AII fueron similares a los observados en pacientes adultos con AR tratados con Enbrel.
En estudios de PsO en adultos que evaluaron la exposición a etanercept durante un máximo de 120 semanas, el porcentaje de pacientes que dieron positivo en los puntos de tiempo evaluados de 24, 48, 72 y 96 semanas osciló entre el 3,6% y el 8,7% y todos fueron no neutralizantes. El porcentaje de pacientes que dieron positivo aumentó con el aumento de la duración del estudio; sin embargo, se desconoce la importancia clínica de este hallazgo. No se observó una correlación aparente del desarrollo de anticuerpos con la respuesta clínica o los eventos adversos. Se desconocen los datos de inmunogenicidad de Enbrel más allá de las 120 semanas de exposición.
En estudios de PsO pediátricos, aproximadamente el 10% de los sujetos desarrollaron anticuerpos contra etanercept en la semana 48 y aproximadamente el 16% de los sujetos desarrollaron anticuerpos contra etanercept en la semana 264. Todos estos anticuerpos fueron no neutralizantes. Sin embargo, debido a las limitaciones de los ensayos de inmunogenicidad, es posible que la incidencia de anticuerpos de unión y neutralización no se haya determinado de manera confiable.
Los datos reflejan el porcentaje de pacientes cuyos resultados de las pruebas se consideraron positivos para anticuerpos contra etanercept en un ensayo ELISA, y dependen en gran medida de la sensibilidad y la especificidad del ensayo.
Autoanticuerpos
Las muestras de suero de los pacientes con AR se analizaron para detectar autoanticuerpos en múltiples puntos de tiempo. En los estudios I y II de AR, el porcentaje de pacientes evaluados para detectar anticuerpos antinucleares (ANA) que desarrollaron nuevos ANA positivos (título ≥ 1:40) fue mayor en los pacientes tratados con Enbrel (11%) que en los pacientes tratados con placebo (5%). El porcentaje de pacientes que desarrollaron nuevos anticuerpos anti-ADN bicatenario positivos también fue mayor mediante radioinmunoensayo (15% de los pacientes tratados con Enbrel en comparación con el 4% de los pacientes tratados con placebo) y mediante ensayo de Crithidia luciliae (3% de los pacientes tratados con Enbrel en comparación con ninguno de los pacientes tratados con placebo). La proporción de pacientes tratados con Enbrel que desarrollaron anticuerpos anticardiolipina aumentó de manera similar en comparación con los pacientes tratados con placebo. En el estudio III de AR, no se observó ningún patrón de aumento del desarrollo de autoanticuerpos en los pacientes con Enbrel en comparación con los pacientes con MTX [ver Advertencias y precauciones (5.9)].
6.3 Experiencia postcomercialización
Se han notificado reacciones adversas durante el uso posterior a la aprobación de Enbrel en adultos y pacientes pediátricos. Debido a que estas reacciones se notifican de forma voluntaria a partir de una población de tamaño incierto, no siempre es posible estimar su frecuencia de forma fiable o establecer una relación causal con la exposición a Enbrel.
Las reacciones adversas se enumeran a continuación por sistema corporal:
| Trastornos de la sangre y del sistema linfático: | pancitopenia, anemia, leucopenia, neutropenia, trombocitopenia, linfadenopatía, anemia aplásica [ver Advertencias y precauciones (5.5)] |
| Trastornos cardíacos: | insuficiencia cardíaca congestiva [ver Advertencias y precauciones (5.4)] |
| Trastornos gastrointestinales: | enfermedad inflamatoria intestinal (EII) |
| Trastornos generales: | angioedema, dolor en el pecho |
| Trastornos hepatobiliares: | hepatitis autoinmune, elevación de las transaminasas, reactivación de la hepatitis B |
| Trastornos inmunitarios: | síndrome de activación de macrófagos, vasculitis sistémica, sarcoidosis |
| Trastornos musculoesqueléticos y del tejido conjuntivo: | síndrome similar al lupus |
| Neoplasias benignas, malignas y no especificadas: | melanoma y cánceres de piel no melanoma, carcinoma de células de Merkel [ver Advertencias y precauciones (5.3)] |
| Trastornos del sistema nervioso: | convulsiones, esclerosis múltiple, desmielinización, neuritis óptica, mielitis transversa, parestesias, cefalea [ver Advertencias y precauciones (5.2)] |
| Trastornos oculares: | uveítis, escleritis |
| Trastornos renales y urinarios: | glomerulonefritis |
| Trastornos respiratorios, torácicos y mediastínicos: | enfermedad pulmonar intersticial |
| Trastornos de la piel y del tejido subcutáneo: | lupus eritematoso cutáneo, vasculitis cutánea (incluida la vasculitis leucocitoclástica), eritema multiforme, síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, nódulo subcutáneo, psoriasis nueva o que empeora (todos los subtipos, incluida la pustulosa y la palmoplantar) |
También se han notificado infecciones oportunistas, incluida la infección por micobacterias atípicas, herpes zóster, aspergilosis y Pneumocystis jiroveci neumonía, e infecciones por protozoos en el uso posterior a la comercialización.
Se han notificado casos raros (< 0,1%) de IBD en pacientes con AAI que reciben Enbrel, que no es eficaz para el tratamiento de la IBD.
7 INTERACCIONES MEDICAMENTOSAS
No se han realizado estudios específicos de interacción farmacológica con Enbrel.
7.1 Vacunas
La mayoría de los pacientes con artritis psoriásica (APs) que recibieron Enbrel pudieron desarrollar respuestas inmunitarias de células B eficaces a la vacuna antineumocócica de polisacáridos, pero los títulos en conjunto fueron moderadamente más bajos y menos pacientes tuvieron aumentos de 2 veces en los títulos en comparación con los pacientes que no recibieron Enbrel. Se desconoce la importancia clínica de esto. Los pacientes que reciben Enbrel pueden recibir vacunas simultáneamente, excepto vacunas vivas. No hay datos disponibles sobre la transmisión secundaria de la infección por vacunas vivas en pacientes que reciben Enbrel.
Los pacientes con una exposición significativa al virus de la varicela deben suspender temporalmente el tratamiento con Enbrel y se debe considerar el tratamiento profiláctico con inmunoglobulina contra la varicela zóster [ver Advertencias y precauciones (5.8, 5.10)].
7.2 Productos biológicos inmunomoduladores
En un estudio en el que pacientes con AR activa fueron tratados durante un máximo de 24 semanas con terapia concurrente de Enbrel y anakinra, se observó una tasa del 7% de infecciones graves, que fue mayor que la observada con Enbrel solo (0%) [ver Advertencias y precauciones (5.12)] y no dio lugar a tasas de respuesta ACR más altas en comparación con Enbrel solo. Las infecciones más comunes consistieron en neumonía bacteriana (4 casos) y celulitis (4 casos). Un paciente con fibrosis pulmonar y neumonía murió debido a insuficiencia respiratoria. El dos por ciento de los pacientes tratados simultáneamente con Enbrel y anakinra desarrollaron neutropenia (ANC < 1 × 109/L).
En estudios clínicos, la administración concomitante de abatacept y Enbrel resultó en una mayor incidencia de eventos adversos graves, incluidas infecciones, y no demostró un mayor beneficio clínico [ver Advertencias y precauciones (5.12)].
7.3 Ciclofosfamida
No se recomienda el uso de Enbrel en pacientes que reciben terapia concurrente con ciclofosfamida [ver Advertencias y precauciones (5.11)].
7.4 Sulfasalazina
Se observó que los pacientes en un estudio clínico que estaban en terapia establecida con sulfasalazina, a la que se agregó Enbrel, desarrollaron una disminución leve en el recuento medio de neutrófilos en comparación con los grupos tratados con Enbrel o sulfasalazina sola. Se desconoce la importancia clínica de esta observación.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgos
Los estudios disponibles con el uso de etanercept durante el embarazo no respaldan de manera confiable una asociación entre etanercept y defectos de nacimiento importantes. Los datos clínicos están disponibles de la Organización de Especialistas en Información de Teratología (OTIS) Enbrel Pregnancy Registry en mujeres con enfermedades reumáticas o psoriasis y un estudio escandinavo en mujeres embarazadas con enfermedad inflamatoria crónica. Tanto el Registro OTIS como el estudio escandinavo mostraron que la proporción de bebés nacidos vivos con defectos de nacimiento importantes fue mayor para las mujeres expuestas a etanercept en comparación con las mujeres con enfermedades no expuestas a etanercept. Sin embargo, la falta de patrón de defectos de nacimiento importantes es tranquilizadora y las diferencias entre los grupos de exposición (por ejemplo, la gravedad de la enfermedad) pueden haber afectado la aparición de defectos de nacimiento (ver Datos).
Los informes sobre el uso de etanercept durante el tercer trimestre del embarazo demostraron que la transferencia placentaria de etanercept fue baja en los bebés al nacer (ver Datos). Existen riesgos para la madre y el feto asociados con la artritis reumatoide activa. Los riesgos teóricos de la administración de vacunas vivas o atenuadas vivas a los bebés expuestos in útero a Enbrel deben sopesarse con los beneficios de las vacunas (ver Consideraciones Clínicas).
En estudios de reproducción animal con ratas y conejas embarazadas, no se observaron daños fetales ni malformaciones con la administración subcutánea de etanercept durante el período de organogénesis a dosis que lograron exposiciones sistémicas de 48 a 58 veces la exposición en pacientes tratados con 50 mg de Enbrel una vez por semana (ver Datos).
Todos los embarazos tienen un riesgo de fondo de defectos de nacimiento, pérdida u otros resultados adversos. Se desconoce el riesgo de fondo estimado de defectos de nacimiento importantes y aborto espontáneo para las poblaciones indicadas. En los Estados Unidos, aproximadamente del 2 al 4% de los bebés nacidos vivos tienen un defecto de nacimiento importante y aproximadamente del 15 al 20% de los embarazos terminan en aborto espontáneo, independientemente de la exposición a medicamentos.
Consideraciones Clínicas
Riesgo Materno y/o Embrionario/Fetal Asociado a la Enfermedad
Los datos publicados sugieren que el riesgo de resultados adversos del embarazo en mujeres con artritis reumatoide está correlacionado con la actividad de la enfermedad materna y que la enfermedad activa aumenta el riesgo de resultados adversos del embarazo, incluida la pérdida fetal, el parto prematuro (antes de las 37 semanas de gestación), el bajo peso al nacer (menos de 2500 g) y el nacimiento pequeño para la edad gestacional.
Reacciones Adversas Fetales/Neonatales
Se desconoce el riesgo de reacciones adversas fetales/neonatales con la exposición in útero a Enbrel. Se deben considerar los riesgos y beneficios antes de administrar vacunas vivas o atenuadas vivas a los bebés expuestos a Enbrel in útero [ver Advertencias y Precauciones (5.8) y Interacciones Medicamentosas (7.1)].
Datos
Datos Humanos
Un registro de embarazo de cohorte prospectivo realizado por OTIS en los EE. UU. y Canadá entre 2000 y 2012 comparó el riesgo de defectos de nacimiento importantes en bebés nacidos vivos de mujeres con enfermedades reumáticas o psoriasis expuestas a etanercept en el primer trimestre. La proporción de defectos de nacimiento importantes entre los bebés nacidos vivos en las cohortes expuestas a etanercept (N = 319) y las cohortes con enfermedades no expuestas a etanercept (N = 144) fue del 9,4% y el 3,5%, respectivamente. Los hallazgos no mostraron un aumento estadísticamente significativo del riesgo de defectos de nacimiento menores y ningún patrón de defectos de nacimiento mayores o menores.
Un estudio escandinavo comparó el riesgo de defectos de nacimiento importantes en bebés nacidos vivos de mujeres con enfermedad inflamatoria crónica (CID) expuestas a inhibidores del TNF durante el embarazo temprano. Las mujeres fueron identificadas de los registros de salud basados en la población danesa (2004-2012) y sueca (2006-2012). La proporción de defectos de nacimiento importantes entre los bebés nacidos vivos en las cohortes expuestas a etanercept (N = 344) y las cohortes con CID no expuestas a etanercept (N = 21,549) fue del 7,0% y el 4,7%, respectivamente.
En general, si bien tanto el Registro OTIS como el estudio escandinavo muestran una mayor proporción de defectos de nacimiento importantes en pacientes expuestos a etanercept en comparación con los pacientes con enfermedades no expuestas a etanercept, la falta de patrón de defectos de nacimiento es tranquilizadora y las diferencias entre los grupos de exposición (por ejemplo, la gravedad de la enfermedad) pueden haber afectado la aparición de defectos de nacimiento.
Los informes de la literatura mostraron que los niveles de etanercept en sangre del cordón umbilical al nacer, en bebés nacidos de mujeres que recibieron etanercept durante el embarazo, variaron de indetectables al 32% del nivel sérico materno. En un estudio de cohorte de 30 mujeres embarazadas con AR, 29 fueron tratadas con etanercept hasta las 30 semanas de gestación y 1 fue tratada hasta las 36 semanas de gestación. No se detectó etanercept en la muestra de sangre del cordón umbilical de ningún bebé al nacer. En tres informes de casos publicados, se detectó etanercept en sangre del cordón umbilical a niveles del 3,3%, 3,6% y 7,4% de la concentración materna, cuando se administró etanercept a 50 mg cada 7-12 días durante el embarazo hasta 4 días antes del parto, 25 mg dos veces por semana hasta las 36 semanas de gestación, y 25 mg subcutáneos cada semana durante el tercer trimestre, respectivamente. Hubo un informe de seguridad posterior a la comercialización de una mujer embarazada que recibió etanercept 25 mg una o dos veces por semana durante todo el embarazo, y se detectó etanercept en sangre del cordón umbilical al 32% de la concentración materna.
Datos Animales
En estudios de desarrollo embrio-fetal con etanercept administrado durante el período de organogénesis a ratas preñadas desde el día de gestación (GD) 6 hasta el 20 o conejas preñadas desde el GD 6 hasta el 18, no hubo evidencia de malformaciones fetales o embriotoxicidad en ratas o conejos a dosis respectivas que alcanzaron exposiciones sistémicas 48 a 58 veces la exposición en pacientes tratados con 50 mg de Enbrel una vez por semana (sobre una base de AUC con dosis subcutáneas maternas de hasta 30 mg/kg/día en ratas y 40 mg/kg/día en conejos). En un estudio de desarrollo peri y postnatal con ratas preñadas que recibieron etanercept durante la organogénesis y el período gestacional posterior desde el GD 6 hasta el 21, el desarrollo de las crías hasta el día postnatal 4 no se vio afectado a dosis que alcanzaron exposiciones 48 veces la exposición en pacientes tratados con 50 mg de Enbrel una vez por semana (sobre una base de AUC con dosis subcutáneas maternas de hasta 30 mg/kg/día).
8.2 Lactancia
Resumen de riesgos
Los datos de la literatura publicada muestran que el etanercept está presente en niveles bajos en la leche materna, pero no se detecta en el plasma de los lactantes (ver Datos). No hay datos sobre los efectos del etanercept en la producción de leche. No ha habido informes consistentes de eventos adversos en lactantes durante décadas de uso. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de Enbrel y cualquier posible efecto adverso en el niño amamantado por el medicamento o por la condición materna subyacente.
Datos
En tres informes de casos, el etanercept se detectó en la leche materna en niveles que oscilan entre <2 y 7,5 ng/mL después de que las mujeres lactantes hubieran recibido dosis de etanercept de 25 mg semanales o dos veces por semana. Aunque el etanercept se detectó en la leche materna en estos casos, el etanercept no se detectó en el suero de los lactantes.
8.4 Uso pediátrico
Artritis idiopática juvenil poliarticular
La seguridad y eficacia de Enbrel se han establecido en pacientes pediátricos de 2 años de edad o mayores con pJIA. Enbrel se ha estudiado en 69 niños con artritis juvenil poliarticular de moderada a gravemente activa de 2 a 17 años de edad.
La seguridad y eficacia de Enbrel en pacientes pediátricos menores de 2 años de edad con pJIA no se han establecido.
Artritis psoriásica juvenil
La seguridad y eficacia de Enbrel se han establecido en pacientes pediátricos de 2 a 17 años de edad con JPsA. El uso de Enbrel en JPsA está respaldado por evidencia de estudios adecuados y bien controlados de Enbrel en adultos con PsA; datos farmacocinéticos de pacientes adultos con PsA, RA y PsO; y datos farmacocinéticos de pacientes pediátricos con JIA activa y PsO. La seguridad de Enbrel en JPsA está respaldada por un estudio clínico en 69 pacientes pediátricos con JIA de moderada a gravemente activa de 2 a 17 años de edad; un estudio clínico en 211 pacientes pediátricos con PsO de moderada a grave de 4 a 17 años de edad; y un estudio de extensión de etiqueta abierta en 182 pacientes pediátricos con PsO de moderada a grave de 4 a 17 años de edad.
Las concentraciones previas a la dosis (en el valle) observadas son generalmente comparables entre adultos con RA y PsA y pacientes pediátricos con JIA activa, así como adultos con PsO y pacientes pediátricos con PsO. Se espera que la exposición farmacocinética sea comparable entre adultos con PsA y pacientes pediátricos con JPsA [ver Reacciones adversas (6.1), Farmacología clínica (12.3), y Estudios clínicos (14.1, 14.2, 14.3, 14.5, 14.6)].
La seguridad y eficacia en pacientes pediátricos menores de 2 años de edad no se han establecido en JPsA.
Psoriasis en placas
La seguridad y eficacia de Enbrel para la psoriasis en placas se han establecido en pacientes pediátricos de 4 años de edad o mayores. Enbrel se ha estudiado en 211 pacientes pediátricos con PsO de moderada a grave de 4 a 17 años de edad.
La seguridad y eficacia de Enbrel en pacientes pediátricos menores de 4 años de edad con PsO no se han establecido.
Neoplasias en pacientes pediátricos
Se han notificado neoplasias, algunas fatales, en niños, adolescentes y adultos jóvenes que recibieron tratamiento con agentes bloqueadores del TNF (inicio del tratamiento a los ≤ 18 años de edad), incluido Enbrel [ver Advertencias y precauciones (5.3)].
8.5 Uso geriátrico
Se han estudiado un total de 480 pacientes con RA de 65 años de edad o mayores en ensayos clínicos. En los ensayos clínicos aleatorizados de PsO, un total de 138 de 1965 pacientes tratados con Enbrel o placebo tenían 65 años de edad o mayores. No se observaron diferencias generales en la seguridad o eficacia entre estos pacientes y los pacientes más jóvenes, pero el número de pacientes geriátricos con PsO es demasiado pequeño para determinar si responden de manera diferente a los pacientes más jóvenes. Debido a que hay una mayor incidencia de infecciones en la población de ancianos en general, se debe tener precaución al tratar a los ancianos.
8.6 Uso en pacientes con diabetes
Ha habido informes de hipoglucemia después del inicio del tratamiento con Enbrel en pacientes que reciben medicamentos para la diabetes, lo que ha requerido una reducción en la medicación antidiabética en algunos de estos pacientes.
10 SOBREDOSIS
No se han observado toxicidades limitantes de la dosis durante los ensayos clínicos de Enbrel. Se han administrado dosis IV únicas de hasta 60 mg/m2 (aproximadamente el doble de la dosis recomendada) a voluntarios sanos en un estudio de endotoxemia sin evidencia de toxicidades limitantes de la dosis.
11 DESCRIPCIÓN
Etanercept, un bloqueador del factor de necrosis tumoral (TNF), es una proteína de fusión dimérica que consiste en la porción extracelular de unión al ligando del receptor del factor de necrosis tumoral humano de 75 kilodaltons (p75) (TNFR) unida a la porción Fc de la IgG1 humana. El componente Fc de etanercept contiene el dominio CH2, el dominio CH3 y la región de bisagra, pero no el dominio CH1 de la IgG1. Etanercept se produce mediante tecnología de ADN recombinante en un sistema de expresión de células mamíferas de ovario de hámster chino (CHO). Consiste en 934 aminoácidos y tiene un peso molecular aparente de aproximadamente 150 kilodaltons.
Enbrel (etanercept) Inyección en la jeringa precargada de dosis única, el autoinyector SureClick precargado de dosis única y el vial de dosis única es una solución transparente e incolora, estéril, sin conservantes, y se formula a pH 6.3 ± 0.2.
Enbrel (etanercept) para inyección se suministra en un vial de dosis múltiple como un polvo liofilizado estéril, blanco, sin conservantes. La reconstitución con 1 mL de Agua estéril bacteriostática para inyección, USP (que contiene 0.9% de alcohol bencílico) produce una solución de dosis múltiple, transparente e incolora de 1 mL que contiene 25 mg de Enbrel, con un pH de 7.4 ± 0.3.
Enbrel (etanercept) Inyección en el cartucho precargado de dosis única Enbrel Mini para uso con el autoinyector reutilizable AutoTouch es una solución transparente e incolora, estéril, sin conservantes, y se formula a pH 6.3 ± 0.2.
| Presentación | Contenido del ingrediente activo | Contenido de los ingredientes inactivos |
|---|---|---|
| Enbrel 50 mg jeringa precargada y autoinyector SureClick | 50 mg de etanercept en 1 mL | 25 mM L-arginina clorhidrato 120 mM cloruro de sodio 1% sacarosa |
| Enbrel 25 mg jeringa precargada | 25 mg de etanercept en 0.5 mL | 25 mM L-arginina clorhidrato 120 mM cloruro de sodio 1% sacarosa |
| Enbrel 25 mg vial de dosis única | 25 mg de etanercept en 0.5 mL | 25 mM L-arginina clorhidrato 120 mM cloruro de sodio 1% sacarosa |
| Enbrel 25 mg vial de dosis múltiple | Después de la reconstitución, 25 mg de etanercept en 1 mL | 40 mg de manitol 10 mg de sacarosa 1.2 mg de trometamina |
| Enbrel 50 mg Enbrel Mini cartucho precargado de dosis única para uso solo con el autoinyector reutilizable AutoTouch | 50 mg de etanercept en 1 mL | 25 mM L-arginina clorhidrato 120 mM cloruro de sodio 1% sacarosa |
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
TNF es una citocina natural que participa en las respuestas inflamatorias e inmunitarias normales. Juega un papel importante en los procesos inflamatorios de la AR, la AIJ poliarticular, la PsA y la AS y la patología articular resultante. Además, TNF juega un papel en el proceso inflamatorio de la PsO. Se encuentran niveles elevados de TNF en los tejidos y fluidos afectados de pacientes con AR, AIJ, PsA, AS y PsO.
Existen dos receptores distintos para TNF (TNFR), una proteína de 55 kilodaltons (p55) y una proteína de 75 kilodaltons (p75), que existen naturalmente como moléculas monoméricas en las superficies celulares y en formas solubles. La actividad biológica de TNF depende de la unión a cualquiera de los TNFR de la superficie celular.
Etanercept es una forma soluble dimérica del receptor p75 TNF que puede unirse a las moléculas de TNF. Etanercept inhibe la unión de TNF-α y TNF-β (linfotoxina alfa [LT-α]) a los TNFR de la superficie celular, lo que hace que TNF sea biológicamente inactivo. En estudios in vitro, no se detectaron grandes complejos de etanercept con TNF-α y las células que expresan TNF transmembrana (que se une a Enbrel) no se lisan en presencia o ausencia de complemento.
12.2 Farmacodinamia
Etanercept puede modular las respuestas biológicas que son inducidas o reguladas por TNF, incluida la expresión de moléculas de adhesión responsables de la migración de leucocitos (por ejemplo, E-selectina, y en menor medida, molécula de adhesión intercelular-1 [ICAM-1]), los niveles séricos de citocinas (por ejemplo, IL-6), y los niveles séricos de metaloproteinasa de matriz-3 (MMP-3 o estromelisina). Se ha demostrado que etanercept afecta varios modelos animales de inflamación, incluida la artritis inducida por colágeno murina.
12.3 Farmacocinética
Después de la administración de 25 mg de Enbrel mediante una sola inyección SC a 25 pacientes con AR, se observó una vida media media ± desviación estándar de 102 ± 30 horas con una depuración de 160 ± 80 mL/hora. Se observó una concentración sérica máxima (Cmax) de 1,1 ± 0,6 mcg/mL y un tiempo hasta Cmax de 69 ± 34 horas en estos pacientes después de una sola dosis de 25 mg. Después de 6 meses de dosis de 25 mg dos veces por semana en estos mismos pacientes con AR, la Cmax media fue de 2,4 ± 1,0 mcg/mL (N = 23). Los pacientes exhibieron un aumento de 2 a 7 veces en las concentraciones séricas máximas y un aumento de aproximadamente 4 veces en el AUC0-72 hr (rango de 1 a 17 veces) con la dosificación repetida. Las concentraciones séricas en pacientes con AR no se han medido durante períodos de dosificación que excedan los 6 meses.
En otro estudio, los perfiles de concentración sérica en estado estacionario fueron comparables entre los pacientes con AR tratados con 50 mg de Enbrel una vez por semana y los tratados con 25 mg de Enbrel dos veces por semana. La Cmax, Cmin y AUC parcial medias (± desviación estándar) fueron de 2,4 ± 1,5 mcg/mL, 1,2 ± 0,7 mcg/mL y 297 ± 166 mcg∙h/mL, respectivamente, para los pacientes tratados con 50 mg de Enbrel una vez por semana (N = 21); y 2,6 ± 1,2 mcg/mL, 1,4 ± 0,7 mcg/mL y 316 ± 135 mcg∙h/mL para los pacientes tratados con 25 mg de Enbrel dos veces por semana (N = 16).
Los pacientes con AIJ (edades de 4 a 17 años) recibieron 0,4 mg/kg de Enbrel dos veces por semana (hasta una dosis máxima de 50 mg por semana) durante un máximo de 18 semanas. La concentración sérica media después de la dosificación SC repetida fue de 2,1 mcg/mL, con un rango de 0,7 a 4,3 mcg/mL. Los datos limitados sugieren que la depuración de etanercept se reduce ligeramente en niños de 4 a 8 años. Los análisis farmacocinéticos poblacionales predicen que las diferencias farmacocinéticas entre los regímenes de 0,4 mg/kg dos veces por semana y 0,8 mg/kg una vez por semana en pacientes con AIJ son del mismo orden de magnitud que las diferencias observadas entre los regímenes dos veces por semana y semanales en pacientes adultos con AR.
Las concentraciones en estado estacionario en valle medias (± DE) para la dosificación de 50 mg QW en sujetos adultos con PsA fueron de 2,1 ± 1,2 mcg/mL y 2,1 ± 1,4 mcg/mL en las semanas 24 y 48, respectivamente.
Las concentraciones en estado estacionario en valle medias (± DE) para la dosificación de 50 mg QW en sujetos adultos con PsO fueron de 1,5 ± 0,7 mcg/mL. Los pacientes pediátricos con PsO (edades de 4 a 17 años) recibieron 0,8 mg/kg de Enbrel una vez por semana (hasta una dosis máxima de 50 mg por semana) durante un máximo de 48 semanas. Las concentraciones en estado estacionario en valle medias (± DE) oscilaron entre 1,6 ± 0,8 y 2,1 ± 1,3 mcg/mL en las semanas 12, 24 y 48.
En general, las concentraciones de etanercept observadas en pacientes con AIJ y PsO pediátrica estuvieron dentro del rango de las observadas para la AR, PsA y PsO adultas después de la administración de Enbrel.
En estudios clínicos con Enbrel, los parámetros farmacocinéticos no fueron diferentes entre hombres y mujeres y no variaron con la edad en pacientes adultos. La farmacocinética de etanercept no se vio alterada por el MTX concomitante en pacientes con AR. No se han realizado estudios farmacocinéticos formales para examinar los efectos del deterioro renal o hepático en la disposición de etanercept.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogenesis, Mutagenesis, Impairment of Fertility
No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico de etanercept o su efecto sobre la fertilidad.
14 ESTUDIOS CLÍNICOS
14.1 Artritis Reumatoide en Adultos
La seguridad y eficacia de Enbrel se evaluaron en cuatro estudios aleatorizados, doble ciego y controlados. Los resultados de los cuatro ensayos se expresaron como el porcentaje de pacientes con mejoría en la AR utilizando los criterios de respuesta ACR.
El Estudio I evaluó a 234 pacientes con AR activa de ≥ 18 años de edad, que habían fracasado en la terapia con al menos un fármaco antirreumático modificador de la enfermedad (DMARD), pero no más de cuatro (p. ej., hidroxicloroquina, oro oral o inyectable, MTX, azatioprina, D-penicilamina, sulfasalazina), y tenían ≥ 12 articulaciones dolorosas, ≥ 10 articulaciones inflamadas y una velocidad de sedimentación globular (VSG) ≥ 28 mm/h, proteína C reactiva (PCR) > 2,0 mg/dL o rigidez matutina durante ≥ 45 minutos. Se administraron dosis de 10 mg o 25 mg de Enbrel o placebo SC dos veces por semana durante 6 meses consecutivos.
El Estudio II evaluó a 89 pacientes y tuvo criterios de inclusión similares al Estudio I, excepto que los pacientes del Estudio II habían recibido además MTX durante al menos 6 meses con una dosis estable (12,5 a 25 mg/semana) durante al menos 4 semanas y tenían al menos 6 articulaciones dolorosas o sensibles. Los pacientes del Estudio II recibieron una dosis de 25 mg de Enbrel o placebo SC dos veces por semana durante 6 meses además de su dosis estable de MTX.
El Estudio III comparó la eficacia de Enbrel con la del MTX en pacientes con AR activa. Este estudio evaluó a 632 pacientes de ≥ 18 años de edad con AR activa temprana (≤ 3 años de duración de la enfermedad), que nunca habían recibido tratamiento con MTX y tenían ≥ 12 articulaciones dolorosas, ≥ 10 articulaciones inflamadas y una VSG ≥ 28 mm/h, PCR > 2,0 mg/dL o rigidez matutina durante ≥ 45 minutos. Se administraron dosis de 10 mg o 25 mg de Enbrel SC dos veces por semana durante 12 meses consecutivos. El estudio se descifró después de que todos los pacientes hubieran completado al menos 12 meses (y una mediana de 17,3 meses) de terapia. La mayoría de los pacientes permanecieron en el estudio con el tratamiento al que fueron asignados al azar durante 2 años, después de lo cual ingresaron a un estudio de extensión y recibieron Enbrel de 25 mg en abierto. Se administraron comprimidos de MTX (aumentados de 7,5 mg/semana a un máximo de 20 mg/semana durante las primeras 8 semanas del ensayo) o comprimidos de placebo una vez por semana el mismo día que la inyección de placebo o dosis de Enbrel, respectivamente.
El Estudio IV evaluó a 682 pacientes adultos con AR activa de 6 meses a 20 años de duración (media de 7 años) que habían tenido una respuesta inadecuada a al menos un DMARD que no fuera MTX. El cuarenta y tres por ciento de los pacientes habían recibido previamente MTX durante una media de 2 años antes del ensayo a una dosis media de 12,9 mg. Los pacientes fueron excluidos de este estudio si se había interrumpido el MTX por falta de eficacia o por razones de seguridad. Las características basales de los pacientes fueron similares a las de los pacientes del Estudio I. Los pacientes fueron aleatorizados a MTX solo (7,5 a 20 mg semanales, dosis aumentada como se describió para el Estudio III; dosis mediana 20 mg), Enbrel solo (25 mg dos veces por semana) o la combinación de Enbrel y MTX iniciada simultáneamente (a las mismas dosis que las anteriores). El estudio evaluó la respuesta ACR, la puntuación radiográfica de Sharp y la seguridad.
Respuesta Clínica
Un porcentaje mayor de pacientes tratados con Enbrel y Enbrel en combinación con MTX lograron respuestas ACR 20, ACR 50 y ACR 70 y Respuestas Clínicas Mayores que en los grupos de comparación. Los resultados de los Estudios I, II y III se resumen en la Tabla 6. Los resultados del Estudio IV se resumen en la Tabla 7.
| Controlado con placebo | Controlado con activo | |||||
|---|---|---|---|---|---|---|
| Estudio I | Estudio II | Estudio III | ||||
| Placebo | Enbrel* | MTX/Placebo | MTX/Enbrel* | MTX | Enbrel* | |
| Respuesta | N = 80 | N = 78 | N = 30 | N = 59 | N = 217 | N = 207 |
| ACR 20 | ||||||
| Mes 3 | 23% | 62%† | 33% | 66%† | 56% | 62% |
| Mes 6 | 11% | 59%† | 27% | 71%† | 58% | 65% |
| Mes 12 | NA | NA | NA | NA | 65% | 72% |
| ACR 50 | ||||||
| Mes 3 | 8% | 41%† | 0% | 42%† | 24% | 29% |
| Mes 6 | 5% | 40%† | 3% | 39%† | 32% | 40% |
| Mes 12 | NA | NA | NA | NA | 43% | 49% |
| ACR 70 | ||||||
| Mes 3 | 4% | 15%† | 0% | 15%† | 7% | 13%‡ |
| Mes 6 | 1% | 15%† | 0% | 15%† | 14% | 21%‡ |
| Mes 12 | NA | NA | NA | NA | 22% | 25% |
| Punto final | MTX (N = 228) |
Enbrel (N = 223) |
Enbrel/MTX (N = 231) |
|---|---|---|---|
|
|||
| ACR N*, † | |||
| Mes 12 | 40% | 47% | 63%‡ |
| ACR 20 | |||
| Mes 12 | 59% | 66% | 75%‡ |
| ACR 50 | |||
| Mes 12 | 36% | 43% | 63%‡ |
| ACR 70 | |||
| Mes 12 | 17% | 22% | 40%‡ |
| Respuesta clínica mayor§ | 6% | 10% | 24%‡ |
La evolución temporal de las tasas de respuesta ACR 20 para los pacientes que recibieron placebo o 25 mg de Enbrel en los estudios I y II se resume en la figura 1. La evolución temporal de las respuestas a Enbrel en el estudio III fue similar.
|
|
Entre los pacientes que recibieron Enbrel, las respuestas clínicas generalmente aparecieron entre 1 y 2 semanas después del inicio de la terapia y casi siempre ocurrieron a los 3 meses. Se observó una respuesta a la dosis en los estudios I y III: 25 mg de Enbrel fueron más efectivos que 10 mg (10 mg no se evaluó en el estudio II). Enbrel fue significativamente mejor que el placebo en todos los componentes de los criterios ACR, así como en otras medidas de la actividad de la AR no incluidas en los criterios de respuesta ACR, como la rigidez matutina.
En el estudio III, las tasas de respuesta ACR y la mejora en todos los criterios de respuesta ACR individuales se mantuvieron durante 24 meses de terapia con Enbrel. Durante el estudio de 2 años, el 23% de los pacientes con Enbrel lograron una respuesta clínica importante, definida como el mantenimiento de una respuesta ACR 70 durante un período de 6 meses.
Los resultados de los componentes de los criterios de respuesta ACR para el estudio I se muestran en la tabla 8. Se observaron resultados similares para los pacientes tratados con Enbrel en los estudios II y III.
| Placebo N = 80 |
Enbrel* N = 78 |
|||
|---|---|---|---|---|
| Parámetro (mediana) | Línea de base | 3 meses | Línea de base | 3 meses† |
|
||||
| Número de articulaciones sensibles ‡ | 34.0 | 29.5 | 31.2 | 10.0§ |
| Número de articulaciones inflamadas ¶ | 24.0 | 22.0 | 23.5 | 12.6§ |
| Evaluación global del médico # | 7.0 | 6.5 | 7.0 | 3.0§ |
| Evaluación global del paciente # | 7.0 | 7.0 | 7.0 | 3.0§ |
| Dolor # | 6.9 | 6.6 | 6.9 | 2.4§ |
| Índice de discapacidad Þ | 1.7 | 1.8 | 1.6 | 1.0§ |
| VSG (mm/h) | 31.0 | 32.0 | 28.0 | 15.5§ |
| PCR (mg/dL) | 2.8 | 3.9 | 3.5 | 0.9§ |
Después de la interrupción de Enbrel, los síntomas de la artritis generalmente regresaron dentro de un mes. La reintroducción del tratamiento con Enbrel después de interrupciones de hasta 18 meses dio como resultado las mismas magnitudes de respuesta que en los pacientes que recibieron Enbrel sin interrupción de la terapia, según los resultados de los estudios abiertos.
Se observaron respuestas duraderas continuas durante más de 60 meses en ensayos de tratamiento de extensión de etiqueta abierta cuando los pacientes recibieron Enbrel sin interrupción. Un número sustancial de pacientes que inicialmente recibieron MTX o corticosteroides concomitantes pudieron reducir sus dosis o suspender estas terapias concomitantes mientras mantenían sus respuestas clínicas.
Respuesta de la función física
En los estudios I, II y III, la función física y la discapacidad se evaluaron utilizando el Cuestionario de Evaluación de la Salud (HAQ). Además, en el estudio III, los pacientes recibieron la Encuesta de Salud SF-36. En los estudios I y II, los pacientes tratados con 25 mg de Enbrel dos veces por semana mostraron una mayor mejoría desde el inicio en la puntuación HAQ a partir del mes 1 hasta el mes 6 en comparación con el placebo (p < 0,001) para el dominio de discapacidad HAQ (donde 0 = ninguno y 3 = severo). En el estudio I, la mejora media en la puntuación HAQ desde el inicio hasta el mes 6 fue de 0,6 (de 1,6 a 1,0) para el grupo de 25 mg de Enbrel y 0 (de 1,7 a 1,7) para el grupo placebo. En el estudio II, la mejora media desde el inicio hasta el mes 6 fue de 0,6 (de 1,5 a 0,9) para el grupo Enbrel/MTX y 0,2 (de 1,3 a 1,2) para el grupo placebo/MTX. En el estudio III, la mejora media en la puntuación HAQ desde el inicio hasta el mes 6 fue de 0,7 (de 1,5 a 0,7) para 25 mg de Enbrel dos veces por semana. Todos los subdominios del HAQ en los estudios I y III mejoraron en los pacientes tratados con Enbrel.
En el estudio III, los pacientes tratados con 25 mg de Enbrel dos veces por semana mostraron una mayor mejoría desde el inicio en la puntuación resumida del componente físico SF-36 en comparación con Enbrel 10 mg dos veces por semana y sin empeoramiento en la puntuación resumida del componente mental SF-36. En los estudios abiertos de Enbrel, las mejoras en las medidas de función física y discapacidad se han mantenido durante hasta 4 años.
En el estudio IV, las puntuaciones medianas de HAQ mejoraron de los niveles iniciales de 1,8, 1,8 y 1,8 a 1,1, 1,0 y 0,6 a los 12 meses en los grupos de tratamiento con MTX, Enbrel y Enbrel/MTX, respectivamente (combinación frente a MTX y Enbrel, p < 0,01). El veintinueve por ciento de los pacientes en el grupo de tratamiento solo con MTX tuvo una mejora de HAQ de al menos 1 unidad frente al 40% y el 51% en los grupos de tratamiento solo con Enbrel y la combinación Enbrel/MTX, respectivamente.
Respuesta radiográfica
En el estudio III, el daño articular estructural se evaluó radiográficamente y se expresó como cambio en la puntuación total de Sharp (TSS) y sus componentes, la puntuación de erosión y la puntuación de estrechamiento del espacio articular (JSN). Se obtuvieron radiografías de manos/muñecas y antepiés al inicio, a los 6 meses, a los 12 meses y a los 24 meses y fueron puntuadas por lectores que desconocían el grupo de tratamiento. Los resultados se muestran en la Tabla 9. Se observó una diferencia significativa para el cambio en la puntuación de erosión a los 6 meses y se mantuvo a los 12 meses.
| MTX | 25 mg Enbrel | MTX/Enbrel (Intervalo de confianza del 95%*) |
Valor P | ||
|---|---|---|---|---|---|
|
|||||
| 12 meses | Puntuación total de Sharp | 1,59 | 1,00 | 0,59 (-0,12, 1,30) | 0,1 |
| Puntuación de erosión | 1,03 | 0,47 | 0,56 (0,11, 1,00) | 0,002 | |
| Puntuación JSN | 0,56 | 0,52 | 0,04 (-0,39, 0,46) | 0,5 | |
| 6 meses | Puntuación total de Sharp | 1,06 | 0,57 | 0,49 (0,06, 0,91) | 0,001 |
| Puntuación de erosión | 0,68 | 0,30 | 0,38 (0,09, 0,66) | 0,001 | |
| Puntuación JSN | 0,38 | 0,27 | 0,11 (-0,14, 0,35) | 0,6 | |
Los pacientes continuaron con la terapia a la que fueron asignados aleatoriamente durante el segundo año del Estudio III. El setenta y dos por ciento de los pacientes se realizaron radiografías a los 24 meses. En comparación con los pacientes del grupo MTX, se observó una mayor inhibición de la progresión en la puntuación TSS y de erosión en el grupo de Enbrel de 25 mg y, además, se observó menos progresión en la puntuación JSN.
En la extensión de etiqueta abierta del Estudio III, el 48% de los pacientes originales tratados con 25 mg de Enbrel han sido evaluados radiográficamente a los 5 años. Los pacientes tuvieron una inhibición continua del daño estructural, medido por el TSS, y el 55% de ellos no tuvo progresión del daño estructural. Los pacientes tratados originalmente con MTX tuvieron una mayor reducción en la progresión radiográfica una vez que comenzaron el tratamiento con Enbrel.
En el Estudio IV, se observó menos progresión radiográfica (TSS) con Enbrel en combinación con MTX en comparación con Enbrel solo o MTX solo al mes 12 (Tabla 10). En el grupo de tratamiento con MTX, el 55% de los pacientes no experimentaron progresión radiográfica (cambio TSS ≤ 0,0) a los 12 meses en comparación con el 63% y el 76% en los grupos de tratamiento con Enbrel solo y la combinación de Enbrel/MTX, respectivamente.
| MTX (N = 212)* |
Enbrel (N = 212)* |
Enbrel/MTX (N = 218)* |
|
|---|---|---|---|
| Puntuación total de Sharp (TSS) | 2,80 (1,08, 4,51) |
0,52† (-0,10, 1,15) |
-0,54‡,§ (-1,00, -0,07) |
| Puntuación de erosión (ES) | 1,68 (0,61, 2,74) |
0,21† (-0,20, 0,61) |
-0,30‡ (-0,65, 0,04) |
| Puntuación de estrechamiento del espacio articular (JSN) | 1,12 (0,34, 1,90) |
0,32 (0,00, 0,63) |
-0,23‡,§ (-0,45, -0,02) |
Dosificación Una Vez por Semana
La seguridad y eficacia de 50 mg de Enbrel (dos inyecciones SC de 25 mg) administradas una vez por semana se evaluaron en un estudio doble ciego, controlado con placebo, de 420 pacientes con AR activa. Cincuenta y tres pacientes recibieron placebo, 214 pacientes recibieron 50 mg de Enbrel una vez por semana y 153 pacientes recibieron 25 mg de Enbrel dos veces por semana. Los perfiles de seguridad y eficacia de los dos grupos de tratamiento con Enbrel fueron similares.
14.2 Artritis Idiopática Juvenil Poliarticular (JIA)
La seguridad y eficacia de Enbrel se evaluaron en un estudio de 2 partes en 69 niños con JIA poliarticular que tenían una variedad de tipos de inicio de JIA. Se inscribieron pacientes de 2 a 17 años con JIA poliarticular moderada a gravemente activa refractaria o intolerante a MTX; los pacientes permanecieron en una dosis estable de un solo fármaco antiinflamatorio no esteroideo y/o prednisona (≤ 0,2 mg/kg/día o 10 mg como máximo). En la parte 1, todos los pacientes recibieron 0,4 mg/kg (máximo 25 mg por dosis) de Enbrel SC dos veces por semana. En la parte 2, los pacientes con una respuesta clínica al día 90 se asignaron aleatoriamente para permanecer en Enbrel o recibir placebo durante 4 meses y se evaluaron para detectar un brote de la enfermedad. Las respuestas se midieron utilizando la Definición de Mejora de la JIA (DOI), definida como ≥ 30% de mejora en al menos tres de seis y ≥ 30% de empeoramiento en no más de uno de los seis criterios del conjunto central de la JIA, que incluyen el recuento de articulaciones activas, la limitación del movimiento, las evaluaciones globales del médico y del paciente/padre, la evaluación funcional y la VES. El brote de la enfermedad se definió como un empeoramiento ≥ 30% en tres de los seis criterios del conjunto central de la JIA y una mejora ≥ 30% en no más de uno de los seis criterios del conjunto central de la JIA y un mínimo de dos articulaciones activas.
En la parte 1 del estudio, 51 de 69 (74%) pacientes demostraron una respuesta clínica y entraron en la parte 2. En la parte 2, 6 de 25 (24%) pacientes que permanecieron en Enbrel experimentaron un brote de la enfermedad en comparación con 20 de 26 (77%) pacientes que recibieron placebo (p = 0,007). Desde el inicio de la parte 2, el tiempo medio hasta el brote fue ≥ 116 días para los pacientes que recibieron Enbrel y 28 días para los pacientes que recibieron placebo. Cada componente de los criterios del conjunto central de la JIA empeoró en el brazo que recibió placebo y se mantuvo estable o mejoró en el brazo que continuó con Enbrel. Los datos sugirieron la posibilidad de una tasa de brotes más alta entre aquellos pacientes con una VES basal más alta. De los pacientes que demostraron una respuesta clínica a los 90 días y entraron en la parte 2 del estudio, algunos de los pacientes que permanecieron en Enbrel continuaron mejorando del mes 3 al mes 7, mientras que los que recibieron placebo no mejoraron.
La mayoría de los pacientes con JIA que desarrollaron un brote de la enfermedad en la parte 2 y reintrodujeron el tratamiento con Enbrel hasta 4 meses después de la interrupción volvieron a responder a la terapia con Enbrel en estudios abiertos. La mayoría de los pacientes que respondieron que continuaron la terapia con Enbrel sin interrupción han mantenido las respuestas hasta por 48 meses.
No se han realizado estudios en pacientes con JIA poliarticular para evaluar los efectos de la terapia continua con Enbrel en pacientes que no responden dentro de los 3 meses de iniciar la terapia con Enbrel, o para evaluar la combinación de Enbrel con MTX.
14.3 Artritis Psoriásica
La seguridad y eficacia de Enbrel se evaluaron en un estudio aleatorizado, doble ciego, controlado con placebo, en 205 pacientes con AP. Los pacientes tenían entre 18 y 70 años de edad y tenían AP activa (≥ 3 articulaciones inflamadas y ≥ 3 articulaciones sensibles) en una o más de las siguientes formas: (1) afectación interfalángica distal (DIP) (N = 104); (2) artritis poliarticular (ausencia de nódulos reumatoides y presencia de psoriasis; N = 173); (3) artritis mutilans (N = 3); (4) artritis psoriásica asimétrica (N = 81); o (5) similar a la espondilitis anquilosante (N = 7). Los pacientes también tenían psoriasis en placas con una lesión diana calificada ≥ 2 cm de diámetro. Los pacientes en terapia con MTX al momento de la inscripción (estable durante ≥ 2 meses) podrían continuar con una dosis estable de ≤ 25 mg/semana de MTX. Se administraron dosis de 25 mg de Enbrel o placebo SC dos veces por semana durante el período inicial de 6 meses de doble ciego del estudio. Los pacientes continuaron recibiendo terapia ciega en un período de mantenimiento de hasta 6 meses hasta que todos los pacientes completaron el período controlado. Después de esto, los pacientes recibieron 25 mg de Enbrel de etiqueta abierta dos veces por semana en un período de extensión de 12 meses.
En comparación con el placebo, el tratamiento con Enbrel dio como resultado mejoras significativas en las medidas de actividad de la enfermedad (Tabla 11).
| Placebo N = 104 |
Enbrel* N = 101 |
|||
|---|---|---|---|---|
| Parámetro (mediana) | Línea de base | 6 Meses | Línea de base | 6 Meses |
|
||||
| Número de articulaciones sensibles† | 17,0 | 13,0 | 18,0 | 5,0 |
| Número de articulaciones inflamadas‡ | 12.5 | 9.5 | 13.0 | 5.0 |
| Evaluación global del médico§ | 3.0 | 3.0 | 3.0 | 1.0 |
| Evaluación global del paciente§ | 3.0 | 3.0 | 3.0 | 1.0 |
| Rigidez matutina (minutos) | 60 | 60 | 60 | 15 |
| Dolor§ | 3.0 | 3.0 | 3.0 | 1.0 |
| Índice de discapacidad¶ | 1.0 | 0.9 | 1.1 | 0.3 |
| PCR (mg/dL)# | 1.1 | 1.1 | 1.6 | 0.2 |
Entre los pacientes con PsA que recibieron Enbrel, las respuestas clínicas fueron evidentes en el momento de la primera visita (4 semanas) y se mantuvieron durante 6 meses de terapia. Las respuestas fueron similares en pacientes que sí o no estaban recibiendo terapia concomitante con MTX al inicio. A los 6 meses, las respuestas ACR 20/50/70 se lograron en el 50%, 37% y 9%, respectivamente, de los pacientes que recibieron Enbrel, en comparación con el 13%, 4% y 1%, respectivamente, de los pacientes que recibieron placebo. Se observaron respuestas similares en pacientes con cada uno de los subtipos de PsA, aunque se inscribieron pocos pacientes con los subtipos de artritis mutilans y espondilitis anquilosante. Los resultados de este estudio fueron similares a los observados en un estudio anterior de un solo centro, aleatorizado y controlado con placebo de 60 pacientes con PsA.
Las lesiones cutáneas de la psoriasis también mejoraron con Enbrel, en relación con el placebo, según lo medido por los porcentajes de pacientes que lograron mejoras en el Índice de Área y Severidad de la Psoriasis (PASI). Las respuestas aumentaron con el tiempo y, a los 6 meses, las proporciones de pacientes que lograron una mejora del 50% o 75% en el PASI fueron del 47% y el 23%, respectivamente, en el grupo Enbrel (N = 66), en comparación con el 18% y el 3%, respectivamente, en el grupo placebo (N = 62). Las respuestas fueron similares en pacientes que sí o no estaban recibiendo terapia concomitante con MTX al inicio.
Respuesta radiográfica
Los cambios radiográficos también se evaluaron en el estudio de PsA. Se obtuvieron radiografías de manos y muñecas al inicio y a los meses 6, 12 y 24. Los lectores cegados al grupo de tratamiento utilizaron una puntuación total modificada de Sharp (TSS), que incluía las articulaciones interfalángicas distales (es decir, no idéntica a la TSS modificada utilizada para la AR) para evaluar las radiografías. Algunas características radiográficas específicas de la PsA (por ejemplo, deformidad en lápiz y copa, ensanchamiento del espacio articular, osteólisis bruta y anquilosis) se incluyeron en el sistema de puntuación, pero otras (por ejemplo, resorción de la cresta falángica, periostitis yuxtaarticular y del eje) no.
La mayoría de los pacientes mostraron poco o ningún cambio en la TSS modificada durante este estudio de 24 meses (cambio mediano de 0 en ambos pacientes que inicialmente recibieron Enbrel o placebo). Más pacientes tratados con placebo experimentaron mayores magnitudes de empeoramiento radiográfico (aumento de TSS) en comparación con el tratamiento con Enbrel durante el período controlado del estudio. A los 12 meses, en un análisis exploratorio, el 12% (12 de 104) de los pacientes con placebo en comparación con ninguno de los 101 pacientes tratados con Enbrel tuvieron aumentos de 3 puntos o más en TSS. La inhibición de la progresión radiográfica se mantuvo en los pacientes que continuaron con Enbrel durante el segundo año. De los pacientes con radiografías de 1 y 2 años, el 3% (2 de 71) tuvieron aumentos de 3 puntos o más en TSS a los 1 y 2 años.
Respuesta de la función física
En el estudio de PsA, la función física y la discapacidad se evaluaron utilizando el Índice de Discapacidad HAQ (HAQ-DI) y la Encuesta de Salud SF-36. Los pacientes tratados con 25 mg de Enbrel dos veces por semana mostraron una mayor mejora desde el inicio en la puntuación HAQ-DI (disminuciones medias del 54% tanto a los 3 como a los 6 meses) en comparación con el placebo (disminuciones medias del 6% tanto a los 3 como a los 6 meses) (p < 0,001). A los 3 y 6 meses, los pacientes tratados con Enbrel mostraron una mayor mejora desde el inicio en la puntuación resumida del componente físico SF-36 en comparación con los pacientes tratados con placebo, y no hubo empeoramiento en la puntuación resumida del componente mental SF-36. Las mejoras en las medidas de función física y discapacidad se mantuvieron hasta por 2 años a través de la parte de etiqueta abierta del estudio.
14.4 Espondilitis anquilosante
La seguridad y eficacia de Enbrel se evaluaron en un estudio aleatorizado, doble ciego, controlado con placebo en 277 pacientes con AS activa. Los pacientes tenían entre 18 y 70 años de edad y tenían AS según la definición de los criterios modificados de Nueva York para la espondilitis anquilosante. Los pacientes debían tener evidencia de enfermedad activa basada en valores ≥ 30 en una escala analógica visual (VAS) de 0 a 100 unidades para el promedio de duración e intensidad de la rigidez matutina, y dos de los tres siguientes parámetros: a) evaluación global del paciente, b) promedio de dolor de espalda nocturno y total, y c) la puntuación promedio en el Índice Funcional de Espondilitis Anquilosante de Bath (BASFI). Los pacientes con anquilosis completa de la columna vertebral fueron excluidos de la participación en el estudio. Los pacientes que tomaban hidroxicloroquina, sulfasalazina, metotrexato o prednisona (≤ 10 mg/día) podían continuar con estos medicamentos a dosis estables durante la duración del estudio. Se administraron dosis de 25 mg de Enbrel o placebo SC dos veces por semana durante 6 meses.
La medida principal de eficacia fue una mejora del 20% en los criterios de respuesta de la Evaluación en Espondilitis Anquilosante (ASAS). En comparación con el placebo, el tratamiento con Enbrel dio como resultado mejoras en el ASAS y otras medidas de actividad de la enfermedad (Figura 2 y Tabla 12).
| Figura 2. Respuestas ASAS 20 en espondilitis anquilosante |
|---|
 |
A las 12 semanas, las respuestas ASAS 20/50/70 se lograron en el 60%, 45% y 29%, respectivamente, de los pacientes que recibieron Enbrel, en comparación con el 27%, 13% y 7%, respectivamente, de los pacientes que recibieron placebo (p ≤ 0,0001, Enbrel versus placebo). Se observaron respuestas similares en la semana 24. Las respuestas fueron similares entre los pacientes que recibieron terapias concomitantes al inicio del estudio y los que no. Los resultados de este estudio fueron similares a los observados en un estudio unicéntrico, aleatorizado, controlado con placebo de 40 pacientes y un estudio multicéntrico, aleatorizado, controlado con placebo de 84 pacientes con AS.
| Placebo N = 139 |
Enbrel* N = 138 |
|||
|---|---|---|---|---|
| Valores medianos en los puntos de tiempo | Línea de base | 6 meses | Línea de base | 6 meses |
|
||||
| Criterios de respuesta ASAS | ||||
| Evaluación global del paciente † | 63 | 56 | 63 | 36 |
| Dolor de espalda ‡ | 62 | 56 | 60 | 34 |
| BASFI § | 56 | 55 | 52 | 36 |
| Inflamación ¶ | 64 | 57 | 61 | 33 |
| Reactivos de fase aguda | ||||
| PCR (mg/dL) # | 2,0 | 1,9 | 1,9 | 0,6 |
| Movilidad espinal (cm): | ||||
| Prueba de Schober modificada | 3,0 | 2,9 | 3,1 | 3,3 |
| Expansión del pecho | 3,2 | 3,0 | 3,3 | 3,9 |
| Medida de occipucio a pared | 5,3 | 6,0 | 5,6 | 4,5 |
14.5 Psoriasis en placa en adultos
La seguridad y eficacia de Enbrel se evaluaron en dos estudios aleatorizados, doble ciego, controlados con placebo en adultos con PsO crónica estable que afectaba ≥ 10% del área de la superficie corporal, una puntuación mínima del Índice de Área y Severidad de la Psoriasis (PASI) de 10 y que habían recibido o eran candidatos a terapia antipsoriásica sistémica o fototerapia. Los pacientes con psoriasis guttata, eritrodérmica o pustulosa y los pacientes con infecciones graves dentro de las 4 semanas previas a la selección fueron excluidos del estudio. No se permitieron terapias antipsoriásicas mayores concomitantes durante el estudio.
El estudio I evaluó a 672 sujetos que recibieron placebo o Enbrel SC en dosis de 25 mg una vez a la semana, 25 mg dos veces a la semana o 50 mg dos veces a la semana durante 3 meses. Después de 3 meses, los sujetos continuaron con tratamientos ciegos durante 3 meses adicionales, tiempo durante el cual los sujetos originalmente asignados al azar al placebo comenzaron el tratamiento con Enbrel ciego a 25 mg dos veces por semana (designado como placebo/Enbrel en la Tabla 13); los sujetos originalmente asignados al azar a Enbrel continuaron con la dosis originalmente asignada al azar (designado como grupos Enbrel/Enbrel en la Tabla 13).
El estudio II evaluó a 611 sujetos que recibieron placebo o Enbrel SC en dosis de 25 mg o 50 mg dos veces a la semana durante 3 meses. Después de 3 meses de tratamiento aleatorizado y ciego, los sujetos en los tres brazos comenzaron a recibir Enbrel de etiqueta abierta a 25 mg dos veces por semana durante 9 meses adicionales.
La respuesta al tratamiento en ambos estudios se evaluó después de 3 meses de terapia y se definió como la proporción de sujetos que lograron una reducción en la puntuación PASI de al menos 75% desde el inicio. El PASI es una puntuación compuesta que tiene en cuenta tanto la fracción del área de la superficie corporal afectada como la naturaleza y gravedad de los cambios psoriásicos dentro de las regiones afectadas (induración, eritema y descamación).
Otros resultados evaluados incluyeron la proporción de sujetos que lograron una puntuación de “limpio” o “mínimo” según la Evaluación Global del Médico Estático (sPGA) y la proporción de sujetos con una reducción del PASI de al menos 50% desde el inicio. El sPGA es una escala de 6 categorías que va de “5 = severo” a “0 = ninguno” que indica la evaluación general del médico de la gravedad de la PsO centrándose en la induración, el eritema y la descamación. El éxito del tratamiento de “limpio” o “mínimo” consistió en ninguna o mínima elevación en la placa, hasta una coloración roja tenue en el eritema y ninguna o mínima escala fina sobre < 5% de la placa.
Los sujetos en todos los grupos de tratamiento y en ambos estudios tuvieron una puntuación PASI mediana al inicio que osciló entre 15 y 17, y el porcentaje de sujetos con clasificaciones sPGA al inicio osciló entre 54% y 66% para moderado, 17% y 26% para marcado y 1% y 5% para severo. En todos los grupos de tratamiento, el porcentaje de sujetos que previamente recibieron terapia sistémica para PsO osciló entre 61% y 65% en el Estudio I y 71% y 75% en el Estudio II, y aquellos que previamente recibieron fototerapia osciló entre 44% y 50% en el Estudio I y 72% y 73% en el Estudio II.
Más sujetos asignados al azar a Enbrel que al placebo lograron al menos una reducción del 75% desde el inicio de la puntuación PASI (PASI 75) con una relación dosis-respuesta en todas las dosis de 25 mg una vez a la semana, 25 mg dos veces a la semana y 50 mg dos veces a la semana (Tablas 13 y 14). Los componentes individuales del PASI (induración, eritema y descamación) contribuyeron de manera comparable a la mejora general del tratamiento en el PASI.
| Placebo/Enbrel | Enbrel/Enbrel | |||
|---|---|---|---|---|
| 25 mg BIW | 25 mg QW | 25 mg BIW | 50 mg BIW | |
| (N = 168) | (N = 169) | (N = 167) | (N = 168) | |
| 3 meses | ||||
| PASI 75 n (%) | 6 (4%) | 23 (14%)* | 53 (32%)† | 79 (47%)† |
| Diferencia (95% IC) |
10% (4, 16) | 28% (21, 36) | 43% (35, 52) | |
| sPGA, “limpio” o “mínimo” n (%) | 8 (5%) | 36 (21%)† | 53 (32%)† | 79 (47%)† |
| Diferencia (95% IC) |
17% (10, 24) | 27% (19, 35) | 42% (34, 50) | |
| PASI 50 n (%) | 24 (14%) | 62 (37%)† | 90 (54%)† | 119 (71%)† |
| Diferencia (95% IC) |
22% (13, 31) | 40% (30, 49) | 57% (48, 65) | |
| 6 meses | ||||
| PASI 75 n (%) | 55 (33%) | 36 (21%) | 68 (41%) | 90 (54%) |
| Placebo | Enbrel | ||
|---|---|---|---|
| 25 mg BIW | 50 mg BIW | ||
| (N = 204) | (N = 204) | (N = 203) | |
|
|||
| PASI 75 n (%) | 6 (3%) | 66 (32%)* | 94 (46%)* |
| Diferencia (95% CI) | 29% (23, 36) | 43% (36, 51) | |
| sPGA, “claro” o “mínimo” n (%) | 7 (3%) | 75 (37%)* | 109 (54%)* |
| Diferencia (95% CI) | 34% (26, 41) | 50% (43, 58) | |
| PASI 50 n (%) | 18 (9%) | 124 (61%)* | 147 (72%)* |
| Diferencia (95% CI) | 52% (44, 60) | 64% (56, 71) | |
14.6 Psoriasis en placa pediátrica
Se inscribió en un estudio aleatorizado, doble ciego, controlado con placebo de 48 semanas a 211 sujetos pediátricos de 4 a 17 años de edad, con psoriasis en placa (PsO) de moderada a grave (como se define por una puntuación sPGA ≥ 3 [moderada, marcada o grave], que involucra ≥ 10% del área de superficie corporal, y una puntuación PASI ≥ 12) que eran candidatos a fototerapia o terapia sistémica, o que no estaban adecuadamente controlados con terapia tópica. Los sujetos en todos los grupos de tratamiento tenían una puntuación PASI basal mediana de 16,4, y el porcentaje de sujetos con clasificaciones sPGA basales fue del 65% para moderado, 31% para marcado y 3% para grave. En todos los grupos de tratamiento, el porcentaje de sujetos que previamente recibieron terapia sistémica o fototerapia para PsO fue del 57%.
Los sujetos recibieron Enbrel 0,8 mg/kg (hasta un máximo de 50 mg por dosis) o placebo una vez por semana durante las primeras 12 semanas. Después de 12 semanas, los sujetos ingresaron a un período de tratamiento abierto de 24 semanas, en el que todos los sujetos recibieron Enbrel a la misma dosis. Esto fue seguido por un período de retiro-retratamiento de 12 semanas.
La respuesta al tratamiento se evaluó después de 12 semanas de terapia y se definió como la proporción de sujetos que lograron una reducción en la puntuación PASI de al menos 75% desde el inicio. El PASI es una puntuación compuesta que tiene en cuenta tanto la fracción del área de superficie corporal afectada como la naturaleza y gravedad de los cambios psoriásicos dentro de las regiones afectadas (induración, eritema y descamación).
Otros resultados evaluados incluyeron la proporción de sujetos que lograron una puntuación de “claro” o “casi claro” por el sPGA y la proporción de sujetos con una reducción en la puntuación PASI de al menos 90% desde el inicio. El sPGA es una escala de 6 categorías que va de “5 = grave” a “0 = ninguno” que indica la evaluación general del médico de la gravedad de la PsO centrándose en la induración, el eritema y la descamación. El éxito del tratamiento de “claro” o “casi claro” consistió en ninguna o mínima elevación en la placa, hasta una coloración roja tenue en el eritema y ninguna o mínima escala fina sobre < 5% de la placa.
Los resultados de eficacia se resumen en la Tabla 15.
| Placebo (N = 105) |
Enbrel 0,8 mg/kg una vez por semana (N = 106) |
|
|---|---|---|
| PASI 75, n (%) | 12 (11%) | 60 (57%) |
| PASI 90, n (%) | 7 (7%) | 29 (27%) |
| sPGA “claro” o “casi claro” n (%) | 14 (13%) | 55 (52%) |
Mantenimiento de la respuesta
Para evaluar el mantenimiento de la respuesta, los sujetos que lograron una respuesta PASI 75 en la semana 36 fueron re-aleatorizados a Enbrel o placebo durante un período de retiro aleatorizado de 12 semanas. El mantenimiento de la respuesta PASI 75 se evaluó en la semana 48. La proporción de sujetos que mantuvieron la respuesta PASI 75 en la semana 48 fue mayor para los sujetos tratados con Enbrel (65%) en comparación con los tratados con placebo (49%).
15 REFERENCIAS
- Instituto Nacional del Cáncer. Programa de Base de Datos de Vigilancia, Epidemiología y Resultados Finales (SEER). Tasas Brutas de Incidencia SEER, 13 Registros, 1992-2002.
- Bröms G, Granath F, Ekbom A, et al. Bajo riesgo de defectos de nacimiento para bebés cuyas madres son tratadas con agentes anti-factor de necrosis tumoral durante el embarazo. Clin Gastroenterol Hepatol. 2016;14:234-241.e5
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
La inyección de Enbrel (etanercept) se suministra como una solución estéril, transparente e incolora, sin conservantes para administración subcutánea en jeringas precargadas de dosis única, un autoinyector SureClick precargado de dosis única de Enbrel con una aguja de calibre 27 y ½ pulgada, o un vial de dosis única. La jeringa precargada y el autoinyector SureClick no están fabricados con látex de caucho natural.
Cada cartucho precargado de dosis única Enbrel® Mini para usar con el autoinyector reutilizable AutoTouch® contiene 1.0 mL de 50 mg/mL de etanercept. El autoinyector reutilizable AutoTouch y el cartucho precargado de dosis única Enbrel Mini no están fabricados con látex de caucho natural.
El autoinyector reutilizable AutoTouch no contiene medicamento y debe usarse con un cartucho precargado de dosis única Enbrel Mini. Además, el autoinyector reutilizable AutoTouch Connect® permitiría la conectividad de datos a través de la tecnología inalámbrica Bluetooth.
| 50 mg/mL jeringa precargada de dosis única | Caja de 4 | NDC 58406-021-04 |
| 50 mg/mL autoinyector SureClick precargado de dosis única | Caja de 4 | NDC 58406-032-04 |
| 25 mg/0.5 mL jeringa precargada de dosis única | Caja de 4 | NDC 58406-010-04 |
| 50 mg/mL Cartucho precargado de dosis única Enbrel Mini para usar solo con el autoinyector reutilizable AutoTouch | Cartuchos: Caja de 4 | NDC 58406-044-04 |
| Autoinyector reutilizable AutoTouch Connect: Caja de 1 | NDC 58406-480-01 | |
| 25 mg/0.5 mL vial de dosis única | Caja de 4 | NDC 58406-055-04 |
Enbrel debe refrigerarse a una temperatura de 36°F a 46°F (2°C a 8°C) en la caja original para protegerlo de la luz o del daño físico. No almacene Enbrel en condiciones de calor o frío extremos. NO AGITAR. NO CONGELAR.
Para mayor comodidad, se permite el almacenamiento de jeringas precargadas de dosis única individuales, autoinyectores SureClick, viales de dosis única o cartuchos Enbrel Mini a temperatura ambiente de 68°F a 77°F (20°C a 25°C) por un período único máximo de 30 días, protegidos de la luz y de fuentes de calor. Una vez que una jeringa precargada de dosis única, un autoinyector SureClick, un vial de dosis única o un cartucho Enbrel Mini se ha almacenado a temperatura ambiente, no debe volver a colocarse en el refrigerador. Si no se utiliza dentro de los 30 días a temperatura ambiente, la jeringa precargada de dosis única, el autoinyector SureClick, el vial de dosis única o el cartucho Enbrel Mini deben desecharse.
No utilice Enbrel después de la fecha de caducidad impresa en la caja o en la etiqueta del cilindro/cartucho. Mantener fuera del alcance de los niños.
El autoinyector reutilizable AutoTouch debe almacenarse a temperatura ambiente. No refrigere el autoinyector reutilizable AutoTouch.
Enbrel Polvo Liofilizado (Utilizado para la Dosificación Basada en el Peso)
Enbrel (etanercept) para inyección se suministra como polvo liofilizado para reconstitución en un vial multidosis. Cada vial se suministra en una caja que contiene cuatro bandejas de dosis. Cada bandeja de dosis contiene un vial de 25 mg de polvo liofilizado de etanercept, una jeringa de diluyente (1 mL de agua bacteriostática estéril para inyección, USP, que contiene 0.9% de alcohol bencílico), una aguja de calibre 27 de ½ pulgada, un adaptador de vial y un émbolo. Cada caja contiene cuatro etiquetas de “Fecha de mezcla:”.
| 25 mg vial multidosis | Caja de 4 | NDC 58406-425-34 |
Enbrel debe refrigerarse a una temperatura de 36°F a 46°F (2°C a 8°C) en la caja original para protegerlo de la luz o del daño físico. No almacene Enbrel en condiciones de calor o frío extremos. NO AGITAR. NO CONGELAR.
Para mayor comodidad, se permite el almacenamiento de una bandeja de dosis individual que contiene el vial multidosis de Enbrel y la jeringa de diluyente a temperatura ambiente de 68°F a 77°F (20°C a 25°C) por un período único máximo de 14 días, protegidos de la luz, fuentes de calor y humedad. Una vez que la bandeja de dosis se ha almacenado a temperatura ambiente, no debe volver a colocarse en el refrigerador. Si no se utiliza dentro de los 14 días a temperatura ambiente, la bandeja de dosis debe desecharse. Una vez reconstituido un vial, la solución debe utilizarse inmediatamente o puede refrigerarse hasta por 14 días.
No utilice Enbrel después de la fecha de caducidad impresa en la bandeja de dosis. Mantener fuera del alcance de los niños.
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente y/o cuidador que lea el etiquetado del paciente aprobado por la FDA (Guía de medicamentos e Instrucciones de uso) antes de que el paciente comience a usar Enbrel, y cada vez que se renueve la receta, ya que puede haber nueva información que deba conocer.
Los pacientes o sus cuidadores deben recibir la “Guía de medicamentos” de Enbrel y tener la oportunidad de leerla y hacer preguntas antes de iniciar la terapia. El profesional de la salud debe hacer preguntas al paciente para determinar cualquier factor de riesgo para el tratamiento. Los pacientes que desarrollen signos y síntomas de infección deben buscar evaluación médica de inmediato.
Asesoramiento al paciente
Se debe informar a los pacientes sobre los posibles beneficios y riesgos de Enbrel. Los médicos deben instruir a sus pacientes para que lean la Guía de medicamentos antes de comenzar la terapia con Enbrel y para que la vuelvan a leer cada vez que se renueve la receta.
Infecciones
Informe a los pacientes que Enbrel puede disminuir la capacidad de su sistema inmunitario para combatir infecciones. Aconseje a los pacientes sobre la importancia de ponerse en contacto con su médico si desarrollan algún síntoma de infección, tuberculosis o reactivación de infecciones por el virus de la hepatitis B.
Otras condiciones médicas
Aconseje a los pacientes que informen cualquier signo de nuevas condiciones médicas o que empeoren, como trastornos desmielinizantes del sistema nervioso central, insuficiencia cardíaca o trastornos autoinmunitarios, como síndrome similar al lupus o hepatitis autoinmune. Aconseje sobre el riesgo de linfoma y otras neoplasias malignas mientras reciben Enbrel. Aconseje a los pacientes que informen cualquier síntoma sugestivo de pancitopenia, como hematomas, sangrado, fiebre persistente o palidez.
Administración de Enbrel
Si un paciente o cuidador va a administrar Enbrel, se debe instruir al paciente o cuidador en las técnicas de inyección y cómo medir y administrar la dosis correcta [ver “Instrucciones de uso”]. Para la dosificación basada en el peso, instruya a los cuidadores y pacientes sobre las técnicas adecuadas para preparar, almacenar, medir y administrar la solución de Enbrel en un vial de dosis única o polvo liofilizado reconstituido en un vial de dosis múltiple.
La primera inyección debe realizarse bajo la supervisión de un profesional de la salud cualificado. Se debe evaluar la capacidad del paciente o cuidador para inyectar por vía subcutánea. Se debe instruir a los pacientes y cuidadores en la técnica, así como en la eliminación adecuada de jeringas y agujas, y se debe advertir contra la reutilización de agujas y jeringas.
Cuando se utiliza el autoinyector SureClick para administrar Enbrel, se debe informar al paciente o cuidador que la ventana se vuelve amarilla cuando la inyección está completa. Después de retirar el autoinyector, si la ventana no se ha vuelto amarilla, o si parece que el medicamento todavía se está inyectando, esto significa que el paciente no ha recibido una dosis completa. Se debe aconsejar al paciente o cuidador que llame a su médico de inmediato.
Cuando se utiliza el autoinyector reutilizable AutoTouch para administrar Enbrel, se debe informar al paciente o cuidador que el botón de estado se vuelve verde al entrar en contacto con la piel, parpadea en verde después de iniciar la inyección y se apaga al finalizar la inyección. Después de retirar el autoinyector reutilizable AutoTouch de la piel, si el botón de estado se ha vuelto rojo, se debe aconsejar al paciente o cuidador que llame inmediatamente al 1-888-4Enbrel (1-888-436-2735). Si parece que el medicamento todavía se está inyectando o todavía hay líquido en Enbrel Mini, esto significa que el paciente no ha recibido una dosis completa. Se debe aconsejar al paciente o cuidador que llame a su médico de inmediato.
Se debe utilizar un contenedor resistente a las punciones para la eliminación de agujas, jeringas, autoinyectores SureClick, viales de dosis única y cartuchos Enbrel Mini. Si el producto está destinado a un uso múltiple, se necesitarán jeringas, agujas y toallitas con alcohol adicionales.
Se puede aconsejar a los pacientes que llamen al 1-888-4ENBREL (1-888-436-2735) o visiten www.enbrel.com para obtener más información sobre Enbrel.
SECCIÓN NO CLASIFICADA DE SPL
AMGEN
Enbrel® (etanercept)
Fabricado por:
Immunex Corporation
Thousand Oaks, CA 91320-1799
Número de licencia de EE. UU. 1132
Patente: http://pat.amgen.com/enbrel/
© 1998-2024 Immunex Corporation. Todos los derechos reservados.
1XXXXXX – v73
 Este material impreso es reciclable.
Este material impreso es reciclable.
Guía de medicación
| Esta Guía del Medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos. | Revisado: 09/2024 | ||
| Guía del Medicamento | |||
| Enbrel® (en-brel) (etanercept) inyección, para uso subcutáneo |
Enbrel® (en-brel) (etanercept) para inyección, para uso subcutáneo |
||
| Lea la Guía del Medicamento que viene con Enbrel antes de comenzar a usarlo y cada vez que obtenga una nueva receta. Puede haber nueva información. Esta Guía del Medicamento no reemplaza hablar con su proveedor de atención médica sobre su condición médica o tratamiento. Es importante permanecer bajo el cuidado de su proveedor de atención médica mientras usa Enbrel. Enbrel es un medicamento recetado llamado bloqueador del Factor de Necrosis Tumoral (TNF) que afecta su sistema inmunológico. |
|||
|
¿Cuál es la información más importante que debo saber sobre Enbrel?
No debe comenzar a tomar Enbrel si tiene algún tipo de infección, a menos que su proveedor de atención médica diga que está bien.
Antes de comenzar a tomar Enbrel, asegúrese de hablar con su proveedor de atención médica: Enbrel puede no ser adecuado para usted. Antes de comenzar a tomar Enbrel, informe a su proveedor de atención médica sobre todas sus afecciones médicas, que incluyen:
Además, antes de comenzar a tomar Enbrel, informe a su proveedor de atención médica:
Lleve consigo una lista de todos sus medicamentos para mostrársela a su proveedor de atención médica y farmacéutico cada vez que obtenga un medicamento nuevo. Pregúntele a su proveedor de atención médica si no está seguro de si su medicamento está en la lista anterior.
Consulte la sección “¿Cuáles son los posibles efectos secundarios de Enbrel?“ a continuación para obtener más información. |
|||
| ¿Qué es Enbrel? Enbrel es un medicamento recetado llamado bloqueador del factor de necrosis tumoral (TNF). Enbrel se usa para tratar:
Puede continuar usando otros medicamentos que ayudan a tratar su condición mientras toma Enbrel, como los medicamentos antiinflamatorios no esteroideos (AINE) y los esteroides recetados, según lo recomendado por su proveedor de atención médica. |
|||
| ¿Quién no debe usar Enbrel? No use Enbrel si usted:
|
|||
¿Cómo debo usar Enbrel?
|
|||
|
¿Cuáles son los posibles efectos secundarios de Enbrel?
Los efectos secundarios comunes de Enbrel incluyen:
Estos no son todos los posibles efectos secundarios de Enbrel. Dígale a su proveedor de atención médica sobre cualquier efecto secundario que le moleste o que no desaparezca. |
|||
¿Cómo debo almacenar Enbrel?
|
|||
| Información general sobre el uso seguro y eficaz de Enbrel. Los medicamentos a veces se recetan para fines distintos a los que se enumeran en una Guía de Medicación. No use Enbrel para una afección para la que no se le ha recetado. No le dé Enbrel a otras personas, incluso si tienen los mismos síntomas que usted. Puede dañarlos. Esta Guía de Medicación resume la información más importante sobre Enbrel. Si desea más información, hable con su proveedor de atención médica. Puede pedir a su proveedor de atención médica o farmacéutico información sobre Enbrel que esté escrita para profesionales de la salud. |
|||
| ¿Cuáles son los ingredientes de Enbrel? Jeringa precargada de dosis única, autoinyector SureClick precargado de dosis única, vial de dosis única y cartucho de dosis única Enbrel Mini: Ingrediente activo: etanercept Ingredientes inactivos: clorhidrato de L-arginina, cloruro de sodio y sacarosa Vial de dosis múltiple: Ingrediente activo: etanercept Ingredientes inactivos: manitol, sacarosa, trometamina AMGEN Fabricado por: Immunex Corporation, Thousand Oaks, CA 91320-1799, Número de licencia de EE. UU. 1132 Immunex Corporation. Todos los derechos reservados. 1XXXXXX – v25 Para obtener más información, llame al 1 888 4ENBREL (1 888 436 2735) o www.enbrel.com. |
|||
|
|
|||
INSTRUCCIONES DE USO DE ENBREL® (en-brel) (etanercept) inyección, para uso subcutáneo 50 mg/ml autoinyector SureClick® de dosis única
Estas Instrucciones de uso contienen información sobre cómo inyectar ENBREL con un autoinyector SureClick.
Si su profesional sanitario decide que usted o un cuidador pueden administrarse las inyecciones de ENBREL en casa, debe recibir formación sobre la forma correcta de preparar e inyectar ENBREL. No intente inyectarse hasta que no le hayan mostrado la forma correcta de administrar las inyecciones su profesional sanitario o enfermero.
El medicamento del autoinyector ENBREL es para inyección bajo la piel (inyección subcutánea). Consulte la Guía del medicamento de ENBREL para obtener información sobre ENBREL.
Conocer su autoinyector precargado |
1. Información importante que debe saber antes de inyectar ENBREL
- Es importante que no intente administrarse la inyección hasta que no haya leído y comprendido completamente estas Instrucciones de uso.
- No utilice el autoinyector si la caja está dañada o el sello está roto.
- No utilice el autoinyector después de la fecha de caducidad que figura en la etiqueta.
- No agite el autoinyector.
- No retire la tapa blanca del autoinyector hasta que esté listo para inyectarse.
- No utilice el autoinyector si se ha congelado.
- No utilice el autoinyector si se ha caído sobre una superficie dura. Es posible que parte del autoinyector esté rota aunque no se vea la rotura. Utilice un autoinyector nuevo y llame al 1-888-4ENBREL (1-888-436-2735).
- Los niños deben pesar al menos 138 libras para usar el autoinyector Enbrel SureClick. Los niños que pesen menos de 138 libras deben usar una forma diferente de Enbrel.
- El autoinyector no está hecho con látex de caucho natural.
Preguntas frecuentes:
Para obtener información adicional y respuestas a las preguntas frecuentes, visite www.enbrel.com.
Dónde obtener ayuda:
Si desea obtener más información o ayuda sobre el uso de ENBREL:
- Póngase en contacto con su profesional sanitario,
- Visite www.enbrel.com, o
- Llame al 1-888-4ENBREL (1-888-436-2735).
2. Almacenamiento y preparación para inyectar ENBREL
 |
2a Refrigere la caja del autoinyector hasta que esté listo para usarlo.
- Mantenga el autoinyector en el refrigerador entre 36°F y 46°F (2°C y 8°C).
- Mantenga el autoinyector en la caja original para protegerlo de la luz o los daños físicos.
- No congele el autoinyector.
- No almacene el autoinyector en condiciones de calor o frío extremos. Por ejemplo, evite almacenarlo en la guantera o el maletero de su vehículo.
| Importante: Mantenga el autoinyector y todos los medicamentos fuera del alcance y la vista de los niños. |
ESPERE |
2b Espere 30 minutos para que el autoinyector alcance la temperatura ambiente.
- Saque el número de autoinyectores que necesita para su inyección y vuelva a colocar los autoinyectores no utilizados en el refrigerador.
- Levante el autoinyector(es) directamente de la caja.
- Deje que el autoinyector se caliente de forma natural.
- No caliente el autoinyector con agua caliente, un microondas o la luz solar directa.
- No agite el autoinyector en ningún momento.
- El uso del autoinyector a temperatura ambiente garantiza que se administre la dosis completa y permite una inyección más cómoda.
 |
2c Puede mantener ENBREL a temperatura ambiente hasta 30 días, si es necesario.
- Por ejemplo, cuando viaja, puede mantener ENBREL a temperatura ambiente.
- Manténgalo a temperatura ambiente entre 68°F y 77°F (20°C y 25°C).
- No lo vuelva a colocar en el refrigerador.
- Anote la fecha en que lo sacó del refrigerador y úselo en un plazo de 30 días.
| Importante: Coloque el autoinyector en un contenedor de eliminación de objetos punzantes si ha alcanzado la temperatura ambiente y no se ha utilizado en un plazo de 30 días. |
 |
2d Inspeccione el medicamento. Debe ser transparente e incoloro a ligeramente amarillo.
- Es normal ver burbujas de aire o pequeñas partículas blancas en el autoinyector.
- No use ENBREL si el medicamento está turbio, descolorido o contiene grumos grandes, escamas o partículas coloreadas.
| Importante: Si el medicamento está turbio, descolorido o contiene grumos grandes, escamas o partículas coloreadas, o si el autoinyector está dañado o vencido, llame al 1-888-4ENBREL (1-888-436-2735). |
 |
2e Compruebe la fecha de caducidad (Exp.) e inspeccione el autoinyector para detectar daños.
- No use el autoinyector si la fecha de caducidad ha pasado.
-
No use el autoinyector si:
- falta o está suelta la tapa blanca.
- tiene grietas o partes rotas.
- se ha caído sobre una superficie dura.
- Asegúrese de tener el medicamento y la dosis correctos.
3. Preparándose para su inyección
 |
3a Reúna y coloque los siguientes artículos para su inyección en una superficie limpia, plana y bien iluminada:
- Autoinyector ENBREL (temperatura ambiente)
- Contenedor de eliminación de objetos punzantes [ver Eliminación de ENBREL y comprobación del sitio de inyección]
- Toallita con alcohol
- Vendaje adhesivo
- Bola de algodón o gasa
 |
3b Inyecte en uno de estos sitios.
- Inyecte en la parte delantera del muslo o el estómago (excepto en los 5 cm alrededor del ombligo).
- Otra persona puede inyectar en el muslo, el estómago o la parte posterior de la parte superior del brazo.
- Elija un sitio diferente para cada inyección.
| Importante: Evite las áreas con cicatrices o estrías, o donde la piel esté sensible, magullada, roja, dura, elevada, gruesa o con parches o lesiones de piel escamosa. |
 |
3c Lávese bien las manos con agua y jabón.
 |
3d Limpie el sitio de inyección con una toallita con alcohol.
- Deje que la piel se seque sola.
- No toque esta área de nuevo antes de inyectar.
4. Inyectando ENBREL
| Importante: Solo retire la tapa blanca cuando pueda inyectar de inmediato (dentro de los 5 minutos) porque el medicamento puede secarse. No vuelva a tapar. |
 |
4a Sujete el autoinyector de modo que pueda ver la ventana. Tire de la tapa blanca hacia afuera. Es posible que deba tirar con fuerza.
- No gire, doble ni mueva la tapa blanca para quitarla.
- Nunca vuelva a colocar la tapa blanca. Puede dañar la aguja.
- No coloque el dedo dentro del protector de seguridad verde oscuro.
- Es normal ver una gota de medicamento en el extremo de la aguja o en el protector de seguridad verde oscuro.
 |
4b Estire o pellizque la piel para crear una superficie firme en el sitio de inyección. Coloque el protector de seguridad verde oscuro directamente contra la piel.
- Mantenga la piel estirada o pellizcada hasta que termine la inyección.
- Asegúrese de poder ver la ventana.
- Asegúrese de que el autoinyector esté colocado en posición recta en el sitio de inyección (en un ángulo de 90 grados).
| PRESIONE y mantenga contra la piel  |
4c Empuje el autoinyector hacia abajo con firmeza hasta que el protector de seguridad verde oscuro deje de moverse. Mantenga el autoinyector hacia abajo, no lo levante.
- El protector de seguridad verde oscuro se empuja hacia adentro y desbloquea el botón de inicio morado.
| PRESIONE el botón de inicio morado  |
4d Mantenga el autoinyector hacia abajo y presione el botón de inicio morado para iniciar la inyección.
- Es posible que escuche o sienta un clic.
- La ventana comienza a ponerse amarilla.
- Está bien soltar el botón de inicio morado.
| OBSERVE y CONFIRME que la ventana se ponga completamente amarilla  |
4e Mantenga el autoinyector hacia abajo. Cuando la ventana esté completamente amarilla, la inyección estará completa.
- La inyección puede tardar hasta 15 segundos en completarse.
- Es posible que escuche o sienta un clic.
- Levante el autoinyector de la piel.
- El protector de seguridad verde oscuro se bloquea alrededor de la aguja.
| Importante: Si la ventana no se ha puesto completamente amarilla, o parece que el medicamento todavía está saliendo, no ha recibido una dosis completa. Llame a su proveedor de atención médica de inmediato. |
5. Desecho de ENBREL y comprobación del sitio de inyección
 |
5a Coloque el autoinyector usado y la tapa blanca en un contenedor de eliminación de objetos punzantes aprobado por la FDA inmediatamente después de su uso.
| Importante: No tire el autoinyector a la basura de su hogar. |
- No reutilice el autoinyector.
- No toque el protector de seguridad verde oscuro.
 |
5b Compruebe el sitio de inyección.
- No frote el sitio de inyección.
- Si hay sangre, presione una bola de algodón o una gasa en el sitio de inyección. Aplique un vendaje adhesivo si es necesario.
Información adicional sobre su contenedor de eliminación de objetos punzantes
Si no tiene un contenedor de eliminación de objetos punzantes aprobado por la FDA, puede usar un contenedor doméstico que sea:
- hecho de plástico de alta resistencia,
- se puede cerrar con una tapa hermética y resistente a las perforaciones, sin que los objetos punzantes puedan salir,
- vertical y estable durante el uso,
- resistente a las fugas, y
- adecuadamente etiquetado para advertir sobre los residuos peligrosos dentro del contenedor.
Eliminación de los contenedores de eliminación de objetos punzantes:
Cuando su contenedor de eliminación de objetos punzantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de desechar su contenedor de eliminación de objetos punzantes.
Puede haber leyes estatales o locales sobre cómo debe desechar las agujas y jeringas usadas.
Para obtener más información sobre la eliminación segura de objetos punzantes y para obtener información específica sobre la eliminación de objetos punzantes en el estado en el que vive, visite el sitio web de la FDA en:
http://www.fda.gov/safesharpsdisposal
No deseche su contenedor de eliminación de objetos punzantes usado en la basura de su hogar a menos que las pautas de su comunidad lo permitan.
No recicle su contenedor de eliminación de objetos punzantes usado.
Importante: Mantenga el autoinyector y el contenedor de eliminación de objetos punzantes fuera de la vista y el alcance de los niños. Para obtener más información o ayuda, llame al 1-888-4ENBREL (1-888-436-2735).
ENBREL (etanercept)
AMGEN®
Fabricado por:
Immunex Corporation
Thousand Oaks, CA 91320-1799
Número de licencia de EE. UU. 1132
©1998 – 2016, 2019-2024 Immunex Corporation. Todos los derechos reservados.
nnnnnnnnnn
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los EE. UU.
Revisado: 07/2024
V19
Instrucciones de uso Enbrel® (en-brel) (etanercept) inyección, para uso subcutáneo Jeringa precargada de dosis única
¿Cómo preparo y administro una inyección con la jeringa precargada de dosis única de Enbrel?
Hay 2 tipos de jeringas precargadas de dosis única de Enbrel:
- La jeringa precargada de dosis única de 50 mg/mL que contiene una dosis de 50 mg de Enbrel.
- La jeringa precargada de dosis única de 25 mg/0.5 mL que contiene una dosis de 25 mg de Enbrel.
Su profesional de la salud le dirá cuál usar.
Una dosis de 50 mg se puede administrar como una inyección usando una jeringa precargada de dosis única de 50 mg/mL o como dos inyecciones usando jeringas precargadas de dosis única de 25 mg/0.5 mL. Su profesional de la salud le dirá si las dos inyecciones con jeringas precargadas de dosis única de 25 mg/0.5 mL deben administrarse el mismo día una vez a la semana o en dos días diferentes (con 3 o 4 días de diferencia) en la misma semana.
Los niños deben pesar al menos 138 libras para usar la jeringa precargada de dosis única de Enbrel 50 mg/mL. Los niños que pesan menos de 138 libras deben usar una forma diferente de Enbrel. La jeringa precargada de dosis única de Enbrel 25 mg/0.5 mL no debe usarse en pacientes pediátricos que pesen menos de 68 libras.
Importante: La jeringa precargada de Enbrel no está hecha con látex de caucho natural.
Almacenamiento de su jeringa precargada de Enbrel
- Almacene la jeringa precargada de Enbrel en el refrigerador a 36°F a 46°F (2°C a 8°C).
- Almacene la jeringa precargada de Enbrel en la caja original para protegerla de la luz o daños físicos.
- Si es necesario, puede almacenar su jeringa precargada de Enbrel a temperatura ambiente entre 68°F a 77°F (20°C a 25°C) por hasta 30 días.
- Una vez que la jeringa precargada de Enbrel haya alcanzado la temperatura ambiente, no la vuelva a poner en el refrigerador.
- Deseche cualquier jeringa precargada de Enbrel que se haya almacenado a temperatura ambiente después de 30 días.
- No almacene la jeringa precargada de Enbrel en calor o frío extremos. Por ejemplo, evite almacenar la jeringa precargada de Enbrel en la guantera o el maletero de su vehículo.
- No congelar.
- No agitar.
- Mantenga la jeringa precargada de Enbrel y todos los medicamentos fuera del alcance de los niños.
Si tiene alguna pregunta sobre el almacenamiento, comuníquese con su profesional de la salud o llame al 1-888-4ENBREL (1-888-436-2735) para obtener más instrucciones.
Paso 1: Preparación para una inyección
- Seleccione una superficie de trabajo limpia, bien iluminada y plana, como una mesa.
- Saque la caja de Enbrel que contiene las jeringas precargadas del refrigerador y colóquela en su superficie de trabajo plana. Saque una jeringa precargada y colóquela en su superficie de trabajo. Levante con cuidado la jeringa precargada directamente de la caja. No agite la jeringa precargada de Enbrel. Vuelva a colocar la caja que contiene las jeringas precargadas restantes en el refrigerador a 36°F a 46°F (2°C a 8°C).
- Compruebe la fecha de caducidad en la jeringa precargada. Si la fecha de caducidad ha pasado, no use la jeringa precargada y comuníquese con su farmacéutico o llame al 1-888-4ENBREL (1-888-436-2735) para obtener ayuda.
- No use la jeringa precargada si falta la cubierta de la aguja o no está bien sujeta. Llame al 1-888-4ENBREL (1-888-436-2735).
- Para una inyección más cómoda, deje la jeringa precargada a temperatura ambiente durante unos 15 a 30 minutos antes de inyectarla. No retire la cubierta de la aguja mientras la deja alcanzar la temperatura ambiente. No caliente Enbrel de ninguna otra manera (por ejemplo, no lo caliente en un microondas o en agua caliente).
- Sostenga la jeringa precargada con la aguja cubierta apuntando hacia abajo. Si se ven burbujas en la jeringa, golpee muy suavemente la jeringa precargada para permitir que las burbujas suban a la parte superior de la jeringa. Gire la jeringa de modo que las líneas horizontales moradas en el barril estén directamente frente a usted. Compruebe si la cantidad de líquido en la jeringa cae entre las líneas moradas. La parte superior del líquido puede estar curvada. Si la jeringa no tiene la cantidad correcta de líquido, no use esa jeringa. Comuníquese con su farmacéutico o llame al 1-888-4ENBREL (1-888-436-2735) para obtener ayuda.

Indicador de nivel de llenado - Reúna los suministros adicionales que necesitará para su inyección. Estos incluyen una torunda con alcohol, una bola de algodón o gasa y un contenedor de eliminación de objetos punzantes (consulte “Paso 4: Eliminación de los suministros“).
- Lávese las manos con agua y jabón.
- Asegúrese de que la solución en la jeringa precargada esté clara e incolora. Es posible que observe pequeñas partículas blancas en la solución. Estas partículas se forman a partir de Enbrel y esto es aceptable. Sin embargo, no inyecte la solución si está turbia o descolorida, o contiene partículas grandes o coloreadas, llame al 1-888-4ENBREL (1-888-436-2735).
Paso 2: Elegir y preparar un sitio de inyección
- Los sitios de inyección recomendados para Enbrel utilizando una jeringa precargada incluyen:
- la parte delantera de la mitad del muslo
- el área del estómago (abdomen), excepto el área de 2 pulgadas alrededor del ombligo (ombligo)
- el área externa de la parte superior del brazo (solo si otra persona le está administrando la inyección)
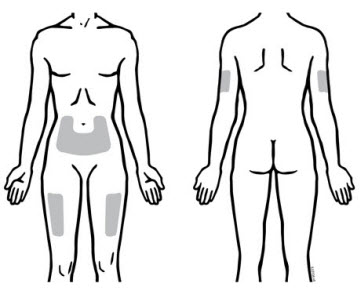
Frente Espalda
- Rote el sitio para cada inyección. No inyecte en áreas donde la piel esté sensible, magullada, roja o dura. Evite las áreas con cicatrices o estrías.
- Si tiene psoriasis, no debe inyectar directamente en ninguna mancha o lesión de la piel elevada, gruesa, roja o escamosa.
- Para preparar el área de la piel donde se va a inyectar Enbrel, limpie el sitio de inyección con una torunda con alcohol. No vuelva a tocar esta área antes de administrar la inyección.
Paso 3: Inyectar Enbrel utilizando una jeringa precargada
No retire la cubierta de la aguja de la jeringa precargada hasta que esté listo para inyectar.
- Tome la jeringa precargada de su superficie de trabajo plana. Sostenga el barril de la jeringa precargada con una mano y tire de la cubierta de la aguja hacia afuera, solo cuando esté listo para inyectar. No deje la cubierta de la aguja fuera por más de 5 minutos. Esto puede secar el medicamento.

 Para evitar dañar la aguja, no gire ni doble la cubierta de la aguja mientras la retira, y no intente volver a colocar la cubierta de la aguja en la jeringa precargada.
Para evitar dañar la aguja, no gire ni doble la cubierta de la aguja mientras la retira, y no intente volver a colocar la cubierta de la aguja en la jeringa precargada.
Cuando retire la cubierta de la aguja, puede haber una gota de líquido en el extremo de la aguja; esto es normal. No toque la aguja ni permita que toque ninguna superficie. No toque ni golpee el émbolo. Si lo hace, el líquido podría filtrarse.- Sosteniendo la jeringa con la aguja apuntando hacia arriba, revise la jeringa para ver si hay burbujas de aire. Si hay burbujas, golpee suavemente la jeringa con el dedo hasta que las burbujas de aire suban a la parte superior de la jeringa. Empuje lentamente el émbolo hacia arriba para expulsar las burbujas de aire de la jeringa.
- Sosteniendo la jeringa en una mano como un lápiz, use la otra mano para pellizcar suavemente un pliegue de piel en el sitio de inyección limpio y sosténgalo firmemente.
- Con un movimiento rápido y “tipo dardo”, inserte la aguja en un ángulo de 45 grados en la piel.

- Cuando la aguja esté completamente insertada en la piel, suelte la piel que está sosteniendo. Con la mano libre, sostenga la jeringa cerca de su base para estabilizarla. Luego, empuje el émbolo para inyectar toda la solución de Enbrel a una velocidad lenta y constante.
- Cuando la jeringa esté vacía, retire la aguja de la piel, teniendo cuidado de mantenerla en el mismo ángulo que la inserción. Puede haber un poco de sangrado en el sitio de inyección. Puede presionar una bola de algodón o una gasa sobre el sitio de inyección durante 10 segundos. No frote el sitio de inyección. Si es necesario, puede cubrir el sitio de inyección con un vendaje.
Paso 4: Desecho de los suministros
La jeringa nunca debe reutilizarse. Nunca vuelva a colocar la tapa a una aguja.
- Coloque las jeringas precargadas usadas en un contenedor de eliminación de objetos punzantes aprobado por la FDA inmediatamente después de su uso. No tire (deseche) las jeringas precargadas en la basura de su hogar.
- Si no tiene un contenedor de eliminación de objetos punzantes aprobado por la FDA, puede usar un contenedor doméstico que sea:
- hecho de plástico resistente,
- se puede cerrar con una tapa hermética y resistente a las perforaciones, sin que los objetos punzantes puedan salir,
- vertical y estable durante el uso,
- a prueba de fugas, y
- adecuadamente etiquetado para advertir sobre los residuos peligrosos dentro del contenedor.
- Cuando su contenedor de eliminación de objetos punzantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de desechar su contenedor de eliminación de objetos punzantes. Puede haber leyes estatales o locales sobre cómo debe desechar las jeringas y agujas usadas. Para obtener más información sobre la eliminación segura de objetos punzantes y para obtener información específica sobre la eliminación de objetos punzantes en el estado en el que vive, visite el sitio web de la FDA en: http://www.fda.gov/safesharpsdisposal
- No reutilice la jeringa.
- No recicle la jeringa o el contenedor de eliminación de objetos punzantes ni los tire a la basura doméstica.
Importante: Mantenga siempre el contenedor de eliminación de objetos punzantes fuera del alcance de los niños.
Un profesional de la salud familiarizado con Enbrel debe responder todas las preguntas. Llame al 1-888-4ENBREL (1-888-436-2735) o visite www.enbrel.com para obtener más información sobre Enbrel.
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los EE. UU.
AMGEN®
Fabricado por:
Immunex Corporation
Thousand Oaks, CA 91320-1799
Número de licencia de EE. UU. 1132
© 1998 – 2016, 2019-2020, 2022-2023 Immunex Corporation. Todos los derechos reservados.1XXXXXX – v12
Revisado: 06/2023 Este material impreso es reciclable.
Este material impreso es reciclable.Instrucciones de uso Enbrel® (en-brel) (etanercept) para inyección, para uso subcutáneo Vial multidosis
¿Cómo preparo y administro una inyección con el vial de dosis múltiples de Enbrel?
Un vial de dosis múltiples contiene 25 mg de Enbrel.
Almacenamiento del vial de dosis múltiples de Enbrel
- Almacene el vial de dosis múltiples de Enbrel en el refrigerador a 36°F a 46°F (2°C a 8°C).
- Almacene el vial de dosis múltiples de Enbrel en la caja original para protegerlo de la luz o daños físicos.
- Si es necesario, puede almacenar su vial de dosis múltiples de Enbrel y la jeringa con diluyente (bandeja de dosis) a temperatura ambiente entre 68°F a 77°F (20°C a 25°C) durante un máximo de 14 días.
○ Una vez que el vial de dosis múltiples de Enbrel haya alcanzado la temperatura ambiente, no lo vuelva a colocar en el refrigerador. - Deseche el vial de dosis múltiples de Enbrel que se haya almacenado a temperatura ambiente después de 14 días.
- El vial de dosis múltiples de Enbrel mezclado (reconstituido) debe usarse de inmediato o mantenerse en el refrigerador a 36°F a 46°F (2°C a 8°C) durante un máximo de 14 días.
- No almacene el vial de dosis múltiples de Enbrel en calor o frío extremos. Por ejemplo, evite almacenar el vial de dosis múltiples de Enbrel en la guantera o el maletero de su vehículo.
- No congele.
-
No agite.
- Mantenga el vial de dosis múltiples de Enbrel y todos los medicamentos fuera del alcance de los niños.
Si tiene alguna pregunta sobre el almacenamiento, comuníquese con su proveedor de atención médica o llame al 1-888-4ENBREL (1-888-436-2735) para obtener más instrucciones.
Paso 1: Preparación para una inyección
- Seleccione una superficie de trabajo limpia, bien iluminada y plana, como una mesa.
- Saque la bandeja de dosis de Enbrel del refrigerador y colóquela sobre su superficie de trabajo plana.
- Compruebe la fecha de caducidad de la bandeja de dosis. Si la fecha de caducidad ha pasado, no use la bandeja de dosis. También verifique que la bandeja de dosis tenga 5 artículos como se muestra a continuación:
• Una jeringa con diluyente prellenada que contiene 1 mL de diluyente (líquido) con adaptador adjunto y tapa extraíble
• Un émbolo
• Un vial de Enbrel
• Una aguja de 27 calibre de ½ pulgada en una cubierta de plástico duro
• Un adaptador de vial
Si la fecha de caducidad ha pasado, los cinco artículos no están incluidos en la bandeja de dosis o si algún artículo parece dañado, comuníquese con su farmacéutico o llame al 1-888-4ENBREL (1-888-436-2735) para obtener ayuda.
- Para una inyección más cómoda, deje la bandeja de dosis a temperatura ambiente durante unos 15 a 30 minutos antes de inyectarla.
- Lávese las manos con agua y jabón.
- Despegue el sello de papel de la bandeja de dosis y retire todos los artículos.
- Inspeccione el volumen de diluyente en la jeringa con la tapa extraíble apuntando hacia abajo. Use las marcas de la unidad en el lateral de la jeringa para asegurarse de que haya al menos 1 mL de líquido en la jeringa. Si el nivel de líquido está por debajo de la marca de 1 mL, no lo use. Comuníquese con su farmacéutico o llame al 1-888-4ENBREL (1-888-436-2735) para obtener ayuda.
- No use la jeringa si falta la tapa extraíble o no está bien sujeta. Llame al 1-888-4ENBREL (1-888-436-2735).
- Deben estar disponibles dos torundas con alcohol para la preparación e inyección de Enbrel. Las torundas con alcohol se pueden encontrar en su farmacia local.
Paso 2: Preparación de la solución de Enbrel
Hay dos métodos para preparar la solución de Enbrel. Para algunos niños, un vial de solución de Enbrel se puede usar para más de una dosis. El método a mano alzada debe usarse para niños que usan Enbrel que usan un vial de solución de Enbrel para más de una dosis. No debe usar el método del adaptador de vial si va a usar el vial más de una vez. Pregúntele a su proveedor de atención médica si tiene alguna pregunta sobre qué método usar.
- El método del adaptador de vial
Los adultos y los niños más grandes que usan Enbrel pueden usar el dispositivo adaptador de vial para ayudar a mezclar el polvo con el líquido y extraer Enbrel, y luego usar una aguja de 27 calibre para inyectar la dosis. Este método no debe usarse para niños que usan múltiples dosis del mismo vial de Enbrel. Las instrucciones para usar el método del adaptador de vial están en el Paso 2A.
- El método a mano alzada
En el método a mano alzada, se usa una aguja de 25 calibre para ayudar a mezclar el polvo con el líquido y extraer Enbrel, y se usa una aguja de 27 calibre para inyectar la dosis. Obtenga agujas de 25 calibre de su proveedor de atención médica. Las instrucciones para usar el método a mano alzada están en el Paso 2B.
Las instrucciones para preparar dosis adicionales del mismo vial de solución de Enbrel están en el Paso 3. Para cada dosis adicional, necesitará dos agujas nuevas (una aguja de 25 calibre para extraer la solución y una aguja de 27 calibre para la inyección) y una jeringa vacía nueva (1 mL). Nunca reutilice una jeringa o una aguja.
Si está usando el vial de Enbrel para más de una dosis, debe escribir la fecha en que mezcló el polvo y el líquido en el área marcada “Fecha de mezcla:” en la etiqueta que se proporciona con estas instrucciones y adjuntar la etiqueta al vial de Enbrel.
Después de haber extraído la dosis de Enbrel que necesita, almacene el vial de Enbrel (en la bandeja de dosis) en el refrigerador a 36º a 46ºF (2º a 8ºC) lo antes posible, pero siempre dentro de las 4 horas posteriores a la mezcla de la solución. No congele. Si tiene alguna pregunta sobre el almacenamiento, comuníquese con su proveedor de atención médica o llame al 1-888-4ENBREL (1-888-436-2735) para obtener más instrucciones.
La solución de Enbrel debe usarse dentro de los 14 días posteriores a la fecha de mezcla. Debe desechar el vial de Enbrel y cualquier solución restante si no se usa dentro de los 14 días. No mezcle ningún líquido restante en un vial de solución de Enbrel con otro.
PASO 2A: Método del adaptador de vial
- Retire la tapa de plástico rosa del vial de Enbrel. No quite el tapón gris o el anillo metálico plateado alrededor de la parte superior del vial de Enbrel.
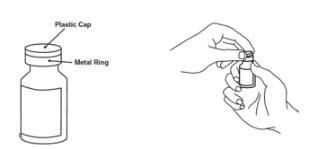
- Coloque el vial de Enbrel sobre su superficie de trabajo plana o voltee la bandeja de dosis boca abajo y coloque el vial de Enbrel en el espacio redondo marcado con “V”. Use una torunda con alcohol para limpiar el tapón gris del vial de Enbrel. No toque el tapón gris con las manos.
- Abra el envoltorio que contiene la aguja de calibre 27 separando las pestañas y deje la aguja a un lado para usarla más tarde.

- Abra el envoltorio que contiene el adaptador de vial separando las pestañas y deje el adaptador de vial a un lado para usarlo más tarde. No toque el extremo roscable del adaptador de vial ni la punta que hay dentro.

- Deslice el émbolo en el extremo de la brida de la jeringa.

- Fije el émbolo al tapón de goma gris de la jeringa girando el émbolo en el sentido de las agujas del reloj hasta que sienta una ligera resistencia.
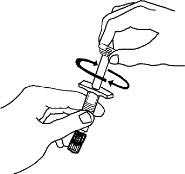
- Retire la tapa roscable de la jeringa precargada con diluyente girándola en sentido contrario a las agujas del reloj. No golpee ni toque el émbolo. Si lo hace, el líquido podría derramarse. Es posible que vea una gota de líquido al retirar la tapa. Esto es normal. Coloque la tapa sobre su superficie de trabajo plana. No toque la punta de la jeringa.

- Una vez que se retire la tapa roscable, tome el adaptador de vial con su mano libre. Rosque el adaptador de vial en la jeringa, girándolo en el sentido de las agujas del reloj hasta que sienta una ligera resistencia. No apriete demasiado.
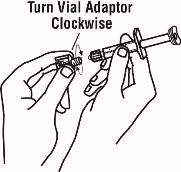
- Sostenga el vial de Enbrel en posición vertical sobre su superficie de trabajo plana. Agarre los lados del adaptador de vial y colóquelo sobre la parte superior del vial de Enbrel. No golpee ni toque el émbolo. Si lo hace, el líquido podría derramarse. Inserte el adaptador de vial en el tapón gris del vial de Enbrel. La punta de plástico dentro del adaptador de vial debe perforar el tapón gris. El adaptador de vial debe quedar bien ajustado.

- Sostenga el vial de Enbrel en posición vertical sobre su superficie de trabajo plana y empuje el émbolo hacia abajo hasta que todo el líquido de la jeringa esté en el vial de Enbrel. Es posible que vea espuma (burbujas) en el vial. Esto es normal.

- Gire suavemente el vial de Enbrel con un movimiento circular para disolver el polvo. Si utilizó la bandeja de dosis para sostener el vial de Enbrel, saque el vial (con el adaptador de vial y la jeringa aún conectados) de la bandeja de dosis y gire suavemente el vial con un movimiento circular para disolver el polvo.

No agite. Espere hasta que todo el polvo se disuelva (generalmente menos de 10 minutos). La solución debe ser transparente e incolora. Después de que el polvo se haya disuelto por completo, es posible que aún haya espuma (burbujas). Esto es normal. No inyecte la solución si está descolorida, contiene grumos, escamas o partículas. Si todo el polvo del vial de Enbrel no se disuelve o hay partículas presentes después de 10 minutos, llame al 1-888-4ENBREL (1-888-436-2735).
- Voltee el vial de Enbrel boca abajo. Sostenga la jeringa a la altura de los ojos y tire lentamente del émbolo hacia abajo hasta las marcas de unidades en el lateral de la jeringa que correspondan con la dosis de usted/su hijo. Para los pacientes adultos, retire todo el volumen (1 mL), a menos que su proveedor de atención médica le indique lo contrario. Tenga cuidado de no sacar el émbolo por completo de la jeringa. Es posible que quede algo de espuma blanca en el vial de Enbrel. Esto es normal.

- Compruebe si hay burbujas de aire en la jeringa. Golpee suavemente la jeringa para que las burbujas de aire suban a la parte superior de la jeringa. Empuje lentamente el émbolo hacia arriba para eliminar las burbujas de aire. Si empuja la solución de regreso al vial, tire lentamente del émbolo hacia atrás para volver a extraer la cantidad correcta de solución en la jeringa.

- Retire la jeringa del adaptador de vial, sosteniendo el adaptador de vial con una mano y girando la jeringa en sentido contrario a las agujas del reloj con la otra mano. No toque ni golpee el émbolo. Coloque el vial de Enbrel con el adaptador de vial sobre su superficie de trabajo plana.

- Continúe sosteniendo el cañón de la jeringa. Con su mano libre, rosque la aguja de calibre 27 en la punta de la jeringa hasta que quede bien ajustada. No quite la cubierta de la aguja de la jeringa. Coloque la jeringa sobre su superficie de trabajo plana hasta que esté listo para inyectar Enbrel.

Vaya al paso 4: Elegir y preparar un sitio de inyección.
Paso 2B: Método de mano-libre
Si está preparando una dosis de un vial de Enbrel que se usó anteriormente, vaya al paso 3: Preparación de dosis adicionales de un solo vial de Enbrel.
- Retire la tapa de plástico rosa del vial de Enbrel. No retire el tapón gris o el anillo metálico plateado alrededor de la parte superior del vial de Enbrel. Anote la fecha en que mezcló el polvo y la solución en la etiqueta proporcionada “Fecha de mezcla:” y péguela al vial de Enbrel.

- Coloque el vial de Enbrel sobre su superficie de trabajo plana. Use una torunda con alcohol para limpiar el tapón gris del vial de Enbrel. No toque el tapón gris con las manos.
- Abra el envoltorio que contiene la aguja de calibre 25 separando las pestañas y coloque la aguja a un lado para usarla más tarde. La aguja de calibre 25 se utilizará para mezclar el líquido con el polvo y para extraer Enbrel del vial.

- Deslice el émbolo en el extremo de la brida de la jeringa.

- Fije el émbolo al tapón de goma gris de la jeringa girando el émbolo en el sentido de las agujas del reloj hasta que sienta una ligera resistencia.
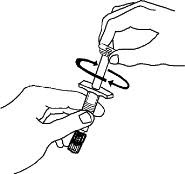
- Retire la tapa de rosca de la jeringa de diluyente precargada girándola en sentido contrario a las agujas del reloj. No toque ni golpee el émbolo. Si lo hace, el líquido podría derramarse. Es posible que vea una gota de líquido al retirar la tapa. Esto es normal. Coloque la tapa sobre su superficie de trabajo plana. No toque la punta de la jeringa.
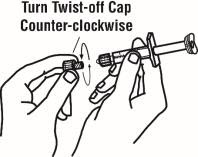
- Continúe sujetando el cañón de la jeringa. Con la mano libre, gire la aguja de calibre 25 en la punta de la jeringa hasta que encaje a presión. Coloque la jeringa sobre su superficie de trabajo plana.
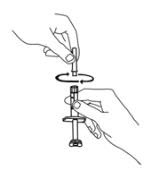
- Abra el envoltorio que contiene la aguja de calibre 27 separando las pestañas y coloque la aguja a un lado para usarla más tarde. La aguja de calibre 27 se utilizará para inyectar la dosis.

- Tome la jeringa de su superficie de trabajo plana. Sujete el cañón de la jeringa con una mano y tire de la cubierta de la aguja hacia arriba. Para evitar dañar la aguja, no gire ni doble la cubierta de la aguja mientras la retira. No toque la aguja ni permita que toque ninguna superficie. No toque ni golpee el émbolo. Si lo hace, el líquido podría derramarse.

- Coloque la cubierta de la aguja (con el lado abierto hacia arriba) en el espacio redondo marcado con “N” en la bandeja de dosis de Enbrel.

- Coloque el vial de Enbrel sobre su superficie de trabajo plana. Sujete la jeringa con la aguja hacia arriba y tire suavemente del émbolo para introducir una pequeña cantidad de aire en la jeringa. Luego, inserte la aguja recta hacia abajo a través del anillo central del tapón gris (vea las ilustraciones). Debería sentir una ligera resistencia y luego un “pop” cuando la aguja atraviesa el centro del tapón. Busque la punta de la aguja dentro de la ventana abierta del tapón. Si la aguja no está correctamente alineada con el centro del tapón, sentirá una resistencia constante a medida que atraviesa el tapón y no habrá ningún “pop”. La aguja puede entrar en ángulo y doblarse, romperse o impedir que agregue diluyente al vial de Enbrel.
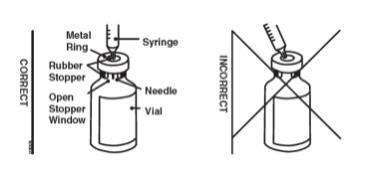
- Empuje el émbolo hacia abajo muy lentamente hasta que todo el líquido de la jeringa esté en el vial de Enbrel. Agregar el líquido demasiado rápido provocará espuma (burbujas).

- Deje la jeringa en su lugar. Gire suavemente el vial de Enbrel en un movimiento circular para disolver el polvo.

No agite. Espere hasta que todo el polvo se disuelva (generalmente menos de 10 minutos). La solución debe ser transparente e incolora. Después de que el polvo se haya disuelto por completo, es posible que aún haya espuma (burbujas). Esto es normal. No inyecte la solución si está descolorida, contiene grumos, escamas o partículas. Si todo el polvo del vial de Enbrel no se disuelve o hay partículas presentes después de 10 minutos, llame al 1-888-4ENBREL (1-888-436-2735).
- Con la aguja en el vial de Enbrel, voltee el vial. Sujete la jeringa a la altura de los ojos y tire lentamente del émbolo hacia abajo hasta las marcas de la unidad en el lateral de la jeringa que corresponden con la dosis correcta. Asegúrese de mantener la punta de la aguja en la solución. Es posible que quede algo de espuma blanca en el vial de Enbrel. Esto es normal.

- Con la aguja aún insertada en el vial de Enbrel, revise si hay burbujas de aire en la jeringa. Golpee suavemente la jeringa para que las burbujas de aire suban a la parte superior de la jeringa. Empuje lentamente el émbolo hacia arriba para eliminar las burbujas de aire. Si empuja la solución de regreso al vial, tire lentamente del émbolo hacia atrás para volver a extraer la cantidad correcta de solución en la jeringa.

- Retire la jeringa y la aguja del vial de Enbrel. Mantenga la aguja conectada a la jeringa e inserte la aguja de calibre 25 directamente hacia abajo en la cubierta de la aguja en la bandeja de dosis de Enbrel.

Debería escuchar un “chasquido” cuando la aguja esté segura en la cubierta de la aguja. Una vez que la aguja esté segura en la cubierta de la aguja, desenrosque la aguja de calibre 25 de la jeringa y deseche la aguja en su contenedor de eliminación de objetos punzantes (consulte “Paso 6: Eliminación de los suministros”).
- Gire la aguja de calibre 27 sobre la jeringa hasta que encaje perfectamente. No retire la cubierta de la aguja de la jeringa. Coloque la jeringa sobre su superficie de trabajo plana hasta que esté listo para inyectar Enbrel.

- Si queda suficiente solución en el vial de Enbrel para otra dosis, escriba la fecha en que mezcló el polvo y el líquido en el área marcada “Fecha de mezcla:” en la etiqueta que se proporciona con estas instrucciones y adjunte la etiqueta al vial de Enbrel. Refrigere el vial de Enbrel reconstituido (mezclado) (en la bandeja de dosis) después de mezclarlo. Prepare dosis adicionales del vial de Enbrel como se describe en el paso 3. De lo contrario, deseche el vial de Enbrel y cualquier solución restante.
Vaya al paso 4: Elegir y preparar un sitio de inyección.
Paso 3: Preparación de dosis adicionales de un solo vial de Enbrel
- Seleccione una superficie de trabajo plana, limpia y bien iluminada, como una mesa.
- No reutilice las agujas y jeringas que se suministran con la bandeja de dosis de Enbrel. Necesitará agujas y jeringas nuevas para cada dosis adicional. Su proveedor de atención médica le dirá qué tipo de jeringas (1 mL) y agujas (calibre 25 y calibre 27) debe usar. Coloque la jeringa estéril con una aguja de calibre 25 (para extraer Enbrel), una aguja de calibre 27 (para inyectar Enbrel) y dos hisopos con alcohol en su superficie de trabajo plana.
- Saque el vial de solución de Enbrel que está almacenado en la bandeja de dosis del refrigerador y colóquelo en su superficie de trabajo plana.
- Compruebe la fecha de mezcla que escribió en la etiqueta del vial de Enbrel. Deseche el vial de Enbrel si han pasado más de 14 días desde que se mezcló la solución de Enbrel.
- Lávese las manos con agua y jabón.
- Use un hisopo con alcohol para limpiar el tapón gris del vial de Enbrel. No toque el tapón con las manos.
- Si la jeringa y la aguja de calibre 25 no están preensambladas, ensamblelas según las instrucciones de su proveedor de atención médica.
- Abra el envoltorio que contiene la aguja de calibre 27 pelando las pestañas y coloque la aguja a un lado para usarla más tarde. La aguja de calibre 27 se utilizará para inyectar la dosis de Enbrel.
- Sostenga la jeringa y tire de la cubierta de la aguja directamente hacia afuera. Para evitar dañar la aguja, no gire ni doble la cubierta de la aguja mientras la retira. No toque la aguja ni permita que toque ninguna superficie. Coloque la cubierta de la aguja (con el lado abierto hacia arriba) en el espacio redondo marcado con “N” en la bandeja de dosis de Enbrel.
- Coloque el vial de Enbrel en su superficie de trabajo plana. Sostenga la jeringa con la aguja hacia arriba y tire suavemente del émbolo para aspirar una pequeña cantidad de aire en la jeringa. Luego, inserte la aguja de calibre 25 directamente hacia abajo a través del anillo central del tapón gris. Debería sentir una ligera resistencia y luego un “pop” cuando la aguja atraviese el centro del tapón. Busque la punta de la aguja dentro de la ventana del tapón abierto. Si la aguja no está correctamente alineada con el centro del tapón, sentirá una resistencia constante a medida que atraviesa el tapón y no habrá ningún “pop”. La aguja puede entrar en ángulo y doblarse, romperse o evitar que se extraiga correctamente la solución de Enbrel del vial.
- Mantenga la aguja en el vial de Enbrel y voltee el vial boca abajo. Sostenga la jeringa a la altura de los ojos y tire lentamente del émbolo hacia abajo hasta las marcas de la unidad en la jeringa que corresponden a la dosis de su hijo. A medida que la cantidad de solución en el vial de Enbrel disminuye, es posible que deba tirar de la aguja hacia atrás lo suficiente para mantener la punta de la aguja en la solución.
- Con la aguja aún insertada en el vial de Enbrel, revise si hay burbujas de aire en la jeringa. Golpee suavemente la jeringa para que las burbujas de aire suban a la parte superior de la jeringa. Empuje lentamente el émbolo hacia arriba para eliminar las burbujas de aire. Si empuja la solución de regreso al vial de Enbrel, tire lentamente del émbolo hacia atrás para volver a aspirar la cantidad correcta de solución en la jeringa.
- Retire la jeringa y la aguja del vial de Enbrel. Mantenga la aguja conectada a la jeringa e inserte la aguja de calibre 25 directamente hacia abajo en la cubierta de la aguja en la bandeja de dosis de Enbrel. Debería escuchar un “chasquido” cuando la aguja esté segura en la cubierta de la aguja. Una vez que la aguja esté segura en la cubierta de la aguja, retire la aguja de calibre 25 de la jeringa y deseche la aguja en un contenedor de eliminación de objetos punzantes (consulte “Paso 6: Eliminación de los suministros”).
- Conecte la aguja de calibre 27 a la punta de la jeringa hasta que encaje perfectamente. No retire la cubierta de la aguja de la jeringa. Coloque la jeringa sobre su superficie de trabajo plana hasta que esté listo para inyectar Enbrel.
Paso 4: Elegir y preparar un sitio de inyección
- Los 3 sitios de inyección recomendados para Enbrel incluyen:
• la parte delantera de la parte media de los muslos
• el área del estómago (abdomen), excepto el área de 2 pulgadas alrededor del ombligo (ombligo)
• el área externa de la parte superior de los brazos (solo si otra persona le está administrando la inyección)
- Rote el sitio para cada inyección. No inyecte en áreas donde la piel esté sensible, magullada, roja o dura. Evite las áreas con cicatrices o estrías.
- Si tiene psoriasis, no debe inyectar directamente en ninguna mancha o lesión de la piel elevada, gruesa, roja o escamosa.
- Para preparar el área de la piel donde se va a inyectar Enbrel, limpie el sitio de inyección con una nueva torunda con alcohol. No toque esta área nuevamente antes de administrar la inyección.
Paso 5: Inyección de la solución de Enbrel
No quite la cubierta de la aguja de la jeringa hasta que esté listo para inyectar.
- Tome la jeringa de su superficie de trabajo plana. Sostenga el barril de la jeringa con una mano y tire de la cubierta de la aguja hacia afuera. Para evitar dañar la aguja, no gire ni doble la cubierta de la aguja mientras la está quitando, y no intente volver a colocar la cubierta de la aguja en la jeringa. Cuando retire la cubierta de la aguja, puede haber una gota de líquido en el extremo de la aguja. Esto es normal. No toque la aguja ni permita que toque ninguna superficie. No toque ni golpee el émbolo. Hacerlo podría hacer que el líquido se filtre.

- Con una mano, pellizque suavemente el área limpia de la piel y sosténgala firmemente. Con la otra mano, sostenga la jeringa (como un lápiz) en un ángulo de 45 grados con respecto a la piel.
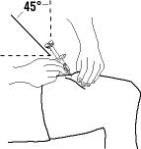
- Con un movimiento rápido y “tipo dardo”, inserte la aguja en un ángulo de 45 grados en la piel.
- Cuando la aguja esté completamente insertada en la piel, suelte la piel que está sosteniendo. Con su mano libre, sostenga la jeringa cerca de su base para estabilizarla. Luego, empuje el émbolo para inyectar toda la solución de Enbrel a un ritmo lento y constante.

- Cuando la jeringa esté vacía, retire la aguja de la piel, teniendo cuidado de mantenerla en el mismo ángulo que la inserción.
- Puede haber un poco de sangrado en el sitio de inyección. Puede presionar una bola de algodón o una gasa sobre el sitio de inyección durante 10 segundos. No frote el sitio de inyección. Si es necesario, puede cubrir el sitio de inyección con un vendaje.
- Si su proveedor de atención médica le ha indicado que se administre dos inyecciones de Enbrel el mismo día, repita los pasos para preparar y administrar una inyección de Enbrel. Elija y prepare un nuevo sitio de inyección para la segunda inyección.
- Para el método de mano libre: Si queda suficiente solución en el vial de Enbrel para otra dosis, refrigere el vial de Enbrel reconstituido (mezclado) (en la bandeja de dosis) después de su uso. De lo contrario, deseche el vial de Enbrel y cualquier solución restante.
Paso 6: Eliminación de los suministros
La jeringa, las agujas y el adaptador del vial nunca deben reutilizarse. Nunca vuelva a colocar la tapa a una aguja.
- Coloque las jeringas, agujas y viales usados en un contenedor de eliminación de objetos punzantes aprobado por la FDA inmediatamente después de su uso. No deseche las agujas, jeringas y viales en la basura de su hogar.
- Si no tiene un contenedor de eliminación de objetos punzantes aprobado por la FDA, puede usar un contenedor doméstico que sea:
○ hecho de plástico resistente,
○ se puede cerrar con una tapa hermética y resistente a las perforaciones, sin que los objetos punzantes puedan salir,
○ vertical y estable durante el uso,
○ a prueba de fugas, y
○ debidamente etiquetado para advertir sobre los residuos peligrosos dentro del contenedor. - Cuando su contenedor de eliminación de objetos punzantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de desechar su contenedor de eliminación de objetos punzantes. Puede haber leyes estatales o locales sobre cómo debe desechar las jeringas y agujas usadas. Para obtener más información sobre la eliminación segura de objetos punzantes y para obtener información específica sobre la eliminación de objetos punzantes en el estado en el que vive, visite el sitio web de la FDA en: http://www.fda.gov/safesharpsdisposal
- No reutilice la jeringa o el vial.
- No recicle la jeringa, el vial o el contenedor de eliminación de objetos punzantes ni los tire a la basura doméstica.
Importante: Mantenga siempre el contenedor de eliminación de objetos punzantes fuera del alcance de los niños.
Un proveedor de atención médica familiarizado con Enbrel debe responder todas las preguntas. Llame al 1-888-4ENBREL (1-888-436-2735) o visite www.enbrel.com para obtener más información sobre Enbrel.
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos.
AMGEN®
Fabricado por:
Immunex Corporation
Thousand Oaks, CA 91320-1799
Número de licencia de EE. UU. 1132© 1998 – 2016, 2019 Immunex Corporation. Todos los derechos reservados.
1XXXXXX – v9
Revisado: 10/2019
 Este material impreso es reciclable.
Este material impreso es reciclable.INSTRUCCIONES DE USO
Texto en el panel frontal
Lea estas instrucciones antes de usar un autoinyector reutilizable AutoTouch® para usarse con el cartucho precargado de dosis única de Enbrel Mini® (etanercept).
Texto en el lado 1
Su proveedor de atención médica le ha recetado el autoinyector reutilizable Enbrel® AutoTouch para sus inyecciones. Si su proveedor de atención médica decide que usted o un cuidador puede administrar sus inyecciones de Enbrel en casa, debe recibir capacitación sobre la forma correcta de preparar e inyectar Enbrel. No intente inyectarse hasta que su proveedor de atención médica le haya mostrado la forma correcta de administrar las inyecciones. Llame a su proveedor de atención médica si usted o su cuidador tiene alguna pregunta sobre la forma correcta de inyectar Enbrel.
Lea estas instrucciones antes de usar un autoinyector reutilizable AutoTouch para usarse con el cartucho precargado de dosis única de Enbrel Mini (etanercept).
Interruptor de velocidad
Cambio de la velocidad de inyección
El autoinyector reutilizable AutoTouch le permite elegir la velocidad de su inyección. Puede probar las tres velocidades para decidir cuál es la más cómoda para usted.- Hay tres configuraciones de velocidad disponibles: Rápida, Media y Lenta.
- La configuración de fábrica se establece en Media, el punto negro (•).
Para cambiar la velocidad de inyección:- Para una inyección más rápida, mueva el interruptor de velocidad hacia arriba, al signo más (+).
- Para una inyección más lenta, mueva el interruptor de velocidad hacia abajo, al signo menos (-).
NOTA: Cuando reciba su autoinyector reutilizable AutoTouch, la velocidad se establecerá en Media (•). Establezca la velocidad de inyección antes de colocar el autoinyector en su piel y presionar el botón de inicio. La velocidad de inyección no se puede cambiar después de comenzar una inyección.

Interruptor de sonido
Apagado de sonidos
El autoinyector AutoTouch emite sonidos (
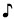 ) para ayudar a guiar su inyección. Cuando reciba un nuevo autoinyector, estará configurado con los sonidos activados (interruptor de sonido hacia abajo).
) para ayudar a guiar su inyección. Cuando reciba un nuevo autoinyector, estará configurado con los sonidos activados (interruptor de sonido hacia abajo).- Para apagar estos sonidos, deslice el interruptor de sonido hacia arriba (se ve la barra roja).
- Incluso cuando el sonido esté apagado, todavía escuchará el ruido del motor durante la inyección y escuchará cualquier alerta de error para advertirle si hay un problema. Consulte (Solución de problemas: Símbolos de error) a continuación si recibe alguna alerta de error.

Voltee para obtener INSTRUCCIONES DE USO paso a paso y otra información. Texto en el lado 2
INSTRUCCIONES DE USO
ENBREL® (en-brel)
(etanercept)
inyección, para uso subcutáneo
Cartucho precargado de dosis única Enbrel Mini®
para usarse con todos los autoinyectores reutilizables AutoTouch®Guía de partes Autoinyector reutilizable AutoTouch 

Cartucho de dosis única Enbrel Mini® Antes de usar

Después de usar

Importante: La aguja está dentro de Enbrel Mini.
Importante
El autoinyector reutilizable AutoTouch® se usa con el cartucho prellenado de dosis única Enbrel Mini® para administrar su dosis de Enbrel®. El cartucho prellenado de dosis única Enbrel Mini contiene una dosis única de 50 mg de Enbrel.
Antes de usar el autoinyector reutilizable AutoTouch con el cartucho prellenado de dosis única Enbrel Mini para usar con Enbrel, lea esta información importante:
Almacenamiento de sus cartuchos de dosis única Enbrel Mini:
- Guarde Enbrel Mini, que contiene Enbrel, en el refrigerador entre 2 °C y 8 °C (36 °F y 46 °F).
- Si es necesario, puede guardar Enbrel Mini a temperatura ambiente entre 20 °C y 25 °C (68 °F y 77 °F) hasta por 30 días.
- Una vez que Enbrel haya alcanzado la temperatura ambiente, no lo vuelva a colocar en el refrigerador.
- Deseche Enbrel Mini que se haya almacenado a temperatura ambiente después de 30 días.
- No guarde Enbrel Mini en condiciones de calor o frío extremos. Por ejemplo, evite guardarlo en la guantera o el maletero de su vehículo.
- No congelar.
- No agitar.
- Guarde Enbrel Mini en la caja original para protegerlo de la luz o daños.
Uso de sus cartuchos de dosis única Enbrel Mini:
- Es importante que no intente administrar la inyección a menos que usted o su cuidador hayan recibido capacitación de su proveedor de atención médica.
- No use Enbrel Mini después de la fecha de vencimiento impresa en la etiqueta.
- No agite Enbrel Mini.
- No retire la tapa morada de Enbrel Mini hasta que esté dentro del autoinyector reutilizable AutoTouch y esté listo para inyectar.
- No use Enbrel Mini si se ha caído sobre una superficie dura. Es posible que parte de Enbrel Mini esté roto incluso si no puede ver la rotura. Use un nuevo cartucho de Enbrel Mini y llame al 1-888-4Enbrel (1-888-436-2735).
- El autoinyector reutilizable AutoTouch y el cartucho Enbrel Mini no están fabricados con látex de caucho natural.
- Los niños deben pesar al menos 138 libras (62.6 kg) para recibir 50 mg de Enbrel Mini. Los niños que pesan menos de 138 libras (62.6 kg) deben recibir una forma diferente de Enbrel.
Almacenamiento de su autoinyector reutilizable AutoTouch:
- Guarde AutoTouch a temperatura ambiente en un lugar seco y seguro, como un gabinete o cajón a 10 °C a 40 °C (50 °F a 104 °F).
- Use una toallita con alcohol para limpiar la parte inferior (extremo de inyección) antes y después de cada uso.
- No guarde AutoTouch en el refrigerador con Enbrel Mini.
Mantenga Enbrel Mini y AutoTouch y todos los medicamentos fuera del alcance de los niños.
Para obtener más información o ayuda, visite www.enbrel.com o llame al 1-888-4Enbrel (1-888-436-2735). Lea el Manual del usuario de AutoTouch para obtener información adicional sobre cuidado y almacenamiento.
Paso 1: Preparar
A Retire un cartucho de dosis única Enbrel Mini® de la caja.
- Vuelva a colocar la caja que contiene cualquier Enbrel Mini sin usar en el refrigerador.
- Deje Enbrel Mini a temperatura ambiente durante al menos 30 minutos antes de inyectar.
- No vuelva a colocar Enbrel Mini en el refrigerador una vez que haya alcanzado la temperatura ambiente.
- No intente calentar Enbrel Mini utilizando una fuente de calor como agua caliente o microondas.
- No agite Enbrel Mini.
- No retire la tapa morada de Enbrel Mini todavía.
B Inspeccione el cartucho prellenado de dosis única Enbrel Mini.
Asegúrese de que el medicamento en la ventana sea transparente e incoloro. Está bien si ve pequeñas partículas blancas en la ventana del medicamento.
- No use Enbrel Mini si el medicamento está turbio, descolorido o contiene grumos grandes, escamas o partículas de color.
- No use Enbrel Mini si alguna parte parece agrietada o rota.
- No use Enbrel Mini si falta la tapa morada o no está bien colocada.
- No use Enbrel Mini si ha pasado la fecha de vencimiento impresa en la etiqueta.
En todos los casos, use un nuevo Enbrel Mini y llame al 1-888-4Enbrel (1-888-436-2735).
C Reúna todos los materiales que necesita para su inyección.
Lávese bien las manos con agua y jabón.
Coloque lo siguiente sobre una superficie limpia, bien iluminada y plana:
- AutoTouch®
- 1 Enbrel Mini®
- 3 toallitas con alcohol
- Bola de algodón o gasa
- Vendaje adhesivo
- Contenedor de desechos de objetos punzocortantes

D Prepare y limpie su sitio de inyección.
También limpie el extremo de inyección del AutoTouch® con una nueva toallita con alcohol.


Limpie el lugar de la inyección con una toallita con alcohol. Deje que la piel se seque.
Puede usar:
- El muslo
- El área del estómago (abdomen), excepto por un área de 2 pulgadas alrededor del ombligo
- El área externa de la parte superior del brazo (solo si alguien más le está aplicando la inyección)
Importante:
- No toque esta área nuevamente antes de inyectar.
- Elija un lugar diferente cada vez que se aplique una inyección. Si desea usar el mismo lugar de inyección, asegúrese de que no sea el mismo punto en el lugar de inyección que usó para una inyección anterior.
- No inyecte en áreas donde la piel esté sensible, con moretones, roja o dura. Evite inyectar en áreas con cicatrices o estrías.
- Si tiene psoriasis, debe evitar inyectar directamente en parches o lesiones de piel elevados, gruesos, rojos o escamosos.
Paso 2: Prepárese
E Presione el botón de la puerta para abrirla.
F Sostenga el cartucho de dosis única Enbrel Mini® con el lado etiquetado hacia afuera y deslícelo en la puerta.

Sostenga con el lado etiquetado hacia afuera y la tapa morada apuntando hacia abajo. Luego, deslice Enbrel Mini en la puerta. Se deslizará completamente hacia abajo en AutoTouch®.
- No fuerce Enbrel Mini en AutoTouch si no se desliza fácilmente. Compruebe que esté colocado correctamente dentro de AutoTouch.
G Cierre la puerta.


AutoTouch® está activo cuando la luz está encendida en la ventana de visualización

Si ve un botón de estado rojo, llame al 1-888-4Enbrel
(1-888-436-2735)Cuando vea que la ventana de visualización se ilumina y escuche un “timbre”, esto significa que Enbrel Mini® se ha cargado correctamente. AutoTouch ahora está en modo activo.
Nota: Si el interruptor de sonido está configurado en la posición “sonidos apagados”, no escuchará este sonido. Para activar los “sonidos”, deslice el interruptor de sonido hacia abajo. La barra roja ya no será visible.Sonidos activados  Deslice el interruptor hacia abajo
Deslice el interruptor hacia abajoSonidos desactivados
 Deslice el interruptor hacia arriba
Deslice el interruptor hacia arribaImportante: No retire la tapa morada hasta que esté listo para aplicar la inyección.
Paso 3: Inyectar

Lea la siguiente información antes de continuar con su inyección. Ahora realizará las siguientes tareas en orden:
- Sostenga AutoTouch® correctamente.
- Retire la tapa morada.
- Confirme que AutoTouch esté “activo”.
- Coloque y sostenga AutoTouch en el lugar de la inyección.
- Después de que el botón de estado se vuelva verde, presione el botón de estado para iniciar la inyección.
- Espere a que termine la inyección (asegúrese de que AutoTouch mantenga contacto total con la piel).
- Confirme que la inyección se haya completado.
No se aplique la inyección hasta que haya leído estas instrucciones y se sienta cómodo con la forma de usar AutoTouch de la manera correcta.
H Sostenga el autoinyector reutilizable AutoTouch con los dedos alrededor de la empuñadura gris para los dedos como se muestra. - Antes de colocar AutoTouch sobre su piel, asegúrese de que AutoTouch esté “activo”. Observe que la luz de la ventana de visualización esté encendida. Si la luz de visualización está apagada, esto significa que está en “modo de suspensión”, presione el botón de estado para “activarlo”.

I Cuando esté listo para inyectar, tire de la tapa morada hacia abajo y quítela. No deje la tapa morada quitada durante más de 5 minutos. Esto puede secar el medicamento.
Deseche la tapa morada en un contenedor para objetos punzocortantes. Las piezas pequeñas, como la tapa morada, pueden representar un peligro de asfixia para los niños y las mascotas. - La luz del sitio AutoTouch® se encenderá para ayudarlo a ver el sitio de inyección.
Es normal ver una gota de líquido al final de la aguja de Enbrel Mini® o en la parte inferior de AutoTouch.
- No gire ni doble la tapa morada.
- No vuelva a colocar la tapa morada en AutoTouch.
- No retire la tapa morada de AutoTouch hasta que esté listo para inyectar.
Si no puede inyectar, comuníquese con su proveedor de atención médica.

J Coloque y mantenga sobre la piel. Espere a que el botón de estado se vuelva verde y suene una señal.
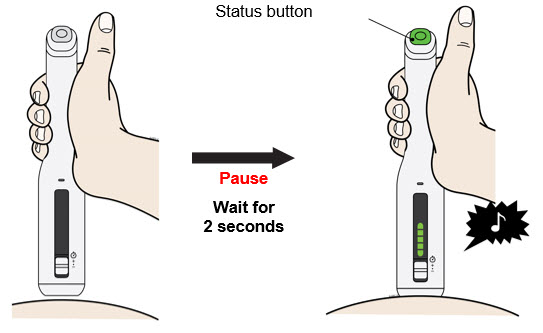
Coloque suavemente y mantenga el autoinyector reutilizable AutoTouch® sobre su piel y espere 2 segundos a que el botón de estado se vuelva verde. Escuchará una “señal” (a menos que el interruptor de sonido esté en la posición “sin sonido”).
- Mantenga su pulgar fuera del botón de estado durante este paso.
- No presione el autoinyector con fuerza sobre su piel. No es necesario estirar ni pellizcar la piel.
K Presione y suelte el botón de estado. El botón de estado comenzará a parpadear en verde. Escuchará un clic cuando comience la inyección.

El botón de estado verde significa que su inyección ha comenzado. Escuchará un ruido de motor y el botón de estado parpadeará en verde.
Importante: No levante AutoTouch® de su piel mientras la inyección está en progreso. Continúe sosteniendo AutoTouch recto y firme.
L La inyección finaliza cuando la luz verde se apaga y suena una “señal”. Verifique que no vea un botón de estado rojo.



(luz apagada)
Inyección finalizada(luz roja encendida)
Error de inyección
Llame al 1-888-4Enbrel
(1-888-436-2735)Levante AutoTouch® de su piel.
Cuando termine su inyección, escuchará un ruido de motor durante unos segundos. Cuando termine, la puerta se abrirá automáticamente. No bloquee la puerta con la mano.

Importante: Cuando retire AutoTouch, si el botón de estado se ha puesto rojo, llame al 1-888-4Enbrel (1-888-436-2735). Si parece que el medicamento todavía se está inyectando o si ve medicamento en la ventana de Enbrel Mini®, esto significa que es posible que no haya recibido una dosis completa. Llame a su proveedor de atención médica de inmediato.
Paso 4: Terminar
M Retire y deseche el cartucho prellenado de dosis única Enbrel Mini®.

Cuando se abra la puerta, retire Enbrel Mini, cierre la puerta y luego colóquelo en un contenedor de desechos punzocortantes aprobado por la FDA inmediatamente después de su uso. No deseche Enbrel Mini en la basura doméstica.
Si no tiene un contenedor de desechos punzocortantes aprobado por la FDA, puede usar un contenedor doméstico que sea:
- hecho de plástico resistente
- se pueda cerrar con una tapa hermética y resistente a las perforaciones, sin que puedan salir objetos punzocortantes
- vertical y estable durante el uso
- resistente a fugas y debidamente etiquetado para advertir sobre desechos peligrosos dentro del contenedor
Cuando su contenedor de desechos punzocortantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de desecharlo. Puede haber leyes estatales o locales sobre cómo debe desechar las agujas y jeringas usadas. Para obtener más información sobre la eliminación segura de objetos punzocortantes y para obtener información específica sobre la eliminación de objetos punzocortantes en el estado en el que vive, visite el sitio web de la FDA en: http://www.fda.gov/safesharpsdisposal.
- No reutilice Enbrel Mini.
- No recicle Enbrel Mini ni el contenedor de desechos punzocortantes ni los tire a la basura doméstica.
Importante: Mantenga siempre el contenedor de desechos punzocortantes fuera del alcance de los niños.
N Examine el lugar de la inyección.
Si hay sangre, presione una bola de algodón o una gasa sobre el lugar de la inyección. No frote el lugar de la inyección. Aplique una venda adhesiva, si es necesario.
O Limpie y guarde el autoinyector reutilizable AutoTouch®.
Limpie el extremo de inyección del autoinyector con una nueva toallita con alcohol y deje que se seque.
Guarde AutoTouch a temperatura ambiente en un lugar seco y seguro, como un armario o cajón.
Importante: No guarde AutoTouch en el refrigerador.
Solución de problemas: Símbolos de error
¿Por qué parpadea en rojo el botón de estado? 
Batería baja: La batería está muy baja. Solo quedan unas pocas inyecciones. Nota: el ícono de la batería puede ser amarillo en algunos dispositivos. Llame al 1-888-4Enbrel (1-888-436-2735) para obtener un autoinyector reutilizable AutoTouch de reemplazo. 

Batería agotada: La batería está agotada. Nota: el ícono de la batería puede ser amarillo en algunos dispositivos. Llame al 1-888-4Enbrel (1-888-436-2735) para obtener un autoinyector reutilizable AutoTouch de reemplazo. 
Demasiado caliente o demasiado frío: El autoinyector reutilizable AutoTouch está demasiado caliente o demasiado frío. Deje que se enfríe o caliente naturalmente a temperatura ambiente hasta que desaparezcan los símbolos. 
Problema con Enbrel Mini®: Hay varias razones por las que podría recibir este error. Consulte el Manual del usuario para obtener más información o llame al 1-888-4Enbrel (1-888-436-2735). 
Exposición de la aguja: La aguja puede estar expuesta y es posible que se haya inyectado una dosis incompleta. Busque medicamento en Enbrel Mini. Llame a su proveedor de atención médica si cree que se ha administrado una inyección incompleta. Tenga especial cuidado al retirar y manipular Enbrel Mini desechándolo correctamente en el contenedor de objetos punzocortantes. 
Falla del autoinyector reutilizable AutoTouch: Llame al 1-888-4Enbrel (1-888-436-2735) para obtener instrucciones de reinicio o un autoinyector reutilizable AutoTouch de reemplazo. Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los EE. UU.
AMGEN®
Fabricado por:
Immunex Corporation
Thousand Oaks, CA 91320-1799
©1998 – 2018, 2021-2023 Immunex Corporation. Todos los derechos reservados.
[partnumber]
Revisado: 06/2023 v7
Número de licencia de EE. UU. 1132 Este material impreso es reciclable.
Este material impreso es reciclable.INSTRUCCIONES DE USO
AutoTouch® reutilizable
autoinyector para usar con
Enbrel Mini® (etanercept)
cartucho prellenado de dosis únicaManual del usuario

Tabla de contenido Introducción 4 Guía de referencia 5 Recursos 6 Guía de las partes 8 Solución de problemas: Símbolos de error 18 Solución de problemas: Problemas comunes 24 Almacenamiento y manipulación 28 Instrucciones de limpieza 30 Advertencias 31 Información técnica 32 Tabla de símbolos 34 Introducción Este Manual del usuario contiene información útil sobre su autoinyector reutilizable AutoTouch®. Incluye recursos, detalles de cuidado y una guía de solución de problemas para guardar como referencia continua.
Para aprender a inyectar usando AutoTouch, consulte a su profesional de la salud para recibir capacitación en inyección y use las Instrucciones de uso incluidas en la caja.
Instrucciones de uso
Se proporcionan instrucciones de uso paso a paso desplegables en la caja, que le brindan instrucciones completas para aprender a administrarse una inyección segura, exitosa y precisa.
Nota: Lea las Instrucciones de uso completas incluidas en la caja.
La Guía de referencia en la página siguiente solo debe utilizarse cuando haya completado correctamente una inyección utilizando las Instrucciones de uso.
Guía de referencia Prepare y limpie el sitio de inyección. Sostenga el cartucho prellenado de dosis única Enbrel Mini® con el lado etiquetado hacia afuera y deslice en la puerta. Cierre la puerta. Retire la tapa morada. 1 
2 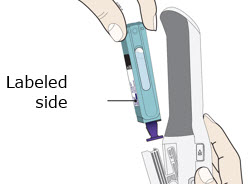

Coloque y sostenga sobre la piel. Espere a que el botón de estado se vuelva verde. Para iniciar la inyección:
Presione y suelte el botón de estado verde.La inyección termina cuando se escucha un timbre y todas las luces se apagan. 3 
4 
5 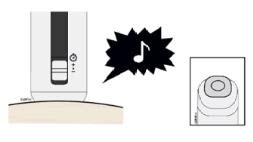
Recursos Ayuda personalizada de ENBREL Support™
Estos son solo algunos de los beneficios disponibles sin costo para usted:
- Enfermeras en vivo en línea o por teléfono los siete días de la semana, de 8 AM a 11 PM (ET)
- Tarjeta de copago ENBREL Support y otra ayuda financiera
- Recordatorios de medicamentos y reabastecimiento por teléfono o correo electrónico
- Contenedores de eliminación de agujas a través del Programa de devolución de agujas por correo
Regístrese al 1-888-4ENBREL (1-888-436-2735) o EnbrelSupport.com.
Guía de las partes Autoinyector reutilizable AutoTouch®

Agarre para los dedos
Al inyectar, sostenga el autoinyector reutilizable AutoTouch® con los dedos envueltos alrededor del agarre gris para los dedos.
Botón de la puerta
Presione este botón para abrir la puerta e insertar el cartucho prellenado de dosis única Enbrel Mini®. Cuando termine la inyección, la puerta se abrirá automáticamente.
Ventana de visualización
Durante una inyección, puede mirar a través de esta ventana y ver cómo baja el émbolo para administrar el medicamento. Cuando AutoTouch está activo, la ventana de visualización se iluminará. Si Enbrel Mini está en AutoTouch y la ventana de visualización no tiene luz, presione el botón de estado para activar AutoTouch.
Usted abrirá esta puerta e insertará Enbrel Mini en AutoTouch. La puerta se abrirá automáticamente cuando termine la inyección. Cuando se inserta correctamente, Enbrel Mini se deslizará libre y completamente dentro y fuera de la puerta.
Guía de partes Autoinyector reutilizable AutoTouch®

Botón de estado
Presione este botón para comenzar una inyección. Las luces indicarán el estado de su inyección.
Verde:
Listo para presionar e iniciar la inyección.Verde intermitente:
La aguja se está insertando y su inyección está en progreso.Rojo:
Se ha producido un error. Consulte la sección de solución de problemas de este manual.Barra de progreso
Estas barras verdes apiladas están completamente iluminadas cuando comienza la inyección, y la barra de luces disminuye a medida que la inyección está en progreso. Las luces desaparecerán cuando termine la inyección.
Interruptor de velocidad
El autoinyector reutilizable AutoTouch® le permite elegir entre tres velocidades de inyección. La velocidad preestablecida es media.
(+) es más rápido
(•) es medio
(–) es más lentoGuía de partes Autoinyector reutilizable AutoTouch®

Interruptor de sonido
Los sonidos se pueden activar y desactivar. (Sonidos activados) Deslice el interruptor hacia abajo. (Sonidos desactivados) Deslice el interruptor hacia arriba para que la barra roja sea visible.
Nota: Los sonidos de error aún se escucharán si los sonidos se han desactivado.
Extremo de inyección
Todo el extremo de inyección debe estar en contacto con la piel durante las inyecciones. Aquí es también donde saldrá la aguja.
Sensor de piel
Hay un sensor de piel ubicado en el extremo de inyección. Cuando el extremo de inyección se coloca sobre la piel, la luz del botón de inicio se volverá verde. Mantenga el extremo de inyección plano y firme sobre la piel durante todo el proceso de inyección.
Luz del sitio
Cuando el cartucho prellenado de dosis única Enbrel Mini® está cargado y se retira la tapa morada, el extremo de inyección se iluminará para ayudarlo a ver el sitio de inyección.
Guía de partes Cartucho prellenado de dosis única Enbrel Mini®

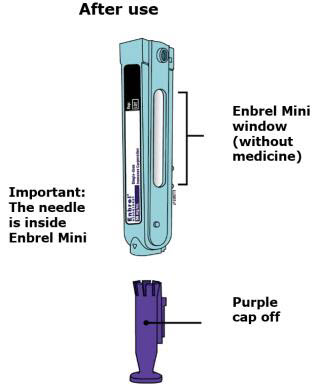
Lado etiquetado
Al insertar el cartucho Enbrel Mini®, asegúrese de que el lado etiquetado esté hacia afuera. Luego, deslice Enbrel Mini hacia la puerta. Se deslizará completamente hacia el autoinyector reutilizable AutoTouch®.
Fecha de caducidad
Confirme que la fecha de caducidad impresa en la etiqueta no haya pasado.
Ventana de Enbrel Mini
Aquí es donde mirará para examinar su medicamento antes de comenzar una inyección. Consulte las instrucciones de uso para obtener más información.
Tapa morada
La tapa morada mantiene su medicamento seguro. No retire la tapa de Enbrel Mini antes de cargarlo en AutoTouch. Cargue Enbrel Mini con la tapa morada puesta y retire la tapa solo cuando esté listo para aplicarse la inyección. No deje la tapa morada quitada por más de cinco minutos. Esto puede secar el medicamento.
Consulte las instrucciones de uso para obtener más detalles sobre cómo cargar Enbrel Mini y cuándo quitar la tapa morada.
Guía de partes AutoTouch® autoinyector reutilizable
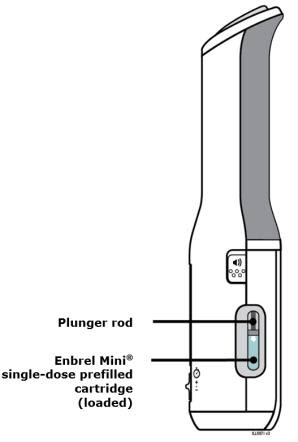
Cómo funciona.
Cuando presiona el botón de estado para iniciar una inyección, el autoinyector reutilizable AutoTouch® empuja una aguja oculta fuera del cartucho prellenado de dosis única Enbrel Mini® hacia su piel. Luego, una varilla de émbolo empujará hacia Enbrel Mini, inyectando el medicamento en su cuerpo. Después de que se inyecta el medicamento, la varilla se retraerá y la aguja se retirará de su piel. Después de una inyección exitosa, todas las luces se apagarán y la puerta se abrirá. La aguja permanece oculta en todo momento durante el proceso de inyección.
Lo que escuchará.
La inserción de la aguja y la varilla de émbolo son operadas por motores. Escuchará un ruido de motor a medida que la varilla se mueve hacia abajo y luego hacia arriba nuevamente. Siempre que escuche un ruido motorizado, sabrá que una inyección está en progreso.
Lo que verá.
Durante la inyección, la luz de la ventana de visualización estará encendida y la varilla de émbolo se moverá a través de la ventana. También durante la inyección, la luz de estado parpadeará en verde y la barra de progreso disminuirá. Después de una inyección exitosa, la barra de progreso y el botón de estado se apagarán y AutoTouch abrirá la puerta.
Si la luz de estado se pone roja y emite pitidos durante más de unos segundos, se ha producido un error. Utilice la sección de solución de problemas de este manual para ver qué hacer si esto sucede.
Solución de problemas: Símbolos de error Símbolos de error
El autoinyector reutilizable AutoTouch® emite un sonido de campanilla, enciende el botón de estado en rojo y muestra un símbolo de error si hay un problema.
Consulte la siguiente descripción de cada símbolo de error, las posibles razones del error y las acciones que puede tomar.
 Batería baja
Batería baja
Símbolo: Batería naranja y sonido de error.
Problema: La batería está muy baja. Quedan menos de tres semanas o tres inyecciones. La batería tiene una duración de dos años o 130 inyecciones desde su primera inyección. La batería no es reemplazable ni recargable.
Acción: Llame al 1-888-4ENBREL (1-888-436-2735) para obtener un autoinyector reutilizable AutoTouch de reemplazo. Batería agotada
Batería agotada
Símbolo: Batería naranja y triángulo rojo con signo de exclamación, botón de estado rojo y sonido de error.
Problema: La batería del autoinyector reutilizable AutoTouch® está agotada.
Acción: Llame al 1-888-4ENBREL (1-888-436-2735) para obtener un autoinyector reutilizable AutoTouch de reemplazo. Demasiado caliente o frío
Demasiado caliente o frío
Símbolo: Sol naranja y copo de nieve, y un sonido de error.
Problema: AutoTouch está demasiado caliente o demasiado frío. Esto bloqueará la puerta.
Acción: Coloque AutoTouch a temperatura ambiente en un lugar seguro y seco y permita que se enfríe o se caliente naturalmente a temperatura ambiente. Luego, inténtelo de nuevo. Guarde el autoinyector reutilizable AutoTouch en un lugar seco y seguro, como un armario o un cajón, a una temperatura de 50 ° F a 104 ° F (10 ° C a 40 ° C).Solución de problemas: Símbolos de error
 Problema con Enbrel Mini
Problema con Enbrel Mini
Símbolo: Cartucho prellenado de dosis única Enbrel Mini® naranja con botón de estado rojo parpadeante y sonido de alerta de error.
Problema: Hay cinco posibles razones por las que está recibiendo este error. Lea a continuación.Problema n.º 1: La tapa morada se quitó antes de insertar Enbrel Mini.
Acción: Espere a que el error desaparezca y cierre la puerta sin Enbrel Mini dentro, e inténtelo de nuevo con un Enbrel Mini nuevo. Asegúrese de dejar la tapa morada puesta hasta que Enbrel Mini se haya colocado dentro del autoinyector reutilizable AutoTouch® y la puerta esté cerrada. Llame al 1-888-4ENBREL (1-888-436-2735) para obtener un Enbrel Mini de reemplazo.Problema n.º 2: El sensor perdió contacto con la piel durante la inyección.
Acción: Mantenga el extremo de inyección de AutoTouch sobre su piel durante toda la inyección hasta que el botón de estado verde se apague, incluso si los sonidos del motor se detienen. Levantar o mover la piel durante la inyección puede provocar una inyección incompleta. Llame a su proveedor de atención médica si siente que se ha administrado una inyección incompleta.Problema n.º 3: El cartucho prellenado de dosis única Enbrel Mini® está defectuoso o no se reconoce como un producto de Amgen.
Acción: Retire Enbrel Mini. Reemplácelo con un Enbrel Mini nuevo. Llame al 1-888-4ENBREL (1-888-436-2735) para obtener un Enbrel Mini de reemplazo.Problema n.º 4: La puerta se mantiene cerrada durante más de un minuto.
Acción: Retire la mano de la puerta. Cuando la puerta se abra, retire Enbrel Mini de AutoTouch®, si está presente. Espere a que el símbolo de error deje de parpadear y cierre la puerta. Si no se ha administrado una inyección, coloque un Enbrel Mini nuevo en AutoTouch y continúe. Si el símbolo de error permanece encendido, llame al 1-888-4ENBREL (1-888-436-2735).Problema n.º 5: AutoTouch se ha caído.
Acción: Un AutoTouch que se ha caído no es seguro de usar. Llame al 1-888-4ENBREL (1-888-436-2735) para obtener un reemplazo.Solución de problemas: Símbolos de error
 Exposición de la aguja
Exposición de la aguja
Símbolo: Cartucho prellenado de dosis única Enbrel Mini® naranja, un triángulo rojo con un signo de exclamación, botón de estado rojo y sonido de error.
Problema: Se produjo un problema durante una inyección y la aguja puede estar expuesta.
Acción: Si todavía hay líquido en Enbrel Mini, es posible que se haya inyectado una dosis incompleta. Llame a su proveedor de atención médica si siente que se ha administrado una inyección incompleta. Llame al 1-888-4ENBREL (1-888-436-2735) para obtener más ayuda con su AutoTouch®.Tenga cuidado cuando estén encendidos tanto el símbolo de problema de Enbrel Mini como los símbolos de falla del autoinyector reutilizable AutoTouch®, ya que la aguja puede estar expuesta. Tenga especial cuidado al retirar y manipular Enbrel Mini. Retire Enbrel Mini y colóquelo en un contenedor de eliminación de objetos punzantes aprobado por la FDA.
 Falla del autoinyector reutilizable AutoTouch®
Falla del autoinyector reutilizable AutoTouch®
Símbolo: Triángulo rojo con un signo de exclamación, botón de estado rojo y sonido de error.
Problema: Se han producido varios errores o AutoTouch ha dejado de funcionar.
Acción: Restablezca AutoTouch.Para restablecer AutoTouch:
Mantenga AutoTouch alejado de la piel y presione el botón de estado para activar AutoTouch. El símbolo de falla debe comenzar a parpadear y debe sonar una campanilla.
Mientras el símbolo de falla parpadea, presione y mantenga presionado el botón de la puerta hasta que todos los símbolos se muestren temporalmente y el botón de estado parpadee en verde. El botón de la puerta debe mantenerse presionado durante al menos 10 segundos. Después de un reinicio exitoso, si un cartucho prellenado de dosis única Enbrel Mini® todavía está dentro de AutoTouch, retírelo. Cierre la puerta de AutoTouch. Luego, para la próxima inyección, comience presionando el botón de la puerta para abrir la puerta de Enbrel Mini.
Si AutoTouch no responde después de tres intentos de reinicio, llame al 1-888-4ENBREL (1-888-436-2735).
Solución de problemas: problemas comunes Problemas comunes
El cartucho prellenado de dosis única Enbrel Mini® es difícil de insertar en la puerta.
Nunca fuerce Enbrel Mini en la puerta. Cuando esté colocado correctamente, caerá libremente y por completo dentro y fuera de la puerta. Si es difícil de cargar, verifique dos veces que está sosteniendo Enbrel Mini como se muestra.

- La tapa morada está hacia abajo
- La etiqueta hacia afuera (lejos del mango)
La inyección no comienza al presionar el botón de estado.
Razón #1: Coloque el autoinyector reutilizable AutoTouch® sobre su piel y espere a que el botón de estado se vuelva verde. Un sensor de piel está ubicado en el extremo de inyección. No puede iniciar una inyección a menos que el extremo de inyección de AutoTouch esté tocando su piel. Mantenga el extremo de inyección sobre su piel durante toda la inyección.
Razón #2: AutoTouch puede estar dormido. Para conservar la energía de la batería, AutoTouch entra en un “modo de suspensión” después de tres minutos de inactividad. Si parece que no responde/está dormido, retire AutoTouch de su piel y presione el botón de estado para despertarlo.
Aparece un símbolo de error de Enbrel Mini inmediatamente después de cargar el cartucho prellenado de dosis única Enbrel Mini®.
Razón: Esto sucederá si la tapa morada se ha quitado antes de insertar Enbrel Mini en la puerta. No reutilice ni vuelva a tapar. Comience de nuevo usando un nuevo Enbrel Mini.
No retire la tapa morada hasta después de que Enbrel Mini se haya insertado en AutoTouch.Solución de problemas: problemas comunes La inyección se aborta o aparece un símbolo de error mientras la inyección está en proceso.
El autoinyector reutilizable AutoTouch® abortará una inyección si el sensor pierde contacto con la piel. Evite ajustar o mover AutoTouch durante una inyección. Mantenga AutoTouch sobre su piel hasta que la luz verde de estado se apague y la inyección haya terminado. Desplazarse, reposicionar o levantar de su piel durante la inyección puede provocar una dosis incompleta.La puerta de AutoTouch no permanece cerrada.
Razón #1: Al final de una inyección, la puerta no se puede cerrar con un cartucho prellenado de dosis única Enbrel Mini® usado en el interior.
Razón #2: Cuando AutoTouch experimenta una falla, la puerta se abrirá y permanecerá abierta. Si esto ocurre, llame al 1-888-4ENBREL (1-888-436-2735).Una campanilla está repitiéndose pero no se muestran luces de error.
Si la puerta se deja abierta durante más de 45 segundos, sonará una campanilla. Cierre la puerta para silenciar la campanilla.AutoTouch no produce sonidos de campanilla.
La configuración de sonido puede estar desactivada. Enciéndalo deslizando el interruptor de sonido hacia abajo.
Enbrel Mini® cartucho prellenado de dosis única no se expulsa.
Razón #1: Si la ventana de visualización no tiene luz, presione el botón de estado para despertar AutoTouch. Luego presione y mantenga presionado el botón de la puerta durante al menos dos segundos para expulsar.
Razón #2: Si Enbrel Mini no se expulsa automáticamente al final de una inyección, puede haber un problema. Llame al 1-888-4ENBREL (1-888-436-2735).La tapa morada es muy difícil de quitar.
La tapa morada no debe quitarse fuera del autoinyector reutilizable AutoTouch®. Debe quitarse después de que se cargue en AutoTouch, cuando esté listo para inyectar. Si Enbrel Mini está cargado y la tapa morada es difícil de quitar, llame al 1-888-4ENBREL (1-888-436-2735).La velocidad de inyección no cambiará durante la inyección.
Una vez que comienza la inyección, la velocidad no se puede cambiar. Siempre configure la velocidad antes de la inyección.La inyección es más rápida o más lenta de lo esperado.
El interruptor de velocidad puede haberse movido sin querer. Verifique la configuración de velocidad antes de comenzar cada inyección.Almacenamiento y manipulación
Almacenamiento
AutoTouch® autoinyector reutilizableHaga No haga Haga almacenar AutoTouch en un lugar seco y seguro a temperatura ambiente, como un armario o un cajón. No haga almacenar AutoTouch en el refrigerador con los cartuchos prellenados de dosis única Enbrel Mini®. Haga almacenar AutoTouch en su caja cuando no esté en uso. No haga almacenar AutoTouch en calor o frío extremos, o en ambientes muy húmedos como el baño. Manipulación
AutoTouch autoinyector reutilizableHaga No haga Haga inspeccionar AutoTouch para detectar daños físicos o defectos antes de cada uso. No haga usar AutoTouch si se ha caído sobre una superficie dura.
No haga usar AutoTouch si alguna parte parece agrietada o rota.No haga dejar la puerta de AutoTouch abierta por más de 45 segundos cuando no esté en uso. (Sonará una señal y AutoTouch se pondrá en modo de suspensión). No haga aplastar, quemar, calentar o incinerar la batería, ya que esto puede causar riesgo de incendio o explosión. No haga usar AutoTouch si se ha caído sobre una superficie dura. Llame al 1-888-4ENBREL
(1-888-436-2735) para obtener un reemplazo.Almacenamiento y manipulación
Enbrel Mini® cartucho prellenado de dosis únicaHaga No haga Haga almacenar Enbrel Mini sin usar en el refrigerador. No haga congelar Enbrel Mini sin usar.
No haga calentar Enbrel Mini usando una fuente de calor como agua caliente o un microondas.Haga asegurarse de sostener Enbrel Mini con el lado etiquetado hacia afuera y deslizarlo en la puerta. No haga forzar Enbrel Mini en la puerta.
No haga usar Enbrel Mini si se ha caído sobre una superficie dura.Haga poner Enbrel Mini en la puerta antes de quitar la tapa morada. No haga quitar la tapa morada antes de insertar en AutoTouch.
No haga volver a usar o volver a tapar Enbrel Mini.Haga desechar la tapa morada inmediatamente después de quitarla para evitar el riesgo de asfixia. No haga usar Enbrel Mini si alguna parte parece agrietada o rota. Instrucciones de limpieza
Limpieza
AutoTouch® autoinyector reutilizableHaga No haga Haga usar una toallita con alcohol para limpiar el extremo de inyección de AutoTouch antes y después de las inyecciones. No haga limpiar AutoTouch con agua. Haga usar una toallita con alcohol para limpiar todas las demás áreas de AutoTouch según sea necesario. No haga sumergir AutoTouch en agua. No haga limpiar AutoTouch con limpiador doméstico o jabón. Advertencias No se permite la modificación del autoinyector reutilizable AutoTouch®.
Ninguna parte de AutoTouch puede repararse o reemplazarse, incluida la batería.
No coloque nada dentro de la puerta que no sea un cartucho prellenado de dosis única Enbrel Mini®.
No sumerja AutoTouch en agua.
No introduzca la mano en AutoTouch.
No aplaste, queme ni caliente AutoTouch.
AutoTouch contiene piezas móviles. Mantenga los dedos alejados de las aberturas en el extremo de inyección o la puerta abierta.
Mantenga AutoTouch y Enbrel Mini fuera del alcance de los niños.
Si AutoTouch falla, la cantidad máxima de medicamento que podría recibir es el contenido del Enbrel Mini completo, que es la dosis correcta.
Tenga cuidado si se produce un error, ya que la aguja puede quedar expuesta.
Deseche Enbrel Mini cuidadosamente en un contenedor de objetos punzantes aprobado por la FDA.
Llame a su proveedor de atención médica si tiene alguna inquietud con respecto a una inyección incompleta.
Cuando viaje, lleve AutoTouch consigo, en su equipaje de mano.
No deseche AutoTouch en la basura doméstica. Llame al 1-888-4ENBREL (1-888-436-2735) para obtener un reemplazo.
Información técnica Clasificación de protección internacional
El código de protección internacional para el autoinyector reutilizable AutoTouch® cuando se almacena en su caja es IP52. Lo que significa que está protegido contra la entrada limitada de polvo y contra el goteo limitado de agua. AutoTouch no está clasificado para la entrada de polvo o líquido cuando no se almacena en su caja.
Rango de funcionamiento ambiental
AutoTouch funcionará en el rango de temperatura de 50° F a 104° F (10° C a 40° C), y del 20% al 90% de humedad relativa, y a elevaciones de 197 pies por debajo del nivel del mar a 11,483 pies por encima del nivel del mar (-60 m a 3500 m).
Rango de almacenamiento ambiental
Transporte y almacene AutoTouch en su caja, en un lugar seco a temperatura ambiente: 50° F a 104° F (10° C a 40° C). AutoTouch se ha probado para una breve exposición a -40° F a 158° F (-40° C a 70° C), 50% de humedad relativa y presión equivalente a 14000 pies (4267 m).
Compatibilidad electromagnética
Evite operar AutoTouch cerca de hornos de microondas, enrutadores inalámbricos, monitores para bebés u otros dispositivos electrónicos domésticos comunes que funcionan con transmisión de RF. Dos metros (seis pies) es una distancia razonable.
Evite operar AutoTouch cerca de campos magnéticos altos u otros campos, como los que se encuentran alrededor de los escáneres de resonancia magnética, tomografía computarizada o PET.
AutoTouch no emite RF.
Características eléctricas
El autoinyector reutilizable AutoTouch® utiliza una batería de litio DL123 no reemplazable y no recargable. La batería tiene un voltaje nominal de 3.0 V con una capacidad de 1400 mAh. La vida útil esperada de AutoTouch es de dos años o 130 inyecciones desde la primera inyección.
AutoTouch tiene una parte aplicada de tipo BF: tiene un sensor eléctrico capacitivo que está aislado por plástico de la piel.
Dimensiones y peso
AutoTouch pesa 0.4 libras (180 gramos) y mide 9 pulgadas (228 mm) de alto por 1.5 pulgadas (38 mm) de ancho por 1.8 pulgadas (45 mm) de profundidad.
Biocompatibilidad y aislamiento eléctrico
El extremo de inyección del autoinyector reutilizable está diseñado para entrar en contacto con la piel (consulte la Guía de piezas). Es una parte aplicada de tipo BF. Esto significa que está aislado eléctricamente de la batería. El extremo de inyección y el agarre de los dedos de AutoTouch están hechos de plástico ABS. Este material ha sido probado en biocompatibilidad para la sensibilidad e irritación de la piel.
Tabla de símbolos 
No reutilizar 
Fecha de caducidad
(Fecha exp.)
Número de lote 
Mantener seco 
Número de serie 
Parte aplicada de tipo BF
El extremo de inyección del dispositivo es una parte aplicada de tipo BF.
PRECAUCIÓN, consulte los documentos adjuntos 
Consulte las instrucciones de uso 
No lo use si el paquete está dañado 
Este producto contiene caucho natural seco AMGEN®
Fabricado por:
Immunex Corporation
Thousand Oaks, CA 91320-1799
©1998 – 2018 Immunex Corporation. Todos los derechos reservados.
[partnumber]
Revisado: 12/2018 v5INSTRUCCIONES DE USO
AutoTouch Connect® autoinyector reutilizable
para usar con
Enbrel Mini® (etanercept)
cartucho prellenado de dosis únicaManual de usuario

Índice Primeros pasos 4 Guía de referencia 5 Recursos 6 Guía de piezas 8 Solución de problemas: Símbolos de error 18 Solución de problemas: Problemas comunes 24 Almacenamiento y manipulación 28 Instrucciones de limpieza 30 Advertencias 31 ¿Qué es la función inalámbrica Bluetooth®? 32 Información técnica 36 Tabla de símbolos 39 Primeros pasos
Este Manual de usuario contiene información útil sobre su Autoinyector reutilizable AutoTouch Connect® (AutoTouch Connect). Incluye recursos, detalles de cuidado y una guía de solución de problemas para guardar como referencia continua.
Para aprender cómo inyectar usando AutoTouch Connect, consulte a su proveedor de atención médica para el entrenamiento de inyección y use las Instrucciones de uso incluidas en la caja.
Instrucciones de uso
En la caja se proporciona un folleto desplegable con instrucciones paso a paso para el uso, que le proporciona instrucciones completas para aprender a administrarse una inyección segura, exitosa y precisa.
Nota: Lea las Instrucciones de uso completas incluidas en la caja.
La Guía de referencia en la página siguiente solo debe usarse cuando haya completado con éxito una inyección utilizando las Instrucciones de uso.
Guía de referencia
Prepare y limpie el lugar de la inyección. Sostenga el cartucho prellenado de dosis única Enbrel Mini® con el lado etiquetado hacia afuera y deslícelo en la puerta. Cierre la puerta. Retire la tapa morada. 1 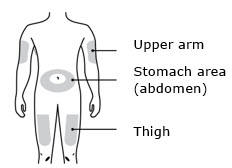
2 
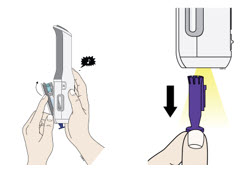
Coloque y mantenga sobre la piel. Espere a que el botón de estado se vuelva verde. Para iniciar la inyección:
Presione y suelte el botón de estado verde.La inyección finaliza cuando escucha una señal sonora y todas las luces se apagan. 3 
4 
5 
Recursos
ENBREL® SupportPlus ofrece servicios de apoyo personalizados a los pacientes de ENBREL®, sin costo adicional, que incluyen:
- Información sobre opciones de apoyo financiero
- Entrenamiento suplementario de inyección con un ENBREL Nurse Partner™
- Materiales educativos para ayudarlo en el camino
Llame al 1-888-4ENBREL (1-888-436-2735) para inscribirse o visite www.EnbrelSupportPlus.com para obtener más información.
Guía de piezas
Autoinyector reutilizable AutoTouch Connect®
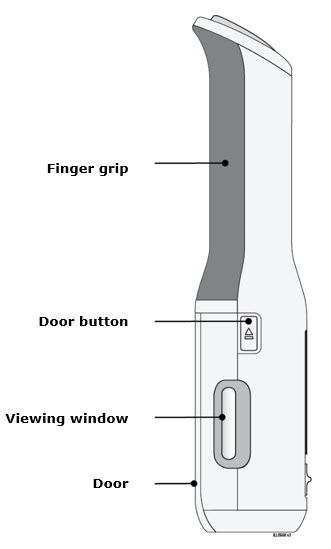
Empuñadura para los dedos
Al inyectar, sostenga el autoinyector reutilizable AutoTouch Connect® con los dedos alrededor de la empuñadura gris para los dedos. 
Botón de puerta
Presione este botón para abrir la puerta para insertar el cartucho prellenado de dosis única Enbrel Mini®. Cuando termine su inyección, la puerta se abrirá automáticamente.
Ventana de visualización
Durante una inyección, puede mirar a través de esta ventana y ver cómo baja el émbolo para administrar su medicamento. Cuando AutoTouch Connect está activo, la ventana de visualización se iluminará. Si Enbrel Mini está en AutoTouch Connect y la ventana de visualización no tiene luz, presione el botón de estado para activar AutoTouch Connect.
Abrirás esta puerta e insertarás Enbrel Mini en AutoTouch Connect. La puerta se abrirá automáticamente cuando termine su inyección. Cuando se inserta correctamente, Enbrel Mini se deslizará libre y completamente dentro y fuera de la puerta.
Guía de piezas
Autoinyector reutilizable AutoTouch Connect®

Botón de estado
Presione este botón para comenzar una inyección. Las luces indicarán el estado de su inyección.
Verde:
Listo para presionar e iniciar la inyección.Verde parpadeante:
La aguja se está insertando y su inyección está en progreso.Rojo:
Ha ocurrido un error. Consulte la sección Solución de problemas de este manual.Barra de progreso
Estas barras verdes apiladas están completamente iluminadas cuando comienza su inyección, y la barra de luces disminuye a medida que su inyección está en progreso. Las luces desaparecerán cuando termine su inyección.
Interruptor de velocidad
El autoinyector reutilizable AutoTouch Connect® le permite elegir entre tres velocidades de inyección. La velocidad preestablecida es media.
(+) es más rápido
(•) es medio
(–) es más lentoGuía de piezas
Autoinyector reutilizable AutoTouch Connect®

Interruptor de sonido
Los sonidos se pueden activar y desactivar. (Sonidos activados) Deslice el interruptor hacia abajo. (Sonidos desactivados) Deslice el interruptor hacia arriba para que la barra roja sea visible.
Nota: Los sonidos de error aún se escucharán si los sonidos se han desactivado.
Extremo de inyección
Todo el extremo de inyección debe tocar su piel durante las inyecciones. Aquí también es donde saldrá la aguja.
Sensor de piel
Hay un sensor de piel ubicado en el extremo de inyección. Cuando el extremo de inyección se coloca sobre la piel, la luz del botón de inicio se volverá verde. Mantenga el extremo de inyección plano y firme sobre su piel durante todo el proceso de inyección.
Luz del sitio
Cuando se carga el cartucho prellenado de dosis única Enbrel Mini® y se retira la tapa morada, el extremo de inyección se iluminará para ayudarlo a ver su sitio de inyección.
Enbrel Mini®
cartucho prellenado de dosis única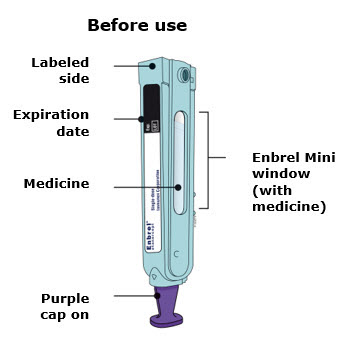

Lado etiquetado
Al insertar el cartucho Enbrel Mini®, asegúrese de que el lado etiquetado esté hacia afuera. Luego, deslice Enbrel Mini en la puerta. Se deslizará completamente hacia abajo en el autoinyector reutilizable AutoTouch Connect®.
Fecha de caducidad
Confirme que la fecha de vencimiento impresa en la etiqueta no haya pasado.
Ventana de Enbrel Mini
Aquí es donde mirará para examinar su medicamento antes de comenzar una inyección. Consulte las Instrucciones de uso para obtener más información.
Tapa morada
La tapa morada mantiene su medicamento seguro. No retire la tapa de Enbrel Mini antes de cargarlo en AutoTouch Connect. Cargue Enbrel Mini con la tapa morada puesta y retire la tapa solo cuando esté listo para administrarse la inyección. No deje la tapa morada quitada durante más de cinco minutos. Esto puede secar el medicamento.
Consulte las Instrucciones de uso para obtener más detalles sobre cómo cargar Enbrel Mini y cuándo retirar la tapa morada.
Guía de piezas
Autoinyector reutilizable AutoTouch Connect®

Cómo funciona.
Cuando presiona el botón de estado para iniciar una inyección, el autoinyector reutilizable AutoTouch Connect® empuja una aguja oculta fuera del cartucho prellenado de dosis única Enbrel Mini® hacia su piel. Luego, una varilla de émbolo empujará hacia Enbrel Mini, inyectando el medicamento en su cuerpo. Después de que se inyecta el medicamento, la varilla se retraerá y la aguja se retirará de su piel. Después de una inyección exitosa, todas las luces se apagarán y la puerta se abrirá. La aguja permanece oculta en todo momento durante el proceso de inyección.
Lo que escuchará.
La inserción de la aguja y la varilla del émbolo son operadas por motores. Escuchará un ruido de motor a medida que la varilla se mueve hacia abajo y luego vuelve a subir. Siempre que escuche un ruido motorizado, sabrá que se está realizando una inyección.
Lo que verá.
Durante la inyección, la luz de la ventana de visualización estará encendida y la varilla del émbolo se moverá a través de la ventana. También durante la inyección, la luz de estado parpadeará en verde y la barra de progreso disminuirá. Después de una inyección exitosa, la barra de progreso y el botón de estado se apagarán y AutoTouch Connect abrirá la puerta.
Si la luz de estado se vuelve roja y emite un pitido durante más de unos segundos, se ha producido un error. Utilice la sección de solución de problemas de este manual para ver qué hacer si esto sucede.
Solución de problemas:
Símbolos de errorSímbolos de error
El autoinyector reutilizable AutoTouch Connect® emite un timbre, enciende el botón de estado en rojo y muestra un símbolo de error si hay un problema.
Consulte la siguiente descripción de cada símbolo de error, las posibles razones del error y las acciones que puede realizar.
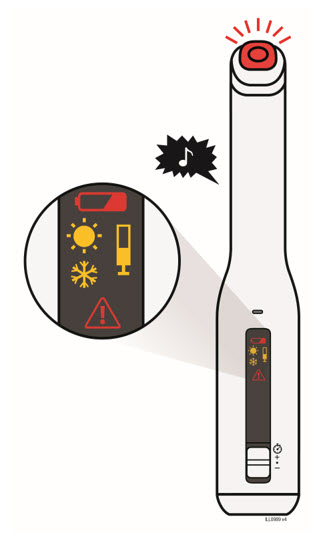
 Batería baja
Batería baja
Símbolo: Batería roja y sonido de error.
Problema: La batería se está agotando. Quedan menos de tres semanas o tres inyecciones. La batería no es reemplazable ni recargable.
Acción: Llame al 1-888-4ENBREL (1-888-436-2735) para obtener un autoinyector reutilizable AutoTouch Connect® de reemplazo. Batería agotada
Batería agotada
Símbolo: Batería roja y triángulo rojo con signo de exclamación, botón de estado rojo y sonido de error.
Problema: La batería del autoinyector reutilizable AutoTouch Connect está agotada.
Acción: Llame al 1-888-4ENBREL (1-888-436-2735) para obtener un autoinyector reutilizable AutoTouch Connect de reemplazo. Demasiado caliente o frío
Demasiado caliente o frío
Símbolo: Sol naranja y un copo de nieve, y un sonido de error.
Problema: AutoTouch Connect está demasiado caliente o demasiado frío. Esto bloqueará la puerta.
Acción: Coloque AutoTouch Connect a temperatura ambiente en un lugar seguro y seco y deje que se enfríe o caliente naturalmente a temperatura ambiente. Luego, inténtalo de nuevo. Guarde el autoinyector reutilizable AutoTouch Connect en un lugar seco y seguro, como un armario o cajón a una temperatura de 10 °C a 40 °C (50 °F a 104 °F).Solución de problemas:
Símbolos de error Problema con Enbrel Mini®
Problema con Enbrel Mini®
Símbolo: Cartucho precargado de dosis única Enbrel Mini naranja con botón de estado rojo parpadeante y sonido de alerta de error.
Problema: Hay cinco posibles razones por las que recibe este error. Por favor lea a continuación.Problema n.° 1: Se quitó la tapa morada antes de insertar Enbrel Mini.
Acción: Espere a que desaparezca el error y cierre la puerta sin Enbrel Mini adentro, y vuelva a intentarlo con un nuevo Enbrel Mini. Asegúrese de dejar la tapa morada puesta hasta que Enbrel Mini se haya colocado dentro del autoinyector reutilizable AutoTouch Connect® y la puerta esté cerrada. Llame al 1-888-4ENBREL (1-888-436-2735) para obtener un Enbrel Mini de reemplazo.Problema n.° 2: El sensor perdió contacto con la piel durante la inyección.
Acción: Mantenga el extremo de inyección de AutoTouch Connect sobre su piel durante toda la inyección hasta que el botón de estado verde se apague, incluso si los sonidos del motor se detienen. Levantar o cambiar de posición sobre la piel durante la inyección puede provocar una inyección incompleta. Llame a su proveedor de atención médica si cree que se ha administrado una inyección incompleta.Problema n.° 3: El cartucho precargado de dosis única Enbrel Mini® está defectuoso o no se reconoce como un producto de Amgen.
Acción: Retire Enbrel Mini. Reemplácelo con un nuevo Enbrel Mini. Llame al 1-888-4ENBREL (1-888-436-2735) para obtener un Enbrel Mini de reemplazo.Problema n.° 4: La puerta se mantiene cerrada durante más de un minuto.
Acción: Retire la mano de la puerta. Cuando se abra la puerta, retire Enbrel Mini de AutoTouch Connect®, si está presente. Espere a que el símbolo de error deje de parpadear y cierre la puerta. Si no se ha administrado una inyección, coloque un nuevo Enbrel Mini en AutoTouch Connect y continúe. Si el símbolo de error permanece encendido, llame al 1-888-4ENBREL (1-888-436-2735).Problema n.° 5: Se ha caído AutoTouch Connect.
Acción: Un AutoTouch Connect que se ha caído no es seguro de usar. Llame al 1-888-4ENBREL (1-888-436-2735) para obtener un reemplazo.Solución de problemas:
Símbolos de error Exposición de la aguja
Exposición de la aguja
Símbolo: Cartucho precargado de dosis única Enbrel Mini® naranja, un triángulo rojo con un signo de exclamación, botón de estado rojo y sonido de error.
Problema: Ocurrió un problema durante una inyección y la aguja puede estar expuesta.
Acción: Si todavía hay líquido en Enbrel Mini, es posible que se haya inyectado una dosis incompleta. Llame a su proveedor de atención médica si cree que se ha administrado una inyección incompleta. Llame al 1-888-4ENBREL (1-888-436-2735) para obtener más ayuda con su AutoTouch Connect®.Tenga cuidado cuando el símbolo de problema de Enbrel Mini y los símbolos de falla del autoinyector reutilizable AutoTouch Connect estén encendidos, ya que la aguja puede estar expuesta. Tenga especial cuidado al retirar y manipular Enbrel Mini. Retire Enbrel Mini y luego colóquelo en un contenedor para objetos punzocortantes aprobado por la FDA.
 Falla del autoinyector reutilizable AutoTouch Connect®
Falla del autoinyector reutilizable AutoTouch Connect®
Símbolo: Triángulo rojo con un signo de exclamación, botón de estado rojo y sonido de error.
Problema: Se han producido varios errores o AutoTouch Connect ha dejado de funcionar.
Acción: Reinicie AutoTouch Connect.Para reiniciar AutoTouch Connect:
Mantenga AutoTouch Connect alejado de la piel y presione el botón de estado para activar AutoTouch Connect. El símbolo de falla debería comenzar a parpadear y debería sonar una campanilla.
Mientras el símbolo de falla parpadea, mantenga presionado el botón de la puerta hasta que todos los símbolos se muestren temporalmente y el botón de estado parpadee en verde. El botón de la puerta debe mantenerse presionado durante al menos 10 segundos. Después de un reinicio exitoso, si un cartucho precargado de dosis única Enbrel Mini® todavía está dentro de AutoTouch Connect, retírelo. Cierre la puerta de AutoTouch Connect. Luego, para la siguiente inyección, comience presionando el botón de la puerta para abrir la puerta de Enbrel Mini.
Si AutoTouch Connect no responde después de tres intentos de reinicio, llame al 1-888-4ENBREL (1-888-436-2735).
Solución de problemas:
Problemas comunesProblemas comunes
Resulta difícil insertar el cartucho prellenado de dosis única Enbrel Mini® en la puerta.
Nunca fuerce Enbrel Mini en la puerta. Cuando se coloca correctamente, caerá libre y completamente dentro y fuera de la puerta. Si es difícil de cargar, verifique que esté sosteniendo Enbrel Mini como se muestra.

- La tapa morada está hacia abajo
- Etiqueta hacia afuera (lejos del mango)
La inyección no comienza al presionar el botón de estado.
Razón n.° 1: Coloque el autoinyector reutilizable AutoTouch Connect® sobre su piel y espere a que el botón de estado se vuelva verde. Hay un sensor de piel ubicado en el extremo de la inyección. No puede iniciar una inyección a menos que el extremo de inyección de AutoTouch Connect esté tocando su piel. Mantenga el extremo de inyección sobre su piel durante toda la inyección.
Razón n.° 2: AutoTouch Connect puede estar en reposo. Para conservar la energía de la batería, AutoTouch Connect entra en “modo de reposo” después de tres minutos de inactividad. Si parece que no responde/está en reposo, retire AutoTouch Connect de su piel y presione el botón de estado para activarlo.
Aparece un símbolo de error de Enbrel Mini® inmediatamente después de cargar el cartucho prellenado de dosis única Enbrel Mini. Razón: Esto sucederá si se ha quitado la tapa morada antes de insertar Enbrel Mini en la puerta. No reutilizar ni volver a tapar. Comience de nuevo usando un nuevo Enbrel Mini.
No retire la tapa morada hasta después de que Enbrel Mini se haya insertado en AutoTouch Connect.
Solución de problemas:
Problemas comunesLa inyección se interrumpe o aparece un símbolo de error mientras la inyección está en proceso.
El autoinyector reutilizable AutoTouch Connect® interrumpirá una inyección si el sensor pierde contacto con la piel. Evite ajustar o mover AutoTouch Connect durante una inyección. Mantenga AutoTouch Connect sobre su piel hasta que la luz verde de estado se apague y la inyección haya finalizado. Cambiar, reposicionar o levantar de la piel durante la inyección puede provocar una dosis incompleta.
La puerta de AutoTouch Connect no permanece cerrada. Razón n.° 1: Al final de una inyección, la puerta no se puede cerrar con un cartucho prellenado de dosis única Enbrel Mini® usado en el interior.
Razón n.° 2: Cuando AutoTouch Connect experimenta una falla, la puerta se abrirá y permanecerá abierta. Si esto ocurre, llame al 1-888-4ENBREL (1-888-436-2735).
Se repite un timbre pero no se muestran luces de error. Si la puerta se deja abierta durante más de 45 segundos, sonará un timbre. Cierre la puerta para silenciar el timbre.
AutoTouch Connect no produce sonidos de timbre. Es posible que la configuración de sonido esté desactivada. Enciéndalo deslizando el interruptor de sonido hacia abajo.
El cartucho prellenado de dosis única Enbrel Mini® no se expulsa.
Razón n.° 1: Si la ventana de visualización no tiene luz, presione el botón de estado para activar AutoTouch Connect®. Luego presione y mantenga presionado el botón de la puerta durante al menos dos segundos para expulsar.
Razón n.° 2: Si Enbrel Mini no se expulsa automáticamente al final de una inyección, puede haber un problema. Llame al 1-888-4ENBREL (1-888-436-2735).
La tapa morada es muy difícil de quitar. La tapa morada no debe quitarse fuera del autoinyector reutilizable AutoTouch Connect. Debe quitarse después de que se carga en AutoTouch Connect, cuando esté listo para inyectar. Si Enbrel Mini está cargado y la tapa morada es difícil de quitar, llame al 1-888-4ENBREL (1-888-436-2735).
La velocidad de inyección no cambiará durante la inyección. Una vez que comienza la inyección, no se puede cambiar la velocidad. Siempre ajuste la velocidad antes de la inyección.
La inyección es más rápida o más lenta de lo esperado. El interruptor de velocidad puede haberse movido involuntariamente. Compruebe el ajuste de velocidad antes de comenzar cada inyección.
Almacenamiento y manipulación
Almacenamiento
Autoinyector reutilizable AutoTouch Connect®Qué hacer Qué no hacer Guarde AutoTouch Connect en un lugar seco y seguro a temperatura ambiente, como un armario o cajón. No guarde AutoTouch Connect en el refrigerador con los cartuchos precargados de dosis única Enbrel Mini®. Guarde AutoTouch Connect en su caja cuando no esté en uso. No guarde AutoTouch Connect en condiciones de calor o frío extremos, ni en ambientes muy húmedos como el baño. Manipulación
Autoinyector reutilizable AutoTouch ConnectQué hacer Qué no hacer Inspeccione AutoTouch Connect para detectar daños físicos o defectos antes de cada uso. No utilice AutoTouch Connect si se ha caído sobre una superficie dura.
No utilice AutoTouch Connect si alguna pieza parece agrietada o rota.No deje la puerta de AutoTouch Connect abierta durante más de 45 segundos cuando no esté en uso. (Sonará una campanilla y AutoTouch Connect se apagará). No aplaste, queme, caliente ni incinere la batería, ya que esto puede provocar riesgo de incendio o explosión. No utilice AutoTouch Connect si se ha caído sobre una superficie dura. Llame al 1-888-4ENBREL (1-888-436-2735) para obtener un reemplazo. Almacenamiento y manipulación
Cartucho precargado de dosis única Enbrel Mini®Qué hacer Qué no hacer Guarde el Enbrel Mini sin usar en el refrigerador. No congele el Enbrel Mini sin usar.
No caliente Enbrel Mini con una fuente de calor como agua caliente o un microondas.Asegúrese de sostener Enbrel Mini con el lado etiquetado hacia afuera y deslícelo en la puerta. No fuerce la entrada de Enbrel Mini en la puerta.
No utilice Enbrel Mini si se ha caído sobre una superficie dura.Coloque Enbrel Mini en la puerta antes de retirar la tapa morada. No retire la tapa morada antes de insertarla en AutoTouch Connect®.
No vuelva a utilizar ni vuelva a tapar Enbrel Mini.Deseche la tapa morada inmediatamente después de retirarla para evitar el riesgo de asfixia. No utilice Enbrel Mini si alguna pieza parece agrietada o rota. Instrucciones de limpieza
Limpieza
Autoinyector reutilizable AutoTouch Connect®Qué hacer Qué no hacer Utilice una toallita con alcohol para limpiar el extremo de inyección de AutoTouch Connect antes y después de las inyecciones. No limpie AutoTouch Connect con agua. Utilice una toallita con alcohol para limpiar todas las demás áreas de AutoTouch Connect según lo desee. No sumerja AutoTouch Connect en agua. No limpie AutoTouch Connect con limpiadores domésticos o jabón. Advertencias
No se permite ninguna modificación del autoinyector reutilizable AutoTouch Connect®.
Ninguna parte de AutoTouch Connect se puede reparar o reemplazar, incluida la batería.
No coloque nada dentro de la puerta que no sea un cartucho precargado de dosis única Enbrel Mini®.
No sumerja AutoTouch Connect en agua.
No introduzca la mano dentro de AutoTouch Connect.
No aplaste, queme ni caliente AutoTouch Connect.
AutoTouch Connect contiene piezas móviles. Mantenga los dedos fuera de las aberturas en el extremo de inyección o la puerta abierta.
Mantenga AutoTouch Connect y Enbrel Mini fuera del alcance de los niños.
Si AutoTouch Connect falla, la cantidad máxima de medicamento que podría recibir es el contenido completo de Enbrel Mini, que es la dosis correcta.
Tenga cuidado si se produce un error, ya que la aguja puede estar expuesta.
Deseche con cuidado Enbrel Mini en un contenedor de objetos punzocortantes aprobado por la FDA.
Llame a su proveedor de atención médica si tiene alguna inquietud con respecto a una inyección incompleta.
Cuando viaje, mantenga AutoTouch Connect con usted, en su equipaje de mano.
No deseche AutoTouch Connect en la basura doméstica. Llame al 1-888-4ENBREL (1-888-436-2735) para obtener un reemplazo.
¿Qué es la función inalámbrica Bluetooth®?
Este autoinyector reutilizable AutoTouch Connect® tiene una función inalámbrica Bluetooth®, que está diseñada para comunicarse de forma inalámbrica con una aplicación en su dispositivo móvil para ayudarlo a realizar un seguimiento de sus inyecciones.
Actualmente, no hay ninguna aplicación móvil disponible para usar con esta función inalámbrica. Esta función inalámbrica no afectará sus pasos de inyección.
Puede inyectarse sin usar la función inalámbrica. Siga siempre todos los pasos que se encuentran en las Instrucciones de uso.
Información importante requerida por la Comisión Federal de Comunicaciones (FCC)
FCCID: 2AGZ4–ATCONNECT
El autoinyector reutilizable AutoTouch Connect® contiene una función inalámbrica Bluetooth®.
AutoTouch Connect cumple con la Parte 15 de las Reglas de la FCC.
El funcionamiento está sujeto a las dos condiciones siguientes:
- AutoTouch Connect no debe causar interferencias perjudiciales.
- AutoTouch Connect debe aceptar cualquier interferencia recibida, incluidas las interferencias que puedan causar un funcionamiento no deseado.
No se deben realizar modificaciones a AutoTouch Connect sin el consentimiento por escrito de Amgen.
La modificación no autorizada puede anular la autoridad otorgada bajo las reglas de la FCC que permiten el funcionamiento de AutoTouch Connect.
AutoTouch Connect ha sido probado y se ha determinado que cumple con los límites para un dispositivo digital de Clase B, de conformidad con la parte 15 de las Reglas de la FCC. Estos límites están diseñados para proporcionar una protección razonable contra interferencias perjudiciales en una instalación residencial. AutoTouch Connect genera, usa y puede irradiar energía de radiofrecuencia y, si no se instala y usa de acuerdo con las instrucciones, puede causar interferencias perjudiciales en las comunicaciones por radio. Sin embargo, no hay garantía de que no se produzcan interferencias en una instalación en particular.
Si AutoTouch Connect® causa interferencias perjudiciales en la recepción de radio o televisión, lo que se puede determinar alejando y volviendo a acercar AutoTouch Connect, se recomienda al usuario que intente corregir la interferencia mediante una o más de las siguientes medidas:
- Reorientar o reubicar la antena receptora.
- Aumentar la separación entre AutoTouch Connect y el receptor de interferencia.
- Consultar al distribuidor o a un técnico de radio/TV experimentado para obtener ayuda.
La marca denominativa y los logotipos de Bluetooth® son marcas comerciales registradas propiedad de Bluetooth Special Interest Group (SIG) Inc. y cualquier uso de dichas marcas por parte de Amgen se realiza bajo licencia. Otras marcas comerciales y nombres comerciales pertenecen a sus respectivos propietarios.
Información técnica
Grado de protección internacional
El código de protección internacional para el autoinyector reutilizable AutoTouch Connect® cuando se almacena en su caja es IP52. Lo que significa que está protegido contra la entrada limitada de polvo y contra el goteo limitado de agua. AutoTouch Connect no está clasificado para la entrada de polvo o líquidos cuando no se almacena en su caja.
Rango de funcionamiento ambiental
AutoTouch Connect funcionará en el rango de temperatura de 50 °F a 104 °F (10 °C a 40 °C), y del 20 % al 90 % de humedad relativa, y a elevaciones de 197 pies bajo el nivel del mar a 11 483 pies sobre el nivel del mar (-60 m a 3500 m).
Rango de almacenamiento ambiental
Transporte y almacene AutoTouch Connect en su caja, en un lugar seco a temperatura ambiente: 50 °F a 104 °F (10 °C a 40 °C). AutoTouch Connect ha sido probado para una breve exposición a -40 °F a 158 °F (-40 °C a 70 °C), 50 % de humedad relativa y presión equivalente a 14 000 pies (4267 m).
Características de Bluetooth®
La tecnología Bluetooth en AutoTouch Connect cumple con la Especificación principal de Bluetooth v5.0 y está calificada por Bluetooth SIG. AutoTouch Connect ha sido diseñado para transmitir radiofrecuencia (RF) de banda estándar industrial, científica y médica (ISM) de 2,4 GHz de 0 dBm predeterminada y cubre un rango de comunicación de hasta 10 metros.
Información de seguridad y calidad del servicio
El autoinyector AutoTouch Connect tiene una función inalámbrica Bluetooth para establecer una conexión autenticada y cifrada con un dispositivo con capacidad Bluetooth (por ejemplo, aplicación móvil). La configuración inicial requiere acceso físico al número de serie etiquetado del autoinyector para la entrada del usuario en el emparejamiento/enlace seguro inicial. Actualmente no hay ninguna aplicación móvil disponible.
Los datos se transfieren desde el autoinyector en un dispositivo móvil emparejado uno a uno para garantizar la integridad de los datos y la calidad del servicio (QoS). Los datos transferidos son de solo lectura y no se almacena información del paciente en el autoinyector.
Los datos se pueden enviar en cualquier momento y la pérdida temporal de la QoS adecuada se resolverá al reanudarse la conexión con la aplicación. Si la conexión con la aplicación se interrumpe y se restablece, la transferencia de datos se reanuda con la verificación de la integridad de los datos. La latencia o asincronización de la transferencia de datos no afecta el seguimiento de la administración del fármaco, ya que los datos se confirmarán al volver a conectar.
Compatibilidad electromagnética
Los equipos portátiles y móviles de comunicaciones de radiofrecuencia (RF) pueden afectar a los equipos eléctricos médicos. Evite utilizar AutoTouch Connect® cerca de hornos microondas, routers inalámbricos, monitores para bebés u otros aparatos electrónicos domésticos comunes que funcionen mediante transmisión de RF, incluidos los emisores RFID. Se recomienda una distancia mínima de 30 cm (12 pulgadas).
Evite utilizar AutoTouch Connect cerca de campos magnéticos elevados u otros campos, como los que rodean los escáneres de resonancia magnética, tomografía axial computarizada o tomografía por emisión de positrones.
AutoTouch Connect emite RF.
Emisiones electromagnéticas
El autoinyector está diseñado para su uso en el entorno electromagnético especificado a continuación. El usuario del autoinyector debe asegurarse de que se utiliza en dicho entorno. Prueba de emisiones Cumplimiento Entorno electromagnético: Guía Emisiones de RF
(CISPR 11)Group 1 El autoinyector utiliza energía de RF para sus funciones internas y de interfaz del sistema. Sus emisiones de RF son muy bajas y no es probable que causen interferencias en los equipos electrónicos cercanos. Emisiones de RF
(CISPR 11)Class B El autoinyector es apto para su uso en todos los establecimientos, incluidos los domésticos y los conectados directamente a la red pública de suministro de energía de baja tensión que abastece a los edificios utilizados con fines domésticos. Emisiones armónicas
IEC 61000-3-2Not Applicable Fluctuaciones de tensión/emisiones de parpadeo
IEC 61000-3-3Not Applicable Inmunidad electromagnética
El autoinyector está diseñado para su uso en el entorno electromagnético especificado a continuación. El usuario de este autoinyector debe asegurarse de que se utiliza en dicho entorno. Prueba de inmunidad Nivel de prueba IEC 60601 Nivel de cumplimiento Entorno electromagnético: Guía Descarga electrostática (ESD)
IEC 61000-4-2±8 kV Contacto
±15 kV Aire±15 kV Contacto
±20 kV AireLos suelos deben ser de madera, hormigón o baldosas cerámicas. Si los suelos son sintéticos, la humedad relativa debe ser de al menos el 30%. Campos magnéticos de frecuencia de potencia 50/60 Hz
IEC 61000-4-830 A/m 30 A/m a 60 Hz Los campos magnéticos de frecuencia de potencia deben ser los típicos de un entorno comercial u hospitalario. RF
Campo electromagnético
IEC 61000-4-310 V/m
80 MHz – 2.5 GHz(E1) = 10 V/m
26 MHz – 2.7 GHzLos equipos portátiles y móviles de comunicaciones de RF deben estar separados del dispositivo por una distancia no inferior a 30 cm. Características eléctricas
El autoinyector reutilizable AutoTouch Connect® utiliza una batería de litio DL123 no reemplazable y no recargable. La batería tiene un voltaje nominal de 3.0 V con una capacidad de 1400 mAh.
La carcasa del autoinyector es una parte aplicada de Tipo BF:
El sensor de piel y otros componentes electrónicos están aislados de la piel.Dimensiones y peso
AutoTouch Connect pesa 0.4 libras (180 gramos) y mide 9 pulgadas (228 mm) de alto por 1.5 pulgadas (38 mm) de ancho por 1.8 pulgadas (45 mm) de profundidad.
Biocompatibilidad y aislamiento eléctrico
La carcasa del autoinyector está diseñada para entrar en contacto con la piel (consulte Guía de piezas). Es una parte aplicada de Tipo BF. Esto significa que está eléctricamente aislada de la batería. El extremo de inyección y la empuñadura para los dedos de AutoTouch Connect® están hechos de plástico ABS. Este material ha sido sometido a pruebas de biocompatibilidad para la sensibilidad e irritación de la piel.
Contraindicaciones
Este dispositivo está contraindicado para su uso en un entorno de resonancia magnética (RM). Para conocer las contraindicaciones de ENBREL®, consulte la información de prescripción de ENBREL.
Tabla de símbolos

No reutilizar 
Fecha de caducidad
(Fecha de vencimiento)
Número de lote 
Mantener seco 
Número de serie 
Parte aplicada de Tipo BF
La carcasa del autoinyector es una parte aplicada de Tipo BF.
PRECAUCIÓN, consulte los documentos adjuntos 
Consultar las instrucciones de uso 
No usar si el empaque está dañado 
Inseguro para resonancia magnética (RM) AMGEN®
Fabricado por:
Immunex Corporation
Thousand Oaks, CA 91320-1799
©2021-2024 Immunex Corporation.
Todos los derechos reservados.
[partnumber]
Revisado: 07/2024 v3 Este material impreso es reciclable.
Este material impreso es reciclable.Instrucciones de uso Enbrel® (en-brel) (etanercept) inyección, vial de dosis única para uso subcutáneo
Lea estas Instrucciones de uso antes de empezar a tomar Enbrel y cada vez que le receten una nueva cantidad. Puede haber información nueva. Esta información no reemplaza hablar con su proveedor de atención médica sobre su condición médica y tratamiento.
Paso 1: Preparación

1a. Concentración y dosis
La concentración del vial de dosis única de Enbrel es diferente a la del vial de dosis múltiple de Enbrel.
Cada vial de dosis única contiene 25 mg (0.5 mL).
Revise su receta cuidadosamente para la dosis y el programa de dosificación. Solo inyecte Enbrel después de que usted o su cuidador hayan recibido capacitación de su proveedor de atención médica. Su proveedor de atención médica le dirá con qué frecuencia debe usar Enbrel. No use Enbrel con más frecuencia de lo que le indique su proveedor de atención médica. Si olvida usar Enbrel, inyecte su dosis de inmediato. Inyecte su próxima dosis a la hora programada habitual. Si no sabe cuándo inyectar Enbrel, llame a su proveedor de atención médica o farmacéutico.
Mantenga Enbrel fuera del alcance de los niños.

1b. Almacenamiento de los viales de dosis única de Enbrel
Almacene Enbrel en el refrigerador entre 36°F a 46°F (2°C a 8°C). También puede almacenar los viales de dosis única de Enbrel a temperatura ambiente entre 68°F a 77°F (20°C a 25°C) durante un máximo de 30 días. Deseche Enbrel que haya sido almacenado a temperatura ambiente después de 30 días.
No agite.
No congele ni almacene en calor o frío extremos.
Almacene Enbrel en la caja original para protegerlo de la luz o daños.
Si su dosis es de 0.5 mL o MENOS 
Retire 1 vial de dosis única Si su dosis es MÁS de 0.5 mL 
Retire 2 viales de dosis única 1c. Retire la cantidad correcta de viales
Retire la cantidad correcta de viales de dosis única de Enbrel de la caja original.
Compruebe su receta para determinar si su dosis requerirá 1 o 2 viales de dosis única.
Su dosis se determina en mililitros (mL).
La dosis de Enbrel de su hijo depende de su peso. El proveedor de atención médica de su hijo le dirá qué forma de Enbrel usar y cuánto darle a su hijo.
Tapa verde del vial ESPERE 
1d. Inspeccione el vial de dosis única
Deje el vial de dosis única a temperatura ambiente, con la tapa verde puesta, durante al menos 30 minutos.
Enbrel es transparente e incoloro. Puede haber pequeñas partículas blancas en la solución. Compruebe la fecha de caducidad.
Manténgalo fuera de la luz solar directa.
No use Enbrel si:
- la fecha de caducidad ha pasado
- la tapa verde no está puesta
- tiene grumos, está descolorido o está turbio.
Si tiene algún problema con sus viales de dosis única de Enbrel, llame al 1-888-4ENBREL (1-888-436-2735).

1e. Reúna todos los materiales y lávese las manos
Lávese las manos con agua y jabón.
Coloque los siguientes artículos sobre una superficie limpia, bien iluminada y plana:
- Jeringa de 1 mL
- Aguja larga: para la extracción
- Aguja corta: para la inyección
- Toallitas con alcohol
- Bolas de algodón
- Vendaje
- Contenedor de eliminación de objetos punzantes

1f. Retire la tapa verde del vial y luego limpie el tapón gris
Utilice una toallita con alcohol para limpiar el tapón gris.
Si necesita un segundo vial de dosis única, limpie el tapón gris del segundo vial de dosis única con una nueva toallita con alcohol.
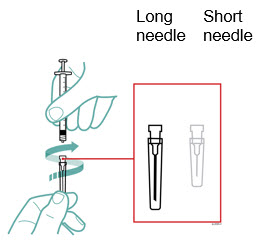
1g. Conecte la aguja larga a la jeringa
Gire la aguja larga sobre la jeringa.
Paso 2: Prepare la dosis

2a. Tire del émbolo hacia atrás, inserte la aguja y empuje el aire en el vial de dosis única
Tire de la tapa de la aguja recta hacia afuera y lejos de su cuerpo. Guarde la tapa de la aguja para más tarde.
Tire del émbolo de la jeringa hacia atrás hasta 0,5 mL.
Sostenga el vial de dosis única sobre una superficie plana con una mano. Inserte la aguja larga a través del tapón de goma gris por encima del medicamento en el vial de dosis única.
Empuje lentamente 0,5 mL de aire en el vial de dosis única.

2b. Incline el vial de dosis única para extraer todo el medicamento
Tire lentamente del émbolo hacia atrás para llenar la jeringa con todo el medicamento del vial de dosis única.
Retire la aguja del vial de dosis única.
El aire de la jeringa se eliminará más tarde.

2c. Golpee suavemente la jeringa con los dedos para liberar las burbujas
Golpee suavemente la jeringa con los dedos para liberar las bolsas de aire y las burbujas hasta que suban a la parte superior de la jeringa.
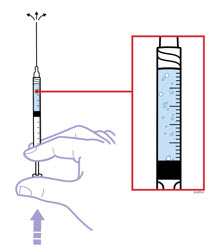
2d. Empuje las bolsas de aire y las burbujas grandes hacia afuera
Después de haber golpeado suavemente las bolsas de aire y las burbujas grandes hasta la parte superior de la jeringa, empuje el émbolo hacia arriba para eliminar el aire de la jeringa.
Pequeñas cantidades de burbujas de aire diminutas están bien.
Si necesita 1 vial de dosis única, empuje el émbolo hasta su dosis total prescrita y continúe con el paso 2g.
Si necesita más de 1 vial de dosis única para obtener su dosis total prescrita, siga estos 2 pasos:


2e. Inserte la misma aguja en el segundo vial
Incline el vial para extraer el medicamento. Tire lentamente
del émbolo hacia atrás para llenar la jeringa con todo el medicamento
del vial.
Retire la aguja del vial de dosis única.
El aire se eliminará en el siguiente paso2f. Golpee suavemente la jeringa para eliminar el aire
Sostenga la aguja apuntando hacia arriba y golpee suavemente la jeringa para que las burbujas de aire suban a la parte superior.
Empuje el émbolo hasta su dosis prescrita.
Pequeñas cantidades de burbujas de aire diminutas están bien.
2g. Utilice el método de la cuchara con una mano para volver a poner la tapa
Para su seguridad, coloque la tapa de la aguja sobre una superficie plana.Usando 1 mano, deslice la aguja hacia la tapa y levante hacia arriba para tapar la aguja, sin usar la otra mano.
Luego, use la otra mano para asegurar la tapa y hacerla encajar en su lugar.
Paso 3: Inyecte y deseche

3a. Reemplace la aguja larga por la aguja corta
Gire la aguja larga de la jeringa.
Deseche la aguja larga en el contenedor de eliminación de objetos punzantes.
Gire la aguja corta en la jeringa.
No retire la cubierta de la aguja hasta que esté listo para inyectar.

3b. Elija y limpie el sitio de inyección
- muslo o estómago (evite 2 pulgadas alrededor del ombligo)
- parte posterior de la parte superior del brazo (solo si otra persona está administrando la inyección)
Elija un sitio diferente cada vez que se administre una inyección. Evite inyectar en la piel sensible, elevada, roja o escamosa.
Limpie el sitio de inyección con una toallita con alcohol y deje secar. No toque esta área nuevamente antes de inyectar.

3c. Pellizque e inyecte Enbrel
Pellizque suavemente la piel. Con un movimiento rápido y firme, inserte la aguja en la piel en un ángulo de 45 grados.
Cuando la aguja esté completamente insertada en la piel, empuje lentamente el émbolo hasta el final.
Cuando la jeringa esté vacía, retire la aguja y la jeringa de la piel. No vuelva a tapar la aguja.
No frote el sitio de inyección. Si ve gotas de sangre en el sitio de inyección, puede presionar una bola de algodón sobre el sitio de inyección hasta que deje de sangrar. Aplique una venda adhesiva, si es necesario.

3d. Deseche los viales de dosis única usados, las agujas y la jeringa
Los viales de dosis única no contienen conservantes y son para uso único. Los medicamentos no utilizados en los viales de dosis única deben desecharse en un contenedor de eliminación de objetos punzantes.
Información adicional sobre la eliminación
No deseche los viales, las agujas y la jeringa en la basura de su hogar.
Si no tiene un contenedor de eliminación de objetos punzantes aprobado por la FDA, puede usar un contenedor doméstico que sea:
- hecho de plástico de alta resistencia
- se puede cerrar con una tapa hermética y resistente a las perforaciones sin que los objetos punzantes puedan salir
- vertical y estable durante el uso
- resistente a las fugas
- debidamente etiquetado para advertir sobre los residuos peligrosos dentro del contenedor
Cuando su contenedor de eliminación de objetos punzantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de desechar su contenedor de eliminación de objetos punzantes. Puede haber leyes estatales o locales sobre cómo debe desechar los viales, las agujas y las jeringas usadas.
Para obtener más información sobre la eliminación segura de objetos punzantes y para obtener información específica sobre la eliminación de objetos punzantes en el estado en el que vive, visite el sitio web de la FDA en: http://www.fda.gov/safesharpsdisposal
- No deseche su contenedor de eliminación de objetos punzantes usado en la basura de su hogar a menos que las pautas de su comunidad lo permitan. No recicle su contenedor de eliminación de objetos punzantes usado.
- No reutilice los viales, la jeringa o las agujas.
- No recicle los viales, la jeringa, las agujas o el contenedor de eliminación de objetos punzantes ni los tire a la basura doméstica.
Importante: Mantenga siempre el contenedor de eliminación de objetos punzantes fuera del alcance de los niños.
Si tiene alguna dificultad para usar sus viales de dosis única de Enbrel, llame al 1-888-4ENBREL (1-888-436-2735).
Si tiene alguna pregunta sobre su dosis de Enbrel, llame a su proveedor de atención médica.
Estas instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos.
AMGEN®
Fabricado por:
Immunex Corporation
Thousand Oaks, CA 91320-1799
Número de licencia de EE. UU. 1132
© 1998-2020, 2022 Immunex Corporation. Todos los derechos reservados.
[número de parte]
Revisado: 06/2022 v2 Este material impreso es reciclable.
Este material impreso es reciclable.Panel frontal
Lea estas instrucciones antes de usar Enbrel®
Vial de dosis única
Instrucciones de usoSECCIÓN NO CLASIFICADA DE SPL
GUÍA DE REFERENCIA
Lado 1 Guía de Referencia
Enbrel® (en-brel) (etanercept)
inyección, para uso subcutáneo
Autoinyector SureClick® prellenado de dosis única
50 mg/mLLea todas las instrucciones en la caja antes de usar.
¿Preguntas? Llame al 1-888-4ENBREL (1-888-436-2735)(Material #, Code 128 w/ Human Readable) Guía de las partes 
Espere por lo menos 30 minutos para que el autoinyector alcance la temperatura ambiente antes de administrarse la inyección. Retire la tapa blanca recta solo cuando esté listo para inyectar.
No deje la tapa blanca quitada por más de 5 minutos.
Esto puede secar el medicamento.Prepare y limpie su lugar de inyección.
21 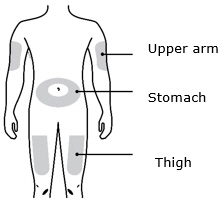

5 minutos
Dé la vuelta para continuar Lado 2 Guía de Referencia
Enbrel® (en-brel) (etanercept)
inyección, para uso subcutáneo
Autoinyector SureClick® prellenado de dosis única
50 mg/mLAMGEN® Lea el otro lado primero Fabricado por:
Immunex Corporation
Thousand Oaks, CA 91320-1799
© 1998, 2019, 2021-2022 Immunex Corporation. Todos los derechos reservados.
<part number>
Revisado: 8/2022 v9 Este material impreso es reciclable.
Este material impreso es reciclable.Estire o pellizque el lugar de la inyección para crear una superficie firme. Coloque el protector de seguridad verde (aguja adentro) sobre su piel a 90 grados. Presione firmemente el autoinyector sobre su piel hasta que deje de moverse. Siga presionando sobre su piel durante unos 15 segundos. 3 4 5 6 Método de estiramiento: 

Cuando esté listo para inyectar, presione el botón de inicio morado. Escuchará un clic. 15 segundos

La ventana cambia de transparente a amarilla cuando se completa la inyección.Método de pellizco: o 
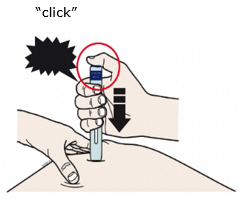

PANEL DE VISUALIZACIÓN PRINCIPAL
PANEL PRINCIPAL DE VISUALIZACIÓN
Contiene 4 Jeringas Prefiltradas de Dosis Única
NDC 58406-455-04
Enbrel®
etanercept
25 mg/0.5 mL
Jeringa Prefiltrada de Dosis Única
25 mg/0.5 mL
Atención: No usar en pacientes pediátricos menores de 31 kg (68 libras).
Solo para uso subcutáneo
Solución estéril – Sin conservante
Refrigerar a 2° a 8°C (36° a 46°F). NO CONGELAR.
El contenido del cartón (4 jeringas precargadas de dosis única, 1 folleto
con la Guía de Medicamentos adjunta) está destinado a ser
despachado como una unidad.
ATENCIÓN: La Guía de Medicamentos adjunta es obligatoria
para cada paciente.
Este producto contiene caucho natural seco.
AMGEN®
Receta médica únicamente
Fabricado por Immunex Corporation, Thousand Oaks, CA 91320
PANEL DE VISUALIZACIÓN PRINCIPAL
PANEL PRINCIPAL DE VISUALIZACIÓN
Contiene 4 Jeringas Prellenadas de Dosis Única
NDC 58406-435-04
Enbrel®
etanercept
50 mg/mL
Jeringa Prellenada de Dosis Única
50 mg/mL
Atención: No usar en pacientes pediátricos menores de 63 kg (138 libras).
Solo para uso subcutáneo
Solución estéril – Sin conservante
Refrigerar a 2° a 8°C (36° a 46°F). NO CONGELAR.
El contenido del cartón (4 jeringas prellenadas de dosis única, 1 folleto informativo con la Guía de Medicamentos adjunta) está destinado a ser dispensado como una unidad.
ATENCIÓN: La Guía de Medicamentos adjunta es necesaria para cada paciente.
Este producto contiene caucho natural seco.
AMGEN®
Receta médica únicamente
Fabricado por Immunex Corporation, Thousand Oaks, CA 91320
PANEL PRINCIPAL DE EXHIBICIÓN – Cartón de la jeringa de 25 mg/0,5 mL
Contiene 4 jeringas precargadas de dosis única
NDC 58406-010-04
Enbrel®
etanercept25
mg/0.5 mLNo fabricado con
látex de caucho natural25 mg/0.5 mL
Jeringa precargada de dosis únicaAtención: No para uso en pacientes pediátricos menores de 31 kg (68 libras).
Solo para uso subcutáneo
Solución estéril – Sin conservante
Refrigerar a 2° a 8°C (36° a 46°F). NO CONGELAR.Cada jeringa precargada de dosis única contiene 0.5 mL de una solución clara e
incolora que contiene 25 mg/0.5 mL de etanercept y está formulada a
pH 6.3 ± 0.2, con 25 mM de clorhidrato de L-arginina, 120 mM de cloruro de sodio,
y 1% de sacarosa.Actividad específica: aproximadamente 1.7 x 106 U/mg.
Fabricado por Immunex Corporation, Thousand Oaks, CA 91320
Licencia de EE. UU. No. 1132©2013, 2017, 2022-2023 Immunex Corporation
Patente: http://pat.amgen.com/enbrel/Esta caja es reciclable.

PANEL PRINCIPAL DE VISUALIZACIÓN – Jeringa en caja de 50 mg/mL
Contiene 4 jeringas precargadas de dosis única
NDC 58406-021-04
Enbrel®
etanercept50
mg/mLNo fabricado con
látex de caucho natural50 mg/mL
Jeringa precargada de dosis únicaAtención: No usar en pacientes pediátricos menores de 63 kg (138 libras).
Solo para uso subcutáneo
Solución estéril – Sin conservantes
Refrigerar de 2° a 8°C (36° a 46°F). NO CONGELAR.Cada jeringa precargada de dosis única contiene 1 mL de una solución transparente e
incolora que contiene 50 mg/mL de etanercept y está formulada a
pH 6.3 ± 0.2, con 25 mM de hidrocloruro de L-arginina, 120 mM de cloruro de sodio
y 1% de sacarosa.Actividad específica: aproximadamente 1.7 x 106 U/mg.
Fabricado por Immunex Corporation, Thousand Oaks, CA 91320
Licencia de EE. UU. n.° 1132©2013, 2017, 2022-2023 Immunex Corporation
Patente: http://pat.amgen.com/enbrel/Esta caja es reciclable.
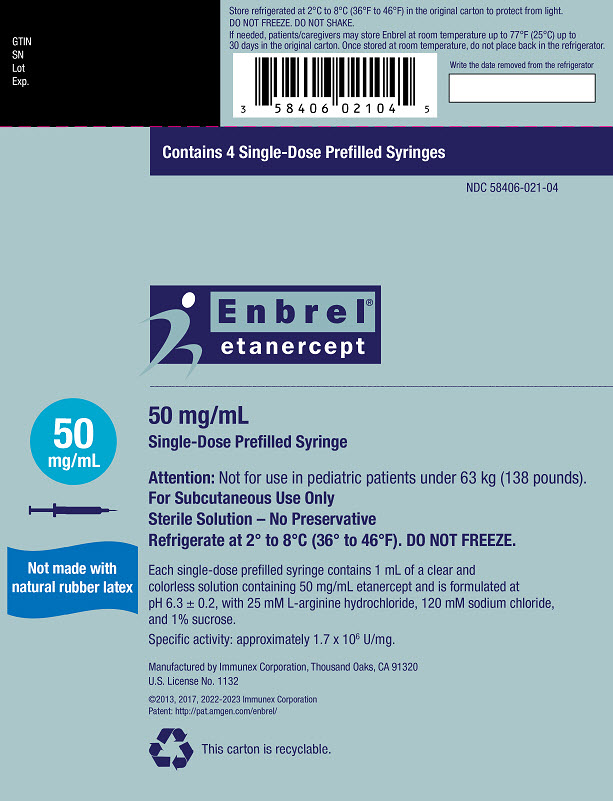
PANEL DE VISUALIZACIÓN PRINCIPAL
PANEL PRINCIPAL DE VISUALIZACIÓN
Contiene 4 autoinyectores precargados de dosis única
NDC 58406-445-04
Enbrel®
etanercept
SureClick® Autoinjector
50 mg/mL
Autoinyector precargado de dosis única
50 mg/mL
Atención: No se debe usar en pacientes pediátricos que pesen menos de 63 kg (138 libras).
Solo para uso subcutáneo
Solución estéril – Sin conservantes
Refrigerar de 2° a 8°C (36° a 46°F). NO CONGELAR.
El contenido de la caja (4 autoinyectores precargados SureClick®, 1 prospecto con
la Guía del Medicamento adjunta) debe dispensarse como una unidad.
ATENCIÓN: Se requiere la Guía del Medicamento adjunta para cada paciente.
Este producto contiene caucho natural seco.
AMGEN®
Rx Only
Fabricado por Immunex Corporation, Thousand Oaks, CA 91320-1799
PANEL PRINCIPAL DE VISUALIZACIÓN – Cartón de autoinyector de 50 mg/mL
Contiene 4 autoinyectores precargados de dosis única
NDC 58406-032-04
Enbrel®
etanercept50
mg/mLNo fabricado con
látex de caucho naturalSureClick® Autoinjector
50 mg/mL
Autoinyector precargado de dosis únicaAtención: No apto para uso en pacientes pediátricos menores de 63 kg (138 libras).
Solo para uso subcutáneo
Solución estéril – Sin conservantes
Refrigerar de 2° a 8°C (36° a 46°F). NO CONGELAR.Cada autoinyector precargado de dosis única contiene 1 mL de una solución transparente e incolora que contiene
50 mg/mL de etanercept y está formulada a un pH de 6.3 ± 0.2, con 25 mM de hidrocloruro de L-arginina,
120 mM de cloruro de sodio y 1% de sacarosa.Actividad específica: aproximadamente 1.7 x 106 U/mg.
Fabricado por Immunex Corporation, Thousand Oaks, CA 91320-1799
Licencia de EE. UU. n.° 1132©2015, 2017, 2022-2023 Immunex Corporation
Patente: http://pat.amgen.com/enbrel/Este cartón es reciclable.

PANEL DE VISUALIZACIÓN PRINCIPAL
PANEL PRINCIPAL DE VISUALIZACIÓN
Contiene 4 bandejas de dosis múltiples
NDC 58406-425-34
AMGEN®
Enbrel®
etanercept
25 mg/vial
Vial de dosis múltiples
Consulte el prospecto para obtener información completa sobre la prescripción
e instrucciones para la preparación y administración.
25 mg/vial
Cada vial contiene una preparación liofilizada estéril
de 25 mg de etanercept (un producto derivado de células CHO recombinantes)
producto), 40 mg de manitol, 10 mg de sacarosa y
1,2 mg de trometamina.
Actividad específica: aproximadamente 1,7 x 106 U/mg.
No hay un estándar de potencia de EE. UU. Volumen después de la reconstitución
con 1 mL de diluyente es 1 mL.
Antes y después de la reconstitución, refrigerar
a 2° a 8°C (36° a 46°F). NO CONGELAR.
Solo para uso subcutáneo
AMGEN®
Fabricado por Immunex Corporation, Thousand Oaks, CA 91320
Contiene jeringas de diluyente (Hecho en Alemania)
Licencia de EE. UU. No. 1132
©2013, 2016 Immunex Corporation
Patente: http://pat.amgen.com/enbrel/
PANEL DE VISUALIZACIÓN PRINCIPAL
PANEL PRINCIPAL DE VISUALIZACIÓN
Contiene 4 cartuchos prellenados de dosis única
NDC 58406-456-04
Enbrel®
etanercept
50 mg/mL
Enbrel Mini™ prefilled cartridge
50 mg/mL
Cartucho prellenado de dosis única
Para uso exclusivo con el autoinyector reutilizable AutoTouch™
Atención: No debe usarse en pacientes pediátricos que pesen menos de 62.6 kg (138 lbs).
Sólo para uso subcutáneo
Solución estéril – Sin conservantes
Refrigerar de 2°C a 8°C (36° a 46°F). NO CONGELAR. NO AGITAR.
El contenido del cartón (4 cartuchos prellenados, 1 prospecto con la Guía del Medicamento adjunta)
está destinado a dispensarse como una unidad.
ATENCIÓN: Se requiere la Guía del Medicamento adjunta para cada paciente.
Este producto contiene
caucho natural seco.
No reutilizar
PRECAUCIÓN, Consulte el prospecto
para obtener la información de prescripción completa
y las Instrucciones de Uso
Rx Only
AMGEN®
PANEL PRINCIPAL DE VISUALIZACIÓN – Cartucho de 50 mg/mL
Contiene 4 cartuchos precargados de dosis única
NDC 58406-044-04
Enbrel®
etanercept50
mg/mLNo fabricado con
látex de caucho naturalEnbrel Mini® cartucho precargado
50 mg/mL
Cartucho precargado de dosis única
Para usar únicamente con todos los autoinyectores reutilizables AutoTouch®Atención: No usar en pacientes pediátricos que pesen menos de 138 lbs (62.6 kg).
Sólo para uso subcutáneo
Solución estéril – Sin conservantes
Refrigerar de 2° a 8°C (36° a 46°F). NO CONGELAR. NO AGITAR.El contenido del cartón (4 cartuchos precargados, 1 prospecto con la Guía del Medicamento adjunta)
está destinado a dispensarse como una unidad.ATENCIÓN: Se requiere la Guía del Medicamento adjunta para cada paciente.
No reutilizar
PRECAUCIÓN, Consulte el prospecto
para obtener la información de prescripción completa
e Instrucciones de usoRx Only
AMGEN®
↓ ABRIR AQUÍ ↓

PANEL DE VISUALIZACIÓN PRINCIPAL
PANEL PRINCIPAL DE PRESENTACIÓN
NDC 58406-470-01AMGEN®
AutoTouch® autoinyector reutilizable
Para usar con Enbrel Mini® (etanercept)
Para usar con Enbrel Mini® (etanercept) cartucho prellenado de dosis única
Contiene 1 AutoTouch® autoinyector reutilizable
Sólo para uso subcutáneo
Almacenar a temperatura ambiente.
IP52 – Este paquete resiste gotas de agua y polvo.
No usar si el paquete está dañado
Tipo BF Parte Aplicada
Exp: Fecha de caducidad
Seguir las instrucciones de uso
Rx Only

PANEL PRINCIPAL DE VISUALIZACIÓN – Etiqueta del autoinyector de cartucho precargado de dosis única de 50 mg/ml
NDC 58406-480-01
AMGEN®
Bluetooth®
AutoTouch Connect™
autoinyector reutilizablePara uso con Enbrel Mini® (etanercept)
cartucho prellenado de dosis únicaContiene 1 autoinyector reutilizable AutoTouch Connect™
Solo para uso subcutáneoAlmacenar en un lugar seco a temperatura ambiente: 50°F a 104°F (10°C a 40°C)
IP52 – Este paquete resistirá las gotas de agua y el polvo.No usar si el paquete está dañado
Tipo BF Parte aplicada
MR inseguro
Exp: Fecha de caducidad
Siga las instrucciones de usoRx Only

PANEL PRINCIPAL DE VISUALIZACIÓN – Vial Cartón de 25 mg/0.5 mL
4 Viales de Dosis Única, cada vial es de 25 mg/0.5mL
NDC 58406-055-04AMGEN®
Enbrel®
etanercept
Inyección25
mg25 mg/0.5 mL
Vial de Dosis Única – Deseche la porción no utilizadaPara uso subcutáneo únicamente.
Solución estéril – Sin conservante.
Almacenar refrigerado a 2° a 8°C (36° a 46°F). NO CONGELAR.
NO AGITAR.
Proteger de la luz.Licencia de EE. UU. No. 1132
Fabricado por Immunex Corporation
Thousand Oaks, CA 91320-1799 EE. UU.
© 2020, 2022-2023 Immunex CorporationRx Only
 Tags: F10
Tags: F10



 Este material impreso es reciclable
Este material impreso es reciclable