Fabricante de medicamentos: E.R. Squibb & Sons, L.L.C. (Updated: 2021-09-30)
Aspectos Destacados de la Información de Prescripción
ELIQUIS® (apixaban) tabletas, para administración oral
Aprobación inicial en EE. UU.: 2012
ADVERTENCIA: (A) LA SUSPENSIÓN PREMATURA DE ELIQUIS AUMENTA EL RIESGO DE EVENTOS TROMBÓTICOS
(B) HEMATOMA ESPINAL/EPIDURAL
Consulte la información completa de prescripción para la advertencia completa en recuadro.
(A) LA SUSPENSIÓN PREMATURA DE ELIQUIS AUMENTA EL RIESGO DE EVENTOS TROMBÓTICOS: La suspensión prematura de cualquier anticoagulante oral, incluido ELIQUIS, aumenta el riesgo de eventos trombóticos. Para reducir este riesgo, considere la cobertura con otro anticoagulante si se suspende ELIQUIS por una razón que no sea sangrado patológico o la finalización de un ciclo de terapia. (2.4, 5.1, 14.1)
(B) HEMATOMA ESPINAL/EPIDURAL: Los hematomas epidurales o espinales pueden ocurrir en pacientes tratados con ELIQUIS que reciben anestesia neuroaxial o se someten a punción espinal. Estos hematomas pueden provocar parálisis a largo plazo o permanente. Considere estos riesgos al programar a los pacientes para procedimientos espinales. (5.3)
INDICACIONES Y USO
ELIQUIS es un inhibidor del factor Xa indicado:
- •
- para reducir el riesgo de accidente cerebrovascular y embolia sistémica en pacientes con fibrilación auricular no valvular. (1.1)
- •
- para la profilaxis de la trombosis venosa profunda (TVP), que puede provocar embolia pulmonar (EP), en pacientes que se han sometido a una cirugía de reemplazo de cadera o rodilla. (1.2)
- •
- para el tratamiento de la TVP y la EP, y para la reducción del riesgo de TVP y EP recurrentes después de la terapia inicial. (1.3, 1.4, 1.5)
DOSIFICACIÓN Y ADMINISTRACIÓN
- •
- Reducción del riesgo de accidente cerebrovascular y embolia sistémica en fibrilación auricular no valvular:
- •
- La dosis recomendada es de 5 mg por vía oral dos veces al día. (2.1)
- •
- En pacientes con al menos 2 de las siguientes características: edad mayor o igual a 80 años, peso corporal menor o igual a 60 kg o creatinina sérica mayor o igual a 1,5 mg/dL, la dosis recomendada es de 2,5 mg por vía oral dos veces al día. (2.1)
- •
- Profilaxis de la TVP después de la cirugía de reemplazo de cadera o rodilla:
- •
- La dosis recomendada es de 2,5 mg por vía oral dos veces al día. (2.1)
- •
- Tratamiento de la TVP y la EP:
- •
- La dosis recomendada es de 10 mg por vía oral dos veces al día durante 7 días, seguida de 5 mg por vía oral dos veces al día. (2.1)
- •
- Reducción del riesgo de TVP y EP recurrentes después de la terapia inicial:
- •
- La dosis recomendada es de 2,5 mg por vía oral dos veces al día. (2.1)
FORMAS Y FUERZAS DE DOSIFICACIÓN
- •
- Tabletas: 2,5 mg y 5 mg (3)
ADVERTENCIAS Y PRECAUCIONES
- •
- ELIQUIS puede causar sangrado grave, potencialmente fatal. Evalúe rápidamente los signos y síntomas de pérdida de sangre. Existe un agente para revertir la actividad antifactor Xa de apixaban. (5.2)
- •
- Prótesis valvulares cardíacas: No se recomienda el uso de ELIQUIS. (5.4)
- •
- Aumento del riesgo de trombosis en pacientes con síndrome antifosfolipídico triple positivo: No se recomienda el uso de ELIQUIS. (5.6)
REACCIONES ADVERSAS
Las reacciones adversas más comunes (>1%) están relacionadas con el sangrado. (6.1)
Para informar sobre REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Bristol-Myers Squibb al 1-800-721-5072 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES MEDICAMENTOSAS
- •
- Los inhibidores combinados de P-gp y CYP3A4 fuertes aumentan los niveles sanguíneos de apixaban. Reduzca la dosis de ELIQUIS o evite la administración conjunta. (2.5, 7.1, 12.3)
- •
- El uso simultáneo de inductores combinados de P-gp y CYP3A4 fuertes reduce los niveles sanguíneos de apixaban: Evite el uso concomitante. (7.2, 12.3)
USO EN POBLACIONES ESPECÍFICAS
Consulte 17 para obtener INFORMACIÓN PARA EL PACIENTE y la Guía de medicamentos.
Revisado: 4/2021
Tabla de contenido
FULL PRESCRIBING INFORMATION: CONTENTS*
WARNING: (A) PREMATURE DISCONTINUATION OF ELIQUIS INCREASES THE RISK OF THROMBOTIC EVENTS
(B) SPINAL/EPIDURAL HEMATOMA
1 INDICACIONES Y USO
1.1 Reducción del Riesgo de Accidente Cerebrovascular y Embolia Sistémica en la Fibrilación Auricular No Valvular
1.2 Profilaxis de la Trombosis Venosa Profunda Después de una Cirugía de Reemplazo de Cadera o Rodilla
1.3 Tratamiento de la Trombosis Venosa Profunda
1.4 Tratamiento de la Embolia Pulmonar
1.5 Reducción en el Riesgo de Recurrencia de TVP y EP
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis Recomendada
2.2 Dosis Omitida
2.3 Interrupción Temporal para Cirugía y Otras Intervenciones
2.4 Cambio de o a ELIQUIS
2.5 Inhibidores Combinados de P-gp y CYP3A4 Fuertes
2.6 Opciones de Administración
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Mayor Riesgo de Eventos Trombóticos Después de la Suspensión Prematura
5.2 Sangrado
5.3 Anestesia o Punción Espinal/Epidural
5.4 Pacientes con Prótesis Valvulares Cardíacas
5.5 EP Aguda en Pacientes Hemodinámicamente Inestables o Pacientes que Requieren Trombólisis o Embolectomía Pulmonar
5.6 Mayor Riesgo de Trombosis en Pacientes con Síndrome Antifosfolípido Triple Positivo
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
7 INTERACCIONES CON MEDICAMENTOS
7.1 Inhibidores Combinados de P-gp y CYP3A4 Fuertes
7.2 Inductores Combinados de P-gp y CYP3A4 Fuertes
7.3 Anticoagulantes y Agentes Antiplaquetarios
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.3 Mujeres y Hombres con Potencial Reproductivo
8.4 Uso Pediátrico
8.5 Uso Geriátrico
8.6 Insuficiencia Renal
8.7 Insuficiencia Hepática
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Reducción del Riesgo de Accidente Cerebrovascular y Embolia Sistémica en la Fibrilación Auricular No Valvular
14.2 Profilaxis de la Trombosis Venosa Profunda Después de una Cirugía de Reemplazo de Cadera o Rodilla
14.3 Tratamiento de la TVP y la EP y Reducción del Riesgo de Recurrencia de TVP y EP
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANIPULACIÓN
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información de prescripción completa no se enumeran.
ADVERTENCIA RECUADRADA
ADVERTENCIA: (A) LA INTERRUPCIÓN PREMATURA DE ELIQUIS AUMENTA EL RIESGO DE EVENTOS TROMBÓTICOS
(B) HEMATOMA ESPINAL/EPIDURAL
(A) LA INTERRUPCIÓN PREMATURA DE ELIQUIS AUMENTA EL RIESGO DE EVENTOS TROMBÓTICOS
La interrupción prematura de cualquier anticoagulante oral, incluido ELIQUIS, aumenta el riesgo de eventos trombóticos. Si se interrumpe la anticoagulación con ELIQUIS por una razón que no sea una hemorragia patológica o la finalización de un ciclo de tratamiento, considere la posibilidad de administrar otro anticoagulante [consulte Dosificación y administración (2.4), Advertencias y precauciones (5.1) y Estudios clínicos (14.1)].
(B) HEMATOMA ESPINAL/EPIDURAL
Los pacientes tratados con ELIQUIS que reciben anestesia neuraxial o se someten a una punción lumbar pueden sufrir hematomas epidurales o espinales. Estos hematomas pueden provocar parálisis a largo plazo o permanente. Tenga en cuenta estos riesgos al programar a los pacientes para procedimientos de la columna vertebral. Los factores que pueden aumentar el riesgo de desarrollar hematomas epidurales o espinales en estos pacientes incluyen:
- •
- uso de catéteres epidurales permanentes
- •
- uso concomitante de otros fármacos que afectan a la hemostasia, como los antiinflamatorios no esteroideos (AINE), los antiagregantes plaquetarios y otros anticoagulantes
- •
- antecedentes de punciones epidurales o espinales traumáticas o repetidas
- •
- antecedentes de deformidad o cirugía de la columna vertebral
- •
- se desconoce el momento óptimo entre la administración de ELIQUIS y los procedimientos neuraxiales
[consulte Advertencias y precauciones (5.3)]
Controle con frecuencia a los pacientes para detectar signos y síntomas de deterioro neurológico. Si se observa compromiso neurológico, es necesario un tratamiento urgente [consulte Advertencias y precauciones (5.3)].
Considere los beneficios y los riesgos antes de una intervención neuraxial en pacientes anticoagulados o que vayan a ser anticoagulados [consulte Advertencias y precauciones (5.3)].
1 INDICACIONES Y USO
1.1 Reducción del Riesgo de Accidente Cerebrovascular y Embolia Sistémica en Fibrilación Auricular No Valvular
ELIQUIS está indicado para reducir el riesgo de accidente cerebrovascular y embolia sistémica en pacientes con fibrilación auricular no valvular.
1.2 Profilaxis de Trombosis Venosa Profunda Después de Cirugía de Reemplazo de Cadera o Rodilla
ELIQUIS está indicado para la profilaxis de la trombosis venosa profunda (TVP), que puede conducir a embolia pulmonar (EP), en pacientes que se han sometido a cirugía de reemplazo de cadera o rodilla.
1.3 Tratamiento de la Trombosis Venosa Profunda
ELIQUIS está indicado para el tratamiento de la TVP.
1.5 Reducción del Riesgo de Recurrencia de TVP y EP
ELIQUIS está indicado para reducir el riesgo de recurrencia de TVP y EP después de la terapia inicial.
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis recomendada
Reducción del riesgo de accidente cerebrovascular y embolia sistémica en pacientes con fibrilación auricular no valvular
La dosis recomendada de ELIQUIS para la mayoría de los pacientes es de 5 mg por vía oral dos veces al día.
La dosis recomendada de ELIQUIS es de 2.5 mg dos veces al día en pacientes con al menos dos de las siguientes características:
- •
- edad mayor o igual a 80 años
- •
- peso corporal menor o igual a 60 kg
- •
- creatinina sérica mayor o igual a 1.5 mg/dL
Profilaxis de la trombosis venosa profunda después de una cirugía de reemplazo de cadera o rodilla
La dosis recomendada de ELIQUIS es de 2.5 mg por vía oral dos veces al día. La dosis inicial debe tomarse entre 12 y 24 horas después de la cirugía.
- •
- En pacientes sometidos a cirugía de reemplazo de cadera, la duración recomendada del tratamiento es de 35 días.
- •
- En pacientes sometidos a cirugía de reemplazo de rodilla, la duración recomendada del tratamiento es de 12 días.
Tratamiento de la TVP y la EP
La dosis recomendada de ELIQUIS es de 10 mg por vía oral dos veces al día durante los primeros 7 días de terapia. Después de 7 días, la dosis recomendada es de 5 mg por vía oral dos veces al día.
Reducción del riesgo de recurrencia de TVP y EP
La dosis recomendada de ELIQUIS es de 2.5 mg por vía oral dos veces al día después de al menos 6 meses de tratamiento para la TVP o la EP [consulte Estudios clínicos (14.3)].
2.2 Dosis olvidada
Si no se toma una dosis de ELIQUIS a la hora programada, la dosis debe tomarse tan pronto como sea posible el mismo día y se debe reanudar la administración dos veces al día. La dosis no debe duplicarse para compensar la dosis olvidada.
2.3 Interrupción temporal para cirugía y otras intervenciones
El tratamiento con ELIQUIS debe interrumpirse al menos 48 horas antes de una cirugía electiva o procedimientos invasivos con un riesgo moderado o alto de sangrado inaceptable o clínicamente significativo [consulte Advertencias y precauciones (5.2)]. El tratamiento con ELIQUIS debe interrumpirse al menos 24 horas antes de una cirugía electiva o procedimientos invasivos con bajo riesgo de sangrado o en los que el sangrado no sería crítico en su localización y se controlaría fácilmente. Por lo general, no se requiere un tratamiento anticoagulante de transición durante las 24 a 48 horas posteriores a la suspensión de ELIQUIS y antes de la intervención. El tratamiento con ELIQUIS debe reiniciarse después de los procedimientos quirúrgicos u otros procedimientos tan pronto como se haya establecido una hemostasia adecuada.
2.4 Conversión de o a ELIQUIS
Cambio de warfarina a ELIQUIS: Se debe interrumpir la administración de warfarina e iniciar el tratamiento con ELIQUIS cuando el índice internacional normalizado (INR) sea inferior a 2.0.
Cambio de ELIQUIS a warfarina: ELIQUIS afecta al INR, por lo que las mediciones iniciales del INR durante la transición a warfarina pueden no ser útiles para determinar la dosis adecuada de warfarina. Un enfoque consiste en interrumpir la administración de ELIQUIS e iniciar el tratamiento con un anticoagulante parenteral y warfarina en el momento en que se habría tomado la siguiente dosis de ELIQUIS, interrumpiendo la administración del anticoagulante parenteral cuando el INR alcance un intervalo aceptable.
Cambio de ELIQUIS a anticoagulantes distintos de la warfarina (orales o parenterales): Interrumpa la administración de ELIQUIS y comience a tomar el nuevo anticoagulante distinto de la warfarina a la hora habitual de la siguiente dosis de ELIQUIS.
Cambio de anticoagulantes distintos de la warfarina (orales o parenterales) a ELIQUIS: Interrumpa la administración del anticoagulante distinto de la warfarina y comience a tomar ELIQUIS a la hora habitual de la siguiente dosis del anticoagulante distinto de la warfarina.
2.5 Inhibidores combinados de la P-gp y CYP3A4 fuertes
En pacientes que reciben dosis de ELIQUIS de 5 mg o 10 mg dos veces al día, reduzca la dosis en un 50% cuando ELIQUIS se administre conjuntamente con medicamentos que sean inhibidores combinados de la glicoproteína P (P-gp) y CYP3A4 fuertes (p. ej., ketoconazol, itraconazol, ritonavir) [consulte Farmacología clínica (12.3)].
En pacientes que ya están tomando 2.5 mg dos veces al día, evite la administración conjunta de ELIQUIS con inhibidores combinados de la P-gp y CYP3A4 fuertes [consulte Interacciones medicamentosas (7.1)].
2.6 Opciones de administración
En pacientes que no pueden tragar los comprimidos enteros, los comprimidos de ELIQUIS de 5 mg y 2.5 mg pueden triturarse y suspenderse en agua, dextrosa al 5% en agua (D5W) o zumo de manzana, o mezclarse con puré de manzana y administrarse inmediatamente por vía oral [consulte Farmacología clínica (12.3)]. Alternativamente, los comprimidos de ELIQUIS pueden triturarse y suspenderse en 60 ml de agua o D5W y administrarse inmediatamente a través de una sonda nasogástrica [consulte Farmacología clínica (12.3)].
Los comprimidos de ELIQUIS triturados son estables en agua, D5W, zumo de manzana y puré de manzana hasta 4 horas.
3 FORMAS FARMACÉUTICAS Y CONCENTRACIONES
- •
- 2.5 mg, tabletas recubiertas con película de color amarillo, redondas, biconvexas, con “893” grabado en un lado y “2½” en el otro.
- •
- 5 mg, tabletas recubiertas con película de color rosa, ovaladas, biconvexas, con “894” grabado en un lado y “5” en el otro.
4 CONTRAINDICACIONES
ELIQUIS está contraindicado en pacientes con las siguientes condiciones:
- •
- Hemorragia patológica activa [ver Advertencias y precauciones (5.2) y Reacciones adversas (6.1)]
- •
- Reacción de hipersensibilidad grave a ELIQUIS (por ejemplo, reacciones anafilácticas) [ver Reacciones adversas (6.1)]
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Aumento del riesgo de eventos trombóticos después de la interrupción prematura
La interrupción prematura de cualquier anticoagulante oral, incluido ELIQUIS, en ausencia de una anticoagulación alternativa adecuada aumenta el riesgo de eventos trombóticos. Se observó una mayor tasa de accidente cerebrovascular durante la transición de ELIQUIS a warfarina en ensayos clínicos en pacientes con fibrilación auricular. Si se interrumpe el tratamiento con ELIQUIS por una razón distinta a la hemorragia patológica o la finalización de un ciclo de tratamiento, considere la posibilidad de administrar otro anticoagulante [ver Dosificación y administración (2.4) y Estudios clínicos (14.1)].
5.2 Hemorragia
ELIQUIS aumenta el riesgo de hemorragia y puede causar hemorragias graves, potencialmente mortales [ver Dosificación y administración (2.1) y Reacciones adversas (6.1)].
El uso concomitante de fármacos que afectan a la hemostasia aumenta el riesgo de hemorragia. Entre ellos se encuentran la aspirina y otros antiagregantes plaquetarios, otros anticoagulantes, la heparina, los agentes trombolíticos, los inhibidores selectivos de la recaptación de serotonina, los inhibidores de la recaptación de serotonina y noradrenalina y los fármacos antiinflamatorios no esteroideos (AINE) [ver Interacciones farmacológicas (7.3)].
Informe a los pacientes sobre los signos y síntomas de la pérdida de sangre y dígales que los notifiquen inmediatamente o que acudan a una sala de emergencias. Interrumpa el tratamiento con ELIQUIS en pacientes con hemorragia patológica activa.
Reversión del efecto anticoagulante
Se dispone de un agente para revertir la actividad antifactor Xa de apixaban. Se puede esperar que el efecto farmacodinámico de ELIQUIS persista durante al menos 24 horas después de la última dosis, es decir, durante aproximadamente dos vidas medias del fármaco. Se puede considerar el uso de concentrado de complejo de protrombina (CCP), concentrado de complejo de protrombina activado o factor VIIa recombinante, pero no se han evaluado en estudios clínicos [ver Farmacología clínica (12.2)]. Cuando se utilizan CCP, la monitorización del efecto anticoagulante de apixaban mediante una prueba de coagulación (TP, INR o TTP) o la actividad antifactor Xa (FXa) no es útil y no se recomienda. El carbón activado oral reduce la absorción de apixaban, lo que reduce la concentración plasmática de apixaban [ver Sobredosis (10)].
La hemodiálisis no parece tener un impacto sustancial en la exposición a apixaban [ver Farmacología clínica (12.3)]. No se espera que el sulfato de protamina y la vitamina K afecten a la actividad anticoagulante de apixaban. No se tiene experiencia con agentes antifibrinolíticos (ácido tranexámico, ácido aminocaproico) en individuos que reciben apixaban. No se tiene experiencia con hemostáticos sistémicos (desmopresina) en individuos que reciben ELIQUIS, y no se espera que sean eficaces como agentes de reversión.
5.3 Anestesia o punción espinal/epidural
Cuando se emplea anestesia neuraxial (anestesia espinal/epidural) o punción espinal/epidural, los pacientes tratados con agentes antitrombóticos para la prevención de complicaciones tromboembólicas corren el riesgo de desarrollar un hematoma epidural o espinal que puede dar lugar a una parálisis prolongada o permanente.
El riesgo de estos eventos puede verse incrementado por el uso postoperatorio de catéteres epidurales permanentes o por el uso concomitante de medicamentos que afectan a la hemostasia. Los catéteres epidurales o intratecales permanentes no deben retirarse antes de que hayan transcurrido 24 horas desde la última administración de ELIQUIS. La siguiente dosis de ELIQUIS no debe administrarse antes de que hayan transcurrido 5 horas desde la retirada del catéter. El riesgo también puede verse incrementado por una punción epidural o espinal traumática o repetida. Si se produce una punción traumática, retrase la administración de ELIQUIS durante 48 horas.
Controle a los pacientes con frecuencia para detectar signos y síntomas de deterioro neurológico (por ejemplo, entumecimiento o debilidad de las piernas, o disfunción intestinal o vesical). Si se observa compromiso neurológico, es necesario un diagnóstico y tratamiento urgentes. Antes de la intervención neuraxial, el médico debe considerar el posible beneficio frente al riesgo en pacientes anticoagulados o en pacientes que van a ser anticoagulados para la tromboprofilaxis.
5.4 Pacientes con prótesis valvulares cardíacas
No se ha estudiado la seguridad y eficacia de ELIQUIS en pacientes con prótesis valvulares cardíacas. Por lo tanto, no se recomienda el uso de ELIQUIS en estos pacientes.
5.5 EP aguda en pacientes hemodinámicamente inestables o pacientes que requieren trombólisis o embolectomía pulmonar
No se recomienda el inicio del tratamiento con ELIQUIS como alternativa a la heparina no fraccionada para el tratamiento inicial de pacientes con EP que se presentan con inestabilidad hemodinámica o que pueden recibir trombólisis o embolectomía pulmonar.
5.6 Mayor riesgo de trombosis en pacientes con síndrome antifosfolípido triple positivo
Los anticoagulantes orales de acción directa (DOAC), incluido ELIQUIS, no se recomiendan para su uso en pacientes con síndrome antifosfolípido (SAF) triple positivo. En los pacientes con SAF (especialmente en aquellos que son triple positivo [positivo para anticoagulante lúpico, anticardiolipina y anticuerpos anti-beta 2-glicoproteína I]), el tratamiento con DOAC se ha asociado a mayores tasas de eventos trombóticos recurrentes en comparación con el tratamiento con antagonistas de la vitamina K.
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas clínicamente significativas se analizan con mayor detalle en otras secciones de la información de prescripción.
- •
- Aumento del riesgo de eventos trombóticos después de la interrupción prematura [ver Advertencias y precauciones (5.1)]
- •
- Hemorragia [ver Advertencias y precauciones (5.2)]
- •
- Anestesia o punción espinal/epidural [ver Advertencias y precauciones (5.3)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica.
Reducción del riesgo de accidente cerebrovascular y embolia sistémica en pacientes con fibrilación auricular no valvular
La seguridad de ELIQUIS se evaluó en los estudios ARISTOTLE y AVERROES [ver Estudios clínicos (14)], incluidos 11.284 pacientes expuestos a ELIQUIS 5 mg dos veces al día y 602 pacientes expuestos a ELIQUIS 2,5 mg dos veces al día. La duración de la exposición a ELIQUIS fue ≥12 meses para 9375 pacientes y ≥24 meses para 3369 pacientes en los dos estudios. En ARISTOTLE, la duración media de la exposición fue de 89 semanas (>15.000 años-paciente). En AVERROES, la duración media de la exposición fue de aproximadamente 59 semanas (>3000 años-paciente).
La razón más común para la interrupción del tratamiento en ambos estudios fue por reacciones adversas relacionadas con la hemorragia; en ARISTOTLE esto ocurrió en el 1,7% y el 2,5% de los pacientes tratados con ELIQUIS y warfarina, respectivamente, y en AVERROES, en el 1,5% y el 1,3% en ELIQUIS y aspirina, respectivamente.
Hemorragia en pacientes con fibrilación auricular no valvular en ARISTOTLE y AVERROES
Las tablas 1 y 2 muestran el número de pacientes que experimentaron hemorragia mayor durante el período de tratamiento y la tasa de hemorragia (porcentaje de sujetos con al menos un evento de hemorragia por cada 100 años-paciente) en ARISTOTLE y AVERROES.
| ELIQUIS N=9088 n (por cada 100 años-paciente) |
Warfarina N=9052 n (por cada 100 años-paciente) |
Hazard Ratio (IC del 95%) |
Valor p | |
|---|---|---|---|---|
|
Mayor† |
327 (2,13) |
462 (3,09) |
0,69 (0,60, 0,80) |
<0,0001 |
|
Intracraneal (ICH)‡ |
52 (0,33) |
125 (0,82) |
0,41 (0,30, 0,57) |
– |
|
Accidente cerebrovascular hemorrágico§ |
38 (0,24) |
74 (0,49) |
0,51 (0,34, 0,75) |
– |
|
Otro ICH |
15 (0,10) |
51 (0,34) |
0,29 (0,16, 0,51) |
– |
|
Gastrointestinal (GI)¶ |
128 (0,83) |
141 (0,93) |
0,89 (0,70, 1,14) |
– |
|
Fatal** |
10 (0,06) |
37 (0,24) |
0,27 (0,13, 0,53) |
– |
|
Intracraneal |
4 (0,03) |
30 (0,20) |
0,13 (0,05, 0,37) |
– |
|
No intracraneal |
6 (0,04) |
7 (0,05) |
0,84 (0,28, 2,15) |
– |
- * Los eventos de sangrado dentro de cada subcategoría se contaron una vez por sujeto, pero los sujetos pueden haber contribuido con eventos a múltiples puntos finales. Los eventos de sangrado se contaron durante el tratamiento o dentro de los 2 días de suspender el tratamiento del estudio (período de tratamiento).
† Definido como sangrado clínicamente evidente acompañado de uno o más de los siguientes: una disminución en la hemoglobina de ≥2 g/dL, una transfusión de 2 o más unidades de glóbulos rojos empaquetados, sangrado en un sitio crítico: intracraneal, intraespinal, intraocular, pericárdico, intraarticular, intramuscular con síndrome compartimental, retroperitoneal o con desenlace fatal.
‡ El sangrado intracraneal incluye sangrado intracerebral, intraventricular, subdural y subaracnoideo. Cualquier tipo de accidente cerebrovascular hemorrágico se adjudicó y se contó como un sangrado mayor intracraneal.
§ Análisis de tratamiento basado en la población de seguridad, en comparación con el análisis ITT presentado en la Sección 14.
¶ El sangrado GI incluye sangrado GI superior, GI inferior y rectal.
** El sangrado fatal es una muerte adjudicada con la causa principal de muerte como sangrado intracraneal o sangrado no intracraneal durante el período de tratamiento.
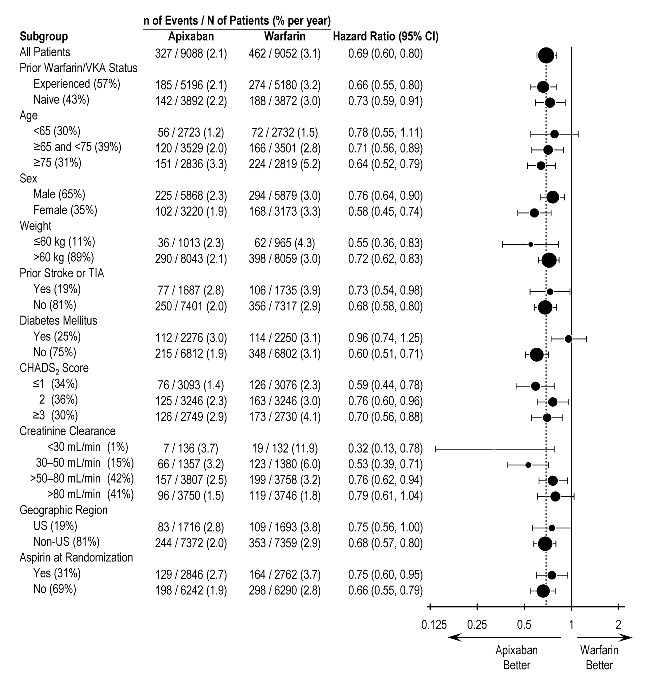
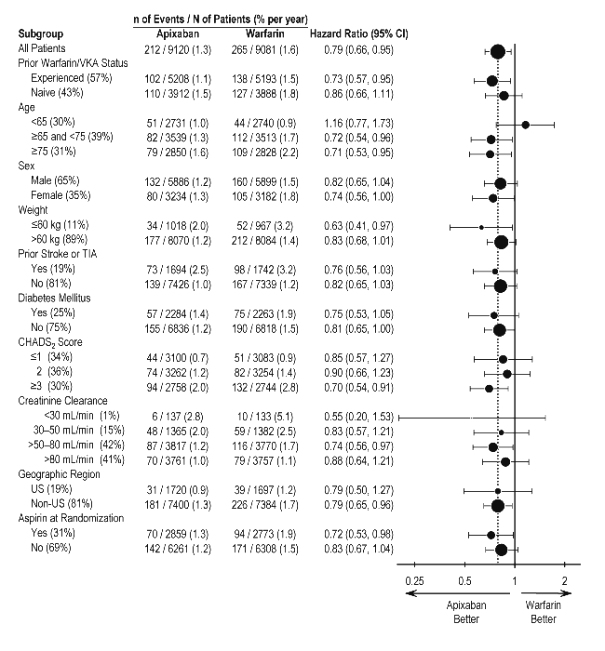
En ARISTOTLE, los resultados para el sangrado mayor fueron generalmente consistentes en la mayoría de los subgrupos principales, incluida la edad, el peso, la puntuación CHADS2 (una escala de 0 a 6 utilizada para estimar el riesgo de accidente cerebrovascular, con puntuaciones más altas que predicen un mayor riesgo), el uso previo de warfarina, la región geográfica y el uso de aspirina en la aleatorización (Figura 1). Los sujetos tratados con ELIQUIS con diabetes sangraron más (3% por año) que los sujetos sin diabetes (1.9% por año).
Figura 1: Razones de riesgo de sangrado mayor por características basales – Estudio ARISTOTLE
Nota: La figura anterior presenta efectos en varios subgrupos, todos los cuales son características basales y todos los cuales fueron preespecificados, si no las agrupaciones. Los límites de confianza del 95% que se muestran no tienen en cuenta cuántas comparaciones se realizaron, ni reflejan el efecto de un factor particular después del ajuste para todos los demás factores. La homogeneidad o heterogeneidad aparente entre los grupos no debe sobreinterpretarse.
| ELIQUIS N=2798 n (%/año) |
Aspirina N=2780 n (%/año) |
Razón de riesgo (IC del 95%) |
Valor p | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Los eventos asociados con cada punto final se contaron una vez por sujeto, pero los sujetos pueden haber contribuido con eventos a múltiples puntos finales. | |||||||||
|
Mayor |
45 (1.41) |
29 (0.92) |
1.54 (0.96, 2.45) |
0.07 |
|||||
|
Fatal |
5 (0.16) |
5 (0.16) |
0.99 (0.23, 4.29) |
– |
|||||
|
Intracraneal |
11 (0.34) |
11 (0.35) |
0.99 (0.39, 2.51) |
– |
|||||
Profilaxis de la trombosis venosa profunda después de la cirugía de reemplazo de cadera o rodilla
La seguridad de ELIQUIS se ha evaluado en 1 estudio de Fase II y 3 estudios de Fase III que incluyeron 5924 pacientes expuestos a ELIQUIS 2.5 mg dos veces al día que se sometieron a cirugía ortopédica mayor de las extremidades inferiores (reemplazo de cadera electivo o reemplazo de rodilla electivo) tratados durante un máximo de 38 días.
En total, el 11% de los pacientes tratados con ELIQUIS 2.5 mg dos veces al día experimentaron reacciones adversas.
Los resultados de sangrado durante el período de tratamiento en los estudios de Fase III se muestran en la Tabla 3. El sangrado se evaluó en cada estudio comenzando con la primera dosis del fármaco de estudio doble ciego.
| Punto final de sangrado* | ADVANCE-3 Cirugía de reemplazo de cadera |
ADVANCE-2 Cirugía de reemplazo de rodilla |
ADVANCE-1 Cirugía de reemplazo de rodilla |
|||
|---|---|---|---|---|---|---|
| * Todos los criterios de sangrado incluyeron sangrado en el sitio quirúrgico. † Incluye 13 sujetos con eventos de sangrado mayor que ocurrieron antes de la primera dosis de ELIQUIS (administrada de 12 a 24 horas después de la cirugía). ‡ Incluye 5 sujetos con eventos de sangrado mayor que ocurrieron antes de la primera dosis de ELIQUIS (administrada de 12 a 24 horas después de la cirugía). § Intracraneal, intraespinal, intraocular, pericárdico, una articulación operada que requiere reoperación o intervención, intramuscular con síndrome compartimental o retroperitoneal. El sangrado en una articulación operada que requiere reoperación o intervención estuvo presente en todos los pacientes con esta categoría de sangrado. Los eventos y las tasas de eventos incluyen un paciente tratado con enoxaparina en ADVANCE-1 que también tuvo hemorragia intracraneal. ¶ CRNM = clínicamente relevante no mayor. |
||||||
|
ELIQUIS |
Enoxaparina |
ELIQUIS |
Enoxaparina |
ELIQUIS |
Enoxaparina |
|
|
Primera dosis |
Primera dosis |
Primera dosis |
Primera dosis |
Primera dosis |
Primera dosis |
|
|
Todos tratados |
N=2673 |
N=2659 |
N=1501 |
N=1508 |
N=1596 |
N=1588 |
|
Mayor (incluido el sitio quirúrgico) |
22 (0.82%)† |
18 (0.68%) |
9 (0.60%)‡ |
14 (0.93%) |
11 (0.69%) |
22 (1.39%) |
|
Fatal |
0 |
0 |
0 |
0 |
0 |
1 (0.06%) |
|
Disminución de Hgb ≥2 g/dL |
13 (0.49%) |
10 (0.38%) |
8 (0.53%) |
9 (0.60%) |
10 (0.63%) |
16 (1.01%) |
|
Transfusión de ≥2 unidades de GR |
16 (0.60%) |
14 (0.53%) |
5 (0.33%) |
9 (0.60%) |
9 (0.56%) |
18 (1.13%) |
|
Hemorragia en el sitio crítico§ |
1 (0.04%) |
1 (0.04%) |
1 (0.07%) |
2 (0.13%) |
1 (0.06%) |
4 (0.25%) |
|
Mayor |
129 (4.83%) |
134 (5.04%) |
53 (3.53%) |
72 (4.77%) |
46 (2.88%) |
68 (4.28%) |
|
Todas |
313 (11.71%) |
334 (12.56%) |
104 (6.93%) |
126 (8.36%) |
85 (5.33%) |
108 (6.80%) |
Las reacciones adversas que ocurren en ≥1% de los pacientes que se someten a cirugía de reemplazo de cadera o rodilla en el estudio de Fase II y los 3 estudios de Fase III se enumeran en la Tabla 4.
| ELIQUIS, n (%) 2.5 mg po bid N=5924 |
Enoxaparina, n (%) 40 mg sc qd o 30 mg sc q12h N=5904 |
|
|---|---|---|
|
Náuseas |
153 (2.6) |
159 (2.7) |
|
Anemia (incluida la anemia postoperatoria y hemorrágica, y los parámetros de laboratorio respectivos) |
153 (2.6) |
178 (3.0) |
|
Contusión |
83 (1.4) |
115 (1.9) |
|
Hemorragia (incluidos hematoma y hemorragia vaginal y uretral) |
67 (1.1) |
81 (1.4) |
|
Hemorragia postprocedimiento (incluidos hematoma postprocedimiento, hemorragia de la herida, hematoma en el sitio de punción vascular y hemorragia en el sitio del catéter) |
54 (0.9) |
60 (1.0) |
|
Transaminasas elevadas (incluida la alanina aminotransferasa elevada y la alanina aminotransferasa anormal) |
50 (0.8) |
71 (1.2) |
|
Aspartato aminotransferasa elevada |
47 (0.8) |
69 (1.2) |
|
Gamma-glutamiltransferasa elevada |
38 (0.6) |
65 (1.1) |
Reacciones adversas menos frecuentes en pacientes tratados con ELIQUIS que se sometieron a cirugía de reemplazo de cadera o rodilla que ocurrieron con una frecuencia de ≥0.1% a <1%:
Trastornos de la sangre y del sistema linfático: trombocitopenia (incluidas las disminuciones del recuento plaquetario)
Trastornos vasculares: hipotensión (incluida la hipotensión procedimental)
Trastornos respiratorios, torácicos y mediastínicos: epistaxis
Trastornos gastrointestinales: hemorragia gastrointestinal (incluidas la hematemesis y la melena), hematochezia
Trastornos hepatobiliares: prueba de función hepática anormal, fosfatasa alcalina en sangre aumentada, bilirrubina en sangre aumentada
Trastornos renales y urinarios: hematuria (incluidos los parámetros de laboratorio respectivos)
Lesiones, envenenamiento y complicaciones de procedimientos: secreción de la herida, hemorragia en el sitio de la incisión (incluido el hematoma en el sitio de la incisión), hemorragia operatoria
Reacciones adversas menos frecuentes en pacientes tratados con ELIQUIS que se sometieron a cirugía de reemplazo de cadera o rodilla que ocurrieron con una frecuencia de <0.1%:
Sangrado gingival, hemoptisis, hipersensibilidad, hemorragia muscular, hemorragia ocular (incluida la hemorragia conjuntival), hemorragia rectal
Tratamiento de la TVP y la EP y reducción del riesgo de recurrencia de la TVP o la EP
La seguridad de ELIQUIS se ha evaluado en los estudios AMPLIFY y AMPLIFY-EXT, incluidos 2676 pacientes expuestos a ELIQUIS 10 mg dos veces al día, 3359 pacientes expuestos a ELIQUIS 5 mg dos veces al día y 840 pacientes expuestos a ELIQUIS 2.5 mg dos veces al día.
Las reacciones adversas comunes (≥1%) fueron sangrado gingival, epistaxis, contusión, hematuria, hemorragia rectal, hematoma, menorragia y hemoptisis.
Estudio AMPLIFY
La duración media de la exposición a ELIQUIS fue de 154 días y a enoxaparina/warfarina fue de 152 días en el estudio AMPLIFY. Las reacciones adversas relacionadas con el sangrado ocurrieron en 417 (15.6%) pacientes tratados con ELIQUIS en comparación con 661 (24.6%) pacientes tratados con enoxaparina/warfarina. La tasa de interrupción debido a eventos de sangrado fue del 0.7% en los pacientes tratados con ELIQUIS en comparación con el 1.7% en los pacientes tratados con enoxaparina/warfarina en el estudio AMPLIFY.
En el estudio AMPLIFY, ELIQUIS fue estadísticamente superior a la enoxaparina/warfarina en el criterio de valoración de seguridad principal de sangrado mayor (riesgo relativo 0.31, IC del 95% [0.17, 0.55], valor de p <0.0001).
Los resultados del sangrado del estudio AMPLIFY se resumen en la Tabla 5.
| ELIQUIS N=2676 n (%) |
Enoxaparina/Warfarina N=2689 n (%) |
Riesgo relativo (IC del 95%) | |
|---|---|---|---|
| * CRNM = sangrado no mayor clínicamente relevante. Los eventos asociados con cada criterio de valoración se contaron una vez por sujeto, pero los sujetos pueden haber contribuido con eventos a múltiples criterios de valoración. |
|||
|
Mayor |
15 (0.6) |
49 (1.8) |
0.31 (0.17, 0.55) |
|
CRNM* |
103 (3.9) |
215 (8.0) |
|
|
Mayor + CRNM |
115 (4.3) |
261 (9.7) |
|
|
Menor |
313 (11.7) |
505 (18.8) |
|
|
Todos |
402 (15.0) |
676 (25.1) |
|
Las reacciones adversas que ocurren en ≥1% de los pacientes en el estudio AMPLIFY se enumeran en la Tabla 6.
| ELIQUIS N=2676 n (%) |
Enoxaparina/Warfarina N=2689 n (%) |
|
|---|---|---|
|
Epistaxis |
77 (2.9) |
146 (5.4) |
|
Contusión |
49 (1.8) |
97 (3.6) |
|
Hematuria |
46 (1.7) |
102 (3.8) |
|
Menorragia |
38 (1.4) |
30 (1.1) |
|
Hematoma |
35 (1.3) |
76 (2.8) |
|
Hemoptisis |
32 (1.2) |
31 (1.2) |
|
Hemorragia rectal |
26 (1.0) |
39 (1.5) |
|
Hemorragia gingival |
26 (1.0) |
50 (1.9) |
Estudio AMPLIFY-EXT
La duración media de la exposición a ELIQUIS fue de aproximadamente 330 días y al placebo de 312 días en el estudio AMPLIFY-EXT. Las reacciones adversas relacionadas con la hemorragia ocurrieron en 219 (13.3%) pacientes tratados con ELIQUIS en comparación con 72 (8.7%) pacientes tratados con placebo. La tasa de interrupción debido a eventos hemorrágicos fue de aproximadamente 1% en los pacientes tratados con ELIQUIS en comparación con 0.4% en aquellos pacientes en el grupo placebo en el estudio AMPLIFY-EXT.
Los resultados de la hemorragia del estudio AMPLIFY-EXT se resumen en la Tabla 7.
| ELIQUIS 2.5 mg bid N=840 n (%) |
ELIQUIS 5 mg bid N=811 n (%) |
Placebo N=826 n (%) |
|
|---|---|---|---|
| * CRNM = hemorragia no mayor clínicamente relevante. Los eventos asociados con cada punto final se contaron una vez por sujeto, pero los sujetos pueden haber contribuido con eventos a múltiples puntos finales. |
|||
|
Mayor |
2 (0.2) |
1 (0.1) |
4 (0.5) |
|
CRNM* |
25 (3.0) |
34 (4.2) |
19 (2.3) |
|
Mayor + CRNM |
27 (3.2) |
35 (4.3) |
22 (2.7) |
|
Menor |
75 (8.9) |
98 (12.1) |
58 (7.0) |
|
Todas |
94 (11.2) |
121 (14.9) |
74 (9.0) |
Las reacciones adversas que ocurrieron en ≥1% de los pacientes en el estudio AMPLIFY-EXT se enumeran en la Tabla 8.
| ELIQUIS 2.5 mg bid N=840 n (%) |
ELIQUIS 5 mg bid N=811 n (%) |
Placebo N=826 n (%) |
|
|---|---|---|---|
|
Epistaxis |
13 (1.5) |
29 (3.6) |
9 (1.1) |
|
Hematuria |
12 (1.4) |
17 (2.1) |
9 (1.1) |
|
Hematoma |
13 (1.5) |
16 (2.0) |
10 (1.2) |
|
Contusión |
18 (2.1) |
18 (2.2) |
18 (2.2) |
|
Hemorragia gingival |
12 (1.4) |
9 (1.1) |
3 (0.4) |
Otras reacciones adversas
Reacciones adversas menos frecuentes en pacientes tratados con ELIQUIS en los estudios AMPLIFY o AMPLIFY-EXT que ocurren con una frecuencia de ≥0.1% a <1%:
Trastornos de la sangre y del sistema linfático: anemia hemorrágica
Trastornos gastrointestinales: hematochezia, hemorragia hemorroidal, hemorragia gastrointestinal, hematemesis, melena, hemorragia anal
Lesiones, envenenamiento y complicaciones de procedimientos: hemorragia de la herida, hemorragia posprocedimiento, hematoma traumático, hematoma periorbitario
Trastornos musculoesqueléticos y del tejido conjuntivo: hemorragia muscular
Trastornos del sistema reproductor y de las mamas: hemorragia vaginal, metrorragia, menometrorragia, hemorragia genital
Trastornos vasculares: hemorragia
Trastornos de la piel y del tejido subcutáneo: equimosis, hemorragia cutánea, petequias
Trastornos oculares: hemorragia conjuntival, hemorragia retiniana, hemorragia ocular
Investigaciones: sangre en orina presente, sangre oculta positiva, sangre oculta, glóbulos rojos en orina positivos
Trastornos generales y condiciones del sitio de administración: hematoma en el sitio de inyección, hematoma en el sitio de punción vascular
7 INTERACCIONES MEDICAMENTOSAS
Apixaban es un sustrato tanto de CYP3A4 como de P-gp. Los inhibidores de CYP3A4 y P-gp aumentan la exposición a apixaban y aumentan el riesgo de sangrado. Los inductores de CYP3A4 y P-gp disminuyen la exposición a apixaban y aumentan el riesgo de accidente cerebrovascular y otros eventos tromboembólicos.
7.1 Inhibidores combinados de P-gp y CYP3A4 fuertes
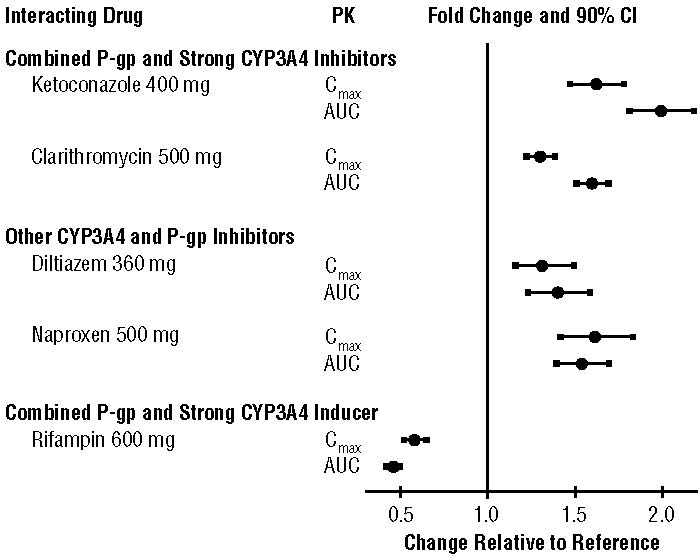
Para los pacientes que reciben ELIQUIS 5 mg o 10 mg dos veces al día, la dosis de ELIQUIS debe reducirse en un 50% cuando se administra conjuntamente con medicamentos que son inhibidores combinados de P-gp y CYP3A4 fuertes (por ejemplo, ketoconazol, itraconazol, ritonavir) [ver Dosificación y administración (2.5) y Farmacología clínica (12.3)].
Para los pacientes que reciben ELIQUIS a una dosis de 2.5 mg dos veces al día, evite la administración conjunta con inhibidores combinados de P-gp y CYP3A4 fuertes [ver Dosificación y administración (2.5) y Farmacología clínica (12.3)].
Claritromicina
Aunque la claritromicina es un inhibidor combinado de P-gp y CYP3A4 fuerte, los datos farmacocinéticos sugieren que no es necesario ningún ajuste de dosis con la administración concomitante con ELIQUIS [ver Farmacología clínica (12.3)].
7.2 Inductores combinados de P-gp y CYP3A4 fuertes
Evite el uso concomitante de ELIQUIS con inductores combinados de P-gp y CYP3A4 fuertes (por ejemplo, rifampicina, carbamazepina, fenitoína, hierba de San Juan) porque estos medicamentos disminuirán la exposición a apixaban [ver Farmacología clínica (12.3)].
7.3 Anticoagulantes y agentes antiplaquetarios
La administración conjunta de agentes antiplaquetarios, fibrinolíticos, heparina, aspirina y el uso crónico de AINE aumenta el riesgo de sangrado.
APPRAISE-2, un ensayo clínico controlado con placebo de ELIQUIS en pacientes de alto riesgo con síndrome coronario agudo tratados con aspirina o la combinación de aspirina y clopidogrel, se terminó antes de tiempo debido a una tasa más alta de sangrado con ELIQUIS en comparación con el placebo. La tasa de sangrado mayor ISTH fue del 2.8% por año con ELIQUIS versus 0.6% por año con placebo en pacientes que recibieron terapia antiplaquetaria única y fue del 5.9% por año con ELIQUIS versus 2.5% por año con placebo en aquellos que recibieron terapia antiplaquetaria dual.
En ARISTOTLE, el uso concomitante de aspirina aumentó el riesgo de sangrado con ELIQUIS del 1.8% por año al 3.4% por año y el uso concomitante de aspirina y warfarina aumentó el riesgo de sangrado del 2.7% por año al 4.6% por año. En este ensayo clínico, hubo un uso limitado (2.3%) de terapia antiplaquetaria dual con ELIQUIS.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgos
Los datos limitados disponibles sobre el uso de ELIQUIS en mujeres embarazadas son insuficientes para informar los riesgos asociados a los medicamentos de defectos de nacimiento importantes, aborto espontáneo o resultados de desarrollo adversos. El tratamiento puede aumentar el riesgo de sangrado durante el embarazo y el parto. En estudios de reproducción en animales, no se observaron efectos adversos en el desarrollo cuando se administró apixaban a ratas (por vía oral), conejos (por vía intravenosa) y ratones (por vía oral) durante la organogénesis a niveles de exposición de apixaban no unido hasta 4, 1 y 19 veces, respectivamente, la exposición humana basada en el área bajo la curva de concentración plasmática-tiempo (AUC) en la Dosis Humana Máxima Recomendada (MRHD) de 5 mg dos veces al día.
El riesgo de fondo estimado de defectos de nacimiento importantes y aborto espontáneo para las poblaciones indicadas es desconocido. Todos los embarazos tienen un riesgo de fondo de defectos de nacimiento, pérdida u otros resultados adversos. En la población general de EE. UU., el riesgo de fondo estimado de defectos de nacimiento importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente.
Consideraciones Clínicas
Riesgo materno y/o embrionario/fetal asociado a la enfermedad
El embarazo confiere un mayor riesgo de tromboembolismo que es mayor para las mujeres con enfermedad tromboembólica subyacente y ciertas condiciones de embarazo de alto riesgo. Los datos publicados describen que las mujeres con antecedentes de trombosis venosa tienen un alto riesgo de recurrencia durante el embarazo.
Reacciones adversas fetales/neonatales
El uso de anticoagulantes, incluido ELIQUIS, puede aumentar el riesgo de sangrado en el feto y el recién nacido.
Trabajo de parto o parto
Todos los pacientes que reciben anticoagulantes, incluidas las mujeres embarazadas, tienen riesgo de sangrado. El uso de ELIQUIS durante el trabajo de parto o el parto en mujeres que reciben anestesia neuroaxial puede provocar hematomas epidurales o espinales. Considere el uso de un anticoagulante de acción más corta a medida que se acerca el parto [ver Advertencias y precauciones (5.3)].
Datos
Datos de animales
No se observaron toxicidades de desarrollo cuando se administró apixaban durante la organogénesis a ratas (por vía oral), conejos (por vía intravenosa) y ratones (por vía oral) a niveles de exposición de apixaban no unido 4, 1 y 19 veces, respectivamente, las exposiciones humanas en la MRHD. No hubo evidencia de sangrado fetal, aunque se confirmó la exposición del concepto en ratas y conejos. La administración oral de apixaban a ratas hembras desde el día 6 de gestación hasta el día 21 de lactancia a exposiciones maternas de apixaban no unido que van desde 1,4 a 5 veces las exposiciones humanas en la MRHD no se asoció con una reducción de la mortalidad materna o una reducción de la viabilidad del concepto/neonatal, aunque se observaron incidencias aumentadas de sangrado perivaginal en las hembras a todas las dosis. No hubo evidencia de sangrado neonatal.
8.2 Lactancia
Resumen de Riesgos
No hay datos sobre la presencia de apixaban o sus metabolitos en la leche materna, los efectos en el niño amamantado o los efectos en la producción de leche. Apixaban y/o sus metabolitos estuvieron presentes en la leche de ratas (ver Datos). Debido a que la exposición humana a través de la leche es desconocida, no se recomienda la lactancia durante el tratamiento con ELIQUIS.
Datos
Datos de animales
Se observaron concentraciones plasmáticas máximas después de 30 minutos después de una sola administración oral de una dosis de 5 mg a ratas lactantes. Se observaron concentraciones máximas en la leche 6 horas después de la dosificación. La relación AUC (0-24) de leche a plasma es 30:1, lo que indica que el apixaban puede acumularse en la leche. Las concentraciones de apixaban en la leche animal no predicen necesariamente la concentración del fármaco en la leche humana.
8.3 Mujeres y hombres en edad fértil
Las mujeres en edad fértil que requieren anticoagulación deben discutir la planificación del embarazo con su médico.
El riesgo de sangrado uterino clínicamente significativo, que puede requerir intervenciones quirúrgicas ginecológicas, identificado con anticoagulantes orales, incluido ELIQUIS, debe evaluarse en mujeres en edad fértil y en aquellas con sangrado uterino anormal.
8.5 Uso geriátrico
De los sujetos totales en los estudios clínicos ARISTOTLE y AVERROES, >69% tenían 65 años de edad o más, y >31% tenían 75 años de edad o más. En los estudios clínicos ADVANCE-1, ADVANCE-2 y ADVANCE-3, el 50% de los sujetos tenían 65 años de edad o más, mientras que el 16% tenían 75 años de edad o más. En los estudios clínicos AMPLIFY y AMPLIFY-EXT, >32% de los sujetos tenían 65 años de edad o más y >13% tenían 75 años de edad o más. No se observaron diferencias clínicamente significativas en seguridad o eficacia al comparar sujetos en diferentes grupos de edad.
8.6 Insuficiencia renal
Reducción del riesgo de accidente cerebrovascular y embolia sistémica en pacientes con fibrilación auricular no valvular
La dosis recomendada es de 2,5 mg dos veces al día en pacientes con al menos dos de las siguientes características [ver Dosificación y administración (2.1)]:
- •
- edad mayor o igual a 80 años
- •
- peso corporal menor o igual a 60 kg
- •
- creatinina sérica mayor o igual a 1,5 mg/dL
Pacientes con enfermedad renal en estadio terminal en diálisis
Los estudios de eficacia clínica y seguridad con ELIQUIS no incluyeron pacientes con enfermedad renal en estadio terminal (ESRD) en diálisis. En pacientes con ESRD mantenidos en hemodiálisis intermitente, la administración de ELIQUIS a la dosis generalmente recomendada [ver Dosificación y administración (2.1)] dará como resultado concentraciones de apixaban y actividad farmacodinámica similar a la observada en el estudio ARISTOTLE [ver Farmacología clínica (12.3)]. No se sabe si estas concentraciones conducirán a una reducción similar del accidente cerebrovascular y un riesgo de sangrado en pacientes con ESRD en diálisis como se observó en ARISTOTLE.
Profilaxis de la trombosis venosa profunda después de la cirugía de reemplazo de cadera o rodilla, y tratamiento de la TVP y la EP y reducción del riesgo de recurrencia de la TVP y la EP
No se recomienda ningún ajuste de dosis para pacientes con insuficiencia renal, incluidos aquellos con ESRD en diálisis [ver Dosificación y administración (2.1)]. Los estudios de eficacia clínica y seguridad con ELIQUIS no incluyeron pacientes con ESRD en diálisis o pacientes con un CrCl <15 mL/min; por lo tanto, las recomendaciones de dosificación se basan en datos farmacocinéticos y farmacodinámicos (actividad anti-FXa) en sujetos con ESRD mantenidos en diálisis [ver Farmacología clínica (12.3)].
8.7 Insuficiencia hepática
No se requiere ajuste de dosis en pacientes con insuficiencia hepática leve (clase A de Child-Pugh).
Debido a que los pacientes con insuficiencia hepática moderada (clase B de Child-Pugh) pueden tener anomalías intrínsecas de la coagulación y hay experiencia clínica limitada con ELIQUIS en estos pacientes, no se pueden proporcionar recomendaciones de dosificación [ver Farmacología clínica (12.2)].
ELIQUIS no se recomienda en pacientes con insuficiencia hepática grave (clase C de Child-Pugh) [ver Farmacología clínica (12.2)].
10 SOBREDOSIS
La sobredosis de ELIQUIS aumenta el riesgo de sangrado [ver Advertencias y precauciones (5.2)].
En ensayos clínicos controlados, la administración oral de apixaban en sujetos sanos a dosis de hasta 50 mg diarios durante 3 a 7 días (25 mg dos veces al día durante 7 días o 50 mg una vez al día durante 3 días) no tuvo efectos adversos clínicamente relevantes.
En sujetos sanos, la administración de carbón activado 2 y 6 horas después de la ingestión de una dosis de 20 mg de apixaban redujo el AUC medio de apixaban en un 50% y un 27%, respectivamente. Por lo tanto, la administración de carbón activado puede ser útil en el manejo de la sobredosis de ELIQUIS o la ingestión accidental. Existe un agente para revertir la actividad antifactor Xa de apixaban.
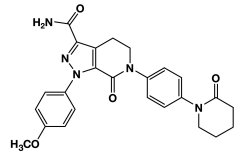
11 DESCRIPCIÓN
ELIQUIS (apixaban), un inhibidor del factor Xa (FXa), se describe químicamente como 1-(4-metoxifenil) -7-oxo-6-[4-(2-oxopiperidin-1-il)fenil]-4,5,6,7-tetrahidro-1H-pirazolo [3,4 – c] piridina-3 -carboxamida. Su fórmula molecular es C25H25N5O4, que corresponde a un peso molecular de 459,5. Apixaban tiene la siguiente fórmula estructural:
Apixaban es un polvo blanco a amarillo pálido. A pH fisiológico (1,2 – 6,8), apixaban no se ioniza; su solubilidad acuosa en el rango de pH fisiológico es de ~ 0,04 mg/mL.
Las tabletas de ELIQUIS están disponibles para administración oral en potencias de 2,5 mg y 5 mg de apixaban con los siguientes excipientes inactivos: lactosa anhidra, celulosa microcristalina, croscarmelosa sódica, laurilsulfato sódico y estearato de magnesio. El recubrimiento de la película contiene lactosa monohidrato, hipromelosa, dióxido de titanio, triacetina y óxido de hierro amarillo (tabletas de 2,5 mg) o óxido de hierro rojo (tabletas de 5 mg).
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Apixaban es un inhibidor selectivo de FXa. No requiere antitrombina III para la actividad antitrombótica. Apixaban inhibe FXa libre y unido a coágulos, y la actividad de la protrombinasa. Apixaban no tiene efecto directo sobre la agregación plaquetaria, pero inhibe indirectamente la agregación plaquetaria inducida por la trombina. Al inhibir FXa, apixaban disminuye la generación de trombina y el desarrollo de trombos.
12.2 Farmacodinamia
Como resultado de la inhibición de FXa, apixaban prolonga las pruebas de coagulación como el tiempo de protrombina (TP), INR y el tiempo de tromboplastina parcial activado (TTPa). Sin embargo, los cambios observados en estas pruebas de coagulación a la dosis terapéutica esperada son pequeños, están sujetos a un alto grado de variabilidad y no son útiles para controlar el efecto anticoagulante de apixaban.
El ensayo cromogénico de heparina Rotachrom® se utilizó para medir el efecto de apixaban sobre la actividad de FXa en humanos durante el programa de desarrollo de apixaban. Se observó un aumento dependiente de la concentración en la actividad anti-FXa en el rango de dosis probado y fue similar en sujetos sanos y pacientes con FA.
Esta prueba no se recomienda para evaluar el efecto anticoagulante de apixaban.
Efecto de los PCC en la farmacodinamia de ELIQUIS
No hay experiencia clínica para revertir el sangrado con el uso de productos PCC de 4 factores en individuos que han recibido ELIQUIS.
Los efectos de los PCC de 4 factores sobre la farmacodinamia de apixaban se estudiaron en sujetos sanos. Después de la administración de apixaban dosificado a estado estacionario, el potencial de trombina endógeno (ETP) volvió a los niveles previos a apixaban 4 horas después del inicio de una infusión de PCC de 30 minutos, en comparación con 45 horas con placebo. Los niveles medios de ETP continuaron aumentando y superaron los niveles previos a apixaban alcanzando un máximo (34%-51% de aumento sobre los niveles previos a apixaban) a las 21 horas después de iniciar el PCC y permanecieron elevados (21%-27% de aumento) al final del estudio (69 horas después de iniciar el PCC). La relevancia clínica de este aumento en ETP es desconocida.
Estudios de interacción farmacodinámica de fármacos
Se realizaron estudios de interacción farmacodinámica de fármacos con aspirina, clopidogrel, aspirina y clopidogrel, prasugrel, enoxaparina y naproxeno. No se observaron interacciones farmacodinámicas con aspirina, clopidogrel o prasugrel [ver Advertencias y precauciones (5.2)]. Se observó un aumento del 50% al 60% en la actividad anti-FXa cuando ELIQUIS se administró conjuntamente con enoxaparina o naproxeno.
Poblaciones específicas
Insuficiencia renal: La actividad anti-FXa ajustada para la exposición a apixaban fue similar en todas las categorías de función renal.
Insuficiencia hepática: Los cambios en la actividad anti-FXa fueron similares en pacientes con insuficiencia hepática leve a moderada y sujetos sanos. Sin embargo, en pacientes con insuficiencia hepática moderada, no hay una comprensión clara del impacto de este grado de insuficiencia de la función hepática en la cascada de coagulación y su relación con la eficacia y el sangrado. No se estudiaron pacientes con insuficiencia hepática grave.
12.3 Farmacocinética
Apixaban demuestra una farmacocinética lineal con aumentos proporcionales a la dosis en la exposición para dosis orales de hasta 10 mg.
Absorción
La biodisponibilidad absoluta de apixaban es aproximadamente del 50% para dosis de hasta 10 mg de ELIQUIS. Los alimentos no afectan la biodisponibilidad de apixaban. Las concentraciones máximas (Cmax) de apixaban aparecen de 3 a 4 horas después de la administración oral de ELIQUIS. A dosis ≥25 mg, apixaban muestra una absorción limitada por disolución con una biodisponibilidad disminuida. Después de la administración oral de 10 mg de apixaban como 2 comprimidos de 5 mg triturados suspendidos en 30 mL de agua, la exposición fue similar a la que se observó después de la administración oral de 2 comprimidos intactos de 5 mg. Después de la administración oral de 10 mg de apixaban como 2 comprimidos de 5 mg triturados mezclados con 30 g de puré de manzana, la Cmax y el AUC fueron un 20% y un 16% más bajos, respectivamente, en comparación con la administración de 2 comprimidos intactos de 5 mg. Después de la administración de un comprimido de ELIQUIS de 5 mg triturado que se suspendió en 60 mL de D5W y se administró a través de una sonda nasogástrica, la exposición fue similar a la observada en otros ensayos clínicos que involucraron voluntarios sanos que recibieron una dosis única oral de 5 mg.
Distribución
La unión a proteínas plasmáticas en humanos es aproximadamente del 87%. El volumen de distribución (Vss) es de aproximadamente 21 litros.
Metabolismo
Aproximadamente el 25% de una dosis de apixaban administrada por vía oral se recupera en orina y heces como metabolitos. Apixaban se metaboliza principalmente a través de CYP3A4 con contribuciones menores de CYP1A2, 2C8, 2C9, 2C19 y 2J2. La O-desmetilación e hidroxilación en la porción 3-oxopiperidinilo son los principales sitios de biotransformación.
Apixaban sin cambios es el principal componente relacionado con el fármaco en el plasma humano; no hay metabolitos circulantes activos.
Eliminación
Apixaban se elimina tanto en orina como en heces. La excreción renal representa aproximadamente el 27% del aclaramiento total. La excreción biliar e intestinal directa contribuye a la eliminación de apixaban en las heces.
Apixaban tiene un aclaramiento total de aproximadamente 3,3 L/hora y una vida media aparente de aproximadamente 12 horas después de la administración oral.
Apixaban es un sustrato de proteínas de transporte: P-gp y proteína de resistencia al cáncer de mama.
Estudios de interacción medicamentosa
En estudios in vitro con apixabán a concentraciones significativamente superiores a las exposiciones terapéuticas, no se observó ningún efecto inhibitorio sobre la actividad de CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2D6, CYP3A4/5 o CYP2C19, ni efecto inductor sobre la actividad de CYP1A2, CYP2B6 o CYP3A4/5. Por lo tanto, no se espera que el apixabán altere la depuración metabólica de fármacos coadministrados que son metabolizados por estas enzimas. El apixabán no es un inhibidor significativo de P-gp.
Los efectos de fármacos coadministrados sobre la farmacocinética del apixabán se resumen en la Figura 2 [ver también Advertencias y Precauciones (5.2) y Interacciones Medicamentosas (7)].
Figura 2: Efecto de los fármacos coadministrados en la farmacocinética del apixabán
En estudios específicos realizados en sujetos sanos, la famotidina, el atenolol, el prasugrel y la enoxaparina no alteraron de manera significativa la farmacocinética del apixabán.
En estudios realizados en sujetos sanos, el apixabán no alteró de manera significativa la farmacocinética de la digoxina, el naproxeno, el atenolol, el prasugrel o el ácido acetilsalicílico.
Poblaciones específicas
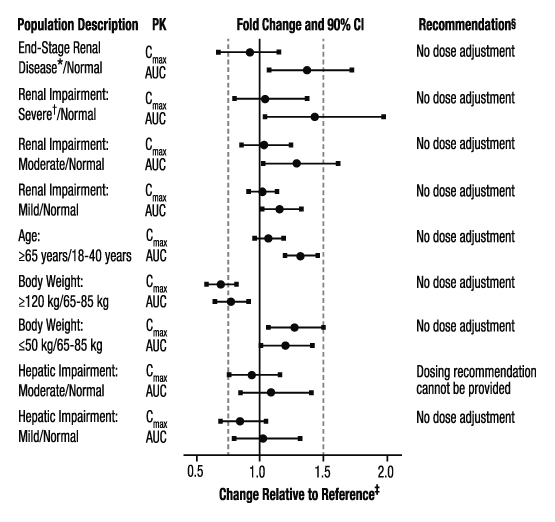
Los efectos del grado de insuficiencia renal, la edad, el peso corporal y el grado de insuficiencia hepática en la farmacocinética del apixabán se resumen en la Figura 3.
Figura 3: Efecto de poblaciones específicas en la farmacocinética del apixabán
* Sujetos con ESRD tratados con hemodiálisis intermitente; los hallazgos de la PK informados son tras una dosis única de apixabán después de la hemodiálisis.
† Los resultados reflejan un CrCl de 15 mL/min basado en el análisis de regresión.
‡ Las líneas verticales discontinuas ilustran los cambios farmacocinéticos que se utilizaron para informar las recomendaciones de dosificación.
§ No se recomienda ningún ajuste de dosis para pacientes con fibrilación auricular no valvular a menos que estén presentes al menos 2 de las siguientes características del paciente (edad mayor o igual a 80 años, peso corporal menor o igual a 60 kg o creatinina sérica mayor o igual a 1,5 mg/dL).
Género: Un estudio en sujetos sanos que comparó la farmacocinética en hombres y mujeres no mostró ninguna diferencia significativa.
Raza: Los resultados en todos los estudios farmacocinéticos en sujetos normales no mostraron diferencias en la farmacocinética del apixabán entre sujetos blancos/blancos caucásicos, asiáticos y negros/afroamericanos. No se requiere ningún ajuste de dosis en función de la raza/etnia.
Hemodiálisis en sujetos con ESRD: La exposición sistémica al apixabán administrado como una dosis única de 5 mg en sujetos con ESRD dosificada inmediatamente después de la finalización de una sesión de hemodiálisis de 4 horas (post-diálisis) es un 36% mayor en comparación con sujetos con función renal normal (Figura 3). La exposición sistémica al apixabán administrado 2 horas antes de una sesión de hemodiálisis de 4 horas con una velocidad de flujo de dializado de 500 mL/min y una velocidad de flujo sanguíneo en el rango de 350 a 500 mL/min es un 17% mayor en comparación con aquellos con función renal normal. La depuración dialítica del apixabán es de aproximadamente 18 mL/min. La exposición sistémica del apixabán es un 14% menor en diálisis en comparación con fuera de diálisis.
La unión proteica fue similar (92%-94%) entre los controles sanos y los sujetos con ESRD durante los períodos de diálisis y fuera de diálisis.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Carcinogénesis: Apixaban no fue carcinogénico cuando se administró a ratones y ratas durante un máximo de 2 años. Las exposiciones sistémicas (AUC) de apixaban no unido en ratones machos y hembras a las dosis más altas probadas (1500 y 3000 mg/kg/día) fueron 9 y 20 veces, respectivamente, la exposición humana de fármaco no unido a la MRHD de 10 mg/día. Las exposiciones sistémicas de apixaban no unido en ratas machos y hembras a la dosis más alta probada (600 mg/kg/día) fueron 2 y 4 veces, respectivamente, la exposición humana.
Mutagénesis: Apixaban no fue ni mutagénico en la prueba de mutación inversa bacteriana (Ames), ni clastogénico en células de ovario de hámster chino in vitro, en un estudio de citogenética in vivo/in vitro de 1 mes en linfocitos de sangre periférica de rata, o en un estudio de micronúcleos de rata in vivo.
Deterioro de la Fertilidad: Apixaban no tuvo ningún efecto sobre la fertilidad en ratas machos o hembras cuando se administró a dosis de hasta 600 mg/kg/día, una dosis que resultó en niveles de exposición a apixaban no unido que son 3 y 4 veces, respectivamente, la exposición humana.
Apixaban administrado a ratas hembras a dosis de hasta 1000 mg/kg/día desde la implantación hasta el final de la lactancia no produjo hallazgos adversos en la descendencia masculina (generación F1) a dosis de hasta 1000 mg/kg/día, una dosis que resultó en una exposición a apixaban no unido que es 5 veces la exposición humana. Los efectos adversos en la descendencia femenina de la generación F1 se limitaron a la disminución de los índices de apareamiento y fertilidad a ≥200 mg/kg/día (una dosis que resultó en una exposición a apixaban no unido que es ≥5 veces la exposición humana).
14 ESTUDIOS CLÍNICOS
14.1 Reducción del riesgo de accidente cerebrovascular y embolia sistémica en fibrilación auricular no valvular
ARISTOTLE
La evidencia de la eficacia y seguridad de ELIQUIS se obtuvo de ARISTOTLE, un estudio multinacional, doble ciego en pacientes con fibrilación auricular no valvular que comparaba los efectos de ELIQUIS y warfarina sobre el riesgo de accidente cerebrovascular y embolia sistémica no central (CNS). En ARISTOTLE, los pacientes fueron asignados aleatoriamente a ELIQUIS 5 mg por vía oral dos veces al día (o 2.5 mg dos veces al día en sujetos con al menos 2 de las siguientes características: edad mayor o igual a 80 años, peso corporal menor o igual a 60 kg, o creatinina sérica mayor o igual a 1.5 mg/dL) o a warfarina (dirigida a un rango de INR de 2.0-3.0). Los pacientes debían tener uno o más de los siguientes factores de riesgo adicionales para el accidente cerebrovascular:
- •
- accidente cerebrovascular o ataque isquémico transitorio (AIT) previo
- •
- embolia sistémica previa
- •
- edad mayor o igual a 75 años
- •
- hipertensión arterial que requiere tratamiento
- •
- diabetes mellitus
- •
- insuficiencia cardíaca ≥Clase 2 de la Asociación Americana del Corazón (New York Heart Association)
- •
- fracción de eyección del ventrículo izquierdo ≤40%
El objetivo principal de ARISTOTLE fue determinar si ELIQUIS 5 mg dos veces al día (o 2.5 mg dos veces al día) era eficaz (no inferior a la warfarina) para reducir el riesgo de accidente cerebrovascular (isquémico o hemorrágico) y embolia sistémica. También se examinó la superioridad de ELIQUIS a la warfarina para el criterio de valoración principal (tasa de accidente cerebrovascular y embolia sistémica), hemorragia mayor y muerte por cualquier causa.
Se asignaron aleatoriamente un total de 18.201 pacientes y se les siguió en el tratamiento del estudio durante una mediana de 89 semanas. El cuarenta y tres por ciento de los pacientes eran “vírgenes” de antagonistas de la vitamina K (VKA), definidos como aquellos que habían recibido ≤30 días consecutivos de tratamiento con warfarina u otro VKA antes de ingresar al estudio. La edad media fue de 69 años y la puntuación media de CHADS2 (una escala de 0 a 6 que se utiliza para estimar el riesgo de accidente cerebrovascular, con puntuaciones más altas que predicen un mayor riesgo) fue de 2.1. La población era 65% masculina, 83% caucásica, 14% asiática y 1% negra. Hubo antecedentes de accidente cerebrovascular, AIT o embolia sistémica no CNS en el 19% de los pacientes. Las enfermedades concomitantes de los pacientes en este estudio incluyeron hipertensión 88%, diabetes 25%, insuficiencia cardíaca congestiva (o fracción de eyección del ventrículo izquierdo ≤40%) 35% e infarto de miocardio previo 14%. Los pacientes tratados con warfarina en ARISTOTLE tuvieron un porcentaje medio de tiempo en el rango terapéutico (INR 2.0-3.0) del 62%.
ELIQUIS fue superior a la warfarina para el criterio de valoración principal de reducción del riesgo de accidente cerebrovascular y embolia sistémica (Tabla 9 y Figura 4). La superioridad a la warfarina se debió principalmente a una reducción del accidente cerebrovascular hemorrágico y los accidentes cerebrovasculares isquémicos con conversión hemorrágica en comparación con la warfarina. Los accidentes cerebrovasculares puramente isquémicos se produjeron con tasas similares en ambos fármacos.
ELIQUIS también mostró significativamente menos hemorragias mayores que la warfarina [ver Reacciones adversas (6.1)].
| ELIQUIS N=9120 n (%/año) |
Warfarina N=9081 n (%/año) |
Razón de riesgos (IC del 95%) |
Valor de p | |
|---|---|---|---|---|
| El criterio de valoración principal se basó en el tiempo hasta el primer evento (uno por sujeto). Los recuentos de componentes son para sujetos con cualquier evento, no necesariamente el primero. | ||||
|
Accidente cerebrovascular o embolia sistémica |
212 (1.27) |
265 (1.60) |
0.79 (0.66, 0.95) |
0.01 |
|
Accidente cerebrovascular |
199 (1.19) |
250 (1.51) |
0.79 (0.65, 0.95) |
|
|
Isquémico sin hemorragia |
140 (0.83) |
136 (0.82) |
1.02 (0.81, 1.29) |
|
|
Isquémico con conversión hemorrágica |
12 (0.07) |
20 (0.12) |
0.60 (0.29, 1.23) |
|
|
Hemorrágico |
40 (0.24) |
78 (0.47) |
0.51 (0.35, 0.75) |
|
|
Desconocido |
14 (0.08) |
21 (0.13) |
0.65 (0.33, 1.29) |
|
|
Embolia sistémica |
15 (0.09) |
17 (0.10) |
0.87 (0.44, 1.75) |
|
Figura 4: Estimación de Kaplan-Meier del tiempo hasta el primer ictus o embolismo sistémico en ARISTOTLE (población con intención de tratar)
La muerte por todas las causas se evaluó mediante una estrategia de pruebas secuenciales que permitió probar la superioridad si se demostraban efectos en puntos finales anteriores (ictus más embolismo sistémico y hemorragia mayor). El tratamiento con ELIQUIS dio lugar a una tasa significativamente más baja de muerte por todas las causas (p = 0,046) que el tratamiento con warfarina, principalmente debido a una reducción en la muerte cardiovascular, particularmente la muerte por ictus. Las tasas de muerte no vascular fueron similares en los brazos de tratamiento.
En ARISTOTLE, los resultados del punto final de eficacia primario fueron generalmente consistentes en la mayoría de los subgrupos principales, incluidos el peso, la puntuación CHADS2 (una escala de 0 a 6 utilizada para predecir el riesgo de ictus en pacientes con FA, con puntuaciones más altas que predicen un mayor riesgo), uso previo de warfarina, nivel de insuficiencia renal, región geográfica y uso de aspirina al azar (Figura 5).
Figura 5: Razones de riesgo de ictus y embolismo sistémico según las características de referencia – Estudio ARISTOTLE
Nota: La figura anterior presenta los efectos en varios subgrupos, todos los cuales son características de referencia y todos los cuales fueron predefinidos, si no las agrupaciones. Los límites de confianza del 95% que se muestran no tienen en cuenta cuántas comparaciones se hicieron, ni reflejan el efecto de un factor particular después del ajuste por todos los demás factores. La aparente homogeneidad o heterogeneidad entre grupos no debe sobreinterpretarse.
Al final del estudio ARISTOTLE, los pacientes tratados con warfarina que completaron el estudio generalmente se mantuvieron en un AVK sin interrupción de la anticoagulación. Los pacientes de ELIQUIS que completaron el estudio generalmente se cambiaron a un AVK con un período de 2 días de administración conjunta de ELIQUIS y AVK, de modo que algunos pacientes pueden no haber estado adecuadamente anticoagulados después de dejar ELIQUIS hasta alcanzar un INR estable y terapéutico. Durante los 30 días posteriores al final del estudio, hubieron 21 eventos de ictus o embolismo sistémico en los 6791 pacientes (0,3%) en el brazo de ELIQUIS en comparación con 5 en los 6569 pacientes (0,1%) en el brazo de warfarina [ver Dosis y administración (2.4)].
AVERROES
En AVERROES, los pacientes con fibrilación auricular no valvular que se consideraron no candidatos para el tratamiento con warfarina se aleatorizaron al tratamiento con ELIQUIS 5 mg por vía oral dos veces al día (o 2,5 mg dos veces al día en pacientes seleccionados) o aspirina 81 a 324 mg una vez al día. El objetivo principal del estudio era determinar si ELIQUIS era superior a la aspirina en la prevención del resultado compuesto de ictus o embolismo sistémico. AVERROES se detuvo prematuramente en base a un análisis intermedio preespecificado que mostraba una reducción significativa de ictus y embolismo sistémico para ELIQUIS en comparación con la aspirina que se asoció con un aumento modesto en hemorragia mayor (Tabla 10) [ver Reacciones adversas (6.1)].
| ELIQUIS N=2807 n (%/año) |
Aspirina N=2791 n (%/año) |
Ratio de riesgo (95% IC) |
Valor de p | |
|---|---|---|---|---|
|
Ictus o embolismo sistémico |
51 (1,62) |
113 (3,63) |
0,45 (0,32, 0,62) |
<0,0001 |
|
Ictus |
||||
|
Isquémico o indeterminado |
43 (1,37) |
97 (3,11) |
0,44 (0,31, 0,63) |
– |
|
Hemorrágico |
6 (0,19) |
9 (0,28) |
0,67 (0,24, 1,88) |
– |
|
Embolismo sistémico |
2 (0,06) |
13 (0,41) |
0,15 (0,03, 0,68) |
– |
|
IM |
24 (0,76) |
28 (0,89) |
0,86 (0,50, 1,48) |
– |
|
Muerte por todas las causas |
111 (3,51) |
140 (4,42) |
0,79 (0,62, 1,02) |
0,068 |
|
Muerte vascular |
84 (2,65) |
96 (3,03) |
0,87 (0,65, 1,17) |
– |
14.2 Profilaxis de la Trombosis Venosa Profunda Después de la Cirugía de Reemplazo de Cadera o Rodilla
La evidencia clínica de la eficacia de ELIQUIS se deriva de los ensayos clínicos ADVANCE-1, ADVANCE-2 y ADVANCE-3 en pacientes adultos que se someten a cirugía electiva de reemplazo de cadera (ADVANCE-3) o rodilla (ADVANCE-2 y ADVANCE-1). Un total de 11.659 pacientes fueron aleatorizados en 3 estudios multinacionales doble ciego. Incluidos en este total estaban 1866 pacientes de 75 años o más, 1161 pacientes con bajo peso corporal (≤60 kg), 2528 pacientes con Índice de Masa Corporal ≥33 kg/m2 y 625 pacientes con insuficiencia renal grave o moderada.
En el estudio ADVANCE-3, 5407 pacientes que se sometieron a cirugía electiva de reemplazo de cadera fueron aleatorizados para recibir ELIQUIS 2,5 mg por vía oral dos veces al día o enoxaparina 40 mg por vía subcutánea una vez al día. La primera dosis de ELIQUIS se administró de 12 a 24 horas después de la cirugía, mientras que la enoxaparina se inició de 9 a 15 horas antes de la cirugía. La duración del tratamiento fue de 32 a 38 días.
En pacientes que se sometieron a cirugía electiva de reemplazo de rodilla, ELIQUIS 2,5 mg por vía oral dos veces al día se comparó con enoxaparina 40 mg por vía subcutánea una vez al día (ADVANCE-2, N=3057) o enoxaparina 30 mg por vía subcutánea cada 12 horas (ADVANCE-1, N=3195). En el estudio ADVANCE-2, la primera dosis de ELIQUIS se administró de 12 a 24 horas después de la cirugía, mientras que la enoxaparina se inició de 9 a 15 horas antes de la cirugía. En el estudio ADVANCE-1, tanto ELIQUIS como la enoxaparina se iniciaron de 12 a 24 horas después de la cirugía. La duración del tratamiento en ambos ADVANCE-2 y ADVANCE-1 fue de 10 a 14 días.
En los 3 estudios, el criterio de valoración principal fue un compuesto de TVP asintomática y sintomática adjudicada, EP no fatal y muerte por cualquier causa al final del período de tratamiento intencionado doble ciego. En ADVANCE-3 y ADVANCE-2, el criterio de valoración principal se probó para la no inferioridad, luego la superioridad, de ELIQUIS a la enoxaparina. En ADVANCE-1, el criterio de valoración principal se probó para la no inferioridad de ELIQUIS a la enoxaparina.
Los datos de eficacia se proporcionan en las Tablas 11 y 12.
| * Los eventos asociados con cada criterio de valoración se contaron una vez por sujeto, pero los sujetos pueden haber contribuido con eventos a múltiples criterios de valoración. † La TVP total incluye TVP sintomática y asintomática y EP. ‡ Incluye TVP sintomática y asintomática. |
|||
|
ADVANCE-3 |
|||
|
Eventos durante el período de tratamiento de 35 días |
ELIQUIS |
Enoxaparina |
Riesgo relativo |
|
Número de pacientes |
N=1949 |
N=1917 |
|
|
TVP total†/Muerte por cualquier causa |
27 (1,39%) |
74 (3,86%) |
0,36 |
|
Número de pacientes |
N=2708 |
N=2699 |
|
|
Muerte por cualquier causa |
3 (0,11%) |
1 (0,04%) |
|
|
EP |
3 (0,11%) |
5 (0,19%) |
|
|
TVP sintomática |
1 (0,04%) |
5 (0,19%) |
|
|
Número de pacientes |
N=2196 |
N=2190 |
|
|
TVP proximal‡ |
7 (0,32%) |
20 (0,91%) |
|
|
Número de Pacientes |
N=1951 |
N=1908 |
|
|
Trombosis venosa profunda distal‡ |
20 (1.03%) |
57 (2.99%) |
|
| ADVANCE-1 | ADVANCE-2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| * Los eventos asociados con cada punto final se contaron una vez por sujeto, pero los sujetos pueden haber contribuido con eventos a múltiples puntos finales. † El TVE total incluye DVT y EP sintomática y asintomática. ‡ Incluye DVT sintomática y asintomática. |
||||||||||
|
Eventos durante |
ELIQUIS |
Enoxaparina |
Riesgo relativo |
ELIQUIS |
Enoxaparina qd |
Riesgo relativo Valor p |
||||
|
Número de pacientes |
N=1157 |
N=1130 |
N=976 |
N=997 |
||||||
|
TVE total†/Muerte por cualquier causa |
104 (8.99%) |
100 (8.85%) |
1.02 |
147 (15.06%) |
243 (24.37%) |
0.62 |
||||
|
Número de pacientes |
N=1599 |
N=1596 |
N=1528 |
N=1529 |
||||||
|
Muerte por cualquier causa |
3 (0.19%) |
3 (0.19%) |
2 (0.13%) |
0 (0%) |
||||||
|
EP |
16 (1.0%) |
7 (0.44%) |
4 (0.26%) |
0 (0%) |
||||||
|
DVT sintomática |
3 (0.19%) |
7 (0.44%) |
3 (0.20%) |
7 (0.46%) |
||||||
|
Número de pacientes |
N=1254 |
N=1207 |
N=1192 |
N=1199 |
||||||
Trombosis venosa profunda proximal‡
9 (0.72%)
(0.36, 1.39)
11 (0.91%)
(0.49, 1.65)
9 (0.76%)
(0.38, 1.46)
26 (2.17%)
(1.47, 3.18)
Número de Pacientes
N=1146
N=1133
N=978
N=1000
Trombosis venosa profunda distal‡
83 (7.24%)
(5.88, 8.91)
91 (8.03%)
(6.58, 9.78)
142 (14.52%)
(12.45, 16.88)
239 (23.9%)
(21.36, 26.65)
El perfil de eficacia de ELIQUIS fue generalmente consistente en todos los subgrupos de interés para esta indicación (por ejemplo, edad, sexo, raza, peso corporal, insuficiencia renal).
14.3 Tratamiento de la TVP y la EP y reducción del riesgo de recurrencia de la TVP y la EP
La eficacia y seguridad de ELIQUIS para el tratamiento de la TVP y la EP, y para la reducción del riesgo de recurrencia de la TVP y la EP tras 6 a 12 meses de tratamiento anticoagulante se derivó de los estudios AMPLIFY y AMPLIFY-EXT. Ambos estudios fueron ensayos aleatorizados, de grupos paralelos, doble ciego en pacientes con TVP proximal sintomática y/o EP sintomática. Todos los criterios de valoración de seguridad y eficacia clave fueron adjudicados de forma ciega por un comité independiente.
AMPLIFY
El objetivo principal de AMPLIFY fue determinar si ELIQUIS era no inferior a la enoxaparina/warfarina para la incidencia de TVE (tromboembolismo venoso) recurrente o muerte relacionada con la TVE. Los pacientes con una TVP sintomática confirmada objetivamente y/o EP fueron aleatorizados para recibir tratamiento con ELIQUIS 10 mg dos veces al día por vía oral durante 7 días seguido de ELIQUIS 5 mg dos veces al día por vía oral durante 6 meses, o enoxaparina 1 mg/kg dos veces al día por vía subcutánea durante al menos 5 días (hasta que el INR ≥2) seguido de warfarina (rango objetivo de INR 2.0-3.0) por vía oral durante 6 meses. Los pacientes que requirieron trombectomía, inserción de un filtro de la cava o uso de un agente fibrinolítico, y los pacientes con aclaramiento de creatinina <25 mL/min, enfermedad hepática significativa, una válvula cardíaca existente o fibrilación auricular, o sangrado activo fueron excluidos del estudio AMPLIFY. Los pacientes pudieron ingresar al estudio con o sin anticoagulación parenteral previa (hasta 48 horas).
Un total de 5244 pacientes fueron evaluables para la eficacia y fueron seguidos durante una media de 154 días en el grupo de ELIQUIS y 152 días en el grupo de enoxaparina/warfarina. La edad media fue de 57 años. La población del estudio AMPLIFY fue 59% masculina, 83% caucásica, 8% asiática y 4% negra. Para los pacientes aleatorizados a warfarina, el porcentaje medio de tiempo en el rango terapéutico (INR 2.0-3.0) fue del 60.9%.
Aproximadamente el 90% de los pacientes inscritos en AMPLIFY tenían una TVP o EP no provocada en el momento basal. El 10% restante de los pacientes con una TVP o EP provocada debían tener un factor de riesgo adicional en curso para ser aleatorizados, que incluía un episodio previo de TVP o EP, inmovilización, antecedentes de cáncer, cáncer activo y genotipo pro-trombótico conocido.
Se demostró que ELIQUIS era no inferior a la enoxaparina/warfarina en el estudio AMPLIFY para el criterio de valoración principal de TVE sintomática recurrente (TVP no mortal o EP no mortal) o muerte relacionada con la TVE durante 6 meses de terapia (Tabla 13).
| ELIQUIS N=2609 n |
Enoxaparina/Warfarina N=2635 n |
Riesgo relativo (IC del 95%) |
|
|---|---|---|---|
| * No inferior en comparación con la enoxaparina/warfarina (valor de p <0.0001). † Los eventos asociados con cada criterio de valoración se contabilizaron una vez por sujeto, pero los sujetos pueden haber contribuido con eventos a múltiples criterios de valoración. |
|||
|
TVE o muerte relacionada con la TVE* |
59 (2.3%) |
71 (2.7%) |
0.84 (0.60, 1.18) |
|
TVP† |
22 (0.8%) |
35 (1.3%) |
|
|
EP† |
27 (1.0%) |
25 (0.9%) |
|
|
Muerte relacionada con la TVE† |
12 (0.4%) |
16 (0.6%) |
|
|
TVE o muerte por cualquier causa |
84 (3.2%) |
104 (4.0%) |
0.82 (0.61, 1.08) |
|
TVE o muerte relacionada con CV |
61 (2.3%) |
77 (2.9%) |
0.80 (0.57, 1.11) |
En el estudio AMPLIFY, los pacientes se estratificaron según su evento índice de EP (con o sin TVP) o TVP (sin EP). La eficacia en el tratamiento inicial de la TVE fue consistente entre los dos subgrupos.
AMPLIFY-EXT
Los pacientes que habían sido tratados para TVP y/o EP durante 6 a 12 meses con terapia anticoagulante sin haber tenido un evento recurrente se asignaron aleatoriamente al tratamiento con ELIQUIS 2.5 mg por vía oral dos veces al día, ELIQUIS 5 mg por vía oral dos veces al día o placebo durante 12 meses. Aproximadamente un tercio de los pacientes participaron en el estudio AMPLIFY antes de la inscripción en el estudio AMPLIFY-EXT.
Se asignaron aleatoriamente un total de 2482 pacientes al tratamiento del estudio y se les hizo un seguimiento durante una media de aproximadamente 330 días en el grupo de ELIQUIS y 312 días en el grupo de placebo. La edad media en el estudio AMPLIFY-EXT fue de 57 años. La población del estudio fue 57% masculina, 85% caucásica, 5% asiática y 3% negra.
El estudio AMPLIFY-EXT incluyó pacientes con TVP o EP no provocada en el inicio (aproximadamente el 92%) o pacientes con un evento de inicio provocado y un factor de riesgo adicional para la recurrencia (aproximadamente el 8%). Sin embargo, los pacientes que habían experimentado múltiples episodios de TVP o EP no provocada fueron excluidos del estudio AMPLIFY-EXT. En el estudio AMPLIFY-EXT, ambas dosis de ELIQUIS fueron superiores al placebo en el criterio de valoración principal de TVE recurrente sintomática (TVP no mortal o EP no mortal), o muerte por cualquier causa (Tabla 14).
| Riesgo relativo (IC del 95%) | |||||
|---|---|---|---|---|---|
| ELIQUIS 2.5 mg bid N=840 |
ELIQUIS 5 mg bid N=813 |
Placebo
N=829 |
ELIQUIS 2.5 mg bid vs Placebo |
ELIQUIS 5 mg bid vs Placebo |
|
| * Los pacientes con más de un evento se cuentan en varias filas. | |||||
|
n (%) |
|||||
|
TVE recurrente o muerte por cualquier causa |
32 (3.8) |
34 (4.2) |
96 (11.6) |
0.33 (0.22, 0.48) |
0.36 (0.25, 0.53) |
|
TVP* |
19 (2.3) |
28 (3.4) |
72 (8.7) |
||
|
EP* |
23 (2.7) |
25 (3.1) |
37 (4.5) |
||
|
Muerte por cualquier causa |
22 (2.6) |
25 (3.1) |
33 (4.0) |
||
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANEJO
Cómo se suministra
Las tabletas de ELIQUIS (apixaban) están disponibles como se indica en la tabla a continuación.
| Tableta Fuerza |
Tableta Color/Forma |
Marcas de la tableta | Tamaño del paquete | Código NDC |
|---|---|---|---|---|
|
2.5 mg |
Amarillo, redondo, |
Grabado con “893” en |
Frascos de 60 |
0003-0893-21 |
|
biconvexo |
un lado y “2½” en el otro lado |
Paquete de blíster de dosis unitaria para hospital |
0003-0893-31 |
|
|
5 mg |
Rosa, ovalado, biconvexo |
Grabado con “894” en |
Frascos de 60 |
0003-0894-21 |
|
un lado y “5” en el |
Frascos de 74 |
0003-0894-70 |
||
|
otro lado |
Paquete de blíster de dosis unitaria para hospital |
0003-0894-31 |
||
|
Paquete de inicio de 30 días para el tratamiento de TVP y EP que contiene 74 tabletas (1 paquete de blíster de 42 tabletas y 1 paquete de blíster de 32 tabletas) |
0003-3764-74 |
17 INFORMACIÓN PARA EL PACIENTE
Aconseje a los pacientes que lean el etiquetado del paciente aprobado por la FDA (Guía de medicamentos).
Aconseje a los pacientes lo siguiente:
- •
- Que no interrumpan ELIQUIS sin hablar primero con su médico.
- •
- Que puede tardar más de lo habitual en detenerse el sangrado, y que pueden tener más hematomas o sangrar más fácilmente cuando se les trata con ELIQUIS. Aconseje a los pacientes sobre cómo reconocer el sangrado o los síntomas de hipovolemia y sobre la necesidad urgente de informar a su médico de cualquier sangrado inusual.
- •
- Que le digan a sus médicos y dentistas que están tomando ELIQUIS, y/o cualquier otro producto que se sabe que afecta al sangrado (incluidos los productos de venta libre, como la aspirina o los AINE), antes de programar cualquier cirugía o procedimiento médico o dental y antes de tomar cualquier medicamento nuevo.
- •
- Si el paciente va a recibir anestesia neuroaxial o punción lumbar, informe al paciente que debe observar los signos y síntomas de hematomas espinales o epidurales [ver Advertencias y precauciones (5.3)]. Si se produce alguno de estos síntomas, aconseje al paciente que busque atención médica de emergencia.
- •
- Que le digan a sus médicos si están embarazadas o planean quedar embarazadas o si están amamantando o tienen intención de amamantar durante el tratamiento con ELIQUIS [ver Uso en poblaciones específicas (8.1, 8.2)].
- •
- Cómo tomar ELIQUIS si no pueden tragar o necesitan una sonda nasogástrica [ver Dosificación y administración (2.6)].
- •
- Qué hacer si se olvida una dosis [ver Dosificación y administración (2.2)].
SECCIÓN SIN CLASIFICAR DE SPL
Comercializado por:
Bristol-Myers Squibb Company
Princeton, New Jersey 08543 USA
y
Pfizer Inc
New York, New York 10017 USA
Rotachrom® es una marca registrada de Diagnostica Stago.
[PRINT CODES]
Guía de medicación
ELIQUIS® (ELL eh kwiss)
(apixaban)
comprimidos
¿Cuál es la información más importante que debo saber sobre ELIQUIS?
- ●
-
Para las personas que toman ELIQUIS por fibrilación auricular:
Las personas con fibrilación auricular (un tipo de latido cardiaco irregular) tienen un mayor riesgo de formar un coágulo sanguíneo en el corazón, que puede viajar al cerebro, causando un ictus, o a otras partes del cuerpo. ELIQUIS reduce sus probabilidades de sufrir un ictus al ayudar a evitar la formación de coágulos. Si deja de tomar ELIQUIS, puede tener un mayor riesgo de formar un coágulo en la sangre.
No deje de tomar ELIQUIS sin hablar con el médico que se lo haya recetado. Detener ELIQUIS aumenta el riesgo de sufrir un ictus.
ELIQUIS puede tener que suspenderse, si es posible, antes de una cirugía o un procedimiento médico o dental. Pregunte al médico que le recetó ELIQUIS cuándo debe dejar de tomarlo. Su médico le indicará cuándo puede volver a empezar a tomar ELIQUIS después de su cirugía o procedimiento. Si tiene que dejar de tomar ELIQUIS, su médico puede recetarle otro medicamento para ayudar a evitar la formación de un coágulo sanguíneo.
- ●
-
ELIQUIS puede causar hemorragias que pueden ser graves y en raras ocasiones pueden llevar a la muerte. Esto se debe a que ELIQUIS es un medicamento anticoagulante que reduce la coagulación sanguínea.
Puede tener un mayor riesgo de hemorragia si toma ELIQUIS y otros medicamentos que aumentan el riesgo de hemorragia, incluidos:
- ●
- aspirina o productos que contengan aspirina
- ●
- uso a largo plazo (crónico) de antiinflamatorios no esteroideos (AINE)
- ●
- warfarina sódica (COUMADIN®, JANTOVEN®)
- ●
- cualquier medicamento que contenga heparina
- ●
- inhibidores selectivos de la recaptación de serotonina (ISRS) o inhibidores de la recaptación de serotonina y norepinefrina (IRSN)
- ●
- otros medicamentos para ayudar a prevenir o tratar coágulos sanguíneos
Hable con su médico si toma alguno de estos medicamentos. Pregunte a su médico o farmacéutico si no está seguro de si su medicamento es uno de los enumerados anteriormente.Mientras toma ELIQUIS:
-
- ●
- puede magullarse más fácilmente
- ●
- puede tardar más de lo habitual en parar cualquier hemorragia
Llame a su médico o pida ayuda médica inmediatamente si tiene alguno de estos signos o síntomas de hemorragia al tomar ELIQUIS:
-
- ●
- hemorragia inesperada o que dure mucho tiempo, como:
- ●
- hemorragia inusual de las encías
- ●
- epistaxis que ocurren con frecuencia
- ●
- menstruación o hemorragia vaginal más abundante de lo normal
- ●
- hemorragia que sea grave o que no pueda controlar
- ●
- orina roja, rosa o marrón
- ●
- heces rojas o negras (parecidas al alquitrán)
- ●
- tos con sangre o coágulos sanguíneos
- ●
- vómitos con sangre o su vómito parece posos de café
- ●
- dolor inesperado, hinchazón o dolor en las articulaciones
- ●
- dolor de cabeza, sensación de mareo o debilidad
- ●
- ELIQUIS no es para pacientes con válvulas cardíacas artificiales.
- ●
-
Coágulos sanguíneos espinales o epidurales (hematoma). Las personas que toman un medicamento anticoagulante como ELIQUIS y reciben inyecciones en la zona espinal y epidural, o se les realiza una punción espinal tienen un riesgo de formar un coágulo sanguíneo que puede provocar una pérdida a largo plazo o permanente de la capacidad de movimiento (parálisis). Su riesgo de desarrollar un coágulo sanguíneo espinal o epidural es mayor si:
- ●
- se coloca un tubo delgado llamado catéter epidural en la espalda para administrarle ciertos medicamentos
- ●
- toma AINE o un medicamento para evitar la coagulación de la sangre
- ●
- tiene antecedentes de punciones epidurales o espinales difíciles o repetidas
- ●
- tiene antecedentes de problemas en la columna vertebral o ha tenido cirugía en la espalda
Si toma ELIQUIS y recibe anestesia espinal o se le realiza una punción espinal, su médico debe vigilarle atentamente en busca de síntomas de coágulos sanguíneos espinales o epidurales o hemorragia. Dígale inmediatamente a su médico si tiene hormigueo, entumecimiento o debilidad muscular, especialmente en las piernas y los pies.
- ●
- ELIQUIS no se debe usar en personas con síndrome antifosfolípido (SAF), especialmente con pruebas de triple anticuerpo positivas, que tienen antecedentes de coágulos sanguíneos.
¿Qué es ELIQUIS?
ELIQUIS es un medicamento recetado que se utiliza para:
- ●
- reducir el riesgo de ictus y coágulos sanguíneos en personas que tienen fibrilación auricular.
- ●
- reducir el riesgo de formar un coágulo sanguíneo en las piernas y los pulmones de personas que acaban de someterse a una cirugía de reemplazo de cadera o rodilla.
- ●
- tratar coágulos sanguíneos en las venas de las piernas (trombosis venosa profunda) o los pulmones (embolismo pulmonar) y reducir el riesgo de que vuelvan a ocurrir.
No se sabe si ELIQUIS es seguro y eficaz en niños.
¿Quién no debe tomar ELIQUIS?
No tome ELIQUIS si usted:
- ●
- tiene actualmente ciertos tipos de hemorragia anormal.
- ●
- ha tenido una reacción alérgica grave a ELIQUIS. Pregunte a su médico si no está seguro.
¿Qué debo decirle a mi médico antes de tomar ELIQUIS?
Antes de tomar ELIQUIS, dígale a su médico si usted:
- ●
- tiene problemas renales o hepáticos
- ●
- tiene síndrome antifosfolípido
- ●
- tiene cualquier otra afección médica
- ●
- ha tenido problemas de hemorragia alguna vez
- ●
- está embarazada o planea quedarse embarazada. No se sabe si ELIQUIS le dañará al bebé que no ha nacido.
Mujeres que puedan quedarse embarazadas: Hable con su proveedor de atención médica sobre la planificación del embarazo durante el tratamiento con ELIQUIS. Hable con su proveedor de atención médica sobre su riesgo de hemorragia uterina grave si se trata con medicamentos anticoagulantes, incluidos ELIQUIS.
- ●
- está amamantando o planea amamantar. No se sabe si ELIQUIS pasa a la leche materna. Usted y su médico deben decidir si tomará ELIQUIS o amamantará. No debe hacer ambas cosas.
Informe a todos sus médicos y dentistas de que está tomando ELIQUIS. Deben hablar con el médico que le recetó ELIQUIS para usted, antes de que usted tenga cualquier cirugía, procedimiento médico o dental.
Informe a su médico sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos herbales. Algunos de sus otros medicamentos pueden afectar la forma en que funciona ELIQUIS. Ciertos medicamentos pueden aumentar su riesgo de sangrado o accidente cerebrovascular cuando se toman con ELIQUIS. Consulte “¿Cuál es la información más importante que debo saber sobre ELIQUIS?“
Conozca los medicamentos que toma. Mantenga una lista de ellos para mostrársela a su médico y farmacéutico cuando obtenga un nuevo medicamento.
¿Cómo debo tomar ELIQUIS?
- ●
- Tome ELIQUIS exactamente como se lo recetó su médico.
- ●
- Tome ELIQUIS dos veces al día con o sin alimentos.
- ●
- No cambie su dosis ni deje de tomar ELIQUIS a menos que su médico se lo indique.
- ●
- Si olvida una dosis de ELIQUIS, tómela tan pronto como lo recuerde. No tome más de una dosis de ELIQUIS al mismo tiempo para compensar una dosis olvidada.
- ●
- Si tiene dificultad para tragar la tableta entera, hable con su médico sobre otras formas de tomar ELIQUIS.
- ●
- Su médico decidirá cuánto tiempo debe tomar ELIQUIS. No deje de tomarlo sin antes hablar con su médico. Si está tomando ELIQUIS para la fibrilación auricular, dejar de tomar ELIQUIS puede aumentar su riesgo de tener un derrame cerebral.
- ●
- No se quede sin ELIQUIS. Vuelva a surtir su receta antes de que se le acabe. Al salir del hospital después de una cirugía de reemplazo de cadera o rodilla, asegúrese de tener ELIQUIS disponible para evitar perderse alguna dosis.
- ●
- Si toma demasiado ELIQUIS, llame a su médico o vaya a la sala de emergencias del hospital más cercano de inmediato.
- ●
- Llame a su médico o proveedor de atención médica de inmediato si se cae o se lesiona, especialmente si se golpea la cabeza. Su médico o proveedor de atención médica puede necesitar revisarlo.
¿Cuáles son los posibles efectos secundarios de ELIQUIS?
- ●
- Consulte “¿Cuál es la información más importante que debo saber sobre ELIQUIS?“
- ●
- ELIQUIS puede causar erupción cutánea o reacción alérgica grave. Llame a su médico o busque atención médica de inmediato si tiene alguno de los siguientes síntomas:
- ●
- dolor u opresión en el pecho
- ●
- hinchazón de la cara o la lengua
- ●
- dificultad para respirar o sibilancias
- ●
- sensación de mareo o desmayo
Informe a su médico si tiene algún efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de ELIQUIS. Para obtener más información, consulte a su médico o farmacéutico.
Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar ELIQUIS?
Almacene ELIQUIS a temperatura ambiente entre 68 ° F y 77 ° F (20 ° C y 25 ° C).
Mantenga ELIQUIS y todos los medicamentos fuera del alcance de los niños.
Información general sobre ELIQUIS
Los medicamentos a veces se recetan para fines distintos de los que se enumeran en una Guía de medicamentos. No use ELIQUIS para una afección para la que no se lo recetó. No le dé ELIQUIS a otras personas, incluso si tienen los mismos síntomas que usted. Puede hacerles daño.
Si desea obtener más información, hable con su médico. Puede pedirle a su farmacéutico o médico información sobre ELIQUIS que esté escrita para profesionales de la salud.
Para obtener más información, llame al 1-855-354-7847 (1-855-ELIQUIS) o visite www.ELIQUIS.com.
¿Cuáles son los ingredientes de ELIQUIS?
Ingrediente activo: apixaban.
Ingredientes inactivos: lactosa anhidra, celulosa microcristalina, croscarmelosa sódica, lauril sulfato de sodio y estearato de magnesio. La cubierta de la película contiene monohidrato de lactosa, hipromelosa, dióxido de titanio, triacetina y óxido de hierro amarillo (tabletas de 2,5 mg) u óxido de hierro rojo (tabletas de 5 mg).
Esta Guía de medicamentos ha sido aprobada por la Administración de Alimentos y Medicamentos de los EE. UU.
Comercializado por:
Bristol-Myers Squibb Company
Princeton, Nueva Jersey 08543 EE. UU.
y
Pfizer Inc
Nueva York, Nueva York 10017 EE. UU.
COUMADIN® es una marca registrada de Bristol-Myers Squibb Pharma Company.
Todas las demás marcas comerciales son propiedad de sus respectivas compañías.
Revisado en septiembre de 2021
ELIQUIS 2.5 mg comprimidos Embalaje Representativo
Consulte la sección Presentación para obtener una lista completa de los envases disponibles de ELIQUIS.
60 Comprimidos
NDC 0003-0893-21
ELIQUIS®
(apixaban) comprimidos
2.5 mg
DISPENSAR CON LA GUÍA DE MEDICAMENTOS
Sólo con receta médica
Bristol Myers Squibb
Pfizer
ELIQUIS 5 mg comprimidos Envase representativo
60 Tabletas
NDC 0003-0894-21
ELIQUIS®
(apixaban) tabletas
5 mg
DISPENSE CON LA GUÍA DE MEDICAMENTOS
Rx solamente
Bristol Myers Squibb
Pfizer
Eliquis Starter-Pack 5 mg Tabletas, Embalaje Representativo
Receta médica únicamente
Paquete de inicio de 30 días
para el tratamiento de
trombosis venosa profunda (TVP)
y embolia pulmonar (EP)
5 mg
por tableta
Dispensar con la Guía de Medicamentos
Por favor, consulte la información completa de prescripción adjunta,
incluidas las ADVERTENCIAS en recuadro y la Guía de Medicamentos.
NDC 0003-3764-74
Contiene dos carteras
74 tabletas, 5 mg por tableta
ELIQUIS®
(apixaban) tabletas
Cartera 1: Días 1-14
Comience con la Cartera 1
Cartera 2: Días 15-30
Cambie a la Cartera 2 el día 15
Mantener fuera del alcance de los niños