Fabricante de medicamentos: Exelixis, Inc. (Updated: 2025-02-04)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
CABOMETYX® (cabozantinib) comprimidos, para administración oral
Aprobación inicial en EE. UU.: 2012
INDICACIONES Y USO
CABOMETYX es un inhibidor de la cinasa indicado para el tratamiento de
- pacientes con carcinoma de células renales (CCR) avanzado (1.1)
- pacientes con carcinoma de células renales avanzado, como tratamiento de primera línea en combinación con nivolumab (1.1)
- pacientes con carcinoma hepatocelular (CHC) que han sido tratados previamente con sorafenib (1.2)
- pacientes adultos y pediátricos de 12 años o más con cáncer de tiroides diferenciado (CTD) localmente avanzado o metastásico que ha progresado después de un tratamiento previo dirigido a VEGFR y que son refractarios al yodo radiactivo o no son elegibles (1.3)
POSOLOGÍA Y ADMINISTRACIÓN
FORMAS Y CONCENTRACIONES FARMACÉUTICAS
Comprimidos: 20 mg, 40 mg y 60 mg. (3)
CONTRAINDICACIONES
Ninguna (4)
ADVERTENCIAS Y PRECAUCIONES
- Hemorragia: No administre CABOMETYX si hay antecedentes recientes de hemorragia. (5.1)
- Perforaciones y fístulas: Controle los síntomas. Suspenda CABOMETYX en caso de fístula o perforación de grado 4. (5.2)
- Eventos trombóticos: Suspenda CABOMETYX en caso de infarto de miocardio o eventos tromboembólicos venosos o arteriales graves. (5.3)
- Hipertensión e hipertensión crisis: Controle la presión arterial regularmente. Interrupción para la hipertensión que no se controla adecuadamente con terapia antihipertensiva. Suspenda CABOMETYX en caso de crisis hipertensiva o hipertensión grave que no pueda controlarse con terapia antihipertensiva. (5.4)
- Diarrea: Puede ser grave. Interrupción de CABOMETYX hasta que la diarrea desaparezca o disminuya a ≤Grado 1, reanudar con una dosis reducida. Se recomiendan los tratamientos antidiarreicos estándar. (5.5)
- Eritrodisestesia palmoplantar (EPP): Interrupción del tratamiento con CABOMETYX hasta que la EPP desaparezca o disminuya a Grado 1. (5.6)
- Hepatotoxicidad: Cuando se usa en combinación con nivolumab, pueden producirse frecuencias más altas de elevación de ALT y AST de grado 3 y 4 que con CABOMETYX solo. Controle las enzimas hepáticas antes del inicio y periódicamente durante el tratamiento. Considere la posibilidad de suspender CABOMETYX y/o nivolumab, iniciar tratamiento con corticosteroides y/o suspender permanentemente la combinación en caso de hepatotoxicidad grave o potencialmente mortal. (5.7)
- Insuficiencia suprarrenal: Cuando se usa en combinación con nivolumab, puede producirse insuficiencia suprarrenal primaria o secundaria. En caso de insuficiencia suprarrenal de grado 2 o superior, inicie el tratamiento sintomático, incluida la terapia de reemplazo hormonal según esté clínicamente indicado. Suspenda CABOMETYX y/o nivolumab según la gravedad. (5.8)
- Proteinuria: Controle la proteína en la orina. Interrupción de CABOMETYX hasta que la proteinuria desaparezca a ≤ Grado 1, reanudar CABOMETYX con una dosis reducida. Suspender en caso de síndrome nefrótico. (5.9)
- Osteonecrosis de la mandíbula (ONM): Suspenda CABOMETYX durante al menos 3 semanas antes de los procedimientos dentales invasivos y en caso de desarrollo de ONM. (5.10)
- Alteración de la cicatrización de heridas: Suspenda CABOMETYX durante al menos 3 semanas antes de la cirugía electiva. No administre durante al menos 2 semanas después de una cirugía mayor y una cicatrización adecuada de la herida. No se ha establecido la seguridad de la reanudación de CABOMETYX después de la resolución de las complicaciones de la cicatrización de heridas. (5.11)
- Síndrome de leucoencefalopatía posterior reversible (SLPR): Suspenda CABOMETYX. (5.12)
- Disfunción tiroidea: Controle la función tiroidea antes y durante el tratamiento con CABOMETYX. (5.13)
- Hipocalcemia: Suspenda CABOMETYX y reanude con una dosis reducida una vez recuperado o suspenda permanentemente CABOMETYX según la gravedad. (5.14)
- Toxicidad embriofetal: Puede causar daño fetal. Avise a las mujeres en edad fértil del riesgo potencial para el feto y del uso de métodos anticonceptivos eficaces. (5.15, 8.1, 8.3)
REACCIONES ADVERSAS
Las reacciones adversas más frecuentes (≥ 20%) son:
- como agente único: diarrea, fatiga, EPP, disminución del apetito, hipertensión, náuseas, vómitos, disminución de peso, estreñimiento. (6.1)
- en combinación con nivolumab: diarrea, fatiga, hepatotoxicidad, EPP, estomatitis, erupción cutánea, hipertensión, hipotiroidismo, dolor musculoesquelético, disminución del apetito, náuseas, disgeusia, dolor abdominal, tos e infección de las vías respiratorias superiores. (6.1)
Para notificar SOSPECHAS DE REACCIONES ADVERSAS, póngase en contacto con Exelixis, Inc. al 1-855-500-3935 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES MEDICAMENTOSAS
USO EN POBLACIONES ESPECÍFICAS
- Insuficiencia hepática: Reduzca la dosis de CABOMETYX para pacientes con insuficiencia hepática moderada. Evite en pacientes con insuficiencia hepática grave. (2.8, 8.6)
- Lactancia: Aconseje no amamantar. (8.2)
- Uso pediátrico: Controle las placas de crecimiento abiertas en pacientes adolescentes. Considere interrumpir o suspender CABOMETYX si se producen anomalías. (8.4)
Ver 17 para INFORMACIÓN AL PACIENTE y etiquetado del paciente aprobado por la FDA.
Revisado: 9/2023
Tabla de contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
1.1 Carcinoma de Células Renales
1.2 Carcinoma Hepatocelular
1.3 Cáncer de Tiroides Diferenciado
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Información Importante sobre la Dosificación
2.2 Dosis Recomendada para Carcinoma de Células Renales
2.3 Dosis Recomendada para Carcinoma Hepatocelular
2.4 Dosis Recomendada para Cáncer de Tiroides Diferenciado
2.5 Modificaciones de la Dosis para Reacciones Adversas
2.6 Modificaciones de la Dosis para la Coadministración con Inhibidores Potentes del CYP3A4
2.7 Modificaciones de la Dosis para la Coadministración con Inductores Potentes del CYP3A4
2.8 Modificaciones de la Dosis para Pacientes con Insuficiencia Hepática
2.9 Administración
3 FORMAS Y CONCENTRACIONES FARMACÉUTICAS
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Hemorragia
5.2 Perforaciones y Fístulas
5.3 Eventos Trombóticos
5.4 Hipertensión y Crisis Hipertensiva
5.5 Diarrea
5.6 Eritrodisestesia Palmar-Plantar
5.7 Hepatotoxicidad
5.8 Insuficiencia Suprarrenal
5.9 Proteinuria
5.10 Osteonecrosis de la Mandíbula
5.11 Alteración de la Cicatrización de Heridas
5.12 Síndrome de Leucoencefalopatía Posterior Reversible
5.13 Disfunción Tiroidea
5.14 Hipocalcemia
5.15 Toxicidad Embrio-Fetal
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Postcomercialización
7 INTERACCIONES MEDICAMENTOSAS
7.1 Efectos de Otros Medicamentos sobre CABOMETYX
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.3 Mujeres y Hombres en Edad Reproductiva
8.4 Uso Pediátrico
8.5 Uso Geriátrico
8.6 Insuficiencia Hepática
8.7 Insuficiencia Renal
10 SOBREDOSIFICACIÓN
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinámica
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Carcinoma de Células Renales
14.2 Carcinoma Hepatocelular
14.3 Cáncer de Tiroides Diferenciado
16 PRESENTACIÓN/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no se enumeran.
1 INDICACIONES Y USO
1.1 Carcinoma de células renales
CABOMETYX está indicado para el tratamiento de pacientes con carcinoma de células renales (CCR) avanzado.
CABOMETYX, en combinación con nivolumab, está indicado para el tratamiento de primera línea de pacientes con CCR avanzado.
1.2 Carcinoma hepatocelular
CABOMETYX está indicado para el tratamiento de pacientes con carcinoma hepatocelular (CHC) que han sido tratados previamente con sorafenib.
1.3 Cáncer de tiroides diferenciado
CABOMETYX está indicado para el tratamiento de pacientes adultos y pediátricos de 12 años o más con cáncer de tiroides diferenciado (CTD) localmente avanzado o metastásico que ha progresado después de una terapia previa dirigida a VEGFR y que son refractarios al yodo radiactivo o no son elegibles.
2 DOSIS Y ADMINISTRACIÓN
2.1 Información Importante sobre la Dosis
- Suspenda el tratamiento con CABOMETYX al menos 3 semanas antes de la cirugía programada, incluida la cirugía dental [ver Advertencias y precauciones (5.1, 5.10, 5.11)].
- No sustituya las tabletas de CABOMETYX por cápsulas de cabozantinib.
2.2 Dosis Recomendada para el Carcinoma de Células Renales
La dosis recomendada de CABOMETYX como agente único es de 60 mg una vez al día hasta la progresión de la enfermedad o toxicidad inaceptable, administrada según lo recomendado [ver Dosis y administración (2.9)].
La dosis recomendada de CABOMETYX en combinación con nivolumab se proporciona en la siguiente tabla:
| Dosis recomendada | Duración del tratamiento |
|---|---|
| CABOMETYX 40 mg una vez al día sin alimentos | hasta la progresión de la enfermedad o toxicidad inaceptable |
| Nivolumab 240 mg cada 2 semanas (infusión intravenosa de 30 minutos) o 480 mg cada 4 semanas (infusión intravenosa de 30 minutos) | hasta la progresión de la enfermedad o toxicidad inaceptable durante un máximo de 2 años |
2.3 Dosis Recomendada para el Carcinoma Hepatocelular
La dosis recomendada de CABOMETYX como agente único es de 60 mg una vez al día hasta la progresión de la enfermedad o toxicidad inaceptable, administrada según lo recomendado [ver Dosis y administración (2.9)].
2.4 Dosis Recomendada para el Cáncer de Tiroides Diferenciado
La dosis recomendada de CABOMETYX como agente único para pacientes adultos y pediátricos de 12 años o más con una superficie corporal (BSA) mayor o igual a 1,2 m2 es de 60 mg una vez al día hasta la progresión de la enfermedad o toxicidad inaceptable, administrada según lo recomendado [ver Dosis y administración (2.9), Farmacología clínica (12.3)].
La dosis recomendada de CABOMETYX como agente único en pacientes pediátricos de 12 años o más con una BSA menor de 1,2 m2 es de 40 mg una vez al día hasta la progresión de la enfermedad o toxicidad inaceptable, administrada según lo recomendado [ver Dosis y administración (2.9), Farmacología clínica (12.3)].
2.5 Modificaciones de la Dosis para las Reacciones Adversas
Suspenda CABOMETYX para:
- Reacciones adversas de grado 2 intolerables
- Reacciones adversas de grado 3 o 4
- Osteonecrosis de la mandíbula
Una vez que la reacción adversa se resuelva o mejore (es decir, que vuelva a la línea de base o se resuelva hasta el grado 1), reduzca la dosis de la siguiente manera:
| Dosis recomendada | Primera reducción de la dosis a | Segunda reducción de la dosis a |
|---|---|---|
|
||
| CABOMETYX 60 mg diarios en pacientes adultos y pediátricos con BSA mayor o igual a 1,2 m2 | 40 mg diarios | 20 mg diarios* |
| CABOMETYX 40 mg diarios en pacientes pediátricos con BSA menor de 1,2 m2 | 20 mg diarios | 20 mg cada dos días* |
| CABOMETYX 40 mg diarios en combinación con nivolumab | 20 mg diarios | 20 mg cada dos días* |
| Reacción adversa | Gravedad* | Modificación de la dosis de CABOMETYX |
|---|---|---|
|
||
| Hemorragia [ver Advertencias y precauciones (5.1)] | Grado 3 o 4 |
|
| Perforaciones y fístulas [ver Advertencias y precauciones (5.2)] | Cualquier grado de perforación gastrointestinal o
Fístula de grado 4 |
|
| Eventos trombóticos [ver Advertencias y precauciones (5.3)] | Cualquier grado de infarto agudo de miocardio o
Infarto cerebral de grado 2 o superior o Eventos tromboembólicos arteriales de grado 3 o 4 o Eventos tromboembólicos venosos de grado 4 |
|
| Hipertensión y crisis hipertensiva [ver Advertencias y precauciones (5.4)] | Grado 3 |
|
| Grado 4 |
|
|
| Diarrea [ver Advertencias y precauciones (5.5)] | Grado 2, Grado 3 o Grado 4 |
|
| Eritrodisestesia palmoplantar [ver Advertencias y precauciones (5.6)] | Grado 2 o Grado 3 intolerable |
|
| Proteinuria [ver Advertencias y precauciones (5.9)] | Grado 2 o 3 |
|
| Osteonecrosis de la mandíbula (ONM) [ver Advertencias y precauciones (5.10)] | Cualquier grado |
|
| Síndrome de leucoencefalopatía posterior reversible [ver Advertencias y precauciones (5.12)] |
Cualquier grado |
|
| Otras reacciones adversas [ver Reacciones adversas (6.1)] |
Grado 2 intolerable,
o Grado 3, o Grado 4 |
|
La siguiente tabla muestra las modificaciones de la dosis para el fármaco administrado en combinación que son diferentes de las descritas anteriormente para CABOMETYX o en la Información completa de prescripción:
|
||
| CABOMETYX en combinación con nivolumab | ALT o AST >3 veces el LSN pero ≤10 veces el LSN con bilirrubina total concurrente <2 veces el LSN | Suspender* tanto CABOMETYX como nivolumab hasta que las reacciones adversas se recuperen† a Grados 0 o 1 |
| ALT o AST >10 veces el LSN o >3 veces el LSN con bilirrubina total concurrente ≥2 veces el LSN | Interrumpir permanentemente tanto CABOMETYX como nivolumab | |
Cuando se administre CABOMETYX en combinación con nivolumab para el tratamiento del CCR avanzado, consulte la información de prescripción de nivolumab.
2.6 Modificaciones de la dosis para la administración conjunta con inhibidores potentes del CYP3A4
Reduzca la dosis diaria de CABOMETYX en 20 mg (por ejemplo, de 60 mg a 40 mg diarios o de 40 mg a 20 mg diarios o de 20 mg diarios a 20 mg cada dos días en pacientes pediátricos con una superficie corporal menor de 1,2 m2). Reanude la dosis que se usó antes de iniciar el inhibidor potente del CYP3A4 de 2 a 3 días después de la interrupción del inhibidor potente [véase Interacciones medicamentosas (7.1), Farmacología clínica (12.3)].
2.7 Modificaciones de la dosis para la administración conjunta con inductores potentes del CYP3A4
Aumente la dosis diaria de CABOMETYX en 20 mg (por ejemplo, de 60 mg a 80 mg diarios o de 40 mg a 60 mg diarios) según se tolere. Reanude la dosis que se usó antes de iniciar el inductor potente del CYP3A4 de 2 a 3 días después de la interrupción del inductor potente. No exceda una dosis diaria de 80 mg [véase Interacciones medicamentosas (7.1), Farmacología clínica (12.3)].
2.8 Modificaciones de la dosis para pacientes con insuficiencia hepática
Reduzca la dosis inicial de CABOMETYX de 60 mg diarios a 40 mg diarios o de 40 mg diarios a 20 mg diarios (para pacientes pediátricos con una superficie corporal menor de 1,2 m2) en pacientes con insuficiencia hepática moderada (Child-Pugh B) [véase Uso en poblaciones específicas (8.6), Farmacología clínica (12.3)].
2.9 Administración
No administre CABOMETYX con alimentos. Administre al menos 1 hora antes o al menos 2 horas después de comer [véase Farmacología clínica (12.3)].
- Trague los comprimidos de CABOMETYX enteros. No triture los comprimidos de CABOMETYX.
- No tome una dosis olvidada dentro de las 12 horas de la siguiente dosis.
- Modifique la dosis de CABOMETYX para los pacientes que toman medicamentos que se sabe que inducen o inhiben fuertemente el CYP3A4 y para los pacientes con insuficiencia hepática moderada [véase Posología y administración (2.6, 2.7, 2.8)].
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Comprimidos:
- 60 mg: amarillo con recubrimiento pelicular, de forma ovalada sin ranura, y con la inscripción “XL” en una cara y “60” en la otra.
- 40 mg: amarillo con recubrimiento pelicular, de forma triangular sin ranura, y con la inscripción “XL” en una cara y “40” en la otra.
- 20 mg: amarillo con recubrimiento pelicular, redondo sin ranura, y con la inscripción “XL” en una cara y “20” en la otra.
4 CONTRAINDICACIONES
Ninguna.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Hemorragia
Se produjeron hemorragias graves y mortales con CABOMETYX [ver Reacciones adversas (6.1)]. La incidencia de eventos hemorrágicos de Grado 3 a 5 fue del 5% en pacientes tratados con CABOMETYX en estudios de CCR, HCC y DTC.
Suspenda la administración de CABOMETYX en caso de hemorragia de Grado 3 o 4 y antes de la cirugía según se recomiende [ver Posología y administración (2.5), Advertencias y precauciones (5.10, 5.11)]. No administre CABOMETYX a pacientes con antecedentes recientes de hemorragia, incluyendo hemoptisis, hematemesis o melena.
5.2 Perforaciones y fístulas
Se produjeron fístulas, incluidos casos mortales, en el 1% de los pacientes tratados con CABOMETYX [ver Reacciones adversas (6.1)]. Se produjeron perforaciones gastrointestinales (GI), incluidos casos mortales, en el 1% de los pacientes tratados con CABOMETYX.
Controle a los pacientes para detectar signos y síntomas de fístulas y perforaciones, incluyendo absceso y sepsis. Suspenda la administración de CABOMETYX en pacientes que experimenten una fístula de Grado 4 o una perforación GI [ver Posología y administración (2.5)].
5.3 Eventos trombóticos
CABOMETYX aumentó el riesgo de eventos trombóticos [ver Reacciones adversas (6.1)]. Se produjo tromboembolismo venoso en el 7% (incluido el 4% de embolia pulmonar) y tromboembolismo arterial en el 2% de los pacientes tratados con CABOMETYX. Se produjeron eventos trombóticos mortales en pacientes tratados con CABOMETYX.
Suspenda la administración de CABOMETYX en pacientes que desarrollen un infarto agudo de miocardio o eventos tromboembólicos arteriales o venosos graves que requieran intervención médica [ver Posología y administración (2.5)].
5.4 Hipertensión y crisis hipertensiva
CABOMETYX puede causar hipertensión, incluyendo crisis hipertensiva [ver Reacciones adversas (6.1)]. Se informó hipertensión en el 37% (16% de Grado 3 y <1% de Grado 4) de los pacientes tratados con CABOMETYX.
No inicie el tratamiento con CABOMETYX en pacientes con hipertensión no controlada. Controle la presión arterial regularmente durante el tratamiento con CABOMETYX. Suspenda la administración de CABOMETYX en caso de hipertensión que no esté adecuadamente controlada con tratamiento médico; una vez controlada, reanude la administración de CABOMETYX a una dosis reducida [ver Posología y administración (2.5)]. Suspenda permanentemente la administración de CABOMETYX en caso de hipertensión grave que no pueda controlarse con terapia antihipertensiva o en caso de crisis hipertensiva [ver Posología y administración (2.5)].
5.5 Diarrea
Se produjo diarrea en el 62% de los pacientes tratados con CABOMETYX. Se produjo diarrea de Grado 3 en el 10% de los pacientes tratados con CABOMETYX [ver Reacciones adversas (6.1)].
Controle y maneje a los pacientes utilizando antidiarreicos según sea necesario. Suspenda la administración de CABOMETYX hasta que mejore a ≤ Grado 1, reanude la administración de CABOMETYX a una dosis reducida [ver Posología y administración (2.5)].
5.6 Eritrodisestesia palmar-plantar
Se produjo eritrodisestesia palmar-plantar (EPP) en el 45% de los pacientes tratados con CABOMETYX [ver Reacciones adversas (6.1)]. Se produjo EPP de Grado 3 en el 13% de los pacientes tratados con CABOMETYX.
Suspenda la administración de CABOMETYX hasta que mejore a Grado 1 y reanude la administración de CABOMETYX a una dosis reducida en caso de EPP de Grado 2 o Grado 3 intolerable [ver Posología y administración (2.5)].
5.7 Hepatotoxicidad
CABOMETYX en combinación con nivolumab puede causar toxicidad hepática con mayores frecuencias de elevaciones de ALT y AST de Grados 3 y 4 en comparación con CABOMETYX solo.
Controle las enzimas hepáticas antes de iniciar el tratamiento y periódicamente durante el mismo. Considere un control más frecuente de las enzimas hepáticas en comparación con cuando los medicamentos se administran como agentes únicos. En caso de elevación de las enzimas hepáticas, interrumpa la administración de CABOMETYX y nivolumab y considere la administración de corticosteroides [ver Posología y administración (2.5)].
Con la combinación de CABOMETYX y nivolumab, se observaron ALT o AST aumentadas de Grados 3 y 4 en el 11% de los pacientes [ver Reacciones adversas (6.1)]. Se informó ALT o AST > 3 veces el LSN (Grado ≥2) en 83 pacientes, de los cuales 23 (28%) recibieron corticosteroides sistémicos; la ALT o AST se resolvió a Grados 0-1 en 74 (89%). Entre los 44 pacientes con aumento de ALT o AST de Grado ≥2 a los que se volvió a desafiar con CABOMETYX (n=9) o nivolumab (n=11) como agente único o con ambos (n=24), se observó recurrencia de aumento de ALT o AST de Grado ≥2 en 2 pacientes que recibieron CABOMETYX, 2 pacientes que recibieron nivolumab y 7 pacientes que recibieron tanto CABOMETYX como nivolumab. Suspenda y reanude a una dosis reducida según la gravedad [ver Posología y administración (2.5)].
5.8 Insuficiencia suprarrenal
CABOMETYX en combinación con nivolumab puede causar insuficiencia suprarrenal primaria o secundaria. En caso de insuficiencia suprarrenal de Grado 2 o superior, inicie el tratamiento sintomático, incluyendo la sustitución hormonal según esté clínicamente indicado. Suspenda la administración de CABOMETYX y/o nivolumab y reanude la administración de CABOMETYX a una dosis reducida según la gravedad [ver Posología y administración (2.5)].
La insuficiencia suprarrenal se produjo en el 4,7 % (15/320) de los pacientes con CCR que recibieron CABOMETYX con nivolumab, incluidas reacciones adversas de grado 3 (2,2 %) y de grado 2 (1,9 %). La insuficiencia suprarrenal provocó la interrupción permanente de CABOMETYX y nivolumab en el 0,9 % y la suspensión de CABOMETYX y nivolumab en el 2,8 % de los pacientes con CCR.
Aproximadamente el 80 % (12/15) de los pacientes con insuficiencia suprarrenal recibieron terapia de reemplazo hormonal, incluidos corticosteroides sistémicos. La insuficiencia suprarrenal se resolvió en el 27 % (n = 4) de los 15 pacientes. De los 9 pacientes en los que se suspendió el tratamiento con CABOMETYX y nivolumab por insuficiencia suprarrenal, 6 reanudaron el tratamiento después de la mejoría de los síntomas; de estos, todos (n = 6) recibieron terapia de reemplazo hormonal y 2 presentaron una recurrencia de la insuficiencia suprarrenal.
5.9 Proteinuria
Se observó proteinuria en el 8 % de los pacientes que recibieron CABOMETYX [véase Reacciones adversas (6.1)].
Controle la proteína en orina regularmente durante el tratamiento con CABOMETYX. En caso de proteinuria de grado 2 o 3, suspenda CABOMETYX hasta que mejore a ≤ proteinuria de grado 1, reanude CABOMETYX a una dosis reducida. Suspenda CABOMETYX en pacientes que desarrollen síndrome nefrótico [véase Posología y administración (2.5)].
5.10 Osteonecrosis de la mandíbula
La osteonecrosis de la mandíbula (ONM) se produjo en <1 % de los pacientes tratados con CABOMETYX [véase Reacciones adversas (6.1)].
La ONM puede manifestarse como dolor en la mandíbula, osteomielitis, osteítis, erosión ósea, infección dental o periodontal, dolor de muelas, ulceración o erosión gingival, dolor persistente en la mandíbula o cicatrización lenta de la boca o la mandíbula después de una cirugía dental. Realice una exploración oral antes de iniciar el tratamiento con CABOMETYX y periódicamente durante el tratamiento con CABOMETYX. Avise a los pacientes sobre las buenas prácticas de higiene bucal. Si es posible, suspenda CABOMETYX durante al menos 3 semanas antes de la cirugía dental programada o los procedimientos dentales invasivos. Suspenda CABOMETYX por el desarrollo de ONM hasta su resolución completa, reanude a una dosis reducida [véase Posología y administración (2.5)].
5.11 Alteración de la cicatrización de heridas
Se produjeron complicaciones en las heridas con CABOMETYX [véase Reacciones adversas (6.1)]. Suspenda CABOMETYX durante al menos 3 semanas antes de la cirugía electiva [véase Posología y administración (2.1)]. No administre CABOMETYX durante al menos 2 semanas después de una cirugía mayor y hasta que se produzca una cicatrización adecuada de la herida. No se ha establecido la seguridad de la reanudación de CABOMETYX después de la resolución de las complicaciones de la cicatrización de heridas [véase Posología y administración (2.5)].
5.12 Síndrome de leucoencefalopatía posterior reversible
El síndrome de leucoencefalopatía posterior reversible (SLPR), un síndrome de edema vasogénico subcortical diagnosticado por hallazgos característicos en la RMN, puede producirse con CABOMETYX. Realice una evaluación del SLPR en cualquier paciente que presente convulsiones, dolor de cabeza, trastornos visuales, confusión o alteración de la función mental. Suspenda CABOMETYX en pacientes que desarrollen SLPR [véase Posología y administración (2.5)].
5.13 Disfunción tiroidea
Se ha observado disfunción tiroidea, principalmente hipotiroidismo, con CABOMETYX. Según la población de seguridad [véase Reacciones adversas (6.1)], la disfunción tiroidea se produjo en el 19 % de los pacientes tratados con CABOMETYX, incluido el grado 3 en el 0,4 % de los pacientes.
Se debe evaluar a los pacientes en busca de signos de disfunción tiroidea antes de iniciar el tratamiento con CABOMETYX y controlarlos en busca de signos y síntomas de disfunción tiroidea durante el tratamiento con CABOMETYX. Las pruebas de función tiroidea y el manejo de la disfunción deben realizarse según lo indicado clínicamente [véase Posología y administración (2.5)].
5.14 Hipocalcemia
CABOMETYX puede causar hipocalcemia. Según la población de seguridad [véase Reacciones adversas (6.1)], la hipocalcemia se produjo en el 13 % de los pacientes tratados con CABOMETYX, incluido el grado 3 en el 2 % y el grado 4 en el 1 % de los pacientes. Los datos de anomalías de laboratorio no se recogieron en CABOSUN.
En COSMIC-311 [véase Estudios clínicos (14.3)], la hipocalcemia se produjo en el 36 % de los pacientes tratados con CABOMETYX, incluido el grado 3 en el 6 % y el grado 4 en el 3 % de los pacientes.
Controle los niveles de calcio en sangre y reemplace el calcio según sea necesario durante el tratamiento. Suspenda y reanude a una dosis reducida tras la recuperación o suspenda permanentemente CABOMETYX en función de la gravedad [véase Posología y administración (2.5)].
5.15 Toxicidad embriofetal
Según los datos de estudios en animales y su mecanismo de acción, CABOMETYX puede causar daño fetal cuando se administra a una mujer embarazada. La administración de cabozantinib a animales preñados durante la organogénesis provocó embrioletalidad a exposiciones inferiores a las que se producen clínicamente a la dosis recomendada, y un aumento de la incidencia de variaciones esqueléticas en ratas y variaciones viscerales y malformaciones en conejos.
Avise a las mujeres embarazadas del riesgo potencial para el feto. Avise a las mujeres en edad fértil que utilicen un método anticonceptivo eficaz durante el tratamiento con CABOMETYX y durante 4 meses después de la última dosis [véase Uso en poblaciones específicas (8.1, 8.3), Farmacología clínica (12.1)].
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas clínicamente significativas se discuten en otras partes del etiquetado:
- Hemorragia [ver Advertencias y precauciones (5.1)]
- Perforaciones y fístulas [ver Advertencias y precauciones (5.2)]
- Eventos trombóticos [ver Advertencias y precauciones (5.3)]
- Hipertensión y crisis hipertensiva [ver Advertencias y precauciones (5.4)]
- Diarrea [ver Advertencias y precauciones (5.5)]
- Eritrodisestesia palmar-plantar [ver Advertencias y precauciones (5.6)]
- Hepatotoxicidad [ver Advertencias y precauciones (5.7)]
- Insuficiencia suprarrenal [ver Advertencias y precauciones (5.8)]
- Proteinuria [ver Advertencias y precauciones (5.9)]
- Osteonecrosis de la mandíbula [ver Advertencias y precauciones (5.10)]
- Cicatrización deficiente de heridas [ver Advertencias y precauciones (5.11)]
- Síndrome de leucoencefalopatía posterior reversible [ver Advertencias y precauciones (5.12)]
- Disfunción tiroidea [ver Advertencias y precauciones (5.13)]
- Hipocalcemia [ver Advertencias y precauciones (5.14)]
6.1 Experiencia en ensayos clínicos
Los datos descritos en la sección ADVERTENCIAS Y PRECAUCIONES y a continuación reflejan la exposición a CABOMETYX como agente único en 409 pacientes con CCR inscritos en ensayos aleatorizados y controlados con activo (CABOSUN, METEOR), 467 pacientes con HCC inscritos en un ensayo aleatorizado y controlado con placebo (CELESTIAL), y 125 pacientes con DTC inscritos en un ensayo aleatorizado y controlado con placebo (COSMIC-311), y en combinación con nivolumab 240 mg/m2 cada 2 semanas en 320 pacientes con CCR inscritos en un ensayo aleatorizado y controlado con activo (CHECKMATE-9ER).
Debido a que los ensayos clínicos se realizan en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica.
Carcinoma de células renales
METEOR
La seguridad de CABOMETYX se evaluó en METEOR, un ensayo aleatorizado y abierto en el que 331 pacientes con carcinoma de células renales avanzado recibieron CABOMETYX 60 mg una vez al día y 322 pacientes recibieron everolimus 10 mg una vez al día hasta la progresión de la enfermedad o toxicidad inaceptable. Los pacientes de ambos brazos que tuvieron progresión de la enfermedad pudieron continuar el tratamiento a discreción del investigador [ver Estudios clínicos (14)]. La duración media del tratamiento fue de 7,6 meses (rango 0,3 – 20,5) para los pacientes que recibieron CABOMETYX y de 4,4 meses (rango 0,21 – 18,9) para los pacientes que recibieron everolimus.
Las reacciones adversas que ocurrieron en ≥ 25% de los pacientes tratados con CABOMETYX, en orden de frecuencia decreciente, fueron: diarrea, fatiga, náuseas, disminución del apetito, eritrodisestesia palmar-plantar (PPE), hipertensión, vómitos, disminución de peso y estreñimiento. Las reacciones adversas y las anormalidades de laboratorio de grado 3-4 que ocurrieron en ≥ 5% de los pacientes fueron hipertensión, diarrea, fatiga, PPE, hiponatremia, hipofosfatemia, hipomagnesemia, linfopenia, anemia, hipokalemia y aumento de GGT.
La dosis se redujo en el 60% de los pacientes que recibieron CABOMETYX y en el 24% de los pacientes que recibieron everolimus. El veinte por ciento (20%) de los pacientes recibieron CABOMETYX 20 mg una vez al día como dosis más baja. Las reacciones adversas más frecuentes que llevaron a la reducción de la dosis en pacientes tratados con CABOMETYX fueron: diarrea, PPE, fatiga e hipertensión. Las reacciones adversas que llevaron a la interrupción de la dosis ocurrieron en el 70% de los pacientes que recibieron CABOMETYX y en el 59% de los pacientes que recibieron everolimus. Las reacciones adversas llevaron a la interrupción del tratamiento del estudio en el 10% de los pacientes que recibieron CABOMETYX y en el 10% de los pacientes que recibieron everolimus. Las reacciones adversas más frecuentes que llevaron a la interrupción permanente en pacientes tratados con CABOMETYX fueron disminución del apetito (2%) y fatiga (1%).
| Reacción adversa | CABOMETYX (n=331)* |
Everolimus (n=322) |
||
|---|---|---|---|---|
| Todos los grados† |
Grados 3-4 |
Todos los grados† |
Grados 3-4 |
|
| Porcentaje (%) de pacientes | ||||
|
||||
| Gastrointestinal | ||||
| Diarrea | 74 | 11 | 28 | 2 |
| Náuseas | 50 | 4 | 28 | <1 |
| Vómitos | 32 | 2 | 14 | <1 |
| Estomatitis | 22 | 2 | 24 | 2 |
| Estreñimiento | 25 | <1 | 19 | <1 |
| Dolor abdominal‡ | 23 | 4 | 13 | 2 |
| Dispepsia | 12 | <1 | 5 | 0 |
| General | ||||
| Fatiga | 56 | 9 | 47 | 7 |
| Inflamación de la mucosa | 19 | <1 | 23 | 3 |
| Astenia | 19 | 4 | 16 | 2 |
| Metabolismo y Nutrición | ||||
| Disminución del apetito | 46 | 3 | 34 | <1 |
| Piel y Tejido Subcutáneo | ||||
| Eritrodisestesia palmar-plantar | 42 | 8 | 6 | <1 |
| Erupción cutánea§ | 23 | <1 | 43 | <1 |
| Piel seca | 11 | 0 | 10 | 0 |
| Vascular | ||||
| Hipertensión¶ | 39 | 16 | 8 | 3 |
| Investigaciones | ||||
| Pérdida de peso | 31 | 2 | 12 | 0 |
| Sistema Nervioso | ||||
| Disgeusia | 24 | 0 | 9 | 0 |
| Cefalea | 11 | <1 | 12 | <1 |
| Mareo | 11 | 0 | 7 | 0 |
| Endocrino | ||||
|---|---|---|---|---|
| Hipotiroidismo | 21 | 0 | <1 | <1 |
| Respiratorio, torácico y mediastínico | ||||
| Disfonía | 20 | <1 | 4 | 0 |
| Disnea | 19 | 3 | 29 | 4 |
| Tos | 18 | <1 | 33 | <1 |
| Sangre y sistema linfático | ||||
| Anemia | 17 | 5 | 38 | 16 |
| Musculoesquelético y tejido conjuntivo | ||||
| Dolor en extremidades | 14 | 1 | 8 | <1 |
| Espasmos musculares | 13 | 0 | 5 | 0 |
| Artralgia | 11 | <1 | 14 | 1 |
| Renal y urinario | ||||
| Proteinuria | 12 | 2 | 9 | <1 |
Otras reacciones adversas clínicamente importantes (todos los grados) que se notificaron en <10% de los pacientes tratados con CABOMETYX incluyeron: complicaciones de la herida (2%), convulsiones (<1%), pancreatitis (<1%), osteonecrosis de la mandíbula (<1%) y hepatitis colestásica (<1%).
| Anormalidad de laboratorio | CABOMETYX (n=331) |
Everolimus (n=322) |
||
|---|---|---|---|---|
| Todos los grados |
Grado 3-4 | Todos los grados |
Grado 3-4 | |
| Porcentaje (%) de pacientes | ||||
|
||||
| Química | ||||
| AST aumentada | 74 | 3 | 40 | <1 |
| ALT aumentada | 68 | 3 | 32 | <1 |
| Creatinina aumentada | 58 | <1 | 71 | 0 |
| Triglicéridos aumentados | 53 | 4 | 73 | 13 |
| Hipofosfatemia | 48 | 8 | 36 | 5 |
| Hiperglucemia | 37 | 2 | 59 | 8 |
| Hipoalbuminemia | 36 | 2 | 28 | <1 |
| ALP aumentada | 35 | 2 | 29 | 1 |
| Hipomagnesemia | 31 | 7 | 4 | <1 |
| Hiponatremia | 30 | 8 | 26 | 6 |
| GGT aumentada | 27 | 5 | 43 | 9 |
| Hematología | ||||
| Leucopenia | 35 | <1 | 31 | <1 |
| Neutropenia | 31 | 2 | 17 | <1 |
| Anemia* | 31 | 4 | 71 | 17 |
| Linfopenia | 25 | 7 | 39 | 12 |
| Trombocitopenia | 25 | <1 | 27 | <1 |
| ALP, fosfatasa alcalina; ALT, alanina aminotransferasa; AST, aspartato aminotransferasa; GGT, gamma-glutamil transferasa. | ||||
| NCI CTCAE, Versión 4.0 | ||||
CABOSUN
La seguridad de CABOMETYX se evaluó en CABOSUN, un ensayo aleatorizado, abierto en pacientes con carcinoma de células renales avanzado, en el que 78 pacientes recibieron CABOMETYX 60 mg una vez al día y 72 pacientes recibieron sunitinib 50 mg una vez al día (4 semanas de tratamiento seguidas de 2 semanas de descanso), hasta la progresión de la enfermedad o toxicidad inaceptable [ver Estudios Clínicos (14.1)]. La duración media del tratamiento fue de 6,5 meses (rango 0,2 – 28,7) para los pacientes que recibieron CABOMETYX y de 3,1 meses (rango 0,2 – 25,5) para los pacientes que recibieron sunitinib.
Dentro de los 30 días posteriores al tratamiento, hubo 4 muertes en pacientes tratados con CABOMETYX y 6 muertes en pacientes tratados con sunitinib. De los 4 pacientes tratados con CABOMETYX, 2 pacientes murieron debido a perforación gastrointestinal, 1 paciente presentó insuficiencia renal aguda y 1 paciente murió debido a deterioro clínico. Todas las reacciones adversas de Grado 3-4 se recogieron en toda la población de seguridad. Las reacciones adversas de Grado 3-4 más frecuentes (≥5%) en pacientes tratados con CABOMETYX fueron hipertensión, diarrea, hiponatremia, hipofosfatemia, PPE, fatiga, aumento de ALT, disminución del apetito, estomatitis, dolor, hipotensión y síncope.
La dosis diaria media fue de 50,3 mg para CABOMETYX y de 44,7 mg para sunitinib (excluyendo los días sin dosificación de sunitinib programados). La dosis se redujo en el 46% de los pacientes que recibieron CABOMETYX y en el 35% de los pacientes que recibieron sunitinib. La dosis se suspendió en el 73% de los pacientes que recibieron CABOMETYX y en el 71% de los pacientes que recibieron sunitinib. Según la situación del paciente, el 21% de los pacientes que recibieron CABOMETYX y el 22% de los pacientes que recibieron sunitinib interrumpieron el tratamiento debido a una reacción adversa.
| Reacción adversa | CABOMETYX (n = 78) |
Sunitinib (n = 72) |
|---|---|---|
| Grado 3-4* | Grado 3-4* | |
| Porcentaje (%) de pacientes | ||
| Pacientes con cualquier reacción adversa de Grado 3-4 | 68 | 65 |
| Gastrointestinal | ||
| Diarrea | 10 | 11 |
| Estomatitis | 5 | 6 |
| Náuseas | 3 | 4 |
| Vómitos | 1 | 3 |
| Estreñimiento | 1 | 0 |
| General | ||
| Fatiga | 6 | 17 |
| Dolor | 5 | 0 |
| Metabolismo y Nutrición | ||
| Hiponatremia† | 9 | 8 |
| Hipofosfatemia† | 9 | 7 |
| Disminución del apetito | 5 | 1 |
| Deshidratación | 4 | 1 |
| Hipocalcemia† | 3 | 0 |
| Hipomagnesemia† | 3 | 0 |
| Hipokalemia† | 1 | 3 |
| Piel y Tejido Subcutáneo | ||
| Eritrodisestesia palmar-plantar | 8 | 4 |
| Úlcera cutánea | 3 | 0 |
| Vascular | ||
|---|---|---|
| Hipertensión‡ | 28 | 21 |
| Hipotensión | 5 | 1 |
| Angiopatía | 1 | 1 |
| Pruebas de laboratorio | ||
| ALT elevada† | 5 | 0 |
| Pérdida de peso | 4 | 0 |
| AST elevada† | 3 | 3 |
| Creatinina en sangre elevada† | 3 | 3 |
| Linfopenia† | 1 | 6 |
| Trombocitopenia† | 1 | 11 |
| Sistema nervioso | ||
| Síncope | 5 | 0 |
| Respiratorio, torácico y mediastínico | ||
| Disnea | 1 | 6 |
| Disfonía | 1 | 0 |
| Sangre y sistema linfático | ||
| Anemia | 1 | 3 |
| Psiquiátrico | ||
| Depresión | 4 | 0 |
| Estado confusional | 1 | 1 |
| Infecciones | ||
| Infección pulmonar | 4 | 0 |
| Musculoesquelético y tejido conjuntivo | ||
| Dolor de espalda | 4 | 0 |
| Dolor óseo | 3 | 1 |
| Dolor en extremidades | 3 | 0 |
| Artralgia | 1 | 0 |
| Renal y urinario | ||
| Insuficiencia renal aguda | 4 | 1 |
| Proteinuria | 3 | 1 |
| ALT, alanina aminotransferasa; AST, aspartato aminotransferasa | ||
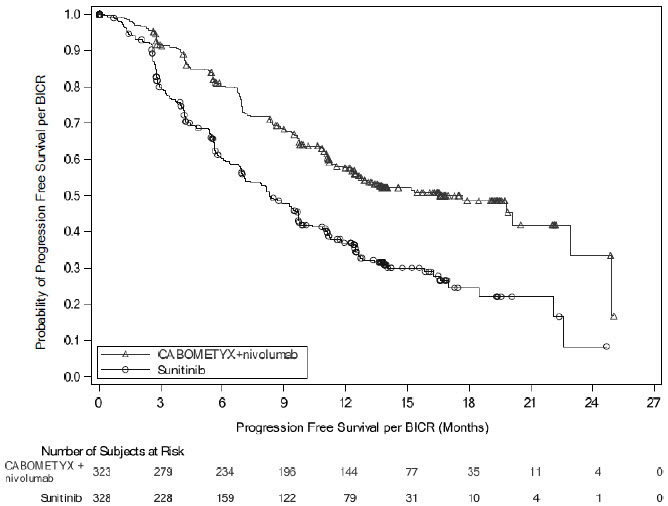
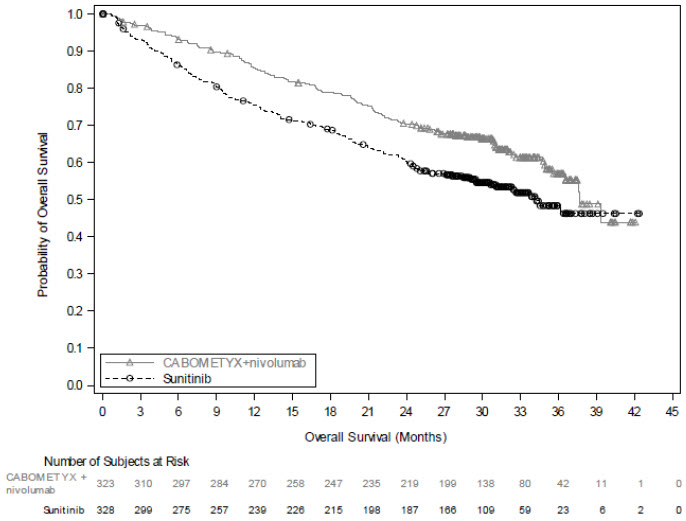
CHECKMATE-9ER
La seguridad de CABOMETYX con nivolumab se evaluó en CHECKMATE-9ER, un estudio aleatorizado, abierto en pacientes con CCR avanzado previamente no tratado [ver Estudios Clínicos (14.1)]. Los pacientes recibieron CABOMETYX 40 mg por vía oral una vez al día con nivolumab 240 mg durante 30 minutos cada 2 semanas (n=320) o sunitinib 50 mg diarios, administrado por vía oral durante 4 semanas en tratamiento seguidas de 2 semanas de descanso (n=320) [ver Estudios Clínicos (14.1)]. CABOMETYX podría interrumpirse o reducirse a 20 mg diarios o 20 mg cada dos días. La duración media del tratamiento fue de 14 meses (rango: 0,2 a 27 meses) en pacientes tratados con CABOMETYX y nivolumab. En este ensayo, el 82% de los pacientes del brazo de CABOMETYX y nivolumab estuvieron expuestos al tratamiento durante >6 meses y el 60% de los pacientes estuvieron expuestos al tratamiento durante >1 año.
Se produjeron reacciones adversas graves en el 48% de los pacientes que recibieron CABOMETYX y nivolumab. Las reacciones adversas graves más frecuentes (≥2%) fueron diarrea, neumonía, neumonitis, embolia pulmonar, infección del tracto urinario e hiponatremia. Se produjeron perforaciones intestinales fatales en 3 (0,9%) pacientes.
Las reacciones adversas que llevaron a la interrupción de CABOMETYX o nivolumab se produjeron en el 20% de los pacientes: 8% solo CABOMETYX, 7% solo nivolumab y 6% ambos fármacos debido a la misma reacción adversa al mismo tiempo. Las reacciones adversas que llevaron a la interrupción o reducción de la dosis de CABOMETYX o nivolumab se produjeron en el 83% de los pacientes: 46% solo CABOMETYX, 3% solo nivolumab y 21% ambos fármacos debido a la misma reacción adversa al mismo tiempo, y 6% ambos fármacos secuencialmente.
Las reacciones adversas más comunes notificadas en ≥20% de los pacientes tratados con CABOMETYX y nivolumab fueron diarrea, fatiga, hepatotoxicidad, PPE, estomatitis, erupción cutánea, hipertensión, hipotiroidismo, dolor musculoesquelético, disminución del apetito, náuseas, disgeusia, dolor abdominal, tos e infección del tracto respiratorio superior.
| Reacción adversa | CABOMETYX y Nivolumab (n=320) |
Sunitinib (n=320) |
||
|---|---|---|---|---|
| Grados 1-4 | Grados 3-4 | Grados 1-4 | Grados 3-4 | |
| Porcentaje (%) de pacientes | ||||
|
||||
| Gastrointestinal | ||||
| Diarrea | 64 | 7 | 47 | 4.4 |
| Náuseas | 27 | 0.6 | 31 | 0.3 |
| Dolor abdominal* | 22 | 1.9 | 15 | 0.3 |
| Vómitos | 17 | 1.9 | 21 | 0.3 |
| Dispepsia† | 15 | 0 | 22 | 0.3 |
| General | ||||
| Fatiga‡ | 51 | 8 | 50 | 8 |
| Hepatobiliar | ||||
|---|---|---|---|---|
| Hepatotoxicidad§ | 44 | 11 | 26 | 5 |
| Piel y tejido subcutáneo | ||||
| Eritrodisestesia palmar-plantar | 40 | 8 | 41 | 8 |
| Estomatitis¶ | 37 | 3.4 | 46 | 4.4 |
| Erupción# | 36 | 3.1 | 14 | 0 |
| Prurito | 19 | 0.3 | 4.4 | 0 |
| Vascular | ||||
| HipertensiónÞ | 36 | 13 | 39 | 14 |
| Endocrino | ||||
| Hipotiroidismoß | 34 | 0.3 | 30 | 0.3 |
| Musculoesquelético y tejido conectivo | ||||
| Dolor musculoesqueléticoà | 33 | 3.8 | 29 | 3.1 |
| Artralgia | 18 | 0.3 | 9 | 0.3 |
| Metabolismo y nutrición | ||||
| Disminución del apetito | 28 | 1.9 | 20 | 1.3 |
| Trastornos del sistema nervioso | ||||
| Disgeusia | 24 | 0 | 22 | 0 |
| Cefalea | 16 | 0 | 12 | 0.6 |
| Respiratorio, torácico y mediastínico | ||||
| Tosè | 20 | 0.3 | 17 | 0 |
| Disfonía | 17 | 0.3 | 3.4 | 0 |
| Infecciones e infestaciones | ||||
| Infección de las vías respiratorias altasð | 20 | 0.3 | 8 | 0.3 |
| La toxicidad se clasificó según NCI CTCAE v4. | ||||
| Anormalidad de laboratorio | CABOMETYX y Nivolumab |
Sunitinib | ||
|---|---|---|---|---|
| Grados 1-4 | Grados 3-4 | Grados 1-4 | Grados 3-4 | |
| Porcentaje (%) de pacientes | ||||
|
||||
| Química | ||||
| ALT aumentada | 79 | 9.8 | 39 | 3.5 |
| AST aumentada | 77 | 7.9 | 57 | 2.6 |
| Hipofosfatemia | 69 | 28 | 48 | 10 |
| Hipocalcemia | 54 | 1.9 | 24 | 0.6 |
| Hipomagnesemia | 47 | 1.3 | 25 | 0.3 |
| Hiperglucemia | 44 | 3.5 | 44 | 1.7 |
| Hiponatremia | 43 | 11 | 36 | 12 |
| Lipasa aumentada | 41 | 14 | 38 | 13 |
| Amilasa aumentada | 41 | 10 | 28 | 6 |
| Fosfatasa alcalina aumentada | 41 | 2.8 | 37 | 1.6 |
| Creatinina aumentada | 39 | 1.3 | 42 | 0.6 |
| Hiperkalemia | 35 | 4.7 | 27 | 1 |
| Hipoglucemia | 26 | 0.8 | 14 | 0.4 |
| Hematología | ||||
| Linfopenia | 42 | 6.6 | 45 | 10 |
| Trombocitopenia | 41 | 0.3 | 70 | 9.7 |
| Anemia | 37 | 2.5 | 61 | 4.8 |
| Leucopenia | 37 | 0.3 | 66 | 5.1 |
| Neutropenia | 35 | 3.2 | 67 | 12 |
Carcinoma hepatocelular
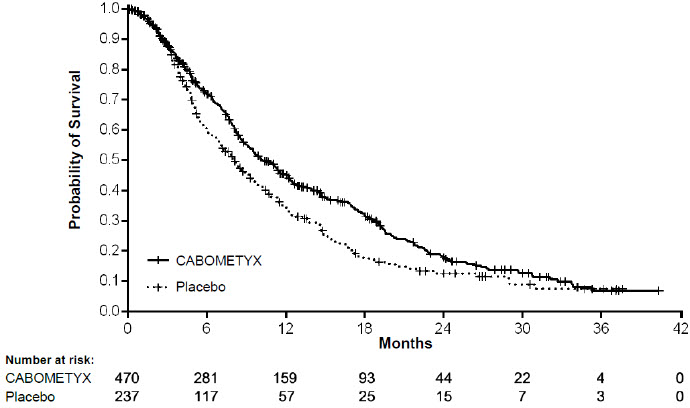
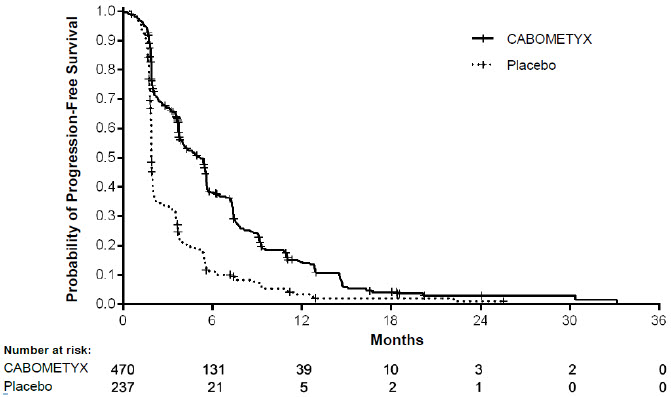
La seguridad de CABOMETYX se evaluó en CELESTIAL, un ensayo aleatorizado, doble ciego, controlado con placebo en el que 704 pacientes con carcinoma hepatocelular avanzado fueron aleatorizados para recibir CABOMETYX 60 mg por vía oral una vez al día (n=467) o placebo (n=237) hasta la progresión de la enfermedad o toxicidad inaceptable [ver Estudios Clínicos (14.2)]. La duración media del tratamiento fue de 3,8 meses (rango 0,1 – 37,3) para los pacientes que recibieron CABOMETYX y de 2,0 meses (rango 0,0 – 27,2) para los pacientes que recibieron placebo. La población expuesta a CABOMETYX fue 81% masculina, 56% blanca y tenía una mediana de edad de 64 años.
Las reacciones adversas que ocurrieron en ≥ 25% de los pacientes tratados con CABOMETYX, en orden de frecuencia decreciente fueron: diarrea, disminución del apetito, PPE, fatiga, náuseas, hipertensión y vómitos. Las reacciones adversas de grado 3-4 que ocurrieron en ≥ 5% de los pacientes fueron PPE, hipertensión, fatiga, diarrea, astenia y disminución del apetito. Hubo 6 reacciones adversas que provocaron la muerte en pacientes que recibieron CABOMETYX (insuficiencia hepática, síndrome hepatorenal, fístula esofagogástrica, trombosis de la vena porta, embolia pulmonar, hemorragia gastrointestinal superior).
La dosis diaria media fue de 35,8 mg para CABOMETYX. La dosis se redujo en el 62% de los pacientes que recibieron CABOMETYX; el 33% de los pacientes requirieron una reducción a 20 mg diarios. Las reacciones adversas o anomalías de laboratorio más frecuentes que llevaron a la reducción de la dosis de CABOMETYX fueron: PPE, diarrea, fatiga, hipertensión y aumento de AST. Las reacciones adversas que llevaron a la interrupción de la dosis ocurrieron en el 84% de los pacientes que recibieron CABOMETYX. Las reacciones adversas que llevaron a la interrupción permanente de CABOMETYX ocurrieron en el 16% de los pacientes. Las reacciones adversas más frecuentes que llevaron a la interrupción permanente de CABOMETYX fueron PPE (2%), fatiga (2%), disminución del apetito (1%), diarrea (1%) y náuseas (1%).
| Reacción adversa | CABOMETYX (n=467) |
Placebo (n=237) |
||
|---|---|---|---|---|
| Todos los grados† | Grado 3-4 | Todos los grados† | Grado 3-4 | |
| Porcentaje (%) de pacientes | ||||
|
||||
| Gastrointestinal | ||||
| Diarrea | 54 | 10 | 19 | 2 |
| Náuseas | 31 | 2 | 18 | 2 |
| Vómitos | 26 | <1 | 12 | 3 |
| Estomatitis | 13 | 2 | 2 | 0 |
| Dispepsia | 10 | 0 | 3 | 0 |
| General | ||||
| Fatiga | 45 | 10 | 30 | 4 |
| Astenia | 22 | 7 | 8 | 2 |
| Inflamación de la mucosa | 14 | 2 | 2 | <1 |
| Metabolismo y Nutrición | ||||
| Disminución del apetito | 48 | 6 | 18 | <1 |
| Piel y Tejido Subcutáneo | ||||
| Eritrodisestesia palmar-plantar | 46 | 17 | 5 | 0 |
| Erupción cutánea‡ | 21 | 2 | 9 | <1 |
| Vascular | ||||
| Hipertensión§ | 30 | 16 | 6 | 2 |
| Investigaciones | ||||
| Pérdida de peso | 17 | 1 | 6 | 0 |
| Sistema Nervioso | ||||
| Disgeusia | 12 | 0 | 2 | 0 |
| Endocrino | ||||
| Hipotiroidismo | 8 | <1 | <1 | 0 |
| Respiratorio, Torácico y Mediastinico | ||||
| Disfonía | 19 | 1 | 2 | 0 |
| Disnea | 12 | 3 | 10 | <1 |
| Musculoesquelético y Tejido Conectivo | ||||
| Dolor en extremidades | 9 | <1 | 4 | 1 |
| Espasmos musculares | 8 | <1 | 2 | 0 |
| Anormalidad de laboratorio | CABOMETYX (n=467) |
Placebo (n=237) |
||
|---|---|---|---|---|
| Todos los grados | Grado 3-4 | Todos los grados | Grado 3-4 | |
| Porcentaje (%) de pacientes | ||||
|
||||
| Química | ||||
| LDH aumentada | 84 | 9 | 29 | 2 |
| ALT aumentada | 73 | 12 | 37 | 6 |
| AST aumentada | 73 | 24 | 46 | 19 |
| Hipoalbuminemia | 51 | 1 | 32 | 1 |
| ALP aumentada | 43 | 8 | 38 | 6 |
| Hipofosfatemia | 25 | 9 | 8 | 4 |
| Hipokalemia | 23 | 6 | 6 | 1 |
| Hipomagnesemia | 22 | 3 | 3 | 0 |
| Amilasa aumentada | 16 | 2 | 9 | 2 |
| Hipocalcemia | 8 | 2 | 0 | 0 |
| Hematología | ||||
| Disminución de plaquetas | 54 | 10 | 16 | 1 |
| Neutropenia | 43 | 7 | 8 | 1 |
| Hemoglobina aumentada | 8 | 0 | 1 | 0 |
| ALP, fosfatasa alcalina; ALT, alanina aminotransferasa; AST, aspartato aminotransferasa; LDH, lactato deshidrogenasa sanguínea | ||||
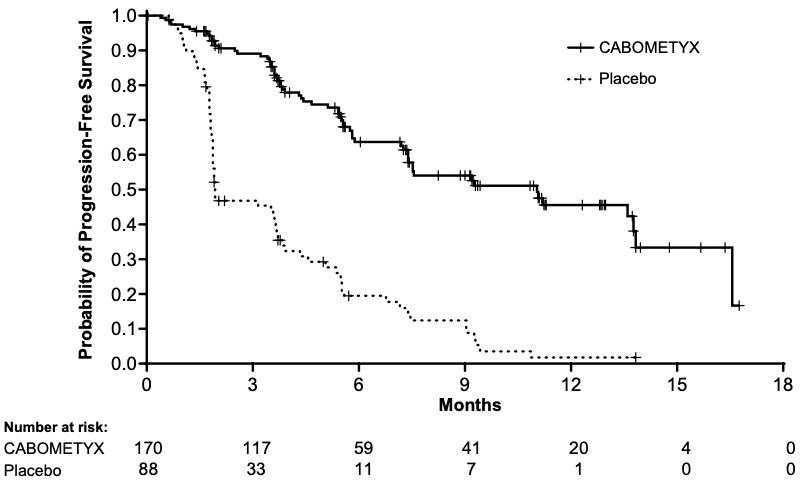
Cáncer de tiroides diferenciado
La seguridad de CABOMETYX se evaluó en COSMIC-311, un ensayo aleatorizado, doble ciego, controlado con placebo en el que 187 pacientes con cáncer de tiroides diferenciado avanzado fueron aleatorizados para recibir CABOMETYX 60 mg por vía oral una vez al día (n=125) o placebo (n=62) con atención de apoyo hasta la progresión de la enfermedad o toxicidad inaceptable [ver Estudios clínicos (14.3)]. En el momento del análisis de eficacia primaria, la duración media del tratamiento fue de 4,4 meses (rango 0,0 – 15,7) para los pacientes que recibieron CABOMETYX y de 2,3 meses (rango 0,3 – 11,6) para los pacientes que recibieron placebo. La mediana de edad fue de 66 años (rango de 32 a 85 años), el 55% eran mujeres, el 70% eran blancos, el 18% eran asiáticos, el 2% eran negros, el 2% eran amerindios o nativos de Alaska, y el 63% recibieron lenvatinib previamente.
Las reacciones adversas que ocurrieron en ≥ 25% de los pacientes tratados con CABOMETYX, en orden de frecuencia decreciente fueron: diarrea, PPE, fatiga, hipertensión y estomatitis. Las reacciones adversas de grado 3-4 que ocurrieron en ≥ 5% de los pacientes fueron PPE, hipertensión, fatiga, diarrea y estomatitis. Se produjeron reacciones adversas graves en el 34% de los pacientes que recibieron CABOMETYX. Las reacciones adversas graves en ≥2% incluyeron diarrea, derrame pleural, embolia pulmonar y disnea. Se produjeron reacciones adversas mortales en el 1,6% de los pacientes del brazo de CABOMETYX, incluyendo hemorragia arterial (0,8%) y embolia pulmonar (0,8%).
La dosis diaria media mediana fue de 42,0 mg para CABOMETYX. La dosis se redujo en el 56% de los pacientes que recibieron CABOMETYX; el 22% de los pacientes requirieron una segunda reducción de la dosis. Las reacciones adversas más frecuentes (≥5%) que llevaron a la reducción de la dosis de CABOMETYX fueron PPE, diarrea, fatiga, proteinuria y disminución del apetito. Se produjeron interrupciones de la dosis en el 72% de los pacientes que recibieron CABOMETYX. Las reacciones adversas que requirieron la interrupción de la dosis en ≥5% de los pacientes fueron PPE, diarrea, disnea, hipertensión, disminución del apetito y proteinuria. Las reacciones adversas que llevaron a la interrupción permanente de CABOMETYX ocurrieron en el 5% de los pacientes.
| Reacción adversa | CABOMETYX (N=125) |
Placebo (N=62) |
||
|---|---|---|---|---|
| Todos los grados† | Grado 3-4 | Todos los grados† | Grado 3-4 | |
| Porcentaje de pacientes | ||||
|
||||
| Gastrointestinal | ||||
| Diarrea | 51 | 7 | 3 | 0 |
| Náuseas | 24 | 3 | 2 | 0 |
| Vómitos | 14 | 1 | 8 | 0 |
| Estomatitis‡ | 26 | 5 | 3 | 0 |
| Boca seca | 10 | 1 | 2 | 0 |
| General | ||||
| Fatiga§ | 42 | 10 | 23 | 0 |
| Metabolismo y nutrición | ||||
| Disminución del apetito | 23 | 3 | 16 | 0 |
| Piel y tejido subcutáneo | ||||
| Eritrodisestesia palmar-plantar | 46 | 10 | 0 | 0 |
| Vascular | ||||
| Hipertensión¶ | 30 | 10 | 5 | 3 |
| Exploraciones complementarias | ||||
| Pérdida de peso | 18 | 1 | 5 | 0 |
| Sistema nervioso | ||||
| Disgeusia | 10 | 0 | 0 | 0 |
| Cefalea | 10 | 2 | 2 | 0 |
| Respiratorio, torácico y mediastínico | ||||
| Disfonía | 10 | 0 | 2 | 0 |
| Embolia pulmonar | 5 | 2 | 0 | 0 |
| Renal y urinario | ||||
| Proteinuria | 15 | 1 | 3 | 0 |
| Anormalidad de laboratorio | CABOMETYX (N=125) |
Placebo (N=62) |
||
|---|---|---|---|---|
| Todos los grados | Grado 3-4 | Todos los grados | Grado 3-4 | |
| Porcentaje de pacientes | ||||
|
||||
| Química | ||||
| LDH aumentada† | 90 | 10 | 32 | 3 |
| AST aumentada | 77 | 1 | 18 | 0 |
| ALT aumentada | 66 | 2 | 11 | 0 |
| Hipocalcemia | 36 | 9 | 10 | 2 |
| ALP aumentada | 34 | 0 | 15 | 0 |
| GGT aumentada | 26 | 2 | 21 | 2 |
| Hipomagnesemia | 25 | 2 | 5 | 0 |
| Hipoalbuminemia | 19 | 1 | 7 | 0 |
| Hipokalemia | 18 | 1 | 3 | 0 |
| Hiponatremia | 15 | 0 | 10 | 2 |
| Hiperbilirrubinemia | 12 | 0 | 5 | 0 |
| Hematología | ||||
| Leucocitos disminuidos | 38 | 2 | 7 | 2 |
| Neutrófilos disminuidos | 31 | 2 | 5 | 2 |
| Plaquetas disminuidas | 26 | 0 | 5 | 0 |
| ALP, fosfatasa alcalina; ALT, alanina aminotransferasa; AST, aspartato aminotransferasa; GGT, gamma-glutamil transferasa; LDH, lactato deshidrogenasa | ||||
6.2 Experiencia Postcomercialización
Las siguientes reacciones adversas se han identificado durante el uso post-aprobación de CABOMETYX. Debido a que estas reacciones se notifican voluntariamente a partir de una población de tamaño incierto, no siempre es posible estimar su frecuencia de manera fiable o establecer una relación causal con la exposición al fármaco.
Trastornos vasculares: Aneurisma arterial (incluyendo aórtico), disecciones y rotura
7 INTERACCIONES MEDICAMENTOSAS
7.1 Efectos de otros medicamentos sobre CABOMETYX
Inhibidores potentes del CYP3A4
La administración conjunta de una formulación en cápsula de cabozantinib con un inhibidor potente del CYP3A4 aumentó la exposición a cabozantinib, lo que puede aumentar el riesgo de reacciones adversas relacionadas con la exposición [ver Farmacología clínica (12.3)]. Evite la administración conjunta de CABOMETYX con inhibidores potentes del CYP3A4. Reduzca la dosis de CABOMETYX si no se puede evitar la administración conjunta con inhibidores potentes del CYP3A4 [ver Posología y administración (2.6)]. Evite el pomelo o el zumo de pomelo, que también pueden aumentar la exposición a cabozantinib.
Inductores potentes del CYP3A
La administración conjunta de una formulación en cápsula de cabozantinib con un inductor potente del CYP3A4 disminuyó la exposición a cabozantinib, lo que puede reducir la eficacia [ver Farmacología clínica (12.3)]. Evite la administración conjunta de CABOMETYX con inductores potentes del CYP3A4. Aumente la dosis de CABOMETYX si no se puede evitar la administración conjunta con inductores potentes del CYP3A4 [ver Posología y administración (2.7)]. Evite el hipérico, que también puede disminuir la exposición a cabozantinib.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgo
Basándose en los hallazgos de estudios en animales y en su mecanismo de acción [ver Farmacología Clínica (12.1)], CABOMETYX puede causar daño fetal cuando se administra a una mujer embarazada. No hay datos disponibles en mujeres embarazadas para informar sobre el riesgo asociado al fármaco. En estudios de toxicología del desarrollo y la reproducción en animales, la administración de cabozantinib a ratas y conejas embarazadas durante la organogénesis provocó letalidad embriofetal y anomalías estructurales a exposiciones inferiores a las que se producen clínicamente a la dosis recomendada (ver Datos). Se debe advertir a las mujeres embarazadas sobre el riesgo potencial para el feto.
En la población general de EE. UU., el riesgo estimado de fondo de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2-4 % y del 15-20 %, respectivamente.
Datos en animales
En un estudio de desarrollo embriofetal en ratas embarazadas, la administración oral diaria de cabozantinib durante toda la organogénesis provocó un aumento de la letalidad embriofetal en comparación con los controles a una dosis de 0,03 mg/kg (aproximadamente 0,12 veces el área bajo la curva [AUC] humana a la dosis recomendada). Los hallazgos incluyeron retraso en la osificación y variaciones esqueléticas a una dosis de 0,01 mg/kg/día (aproximadamente 0,04 veces el AUC humano a la dosis recomendada).
En conejas embarazadas, la administración oral diaria de cabozantinib durante toda la organogénesis dio lugar a hallazgos de malformaciones y variaciones viscerales, incluida la reducción del tamaño del bazo y la ausencia de lóbulo pulmonar a 3 mg/kg (aproximadamente 1,1 veces el AUC humano a la dosis recomendada).
En un estudio pre y postnatal en ratas, se administró cabozantinib por vía oral desde el día 10 de gestación hasta el día 20 postnatal. El cabozantinib no produjo toxicidad materna adversa ni afectó al embarazo, el parto o la lactancia de las ratas hembra, y no afectó a la supervivencia, el crecimiento o el desarrollo postnatal de la descendencia a dosis de hasta 0,3 mg/kg/día (0,05 veces la dosis clínica máxima recomendada).
8.2 Lactancia
Resumen de Riesgo
No hay información sobre la presencia de cabozantinib o sus metabolitos en la leche materna, ni sobre sus efectos en el niño amamantado o en la producción de leche. Debido a la posibilidad de reacciones adversas graves en los niños amamantados, se debe aconsejar a las mujeres que no den el pecho durante el tratamiento con CABOMETYX y durante 4 meses después de la dosis final.
8.3 Mujeres y hombres en edad fértil
Prueba de embarazo
Verificar el estado de embarazo de las mujeres en edad fértil antes de iniciar el tratamiento con CABOMETYX [ver Uso en poblaciones específicas (8.1)].
Anticoncepción
CABOMETYX puede causar daño fetal cuando se administra a una mujer embarazada [ver Uso en poblaciones específicas (8.1)].
Mujeres
Se debe aconsejar a las mujeres en edad fértil que utilicen un método anticonceptivo eficaz durante el tratamiento con CABOMETYX y durante 4 meses después de la dosis final.
Infertilidad
Mujeres y hombres
Basándose en los hallazgos en animales, CABOMETYX puede afectar a la fertilidad en mujeres y hombres en edad fértil [ver Toxicología no clínica (13.1)].
8.4 Uso pediátrico
La seguridad y eficacia de CABOMETYX para el tratamiento del cáncer de tiroides diferenciado (CTD) se han establecido en pacientes pediátricos de 12 años o más.
El uso de CABOMETYX en pacientes pediátricos de 12 años o más con CTD se apoya en la evidencia de estudios adecuados y bien controlados de CABOMETYX en adultos, con datos farmacocinéticos poblacionales adicionales que demuestran que la exposición a cabozantinib se encuentra dentro del mismo rango entre adultos y pacientes pediátricos de 12 años o más a las dosis recomendadas [ver Dosis y administración (2.5), Reacciones adversas (6.1), Farmacología clínica (12.3) y Estudios clínicos (14.3)].
Se ha observado un ensanchamiento de la fisis en niños con placas de crecimiento abiertas cuando se les trata con CABOMETYX. Basándose en los datos limitados disponibles sobre los efectos de CABOMETYX en el crecimiento longitudinal, se recomienda la monitorización del crecimiento de la fisis y el crecimiento longitudinal en niños con placas de crecimiento abiertas.
No se ha establecido la seguridad y eficacia de CABOMETYX en pacientes pediátricos menores de 12 años.
Datos de toxicidad en animales jóvenes
Se administró cabozantinib a ratas jóvenes a dosis de 1 o 2 mg/kg/día desde el día postnatal 12 (comparable a menos de 2 años en humanos) hasta el día postnatal 35 o 70. Se produjeron muertes a dosis ≥1 mg/kg/día (aproximadamente 0,16 veces la dosis clínica de 60 mg/día basada en el área de superficie corporal). Se observó hipoactividad a ambas dosis probadas en el día postnatal 22. Los objetivos fueron generalmente similares a los observados en animales adultos, se produjeron a ambas dosis e incluyeron el riñón (nefropatía, glomerulonefritis), órganos reproductivos, tracto gastrointestinal (dilatación quística e hiperplasia en la glándula de Brunner e inflamación del duodeno; e hiperplasia epitelial del colon y ciego), médula ósea (hipocelularidad y depleción linfoide) e hígado. También se produjeron anomalías y blanqueamiento dentales, así como efectos en los huesos, incluyendo una reducción del contenido y la densidad mineral ósea, hipertrofia de la fisis y disminución del hueso cortical a todos los niveles de dosis. No se evaluó la recuperación a una dosis de 2 mg/kg (aproximadamente 0,32 veces la dosis clínica de 60 mg basada en el área de superficie corporal) debido a los altos niveles de mortalidad. A la dosis baja, los efectos sobre los parámetros óseos se resolvieron parcialmente, pero los efectos sobre el riñón y el epidídimo/testículo persistieron después de que cesó el tratamiento.
8.5 Uso en pacientes geriátricos
En los estudios CABOSUN y METEOR, el 41 % de los 409 pacientes tratados con CABOMETYX tenían 65 años o más, y el 8 % tenían 75 años o más. En el estudio CELESTIAL, el 49 % de los 467 pacientes tratados con CABOMETYX tenían 65 años o más, y el 15 % tenían 75 años o más [ver Estudios clínicos (14)].
No se observaron diferencias generales en la seguridad o la eficacia entre estos pacientes y los pacientes más jóvenes.
De los 320 pacientes aleatorizados a CABOMETYX administrado con nivolumab en CHECKMATE-9ER, el 41 % tenía 65 años o más y el 9 % tenía 75 años o más. No se informó ninguna diferencia general en la seguridad entre los pacientes de edad avanzada y los pacientes más jóvenes.
8.6 Insuficiencia hepática
Se ha observado un aumento de la exposición a cabozantinib en pacientes con insuficiencia hepática moderada (Child-Pugh B). Reduzca la dosis de CABOMETYX en pacientes con insuficiencia hepática moderada. Evite el uso de CABOMETYX en pacientes con insuficiencia hepática grave (Child-Pugh C), ya que no se ha estudiado en esta población [ver Posología y administración (2.8), Farmacología clínica (12.3)].
8.7 Insuficiencia renal
No se recomienda ningún ajuste de dosis en pacientes con insuficiencia renal leve o moderada. No hay experiencia con CABOMETYX en pacientes con insuficiencia renal grave [ver Farmacología clínica (12.3)].
10 SOBREDOSIS
Se notificó un caso de sobredosis tras la administración de otra formulación de cabozantinib; un paciente tomó inadvertidamente el doble de la dosis prevista durante 9 días. El paciente sufrió deterioro de la memoria de grado 3, cambios en el estado mental de grado 3, trastorno cognitivo de grado 3, pérdida de peso de grado 2 y aumento de BUN de grado 1. No se documentó el grado de recuperación.
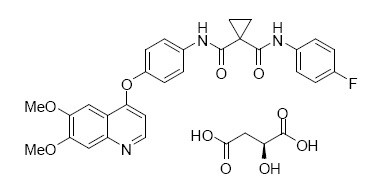
11 DESCRIPCIÓN
CABOMETYX es la sal (S)-malato de cabozantinib, un inhibidor de la quinasa. El (S)-malato de cabozantinib se describe químicamente como N-(4-(6,7-dimetoxichinolin-4-iloxi)fenil)-N’-(4-fluorofenil)ciclopropano-1,1-dicarboxamida, (2S)-hidroxibutanodioato. La fórmula molecular es C28H24FN3O5•C4H6O5 y el peso molecular es de 635.6 Daltons como sal de malato. La estructura química de la sal (S)-malato de cabozantinib es:
La sal (S)-malato de Cabozantinib es un sólido de blanco a blanquecino que es prácticamente insoluble en medios acuosos.
Los comprimidos de CABOMETYX (cabozantinib) para uso oral se suministran como comprimidos recubiertos con película que contienen 20 mg, 40 mg o 60 mg de cabozantinib, lo que equivale a 25 mg, 51 mg o 76 mg de (S)-malato de cabozantinib, respectivamente. CABOMETYX también contiene los siguientes ingredientes inactivos: celulosa microcristalina, lactosa anhidra, hidroxipropilcelulosa, croscarmelosa sódica, dióxido de silicio coloidal y estearato de magnesio.
El recubrimiento de la película contiene hipromelosa, dióxido de titanio, triacetina y óxido de hierro amarillo.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Los ensayos bioquímicos y/o celulares in vitro han demostrado que el cabozantinib inhibe la actividad de la tirosina quinasa de MET, VEGFR-1, -2 y -3, AXL, RET, ROS1, TYRO3, MER, KIT, TRKB, FLT-3 y TIE-2. Estas tirosina quinasas receptoras están implicadas tanto en la función celular normal como en procesos patológicos como la oncogenia, metástasis, angiogénesis tumoral, resistencia a fármacos y mantenimiento del microentorno tumoral.
12.2 Farmacodinamia
Se desconoce la relación exposición-respuesta o exposición-seguridad para el cabozantinib.
Electrofisiología cardíaca
El efecto del cabozantinib sobre el intervalo QTc se evaluó en un ensayo aleatorizado, doble ciego, controlado con placebo en pacientes con cáncer medular de tiroides a los que se administró una formulación en cápsula de cabozantinib. Se observó un aumento medio en el QTcF de 10-15 ms a las 4 semanas después del inicio del tratamiento. No se pudo establecer definitivamente una relación concentración-QTc. No se observaron cambios en la morfología de la onda cardíaca ni nuevos ritmos. Ningún paciente de este estudio tuvo un QTcF confirmado > 500 ms, ni tampoco ningún paciente en METEOR, CABOSUN, CELESTIAL, CHECKMATE-9ER o COSMIC-311.
12.3 Farmacocinética
La administración diaria repetida de una formulación en cápsula de cabozantinib durante 19 días dio como resultado una acumulación media de cabozantinib de 4 a 5 veces (basada en el AUC) en comparación con la administración de una dosis única; el estado estacionario se alcanzó en el día 15.
Absorción
El tiempo medio hasta alcanzar las concentraciones máximas de cabozantinib (Tmax) osciló entre 3 y 4 horas después de la administración de la dosis. Se observó un aumento del 19% en la Cmax de CABOMETYX en comparación con una formulación en cápsula de cabozantinib después de una dosis única de 140 mg. Se observó una diferencia inferior al 10% en el AUC entre CABOMETYX y una formulación en cápsula de cabozantinib [véase Posología y administración (2.1)].
Efecto de los alimentos
La Cmax y el AUC del cabozantinib aumentaron en un 41% y un 57%, respectivamente, después de una comida rica en grasas en relación con las condiciones en ayunas en sujetos sanos a los que se administró una dosis oral única de una formulación en cápsula de cabozantinib.
Distribución
El volumen de distribución oral (Vz/F) del cabozantinib es de aproximadamente 319 L. El cabozantinib se une en gran medida a las proteínas del plasma humano (≥ 99,7%).
Eliminación
La semivida terminal predicha es de aproximadamente 99 horas y el aclaramiento (CL/F) en estado estacionario se estima en 2,2 L/hora.
Metabolismo
El cabozantinib es un sustrato del CYP3A4 in vitro.
Excreción
Aproximadamente el 81% de la radiactividad total administrada se recuperó en un período de recolección de 48 días después de una dosis única de 14C-cabozantinib radiomarcado en sujetos sanos. Aproximadamente el 54% se recuperó en las heces y el 27% en la orina. El cabozantinib inalterado representó el 43% de la radiactividad total en las heces y no fue detectable en la orina después de una recolección de 72 horas.
Poblaciones específicas
Las siguientes características del paciente no dieron como resultado una diferencia clínicamente relevante en la farmacocinética del cabozantinib: edad (32-86 años), sexo, raza (blancos y no blancos) o insuficiencia renal leve a moderada (eGFR ≥ 30 mL/min/1,73 m2 según lo estimado por la ecuación MDRD (modificación de la dieta en la enfermedad renal)). Se desconoce la farmacocinética del cabozantinib en pacientes con eGFR < 29 mL/min/1,73 m2 según lo estimado por la ecuación MDRD o que requieren diálisis.
Pacientes pediátricos
Se espera que las exposiciones sistémicas al cabozantinib en pacientes pediátricos de 12 años o más a las dosis recomendadas sean comparables a la exposición en adultos a la dosis de CABOMETYX 60 mg una vez al día.
Pacientes con insuficiencia hepática
Basándose en un análisis farmacocinético poblacional de cabozantinib en sujetos sanos y pacientes con cáncer, no se observaron diferencias clínicamente significativas en la exposición media al cabozantinib entre los sujetos con función hepática normal (bilirrubina total y AST ≤ LSN) y aquellos con insuficiencia hepática leve (bilirrubina total ≤ LSN y AST > LSN o bilirrubina total > 1 a 1,5 x LSN y cualquier valor de AST). En un estudio farmacocinético específico, la exposición al cabozantinib (AUC0-INF) aumentó en un 63% en pacientes con insuficiencia hepática moderada (Child-Pugh B). No se han estudiado pacientes con insuficiencia hepática grave [véase Posología y administración (2.8), Uso en poblaciones específicas (8.6)].
Estudios de interacción medicamentosa
Estudios clínicos
Inhibidores del CYP3A4:
La administración de un inhibidor potente del CYP3A4, ketoconazol (400 mg diarios durante 27 días), con una formulación en cápsula de cabozantinib a sujetos sanos aumentó la exposición a una dosis única de cabozantinib (AUC0-INF) en un 38%.
Inductores del CYP3A4:
La administración de un inductor potente del CYP3A4, rifampicina (600 mg diarios durante 31 días), con una formulación en cápsula de cabozantinib a sujetos sanos disminuyó la exposición a una dosis única de cabozantinib (AUC0-INF) en un 77%.
Sustratos del CYP2C8:
No se observó ningún efecto clínicamente significativo sobre la exposición a una dosis única de rosiglitazona (un sustrato del CYP2C8) (Cmax y AUC) cuando se administró conjuntamente con una formulación en cápsula de cabozantinib a concentraciones en estado estacionario.
Agentes reductores del ácido gástrico:
No se observó ningún efecto clínicamente significativo sobre la exposición al cabozantinib (AUC) después de la administración conjunta del inhibidor de la bomba de protones (IBP) esomeprazol (40 mg diarios durante 6 días) con una dosis única de 100 mg de una formulación en cápsula de cabozantinib a sujetos sanos.
Estudios in vitro
Enzimas CYP:
La inhibición de CYP3A4 redujo la formación del metabolito oxidativo en > 80%. La inhibición de CYP2C9 tuvo un efecto mínimo en la formación del metabolito de cabozantinib (es decir, una reducción <20%). La inhibición de CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C19, CYP2D6 y CYP2E1 no tuvo ningún efecto en la formación del metabolito de cabozantinib.
Aunque cabozantinib es un inhibidor de CYP2C8 in vitro, un estudio clínico de esta posible interacción concluyó que el uso concomitante no dio como resultado un efecto clínicamente relevante en la exposición al sustrato de CYP2C8. Dado este hallazgo, otros sustratos menos sensibles de las vías afectadas por cabozantinib in vitro (es decir, CYP2C9, CYP2C19 y CYP3A4) no se evaluaron en un estudio clínico, porque, aunque no se puede descartar un efecto de exposición clínicamente relevante, es improbable. Cabozantinib no inhibe las isoenzimas CYP1A2 y CYP2D6 in vitro.
Cabozantinib es un inductor del ARNm de CYP1A1; sin embargo, la relevancia clínica de este hallazgo se desconoce. Cabozantinib no induce CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19 o CYP3A4.
Transportadores:
Cabozantinib es un inhibidor, pero no un sustrato, de las actividades de transporte de P-gp y tiene el potencial de aumentar las concentraciones de sustratos de P-gp coadministrados. La relevancia clínica de este hallazgo se desconoce.
Cabozantinib es un sustrato de MRP2 in vitro y los inhibidores de MRP2 tienen el potencial de aumentar las concentraciones de cabozantinib. La relevancia clínica de este hallazgo se desconoce.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogenicidad, Mutagénesis, Deterioro de la Fertilidad
El potencial carcinogénico del cabozantinib se ha evaluado en dos especies: ratones transgénicos rasH2 y ratas Sprague-Dawley. En el estudio de carcinogenicidad en ratas de 2 años, la administración oral diaria de cabozantinib produjo un aumento estadísticamente significativo en la incidencia de feocromocitoma maligno/complejo maligno en combinación con feocromocitoma benigno o en feocromocitoma benigno solo en ratas macho a una dosis de 1 mg/kg (aproximadamente 5 veces la exposición humana por AUC a la dosis recomendada de 60 mg). El cabozantinib no fue carcinogénico en un estudio de carcinogenicidad de 26 semanas en ratones transgénicos rasH2 a una exposición ligeramente superior a la exposición terapéutica humana prevista.
El cabozantinib no fue mutagénico in vitro en el ensayo de mutación inversa bacteriana (Ames) y no fue clastogénico ni en el ensayo citogenético in vitro con linfocitos humanos ni en el ensayo in vivo de micronúcleos en ratones.
Según los hallazgos no clínicos, la fertilidad masculina y femenina puede verse afectada por el tratamiento con CABOMETYX. En un estudio de fertilidad en el que se administró cabozantinib a ratas macho y hembra a dosis de 1, 2,5 y 5 mg/kg/día, la fertilidad masculina se vio significativamente comprometida a dosis iguales o superiores a 2,5 mg/kg/día (aproximadamente 13 veces el AUC humano a la dosis recomendada), con una disminución en el recuento de espermatozoides y el peso de los órganos reproductivos. En las hembras, la fertilidad se redujo significativamente a dosis iguales o superiores a 1 mg/kg/día (5 veces el AUC humano a la dosis recomendada) con una disminución significativa en el número de embriones vivos y un aumento significativo en las pérdidas pre y postimplantacionales.
Las observaciones de los efectos en los tejidos del tracto reproductivo en los estudios de toxicología general apoyaron los efectos observados en el estudio de fertilidad específico e incluyeron hipospermia y ausencia de cuerpos lúteos en perros machos y hembras en un estudio de dosis repetidas de 6 meses a exposiciones plasmáticas (AUC) aproximadamente 0,5 veces (machos) y <0,1 veces (hembras) de las esperadas en humanos a la dosis recomendada. Además, las ratas hembras a las que se administraron 5 mg/kg/día durante 14 días (aproximadamente 9 veces el AUC humano a la dosis recomendada) presentaron necrosis ovárica.
14 ESTUDIOS CLÍNICOS
14.1 Carcinoma de células renales
Previamente tratado con terapia antiangiogénica
La eficacia de CABOMETYX se evaluó en METEOR (NCT01865747), un ensayo aleatorizado (1:1), abierto, multicéntrico de CABOMETYX versus everolimus realizado en pacientes con CCR avanzada que habían recibido al menos 1 terapia antiangiogénica previa. Los pacientes debían tener una puntuación de rendimiento de Karnofsky (KPS) ≥ 70 %. Los pacientes fueron estratificados por el número de inhibidores de tirosina quinasa (ITK) de VEGFR previos y el grupo de riesgo del Memorial Sloan Kettering Cancer Center (MSKCC).
Los pacientes fueron aleatorizados para recibir CABOMETYX (N=330) 60 mg por vía oral una vez al día o everolimus (N=328) 10 mg por vía oral una vez al día. La mayoría de los pacientes fueron hombres (75 %), con una mediana de edad de 62 años. El sesenta y nueve por ciento (69 %) recibió solo una terapia antiangiogénica previa. La distribución de los pacientes por grupos de riesgo del MSKCC fue del 46 % favorable (0 factores de riesgo), 42 % intermedio (1 factor de riesgo) y 13 % pobre (2 o 3 factores de riesgo). El cincuenta y cuatro por ciento (54 %) de los pacientes tenían 3 o más órganos con enfermedad metastásica, incluidos pulmón (63 %), ganglios linfáticos (62 %), hígado (29 %) y hueso (22 %).
La principal medida de resultado de eficacia fue la supervivencia libre de progresión (SLP) evaluada por un comité de revisión radiológica independiente ciego entre los primeros 375 sujetos aleatorizados. Otros criterios de valoración de eficacia fueron la tasa de respuesta objetiva (TRO) y la supervivencia general (SG) en la población por intención de tratar (ITT). Las evaluaciones tumorales se realizaron cada 8 semanas durante los primeros 12 meses, y luego cada 12 semanas a partir de entonces. Los pacientes recibieron tratamiento hasta la progresión de la enfermedad o la aparición de toxicidad inaceptable. Los pacientes de ambos brazos que presentaron progresión de la enfermedad pudieron continuar el tratamiento a discreción del investigador.
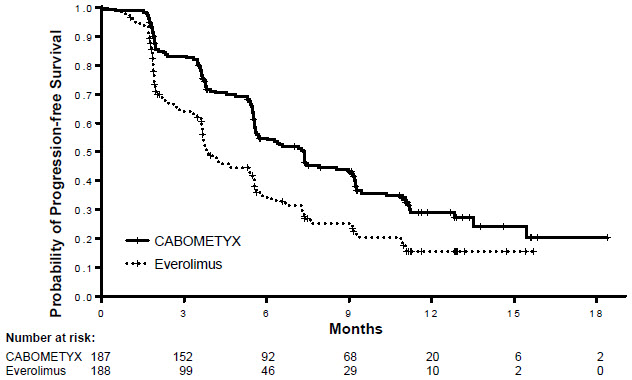
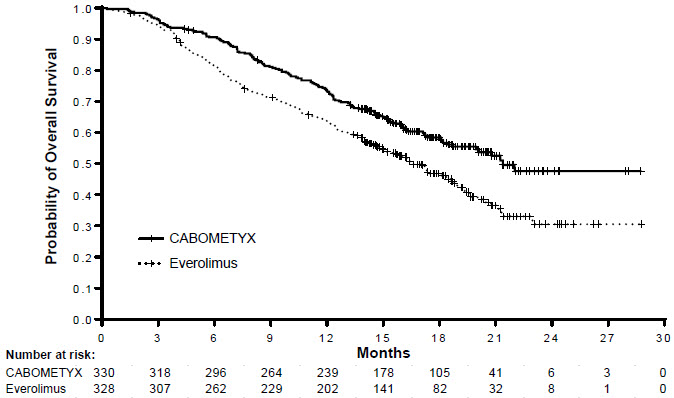
Se demostraron mejoras estadísticamente significativas en la SLP, la SG y la TRO para CABOMETYX en comparación con everolimus. Los resultados de eficacia se presentan en las Tablas 14 y 15 y las Figuras 1 y 2.
| Variable principal | CABOMETYX | Everolimus |
|---|---|---|
| N = 187 | N = 188 | |
|
||
| SLP mediana (IC del 95 %), meses | 7.4 (5.6, 9.1) | 3.8 (3.7, 5.4) |
| HR (IC del 95 %), valor p* | 0.58 (0.45, 0.74), p<0.0001 | |
Figura 1: Curvas de Kaplan-Meier de la supervivencia libre de progresión en METEOR (primeros 375 aleatorizados)
| Variable principal | CABOMETYX | Everolimus |
|---|---|---|
| N = 330 | N = 328 | |
| SG mediana (IC del 95 %), meses | 21.4 (18.7, NE) | 16.5 (14.7, 18.8) |
| HR (IC del 95 %), valor p* | 0.66 (0.53, 0.83), p=0.0003 | |
| TRO confirmada (solo respuestas parciales) (IC del 95 %) | 17 % (13 %, 22 %) | 3 % (2 %, 6 %) |
| valor p† | p<0.0001 | |
Figura 2: Curva de Kaplan-Meier de la supervivencia general en METEOR (ITT)
Tratamiento de primera línea
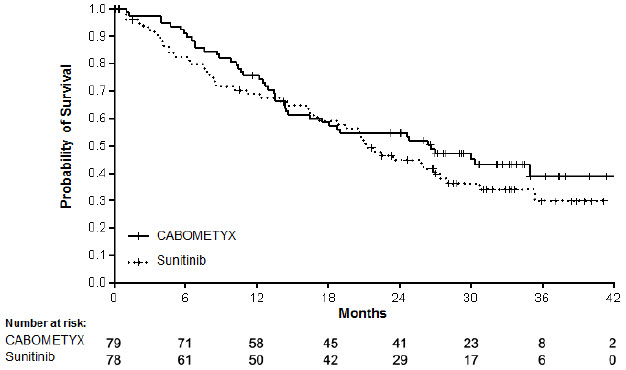
CABOSUN
La eficacia de CABOMETYX se evaluó en CABOSUN (NCT01835158), un ensayo multicéntrico, abierto, aleatorizado (1:1) de CABOMETYX versus sunitinib realizado en pacientes con CCR avanzado que no habían recibido tratamiento previo. Los pacientes fueron aleatorizados para recibir CABOMETYX (N=79) 60 mg por vía oral una vez al día o sunitinib (N=78) 50 mg por vía oral una vez al día (4 semanas de tratamiento seguidas de 2 semanas de descanso) hasta la progresión de la enfermedad o toxicidad inaceptable. Todos los pacientes debían tener una enfermedad de riesgo intermedio o alto según las categorías del grupo de riesgo del Consorcio Internacional de Base de Datos de CCR metastásico (IMDC). Los pacientes fueron estratificados por grupo de riesgo IMDC y presencia de metástasis óseas (sí/no).
La mayoría de los pacientes fueron hombres (78%), con una mediana de edad de 63 años. La distribución de los pacientes por grupos de riesgo IMDC fue del 81% intermedio (1-2 factores de riesgo) y del 19% alto (≥3 factores de riesgo). El 36% de los pacientes tenían metástasis óseas. El 46% de los pacientes fueron ECOG 0, el 41% ECOG 1 y el 13% ECOG 2.
La principal medida de resultado de eficacia fue la supervivencia libre de progresión (SLP) según un comité de revisión radiológica independiente ciego retrospectivo (BIRC).
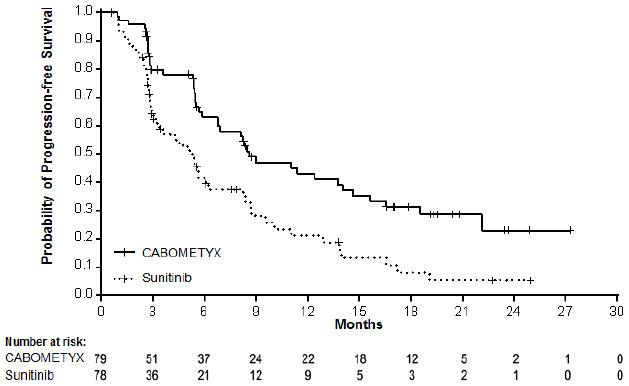
Se demostró una mejora estadísticamente significativa en la SLP, según la evaluación de un comité de revisión radiológica independiente ciego, para CABOMETYX en comparación con sunitinib. Los resultados de eficacia se presentan en la Tabla 16, Figura 3 y Figura 4.
| Variable principal | CABOMETYX | Sunitinib |
|---|---|---|
| N = 79 | N = 78 | |
| Supervivencia libre de progresión* | ||
|
||
| Eventos, n(%) | 43 (54) | 49 (63) |
| Mediana de SLP (IC del 95%), meses* | 8.6 (6.8, 14.0) | 5.3 (3.0, 8.2) |
| Hazard Ratio† (IC del 95%), p-valor‡ | 0.48 (0.31, 0.74), p=0.0008 | |
| Supervivencia general | ||
| Eventos, n(%) | 43 (54) | 47 (60) |
| Hazard Ratio†, § (IC del 95%) | 0.80 (0.53, 1.21) | |
| TEO confirmada, solo respuestas parciales (IC del 95%)*, § | 20% (12.0, 30.8) | 9% (3.7, 17.6) |
Figura 3: Curva de Kaplan-Meier de Supervivencia Libre de Progresión en CABOSUN
Figura 4: Curva de Kaplan-Meier de Supervivencia Global en CABOSUN
CHECKMATE-9ER
CHECKMATE-9ER (NCT03141177) fue un estudio aleatorizado, abierto, de CABOMETYX combinado con nivolumab versus sunitinib en pacientes con RCC avanzado previamente no tratado. CHECKMATE-9ER excluyó a pacientes con enfermedad autoinmune u otras afecciones médicas que requirieran inmunosupresión sistémica. Los pacientes fueron estratificados por puntuación pronóstica IMDC (favorable frente a intermedia frente a pobre), expresión tumoral de PD-L1 (≥1% frente a <1% o indeterminada) y región (EE. UU./Canadá/Europa occidental/Europa septentrional frente al resto del mundo).
Los pacientes fueron aleatorizados a CABOMETYX 40 mg por vía oral diaria y nivolumab 240 mg por vía intravenosa cada 2 semanas (n=323), o sunitinib 50 mg por vía oral diaria durante las primeras 4 semanas de un ciclo de 6 semanas (4 semanas de tratamiento seguidas de 2 semanas de descanso) (n=328). El tratamiento continuó hasta la progresión de la enfermedad según RECIST v1.1 o toxicidad inaceptable. Se permitió el tratamiento más allá de la progresión de la enfermedad definida por RECIST si el paciente era clínicamente estable y se consideraba que estaba obteniendo un beneficio clínico según el investigador. Las evaluaciones tumorales se realizaron al inicio, después de la aleatorización en la semana 12, luego cada 6 semanas hasta la semana 60, y luego cada 12 semanas a partir de entonces.
Las características de la población del ensayo fueron: edad media de 61 años (rango: 28 a 90) con un 38% ≥65 años de edad y un 10% ≥75 años de edad. La mayoría de los pacientes fueron hombres (74%) y blancos (82%), y el 23% y el 77% de los pacientes tenían una KPS basal del 70% al 80% y del 90% al 100%, respectivamente. La distribución de los pacientes por categorías de riesgo IMDC fue del 22% favorable, 58% intermedia y 20% pobre.
La principal medida de resultado de eficacia fue la SLP (evaluada por el BICR). Las medidas de resultado de eficacia adicionales fueron la SG y la TTR (evaluadas por el BICR). El ensayo demostró una mejora estadísticamente significativa en la SLP, la SG y la TTR para los pacientes aleatorizados a CABOMETYX y nivolumab en comparación con sunitinib. Se observaron resultados consistentes para la SLP en todos los subgrupos preespecificados de categorías de riesgo IMDC y estado de expresión tumoral de PD-L1. Se realizó un análisis de eficacia actualizado cuando se observaron 271 muertes según el número preespecificado de muertes para el análisis final preplanificado de la SG. Los resultados de eficacia se muestran en la Tabla 17 y las Figuras 5 y 6.
| CABOMETYX y Nivolumab (n=323) |
Sunitinib (n=328) |
|
|---|---|---|
|
||
| Supervivencia libre de progresión | ||
| Progresión de la enfermedad o muertes (%) | 144 (45) | 191 (58) |
| SLP mediana (meses)* (IC del 95%) | 16.6 (12.5, 24.9) | 8.3 (7.0, 9.7) |
| Razón de riesgo (IC del 95%)† | 0.51 (0.41, 0.64) | |
| Valor p‡, § | <0.0001 | |
| Supervivencia global | ||
| Muertes (%) | 67 (21) | 99 (30) |
| SG mediana (meses)* (IC del 95%) | NR¶ | NR (22.6, NR¶) |
| Razón de riesgo (IC del 95%)† | 0.60 (0.40, 0.89) | |
| Valor p‡, §, # | 0.0010 | |
| Supervivencia general actualizada | ||
| Defunciones (%) | 121 (37) | 150 (46) |
| Supervivencia mediana (meses)* (IC del 95%) | 37.7 (35.5, NR¶) | 34.3 (29.0, NR¶) |
| Razón de riesgo (IC del 95%)† | 0.70 (0.55, 0.90) | |
| Tasa de respuesta objetiva confirmada (IC del 95%)Þ | 55.7% (50.1, 61.2) | 27.1% (22.4, 32.3) |
| Valor pß | <0.0001 | |
| Respuesta completa (RC) | 26 (8%) | 15 (4.6%) |
| Respuesta parcial (RP) | 154 (48%) | 74 (23%) |
| Duración mediana de la respuesta en meses (IC del 95%)* | 20.2 (17.3, NR¶) | 11.5 (8.3, 18.4) |
Figura 5: Curva de Kaplan-Meier de la Supervivencia Libre de Progresión en CHECKMATE-9ER
Figura 6: Curva de Kaplan-Meier de la Supervivencia Global Actualizada en CHECKMATE-9ER
En un análisis exploratorio, el análisis actualizado de la SG en pacientes con riesgo IMDC favorable, intermedio, intermedio/pobre y pobre demostró una HR (IC del 95%) de 1,03 (0,55; 1,92), 0,74 (0,54; 1,01), 0,65 (0,50; 0,85) y 0,49 (0,31; 0,79), respectivamente.
14.2 Carcinoma Hepatocelular
La eficacia de CABOMETYX se evaluó en CELESTIAL (NCT01908426), un ensayo multicéntrico, aleatorizado (2:1), doble ciego, controlado con placebo en pacientes con carcinoma hepatocelular (CHC) que habían recibido previamente sorafenib y tenían insuficiencia hepática de Child Pugh clase A. Los pacientes fueron aleatorizados para recibir CABOMETYX 60 mg por vía oral una vez al día o placebo hasta la progresión de la enfermedad o toxicidad inaceptable. La aleatorización se estratificó por etiología de la enfermedad (virus de la hepatitis B [VHB] con o sin virus de la hepatitis C [VHC] frente a VHC [sin VHB] frente a otra [sin VHB y VHC]), región geográfica (Asia frente a otras regiones) y presencia de diseminación extrahepática de la enfermedad y/o invasión macrovascular (sí frente a no). La medida de resultado de eficacia primaria fue la supervivencia global (SG). Las medidas de resultado adicionales fueron la supervivencia libre de progresión (SLP) y la tasa de respuesta objetiva (TRO), según la evaluación de los investigadores según RECIST 1.1. Las evaluaciones tumorales se realizaron cada 8 semanas.
En CELESTIAL, se aleatorizó un total de 707 pacientes, 470 a CABOMETYX y 237 a placebo. La mediana de edad fue de 64 años (rango de 22 a 86 años), el 82% eran hombres, el 56% eran blancos y el 34% eran asiáticos. El estado de rendimiento ECOG basal fue 0 (53%) o 1 (47%). La etiología del CHC se atribuyó al VHB en el 38% de los pacientes y al VHC en el 21%; la etiología se atribuyó a causas distintas del VHB o el VHC en el 40%. La invasión vascular macroscópica o la diseminación tumoral extrahepática estuvieron presentes en el 78% de los pacientes y el 41% tenía niveles de alfa-fetoproteína (AFP) ≥ 400 mcg/L. Todos los pacientes recibieron sorafenib previamente y el 27% recibió dos regímenes de terapia sistémica previos.
Los resultados de eficacia se resumen en la Tabla 18, la Figura 7 y la Figura 8.
| Variable principal | CABOMETYX | Placebo |
|---|---|---|
| N = 470 | N = 237 | |
| Supervivencia Global | ||
|
||
| Número de muertes, (%) | 317 (67) | 167 (70) |
| Mediana de SG en meses (IC del 95%) | 10,2 (9,1; 12,0) | 8,0 (6,8; 9,4) |
| Hazard Ratio (IC del 95%)* | 0,76 (0,63; 0,92) | |
| p-valor† | p=0,0049‡ | |
| Supervivencia Libre de Progresión | ||
| Número de eventos, (%) | 349 (74) | 205 (86) |
| Enfermedad progresiva | 284 (60) | 186 (78) |
| Muerte | 65 (14) | 19 (8) |
| Mediana de SLP en meses (IC del 95%) | 5,2 (4,0; 5,5) | 1,9 (1,9; 1,9) |
| Hazard Ratio (IC del 95%)* | 0,44 (0,36; 0,52) | |
| p-valor† | p< 0,0001 | |
| Tasa de Respuesta Global (TRG) | ||
| ORR confirmada (solo respuestas parciales) (IC del 95%)‡ | 4% (2.3, 6.0) | 0.4% (0.0, 2.3) |
| Valor p§ | p=0.0086 | |
| IC, intervalo de confianza | ||
Figura 7: Curva de Kaplan-Meier de la supervivencia general en CELESTIAL
Figura 8: Curva de Kaplan-Meier de la supervivencia libre de progresión en CELESTIAL
14.3 Cáncer de tiroides diferenciado
La eficacia de CABOMETYX se evaluó en COSMIC-311 (NCT03690388), un ensayo multicéntrico, aleatorizado (2:1), doble ciego, controlado con placebo en pacientes con cáncer de tiroides diferenciado (CTD) localmente avanzado o metastásico que había progresado después de una terapia previa dirigida a VEGFR y que era refractario al yodo radiactivo o no era elegible. Los pacientes fueron aleatorizados para recibir CABOMETYX 60 mg por vía oral una vez al día o placebo con atención de apoyo hasta la progresión de la enfermedad o una toxicidad inaceptable. La aleatorización se estratificó por la administración previa de lenvatinib (sí frente a no) y la edad (≤ 65 años frente a > 65 años). Los pacientes elegibles aleatorizados a placebo pudieron cambiar a CABOMETYX tras la confirmación de la progresión de la enfermedad por el comité de revisión radiológica independiente ciego (BIRC). Las múltiples medidas de resultado de eficacia primarias fueron la supervivencia libre de progresión (SLP) en la población ITT y la tasa de respuesta general (TRG) en los primeros 100 pacientes aleatorizados, según la evaluación del BIRC según RECIST 1.1. Las evaluaciones tumorales se realizaron cada 8 semanas. La supervivencia general (SG) fue una medida de resultado descriptiva.
El análisis primario de la SLP incluyó 187 pacientes aleatorizados. Se realizó un análisis actualizado de la SLP que incluyó 258 pacientes aleatorizados. La mediana de edad fue de 65 años (rango de 31 a 85 años), el 53% eran mujeres, el 70% eran blancos, el 19% eran asiáticos, el 2% eran negros, el 2% eran amerindios o nativos de Alaska, y el 63% recibieron lenvatinib previamente. El estado de rendimiento ECOG basal fue 0 (46%) o 1 (54%) y el 93% de los pacientes tenían enfermedad metastásica.
El ensayo demostró una mejora estadísticamente significativa en la SLP, mientras que no logró demostrar una mejora estadísticamente significativa en la TRG, para los pacientes aleatorizados a CABOMETYX en comparación con el placebo. Los resultados de eficacia se resumen en la Tabla 19 y la Figura 9.
| Análisis primario | Análisis actualizado* | |||
|---|---|---|---|---|
| CABOMETYX (n=125) |
Placebo (n=62) |
CABOMETYX (n=170) |
Placebo (n=88) |
|
| Supervivencia libre de progresión | ||||
|
||||
| Número de eventos, (%) | 31 (25) | 43 (69) | 62 (36) | 69 (78) |
| Mediana de SLP en meses (IC del 95%) |
NR (5.7, NE) | 1.9 (1.8, 3.6) | 11.0 (7.4, 13.8) | 1.9 (1.9, 3.7) |
| Razón de riesgo (IC del 95%)† | 0.22 (0.14, 0.35) | 0.22 (0.15, 0.31) | ||
| p-valor‡ | < 0.0001 | |||
| Tasa de respuesta general (IC del 95%) | ||||
| Respuesta general, % (IC del 95%)§,¶ | 15% (7%, 26%) | 0% (0.0%, 11%) | 18% (10%, 29%) | 0% (0.0%, 11%) |
| Valor p# | 0.0281 | |||
| IC, intervalo de confianza; NR, no alcanzado; NE, no evaluable | ||||
Figura 9: Curva de Kaplan-Meier de la supervivencia libre de progresión en COSMIC-311 (Análisis actualizado, N=258)
16 SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Los comprimidos de CABOMETYX se suministran de la siguiente manera:
Los comprimidos de 60 mg son de color amarillo, recubiertos con película, de forma ovalada, sin línea de rotura, con “XL” grabado en relieve en un lado y “60” en el otro lado del comprimido; disponibles en:
frasco de 30 comprimidos: NDC 42388-023-26
frasco de 30 comprimidos envasados en una caja de cartón: NDC 42388-023-46
Los comprimidos de 40 mg son de color amarillo, recubiertos con película, de forma triangular, sin línea de rotura, con “XL” grabado en relieve en un lado y “40” en el otro lado del comprimido; disponibles en:
frasco de 30 comprimidos: NDC 42388-025-26
frasco de 30 comprimidos envasados en una caja de cartón: NDC 42388-025-46
Los comprimidos de 20 mg son de color amarillo, recubiertos con película, de forma redonda, sin línea de rotura, con “XL” grabado en relieve en un lado y “20” en el otro lado del comprimido; disponibles en:
frasco de 30 comprimidos: NDC 42388-024-26
frasco de 30 comprimidos envasados en una caja de cartón: NDC 42388-024-46
Conserve CABOMETYX a 20°C-25°C (68°F-77°F); se permiten excursiones de 15°C a 30°C (59°F a 86°F) [véase Temperatura ambiente controlada USP].
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
Aconseje al paciente que lea el etiquetado del paciente aprobado por la FDA (Información para el paciente).
- Hemorragia: Indique a los pacientes que se pongan en contacto con su proveedor de atención médica para buscar atención médica inmediata en caso de signos o síntomas de hemorragia grave o inusual [ver Advertencias y precauciones (5.1)].
- Perforaciones y fístulas: Avise a los pacientes que pueden desarrollar trastornos gastrointestinales como diarrea, náuseas, vómitos y estreñimiento durante el tratamiento con CABOMETYX y que busquen atención médica inmediata si experimentan dolor abdominal persistente o intenso, ya que se han notificado casos de perforación gastrointestinal y fístula en pacientes que toman CABOMETYX [ver Advertencias y precauciones (5.2)].
- Eventos trombóticos: Se han notificado eventos trombóticos venosos y arteriales. Avise a los pacientes que informen sobre los signos o síntomas de una trombosis arterial. Se han notificado eventos tromboembólicos venosos, incluido el émbolo pulmonar. Avise a los pacientes que se pongan en contacto con su proveedor de atención médica si se produce una disnea, dolor torácico o edema localizado en las extremidades de nueva aparición [ver Advertencias y precauciones (5.3)].
- Hipertensión y crisis hipertensiva: Informe a los pacientes sobre los signos y síntomas de la hipertensión. Avise a los pacientes que se sometan a un control regular de la presión arterial y que se pongan en contacto con su proveedor de atención médica si la presión arterial está elevada o si experimentan signos o síntomas de hipertensión [ver Advertencias y precauciones (5.4)].
- Diarrea: Avise a los pacientes que notifiquen a su proveedor de atención médica a la primera señal de heces mal formadas o sueltas o un aumento en la frecuencia de las deposiciones [ver Advertencias y precauciones (5.5)].
- Eritrodisestesia palmar-plantar: Avise a los pacientes que se pongan en contacto con su proveedor de atención médica si la erupción es progresiva o intolerable [ver Advertencias y precauciones (5.6)].
- Hepatotoxicidad: Avise a los pacientes que se pongan en contacto con su proveedor de atención médica inmediatamente si presentan ictericia, náuseas o vómitos intensos, o facilidad para la formación de hematomas o hemorragias [ver Advertencias y precauciones (5.7)].
- Insuficiencia suprarrenal: Avise a los pacientes que reciben nivolumab que se pongan en contacto con su proveedor de atención médica inmediatamente si presentan signos o síntomas de insuficiencia suprarrenal [ver Advertencias y precauciones (5.8)].
- Proteinuria: Avise a los pacientes que se pongan en contacto con su proveedor de atención médica si presentan signos o síntomas de proteinuria [ver Advertencias y precauciones (5.9)].
- Osteonecrosis de la mandíbula: Avise a los pacientes sobre las buenas prácticas de higiene bucal. Avise a los pacientes que se pongan en contacto inmediatamente con su proveedor de atención médica si presentan signos o síntomas asociados con la osteonecrosis de la mandíbula [ver Advertencias y precauciones (5.10)].
- Cicatrización deficiente de heridas: Avise a los pacientes que CABOMETYX puede afectar la cicatrización de heridas. Avise a los pacientes que informen a su proveedor de atención médica sobre cualquier procedimiento quirúrgico planificado [ver Dosis y administración (2.1), Advertencias y precauciones (5.11)].
- Síndrome de leucoencefalopatía posterior reversible: Avise a los pacientes que se pongan en contacto inmediatamente con su proveedor de atención médica si presentan una nueva aparición o un empeoramiento de la función neurológica [ver Advertencias y precauciones (5.12)].
- Disfunción tiroidea: Avise a los pacientes que CABOMETYX puede causar disfunción tiroidea y que su función tiroidea debe controlarse regularmente durante el tratamiento. Avise a los pacientes que se pongan en contacto inmediatamente con su proveedor de atención médica si presentan signos o síntomas de disfunción tiroidea [ver Advertencias y precauciones (5.13)].
- Hipocalcemia: Avise a los pacientes que CABOMETYX puede causar niveles bajos de calcio y que sus niveles de calcio en suero deben controlarse regularmente durante el tratamiento. Avise a los pacientes que se pongan en contacto inmediatamente con su proveedor de atención médica si presentan signos o síntomas de hipocalcemia [ver Advertencias y precauciones (5.14)].
-
Toxicidad embriofetal:
- Avise a las mujeres en edad fértil sobre el riesgo potencial para el feto. Avise a las mujeres que informen a su proveedor de atención médica sobre un embarazo conocido o sospechoso [ver Advertencias y precauciones (5.15), Uso en poblaciones específicas (8.1)].
- Avise a las mujeres en edad fértil que usen un método anticonceptivo eficaz durante el tratamiento con CABOMETYX y durante 4 meses después de la dosis final [Uso en poblaciones específicas (8.3)].
- Lactancia: Avise a las mujeres que no deben amamantar durante el tratamiento con CABOMETYX y durante 4 meses después de la última dosis [Uso en poblaciones específicas (8.2)].
- Interacciones medicamentosas: Avise a los pacientes que informen a su proveedor de atención médica sobre todos los medicamentos recetados o de venta libre, vitaminas o productos herbales. Informe a los pacientes que eviten el pomelo, el zumo de pomelo y la hierba de San Juan [ver Interacciones medicamentosas (7.1)].
Información importante sobre la administración
- Indique a los pacientes que tomen CABOMETYX al menos 1 hora antes o al menos 2 horas después de comer.
Fabricado para Exelixis, Inc. Alameda, CA 94502
PROSPECTO PARA EL PACIENTE
| INFORMACIÓN PARA EL PACIENTE CABOMETYX® (Ka-boe-met-iks) cabozantinib comprimidos |
|
| Si su proveedor de atención médica le receta CABOMETYX en combinación con nivolumab, lea también la Guía del medicamento que viene con nivolumab. | |
| ¿Qué es CABOMETYX? CABOMETYX es un medicamento recetado que se usa para tratar:
No se sabe si CABOMETYX es seguro y eficaz en niños menores de 12 años. |
|
Antes de tomar CABOMETYX, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si:
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados o de venta libre, las vitaminas y los suplementos herbales. CABOMETYX y ciertos otros medicamentos pueden afectarse mutuamente causando efectos secundarios. |
|
¿Cómo debo tomar CABOMETYX?
|
|
| ¿Qué debo evitar mientras tomo CABOMETYX? Evite tomar jugo de toronja, comer toronja o tomar suplementos que contengan toronja o hierba de San Juan durante el tratamiento con CABOMETYX. |
CABOMETYX puede causar efectos secundarios graves, incluyendo:
-
hemorragia (sangrado). CABOMETYX puede causar sangrado grave que puede provocar la muerte. Informe a su proveedor de atención médica de inmediato si presenta algún signo de sangrado durante el tratamiento con CABOMETYX, incluyendo:
- tos con sangre o coágulos de sangre
- vómitos de sangre o si su vómito parece posos de café
- heces rojas o negras (con aspecto de alquitrán)
- sangrado menstrual más abundante de lo normal
- cualquier sangrado inusual o abundante
- perforación del estómago o de la pared intestinal o fístula (conexión anormal entre dos partes del cuerpo). Informe a su proveedor de atención médica de inmediato si siente sensibilidad o dolor intenso en el área del estómago (abdomen) que sea intenso o que no desaparezca.
-
coágulos de sangre, accidente cerebrovascular, ataque cardíaco y dolor en el pecho. Busque ayuda médica de emergencia de inmediato si presenta:
- hinchazón o dolor en los brazos o las piernas
- falta de aliento
- sensación de mareo o desmayo
- sudoración más abundante de lo habitual
- entumecimiento o debilidad en la cara, el brazo o la pierna, especialmente en un lado del cuerpo
- confusión repentina, dificultad para hablar o comprender
- dificultad repentina para ver en uno o ambos ojos
- dificultad repentina para caminar
- mareos, pérdida del equilibrio o coordinación
- dolor de cabeza repentino e intenso
- presión arterial alta (hipertensión). La hipertensión es común con CABOMETYX y, a veces, puede ser grave. Su proveedor de atención médica le controlará la presión arterial antes de comenzar el tratamiento con CABOMETYX y regularmente durante el tratamiento. Si es necesario, su proveedor de atención médica puede recetarle medicamentos para tratar su presión arterial alta. Informe a su proveedor de atención médica si desarrolla dolores de cabeza intensos, hemorragias nasales, cansancio o confusión, cambios en la visión, dolor en el pecho, dificultad para respirar, ritmo cardíaco irregular o sangre en la orina.
- diarrea. La diarrea es común con CABOMETYX y puede ser grave. Si es necesario, su proveedor de atención médica puede recetarle medicamentos para tratar su diarrea. Informe a su proveedor de atención médica de inmediato si tiene deposiciones frecuentes, sueltas y acuosas.
- un problema de la piel llamado reacción cutánea mano-pie. Las reacciones cutáneas mano-pie son comunes con CABOMETYX y pueden ser graves. Informe a su proveedor de atención médica de inmediato si tiene erupciones cutáneas, enrojecimiento, dolor, hinchazón o ampollas en las palmas de las manos o las plantas de los pies.
- problemas hepáticos. Pueden producirse problemas hepáticos durante el tratamiento con CABOMETYX. Cuando se toma CABOMETYX en combinación con nivolumab, pueden producirse cambios graves en las pruebas de función hepática con más frecuencia que si toma CABOMETYX solo. Su proveedor de atención médica le realizará análisis de sangre para controlar su función hepática antes y durante el tratamiento con CABOMETYX. Informe a su proveedor de atención médica de inmediato si desarrolla síntomas de problemas hepáticos, incluyendo: coloración amarillenta de la piel o el blanco de los ojos, náuseas o vómitos intensos, dolor en el lado derecho del área del estómago (abdomen), orina oscura, sangrado o hematomas con más facilidad de lo normal.
- problemas de las glándulas suprarrenales. Su proveedor de atención médica le controlará este problema. Su proveedor de atención médica puede recetarle terapia de reemplazo hormonal o corticosteroides si es necesario. Informe a su proveedor de atención médica de inmediato si desarrolla alguno de los siguientes signos o síntomas: cansancio extremo, mareos o desmayos, debilidad, náuseas o vómitos.
- proteína en la orina y posibles problemas renales. Los síntomas pueden incluir hinchazón en las manos, brazos, piernas o pies. Su proveedor de atención médica le controlará este problema durante el tratamiento con CABOMETYX.
- problemas graves en los huesos de la mandíbula (osteonecrosis). Su proveedor de atención médica debe examinar su boca antes de comenzar y durante el tratamiento con CABOMETYX. Informe a su dentista que está tomando CABOMETYX. Es importante que practique una buena higiene bucal durante el tratamiento con CABOMETYX. Informe a su proveedor de atención médica de inmediato si desarrolla algún síntoma de problemas en la mandíbula, incluyendo: dolor en la mandíbula, dolor de muelas o llagas en las encías.
-
problemas de cicatrización de heridas. Se han producido problemas de cicatrización de heridas en algunas personas que toman CABOMETYX. Informe a su proveedor de atención médica si planea someterse a alguna cirugía antes o durante el tratamiento con CABOMETYX.
- Debe dejar de tomar CABOMETYX al menos 3 semanas antes de la cirugía programada.
- Su proveedor de atención médica debe indicarle cuándo puede volver a tomar CABOMETYX después de la cirugía.
- Síndrome de leucoencefalopatía posterior reversible (RPLS). Puede producirse una afección llamada síndrome de leucoencefalopatía posterior reversible durante el tratamiento con CABOMETYX. Informe a su proveedor de atención médica de inmediato si tiene dolores de cabeza, convulsiones, confusión, cambios en la visión o problemas de pensamiento.
- cambio en la función tiroidea. CABOMETYX puede causar cambios en su función tiroidea, incluyendo cambios en los niveles de hormona tiroidea en su sangre. Su proveedor de atención médica le realizará análisis de sangre para controlar su función tiroidea antes y durante el tratamiento con CABOMETYX.
-
disminución del nivel de calcio en la sangre (hipocalcemia). CABOMETYX puede causar una disminución de la cantidad de calcio en la sangre. Su proveedor de atención médica le realizará análisis de sangre para controlar este problema y le administrará calcio si es necesario. Informe a su proveedor de atención médica de inmediato si presenta alguno de los siguientes signos o síntomas:
- rigidez muscular o espasmos musculares
- entumecimiento u hormigueo en los dedos de las manos, los dedos de los pies o alrededor de la boca
- convulsiones
- aumento de peso repentino
- hinchazón de los brazos, las manos, las piernas y los tobillos
Su proveedor de atención médica puede cambiar su dosis, suspenderla temporalmente o suspenderla permanentemente si tiene ciertos efectos secundarios.
Los efectos secundarios más comunes de CABOMETYX incluyen:
- cansancio
- disminución del apetito
- náuseas y vómitos
- pérdida de peso
- estreñimiento
Los efectos secundarios más comunes de CABOMETYX cuando se usa en combinación con nivolumab incluyen:
- cansancio
- llagas en la boca
- erupción cutánea
- niveles bajos de hormona tiroidea (hipotiroidismo)
- dolor en los músculos, huesos y articulaciones
- disminución del apetito
- náuseas
- cambios en el gusto
- dolor en el área del estómago (abdominal)
- tos
- infección de las vías respiratorias superiores
CABOMETYX puedePuede causar problemas de fertilidad en mujeres y hombres, lo que puede afectar su capacidad de tener hijos. Hable con su proveedor de atención médica si tiene preocupaciones sobre la fertilidad.
Estos no son todos los posibles efectos secundarios de CABOMETYX. Llame a su médico para obtener consejos médicos sobre los efectos secundarios. Puede reportar los efectos secundarios a la FDA al 1-800-FDA-1088.
¿Cómo debo almacenar CABOMETYX?
- Almacene CABOMETYX a temperatura ambiente entre 68°F y 77°F (20°C y 25°C).
Mantenga CABOMETYX y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de CABOMETYX.
Los medicamentos a veces se recetan para fines distintos a los enumerados en un folleto de información para el paciente. No use CABOMETYX para una condición para la que no fue prescrita. No le dé CABOMETYX a otras personas, incluso si tienen los mismos síntomas que usted. Puede dañarles.
Puede pedir a su farmacéutico o proveedor de atención médica información sobre CABOMETYX que esté escrita para profesionales de la salud.
¿Cuáles son los ingredientes de CABOMETYX?
Ingrediente activo: cabozantinib
Ingredientes inactivos: celulosa microcristalina, lactosa anhidra, hidroxipropilcelulosa, croscarmelosa sódica, dióxido de silicio coloidal y estearato de magnesio. El recubrimiento de la película contiene hipromelosa, dióxido de titanio, triacetina y óxido de hierro amarillo.
Fabricado para Exelixis, Inc. Alameda, CA 94502
Para más información, visite www.cabometyx.com o llame al 1-855-292-3935.
Esta información para el paciente ha sido aprobada por la Administración de Alimentos y Medicamentos de los EE. UU.
Emitido: 09/2021