Fabricante de medicamentos: Wockhardt USA LLC. (Updated: 2021-12-07)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
CAMBIOS IMPORTANTES RECIENTES
Advertencias y precauciones, Muerte cardiovascular (
5.5) 11/2021
INDICACIONES Y USO
Azithromycin es un antibacteriano macrólido indicado para infecciones leves a moderadas causadas por bacterias susceptibles designadas:
- Infecciones por micobacterias (
1.2)
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de las tabletas de azithromycin y otros medicamentos antibacterianos, las tabletas de azithromycin deben usarse solo para tratar o prevenir infecciones que se hayan demostrado o se sospeche fuertemente que son causadas por bacterias susceptibles. (
1.3)
DOSIS Y ADMINISTRACIÓN
- Infecciones por micobacterias (
2.2)
FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
- Tabletas de azithromycin de 600 mg (
3)
CONTRAINDICACIONES
ADVERTENCIAS Y PRECAUCIONES
- Reacciones alérgicas y cutáneas graves (incluidas las mortales). Suspender azithromycin e iniciar la terapia adecuada si se produce una reacción. (
5.1)
- Hepatotoxicidad: Suspenda inmediatamente azithromycin si aparecen signos y síntomas de hepatitis. (
5.2)
- Estenosis pilórica hipertrófica infantil (IHPS): Después del uso de azithromycin en neonatos (tratamiento hasta los 42 días de vida), se ha informado IHPS. Indique a los padres y cuidadores que se comuniquen con su médico si se producen vómitos o irritabilidad con la alimentación. (
5.3)
- Se ha informado prolongación del intervalo QT y casos de torsades de pointes. Este riesgo, que puede ser fatal, debe considerarse en pacientes con ciertos trastornos cardiovasculares, incluida la prolongación conocida del QT o antecedentes de torsades de pointes, aquellos con afecciones proarrítmicas y con otros medicamentos que prolongan el intervalo QT. (
5.4)
- Muerte cardiovascular: Algunos estudios observacionales han mostrado un riesgo potencial a corto plazo de aproximadamente el doble de muerte cardiovascular aguda en adultos expuestos a azithromycin en relación con otros medicamentos antibacterianos, incluida la amoxicilina. Considere equilibrar este riesgo potencial con los beneficios del tratamiento al prescribir azithromycin. (
5.5)
- Diarrea asociada a Clostridium difficile: Evalúe a los pacientes si se presenta diarrea. (
5.6)
- Azithromycin puede exacerbar la debilidad muscular en personas con miastenia gravis. (
5.7)
REACCIONES ADVERSAS
Las reacciones adversas más comunes son diarrea (5%), náuseas (3%), dolor abdominal (3%) o vómitos, (no se da porcentaje). (
6)
Para reportar SOSPECHAS DE REACCIONES ADVERSAS, comuníquese con Wockhardt USA LLC. al 1-800-346-6854 o FDA al 1-800-FDA-1088 o
www.fda.gov/medwatch.
INTERACCIONES MEDICAMENTOSAS
USO EN POBLACIONES ESPECÍFICAS
Ver sección 17 para INFORMACIÓN DE ASESORAMIENTO PARA EL PACIENTE.
Revisado: 12/2021
Tabla de contenido
INFORMACIÓN DE PRESCRIPCIÓN COMPLETA: CONTENIDO*
1 INDICACIONES Y USO
1.2 Infecciones micobacterianas
1.3 Uso
2 DOSIS Y ADMINISTRACIÓN
2.2 Infecciones micobacterianas
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
4 CONTRAINDICACIONES
4.1 Hipersensibilidad
4.2 Disfunción hepática
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Hipersensibilidad
5.2 Hepatotoxicidad
5.3 Estenosis pilórica hipertrófica infantil (IHPS)
5.4 Prolongación del intervalo QT
5.5 Muerte cardiovascular
5.6 Diarrea asociada a Clostridium difficile (CDAD)
5.7 Exacerbación de miastenia gravis
5.9 Desarrollo de bacterias resistentes a los medicamentos
6 REACCIONES ADVERSAS
6.1 Experiencia en ensayos clínicos
6.2 Experiencia poscomercialización
6.3 Anomalías de laboratorio
7 INTERACCIONES FARMACOLÓGICAS
7.1 Nelfinavir
7.2 Warfarina
7.3 Posible interacción fármaco-fármaco con macrólidos
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso pediátrico
8.5 Uso geriátrico
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
12.2 Farmacodinámica
12.3 Farmacocinética
12.4 Microbiología
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad
13.2 Toxicología animal
14 ESTUDIOS CLÍNICOS
14.1 Estudios clínicos en pacientes con infección avanzada por VIH para la prevención y el tratamiento de la enfermedad debido a MAC diseminado
15 REFERENCIAS
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANIPULACIÓN
17 INFORMACIÓN DE ASESORAMIENTO PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información de prescripción completa no están enumeradas.
1 INDICACIONES Y USO
Los comprimidos de azitromicina, USP son un fármaco antibacteriano macrólido indicado para el tratamiento de pacientes con infecciones leves a moderadas causadas por cepas susceptibles de los microorganismos designados en las condiciones específicas enumeradas a continuación.
1.2 Infecciones por Mycobacterias
Profilaxis de la Enfermedad Diseminada por Complejo Mycobacterium avium (MAC)
El comprimido de azitromicina, USP tomado solo o en combinación con rifabutina en su dosis aprobada, está indicado para la prevención de la enfermedad diseminada por MAC en personas con infección avanzada por VIH
[ver
Dosificación y Administración (2)].
Tratamiento de la Enfermedad Diseminada por MAC
El comprimido de azitromicina, USP tomado en combinación con etambutol, está indicado para el tratamiento de infecciones diseminadas por MAC en personas con infección avanzada por VIH
[ver
Uso en Poblaciones Específicas (8.4) y
1.3 Uso
Para reducir el desarrollo de bacterias resistentes a los medicamentos y mantener la eficacia de azitromicina y otros fármacos antibacterianos, azitromicina debe usarse solo para tratar infecciones que estén comprobadas o que se sospeche firmemente que son causadas por bacterias susceptibles. Cuando se disponga de información sobre el cultivo y la susceptibilidad, se deben considerar al seleccionar o modificar la terapia antibacteriana. En ausencia de tales datos, la epidemiología local y los patrones de susceptibilidad pueden contribuir a la selección empírica de la terapia.
2 DOSIS Y ADMINISTRACIÓN
2.2 Infecciones Micobacterianas
Prevención de Infecciones Diseminadas por MAC
La dosis recomendada de azitromicina para la prevención de la enfermedad diseminada por el complejo
Mycobacterium avium (MAC) es: 1200 mg tomados una vez por semana. Esta dosis de tabletas de azitromicina, USP puede combinarse con el régimen de dosificación aprobado de rifabutina.
Tratamiento de Infecciones Diseminadas por MAC
Azitromicina debe tomarse a una dosis diaria de 600 mg, en combinación con etambutol a la dosis diaria recomendada de 15 mg/kg. Otros fármacos antimicobacterianos que han mostrado actividad
in vitro contra MAC pueden agregarse al régimen de azitromicina más etambutol a discreción del médico o proveedor de atención médica.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Los comprimidos de azithromycin de 600 mg se suministran como comprimidos biconvexos de forma ovalada, recubiertos con una película blanca, con la inscripción W962 en un lado y el otro lado liso, que contienen 600 mg de azithromycin anhidra. Estos se envasan en frascos de 30 comprimidos.
4 CONTRAINDICACIONES
4.1 Hipersensibilidad
Los comprimidos de azithromycin están contraindicados en pacientes con hipersensibilidad conocida a azithromycin, erythromycin, cualquier macrólido o fármaco ketolide.
4.2 Disfunción Hepática
Los comprimidos de azithromycin están contraindicados en pacientes con antecedentes de ictericia colestásica/disfunción hepática asociada con el uso previo de azithromycin.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Hipersensibilidad
Raramente se han reportado reacciones alérgicas graves, incluyendo angioedema, anafilaxia y reacciones dermatológicas como Pustulosis Exantemática Generalizada Aguda (AGEP), Síndrome de Stevens-Johnson y necrolisis epidérmica tóxica, en pacientes bajo terapia con azitromicina.
[ver
Se han reportado casos fatales. También se han reportado casos de Reacción Medicamentosa con Eosinofilia y Síntomas Sistémicos (DRESS). A pesar del tratamiento sintomático inicialmente exitoso de los síntomas alérgicos, cuando se suspendió la terapia sintomática, los síntomas alérgicos reaparecieron poco después en algunos pacientes sin exposición adicional a la azitromicina. Estos pacientes requirieron períodos prolongados de observación y tratamiento sintomático. La relación de estos episodios con la larga vida media tisular de la azitromicina y la posterior exposición prolongada al antígeno actualmente se desconoce.
Si ocurre una reacción alérgica, se debe suspender el medicamento e instaurar una terapia adecuada. Los médicos deben ser conscientes de que los síntomas alérgicos pueden reaparecer cuando se suspende la terapia sintomática.
5.2 Hepatotoxicidad
Se han reportado función hepática anormal, hepatitis, ictericia colestásica, necrosis hepática e insuficiencia hepática, algunas de las cuales han resultado en muerte. Suspenda la azitromicina inmediatamente si aparecen signos y síntomas de hepatitis.
5.3 Estenosis Pilórica Hipertrófica Infantil (IHPS)
Después del uso de azitromicina en neonatos (tratamiento hasta 42 días de vida), se ha reportado IHPS. Indique a los padres y cuidadores que se comuniquen con su médico si ocurren vómitos o irritabilidad con la alimentación.
5.4 Prolongación del intervalo QT
Se ha observado repolarización cardíaca prolongada e intervalo QT prolongado, lo que conlleva un riesgo de desarrollar arritmia cardíaca y torsades de pointes, con el tratamiento con macrólidos, incluida la azitromicina. Se han reportado espontáneamente casos de torsades de pointes durante la vigilancia posterior a la comercialización en pacientes que reciben azitromicina. Los proveedores deben considerar el riesgo de prolongación del intervalo QT, que puede ser fatal, al sopesar los riesgos y beneficios de la azitromicina para grupos en riesgo, que incluyen:
- pacientes con prolongación conocida del intervalo QT, antecedentes de torsades de pointes, síndrome de QT largo congénito, bradiarritmias o insuficiencia cardíaca no compensada
- pacientes que toman medicamentos conocidos por prolongar el intervalo QT
- pacientes con afecciones proarrítmicas en curso, como hipopotasemia o hipomagnesemia no corregidas, bradicardia clínicamente significativa y en pacientes que reciben agentes antiarrítmicos de Clase IA (quinidina, procainamida) o Clase III (dofetilida, amiodarona, sotalol).
Los pacientes de edad avanzada pueden ser más susceptibles a los efectos asociados a medicamentos sobre el intervalo QT.
5.5 Muerte Cardiovascular
Algunos estudios observacionales han mostrado un riesgo potencial a corto plazo de muerte cardiovascular aguda aproximadamente dos veces mayor en adultos expuestos a azitromicina en relación con otros medicamentos antibacterianos, incluida la amoxicilina. La mortalidad cardiovascular a los cinco días observada en estos estudios varió de 20 a 400 por millón de ciclos de tratamiento con azitromicina. Se observó que este riesgo potencial era mayor durante los primeros cinco días de uso de azitromicina y no parece estar limitado a aquellos pacientes con enfermedades cardiovasculares preexistentes. Los datos de estos estudios observacionales son insuficientes para establecer o excluir una relación causal entre la muerte cardiovascular aguda y el uso de azitromicina. Considere equilibrar este riesgo potencial con los beneficios del tratamiento al prescribir azitromicina.
5.6 Diarrea Asociada a Clostridium difficile (CDAD)
Se ha reportado CDAD con el uso de casi todos los agentes antibacterianos, incluida la azitromicina, y puede variar en gravedad desde diarrea leve hasta colitis fatal. El tratamiento con agentes antibacterianos altera la flora normal del colon, lo que conduce al crecimiento excesivo de
C. difficile.
C. difficile produce las toxinas A y B que contribuyen al desarrollo de CDAD. Las cepas de
C. difficile productoras de hipertoxinas causan un aumento de la morbilidad y mortalidad, ya que estas infecciones pueden ser refractarias a la terapia antibacteriana y pueden requerir colectomía. Se debe considerar CDAD en todos los pacientes que presenten diarrea después del uso de antibióticos. Es necesaria una cuidadosa historia clínica, ya que se ha informado que la CDAD ocurre más de dos meses después de la administración de agentes antibacterianos.
Si se sospecha o confirma CDAD, puede ser necesario suspender el uso continuo de antibióticos no dirigidos contra
C. difficile. Se debe instituir un manejo adecuado de líquidos y electrolitos, suplementación de proteínas, tratamiento antibiótico de
C. difficile y evaluación quirúrgica según esté clínicamente indicado.
5.7 Exacerbación de Miastenia Gravis
Se han reportado exacerbaciones de los síntomas de miastenia gravis y la aparición de un nuevo síndrome miasténico en pacientes que reciben terapia con azitromicina.
5.9 Desarrollo de Bacterias Resistentes a los Medicamentos
La prescripción de azitromicina en ausencia de una infección bacteriana comprobada o fuertemente sospechada o una indicación profiláctica es poco probable que proporcione un beneficio al paciente y aumenta el riesgo de desarrollo de bacterias resistentes a los medicamentos.
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas clínicamente significativas se describen en otras partes del etiquetado:
- Hipersensibilidad
[ver Advertencias y Precauciones (5.1)]
- Hepatotoxicidad
[ver Advertencias y Precauciones (5.2)]
- Estenosis pilórica hipertrófica infantil (IHPS)
[ver Advertencias y Precauciones (5.3)]
- Prolongación del intervalo QT
[ver Advertencias y Precauciones (5.4)]
- Muerte cardiovascular
[ver Advertencias y Precauciones (5.5)]
- Diarrea asociada a Clostridiodes difficile (CDAD)
[ver Advertencias y Precauciones (5.6)]
- Exacerbación de miastenia gravis
[ver Advertencias y Precauciones (5.7)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo bajo condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas observadas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica.
En ensayos clínicos, la mayoría de las reacciones adversas reportadas fueron de leves a moderadas en severidad y fueron reversibles tras la interrupción del fármaco. Aproximadamente el 0,7% de los pacientes de los ensayos clínicos de dosis múltiples suspendieron el tratamiento con azitromicina debido a reacciones adversas relacionadas con el tratamiento. Las reacciones adversas graves incluyeron angioedema e ictericia colestática. La mayoría de las reacciones adversas que llevaron a la interrupción estaban relacionadas con el tracto gastrointestinal, por ejemplo, náuseas, vómitos, diarrea o dolor abdominal.
[ver
Régimen de dosis múltiples
En general, las reacciones adversas más comunes en pacientes adultos que recibieron un régimen de dosis múltiples de azitromicina estaban relacionadas con el sistema gastrointestinal, siendo diarrea/heces sueltas (5%), náuseas (3%) y dolor abdominal (3%) las más frecuentemente reportadas.
Ninguna otra reacción adversa ocurrió en pacientes con el régimen de dosis múltiples de azitromicina con una frecuencia mayor al 1%. Las reacciones adversas que ocurrieron con una frecuencia del 1% o menos incluyeron las siguientes:
Cardiovasculares: Palpitaciones y dolor en el pecho.
Gastrointestinales: Dispepsia, flatulencia, vómitos, melena e ictericia colestática.
Genitourinarias: Moniliasis, vaginitis y nefritis.
Sistema nervioso: Mareos, cefalea, vértigo y somnolencia.
Generales: Fatiga.
Alérgicas: Erupción cutánea, fotosensibilidad y angioedema.
Terapia crónica con régimen semanal de 1200 mg
La naturaleza de las reacciones adversas observadas con el régimen de dosificación semanal de 1200 mg para la prevención de la infección por
Mycobacterium avium en pacientes gravemente inmunocomprometidos con VIH fue similar a las observadas con los regímenes de dosificación a corto plazo.
[ver Estudios clínicos (14)]
Terapia crónica con régimen diario de 600 mg combinado con etambutol
La naturaleza de las reacciones adversas observadas con el régimen de dosificación diaria de 600 mg para el tratamiento de la infección por el complejo
Mycobacterium avium en pacientes gravemente inmunocomprometidos con VIH fue similar a las observadas con los regímenes de dosificación a corto plazo. El cinco por ciento de los pacientes experimentaron deterioro auditivo reversible en el ensayo clínico pivotal para el tratamiento de MAC diseminada en pacientes con SIDA. Se ha informado deterioro auditivo con los antibióticos macrólidos, especialmente a dosis más altas. Otras reacciones adversas relacionadas con el tratamiento que ocurrieron en >5% de los sujetos y se observaron en cualquier momento durante una mediana de 87,5 días de terapia incluyen: dolor abdominal (14%), náuseas (14%), vómitos (13%), diarrea (12%), flatulencia (5%), cefalea (5%) y visión anormal (5%). Las interrupciones del tratamiento debido a anomalías de laboratorio o reacciones adversas consideradas relacionadas con el fármaco del estudio ocurrieron en 8 de 88 (9,1%) sujetos.
Régimen de dosis única de 1 gramo
En general, las reacciones adversas más comunes en los pacientes que recibieron un régimen de dosis única de 1 gramo de azitromicina estaban relacionadas con el sistema gastrointestinal y se notificaron con mayor frecuencia que en los pacientes que recibieron el régimen de dosis múltiples.
Las reacciones adversas que ocurrieron en pacientes con el régimen de dosis única de 1 gramo de azitromicina con una frecuencia del 1% o mayor incluyeron diarrea/heces sueltas (7%), náuseas (5%), dolor abdominal (5%), vómitos (2%), dispepsia (1%) y vaginitis (1%).
6.2 Experiencia postcomercialización
Las siguientes reacciones adversas se han identificado durante el uso posterior a la aprobación de azitromicina. Debido a que estas reacciones se notifican voluntariamente a partir de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Las reacciones adversas notificadas con azitromicina durante el período posterior a la comercialización en pacientes adultos y/o pediátricos para las cuales no se puede establecer una relación causal incluyen:
Alérgicas: Artralgia, edema, urticaria y angioedema.
Cardiovasculares: Arritmias, incluida taquicardia ventricular e hipotensión. Ha habido informes de prolongación del intervalo QT y
torsades de pointes y muerte cardiovascular.
Gastrointestinales: Anorexia, estreñimiento, dispepsia, flatulencia, vómitos/diarrea, colitis pseudomembranosa, pancreatitis, candidiasis oral, estenosis pilórica y decoloración de la lengua.
Generales: Astenia, parestesia, fatiga, malestar y anafilaxia.
Genitourinarias: Nefritis intersticial, insuficiencia renal aguda y vaginitis.
Hematopoyéticas: Trombocitopenia.
Hepáticas/Biliares: Función hepática anormal, hepatitis, ictericia colestática, necrosis hepática e insuficiencia hepática,
[ver
Advertencias y precauciones (5.2)]
.
Sistema nervioso: Convulsiones, mareos/vértigo, dolor de cabeza, somnolencia, hiperactividad, nerviosismo, agitación y síncope.
Psiquiátrico: Reacción agresiva y ansiedad.
Piel/Apéndices: Prurito y reacciones cutáneas graves, incluyendo eritema multiforme, AGEP, síndrome de Stevens-Johnson, necrólisis epidérmica tóxica y DRESS.
Sentidos especiales: Trastornos de la audición, incluida la pérdida de audición, sordera y/o tinnitus, e informes de perversión y/o pérdida del gusto/olfato.
6.3 Anomalías de laboratorio
Las anomalías significativas (independientemente de la relación con el fármaco) que ocurrieron durante los ensayos clínicos se informaron de la siguiente manera:
- Con una incidencia del 1 al 2%, elevación de la creatina fosfoquinasa sérica, potasio, ALT (SGPT), GGT y AST (SGOT).
- Con una incidencia de menos del 1%, leucopenia, neutropenia, disminución del recuento de plaquetas, elevación de la fosfatasa alcalina sérica, bilirrubina, BUN, creatinina, glucosa en sangre, LDH y fosfato.
Cuando se proporcionó seguimiento, los cambios en las pruebas de laboratorio parecieron ser reversibles.
En ensayos clínicos de dosis múltiples que involucraron a más de 3000 pacientes, 3 pacientes suspendieron la terapia debido a anomalías de enzimas hepáticas relacionadas con el tratamiento y 1 debido a una anomalía de la función renal.
En un estudio de interacción farmacológica de fase 1 realizado en voluntarios normales, 1 de 6 sujetos que recibieron la combinación de azitromicina y rifabutina, 1 de 7 que recibieron rifabutina sola y 0 de 6 que recibieron azitromicina sola desarrollaron una neutropenia clínicamente significativa (<500 células/mm
3).
Anomalías de laboratorio observadas en ensayos clínicos para la prevención de la enfermedad diseminada por
Mycobacterium avium en pacientes con VIH gravemente inmunocomprometidos.
[ver
La terapia crónica (duración media: 87,5 días, rango: 1 a 229 días) que resultó en anomalías de laboratorio en >5% de los sujetos con valores basales normales en el ensayo pivotal para el tratamiento de MAC diseminada en pacientes con VIH gravemente inmunocomprometidos tratados con azitromicina 600 mg diarios en combinación con etambutol incluyen: una reducción en los neutrófilos absolutos a <50% del límite inferior de lo normal (10/52, 19%) y un aumento a cinco veces el límite superior de lo normal en la fosfatasa alcalina (3/35, 9%). Estos hallazgos en sujetos con valores basales normales son similares cuando se comparan con todos los sujetos para análisis de reducciones de neutrófilos (22/75, 29%) y fosfatasa alcalina elevada (16/80, 20%). No se ha establecido la causalidad de estas anomalías de laboratorio debido al uso del fármaco del estudio.
7 INTERACCIONES MEDICAMENTOSAS
7.1 Nelfinavir
La coadministración de nelfinavir en estado estacionario con una dosis oral única de azithromycin resultó en un aumento de las concentraciones séricas de azithromycin. Aunque no se recomienda un ajuste de dosis de azithromycin cuando se administra en combinación con nelfinavir, se justifica una estrecha vigilancia de las reacciones adversas conocidas de azithromycin, como las anomalías de las enzimas hepáticas y la discapacidad auditiva.
[ver
7.2 Warfarin
Los informes espontáneos de poscomercialización sugieren que la administración concomitante de azithromycin puede potenciar los efectos de los anticoagulantes orales como warfarin, aunque el tiempo de protrombina no se vio afectado en el estudio dedicado a la interacción de medicamentos con azithromycin y warfarin. Los tiempos de protrombina deben ser cuidadosamente monitoreados mientras los pacientes reciben azithromycin y anticoagulantes orales de forma concomitante.
7.3 Posible Interacción Fármaco-Fármaco con Macrólidos
No se han reportado interacciones con digoxina, colchicina o fenitoína en ensayos clínicos con azithromycin. No se han realizado estudios específicos de interacción de medicamentos para evaluar la posible interacción fármaco-fármaco. Sin embargo, se han observado interacciones farmacológicas con otros productos macrólidos. Hasta que se desarrollen más datos sobre las interacciones farmacológicas cuando se use digoxina, colchicina o fenitoína con azithromycin, se aconseja una cuidadosa monitorización de los pacientes.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Los datos disponibles de la literatura publicada y la experiencia poscomercialización durante varias décadas con el uso de azitromicina en mujeres embarazadas no han identificado ningún riesgo asociado con el fármaco para defectos congénitos importantes, aborto espontáneo o resultados adversos maternos o fetales (
ver Datos).
Estudios de toxicidad del desarrollo con azitromicina en ratas, ratones y conejos no mostraron malformaciones fetales inducidas por el fármaco en dosis de hasta 3, 2 y 1 veces, respectivamente, una dosis diaria humana adulta de 600 mg basada en el área de superficie corporal. Se observó disminución de la viabilidad y retraso del desarrollo en las crías de ratas embarazadas a las que se les administró azitromicina desde el día 6 del embarazo hasta el destete a una dosis equivalente a 3 veces una dosis diaria humana adulta de 600 mg basada en el área de superficie corporal (
ver Datos).
Se desconoce el riesgo de base estimado de defectos congénitos importantes y aborto espontáneo para las poblaciones indicadas. Todos los embarazos tienen un riesgo de base de defectos congénitos, pérdida u otros resultados adversos. En la población general de los EE. UU., el riesgo de base estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 al 4% y del 15 al 20%, respectivamente.
Datos
Datos en humanos
Los datos disponibles de estudios observacionales publicados, series de casos e informes de casos durante varias décadas no sugieren un mayor riesgo de defectos congénitos importantes, aborto espontáneo o resultados adversos maternos o fetales con el uso de azitromicina en mujeres embarazadas. Las limitaciones de estos datos incluyen la falta de aleatorización y la incapacidad de controlar los factores de confusión, como la enfermedad materna subyacente y el uso materno de medicamentos concomitantes.
Datos en animales
La azitromicina administrada durante el período de organogénesis no causó malformaciones fetales en ratas y ratones a dosis orales de hasta 200 mg/kg/día (moderadamente tóxica para la madre). Según el área de superficie corporal, esta dosis es aproximadamente 3 (ratas) y 2 (ratones) veces una dosis diaria humana adulta de 600 mg. En conejos a los que se les administró azitromicina a dosis orales de 10, 20 y 40 mg/kg/día durante la organogénesis, se observó una reducción del peso corporal materno y del consumo de alimentos en todos los grupos; no se observó evidencia de fetotoxicidad o teratogenicidad en estas dosis, la más alta de las cuales es aproximadamente igual a una dosis diaria humana adulta de 600 mg basada en el área de superficie corporal.
En un estudio de desarrollo pre y posnatal, se administró azitromicina por vía oral a ratas preñadas desde el día 6 del embarazo hasta el destete a dosis de 50 o 200 mg/kg/día. Se observó toxicidad materna (reducción del consumo de alimentos y aumento de peso corporal; aumento del estrés en el parto) con la dosis más alta. Se observaron efectos en las crías con 200 mg/kg/día durante el período de desarrollo posnatal (disminución de la viabilidad, retraso en los hitos del desarrollo). Estos efectos no se observaron en un estudio pre y posnatal en ratas cuando se administraron hasta 200 mg/kg/día de azitromicina por vía oral desde el día 15 del embarazo hasta el destete.
8.2 Lactancia
Resumen de riesgos La azitromicina está presente en la leche materna (
ver Datos). Se han notificado reacciones adversas no graves en lactantes alimentados con leche materna después de la administración de azitromicina a la madre (
ver Consideraciones clínicas). No hay datos disponibles sobre los efectos de la azitromicina en la producción de leche. Se deben considerar los beneficios para el desarrollo y la salud de la lactancia materna junto con la necesidad clínica de la madre de azitromicina y cualquier posible efecto adverso en el lactante alimentado con leche materna por la azitromicina o por la afección materna subyacente.
Consideraciones clínicas
Aconseje a las mujeres que monitoreen al bebé amamantado en busca de diarrea, vómitos o erupción cutánea.
Datos
Se midieron las concentraciones de azitromicina en la leche materna en 20 mujeres después de recibir una dosis oral única de 2 g de azitromicina durante el parto. Las muestras de leche materna recolectadas los días 3 y 6 posparto, así como 2 y 4 semanas posparto, revelaron la presencia de azitromicina en la leche materna hasta 4 semanas después de la dosis. En otro estudio, se administró una dosis única de azitromicina de 500 mg por vía intravenosa a 8 mujeres antes de la incisión para una cesárea. Las muestras de leche materna (calostro) obtenidas entre 12 y 48 horas después de la dosis revelaron que la azitromicina persistió en la leche materna hasta 48 horas.
8.4 Uso pediátrico
En estudios clínicos controlados, se ha administrado azitromicina a pacientes pediátricos de 6 meses a 12 años de edad. Para obtener información sobre el uso de azitromicina para suspensión oral en el tratamiento de pacientes pediátricos,
[ver
y
de la información de prescripción para azitromicina para suspensión oral en frascos de 100 mg/5 ml y 200 mg/5 ml.
Pacientes pediátricos infectados por VIH: No se ha establecido la seguridad y eficacia de la azitromicina para la prevención o el tratamiento del MAC en niños infectados por el VIH. Se dispone de datos de seguridad para 72 niños de 5 meses a 18 años de edad (media de 7 años) que recibieron azitromicina para el tratamiento de infecciones oportunistas. La duración media del tratamiento fue de 242 días (rango de 3 a 2004 días) a dosis de <1 a 52 mg/kg/día (media de 12 mg/kg/día). Las reacciones adversas fueron similares a las observadas en la población adulta, la mayoría de las cuales involucraron el tracto gastrointestinal. Se observó deterioro auditivo reversible relacionado con el tratamiento en 4 sujetos (5,6%). Dos (2,8%) niños suspendieron prematuramente el tratamiento debido a reacciones adversas: uno debido a dolor de espalda y otro debido a dolor abdominal, sofocos, mareos, dolor de cabeza y entumecimiento. Un tercer niño suspendió debido a una anomalía de laboratorio (eosinofilia). Los protocolos en los que se basan estos datos especificaron una dosis diaria de 10 a 20 mg/kg/día (oral y/o IV) de azitromicina.
8.5 Uso geriátrico
En ensayos clínicos de dosis múltiples de azitromicina oral, el 9% de los pacientes tenían al menos 65 años de edad (458/4949) y el 3% de los pacientes (144/4949) tenían al menos 75 años de edad. No se observaron diferencias generales en seguridad o efectividad entre estos sujetos y sujetos más jóvenes, y otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los pacientes de edad avanzada y los más jóvenes, pero no se puede descartar una mayor sensibilidad de algunas personas mayores.
Los pacientes de edad avanzada pueden ser más susceptibles al desarrollo de arritmias de torsades de pointes que los pacientes más jóvenes. [
ver
Advertencias y precauciones (5.4)]
Las tabletas de azitromicina de 600 mg contienen 2,9 mg de sodio por tableta.
Pacientes geriátricos con infecciones oportunistas, incluida la enfermedad por MAC: Se dispone de datos de seguridad para 30 pacientes (de 65 a 94 años) tratados con azitromicina a dosis >300 mg/día durante una media de 207 días. Estos pacientes fueron tratados por una variedad de infecciones oportunistas, incluido el MAC. Las reacciones adversas fueron generalmente similares a las observadas en pacientes más jóvenes, excepto por una mayor incidencia de reacciones adversas relacionadas con el sistema gastrointestinal y con el deterioro reversible de la audición.
[ver
10 SOBREDOSIS
Las reacciones adversas experimentadas en dosis más altas que las recomendadas fueron similares a las observadas con dosis normales. En caso de sobredosis, se indican medidas generales sintomáticas y de apoyo según sea necesario.
11 DESCRIPCIÓN
Los comprimidos de azitromicina, USP contienen el ingrediente activo azitromicina, un fármaco antibacteriano macrólido, para administración oral. La azitromicina tiene el nombre químico (
2R,3S,4R,5R,8R,10R,11R,12S,13S,14R)-13-[(2,6-didesoxi-3-
C-metil-3-
O-metil-α
-L-ribo-hexopiranosil)oxi]-2-etil-3,4,10-trihidroxi-3,5,6,8,10,12,14-heptametil-11-[[3,4,6-tridesoxi-3-(dimetilamino)-β-
D-xylo-hexopiranosil]oxi]-1-oxa-6-azaciclopentadecan-15-ona. La azitromicina se deriva de la eritromicina; sin embargo, difiere químicamente de la eritromicina en que un átomo de nitrógeno sustituido con metilo se incorpora en el anillo de lactona. Su fórmula molecular es C
38H
72N
2O
12, y su peso molecular es 749. La azitromicina tiene la siguiente fórmula estructural:
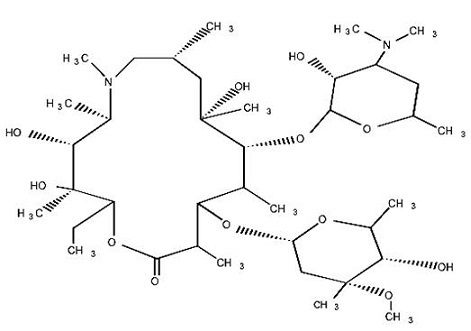
La azitromicina anhidra es un polvo amorfo blanco con una fórmula molecular de C
38H
72N
2O
12 y un peso molecular de 749.
El comprimido de azitromicina, USP se suministra para administración oral como comprimidos blancos, recubiertos con película, de forma ovalada biconvexa que contienen 600 mg de azitromicina anhidra. Además, cada comprimido contiene los siguientes ingredientes inactivos: dióxido de silicio coloidal, almidón de maíz, croscarmelosa sódica, hidroxipropilcelulosa, estearato de magnesio, trisilicato de magnesio, celulosa microcristalina, laurilsulfato de sodio y una cubierta pelicular acuosa que consiste en hipromelosa, polietilenglicol y dióxido de titanio.
12 FARMACOLOGÍA CLÍNICA
12.2 Farmacodinámica
Basado en modelos animales de infección, la actividad antibacteriana de azithromycin parece correlacionarse con la relación entre el área bajo la curva de concentración-tiempo y la concentración inhibitoria mínima (AUC/MIC) para ciertos patógenos (
S. pneumoniae y
S. aureus). El principal parámetro farmacocinético/farmacodinámico mejor asociado con la cura clínica y microbiológica no ha sido elucidado en los ensayos clínicos con azithromycin.
Electrofisiología cardíaca
La prolongación del intervalo QTc se estudió en un ensayo paralelo aleatorizado y controlado con placebo en 116 sujetos sanos que recibieron cloroquina (1000 mg) sola o en combinación con azithromycin oral (500 mg, 1000 mg y 1500 mg una vez al día). La administración conjunta de azithromycin aumentó el intervalo QTc de una manera dependiente de la dosis y la concentración. En comparación con la cloroquina sola, los aumentos máximos promedio (límite superior de confianza del 95 %) en QTcF fueron 5 (10) ms, 7 (12) ms y 9 (14) ms con la administración conjunta de 500 mg, 1000 mg y 1500 mg de azithromycin, respectivamente.
12.3 Farmacocinética
Los parámetros farmacocinéticos de azithromycin en plasma después de la dosificación según las recomendaciones etiquetadas en adultos jóvenes sanos y adultos asintomáticos VIH positivos (de 18 a 40 años) se presentan en el siguiente cuadro:
|
aAUC 0-24 ; b0-last. |
||||||||
| DOSIS/FORMA DE DOSIFICACIÓN (suero, excepto donde se indique) |
Sujetos |
Día No. |
C
max (mcg/mL) |
T
max (hr) |
C
24 (mcg/mL) |
AUC (mcg•hr/mL) |
T
1/2 (hr) |
Excreción urinaria (% de dosis) |
| cápsula de 500 mg/250 mg
|
12
|
1
|
0.41
|
2.5
|
0.05
|
2.6
a |
–
|
4.5
|
| y 250 mg en los días 2 a 5
|
12
|
5
|
0.24
|
3.2
|
0.05
|
2.1
a |
–
|
6.5
|
| comprimidos de 1200 mg/600 mg
|
12
|
1
|
0.66
|
2.5
|
0.074
|
6.8
b |
40
|
–
|
| %CV
|
(62%)
|
(79%)
|
(49%)
|
(64%)
|
(33%)
|
|||
| comprimido de 600 mg/día
|
7
|
1
|
0.33
|
2
|
0.039
|
2.4
a |
||
| %CV
|
(25%)
|
(50%)
|
(36%)
|
(19%)
|
||||
| 7
|
22
|
0.55
|
2.1
|
0.14
|
5.8
a |
84.5
|
–
|
|
| %CV
|
(18%)
|
(52%)
|
(26%)
|
(25%)
|
–
|
|||
| comprimido de 600 mg/día (leucocitos)
|
7
|
22
|
252
|
10.9
|
146
|
4763
a |
82.8
|
–
|
| %CV
|
(49%)
|
(28%)
|
(33%)
|
(42%)
|
–
|
–
|
||
Con un régimen de 500 mg en el Día 1 y 250 mg/día en los Días 2 a 5, C
min y C
max permanecieron esencialmente sin cambios desde el Día 2 hasta el Día 5 del tratamiento. Sin embargo, sin una dosis de carga, los niveles C
min de azitromicina requirieron de 5 a 7 días para alcanzar el estado estacionario.
En sujetos adultos asintomáticos VIH positivos que recibieron tabletas de azitromicina de 600 mg una vez al día durante 22 días, se alcanzaron niveles séricos de azitromicina en estado estacionario para el Día 15 de la dosificación.
Los valores altos en adultos para el volumen de distribución aparente en estado estacionario (31.1 L/kg) y el clearance plasmático (630 mL/min) sugieren que la vida media prolongada se debe a una captación extensa y posterior liberación del fármaco de los tejidos.
Absorción
El paquete de dosis única de 1 gramo es bioequivalente a cuatro cápsulas de azitromicina de 250 mg.
Cuando se administró la suspensión oral de azitromicina con alimentos, la C
max aumentó un 46% y el AUC un 14%.
La biodisponibilidad absoluta de dos tabletas de 600 mg fue del 34% (CV=56%). La administración de dos tabletas de 600 mg con alimentos aumentó la C
max en un 31% (CV=43%) mientras que la extensión de la absorción (AUC) no cambió (razón media de AUC=1; CV=55%).
Distribución
La unión a proteínas séricas de azitromicina es variable en el rango de concentración que se aproxima a la exposición humana, disminuyendo del 51% a 0.02 mcg/mL al 7% a 2 mcg/mL.
La actividad antibacteriana de la azitromicina está relacionada con el pH y parece reducirse con la disminución del pH. Sin embargo, la amplia distribución del fármaco a los tejidos puede ser relevante para la actividad clínica.
Se ha demostrado que la azitromicina penetra en los tejidos en humanos, incluidos la piel, el pulmón, la amígdala y el cuello uterino. La amplia distribución tisular se confirmó mediante el examen de tejidos y fluidos adicionales (hueso, eyaculado, próstata, ovario, útero, salpinx, estómago, hígado y vesícula biliar). Como no hay datos de estudios adecuados y bien controlados del tratamiento con azitromicina de infecciones en estos sitios corporales adicionales, se desconoce la importancia clínica de estos datos de concentración tisular.
La azitromicina se concentra en los fagocitos y fibroblastos como se demuestra mediante técnicas de incubación
in vitro. Usando dicha metodología, la proporción de concentración intracelular a extracelular fue >30 después de una hora de incubación. Los estudios
in vivo sugieren que la concentración en fagocitos puede contribuir a la distribución del fármaco en los tejidos inflamados.
Después de la administración oral de una dosis única de 1200 mg (dos tabletas de 600 mg), la concentración máxima promedio en leucocitos periféricos fue de 140 mcg/mL. La concentración se mantuvo por encima de 32 mcg/mL durante aproximadamente 60 horas. Las vidas medias promedio para 6 hombres y 6 mujeres fueron de 34 horas y 57 horas, respectivamente. Los cocientes C
max leucocito-plasma para hombres y mujeres fueron 258 (±77%) y 175 (±60%), respectivamente, y los cocientes de AUC fueron 804 (±31%) y 541 (±28%) respectivamente. Se desconoce la relevancia clínica de estos hallazgos. Después de la administración oral de múltiples dosis diarias de 600 mg (1 tableta/día) a adultos asintomáticos VIH positivos, la concentración máxima promedio en leucocitos periféricos fue de 252 mcg/mL (±49%). Las concentraciones mínimas en leucocitos periféricos en estado estacionario promediaron 146 mcg/mL (±33%). La proporción media de C
max leucocito-suero fue 456 (±38%) y la proporción media de AUC leucocito-suero fue 816 (±31%). Se desconoce la relevancia clínica de estos hallazgos.
Metabolismo
No se han realizado estudios
in vitro e
in vivo para evaluar el metabolismo de la azitromicina.
Eliminación
Las concentraciones plasmáticas de azitromicina después de dosis orales e IV únicas de 500 mg disminuyeron en un patrón polifásico, lo que resultó en una vida media terminal promedio de 68 horas. La excreción biliar de azitromicina, predominantemente como fármaco inalterado, es una vía importante de eliminación. En el transcurso de una semana, aproximadamente el 6% de la dosis administrada aparece como fármaco inalterado en la orina.
Poblaciones específicas
Pacientes con Insuficiencia Renal
Se investigó la farmacocinética de la azitromicina en 42 adultos (de 21 a 85 años de edad) con diversos grados de insuficiencia renal. Después de la administración oral de una dosis única de 1 g de azitromicina (4 cápsulas de 250 mg), la C
max y el AUC
0-120 promedio aumentaron 5.1% y 4.2%, respectivamente, en sujetos con TFG de 10 a 80 mL/min en comparación con sujetos con función renal normal (TFG >80 mL/min). La C
max y el AUC
0-120 promedio aumentaron 61% y 35%, respectivamente, en sujetos con enfermedad renal en etapa terminal (TFG <10 mL/min) en comparación con sujetos con función renal normal (TFG >80 mL/min
).
Pacientes con Insuficiencia Hepática
No se ha establecido la farmacocinética de la azitromicina en sujetos con insuficiencia hepática.
Pacientes Masculinos y Femeninos
No hay diferencias significativas en la disposición de azitromicina entre sujetos masculinos y femeninos. No se recomienda ajuste de dosis en función del género.
Pacientes Geriátricos
Los parámetros farmacocinéticos en voluntarios mayores (65 a 85 años) fueron similares a los de voluntarios más jóvenes (18 a 40 años) para el régimen terapéutico de 5 días. No parece ser necesario un ajuste de la dosis para pacientes mayores con función renal y hepática normal que reciben tratamiento con este régimen de dosificación.
[ver Uso geriátrico (8.5)]
Pacientes pediátricos
Para obtener información sobre la farmacocinética de azitromicina para suspensión oral en pacientes pediátricos, consulte la información de prescripción para azitromicina para suspensión oral en frascos de 100 mg/5 ml y 200 mg/5 ml.
Estudios de interacción de medicamentos
Se realizaron estudios de interacción de medicamentos con azitromicina y otros medicamentos que probablemente se administren de forma concomitante. Los efectos de la administración conjunta de azitromicina sobre la farmacocinética de otros medicamentos se muestran en la Tabla 1 y los efectos de otros medicamentos sobre la farmacocinética de azitromicina se muestran en la Tabla 2.
La administración conjunta de azitromicina en dosis terapéuticas tuvo un efecto modesto sobre la farmacocinética de los medicamentos enumerados en la Tabla 1. No se recomienda ajustar la dosis de los medicamentos enumerados en la Tabla 1 cuando se administran conjuntamente con azitromicina.
La administración conjunta de azitromicina con efavirenz o fluconazol tuvo un efecto modesto sobre la farmacocinética de azitromicina. Nelfinavir aumentó significativamente la C
max y el AUC de azitromicina. No se recomienda ajustar la dosis de azitromicina cuando se administra con los medicamentos enumerados en la Tabla 2.
[ver
Interacciones farmacológicas (7.3)]
|
*-Intervalo de confianza del 90% no reportado | Medicamento Coadministrado |
Dosis del Medicamento Coadministrado |
Dosis de Azitromicina |
n |
Razón (con/sin azitromicina) de los Parámetros Farmacocinéticos del Medicamento Coadministrado (IC del 90%); Sin Efecto = 1 |
||||||
| Media C
max |
Media AUC |
||||||||||
| Atorvastatina
|
10 mg/día
por 8 días
|
500 mg/día vía oral
en los días 6 a 8
|
12
|
0.83 (0.63 a 1.08)
|
1.01 (0.81 a 1.25)
|
||||||
| Carbamazepina
|
200 mg/día por 2 días,
luego 200 mg dos veces al día por 18 días
|
500 mg/día vía oral
por los días 16 a 18
|
7
|
0.97 (0.88 a 1.06)
|
0.96 (0.88 a 1.06)
|
||||||
| Cetirizina
|
20 mg/día por 11 días
|
500 mg vía oral en el día 7,
luego 250 mg/día en los días 8 a 11
|
14
|
1.03 (0.93 a 1.14)
|
1.02 (0.92 a 1.13)
|
||||||
| Didanosina
|
200 mg vía oral dos veces al día
por 21 días
|
1,200 mg/día vía oral
en los días 8 a 21
|
6
|
1.44 (0.85 a 2.43)
|
1.14 (0.83 a 1.57)
|
||||||
| Efavirenz
|
400 mg/día por 7 días
|
600 mg vía oral en el día 7
|
14
|
1.04*
|
0.95*
|
||||||
| Fluconazol
|
200 mg vía oral dosis única
|
1,200 mg vía oral
dosis única
|
18
|
1.04 (0.98 a 1.11)
|
1.01 (0.97 a 1.05)
|
||||||
| Indinavir
|
800 mg tres veces al día
por 5 días
|
1,200 mg vía oral en el
día 5
|
18
|
0.96 (0.86 a 1.08)
|
0.90 (0.81 a 1)
|
||||||
| Midazolam
|
15 mg vía oral en el día 3
|
500 mg/día vía oral
por 3 días
|
12
|
1.27 (0.89 a 1.81)
|
1.26 (1.01 a 1.56)
|
||||||
| Nelfinavir
|
750 mg tres veces al día
por 11 días
|
1,200 mg vía oral en el
día 9
|
14
|
0.90 (0.81 a 1.01)
|
0.85 (0.78 a 0.93)
|
||||||
| Sildenafil
|
100 mg en los días 1 y 4
|
500 mg/día por vía oral
durante 3 días
|
12
|
1.16 (0.86 a 1.57)
|
0.92 (0.75 a 1.12)
|
||||||
| Theophylline
|
4 mg/kg IV
en los días 1, 11, 25
|
500 mg por vía oral el día 7,
250 mg/día los días 8 a 11
|
10
|
1.19 (1.02 a 1.40)
|
1.02 (0.86 a 1.22)
|
||||||
| Theophylline
|
300 mg por vía oral BID ×15 días
|
500 mg por vía oral el día 6,
luego 250 mg/día los días 7 a 10
|
8
|
1.09 (0.92 a 1.29)
|
1.08 (0.89 a 1.31)
|
||||||
| Triazolam
|
0.125 mg el día 2
|
500 mg por vía oral el día 1,
luego 250 mg/día el día 2
|
12
|
1.06*
|
1.02*
|
||||||
| Trimetoprim/ Sulfametoxazol
|
160 mg/800 mg/día por vía oral
durante 7 días
|
1,200 mg por vía oral el día 7
|
12
|
0.85 (0.75 a 0.97)/ 0.90 (0.78 a 1.03)
|
0.87 (0.80 a 0.95/ 0.96 (0.88 a 1.03)
|
||||||
| Zidovudine
|
500 mg/día por vía oral
durante 21 días
|
600 mg/día por vía oral
durante 14 días
|
5
|
1.12 (0.42 a 3.02)
|
0.94 (0.52 a 1.70)
|
||||||
| Zidovudine
|
500 mg/día por vía oral
durante 21 días
|
1,200 mg/día por vía oral
durante 14 días
|
4
|
1.31 (0.43 a 3.97)
|
1.30 (0.69 a 2.43)
|
||||||
|
* -Intervalo de confianza del 90% no reportado |
|||||
| Fármaco coadministrado |
Dosis del fármaco coadministrado |
Dosis de azitromicina |
n |
Relación (con/sin fármaco coadministrado) de parámetros farmacocinéticos de azitromicina (IC 90%); Sin efecto = 1 |
|
| Media C
max |
Media AUC |
||||
| Efavirenz
|
400 mg/día durante 7 días
|
600 mg por vía oral en el día 7
|
14
|
1.22
(1.04 a 1.42)
|
0.92*
|
| Fluconazol
|
200 mg dosis única oral
|
1,200 mg dosis única oral
|
18
|
0.82
(0.66 a 1.02)
|
1.07
(0.94 a 1.22)
|
| Nelfinavir
|
750 mg tres veces al día durante 11 días
|
1,200 mg por vía oral en el día 9
|
14
|
2.36
(1.77 a 3.15)
|
2.12
(1.80 a 2.50)
|
12.4 Microbiología
La azitromicina actúa uniéndose al ARNr 23S de la subunidad ribosómica 50S de los microorganismos susceptibles, inhibiendo la síntesis de proteínas bacterianas e impidiendo el ensamblaje de la subunidad ribosómica 50S.
Resistencia
El mecanismo más frecuente de resistencia a azitromicina es la modificación del ARNr 23S, más a menudo por metilación. Las modificaciones ribosómicas pueden determinar la resistencia cruzada a otros macrólidos, lincosamidas y estreptogramina B (fenotipo MLS
B). El mecanismo de resistencia mutacional adquirida en aislados del complejo
Mycobacterium avium (es decir, mutación del gen ARNr 23S) es el mismo tanto para claritromicina como para azitromicina.
Actividad antimicrobiana
Se ha demostrado que la azitromicina es activa contra los siguientes microorganismos, tanto
in vitro como en infecciones clínicas. [
ver Indicaciones y uso (1)]
Micobacterias
Complejo
Mycobacterium avium (MAC) que consiste en:
Mycobacterium avium
Mycobacterium intracellulare
Otros microorganismos
Chlamydia trachomatis
Pruebas de susceptibilidad
Para obtener información específica sobre los criterios interpretativos de las pruebas de susceptibilidad y los métodos de prueba y estándares de control de calidad asociados reconocidos por la FDA para este medicamento, consulte: https://www.fda.gov/STIC.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico. Azithromycin no ha mostrado potencial mutagénico en pruebas de laboratorio estándar: ensayo de linfoma de ratón, ensayo clastogénico de linfocitos humanos y ensayo clastogénico de médula ósea de ratón. En estudios de fertilidad realizados en ratas macho y hembra, la administración oral de azithromycin durante 64 a 66 días (machos) o 15 días (hembras) antes y durante la cohabitación resultó en una disminución de la tasa de embarazo a 20 y 30 mg/kg/día cuando tanto los machos como las hembras fueron tratados con azithromycin. Este efecto mínimo sobre la tasa de embarazo (aproximadamente 12% de reducción en comparación con los controles concurrentes) no se hizo más pronunciado cuando la dosis se aumentó de 20 a 30 mg/kg/día (aproximadamente 0.3 a 0.5 veces la dosis diaria para adultos de 600 mg basada en el área de superficie corporal) y no se observó cuando solo un animal en la pareja apareada fue tratado. No hubo efectos sobre ningún otro parámetro reproductivo, y no hubo efectos sobre la fertilidad a 10 mg/kg/día. La relevancia de estos hallazgos para los pacientes que están siendo tratados con azithromycin a las dosis y duraciones recomendadas en la información de prescripción es incierta.
13.2 Toxicología Animal
Se ha observado fosfolipidosis (acumulación de fosfolípidos intracelulares) en algunos tejidos de ratones, ratas y perros a los que se les administraron dosis múltiples de azithromycin. Se ha demostrado en numerosos sistemas de órganos (por ejemplo, ojo, ganglios de la raíz dorsal, hígado, vesícula biliar, riñón, bazo y/o páncreas) en perros y ratas tratados con azithromycin a dosis que, expresadas sobre la base del área de superficie corporal, son similares o menores que la dosis más alta recomendada para adultos humanos. Se ha demostrado que este efecto es reversible después del cese del tratamiento con azithromycin. Según los datos farmacocinéticos, se ha observado fosfolipidosis en la rata (dosis de 50 mg/kg/día) a la concentración plasmática máxima observada de 1.3 mcg/mL (1.6 veces la C
max observada de 0.821 mcg/mL a la dosis de adulto de 2 g). De manera similar, se ha demostrado en el perro (dosis de 10 mg/kg/día) a la concentración sérica máxima observada de 1 mcg/mL (1.2 veces la C
max observada de 0.821 mcg/mL a la dosis de adulto de 2 g).
También se observó fosfolipidosis en ratas neonatales dosificadas durante 18 días a 30 mg/kg/día, que es menor que la dosis pediátrica de 60 mg/kg basada en el área de superficie. No se observó en ratas neonatales tratadas durante 10 días a 40 mg/kg/día con concentraciones séricas máximas medias de 1.86 mcg/mL, aproximadamente 1.5 veces la C
max de 1.27 mcg/mL a la dosis pediátrica. Se ha observado fosfolipidosis en perros neonatales (10 mg/kg/día) a concentraciones máximas medias de sangre entera de 3.54 mcg/mL, aproximadamente 3 veces la C
max de la dosis pediátrica.
Se desconoce la importancia del hallazgo para los animales y para los humanos.
14 ESTUDIOS CLÍNICOS
14.1 Estudios Clínicos en Pacientes con Infección Avanzada por VIH para la Prevención y el Tratamiento de la Enfermedad Debida a MAC Diseminado
Prevención de la Enfermedad por MAC Diseminado
Se realizaron dos ensayos clínicos aleatorizados, doble ciego en pacientes con recuentos de CD4 <100 células/µL. El primer ensayo (Estudio 155) comparó azitromicina (1200 mg una vez por semana) con placebo e incluyó a 182 pacientes con un recuento medio de CD4 de 35 células/mcgL. El segundo ensayo (Estudio 174) aleatorizó a 723 pacientes a azitromicina (1200 mg una vez por semana), rifabutina (300 mg diarios), o la combinación de ambos. El recuento medio de CD4 fue de 51 células/mcgL. El criterio de valoración principal en estos ensayos fue la enfermedad por MAC diseminado. Otros criterios de valoración incluyeron la incidencia de enfermedad por MAC clínicamente significativa y las interrupciones del tratamiento por efectos secundarios relacionados con el fármaco.
Bacteriemia por MAC
En el Estudio 155, 85 pacientes aleatorizados para recibir azitromicina y 89 pacientes aleatorizados para recibir placebo cumplieron los criterios de inclusión. Las incidencias acumuladas a los 6, 12 y 18 meses de los posibles resultados se encuentran en la siguiente tabla:
| Tasa de Incidencia Acumulada, %: Placebo (n=89) |
||||
| Mes |
Libre de MAC y Vivo |
MAC |
Experiencia Adversa |
Perdido durante el Seguimiento |
| 6
|
69.7
|
13.5
|
6.7
|
10.1
|
| 12
|
47.2
|
19.1
|
15.7
|
18
|
| 18
|
37.1
|
22.5
|
18
|
22.5
|
| Tasa de Incidencia Acumulada, %: Azitromicina (n=85) |
||||
| Mes |
Libre de MAC y Vivo |
MAC |
Experiencia Adversa |
Perdido durante el Seguimiento |
| 6
|
84.7
|
3.5
|
9.4
|
2.4
|
| 12
|
63.5
|
8.2
|
16.5
|
11.8
|
| 18
|
44.7
|
11.8
|
25.9
|
17.6
|
La diferencia en las tasas de incidencia acumulada a un año de enfermedad por MAC diseminado (placebo – azitromicina) es del 10,9%. Esta diferencia es estadísticamente significativa (p=0,037) con un intervalo de confianza del 95% para esta diferencia del 0,8%, 20,9%. El número comparable de pacientes que experimentaron eventos adversos y el menor número de pacientes perdidos durante el seguimiento con azitromicina deben tenerse en cuenta al interpretar la importancia de esta diferencia.
En el Estudio 174, 223 pacientes aleatorizados para recibir rifabutina, 223 pacientes aleatorizados para recibir azitromicina y 218 pacientes aleatorizados para recibir tanto rifabutina como azitromicina cumplieron los criterios de inclusión. Las incidencias acumuladas a los 6, 12 y 18 meses de los posibles resultados se registran en la siguiente tabla:
| Tasa de incidencia acumulada, %: Rifabutina (n=223) |
||||
| Mes |
Libre de MAC y vivo |
MAC |
Experiencia adversa |
Perdido en el seguimiento |
| 6
|
83.4
|
7.2
|
8.1
|
1.3
|
| 12
|
60.1
|
15.2
|
16.1
|
8.5
|
| 18
|
40.8
|
21.5
|
24.2
|
13.5
|
| Tasa de incidencia acumulada, %: Azitromicina (n=223) |
||||
| Mes |
Libre de MAC y vivo |
MAC |
Experiencia adversa |
Perdido en el seguimiento |
| 6
|
85.2
|
3.6
|
5.8
|
5.4
|
| 12
|
65.5
|
7.6
|
16.1
|
10.8
|
| 18
|
45.3
|
12.1
|
23.8
|
18.8
|
| Tasa de incidencia acumulada, %: Combinación Azitromicina/Rifabutina (n=218) |
||||
| Mes |
Libre de MAC y vivo |
MAC |
Experiencia adversa |
Perdido en el seguimiento |
| 6
|
89.4
|
1.8
|
5.5
|
3.2
|
| 12
|
71.6
|
2.8
|
15.1
|
10.6
|
| 18
|
49.1
|
6.4
|
29.4
|
15.1
|
Comparando las tasas de incidencia acumuladas de un año, la monoterapia con azitromicina es al menos tan eficaz como la monoterapia con rifabutina. La diferencia (rifabutina – azitromicina) en las tasas de un año (7.6%) es estadísticamente significativa (p=0.022) con un intervalo de confianza del 95% ajustado (0.9%, 14.3%). Además, la terapia de combinación azitromicina/rifabutina es más eficaz que la rifabutina sola. La diferencia (rifabutina – azitromicina/rifabutina) en las tasas de incidencia acumulada de un año (12.5%) es estadísticamente significativa (p<0.001) con un intervalo de confianza del 95% ajustado de 6.6%, 18.4%. El número comparable de pacientes que experimentan eventos adversos y el menor número de pacientes perdidos en el seguimiento con rifabutina deben tenerse en cuenta al interpretar la importancia de esta diferencia.
En el Estudio 174, se realizó una prueba de sensibilidad
1 en todos los aislados de MAC disponibles de sujetos aleatorizados a azitromicina, rifabutina o la combinación. La distribución de los valores de MIC para azitromicina de las pruebas de susceptibilidad de los aislados breakthrough fue similar entre los brazos del estudio. Como la eficacia de azitromicina en el tratamiento de MAC diseminado no ha sido establecida, la relevancia clínica de estos MICs
in vitro como un indicador de susceptibilidad o resistencia no se conoce.
Enfermedad de MAC Diseminada Clínicamente Significativa
En asociación con la disminución de la incidencia de bacteriemia, los pacientes en los grupos aleatorizados a azitromicina sola o azitromicina en combinación con rifabutina mostraron reducciones en los signos y síntomas de la enfermedad de MAC diseminada, incluyendo fiebre o sudores nocturnos, pérdida de peso y anemia.
Discontinuaciones de la Terapia por Efectos Secundarios Relacionados con el Fármaco
En el Estudio 155, las discontinuaciones por toxicidad relacionada con el fármaco ocurrieron en 8.2% de los sujetos tratados con azitromicina y 2.3% de los que recibieron placebo (p=0.121). En el Estudio 174, más sujetos discontinuaron la combinación de azitromicina y rifabutina (22.7%) que con azitromicina sola (13.5%; p=0.026) o rifabutina sola (15.9%; p=0.209).
Seguridad
Como estos pacientes con enfermedad avanzada por VIH estaban tomando múltiples medicamentos concomitantes y experimentaron una variedad de enfermedades intercurrentes, a menudo fue difícil atribuir las reacciones adversas a la medicación del estudio. En general, la naturaleza de las reacciones adversas observadas con el régimen de dosificación semanal de azitromicina durante un período de aproximadamente un año en pacientes con enfermedad avanzada por VIH fue similar a la reportada previamente para terapias de curso más corto.
|
a Incluye las reacciones consideradas posiblemente o probablemente relacionadas con el fármaco del estudio |
|||||
|
b Tasas de reacción adversa >2% para cualquier grupo (excepto uveítis) |
|||||
| Estudio 155 |
Estudio 174 |
||||
| Placebo (N=91) |
Azithromycin 1200 mg semanal (N=89) |
Azithromycin 1200 mg semanal (N=233) |
Rifabutin 300 mg diario (N=236) |
Azithromycin + Rifabutin (N=224) |
|
| Duración media de la terapia (días)
|
303.8
|
402.9
|
315
|
296.1
|
344.4
|
| Interrupción de la terapia
|
2.3
|
8.2
|
13.5
|
15.9
|
22.7
|
| Sistema nervioso autónomo |
|||||
| Boca seca
|
0
|
0
|
0
|
3
|
2.7
|
| Sistema nervioso central |
|||||
| Mareos
|
0
|
1.1
|
3.9
|
1.7
|
0.4
|
| Dolor de cabeza
|
0
|
0
|
3
|
5.5
|
4.5
|
| Gastrointestinal |
|||||
| Diarrea
|
15.4
|
52.8
|
50.2
|
19.1
|
50.9
|
| Heces sueltas
|
6.6
|
19.1
|
12.9
|
3
|
9.4
|
| Dolor abdominal
|
6.6
|
27
|
32.2
|
12.3
|
31.7
|
| Dispepsia
|
1.1
|
9
|
4.7
|
1.7
|
1.8
|
| Flatulencia
|
4.4
|
9
|
10.7
|
5.1
|
5.8
|
| Náuseas
|
11
|
32.6
|
27
|
16.5
|
28.1
|
| Vómitos
|
1.1
|
6.7
|
9
|
3.8
|
5.8
|
| General |
|||||
| Fiebre
|
1.1
|
0
|
2.1
|
4.2
|
4.9
|
| Fatiga
|
0
|
2.2
|
3.9
|
2.1
|
3.1
|
| Malestar general
|
0
|
1.1
|
0.4
|
0
|
2.2
|
| Musculoesquelético |
|||||
| Artralgia
|
0
|
0
|
3
|
4.2
|
7.1
|
| Psiquiátrico |
|||||
| Anorexia
|
1.1
|
0
|
2.1
|
2.1
|
3.1
|
| Piel y Anexos |
|||||
| Prurito
|
3.3
|
0
|
3.9
|
3.4
|
7.6
|
| Erupción cutánea
|
3.2
|
3.4
|
8.1
|
9.4
|
11.1
|
| Decoloración de la piel
|
0
|
0
|
0
|
2.1
|
2.2
|
| Sentidos Especiales |
|||||
| Tinnitus
|
4.4 | 3.4
|
0.9
|
1.3
|
0.9
|
| Audición
Disminuida
|
2.2
|
1.1
|
0.9
|
0.4
|
0
|
| Uveítis
|
0
|
0
|
0.4
|
1.3
|
1.8
|
| Alteración del Gusto
|
0
|
0
|
1.3
|
2.5
|
1.3
|
Las reacciones adversas relacionadas con el tracto gastrointestinal se observaron con mayor frecuencia en los pacientes que recibieron azitromicina que en aquellos que recibieron placebo o rifabutina. En el Estudio 174, el 86% de los episodios de diarrea fueron de naturaleza leve a moderada y la interrupción del tratamiento por este motivo ocurrió solo en 9/233 (3.8%) de los pacientes.
Cambios en los Valores de Laboratorio
En estos pacientes inmunocomprometidos con infección avanzada por VIH, fue necesario evaluar las anormalidades de laboratorio que se desarrollaron durante el ensayo con criterios adicionales si los valores basales estaban fuera del rango normal relevante.


