Fabricante de medicamentos: Teva Neuroscience, Inc. (Updated: 2024-07-01)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
AUSTEDO® XR (deutetrabenazina) comprimidos de liberación prolongada, para administración oral
AUSTEDO® (deutetrabenazina) comprimidos, para administración oral
Aprobación inicial en EE. UU.: 2017
ADVERTENCIA: DEPRESIÓN Y SUICIDIO EN PACIENTES CON ENFERMEDAD DE HUNTINGTON
Consulte la información completa de prescripción para obtener la advertencia completa en recuadro.
- Aumenta el riesgo de depresión y pensamientos y comportamiento suicidas (suicidabilidad) en pacientes con enfermedad de Huntington (5.1)
- Equilibrar los riesgos de depresión y suicidabilidad con la necesidad clínica de tratamiento de la corea al considerar el uso de AUSTEDO XR o AUSTEDO (5.1)
- Supervisar a los pacientes para detectar la aparición o el empeoramiento de la depresión, la suicidabilidad o los cambios inusuales en el comportamiento (5.1)
- Informar a los pacientes, cuidadores y familias sobre el riesgo de depresión y suicidabilidad e indicar que informen al médico tratante de inmediato sobre cualquier comportamiento preocupante (5.1)
- Tener precaución al tratar a pacientes con antecedentes de depresión o intentos de suicidio o ideación previos (5.1)
- AUSTEDO XR y AUSTEDO están contraindicados en pacientes que son suicidas y en pacientes con depresión no tratada o inadecuadamente tratada (4, 5.1)
INDICACIONES Y USO
DOSIFICACIÓN Y ADMINISTRACIÓN
| AUSTEDO XR | AUSTEDO | |
| Dosis inicial recomendada | 12 mg una vez al día (12 mg por día) |
6 mg dos veces al día (12 mg por día) |
- Titrate a intervalos semanales por 6 mg por día según la reducción de la corea o la discinesia tardía, y la tolerabilidad, hasta una dosis diaria máxima recomendada de 48 mg (2.1)
- Administrar AUSTEDO XR con o sin alimentos en dosis únicas diarias (2.1)
- Administrar AUSTEDO con alimentos y administrar dosis diarias totales de 12 mg o más en dos dosis divididas (2.1)
- Traga las tabletas enteras; no mastique, triture ni rompa (2.1)
- Si se cambia a los pacientes de tetrabenazina, suspenda la tetrabenazina e inicie AUSTEDO XR o AUSTEDO al día siguiente. Consulte la información completa de prescripción para la tabla de conversión recomendada (2.2)
- La dosis máxima recomendada de AUSTEDO XR o AUSTEDO en metabolizadores deficientes de CYP2D6 es de 36 mg por día (2.4, 8.7)
FORMAS DE DOSIFICACIÓN Y FUERZAS
CONTRAINDICACIONES
ADVERTENCIAS Y PRECAUCIONES
- Prolongación del QT: Evite el uso en pacientes con síndrome de QT largo congénito o con arritmias asociadas con un intervalo QT prolongado (5.3)
- Síndrome Neuroléptico Maligno (SNM): Suspenda si esto ocurre (5.4)
- Acatisia, agitación, inquietud y parkinsonismo: Reduzca la dosis o suspenda si esto ocurre (5.5, 5.6)
- Sedación/somnolencia: Puede afectar la capacidad del paciente para conducir u operar maquinaria compleja (5.7)
REACCIONES ADVERSAS
- Reacciones adversas más comunes (>8% de los pacientes tratados con AUSTEDO con enfermedad de Huntington y mayor que placebo): somnolencia, diarrea, boca seca y fatiga (6.1)
- Reacciones adversas más comunes (que ocurrieron en el 4% de los pacientes tratados con AUSTEDO con discinesia tardía y mayor que placebo): nasofaringitis e insomnio (6.1)
Para informar sobre REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Teva Pharmaceuticals al 1-888-483-8279 o la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES MEDICAMENTOSAS
USO EN POBLACIONES ESPECÍFICAS
Embarazo: Según datos de animales, puede causar daño fetal (8.1)
Ver 17 para INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y Guía de medicamentos.
Revisado: 7/2024
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
ADVERTENCIA: DEPRESIÓN Y SUICIDIO EN PACIENTES CON ENFERMEDAD DE HUNTINGTON
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Información de Dosificación
2.2 Cambio de Pacientes de Tetrabenazina a AUSTEDO XR o AUSTEDO
2.3 Ajuste de Dosis con Inhibidores Fuertes de CYP2D6
2.4 Ajuste de Dosis en Metabolizadores Débiles de CYP2D6
2.5 Descontinuación e Interrupción del Tratamiento
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Depresión y Suicidality en Pacientes con Enfermedad de Huntington
5.2 Deterioro Clínico y Eventos Adversos en Pacientes con Enfermedad de Huntington
5.3 Prolongación del QTc
5.4 Síndrome Neuroléptico Maligno (SNM)
5.5 Acatisia, Agitación e Inquietud
5.6 Parkinsonismo
5.7 Sedación y Somnolencia
5.8 Hiperprolactinemia
5.9 Unión a Tejidos que Contienen Melanina
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
7 INTERACCIONES MEDICAMENTOSAS
7.1 Inhibidores Fuertes de CYP2D6
7.2 Reserpina
7.3 Inhibidores de la Monoaminooxidasa (IMAO)
7.4 Fármacos Neurolépticos
7.5 Alcohol u Otros Fármacos Sedantes
7.6 Tetrabenazina o Valbenazina Concomitante
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
8.6 Insuficiencia Hepática
8.7 Metabolizadores Débiles de CYP2D6
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Corea Asociada con la Enfermedad de Huntington
14.2 Disquinesia Tardiva
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANEJO
16.1 Forma de Suministro
16.2 Almacenamiento
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
ADVERTENCIA RECUADRADA
ADVERTENCIA: DEPRESIÓN Y SUICIDIO EN PACIENTES CON ENFERMEDAD DE HUNTINGTON
AUSTEDO XR y AUSTEDO pueden aumentar el riesgo de depresión y pensamientos y comportamiento suicidas (suicidabilidad) en pacientes con enfermedad de Huntington. Cualquier persona que considere el uso de AUSTEDO XR o AUSTEDO debe equilibrar los riesgos de depresión y suicidabilidad con la necesidad clínica de tratamiento de la corea. Monitorear de cerca a los pacientes para detectar la aparición o el empeoramiento de la depresión, la suicidabilidad o los cambios inusuales en el comportamiento. Los pacientes, sus cuidadores y familias deben ser informados del riesgo de depresión y suicidabilidad y se les debe indicar que informen de inmediato al médico tratante sobre cualquier comportamiento preocupante.
Se debe tener especial precaución al tratar a pacientes con antecedentes de depresión o intentos de suicidio o ideación previos, que son más frecuentes en la enfermedad de Huntington. AUSTEDO XR y AUSTEDO están contraindicados en pacientes que son suicidas y en pacientes con depresión no tratada o inadecuadamente tratada [ver Contraindicaciones (4) y Advertencias y precauciones (5.1)].
1 INDICACIONES Y USO
AUSTEDO® XR y AUSTEDO® están indicados en adultos para el tratamiento de:
- corea asociada con la enfermedad de Huntington [ver Estudios clínicos (14.1)]
- disquinesia tardía [ver Estudios clínicos (14.2)]
2 DOSIS Y ADMINISTRACIÓN
2.1 Información sobre la dosificación
La dosis de AUSTEDO XR y AUSTEDO se determina individualmente para cada paciente en función de la reducción de la corea o la discinesia tardía y la tolerabilidad. La Tabla 1 muestra la dosis recomendada y las instrucciones importantes de administración de AUSTEDO XR y AUSTEDO cuando se prescriben por primera vez a pacientes que no están siendo cambiados de tetrabenazina (un inhibidor de VMAT2 relacionado).
Tabla 1: Dosis recomendada e instrucciones importantes de administración para AUSTEDO XR y AUSTEDO
| AUSTEDO XR comprimido de liberación prolongada |
AUSTEDO comprimido |
|
| Dosis inicial recomendada | 12 mg una vez al día (12 mg por día) |
6 mg dos veces al día (12 mg por día) |
| Titulación de dosis recomendada | La dosis de AUSTEDO XR o AUSTEDO puede aumentarse a intervalos semanales en incrementos de 6 mg por día en función de la reducción de la corea o la discinesia tardía, y la tolerabilidad, hasta una dosis diaria máxima recomendada de 48 mg [ver Ensayos clínicos (14.1, 14.2)]. | |
| Instrucciones importantes de administración |
|
|
| Cambio entre AUSTEDO y AUSTEDO XR | Al cambiar entre los comprimidos de AUSTEDO (dos veces al día) y los comprimidos de liberación prolongada de AUSTEDO XR (una vez al día), cambie a la misma dosis diaria total. | |
2.2 Cambio de Pacientes de Tetrabenazina a AUSTEDO XR o AUSTEDO
Suspenda la tetrabenazina e inicie AUSTEDO XR o AUSTEDO al día siguiente. El régimen de dosificación inicial recomendado de AUSTEDO XR o AUSTEDO en pacientes que cambian de tetrabenazina a AUSTEDO XR o AUSTEDO se muestra en la Tabla 2.
Tabla 2: Régimen de Dosificación Inicial Recomendado al Cambiar de Tetrabenazina a AUSTEDO XR o AUSTEDO
| Dosificación diaria actual de tetrabenazina |
Régimen inicial de la tableta de liberación prolongada AUSTEDO XR | Régimen inicial de la tableta AUSTEDO |
|---|---|---|
|
12.5 mg |
6 mg una vez al día |
6 mg una vez al día |
|
25 mg |
12 mg una vez al día |
6 mg dos veces al día |
|
37.5 mg |
18 mg una vez al día |
9 mg dos veces al día |
|
50 mg |
24 mg una vez al día |
12 mg dos veces al día |
|
62.5 mg |
30 mg una vez al día |
15 mg dos veces al día |
|
75 mg |
36 mg una vez al día |
18 mg dos veces al día |
|
87.5 mg |
42 mg una vez al día |
21 mg dos veces al día |
|
100 mg |
48 mg una vez al día |
24 mg dos veces al día |
Después de que los pacientes cambien a AUSTEDO XR o AUSTEDO, la dosis puede ajustarse a intervalos semanales [ver Dosificación y Administración (2.1)].
2.3 Ajuste de la Dosificación con Inhibidores Fuertes de CYP2D6
En pacientes que reciben inhibidores fuertes de CYP2D6, la dosis diaria total de AUSTEDO XR o AUSTEDO no debe exceder los 36 mg [ver Interacciones Medicamentosas (7.1) y Farmacología Clínica (12.3)].
2.4 Ajuste de la Dosificación en Metabolizadores Débiles de CYP2D6
En pacientes que son metabolizadores débiles de CYP2D6, la dosis diaria total de AUSTEDO XR o AUSTEDO no debe exceder los 36 mg [ver Uso en Poblaciones Específicas (8.7)].
2.5 Descontinuación e Interrupción del Tratamiento
El tratamiento con AUSTEDO XR o AUSTEDO puede interrumpirse sin reducción gradual. Después de una interrupción del tratamiento superior a una semana, el tratamiento con AUSTEDO XR o AUSTEDO debe volver a titularse cuando se reanude. Para una interrupción del tratamiento inferior a una semana, el tratamiento puede reanudarse a la dosis de mantenimiento anterior sin titulación.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Las tabletas de liberación prolongada AUSTEDO XR están disponibles en las siguientes concentraciones:
- Las tabletas de liberación prolongada de 6 mg son redondas, de color gris recubiertas, con “Q6” impreso en tinta negra en un lado.
- Las tabletas de liberación prolongada de 12 mg son redondas, de color azul recubiertas, con “Q12” impreso en tinta negra en un lado.
- Las tabletas de liberación prolongada de 18 mg son redondas, de color gris claro recubiertas, con “Q18” impreso en tinta negra en un lado.
- Las tabletas de liberación prolongada de 24 mg son redondas, de color morado recubiertas, con “Q24” impreso en tinta negra en un lado.
- Las tabletas de liberación prolongada de 30 mg son redondas, de color naranja claro recubiertas, con “Q30” impreso en tinta negra en un lado.
- Las tabletas de liberación prolongada de 36 mg son redondas, de color morado claro recubiertas, con “Q36” impreso en tinta negra en un lado.
- Las tabletas de liberación prolongada de 42 mg son redondas, de color naranja recubiertas, con “Q42” impreso en tinta negra en un lado.
- Las tabletas de liberación prolongada de 48 mg son redondas, de color rosa recubiertas, con “Q48” impreso en tinta negra en un lado.
Las tabletas AUSTEDO están disponibles en las siguientes concentraciones:
- Las tabletas de 6 mg son redondas, de color morado recubiertas, con “SD” sobre “6” impreso en tinta negra en un lado.
- Las tabletas de 9 mg son redondas, de color azul recubiertas, con “SD” sobre “9” impreso en tinta negra en un lado.
- Las tabletas de 12 mg son redondas, de color beige recubiertas, con “SD” sobre “12” impreso en tinta negra en un lado.
4 CONTRAINDICACIONES
AUSTEDO XR y AUSTEDO están contraindicados en pacientes:
- Con enfermedad de Huntington que son suicidas o tienen depresión no tratada o inadecuadamente tratada [ver Advertencias y precauciones (5.1)].
- Con insuficiencia hepática [ver Uso en poblaciones específicas (8.6), Farmacología clínica (12.3)].
- Que toman reserpina. Deben transcurrir al menos 20 días después de suspender la reserpina antes de comenzar a tomar AUSTEDO XR o AUSTEDO [ver Interacciones medicamentosas (7.2)].
- Que toman inhibidores de la monoaminooxidasa (IMAO). AUSTEDO XR y AUSTEDO no deben utilizarse en combinación con un IMAO, ni dentro de los 14 días posteriores a la interrupción del tratamiento con un IMAO [ver Interacciones medicamentosas (7.3)].
- Que toman tetrabenazina o valbenazina [ver Interacciones medicamentosas (7.6)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Depresión y Suicidabilidad en Pacientes con Enfermedad de Huntington
Los pacientes con enfermedad de Huntington tienen un mayor riesgo de depresión e ideación suicida o comportamientos (suicidabilidad). AUSTEDO XR y AUSTEDO pueden aumentar el riesgo de suicidabilidad en pacientes con enfermedad de Huntington.
En un ensayo de 12 semanas, doble ciego, controlado con placebo, la ideación suicida fue reportada por el 2% de los pacientes tratados con AUSTEDO, en comparación con ningún paciente en placebo; no se reportaron intentos de suicidio ni suicidios consumados. La depresión fue reportada por el 4% de los pacientes tratados con AUSTEDO.
Al considerar el uso de AUSTEDO XR o AUSTEDO, el riesgo de suicidabilidad debe equilibrarse con la necesidad de tratamiento de la corea. Todos los pacientes tratados con AUSTEDO XR o AUSTEDO deben ser observados para detectar depresión o suicidabilidad nuevas o que empeoren. Si la depresión o la suicidabilidad no se resuelven, considere suspender el tratamiento con AUSTEDO XR o AUSTEDO.
Los pacientes, sus cuidadores y familias deben ser informados de los riesgos de depresión, empeoramiento de la depresión y suicidabilidad asociados con AUSTEDO XR y AUSTEDO, y deben recibir instrucciones para informar los comportamientos de preocupación de inmediato al médico tratante. Los pacientes con enfermedad de Huntington que expresen ideación suicida deben ser evaluados de inmediato.
5.2 Empeoramiento Clínico y Eventos Adversos en Pacientes con Enfermedad de Huntington
La enfermedad de Huntington es un trastorno progresivo caracterizado por cambios en el estado de ánimo, la cognición, la corea, la rigidez y la capacidad funcional con el tiempo. Los inhibidores de VMAT2, incluidos AUSTEDO XR y AUSTEDO, pueden causar un empeoramiento del estado de ánimo, la cognición, la rigidez y la capacidad funcional.
Los prescriptores deben reevaluar periódicamente la necesidad de AUSTEDO XR o AUSTEDO en sus pacientes evaluando el efecto sobre la corea y los posibles efectos adversos, incluida la sedación/somnolencia, la depresión y la suicidabilidad, el parkinsonismo, la acatisia, la inquietud y el deterioro cognitivo. Puede ser difícil distinguir entre las reacciones adversas y la progresión de la enfermedad subyacente; disminuir la dosis o suspender el medicamento puede ayudar al médico a distinguir entre las dos posibilidades. En algunos pacientes, la corea subyacente puede mejorar con el tiempo, disminuyendo la necesidad de AUSTEDO XR o AUSTEDO.
5.3 Prolongación del QTc
AUSTEDO XR y AUSTEDO pueden prolongar el intervalo QT, pero el grado de prolongación del QT no es clínicamente significativo cuando AUSTEDO XR o AUSTEDO se administran dentro del rango de dosificación recomendado [ver Farmacología Clínica (12.2)].
AUSTEDO XR y AUSTEDO deben evitarse en pacientes con síndrome de QT largo congénito y en pacientes con antecedentes de arritmias cardíacas. Ciertas circunstancias pueden aumentar el riesgo de aparición de torsades de pointes y/o muerte súbita en asociación con el uso de medicamentos que prolongan el intervalo QTc, que incluyen (1) bradicardia; (2) hipokalemia o hipomagnesemia; (3) uso concomitante de otros medicamentos que prolongan el intervalo QTc; y (4) presencia de prolongación congénita del intervalo QT.
5.4 Síndrome Neuroléptico Maligno (SNM)
Se ha informado un complejo de síntomas potencialmente fatal, a veces denominado Síndrome Neuroléptico Maligno (SNM), en asociación con medicamentos que reducen la transmisión dopaminérgica. Si bien el SNM no se ha observado en pacientes que reciben AUSTEDO XR o AUSTEDO, se ha observado en pacientes que reciben tetrabenazina (un inhibidor de VMAT2 estrechamente relacionado). Los médicos deben estar alerta a los signos y síntomas asociados con el SNM. Las manifestaciones clínicas del SNM son hipertermia, rigidez muscular, alteración del estado mental y evidencia de inestabilidad autonómica (pulso o presión arterial irregular, taquicardia, diaforesis y disritmia cardíaca). Los signos adicionales pueden incluir fosfocreatina quinasa elevada, mioglobinuria, rabdomiólisis e insuficiencia renal aguda. El diagnóstico del SNM puede ser complicado; otras enfermedades médicas graves (por ejemplo, neumonía, infección sistémica) y trastornos extrapiramidales no tratados o tratados inadecuadamente pueden presentarse con signos y síntomas similares. Otras consideraciones importantes en el diagnóstico diferencial incluyen toxicidad anticolinérgica central, golpe de calor, fiebre medicamentosa y patología central del sistema nervioso primario.
El manejo del SNM debe incluir (1) la interrupción inmediata de AUSTEDO XR y AUSTEDO; (2) tratamiento sintomático intensivo y monitoreo médico; y (3) tratamiento de cualquier problema médico grave concomitante para el que haya tratamientos específicos disponibles. No existe un acuerdo general sobre los regímenes de tratamiento farmacológico específicos para el SNM.
Se ha informado la recurrencia del SNM con la reanudación de la terapia farmacológica. Si se necesita tratamiento con AUSTEDO XR o AUSTEDO después de la recuperación del SNM, los pacientes deben ser monitoreados para detectar signos de recurrencia.
5.5 Acatisia, Agitación e Inquietud
AUSTEDO XR y AUSTEDO pueden aumentar el riesgo de acatisia, agitación e inquietud en pacientes con enfermedad de Huntington y discinesia tardía.
En un ensayo de 12 semanas, doble ciego, controlado con placebo en pacientes con enfermedad de Huntington, la acatisia, la agitación o la inquietud fueron reportadas por el 4% de los pacientes tratados con AUSTEDO, en comparación con el 2% de los pacientes en placebo; en pacientes con discinesia tardía, el 2% de los pacientes tratados con AUSTEDO y el 1% de los pacientes en placebo experimentaron estos eventos.
Los pacientes que reciben AUSTEDO XR o AUSTEDO deben ser monitoreados para detectar signos y síntomas de inquietud y agitación, ya que estos pueden ser indicadores del desarrollo de acatisia. Si un paciente desarrolla acatisia durante el tratamiento con AUSTEDO XR o AUSTEDO, la dosis de AUSTEDO XR o AUSTEDO debe reducirse; algunos pacientes pueden requerir la interrupción de la terapia.
5.6 Parkinsonismo
AUSTEDO XR y AUSTEDO pueden causar parkinsonismo en pacientes con enfermedad de Huntington o discinesia tardía. El parkinsonismo también se ha observado con otros inhibidores de VMAT2.
Debido a que la rigidez puede desarrollarse como parte del proceso de la enfermedad subyacente en la enfermedad de Huntington, puede ser difícil distinguir entre el posible parkinsonismo inducido por fármacos y la progresión de la enfermedad de Huntington subyacente. El parkinsonismo inducido por fármacos tiene el potencial de causar más discapacidad funcional que la corea no tratada para algunos pacientes con enfermedad de Huntington.
Se han notificado casos postcomercialización de parkinsonismo en pacientes tratados con AUSTEDO para la discinesia tardía. Los signos y síntomas en los casos notificados han incluido bradicinesia, alteraciones de la marcha, que llevaron a caídas en algunos casos, y la aparición o el empeoramiento del temblor. En la mayoría de los casos, el desarrollo del parkinsonismo se produjo en las dos primeras semanas después de iniciar o aumentar la dosis de AUSTEDO. En los casos en los que se disponía de información clínica de seguimiento, se informó que el parkinsonismo se resolvía tras la interrupción del tratamiento con AUSTEDO.
Si un paciente desarrolla parkinsonismo durante el tratamiento con AUSTEDO XR o AUSTEDO, la dosis de AUSTEDO XR o AUSTEDO debe reducirse; algunos pacientes pueden requerir la interrupción del tratamiento.
5.7 Sedación y somnolencia
La sedación es una reacción adversa común que limita la dosis de AUSTEDO XR y AUSTEDO. En un ensayo de 12 semanas, doble ciego, controlado con placebo que examinó a pacientes con enfermedad de Huntington, el 11% de los pacientes tratados con AUSTEDO informaron somnolencia en comparación con el 4% de los pacientes que recibieron placebo y el 9% de los pacientes tratados con AUSTEDO informaron fatiga en comparación con el 4% de los pacientes que recibieron placebo.
Los pacientes no deben realizar actividades que requieran alerta mental para mantener la seguridad de sí mismos o de los demás, como conducir un vehículo de motor o operar maquinaria peligrosa, hasta que estén en una dosis de mantenimiento de AUSTEDO XR o AUSTEDO y sepan cómo les afecta el fármaco.
5.8 Hiperprolactinemia
Los niveles de prolactina sérica no se evaluaron en el programa de desarrollo de AUSTEDO XR y AUSTEDO. La tetrabenazina, un inhibidor de VMAT2 estrechamente relacionado, eleva las concentraciones de prolactina sérica en humanos. Tras la administración de 25 mg de tetrabenazina a voluntarios sanos, los niveles máximos de prolactina plasmática aumentaron de 4 a 5 veces.
Los experimentos de cultivo de tejidos indican que aproximadamente un tercio de los cánceres de mama humanos son dependientes de la prolactina in vitro, un factor de importancia potencial si se está considerando AUSTEDO XR o AUSTEDO para un paciente con cáncer de mama previamente detectado. Aunque la amenorrea, la galactorrea, la ginecomastia y la impotencia pueden ser causadas por concentraciones elevadas de prolactina sérica, la importancia clínica de las concentraciones elevadas de prolactina sérica para la mayoría de los pacientes es desconocida.
El aumento crónico de los niveles de prolactina sérica (aunque no se evaluó en los programas de desarrollo de AUSTEDO XR, AUSTEDO o tetrabenazina) se ha asociado con bajos niveles de estrógeno y un mayor riesgo de osteoporosis. Si existe una sospecha clínica de hiperprolactinemia sintomática, se deben realizar pruebas de laboratorio apropiadas y se debe considerar la interrupción de AUSTEDO XR y AUSTEDO.
5.9 Unión a tejidos que contienen melanina
Dado que la deutetrabenazina o sus metabolitos se unen a los tejidos que contienen melanina, podría acumularse en estos tejidos con el tiempo. Esto aumenta la posibilidad de que AUSTEDO XR y AUSTEDO puedan causar toxicidad en estos tejidos después de un uso prolongado. Ni el examen oftalmológico ni el examen microscópico del ojo se han realizado en los estudios de toxicidad crónica en una especie pigmentada como los perros. La monitorización oftalmológica en humanos fue inadecuada para excluir la posibilidad de que se produjeran lesiones después de una exposición a largo plazo.
La relevancia clínica de la unión de la deutetrabenazina a los tejidos que contienen melanina es desconocida. Aunque no hay recomendaciones específicas para la monitorización oftalmológica periódica, los prescriptores deben ser conscientes de la posibilidad de efectos oftalmológicos a largo plazo [ver Farmacología clínica (12.2)].
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas graves se analizan con mayor detalle en otras secciones del etiquetado:
- Depresión y suicidio en pacientes con enfermedad de Huntington [ver Advertencias y precauciones (5.1)]
- Prolongación del QTc [ver Advertencias y precauciones (5.3)]
- Síndrome Neuroléptico Maligno (SNM) [ver Advertencias y precauciones (5.4)]
- Acatisia, agitación e inquietud [ver Advertencias y precauciones (5.5)]
- Parkinsonismo [ver Advertencias y precauciones (5.6)]
- Sedación y somnolencia [ver Advertencias y precauciones (5.7)]
- Hiperprolactinemia [ver Advertencias y precauciones (5.8)]
- Unión a tejidos que contienen melanina [ver Advertencias y precauciones (5.9)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica.
Los estudios que se describen a continuación se llevaron a cabo con tabletas de AUSTEDO; se espera que las reacciones adversas con las tabletas de liberación prolongada AUSTEDO XR sean similares a las tabletas de AUSTEDO.
Pacientes con enfermedad de Huntington
Estudio 1 [ver Estudios clínicos (14.1)] fue un estudio aleatorizado, de 12 semanas, controlado con placebo en pacientes con corea asociada con la enfermedad de Huntington. Un total de 45 pacientes recibieron AUSTEDO y 45 pacientes recibieron placebo. Los pacientes tenían entre 23 y 74 años (media de 54 años); el 56% eran hombres y el 92% eran caucásicos. Las reacciones adversas más comunes que ocurrieron en más del 8% de los pacientes tratados con AUSTEDO fueron somnolencia, diarrea, boca seca y fatiga. Las reacciones adversas que ocurrieron en el 4% o más de los pacientes tratados con AUSTEDO y con una mayor incidencia que en los pacientes que recibieron placebo se resumen en la Tabla 3.
Tabla 3: Reacciones adversas en pacientes con enfermedad de Huntington (Estudio 1) experimentadas por al menos el 4% de los pacientes que recibieron AUSTEDO y con una mayor incidencia que con placebo
| Reacción adversa | AUSTEDO (N = 45) % |
Placebo (N = 45) % |
|---|---|---|
|
Somnolencia |
11 |
4 |
|
Diarrea |
9 |
0 |
|
Boca seca |
9 |
7 |
|
Fatiga |
9 |
4 |
|
Infección del tracto urinario |
7 |
2 |
|
Insomnio |
7 |
4 |
|
Ansiedad |
4 |
2 |
|
Estreñimiento |
4 |
2 |
|
Contusión |
4 |
2 |
Una o más reacciones adversas dieron como resultado una reducción de la dosis del medicamento del estudio en el 7% de los pacientes en el Estudio 1. La reacción adversa más común que resultó en una reducción de la dosis en los pacientes que recibieron AUSTEDO fue mareos (4%).
La agitación condujo a la interrupción en el 2% de los pacientes tratados con AUSTEDO en el Estudio 1.
Pacientes con discinesia tardía
Los datos descritos a continuación reflejan 410 pacientes con discinesia tardía que participaron en ensayos clínicos. AUSTEDO se estudió principalmente en dos ensayos de 12 semanas controlados con placebo (dosis fija, escalada de dosis) [ver Estudios clínicos (14.2)]. La población tenía entre 18 y 80 años de edad, y tenía discinesia tardía y diagnósticos concurrentes de trastorno del estado de ánimo (33%) o esquizofrenia/trastorno esquizoafectivo (63%). En estos estudios, AUSTEDO se administró en dosis que oscilaban entre 12 y 48 mg por día. Todos los pacientes continuaron con los regímenes estables previos de antipsicóticos; 71% y 14% de medicamentos antipsicóticos atípicos y típicos respectivamente al inicio del estudio.
Las reacciones adversas más comunes que ocurrieron en más del 3% de los pacientes tratados con AUSTEDO y más que el placebo fueron nasofaringitis e insomnio. Las reacciones adversas que ocurrieron en >2% o más pacientes tratados con AUSTEDO (12-48 mg por día) y más que en los pacientes con placebo en dos estudios doble ciego controlados con placebo en pacientes con discinesia tardía (Estudio 1 y Estudio 2) se resumen en la Tabla 4.
Tabla 4: Reacciones adversas en 2 estudios controlados con placebo de discinesia tardía (Estudio 1 y Estudio 2) de tratamiento de 12 semanas con AUSTEDO reportadas en al menos el 2% de los pacientes y más que el placebo
|
Término preferido |
AUSTEDO |
Placebo |
|
Nasofaringitis |
4 |
2 |
|
Insomnio |
4 |
1 |
|
Depresión/ Trastorno distímico |
2 |
1 |
|
Acatisia/Agitación/Inquietud |
2 |
1 |
Una o más reacciones adversas dieron como resultado una reducción de la dosis del medicamento del estudio en el 4% de los pacientes tratados con AUSTEDO y en el 2% de los pacientes tratados con placebo.
7 INTERACCIONES MEDICAMENTOSAS
7.1 Inhibidores fuertes de CYP2D6
Puede ser necesario reducir la dosis de AUSTEDO XR o AUSTEDO al añadir un inhibidor fuerte de CYP2D6 en pacientes que se mantengan en una dosis estable de AUSTEDO XR o AUSTEDO. Se ha demostrado que el uso concomitante de inhibidores fuertes de CYP2D6 (por ejemplo, paroxetina, fluoxetina, quinidina, bupropión) aumenta la exposición sistémica a los metabolitos dihidro activos de deutetrabenazina en aproximadamente 3 veces. La dosis diaria de AUSTEDO XR o AUSTEDO no debe superar los 36 mg al día en pacientes que tomen inhibidores fuertes de CYP2D6 [véase Dosificación y Administración (2.3) y Farmacología Clínica (12.3)].
7.2 Reserpina
La reserpina se une irreversiblemente al VMAT2 y la duración de su efecto es de varios días. Los prescriptores deben esperar que reaparezcan la correa o la discinesia antes de administrar AUSTEDO XR o AUSTEDO para ayudar a reducir el riesgo de sobredosis y el agotamiento importante de serotonina y norepinefrina en el sistema nervioso central. Deben transcurrir al menos 20 días después de detener la reserpina antes de iniciar AUSTEDO XR o AUSTEDO. AUSTEDO XR y AUSTEDO no deben usarse concomitantemente con la reserpina [véase Contraindicaciones (4)].
7.3 Inhibidores de la monoamino oxidasa (MAOI)
AUSTEDO XR y AUSTEDO están contraindicados en pacientes que toman MAOI. AUSTEDO XR y AUSTEDO no deben usarse en combinación con un MAOI ni dentro de los 14 días de haber suspendido el tratamiento con un MAOI [véase Contraindicaciones (4)].
7.4 Fármacos neurolépticos
El riesgo de parkinsonismo, NMS y acatisia puede aumentar mediante el uso concomitante de AUSTEDO XR o AUSTEDO con antagonistas de la dopamina o antipsicóticos.
7.5 Alcohol u otros fármacos sedantes
El uso concomitante de alcohol u otros fármacos sedantes puede tener efectos aditivos y empeorar la sedación y la somnolencia [véase Advertencias y Precauciones (5.7)].
7.6 Tetrabenazina o valbenazina concomitantes
AUSTEDO XR y AUSTEDO están contraindicados en pacientes que tomen actualmente tetrabenazina o valbenazina. AUSTEDO XR o AUSTEDO pueden iniciarse al día siguiente de la suspensión de tetrabenazina [véase Dosificación y Administración (2.2)].
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgos
No hay datos adecuados sobre el riesgo de desarrollo asociado con el uso de AUSTEDO XR o AUSTEDO en mujeres embarazadas. La administración de deutetrabenazina a ratas durante la organogénesis no produjo ningún efecto adverso claro en el desarrollo embrio-fetal. Sin embargo, la administración de tetrabenazina a ratas durante todo el embarazo y la lactancia resultó en un aumento de las muertes fetales y la mortalidad postnatal de las crías [ver Datos].
En la población general de los EE. UU., el riesgo de fondo estimado de defectos de nacimiento mayores y aborto espontáneo en embarazos clínicamente reconocidos es del 2-4% y del 15-20%, respectivamente. El riesgo de fondo de defectos de nacimiento mayores y aborto espontáneo para la población indicada es desconocido.
Datos
Datos en animales
La administración oral de deutetrabenazina (5, 10 o 30 mg/kg/día) o tetrabenazina (30 mg/kg/día) a ratas embarazadas durante la organogénesis no tuvo ningún efecto claro en el desarrollo embrio-fetal. La dosis más alta probada fue 6 veces la dosis humana máxima recomendada de 48 mg/día, sobre una base de superficie corporal (mg/m2).
No se han evaluado los efectos de la deutetrabenazina cuando se administra durante la organogénesis a conejos o durante el embarazo y la lactancia a ratas.
La tetrabenazina no tuvo efectos sobre el desarrollo embrio-fetal cuando se administró a conejas embarazadas durante el período de organogénesis a dosis orales de hasta 60 mg/kg/día. Cuando se administró tetrabenazina a ratas hembra (dosis de 5, 15 y 30 mg/kg/día) desde el comienzo de la organogénesis hasta el período de lactancia, se observó un aumento de las muertes fetales y la mortalidad postnatal de las crías a 15 y 30 mg/kg/día, y se observó un retraso en la maduración de las crías a todas las dosis.
8.2 Lactancia
Resumen de Riesgos
No hay datos sobre la presencia de deutetrabenazina o sus metabolitos en la leche materna, los efectos en el lactante amamantado o los efectos del fármaco en la producción de leche.
Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de AUSTEDO XR o AUSTEDO y cualquier posible efecto adverso en el lactante amamantado de AUSTEDO XR o AUSTEDO o de la condición materna subyacente.
8.4 Uso pediátrico
Corea asociada con la enfermedad de Huntington y discinesia tardía
No se ha establecido la seguridad y eficacia de AUSTEDO XR y AUSTEDO en pacientes pediátricos para el tratamiento de la corea asociada con la enfermedad de Huntington o para el tratamiento de la discinesia tardía.
Síndrome de Tourette
No se ha establecido la seguridad y eficacia de AUSTEDO XR y AUSTEDO en pacientes pediátricos para el tratamiento del síndrome de Tourette.
La eficacia no se demostró en dos estudios aleatorizados, doble ciego, controlados con placebo en pacientes pediátricos de 6 a 16 años con síndrome de Tourette. Un estudio evaluó dosis fijas de deutetrabenazina durante 8 semanas (NCT03571256); el otro evaluó dosis flexibles de deutetrabenazina durante 12 semanas (NCT03452943). Los estudios incluyeron un total de 274 pacientes pediátricos que recibieron al menos una dosis de deutetrabenazina o placebo. El criterio de valoración principal de eficacia en ambos estudios fue el cambio desde el inicio hasta el final del tratamiento en la puntuación total de tics de la escala de gravedad global de tics de Yale (YGTSS-TTS). El efecto del tratamiento estimado de la deutetrabenazina en la YGTSS-TTS no fue estadísticamente significativamente diferente del placebo en ninguno de los estudios. La diferencia de medias de mínimos cuadrados restada por placebo en la YGTSS-TTS desde el inicio hasta el final del tratamiento fue de -0.7 (IC del 95%: -4.1, 2.8) en el estudio de dosis flexible y de -0.8 (IC del 95%: -3.9, 2.3) para el análisis principal en el estudio de dosis fija.
Las siguientes reacciones adversas se informaron en frecuencias de al menos el 5% de los pacientes pediátricos tratados con AUSTEDO y con una mayor incidencia que en los pacientes pediátricos que recibieron placebo (AUSTEDO vs placebo): dolor de cabeza (incluye: migraña, migraña con aura y dolor de cabeza; 13% vs 9%), somnolencia (incluye: sedación, hipersomnia y somnolencia; 11% vs 2%), fatiga (8% vs 3%), aumento del apetito (5% vs <1%) y aumento de peso (5% vs <1%).
Datos de toxicidad en animales juveniles
La deutetrabenazina administrada por vía oral a ratas juveniles desde los días 21 hasta los 70 posnatales (a 2.5, 5 o 10 mg/kg/día) resultó en un aumento de la incidencia de temblores, hiperactividad y aumentos adversos en la actividad motora a ≥5 mg/kg/día, y reducción del peso corporal y el consumo de alimentos a 10 mg/kg/día. No hubo toxicidad reproductiva o embrionaria temprana hasta la dosis más alta. Todos los hallazgos relacionados con el fármaco fueron reversibles después de un período sin fármaco. El nivel de efecto adverso no observado (NOAEL) en ratas juveniles fue de 2.5 mg/kg/día. Estos hallazgos relacionados con el fármaco fueron similares a los observados en ratas adultas; sin embargo, las ratas juveniles fueron más sensibles.
8.5 Uso geriátrico
Los estudios clínicos de AUSTEDO XR y AUSTEDO no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. Otra experiencia clínica informada no ha identificado diferencias en las respuestas entre los pacientes ancianos y los pacientes más jóvenes. En general, la selección de la dosis para un paciente anciano debe ser cautelosa, comenzando generalmente en el extremo inferior del rango de dosificación, lo que refleja la mayor frecuencia de disfunción hepática, renal y cardíaca, y de enfermedad concomitante u otra terapia farmacológica.
8.6 Insuficiencia hepática
No se ha estudiado el efecto de la insuficiencia hepática en la farmacocinética de la deutetrabenazina y sus metabolitos primarios; sin embargo, en un estudio clínico realizado con tetrabenazina, un inhibidor de VMAT2 estrechamente relacionado, se observó un gran aumento en la exposición a la tetrabenazina y sus metabolitos activos en pacientes con insuficiencia hepática. No se ha evaluado la importancia clínica de esta mayor exposición, pero debido a las preocupaciones por un mayor riesgo de reacciones adversas graves, el uso de AUSTEDO XR o AUSTEDO en pacientes con insuficiencia hepática está contraindicado [ver Contraindicaciones (4), Farmacología clínica (12.3)].
8.7 Metabolizadores lentos de CYP2D6
Aunque la farmacocinética de la deutetrabenazina y sus metabolitos no se ha evaluado sistemáticamente en pacientes que no expresan la enzima metabolizadora de fármacos, es probable que la exposición a α-HTBZ y β-HTBZ aumente de manera similar a la toma de un inhibidor potente de CYP2D6 (aproximadamente 3 veces). En pacientes que son metabolizadores lentos de CYP2D6, la dosis diaria de AUSTEDO XR o AUSTEDO no debe exceder los 36 mg [ver Dosificación y administración (2.4) y Farmacología clínica (12.3)].
10 SOBREDOSIS
Se han reportado en la literatura sobredosis que van de 100 mg a 1 g con tetrabenazina, un inhibidor de VMAT2 estrechamente relacionado. Las siguientes reacciones adversas ocurrieron con la sobredosis: distonía aguda, crisis oculogírica, náuseas y vómitos, sudoración, sedación, hipotensión, confusión, diarrea, alucinaciones, rubor y temblor.
El tratamiento debe consistir en las medidas generales empleadas en el manejo de la sobredosis con cualquier fármaco activo del sistema nervioso central. Se recomiendan medidas generales de apoyo y sintomáticas. Se debe controlar el ritmo cardíaco y los signos vitales. Al manejar la sobredosis, siempre se debe considerar la posibilidad de la participación de múltiples fármacos. El médico debe considerar la posibilidad de comunicarse con un centro de control de intoxicaciones sobre el tratamiento de cualquier sobredosis. Los números de teléfono de los centros de control de intoxicaciones certificados se enumeran en el sitio web de la Asociación Americana de Centros de Control de Intoxicaciones www.aapcc.org.
11 DESCRIPCIÓN
Las tabletas de liberación prolongada AUSTEDO XR y las tabletas de AUSTEDO están formuladas con deutetrabenazina, un inhibidor del transportador 2 de monoamina vesicular (VMAT2) para administración oral. El peso molecular de la deutetrabenazina es 323.46; el pKa es 6.31. La deutetrabenazina es un derivado de hexahidro-dimetoxibenzoquinolizinona y tiene el siguiente nombre químico: (RR, SS)-1, 3, 4, 6, 7, 11b-hexahidro-9, 10-di(methoxy-d3)-3-(2-metilpropilo)-2H-benzo[a]quinolizin-2-ona.
La fórmula molecular de la deutetrabenazina es C19H21D6NO3. La deutetrabenazina es una mezcla racémica que contiene las siguientes estructuras:
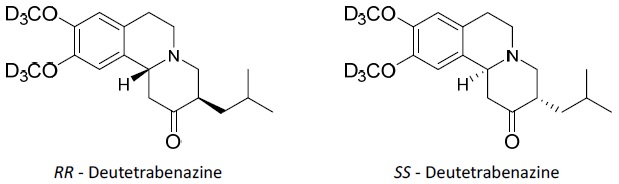
La deutetrabenazina es un polvo cristalino blanco a ligeramente amarillo, poco soluble en agua y soluble en etanol.
AUSTEDO XR
Las tabletas de liberación prolongada AUSTEDO XR contienen 6 mg, 12 mg, 18 mg, 24 mg, 30 mg, 36 mg, 42 mg o 48 mg de deutetrabenazina, y los siguientes ingredientes inactivos: hidróxido de amonio, óxido de hierro negro, alcohol butílico, butilhidroxianisol, butilhidroxitolueno, acetato de celulosa, hidroxipropilcelulosa, hipromelosa, alcohol isopropílico, estearato de magnesio, polietilenglicol, polietilenglicol 3350, óxido de polietileno, alcohol polivinílico, propilenglicol, goma laca, cloruro de sodio, talco, dióxido de titanio y FD&C rojo #40 lago. Las tabletas de liberación prolongada de 6 mg, 12 mg, 18 mg, 30 mg, 36 mg y 42 mg también contienen FD&C amarillo #6 lago. Las tabletas de liberación prolongada de 6 mg, 12 mg, 24 mg y 36 mg también contienen FD&C azul #2 lago. Las tabletas de liberación prolongada de 18 mg también contienen carmín.
Componentes y rendimiento del sistema de administración de AUSTEDO XR
AUSTEDO XR utiliza la presión osmótica para administrar deutetrabenazina a una velocidad controlada. El sistema de administración, que tiene un aspecto similar a una tableta redonda, consiste en una tableta de núcleo bicapa que contiene deutetrabenazina junto con otros excipientes. Los componentes biológicamente inertes de la tableta permanecen intactos durante el tránsito gastrointestinal y se eliminan en las heces.
AUSTEDO
Las tabletas de AUSTEDO contienen 6 mg, 9 mg o 12 mg de deutetrabenazina, y los siguientes ingredientes inactivos: hidróxido de amonio, óxido de hierro negro, alcohol butílico, butilhidroxianisol, butilhidroxitolueno, estearato de magnesio, manitol, celulosa microcristalina, polietilenglicol, óxido de polietileno, polisorbato 80, alcohol polivinílico, povidona, propilenglicol, goma laca, talco, dióxido de titanio y FD&C azul #2 lago. Las tabletas de 6 mg también contienen FD&C rojo #40 lago. Las tabletas de 12 mg también contienen FD&C amarillo #6 lago.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Se desconoce el mecanismo preciso por el cual la deutetrabenazina ejerce sus efectos en el tratamiento de la discinesia tardía y la corea en pacientes con enfermedad de Huntington, pero se cree que está relacionado con su efecto como depletor reversible de monoaminas (como dopamina, serotonina, norepinefrina e histamina) de las terminales nerviosas. Los principales metabolitos circulantes (α-dihidrotetrabenazina [HTBZ] y β-HTBZ) de la deutetrabenazina son inhibidores reversibles de VMAT2, lo que resulta en una disminución de la recaptación de monoaminas en las vesículas sinápticas y el agotamiento de las reservas de monoaminas.
12.2 Farmacodinamia
Electrofisiología cardíaca
A la dosis máxima recomendada, AUSTEDO XR y AUSTEDO no prolongan el intervalo QT en ningún grado clínicamente relevante. Un análisis de respuesta a la exposición sobre la prolongación del QTc de un estudio en metabolizadores extensos o intermedios (EM) y metabolizadores lentos de CYP2D6 (PM) mostró que se puede excluir un efecto clínicamente relevante a exposiciones después de dosis únicas de 24 y 48 mg de AUSTEDO.
Unión a la melanina
La deutetrabenazina o sus metabolitos se unen a los tejidos que contienen melanina (es decir, ojos, piel, pelaje) en ratas pigmentadas. Después de una dosis oral única de deutetrabenazina radiomarcada, la radiactividad todavía se detectó en los ojos y el pelaje a los 35 días después de la administración [ver Advertencias y precauciones (5.9)].
12.3 Farmacocinética
Después de la administración oral, las concentraciones plasmáticas de deutetrabenazina son bajas en comparación con las de los metabolitos deuterados activos debido al extenso metabolismo hepático de la deutetrabenazina.
AUSTEDO XR
La exposición sistémica (es decir, las concentraciones plasmáticas máximas [Cmáx] y el área bajo la curva de concentración plasmática-tiempo [AUC]) para la deutetrabenazina y los metabolitos dihidro deuterados activos (HTBZ), α-HTBZ y β-HTBZ, aumentaron proporcionalmente a la dosis después de dosis únicas de AUSTEDO XR en el rango de dosificación clínica recomendado (6 mg a 48 mg).
AUSTEDO
La exposición sistémica (Cmáx y AUC) para los metabolitos activos aumentó proporcionalmente a la dosis después de dosis únicas o múltiples de deutetrabenazina (6 mg a 24 mg y 7.5 mg dos veces al día a 22.5 mg dos veces al día).
Absorción
Después de la administración oral de deutetrabenazina, el grado de absorción es de al menos el 80%.
AUSTEDO XR
Las concentraciones plasmáticas máximas (Cmáx) de deutetrabenazina, α-HTBZ deuterado y β-HTBZ se alcanzan en aproximadamente 3 horas, seguidas de mesetas sostenidas durante varias horas, lo que permite un intervalo de dosificación de 24 horas.
AUSTEDO
Las concentraciones plasmáticas máximas (Cmáx) de deutetrabenazina, α-HTBZ deuterado y β-HTBZ se alcanzan dentro de las 3 a 4 horas posteriores a la administración.
Efecto de los alimentos
AUSTEDO XR
Los efectos de los alimentos sobre la biodisponibilidad de AUSTEDO XR se estudiaron en sujetos a los que se les administró una dosis única con y sin alimentos. Los alimentos no tuvieron ningún efecto sobre la Cmáx o el AUC de la deutetrabenazina, α-HTBZ o β-HTBZ [ver Dosis y administración (2.1)].
AUSTEDO
Los efectos de los alimentos sobre la biodisponibilidad de AUSTEDO se estudiaron en sujetos a los que se les administró una dosis única con y sin alimentos. Los alimentos no tuvieron ningún efecto sobre el AUC de α-HTBZ o β-HTBZ, aunque la Cmáx aumentó aproximadamente un 50% en presencia de alimentos [ver Dosis y administración (2.1)].
Distribución
El volumen de distribución medio (Vc/F) de los metabolitos α-HTBZ y β-HTBZ de la deutetrabenazina es de aproximadamente 500 L y 730 L, respectivamente.
Los resultados de los estudios de TEP en humanos muestran que después de la inyección intravenosa de tetrabenazina o α-HTBZ marcada con 11C, la radiactividad se distribuye rápidamente al cerebro, con la unión más alta en el cuerpo estriado y la unión más baja en la corteza.
La unión a proteínas in vitro de tetrabenazina, α-HTBZ y β-HTBZ se examinó en plasma humano para concentraciones que oscilaban entre 50 y 200 ng/mL. La unión de tetrabenazina osciló entre el 82% y el 85%, la unión de α-HTBZ osciló entre el 60% y el 68%, y la unión de β-HTBZ osciló entre el 59% y el 63%.
Eliminación
AUSTEDO XR y AUSTEDO se eliminan principalmente por vía renal en forma de metabolitos.
La vida media de los metabolitos deuterados activos α-HTBZ, β-HTBZ y total (α+β)-HTBZ es de aproximadamente 12 horas, 7.5 horas y 9 a 11 horas, respectivamente.
Los valores de aclaramiento (CL/F) de los metabolitos α-HTBZ y β-HTBZ de AUSTEDO son de aproximadamente 65 L/hora y 200 L/hora, respectivamente, para un paciente con EH o DT de 70 kg con metabolismo funcional de CYP2D6 en estado posprandial.
La vida media de eliminación y el aclaramiento de AUSTEDO XR son similares a los de AUSTEDO.
Metabolismo
Los experimentos in vitro en microsomas hepáticos humanos demuestran que la deutetrabenazina se biotransforma ampliamente, principalmente por la carbonil reductasa, a sus principales metabolitos activos, α-HTBZ y β-HTBZ, que posteriormente se metabolizan principalmente por CYP2D6, con contribuciones menores de CYP1A2 y CYP3A4/5, para formar varios metabolitos menores.
Excreción
En un estudio de balance de masas en 6 sujetos sanos, del 75% al 86% de la dosis de deutetrabenazina se excretó en la orina, y la recuperación fecal representó del 8% al 11% de la dosis. La excreción urinaria de los metabolitos α-HTBZ y β-HTBZ de la deutetrabenazina representó cada uno menos del 10% de la dosis administrada. Los conjugados de sulfato y glucurónido de los metabolitos α-HTBZ y β-HTBZ de la deutetrabenazina, así como los productos del metabolismo oxidativo, representaron la mayoría de los metabolitos en la orina.
Poblaciones específicas
Pacientes masculinos y femeninos
No existe un efecto aparente del género en la farmacocinética de α-HTBZ y β‑HTBZ de la deutetrabenazina.
Pacientes con insuficiencia renal
No se han realizado estudios clínicos para evaluar el efecto de la insuficiencia renal en la farmacocinética de la deutetrabenazina y sus metabolitos primarios.
Pacientes con insuficiencia hepática
No se ha estudiado el efecto de la insuficiencia hepática en la farmacocinética de la deutetrabenazina y sus metabolitos primarios. Sin embargo, en un estudio clínico realizado para evaluar el efecto de la insuficiencia hepática en la farmacocinética de la tetrabenazina, un inhibidor de VMAT2 estrechamente relacionado, la exposición a α-HTBZ y β-HTBZ fue hasta un 40% mayor en pacientes con insuficiencia hepática, y la Cmáx media de tetrabenazina en pacientes con insuficiencia hepática fue hasta 190 veces mayor que en sujetos sanos [ver Contraindicaciones (4), Uso en poblaciones específicas (8.6)].
Metabolizadores CYP2D6 deficientes
Aunque la farmacocinética de la deutetrabenazina y sus metabolitos no se ha evaluado sistemáticamente en pacientes que no expresan la enzima metabolizadora de fármacos CYP2D6, es probable que la exposición a α-HTBZ y β-HTBZ aumente de manera similar a la toma de inhibidores potentes de CYP2D6 (aproximadamente 3 veces) [ver Dosis y administración (2.4), Interacciones farmacológicas (7.1)].
Estudios de interacción farmacológica
La deutetrabenazina, α-HTBZ y β-HTBZ no se han evaluado en estudios in vitro para la inducción o inhibición de enzimas CYP o la interacción con la glicoproteína P. Los resultados de los estudios in vitro de tetrabenazina no sugieren que la tetrabenazina o sus metabolitos α-HTBZ o β-HTBZ puedan producir una inhibición clínicamente significativa de CYP2D6, CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2E1 o CYP3A. Los estudios in vitro sugieren que ni la tetrabenazina ni sus metabolitos α-HTBZ o β-HTBZ pueden producir una inducción clínicamente significativa de CYP1A2, CYP3A4, CYP2B6, CYP2C8, CYP2C9 o CYP2C19. No es probable que ni la tetrabenazina ni sus metabolitos α-HTBZ o β-HTBZ sean un sustrato o inhibidor de la glicoproteína P a concentraciones clínicamente relevantes in vivo.
Los metabolitos de la deutetrabenazina, ácido 2-metilpropanoico de β-HTBZ (M1) y monohidroxi tetrabenazina (M4), se han evaluado en un panel de estudios in vitro de interacciones farmacológicas; los resultados indican que no se espera que M1/M4 causen interacciones farmacológicas clínicamente relevantes.
Inhibidores de CYP2D6
Los estudios in vitro indican que los metabolitos α-HTBZ y β-HTBZ de la deutetrabenazina son sustratos de CYP2D6. El efecto de la inhibición de CYP2D6 en la farmacocinética de la deutetrabenazina y sus metabolitos se estudió en 24 sujetos sanos después de una dosis única de 22,5 mg de deutetrabenazina administrada después de 8 días de administración del inhibidor potente de CYP2D6 paroxetina 20 mg al día. En presencia de paroxetina, la exposición sistémica (AUCinf) de α-HTBZ fue 1,9 veces mayor y la de β-HTBZ fue 6,5 veces mayor, lo que resultó en un aumento aproximado de 3 veces en el AUCinf para el total (α+β)-HTBZ. La paroxetina disminuyó el aclaramiento de los metabolitos α-HTBZ y β-HTBZ de AUSTEDO con los correspondientes aumentos en la vida media media de aproximadamente 1,5 veces y 2,7 veces, respectivamente. En presencia de paroxetina, la Cmáx de α-HTBZ y β-HTBZ fue 1,2 veces y 2,2 veces mayor, respectivamente.
No se ha evaluado el efecto de los inhibidores moderados o débiles de CYP2D6, como duloxetina, terbinafina, amiodarona o sertralina, en la exposición a la deutetrabenazina y sus metabolitos.
Digoxina
AUSTEDO XR y AUSTEDO no se evaluaron para la interacción con digoxina. La digoxina es un sustrato de la glicoproteína P. Un estudio en sujetos sanos demostró que la tetrabenazina (25 mg dos veces al día durante 3 días) no afectó a la biodisponibilidad de la digoxina, lo que sugiere que a esta dosis, la tetrabenazina no afecta a la glicoproteína P en el tracto intestinal. Los estudios in vitro tampoco sugieren que la tetrabenazina o sus metabolitos sean inhibidores de la glicoproteína P.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Carcinogénesis
No se realizaron estudios de carcinogenicidad con deutetrabenazina.
No se observó un aumento en los tumores en ratones transgénicos p53+/– tratados por vía oral con tetrabenazina a dosis de 0, 5, 15 y 30 mg/kg/día durante 26 semanas.
Mutagénesis
La deutetrabenazina y sus metabolitos deuterados α-HTBZ y β-HTBZ fueron negativos en ensayos in vitro (mutación inversa bacteriana y aberración cromosómica en linfocitos de sangre periférica humana) en presencia o ausencia de activación metabólica y en el ensayo de micronúcleos in vivo en ratones.
Deterioro de la Fertilidad
No se han evaluado los efectos de la deutetrabenazina sobre la fertilidad. La administración oral de deutetrabenazina (dosis de 5, 10 o 30 mg/kg/día) a ratas hembra durante 3 meses provocó una interrupción del ciclo estral a todas las dosis; la dosis más baja probada fue similar a la dosis humana máxima recomendada (48 mg/día) en función del área de superficie corporal (mg/m2).
La administración oral de tetrabenazina (dosis de 5, 15 o 30 mg/kg/día) a ratas hembra antes y durante el apareamiento, y continuando hasta el día 7 de gestación, provocó una interrupción del ciclo estral a dosis superiores a 5 mg/kg/día. No se observaron efectos en los índices de apareamiento y fertilidad o en los parámetros del esperma (motilidad, recuento, densidad) cuando los machos fueron tratados por vía oral con tetrabenazina a dosis de 5, 15 o 30 mg/kg/día antes y durante el apareamiento con hembras no tratadas.
14 ESTUDIOS CLÍNICOS
Los estudios descritos a continuación que establecen la eficacia para la enfermedad de Huntington y la discinesia tardía se realizaron con tabletas de AUSTEDO. La eficacia de AUSTEDO XR se basa en un estudio de biodisponibilidad relativa que compara las tabletas de AUSTEDO XR administradas una vez al día y las tabletas de AUSTEDO administradas dos veces al día [ver Farmacología clínica (12.3)].
14.1 Corea asociada con la enfermedad de Huntington
La eficacia de AUSTEDO como tratamiento para la corea asociada con la enfermedad de Huntington se estableció principalmente en el Estudio 1, un ensayo aleatorizado, doble ciego, controlado con placebo, multicéntrico realizado en 90 pacientes ambulatorios con corea manifiesta asociada con la enfermedad de Huntington. El diagnóstico de la enfermedad de Huntington se basó en la historia familiar, el examen neurológico y las pruebas genéticas. La duración del tratamiento fue de 12 semanas, incluido un período de titulación de dosis de 8 semanas y un período de mantenimiento de 4 semanas, seguido de un lavado de 1 semana. Los pacientes no fueron cegados a la interrupción. AUSTEDO se inició a 6 mg por día y se tituló hacia arriba, a intervalos semanales, en incrementos de 6 mg hasta que se logró un tratamiento satisfactorio de la corea, se produjeron efectos secundarios intolerables o hasta que se alcanzó una dosis máxima de 48 mg por día. El criterio de valoración principal de eficacia fue la puntuación total máxima de corea, un elemento de la Escala de calificación unificada de la enfermedad de Huntington (UHDRS). En esta escala, la corea se califica de 0 a 4 (con 0 que representa ninguna corea) para 7 partes diferentes del cuerpo. La puntuación total oscila entre 0 y 28.
De los 90 pacientes inscritos, 87 pacientes completaron el estudio. La edad media fue de 54 (rango de 23 a 74). Los pacientes fueron 56% hombres y 92% caucásicos. La dosis media después de la titulación fue de 40 mg por día. La Tabla 5 y la Figura 1 resumen los efectos de AUSTEDO en la corea según la puntuación total máxima de corea. Las puntuaciones totales máximas de corea para los pacientes que recibieron AUSTEDO mejoraron aproximadamente 4,4 unidades desde el inicio hasta el período de mantenimiento (promedio de la semana 9 y la semana 12), en comparación con aproximadamente 1,9 unidades en el grupo placebo. El efecto del tratamiento de -2,5 unidades fue estadísticamente significativo (p<0,0001). El criterio de valoración de mantenimiento es la media de las puntuaciones totales máximas de corea para las visitas de la semana 9 y la semana 12. En la visita de seguimiento de la semana 13 (1 semana después de la interrupción del medicamento del estudio), las puntuaciones totales máximas de corea de los pacientes que habían recibido AUSTEDO volvieron al nivel inicial (Figura 1).
| Criterio de valoración motor | AUSTEDO N = 45 |
Placebo N = 45 |
Valor p |
|---|---|---|---|
|
Cambio en la puntuación total de corea* desde el inicio hasta la terapia de mantenimiento† |
-4.4 |
-1.9 |
<0.0001 |
*TMC es una subescala de la Escala de Calificación Unificada de la Enfermedad de Huntington (UHDRS)
†Punto final de eficacia principal
Figura 1: Puntuación total máxima de corea a lo largo del tiempo en el estudio 1
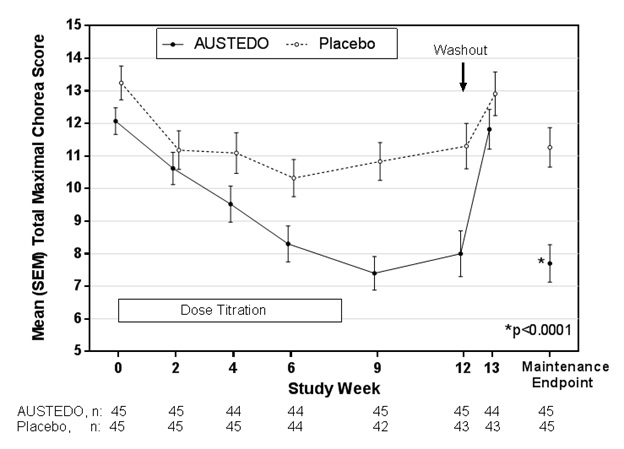
Figura 2: Distribución del cambio en las puntuaciones totales máximas de corea en el estudio 1
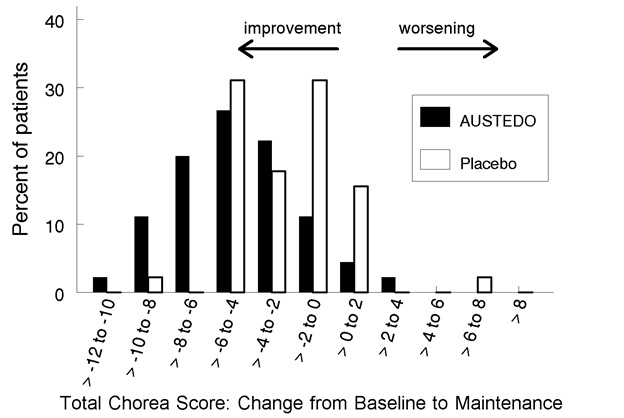
La figura 2 muestra la distribución de los valores para el cambio en la puntuación total máxima de corea en el estudio 1. Los valores negativos indican una reducción de la corea y los números positivos indican un aumento de la corea.
Una impresión global de cambio calificada por el paciente evaluó cómo los pacientes calificaron sus síntomas generales de la enfermedad de Huntington. El cincuenta y un por ciento de los pacientes tratados con AUSTEDO calificaron sus síntomas como “Mucho mejor” o “Mucho mejor” al final del tratamiento, en comparación con el 20% de los pacientes tratados con placebo.
En una impresión global clínica de cambio calificada por el médico, los médicos calificaron al 42% de los pacientes tratados con AUSTEDO como “Mucho mejor” o “Mucho mejor” al final del tratamiento en comparación con el 13% de los pacientes tratados con placebo.
14.2 Disquinesia tardía
La eficacia de AUSTEDO en el tratamiento de la disquinesia tardía se estableció en dos ensayos de 12 semanas, aleatorizados, doble ciego, controlados con placebo, multicéntricos, realizados en 335 pacientes adultos ambulatorios con disquinesia tardía causada por el uso de antagonistas de los receptores de dopamina. Los pacientes tenían antecedentes de uso de un antagonista de los receptores de dopamina (antipsicóticos, metoclopramida) durante al menos 3 meses (o 1 mes en pacientes de 60 años o más). Los diagnósticos concurrentes incluyeron esquizofrenia/trastorno esquizoafectivo (62%) y trastorno del estado de ánimo (33%). Con respecto al uso concomitante de antipsicóticos, el 64% de los pacientes recibieron antipsicóticos atípicos, el 12% recibieron antipsicóticos típicos o combinados y el 24% no recibieron antipsicóticos.
La Escala de Movimientos Involuntarios Anormales (AIMS) fue la medida principal de eficacia para la evaluación de la gravedad de la disquinesia tardía. La AIMS es una escala de 12 ítems; los ítems 1 a 7 evalúan la gravedad de los movimientos involuntarios en todas las regiones del cuerpo y estos ítems se utilizaron en este estudio. Cada uno de los 7 ítems se calificó en una escala de 0 a 4, calificada como: 0=no presente; 1=mínima, puede ser normal extrema (los movimientos anormales ocurren con poca frecuencia y/o son difíciles de detectar); 2=leve (los movimientos anormales ocurren con poca frecuencia y son fáciles de detectar); 3=moderada (los movimientos anormales ocurren con frecuencia y son fáciles de detectar) o 4 =grave (los movimientos anormales ocurren casi continuamente y/o de intensidad extrema). La puntuación total de AIMS (suma de los ítems 1 a 7) podría variar de 0 a 28, con una disminución de la puntuación que indica una mejora.
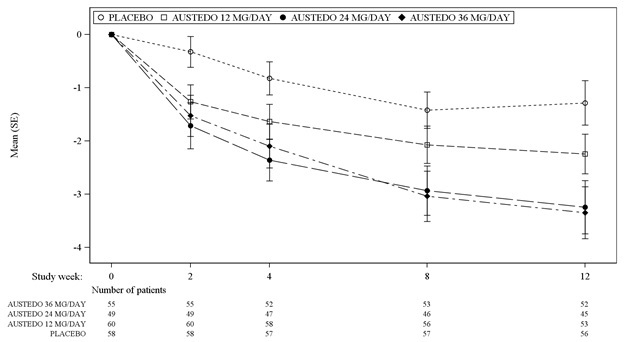
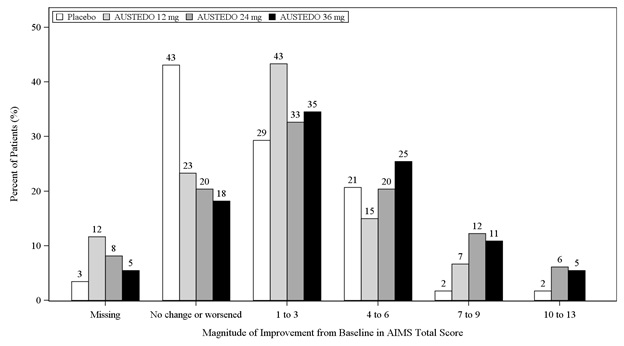
En el estudio 1, un ensayo de dosis fija de 12 semanas controlado con placebo, los adultos con disquinesia tardía se asignaron aleatoriamente 1:1:1:1 a 12 mg de AUSTEDO, 24 mg de AUSTEDO, 36 mg de AUSTEDO o placebo. La duración del tratamiento incluyó un período de escalada de dosis de 4 semanas y un período de mantenimiento de 8 semanas seguido de un lavado de 1 semana. La dosis de AUSTEDO se inició a 12 mg por día y se aumentó a intervalos semanales en incrementos de 6 mg/día hasta una dosis objetivo de 12 mg, 24 mg o 36 mg por día. La población (n= 222) tenía entre 21 y 81 años (media de 57 años), el 48% eran hombres y el 79% eran caucásicos. En el estudio 1, la puntuación total de AIMS para los pacientes que recibieron AUSTEDO demostró una mejora estadísticamente significativa, desde el inicio hasta la semana 12, de 3,3 y 3,2 unidades para los brazos de 36 mg y 24 mg, respectivamente, en comparación con 1,4 unidades en placebo (Estudio 1 en la Tabla 6). Las mejoras en la puntuación total de AIMS a lo largo del estudio se muestran en la Figura 3. Los datos no sugirieron diferencias sustanciales en la eficacia entre los distintos grupos demográficos. La distribución de la tasa de respuesta al tratamiento, basada en la magnitud de la puntuación total de AIMS desde el inicio hasta la semana 12, se muestra en la Figura 4.
Los cambios medios en la puntuación total de AIMS por visita se muestran en la Figura 3.
En el estudio 2, un ensayo de dosis flexible de 12 semanas controlado con placebo, los adultos con disquinesia tardía (n=113) recibieron dosis diarias de placebo o AUSTEDO, comenzando a 12 mg por día con aumentos permitidos en incrementos de 6 mg a intervalos de 1 semana hasta que se logró un control satisfactorio de la disquinesia, hasta que ocurrieron efectos secundarios intolerables, o hasta que se alcanzó una dosis máxima de 48 mg por día. La duración del tratamiento incluyó un período de titulación de dosis de 6 semanas y un período de mantenimiento de 6 semanas seguido de un lavado de 1 semana. La población tenía entre 25 y 75 años (media de 55 años), el 48% eran hombres y el 70% eran caucásicos. Los pacientes se titularon a una dosis óptima durante 6 semanas. La dosis promedio de AUSTEDO después del tratamiento fue de 38,3 mg por día. No hubo evidencia que sugiriera diferencias sustanciales en la eficacia entre los distintos grupos demográficos. En el estudio 2, la puntuación total de AIMS para los pacientes que recibieron AUSTEDO demostró una mejora estadísticamente significativa en 3,0 unidades desde el inicio hasta el punto final (semana 12), en comparación con 1,6 unidades en el grupo placebo con un efecto de tratamiento de -1,4 unidades. La Tabla 6 resume los efectos de AUSTEDO en la disquinesia tardía basados en la AIMS.
| Estudio | Grupo de tratamiento | Medida principal de eficacia: Puntuación total de AIMS | ||
|---|---|---|---|---|
| Puntuación media inicial (DE) | Cambio medio de LS desde el inicio (EE) | Efecto del tratamiento (IC del 95%) | ||
|
Estudio 1 |
AUSTEDO 36 mg* (n= 55) |
10.1 (3.21) |
-3.3 (0.42) |
-1.9 (-3.09, -0.79) |
|
AUSTEDO 24 mg (n= 49) |
9.4 (2.93) |
-3.2 (0.45) |
-1.8 (-3.00, -0.63) |
|
|
AUSTEDO 12 mg (n= 60) |
9.6 (2.40) |
-2.1 (0.42) |
-0.7 (-1.84, 0.42) |
|
|
Placebo (n= 58) |
9.5 (2.71) |
-1.4 (0.41) |
||
|
Estudio 2 |
AUSTEDO (12-48 mg/day)* (n= 56) |
9.7 (4.14) |
-3.0 (0.45) |
-1.4 (-2.6, -0.2) |
|
Placebo (n= 57) |
9.6 (3.78) |
-1.6 (0.46) |
||
*Dosis que fue estadísticamente significativamente diferente del placebo después de ajustar por multiplicidad.
LS Mean = Media de mínimos cuadrados; SD = Desviación estándar; SE = Error estándar; CI = Intervalo de confianza del 95% de 2 lados
Figura 3: Medias de mínimos cuadrados del cambio en la puntuación total de AIMS desde el inicio para AUSTEDO en comparación con el placebo (Estudio 1)
SE = Error estándar
Figura 4: Porcentaje de pacientes con una magnitud especificada de mejora de la puntuación total de AIMS al final de la semana 12 (Estudio 1)
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
16.1 Cómo se suministra
Las tabletas de liberación prolongada AUSTEDO XR se suministran en las siguientes configuraciones:
|
Fuerza |
Descripción |
Configuración del paquete |
Código NDC |
| 6 mg |
Tabletas redondas, recubiertas de gris, con “Q6” impreso en tinta negra en un lado |
Frasco con tapa a prueba de niños / 30 unidades | 68546-470-56 |
| 12 mg |
Tabletas redondas, recubiertas de azul, con “Q12” impreso en tinta negra en un lado |
Frasco con tapa a prueba de niños / 30 unidades | 68546-471-56 |
| 18 mg | Tabletas redondas, recubiertas de gris claro, con “Q18” impreso en tinta negra en un lado | Frasco con tapa a prueba de niños / 30 unidades | 68546-479-56 |
| 24 mg |
Tabletas redondas, recubiertas de morado, con “Q24” impreso en tinta negra en un lado |
Frasco con tapa a prueba de niños / 30 unidades | 68546-472-56 |
| 30 mg | Tabletas redondas, recubiertas de naranja claro, con “Q30” impreso en tinta negra en un lado | Frasco con tapa a prueba de niños / 30 unidades | 68546-473-56 |
| 36 mg | Tabletas redondas, recubiertas de morado claro, con “Q36” impreso en tinta negra en un lado | Frasco con tapa a prueba de niños / 30 unidades | 68546-474-56 |
| 42 mg | Tabletas redondas, recubiertas de naranja, con “Q42” impreso en tinta negra en un lado | Frasco con tapa a prueba de niños / 30 unidades | 68546-475-56 |
| 48 mg | Tabletas redondas, recubiertas de rosa, con “Q48” impreso en tinta negra en un lado | Frasco con tapa a prueba de niños / 30 unidades | 68546-476-56 |
Los kits de titulación para pacientes AUSTEDO XR se suministran en la siguiente configuración:
| Fuerza | Descripción | Configuración del paquete | Código NDC |
|
Kit de titulación para pacientes de 4 semanas |
|||
|
12 mg |
Tabletas redondas, recubiertas de azul, con “Q12” impreso en tinta negra en un lado |
Kit de titulación / 28 unidades Cada kit de titulación contiene 1 blíster a prueba de niños, que contiene una tarjeta de aluminio con tabletas de liberación prolongada en la siguiente configuración: Siete tabletas de 12 mg tomadas durante la semana 1; siete tabletas de 18 mg tomadas durante la semana 2; siete tabletas de 24 mg tomadas durante la semana 3; y siete tabletas de 30 mg tomadas durante la semana 4. |
68546-477-29 |
|
18 mg |
Tabletas redondas, recubiertas de gris claro, con “Q18” impreso en tinta negra en un lado |
||
| 24 mg | Tabletas redondas, recubiertas de morado, con “Q24” impreso en tinta negra en un lado | ||
|
30 mg |
Tabletas redondas, recubiertas de naranja claro, con “Q30” impreso en tinta negra en un lado |
||
Las tabletas de AUSTEDO se suministran en las siguientes configuraciones:
|
Fuerza |
Descripción |
Configuración del paquete |
Código NDC |
|
6 mg |
Tabletas redondas, recubiertas de color púrpura, con “SD” sobre “6” impreso en tinta negra en un lado |
Frasco con tapa a prueba de niños / 60 unidades |
68546-170-60 |
|
9 mg |
Tabletas redondas, recubiertas de color azul, con “SD” sobre “9” impreso en tinta negra en un lado |
Frasco con tapa a prueba de niños / 60 unidades |
68546-171-60 |
|
12 mg |
Tabletas redondas, recubiertas de color beige, con “SD” sobre “12” impreso en tinta negra en un lado |
Frasco con tapa a prueba de niños / 60 unidades |
68546-172-60
|
16.2 Almacenamiento
Almacenar a 25°C (77°F); se permiten excursiones a 15°C a 30°C (59°F a 86°F) [ver Temperatura ambiente controlada USP]. Proteger de la luz y la humedad. Dispensar en los envases originales o en envases herméticos según se define en USP.
17 INFORMACIÓN PARA EL PACIENTE
Avise al paciente o cuidador que lea la etiqueta del paciente aprobada por la FDA (Guía de medicamentos).
Instrucciones de administración
Indique a los pacientes que traguen AUSTEDO XR o AUSTEDO entero y que no mastiquen, trituren o rompan AUSTEDO XR o AUSTEDO [ver Dosificación y administración (2.1)].
AUSTEDO XR
Avise a los pacientes que tomen AUSTEDO XR con o sin alimentos en dosis una vez al día. Informe a los pacientes que no se preocupen si ocasionalmente notan algo que parece una cáscara de tableta en sus heces [ver Descripción (11)].
AUSTEDO
Avise a los pacientes que tomen AUSTEDO con alimentos. Avise a los pacientes que tomen dosis diarias de 12 mg o más en dos dosis divididas (dos veces al día).
Riesgo de depresión y suicidio en pacientes con enfermedad de Huntington
Avise a los pacientes, sus cuidadores y familias que AUSTEDO XR y AUSTEDO pueden aumentar el riesgo de depresión, empeoramiento de la depresión y suicidio, y que informen inmediatamente cualquier síntoma a un profesional de la salud [ver Contraindicaciones (4), Advertencias y precauciones (5.1)].
Prolongación del intervalo QTc
Informe a los pacientes que consulten a su médico de inmediato si se sienten débiles, pierden el conocimiento o tienen palpitaciones [ver Advertencias y precauciones (5.3)]. Avise a los pacientes que informen a los médicos que están tomando AUSTEDO XR o AUSTEDO antes de tomar cualquier medicamento nuevo.
Parkinsonismo
Informe a los pacientes que AUSTEDO XR y AUSTEDO pueden causar síntomas similares al Parkinson, que podrían ser graves. Avise a los pacientes que consulten a su profesional de la salud si experimentan temblores leves, rigidez corporal, dificultad para moverse, dificultad para mantener el equilibrio o caídas [ver Advertencias y precauciones (5.6)].
Riesgo de sedación y somnolencia
Avise a los pacientes que AUSTEDO XR y AUSTEDO pueden causar sedación y somnolencia y pueden afectar la capacidad para realizar tareas que requieren habilidades motoras y mentales complejas. Hasta que aprendan cómo responden a una dosis estable de AUSTEDO XR o AUSTEDO, los pacientes deben tener cuidado al realizar actividades que requieren que estén alerta, como conducir un automóvil u operar maquinaria [ver Advertencias y precauciones (5.7)].
Interacción con alcohol u otros medicamentos sedantes
Avise a los pacientes que el alcohol u otros medicamentos que causan somnolencia empeorarán la somnolencia [ver Interacciones medicamentosas (7.5)].
Medicamentos concomitantes
Avise a los pacientes que notifiquen a su médico todos los medicamentos que están tomando y que consulten con su profesional de la salud antes de comenzar cualquier medicamento nuevo debido a la posibilidad de interacciones [ver Contraindicaciones (4) e Interacciones medicamentosas (7.1, 7.4)].
Dispense con la Guía de medicamentos disponible en: www.tevausa.com/medguides
Fabricado para:
Teva Neuroscience, Inc.
Parsippany, NJ 07054
©2024 Teva Neuroscience, Inc.
AUS-012
AUSTEDO XR Números de patente de EE. UU.: 8,524,733; 9,550,780; 10,959,996; 11,179,386; 11,357,772; 11,311,488; 11,564,917; 11,446,291; 11,648,244
AUSTEDO Números de patente de EE. UU.: 8,524,733; 9,233,959; 9,296,739; 9,550,780; 9,814,708; 10,959,996; 11,179,386; 11,357,772; 11,564,917; 11,446,291; 11,648,244; 11,666,566
Guía de medicación
Dispense with Medication Guide available at: www.tevausa.com/medguides
|
GUÍA DEL MEDICAMENTO
AUSTEDO® (aw-STED-oh) |
|
¿Cuál es la información más importante que debo saber sobre AUSTEDO XR y AUSTEDO?
Llame a su proveedor de atención médica de inmediato si se deprime o tiene alguno de los siguientes síntomas, especialmente si son nuevos, peores o le preocupan:
|
|
¿Qué son AUSTEDO XR y AUSTEDO? AUSTEDO XR y AUSTEDO son medicamentos recetados que se usan para tratar:
No se sabe si AUSTEDO XR y AUSTEDO son seguros y efectivos en niños. |
|
¿Quién no debe tomar AUSTEDO XR o AUSTEDO? No tome AUSTEDO XR o AUSTEDO si:
|
|
Antes de tomar AUSTEDO XR o AUSTEDO, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si:
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos herbales. Tomar AUSTEDO XR o AUSTEDO con ciertos otros medicamentos puede causar efectos secundarios. No comience a tomar ningún medicamento nuevo mientras toma AUSTEDO XR o AUSTEDO sin hablar primero con su proveedor de atención médica. |
|
¿Cómo debo tomar AUSTEDO XR o AUSTEDO?
|
|
¿Qué debo evitar mientras tomo AUSTEDO XR o AUSTEDO? La somnolencia (sedación) es un efecto secundario común de AUSTEDO XR y AUSTEDO. Mientras toma AUSTEDO XR o AUSTEDO, no conduzca un automóvil ni opere maquinaria peligrosa hasta que sepa cómo AUSTEDO XR o AUSTEDO le afecta. Beber alcohol y tomar otros medicamentos que también pueden causar somnolencia mientras toma AUSTEDO XR o AUSTEDO puede aumentar cualquier somnolencia causada por AUSTEDO XR y AUSTEDO. |
|
¿Cuáles son los posibles efectos secundarios de AUSTEDO XR y AUSTEDO? AUSTEDO XR y AUSTEDO pueden causar efectos secundarios graves, que incluyen:
Los efectos secundarios más comunes de AUSTEDO en personas con enfermedad de Huntington incluyen:
Los efectos secundarios más comunes de AUSTEDO en personas con discinesia tardía incluyen:
Se espera que los efectos secundarios más comunes de AUSTEDO XR sean similares a los de AUSTEDO en personas con enfermedad de Huntington o discinesia tardía. Estos no son todos los posibles efectos secundarios de AUSTEDO XR o AUSTEDO. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede reportar efectos secundarios a la FDA al 1-800-FDA-1088. |
|
¿Cómo debo almacenar AUSTEDO XR y AUSTEDO?
Mantenga AUSTEDO XR y AUSTEDO y todos los medicamentos fuera del alcance de los niños. |
|
Información general sobre el uso seguro y eficaz de AUSTEDO XR y AUSTEDO. Los medicamentos a veces se recetan para fines distintos de los que se enumeran en una Guía de medicamentos. No use AUSTEDO XR o AUSTEDO para una condición para la que no fue recetado. No le dé AUSTEDO XR o AUSTEDO a otras personas, incluso si tienen los mismos síntomas que usted. Puede hacerles daño. Puede pedirle a su farmacéutico o proveedor de atención médica información sobre AUSTEDO XR y AUSTEDO que esté escrita para profesionales de la salud. |
|
¿Cuáles son los ingredientes en AUSTEDO XR y AUSTEDO? AUSTEDO XR: Ingrediente activo: deutetrabenazina Ingredientes inactivos: hidróxido de amonio, óxido de hierro negro, alcohol butílico, butilhidroxianisol, butilhidroxitolueno, acetato de celulosa, hidroxipropilcelulosa, hipromelosa, alcohol isopropílico, estearato de magnesio, polietilenglicol, polietilenglicol 3350, óxido de polietileno, alcohol polivinílico, propilenglicol, goma laca, cloruro sódico, talco, dióxido de titanio y FD&C red #40 lake. Las tabletas de liberación prolongada de 6 mg, 12 mg, 18 mg, 30 mg, 36 mg y 42 mg también contienen FD&C yellow #6 lake. Las tabletas de liberación prolongada de 6 mg, 12 mg, 24 mg y 36 mg también contienen FD&C blue #2 lake. Las tabletas de liberación prolongada de 18 mg también contienen carmín. AUSTEDO: Ingrediente activo: deutetrabenazina Ingredientes inactivos: hidróxido de amonio, óxido de hierro negro, alcohol n-butílico, butilhidroxianisol, butilhidroxitolueno, estearato de magnesio, manitol, celulosa microcristalina, polietilenglicol, óxido de polietileno, polisorbato 80, alcohol polivinílico, povidona, propilenglicol, goma laca, talco, dióxido de titanio y FD&C blue #2 lake. Las tabletas de 6 mg también contienen FD&C red #40 lake. Las tabletas de 12 mg también contienen FD&C yellow #6 lake. Fabricado para: ©2024 Teva Neuroscience, Inc. AUSMG-010 Para obtener más información, visite www.AUSTEDO.com o llame al 1-888-483-8279. |
| Esta Guía de Medicación ha sido aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos. Revisada: julio de 2024 |
Panel de visualización del paquete/etiqueta
NDC 68546-470-56 UNA VEZ AL DÍA
Austedo® XR (deutetrabenazina) tabletas de liberación prolongada
6 mg
30 tabletas
Se requiere la Guía de Medicamentos: Cada vez que se dispense AUSTEDO XR, entregue al paciente una Guía de Medicamentos. Imprima las Guías de Medicamentos en: www.tevausa.com/medguides
Panel de visualización del paquete/etiqueta
NDC 68546-471-56 UNA VEZ AL DÍA
Austedo® XR (deutetrabenazine) tabletas de liberación prolongada
12 mg
30 tabletas
Guía de medicamentos requerida: Cada vez que se dispense AUSTEDO XR, entregue al paciente una Guía de medicamentos. Imprima las Guías de medicamentos en: www.tevausa.com/medguides

Panel de visualización del paquete/etiqueta
NDC 68546-479-56 UNA VEZ AL DÍA
Austedo® XR (deutetrabenazina) comprimidos de liberación prolongada
18 mg
Se requiere la Guía de Medicamentos: Cada vez que se dispense AUSTEDO XR, entregue al paciente una Guía de Medicamentos. Imprima las Guías de Medicamentos en: www.tevausa.com/medguides
30 comprimidos

Panel de visualización del paquete/etiqueta
NDC 68546-472-56 UNA VEZ AL DÍA
Austedo® XR (deutetrabenazine) tabletas de liberación prolongada
24 mg
30 tabletas
Guía de Medicamentos Necesaria: Cada vez que se dispense AUSTEDO XR, entregue al paciente una Guía de Medicamentos. Imprima las Guías de Medicamentos en: www.tevausa.com/medguides

Panel de visualización del paquete/etiqueta
NDC 68546-473-56 ONCE-DAILY
Austedo® XR (deutetrabenazine) extended-release tablets
30 mg
Guía de Medicamentos Necesaria: Cada vez que se dispense AUSTEDO XR, entregue al paciente una Guía de Medicamentos. Imprima las Guías de Medicamentos en: www.tevausa.com/medguides
30 tabletas

Panel de visualización del paquete/etiqueta
NDC 68546-474-56 UNA VEZ AL DÍA
Austedo® XR (deutetrabenazina) comprimidos de liberación prolongada
36 mg
Se requiere la Guía de Medicamentos: Cada vez que se dispense AUSTEDO XR, entregue al paciente una Guía de Medicamentos. Imprima las Guías de Medicamentos en: www.tevausa.com/medguides
30 comprimidos

Panel de visualización del paquete/etiqueta
NDC 68546-475-56 UNA VEZ AL DÍA
Austedo® XR (deutetrabenazina) comprimidos de liberación prolongada
42 mg
Se requiere la Guía de Medicamentos: Cada vez que se dispense AUSTEDO XR, entregue al paciente una Guía de Medicamentos. Imprima las Guías de Medicamentos en: www.tevausa.com/medguides
30 comprimidos

Panel de visualización del paquete/etiqueta
NDC 68546-476-56 UNA VEZ AL DÍA
Austedo® XR (deutetrabenazina) tabletas de liberación prolongada
48 mg
Se requiere la Guía de Medicamentos: Cada vez que se dispense AUSTEDO XR, entregue al paciente una Guía de Medicamentos. Imprima las Guías de Medicamentos en: www.tevausa.com/medguides
30 tabletas

Panel de visualización del paquete/etiqueta
NDC 68546-490-52 ONCE-DAILY
Austedo® XR (deutetrabenazine) extended-release tablets
6 mg, 12 mg, 24 mg
Una vez al día
Kit de dosificación del paciente
4 SEMANAS
Rx Only
Guía de Medicamentos Necesaria: Cada vez que se dispense AUSTEDO XR, entregue al paciente la Guía de Medicamentos adjunta.
Imprima las Guías de Medicamentos en: www.tevausa.com/medguides Dispense en esta caja sellada. La caja mensual contiene 42 tabletas en 2 envases a prueba de niños, incluyendo 14 tabletas grises, cada una con 6 mg de deutetrabenazine, 14 tabletas azules, cada una con 12 mg de deutetrabenazine, y 14 tabletas moradas, cada una con 24 mg de deutetrabenazine.
teva
Panel de visualización del paquete/etiqueta
NDC 68546-477-29 ONCE-DAILY
Austedo® XR (deutetrabenazina) comprimidos de liberación prolongada
12 mg, 18 mg, 24 mg, 30 mg
Un comprimido, una vez al día
Kit de titulación para el paciente
4 SEMANAS
Sólo con receta médica
Guía de medicación requerida: Cada vez que se dispensan las AUSTEDO XR, entregue al paciente la guía de medicación adjunta.
Imprima las guías de medicación en: www.tevausa.com/medguides Dispense en este cartón sellado. El cartón mensual contiene 28 comprimidos en un blíster resistente a los niños, incluyendo 7 comprimidos azules, cada uno que contiene 12 mg de deutetrabenazina, 7 comprimidos gris claro, cada uno que contiene 18 mg de deutetrabenazina, 7 comprimidos morados, cada uno que contiene 24 mg de deutetrabenazina, 7 comprimidos naranjas claros, cada uno que contiene 30 mg de deutetrabenazina.
teva

Panel de visualización del paquete/etiqueta
NDC 68546-170-60
Austedo® (deutetrabenazina) comprimidos
6 mg
60 comprimidos
Guía de medicamentos requerida: Cada vez que se dispense AUSTEDO, entregue al paciente una Guía de medicamentos.

Panel de visualización del paquete/etiqueta
NDC 68546-171-60
Austedo® (deutetrabenazine) comprimidos
9 mg
60 comprimidos
Guía de medicamento requerida: Cada vez que se dispense AUSTEDO, entregar al paciente una Guía de medicamento.

Panel de visualización del paquete/etiqueta
NDC 68546 – 172 – 60
Austedo® (deutetrabenazine) comprimidos
12 mg
60 comprimidos
Guía de medicación requerida: Cada vez que se dispense AUSTEDO, entregue al paciente una Guía de medicación.

Panel de visualización del paquete/etiqueta
NDC 68546-182-70
AUSTEDO®
(deutetrabenazine) tablets
6 mg, 9 mg, 12 mg
4 Week
Patient Titration Kit
12 mg Starting Dose
SAMPLE – NOT FOR SALE
Rx Only
Medication Guide Required: Cada vez que se dispense AUSTEDO, entregue al paciente la Guía de medicamentos que lo acompaña.
Dispense en esta caja sellada.
La caja mensual contiene 70 tabletas en 3 paquetes a prueba de niños, incluyendo 28 tabletas moradas, cada una con 6 mg de deutetrabenazina, 28 tabletas azules, cada una con 9 mg de deutetrabenazina, y 14 tabletas beige, cada una con 12 mg de deutetrabenazina.
teva

Panel de visualización del paquete/etiqueta
NDC 68546-181-49
Rx Only
Corea asociada con la enfermedad de Huntington
Kit de dosificación del paciente de 4 semanas
Dosis inicial de 6 mg
AUSTEDO®(deutetrabenazine) tabletas
6 mg, 9 mg, 12 mg
| Semana | Tabletas por día |
| 1 | Tome 1 tableta (6 mg) cada mañana |
| 2 | Tome 1 tableta (6 mg) cada mañana y 1 tableta (6 mg) cada noche |
| 3 | Tome 1 tableta (9 mg) cada mañana y 1 tableta (9 mg) cada noche |
| 4 | Tome 1 tableta (12 mg) cada mañana y 1 tableta (12 mg) cada noche |
MUESTRA – NO APTA PARA LA VENTA
Guía de Medicamentos Necesaria: Cada vez que se dispense AUSTEDO, entregue al paciente la Guía de Medicamentos adjunta.
Dispense en este envase sellado.
El envase mensual contiene 49 tabletas en 2 envases a prueba de niños, que incluyen 21 tabletas moradas, cada una con 6 mg de deutetrabenazine, 14 tabletas azules, cada una con 9 mg de deutetrabenazine, y 14 tabletas beige, cada una con 12 mg de deutetrabenazine.
teva

Panel de visualización del paquete/etiqueta
NDC 68546-176-28 Rx Only
1 PRESIONE Y MANTENGA AQUÍ
Paquete de Titulación para Disquinesia Tardiva Dosis Inicial de 12 mg
AUSTEDO® (deutetrabenazina) tabletas
6 mg y 9 mg
MUESTRA – NO PARA LA VENTA
1 Presione y mantenga el botón 2 Saque la tarjeta
Guía de Medicamentos Requerida: Cada vez que se dispense AUSTEDO, entregue al paciente la Guía de Medicamentos que lo acompaña.
1 dispensador de tabletas que contiene 28 tabletas en el siguiente orden:
- Semana 1: 14 tabletas moradas que contienen 6 mg de deutetrabenazina
- Semana 2: 14 tabletas azules que contienen 9 mg de deutetrabenazina
2 SAQUE AQUÍ
teva

Panel de visualización del paquete/etiqueta
NDC 68546-177-21 Rx Only
1 PRESIONE Y MANTENGA AQUÍ
Corea asociada con la enfermedad de Huntington Paquete de titulación 6 mg Dosis inicial
AUSTEDO® (deutetrabenazina) tabletas
6 mg
MUESTRA – NO PARA LA VENTA
1 Presione y mantenga el botón 2 Saque la tarjeta
Guía de medicamentos requerida: Cada vez que se dispense AUSTEDO, entregue al paciente la Guía de medicamentos que lo acompaña.
1 dispensador de tabletas que contiene 21 tabletas en el siguiente orden:
- Semana 1: 7 tabletas moradas que contienen 6 mg de deutetrabenazina
- Semana 2: 14 tabletas moradas que contienen 6 mg de deutetrabenazina
2 SAQUE AQUÍ
teva


