Fabricante de medicamentos: GRIFOLS USA, LLC (Updated: 2023-06-06)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
ALPHANATE (FACTOR ANTIHEMOFÍLICO/FACTOR DE VON WILLEBRAND COMPLEJO [HUMANO])
Pólvora liofilizada para solución para inyección intravenosa
Aprobación inicial en EE. UU.: 1978
INDICACIONES Y USOS
ALPHANATE, (factor antihemofílico/factor de Von Willebrand complejo [humano]), se indica para: (1)
- Control y prevención de hemorragias en pacientes adultos y pediátricos con hemofilia A.
- Procedimientos quirúrgicos y/u operativos en pacientes adultos y pediátricos con enfermedad de Von Willebrand en los que el desmopresina (DDAVP) sea ineficaz o esté contraindicado. No está indicado para pacientes con enfermedad de Von Willebrand grave (tipo 3) sometidos a una cirugía mayor.
DOSIS Y ADMINISTRACIÓN
Solo para inyección intravenosa después de la reconstitución.
ALPHANATE contiene la cantidad etiquetada de factor VIII expresada en Unidades Internacionales (UI) FVIII/vial y factor de Von Willebrand:Actividad del cofactor de ristocetina en UI VWF:RCo/vial (2).
Dosis (2.1)
Tratamiento y prevención de episodios hemorrágicos y hemorragia excesiva durante y después de la cirugía en pacientes con hemofilia A
- Dosis (unidades) = peso corporal (kg) x incremento deseado de FVIII (IU/dL o % de normal) x 0,5 (IU/kg por IU/dL).
- Frecuencia de dosificación determinada por el tipo de episodio hemorrágico y la recomendación del médico tratante.
Tratamiento y prevención de hemorragia excesiva durante y después de la cirugía u otros procedimientos invasivos en pacientes con enfermedad de Von Willebrand
- Adultos: Dosis pre-operatoria de 60 UI VWF:RCo/kg de peso corporal; dosis subsiguientes de 40-60 UI VWF:RCo/kg de peso corporal.
- Pediátricos: Dosis pre-operatoria de 75 UI VWF:RCo/kg de peso corporal; dosis subsiguientes de 50-75 UI VWF:RCo/kg de peso corporal.
FORMAS Y POTENCIAS DE DOSIS
ALPHANATE está disponible como una pólvora liofilizada para inyección intravenosa después de la reconstitución en viales de dosis única que contienen 250, 500, 1000, 1500 y 2000 IU FVIII (3).
CONTRAINDICACIONES
No utilizar en pacientes que hayan manifestado reacciones de hipersensibilidad inmediatas que amenazan la vida, incluidas anafilaxis, al producto o sus componentes (4).
ADVERTENCIAS Y PRECAUCIONES
- Es posible la anafilaxis y reacciones de hipersensibilidad severas. Suspender el tratamiento con ALPHANATE y administrar el tratamiento de emergencia apropiado en caso de que ocurran síntomas de anafilaxis o reacciones de hipersensibilidad severas (5.1).
- Se puede producir el desarrollo de anticuerpos que neutralizan la actividad en pacientes que reciben productos que contengan FVIII (5.2).
- Pueden ocurrir eventos tromboembólicos (TE) en pacientes con enfermedad de Von Willebrand, especialmente con factores de riesgo conocidos. Monitorizar a los pacientes por signos y síntomas de TE (5.3).
- Puede ocurrir hemólisis intravascular con la perfusión de dosis grandes de Complejo de Factor Antihemofílico / Factor de Von Willebrand. Si se produce esta condición y conduce a anemia hemolítica progresiva, suspender la administración de ALPHANATE y considerar terapia alternativa (5.4).
- La administración rápida puede resultar en reacciones vasomotoras (5.5).
- ALPHANATE está elaborado a partir de plasma humano y puede conllevar un riesgo de transmisión de agentes infecciosos, por ejemplo, virus, el agente de la enfermedad de Creutzfeldt-Jakob variante (vCJD) y, en teoría, el agente de la enfermedad de Creutzfeldt-Jakob (CJD) (5.6).
- Realizar ensayos para determinar si están presentes inhibidores de FVIII (5.7).
REACCIONES ADVERSAS
Las reacciones adversas farmacológicas más frecuentes reportadas con ALPHANATE en > 1% de las infusiones fueron prurito, dolor de cabeza, dolor de espalda, parestesia, dificultad respiratoria, edema facial, dolor, erupción y escalofríos (6).
Para reportar REACCIONES ADVERSAS SOSPECHADAS, contacte a Grifols Biologicals LLC al 1-888-GRIFOLS (1-888-474-3657) o a la FDA al 1-800-FDA-1088 www.fda.gov/medwatch
USO EN POBLACIONES ESPECÍFICAS
Ver 17 para INFORMACIÓN DE ASESORAMIENTO AL PACIENTE.
Revisado: 11/2022
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
2 DOSIS Y ADMINISTRACIÓN
2.1 Dosis
2.2 Reconstitución
2.3 Administración
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de Hipersensibilidad
5.2 Anticuerpos Neutralizantes
5.3 Eventos Tromboembólicos
5.4 Hemólisis Intravascular
5.5 Reacciones Vasomotoras
5.6 Agentes Infecciosos Transmisibles
5.7 Monitoreo de Pruebas de Laboratorio
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Postcomercialización
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Trabajo de Parto y Parto
8.3 Madres Lactantes
8.4 Uso Pediátrico
8.5 Uso Geriátrico
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.3 Farmacocinética
14 ESTUDIOS CLÍNICOS
15 REFERENCIAS
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANIPULACIÓN
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están listadas.
1 INDICACIONES Y USO
ALPHANATE, (factor del antihemofílico / complejo del factor de von Willebrand [humano]), está indicado para:
- Controlar y prevenir episodios de hemorragia y gestionar el perioperatorio en pacientes adultos y pediátricos con deficiencia de factor VIII (FVIII) debido a hemofilia A.
- Procedimientos quirúrgicos y/o invasivos en pacientes adultos y pediátricos con enfermedad de von Willebrand (EvW) en los que la desmopresina (DDAVP) sea ineficaz o esté contraindicada. No está indicado para pacientes con EvW grave (Tipo 3) que se someten a cirugías mayores.
2 DOSIS Y ADMINISTRACIÓN
Sólo para inyección intravenosa tras la reconstitución
- El tratamiento con ALPHANATE debe iniciarse bajo la supervisión de un médico con experiencia en el tratamiento de la hemofilia.
- Cada vial de ALPHANATE tiene la potencia del factor antihemofílico (AHF) (actividad FVIII:C) expresada en Unidades Internacionales (IU) FVIII/vial en la etiqueta. Además, ALPHANATE contiene Factor de von Willebrand: Cofactor de Ristocetina (VWF:RCo), que se expresa en IU VWF:RCo/vial para el tratamiento de la enfermedad de von Willebrand (VWD).
2.1 Dosis
Tratamiento y prevención de episodios hemorrágicos y hemorragia excesiva durante y después de la cirugía en pacientes con hemofilia A
- La dosis y duración del tratamiento dependen de la gravedad del déficit de FVIII, la ubicación y extensión de la hemorragia, la presencia de inhibidores y la condición clínica del paciente. Un control cuidadoso de la terapia de reemplazo es especialmente importante en los casos de cirugía mayor o episodios hemorrágicos que ponen en peligro la vida.
- Los requisitos de dosificación y la frecuencia de dosificación se calculan sobre la base de una respuesta inicial esperada de un aumento del 2% del FVIII:C normal por IU FVIII:C/kg de peso corporal administrado.1El aumento esperado in vivo del nivel de FVIII expresado como IU/dL (o % de normal) puede estimarse utilizando las siguientes fórmulas:
Dosificación (unidades internacionales) = peso corporal (kg) x aumento deseado de FVIII (IU/dL o % normal) x 0,5 (IU/kg por IU/dL)
o
IU/dL (o % de normal) = [Dosis total (IU)/peso corporal (kg)] x 2
- Ajustar la dosis y la frecuencia a la respuesta clínica del paciente, incluyendo las necesidades individualizadas, la gravedad del déficit, la gravedad de la hemorragia, la presencia de inhibidores y el nivel de FVIII deseado. Los pacientes pueden variar en sus respuestas farmacocinéticas (por ejemplo, la vida media, in vivo recuperación) y clínicas a ALPHANATE.
- Tabla 1 proporciona directrices de dosificación para el control y la prevención de episodios hemorrágicos en pacientes con hemofilia A. La dosificación debe aspirar a mantener un nivel de actividad del factor VIII en plasma en o por encima de los niveles plasmáticos (en IU/dL o en % de normal) descritos en la tabla.
| Tipo de hemorragia | Nivel de FVIII:C requerido(% de normal) | Dosis(IU/kg) | Frecuencia de dosis(horas) | Duración del tratamiento (días) |
| Menor • Grandes hematomas • Cortes o raspaduras significativas • Hemorragia articular no complicada |
30 | 15 | 12 (dos veces al día) | Hasta que se detenga la hemorragia y se complete la cicatrización (1–2 días). |
| Moderada • Hemorragias nasales, bucales y gingivales • Extracciones dentales Hematuria |
50 | 25 | 12 (dos veces al día) |
Hasta que se complete la cicatrización (2–7 días, en promedio). |
| Mayor • Hemorragia articular • Hemorragia muscular • Traumatismo mayor • Hematuria • Hemorragia intracraneal y intraperitoneal |
80–100 | Inicial: 40–50
Mantenimiento: 25 |
12 (dos veces al día) |
Durante al menos 3–5 días
Hasta que se complete la cicatrización hasta 10 días. La hemorragia intracraneal puede requerir tratamiento profiláctico durante hasta 6 meses. |
| Cirugía | Antes de la cirugía: 80–100
Después de la cirugía: |
40–50 30–50 |
Una vez
12 |
Antes de la cirugía
Durante los próximos 7–10 días, o hasta que se complete la cicatrización. |
- Parámetros de monitorización:
- Monitoree periódicamente los niveles de FVIII en plasma para evaluar la respuesta individual del paciente al régimen de dosificación.
- Si los estudios de dosificación han determinado que un paciente en particular exhibe una respuesta más baja/más alta de lo esperado y una vida media más corta/más larga, ajuste la dosis y la frecuencia de administración en consecuencia.
- La falta de alcanzar el nivel de FVIII:C en plasma esperado o de controlar el sangrado después de una dosificación calculada adecuadamente puede indicar el desarrollo de un inhibidor (un anticuerpo a FVIII:C). Cuantifique el nivel del inhibidor mediante procedimientos de laboratorio apropiados y documente su presencia. El tratamiento con AHF en tales casos debe ser individualizado. 2
Tratamiento y prevención del sangrado excesivo durante y después de la cirugía u otros procedimientos invasivos en pacientes con enfermedad de von Willebrand
- La proporción de VWF:RCo a FVIII en ALPHANATE varía por lote, por lo que con cada nuevo lote, verifique las UI VWF:RCo/vial para garantizar una dosificación precisa.
- La dosis y la duración del tratamiento dependen de la gravedad de la deficiencia de VWF, la ubicación y la extensión del sangrado y la condición clínica del paciente. Un control cuidadoso de la terapia de reemplazo es especialmente importante en casos de cirugía mayor o episodios de sangrado que ponen en riesgo la vida.
- Las recuperaciones incrementales medianas in vivo de VWF:RCo y FVIII:C fueron 3.12 (UI/dL)/(UI/kg) [media, 3.29 ± 1.46 (UI/dL)/(UI/kg); rango: 1.28 a 5.73 (UI/dL)/(UI/kg)] para VWF:RCo y 1.95 (UI/dL)/(UI/kg) [media, 2.13 ± 0.58 (UI/dL)/(UI/kg); rango: 1.33 a 3.32 (UI/dL)/(UI/kg)] para FVIII:C.
- Tabla 2 proporciona pautas de dosificación para pacientes pediátricos y adultos con enfermedad de von Willebrand. 3-6
|
a El objetivo terapéutico se referencia en las Pautas de la NHLBI. 7 |
||
|
b El parámetro de seguridad se extrae de Mannucci 2009. 8 |
||
| Cirugía menor/sangrado menor | ||
| Parámetro | VWF:RCo | Objetivo Niveles de actividad de FVIII:C |
| Dosis preoperatoria/preprocedimiento: | Adultos: 60 UI VWF:RCo/kg de peso corporal. Pediátricos: 75 UI VWF:RCo/kg de peso corporal. |
40-50 UI/dL |
| Dosis de mantenimiento: | Adultos: 40 a 60 UI VWF:RCo/kg de peso corporal cada 8 a 12 horas según sea clínicamente necesario durante 1-3 días.
Pediátricos: 50 a 75 UI VWF:RCo/kg de peso corporal cada 8 a 12 horas según sea clínicamente necesario durante 1-3 días. |
40-50 UI/dL |
| Objetivo terapéutico (valle) a : | >50 UI/dL | >50 UI/dL |
| Monitorización de seguridad: | Pico y valle al menos una vez al día | Pico y valle al menos una vez al día |
| Parámetro de seguridad b : | No debe exceder 150 UI/dL | No debe exceder 150 UI/dL |
| Cirugía mayor / sangrado mayor | ||
| Parámetro | VWF:RCo | Objetivo Niveles de actividad de FVIII:C |
| Dosis preoperatoria/preprocedimiento: | Adultos: 60 UI VWF:RCo/kg de peso corporal. Pediátricos: 75 UI VWF:RCo/kg de peso corporal. |
100 UI/dL |
| Dosis de mantenimiento: | Adultos: 40 a 60 UI VWF:RCo/kg de peso corporal cada 8 a 12 horas según sea clínicamente necesario durante al menos 3-7 días. Pediátricos: 50 a 75 UI VWF:RCo/kg de peso corporal cada 8 a 12 horas según sea clínicamente necesario durante al menos 3-7 días. |
100 UI/dL |
| Objetivo terapéutico (valle) a : | >50 UI/dL | >50 UI/dL |
| Monitorización de seguridad: | Pico y valle al menos una vez al día | Pico y valle al menos una vez al día |
| Parámetro de seguridad b: | No debe exceder 150 UI/dL | No debe exceder 150 UI/dL |
2.2 Reconstitución
- Utilice siempre una técnica aséptica.
- Asegúrese de que el concentrado (ALPHANATE) y el diluyente (Agua estéril para inyección, USP) estén a temperatura ambiente (pero no por encima de 37 ˚C) antes de la reconstitución.
- Retire la tapa de plástico que se desprende del frasco de diluyente.
- Limpie suavemente la superficie expuesta del tapón con un agente limpiador como alcohol, intentando evitar dejar exceso de agente limpiador en el tapón.
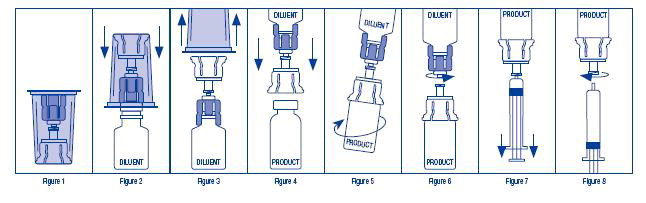
- Abra el paquete Mix2Vial despegando la tapa (Figura 1). Deje el Mix2Vial en el embalaje exterior transparente.
- Coloque el frasco de diluyente en posición vertical sobre una superficie pareja y sujete el frasco firmemente y levante el Mix2Vial en su embalaje exterior transparente. Sujete firmemente el frasco de diluyente y empuje el extremo azul del Mix2Vial verticalmente hacia abajo a través del tapón del frasco de diluyente (Figura 2).
- Mientras mantiene el frasco de diluyente, retire con cuidado el embalaje exterior transparente del conjunto Mix2Vial, asegurándose de que el Mix2Vial permanezca unido al frasco de diluyente (Figura 3).
- Coloque el frasco de producto en posición vertical sobre una superficie pareja, invierta el frasco de diluyente con el Mix2Vial unido.
- Mientras sujeta firmemente el frasco de producto en una superficie plana, empuje el extremo transparente del conjunto Mix2Vial verticalmente hacia abajo a través del tapón del frasco de producto (Figura 4). El diluyente se transferirá automáticamente de su frasco al frasco de producto.
NOTA: Si el Mix2Vial está conectado en un ángulo, el vacío puede liberarse del frasco de producto y el diluyente no se transferirá al frasco de producto.
- Con los frascos de diluyente y de producto todavía unidos al Mix2Vial, agite suavemente el frasco de producto para asegurar que el producto se disuelva completamente (Figura 5). La reconstitución requiere menos de 5 minutos. No agite el frasco.
- Desconecte el Mix2Vial en dos piezas separadas (Figura 6) sujetando cada adaptador de frasco y girando en sentido antihorario. Después de separar, descarte el frasco de diluyente con el extremo azul del Mix2Vial.
- Inyecte aire en una jeringa estéril vacía. Mientras mantiene el frasco de producto en posición vertical con el extremo transparente del Mix2Vial unido, atornille la jeringa desechable en la parte del cierre Luer del dispositivo Mix2Vial presionando y girando en sentido horario. Inyecte aire en el frasco de producto.
- Mientras mantiene el émbolo de la jeringa presionado hacia abajo, invierta el sistema al revés y extraiga el producto reconstituido en la jeringa tirando lentamente del émbolo hacia atrás (Figura 7).
- Cuando el producto reconstituido haya sido transferido a la jeringa, sostenga firmemente el cilindro de la jeringa y el adaptador de frasco transparente (manteniendo el émbolo de la jeringa hacia abajo) y desenrosque la jeringa del Mix2Vial (Figura 8). Mantenga la jeringa en posición vertical y empuje el émbolo hasta que no quede aire en la jeringa. Conecte la jeringa a un conjunto de venipunción.
NOTA: Si el mismo paciente va a recibir más de un frasco de concentrado, el contenido de dos frascos puede ser extraído en la misma jeringa a través de un conjunto Mix2Vial separado sin usar antes de conectarlo al conjunto de venipunción.
- Cuando se sigue estrictamente el procedimiento de reconstitución, pueden ocasionalmente quedar algunas pequeñas partículas. El conjunto Mix2Vial eliminará las partículas y la potencia etiquetada no se reducirá.
- Descarte todo el equipamiento de reconstitución después de usarlo en el recipiente de seguridad apropiado. No lo reutilice.
- Use la droga preparada lo antes posible dentro de las 3 horas después de la reconstitución.
2.3 Administración
Solo para uso intravenoso después de la reconstitución
- Inspeccione visualmente los productos farmacéuticos parenterales en busca de partículas y decoloración antes de la administración, siempre que la solución y el recipiente lo permitan.
- No refrigere después de la reconstitución. Guarde el ALPHANATE reconstituido a temperatura ambiente (no superior a 30 °C) antes de la administración, pero administre por vía intravenosa en un plazo de tres horas.
- Use jeringas desechables de plástico.
- No administre ALPHANATE a una velocidad superior a 10 mL/minuto.
- Descarte cualquier contenido no utilizado en el recipiente de seguridad apropiado.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
ALPHANATE está disponible en forma de polvo liofilizado para inyección intravenosa después de la reconstitución. Está disponible en las siguientes potencias:
250 UI FVIII/5 mL vial de dosis única
500 UI FVIII/5 mL vial de dosis única
1000 UI FVIII/10 mL vial de dosis única
1500 UI FVIII/10 mL vial de dosis única
2000 UI FVIII/10 mL vial de dosis única
4 CONTRAINDICACIONES
ALPHANATE está contraindicado en pacientes que hayan manifestado reacciones de hipersensibilidad inmediata que pongan en peligro la vida, incluidas anafilaxis, al producto o sus componentes [véase Reacciones adversas (6)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de hipersensibilidad
Con ALPHANATE es posible que se produzcan anafilaxis y reacciones de hipersensibilidad graves. Los signos precoces de las reacciones alérgicas, que pueden evolucionar hasta la anafilaxis, pueden incluir edema angioneurótico, opresión torácica, hipotensión, erupción cutánea, náuseas, vómitos, parestesias, inquietud, sibilancias y disnea. Suspenda el uso de ALPHANATE si se producen síntomas de hipersensibilidad e inicie el tratamiento apropiado.
5.2 Anticuerpos neutralizantes
Se ha detectado el desarrollo de anticuerpos (inhibidores) que neutralizan la actividad procoagulante en pacientes que reciben productos que contienen FVIII. supervise cuidadosamente a los pacientes tratados con productos de AHF para el desarrollo de inhibidores de FVIII mediante las observaciones clínicas y las pruebas de laboratorio adecuadas. No se han realizado estudios específicos con ALPHANATE para evaluar la formación de inhibidores. Si no se alcanzan los niveles de actividad de FVIII plasmática previstos, o si el sangrado no se controla con una dosis apropiada, realice un análisis adecuado que mida la concentración de inhibidores de FVIII.
5.3 Eventos tromboembólicos
Se han notificado eventos tromboembólicos en pacientes con enfermedad de Von Willebrand que reciben terapia de reemplazo con complejos de factor antihemofílico/factor de Von Willebrand, especialmente en aquellos con factores de riesgo conocidos de trombosis, incluidos, pero no limitados a, edad avanzada, trombosis previa, síndrome metabólico, cáncer, cirugía, anticonceptivos orales y terapia hormonal, diabetes, hipertensión, hiperlipidemia, tabaquismo y embarazo.9 Supervise los niveles plasmáticos de VWF:RCo y actividades de FVIII para evitar niveles sostenidos excesivos de VWF y FVIII (mayores de 150 UI/dL), lo que puede aumentar el riesgo de eventos trombóticos, durante el tratamiento continuado con complejos de factor antihemofílico/Factor de Von Willebrand. Considere medidas antitrombóticas en pacientes con EVD en riesgo de trombosis [véase Reacciones adversas (6)].
5.4 Hemólisis intravascular
ALPHANATE contiene isoaglutininas específicas de grupo sanguíneo. Supervise al paciente en busca de signos de hemólisis intravascular y disminución del hematocrito cuando se requieren dosis grandes y/o frecuentes de complejos de factor antihemofílico/factor de Von Willebrand en pacientes de grupos sanguíneos A, B o AB, ya que se han notificado casos de anemia hemolítica aguda, tendencia al sangrado aumentada o hiperfibrinogenemia. Estos eventos generalmente disminuyen después del cese de la infusión del concentrado del factor.10 Considere una terapia alternativa si esta condición empeora a pesar de la suspensión de ALPHANATE.
5.5 Reacciones vasomotoras
La administración rápida de un concentrado de FVIII puede ocasionar reacciones vasomotoras. No administre ALPHANATE a una velocidad superior a 10 mL/minuto.
5.6 Agentes infecciosos transmisibles
Debido a que ALPHANATE está fabricada a partir de plasma humano, puede conllevar el riesgo de transmitir agentes infecciosos, por ejemplo, virus, el agente de la enfermedad de Creutzfeldt-Jakob variante (vCJD) y, en teoría, el agente de la enfermedad de Creutzfeldt-Jakob (CJD). El riesgo de que estos productos transmitan un agente infeccioso se ha reducido mediante el screening de los donantes de plasma para detectar la exposición previa a ciertos virus, mediante pruebas para la presencia de ciertas infecciones víricas y mediante la inactivación y/o eliminación de ciertos virus durante la fabricación. [véase Descripción (11)].
5.7 Monitoreo de pruebas de laboratorio
Supervise el desarrollo de inhibidores de FVIII y VWF. Realice análisis adecuados para determinar si existen inhibidores de FVIII y/o VWF si el sangrado no se controla con la dosis prevista de ALPHANATE.
Supervise los niveles plasmáticos de VWF:RCo y actividades de FVIII para evitar niveles sostenidos excesivos de VWF y FVIII (mayores de 150 UI/dL), que pueden aumentar el riesgo de eventos trombóticos, especialmente en pacientes con factores de riesgo conocidos.
6 REACCIONES ADVERSAS
Las reacciones adversas graves a las drogas (RAD) observadas en pacientes que reciben ALPHANATE incluyen anafilaxis / reacciones de hipersensibilidad. También se han observado eventos tromboembólicos en pacientes que reciben ALPHANATE para VWD [ver Advertencias y Precauciones (5.3)].
6.1 Experiencia de ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variadas, las tasas de reacción adversa a la droga (RAD) observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y puede que no reflejen las tasas observadas en la práctica clínica.
Hemofilia A
En un estudio clínico prospectivo con ALPHANATE, 23 sujetos estuvieron expuestos a 1217 infusiones (mediana = 42, rango 2-160). El número total de días de exposición fue de 1133 y el número total de meses en estudio en todos los sujetos fue de 234 (19.5 años sujetos). No se reportaron RAD ni inhibidores de FVIII durante el estudio.
Enfermedad de von Willebrand
En el estudio clínico prospectivo de ALPHANATE [utilizando tanto ALPHANATE Solvent Detergent (A-SD, un producto de la generación anterior) y ALPHANATE Solvent Detergent/Heat Treated (A-SD/HT, el producto de la generación actual)] en sujetos con enfermedad de von Willebrand, se produjeron RAD en 5 de 36 sujetos (13.9%) tratados con ALPHANATE.
Se reportaron un total de sesenta y una RAD en 204 infusiones. La mayoría de las RAD se calificaron como leves (55 de 61 [90.2%]). Seis RAD (9.8%) se calificaron como moderadas. No se reportaron reacciones calificadas como graves. La escala de graduación de reacción adversa a la droga se define de la siguiente manera:
- Ligera: se observó el evento pero la administración del compuesto no se interrumpió; el evento se resolvió espontáneamente o no se requirió tratamiento más allá de la administración de analgésicos sin receta.
- Moderada: la administración del compuesto no se interrumpió necesariamente; el evento requirió tratamiento momentáneo con medicamentos recetados y no produjo secuelas.
En general, la proporción de infusiones asociadas con RAD fue de 14 de 204 infusiones (6.9%).
Las RAD más comunes reportadas (> 1% de infusiones) fueron prurito, dolor de cabeza, dolor de espalda, parestesia, dificultad respiratoria, edema facial, dolor, sarpullido y escalofríos.
Se reportó un incidente de embolismo pulmonar que se consideró que podría tener una posible relación con el producto. Este sujeto recibió una dosis de 60 IU VWF:RCo/kg de peso corporal y el nivel de FVIII:C alcanzado fue del 290%.
En el estudio retrospectivo realizado para determinar la eficacia y seguridad de ALPHANATE (A-SD/HT) en un entorno de procedimiento quirúrgico o invasivo como profilaxis perioperatoria contra el sangrado excesivo, [ver Estudios Clínicos (14)], 3 de 39 sujetos (7.7%) experimentaron 6 reacciones adversas a la droga. Cuatro se consideraron leves y dos se consideraron moderadas. Ningún sujeto suspendió su tratamiento debido a una reacción adversa a la droga. Las reacciones adversas a la droga fueron prurito, parestesia (2 eventos) y hemorragia (todos considerados leves), y un evento cada uno de disminución moderada de hematocrito e hipotensión ortostática.
Se informó de una reacción adversa a la droga (dolor) relacionada con el tratamiento con ALPHANATE tratado térmicamente (A-SD/HT) en cuatro sujetos pediátricos con enfermedad de von Willebrand durante el curso del estudio prospectivo y en ninguno de los cinco sujetos pediátricos en el estudio clínico retrospectivo.
6.2 Experiencia post-comercialización
Debido a que estas reacciones se reportan voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición a la droga.
Las RAD más comunes reportadas en la post-comercialización incluyen reacciones alérgicas / de hipersensibilidad, náuseas, fiebre, dolor articular, fatiga y dolor en el sitio de infusión.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Categoría C de embarazo. No se han realizado estudios de reproducción animal con ALPHANATE. También se desconoce si ALPHANATE puede causar daño fetal cuando se administra a una mujer embarazada o afectar la capacidad reproductiva. ALPHANATE solo debe administrarse a una mujer embarazada si es claramente necesario.
8.4 Uso pediátrico
Hemofilia A
Un total de 21 niños (de 7 a 16 años) participaron en ensayos clínicos con ALPHANATE. Los sujetos recibieron ALPHANATE semanalmente para profilaxis o para tratar hemorragias sospechosas. Se les trató con éxito para 1499 episodios de sangrado o como profilaxis para prevenirlos (por ejemplo, dolor en las articulaciones). La mediana de unidades necesarias para tratar las hemorragias fue de 420 UI, con un rango de 210 a 1620 UI. Los sujetos adultos y pediátricos no difirieron en su respuesta al tratamiento.
Enfermedad de von Willebrand
La eficacia hemostática de ALPHANATE se ha estudiado en 20 sujetos pediátricos (de 7 a 18 años) con VWD. Según los datos de un subconjunto de estos sujetos, la edad no tuvo efecto en la farmacocinética de VWF:RCo. Los sujetos adultos y pediátricos no difirieron en su respuesta al tratamiento.
11 DESCRIPCIÓN
ALPHANATE, (factor de antihemofilia/von Willebrand factor complejo [humano]), es un concentrado estéril, liofilizado de FVIII (AHF) y factor von Willebrand (VWF).
ALPHANATE se prepara a partir de plasma humano en pool por crioprecipitación de FVIII, solubilización fraccionada y purificación ulterior empleando agarosa reticulada y acoplada a heparina, que tiene afinidad por el dominio de unión a heparina del complejo VWF/FVIII:C. El producto se trata con una mezcla de tri-n-butyl phosphate (TNBP) y polisorbato 80 para inactivar virus envoltados. El producto también se somete a un paso de tratamiento térmico a 80 °C durante 72 horas para inactivar virus envoltados y no envoltados. Sin embargo, ningún procedimiento ha demostrado ser totalmente eficaz en eliminar la infectividad viral de los productos de factor de coagulación.
ALPHANATE se etiqueta con la potencia del factor antihemofílico (actividad FVIII:C) en Unidades Internacionales (IU) FVIII/vial y con la actividad VWF:RCo expresada en IU VWF:RCo/vial. Las actividades se refieren a sus respectivas normas internacionales establecidas por la Organización Mundial de la Salud. Una IU de FVIII o una IU de VWF:RCo es aproximadamente igual a la cantidad de actividad FVIII o VWF:RCo en 1 mL de plasma humano fresco en pool.
ALPHANATE contiene albúmina humana como estabilizante, resultando en un concentrado en el contenedor final con una actividad específica de al menos 5 IU FVIII:C/mg de proteína total. ALPHANATE no contiene conservantes.
La composición de ALPHANATE después de la reconstitución es la siguiente:
|
a Suministrado en un vial de diluyente separado |
||||||
| Nombre de los ingredientes | Composición nominal | Unidades/contenedor | ||||
| Factor VIII | 250 | 500 | 1000 | 1500 | 2000 | IU |
| Factor von Willebrand | > 400 | > 400 | > 400 | > 400 | > 400 | IU por 1000 UI Factor VIII |
| Albúmina (humana) | 25 | 25 | 50 | 50 | mg | |
| Arginina | 90 | 90 | 175 | 175 | mg | |
| Histidina | 20 | 20 | 40 | 40 | mg | |
| Agua para inyeccióna | 5 | 5 | 10 | 10 | mL | |
Capacidad de Reducción Viral
Los resultados de los estudios de validación viral realizados para determinar los factores de reducción viral asociados con varios pasos en el proceso de fabricación de ALPHANATE se resumen en Tabla 3.
In vitro se realizaron estudios de inactivación para evaluar el paso de tratamiento con solvente detergente (0.3% Fosfato de tri-n-butilo y 1.0% Polisorbato 80) en la fabricación de ALPHANATE para evaluar la capacidad del paso para inactivar virus envueltos, como los virus de la inmunodeficiencia humana (VIH), así como virus marcadores como el virus Sindbis (SIN, un modelo para el virus de la hepatitis C), el virus de la estomatitis vesicular (VSV, un modelo para los virus ARN envueltos grandes), el virus del herpes bovino (BHV, un modelo para el virus de la hepatitis B) y el virus de la diarrea viral bovina (BVD, un modelo para el virus de la hepatitis C). In vitro Se realizaron estudios de inactivación para evaluar el paso de tratamiento térmico en seco (80 °C, 72 horas) en la fabricación de ALPHANATE para evaluar la capacidad del paso para inactivar tanto virus envueltos como no envueltos, como el virus de la hepatitis A (HAV), el poliovirus humano Sabin tipo 2 (POL, un modelo para HAV), el parvovirus canino (CPV, un modelo para el parvovirus B19), BHV y BVD. Otros pasos en el proceso de fabricación de ALPHANATE (precipitación con 3.5% polietilenglicol (PEG), cromatografía de afinidad a heparina y liofilización) también se evaluaron para la capacidad de eliminación de virus utilizando varios virus envueltos y no envueltos como se muestra en Tabla 3.
|
Virus (Virus Modelo para) |
3.5% PEG Precipitación |
Solvente- Detergente |
Columna Cromatografía |
Liofilización | Ciclo de Calor Seco (80 °C, 72 horas) |
Reducción Logarítmica Total |
| BHV (HBV) |
< 1.0 | ≥ 8.0 | 7.6 | 1.3 | 2.1 | ≥ 19.0 |
| BVD (HCV) |
< 1.0 | ≥ 4.5 | < 1.0 | < 1.0 | ≥ 4.9 | ≥ 9.4 |
| POL (HAV) |
3.3 | – | < 1.0 | 3.4 | ≥ 2.5 | ≥ 9.2 |
| CPV (B19) |
1.2 | – | < 1.0 | < 1.0 | 4.1 | 5.3 |
| VSV | – | ≥ 4.1 | – | – | – | ≥ 4.1 |
| SIN (HCV) |
– | ≥ 4.7 | – | – | – | ≥ 4.7 |
| HIV–1 | < 1.0 | ≥ 11.1 | ≥ 2.0 | – | – | ≥ 13.1 |
| HIV–2 | – | ≥ 6.1 | – | – | – | ≥ 6.1 |
| HAV | – | – | – | 2,1 | ≥ 5,8 | ≥ 7,9 |
Además, se investigó el proceso de fabricación por su capacidad para disminuir la infectividad de un agente experimental de encefalopatía espongiforme transmisible (EET), considerado como un modelo para los agentes de la variante de la enfermedad de Creutzfeldt-Jakob (vCJD) y la enfermedad de Creutzfeldt-Jakob (CJD).
Varias de las etapas individuales de producción en el proceso de fabricación de ALPHANATE han demostrado disminuir la infectividad de un agente experimental modelo de EET. 11 Las etapas de reducción de EET incluyen: precipitación con polietilenglicol al 3,5% (3,23 log 10), cromatografía de afinidad (3,50 log 10) y precipitación en solución salina (1,36 log 10). Estos estudios brindan un razonable aseguramiento de que niveles bajos de infectividad del agente de CJD/vCJD, si están presentes en el material inicial, serían eliminados.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
ALPHANATE contiene factor antihemofílico (FVIII) y factor de von Willebrand (VWF), constituyentes del plasma normal. El FVIII es un cofactor esencial en la activación del factor X que conduce a la formación de trombina y fibrina. El VWF promueve la agregación de plaquetas y la adhesión de las plaquetas en el endotelio vascular dañado; también sirve como una proteína portadora estabilizadora para la proteína procoagulante FVIII. 12, 13
Después de la administración, ALPHANATE reemplaza temporalmente el factor de coagulación VIII y el factor de von Willebrand que faltan y que son necesarios para una hemostasia efectiva.
12.3 Farmacocinética
Farmacocinética en la hemofilia A
Después de la administración de ALPHANATE durante los ensayos clínicos, la mediana de la vida media in vivo del FVIII observada en 12 sujetos adultos con hemofilia A grave fue de 17.9 ± 9.6 horas. En el mismo estudio, la recuperación in vivo fue del 96.7 ± 14.5% a los 10 minutos después de la infusión. La recuperación a los 10 minutos después de la infusión también se determinó como un aumento de 2.4 ± 0.4 UI de FVIII/dL de plasma por UI de FVIII infundido/kg de peso corporal.
Farmacocinética en la enfermedad de von Willebrand (VWD)
Se llevó a cabo un estudio de cruce farmacocinético en 14 sujetos no hemorrágicos con VWD (1 tipo 1, 2 tipo 2A y 11 tipo 3) comparando la farmacocinética de ALPHANATE (A-SD / HT) y una formulación anterior, ALPHANATE (A-SD). Los sujetos recibieron, en orden aleatorio con un intervalo de al menos siete días, una dosis intravenosa única de cada producto, 60 UI de VWF: RCo / kg (75 UI de VWF: RCo / kg en sujetos menores de 18 años de edad). Los parámetros farmacocinéticos eran similares para los dos productos e indicaban que eran bioquímicamente equivalentes. El análisis farmacocinético de ALPHANATE (A-SD / HT) en los 14 sujetos reveló los siguientes resultados: los niveles plasmáticos medianos (% normal) de VWF: RCo aumentaron de 10 UI / dL (rango: 10 a 27 UI / dL) en el punto basal a 206 UI / dL (rango: 87 a 440 UI / dL) 15 minutos después de la infusión; los niveles plasmáticos medianos de FVIII: C aumentaron de 5 UI / dL (rango: 2 a 114 UI / dL) a 206 UI / dL (rango: 110 a 421 UI / dL). El tiempo de sangrado (BT) mediano antes de la infusión fue de 30 minutos (media, 28.8 ± 4.41 minutos; rango: 13.5 a 30 minutos), el cual se acortó a 10.38 minutos (media, 10.4 ± 3.2 minutos; rango: 6 a 16 minutos) 1 hora después de la infusión.
Después de la infusión de ALPHANATE (A-SD / HT), las medias de vida media para VWF: RCo, FVIII: C y VWF: Ag fueron de 6.91 horas (rango: 3.8 a 16.22 horas), 20.92 horas (rango: 7.19 a 32.2 horas) y 12.8 horas (rango: 10.34 a 17.45 horas), respectivamente. La mediana de la recuperación incremental in vivo de VWF: RCo y FVIII: C fue 3.12 (UI / dL) / (UI / kg) [rango: 1.28 a 5.73 (UI / dL) / (UI / kg)] para VWF: RCo y 1.95 (UI / dL) / (UI / kg) [rango: 1.33 a 3.32 (UI / dL) / (UI / kg)] para FVIII: C.
Los datos farmacocinéticos en VWD se resumen en Tabla 4.
| Parámetro |
Plasma VWF: RCo (Media ± DE) |
Plasma FVIII: C (Media ± DE) |
Plasma VWF: Ag (Media ± DE) |
| Número de pacientes | 14 | 14 | 14 |
| Niveles plasmáticos medios (UI/dL) | |||
| Punto basal | 11.86 ± 4.97 | 21.00 ± 33.83 | – |
| 15 minutos después de la infusión | 215.50 ± 101.70 | 215.29 ± 94.26 | – |
| T½ (Mediana de vida media en horas) | 7.67 ± 3.32 | 21.58 ± 7.79 | 13.06 ± 2.20 |
| Recuperación incremental in vivo en (UI/dL)/(UI/kg) | 3.29 ± 1.46 | 2.13 ± 0.58 | – |
Después de la infusión tanto de ALPHANATE (A-SD) como de ALPHANATE (A-SD / HT), se observó un aumento en el tamaño de los multimeros de VWF y persistió durante al menos 24 horas. La reducción del BT fue transitoria, durando menos de 6 horas después del tratamiento y no se correlacionó con la presencia de multimeros de VWF de tamaño grande e intermedio. 14
14 ESTUDIOS CLÍNICOS
En un estudio clínico prospectivo, multicéntrico, 37 sujetos con VWD (6 Tipo 1, 19 Tipo 2, 12 Tipo 3) se sometieron a 59 procedimientos quirúrgicos para los que se administró ALPHANATE (A-SD) o ALPHANATE (A-SD/HT) [21 sujetos recibieron ALPHANATE (A-SD), 18 recibieron ALPHANATE (A-SD/HT) y 2 recibieron ambos productos] para la profilaxis de hemorragia (consulte Tabla 5). Se administró una infusión inicial preoperatoria de 60 UI VWF:RCo/kg (75 UI VWF:RCo/kg para sujetos menores de 18 años), una hora antes de la cirugía. Se obtuvo una muestra de sangre 15 minutos después de la infusión inicial para la determinación del nivel de FVIII:C plasmático. El nivel tenía que ser igual o superior al 100% de lo normal para que se llevara a cabo la operación. No se administró crioprecipitado ni producto de FVIII alternativo durante estos procedimientos quirúrgicos. Se requirieron plaquetas en 2 sujetos. El protocolo permitió infusiones intraoperatorias de ALPHANATE (A-SD) y ALPHANATE (A-SD/HT) a 60 IU VWF:RCo/kg (75 IU VWF:RCo/kg para sujetos menores de 18 años) que se administraran según se requiriera según el criterio del investigador.
|
^ Dos sujetos recibieron ambos preparados; por lo tanto, el número total de sujetos es menor que la suma de las columnas. |
|||
| Parámetro | Tratamiento con Alphanate | Total | |
| Tipo de Procedimiento Quirúrgico | A-SD | A-SD/HT | |
| Número de Sujetos | 21 | 18 | 37^ |
| Dental | 14 | 6 | 20 |
| Dermatoológico | 1 | 1 | 2 |
| Gastrointestinal | 4 | 4 | 8 |
| Gastrointestinal (diagnóstico) | 6 | 0 | 6 |
| Genitourinario | 0 | 2 | 2 |
| Ginecológico | 2 | 1 | 3 |
| Cabeza y cuello | 1 | 1 | 2 |
| Ortopédico | 4 | 3 | 7 |
| Vascular | 3 | 6 | 9 |
| Número total de procedimientos | 35 | 24 | 59 |
Las infusiones postoperatorias en dosis de 40 a 60 UI VWF:RCo/kg (50 a 75 UI VWF:RCo/kg para sujetos pediátricos) se administraban a intervalos de 8 a 12 horas hasta que se produjo la cicatrización. Para mantener la hemostasis secundaria (después de lograr la hemostasis primaria), la dosis se redujo después del tercer día postoperatorio [consulte Dosificación y administración (2.2) ] .
En general, en los procedimientos quirúrgicos utilizando cualquiera de los productos, el BT transcurridos 30 minutos después de la infusión se corrigió completamente en 18 (32,7%) casos, parcialmente en 24 (43,6%) casos, no se corrigió en 12 (21,8%) casos y no se realizó en un caso (1,8%). En general, la pérdida sanguínea media fue inferior a la prevista prospectivamente.
Los datos de resumen de infusiones quirúrgicas se incluyen en Tabla 6.
|
* Dos sujetos recibieron ambos productos |
|||
| Parámetro | A-SD | A-SD/HT | Total |
| Número de pacientes | 21 | 18 | 37* |
| Número de procedimientos quirúrgicos | 35 | 24 | 59 |
| Número medio de infusiones por procedimiento quirúrgico (rango) | 3 (1-13) | 4 (1 – 18) | 4 (1-18) |
| Dosis media en UI VWF:RCo/kg | |||
| Infusión #1 (rango) | 59,8 (19,8-75,1) | 59,9 (40,6 – 75,0) | 59,9 (19,8-75,1) |
| Infusión ≥ #2 combinada (rango) | 40,0 (4,5-75,1) | 40,0 (10,0 – 63,1) | 40,0 (4,5-75,1) |
Además, los procedimientos quirúrgicos que utilizaron solo ALPHANATE SD/HT se clasificaron como procedimientos mayores, menores o invasivos de acuerdo con las definiciones utilizadas en el estudio. El resultado de cada cirugía se evaluó de acuerdo con una escala de evaluación clínica (excelente, buena, mala o ninguna) y se consideró exitoso si el resultado era excelente o bueno.
Los resultados del estudio también fueron evaluados de forma independiente por dos árbitros con experiencia clínica en este campo de la misma manera (clasificación de la cirugía y resultado de cada cirugía de acuerdo con una escala de evaluación clínica). Hubo un alto nivel de acuerdo entre las evaluaciones de los árbitros y los datos de los resultados analizados, con una disminución de solo un éxito en lograr la hemostasia (21/24 [evaluación de los árbitros] frente a 22/24 [evaluación de los investigadores]).
Se realizó un estudio retrospectivo, multicéntrico para evaluar la eficacia de ALPHANATE (A-SD/HT) como terapia de reemplazo para prevenir el sangrado excesivo en sujetos con VWD congénita que se sometían a procedimientos quirúrgicos o invasivos, para los cuales el DDAVP era ineficaz o insuficiente. Se evaluaron un total de 61 cirugías/procedimientos en 39 sujetos. 15
De los 39 sujetos, 18 tenían Tipo 1 VWD (46.2%); 12 sujetos (30.8%) tenían Tipo 2 VWD, y 9 sujetos (23.1%) tenían Tipo 3 VWD. La edad mediana era de 40 años; aproximadamente la mitad de los sujetos eran varones.
La variable de eficacia primaria era el resultado del tratamiento global para cada procedimiento quirúrgico o invasivo, tal como lo calificó el investigador utilizando una escala de calificación verbal de 4 puntos (VRS): “excelente”, “buena”, “mala” o “ninguna (sin indicación de eficacia)”. La clasificación del resultado del tratamiento de reemplazo se basó en la experiencia clínica del investigador y se definió en Tabla 7.
| * El período de evaluación de la eficacia incluyó todo el período perioperatorio. | ||||
| Calificación | Eficacia clínica* | |||
| Hemoestasis | Dosis | |||
| Excelente | La hemoestasis no es diferente de la esperada en sujetos sin trastornos hemorrágicos conocidos. | No hay ajuste de dosis hacia arriba de la terapia de reemplazo con ALPHANATE. | ||
| Buena | Hemoestasis ligeramente inferior a la esperada en sujetos sin trastornos hemorrágicos conocidos, pero juzgada como no clínicamente relevante. | Ajuste de dosis hacia arriba menor de la terapia de reemplazo con ALPHANATE. | ||
| Mala | Menos hemoestasis que la esperada en sujetos sin trastornos hemorrágicos conocidos atribuida a VWD a pesar de la terapia de reemplazo con ALPHANATE. | Ajuste de dosis hacia arriba relevante de la terapia de reemplazo con ALPHANATE. No se necesita terapia alternativa. | ||
| Ninguna | Sangrado severo atribuido a VWD a pesar de la terapia de reemplazo con ALPHANATE. | Ajuste de dosis hacia arriba relevante de la terapia de reemplazo con ALPHANATE y/o necesidad de terapia alternativa inesperada. | ||
Además, se convocó un comité de árbitros independiente para evaluar los resultados de eficacia. Más del 90% de los resultados quirúrgicos recibieron una calificación general y diaria de “eficaz” (“excelente” o “buena”) por el investigador y el árbitro en la obtención de hemoestasis/prevención del sangrado.
La mayoría de las calificaciones se consideraron “excelentes” (≥ 81.3% en cada tipo de VWD). Nueve sujetos con Tipo 3 se sometieron a 1 procedimiento mayor y 15 menores. Dos procedimientos (1 mayor y 1 menor) en un sujeto con Tipo 3 VWD recibieron una calificación de eficacia global de “ninguna”, y un procedimiento menor en un sujeto con Tipo 2 VWD recibió una calificación de eficacia global de “mala”.
15 REFERENCIAS
- Srivastava, A., Brewer, A.K., et al. Directrices de la WFH: Directrices para el manejo de la hemofilia. Haemophilia 2013; 19, e1-e47.
- Kempton, C.L., White, G.C. Cómo tratamos a un paciente con hemofilia A con un inhibidor del factor VIII. Blood 2009; 113:11-17.
- Federici, A.B., Baudo, F., Caracciolo, C., Mancuso, G., Mazzucconi, M.G., Musso, R., Schinco, P.C., Targhetta. R., Mannucci, P.M. Eficacia clínica del concentrado de factor VIII/von Willebrand factor (Fanhdi) altamente purificado y doblemente inactivado por virus en el tratamiento de la enfermedad de von Willebrand: un estudio clínico retrospectivo. Haemophilia 2002; 8:761-767.
- Federici, A.B. Manejo de la enfermedad de von Willebrand con concentrados de factor VIII/von Willebrand factor: resultados de estudios y encuestas actuales. Blood Coagul Fibrinolysis 2005; 16(Suppl 1):S17-S21.
- Mannucci, P.M. Cómo trato a los pacientes con enfermedad de von Willebrand. Blood 2001; 97:1915-1919.
- Mannucci, P.M. Tratamiento de la enfermedad de von Willebrand. N Engl J Med 2004; 351:47-58.
- Nichols, W.L. et al.; Panel de Expertos NHLBI VWD. Diagnóstico, evaluación y manejo de la enfermedad de von Willebrand. Departamento de Salud y Servicios Humanos de los Estados Unidos, Institutos Nacionales de Salud, Instituto Nacional del Corazón, los Pulmones y la Sangre 2007; NIH No. 08-5832.
- Mannucci, P.M., Franchini, M., Castaman, G., Federici, A.B.; Asociación Italiana de Centros de Hemofilia. Recomendaciones basadas en la evidencia sobre el tratamiento de la enfermedad de von Willebrand en Italia. Blood Transfus 2009; 7:117-126.
- Coppola, A., Franchini, M., Makris M. Santagostino, E. Minno, G.DI, Mannucci, P.M. Eventos adversos trombóticos de los concentrados de factor de coagulación para el tratamiento de pacientes con hemofilia y enfermedad de von Willebrand: una revisión sistemática de estudios prospectivos. Haemophilia 2012; 18, e173-e187.
- Soni, N.S., Patel A.R., Vohra, R.M., Shah P.C. Hemofílico con anemia hemolítica resultante del concentrado de factor VIII. Acta Haemato 1977; 58:294-297.
- Diez, J.M., Caballero, S., Belda, P., Otegui, M., Gajardo, R., Jorquera, J.I. Capacidad de eliminación de un agente modelo de EET en el proceso de fabricación de Alphanate/Fanhdi, un concentrado de complejo de factor VIII/VWF humano. Haemophilia 2009; 15(6):1249-1257.
- Hoyer, L.W. El complejo de factor VIII: estructura y función. Blood 1981; 58:1-13.
- Meyer, D., Girma, J-P. Factor von Willebrand: Estructura y función. Thrombosis and Haemostasis 1993; 70:99-104.
- Mannucci, P.M., Chediak, J., Hanna, W. Byrnes, J.J., Kessler, C.M, Ledford, M., Retzios, A.D., Kapelan, B.A., Gallagher, P., Schwartz, R.S., y el Grupo de Estudio de Alphanate. Tratamiento de la enfermedad de von Willebrand (VWD) con un concentrado de factor VIII de alta pureza: Disociación entre la corrección del tiempo de sangrado (BT), el patrón de multímeros de VWF y la eficacia del tratamiento. Blood 1999; 94 (Suppl 1, Parte 2 de 2):98b.
- Rivard, G.E., Aledort, L., et al. Eficacia del concentrado de factor VIII/von Willebrand factor Alphanate en la prevención de hemorragias excesivas durante la cirugía en sujetos con enfermedad de von Willebrand. Haemophilia 2008; 14, 271-275.
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Presentación
ALPHANATE se suministra en forma liofilizada y estéril en un vial de dosis única con un vial de diluyente (Agua Estéril para Inyección, USP) y un conjunto de transferencia de filtro Mix2Vial. La actividad en UI del FVIII y VWF:RCo se indica en el cartón y etiqueta de cada vial.
ALPHANATE está disponible en las siguientes potencias y codificado por colores según el ensayo en el cartón y etiqueta de la siguiente manera:
| Potencia | NDC | Código de color del ensayo |
| 250 UI FVIII/5 mL vial de dosis única | 68516-4611-1 o 68516-4616-1 |
Rango de 250 UI FVIII – caja gris |
| 500 UI FVIII/5 mL vial de dosis única | 68516-4612-1 o 68516-4617-1 |
Rango de 500 UI FVIII – caja verde |
| 1000 UI FVIII/10 mL vial de dosis única | 68516-4613-2 o 68516-4618-2 |
Rango de 1000 UI FVIII – caja azul |
| 1500 UI FVIII/10 mL vial de dosis única | 68516-4614-2 o 68516-4619-2 |
Rango de 1500 UI FVIII – caja naranja |
| 2000 UI FVIII/10 mL vial de dosis única | 68516-4615-2 o 68516-4620-2 |
Rango de 2000 UI FVIII – caja magenta |
Almacenamiento y manipulación
ALPHANATE es estable durante tres años, hasta la fecha de vencimiento impresa en su etiqueta, siempre que la temperatura de almacenamiento no supere los 25 °C (77 °F). No congelar.
17 INFORMACIÓN PARA EL PACIENTE
Aconsejar al paciente:
- Comunicarse con su proveedor de atención médica o acudir al departamento de emergencias de inmediato si se presenta una reacción de hipersensibilidad. Los signos iniciales de las reacciones de hipersensibilidad pueden incluir erupción cutánea, urticaria, picazón, hinchazón facial, opresión en el pecho y sibilancias [ver Advertencia y Precauciones (5.1)].
- Comunicarse con su médico o centro de tratamiento para recibir un tratamiento adicional y/o una evaluación si experimentan una falta de respuesta clínica a la terapia de reemplazo del factor VIII, ya que esto puede ser una manifestación de un inhibidor [ver Advertencia y Precauciones (5.2)].
- Comunicarse con su proveedor de atención médica o acudir al departamento de emergencias de inmediato si se presenta un evento tromboembólico [ver Advertencia y Precauciones (5.3)].
- Que a pesar de los rigurosos procedimientos diseñados para reducir el riesgo, el riesgo de transmisión de agentes infecciosos no puede eliminarse completamente. Aconsejar a los pacientes, especialmente a las mujeres embarazadas y a las personas inmunocomprometidas, que comuniquen inmediatamente a su médico cualquier signo o síntoma de fiebre, erupción cutánea, dolor en las articulaciones o dolor de garganta [ver Advertencia y Precauciones (5.6)].
Fabricado por:
Grifols Biologicals LLC
5555 Valley Boulevard
Los Ángeles, CA 90032, EE. UU.
U. S. License No. 1694
3063713
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel de visualización principal – Etiqueta de frasco de 250 UI
NDC 68516-4605-1 Rango de 250 UI FVIII
Factor antihemofílico/
Factor de von Willebrand
Complejo (Humano)
Alphanate® 5 mL
Tratado con disolvente detergente / Calor
Almacenamiento: Almacenar a temperaturas
que no excedan los 25 °C (77 °F).
Solo con receta médica. Envase de dosis única para
administración intravenosa únicamente.
GRIFOLS Licencia No. 1694 de EE. UU.
Instrucciones: Reconstituir
con 5 mL de Agua Estéril
para Inyección, USP. Administrar
inmediatamente después de la reconstitución
y no refrigerar. Desechar
el contenido no utilizado. Para obtener información
sobre la dosis y las instrucciones de
administración, consulte el folleto adjunto.
No contiene
conservantes. El paciente y el
médico deben discutir los riesgos
y beneficios de este producto.
Grifols Biologicals LLC
5555 Valley Boulevard
Los Angeles, CA 90032, EE. UU.
Lote
CAD
UI FVIII/Frasco
UI VWF:RCo/Frasco 3063712
Lote
UI FVIII/Frasco
UI VWF:RCo/Frasco
Alphanate® 5 mL NDC 68516-4605-1

PANEL DE VISUALIZACIÓN PRINCIPAL
Panel de visualización principal – Etiqueta de cartón de 250 UI
NDC 68516-4616-1 Rango de 250 UI de FVIII
Factor antihemofílico / Complejo de factor de von Willebrand (humano)
Alphanate®
Tratado con solvente detergente / calor
Solo para uso con receta médica
Para administración intravenosa 5 mL
GRIFOLS
Contenido: Un frasco de Factor antihemofílico / Complejo de factor de von Willebrand (humano), Alphanate®, un frasco de 5 mL de Agua estéril para inyección, USP, un conjunto de transferencia de filtro Mix2Vial® y las instrucciones de uso.
Composición:
Factor VIII, Factor de von Willebrand, Arginina, Albúmina
y Histidina.
No contiene conservantes.
Administrar dentro de las tres horas posteriores a la reconstitución.
Desechar el contenido no utilizado.
GRIFOLS
Advertencia:
Este producto se prepara a partir de grandes pools de
plasma humano. La sangre humana y sus componentes
pueden transmitir agentes infecciosos. Consultar el
inserto del paquete, ADVERTENCIAS Y PRECAUCIONES.
Instrucciones: El paciente y el médico deben
discutir los riesgos y beneficios de este producto.
Para obtener información sobre la dosis y las instrucciones de
administración, consulte el inserto del paquete adjunto.
Almacenamiento: Almacenar a temperaturas que no excedan los
25 °C (77 °F). No congelar.
Envase de dosis única solo para administración intravenosa.
Grifols Biologicals LLC
5555 Valley Boulevard
Los Angeles, CA 90032, EE. UU.
N.º de licencia de EE. UU. 1694
GRIFOLS
3063711
GTIN 00368516461617
LOTE XXXXXXXXXX
VTO DDMMMYYYY
N.º de serie XXXXXXXXXX XXXXXX
UI FVIII/Frasco XXXX
UI VWF: RCo/Frasco XXXX

PANEL DE VISUALIZACIÓN PRINCIPAL
Panel principal de visualización: Etiqueta del frasco de 500 UI
NDC 68516-4606-1 Rango de 500 UI de FVIII
Factor antihemofílico/
Factor de von Willebrand
Complejo (humano)
Alphanate® 5 mL
Tratamiento con solvente detergente / tratamiento térmico
Almacenamiento: Almacenar a temperaturas
que no superen los 25 °C (77 °F).
Sólo con receta médica. Contenedor de dosis única para
administración intravenosa solamente.
GRIFOLS N.º de licencia estadounidense 1694
Instrucciones: Reconstituir
con 5 mL de Agua Estéril
para inyección, USP. Administrar
inmediatamente después de la reconstitución
y no refrigerar. Desechar el contenido no utilizado. Para información
sobre la dosis y las indicaciones de administración, consultar el folleto adjunto. No contiene
conservantes. El paciente y el
médico deben discutir los riesgos
y beneficios de este producto.
Grifols Biologicals LLC
5555 Valley Boulevard
Los Angeles, CA 90032, EE. UU.
Lote
EXP
UI FVIII/frasco
UI VWF:RCo/frasco 3063710
Lote
UI FVIII/frasco
UI VWF:RCo/frasco
Alphanate® 5 mL NDC 68516-4606-1

PANEL DE VISUALIZACIÓN PRINCIPAL
Panel de visualización principal – Etiqueta de cartón de 500 UI
NDC 68516-4617-1 Rango de 500 UI FVIII
Factor antihemofílico / Complejo de factor de von Willebrand (humano)
Alphanate®
Tratado con disolvente detergente / calor
Solo con receta médica
Para administración intravenosa 5 mL
GRIFOLS
Contenido:
Un vial de Factor antihemofílico / Complejo de factor de von Willebrand (humano), Alphanate®, un vial de 5 mL de Agua estéril para inyección, USP, un conjunto de transferencia de filtro Mix2Vial® y las instrucciones de uso.
Composición:
Factor VIII, Factor de von Willebrand, Arginina, Albúmina
y Histidina.
No contiene conservantes.
Administrar dentro de las tres horas posteriores a la reconstitución.
Desechar el contenido no utilizado.
GRIFOLS
Advertencia:
Este producto se prepara a partir de grandes pools de
plasma humano. La sangre humana y sus componentes
pueden transmitir agentes infecciosos. Consultar el
folleto del paquete, ADVERTENCIAS Y PRECAUCIONES.
Instrucciones: El paciente y el médico deben
discutir los riesgos y beneficios de este producto.
Para obtener información sobre la dosis y las instrucciones
de administración, consulte el folleto del paquete adjunto.
Almacenamiento: Almacenar a temperaturas que no excedan
los 25 °C (77 °F). No congelar.
Envase de dosis única solo para administración intravenosa.
Grifols Biologicals LLC
5555 Valley Boulevard
Los Angeles, CA 90032, EE. UU.
N.º de licencia de EE. UU. 1694
GRIFOLS
3063709
GTIN 00368516461716
LOTE XXXXXXXXXX
VTO. DDMMMYYYY
N.º de serie XXXXXXXXXX XXXXXX
UI FVIII/Vial XXXX
UI VWF: RCo/Vial XXXX

PANEL DE VISUALIZACIÓN PRINCIPAL
Panel de visualización principal – Etiqueta de vial de 1000 UI
NDC 68516-4607-2 Rango de 1000 UI FVIII
Factor antihemofílico/
Factor de von Willebrand
Complejo (Humano)
Alphanate® 10 mL
Tratado con disolvente detergente / tratado con calor
Almacenamiento: Almacenar a temperaturas
que no excedan los 25 °C (77 °F).
Solo con receta médica. Envase de dosis única para
administración intravenosa únicamente.
GRIFOLS Número de licencia en EE. UU. 1694
Instrucciones: Reconstituir
con 10 mL de Agua Estéril
para Inyección, USP. Administrar
inmediatamente después de la reconstitución
y no refrigerar. Desechar
el contenido no utilizado. Para obtener información
sobre la dosis y las instrucciones de
administración, consulte el folleto adjunto. No contiene
conservantes. El paciente y el médico deben discutir los riesgos
y beneficios de este producto.
Grifols Biologicals LLC
5555 Valley Boulevard
Los Angeles, CA 90032, EE. UU.
Lote
CAD
UI FVIII/Vial
UI VWF:RCo/Vial 3063708
Lote
UI FVIII/Vial
UI VWF:RCo/Vial
Alphanate® 10 mL NDC 68516-4607-2

PANEL DE VISUALIZACIÓN PRINCIPAL
Panel Principal de Visualización – Etiqueta de cartón de 1000 UI
NDC 68516-4618-2 Rango de 1000 UI de FVIII
Factor Antihemofílico/von Willebrand
Complejo (humano)
Alphanate®
Tratado con disolvente detergente / calor
Sólo con receta
Para administración intravenosa 10 mL
GRIFOLS
Contenidos:
Un vial de Factor Antihemofílico/von Willebrand
Complejo (Humano), Alphanate®, un vial
10 mL de Agua Estéril para Inyección, USP, uno
Kit de transferencia de filtro Mix2Vial® y las instrucciones de uso.
Composición:
Factor VIII, Factor von Willebrand, Arginina, Albúmina
y Histidina.
No contiene conservantes.
Administrar en un plazo de tres horas tras la reconstitución.
Descartar el contenido no utilizado.
GRIFOLS
Advertencia:
Este producto se prepara a partir de grandes piscinas de
plasma humano. La sangre humana y sus componentes
pueden transmitir agentes infecciosos. Ver el prospecto, ADVERTENCIAS Y PRECAUCIONES.
Instrucciones: El paciente y el médico deben
discutir los riesgos y beneficios de este producto.
Para más información sobre la dosificación y las instrucciones de
administración, ver el prospecto adjunto.
Almacenamiento: Almacenar a temperaturas no superiores
a 25 °C (77 °F). No congelar.
Contenedor de dosis única para administración intravenosa solamente.
Grifols Biologicals LLC
5555 Valley Boulevard
Los Ángeles, CA 90032, EE. UU.
Número de licencia de EE. UU. 1694
GRIFOLS
3063707
GTIN 00368516461822
LOTE XXXXXXXXXX
CAD DDMMMAAAA
SN XXXXXXXXXX XXXXXX
UI FVIII/Vial XXXX
UI VWF: RCo/Vial XXXX

PANEL DE VISUALIZACIÓN PRINCIPAL
Panel de visualización principal – Etiqueta de vial de 1500 UI
NDC 68516-4608-2 Rango de 1500 UI de FVIII
Factor antihemofílico/
Factor de von Willebrand
Complejo (Humano)
Alphanate® 10 mL
Tratado con disolvente detergente / tratado con calor
Almacenamiento: Almacenar a temperaturas
que no excedan los 25 °C (77 °F).
Solo con receta médica. Envase de dosis única para
administración intravenosa únicamente.
GRIFOLS Número de licencia en EE. UU. 1694
Instrucciones: Reconstituir
con 10 mL de Agua Estéril
para Inyección, USP. Administrar
inmediatamente después de la reconstitución
y no refrigerar. Desechar
el contenido no utilizado. Para obtener información
sobre la dosis y las instrucciones de
administración, consulte el folleto adjunto. No contiene
conservantes. El paciente y el
médico deben discutir los riesgos
y beneficios de este producto.
Grifols Biologicals LLC
5555 Valley Boulevard
Los Angeles, CA 90032, EE. UU.
Lote
Cad.
UI FVIII/Vial
UI VWF:RCo/Vial 3063706
Lote
UI FVIII/Vial
UI VWF:RCo/Vial
Alphanate®10 mL NDC 68516-4608-2

PANEL DE VISUALIZACIÓN PRINCIPAL
Panel de visualización principal – Etiqueta de cartón de 1500 UI
NDC 68516-4619-2 Rango de 1500 UI FVIII
Factor antihemofílico/factor de von Willebrand
complejo (humano)
Alphanate®
Tratado con disolvente detergente / calor
Solo con receta médica
Para administración intravenosa 10 mL
GRIFOLS
Contenido:
Un frasco de factor antihemofílico/factor de von Willebrand
complejo (humano), Alphanate®, un frasco de
10 mL de agua estéril para inyección, USP, un
conjunto de transferencia de filtro Mix2Vial® y las instrucciones de uso.
Composición:
Factor VIII, factor de von Willebrand, arginina, albúmina
y histidina.
No contiene conservantes.
Administrar dentro de las tres horas posteriores a la reconstitución.
Desechar el contenido no utilizado.
GRIFOLS
Advertencia:
Este producto se prepara a partir de grandes pools de
plasma humano. La sangre humana y sus componentes
pueden transmitir agentes infecciosos. Consultar el
folleto del paquete, ADVERTENCIAS Y PRECAUCIONES.
Instrucciones: El paciente y el médico deben
discutir los riesgos y beneficios de este producto.
Para obtener información sobre la dosis y las instrucciones de
administración, consulte el folleto del paquete adjunto.
Almacenamiento: Almacenar a temperaturas que no superen
los 25 °C (77 °F). No congelar.
Envase de dosis única solo para administración intravenosa.
Grifols Biologicals LLC
5555 Valley Boulevard
Los Angeles, CA 90032, EE. UU.
N.º de licencia de EE. UU. 1694
GRIFOLS
3063705
GTIN 00368516461921
LOTE XXXXXXXXXX
VTO. DDMMMYYYY
N.º de serie XXXXXXXXXX XXXXXX
UI FVIII/Vial XXXX
UI VWF: RCo/Vial XXXX
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel principal de visualización – Etiqueta de frasco de 2000 UI
NDC 68516-4610-2 Rango 2000 UI de FVIII
Factor antihemofílico /
Factor de Von Willebrand
Complejo (humano)
Alphanate® 10 mL
Tratado con solvente detergente / calor
Almacenamiento: Almacene a temperaturas
que no superen los 25 °C (77 °F).
Sólo bajo receta. Envase de dosis única para
administración intravenosa solamente.
GRIFOLS N.º de licencia de EE. UU. 1694
Instrucciones: Reconstituir
con 10 mL de Agua estéril
para inyección, USP. Administrar
inmediatamente después de la reconstitución
y no refrigerar. Desechar el contenido no utilizado. Para información
sobre la dosis y las indicaciones de administración, consultar el folleto adjunto. No contiene
conservantes. El paciente y el
médico deben discutir los riesgos
y beneficios de este producto.
Grifols Biologicals LLC
5555 Valley Boulevard
Los Ángeles, CA 90032, EE. UU.
Lote
CAD
UI FVIII/frasco
UI VWF:RCo/frasco 3063704
Lote
10
UI FVIII/frasco
UI VWF:RCo/frasco
Alphanate®10 mL NDC 68516-4608-2

PANEL DE VISUALIZACIÓN PRINCIPAL
Panel de visualización principal – Etiqueta de cartón de 2000 UI
NDC 68516-4620-2 Rango de 2000 UI FVIII
Factor antihemofílico/Complejo de factor von Willebrand
(Humano)
Alphanate®
Tratado con solvente detergente / calentado
Sólo con receta
Para administración intravenosa 10 mL
GRIFOLS
Contenido:
Un frasco de Factor antihemofílico/Complejo de factor von Willebrand
(Humano), Alphanate®, un frasco
10 mL de Agua estéril para inyección, USP, un
Conjunto de transferencia de filtro Mix2Vial® y las instrucciones de uso.
Composición:
Factor VIII, Factor von Willebrand, Arginina, Albúmina
y Histidina.
No contiene conservantes.
Administrar dentro de las tres horas de reconstitución.
Descartar el contenido no utilizado.
GRIFOLS
Advertencia:
Este producto está elaborado a partir de grandes piscinas de
plasma humano. La sangre humana y sus componentes
pueden transmitir agentes infecciosos. Ver el inserto del paquete, ADVERTENCIAS Y PRECAUCIONES.
Instrucciones: El paciente y el médico deben
discutir los riesgos y beneficios de este producto.
Para información sobre la dosis y las instrucciones de administración, ver el inserto del paquete adjunto.
Almacenamiento: Almacenar a temperaturas que no superen
25 °C (77 °F). No congelar.
Envase de dosis única para administración intravenosa solamente.
Grifols Biologicals LLC
5555 Valley Boulevard
Los Angeles, CA 90032, Estados Unidos
Número de licencia estadounidense 1694
GRIFOLS
3063703
GTIN 00368516462027
LOTE XXXXXXXXXX
CAD DDMMMAAAA
SN XXXXXXXXXX XXXXXX
UI FVIII/Frasco XXXX
UI VWF: RCo/Frasco XXXX

PANEL DE VISUALIZACIÓN PRINCIPAL
PANEL DE VISUALIZACIÓN PRINCIPAL
Panel principal de exposición: etiqueta de frasco de 5 ml
NDC 76297-002-02
Agua estéril para inyección, USP
5 mL
Sólo con receta
3057422
Para reconstituir el producto adjunto
Envase de dosis única, no pirogénico
No usar a menos que esté claro. No se ha añadido ningún agente antimicrobiano u otra sustancia. No utilizar para inyección intravenosa sin hacer aproximadamente isotónico mediante la adición de un soluto adecuado. Desechar la porción no utilizada.
Fabricado por: Laboratorios Grifols, S.A. Parets del Vallès,
Barcelona 08150 España
Lote
EXP

Panel principal de exposición: etiqueta de frasco de 10 mL
NDC 76297-002-12
Agua estéril para inyección, USP
10 mL
Sólo con receta
3057423
Para reconstituir el producto adjunto
Envase de dosis única, no pirogénico
No usar a menos que esté claro. No se ha añadido ningún agente antimicrobiano u otra sustancia. No utilizar para inyección intravenosa sin hacer aproximadamente isotónico mediante la adición de un soluto adecuado. Desechar la porción no utilizada.
Fabricado por: Laboratorios Grifols, S.A. Parets del Vallès,
Barcelona 08150 España
Lote
EXP

Panel principal de exposición: etiqueta de frasco de 5 mL
NDC 68516-1001-1
Agua estéril para inyección, USP
5 mL
Sólo con receta
3051532
Para reconstituir el producto adjunto
Envase de dosis única, no pirogénico
No usar a menos que esté claro. No se ha añadido ningún agente antimicrobiano u otra sustancia. No utilizar para inyección intravenosa sin hacer aproximadamente isotónico mediante la adición de un soluto adecuado. Desechar la porción no utilizada.
Fabricado por: Laboratorios Grifols, S.A. Parets del Vallès, Barcelona 08150 España
Fabricado para: Grifols Biologicals LLC Los Angeles, CA 90032, EE. UU.
Lote
EXP

Panel principal de exposición: etiqueta de frasco de 10 mL
NDC 68516-1002-2
Agua estéril para inyección, USP
10 mL
Sólo con receta
3051533
Para reconstituir el producto adjunto
Envase de dosis única, no pirogénico
No usar a menos que esté claro. No se ha añadido ningún agente antimicrobiano u otra sustancia. No utilizar para inyección intravenosa sin hacer aproximadamente isotónico mediante la adición de un soluto adecuado. Desechar la porción no utilizada.
Fabricado por: Laboratorios Grifols, S.A. Parets del Vallès, Barcelona 08150 España
Fabricado para: Grifols Biologicals LLC Los Angeles, CA 90032, EE. UU.
Lote
EXP