Fabricante de medicamentos: Teva Pharmaceuticals USA, Inc. (Updated: 2022-10-31)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
AJOVY® (fremanezumab-vfrm) inyección, para uso subcutáneo
Aprobación inicial en EE. UU.: 2018
INDICACIONES Y USO
AJOVY es un antagonista del péptido relacionado con el gen de la calcitonina indicado para el tratamiento preventivo de la migraña en adultos. (1)
DOSIFICACIÓN Y ADMINISTRACIÓN
- Solo para uso subcutáneo. (2.1, 2.2)
- Hay disponibles dos opciones de dosificación subcutánea de AJOVY para administrar la dosis recomendada:
- 225 mg mensuales, o
- 675 mg cada 3 meses (trimestralmente) (2.1)
- La dosis trimestral de 675 mg se administra como tres inyecciones consecutivas de 225 mg cada una. (2.1)
- Administrar en el abdomen, el muslo o la parte superior del brazo por vía subcutánea. (2.2)
- Consulte Dosificación y administración para obtener instrucciones importantes de administración. (2.2)
FORMAS Y FUERZAS DE DOSIFICACIÓN
CONTRAINDICACIONES
AJOVY está contraindicado en pacientes con hipersensibilidad grave a fremanezumab-vfrm o a cualquiera de los excipientes. (4)
ADVERTENCIAS Y PRECAUCIONES
Reacciones de hipersensibilidad: si se produce hipersensibilidad, considere suspender AJOVY e instituir una terapia adecuada. (5.1)
REACCIONES ADVERSAS
Las reacciones adversas más comunes (≥5% y mayores que el placebo) fueron reacciones en el sitio de inyección. (6.1)
Para informar sobre REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Teva Pharmaceuticals al 1-888-483-8279 o la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
Consulte 17 para obtener INFORMACIÓN PARA EL PACIENTE y el etiquetado del paciente aprobado por la FDA.
Revisado: 10/2022
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis Recomendada
2.2 Instrucciones Importantes de Administración
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de Hipersensibilidad
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Inmunogenicidad
6.3 Experiencia Postcomercialización
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14 ESTUDIOS CLÍNICOS
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANEJO
16.1 Forma de Suministro
16.2 Almacenamiento y Manejo
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están listadas.
1 INDICACIONES Y USO
AJOVY está indicado para el tratamiento preventivo de la migraña en adultos.
2 DOSIS Y ADMINISTRACIÓN
2.1 Dosis recomendada
Hay dos opciones de dosificación subcutánea de AJOVY disponibles para administrar la dosis recomendada:
- 225 mg mensuales, o
- 675 mg cada 3 meses (trimestralmente), que se administra como tres inyecciones subcutáneas consecutivas de 225 mg cada una.
Al cambiar las opciones de dosificación, administre la primera dosis del nuevo régimen en la siguiente fecha de administración programada. Si olvida una dosis de AJOVY, adminístrela lo antes posible. A partir de entonces, AJOVY puede programarse a partir de la fecha de la última dosis.
2.2 Instrucciones importantes para la administración
AJOVY es solo para uso subcutáneo.
AJOVY puede ser administrado por profesionales de la salud, pacientes y/o cuidadores. Antes de su uso, proporcione la capacitación adecuada a los pacientes y/o cuidadores sobre la preparación y administración de la jeringa precargada de AJOVY, incluida la técnica aséptica [consulte las Instrucciones de uso]:
- Retire AJOVY del refrigerador. Antes de usar, deje reposar AJOVY a temperatura ambiente durante 30 minutos protegido de la luz solar directa. No caliente usando una fuente de calor como agua caliente o un microondas. No use AJOVY si ha estado a temperatura ambiente durante 7 días o más [ver Cómo suministrar/almacenamiento y manipulación (16.2)].
- Siga una técnica de inyección aséptica cada vez que se administre AJOVY.
- Inspeccione AJOVY para detectar partículas o decoloración antes de la administración [ver Formas de dosificación y concentraciones (3)]. No lo use si la solución está turbia, descolorida o contiene partículas.
- Administre AJOVY mediante inyección subcutánea en áreas del abdomen, el muslo o la parte superior del brazo que no estén sensibles, magulladas, enrojecidas o induradas. Para inyecciones múltiples, puede usar el mismo sitio del cuerpo, pero no la ubicación exacta de la inyección anterior.
- No administre AJOVY junto con otros medicamentos inyectables en el mismo sitio de inyección.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
AJOVY es una solución estéril, clara a opalescente, incolora a ligeramente amarilla, disponible como sigue:
- Inyección: autoinyector precargado de dosis única de 225 mg/1,5 mL
- Inyección: jeringa precargada de dosis única de 225 mg/1,5 mL
4 CONTRAINDICACIONES
AJOVY está contraindicado en pacientes con hipersensibilidad grave a fremanezumab-vfrm o a cualquiera de los excipientes. Las reacciones han incluido anafilaxia y angioedema [ver Advertencias y precauciones (5.1)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de hipersensibilidad
Se reportaron reacciones de hipersensibilidad con AJOVY en ensayos clínicos, incluyendo sarpullido, prurito, hipersensibilidad al fármaco y urticaria. La mayoría de las reacciones fueron de leves a moderadas, pero algunas llevaron a la suspensión del tratamiento o requirieron tratamiento con corticosteroides. La mayoría de las reacciones se reportaron desde horas hasta un mes después de la administración. Se han reportado casos de anafilaxia y angioedema en la fase posterior a la comercialización.
Si se produce una reacción de hipersensibilidad, considere la posibilidad de suspender la administración de AJOVY e instituya el tratamiento adecuado [consulte Contraindicaciones (4)].
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas clínicamente significativas se discuten con mayor detalle en otras secciones del etiquetado:
- Reacciones de hipersensibilidad [ver Advertencias y precauciones (5.1)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco, y pueden no reflejar las tasas observadas en la práctica clínica.
La seguridad de AJOVY se evaluó en 2512 pacientes con migraña que recibieron al menos 1 dosis de AJOVY, lo que representa 1279 años-paciente de exposición. De estos, 1730 pacientes estuvieron expuestos a AJOVY 225 mg mensuales o AJOVY 675 mg trimestrales durante al menos 6 meses, 775 pacientes durante al menos 12 meses y 138 pacientes durante al menos 15 meses. En los ensayos clínicos controlados con placebo (Estudios 1 y 2), 662 pacientes recibieron AJOVY 225 mg mensuales durante 12 semanas (con o sin una dosis de carga de 675 mg), y 663 pacientes recibieron AJOVY 675 mg trimestrales durante 12 semanas [ver Estudios clínicos (14)]. En los ensayos controlados, el 87% de los pacientes eran mujeres, el 80% eran blancos y la edad media fue de 41 años.
Las reacciones adversas más comunes en los ensayos clínicos para el tratamiento preventivo de la migraña (incidencia al menos del 5% y mayor que el placebo) fueron las reacciones en el sitio de inyección. Las reacciones adversas que con mayor frecuencia llevaron a la interrupción fueron las reacciones en el sitio de inyección (1%). La Tabla 1 resume las reacciones adversas notificadas en los estudios controlados con placebo de 3 meses (Estudio 1 y Estudio 2), y el período de seguimiento de 1 mes después de esos estudios.
| Reacción adversa | AJOVY 225 mg mensuales (n=290) % |
AJOVY 675 mg trimestrales (n=667) % |
Placebo mensuales (n=668) % |
|---|---|---|---|
|
Reacciones en el sitio de inyeccióna |
43 | 45 | 38 |
a Las reacciones en el sitio de inyección incluyen múltiples términos de eventos adversos relacionados, como dolor en el sitio de inyección, induración y eritema.
6.2 Inmunogenicidad
Como ocurre con todas las proteínas terapéuticas, existe la posibilidad de inmunogenicidad. La detección de la formación de anticuerpos depende en gran medida de la sensibilidad y la especificidad del ensayo. Además, la incidencia observada de positividad de anticuerpos (incluidos los anticuerpos neutralizantes) en un ensayo puede verse influenciada por varios factores, incluida la metodología del ensayo, el manejo de las muestras, el momento de la recolección de las muestras, los medicamentos concomitantes y la enfermedad subyacente. Por estas razones, la comparación de la incidencia de anticuerpos a fremanezumab-vfrm en los estudios descritos a continuación con la incidencia de anticuerpos en otros estudios a otros productos puede ser engañosa. La inmunogenicidad clínica de AJOVY se monitorizó mediante el análisis de anticuerpos anti-fármaco (ADA) y anticuerpos neutralizantes en pacientes tratados con fármacos. Los datos reflejan el porcentaje de pacientes cuyos resultados de las pruebas fueron positivos para anticuerpos a AJOVY en ensayos específicos.
En estudios controlados con placebo de 3 meses, se observaron respuestas de ADA emergentes del tratamiento en 6 de 1701 (0,4%) pacientes tratados con AJOVY. Uno de los 6 pacientes desarrolló anticuerpos neutralizantes anti-AJOVY en el día 84. En el estudio de etiqueta abierta a largo plazo en curso, se detectaron ADA en el 1,6% de los pacientes (30 de 1888). De los 30 pacientes con ADA positivos, 17 tuvieron una actividad neutralizante en sus muestras posteriores a la dosis. Aunque estos datos no demuestran un impacto del desarrollo de anticuerpos anti-fremanezumab-vfrm en la eficacia o seguridad de AJOVY en estos pacientes, los datos disponibles son demasiado limitados para sacar conclusiones definitivas.
6.3 Experiencia postcomercialización
Las siguientes reacciones adversas se han identificado durante el uso posterior a la aprobación de AJOVY. Debido a que estas reacciones se notifican voluntariamente de una población de tamaño incierto, no siempre es posible estimar de forma fiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos del sistema inmunitario – Reacciones anafilácticas y angioedema [ver Contraindicaciones (4) y Advertencias y precauciones (5.1)].
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Registro de Exposición al Embarazo
Existe un registro de exposición al embarazo que monitorea los resultados del embarazo en mujeres expuestas a AJOVY durante el embarazo. Se alienta a los profesionales de la salud a registrar a las pacientes embarazadas, o las mujeres embarazadas pueden inscribirse ellas mismas en el registro llamando al 1-833-927-2605 o visitando www.tevamigrainepregnancyregistry.com.
Resumen de Riesgos
No hay datos adecuados sobre el riesgo de desarrollo asociado con el uso de AJOVY en mujeres embarazadas. AJOVY tiene una vida media larga [ver Farmacología Clínica (12.3)]. Esto debe tenerse en cuenta para las mujeres que están embarazadas o planean quedar embarazadas mientras usan AJOVY. La administración de fremanezumab-vfrm a ratas y conejos durante el período de organogénesis o a ratas durante todo el embarazo y la lactancia a dosis que dan como resultado niveles plasmáticos mayores que los esperados clínicamente no produjo efectos adversos en el desarrollo [ver Datos de animales]. En la población general de EE. UU., el riesgo de fondo estimado de defectos de nacimiento mayores y aborto espontáneo en embarazos clínicamente reconocidos es del 2-4% y del 15-20%, respectivamente. La tasa estimada de defectos de nacimiento mayores (2.2-2.9%) y aborto espontáneo (17%) entre los partos de mujeres con migraña es similar a las tasas informadas en mujeres sin migraña.
Consideraciones Clínicas
Riesgo Materno y/o Embrión/Fetal Asociado a la Enfermedad
Los datos publicados han sugerido que las mujeres con migraña pueden tener un mayor riesgo de preeclampsia e hipertensión gestacional durante el embarazo.
Datos
Datos de animales
Cuando se administró fremanezumab-vfrm (0, 50, 100 o 200 mg/kg) a ratas macho y hembra mediante inyección subcutánea semanal antes y durante el apareamiento y continuando en las hembras durante toda la organogénesis, no se observaron efectos embriotóxicos adversos. La dosis más alta probada se asoció con exposiciones plasmáticas (AUC) aproximadamente 2 veces mayor que en humanos a una dosis de 675 mg.
La administración de fremanezumab-vfrm (0, 10, 50 o 100 mg/kg) semanalmente mediante inyección subcutánea a conejas embarazadas durante todo el período de organogénesis no produjo efectos adversos en el desarrollo embriotóxico. La dosis más alta probada se asoció con un AUC plasmático aproximadamente 3 veces mayor que en humanos (675 mg).
La administración de fremanezumab-vfrm (0, 50, 100 o 200 mg/kg) semanalmente mediante inyección subcutánea a ratas hembra durante todo el embarazo y la lactancia no produjo efectos adversos en el desarrollo pre y postnatal. La dosis más alta probada se asoció con un AUC plasmático aproximadamente 2 veces mayor que en humanos (675 mg).
8.2 Lactancia
Resumen de Riesgos
No hay datos sobre la presencia de fremanezumab-vfrm en la leche materna, los efectos en el lactante amamantado o los efectos en la producción de leche. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de AJOVY y cualquier posible efecto adverso en el lactante amamantado de AJOVY o de la condición materna subyacente.
8.5 Uso Geriátrico
Los estudios clínicos de AJOVY no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes.
11 DESCRIPCIÓN
Fremanezumab-vfrm es un anticuerpo monoclonal IgG2Δa/kappa totalmente humanizado específico para el ligando del péptido relacionado con el gen de la calcitonina (CGRP). Fremanezumab-vfrm se produce mediante tecnología de ADN recombinante en células de ovario de hámster chino (CHO). El anticuerpo consta de 1324 aminoácidos y tiene un peso molecular de aproximadamente 148 kDa.
La inyección de AJOVY (fremanezumab-vfrm) es una solución estéril, sin conservantes, de transparente a opalescente, de incolora a ligeramente amarilla para inyección subcutánea, que se suministra en un autoinyector precargado de dosis única de 225 mg/1,5 mL y en una jeringa precargada de dosis única de 225 mg/1,5 mL.
Cada autoinyector precargado o jeringa precargada administra 1,5 mL de solución que contiene 225 mg de fremanezumab-vfrm, etilendiaminotetraacetato disódico dihidrato (EDTA) (0,204 mg), L-histidina (0,815 mg), clorhidrato de L-histidina monohidrato (3,93 mg), polisorbato 80 (0,3 mg), sacarosa (99 mg) y agua para inyección, y tiene un pH de 5,5.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Fremanezumab-vfrm es un anticuerpo monoclonal humanizado que se une al ligando del péptido relacionado con el gen de la calcitonina (CGRP) y bloquea su unión al receptor.
12.2 Farmacodinamia
Se desconoce la relación entre la actividad farmacodinámica y el mecanismo o los mecanismos por los que fremanezumab-vfrm ejerce sus efectos clínicos.
12.3 Farmacocinética
Absorción
Después de administraciones subcutáneas (SC) únicas de 225 mg, 675 mg y 900 mg de fremanezumab-vfrm, el tiempo medio hasta las concentraciones máximas (tmax) fue de 5 a 7 días. Se observó proporcionalidad a la dosis, basada en la PK poblacional, entre 225 mg y 900 mg. El estado estacionario se logró aproximadamente a los 168 días (unos 6 meses) después de los regímenes de dosificación SC mensuales de 225 mg y SC trimestrales de 675 mg. La razón de acumulación media, basada en los regímenes de dosificación mensual y trimestral, es aproximadamente 2,3 y 1,2, respectivamente.
Distribución
Fremanezumab-vfrm tiene un volumen de distribución aparente de aproximadamente 6 litros, lo que sugiere una distribución mínima a los tejidos extravasculares.
Metabolismo
Al igual que otros anticuerpos monoclonales, fremanezumab-vfrm se degrada por proteólisis enzimática en pequeños péptidos y aminoácidos.
Eliminación
El aclaramiento aparente de fremanezumab-vfrm fue de aproximadamente 0,141 L/día. Se estimó que fremanezumab-vfrm tiene una vida media de aproximadamente 31 días.
Poblaciones específicas
Se realizó un análisis de PK poblacional para evaluar los efectos de la edad, la raza, el sexo y el peso en datos de 2287 sujetos. No se recomiendan ajustes de dosis para AJOVY.
Pacientes con insuficiencia hepática o renal
No se espera que la insuficiencia hepática/renal afecte la farmacocinética de fremanezumab. Un análisis de PK poblacional de datos integrados de los estudios clínicos de AJOVY no reveló una diferencia en la farmacocinética de fremanezumab en pacientes con insuficiencia hepática leve, en relación con aquellos con función hepática normal. Solo hubo 4 pacientes con insuficiencia hepática moderada y ningún paciente con insuficiencia hepática grave en los estudios clínicos de fremanezumab. No se realizaron estudios dedicados a la insuficiencia hepática/renal para evaluar el efecto de la insuficiencia hepática o renal en la farmacocinética de fremanezumab.
Interacciones medicamentosas
Fremanezumab no se metaboliza por las enzimas del citocromo P450; por lo tanto, es poco probable que se produzcan interacciones con medicamentos concomitantes que son sustratos, inductores o inhibidores de las enzimas del citocromo P450. Además, los efectos de los medicamentos para el tratamiento agudo (específicamente analgésicos, ergots y triptanos) y el tratamiento preventivo de la migraña se evaluaron en un modelo de PK poblacional y se encontró que no influyen en la exposición a fremanezumab.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Carcinogénesis
No se realizaron estudios de carcinogenicidad de fremanezumab-vfrm.
Mutagénesis
No se realizaron estudios de toxicología genética de fremanezumab-vfrm.
Deterioro de la Fertilidad
Cuando fremanezumab-vfrm (0, 50, 100 o 200 mg/kg) se administró a ratas macho y hembra mediante inyección subcutánea semanal antes y durante el apareamiento y continuando en las hembras durante toda la organogénesis, no se observaron efectos adversos sobre la fertilidad masculina o femenina. La dosis más alta probada se asoció con exposiciones plasmáticas (AUC) aproximadamente 2 veces mayor que en humanos a una dosis de 675 mg.
14 ESTUDIOS CLÍNICOS
La eficacia de AJOVY se evaluó como tratamiento preventivo de la migraña episódica o crónica en dos estudios multicéntricos, aleatorizados, de 3 meses, doble ciego, controlados con placebo (Estudio 1 y Estudio 2, respectivamente).
Migraña episódica
El Estudio 1 (NCT 02629861) incluyó adultos con antecedentes de migraña episódica (pacientes con <15 días de cefalea por mes). Todos los pacientes fueron aleatorizados (1:1:1) para recibir inyecciones subcutáneas de AJOVY 675 mg cada tres meses (trimestralmente), AJOVY 225 mg mensuales o placebo mensuales, durante un período de tratamiento de 3 meses. Se permitió a los pacientes utilizar tratamientos agudos para la cefalea durante el estudio. Se permitió a un subconjunto de pacientes (21%) utilizar un medicamento preventivo concomitante adicional.
El estudio excluyó a pacientes con antecedentes de enfermedad cardiovascular significativa, isquemia vascular o eventos trombóticos, como accidente cerebrovascular, ataques isquémicos transitorios, trombosis venosa profunda o embolia pulmonar.
El criterio de valoración principal de eficacia fue el cambio medio desde el inicio en el número medio mensual de días de migraña durante el período de tratamiento de 3 meses. Los criterios de valoración secundarios incluyeron la proporción de pacientes que alcanzaron al menos una reducción del 50% en el número medio mensual de días de migraña durante el período de tratamiento de 3 meses, el cambio medio desde el inicio en el número medio mensual de días de uso de cualquier medicamento agudo para la cefalea durante el período de tratamiento de 3 meses, y el cambio medio desde el inicio en el número de días de migraña durante el primer mes del período de tratamiento.
En el Estudio 1, se aleatorizaron un total de 875 pacientes (742 mujeres, 133 hombres), con edades comprendidas entre los 18 y los 70 años. Un total de 791 pacientes completaron la fase doble ciego de 3 meses. La frecuencia media de la migraña en el inicio fue de aproximadamente 9 días de migraña por mes, y fue similar en todos los grupos de tratamiento.
Tanto los regímenes de dosificación mensuales como trimestrales de AJOVY demostraron mejoras estadísticamente significativas para los criterios de valoración de eficacia en comparación con el placebo durante el período de 3 meses, como se resume en la Tabla 2.
| Estudio 1 Criterio de valoración de eficacia |
AJOVY 225 mg Mensual (N=287) |
AJOVY 675 mg Trimestral (N=288) |
Placebo
(N=290) |
|---|---|---|---|
| Días de migraña mensuales (DMM) | |||
| Días de migraña en el inicio | 8.9 | 9.2 | 9.1 |
|
Cambio desde el inicio |
-3.7 |
-3.4 |
-2.2 |
| Diferencia con respecto al placebo | -1.5 | -1.2 | |
| Valor p | <0.001 | <0.001 | |
| ≥50% de respondedores a DMM | |||
|
% de respondedores |
47.7% |
44.4% |
27.9% |
| Diferencia con respecto al placebo | 19.8% | 16.5% | |
| Valor p | <0.001 | <0.001 | |
| Días de medicación aguda para la cefalea mensuales | |||
|
Cambio desde el inicio |
-3.0 |
-2.9 |
-1.6 |
| Diferencia con respecto al placebo | -1.4 | -1.3 | |
| Valor p | <0.001 | <0.001 | |
La Figura 1 muestra el cambio medio desde el inicio en el número medio mensual de días de migraña en el Estudio 1.
Figura 1: Cambio desde el inicio en los días mensuales de migraña en el Estudio 1a
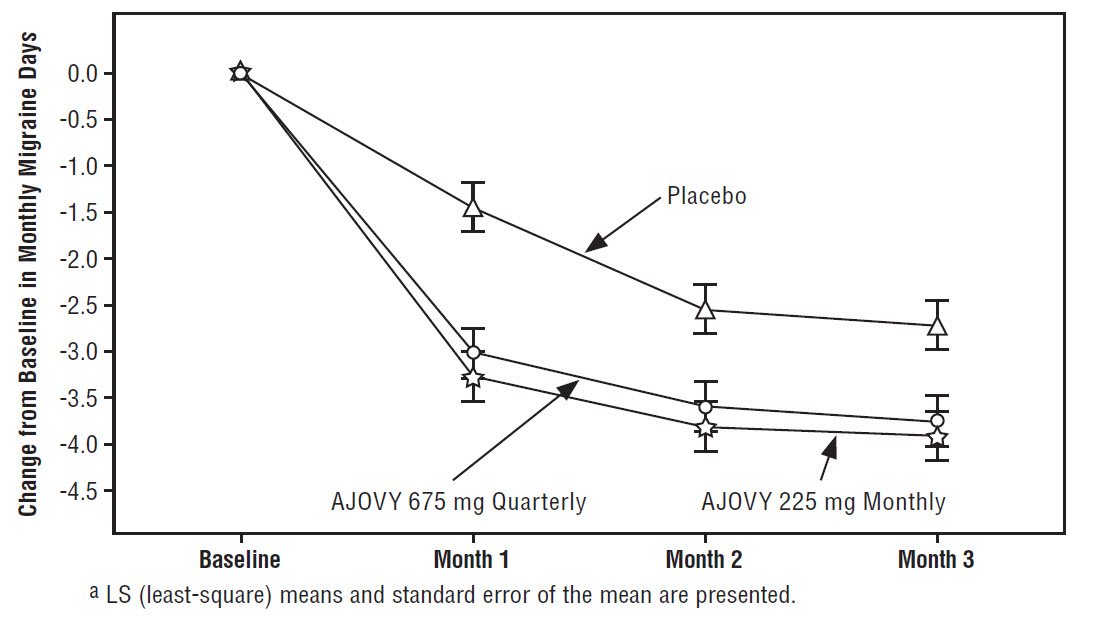
La Figura 2 muestra la distribución del cambio desde el inicio en el número medio mensual de días de migraña en intervalos de 2 días por grupo de tratamiento en el Estudio 1. Se observa un beneficio del tratamiento sobre el placebo para ambas dosis de AJOVY en un rango de cambios desde el inicio en el número mensual de días de migraña.
Figura 2: Distribución del cambio desde el inicio en el número medio mensual de días de migraña por grupo de tratamiento en el Estudio 1
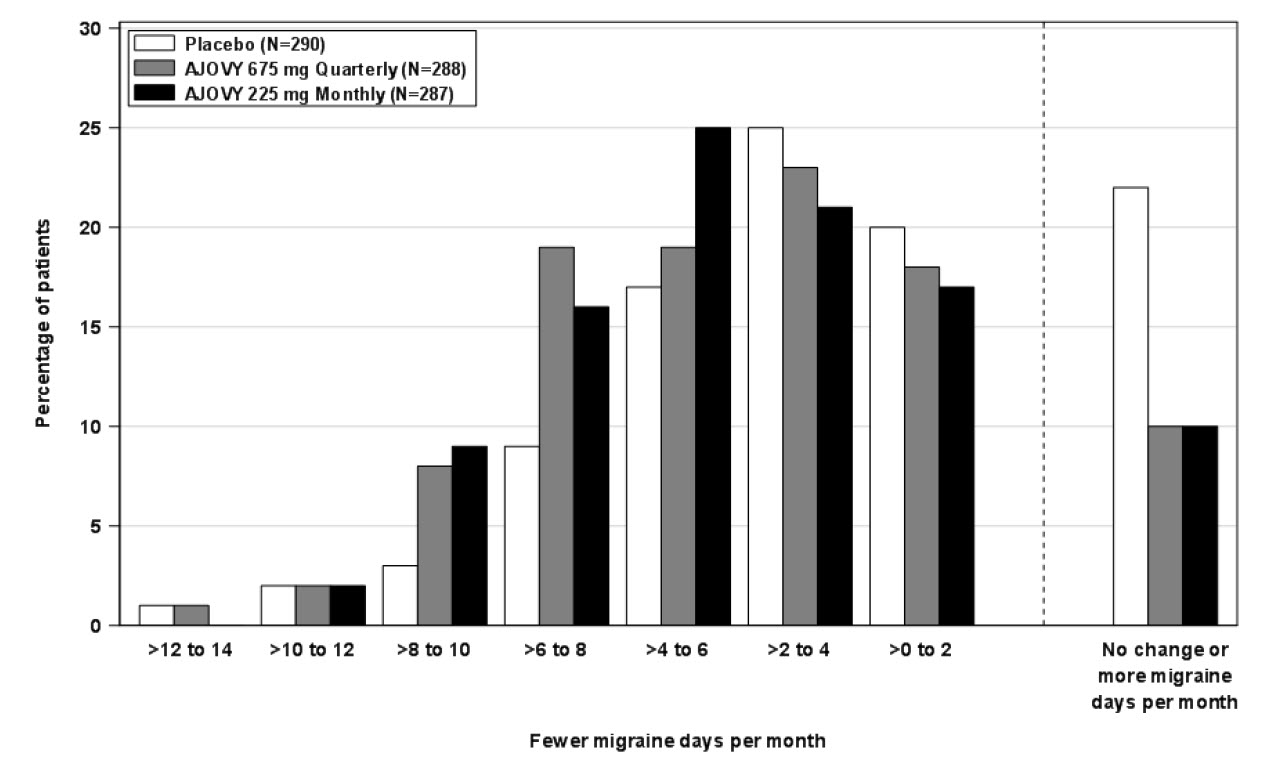
Migraña crónica
El Estudio 2 (NCT 02621931) incluyó adultos con antecedentes de migraña crónica (pacientes con ≥15 días de cefalea al mes). Todos los pacientes fueron aleatorizados (1:1:1) para recibir inyecciones subcutáneas de AJOVY 675 mg como dosis inicial seguida de 225 mg mensuales, 675 mg cada 3 meses (trimestralmente), o placebo mensual, durante un período de tratamiento de 3 meses. Se permitió a los pacientes utilizar tratamientos para la cefalea aguda durante el estudio. A un subgrupo de pacientes (21%) se le permitió utilizar un medicamento preventivo concomitante adicional.
El estudio excluyó a los pacientes con antecedentes de enfermedad cardiovascular significativa, isquemia vascular o eventos trombóticos, como accidente cerebrovascular, ataques isquémicos transitorios, trombosis venosa profunda o embolia pulmonar.
El criterio de valoración principal de eficacia fue el cambio medio desde el inicio en el número medio mensual de días de cefalea de al menos gravedad moderada durante el período de tratamiento de 3 meses. Los criterios de valoración secundarios fueron el cambio medio desde el inicio en el número medio mensual de días de migraña durante el período de tratamiento de 3 meses, la proporción de pacientes que alcanzaron al menos una reducción del 50% en el número medio mensual de días de cefalea de al menos gravedad moderada durante el período de tratamiento de 3 meses, el cambio medio desde el inicio en el número medio mensual de días de uso de cualquier medicamento para la cefalea aguda durante el período de tratamiento de 3 meses, y el cambio medio desde el inicio en el número de días de cefalea de al menos gravedad moderada durante el primer mes de tratamiento.
En el Estudio 2, un total de 1130 pacientes (991 mujeres, 139 hombres), con edades comprendidas entre los 18 y los 70 años, fueron aleatorizados. Un total de 1034 pacientes completaron la fase doble ciego de 3 meses.
Tanto los regímenes de dosificación mensual como trimestral del tratamiento con AJOVY demostraron una mejora estadísticamente significativa para los resultados clave de eficacia en comparación con el placebo, como se resume en la Tabla 3.
|
Estudio 2 |
AJOVY 225 mga |
AJOVY 675 mg |
Placebo (N=371) |
| Días de cefalea de cualquier gravedad al iniciob | 20.3 | 20.4 | 20.3 |
| Días de cefalea de al menos gravedad moderada al inicioc | 12.8 | 13.2 | 13.3 |
|
Cambio desde el inicio en el número medio mensual de días de cefalea de al menos gravedad moderada |
-4.6 |
-4.3 |
-2.5 |
| Diferencia con respecto al placebo | -2.1 | -1.8 | |
| Valor p | <0.001 | <0.001 | |
|
Cambio desde el inicio en el número medio mensual de días de migraña en pacientes |
-5.0 |
-4.9 |
-3.2 |
|
Cambio desde el inicio en el número medio mensual de días de cefalea de al menos gravedad moderada a las 4 semanas después de la 1a dosis |
-4.6 |
-4.6 |
-2.3 |
|
Porcentaje de pacientes con ≥ 50% de reducción en el número medio mensual de días de cefalea de al menos gravedad moderada |
40.8% |
37.6% |
18.1% |
|
Cambio desde el inicio en el número medio mensual de días de medicación para la cefalea aguda |
-4.2 |
-3.7 |
-1.9 |
aEn el Estudio 2, los pacientes recibieron una dosis inicial de 675 mg.
bUtilizado para el diagnóstico de migraña crónica.
cUtilizado para el análisis del criterio de valoración principal.
La Figura 3 muestra el cambio medio desde el inicio en el número medio mensual de días de dolor de cabeza de al menos gravedad moderada en el Estudio 2.
Figura 3: Cambio desde el inicio en los días mensuales de dolor de cabeza de al menos gravedad moderada en el Estudio 2a
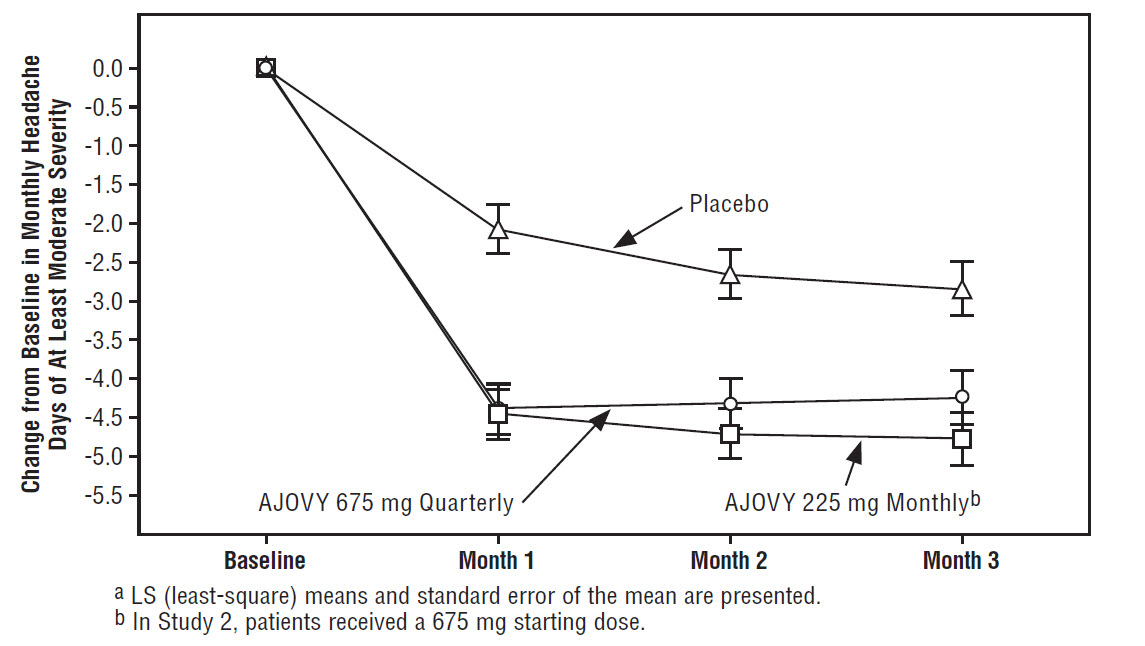
La Figura 4 muestra la distribución del cambio desde el inicio en los días mensuales de dolor de cabeza de al menos gravedad moderada en el mes 3 en intervalos de 3 días por grupo de tratamiento. Se observa un beneficio del tratamiento sobre el placebo para ambos regímenes de dosificación de AJOVY en un rango de cambios desde el inicio en los días de dolor de cabeza.
Figura 4: Distribución del cambio medio desde el inicio en los días mensuales de dolor de cabeza de al menos gravedad moderada por grupo de tratamiento en el Estudio 2
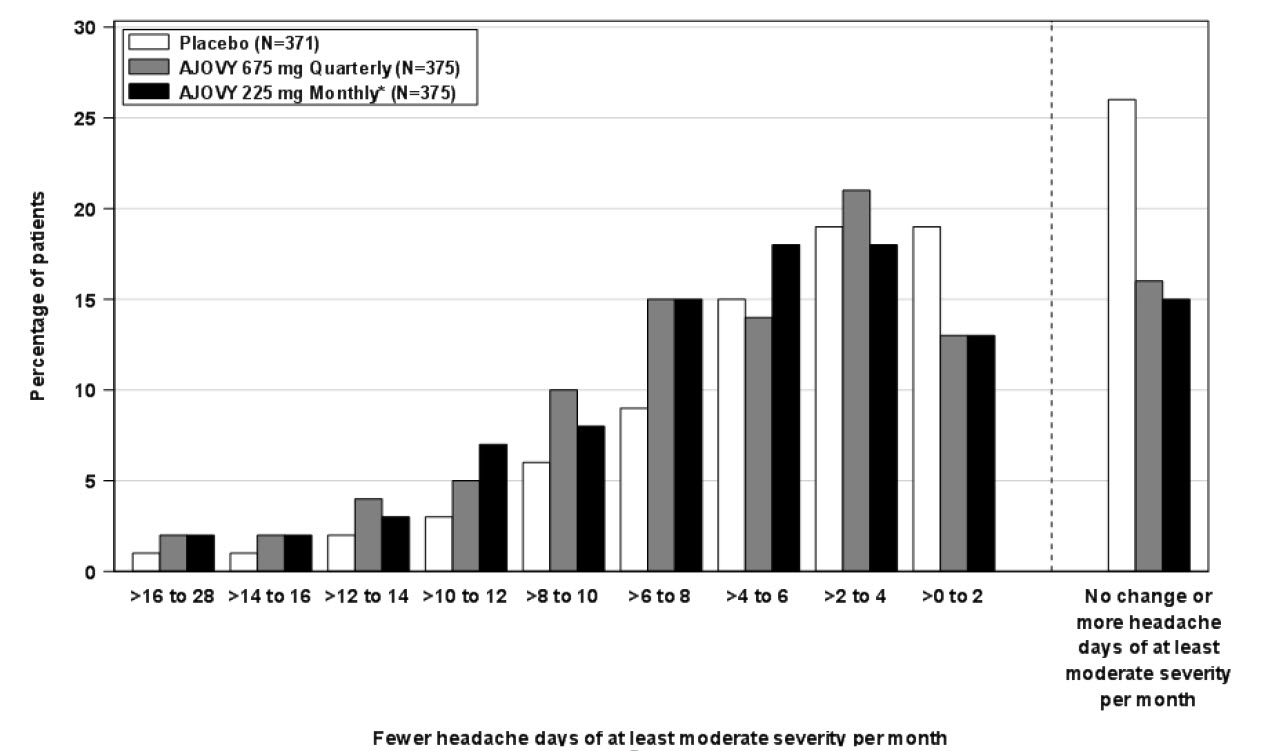
*En el Estudio 2, los pacientes recibieron una dosis inicial de 675 mg.
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
16.1 Cómo se suministra
La inyección de AJOVY (fremanezumab-vfrm) es una solución estéril, sin conservantes, de transparente a opalescente, de incolora a ligeramente amarilla para administración subcutánea.
AJOVY no está fabricado con látex de caucho natural.
AJOVY se suministra de la siguiente manera:
Autoinyector precargado
- Envase de 1 autoinyector: 225 mg/1.5 mL autoinyector precargado de dosis única
NDC 51759-202-10 - Envase de 3 autoinyectores: 3 x 225 mg/1.5mL autoinyectores precargados de dosis única
NDC 51759-202-22
Jeringa precargada
- Envase de 1 jeringa: 225 mg/1.5 mL jeringa precargada de dosis única
NDC 51759-204-10
16.2 Almacenamiento y manipulación
- Conservar en nevera entre 2°C y 8°C (36°F y 46°F) en el embalaje exterior original para proteger de la luz.
- Si es necesario, AJOVY puede conservarse en el embalaje original a temperatura ambiente hasta 30°C (86°F) durante un máximo de 7 días. Después de sacarlo de la nevera, AJOVY debe utilizarse en un plazo de 7 días o desecharse. Una vez conservado a temperatura ambiente, no lo vuelva a meter en la nevera.
- No congelar.
- No exponer a calor extremo ni a la luz solar directa.
- No agitar.
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente y/o cuidador que lea la información para pacientes aprobada por la FDA (Información para pacientes e Instrucciones de uso).
Información sobre la preparación y administración
Oriente a los pacientes y cuidadores sobre la técnica de administración subcutánea adecuada, incluida la técnica aséptica, y cómo utilizar la jeringa precargada de dosis única [ver Dosis y administración (2.2)]. Indique a los pacientes y/o cuidadores que lean y sigan las Instrucciones de uso cada vez que utilicen AJOVY.
Indique a los pacientes a los que se les recete la pauta posológica de 675 mg cada 3 meses que se administren la dosis en tres inyecciones subcutáneas consecutivas de 225 mg cada una [ver Dosis y administración (2.1)].
Reacciones de hipersensibilidad
Informe a los pacientes sobre los signos y síntomas de las reacciones de hipersensibilidad y que estas reacciones pueden producirse hasta 1 mes después de la administración. Aconseje a los pacientes que se pongan en contacto con su médico inmediatamente si se producen signos o síntomas de reacciones de hipersensibilidad [ver Advertencias y precauciones (5.1)].
Embarazo
Aconseje a las mujeres que existe un registro de exposición durante el embarazo que realiza un seguimiento de los resultados del embarazo en mujeres expuestas a AJOVY durante el mismo [ver Uso en poblaciones específicas (8.1)].
Fabricado por:
Teva Pharmaceuticals USA, Inc.
North Wales, PA 19454
US License No. 2016
El uso de AJOVY® (fremanezumab-vfrm) o su proceso de fabricación pueden estar protegidos por una o más patentes de Estados Unidos, incluidas las patentes US 8,007,794, US 8,586,045 y US 9,896,502.
©2022 Teva Pharmaceuticals USA, Inc.
AJO-010
INFORMACIÓN PARA EL PACIENTE
|
AJOVY® (a-JO-vee) (fremanezumab-vfrm) injection for subcutaneous use |
|
¿Qué es AJOVY? AJOVY es un medicamento recetado que se usa para el tratamiento preventivo de la migraña en adultos. No se sabe si AJOVY es seguro y eficaz en niños. |
|
¿Quién no debe usar AJOVY? No use AJOVY si es alérgico a fremanezumab-vfrm o a cualquiera de los ingredientes de AJOVY. Consulte el final de este folleto para obtener una lista completa de los ingredientes de AJOVY. |
|
Antes de usar AJOVY, informe a su proveedor de atención médica si:
Registro de embarazo: Existe un registro para mujeres que quedan embarazadas durante el tratamiento con AJOVY. El propósito de este registro es recopilar información sobre la seguridad de AJOVY durante el embarazo. Comuníquese con el registro tan pronto como se entere de que está embarazada, o pídale a su médico que se comunique con el registro por usted. Usted o su médico pueden obtener información e inscribirlo en el registro llamando al 1-833-927-2605 o visitando www.tevamigrainepregnancyregistry.com.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos herbales. Conozca los medicamentos que toma. Mantenga una lista de sus medicamentos con usted para mostrársela a su proveedor de atención médica y farmacéutico cuando obtenga un medicamento nuevo. |
|
¿Cómo debo usar AJOVY?
|
|
¿Cuáles son los posibles efectos secundarios de AJOVY? AJOVY puede causar efectos secundarios graves, que incluyen:
Los efectos secundarios más comunes de AJOVY incluyen:
Informe a su proveedor de atención médica si tiene algún efecto secundario que le moleste o que no desaparezca. Estos no son todos los posibles efectos secundarios de AJOVY. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088. |
|
¿Cómo debo almacenar AJOVY?
Mantenga el autoinyector precargado AJOVY y la jeringa precargada AJOVY fuera del alcance de los niños pequeños. |
|
Información general sobre el uso seguro y eficaz de AJOVY. Los medicamentos a veces se recetan para fines distintos de los que se enumeran en un folleto de información para el paciente. No use AJOVY para una afección para la que no fue recetado. No le dé AJOVY a otras personas, incluso si tienen los mismos síntomas que usted. Puede hacerles daño. Puede pedirle a su farmacéutico o proveedor de atención médica información sobre AJOVY que esté escrita para profesionales de la salud. |
|
¿Cuáles son los ingredientes de AJOVY? Ingrediente activo: fremanezumab-vfrm Ingredientes inactivos: ácido etilendiaminotetraacético disódico dihidratado (EDTA), L-histidina, clorhidrato de L-histidina monohidratado, polisorbato-80, sacarosa y agua para inyección. La jeringa precargada AJOVY y el autoinyector precargado no están hechos con látex de caucho natural. Fabricado por: Teva Pharmaceuticals USA, Inc., North Wales, PA 19454 Licencia de EE. UU. No. 2016 AJOPL-005 Para obtener más información, visite www.AJOVY.com o llame al 1-888-483-8279. |
Esta información para el paciente ha sido aprobada por la Administración de Alimentos y Medicamentos de los EE. UU. Revisado: 9/2021
INSTRUCCIONES DE USO
AJOVY® (a-JO-vee)
(fremanezumab-vfrm) inyección
autoinyector precargado, para uso subcutáneo
Solo para inyección subcutánea.
Lea y siga las Instrucciones de uso de su autoinyector precargado de AJOVY antes de empezar a usarlo y cada vez que reciba una recarga.
Importante:
- El autoinyector precargado de AJOVY es para un solo uso. Coloque AJOVY en un contenedor de objetos punzocortantes aprobado por la FDA o resistente a las perforaciones inmediatamente después de su uso. No tire (deseche) el contenedor de objetos punzocortantes usado en la basura doméstica.
- Antes de la inyección, deje que AJOVY repose a temperatura ambiente durante 30 minutos.
- Mantenga el autoinyector precargado de AJOVY fuera del alcance de los niños pequeños.
- Después de retirar la tapa protectora de AJOVY, para evitar infecciones, no toque la aguja.
- No se inyecte AJOVY en las venas (por vía intravenosa).
- No reutilice su autoinyector precargado de AJOVY, ya que podría causarle lesiones o una infección.
- No comparta su autoinyector precargado de AJOVY con otra persona. Podría contagiar una infección a otra persona o contraer una infección de ella.
Usted mismo puede administrarse AJOVY. Si no se siente cómodo, no debe recibir la primera dosis de AJOVY hasta que usted o su cuidador reciban formación de un profesional sanitario sobre la forma correcta de utilizar AJOVY.
Condiciones de almacenamiento:
- Guarde AJOVY en el refrigerador entre 36°F y 46°F (2°C y 8°C).
- Mantenga AJOVY en la caja en la que viene para protegerlo de la luz.
- Si es necesario, AJOVY puede conservarse a temperatura ambiente hasta 86°F (30°C) en la caja en la que viene hasta 7 días. No utilice AJOVY si ha estado fuera del refrigerador durante 7 días o más. Deseche AJOVY en un contenedor de objetos punzocortantes o resistente a las perforaciones si ha estado fuera del refrigerador durante 7 días o más. Una vez almacenado a temperatura ambiente, no lo vuelva a colocar en el refrigerador.
- No congele. Si AJOVY se congela, tírelo en un contenedor de objetos punzocortantes.
- Mantenga AJOVY alejado del calor extremo y de la luz solar directa.
No agite AJOVY.
Autoinyector precargado de AJOVY (antes de su uso). Vea la Figura A.
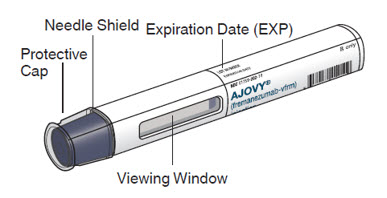
Figura A
Autoinyector precargado de AJOVY (después de su uso). Vea la Figura B.
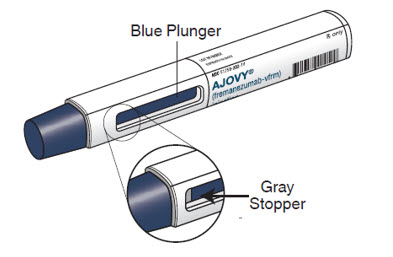
Figura B
- El émbolo azul se desplaza hacia abajo por la ventana de visualización durante la inyección. El émbolo azul llena la ventana cuando la inyección se ha completado. Nota: Cuando el émbolo azul haya llenado la ventana de visualización, todavía podrá ver el tapón gris, como se muestra en la Figura B.
- Cuando se inyecte AJOVY, sujete el autoinyector precargado de forma que la mano no cubra la ventana de visualización.
 Lea esto antes de inyectarse.
Lea esto antes de inyectarse.
Paso 1. Compruebe la dosis que le ha recetado su médico.
AJOVY se presenta en un autoinyector precargado de dosis única. Su médico le recetará la dosis que sea mejor para usted.
- Si su médico le ha recetado 225 mg de AJOVY cada mes, póngase 1 inyección cada mes, utilizando un autoinyector precargado de AJOVY de 225 mg.
- Si su médico le ha recetado 675 mg de AJOVY cada 3 meses, póngase 3 inyecciones separadas, una tras otra, utilizando un autoinyector precargado de AJOVY de 225 mg diferente para cada inyección. Póngase estas inyecciones 1 vez cada 3 meses.
Antes de inyectarse, compruebe siempre la etiqueta de su autoinyector precargado de dosis única para asegurarse de que tiene el medicamento correcto y la dosis correcta de AJOVY. Si no está seguro de su dosis, pregunte a su médico.
¿Cómo me inyecto AJOVY?
Paso 2. Retire el autoinyector precargado de la caja.
- Es posible que tenga que utilizar más de 1 autoinyector precargado, dependiendo de la dosis que le hayan recetado.
- Retire el autoinyector de la caja (vea la Figura C).
- No agite el autoinyector precargado en ningún momento, ya que esto podría afectar a la forma en que funciona el medicamento.
Importante: Si quedan autoinyectores sin usar en la caja, vuelva a colocar la caja y los autoinyectores sin usar en el refrigerador.
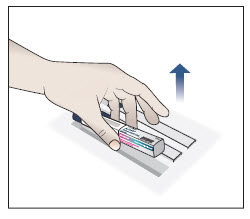
Figura C
Paso 3. Reúna los materiales que necesitará para inyectarse AJOVY.
- Reúna los siguientes materiales (vea la Figura D) y el número de autoinyectores precargados de AJOVY de 225 mg que necesitará para administrarse la dosis prescrita:
– Si su dosis es de 225 mg, necesitará 1 autoinyector precargado de AJOVY de 225 mg.
– Si su dosis es de 675 mg, necesitará 3 autoinyectores precargados de AJOVY de 225 mg.
– Torundas con alcohol (no incluidas).
– Gasas o bolas de algodón (no incluidas).
– Contenedor de objetos punzocortantes o resistente a las perforaciones (no incluido).

Figura D
Paso 4. Deje que AJOVY alcance la temperatura ambiente.
- Coloque los materiales que ha reunido sobre una superficie limpia y plana.
- Espere 30 minutos para que el medicamento alcance la temperatura ambiente.
- No deje el autoinyector precargado expuesto a la luz solar directa.
- No caliente el autoinyector precargado de AJOVY utilizando una fuente de calor como agua caliente o un microondas.

Paso 5. Lávese las manos.
- Lávese las manos con agua y jabón y séqueselas bien con una toalla limpia. Tenga cuidado de no tocarse la cara o el pelo después de lavarse las manos.
Paso 6. Observe atentamente su autoinyector precargado de AJOVY.
Nota: Puede observar burbujas de aire en el autoinyector precargado. Esto es normal. No elimine las burbujas de aire del autoinyector precargado antes de realizar la inyección.
La inyección de AJOVY con estas burbujas de aire no le hará daño.
|
|
|
|
|
|

Figura E
Paso 7: Elija el área de inyección.
-
Elija un área de inyección de las áreas siguientes (ver Figura F):
- su zona abdominal (abdomen), evite una zona de aproximadamente 2 pulgadas alrededor del ombligo.
- la parte frontal de los muslos, un área que esté al menos 2 pulgadas por encima de la rodilla y 2 pulgadas por debajo de la ingle.
- la parte posterior de los brazos superiores, en la zona carnosa de la parte superior posterior.

Figura F
Nota: Hay algunas áreas de inyección en su cuerpo que son difíciles de alcanzar (como la parte posterior del brazo). Puede necesitar ayuda de alguien que haya sido instruido en cómo administrarle la inyección si no puede alcanzar ciertas áreas de inyección.
Paso 8. Limpie el área de inyección.
- Limpie el área de inyección elegida con un paño embebido en alcohol nuevo. Deje que se seque la piel.
- No inyecte AJOVY en un área que esté sensible, roja, magullada, callosa, tatuada, dura o que tenga cicatrices o estrías.
- No inyecte AJOVY en el mismo sitio de inyección donde inyecte otros medicamentos.
- Si desea utilizar la misma área de inyección para las 3 inyecciones separadas necesarias para la dosis de 675 mg, asegúrese de que la segunda y la tercera inyección no sean en el mismo lugar que utilizó para las otras inyecciones.
Paso 9. Retire la tapa protectora y no la vuelva a colocar.
- Recoja el autoinyector precargado con una mano.
- Sostenga el autoinyector precargado como se muestra en la Figura G y tire la tapa protectora directamente hacia fuera con la otra mano. No gire.
- Descarte la tapa protectora de inmediato.
- No vuelva a colocar la tapa protectora en el autoinyector precargado, para evitar lesiones e infecciones.

Figura G
Paso 10. Realice la inyección.
- 10.1 Coloque el autoinyector precargado en un ángulo de 90 grados contra la piel en el sitio de inyección que ha limpiado (ver Figura H).

Figura H
|
10.2 Presione hacia abajo sobre el autoinyector precargado y manténgalo presionado contra la piel durante aproximadamente 30 segundos. No retire la presión hasta que se completen los 3 pasos siguientes. |
||
| 1. Usted oye el primer “clic” (esto significa que la inyección ha empezado y el émbolo azul empieza a moverse). |
2. Usted oye un segundo “clic” (aproximadamente 15 segundos después del primer clic. El émbolo se moverá hacia la parte inferior de la ventana de visualización conforme se inyecta el medicamento). |
3. Espere otros 10 segundos. (para asegurarse de que se ha inyectado todo el medicamento). |
 |
||
10.3 Compruebe que el émbolo azul haya llenado la ventana de visualización y retire el autoinyector de la piel levantándolo en línea recta (consulte la Figura I).
Nota: Cuando el émbolo azul haya llenado la ventana de visualización, podrá ver el tapón gris.
A medida que retira el autoinyector precargado de la piel, el protector de la aguja vuelve a su posición original (antes del uso) y se bloquea en su lugar, cubriendo la aguja.
No intente volver a colocar la tapa protectora en el autoinyector precargado usado, ya que ya no es necesaria.
No intente reutilizar el autoinyector precargado.
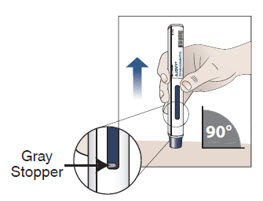
Figura I
Paso 11. Aplique presión en el lugar de la inyección.
- Use una bolita de algodón limpia y seca o una gasa para presionar suavemente el lugar de la inyección durante unos segundos.
- No frote el lugar de la inyección.
- No reutilice el autoinyector precargado.
Paso 12. Deseche el autoinyector precargado de inmediato.
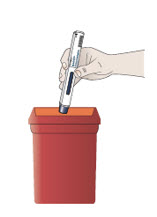
- Coloque los autoinyectores precargados usados en un contenedor de desechos de objetos punzocortantes aprobado por la FDA inmediatamente después de su uso.
- No deseche los autoinyectores precargados en la basura doméstica. No recicle el contenedor de desechos de objetos punzocortantes usado.
- Si no tiene un contenedor de desechos de objetos punzocortantes aprobado por la FDA, puede usar un contenedor doméstico que sea:
- hecho de plástico resistente,
- que se pueda cerrar con una tapa ajustada y resistente a las perforaciones, sin que puedan salir objetos punzocortantes,
- vertical y estable durante su uso,
- resistente a fugas, y
- debidamente etiquetado para advertir sobre los residuos peligrosos que contiene.
- Cuando el contenedor de desechos de objetos punzocortantes esté casi lleno, deberá seguir las pautas de su comunidad para desecharlo correctamente. Puede haber leyes estatales o locales sobre cómo desechar los autoinyectores usados. Para obtener más información sobre la eliminación segura de objetos punzocortantes e información específica sobre la eliminación de objetos punzocortantes en el estado en el que vive, visite el sitio web de la FDA en: http://www.fda.gov/safesharpsdisposal
- No deseche el contenedor de desechos de objetos punzocortantes usado en la basura doméstica a menos que las pautas de su comunidad lo permitan. No recicle el contenedor de desechos de objetos punzocortantes usado.
Inyección completa
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos.
Fabricado por:
Teva Pharmaceuticals USA, Inc.
North Wales, PA 19454
Licencia de EE. UU. n.° 2016
©2020 Teva Pharmaceuticals USA, Inc.
AJOIFU-AI-004
Aprobado: 10/2020
INSTRUCCIONES DE USO
AJOVY® (a-JO-vee)
(fremanezumab-vfrm) inyección
jeringa precargada, para uso subcutáneo
Sólo para inyección subcutánea.
Lea y siga las Instrucciones de uso de su jeringa precargada de AJOVY antes de empezar a usarla y cada vez que reciba un recambio.
Importante:
- La jeringa precargada de AJOVY es solo para un solo uso (una vez). Coloque AJOVY inmediatamente después del uso en un recipiente aprobado por la FDA para desechos de objetos punzantes o resistente a pinchazos. No tire (descarte) el recipiente de desechos de objetos punzantes que haya usado en la basura doméstica.
- Antes de inyectar, deje que AJOVY se encuentre a temperatura ambiente durante 30 minutos.
- Mantenga la jeringa precargada de AJOVY fuera del alcance de los niños pequeños.
- Después de quitar el protector de la aguja de AJOVY, para evitar infecciones, no toque la aguja.
- No retire el émbolo en ningún momento, ya que esto puede romper la jeringa precargada.
- No inyecte AJOVY en sus venas (intravenosamente).
- No reutilice la jeringa precargada de AJOVY, ya que esto podría causar lesiones o infecciones.
- No comparta su jeringa precargada de AJOVY con otra persona. Puede pasarle una infección a otra persona o contraer una infección de ellos.
Puede administrarse AJOVY usted mismo. Si se siente incómodo, no debe recibir su primera dosis de AJOVY hasta que usted o su cuidador reciba entrenamiento de un proveedor de atención médica sobre la forma correcta de utilizar AJOVY.
Condiciones de almacenamiento:
- Almacene AJOVY en el refrigerador entre 36°F y 46°F (2°C y 8°C).
- Mantenga AJOVY en el cartón en el que viene para protegerlo de la luz.
- Si es necesario, AJOVY se puede almacenar a temperatura ambiente hasta 86°F (30°C) en el cartón en el que viene durante hasta 7 días. No use AJOVY si ha estado fuera del refrigerador durante 7 días o más. Deseche (disponga de) AJOVY en un recipiente para desechos de objetos punzantes o resistente a pinchazos si ha estado fuera del refrigerador durante 7 días o más. Una vez almacenado a temperatura ambiente, no vuelva a colocar en el refrigerador.
- No congele. Si AJOVY se congela, deséchelo en un recipiente para desechos punzantes.
- Mantenga AJOVY alejado del calor extremo y la luz solar directa.
- No agite AJOVY.
Jeringa precargada de AJOVY (Antes del uso). Vea la Figura A.
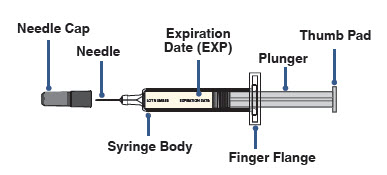
Figura A
Jeringa precargada de AJOVY (Después del uso). Vea la Figura B.

Figura B
 Lea esto antes de inyectar.
Lea esto antes de inyectar.
Paso 1. Compruebe la dosis que le ha recetado su proveedor de atención médica.
AJOVY se presenta como una jeringa precargada de dosis única (una vez). Su proveedor de atención médica le recetará la dosis que sea mejor para usted.
- Si su proveedor de atención médica le ha recetado 225 mg de AJOVY cada mes, administre 1 inyección cada mes utilizando una jeringa precargada de AJOVY de 225 mg.
- Si su proveedor de atención médica le ha recetado 675 mg de AJOVY cada 3 meses, administre 3 inyecciones separadas, una tras otra, utilizando una jeringa precargada diferente de AJOVY de 225 mg para cada inyección. Realice estas inyecciones 1 vez cada 3 meses.
Antes de inyectar, siempre revise la etiqueta de su jeringa precargada de dosis única para asegurarse de que tiene el medicamento correcto y la dosis correcta de AJOVY. Si no está seguro de su dosis, pregunte a su proveedor de atención médica.
¿Cómo me inyecto AJOVY?
Paso 2. Saque la jeringa precargada del cartón.
- Puede necesitar usar más de 1 jeringa precargada dependiendo de su dosis prescrita.
- Sujete la jeringa precargada (como se muestra en la Figura C).
- Saque la jeringa del cartón.
- No agite la jeringa precargada en ningún momento, ya que esto podría afectar el funcionamiento del medicamento.
Figura C
Paso 3. Reúna los suministros que necesitará para inyectarse AJOVY.
- Reúna los siguientes suministros (vea la Figura D) y el número de jeringas precargadas de AJOVY de 225 mg que necesitará para administrar su dosis prescrita:
– Si su dosis es de 225 mg, necesitará 1 jeringa precargada de AJOVY de 225 mg.
– Si su dosis es de 675 mg, necesitará 3 jeringas precargadas de AJOVY de 225 mg.
– hisopos de alcohol (no incluidos).
– gasas o bolas de algodón (no incluidos).
– recipiente para desechos de objetos punzantes o resistente a pinchazos (no incluidos).

Figura D
Paso 4. Deje que AJOVY alcance la temperatura ambiente.
- Coloque los suministros que ha reunido sobre una superficie limpia y plana.
- Espere 30 minutos para que el medicamento alcance la temperatura ambiente.
- No deje la jeringa precargada a la luz solar directa.
- No caliente la jeringa precargada de AJOVY utilizando una fuente de calor como agua caliente o un microondas.

Paso 5. Lávese las manos.
- Lávese las manos con agua y jabón y séquelas bien con una toalla limpia. Tenga cuidado de no tocarse la cara o el cabello después de lavarse las manos.
Paso 6. Mire detenidamente su jeringa precargada de AJOVY.
Nota: Puede ver burbujas de aire en la jeringa precargada. Esto es normal. No elimine las burbujas de aire de la jeringa precargada antes de administrar la inyección. Inyectar AJOVY con estas burbujas de aire no le hará daño.
|
|
|
|
|
|
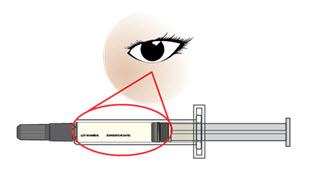
Figura E
Paso 7. Elija el área de inyección.
- Elija un área de inyección de las siguientes áreas (consulte la Figura F):
- su zona del estómago (abdomen), evite aproximadamente 2 pulgadas alrededor del ombligo.
- la parte frontal de sus muslos, un área que esté al menos 2 pulgadas por encima de la rodilla y 2 pulgadas por debajo de la ingle.
- la parte posterior de sus brazos superiores, en la zona carnosa de la parte superior de la espalda.
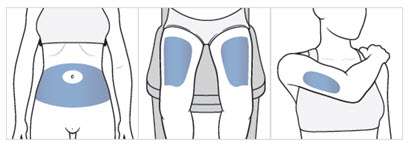
Figura F
Nota: Hay algunas áreas de inyección en su cuerpo que son difíciles de alcanzar (como la parte posterior de su brazo). Es posible que necesite ayuda de alguien que haya sido instruido sobre cómo administrarle la inyección si no puede alcanzar ciertas áreas de inyección.
Paso 8. Limpie el área de inyección.
- Limpie el área de inyección elegida con un hisopo de alcohol nuevo. Deje que se seque la piel.
- No inyecte AJOVY en un área que sea sensible, roja, morada, callosa, tatuada, dura o que tenga cicatrices o estrías.
- No inyecte AJOVY en el mismo sitio de inyección donde inyecta otro medicamento.
- Si desea usar la misma área de inyección para las 3 inyecciones separadas necesarias para la dosis de 675 mg, asegúrese de que la segunda y tercera inyección no estén en el mismo lugar que usó para las otras inyecciones.
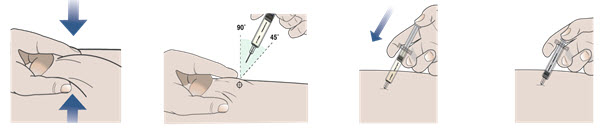
Paso 9. Retire el capuchón de la aguja y no lo vuelva a colocar.
- Tome el cuerpo de la jeringa precargada con 1 mano.
- Extraiga el capuchón de la aguja directamente con la otra mano (consulte la Figura G). No gire.
- Arroje el capuchón de la aguja inmediatamente.
- No vuelva a colocar el capuchón de la aguja en la jeringa precargada, para evitar lesiones e infecciones.

Figura G
Paso 10. Realice la inyección siguiendo los 4 pasos siguientes.
| 1. Utilice la mano libre para pellizcar suavemente al menos 1 pulgada de la piel que ha limpiado. | 2. Inserte la aguja en la piel pellizcada con un ángulo de 45 a 90 grados. | 3. Cuando la aguja esté completamente en su piel, use el pulgar para empujar el émbolo. | 4. Empuje el émbolo lentamente todo el camino hacia abajo hasta que llegue al final para inyectar todo el medicamento. |
 |
|||
Paso 11. Retire la aguja de su piel.
- Después de haber inyectado todo el medicamento, extraiga la aguja directamente (vea la Figura H).
- No vuelva a colocar la aguja en ningún momento para evitar lesiones e infecciones.
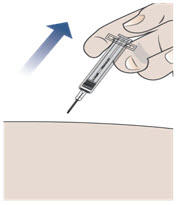
Figura H
Paso 12. Aplique presión en el sitio de inyección.
- Use una bola de algodón o gasa limpia y seca para presionar suavemente el sitio de inyección durante unos segundos.
- No frote el sitio de inyección.
- No vuelva a utilizar la jeringa precargada.
Paso 13. Deseche su jeringa precargada de inmediato.
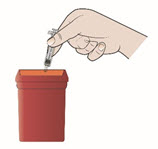
- Coloque sus jeringas precargadas usadas, agujas y objetos punzantes en un contenedor de eliminación de objetos punzantes aprobado por la FDA inmediatamente después de su uso.
- No deseche (elimine) agujas, jeringas o jeringas precargadas sueltas en la basura de su hogar. No recicle su contenedor de eliminación de objetos punzantes usado.
- Si no tiene un contenedor de eliminación de objetos punzantes aprobado por la FDA, puede usar un contenedor doméstico que sea:
- hecho de plástico de alta resistencia,
- se puede cerrar con una tapa hermética y resistente a las perforaciones, sin que los objetos punzantes puedan salir,
- vertical y estable durante el uso,
- a prueba de fugas, y
- adecuadamente etiquetado para advertir sobre los residuos peligrosos dentro del contenedor.
- Cuando su contenedor de eliminación de objetos punzantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de desechar su contenedor de eliminación de objetos punzantes. Puede haber leyes estatales o locales sobre cómo debe desechar las jeringas usadas. Para obtener más información sobre la eliminación segura de objetos punzantes y para obtener información específica sobre la eliminación de objetos punzantes en el estado en el que vive, visite el sitio web de la FDA en: http://www.fda.gov/safesharpsdisposal
- No deseche su contenedor de eliminación de objetos punzantes usado en la basura de su hogar a menos que las pautas de su comunidad lo permitan. No recicle su contenedor de eliminación de objetos punzantes usado.
Inyección Completa
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los EE. UU.
Fabricado por:
Teva Pharmaceuticals USA, Inc.
North Wales, PA 19454
Licencia de EE. UU. No. 2016
©2020 Teva Pharmaceuticals USA, Inc.
AJOIFU-PFS-004
Revisado: 10/2020
PANEL DE EXPOSICIÓN DE ENVASE/ETIQUETA, Cartón de 1 jeringa precargada
NDC 51759-204-10
Solo con receta médica
AJOVY® (fremanezumab-vfrm) inyección 225 mg/1.5 mL
SOLO PARA USO SUBCUTÁNEO
Una jeringa precargada de una sola dosis
Almacenar en refrigerador entre 36°F y 46°F (2° y 8°C) en la caja original para proteger de la luz. NO CONGELAR. NO AGITAR. Si es necesario, AJOVY® se puede conservar a temperatura ambiente de hasta 86°F (30°C) durante 7 días. Una vez almacenado a temperatura ambiente, no devolver al refrigerador. Desechar después de 7 días.
ABRIR AQUÍ
teva

Panel de visualización del paquete/etiqueta, cartón de 1 autoinyector precargado
NDC 51759-202-10
Solo con receta médica
AJOVY (fremanezumab-vfrm) inyección 225 mg/1,5 mL
SOLO PARA USO SUBCUTÁNEO
Un inyector automático precargado de una sola dosis
Almacenar en refrigerador a 36 °F a 46 °F (2 ° a 8 °C) en el cartón original para proteger de la luz. NO CONGELAR. NO SACUDIR. Si es necesario, AJOVY® se puede mantener a temperatura ambiente hasta 86 °F (30 °C) durante 7 días. Una vez almacenado a temperatura ambiente, no devuelva al refrigerador. Desechar después de 7 días.
ABRIR AQUÍ
teva

Panel de visualización de embalaje/etiqueta, Cartón de 3 autoinyectores precargados
NDC 51759-202-22
Rx only
AJOVY (fremanezumab-vfrm) injection 225 mg/1.5 mL
PARA USO SUBCUTÁNEO SOLAMENTE
3 x 225 mg/1.5 mL autoinyectores precargados de dosis única
Conservar en el refrigerador a una temperatura de 36 °F a 46 °F (2 °C a 8 °C) en el envase original para protegerlo de la luz. NO CONGELAR. NO AGITAR. Si es necesario, AJOVY® puede mantenerse a temperatura ambiente hasta 86 °F (30 °C) durante 7 días. Una vez almacenado a temperatura ambiente, no lo vuelva a colocar en el refrigerador. Deseche después de 7 días.
ABRIR AQUÍ
teva


