Fabricante de medicamentos: Amgen Inc (Updated: 2024-08-15)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
AIMOVIG® (erenumab-aooe) injection, for subcutaneous use
Initial U.S. Approval: 2018
CAMBIOS RECIENTES IMPORTANTES
| Dosage and Administration (2.2) | 9/2022 |
INDICACIONES Y USO
AIMOVIG es un antagonista del receptor del péptido relacionado con el gen de la calcitonina indicado para el tratamiento preventivo de la migraña en adultos. (1)
DOSIFICACIÓN Y ADMINISTRACIÓN
- Solo para uso subcutáneo (2.1, 2.2)
- La dosis recomendada es de 70 mg una vez al mes; algunos pacientes pueden beneficiarse de una dosis de 140 mg una vez al mes (2.1)
- Administrar por vía subcutánea en el abdomen, el muslo o la parte superior del brazo (2.2)
- Consulte la sección Dosificación y administración para obtener instrucciones importantes sobre la administración (2.2)
FORMAS FARMACÉUTICAS Y CONCENTRACIONES
- Inyección: solución de 70 mg/ml en un autoinyector SureClick® precargado de dosis única (3)
- Inyección: solución de 140 mg/ml en un autoinyector SureClick® precargado de dosis única (3)
- Inyección: solución de 70 mg/ml en una jeringa precargada de dosis única (3)
- Inyección: solución de 140 mg/ml en una jeringa precargada de dosis única (3)
CONTRAINDICACIONES
AIMOVIG está contraindicado en pacientes con hipersensibilidad grave a erenumab-aooe o a cualquiera de los excipientes. (4)
ADVERTENCIAS Y PRECAUCIONES
- Reacciones de hipersensibilidad: si se produce una reacción de hipersensibilidad grave, suspenda la administración de AIMOVIG e inicie el tratamiento adecuado. Las reacciones de hipersensibilidad pueden ocurrir desde horas hasta más de una semana después de la administración. (5.1)
- Estreñimiento con complicaciones graves: pueden producirse complicaciones graves del estreñimiento. (5.2)
- Hipertensión: puede aparecer hipertensión de nuevo inicio o empeorar la preexistente. (5.3)
REACCIONES ADVERSAS
Las reacciones adversas más comunes en los estudios clínicos de AIMOVIG (que ocurren en al menos el 3% de los pacientes tratados y con más frecuencia que con placebo) son reacciones en el lugar de la inyección y estreñimiento. (6.1)
Para informar de SOSPECHAS DE REACCIONES ADVERSAS, póngase en contacto con el servicio de información médica de Amgen en el teléfono 1-800-77-AMGEN (1-800-772-6436) o con la FDA en el 1-800-FDA-1088 o en www.fda.gov/medwatch.
Consulte la sección 17 para obtener INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y el etiquetado para pacientes aprobado por la FDA.
Revised: 8/2024
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosificación recomendada
2.2 Instrucciones importantes de administración
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de hipersensibilidad
5.2 Estreñimiento con complicaciones graves
5.3 Hipertensión
6 REACCIONES ADVERSAS
6.1 Experiencia en ensayos clínicos
6.2 Experiencia postcomercialización
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso pediátrico
8.5 Uso geriátrico
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
12.2 Farmacodinamia
12.3 Farmacocinética
12.6 Inmunogenicidad
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad
14 ESTUDIOS CLÍNICOS
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANEJO
16.1 Forma de suministro
16.2 Almacenamiento y manejo
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
1 INDICACIONES Y USO
AIMOVIG está indicado para el tratamiento preventivo de la migraña en adultos.
2 DOSIS Y ADMINISTRACIÓN
2.1 Dosificación recomendada
La dosis recomendada de AIMOVIG es de 70 mg administrados por vía subcutánea una vez al mes. Algunos pacientes pueden beneficiarse de una dosis de 140 mg administrados por vía subcutánea una vez al mes.
Si se olvida de una dosis de AIMOVIG, administrela lo antes posible. A partir de entonces, AIMOVIG se puede programar mensualmente a partir de la fecha de la última dosis.
2.2 Instrucciones importantes de administración
AIMOVIG es solo para uso subcutáneo.
AIMOVIG está destinado a la autoadministración por parte del paciente. Antes de su uso, proporcione una capacitación adecuada a los pacientes y/o cuidadores sobre cómo preparar y administrar AIMOVIG utilizando el autoinyector precargado de dosis única o la jeringa precargada de dosis única, incluida la técnica aséptica [ver Instrucciones de uso]:
- Antes de la administración subcutánea, deje que AIMOVIG repose a temperatura ambiente durante al menos 30 minutos protegido de la luz solar directa [ver Presentación/Conservación y manipulación (16.2)]. Esto es importante para administrar la dosis completa y ayuda a minimizar las molestias. No caliente utilizando una fuente de calor como agua caliente o un microondas.
- No agite el producto.
- Inspeccione visualmente la presencia de partículas y decoloración antes de la administración [ver Formas farmacéuticas y concentraciones (3)]. No lo use si la solución está turbia o descolorida o contiene escamas o partículas.
- Administre AIMOVIG en el abdomen, el muslo o la parte superior del brazo por vía subcutánea. No inyecte en áreas donde la piel esté sensible, magullada, roja o dura.
- Tanto el autoinyector precargado como la jeringa precargada son de dosis única y administran todo el contenido.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
AIMOVIG es una solución estéril, transparente a opalescente, incolora a amarillo claro disponible de la siguiente manera:
- Inyección: 70 mg/mL en un autoinyector SureClick® prellenado de dosis única
- Inyección: 140 mg/mL en un autoinyector SureClick® prellenado de dosis única
- Inyección: 70 mg/mL en una jeringa prellenada de dosis única
- Inyección: 140 mg/mL en una jeringa prellenada de dosis única
4 CONTRAINDICACIONES
AIMOVIG está contraindicado en pacientes con hipersensibilidad grave a erenumab-aooe o a cualquiera de los excipientes. Las reacciones han incluido anafilaxia y angioedema [ver Advertencias y precauciones (5.1)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de hipersensibilidad
Se han notificado reacciones de hipersensibilidad con AIMOVIG en la experiencia posterior a la comercialización, entre ellas, erupción cutánea, angioedema y anafilaxia. La mayoría de las reacciones de hipersensibilidad no fueron graves y se produjeron en las horas siguientes a la administración, aunque algunas se produjeron más de una semana después de la administración. Si se produce una reacción de hipersensibilidad grave o intensa, interrumpa la administración de AIMOVIG e inicie el tratamiento adecuado [consulte Contraindicaciones (4) e Información de orientación al paciente (17)].
5.2 Estreñimiento con complicaciones graves
Se ha notificado estreñimiento con complicaciones graves tras el uso de AIMOVIG en la fase posterior a la comercialización. Se dieron casos que requirieron hospitalización, incluidos casos en los que fue necesaria la cirugía. En la mayoría de estos casos, se notificó la aparición de estreñimiento después de la primera dosis de AIMOVIG; sin embargo, los pacientes también han presentado estreñimiento más adelante en el tratamiento. Se interrumpió el tratamiento con AIMOVIG en la mayoría de los casos notificados de estreñimiento con complicaciones graves. El estreñimiento fue una de las reacciones adversas más frecuentes (hasta el 3%) notificadas en los estudios clínicos [consulte Reacciones adversas (6.1)].
Controle a los pacientes tratados con AIMOVIG para detectar el estreñimiento grave y trátelo según proceda clínicamente [consulte Información de orientación al paciente (17)]. El uso simultáneo de medicamentos asociados a una disminución de la motilidad gastrointestinal puede aumentar el riesgo de estreñimiento más grave y la posibilidad de complicaciones relacionadas con el estreñimiento.
5.3 Hipertensión
Se ha notificado la aparición de hipertensión y el agravamiento de la hipertensión preexistente tras el uso de AIMOVIG en la fase posterior a la comercialización. Muchos de los pacientes tenían hipertensión preexistente o factores de riesgo de hipertensión. Se dieron casos que requirieron tratamiento farmacológico y, en algunos casos, hospitalización. La hipertensión puede aparecer en cualquier momento durante el tratamiento, pero se notificó con mayor frecuencia en los siete días siguientes a la administración de la dosis. En la mayoría de los casos, la aparición o el agravamiento de la hipertensión se notificó después de la primera dosis. Se interrumpió el tratamiento con AIMOVIG en muchos de los casos notificados.
Controle a los pacientes tratados con AIMOVIG para detectar la aparición de hipertensión o el agravamiento de la hipertensión preexistente, y considere si está justificada la interrupción del tratamiento con AIMOVIG si la evaluación no permite establecer una etiología alternativa.
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas graves se describen a continuación y en otras partes del etiquetado:
- Reacciones de hipersensibilidad [ver Advertencias y precauciones (5.1)]
- Estreñimiento con complicaciones graves [ver Advertencias y precauciones (5.2)]
- Hipertensión [ver Advertencias y precauciones (5.3)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica clínica.
La seguridad de AIMOVIG se ha evaluado en 2537 pacientes con migraña que recibieron al menos una dosis de AIMOVIG, lo que representa 3040.2 años-paciente de exposición. De estos, 2271 pacientes estuvieron expuestos a 70 mg o 140 mg una vez al mes durante al menos 6 meses, 1305 pacientes estuvieron expuestos durante al menos 12 meses y 216 pacientes estuvieron expuestos durante 5 años.
En estudios clínicos controlados con placebo (Estudios 1, 2 y 3) de 2184 pacientes, 787 pacientes recibieron al menos una dosis de AIMOVIG 70 mg una vez al mes, 507 pacientes recibieron al menos una dosis de AIMOVIG 140 mg una vez al mes y 890 pacientes recibieron placebo durante 3 meses o 6 meses de tratamiento doble ciego [ver Estudios clínicos (14)]. Aproximadamente el 84% eran mujeres, el 91% eran blancas y la edad media era de 42 años al inicio del estudio.
Las reacciones adversas más comunes (incidencia ≥ 3% y más a menudo que el placebo) en los estudios de migraña fueron reacciones en el lugar de la inyección y estreñimiento. La Tabla 1 resume las reacciones adversas que ocurrieron durante los primeros 3 meses en los estudios de migraña (Estudios 1, 2 y 3).
| Reacción adversa | AIMOVIG 70 mg una vez al mes N = 787 % |
AIMOVIG 140 mg una vez al mes N = 507 % |
Placebo
N = 890 |
|---|---|---|---|
| Reacciones en el lugar de la inyección*,† | 6 | 5 | 3 |
| Estreñimiento | 1 | 3 | 1 |
| Calambres, espasmos musculares | < 1 | 2 | < 1 |
En los Estudios 1, 2 y 3, el 1.3% de los pacientes tratados con AIMOVIG 70 mg o 140 mg interrumpieron el tratamiento doble ciego debido a eventos adversos. Las reacciones en el lugar de la inyección más frecuentes fueron dolor en el lugar de la inyección, eritema en el lugar de la inyección y prurito en el lugar de la inyección.
6.2 Experiencia postcomercialización
Las siguientes reacciones adversas se han identificado durante el uso posterior a la aprobación de AIMOVIG. Debido a que estas reacciones se notifican voluntariamente de una población de tamaño incierto, no siempre es posible estimar de forma fiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos del sistema inmunitario: Reacciones de hipersensibilidad, que incluyen erupción cutánea, angioedema y anafilaxia [ver Advertencias y precauciones (5.1)].
Trastornos gastrointestinales: Estreñimiento con complicaciones graves [ver Advertencias y precauciones (5.2)], ulceración de la mucosa oral.
Trastornos de la piel y del tejido subcutáneo: Erupción cutánea, alopecia.
Trastornos vasculares: Hipertensión [ver Advertencias y precauciones (5.3)].
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Registro de Exposición al Embarazo
Existe un registro de exposición al embarazo que monitorea los resultados del embarazo en mujeres expuestas a AIMOVIG durante el embarazo. Se debe alentar a las pacientes a que se inscriban llamando al 1-833-244-4083 o visitando https://www.genesispregnancyregistry.com/.
Resumen de Riesgos
No hay datos adecuados sobre el riesgo de desarrollo asociado con el uso de AIMOVIG en mujeres embarazadas. No se observaron efectos adversos en la descendencia cuando se administró erenumab-aooe a monos preñados durante toda la gestación [ver Datos]. Las exposiciones séricas a erenumab-aooe en monos preñados fueron mayores que las de los humanos a dosis clínicas.
En la población general de los EE. UU., el riesgo de fondo estimado de defectos de nacimiento mayores y aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente. La tasa estimada de defectos de nacimiento mayores (2.2% -2.9%) y aborto espontáneo (17%) entre los partos de mujeres con migraña es similar a las tasas reportadas en mujeres sin migraña.
Datos
Datos de Animales
En un estudio en el que se administró erenumab-aooe (0 o 50 mg/kg) dos veces por semana por inyección subcutánea a monos hembra durante todo el embarazo (día de gestación 20-22 hasta el parto), no se observaron efectos adversos en la descendencia. Las exposiciones séricas a erenumab-aooe (AUC) en monos preñados fueron aproximadamente 20 veces mayores que las de los humanos a una dosis de 140 mg una vez al mes.
8.2 Lactancia
Resumen de Riesgos
No hay datos sobre la presencia de erenumab-aooe en la leche materna, los efectos en el lactante amamantado o los efectos en la producción de leche. Se deben considerar los beneficios de desarrollo y salud de la lactancia materna junto con la necesidad clínica de la madre de AIMOVIG y cualquier posible efecto adverso en el lactante amamantado por AIMOVIG o por la condición materna subyacente.
8.5 Uso Geriátrico
Los estudios clínicos de AIMOVIG no incluyeron un número suficiente de pacientes de 65 años o más para determinar si responden de manera diferente a los pacientes más jóvenes. En general, la selección de la dosis para un paciente de edad avanzada debe ser cautelosa, generalmente comenzando en el extremo inferior del rango de dosificación, lo que refleja la mayor frecuencia de disminución de la función hepática, renal o cardíaca, y de enfermedades concomitantes u otra terapia farmacológica.
11 DESCRIPCIÓN
Erenumab-aooe es un anticuerpo monoclonal humano de inmunoglobulina G2 (IgG2) que tiene una alta afinidad de unión al receptor del péptido relacionado con el gen de la calcitonina. Erenumab-aooe se produce utilizando tecnología de ADN recombinante en células ováricas de hámster chino (CHO). Está compuesto por 2 cadenas pesadas, cada una con 456 aminoácidos, y 2 cadenas ligeras de la subclase lambda, cada una con 216 aminoácidos, con un peso molecular aproximado de 150 kDa.
AIMOVIG (erenumab-aooe) inyección se suministra como una solución estéril, sin conservantes, transparente a opalescente, incolora a amarillo claro para administración subcutánea. Cada autoinyector prellenado de dosis única de 1 mL 70 mg y jeringa de vidrio prellenada de dosis única de 70 mg contiene 70 mg de erenumab-aooe, acetato (1,5 mg), polisorbato 80 (0,10 mg) y sacarosa (73 mg). Cada autoinyector prellenado de dosis única de 1 mL 140 mg y jeringa de vidrio prellenada de dosis única de 140 mg contiene 140 mg de erenumab-aooe, acetato (2,0 mg), polisorbato 80 (0,10 mg) y sacarosa (65 mg). Dentro del autoinyector se encuentra una jeringa de vidrio prellenada de dosis única. La solución de AIMOVIG tiene un pH de 5,2.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Erenumab-aooe es un anticuerpo monoclonal humano que se une al receptor del péptido relacionado con el gen de la calcitonina (CGRP) y antagoniza la función del receptor CGRP.
12.2 Farmacodinamia
En un estudio aleatorizado, doble ciego y controlado con placebo en voluntarios sanos, la administración concomitante de erenumab-aooe (140 mg intravenosos, dosis única) con sumatriptán (12 mg subcutáneos, administrados en dos dosis de 6 mg separadas por una hora) no tuvo ningún efecto sobre la presión arterial en reposo en comparación con sumatriptán solo. AIMOVIG es solo para uso subcutáneo.
12.3 Farmacocinética
Erenumab-aooe exhibe una cinética no lineal como resultado de la unión al receptor CGRP. La media de la Cmáx y la media del AUCúltimo después de la administración subcutánea de una dosis de 70 mg una vez al mes y una dosis de 140 mg una vez al mes en voluntarios sanos o pacientes con migraña se incluyen en la Tabla 2.
Se observó una acumulación inferior al doble en las concentraciones séricas mínimas (Cmín) para pacientes con migraña episódica y crónica después de la administración subcutánea de dosis de 70 mg una vez al mes y 140 mg una vez al mes (consulte la Tabla 2). Las concentraciones séricas mínimas alcanzaron el estado estacionario a los 3 meses de dosificación. La vida media efectiva de erenumab-aooe es de 28 días.
| AIMOVIG 70 mg Subcutáneamente una vez al mes |
AIMOVIG 140 mg Subcutáneamente una vez al mes |
|
|---|---|---|
| Cmáx media (DE)*,† | 6.1 (2.1) mcg/mL | 15.8 (4.8) mcg/mL |
| AUCúltimo media (DE)*,† | 159 (58) días*mcg/mL | 505 (139) días*mcg/mL |
| Cmín (DE) | ||
| Migraña episódica | 5.7 (3.1) mcg/mL | 12.8 (6.5) mcg/mL |
| Migraña crónica | 6.2 (2.9) mcg/mL | 14.9 (6.5) mcg/mL |
Absorción
Después de una dosis única subcutánea de 70 mg o 140 mg de erenumab-aooe administrada a adultos sanos, las concentraciones séricas máximas medias se alcanzaron en aproximadamente 6 días, y la biodisponibilidad absoluta estimada fue del 82%.
Distribución
Después de una dosis intravenosa única de 140 mg, el volumen de distribución medio (DE) durante la fase terminal (Vz) se estimó en 3.86 (0.77) L.
Metabolismo y excreción
Se observaron dos fases de eliminación para erenumab-aooe. A bajas concentraciones, la eliminación se produce predominantemente a través de la unión saturable al objetivo (receptor CGRP), mientras que a concentraciones más altas la eliminación de erenumab-aooe se produce en gran medida a través de una vía proteolítica no específica y no saturable.
Poblaciones específicas
La farmacocinética de erenumab-aooe no se vio afectada por la edad, el sexo, la raza o los subtipos de espectro de migraña (migraña episódica o crónica) según el análisis farmacocinético poblacional.
Pacientes con insuficiencia renal o hepática
El análisis farmacocinético poblacional de los datos integrados de los estudios clínicos de AIMOVIG no reveló diferencias en la farmacocinética de erenumab-aooe en pacientes con insuficiencia renal leve o moderada en comparación con aquellos con función renal normal. No se ha estudiado a pacientes con insuficiencia renal grave (TFGe < 30 ml/min/1.73 m2). No se realizaron estudios clínicos específicos para evaluar el efecto de la insuficiencia hepática o renal en la farmacocinética de erenumab-aooe. No se espera que la insuficiencia renal o hepática afecte a la farmacocinética de erenumab-aooe.
Estudios de interacción farmacológica
Enzimas P450
Erenumab-aooe no se metaboliza por las enzimas del citocromo P450; por lo tanto, es poco probable que se produzcan interacciones con medicamentos concomitantes que sean sustratos, inductores o inhibidores de las enzimas del citocromo P450.
Anticonceptivos orales
En un estudio abierto de interacción farmacológica en mujeres voluntarias sanas, erenumab-aooe (140 mg subcutáneos, dosis única) no afectó a la farmacocinética de un anticonceptivo oral combinado que contenía etinilestradiol y norgestimato.
Sumatriptán
En un estudio en voluntarios sanos, la administración concomitante de erenumab-aooe con sumatriptán no tuvo ningún efecto sobre la farmacocinética de sumatriptán [véase Farmacología clínica (12.2)].
12.6 Inmunogenicidad
La incidencia observada de anticuerpos contra el fármaco depende en gran medida de la sensibilidad y especificidad del ensayo. Las diferencias en los métodos de ensayo impiden realizar comparaciones significativas de la incidencia de anticuerpos contra el fármaco en los estudios que se describen a continuación con la incidencia de anticuerpos contra el fármaco en otros estudios, incluidos los de erenumab-aooe.
La inmunogenicidad de AIMOVIG se ha evaluado mediante un inmunoensayo para la detección de anticuerpos de unión anti-erenumab-aooe. En los pacientes cuyos sueros dieron positivo en el inmunoensayo de detección, se realizó un ensayo biológico in vitro para detectar anticuerpos neutralizantes.
En estudios controlados con AIMOVIG [véase Estudios clínicos (14)], la incidencia de desarrollo de anticuerpos anti-erenumab-aooe fue del 6.2% (48/778) en pacientes que recibieron AIMOVIG 70 mg una vez al mes (2 de los cuales tenían actividad neutralizante in vitro) y del 2.6% (13/504) en pacientes que recibieron AIMOVIG 140 mg una vez al mes (ninguno de los cuales tenía actividad neutralizante in vitro). En un estudio a largo plazo, que incluyó 12 semanas de tratamiento doble ciego y hasta 256 semanas de tratamiento abierto, la incidencia de desarrollo de anticuerpos anti-erenumab-aooe fue del 11.1% (25/225) entre los pacientes cuya dosis de AIMOVIG fue de 70 mg o 140 mg (2 de los cuales tenían actividad neutralizante in vitro). La tasa de anticuerpos neutralizantes anti-erenumab-aooe puede estar subestimada debido a las limitaciones del ensayo. Aunque estos datos no demuestran un impacto del desarrollo de anticuerpos anti-erenumab-aooe en la eficacia o seguridad de AIMOVIG en estos pacientes, los datos disponibles son demasiado limitados para sacar conclusiones definitivas.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogenesis, Mutagenesis, Impairment of Fertility
Impairment of Fertility
No se han realizado estudios de apareamiento en erenumab-aooe. No se observaron cambios histopatológicos en los órganos reproductores masculinos o femeninos en monos a los que se les administró erenumab-aooe (0, 25 o 150 mg/kg) mediante inyección subcutánea dos veces por semana durante un máximo de 6 meses. Las exposiciones séricas a erenumab-aooe (AUC) a la dosis más alta probada fueron más de 100 veces superiores a las de los seres humanos a una dosis de 140 mg una vez al mes.
14 ESTUDIOS CLÍNICOS
La eficacia de AIMOVIG se evaluó como tratamiento preventivo de la migraña episódica o crónica en tres estudios aleatorizados, doble ciego y controlados con placebo: dos estudios en pacientes con migraña episódica (de 4 a 14 días de migraña por mes) (Estudio 1 y Estudio 2) y un estudio en pacientes con migraña crónica (≥ 15 días de cefalea por mes con ≥ 8 días de migraña por mes) (Estudio 3). Los estudios incluyeron pacientes con antecedentes de migraña, con o sin aura, de acuerdo con los criterios de diagnóstico de la Clasificación Internacional de Cefaleas (ICHD-III).
Migraña episódica
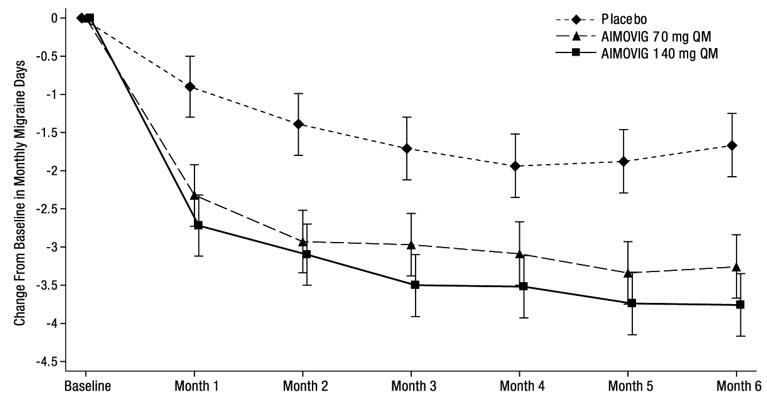
El estudio 1 (NCT 02456740) fue un estudio aleatorizado, multicéntrico, de 6 meses, controlado con placebo, doble ciego que evaluó AIMOVIG para el tratamiento preventivo de la migraña episódica. Un total de 955 pacientes con antecedentes de migraña episódica fueron aleatorizados para recibir AIMOVIG 70 mg (N = 317), AIMOVIG 140 mg (N = 319) o placebo (N = 319) mediante inyección subcutánea una vez al mes (QM) durante 6 meses. Los pacientes pudieron usar tratamientos para el dolor de cabeza agudo, incluidos medicamentos específicos para la migraña (es decir, triptanes, derivados de la ergotamina) y AINE durante el estudio.
El estudio excluyó a los pacientes con cefalea por abuso de medicamentos, así como a los pacientes con infarto de miocardio, accidente cerebrovascular, ataques isquémicos transitorios, angina inestable, cirugía de derivación de la arteria coronaria u otros procedimientos de revascularización dentro de los 12 meses anteriores a la selección.
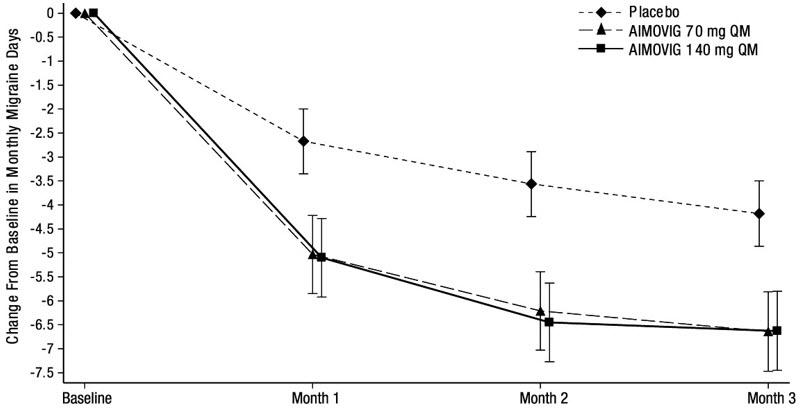
El criterio de valoración principal de eficacia fue el cambio desde el inicio en la media de días de migraña mensuales durante los meses 4 a 6. Los criterios de valoración secundarios incluyeron el logro de una reducción ≥ 50% desde el inicio en la media de días de migraña mensuales durante los meses 4 a 6 (“≥ 50% de respondedores a MMD”), el cambio desde el inicio en la media de días de medicamentos específicos para la migraña aguda mensuales durante los meses 4 a 6 y el cambio desde el inicio en la media del Diario de Impacto de la Función Física de la Migraña (MPFID) durante los meses 4 a 6. El MPFID mide el impacto de la migraña en las actividades cotidianas (EA) y el deterioro físico (PI) utilizando un diario electrónico administrado diariamente. Las puntuaciones mensuales de MPFID se promedian durante 28 días, incluidos los días con y sin migraña; las puntuaciones se escalan de 0 a 100. Las puntuaciones más altas indican un peor impacto en EA y PI. Las reducciones desde el inicio en las puntuaciones de MPFID indican una mejora.
Un total de 858 (90%) pacientes completaron el estudio doble ciego de 6 meses. Los pacientes tenían una edad media de 42 años (rango: 18 a 65 años), el 85% eran mujeres y el 89% eran blancos. El tres por ciento de los pacientes estaban tomando tratamientos preventivos concomitantes para la migraña. La frecuencia media de migraña al inicio fue de aproximadamente 8 días de migraña por mes y fue similar en todos los grupos de tratamiento.
El tratamiento con AIMOVIG demostró mejoras estadísticamente significativas para los criterios de valoración principales de eficacia en comparación con el placebo, como se resume en la Tabla 3.
| AIMOVIG 70 mg Una vez al mes |
AIMOVIG 140 mg Una vez al mes |
Placebo | |
|---|---|---|---|
| N = 312 | N = 318 | N = 316 | |
| Días de migraña mensuales (MMD) | |||
| Cambio desde el inicio | −3.2 | −3.7 | −1.8 |
| Diferencia del placebo | −1.4 | −1.9 | |
| p-valor | < 0.001 | < 0.001 | |
| ≥ 50% de respondedores a MMD | |||
| % de respondedores | 43.3% | 50.0% | 26.6% |
| Diferencia del placebo | 16.7% | 23.4% | |
| Razón de posibilidades en relación con el placebo | 2.1 | 2.8 | |
| p-valor | < 0.001 | < 0.001 | |
| Días de medicamentos específicos para la migraña aguda mensuales | |||
| Cambio desde el inicio | −1.1 | −1.6 | −0.2 |
| Diferencia del placebo | −0.9 | −1.4 | |
| p-valor | < 0.001 | < 0.001 | |
|
|
|
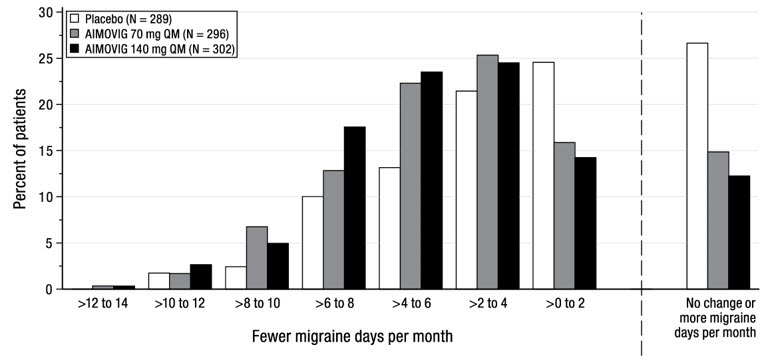
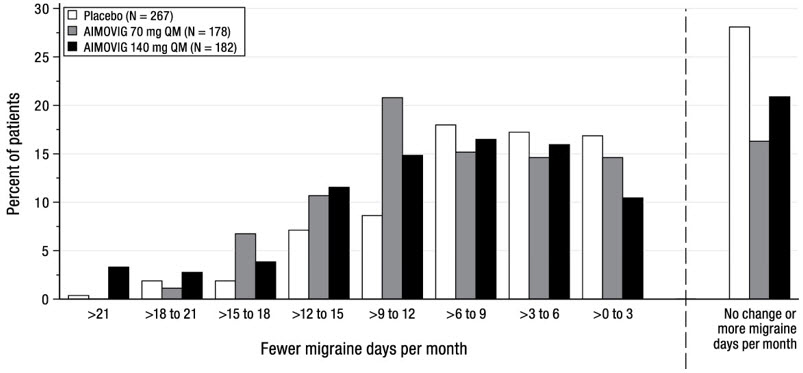
La Figura 2 muestra la distribución del cambio desde la línea de base en los días medios mensuales de migraña durante los meses 4 a 6 en intervalos de 2 días por grupo de tratamiento. Se observa un beneficio del tratamiento sobre el placebo para ambas dosis de AIMOVIG en un rango de cambios desde la línea de base en los días mensuales de migraña.
| La figura excluye a los pacientes con datos faltantes. |
|
|
En comparación con el placebo, los pacientes tratados con AIMOVIG 70 mg una vez al mes y 140 mg una vez al mes mostraron mayores reducciones desde la línea de base en las puntuaciones medias mensuales de la actividad diaria de MPFID promediadas durante los meses 4 a 6 [diferencia con respecto al placebo: −2,2 para AIMOVIG 70 mg y −2,6 para AIMOVIG 140 mg; p-valor < 0,001 para ambos], y en las puntuaciones medias mensuales de deterioro físico de MPFID promediadas durante los meses 4 a 6 [diferencia con respecto al placebo: −1,9 para AIMOVIG 70 mg y −2,4 para AIMOVIG 140 mg; p-valor < 0,001 para ambos].
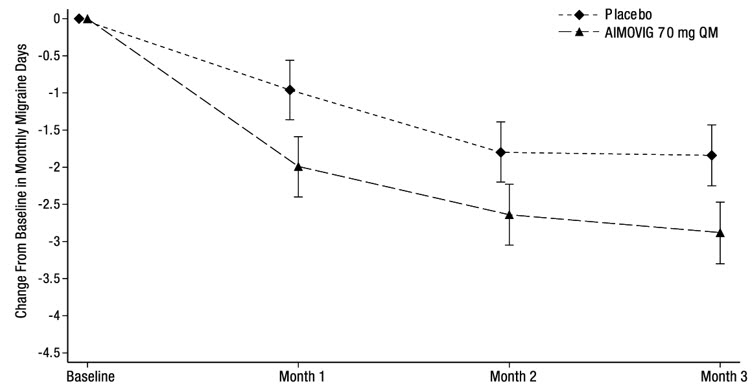
El Estudio 2 (NCT 02483585) fue un estudio aleatorizado, multicéntrico, de 3 meses, controlado con placebo, doble ciego que evaluó AIMOVIG para el tratamiento preventivo de la migraña episódica. Un total de 577 pacientes con antecedentes de migraña episódica fueron aleatorizados para recibir AIMOVIG 70 mg (N = 286) o placebo (N = 291) mediante inyección subcutánea una vez al mes durante 3 meses. Los pacientes pudieron utilizar tratamientos para el dolor de cabeza agudo, incluidos los medicamentos específicos para la migraña (es decir, triptanes, derivados de la ergotamina) y los AINE durante el estudio.
El estudio excluyó a los pacientes con cefalea por abuso de medicamentos, así como a los pacientes con infarto de miocardio, accidente cerebrovascular, ataques isquémicos transitorios, angina inestable, cirugía de derivación de la arteria coronaria u otros procedimientos de revascularización en los 12 meses anteriores a la selección.
El criterio de valoración principal de eficacia fue el cambio desde la línea de base en los días mensuales de migraña en el mes 3. Los criterios de valoración secundarios incluyeron el logro de una reducción ≥ 50% desde la línea de base en los días mensuales de migraña (“≥ 50% de respondedores a MMD”), el cambio desde la línea de base en los días mensuales de medicamentos específicos para la migraña aguda en el mes 3 y la proporción de pacientes con al menos una reducción de 5 puntos desde la línea de base en MPFID en el mes 3.
Un total de 546 (95%) pacientes completaron el estudio doble ciego de 3 meses. Los pacientes tenían una edad media de 43 años (rango: 18 a 65 años), el 85% eran mujeres y el 90% eran blancos. Del 6 al 7% de los pacientes estaban tomando tratamiento preventivo concomitante para la migraña. La frecuencia media de la migraña en la línea de base fue de aproximadamente 8 días de migraña al mes y fue similar entre los grupos de tratamiento.
El tratamiento con AIMOVIG demostró mejoras estadísticamente significativas para los criterios de valoración de eficacia clave en comparación con el placebo, como se resume en la Tabla 4.
| AIMOVIG 70 mg una vez al mes |
Placebo | |
|---|---|---|
| N = 282 | N = 288 | |
| Días mensuales de migraña (MMD) | ||
| Cambio desde la línea de base | −2,9 | −1,8 |
| Diferencia con respecto al placebo | −1,0 | |
| p-valor | < 0,001 | |
| ≥ 50% de respondedores a MMD | ||
| % de respondedores | 39,7% | 29,5% |
| Diferencia con respecto al placebo | 10,2% | |
| Razón de posibilidades relativa al placebo | 1,6 | |
| p-valor | 0,010 | |
| Días mensuales de medicamentos específicos para la migraña aguda | ||
| Cambio desde la línea de base | −1,2 | −0,6 |
| Diferencia con respecto al placebo | −0,6 | |
| p-valor | 0,002 | |
|
|
|
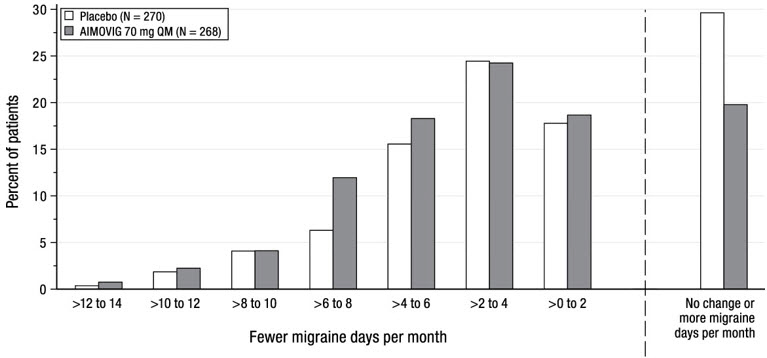
La Figura 4 muestra la distribución del cambio desde la línea de base en los días de migraña mensuales en el mes 3 en intervalos de 2 días por grupo de tratamiento. Se observa un beneficio del tratamiento sobre el placebo para AIMOVIG en un rango de cambios desde la línea de base en los días de migraña mensuales.
| La figura excluye a los pacientes con datos faltantes. |
|
|
El análisis preespecificado para el MPFID se basó en una reducción de al menos 5 puntos dentro del paciente, según la definición de respondedor. AIMOVIG 70 mg una vez al mes no fue significativamente mejor que el placebo para la proporción de respondedores para la actividad diaria [diferencia del placebo: 4.7%; razón de posibilidades = 1.2; p-valor = 0.26] y discapacidad física [diferencia del placebo: 5.9%; razón de posibilidades = 1.3; p-valor = 0.13]. En un análisis exploratorio del cambio desde el inicio en las puntuaciones medias del MPFID en el mes 3, los pacientes tratados con AIMOVIG 70 mg, en comparación con el placebo, mostraron reducciones nominalmente mayores de las puntuaciones de discapacidad física [diferencia del placebo: -1.3; p-valor = 0.021], pero no de las puntuaciones de actividades diarias [diferencia del placebo: -1.1; p-valor = 0.061].
Migraña crónica
El estudio 3 (NCT 02066415) fue un estudio aleatorizado, multicéntrico, de 3 meses, controlado con placebo, doble ciego que evaluó AIMOVIG como tratamiento preventivo de la migraña crónica. Un total de 667 pacientes con antecedentes de migraña crónica con o sin aura fueron aleatorizados para recibir AIMOVIG 70 mg (N = 191), AIMOVIG 140 mg (N = 190) o placebo (N = 286) mediante inyecciones subcutáneas una vez al mes durante 3 meses. Los pacientes pudieron utilizar tratamientos para el dolor de cabeza agudo, incluidos medicamentos específicos para la migraña (es decir, triptanes, derivados de la ergotamina) y AINE durante el estudio.
El estudio excluyó a los pacientes con cefalea por abuso de medicamentos causada por el abuso de opiáceos y a los pacientes con uso concomitante de tratamientos preventivos de la migraña. También se excluyeron los pacientes con infarto de miocardio, accidente cerebrovascular, ataques isquémicos transitorios, angina inestable, cirugía de derivación de la arteria coronaria u otros procedimientos de revascularización dentro de los 12 meses anteriores a la selección.
El criterio de valoración principal de eficacia fue el cambio desde el inicio en los días de migraña mensuales en el mes 3. Los criterios de valoración secundarios incluyeron el logro de una reducción ≥ 50% desde el inicio en los días de migraña mensuales (“respondedores ≥ 50% de MMD”) y el cambio desde el inicio en los días de medicación específica para la migraña aguda mensuales en el mes 3.
Un total de 631 (95%) pacientes completaron el estudio doble ciego de 3 meses. Los pacientes tenían una edad media de 43 años (rango: 18 a 66 años), el 83% eran mujeres y el 94% eran blancos. La frecuencia media de la migraña en el inicio fue de aproximadamente 18 días de migraña al mes y fue similar en todos los grupos de tratamiento.
El tratamiento con AIMOVIG demostró mejoras estadísticamente significativas para los resultados clave de eficacia en comparación con el placebo, como se resume en la Tabla 5.
| AIMOVIG 70 mg una vez al mes |
AIMOVIG 140 mg una vez al mes |
Placebo | |
|---|---|---|---|
| N = 188 | N = 187 | N = 281 | |
| Días de migraña mensuales (MMD) | |||
| Cambio desde el inicio | −6.6 | −6.6 | −4.2 |
| Diferencia del placebo | −2.5 | −2.5 | |
| p-valor | < 0.001 | < 0.001 | |
| ≥ 50% de respondedores de MMD | |||
| % de respondedores | 39.9% | 41.2% | 23.5% |
| Diferencia del placebo | 16.4% | 17.7% | |
| Razón de posibilidades en relación con el placebo | 2.2 | 2.3 | |
| p-valor | < 0.001 | < 0.001 | |
| Días de medicación específica para la migraña aguda mensuales | |||
| Cambio desde el inicio | −3.5 | −4.1 | −1.6 |
| Diferencia del placebo | −1.9 | −2.6 | |
| p-valor | < 0.001 | < 0.001 | |
|
|
|
La Figura 6 muestra la distribución del cambio desde la línea de base en los días de migraña mensuales en el mes 3 en intervalos de 3 días por grupo de tratamiento. Se observa un beneficio del tratamiento sobre el placebo para ambas dosis de AIMOVIG en un rango de cambios desde la línea de base en los días de migraña.
| La figura excluye a los pacientes con datos faltantes. |
|
|
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
16.1 Cómo se suministra
La inyección de AIMOVIG (erenumab-aooe) es una solución estéril, de transparente a opalescente, de incolora a amarillo claro para administración subcutánea.
Las jeringas precargadas y los autoinyectores precargados de AIMOVIG no están fabricados con látex de caucho natural. Cada jeringa precargada de dosis única o autoinyector SureClick® precargado de dosis única de AIMOVIG contiene una jeringa de vidrio Tipo 1 y una aguja de acero inoxidable y suministra 1 ml de solución de 70 mg/ml o 140 mg/ml.
AIMOVIG se suministra de la siguiente manera:
Autoinyector SureClick®
- Envase de 1 autoinyector: autoinyector precargado de dosis única de 70 mg/ml
NDC 55513-841-01 - Envase de 1 autoinyector: autoinyector precargado de dosis única de 140 mg/ml
NDC 55513-843-01
Jeringa
- Envase de 1 jeringa: jeringa precargada de dosis única de 70 mg/ml
NDC 55513-840-01 - Envase de 1 jeringa: jeringa precargada de dosis única de 140 mg/ml
NDC 55513-842-01
16.2 Almacenamiento y manipulación
- Conservar en nevera entre 2 °C y 8 °C (36 °F y 46 °F) en el envase original para protegerlo de la luz hasta el momento de su uso.
- Si se saca de la nevera, AIMOVIG debe conservarse a temperatura ambiente (hasta 25 °C [77 °F]) en el envase original y debe utilizarse en un plazo de 7 días. Deseche el AIMOVIG que haya estado a temperatura ambiente durante más de 7 días.
- No congelar.
- No agitar.
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente que lea el etiquetado para pacientes aprobado por la FDA (Información para el paciente e Instrucciones de uso).
Información sobre la preparación y administración:
Oriente a los pacientes y cuidadores sobre la técnica de administración subcutánea adecuada, incluida la técnica aséptica, y cómo utilizar el autoinyector precargado de dosis única o la jeringa precargada de dosis única [ver Dosificación y administración (2.2)]. Indique a los pacientes y/o cuidadores que lean y sigan las Instrucciones de uso cada vez que utilicen AIMOVIG.
Aconseje a los pacientes que dejen que AIMOVIG repose a temperatura ambiente durante al menos 30 minutos antes de su administración [ver Dosificación y administración (2.2)].
Reacciones de hipersensibilidad:
Aconseje a los pacientes que busquen atención médica inmediata si experimentan algún síntoma de reacciones de hipersensibilidad graves o severas [ver Advertencias y precauciones (5.1)].
Estreñimiento con complicaciones graves:
Avise a los pacientes que el estreñimiento con complicaciones graves puede ocurrir con AIMOVIG y que deben comunicarse con sus proveedores de atención médica si experimentan estreñimiento severo [ver Advertencias y precauciones (5.2)].
Hipertensión:
Avise a los pacientes que el desarrollo de hipertensión y el empeoramiento de la hipertensión preexistente pueden ocurrir con AIMOVIG y que deben comunicarse con sus proveedores de atención médica si experimentan un aumento en su presión arterial [ver Advertencias y precauciones (5.3)].
Embarazo:
Aconseje a las pacientes que existe un registro de exposición al embarazo que monitorea los resultados del embarazo en mujeres expuestas a AIMOVIG durante el embarazo [ver Uso en poblaciones específicas (8.1)].
SECCIÓN NO CLASIFICADA DE SPL
Para obtener más información, visite www.aimovig.com o llame al 1-800-77-AMGEN (1-800-772-6436).
AIMOVIG® (erenumab-aooe)
Fabricado por:
Amgen Inc.
One Amgen Center Drive
Thousand Oaks, CA 91320-1799 U.S.A.
Licencia de EE. UU. No. 1080
Patente: http://pat.amgen.com/aimovig/
© 2018-2024 Amgen Inc. Todos los derechos reservados.
[part number] V11
INSERTO PARA EL PACIENTE
| Información para el paciente AIMOVIG® (AIM-oh-vig) (erenumab-aooe) inyección, para uso subcutáneo |
|
|---|---|
| Esta información para el paciente ha sido aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos. [número de parte] v9 |
Revisado: 8/2024 |
| ¿Qué es AIMOVIG? AIMOVIG es un medicamento recetado que se usa para el tratamiento preventivo de la migraña en adultos. No se sabe si AIMOVIG es seguro y eficaz en niños menores de 18 años. |
|
| ¿Quién no debe usar AIMOVIG? No use AIMOVIG si es alérgico a erenumab-aooe o a cualquiera de los ingredientes de AIMOVIG. Consulte el final de esta información para el paciente para obtener una lista completa de los ingredientes de AIMOVIG. |
|
Antes de comenzar a usar AIMOVIG, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si usted es:
Informe a su farmacéutico o proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas o los suplementos herbales. |
|
¿Cómo debo tomar AIMOVIG?
|
|
| ¿Cuáles son los posibles efectos secundarios de AIMOVIG? AIMOVIG puede causar efectos secundarios graves, que incluyen:
Los efectos secundarios más comunes de AIMOVIG incluyen: dolor, enrojecimiento o hinchazón en el lugar de la inyección y estreñimiento. |
|
¿Cómo debo almacenar AIMOVIG?
Mantenga AIMOVIG y todos los medicamentos fuera del alcance de los niños. |
|
| Información general sobre el uso seguro y eficaz de AIMOVIG. Los medicamentos a veces se recetan para fines distintos de los que se enumeran en un folleto de información para el paciente. No use AIMOVIG para una afección para la que no esté recetado. No le dé AIMOVIG a otras personas, incluso si tienen los mismos síntomas que usted. Puede hacerles daño. Puede pedirle a su farmacéutico o proveedor de atención médica información sobre AIMOVIG que esté escrita para profesionales de la salud. |
|
¿Cuáles son los ingredientes de AIMOVIG?
Los autoinyectores prellenados y las jeringas prellenadas de AIMOVIG no están hechos con látex de caucho natural. |
|
| AIMOVIG® (erenumab-aooe) Fabricado por: Amgen Inc. One Amgen Center Drive Thousand Oaks, CA 91320-1799 U.S.A. Licencia de EE. UU. No. 1080 Patente: http://pat.amgen.com/aimovig/ © 2018-2024 Amgen Inc. Todos los derechos reservados. Para obtener más información, visite www.aimovig.com o llame al 1-800-77-AMGEN (1-800-772-6436). |
|
INSTRUCCIONES DE USO AIMOVIG® (AIM-oh-vig)(erenumab-aooe) inyección, para uso subcutáneo 70 mg/mL autoinyector precargado SureClick® de dosis única
Estas Instrucciones de uso contienen información sobre cómo inyectar AIMOVIG con un autoinyector SureClick.
Si su proveedor de atención médica decide que usted o un cuidador pueden administrarle las inyecciones de AIMOVIG en casa, debe recibir capacitación sobre la forma correcta de preparar e inyectar AIMOVIG. No intente inyectarse usted mismo hasta que su proveedor de atención médica o enfermera le hayan mostrado la forma correcta de administrar las inyecciones.
El medicamento en el autoinyector AIMOVIG es para inyección debajo de la piel (inyección subcutánea). Consulte la Información para el paciente de AIMOVIG para obtener información sobre AIMOVIG.
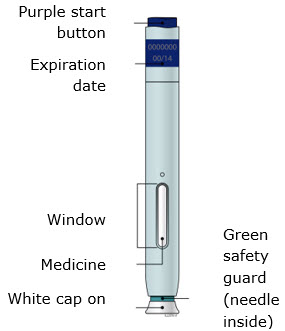
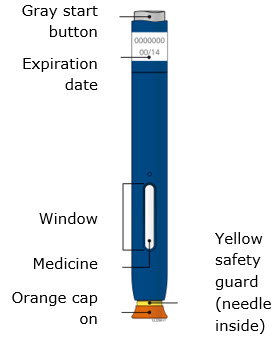
Familiarización con el autoinyector precargado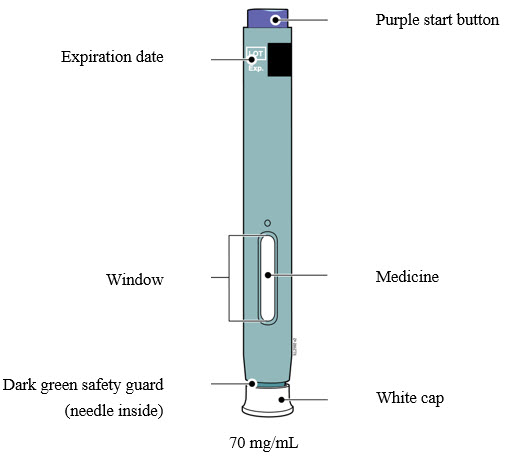 |
1. Información importante que debe saber antes de inyectarse AIMOVIG
|
| Preguntas frecuentes: Para obtener información adicional y respuestas a preguntas frecuentes, visite www.aimovig.com. |
| Dónde obtener ayuda: Si desea obtener más información o ayuda para usar AIMOVIG:
|
2. Almacenamiento y preparación para inyectar AIMOVIG
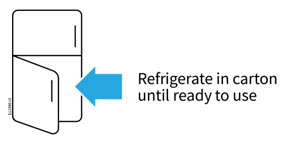
2a Refrigere la caja del autoinyector hasta que esté listo para usarla.
- Mantenga el autoinyector en el refrigerador entre 36 °F y 46 °F (2 °C y 8 °C).
- Mantenga el autoinyector en la caja original para protegerlo de la luz o daños físicos.
- No congele el autoinyector.
- No guarde el autoinyector en condiciones de calor o frío extremos. Por ejemplo, evite guardarlo en la guantera o el maletero de su vehículo.
| Importante: Mantenga el autoinyector y todos los medicamentos fuera de la vista y el alcance de los niños. |
ESPERE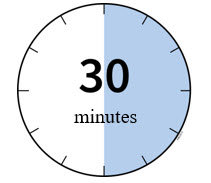 |
2b Espere 30 minutos para que el autoinyector alcance la temperatura ambiente.
|

2c Puede mantener AIMOVIG a temperatura ambiente hasta por 7 días, si es necesario.
- Por ejemplo, cuando viaje, puede mantener AIMOVIG a temperatura ambiente.
- Manténgalo a temperatura ambiente entre 68 °F y 77 °F (20 °C y 25 °C).
- No lo vuelva a poner en el refrigerador.
- Registre la fecha en que lo sacó del refrigerador y úselo dentro de 7 días.
| Importante: Coloque el autoinyector en un contenedor de objetos punzocortantes si ha alcanzado la temperatura ambiente y no se ha utilizado dentro de 7 días. |
2d Inspeccione el medicamento. Debe ser transparente e incoloro o ligeramente amarillo.
- Es normal que se vean burbujas de aire en el autoinyector.
- No use AIMOVIG si el medicamento está turbio, descolorido o tiene escamas o partículas.
| Importante: Si el medicamento está turbio, descolorido o tiene escamas o partículas, o si el autoinyector está dañado o vencido, llame al 1-800-77-AMGEN (1-800-772-6436). |
2e Verifique la fecha de vencimiento (Exp.) e inspeccione el autoinyector para detectar posibles daños.
- No use el autoinyector si la fecha de vencimiento ha pasado.
-
No use el autoinyector si:
- falta la tapa blanca o está floja.
- tiene grietas o piezas rotas.
- se ha caído sobre una superficie dura.
- Asegúrese de tener el medicamento y la dosis correctos.
3. Preparación para la inyección
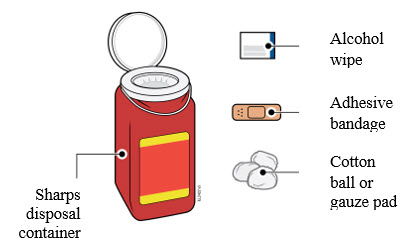
3a Reúna y coloque los siguientes elementos para su inyección en una superficie limpia, plana y bien iluminada:
- Autoinyector de AIMOVIG (temperatura ambiente)
- Contenedor de objetos punzocortantes [consulte Eliminación de AIMOVIG y revisión del sitio de inyección]
- Toallita con alcohol
- Venda adhesiva
- Bola de algodón o gasa
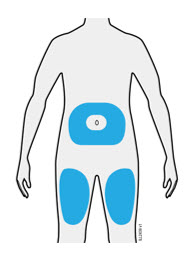
3b Inyecte en uno de estos sitios.
- Inyecte en la parte delantera del muslo o el estómago (excepto en un área de 2 pulgadas alrededor del ombligo).
- Otra persona puede inyectar en el muslo, el estómago o la parte posterior de la parte superior del brazo.
| Importante: Evite las áreas con cicatrices o estrías, o donde la piel esté sensible, magullada, enrojecida, dura, elevada, con parches de piel gruesos o escamosos o lesiones. |
3c Lávese bien las manos con agua y jabón.
3d Limpie el sitio de inyección con una toallita con alcohol.
- Deje que la piel se seque sola.
- No vuelva a tocar esta área antes de inyectar.
4. Inyección de AIMOVIG
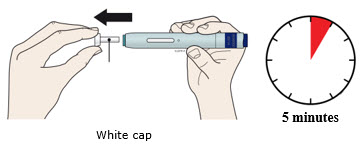
| Importante: Retire la tapa blanca solo cuando pueda inyectar de inmediato (dentro de los 5 minutos) porque el medicamento puede secarse. No vuelva a tapar. |
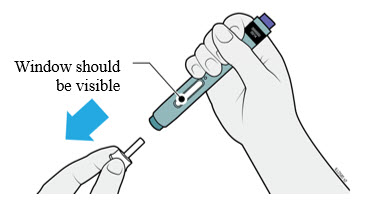
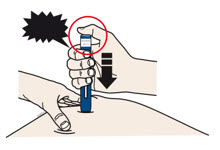
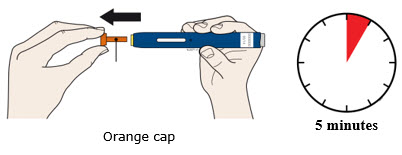
4a Sujete el autoinyector de modo que pueda ver la ventana. Retire la tapa blanca tirando de ella hacia afuera. Es posible que deba tirar con fuerza.
- No gire, doble ni mueva la tapa blanca para quitarla.
- Nunca vuelva a colocar la tapa blanca. Puede dañar la aguja.
- No coloque el dedo dentro del protector de seguridad verde oscuro.
- Es normal ver una gota de medicamento en el extremo de la aguja o del protector de seguridad verde oscuro.
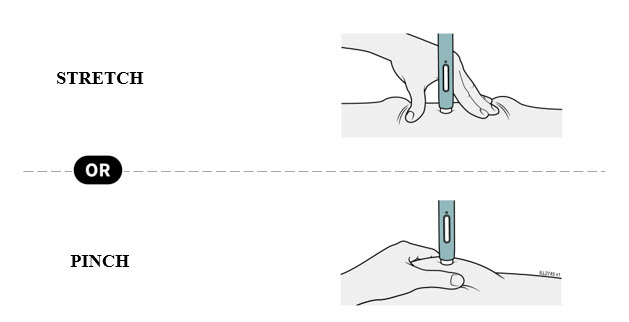
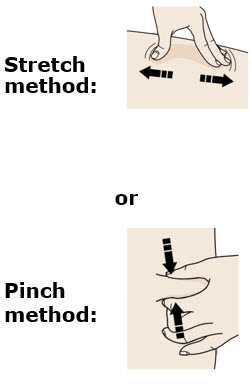
4b Estire o pellizque la piel para crear una superficie firme en el sitio de inyección. Coloque el protector de seguridad verde oscuro directamente contra la piel.
- Mantenga la piel estirada o pellizcada hasta que finalice la inyección.
- Asegúrese de que pueda ver la ventana.
- Asegúrese de que el autoinyector esté colocado directamente sobre el sitio de inyección (en un ángulo de 90 grados).
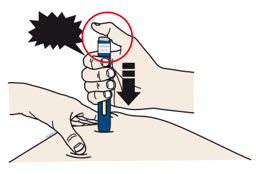
| PRESIONE y mantenga presionado contra la piel 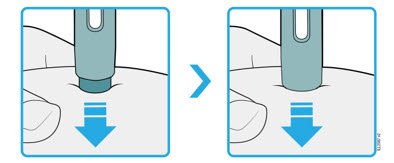 |
4c Empuje firmemente el autoinyector hacia abajo hasta que el protector de seguridad verde oscuro deje de moverse. Mantenga presionado el autoinyector, no lo levante.
- El protector de seguridad verde oscuro se empuja hacia adentro y desbloquea el botón de inicio púrpura.
| PRESIONE el botón de inicio púrpura 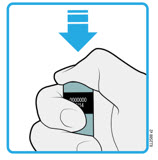 |
4d Siga empujando el autoinyector hacia abajo y presione el botón de inicio púrpura para comenzar la inyección.
- Es posible que escuche o sienta un clic.
- La ventana comienza a ponerse amarilla.
- Está bien soltar el botón de inicio púrpura.
| OBSERVE y CONFIRME que la ventana se ponga completamente amarilla 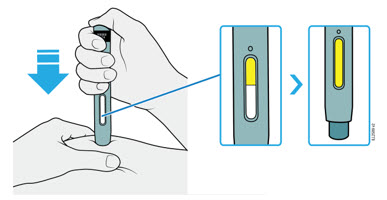 |
4e Siga empujando el autoinyector hacia abajo. Cuando la ventana esté completamente amarilla, la inyección estará completa.
- La inyección puede tardar hasta 15 segundos en completarse.
- Es posible que escuche o sienta un clic.
- Retire el autoinyector de su piel.
- El protector de seguridad verde oscuro se bloquea alrededor de la aguja.
| Importante: Si la ventana no se ha puesto completamente amarilla, o parece que todavía está saliendo el medicamento, no ha recibido una dosis completa. Llame a su proveedor de atención médica de inmediato. |
5. Cómo desechar AIMOVIG y revisar el lugar de la inyección
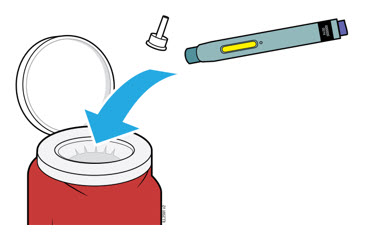
5a Coloque el autoinyector usado y la tapa blanca en un contenedor de desechos de objetos punzocortantes aprobado por la FDA inmediatamente después de su uso.
| Importante: No tire el autoinyector a la basura doméstica. |
- No vuelva a usar el autoinyector.
- No toque el protector de seguridad verde oscuro.
5b Revise el lugar de la inyección.
- No frote el lugar de la inyección.
- Si hay sangre, presione una bola de algodón o una gasa sobre el lugar de la inyección. Aplique una venda adhesiva si es necesario.
Información adicional sobre su contenedor de desechos de objetos punzocortantes
Si no tiene un contenedor de desechos de objetos punzocortantes aprobado por la FDA, puede usar un contenedor doméstico que:
- esté hecho de plástico resistente,
- se pueda cerrar con una tapa ajustada y resistente a las perforaciones, sin que puedan salir objetos punzocortantes,
- se mantenga vertical y estable durante su uso,
- sea resistente a las fugas, y
- esté debidamente etiquetado para advertir sobre los desechos peligrosos que se encuentran dentro del contenedor.
Eliminación de los contenedores de desechos de objetos punzocortantes:
Cuando su contenedor de desechos de objetos punzocortantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de desecharlo.
Es posible que existan leyes estatales o locales sobre cómo debe desechar las agujas y jeringas usadas.
Para obtener más información sobre la eliminación segura de objetos punzocortantes e información específica sobre la eliminación de objetos punzocortantes en el estado en el que vive, visite el sitio web de la FDA en:
http://www.fda.gov/safesharpsdisposal
No deseche el contenedor de desechos de objetos punzocortantes usado en la basura doméstica a menos que las pautas de su comunidad lo permitan.
No recicle su contenedor de desechos de objetos punzocortantes usado.
Importante: Mantenga el autoinyector y el contenedor de desechos de objetos punzocortantes fuera de la vista y el alcance de los niños.
Para obtener más información o ayuda, llame al 1-800-77-AMGEN (1-800-772-6436).
AIMOVIG® (AIM-oh-vig)
Fabricado por:
Amgen Inc.
One Amgen Center Drive
Thousand Oaks, California 91320-1799
Número de licencia de EE. UU. 1080
© 2018 – 2024 Amgen Inc.
Todos los derechos reservados.
Nnnnnnnnnn
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos.
Revisado: 8/2024
v11
GUÍA DE REFERENCIA
| Lado 1 | Guía de referencia Aimovig® (AIM-oh-vig) (erenumab-aooe) inyección, para uso subcutáneo Autoinyector SureClick® prellenado de dosis única 70 mg/mL |
Lea todas las instrucciones en el cartón antes de usar. |
| ¿Preguntas? Llame al 1-800-77-AMGEN (1-800-772-6436) |
| Guía de las partes | Espere al menos 30 minutos para que el autoinyector alcance la temperatura ambiente antes de administrar su inyección. | Tire de la tapa blanca hacia arriba solo cuando esté listo para inyectar. No deje la tapa blanca fuera por más de 5 minutos. Esto puede secar el medicamento. | |||
 |
|||||
| 2 | |||||
 |
|||||
| Prepare y limpie el sitio de inyección. | |||||
| 1 | 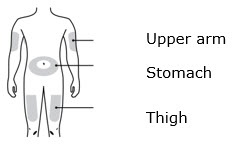 |
||||
| Voltee la página para continuar | |||||
| Lado 2 | Guía de referencia Aimovig® (AIM-oh-vig) (erenumab-aooe) inyección, para uso subcutáneo Autoinyector SureClick® prellenado de dosis única 70 mg/mL |
AMGEN | Lea el otro lado primero | |||||
|
Fabricado por: |
||||||||
| Estire o pellizque el sitio de inyección para crear una superficie firme. | Coloque la protección de seguridad verde (aguja adentro) sobre su piel a 90 grados. | Presione firmemente hacia abajo el autoinyector sobre su piel hasta que deje de moverse. | Mantenga presionando hacia abajo sobre su piel durante unos 15 segundos. | |||||
| 3 | 4 | 5 | 6 | |||||
 |
 |
Cuando esté listo para inyectar, presione el botón de inicio morado. Escuchará un clic. “clic”
|
|
|||||
INSTRUCCIONES DE USO AIMOVIG® (AIM-oh-vig) (erenumab-aooe) inyección, para uso subcutáneo 140 mg/mL autoinyector precargado SureClick® de dosis única
Estas Instrucciones de uso contienen información sobre cómo inyectar AIMOVIG con un autoinyector SureClick.
Si su profesional de la salud decide que usted o un cuidador pueden administrar sus inyecciones de AIMOVIG en casa, debe recibir capacitación sobre la forma correcta de preparar e inyectar AIMOVIG. No intente inyectarse hasta que su profesional de la salud o enfermero le haya mostrado la forma correcta de administrar las inyecciones.
El medicamento en el autoinyector AIMOVIG es para inyección debajo de la piel (inyección subcutánea). Consulte la Información para el paciente de AIMOVIG para obtener información sobre AIMOVIG.
Conozca su autoinyector precargado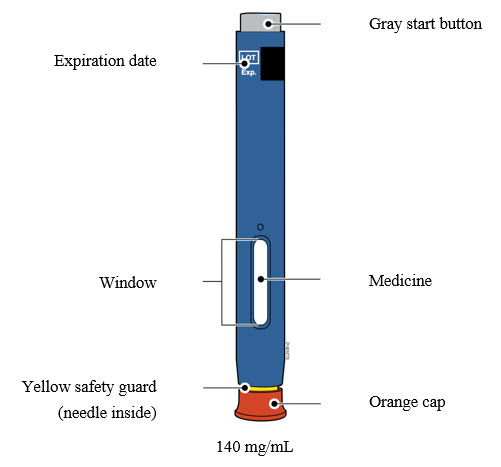 |
1. Información importante que debe saber antes de inyectar AIMOVIG
|
| Preguntas frecuentes: Para obtener información adicional y respuestas a las preguntas frecuentes, visite www.aimovig.com. |
| Dónde obtener ayuda: Si desea obtener más información o ayuda para usar AIMOVIG:
|
2. Almacenamiento y preparación para inyectar AIMOVIG
2a Refrigere la caja del autoinyector hasta que esté listo para usarlo.
- Mantenga el autoinyector en el refrigerador entre 36 °F y 46 °F (2 °C y 8 °C).
- Mantenga el autoinyector en la caja original para protegerlo de la luz o daños físicos.
- No congele el autoinyector.
- No almacene el autoinyector en calor o frío extremos. Por ejemplo, evite almacenarlo en la guantera o el maletero de su vehículo.
| Importante: Mantenga el autoinyector y todos los medicamentos fuera del alcance y la vista de los niños. |
ESPERE |
2b Espere 30 minutos para que el autoinyector alcance la temperatura ambiente.
|

2c Puede mantener AIMOVIG a temperatura ambiente hasta por 7 días, si es necesario.
- Por ejemplo, cuando viaja, puede mantener AIMOVIG a temperatura ambiente.
- Manténgalo a temperatura ambiente entre 68 °F y 77 °F (20 °C y 25 °C).
- No lo vuelva a poner en el refrigerador.
- Anote la fecha en que lo sacó del refrigerador y úselo dentro de los 7 días.
| Importante: Coloque el autoinyector en un contenedor de eliminación de objetos punzantes si ha alcanzado la temperatura ambiente y no se ha utilizado dentro de los 7 días. |
2d Inspeccione el medicamento. Debe ser transparente e incoloro a ligeramente amarillo.
- Está bien ver burbujas de aire en el autoinyector.
- No use AIMOVIG si el medicamento está turbio, descolorido o tiene escamas o partículas.
| Importante: Si el medicamento está turbio, descolorido o tiene escamas o partículas, o si el autoinyector está dañado o caducado, llame al 1-800-77-AMGEN (1-800-772-6436). |
2e Compruebe la fecha de caducidad (Exp.) e inspeccione el autoinyector para detectar daños.
- No use el autoinyector si la fecha de caducidad ha pasado.
-
No use el autoinyector si:
- la tapa naranja falta o está suelta.
- tiene grietas o partes rotas.
- se ha caído sobre una superficie dura.
- Asegúrese de tener el medicamento y la dosis correctos.
3. Preparándose para su inyección
3a Reúna y coloque los siguientes artículos para su inyección en una superficie limpia, plana y bien iluminada:
- Autoinyector AIMOVIG (temperatura ambiente)
- Contenedor de eliminación de objetos punzantes [ver Eliminación de AIMOVIG y verificación del sitio de inyección]
- Toallita con alcohol
- Vendaje adhesivo
- Bola de algodón o gasa
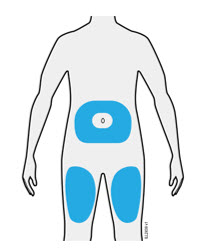
3b Inyecte en uno de estos sitios.
- Inyecte en la parte delantera del muslo o el estómago (excepto en las 2 pulgadas alrededor del ombligo).
- Otra persona puede inyectar en el muslo, el estómago o la parte posterior de la parte superior del brazo.
| Importante: Evite las áreas con cicatrices o estrías, o donde la piel esté sensible, magullada, roja, dura, elevada, gruesa o con un parche o lesión de piel escamosa. |
3c Lávese las manos completamente con agua y jabón.
3d Limpie el sitio de inyección con una toallita con alcohol.
- Deje que la piel se seque sola.
- No toque esta área nuevamente antes de inyectar.
4. Inyectando AIMOVIG
| Importante: Solo retire la tapa naranja cuando pueda inyectar de inmediato (dentro de los 5 minutos) porque el medicamento puede secarse. No vuelva a tapar. |
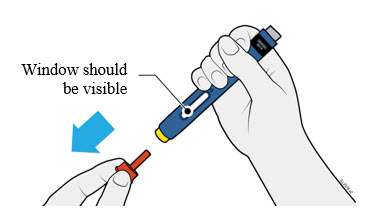
4a Agarre el autoinyector para que pueda ver la ventana. Tire de la tapa naranja hacia afuera. Es posible que deba tirar con fuerza.
- No gire, doble o mueva la tapa naranja para quitarla.
- Nunca vuelva a colocar la tapa naranja. Puede dañar la aguja.
- No coloque el dedo dentro del protector de seguridad amarillo.
- Es normal ver una gota de medicamento en el extremo de la aguja o el protector de seguridad amarillo.
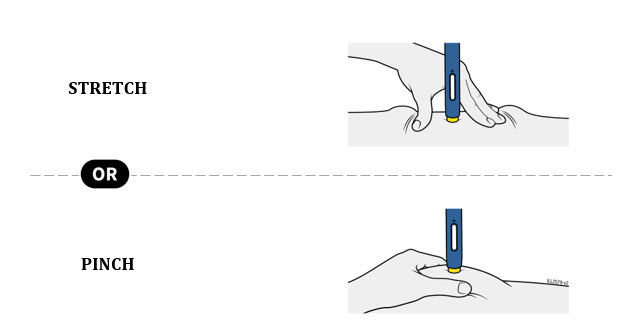
4b Estire o pellizque la piel para crear una superficie firme en el sitio de inyección. Coloque la protección de seguridad amarilla recta contra la piel.
- Mantenga la piel estirada o pellizcada hasta que termine la inyección.
- Asegúrese de poder ver la ventana.
- Asegúrese de que el autoinyector esté colocado recto en el sitio de inyección (en un ángulo de 90 grados).
| PRESIONE y mantenga contra la piel 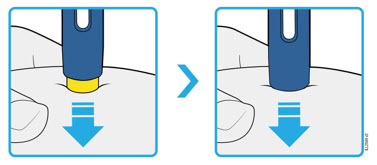 |
4c Empuje firmemente el autoinyector hacia abajo hasta que la protección de seguridad amarilla deje de moverse. Mantenga el autoinyector hacia abajo, no lo levante.
- La protección de seguridad amarilla se empuja hacia adentro y desbloquea el botón de inicio gris.
| PRESIONE el botón de inicio gris 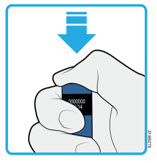 |
4d Mantenga el autoinyector hacia abajo y presione el botón de inicio gris para comenzar la inyección.
- Es posible que escuche o sienta un clic.
- La ventana comienza a ponerse amarilla.
- Está bien soltar el botón de inicio gris.
| OBSERVE y CONFIRME que la ventana se vuelva completamente amarilla 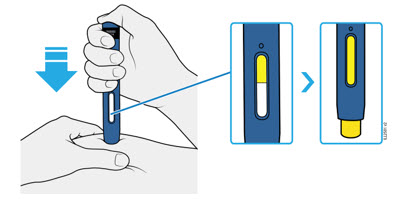 |
4e Mantenga el autoinyector hacia abajo. Cuando la ventana esté completamente amarilla, la inyección estará completa.
- La inyección puede tardar hasta 15 segundos en completarse.
- Es posible que escuche o sienta un clic.
- Levante el autoinyector de su piel.
- La protección de seguridad amarilla se bloquea alrededor de la aguja.
| Importante: Si la ventana no se ha vuelto completamente amarilla, o parece que el medicamento todavía está saliendo, no ha recibido una dosis completa. Llame a su proveedor de atención médica de inmediato. |
5. Desecho de AIMOVIG y verificación del sitio de inyección
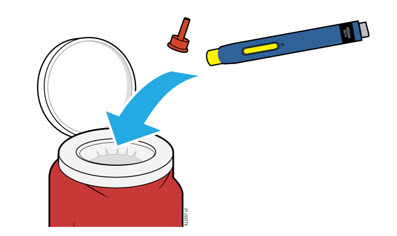
5a Coloque el autoinyector usado y la tapa naranja en un contenedor de eliminación de objetos punzantes aprobado por la FDA inmediatamente después de su uso.
| Importante: No tire el autoinyector a la basura de su hogar. |
- No reutilice el autoinyector.
- No toque la protección de seguridad amarilla.
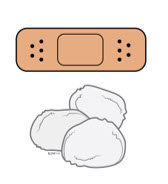
5b Revise el sitio de inyección.
- No frote el sitio de inyección.
- Si hay sangre, presione una bola de algodón o una gasa en el sitio de inyección. Aplique una venda adhesiva si es necesario.
Información adicional sobre su contenedor de eliminación de objetos punzantes
Si no tiene un contenedor de eliminación de objetos punzantes aprobado por la FDA, puede usar un contenedor doméstico que sea:
- hecho de plástico resistente,
- se puede cerrar con una tapa hermética y resistente a las perforaciones, sin que los objetos punzantes puedan salir,
- vertical y estable durante el uso,
- a prueba de fugas, y
- adecuadamente etiquetado para advertir sobre los residuos peligrosos dentro del contenedor.
Eliminación de los contenedores de eliminación de objetos punzantes:
Cuando su contenedor de eliminación de objetos punzantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de desechar su contenedor de eliminación de objetos punzantes.
Puede haber leyes estatales o locales sobre cómo debe desechar las agujas y jeringas usadas.
Para obtener más información sobre la eliminación segura de objetos punzantes y para obtener información específica sobre la eliminación de objetos punzantes en el estado en el que vive, visite el sitio web de la FDA en:
http://www.fda.gov/safesharpsdisposal
No deseche su contenedor de eliminación de objetos punzantes usado en la basura de su hogar a menos que las pautas de su comunidad lo permitan.
No recicle su contenedor de eliminación de objetos punzantes usado.
Importante: Mantenga el autoinyector y el contenedor de eliminación de objetos punzantes fuera de la vista y el alcance de los niños.
Para obtener más información o ayuda, llame al 1-800-77-AMGEN (1-800-772-6436).
AIMOVIG® (AIM-oh-vig)
Fabricado por:
Amgen Inc.
One Amgen Center Drive
Thousand Oaks, California 91320-1799
Número de licencia de EE. UU. 1080
© 2019 – 2024 Amgen Inc. Todos los derechos reservados.
nnnnnnnnnn
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los EE. UU.
Revisado: 8/2024
v10
GUÍA DE REFERENCIA
| Side 1 | Reference Guide Aimovig® (AIM-oh-vig) (erenumab-aooe) injection, for subcutaneous use Single-Dose Prefilled SureClick® Autoinjector 140 mg/mL |
Lea todas las instrucciones en la caja antes de usar. |
| ¿Preguntas? Llame al 1-800-77-AMGEN (1-800-772-6436) |
| Guía de las partes | Espere al menos 30 minutos para que el autoinyector alcance la temperatura ambiente antes de administrar su inyección. | Tire de la tapa naranja hacia arriba solo cuando esté listo para inyectar. No deje la tapa naranja fuera por más de 5 minutos. Esto puede secar el medicamento. | |||
 |
|||||
| 2 | |||||
 |
|||||
| Prepare y limpie el sitio de inyección. | |||||
| 1 | 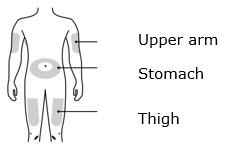 |
||||
| Voltee la página para continuar | |||||
| Side 2 | Reference Guide Aimovig® (AIM-oh-vig) (erenumab-aooe) injection, for subcutaneous use Single-Dose Prefilled SureClick® Autoinjector 140 mg/mL |
AMGEN | Lea la otra cara primero | |||||
|
Manufactured by: |
||||||||
| Estire o pellizque el sitio de inyección para crear una superficie firme. | Coloque la protección de seguridad amarilla (aguja adentro) sobre su piel a 90 grados. | Presione firmemente hacia abajo el autoinyector sobre su piel hasta que deje de moverse. | Mantenga presionando hacia abajo sobre su piel durante unos 15 segundos. | |||||
| 3 | 4 | 5 | 6 | |||||
 |
 |
Cuando esté listo para inyectar, presione el botón de inicio gris. Oirá un clic. “clic”
|
|
|||||
Instrucciones de Uso de AIMOVIG® (AIM-oh-vig) (erenumab-aooe) Inyectable, para Uso Subcutáneo Jeringa Precargada de Dosis Única 70 mg/mL y 140 mg/mL
Importante: La aguja está dentro de la tapa gris de la aguja.
Importante
Antes de usar la jeringa precargada de AIMOVIG, lea esta información importante:
Almacenamiento de la jeringa precargada de AIMOVIG
- Mantenga la jeringa fuera del alcance de los niños.
- Mantenga la jeringa en la caja original para protegerla de la luz.
- La jeringa debe mantenerse en el refrigerador a 36°F a 46°F (2°C a 8°C).
- Después de sacar AIMOVIG del refrigerador, puede almacenarse a temperatura ambiente entre 68°F a 77°F (20°C a 25°C) durante un máximo de 7 días.
- Deseche AIMOVIG que haya estado a temperatura ambiente durante más de 7 días.
- No congele.
Uso de la jeringa precargada de AIMOVIG
- Es importante que no intente administrar la inyección a menos que usted o su cuidador haya recibido capacitación de su proveedor de atención médica.
- No use una jeringa después de la fecha de vencimiento que aparece en la etiqueta.
- No agite la jeringa.
- No retire la tapa gris de la aguja de la jeringa hasta que esté listo para inyectar.
- No use la jeringa si se ha congelado.
- No use una jeringa si se ha caído sobre una superficie dura. Parte de la jeringa puede estar rota aunque no se vea la rotura. Use una jeringa nueva y llame al 1-800-77-AMGEN (1-800-772-6436).
- La jeringa precargada no está hecha con látex de caucho natural.
Paso 1: Preparación
AIMOVIG viene en una jeringa precargada de dosis única (1 vez). Su proveedor de atención médica le recetará la dosis que sea mejor para usted.
Antes de inyectar, siempre revise la etiqueta de su jeringa precargada de dosis única para asegurarse de que tiene el medicamento correcto y la dosis correcta de AIMOVIG.
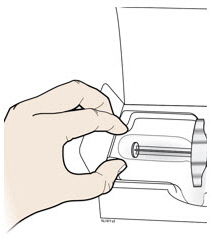
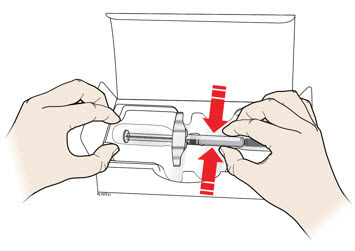
A Retire la jeringa precargada de AIMOVIG de la caja.
Agarre el cañón de la jeringa para retirar la jeringa de la bandeja.
|
|
|
|
| Coloque el dedo o el pulgar en el borde de la bandeja para sujetarla mientras retira la jeringa. | Agarre aquí |
Por razones de seguridad:
- No agarre la varilla del émbolo.
- No agarre la tapa gris de la aguja.
- No retire la tapa gris de la aguja hasta que esté listo para inyectar.
- No retire la brida para los dedos. Esta es parte de la jeringa.
Deje la jeringa a temperatura ambiente durante al menos 30 minutos antes de inyectar.
- No vuelva a colocar la jeringa en el refrigerador después de que haya alcanzado la temperatura ambiente.
- No intente calentar la jeringa utilizando una fuente de calor como agua caliente o microondas.
- No deje la jeringa bajo la luz solar directa.
- No agite la jeringa.
Importante: Siempre sostenga la jeringa precargada por el cañón de la jeringa.
B Inspeccione la jeringa precargada AIMOVIG.
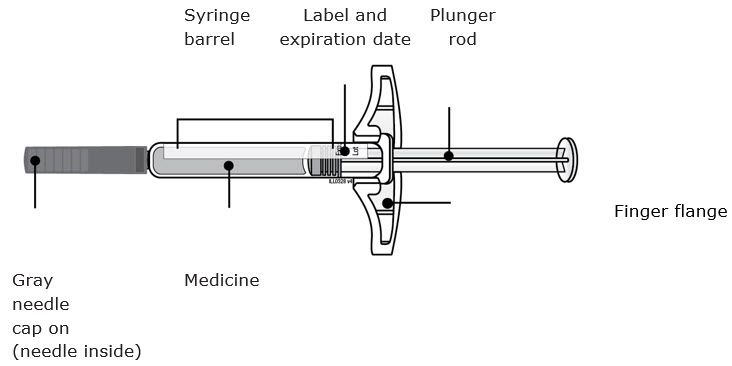
Siempre sostenga la jeringa por el cañón de la jeringa.
Asegúrese de que el medicamento en la jeringa esté claro e incoloro a ligeramente amarillo.
- No use la jeringa si el medicamento está turbio o descolorido o contiene escamas o partículas.
- No use la jeringa si alguna parte parece agrietada o rota.
- No use la jeringa si la jeringa se ha caído.
- No use la jeringa si la tapa gris de la aguja falta o no está bien sujeta.
- No use la jeringa si la fecha de vencimiento impresa en la etiqueta ha pasado.
En todos los casos, use una jeringa nueva y llame al 1-800-77-AMGEN (1-800-772-6436).
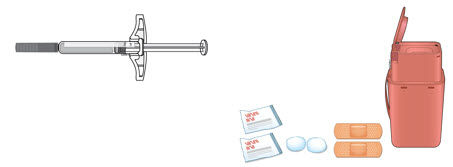
C Reúna todos los materiales necesarios para su inyección.
Lávese las manos completamente con agua y jabón.
En una superficie de trabajo limpia y bien iluminada, coloque lo siguiente:
- Jeringa nueva
- Toallitas con alcohol
- Bolas de algodón o gasas
- Vendajes adhesivos
- Contenedor de eliminación de objetos punzantes
D Prepare y limpie el sitio de inyección.
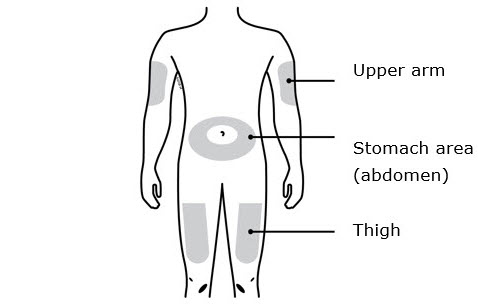
Solo use estos sitios de inyección:
- Su muslo
- Área del estómago (abdomen), excepto un área de dos pulgadas alrededor de su ombligo
- Área externa de la parte superior del brazo (solo si otra persona le está administrando la inyección)
Limpie el sitio de inyección con una toallita con alcohol. Deje que su piel se seque.
- No toque esta área nuevamente antes de inyectar.
-
No inyecte en áreas donde la piel esté sensible, magullada, roja o dura. Evite inyectar directamente en parches o lesiones de piel elevadas, gruesas, rojas o escamosas, o áreas con cicatrices o estrías.
Paso 2: Prepárese
E Tire de la tapa gris de la aguja hacia afuera y lejos de su cuerpo, solo cuando esté listo para inyectar. No deje la tapa gris de la aguja fuera por más de cinco minutos. Esto puede secar el medicamento.
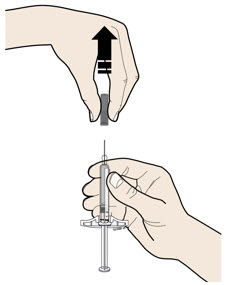
Es normal ver una gota de líquido en el extremo de la aguja.
- No gire ni doble la tapa gris de la aguja.
- No vuelva a colocar la tapa gris de la aguja en la jeringa.
- No retire la tapa gris de la aguja de la jeringa hasta que esté listo para inyectar.
Importante: Tire la tapa gris de la aguja al contenedor de eliminación de objetos punzantes.
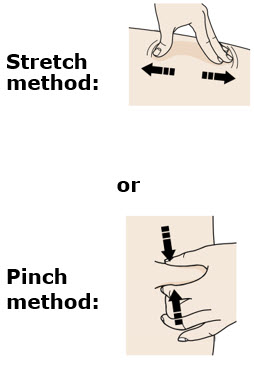
F Pellizque el sitio de inyección para crear una superficie firme.
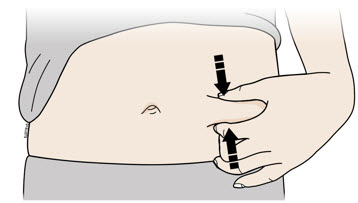
Pellizque la piel firmemente entre el pulgar y los dedos, creando un área de aproximadamente dos pulgadas de ancho.
Importante: Mantenga la piel pellizcada mientras inyecta.
Paso 3: Inyecte
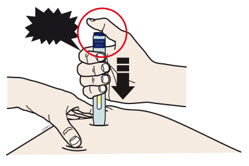
G Mantenga el pellizco. Con la tapa gris de la aguja quitada, inserte la jeringa en su piel en un ángulo de 45 a 90 grados.
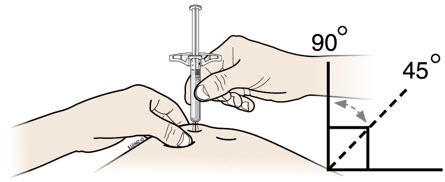
No coloque su dedo en la varilla del émbolo mientras inserta la aguja.
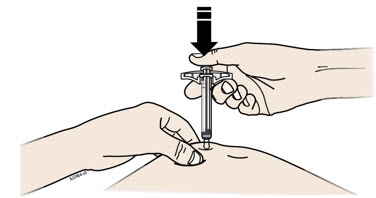
H Coloque su dedo en la varilla del émbolo. Con una presión lenta y constante, empuje la varilla del émbolo hasta el fondo hasta que la jeringa precargada deje de moverse.
I Cuando termine, suelte el pulgar y levante suavemente la jeringa de su piel.
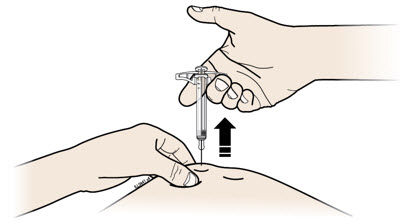
Importante: Cuando retire la jeringa, si parece que el medicamento todavía está en el cañón de la jeringa, esto significa que no ha recibido una dosis completa. Llame a su proveedor de atención médica de inmediato.
Paso 4: Finalice
J Deseche la jeringa usada y la tapa gris de la aguja.
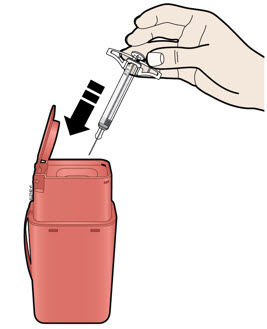
Coloque la jeringa AIMOVIG usada y la tapa gris de la aguja en un contenedor de eliminación de objetos punzantes aprobado por la FDA inmediatamente después de su uso. No tire (deseche) la jeringa en la basura de su hogar.
Si no tiene un contenedor de eliminación de objetos punzantes aprobado por la FDA, puede usar un contenedor doméstico que sea:
- Hecho de plástico resistente
- Se puede cerrar con una tapa hermética y resistente a las perforaciones, sin que los objetos punzantes puedan salir
- Vertical y estable durante el uso
- A prueba de fugas
- Etiquetado adecuadamente para advertir sobre los residuos peligrosos dentro del contenedor
Cuando su contenedor de eliminación de objetos punzantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de desechar su contenedor de eliminación de objetos punzantes. Puede haber leyes estatales o locales sobre cómo debe desechar las agujas y jeringas usadas. Para obtener más información sobre la eliminación segura de objetos punzantes y para obtener información específica sobre la eliminación de objetos punzantes en el estado en el que vive, visite el sitio web de la FDA en: http://www.fda.gov/safesharpsdisposal.
- No reutilice la jeringa.
- No recicle la jeringa o el contenedor de eliminación de objetos punzantes ni los tire a la basura doméstica.
Importante: Mantenga siempre el contenedor de eliminación de objetos punzantes fuera del alcance de los niños.
K Examine el sitio de inyección.
Si hay sangre, presione una bola de algodón o una gasa sobre el sitio de inyección. No frote el sitio de inyección. Aplique un vendaje adhesivo si es necesario.
Para obtener más información, visite www.aimovig.com o llame al 1-800-77-AMGEN (1-800-772-6436).
AIMOVIG® (erenumab-aooe)
Fabricado por:
Amgen Inc.
One Amgen Center Drive
Thousand Oaks, CA 91320-1799 USA
Licencia de EE. UU. No. 1080
© 2018-2022, 2024 Amgen Inc. Todos los derechos reservados.
 |
 |
 |
| No reutilizar | PRECAUCIÓN, Antes de usar, lea las Instrucciones de uso adjuntas para obtener información sobre la administración y consulte el prospecto para obtener información completa sobre la prescripción | Número de lote |
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los EE. UU.
Aprobado: 8/2024
[partnumber] v7
PANEL PRINCIPAL DE PRESENTACIÓN – Jeringa en caja de 70 mg/mL
AMGEN®
1 x 70 mg/mL Jeringa precargada
NDC 55513-840-01
Rx Only
aimovig®
(erenumab-aooe)
Inyección
70
mg/mL
70 mg/mL
Jeringa precargada de dosis única
Solo para uso subcutáneo
Conservar en nevera entre 2 °C y 8 °C (36 °F y 46 °F) en el
envase original para protegerlo de la luz. No congelar. No agitar.
Antes de la inyección, deje que AIMOVIG repose
a temperatura ambiente durante al menos 30 minutos
con la tapa puesta, protegido de la luz solar directa.
Mantener fuera de la vista y el alcance de los niños.
Para obtener más información, visite Aimovig.com o
llame al 1-800-77-AMGEN (1-800-772-6436).
PRECAUCIÓN: Antes de usar,
lea las Instrucciones de uso adjuntas para
obtener información sobre la administración
y consulte el prospecto para obtener
la información de prescripción completa
No reutilizar
No fabricado con
látex de caucho natural
PANEL PRINCIPAL DE VISUALIZACIÓN – Cartón de autoinyector de 70 mg/mL
AMGEN®
1 x 70 mg/mL Autoinyector precargado
NDC 55513-841-01
Receta médica únicamente
aimovig®
(erenumab-aooe)
Inyección
70
mg/mL
70 mg/mL
Autoinyector precargado
Solo para uso subcutáneo
Almacenar refrigerado a 2°C a 8°C (36°F a 46°F) en el envase original
para proteger de la luz. No congelar. No agitar.
Deseche cualquier porción no utilizada.
Mantener fuera del alcance de los niños.
Para obtener más información, visite Aimovig.com o
llame al 1-800-77-AMGEN (1-800-772-6436).
PRECAUCIÓN, Consulte
Los documentos adjuntos
No reutilizar
No fabricado con
látex de caucho natural
No hay un estándar de potencia de EE. UU.

PANEL DE EXPOSICIÓN PRINCIPAL – Cartón de autoinyectores de 140 mg/mL
AMGEN®
1 x 140 mg/mL Autoinyector precargado
NDC 55513-843-01
Receta médica únicamente
aimovig®
(erenumab-aooe)
Inyección
140
mg/mL = 1
dosis
140 mg/mL
Autoinyector precargado
Solo para uso subcutáneo
Almacenar refrigerado a 2°C a 8°C (36°F a 46°F) en
el envase original para proteger de la luz. No congelar.
No agitar. Deseche cualquier porción no utilizada.
Mantener fuera del alcance de los niños.
Para obtener más información, visite Aimovig.com o
llame al 1-800-77-AMGEN (1-800-772-6436).
PRECAUCIÓN, Consulte
los documentos adjuntos
No reutilizar
No fabricado con
látex de caucho natural
No hay un estándar de potencia de EE. UU.
PANEL PRINCIPAL DE EXHIBICIÓN – Cartón de jeringa de 140 mg/ml
AMGEN®
1 x 140 mg/mL Jeringa Prellenada
NDC 55513-842-01
Receta médica únicamente
aimovig®
(erenumab-aooe)
Inyección
140
mg/mL = 1
dosis
140 mg/mL
Jeringa Prellenada de dosis única
Solo para uso subcutáneo
Almacenar refrigerado a 2°C a 8°C (36°F a 46°F) en el envase original
para proteger de la luz. No congelar. No agitar.
Antes de inyectar, deje que AIMOVIG repose a
temperatura ambiente durante al menos 30 minutos
con la tapa puesta, protegido de la luz solar directa.
Mantener fuera del alcance de los niños.
Para obtener más información, visite Aimovig.com o
llame al 1-800-77-AMGEN (1-800-772-6436).
PRECAUCIÓN, Antes de usar,
lea las Instrucciones de uso adjuntas para
información sobre la administración
y consulte el prospecto para
la información completa de prescripción
No reutilizar
No fabricado con
látex de caucho natural



 Este material impreso es reciclable.
Este material impreso es reciclable. 
 This printed material is recyclable.
This printed material is recyclable.