Fabricante de medicamentos: Alvogen, Inc. (Updated: 2024-05-07)
DATOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
Estos puntos destacados no incluyen toda la información necesaria para usar las CÁPSULAS DE LENALIDOMIDA de forma segura y eficaz. Consulte la información de prescripción completa para las CÁPSULAS DE LENALIDOMIDA.
Cápsulas de LENALIDOMIDA, para uso oral
Aprobación inicial en EE. UU.: 2005
ADVERTENCIA: TOXICIDAD EMBRIOFETAL, TOXICIDAD HEMATOLÓGICA Y TROMBOEMBOLIA VENOSA Y ARTERIAL
Consulte la información de prescripción completa para ver la advertencia completa en el recuadro.
TOXICIDAD EMBRIOFETAL
- La lenalidomida, un análogo de la talidomida, causó anomalías en las extremidades en un estudio de desarrollo con monos similar a los defectos de nacimiento causados por la talidomida en humanos. Si se usa lenalidomida durante el embarazo, puede causar defectos de nacimiento o muerte embrionaria o fetal.
- Se debe descartar el embarazo antes de comenzar el tratamiento. Prevenir el embarazo durante el tratamiento mediante el uso de dos métodos anticonceptivos fiables (5.1).
Las cápsulas de lenalidomida solo están disponibles a través de un programa de distribución restringido, llamado programa REMS de lenalidomida (5.2, 17).
TOXICIDAD HEMATOLÓGICA. Las cápsulas de lenalidomida pueden causar neutropenia y trombocitopenia significativas (5.3).
TROMBOEMBOLIA VENOSA Y ARTERIAL
- Aumento significativo del riesgo de trombosis venosa profunda (TVP) y embolia pulmonar (EP), así como del riesgo de infarto de miocardio y accidente cerebrovascular en pacientes con mieloma múltiple que reciben cápsulas de lenalidomida con dexametasona. Se recomienda la profilaxis antitrombótica (5.4).
INDICACIONES Y USO
Las cápsulas de lenalidomida son un análogo de la talidomida indicado para el tratamiento de pacientes adultos con:
- Mieloma múltiple (MM), en combinación con dexametasona (1.1).
- Anemia dependiente de transfusiones debido a síndromes mielodisplásicos (MDS) de riesgo bajo o intermedio-1 asociados con una anomalía de deleción 5q con o sin anomalías citogenéticas adicionales (1.2).
Limitaciones de uso:
- Las cápsulas de lenalidomida no están indicadas y no se recomiendan para el tratamiento de pacientes con leucemia linfocítica crónica (LLC) fuera de ensayos clínicos controlados (1.6).
DOSIFICACIÓN Y ADMINISTRACIÓN
- Terapia combinada MM: 25 mg una vez al día por vía oral los días 1 a 21 de ciclos repetidos de 28 días. (2.1).
- MDS: 10 mg una vez al día (2.2).
- Insuficiencia renal: ajuste la dosis inicial en función del valor de aclaramiento de creatinina (2.6).
- Para conocer las dosis de la terapia concomitante, consulte la información de prescripción completa (2.1, 14.1).
FORMAS FARMACÉUTICAS Y CONCENTRACIONES
Cápsulas: 2.5 mg, 5 mg, 10 mg, 15 mg, 20 mg y 25 mg (3).
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
ADVERTENCIAS Y PRECAUCIONES
- Mayor mortalidad: se produjeron reacciones adversas cardíacas graves y mortales en pacientes con LLC tratados con cápsulas de lenalidomida (5.5).
- Segundas neoplasias malignas primarias (SMNP): Se observaron mayores incidencias de SMNP en ensayos controlados de pacientes con MM que recibían cápsulas de lenalidomida (5.6).
- Aumento de la mortalidad: Observado en pacientes con MM cuando se añadió pembrolizumab a dexametasona y un análogo de la talidomida (5.7).
- Hepatotoxicidad: Insuficiencia hepática, incluidas muertes; controlar la función hepática. Suspenda las cápsulas de lenalidomida y evalúe si se sospecha hepatotoxicidad (5.8).
- Reacciones cutáneas graves: Suspenda las cápsulas de lenalidomida si se producen reacciones graves (5.9).
- Síndrome de lisis tumoral (SLT), incluidas muertes: Controle a los pacientes con riesgo de SLT (es decir, aquellos con una alta carga tumoral) y tome las precauciones adecuadas (5.10).
- Reacción de exacerbación tumoral: Se han producido reacciones graves de exacerbación tumoral, incluyendo reacciones mortales, durante el uso en investigación de cápsulas de lenalidomida para la leucemia linfocítica crónica y el linfoma (5.11).
- Movilización de células madre deteriorada: Se ha notificado una disminución en el número de células CD34+ recogidas después del tratamiento (> 4 ciclos) con cápsulas de lenalidomida. Considere la posibilidad de derivación temprana al centro de trasplante (5.12).
- Hipersensibilidad: Vigile a los pacientes para detectar posibles casos de hipersensibilidad. Suspenda las cápsulas de lenalidomida en caso de angioedema y anafilaxia (5.15).
REACCIONES ADVERSAS
- MM: Las reacciones adversas más frecuentes (≥20%) incluyen diarrea, fatiga, anemia, estreñimiento, neutropenia, leucopenia, edema periférico, insomnio, calambres/espasmos musculares, dolor abdominal, dolor de espalda, náuseas, astenia, pirexia, infección del tracto respiratorio superior, bronquitis, nasofaringitis, gastroenteritis, tos, erupción cutánea, disnea, mareos, disminución del apetito, trombocitopenia y temblor (6.1).
- MDS: Las reacciones adversas más frecuentes (>15%) incluyen trombocitopenia, neutropenia, diarrea, prurito, erupción cutánea, fatiga, estreñimiento, náuseas, nasofaringitis, artralgia, pirexia, dolor de espalda, edema periférico, tos, mareos, dolor de cabeza, calambres musculares, disnea, faringitis y epistaxis (6.1).
Para notificar SOSPECHAS DE REACCIONES ADVERSAS, póngase en contacto con Alvogen, Inc. en el teléfono 1-866-770-3024 o con la FDA en el teléfono 1-800-FDA-1088 o en el sitio web www.fda.gov/medwatch.
INTERACCIONES FARMACOLÓGICAS
- Digoxina: Controle periódicamente las concentraciones plasmáticas de digoxina debido al aumento de la Cmáx y del AUC con el tratamiento concomitante con cápsulas de lenalidomida (7.1).
- El uso concomitante de agentes estimulantes de la eritropoyetina o terapias que contienen estrógenos con cápsulas de lenalidomida puede aumentar el riesgo de trombosis (7.2).
USO EN POBLACIONES ESPECÍFICAS
- Lactancia: Aconsejar no amamantar (8.2).
Consulte la sección 17 para obtener INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y la Guía del medicamento.
Revisado: 11/2023
Tabla de contenido
FULL PRESCRIBING INFORMATION: CONTENTS*
WARNING: EMBRYO-FETAL TOXICITY, HEMATOLOGIC TOXICITY, and VENOUS and ARTERIAL THROMBOEMBOLISM
1 INDICACIONES Y USO
1.1 Mieloma múltiple
1.2 Síndromes mielodisplásicos
1.6 Limitaciones de uso
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis recomendada para el mieloma múltiple
2.2 Dosis recomendada para los síndromes mielodisplásicos
2.5 Modificaciones de la dosis para las reacciones adversas no hematológicas
2.6 Dosis recomendada para pacientes con insuficiencia renal
2.7 Administración
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
4 CONTRAINDICACIONES
4.1 Embarazo
4.2 Reacciones de hipersensibilidad graves
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Toxicidad embriofetal
5.2 Programa REMS de lenalidomida
5.3 Toxicidad hematológica
5.4 Tromboembolia venosa y arterial
5.5 Mayor mortalidad en pacientes con LLC
5.6 Segundas neoplasias malignas primarias
5.7 Mayor mortalidad en pacientes con MM cuando se añade pembrolizumab a un análogo de la talidomida y dexametasona
5.8 Hepatotoxicidad
5.9 Reacciones cutáneas graves
5.10 Síndrome de lisis tumoral
5.11 Reacción de exacerbación tumoral
5.12 Movilización deficiente de células madre
5.13 Trastornos de la tiroides
5.15 Hipersensibilidad
5.16 Riesgo de reacciones alérgicas debido a la tartrazina
6 REACCIONES ADVERSAS
6.1 Experiencia de los ensayos clínicos
6.2 Experiencia posterior a la comercialización
7 INTERACCIONES MEDICAMENTOSAS
7.1 Digoxina
7.2 Terapias concomitantes que pueden aumentar el riesgo de trombosis
7.3 Warfarina
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.3 Mujeres y hombres con potencial reproductivo
8.4 Uso pediátrico
8.5 Uso geriátrico
8.6 Insuficiencia renal
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
12.2 Farmacodinámica
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Mieloma múltiple
14.2 Síndromes mielodisplásicos (SMD) con una anomalía citogenética de deleción 5q
15 REFERENCIAS
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANIPULACIÓN
16.1 Cómo se suministra
16.2 Almacenamiento
16.3 Manipulación y eliminación
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones que se omiten de la información completa de prescripción no aparecen en la lista.
ADVERTENCIA EN EL EMBALAJE
ADVERTENCIA: TOXICIDAD EMBRIOFETAL, TOXICIDAD HEMATOLÓGICA Y TROMBOEMBOLIA VENOSA Y ARTERIAL
Toxicidad Embriofetal
No use las cápsulas de lenalidomida durante el embarazo. La lenalidomida, un análogo de la talidomida, causó anomalías en las extremidades en un estudio de desarrollo en monos. La talidomida es un teratógeno humano conocido que causa defectos de nacimiento humanos graves que ponen en peligro la vida. Si se usa lenalidomida durante el embarazo, puede causar defectos de nacimiento o muerte embrionaria o fetal. En mujeres con potencial reproductivo, obtenga 2 pruebas de embarazo negativas antes de comenzar el tratamiento con cápsulas de lenalidomida. Las mujeres con potencial reproductivo deben usar 2 métodos anticonceptivos o abstenerse continuamente de las relaciones sexuales heterosexuales durante el tratamiento con cápsulas de lenalidomida y durante las 4 semanas posteriores a este [consulte Advertencias y precauciones (5.1), Guía del medicamento (17)]. Para evitar la exposición embrionaria y fetal a la lenalidomida, las cápsulas de lenalidomida solo están disponibles a través de un programa de distribución restringido, el programa REMS de lenalidomida (5.2).
Encontrará información sobre el programa REMS de lenalidomida en www.lenalidomiderems.com o llamando al número gratuito 1-888-423-5436.
Toxicidad hematológica (neutropenia y trombocitopenia)
Las cápsulas de lenalidomida pueden causar neutropenia y trombocitopenia significativas. El ochenta por ciento de los pacientes con síndromes mielodisplásicos con del 5q tuvieron que retrasar/reducir la dosis durante el estudio principal. El treinta y cuatro por ciento de los pacientes tuvieron que someterse a un segundo retraso/reducción de la dosis. Se observó toxicidad hematológica de grado 3 o 4 en el 80 % de los pacientes incluidos en el estudio. Los pacientes en tratamiento para los síndromes mielodisplásicos con del 5q deben someterse a un control de hemograma completo semanalmente durante las primeras 8 semanas de tratamiento y, al menos, mensualmente a partir de entonces. Los pacientes pueden requerir la interrupción y/o reducción de la dosis. Los pacientes pueden requerir el uso de apoyo con hemoderivados y/o factores de crecimiento[consulte Dosificación y administración (2.2)].
Tromboembolia venosa y arterial
Las cápsulas de lenalidomida han demostrado un riesgo significativamente mayor de trombosis venosa profunda (TVP) y embolia pulmonar (EP), así como de infarto de miocardio y accidente cerebrovascular en pacientes con mieloma múltiple que fueron tratados con cápsulas de lenalidomida y dexametasona. Controle a los pacientes para detectar signos y síntomas de tromboembolismo y adviértales al respecto. Aconseje a los pacientes que busquen atención médica inmediata si desarrollan síntomas como dificultad para respirar, dolor en el pecho o hinchazón de brazos o piernas. Se recomienda la tromboprofilaxis y la elección del régimen debe basarse en una evaluación de los riesgos subyacentes del paciente[consulte Advertencias y precauciones (5.4)].
1 INDICACIONES Y USO
1.1 Mieloma múltiple
Las cápsulas de lenalidomida en combinación con dexametasona están indicadas para el tratamiento de pacientes adultos con mieloma múltiple (MM).
1.2 Síndromes mielodisplásicos
Las cápsulas de lenalidomida están indicadas para el tratamiento de pacientes adultos con anemia dependiente de transfusiones debido a síndromes mielodisplásicos (MDS) de riesgo bajo o intermedio-1 asociados con una anomalía citogenética de deleción 5q con o sin anomalías citogenéticas adicionales.
1.6 Limitaciones de uso
Las cápsulas de lenalidomida no están indicadas y no se recomiendan para el tratamiento de pacientes con CLL fuera de ensayos clínicos controlados [consulte Advertencias y precauciones (5.5)].
2 POSOLOGÍA Y ADMINISTRACIÓN
2.1 Dosis recomendada para el mieloma múltiple
Terapia combinada con cápsulas de lenalidomida
La dosis inicial recomendada de las cápsulas de lenalidomida es de 25 mg por vía oral una vez al día en los días 1 a 21 de ciclos repetidos de 28 días en combinación con dexametasona. Consulte la Sección 14.1 para conocer la dosificación específica de dexametasona. Para pacientes mayores de 75 años, la dosis inicial de dexametasona puede reducirse [ver Estudios clínicos (14.1)]. El tratamiento debe continuarse hasta la progresión de la enfermedad o una toxicidad inaceptable.
En pacientes que no son elegibles para auto-HSCT, el tratamiento debe continuarse hasta la progresión de la enfermedad o una toxicidad inaceptable. Para los pacientes elegibles para auto-HSCT, la movilización de células madre hematopoyéticas debe ocurrir dentro de los 4 ciclos de una terapia que contenga lenalidomida [ver Advertencias y precauciones (5.12)].
Ajustes de dosis para toxicidades hematológicas durante el tratamiento de MM
Se recomiendan las pautas de modificación de la dosis, como se resume en la Tabla 1 a continuación, para controlar la neutropenia o trombocitopenia de Grado 3 o 4 u otra toxicidad de Grado 3 o 4 que se considere relacionada con las cápsulas de lenalidomida.
Tabla 1: Ajustes de dosis para toxicidades hematológicas para MM
Recuentos de plaquetas
Trombocitopenia en MM
| Cuando las plaquetas | Curso recomendado
Días 1 a 21 del ciclo repetido de 28 días |
| Caen por debajo de 30,000/mcL | Interrumpir el tratamiento con cápsulas de lenalidomida, seguir el CBC semanalmente |
| Vuelven a al menos 30,000/mcL | Reanudar las cápsulas de lenalidomida en la siguiente dosis más baja. No administrar dosis inferiores a 2,5 mg al día. |
| Por cada caída posterior por debajo de 30,000/mcL | Interrumpir el tratamiento con cápsulas de lenalidomida |
| Vuelven a al menos 30,000/mcL | Reanudar las cápsulas de lenalidomida en la siguiente dosis más baja. No administrar dosis inferiores a 2,5 mg al día. |
Recuentos absolutos de neutrófilos (RAN)
Neutropenia en MM
| Cuando los neutrófilos | Curso recomendado
Días 1 a 21 del ciclo repetido de 28 días |
| Caen por debajo de 1,000/mcL | Interrumpir el tratamiento con cápsulas de lenalidomida, seguir el CBC semanalmente |
| Vuelven a al menos 1,000/mcL y la neutropenia es la única toxicidad | Reanudar las cápsulas de lenalidomida a 25 mg al día o la dosis inicial |
| Vuelven a al menos 1,000/mcL y si hay otra toxicidad | Reanudar las cápsulas de lenalidomida en la siguiente dosis más baja. No administrar dosis inferiores a 2,5 mg al día. |
| Por cada caída posterior por debajo de 1,000/mcL | Interrumpir el tratamiento con cápsulas de lenalidomida |
| Vuelven a al menos 1,000/mcL | Reanudar las cápsulas de lenalidomida en la siguiente dosis más baja. No administrar dosis inferiores a 2,5 mg al día. |
2.2 Dosis recomendada para los síndromes mielodisplásicos
La dosis inicial recomendada de las cápsulas de lenalidomida es de 10 mg al día. El tratamiento se continúa o modifica en función de los hallazgos clínicos y de laboratorio. Continúe el tratamiento hasta la progresión de la enfermedad o una toxicidad inaceptable.
Ajustes de dosis para toxicidades hematológicas durante el tratamiento de los síndromes mielodisplásicos
Los pacientes que reciben una dosis inicial de 10 mg y que experimentan trombocitopenia deben tener su dosis ajustada de la siguiente manera:
Recuentos de plaquetas
Si la trombocitopenia se desarrolla DENTRO de las 4 semanas de comenzar el tratamiento con 10 mg al día en los síndromes mielodisplásicos
| Si el valor inicial es de al menos 100,000/mcL | |
| Cuando las plaquetas | Curso recomendado |
| Caen por debajo de 50,000/mcL | Interrumpir el tratamiento con cápsulas de lenalidomida |
| Vuelven a al menos 50,000/mcL | Reanudar las cápsulas de lenalidomida a 5 mg al día |
| Si el valor inicial es inferior a 100,000/mcL | |
| Cuando las plaquetas | Curso recomendado |
| Caen al 50% del valor inicial | Interrumpir el tratamiento con cápsulas de lenalidomida |
| Si el valor inicial es de al menos 60,000/mcL y vuelven a al menos 50,000/mcL | Reanudar las cápsulas de lenalidomida a 5 mg al día |
| Si el valor inicial es inferior a 60,000/mcL y vuelven a al menos 30,000/mcL | Reanudar las cápsulas de lenalidomida a 5 mg al día |
Si la trombocitopenia se desarrolla DESPUÉS de 4 semanas de comenzar el tratamiento con 10 mg al día en los síndromes mielodisplásicos
| Cuando las plaquetas | Curso recomendado |
| Caen por debajo de 30,000/mcL o por debajo de 50,000/mcL con transfusiones de plaquetas | Interrumpir el tratamiento con cápsulas de lenalidomida |
| Vuelven a al menos 30,000/mcL (sin fallo hemostático) | Reanudar las cápsulas de lenalidomida a 5 mg al día |
Los pacientes que presenten trombocitopenia con 5 mg diarios deberán ajustar su dosis de la siguiente manera:
Si se desarrolla trombocitopenia durante el tratamiento con 5 mg diarios en SMD
| Cuando las plaquetas | Curso recomendado |
| Caigan por debajo de 30 000/mcL o por debajo de 50 000/mcL con transfusiones de plaquetas | Interrumpir el tratamiento con cápsulas de lenalidomida |
| Regresen a por lo menos 30 000/mcL (sin insuficiencia hemostática) | Reanudar las cápsulas de lenalidomida a 2.5 mg diarios |
Los pacientes que reciben una dosis inicial de 10 mg y experimentan neutropenia deben ajustar su dosis de la siguiente manera:
Recuentos absolutos de neutrófilos (RAN)
Si la neutropenia se desarrolla DENTRO de las 4 semanas de comenzar el tratamiento con 10 mg diarios en SMD
| Si el RAN inicial es de al menos 1000/mcL | |
| Cuando los neutrófilos | Curso recomendado |
| Caigan por debajo de 750/mcL | Interrumpir el tratamiento con cápsulas de lenalidomida |
| Regresen a por lo menos 1000/mcL | Reanudar las cápsulas de lenalidomida a 5 mg diarios |
| Si el RAN inicial es inferior a 1000/mcL | |
| Cuando los neutrófilos | Curso recomendado |
| Caigan por debajo de 500/mcL | Interrumpir el tratamiento con cápsulas de lenalidomida |
| Regresen a por lo menos 500/mcL | Reanudar las cápsulas de lenalidomida a 5 mg diarios |
Si la neutropenia se desarrolla DESPUÉS de 4 semanas de comenzar el tratamiento con 10 mg diarios en SMD
| Cuando los neutrófilos | Curso recomendado |
| Caigan por debajo de 500/mcL durante al menos 7 días o por debajo de 500/mcL asociado con fiebre (al menos 38.5 °C) | Interrumpir el tratamiento con cápsulas de lenalidomida |
| Regresen a por lo menos 500/mcL | Reanudar las cápsulas de lenalidomida a 5 mg diarios |
Los pacientes que presenten neutropenia con 5 mg diarios deberán ajustar su dosis de la siguiente manera:
Si se desarrolla neutropenia durante el tratamiento con 5 mg diarios en SMD
| Cuando los neutrófilos | Curso recomendado |
| Caigan por debajo de 500/mcL durante al menos 7 días o por debajo de 500/mcL asociado con fiebre (al menos 38.5 °C) | Interrumpir el tratamiento con cápsulas de lenalidomida |
| Regresen a por lo menos 500/mcL | Reanudar las cápsulas de lenalidomida a 2.5 mg diarios |
2.5 Modificaciones de la dosis para reacciones adversas no hematológicas
Para las toxicidades de grado 3/4 no hematológicas que se considere que están relacionadas con las cápsulas de lenalidomida, suspenda el tratamiento y reinícielo a criterio del médico en el siguiente nivel de dosis más bajo cuando la toxicidad se haya resuelto a Grado 2 o inferior.
Suspenda permanentemente las cápsulas de lenalidomida para el angioedema, anafilaxia, erupción cutánea de grado 4, exfoliación de la piel, ampollas o cualquier otra reacción dermatológica grave [consulte Advertencias y precauciones (5.9, 5.15)].
2.6 Dosis recomendada para pacientes con insuficiencia renal
Las recomendaciones para la dosificación de pacientes con insuficiencia renal se muestran en la siguiente tabla [consulte Farmacología clínica (12.3)].
| Función renal (Cockcroft-Gault) | Dosis en la terapia combinada con cápsulas de lenalidomida para el MM | Dosis en cápsulas de lenalidomida para SMD |
| CLcr de 30 a 60 ml/min | 10 mg una vez al día | 5 mg una vez al día |
| CLcr por debajo de 30 ml/min (que no requiere diálisis) | 15 mg en días alternos | 2.5 mg una vez al día |
| CLcr por debajo de 30 ml/min (que requiere diálisis) | 5 mg una vez al día. En los días de diálisis, administre la dosis después de la diálisis. | 2.5 mg una vez al día. En los días de diálisis, administre la dosis después de la diálisis. |
Terapia combinada con cápsulas de lenalidomida para el MM: Para una CLcr de 30 a 60 ml/min, considere aumentar la dosis a 15 mg después de 2 ciclos si el paciente tolera la dosis de 10 mg de lenalidomida sin toxicidad limitante de la dosis.
Cápsulas de lenalidomida para SMD: Base el posterior aumento o disminución de la dosis de las cápsulas de lenalidomida en la tolerancia al tratamiento individual del paciente [consulte Dosificación y administración (2.2)].
2.7 Administración
Aconseje a los pacientes que tomen las cápsulas de lenalidomida por vía oral aproximadamente a la misma hora todos los días, con o sin alimentos. Aconseje a los pacientes que traguen las cápsulas de lenalidomida enteras con agua y que no las abran, rompan ni mastiquen.
3 FORMAS FARMACÉUTICAS Y CONCENTRACIONES
Cápsulas:
- 2.5 mg: Cápsula de tamaño n.° 4 con tapa opaca azul oscuro/cuerpo opaco naranja claro, con la impresión en tinta negra “LP” en la tapa y “637” en el cuerpo y llenas de polvo blanco.
- 5 mg: Cápsula de tamaño n.° 2 con tapa opaca verde/cuerpo opaco color caramelo claro, con la impresión en tinta negra “LP” en la tapa y “638” en el cuerpo y llenas de polvo blanco.
- 10 mg: Cápsula de tamaño n.° 0 con tapa opaca dorada/cuerpo opaco gris, con la impresión en tinta negra “LP” en la tapa y “639” en el cuerpo y llenas de polvo blanco.
- 15 mg: Cápsula de tamaño n.° 2 con tapa opaca color caramelo/cuerpo opaco gris, con la impresión en tinta negra “LP” en la tapa y “640” en el cuerpo y llenas de polvo blanco.
- 20 mg: Cápsula de tamaño n.° 1 con tapa opaca rojo ladrillo cálido/cuerpo opaco gris claro, con la impresión en tinta negra “LP” en la tapa y “641” en el cuerpo y llenas de polvo blanco.
- 25 mg: Cápsula de tamaño n.° 0 con tapa opaca blanca/cuerpo opaco blanco, con la impresión en tinta negra “LP” en la tapa y “642” en el cuerpo y llenas de polvo blanco.
4 CONTRAINDICACIONES
4.1 Embarazo
La lenalidomida puede causar daño fetal cuando se administra a una mujer embarazada. Se observaron anomalías en las extremidades de las crías de monos que recibieron lenalidomida durante la organogénesis. Este efecto se observó en todas las dosis probadas. Debido a los resultados de este estudio de desarrollo en monos y a las similitudes estructurales de la lenalidomida con la talidomida, un teratógeno humano conocido, la lenalidomida está contraindicada en mujeres embarazadas [ver Recuadro de advertencia]. Si este medicamento se utiliza durante el embarazo o si la paciente queda embarazada mientras lo toma, debe informársele del posible riesgo para el feto [ver Advertencias y precauciones (5.1, 5.2), Uso en poblaciones especiales (8.1, 8.3)].
4.2 Reacciones de hipersensibilidad graves
Las cápsulas de lenalidomida están contraindicadas en pacientes que han demostrado hipersensibilidad grave (p. ej., angioedema, síndrome de Stevens-Johnson, necrólisis epidérmica tóxica) a la lenalidomida [ver Advertencias y precauciones (5.9, 5.15)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Toxicidad embriofetal
Las cápsulas de lenalidomida son un análogo de la talidomida y están contraindicadas durante el embarazo. Se sabe que la talidomida es un teratógeno humano que causa defectos congénitos potencialmente mortales o muerte embriofetal [ver Uso en poblaciones específicas (8.1)]. Un estudio de desarrollo embriofetal en monos indica que la lenalidomida produjo malformaciones en las crías de las monas que recibieron el fármaco durante el embarazo, similares a los defectos congénitos observados en humanos tras la exposición a la talidomida durante el embarazo.
Las cápsulas de lenalidomida solo están disponibles a través del programa REMS de lenalidomida [ver Advertencias y precauciones (5.2)].
Mujeres en edad fértil
Las mujeres en edad fértil deben evitar el embarazo durante al menos 4 semanas antes de comenzar el tratamiento con cápsulas de lenalidomida, durante el tratamiento, durante las interrupciones de la dosis y durante al menos 4 semanas después de completar el tratamiento.
Las mujeres deben comprometerse a abstenerse continuamente de las relaciones sexuales heterosexuales o a utilizar dos métodos anticonceptivos fiables, comenzando 4 semanas antes de iniciar el tratamiento con cápsulas de lenalidomida, durante el tratamiento, durante las interrupciones de la dosis y continuando durante 4 semanas después de la interrupción del tratamiento con cápsulas de lenalidomida.
Se deben obtener dos pruebas de embarazo negativas antes de iniciar el tratamiento. La primera prueba debe realizarse en un plazo de 10 a 14 días y la segunda en un plazo de 24 horas antes de prescribir el tratamiento con cápsulas de lenalidomida y, posteriormente, semanalmente durante el primer mes y, a partir de entonces, mensualmente en mujeres con ciclos menstruales regulares o cada 2 semanas en mujeres con ciclos menstruales irregulares [ver Uso en poblaciones específicas (8.3)].
Hombres
La lenalidomida está presente en el semen de los pacientes que reciben el fármaco. Por lo tanto, los hombres deben utilizar siempre un preservativo de látex o sintético durante cualquier contacto sexual con mujeres en edad fértil mientras tomen cápsulas de lenalidomida y hasta 4 semanas después de interrumpir el tratamiento con cápsulas de lenalidomida, incluso si se han sometido a una vasectomía con éxito. Los pacientes varones que tomen cápsulas de lenalidomida no deben donar esperma y hasta 4 semanas después de interrumpir el tratamiento con cápsulas de lenalidomida [ver Uso en poblaciones específicas (8.3)].
Donación de sangre
Los pacientes no deben donar sangre durante el tratamiento con cápsulas de lenalidomida y durante las 4 semanas siguientes a la interrupción del fármaco, ya que la sangre podría administrarse a una paciente embarazada cuyo feto no debe estar expuesto a las cápsulas de lenalidomida.
5.2 Programa REMS de lenalidomida
Debido al riesgo embriofetal [ver Advertencias y precauciones (5.1)], las cápsulas de lenalidomida solo están disponibles a través de un programa restringido en el marco de una Estrategia de Evaluación y Mitigación de Riesgos (REMS), el programa REMS de lenalidomida .
Los componentes obligatorios del programa REMS de lenalidomida incluyen los siguientes:
- Los prescriptores deben estar certificados por el programa REMS de lenalidomida mediante su inscripción y el cumplimiento de los requisitos del REMS.
- Los pacientes deben firmar un formulario de acuerdo entre el paciente y el médico y cumplir con los requisitos del REMS. En particular, las pacientes en edad fértil que no estén embarazadas deben cumplir con los requisitos de las pruebas de embarazo y la anticoncepción [ver Uso en poblaciones específicas (8.3)] y los hombres deben cumplir con los requisitos de anticoncepción [ver Uso en poblaciones específicas (8.3)].
- Las farmacias deben estar certificadas por el programa REMS de lenalidomida, solo deben dispensar a pacientes que estén autorizados a recibir cápsulas de lenalidomida y deben cumplir con los requisitos del REMS.
Puede encontrar más información sobre el programa REMS de lenalidomida en www.lenalidomiderems.com o por teléfono en el 1-888-423-5436.
5.3 Toxicidad hematológica
Las cápsulas de lenalidomida pueden causar neutropenia y trombocitopenia significativas. Controle a los pacientes con neutropenia para detectar signos de infección. Aconseje a los pacientes que estén atentos a la aparición de hemorragias o hematomas, especialmente con el uso concomitante de medicamentos que pueden aumentar el riesgo de hemorragia. Los pacientes que toman cápsulas de lenalidomida deben someterse a un hemograma completo periódicamente, tal como se describe a continuación [ver Posología y administración (2.1, 2.2)].
Controle los hemogramas completos (CBC) en pacientes que toman cápsulas de lenalidomida en combinación con dexametasona para el MM cada 7 días (semanalmente) durante los primeros 2 ciclos, en los días 1 y 15 del ciclo 3 y cada 28 días (4 semanas) a partir de entonces. Puede ser necesaria una interrupción y/o reducción de la dosis [ver Posología y administración (2.1)]. En ensayos para otra indicación, se notificó neutropenia de grado 3 o 4 en hasta el 59 % de los pacientes tratados con lenalidomida y trombocitopenia de grado 3 o 4 en hasta el 38 % de los pacientes tratados con lenalidomida.
Controle los hemogramas completos (CBC) en pacientes que toman cápsulas de lenalidomida para el MDS semanalmente durante las primeras 8 semanas y al menos mensualmente a partir de entonces. Se observó toxicidad hematológica de grado 3 o 4 en el 80 % de los pacientes incluidos en el estudio de MDS. En el 48 % de los pacientes que desarrollaron neutropenia de grado 3 o 4, la mediana del tiempo hasta la aparición fue de 42 días (rango, 14 a 411 días), y la mediana del tiempo hasta la recuperación documentada fue de 17 días (rango, 2 a 170 días). En el 54 % de los pacientes que desarrollaron trombocitopenia de grado 3 o 4, la mediana del tiempo hasta la aparición fue de 28 días (rango, 8 a 290 días), y la mediana del tiempo hasta la recuperación documentada fue de 22 días (rango, 5 a 224 días) [ver Recuadro de advertencia y Posología y administración (2.2)].
5.4 Tromboembolia venosa y arterial
Los eventos tromboembólicos venosos (ETV [TVP y EP]) y los eventos tromboembólicos arteriales (ETA, infarto de miocardio y accidente cerebrovascular) aumentan en pacientes tratados con cápsulas de lenalidomida.
Se produjo un aumento significativo del riesgo de TVP (7.4%) y de EP (3.7%) en pacientes con MM después de al menos una terapia previa que fueron tratados con cápsulas de lenalidomida y terapia con dexametasona en comparación con los pacientes tratados en el grupo de placebo y dexametasona (3.1% y 0.9%) en ensayos clínicos con uso variable de terapias anticoagulantes. En el estudio de mieloma múltiple recién diagnosticado (MMND) en el que casi todos los pacientes recibieron profilaxis antitrombótica, la TVP se notificó como una reacción adversa grave (3.6%, 2.0% y 1.7%) en los grupos Rd continuo, Rd18 y MPT, respectivamente. La frecuencia de reacciones adversas graves de EP fue similar entre los grupos Rd continuo, Rd18 y MPT (3.8%, 2.8% y 3.7%, respectivamente) [ver Recuadro de advertencia y Reacciones adversas (6.1)].
El infarto de miocardio (1.7%) y el accidente cerebrovascular (ACV) (2.3%) aumentan en pacientes con MM después de al menos una terapia previa que fueron tratados con cápsulas de lenalidomida y terapia con dexametasona en comparación con los pacientes tratados con placebo y dexametasona (0.6% y 0.9%) en ensayos clínicos. En el estudio de MMND, el infarto de miocardio (incluido el agudo) se notificó como una reacción adversa grave (2.3%, 0.6% y 1.1%) en los grupos Rd continuo, Rd18 y MPT, respectivamente. La frecuencia de reacciones adversas graves de ACV fue similar entre los grupos Rd continuo, Rd18 y MPT (0.8%, 0.6% y 0.6%, respectivamente) [ver Reacciones adversas (6.1)].
Los pacientes con factores de riesgo conocidos, incluida la trombosis previa, pueden tener un mayor riesgo y se deben tomar medidas para tratar de minimizar todos los factores modificables (p. ej., hiperlipidemia, hipertensión, tabaquismo).
En ensayos clínicos controlados que no utilizaron tromboprofilaxis concomitante, el 21.5% de los eventos trombóticos generales (eventos embólicos y trombóticos de consulta estandarizada de MedDRA) ocurrieron en pacientes con MM refractario y recidivante que fueron tratados con cápsulas de lenalidomida y dexametasona en comparación con el 8.3% de trombosis en pacientes tratados con placebo y dexametasona. El tiempo medio hasta el primer evento de trombosis fue de 2.8 meses. En el estudio de MMND en el que casi todos los pacientes recibieron profilaxis antitrombótica, la frecuencia general de eventos trombóticos fue del 17.4% en pacientes en los grupos combinados de Rd continuo y Rd18, y fue del 11.6% en el grupo de MPT. El tiempo medio hasta el primer evento de trombosis fue de 4.3 meses en los grupos combinados de Rd continuo y Rd18.
Se recomienda la tromboprofilaxis. El régimen de tromboprofilaxis debe basarse en una evaluación de los riesgos subyacentes del paciente. Indique a los pacientes que informen inmediatamente cualquier signo y síntoma que sugiera eventos trombóticos. Los ESA y los estrógenos pueden aumentar aún más el riesgo de trombosis y su uso debe basarse en una decisión de beneficio-riesgo en pacientes que reciben cápsulas de lenalidomida [ver Interacciones farmacológicas (7.2)].
5.5 Mayor mortalidad en pacientes con LLC
En un ensayo clínico prospectivo aleatorizado (1:1) en el tratamiento de primera línea de pacientes con leucemia linfocítica crónica, la terapia con cápsulas de lenalidomida de agente único aumentó el riesgo de muerte en comparación con la terapia con clorambucilo de agente único. En un análisis intermedio, hubo 34 muertes entre 210 pacientes en el grupo de tratamiento con cápsulas de lenalidomida en comparación con 18 muertes entre 211 pacientes en el grupo de tratamiento con clorambucilo, y el índice de riesgo para la supervivencia general fue de 1.92 [IC del 95%: 1.08 – 3.41], lo que concuerda con un aumento del 92% en el riesgo de muerte. El ensayo se interrumpió por seguridad en julio de 2013.
Las reacciones adversas cardiovasculares graves, como la fibrilación auricular, el infarto de miocardio y la insuficiencia cardíaca, ocurrieron con mayor frecuencia en el grupo de tratamiento con cápsulas de lenalidomida. Las cápsulas de lenalidomida no están indicadas ni se recomiendan para su uso en LLC fuera de ensayos clínicos controlados.
5.6 Segundas neoplasias malignas primarias
En ensayos clínicos en pacientes con MM que recibieron cápsulas de lenalidomida, se ha observado un aumento de las segundas neoplasias malignas primarias (SNMP) hematológicas más tumores sólidos, en particular AML y MDS. Se produjo un aumento de las SNMP hematológicas, incluidas AML y MDS, en el 5.3% de los pacientes con MMND que recibieron lenalidomida en combinación con melfalán oral en comparación con el 1.3% de los pacientes que recibieron melfalán sin lenalidomida. La frecuencia de casos de AML y MDS en pacientes con MMND tratados con lenalidomida en combinación con dexametasona sin melfalán fue del 0.4%.
En un estudio para otra indicación, las SNMP hematológicas ocurrieron en el 7.5% de los pacientes en comparación con el 3.3% en los pacientes que recibieron placebo. La incidencia de SNMP hematológicas más tumores sólidos (excluyendo el carcinoma de células escamosas y el carcinoma de células basales) fue del 14.9%, en comparación con el 8.8% en los pacientes que recibieron placebo con un seguimiento medio de 91.5 meses. El cáncer de piel no melanoma SNMP, incluido el carcinoma de células escamosas y el carcinoma de células basales, ocurrió en el 3.9% de los pacientes que recibieron mantenimiento con lenalidomida, en comparación con el 2.6% en el grupo de placebo.
En pacientes con MM recidivante o refractario tratados con lenalidomida/dexametasona, la incidencia de SNMP hematológicas más tumores sólidos (excluyendo el carcinoma de células escamosas y el carcinoma de células basales) fue del 2.3% frente al 0.6% en el grupo de dexametasona sola. El cáncer de piel no melanoma SNMP, incluido el carcinoma de células escamosas y el carcinoma de células basales, ocurrió en el 3.1% de los pacientes que recibieron lenalidomida/dexametasona, en comparación con el 0.6% en el grupo de dexametasona sola.
Los pacientes que recibieron terapia con lenalidomida hasta la progresión de la enfermedad no mostraron una mayor incidencia de SNMP invasivas que los pacientes tratados en los grupos con lenalidomida de duración fija. Controle a los pacientes para detectar el desarrollo de segundas neoplasias malignas primarias. Tenga en cuenta tanto el beneficio potencial de las cápsulas de lenalidomida como el riesgo de segundas neoplasias malignas primarias al considerar el tratamiento con cápsulas de lenalidomida.
5.7 Mayor mortalidad en pacientes con MM cuando se añade pembrolizumab a un análogo de talidomida y dexametasona
En dos ensayos clínicos aleatorizados en pacientes con MM, la adición de pembrolizumab a un análogo de talidomida más dexametasona, un uso para el que no está indicado ningún anticuerpo bloqueante de PD-1 o PD-L1, dio lugar a un aumento de la mortalidad. No se recomienda el tratamiento de pacientes con MM con un anticuerpo bloqueante de PD-1 o PD-L1 en combinación con un análogo de talidomida más dexametasona fuera de ensayos clínicos controlados.
5.8 Hepatotoxicidad
Se ha producido fallo hepático, incluso casos mortales, en pacientes tratados con lenalidomida en combinación con dexametasona. En ensayos clínicos, el 15% de los pacientes experimentaron hepatotoxicidad (con características hepatocelulares, colestásicas y mixtas); el 2% de los pacientes con MM y el 1% de los pacientes con mielodisplasia presentaron acontecimientos adversos graves de hepatotoxicidad. Se desconoce el mecanismo de la hepatotoxicidad inducida por el fármaco. La hepatopatía vírica preexistente, las enzimas hepáticas elevadas al inicio del tratamiento y la medicación concomitante pueden ser factores de riesgo. Controle periódicamente las enzimas hepáticas. Suspenda las cápsulas de lenalidomida si aumentan las enzimas hepáticas. Una vez que los valores vuelvan a la normalidad, se puede considerar la posibilidad de administrar el tratamiento a una dosis más baja.
5.9 Reacciones cutáneas graves
Se han notificado reacciones cutáneas graves, como el síndrome de Stevens-Johnson (SSJ), la necrólisis epidérmica tóxica (NET) y la reacción medicamentosa con eosinofilia y síntomas sistémicos (DRESS). El síndrome DRESS puede presentarse con una reacción cutánea (como erupción cutánea o dermatitis exfoliativa), eosinofilia, fiebre y/o linfadenopatía con complicaciones sistémicas como hepatitis, nefritis, neumonitis, miocarditis y/o pericarditis. Estos acontecimientos pueden ser mortales. Los pacientes con antecedentes de erupción cutánea de grado 4 asociada al tratamiento con talidomida no deben recibir cápsulas de lenalidomida. Considere la posibilidad de interrumpir o suspender el tratamiento con cápsulas de lenalidomida en caso de erupción cutánea de grado 2-3. Interrumpa permanentemente el tratamiento con cápsulas de lenalidomida en caso de erupción cutánea de grado 4, erupción exfoliativa o bullosa, o en caso de otras reacciones cutáneas graves como SSJ, NET o DRESS [ver Posología y administración (2.5)].
5.10 Síndrome de lisis tumoral
Se han notificado casos mortales de síndrome de lisis tumoral (SLT) durante el tratamiento con lenalidomida. Los pacientes con riesgo de SLT son aquellos con una elevada carga tumoral antes del tratamiento. Vigile estrechamente a los pacientes con riesgo y adopte las medidas preventivas adecuadas.
5.11 Reacción de exacerbación tumoral
Se ha producido reacción de exacerbación tumoral (RET), incluidas reacciones mortales, durante el uso experimental de lenalidomida para la LLC y el linfoma, y se caracteriza por inflamación dolorosa de los ganglios linfáticos, fiebre baja, dolor y erupción cutánea. Las cápsulas de lenalidomida no están indicadas ni se recomienda su uso en la LLC fuera de ensayos clínicos controlados.
La reacción de exacerbación tumoral puede simular la progresión de la enfermedad (PE).
El tratamiento con cápsulas de lenalidomida puede continuarse en pacientes con RET de grado 1 y 2 sin interrupción ni modificación, a criterio del médico. Los pacientes con RET de grado 1 y 2 también pueden ser tratados con corticosteroides, antiinflamatorios no esteroideos (AINE) y/o analgésicos narcóticos para el manejo de los síntomas de la RET. En pacientes con RET de grado 3 o 4, se recomienda suspender el tratamiento con cápsulas de lenalidomida hasta que la RET se resuelva a ≤ Grado 1. Los pacientes con RET de grado 3 o 4 pueden ser tratados para el manejo de los síntomas según la guía para el tratamiento de la RET de grado 1 y 2.
5.12 Movilización deficiente de células madre
Se ha notificado una disminución en el número de células CD34+ recogidas después del tratamiento (> 4 ciclos) con cápsulas de lenalidomida. En los pacientes que son candidatos a un auto-TCMH, la derivación a un centro de trasplante debe realizarse al principio del tratamiento para optimizar el momento de la recogida de células madre. En pacientes que recibieron más de 4 ciclos de un tratamiento que contiene lenalidomida o para quienes no se han recogido cantidades adecuadas de células CD34+ solo con G-CSF, se puede considerar el G-CSF con ciclofosfamida o la combinación de G-CSF con un inhibidor de CXCR4.
5.13 Trastornos de la tiroides
Se ha notificado tanto hipotiroidismo como hipertiroidismo [ver Reacciones adversas (6.2)]. Mida la función tiroidea antes de iniciar el tratamiento con cápsulas de lenalidomida y durante el mismo.
5.15 Hipersensibilidad
Se ha notificado hipersensibilidad, incluyendo angioedema, anafilaxia y reacciones anafilácticas a las cápsulas de lenalidomida. Interrumpa permanentemente el tratamiento con cápsulas de lenalidomida en caso de angioedema y anafilaxia [ver Posología y administración (2.2)].
5.16 Riesgo de reacciones alérgicas debido a la tartrazina
Este producto contiene amarillo FD&C n.º 5 (tartrazina) que puede causar reacciones de tipo alérgico (incluido asma bronquial) en determinadas personas sensibles. Aunque la incidencia global de sensibilidad al amarillo FD&C n.º 5 (tartrazina) en la población general es baja, se observa con frecuencia en pacientes que también tienen hipersensibilidad a la aspirina.
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas clínicamente significativas se describen en detalle en otras secciones de la información de prescripción:
- Toxicidad embriofetal [ver Recuadro de advertencia, Advertencias y precauciones (5.1, 5.2)]
- Toxicidad hematológica[ver Recuadro de advertencia, Advertencias y precauciones (5.3)]
- Tromboembolia venosa y arterial [ver Recuadro de advertencia, Advertencias y precauciones (5.4)]
- Mayor mortalidad en pacientes con LLC [ver Advertencias y precauciones (5.5)]
- Segundas neoplasias malignas primarias [ver Advertencias y precauciones (5.6)]
- Mayor mortalidad en pacientes con MM cuando se añade pembrolizumab a un análogo de la talidomida y dexametasona [ver Advertencias y precauciones (5.7)]
- Hepatotoxicidad [ver Advertencias y precauciones (5.8)]
- Reacciones cutáneas graves [ver Advertencias y precauciones (5.9)]
- Síndrome de lisis tumoral [ver Advertencias y precauciones (5.10)]
- Reacciones de exacerbación tumoral [ver Advertencias y precauciones (5.11)]
- Movilización deficiente de células madre [ver Advertencias y precauciones (5.12)]
- Trastornos de la tiroides [ver Advertencias y precauciones (5.13)]
- Hipersensibilidad [ver Advertencias y precauciones (5.15)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no pueden compararse directamente con las tasas de los ensayos clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica.
MM de diagnóstico reciente: tratamiento combinado con cápsulas de lenalidomida:
Se evaluaron los datos de 1613 pacientes en un estudio amplio de fase 3 que recibieron al menos una dosis de cápsulas de lenalidomida con dosis bajas de dexametasona (Rd) administradas durante 2 periodos de tiempo diferentes (es decir, hasta la progresión de la enfermedad [grupo Rd continuo; N=532] o hasta dieciocho ciclos de 28 días [72 semanas, grupo Rd18; N=540] o que recibieron melfalán, prednisona y talidomida [grupo MPT; N=541] durante un máximo de doce ciclos de 42 días [72 semanas]). La mediana de duración del tratamiento en el grupo Rd continuo fue de 80.2 semanas (rango de 0.7 a 246.7) o 18.4 meses (rango de 0.16 a 56.7).
En general, las reacciones adversas notificadas con mayor frecuencia fueron comparables en el grupo Rd continuo y el grupo Rd18, e incluyeron diarrea, anemia, estreñimiento, edema periférico, neutropenia, fatiga, dolor de espalda, náuseas, astenia e insomnio. Las reacciones de grado 3 o 4 notificadas con mayor frecuencia incluyeron neutropenia, anemia, trombocitopenia, neumonía, astenia, fatiga, dolor de espalda, hipopotasemia, erupción cutánea, cataratas, linfopenia, disnea, TVP, hiperglucemia y leucopenia. La mayor frecuencia de infecciones se produjo en el grupo Rd continuo (75%) en comparación con el grupo MPT (56%). Hubo más reacciones adversas graves y de grado 3 y 4 de infección en el grupo Rd continuo que en el grupo MPT o Rd18.
En el grupo Rd continuo, las reacciones adversas más frecuentes que provocaron la interrupción de la administración de las cápsulas de lenalidomida fueron los episodios de infección (28.8%); en general, la mediana de tiempo hasta la primera interrupción de la administración de las cápsulas de lenalidomida fue de 7 semanas. Las reacciones adversas más frecuentes que provocaron la reducción de la dosis de las cápsulas de lenalidomida en el grupo Rd continuo fueron los episodios hematológicos (10.7%); en general, la mediana de tiempo hasta la primera reducción de la dosis de las cápsulas de lenalidomida fue de 16 semanas. En el grupo Rd continuo, las reacciones adversas más frecuentes que provocaron la suspensión de las cápsulas de lenalidomida fueron los episodios de infección (3.4%).
En ambos grupos de Rd, las frecuencias de aparición de reacciones adversas fueron generalmente más altas en los primeros 6 meses de tratamiento y luego las frecuencias disminuyeron con el tiempo o se mantuvieron estables durante todo el tratamiento, excepto para las cataratas. La frecuencia de aparición de cataratas aumentó con el tiempo, con un 0.7% durante los primeros 6 meses y hasta un 9.6% en el segundo año de tratamiento con Rd continuo.
En la Tabla 4 se resumen las reacciones adversas notificadas para los grupos de tratamiento Rd continuo, Rd18 y MPT.
| Nota: Un sujeto con múltiples apariciones de una reacción adversa se cuenta solo una vez en el Sistema corporal/reacción adversa correspondiente. a Todos los eventos adversos emergentes del tratamiento en al menos el 5 % de los sujetos en los grupos de Rd continuo o Rd18 y al menos una frecuencia un 2 % mayor (%) en los grupos de Rd continuo o Rd18 en comparación con el grupo de MPT. b Todos los eventos adversos emergentes del tratamiento de grado 3 o 4 en al menos el 1 % de los sujetos en los grupos de Rd continuo o Rd18 y al menos una frecuencia un 1 % mayor (%) en los grupos de Rd continuo o Rd18 en comparación con el grupo de MPT. c Eventos adversos graves emergentes del tratamiento en al menos el 1 % de los sujetos en los grupos de Rd continuo o Rd18 y al menos una frecuencia un 1 % mayor (%) en los grupos de Rd continuo o Rd18 en comparación con el grupo de MPT. d Los términos preferidos para el sistema corporal de trastornos sanguíneos y del sistema linfático se incluyeron por criterio médico como reacciones adversas conocidas para Rd continuo/Rd18, y también se han notificado como graves. e La nota al pie “a” no es aplicable. f La nota al pie “b” no es aplicable. @ – reacciones adversas en las que al menos una tuvo un desenlace mortal. % – reacciones adversas en las que al menos una se consideró potencialmente mortal (si el resultado de la reacción fue la muerte, se incluye en los casos de muerte). *Reacciones adversas incluidas en los términos de reacciones adversas combinadas: Dolor abdominal: Dolor abdominal, dolor abdominal superior, dolor abdominal inferior, dolor gastrointestinal Neumonías: Neumonía, neumonía lobular, neumonía neumocócica, bronconeumonía, neumonía por Pneumocystis jiroveci, neumonía por legionela, neumonía estafilocócica, neumonía por klebsiella, neumonía atípica, neumonía bacteriana, neumonía por escherichia, neumonía estreptocócica, neumonía vírica Sepsis: Sepsis, choque séptico, urosepsis, sepsis por escherichia, sepsis neutropénica, sepsis neumocócica, sepsis estafilocócica, sepsis bacteriana, sepsis meningocócica, sepsis enterocócica, sepsis por klebsiella, sepsis por pseudomonas Erupción cutánea: Erupción cutánea, erupción cutánea pruriginosa, erupción cutánea eritematosa, erupción cutánea maculopapular, erupción cutánea generalizada, erupción cutánea papular, erupción cutánea exfoliativa, erupción cutánea folicular, erupción cutánea macular, erupción cutánea por fármacos con eosinofilia y síntomas sistémicos, eritema multiforme, erupción cutánea pustular Trombosis venosa profunda: Trombosis venosa profunda, trombosis venosa de las extremidades, trombosis venosa |
||||||
|
Sistema corporal |
Todas las reacciones adversasa |
Reacciones adversas de grado 3/4b |
||||
|
Rd continuo |
Rd18 |
MPT |
Rd continuo |
Rd18 |
MPT |
|
|
Trastornos generales y afecciones en el lugar de administración |
||||||
|
Fatiga% |
173 (33) |
177 (33) |
154 (28) |
39 (7) |
46 (9) |
31 (6) |
|
Astenia |
150 (28) |
123 (23) |
124 (23) |
41 (8) |
33 (6) |
32 (6) |
|
Pirexiac |
114 (21) |
102 (19) |
76 (14) |
13 (2) |
7 (1) |
7 (1) |
|
Dolor torácico no cardíaco f |
29 (5) |
31 (6) |
18 (3) |
<1% |
< 1% |
< 1% |
|
Trastornos gastrointestinales |
||||||
|
Diarrea |
242 (45) |
208 (39) |
89 (16) |
21 (4) |
18 (3) |
8 (1) |
|
Dolor abdominal% f |
109 (20) |
78 (14) |
60 (11) |
7 (1) |
9 (2) |
< 1% |
|
Dispepsia f |
57 (11) |
28 (5) |
36 (7) |
<1% |
< 1% |
0 (0) |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
||||||
|
Dorsalgiac |
170 (32) |
145 (27) |
116 (21) |
37 (7) |
34 (6) |
28 (5) |
|
Espasmos musculares f |
109 (20) |
102 (19) |
61 (11) |
< 1% |
< 1% |
< 1% |
|
Artralgia f |
101 (19) |
71 (13) |
66 (12) |
9 (2) |
8 (1) |
8 (1) |
|
Dolor óseo f |
87 (16) |
77 (14) |
62 (11) |
16 (3) |
15 (3) |
14 (3) |
|
Dolor en las extremidades f |
79 (15) |
66 (12) |
61 (11) |
8 (2) |
8 (1) |
7 (1) |
|
Dolor musculoesquelético f |
67 (13) |
59 (11) |
36 (7) |
< 1% |
< 1% |
< 1% |
|
Dolor torácico musculoesquelético f |
60 (11) |
51 (9) |
39 (7) |
6 (1) |
< 1% |
< 1% |
|
Debilidad muscular f |
43 (8) |
35 (6) |
29 (5) |
< 1% |
8 (1) |
< 1% |
|
Dolor de cuello f |
40 (8) |
19 (4) |
10 (2) |
< 1% |
< 1% |
< 1% |
|
Infecciones e infestaciones |
||||||
|
Bronquitisc |
90 (17) |
59 (11) |
43 (8) |
9 (2) |
6 (1) |
< 1% |
|
Nasofaringitis f |
80 (15) |
54 (10) |
33 (6) |
0 (0) |
0 (0) |
0 (0) |
|
Infección del tracto urinario f |
76 (14) |
63 (12) |
41 (8) |
8 (2) |
8 (1) |
< 1% |
|
Infección de las vías respiratorias superioresc% f |
69 (13) |
53 (10) |
31 (6) |
< 1% |
8 (1) |
< 1% |
|
Neumoníac@ |
93 (17) |
87 (16) |
56 (10) |
60 (11) |
57 (11) |
41 (8) |
|
Infección del tracto respiratorio% |
35 (7) |
25 (5) |
21 (4) |
7 (1) |
< 1% |
< 1% |
|
Gripe f |
33 (6) |
23 (4) |
15 (3) |
< 1% |
< 1% |
0 (0) |
|
Gastroenteritis f |
32 (6) |
17 (3) |
13 (2) |
0 (0) |
< 1% |
< 1% |
|
Lower respiratory tract infection |
29 (5) |
14 (3) |
16 (3) |
10 (2) |
< 1% |
< 1% |
|
Rinitis f |
29 (5) |
24 (4) |
14 (3) |
0 (0) |
0 (0) |
0 (0) |
|
Celulitisc |
< 5% |
< 5% |
< 5% |
8 (2) |
< 1% |
< 1% |
|
Sepsisc@ |
33 (6) |
26 (5) |
18 (3) |
26 (5) |
20 (4) |
13 (2) |
|
Trastornos del sistema nervioso |
||||||
|
Dolor de cabeza f |
75 (14) |
52 (10) |
56 (10) |
< 1% |
< 1% |
< 1% |
|
Disgeusia f |
39 (7) |
45 (8) |
22 (4) |
< 1% |
0 (0.0) |
< 1% |
|
Trastornos de la sangre y del sistema linfáticod |
||||||
|
Anemia |
233 (44) |
193 (36) |
229 (42) |
97 (18) |
85 (16) |
102 (19) |
|
Neutropenia |
186 (35) |
178 (33) |
328 (61) |
148 (28) |
143 (26) |
243 (45) |
|
Trombocitopenia |
104 (20) |
100 (19) |
135 (25) |
44 (8) |
43 (8) |
60 (11) |
|
Neutropenia febril |
7 (1) |
17 (3) |
15 (3) |
6 (1) |
16 (3) |
14 (3) |
|
Pancitopenia |
< 1% |
6 (1) |
7 (1) |
< 1% |
< 1% |
< 1% |
|
Trastornos respiratorios, torácicos y mediastínicos |
||||||
|
Tos f |
121 (23) |
94 (17) |
68 (13) |
< 1% |
< 1% |
< 1% |
|
Disneac,e |
117 (22) |
89 (16) |
113 (21) |
30 (6) |
22 (4) |
18 (3) |
|
Epistaxis f |
32 (6) |
31 (6) |
17 (3) |
< 1% |
< 1% |
0 (0) |
|
Dolor orofaríngeo f |
30 (6) |
22 (4) |
14 (3) |
0 (0) |
0 (0) |
0 (0) |
|
Disnea de esfuerzo e |
27 (5) |
29 (5) |
< 5% |
6 (1) |
< 1% |
0 (0) |
|
Trastornos del metabolismo y de la nutrición |
||||||
|
Disminución del apetito |
123 (23) |
115 (21) |
72 (13) |
14 (3) |
7 (1) |
< 1% |
|
Hipocalemia% |
91 (17) |
62 (11) |
38 (7) |
35 (7) |
20 (4) |
11 (2) |
|
Hiperglucemia |
62 (12) |
52 (10) |
19 (4) |
28 (5) |
23 (4) |
9 (2) |
|
Hipocalcemia |
57 (11) |
56 (10) |
31 (6) |
23 (4) |
19 (4) |
8 (1) |
|
Deshidratación% |
25 (5) |
29 (5) |
17 (3) |
8 (2) |
13 (2) |
9 (2) |
|
Gota e |
< 5% |
< 5% |
< 5% |
8 (2) |
0 (0) |
0 (0) |
|
Diabetes mellitus% e |
< 5% |
< 5% |
< 5% |
8 (2) |
< 1% |
< 1% |
|
Hypophosphatemia e |
< 5% |
< 5% |
< 5% |
7 (1) |
< 1% |
< 1% |
|
Hiponatremia% e |
< 5% |
< 5% |
< 5% |
7 (1) |
13 (2) |
6 (1) |
|
Trastornos de la piel y del tejido subcutáneo |
||||||
|
Erupción cutánea |
139 (26) |
151 (28) |
105 (19) |
39 (7) |
38 (7) |
33 (6) |
|
Prurito f |
47 (9) |
49 (9) |
24 (4) |
< 1% |
< 1% |
< 1% |
|
Trastornos psiquiátricos |
||||||
|
Insomnio |
147 (28) |
127 (24) |
53 (10) |
< 1% |
6 (1) |
0 (0) |
|
Depresión |
58 (11) |
46 (9) |
30 (6) |
10 (2) |
< 1% |
< 1% |
|
Trastornos vasculares |
||||||
|
Deep vein thrombosisc% |
55 (10) |
39 (7) |
22 (4) |
30 (6) |
20 (4) |
15 (3) |
|
Hipotensiónc% |
51 (10) |
35 (6) |
36 (7) |
11 (2) |
8 (1) |
6 (1) |
|
Lesiones, intoxicaciones y complicaciones de procedimientos |
||||||
|
Caída f |
43 (8) |
25 (5) |
25 (5) |
< 1% |
6 (1) |
6 (1) |
|
Contusión f |
33 (6) |
24 (4) |
15 (3) |
< 1% |
< 1% |
0 (0) |
|
Trastornos oculares |
||||||
|
Catarata |
73 (14) |
31 ( 6) |
< 1% |
31 ( 6) |
14 ( 3) |
< 1% |
|
Catarata subcapsular e |
< 5% |
< 5% |
< 5% |
7 ( 1) |
0 ( 0) |
0 ( 0) |
|
Investigaciones |
||||||
|
Pérdida de peso |
72 (14) |
78 (14) |
48 (9) |
11 (2) |
< 1% |
< 1% |
|
Trastornos cardíacos |
||||||
|
Fibrilación auricularc |
37 (7) |
25 (5) |
25 (5) |
13 (2) |
9 (2) |
6 (1) |
|
Infarto de miocardio (incluido agudo)c ,e |
< 5% |
< 5% |
< 5% |
10 (2) |
< 1% |
< 1% |
|
Trastornos renales y urinarios |
||||||
|
Insuficiencia renal (incluida aguda)c@,f |
49 (9) |
54 (10) |
37 (7) |
28 (5) |
33 (6) |
29 (5) |
|
Neoplasias benignas, malignas y no especificadas (incluidos quistes y pólipos) |
||||||
|
Carcinoma de células escamosasc e |
< 5% |
< 5% |
< 5% |
8 (2) |
< 1% |
0 (0) |
|
Carcinoma basocelularc e,f |
< 5% |
< 5% |
< 5% |
< 1% |
< 1% |
0 (0) |
Después de al menos un tratamiento previo para el MM:
Se evaluaron los datos de 703 pacientes en dos estudios que recibieron al menos una dosis de lenalidomida/dexametasona (353 pacientes) o placebo/dexametasona (350 pacientes).
En el grupo de tratamiento con lenalidomida/dexametasona, 269 pacientes (76%) tuvieron al menos una interrupción de la dosis con o sin una reducción de la dosis de lenalidomida en comparación con 199 pacientes (57%) en el grupo de tratamiento con placebo/dexametasona. De estos pacientes que tuvieron una interrupción de la dosis con o sin una reducción de la dosis, el 50% en el grupo de tratamiento con lenalidomida/dexametasona tuvo al menos una interrupción de la dosis adicional con o sin una reducción de la dosis en comparación con el 21% en el grupo de tratamiento con placebo/dexametasona. La mayoría de las reacciones adversas y las reacciones adversas de Grado 3/4 fueron más frecuentes en los pacientes que recibieron la combinación de lenalidomida/dexametasona en comparación con placebo/dexametasona.
Las Tablas 6, 7 y 8 resumen las reacciones adversas notificadas para los grupos de lenalidomida/dexametasona y placebo/dexametasona.
| Sistema corporal Reacción adversa |
Lenalidomida/Dex (N=353) n (%) |
Placebo/Dex (N=350) n (%) |
|---|---|---|
| Trastornos de la sangre y del sistema linfático | ||
| Neutropenia * | 149 (42) | 22 (6) |
| Anemia † | 111 (31) | 83 (24) |
| Trombocitopenia † | 76 (22) | 37 (11) |
| Leucopenia | 28 (8) | 4 (1) |
| Linfopenia | 19 (5) | 5 (1) |
| Trastornos generales y afecciones en el lugar de administración | ||
| Fatiga | 155 (44) | 146 (42) |
| Pirexia | 97 (27) | 82 (23) |
| Edema periférico | 93 (26) | 74 (21) |
| Dolor torácico | 29 (8) | 20 (6) |
| Letargo | 24 (7) | 8 (2) |
| Trastornos gastrointestinales | ||
| Estreñimiento | 143 (41) | 74 (21) |
| Diarrea † | 136 (39) | 96 (27) |
| Náuseas † | 92 (26) | 75 (21) |
| Vómitos † | 43 (12) | 33 (9) |
| Dolor abdominal † | 35 (10) | 22 (6) |
| Sequedad de boca | 25 (7) | 13 (4) |
| Trastornos musculoesqueléticos y del tejido conjuntivo | ||
| Calambres musculares | 118 (33) | 74 (21) |
| Dolor de espalda | 91 (26) | 65 (19) |
| Dolor óseo | 48 (14) | 39 (11) |
| Dolor en las extremidades | 42 (12) | 32 (9) |
| Trastornos del sistema nervioso | ||
| Mareos | 82 (23) | 59 (17) |
| Temblor | 75 (21) | 26 (7) |
| Disgeusia | 54 (15) | 34 (10) |
| Hipoestesia | 36 (10) | 25 (7) |
| Neuropatíaa | 23 (7) | 13 (4) |
| Trastornos respiratorios, torácicos y mediastínicos | ||
| Disnea | 83 (24) | 60 (17) |
| Nasofaringitis | 62 (18) | 31 (9) |
| Faringitis | 48 (14) | 33 (9) |
| Bronquitis | 40 (11) | 30 (9) |
| Infeccionesb e infestaciones | ||
| Infección de las vías respiratorias altas | 87 (25) | 55 (16) |
| Neumonía † | 48 (14) | 29 (8) |
| Infección del tracto urinario | 30 (8) | 19 (5) |
| Sinusitis | 26 (7) | 16 (5) |
| Trastornos de la piel y del tejido subcutáneo | ||
| Erupción cutáneac | 75 (21) | 33 (9) |
| Sudoración aumentada | 35 (10) | 25 (7) |
| Piel seca | 33 (9) | 14 (4) |
| Prurito | 27 (8) | 18 (5) |
| Trastornos del metabolismo y de la nutrición | ||
| Anorexia | 55 (16) | 34 (10) |
| Hipocalemia | 48 (14) | 21 (6) |
| Hipocalcemia | 31 (9) | 10 (3) |
| Disminución del apetito | 24 (7) | 14 (4) |
| Deshidratación | 23 (7) | 15 (4) |
| Hipomagnesemia | 24 (7) | 10 (3) |
| Investigaciones | ||
| Pérdida de peso | 69 (20) | 52 (15) |
| Trastornos oculares | ||
| Visión borrosa | 61 (17) | 40 (11) |
| Trastornos vasculares | ||
| Trombosis venosa profunda * | 33 (9) | 15 (4) |
| Hipertensión | 28 (8) | 20 (6) |
| Hipotensión | 25 (7) | 15 (4) |
| Sistema corporal Reacción adversa |
Lenalidomida/Dex (N=353) n (%) |
Placebo/Dex (N=350) n (%) |
|---|---|---|
| Trastornos de la sangre y del sistema linfático | ||
| Neutropenia * | 118 (33) | 12 (3) |
| Trombocitopenia † | 43 (12) | 22 (6) |
| Anemia † | 35 (10) | 20 (6) |
| Leucopenia | 14 (4) | < 1% |
| Linfopenia | 10 (3) | 4 (1) |
| Neutropenia febril * | 8 (2) | 0 (0) |
| Trastornos generales y alteraciones en el lugar de administración | ||
| Fatiga | 23 (7) | 17 (5) |
| Trastornos vasculares | ||
| Trombosis venosa profunda * | 29 (8) | 12 (3) |
| Infecciones e infestaciones | ||
| Neumonía † | 30 (8) | 19 (5) |
| Infección de las vías urinarias | 5 (1) | < 1% |
| Trastornos del metabolismo y de la nutrición | ||
| Hipopotasemia | 17 (5) | 5 (1) |
| Hipocalcemia | 13 (4) | 6 (2) |
| Hipofosfatemia | 9 (3) | 0 (0) |
| Trastornos respiratorios, torácicos y mediastínicos | ||
| Embolia pulmonar † | 14 (4) | < 1% |
| Dificultad respiratoria † | 4 (1) | 0 (0) |
| Trastornos musculoesqueléticos y del tejido conjuntivo | ||
| Debilidad muscular | 20 (6) | 10 (3) |
| Trastornos gastrointestinales | ||
| Diarrea † | 11 (3) | 4 (1) |
| Estreñimiento | 7 (2) | < 1% |
| Náuseas † | 6 (2) | < 1% |
| Trastornos cardíacos | ||
| Fibrilación auricular † | 13 (4) | 4 (1) |
| Taquicardia | 6 (2) | < 1% |
| Insuficiencia cardíaca congestiva † | 5 (1) | < 1% |
| Trastornos del sistema nervioso | ||
| Síncope | 10 (3) | < 1% |
| Mareos | 7 (2) | < 1% |
| Trastornos oculares | ||
| Catarata | 6 (2) | < 1% |
| Catarata unilateral | 5 (1) | 0 (0) |
| Trastorno psiquiátrico | ||
| Depresión | 10 (3) | 6 (2) |
| Sistema corporal Reacción adversa |
Lenalidomida/Dex (N=353) n (%) |
Placebo/Dex (N=350) n (%) |
|---|---|---|
| Para las tablas 6, 7 y 8 anteriores: | ||
| Trastornos de la sangre y del sistema linfático | ||
| Neutropenia febril* | 6 (2) | 0 (0) |
| Trastornos vasculares | ||
| Trombosis venosa profunda * | 26 (7) | 11 (3) |
| Infecciones e infestaciones | ||
| Neumonía† | 33 (9) | 21 (6) |
| Trastornos respiratorios, torácicos y mediastínicos | ||
| Embolia pulmonar † | 13 (4) | < 1% |
| Trastornos cardíacos | ||
| Fibrilación auricular † | 11 (3) | < 1% |
| Insuficiencia cardíaca congestiva † | 5 (1) | 0 (0) |
| Trastornos del sistema nervioso | ||
| Accidente cerebrovascular † | 7 (2) | < 1% |
| Trastornos gastrointestinales | ||
| Diarrea † | 6 (2) | < 1% |
| Trastornos musculoesqueléticos y del tejido conjuntivo | ||
| Dolor óseo | 4 (1) | 0 (0) |
La mediana de duración de la exposición entre los pacientes tratados con lenalidomida/dexametasona fue de 44 semanas, mientras que la mediana de duración de la exposición entre los pacientes tratados con placebo/dexametasona fue de 23 semanas. Esto se debe tener en cuenta al comparar la frecuencia de reacciones adversas entre los dos grupos de tratamiento con lenalidomida/dexametasona frente a placebo/dexametasona.
Tromboembolia venosa y arterial [ver Recuadro de advertencia, Advertencias y precauciones (5.4)]
La TEV y la TEA aumentan en pacientes tratados con cápsulas de lenalidomida.
La trombosis venosa profunda (TVP) se notificó como una reacción adversa grave (7,4 %) o intensa (8,2 %) con una tasa mayor en el grupo de lenalidomida/dexametasona en comparación con el 3,1 % y el 3,4 % en el grupo de placebo/dexametasona, respectivamente, en los 2 estudios en pacientes con al menos 1 tratamiento previo con interrupciones debido a reacciones adversas de TVP notificadas con tasas comparables entre los grupos. En el estudio NDMM, la TVP se notificó como una reacción adversa (todos los grados: 10,3 %, 7,2 %, 4,1 %), como una reacción adversa grave (3,6 %, 2,0 %, 1,7 %) y como una reacción adversa de grado 3/4 (5,6 %, 3,7 %, 2,8 %) en los grupos de tratamiento continuo con lenalidomida, lenalidomida durante 18 ciclos y tratamiento de mantenimiento con melfalán, prednisona y talidomida, respectivamente. Las interrupciones y reducciones de la dosis debido a reacciones adversas de TVP se notificaron con tasas comparables entre los grupos de tratamiento continuo con lenalidomida y lenalidomida durante 18 ciclos (ambos <1 %). La interrupción del tratamiento con cápsulas de lenalidomida debido a reacciones adversas de TVP se notificó con tasas comparables entre los grupos de tratamiento continuo con lenalidomida (2,3 %) y lenalidomida durante 18 ciclos (1,5 %). La embolia pulmonar (EP) se notificó como una reacción adversa grave (3,7 %) o de grado 3/4 (4,0 %) con una tasa mayor en el grupo de lenalidomida/dexametasona en comparación con el 0,9 % (grave o de grado 3/4) en el grupo de placebo/dexametasona en los 2 estudios en pacientes con al menos 1 tratamiento previo, con interrupciones debido a reacciones adversas de EP notificadas con tasas comparables entre los grupos. En el estudio NDMM, la frecuencia de reacciones adversas de EP fue similar entre los grupos de tratamiento continuo con lenalidomida, lenalidomida durante 18 ciclos y tratamiento de mantenimiento con melfalán, prednisona y talidomida para las reacciones adversas (todos los grados: 3,9 %, 3,3 % y 4,3 %, respectivamente), las reacciones adversas graves (3,8 %, 2,8 % y 3,7 %, respectivamente) y las reacciones adversas de grado 3/4 (3,8 %, 3,0 % y 3,7 %, respectivamente).
El infarto de miocardio se notificó como una reacción adversa grave (1,7 %) o intensa (1,7 %) con una tasa mayor en el grupo de lenalidomida/dexametasona en comparación con el 0,6 % y el 0,6 %, respectivamente, en el grupo de placebo/dexametasona. La interrupción debido a reacciones adversas de IM (incluido el agudo) fue del 0,8 % en el grupo de lenalidomida/dexametasona y ninguna en el grupo de placebo/dexametasona. En el estudio NDMM, el infarto de miocardio (incluido el agudo) se notificó como una reacción adversa (todos los grados: 2,4 %, 0,6 % y 1,1 %), como una reacción adversa grave (2,3 %, 0,6 % y 1,1 %) o como una reacción adversa intensa (1,9 %, 0,6 % y 0,9 %) en los grupos de tratamiento continuo con lenalidomida, lenalidomida durante 18 ciclos y tratamiento de mantenimiento con melfalán, prednisona y talidomida, respectivamente.
El accidente cerebrovascular (ACV) se notificó como una reacción adversa grave (2,3 %) o intensa (2,0 %) en el grupo de lenalidomida/dexametasona en comparación con el 0,9 % y el 0,9 %, respectivamente, en el grupo de placebo/dexametasona. La interrupción debido a un accidente cerebrovascular (ACV) fue del 1,4 % en el grupo de lenalidomida/dexametasona y del 0,3 % en el grupo de placebo/dexametasona. En el estudio NDMM, el ACV se notificó como una reacción adversa (todos los grados: 0,8 %, 0,6 % y 0,6 %), como una reacción adversa grave (0,8 %, 0,6 % y 0,6 %) o como una reacción adversa intensa (0,6 %, 0,6 %, 0,2 %) en los grupos de tratamiento continuo con lenalidomida, lenalidomida durante 18 ciclos y tratamiento de mantenimiento con melfalán, prednisona y talidomida, respectivamente.
Otras reacciones adversas: después de al menos un tratamiento previo para el MM
En estos 2 estudios, se notificaron las siguientes reacciones adversas a medicamentos (RAM) no descritas anteriormente que ocurrieron con una tasa ≥1 % y de al menos el doble de la tasa porcentual del placebo:
Trastornos de la sangre y del sistema linfático: pancitopenia, anemia hemolítica autoinmune
Trastornos cardíacos: bradicardia, infarto de miocardio, angina de pecho
Trastornos endocrinos: hirsutismo
Trastornos oculares: ceguera, hipertensión ocular
Trastornos gastrointestinales: hemorragia gastrointestinal, glosodinia
Trastornos generales y condiciones en el sitio de administración: malestar
Investigaciones: pruebas de función hepática anormales, aumento de la alanina aminotransferasa
Trastornos del sistema nervioso: isquemia cerebral
Trastornos psiquiátricos: cambios de humor, alucinaciones, pérdida de la libido
Trastornos del sistema reproductor y de la mama: disfunción eréctil
Trastornos respiratorios, torácicos y mediastínicos: tos, ronquera
Trastornos de la piel y del tejido subcutáneo: exantema, hiperpigmentación cutánea
Síndromes mielodisplásicos:
Un total de 148 pacientes recibieron al menos 1 dosis de 10 mg de cápsulas de lenalidomida en el estudio clínico de SMD con deleción 5q. Se notificó al menos una reacción adversa en todos los 148 pacientes que fueron tratados con la dosis inicial de 10 mg de cápsulas de lenalidomida. Las reacciones adversas notificadas con mayor frecuencia estuvieron relacionadas con trastornos de la sangre y del sistema linfático, trastornos de la piel y del tejido subcutáneo, trastornos gastrointestinales y trastornos generales y condiciones en el sitio de administración.
La trombocitopenia (61,5 %; 91/148) y la neutropenia (58,8 %; 87/148) fueron las reacciones adversas notificadas con mayor frecuencia. Las siguientes reacciones adversas más comunes observadas fueron diarrea (48,6 %; 72/148), prurito (41,9 %; 62/148), erupción cutánea (35,8 %; 53/148) y fatiga (31,1 %; 46/148). La Tabla 9 resume las reacciones adversas que se notificaron en ≥ 5 % de los pacientes tratados con cápsulas de lenalidomida en el estudio clínico de SMD con deleción 5q. La Tabla 10 resume las reacciones adversas de grado 3 y grado 4 observadas con mayor frecuencia, independientemente de la relación con el tratamiento con cápsulas de lenalidomida. En los estudios de un solo grupo realizados, a menudo no es posible distinguir las reacciones adversas que están relacionadas con el medicamento y las que reflejan la enfermedad subyacente del paciente.
| Sistema corporal Reacción adversa * |
10 mg en general (N=148) |
|---|---|
|
|
| Pacientes con al menos una reacción adversa | 148 (100) |
| Trastornos de la sangre y del sistema linfático | |
| Trombocitopenia | 91 (61) |
| Neutropenia | 87 (59) |
| Anemia | 17 (11) |
| Leucopenia | 12 (8) |
| Neutropenia febril | 8 (5) |
| Trastornos de la piel y del tejido subcutáneo | |
| Prurito | 62 (42) |
| Erupción cutánea | 53 (36) |
| Piel seca | 21 (14) |
| Contusión | 12 (8) |
| Sudores nocturnos | 12 (8) |
| Aumento de la sudoración | 10 (7) |
| Equimosis | 8 (5) |
| Eritema | 8 (5) |
| Trastornos gastrointestinales | |
| Diarrea | 72 (49) |
| Estreñimiento | 35 (24) |
| Náuseas | 35 (24) |
| Dolor abdominal | 18 (12) |
| Vómitos | 15 (10) |
| Dolor abdominal superior | 12 (8) |
| Sequedad de boca | 10 (7) |
| Heces blandas | 9 (6) |
| Trastornos respiratorios, torácicos y mediastínicos | |
| Nasofaringitis | 34 (23) |
| Tos | 29 (20) |
| Disnea | 25 (17) |
| Faringitis | 23 (16) |
| Epistaxis | 22 (15) |
| Disnea de esfuerzo | 10 (7) |
| Rinitis | 10 (7) |
| Bronquitis | 9 (6) |
| Trastornos generales y alteraciones en el lugar de administración | |
| Fatiga | 46 (31) |
| Pirexia | 31 (21) |
| Edema periférico | 30 (20) |
| Astenia | 22 (15) |
| Edema | 15 (10) |
| Dolor | 10 (7) |
| Rigidez | 9 (6) |
| Dolor de pecho | 8 (5) |
| Trastornos musculoesqueléticos y del tejido conjuntivo | |
| Artralgia | 32 (22) |
| Dolor de espalda | 31 (21) |
| Calambres musculares | 27 (18) |
| Dolor en las extremidades | 16 (11) |
| Mialgia | 13 (9) |
| Hinchazón periférica | 12 (8) |
| Trastornos del sistema nervioso | |
| Mareos | 29 (20) |
| Cefalea | 29 (20) |
| Hipoestesia | 10 (7) |
| Disgeusia | 9 (6) |
| Neuropatía periférica | 8 (5) |
| Infecciones e infestaciones | |
| Infección de las vías respiratorias superiores | 22 (15) |
| Neumonía | 17 (11) |
| Infección del tracto urinario | 16 (11) |
| Sinusitis | 12 (8) |
| Celulitis | 8 (5) |
| Trastornos del metabolismo y de la nutrición | |
| Hypokalemia | 16 (11) |
| Anorexia | 15 (10) |
| Hypomagnesemia | 9 (6) |
| Investigaciones | |
| Alanine Aminotransferase Increased | 12 (8) |
| Trastornos psiquiátricos | |
| Insomnia | 15 (10) |
| Depresión | 8 (5) |
| Trastornos renales y urinarios | |
| Disuria | 10 (7) |
| Trastornos vasculares | |
| Hipertensión | 9 (6) |
| Trastornos endocrinos | |
| Acquired Hypothyroidism | 10 (7) |
| Trastornos cardíacos | |
| Palpitaciones | 8 (5) |
| Reacciones adversas † | 10 mg (N=148) |
|---|---|
|
|
| Pacientes con al menos un EA de grado 3/4 | 131 (89) |
| Neutropenia | 79 (53) |
| Trombocitopenia | 74 (50) |
| Neumonía | 11 (7) |
| Erupción cutánea | 10 (7) |
| Anemia | 9 (6) |
| Leucopenia | 8 (5) |
| Fatiga | 7 (5) |
| Disnea | 7 (5) |
| Dorsalgia | 7 (5) |
| Neutropenia febril | 6 (4) |
| Náuseas | 6 (4) |
| Diarrea | 5 (3) |
| Pirexia | 5 (3) |
| Sepsis | 4 (3) |
| Mareos | 4 (3) |
| Granulocitopenia | 3 (2) |
| Dolor torácico | 3 (2) |
| Embolia pulmonar | 3 (2) |
| Dificultad respiratoria | 3 (2) |
| Prurito | 3 (2) |
| Pancitopenia | 3 (2) |
| Calambres musculares | 3 (2) |
| Infección de las vías respiratorias | 2 (1) |
| Infección de las vías respiratorias altas | 2 (1) |
| Astenia | 2 (1) |
| Fallo multiorgánico | 2 (1) |
| Epistaxis | 2 (1) |
| Hipoxia | 2 (1) |
| Derrame pleural | 2 (1) |
| Neumonitis | 2 (1) |
| Hipertensión pulmonar | 2 (1) |
| Vómitos | 2 (1) |
| Sudoración aumentada | 2 (1) |
| Artralgia | 2 (1) |
| Dolor en las extremidades | 2 (1) |
| Cefalea | 2 (1) |
| Síncope | 2 (1) |
En otros estudios clínicos de cápsulas de lenalidomida en pacientes con SMD, se notificaron las siguientes reacciones adversas graves (independientemente de la relación con el tratamiento del fármaco del estudio) que no se describen en la Tabla 9 o 10:
Trastornos de la sangre y del sistema linfático: anemia hemolítica de tipo caliente, infarto esplénico, depresión de la médula ósea, coagulopatía, hemólisis, anemia hemolítica, anemia refractaria
Trastornos cardíacos: insuficiencia cardíaca congestiva, fibrilación auricular, angina de pecho, paro cardíaco, insuficiencia cardíaca, paro cardiorrespiratorio, miocardiopatía, infarto de miocardio, isquemia miocárdica, fibrilación auricular agravada, bradicardia, shock cardiogénico, edema pulmonar, arritmia supraventricular, taquiarritmia, disfunción ventricular
Trastornos del oído y del laberinto: vértigo
Trastornos endocrinos: enfermedad de Basedow
Trastornos gastrointestinales: hemorragia gastrointestinal, colitis isquémica, perforación intestinal, hemorragia rectal, pólipo de colon, diverticulitis, disfagia, gastritis, gastroenteritis, enfermedad por reflujo gastroesofágico, hernia inguinal obstructiva, síndrome del intestino irritable, melena, pancreatitis debida a obstrucción biliar, pancreatitis, absceso perirrectal, obstrucción del intestino delgado, hemorragia gastrointestinal superior
Trastornos generales y alteraciones en el lugar de administración: progresión de la enfermedad, caída, anomalía de la marcha, pirexia intermitente, nódulo, rigidez, muerte súbita
Trastornos hepatobiliares: hiperbilirrubinemia, colecistitis, colecistitis aguda, insuficiencia hepática
Trastornos del sistema inmunitario: hipersensibilidad
Infecciones e infestaciones: infección bacteriana, infección de la vía central, infección por clostridios, infección de oído, sepsis por Enterobacter, infección fúngica, infección por virus del herpes NOS, gripe, infección renal, sepsis por Klebsiella, neumonía lobular, infección localizada, infección oral, infección por Pseudomonas, shock séptico, sinusitis aguda, sinusitis, infección por Staphylococcal, urosepsis
Lesiones, intoxicaciones y complicaciones de procedimientos: fractura de fémur, reacción a la transfusión, fractura de vértebra cervical, fractura de cuello de fémur, fractura de pelvis, fractura de cadera, sobredosis, hemorragia posterior al procedimiento, fractura de costilla, accidente de tráfico, fractura por compresión espinal
Investigaciones: aumento de la creatinina en sangre, disminución de la hemoglobina, pruebas de función hepática anormales, aumento de la troponina I
Trastornos del metabolismo y de la nutrición: deshidratación, gota, hipernatremia, hipoglucemia
Trastornos musculoesqueléticos y del tejido conjuntivo: artritis, artritis agravada, artritis gotosa, dolor de cuello, condrocalcinosis por pirofosfato
Neoplasias benignas, malignas y no especificadas: leucemia aguda, leucemia mieloide aguda, carcinoma bronco alveolar, cáncer de pulmón metastásico, linfoma, cáncer de próstata metastásico
Trastornos del sistema nervioso: accidente cerebrovascular, afasia, infarto cerebeloso, infarto cerebral, nivel de conciencia deprimido, disartria, migraña, compresión de la médula espinal, hemorragia subaracnoidea, ataque isquémico transitorio
Trastornos psiquiátricos: estado confusional
Trastornos renales y urinarios: insuficiencia renal, hematuria, insuficiencia renal aguda, azotemia, cálculo ureteral, masa renal
Trastornos del aparato reproductor y de la mama: dolor pélvico
Trastornos respiratorios, torácicos y mediastínicos: bronquitis, enfermedad pulmonar obstructiva crónica exacerbada, insuficiencia respiratoria, disnea exacerbada, enfermedad pulmonar intersticial, infiltración pulmonar, sibilancias
Trastornos de la piel y del tejido subcutáneo: dermatosis neutrofílica febril aguda
Trastornos vasculares: trombosis venosa profunda, hipotensión, trastorno aórtico, isquemia, tromboflebitis superficial, trombosis
6.2 Experiencia posterior a la comercialización
Las siguientes reacciones adversas a medicamentos se han identificado a partir de la experiencia posterior a la comercialización de las cápsulas de lenalidomida en todo el mundo. Debido a que estas reacciones se notifican voluntariamente a partir de una población de tamaño incierto, no siempre es posible estimar de forma fiable su frecuencia o establecer una relación causal con la exposición al fármaco [véase la sección de Advertencias y precauciones (5.8 a 5.11 y 5.13)].
Trastornos endocrinos: Hipotiroidismo, hipertiroidismo
Trastornos hepatobiliares: Insuficiencia hepática (incluida la muerte), hepatitis tóxica, hepatitis citolítica, hepatitis colestásica, hepatitis mixta citolítica/colestásica, pruebas de laboratorio hepáticas anormales transitorias
Trastornos del sistema inmunitario: Angioedema, anafilaxia, enfermedad aguda de injerto contra huésped (tras un trasplante hematopoyético alogénico), rechazo de un trasplante de órgano sólido
Infecciones e infestaciones: Reactivación vírica (como el virus de la hepatitis B y el herpes zóster), leucoencefalopatía multifocal progresiva (LMP)
Neoplasias benignas, malignas e inespecíficas (incluidos quistes y pólipos): Síndrome de lisis tumoral, reacción de exacerbación tumoral
Trastornos respiratorios, torácicos y mediastínicos: Neumonitis
Trastornos de la piel y del tejido subcutáneo: Síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, reacción medicamentosa con eosinofilia y síntomas sistémicos (DRESS)
7 INTERACCIONES MEDICAMENTOSAS
7.1 Digoxina
Cuando se administró digoxina junto con dosis múltiples de cápsulas de lenalidomida (10 mg/día), la Cmáx y el AUCinf de digoxina aumentaron en un 14 %. Controle periódicamente las concentraciones plasmáticas de digoxina, de acuerdo con el criterio clínico y según la práctica clínica estándar en pacientes que reciben este medicamento, durante la administración de cápsulas de lenalidomida.
7.2 Tratamientos concomitantes que pueden aumentar el riesgo de trombosis
Los agentes eritropoyéticos u otros agentes que pueden aumentar el riesgo de trombosis, como las terapias que contienen estrógenos, deben utilizarse con precaución tras realizar una evaluación beneficio-riesgo en pacientes que reciben cápsulas de lenalidomida [ver Advertencias y precauciones (5.4)].
7.3 Warfarina
La administración conjunta de dosis múltiples de cápsulas de lenalidomida (10 mg/día) con una dosis única de warfarina (25 mg) no tuvo ningún efecto sobre la farmacocinética de la lenalidomida ni de la warfarina R y S. Se observaron cambios esperados en las evaluaciones de laboratorio del TP y el INR después de la administración de warfarina, pero estos cambios no se vieron afectados por la administración conjunta de cápsulas de lenalidomida. Se desconoce si existe una interacción entre la dexametasona y la warfarina. Se recomienda un estrecho seguimiento del TP y el INR en pacientes con MM que toman warfarina de forma concomitante.
8 Uso en poblaciones específicas
8.1 Embarazo
Registro de exposición durante el embarazo
Existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a las cápsulas de lenalidomida durante el embarazo, así como en las parejas femeninas de pacientes masculinos que están expuestos a las cápsulas de lenalidomida. Este registro también se utiliza para comprender la causa raíz del embarazo. Informe cualquier sospecha de exposición fetal a las cápsulas de lenalidomida a la FDA a través del programa MedWatch al 1-800-FDA-1088 y también al Centro de llamadas REMS al 1-888-423-5436.
Resumen de riesgos
De acuerdo con el mecanismo de acción [ver Farmacología clínica (12.1)] y los hallazgos de estudios en animales [ver Datos], las cápsulas de lenalidomida pueden causar daño embriofetal cuando se administran a una mujer embarazada y están contraindicadas durante el embarazo [ver Recuadro de advertencia, Contraindicaciones (4.1), Uso en poblaciones específicas (5.1)].
Las cápsulas de lenalidomida son un análogo de la talidomida. La talidomida es un teratógeno humano que induce una alta frecuencia de defectos de nacimiento graves y potencialmente mortales, como amelia (ausencia de extremidades), focomelia (extremidades cortas), hipoplasia de los huesos, ausencia de huesos, anomalías del oído externo (incluida la anotia, la micropinna, los conductos auditivos externos pequeños o ausentes), parálisis facial, anomalías oculares (anoftalmia, microftalmia) y defectos cardíacos congénitos. También se han documentado malformaciones del tracto alimentario, del tracto urinario y genitales, y se ha informado de mortalidad en el momento del nacimiento o poco después en aproximadamente el 40% de los lactantes.
La lenalidomida causó defectos en las extremidades de tipo talidomida en crías de mono. La lenalidomida cruzó la placenta después de su administración a conejas y ratas preñadas [ver Datos]. Si se utiliza este medicamento durante el embarazo, o si la paciente queda embarazada mientras lo está tomando, debe informársele del riesgo potencial para el feto.
Si se produce un embarazo durante el tratamiento, interrumpa inmediatamente la administración del medicamento. En estas condiciones, remita a la paciente a un obstetra/ginecólogo con experiencia en toxicidad reproductiva para que la evalúe y la asesore. Informe cualquier sospecha de exposición fetal a las cápsulas de lenalidomida a la FDA a través del programa MedWatch al 1-800-FDA-1088 y también al Centro de llamadas REMS al 1-888-423-5436.
Se desconoce el riesgo de base estimado de defectos de nacimiento importantes y aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de base de defectos de nacimiento, pérdida u otros resultados adversos. El riesgo de base estimado en la población general de los Estados Unidos de defectos de nacimiento importantes es del 2% al 4% y de aborto espontáneo es del 15% al 20% de los embarazos clínicamente reconocidos.
Datos
Datos en animales
En un estudio de toxicidad para el desarrollo embriofetal en monos, se produjo teratogenicidad, incluidos defectos en las extremidades similares a los de la talidomida, en las crías cuando las monas preñadas recibieron lenalidomida oral durante la organogénesis. La exposición (AUC) en monos a la dosis más baja fue de 0.17 veces la exposición humana a la dosis máxima recomendada en humanos (DMRH) de 25 mg. Estudios similares en conejas y ratas preñadas a 20 veces y 200 veces la DMRH, respectivamente, produjeron letalidad embrionaria en conejos y ningún efecto adverso sobre la reproducción en ratas.
En un estudio de desarrollo pre y posnatal en ratas, los animales recibieron lenalidomida desde la organogénesis hasta la lactancia. El estudio reveló algunos efectos adversos en las crías de ratas hembra tratadas con lenalidomida a dosis de hasta 500 mg/kg (aproximadamente 200 veces la dosis humana de 25 mg basada en el área de superficie corporal). Las crías macho mostraron un ligero retraso en la maduración sexual y las crías hembra tuvieron un aumento de peso corporal ligeramente inferior durante la gestación cuando se cruzaron con crías macho. Al igual que con la talidomida, el modelo de rata puede no abordar adecuadamente el espectro completo de los posibles efectos sobre el desarrollo embriofetal humano de la lenalidomida.
Tras la administración oral diaria de lenalidomida desde el día 7 hasta el día 20 de gestación en conejas preñadas, las concentraciones plasmáticas de lenalidomida en el feto fueron aproximadamente del 20% al 40% de la Cmáx materna. Tras una dosis oral única a ratas preñadas, se detectó lenalidomida en el plasma y los tejidos fetales; las concentraciones de radiactividad en los tejidos fetales fueron generalmente inferiores a las de los tejidos maternos. Estos datos indicaron que la lenalidomida cruzaba la placenta.
8.2 Lactancia
Resumen de riesgos
No hay información sobre la presencia de lenalidomida en la leche materna, los efectos de las cápsulas de lenalidomida en el lactante o los efectos de las cápsulas de lenalidomida en la producción de leche. Dado que muchos medicamentos se excretan en la leche materna y debido al potencial de reacciones adversas en los lactantes por las cápsulas de lenalidomida, se aconseja a las mujeres que no amamanten durante el tratamiento con cápsulas de lenalidomida.
8.3 Mujeres y hombres con potencial reproductivo
Prueba de embarazo
Las cápsulas de lenalidomida pueden causar daño fetal cuando se administran durante el embarazo [ver Uso en poblaciones específicas (8.1)]. Verifique el estado de embarazo de las mujeres con potencial reproductivo antes de iniciar el tratamiento con cápsulas de lenalidomida y durante el mismo. Advierta a las mujeres con potencial reproductivo que deben evitar el embarazo 4 semanas antes del tratamiento, mientras toman cápsulas de lenalidomida, durante las interrupciones de la dosis y durante al menos 4 semanas después de completar el tratamiento.
Las mujeres con potencial reproductivo deben tener 2 pruebas de embarazo negativas antes de iniciar el tratamiento con cápsulas de lenalidomida. La primera prueba debe realizarse en un plazo de 10 a 14 días, y la segunda prueba en las 24 horas previas a la prescripción de las cápsulas de lenalidomida. Una vez iniciado el tratamiento y durante las interrupciones de la dosis, las pruebas de embarazo en mujeres con potencial reproductivo deben realizarse semanalmente durante las primeras 4 semanas de uso, y luego deben repetirse cada 4 semanas en mujeres con ciclos menstruales regulares. Si los ciclos menstruales son irregulares, la prueba de embarazo debe realizarse cada 2 semanas. Se debe realizar una prueba de embarazo y asesoramiento si una paciente se salta un periodo o si hay alguna anomalía en su sangrado menstrual. El tratamiento con cápsulas de lenalidomida debe interrumpirse durante esta evaluación.
Anticoncepción
Mujeres
Las mujeres en edad fértil deben comprometerse a abstenerse continuamente de las relaciones sexuales heterosexuales o a utilizar 2 métodos anticonceptivos fiables de forma simultánea: un método anticonceptivo muy eficaz – ligadura de trompas, DIU, hormonal (píldoras anticonceptivas, inyecciones, parches hormonales, anillos vaginales o implantes) o vasectomía de la pareja, y 1 método anticonceptivo eficaz adicional – preservativo masculino de látex o sintético, diafragma o capuchón cervical. La anticoncepción debe comenzar 4 semanas antes de iniciar el tratamiento con cápsulas de lenalidomida, durante el mismo, durante las interrupciones del tratamiento y continuar durante 4 semanas después de la interrupción del tratamiento con cápsulas de lenalidomida. La anticoncepción fiable está indicada incluso cuando ha habido antecedentes de infertilidad, a menos que se deba a una histerectomía. Las mujeres en edad fértil deben ser remitidas a un proveedor cualificado de métodos anticonceptivos, si es necesario.
Varones
La lenalidomida está presente en el semen de los varones que toman cápsulas de lenalidomida. Por lo tanto, los varones deben utilizar siempre un preservativo de látex o sintético durante cualquier contacto sexual con mujeres en edad fértil mientras estén tomando cápsulas de lenalidomida y hasta 4 semanas después de interrumpir el tratamiento con cápsulas de lenalidomida, incluso si se han sometido a una vasectomía con éxito. Los pacientes varones que toman cápsulas de lenalidomida no deben donar esperma hasta 4 semanas después de interrumpir el tratamiento con cápsulas de lenalidomida.
8.5 Uso geriátrico
MM en combinación: En general, de los 1613 pacientes del estudio NDMM que recibieron el tratamiento del estudio, el 94% (1521/1613) tenían 65 años o más, mientras que el 35% (561/1613) tenían más de 75 años. El porcentaje de pacientes mayores de 75 años fue similar entre los grupos de estudio (Rd Continuo: 33%; Rd18: 34%; MPT: 33%). En general, en todos los grupos de tratamiento, la frecuencia en la mayoría de las categorías de reacciones adversas (por ejemplo, todas las reacciones adversas, reacciones adversas de grado 3/4, reacciones adversas graves) fue mayor en los sujetos de mayor edad (> 75 años) que en los más jóvenes (≤75 años). Las reacciones adversas de grado 3 o 4 en el sistema orgánico de trastornos generales y afecciones en el lugar de administración se notificaron de forma sistemática con una frecuencia mayor (con una diferencia de al menos el 5%) en los sujetos de mayor edad que en los más jóvenes en todos los grupos de tratamiento. Las reacciones adversas de grado 3 o 4 en los sistemas orgánicos de infecciones e infestaciones, trastornos cardíacos (incluida la insuficiencia cardíaca y la insuficiencia cardíaca congestiva), trastornos cutáneos y del tejido subcutáneo y trastornos renales y urinarios (incluida la insuficiencia renal) también se notificaron de forma ligeramente, pero sistemáticamente, más frecuente (diferencia < 5%), en los sujetos de mayor edad que en los más jóvenes en todos los grupos de tratamiento. En otros sistemas orgánicos (por ejemplo, trastornos de la sangre y del sistema linfático, infecciones e infestaciones, trastornos cardíacos, trastornos vasculares), hubo una tendencia menos constante a que aumentara la frecuencia de reacciones adversas de grado 3/4 en los sujetos de mayor edad en comparación con los más jóvenes en todos los grupos de tratamiento. Las reacciones adversas graves se notificaron generalmente con mayor frecuencia en los sujetos de mayor edad que en los más jóvenes en todos los grupos de tratamiento.
MM después de al menos un tratamiento previo: De los 703 pacientes con MM que recibieron el tratamiento del estudio en los Estudios 1 y 2, el 45% tenían 65 años o más, mientras que el 12% de los pacientes tenían 75 años o más. El porcentaje de pacientes de 65 años o más no fue significativamente diferente entre los grupos de lenalidomida/dexametasona y placebo/dexametasona. De los 353 pacientes que recibieron lenalidomida/dexametasona, el 46% tenían 65 años o más. En ambos estudios, los pacientes > 65 años de edad fueron más propensos que los pacientes ≤ 65 años de edad a experimentar TVP, embolia pulmonar, fibrilación auricular e insuficiencia renal después del uso de cápsulas de lenalidomida. No se observaron diferencias en la eficacia entre los pacientes mayores de 65 años y los más jóvenes.
De los 148 pacientes con SMD del 5q- que participaron en el estudio principal, el 38% tenían 65 años o más, mientras que el 33% tenían 75 años o más. Aunque la frecuencia global de reacciones adversas (100%) fue la misma en los pacientes mayores de 65 años que en los más jóvenes, la frecuencia de reacciones adversas graves fue mayor en los pacientes mayores de 65 años que en los más jóvenes (54% frente a 33%). Una mayor proporción de pacientes mayores de 65 años abandonaron los estudios clínicos debido a reacciones adversas que la proporción de pacientes más jóvenes (27% frente a 16%). No se observaron diferencias en la eficacia entre los pacientes mayores de 65 años y los más jóvenes.
Dado que los pacientes de edad avanzada tienen más probabilidades de presentar una disminución de la función renal, se debe tener precaución a la hora de seleccionar la dosis. Vigile la función renal.
8.6 Insuficiencia renal
Ajuste la dosis inicial de las cápsulas de lenalidomida en función del valor de aclaramiento de creatinina y en los pacientes en diálisis [véase Posología y administración (2.6)].
10 SOBREDOSIS
No existe experiencia específica en el tratamiento de la sobredosis de lenalidomida en pacientes con MM o MDS. En los estudios de determinación de dosis en sujetos sanos, algunos fueron expuestos a dosis de hasta 200 mg (administrados 100 mg dos veces al día) y en los estudios de dosis única, algunos sujetos fueron expuestos a dosis de hasta 400 mg. Los EA notificados con mayor frecuencia fueron prurito, urticaria, erupción cutánea y aumento de las transaminasas hepáticas. En los ensayos clínicos, la toxicidad limitante de la dosis fue la neutropenia y la trombocitopenia.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
La lenalidomida es un análogo de la talidomida con propiedades inmunomoduladoras, antiangiogénicas y antineoplásicas. Las actividades celulares de la lenalidomida están mediadas por su diana cereblon, un componente de un complejo enzimático de ubiquitina ligasa E3 de anillo de culina. In vitro, en presencia del fármaco, las proteínas sustrato (incluidas Aiolos, Ikaros y CK1α) son objetivo de ubiquitinación y posterior degradación, lo que provoca efectos citotóxicos e inmunomoduladores directos. La lenalidomida inhibe la proliferación e induce la apoptosis de determinadas células tumorales hematopoyéticas, incluidos los síndromes mielodisplásicos MM y del (5q) in vitro. La lenalidomida provoca un retraso en el crecimiento tumoral en algunos modelos tumorales hematopoyéticos no clínicos in vivo, incluido el MM. Las propiedades inmunomoduladoras de la lenalidomida incluyen un mayor número y activación de células T y células asesinas naturales (NK), lo que conduce a una citotoxicidad celular dependiente de anticuerpos (ADCC) directa y mejorada a través del aumento de la secreción de interleucina-2 e interferón-gamma, un mayor número de células NKT y la inhibición de las citocinas proinflamatorias (p. ej., TNF-α e IL-6) por los monocitos. En las células MM, la combinación de lenalidomida y dexametasona sinergiza la inhibición de la proliferación celular y la inducción de la apoptosis.
12.2 Farmacodinamia
Electrofisiología cardíaca
El efecto de la lenalidomida sobre el intervalo QTc se evaluó en 60 sujetos masculinos sanos en un estudio exhaustivo de QT. A una dosis dos veces superior a la dosis máxima recomendada, la lenalidomida no prolongó el intervalo QTc. El límite superior más grande del IC del 90 % bilateral para las diferencias medias entre lenalidomida y placebo fue inferior a 10 ms.
12.3 Farmacocinética
Absorción
Tras dosis únicas y múltiples de cápsulas de lenalidomida en pacientes con MM o SMD, las concentraciones plasmáticas máximas se produjeron entre 0,5 y 6 horas después de la dosis. La disposición farmacocinética de dosis única y múltiple de lenalidomida es lineal, y los valores de AUC y Cmáx. aumentan proporcionalmente con la dosis. Las dosis múltiples de cápsulas de lenalidomida a la dosis recomendada no dan lugar a la acumulación del fármaco.
La administración de una dosis única de 25 mg de cápsulas de lenalidomida con una comida rica en grasas en sujetos sanos reduce el grado de absorción, con una disminución aproximada del 20 % en el AUC y del 50 % en la Cmáx.. En los ensayos en los que se estableció la eficacia y la seguridad de las cápsulas de lenalidomida, el fármaco se administró independientemente de la ingesta de alimentos. Las cápsulas de lenalidomida pueden administrarse con o sin alimentos.
Distribución
La unión de [14C]-lenalidomida in vitro a las proteínas plasmáticas es de aproximadamente el 30 %.
La lenalidomida está presente en el semen a las 2 horas (1379 ng/eyaculado) y 24 horas (35 ng/eyaculado) después de la administración de la cápsula de lenalidomida 25 mg al día.
Eliminación
La semivida media de la lenalidomida es de 3 horas en sujetos sanos y de 3 a 5 horas en pacientes con MM o SMD.
Metabolismo
La lenalidomida sufre un metabolismo limitado. La lenalidomida inalterada es el componente circulante predominante en humanos. Dos metabolitos identificados son la 5-hidroxi-lenalidomida y la N-acetil-lenalidomida; cada uno constituye menos del 5 % de los niveles parentales en circulación.
Excreción
La eliminación es principalmente renal. Tras una única administración oral de 25 mg de [14C]-lenalidomida a sujetos sanos, aproximadamente el 90 % y el 4 % de la dosis radiactiva se eliminó en diez días en la orina y las heces, respectivamente. Aproximadamente el 82 % de la dosis radiactiva se excretó como lenalidomida en la orina en 24 horas. La hidroxi-lenalidomida y la N-acetil-lenalidomida representaron el 4,6 % y el 1,8 % de la dosis excretada, respectivamente. El aclaramiento renal de la lenalidomida supera la tasa de filtración glomerular.
Poblaciones específicas
Insuficiencia renal: Ocho sujetos con insuficiencia renal leve (aclaramiento de creatinina (CLcr) de 50 a 79 ml/min calculado mediante Cockcroft-Gault), 9 sujetos con insuficiencia renal moderada (CLcr de 30 a 49 ml/min), 4 sujetos con insuficiencia renal grave (CLcr < 30 ml/min) y 6 pacientes con enfermedad renal terminal (ERT) que requerían diálisis recibieron una dosis única de 25 mg de cápsulas de lenalidomida. Tres sujetos sanos de edad similar con función renal normal (CLcr > 80 ml/min) también recibieron una dosis única de 25 mg de cápsulas de lenalidomida. A medida que el CLcr disminuía, la semivida aumentaba y el aclaramiento del fármaco disminuía linealmente. Los pacientes con insuficiencia moderada y grave tuvieron un aumento de 3 veces en la semivida y una disminución del 66 % al 75 % en el aclaramiento del fármaco en comparación con los sujetos sanos. Los pacientes en hemodiálisis (n=6) tuvieron un aumento aproximado de 4,5 veces en la semivida y una disminución del 80 % en el aclaramiento del fármaco en comparación con los sujetos sanos. Aproximadamente el 30 % del fármaco en el cuerpo se eliminó durante una sesión de hemodiálisis de 4 horas.
Ajuste la dosis inicial de cápsulas de lenalidomida en pacientes con insuficiencia renal según el valor de CLcr [ver Dosis y administración (2.6)].
Insuficiencia hepática: La insuficiencia hepática leve (definida como bilirrubina total > 1 a 1,5 veces el límite superior normal (LSN) o cualquier aspartato transaminasa superior al LSN) no influyó en la disposición de la lenalidomida. No se dispone de datos farmacocinéticos para pacientes con insuficiencia hepática de moderada a grave.
Otros factores intrínsecos: La edad (de 39 a 85 años), el peso corporal (de 33 a 135 kg), el sexo, la raza y el tipo de neoplasias hematológicas (MM o SMD) no tuvieron un efecto clínicamente relevante sobre el aclaramiento de lenalidomida en pacientes adultos.
Interacciones farmacológicas
La administración conjunta de una dosis única o de dosis múltiples de dexametasona (40 mg) no tuvo un efecto clínicamente relevante sobre la farmacocinética de dosis múltiples de las cápsulas de lenalidomida (25 mg).
La administración conjunta de cápsulas de lenalidomida (25 mg) después de dosis múltiples de un inhibidor de la P-gp como la quinidina (600 mg dos veces al día) no aumentó significativamente la Cmáx. ni el AUC de la lenalidomida.
La administración conjunta de temsirolimus (25 mg), inhibidor y sustrato de la P-gp, con cápsulas de lenalidomida (25 mg) no alteró significativamente la farmacocinética de la lenalidomida, el temsirolimus o el sirolimus (metabolito del temsirolimus).
Los estudios in vitro demostraron que las cápsulas de lenalidomida son un sustrato de la glicoproteína P (P-gp). Las cápsulas de lenalidomida no son un sustrato de la proteína de resistencia al cáncer de mama humano (BCRP), los transportadores de resistencia a múltiples fármacos (MRP) MRP1, MRP2 o MRP3, los transportadores de aniones orgánicos (OAT) OAT1 y OAT3, el polipéptido transportador de aniones orgánicos 1B1 (OATP1B1), los transportadores de cationes orgánicos (OCT) OCT1 y OCT2, la proteína de extrusión de toxinas y múltiples fármacos (MATE) MATE1 y los nuevos transportadores de cationes orgánicos (OCTN) OCTN1 y OCTN2. La lenalidomida no es un inhibidor de la P-gp, la bomba de exportación de sales biliares (BSEP), la BCRP, la MRP2, la OAT1, la OAT3, la OATP1B1, la OATP1B3 ni la OCT2. La lenalidomida no inhibe ni induce las isoenzimas del CYP450. Además, la lenalidomida no inhibe la formación de glucuronidación de la bilirrubina en los microsomas hepáticos humanos con UGT1A1 genotipado como UGT1A1*1/*1, UGT1A1*1/*28 y UGT1A1*28/*28.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad
No se han realizado estudios de carcinogenicidad con lenalidomida.
La lenalidomida no fue mutagénica en la prueba de mutación inversa bacteriana (prueba de Ames) y no indujo aberraciones cromosómicas en linfocitos de sangre periférica humana cultivados, ni mutaciones en el locus de la timidina quinasa (tk) de células de linfoma murino L5178Y. La lenalidomida no aumentó la transformación morfológica en el ensayo de embrión de hámster sirio ni indujo micronúcleos en los eritrocitos policromáticos de la médula ósea de ratas macho.
Un estudio de fertilidad y desarrollo embrionario temprano en ratas, con administración de lenalidomida hasta 500 mg/kg (aproximadamente 200 veces la dosis humana de 25 mg, según el área de superficie corporal) no produjo toxicidad parental ni efectos adversos sobre la fertilidad.
14 ESTUDIOS CLÍNICOS
14.1 Mieloma múltiple
Ensayo clínico aleatorizado, abierto en pacientes con MM recién diagnosticado:
Se realizó un ensayo aleatorizado, abierto, multicéntrico, de 3 brazos con 1623 pacientes para comparar la eficacia y seguridad de las cápsulas de lenalidomida y dosis bajas de dexametasona (Rd) administradas durante 2 duraciones diferentes en comparación con melfalán, prednisona y talidomida (MPT) en pacientes con MM recién diagnosticado que no eran candidatos para trasplante de células madre. En el primer brazo del estudio, se administró Rd de forma continua hasta la progresión de la enfermedad [Brazo Rd continuo]. En el segundo brazo, se administró Rd hasta por dieciocho ciclos de 28 días [72 semanas, Brazo Rd18]). En el tercer brazo, se administró melfalán, prednisona y talidomida (MPT) durante un máximo de doce ciclos de 42 días (72 semanas). Para los fines de este estudio, un paciente menor de 65 años no era candidato para SCT si se negaba a someterse a la terapia SCT o si no tenía acceso a SCT debido al costo u otras razones. Los pacientes se estratificaron en la aleatorización por edad (≤75 frente a >75 años), estadio (estadios ISS I y II frente a estadio III) y país.
Los pacientes de los brazos Rd continuo y Rd18 recibieron cápsulas de lenalidomida de 25 mg una vez al día los días 1 a 21 de ciclos de 28 días. La dexametasona se dosificó a 40 mg una vez al día los días 1, 8, 15 y 22 de cada ciclo de 28 días. Para los pacientes mayores de > 75 años, la dosis inicial de dexametasona fue de 20 mg por vía oral una vez al día los días 1, 8, 15 y 22 de ciclos repetidos de 28 días. La dosis inicial y los regímenes para Rd continuo y Rd18 se ajustaron según la edad y la función renal. Todos los pacientes recibieron anticoagulación profiláctica y la más utilizada fue la aspirina.
Las características demográficas y basales relacionadas con la enfermedad de los pacientes se equilibraron entre los 3 brazos. En general, los sujetos del estudio tenían enfermedad en estadio avanzado. De la población total del estudio, la mediana de edad fue de 73 años en los 3 brazos, con un 35 % del total de pacientes > 75 años; el 59 % tenía estadio ISS I/II; el 41 % tenía estadio ISS III; el 9 % tenía insuficiencia renal grave (aclaramiento de creatinina [CLcr] < 30 ml/min); el 23 % tenía insuficiencia renal moderada (CLcr > 30 a 50 ml/min; el 44 % tenía insuficiencia renal leve (CLcr >50 a 80 ml/min). Para el estado funcional ECOG, el 29 % eran de grado 0, el 49 % de grado 1, el 21 % de grado 2 y el 0,4 % ≥ grado 3.
El criterio principal de valoración de la eficacia, la supervivencia libre de progresión (SLP), se definió como el tiempo desde la aleatorización hasta la primera documentación de progresión de la enfermedad según lo determinado por el Comité Independiente de Adjudicación de Respuesta (IRAC), según los criterios del Grupo de Trabajo Internacional sobre Mieloma [IMWG] o la muerte por cualquier causa, lo que ocurriera primero durante el estudio hasta el final de la fase de seguimiento de la SLP. Para el análisis de eficacia de todos los criterios de valoración, la comparación principal fue entre los brazos Rd continuo y MPT. Los resultados de eficacia se resumen en la siguiente tabla. La SLP fue significativamente más prolongada con Rd continuo que con MPT: HR 0,72 (IC del 95 %: 0,61-0,85 p <0,0001). Un porcentaje menor de sujetos en el brazo Rd continuo en comparación con el brazo MPT tuvo eventos de SLP (52 % frente a 61 %, respectivamente). La mejora en el tiempo medio de SLP en el brazo Rd continuo en comparación con el brazo MPT fue de 4,3 meses. La tasa de respuesta del mieloma fue mayor con Rd continuo en comparación con MPT (75,1 % frente a 62,3 %); con una respuesta completa en el 15,1 % de los pacientes del brazo Rd continuo frente al 9,3 % en el brazo MPT. El tiempo medio hasta la primera respuesta fue de 1,8 meses en el brazo Rd continuo frente a 2,8 meses en el brazo MPT.
Para el análisis intermedio de SG con datos de corte del 3 de marzo de 2014, el tiempo medio de seguimiento de todos los pacientes supervivientes es de 45,5 meses, con 697 eventos de muerte, lo que representa el 78 % de los eventos preespecificados necesarios para el análisis final planificado de SG (697/896 de los eventos finales de SG). La HR de SG observada fue de 0,75 para Rd continuo frente a MPT (IC del 95 % = 0,62, 0,90).
Tabla 13: Resumen de los resultados de eficacia – Estudio MM-020 (Población por intención de tratar)
|
|
Rd continuo (N = 535) |
Rd18 (N = 541) |
MPT (N = 547) |
|
SLP – IRAC (meses)g |
|
|
|
|
Número de eventos de SLP |
278 (52) |
348 (64,3) |
334 (61,1) |
|
Medianaa tiempo de SLP, meses (IC del 95 %)b |
25,5 (20,7, 29,4) |
20,7 (19,4, 22) |
21,2 (19,3, 23,2) |
|
HR [IC del 95 %]c; valor pd |
|
|
|
|
Rd continuo frente a MPT |
0,72 (0,61, 0,85); <0,0001 |
|
|
|
Rd continuo frente a Rd18 |
0,70 (0,60, 0,82) |
|
|
|
Rd18 frente a MPT |
1,03 (0,89, 1,20) |
|
|
|
Supervivencia global (meses)h |
|
|
|
|
Número de eventos de muerte |
208 (38,9) |
228 (42,1) |
261 (47,7) |
|
Medianaa tiempo de SG, meses (IC del 95 %)b |
58,9 (56, NE)f |
56,7 (50,1, NE) |
48,5 (44,2, 52) |
|
HR [95% CI]c |
|
|
|
|
Rd Continuo vs MPT |
0.75 (0.62, 0.90) |
|
|
|
Rd Continuo vs Rd18 |
0.91 (0.75, 1.09) |
|
|
|
Rd18 vs MPT |
0.83 (0.69, 0.99) |
|
|
|
Tasa de respuestae – IRAC, n (%)g |
|
|
|
|
CR |
81 (15.1) |
77 (14.2) |
51 (9.3) |
|
VGPR |
152 (28.4) |
154 (28.5) |
103 (18.8) |
|
PR |
169 (31.6) |
166 (30.7) |
187 (34.2) |
|
Respuesta general: CR, VGPR o PR |
402 (75.1) |
397 (73.4) |
341 (62.3) |
|
CR = respuesta completa; d = dosis baja de dexametasona; HR = hazard ratio; IRAC = Comité Independiente de Adjudicación de Respuesta; M = melfalán; NE = no estimable; OS = supervivencia general; P = prednisona; PFS = supervivencia libre de progresión; PR = respuesta parcial; R = cápsulas de lenalidomida; Rd Continuo = Rd administrado hasta la documentación de enfermedad progresiva; Rd18 = Rd administrado durante ≤ 18 ciclos; T = talidomida; VGPR = muy buena respuesta parcial; vs = versus. a La mediana se basa en la estimación de Kaplan-Meier. b El intervalo de confianza (IC) del 95% sobre la mediana. c Basado en el modelo de riesgos proporcionales de Cox que compara las funciones de riesgo asociadas a los grupos de tratamiento indicados. d El valor p se basa en la prueba logarítmica de rango no estratificada de las diferencias de la curva de Kaplan-Meier entre los grupos de tratamiento indicados. e Mejor evaluación de la respuesta durante la fase de tratamiento del estudio. f Incluyendo pacientes sin datos de evaluación de la respuesta o cuya única evaluación fue “respuesta no evaluable”. g Fecha de corte de datos = 24 de mayo de 2013. h Fecha de corte de datos = 3 de marzo de 2014. |
|||
Curvas de Kaplan-Meier de supervivencia sin progresión basadas en la evaluación del IRAC (población con MM del ITT)
Entre los brazos Rd continuo, Rd18 y MPT
Fecha de corte: 24 de mayo de 2013
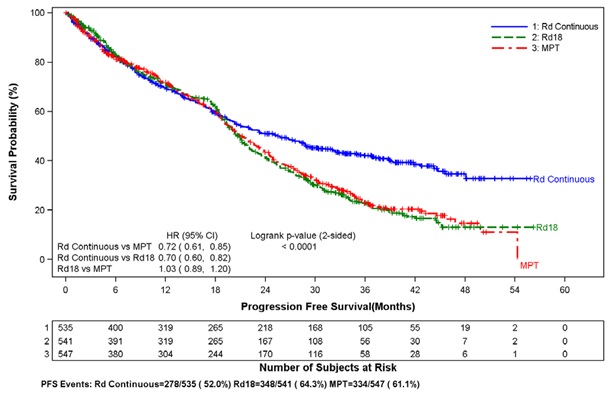
IC = intervalo de confianza; d = dosis baja de dexametasona; HR = hazard ratio; IRAC = Comité de Adjudicación de Respuesta Independiente; M = melfalán; P = prednisona; R = cápsulas de lenalidomida;
Rd continuo = Rd administrado hasta la documentación de enfermedad progresiva; Rd18 = Rd administrado durante ≤ 18 ciclos; T = talidomida.
Curvas de Kaplan-Meier de supervivencia global (población con MM del ITT)
Entre los brazos Rd continuo, Rd18 y MPT
Fecha de corte: 03 de marzo de 2014
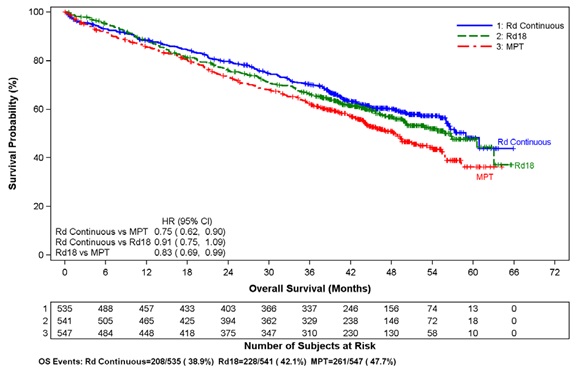
IC = intervalo de confianza; d = dosis baja de dexametasona; HR = hazard ratio; M = melfalán; P = prednisona; R = cápsulas de lenalidomida;
Rd continuo = Rd administrado hasta la documentación de enfermedad progresiva; Rd18 = Rd administrado durante ≤ 18 ciclos; T = talidomida.
Estudios clínicos aleatorizados y abiertos en pacientes con MM después de al menos un tratamiento previo
Se realizaron dos estudios aleatorizados (Estudios 1 y 2) para evaluar la eficacia y seguridad de las cápsulas de lenalidomida. Estos estudios multicéntricos, multinacionales, doble ciego y controlados con placebo compararon las cápsulas de lenalidomida más la terapia oral de dosis altas de dexametasona con la terapia de dexametasona sola en pacientes con MM que habían recibido al menos un tratamiento previo. Estos estudios incluyeron a pacientes con recuentos absolutos de neutrófilos (RAN) ≥ 1000/mm3, recuentos de plaquetas ≥ 75 000/mm3, creatinina sérica ≤ 2,5 mg/dl, SGOT/AST o SGPT/ALT séricas ≤ 3 x límite superior normal (LSN) y bilirrubina directa sérica ≤ 2 mg/dl.
En ambos estudios, los pacientes del grupo de lenalidomida/dexametasona tomaron 25 mg de cápsulas de lenalidomida por vía oral una vez al día los días 1 a 21 y una cápsula de placebo equivalente una vez al día los días 22 a 28 de cada ciclo de 28 días. Los pacientes del grupo de placebo/dexametasona tomaron 1 cápsula de placebo los días 1 a 28 de cada ciclo de 28 días. Los pacientes de ambos grupos de tratamiento tomaron 40 mg de dexametasona por vía oral una vez al día los días 1 a 4, 9 a 12 y 17 a 20 de cada ciclo de 28 días durante los primeros 4 ciclos de terapia.
La dosis de dexametasona se redujo a 40 mg por vía oral una vez al día los días 1 a 4 de cada ciclo de 28 días después de los primeros 4 ciclos de terapia. En ambos estudios, el tratamiento debía continuar hasta la progresión de la enfermedad.
En ambos estudios, se permitieron ajustes de dosis en función de los hallazgos clínicos y de laboratorio. Se permitieron reducciones secuenciales de la dosis a 15 mg diarios, 10 mg diarios y 5 mg diarios por toxicidad [ver Dosificación y administración (2.1)].
La Tabla 16 resume las características basales de los pacientes y de la enfermedad en los dos estudios. En ambos estudios, las características basales demográficas y relacionadas con la enfermedad fueron comparables entre los grupos de lenalidomida/dexametasona y placebo/dexametasona.
Tabla 16: Características demográficas y relacionadas con la enfermedad basales – Estudios 1 y 2 del MM
| Estudio 1 | Estudio 2 | |||
| Lenalidomida/Dex
N=177 |
Placebo/Dex
N=176 |
Lenalidomida/Dex
N=176 |
Placebo/Dex
N=175 |
|
| Características del paciente | ||||
| Edad (años) | ||||
| Mediana | 64 | 62 | 63 | 64 |
| Mín., Máx. | 36, 86 | 37, 85 | 33, 84 | 40, 82 |
| Sexo | ||||
| Masculino | 106 (60%) | 104 (59%) | 104 (59%) | 103 (59%) |
| Femenino | 71 (40%) | 72 (41%) | 72 (41%) | 72 (41%) |
| Raza/etnia | ||||
| Blanca | 141(80%) | 148 (84%) | 172 (98%) | 175 (100%) |
| Otra | 36 (20%) | 28 (16%) | 4 (2%) | 0 (0%) |
| Rendimiento ECOG | ||||
| Estado 0-1 | 157 (89%) | 168 (95%) | 150 (85%) | 144 (82%) |
| Características de la enfermedad | ||||
| Estadio del mieloma múltiple (Durie-Salmon) | ||||
| I | 3% | 3% | 6% | 5% |
| II | 32% | 31% | 28% | 33% |
| III | 64% | 66% | 65% | 63% |
| β2-microglobulina (mg/l) | ||||
| ≤ 2.5 mg/l | 52 (29%) | 51 (29%) | 51 (29%) | 48 (27%) |
| > 2.5 mg/l | 125 (71%) | 125 (71%) | 125 (71%) | 127 (73%) |
| Número de tratamientos previos | ||||
| 1 | 38% | 38% | 32% | 33% |
| ≥ 2 | 62% | 62% | 68% | 67% |
| Tipos de tratamientos previos | ||||
| Trasplante de células madre | 62% | 61% | 55% | 54% |
| Talidomida | 42% | 46% | 30% | 38% |
| Dexametasona | 81% | 71% | 66% | 69% |
| Bortezomib | 11% | 11% | 5% | 4% |
| Melfalán | 33% | 31% | 56% | 52% |
| Doxorrubicina | 55% | 51% | 56% | 57% |
El criterio principal de valoración de la eficacia en ambos estudios fue el tiempo hasta la progresión (TTP). El TTP se definió como el tiempo desde la aleatorización hasta la primera aparición de enfermedad progresiva.
Los análisis provisionales planificados de ambos estudios mostraron que la combinación de lenalidomida/dexametasona fue significativamente superior a la dexametasona sola para el TTP. Los estudios se desenmascaron para permitir que los pacientes del grupo de placebo/dexametasona recibieran tratamiento con la combinación de lenalidomida/dexametasona. Para ambos estudios, se analizaron los datos de supervivencia de seguimiento ampliado con cruces. En el estudio 1, el tiempo medio de supervivencia fue de 39,4 meses (IC del 95%: 32,9, 47,4) en el grupo de lenalidomida/dexametasona y de 31,6 meses (IC del 95%: 24,1, 40,9) en el grupo de placebo/dexametasona, con una razón de riesgo de 0,79 (IC del 95%: 0,61-1,03). En el estudio 2, el tiempo medio de supervivencia fue de 37,5 meses (IC del 95%: 29,9, 46,6) en el grupo de lenalidomida/dexametasona y de 30,8 meses (IC del 95%: 23,5, 40,3) en el grupo de placebo/dexametasona, con una razón de riesgo de 0,86 (IC del 95%: 0,65-1,14).
Tabla 17: Resultados del TTP en el estudio 1 y el estudio 2 del MM
| Estudio 1 | Estudio 2 | |||
| Lenalidomida/Dex
N=177 |
Placebo/Dex
N=176 |
Lenalidomida/Dex
N=176 |
Placebo/Dex
N=175 |
|
| TTP | ||||
| Eventos n (%) | 73 (41) | 120 (68) | 68 (39) | 130 (74) |
| Mediana del TTP en meses [IC del 95%] | 13,9 [9,5, 18,5] | 4,7 [3,7, 4,9] | 12,1 [9,5, NE] | 4,7 [3,8, 4,8] |
| Razón de riesgo [IC del 95%] | 0,285 [0,210, 0,386] | 0,324 [0,240, 0,438] | ||
| Valor p de la prueba de log-rank 3 | <0,001 | <0,001 | ||
| Respuesta | ||||
| Respuesta completa (RC) n (%) | 23 (13) | 1 (1) | 27 (15) | 7 (4) |
| Respuesta parcial (RR/RP) n (%) | 84 (48) | 33 (19) | 77 (44) | 34 (19) |
| Respuesta global n (%) | 107 (61) | 34 (19) | 104 (59) | 41 (23) |
| Valor p | <0,001 | <0,001 | ||
| Razón de posibilidades [IC del 95%] | 6,38 [3,95, 10,32] | 4,72 [2,98, 7,49] | ||
Estimación de Kaplan-Meier del tiempo hasta la progresión – Estudio MM 1
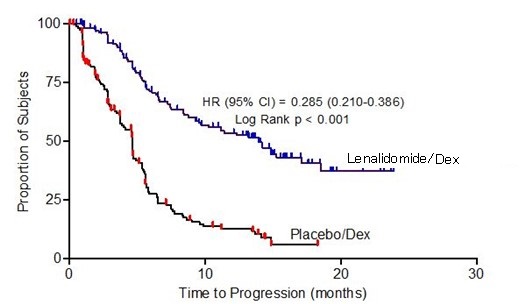
Estimación de Kaplan-Meier del tiempo hasta la progresión – Estudio MM 2
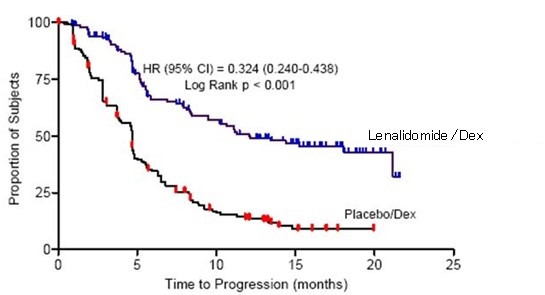
14.2 Síndromes mielodisplásicos (MDS) con anomalía citogenética con deleción 5q
Se evaluó la eficacia y seguridad de las cápsulas de lenalidomida en pacientes con anemia dependiente de transfusiones con riesgo bajo o intermedio-1 de MDS con una anomalía citogenética 5q (q31-33) de forma aislada o con anomalías citogenéticas adicionales, a una dosis de 10 mg una vez al día o 10 mg una vez al día durante 21 días cada 28 días en un estudio abierto, de un solo grupo, multicéntrico. El estudio principal no fue diseñado ni tuvo la potencia para comparar prospectivamente la eficacia de los 2 regímenes de dosificación. Se permitieron reducciones de dosis secuenciales a 5 mg al día y 5 mg en días alternos, así como retrasos en la dosis, por toxicidad [ver Dosificación y administración (2.2)].
Este importante estudio reclutó a 148 pacientes que tenían anemia dependiente de transfusiones de GR. La dependencia de la transfusión de GR se definió como haber recibido ≥ 2 unidades de GR en las 8 semanas previas al tratamiento del estudio. El estudio reclutó a pacientes con recuentos absolutos de neutrófilos (RAN) ≥ 500/mm3, recuentos de plaquetas ≥ 50 000/mm3, creatinina sérica ≤ 2.5 mg/dL, SGOT/AST o SGPT/ALT sérica ≤ 3 x límite superior normal (LSN) y bilirrubina directa sérica ≤ 2 mg/dL. Se permitió el factor estimulante de colonias de granulocitos para los pacientes que desarrollaron neutropenia o fiebre en asociación con neutropenia. Las características basales de los pacientes y de la enfermedad se resumen en la Tabla 18.
Tabla 18: Características demográficas y de la enfermedad basales en el estudio de MDS
| General (N=148) | ||
| Edad (años) | ||
| Mediana | 71 | |
| Mín., Máx. | 37, 95 | |
| Sexo | n | (%) |
| Hombre | 51 | (34.5) |
| Mujer | 97 | (65.5) |
| Raza | n | (%) |
| Blanca | 143 | (96.6) |
| Otra | 5 | (3.4) |
| Duración del MDS (años) | ||
| Mediana | 2.5 | |
| Mín., Máx. | 0.1, 20.7 | |
| Anomalía citogenética Del 5 (q31-33) | n | (%) |
| Sí | 148 | (100) |
| Otras anomalías citogenéticas | 37 | (25.2) |
| Puntuación IPSS a | n | (%) |
| Bajo (0) | 55 | (37.2) |
| Intermedio-1 (0.5 a 1.0) | 65 | (43.9) |
| Intermedio-2 (1.5 a 2.0) | 6 | (4.1) |
| Alto (≥2.5) | 2 | (1.4) |
| Faltan datos | 20 | (13.5) |
| Clasificación FABb de la revisión central | n | (%) |
| RA | 77 | (52) |
| RARS | 16 | (10.8) |
| RAEB | 30 | (20.3) |
| CMML | 3 | (2) |
a Categoría de riesgo IPSS: Bajo (puntuación combinada = 0), Intermedio-1 (puntuación combinada = 0.5 a 1), Intermedio-2 (puntuación combinada = 1.5 a 2.0), Alto (puntuación combinada ≥ 2.5); Puntuación combinada = (Puntuación de blastocitos en médula ósea + Puntuación de cariotipo + Puntuación de citopenia)
b Clasificación franco-estadounidense-británica (FAB) de los MDS.
La frecuencia de la independencia de la transfusión de GR se evaluó utilizando criterios modificados de los criterios de respuesta del Grupo de Trabajo Internacional (IWG) para los MDS. La independencia de la transfusión de GR se definió como la ausencia de cualquier transfusión de GR durante 56 días (8 semanas) “consecutivos” durante el período de tratamiento.
Se observó independencia de la transfusión en 99/148 (67 %) pacientes (IC del 95 % [59, 74]). La mediana de la duración desde la fecha en que se declaró por primera vez la independencia de la transfusión de GR (es decir, el último día del período de 56 días sin transfusión de GR) hasta la fecha en que se recibió una transfusión adicional después del período de 56 días sin transfusión entre los 99 respondedores fue de 44 semanas (rango de 0 a >67 semanas). El 90 % de los pacientes que lograron un beneficio transfusional lo hicieron al completar los tres meses del estudio.
Las tasas de independencia de la transfusión de GR no se vieron afectadas por la edad ni el sexo.
La dosis de cápsulas de lenalidomida se redujo o interrumpió al menos una vez debido a un evento adverso en 118 (79.7 %) de los 148 pacientes; la mediana del tiempo hasta la primera reducción o interrupción de la dosis fue de 21 días (media, 35.1 días; rango, 2 a 253 días), y la mediana de la duración de la primera interrupción de la dosis fue de 22 días (media, 28.5 días; rango, 2 a 265 días). Se requirió una segunda reducción o interrupción de la dosis debido a eventos adversos en 50 (33.8 %) de los 148 pacientes. La mediana del intervalo entre la primera y la segunda reducción o interrupción de la dosis fue de 51 días (media, 59.7 días; rango, 15 a 205 días) y la mediana de la duración de la segunda interrupción de la dosis fue de 21 días (media, 26 días; rango, 2 a 148 días).
15 REFERENCIAS
1. OSHA Hazardous Drugs. OSHA [Consultado el 29 de enero de 2013, en http://www.osha.gov/SLTC/hazardousdrugs/index.html]
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANIPULACIÓN
16.1 Cómo se suministra
Cápsula de cuerpo opaco naranja claro/tapa opaca azul oscuro, tamaño de la cápsula n.° 4 con la impresión en tinta negra “LP” en la tapa y “637” en el cuerpo y llena de polvo blanco.
Frascos de 2,5 mg con 28 unidades (NDC 47781-483-28)
Frascos de 2,5 mg con 100 unidades (NDC 47781-483-01)
Cápsula de cuerpo opaco color caramelo claro/tapa opaca verde, tamaño de la cápsula n.° 2 con la impresión en tinta negra “LP” en la tapa y “638” en el cuerpo y llena de polvo blanco.
Frascos de 5 mg con 28 unidades (NDC 47781-484-28)
Frascos de 5 mg con 100 unidades (NDC 47781-484-01)
Cápsula de cuerpo opaco gris/tapa opaca dorada, tamaño de la cápsula n.° 0 con la impresión en tinta negra “LP” en la tapa y “639” en el cuerpo y llena de polvo blanco.
Frascos de 10 mg con 28 unidades (NDC 47781-485-28)
Frascos de 10 mg con 100 unidades (NDC 47781-485-01)
Cápsula de cuerpo opaco gris/tapa opaca color caramelo, tamaño de la cápsula n.° 2 con la impresión en tinta negra “LP” en la tapa y “640” en el cuerpo y llena de polvo blanco.
Frascos de 15 mg con 21 unidades (NDC 47781-486-77)
Frascos de 15 mg con 100 unidades (NDC 47781-486-01)
Cápsula de cuerpo opaco gris claro/tapa opaca rojo ladrillo cálido, tamaño de la cápsula n.° 1 con la impresión en tinta negra “LP” en la tapa y “641” en el cuerpo y llena de polvo blanco.
Frascos de 20 mg con 21 unidades (NDC 47781-487-77)
Frascos de 20 mg con 100 unidades (NDC 47781-487-01)
Cápsula de cuerpo opaco blanco/tapa opaca blanca, tamaño de la cápsula n.° 0 con la impresión en tinta negra “LP” en la tapa y “642” en el cuerpo y llena de polvo blanco.
Frascos de 25 mg con 21 unidades (NDC 47781-488-77)
Frascos de 25 mg con 100 unidades (NDC 47781-488-01)
16.2 Almacenamiento
Almacenar a una temperatura de 20 °C a 25 °C (68 °F a 77 °F); se permiten variaciones de temperatura de 15 °C a 30 °C (59 °F a 86 °F) [Ver USP Temperatura ambiente controlada].
16.3 Manipulación y eliminación
Se debe tener cuidado al manipular las cápsulas de lenalidomida. Las cápsulas de lenalidomida no deben abrirse ni romperse. Si el polvo de las cápsulas de lenalidomida entra en contacto con la piel, lave la piel inmediatamente y meticulosamente con agua y jabón. Si las cápsulas de lenalidomida entran en contacto con las membranas mucosas, enjuague meticulosamente con agua.
Se deben considerar los procedimientos para la manipulación y eliminación adecuadas de los medicamentos contra el cáncer. Se han publicado varias pautas sobre el tema.1
No dispense más de un suministro para 28 días.
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
Aconseje al paciente que lea la información para pacientes aprobada por la FDA (Guía del Medicamento)
Toxicidad embriofetal
Informe a las pacientes que las cápsulas de lenalidomida están contraindicadas durante el embarazo [ver Recuadro de advertencia, Contraindicaciones (4.1)]. Las cápsulas de lenalidomida son un análogo de la talidomida y pueden provocar defectos de nacimiento graves o la muerte de un bebé en desarrollo [ver Advertencias y precauciones (5.1), Uso en poblaciones específicas (8.1)].
- Aconseje a las mujeres con potencial reproductivo que deben evitar el embarazo mientras toman cápsulas de lenalidomida y durante al menos 4 semanas después de completar el tratamiento.
- Inicie el tratamiento con cápsulas de lenalidomida en mujeres con potencial reproductivo solo después de una prueba de embarazo negativa.
- Informe a las mujeres con potencial reproductivo sobre la importancia de las pruebas de embarazo mensuales y la necesidad de utilizar 2 formas diferentes de anticoncepción, incluyendo al menos 1 forma altamente eficaz, simultáneamente durante el tratamiento con cápsulas de lenalidomida, durante la interrupción de la dosis y durante 4 semanas después de que haya terminado completamente de tomar las cápsulas de lenalidomida. Las formas altamente eficaces de anticoncepción, además de la ligadura de trompas, incluyen el DIU y los métodos hormonales (píldoras anticonceptivas, inyecciones, parches o implantes) y la vasectomía de la pareja. Los métodos anticonceptivos eficaces adicionales incluyen el condón de látex o sintético, el diafragma y el capuchón cervical.
- Indique a la paciente que deje de tomar las cápsulas de lenalidomida inmediatamente y que se ponga en contacto con su proveedor de atención médica si queda embarazada mientras toma este medicamento, si se retrasa su período menstrual o experimenta un sangrado menstrual inusual, si deja de tomar anticonceptivos o si cree, POR CUALQUIER MOTIVO, que puede estar embarazada.
- Aconseje a la paciente que si su proveedor de atención médica no está disponible, debe llamar al Centro de llamadas de REMS al 1-888-423-5436 [ver Advertencias y precauciones (5.1), Uso en poblaciones específicas (8.3)].
- Aconseje a los hombres que siempre usen un condón de látex o sintético durante cualquier contacto sexual con mujeres con potencial reproductivo mientras toman cápsulas de lenalidomida y hasta 4 semanas después de suspender las cápsulas de lenalidomida, incluso si se han sometido a una vasectomía exitosa.
- Aconseje a los pacientes varones que toman cápsulas de lenalidomida que no deben donar esperma y hasta 4 semanas después de la suspensión de las cápsulas de lenalidomida [ver Advertencias y precauciones (5.1), Uso en poblaciones específicas (8.3)].
- Se debe indicar a todos los pacientes que no donen sangre mientras toman cápsulas de lenalidomida, durante las interrupciones de la dosis y durante 4 semanas después de la suspensión de las cápsulas de lenalidomida [ver Advertencias y precauciones (5.1)].
Programa REMS de lenalidomida
Debido al riesgo de toxicidad embriofetal, las cápsulas de lenalidomida solo están disponibles a través de un programa restringido llamado Programa REMS de lenalidomida [ver Advertencias y precauciones (5.2)].
- Los pacientes deben firmar un formulario de acuerdo entre el paciente y el médico y cumplir con los requisitos para recibir las cápsulas de lenalidomida. En particular, las mujeres con potencial reproductivo deben cumplir con los requisitos de las pruebas de embarazo y la anticoncepción, y participar en encuestas telefónicas mensuales. Los hombres deben cumplir con los requisitos de anticoncepción [ver Uso en poblaciones específicas (8.3)].
- Las cápsulas de lenalidomida solo están disponibles en farmacias certificadas en el Programa REMS de lenalidomida. Proporcione a los pacientes el número de teléfono y el sitio web para obtener información sobre cómo obtener el producto.
Registro de exposición durante el embarazo
Informe a las mujeres que existe un Registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a las cápsulas de lenalidomida durante el embarazo y que pueden comunicarse con el Registro de exposición durante el embarazo llamando al 1-888-423-5436 [ver Uso en poblaciones específicas (8.1)].
Toxicidad hematológica
Informe a los pacientes que las cápsulas de lenalidomida están asociadas con neutropenia y trombocitopenia significativas [ver Recuadro de advertencia, Advertencias y precauciones (5.3)].
Tromboembolismo venoso y arterial
Informe a los pacientes sobre el riesgo de trombosis, incluyendo TVP, EP, IM y accidente cerebrovascular, y que informen inmediatamente cualquier signo y síntoma que sugiera estos eventos para su evaluación [ver Recuadro de advertencia, Advertencias y precauciones (5.4)].
Aumento de la mortalidad en pacientes con LLC
Informe a los pacientes que las cápsulas de lenalidomida aumentaron la mortalidad en pacientes con LLC y reacciones adversas cardiovasculares graves, incluyendo fibrilación auricular, infarto de miocardio e insuficiencia cardíaca [ver Advertencias y precauciones (5.5)].
Segundas neoplasias primarias
Informe a los pacientes sobre el riesgo potencial de desarrollar segundas neoplasias primarias durante el tratamiento con cápsulas de lenalidomida [ver Advertencias y precauciones (5.6)].
Hepatotoxicidad
Informe a los pacientes sobre el riesgo de hepatotoxicidad, incluyendo insuficiencia hepática y muerte, y que informen cualquier signo y síntoma asociado con este evento a su proveedor de atención médica para su evaluación [ver Advertencias y precauciones (5.8)].
Reacciones cutáneas graves
Informe a los pacientes sobre el riesgo potencial de reacciones cutáneas graves, como SSJ, NET y DRESS, y que informen cualquier signo y síntoma asociado con estas reacciones a su proveedor de atención médica para su evaluación. Los pacientes con antecedentes de erupción cutánea de grado 4 asociada con el tratamiento con talidomida no deben recibir cápsulas de lenalidomida [ver Advertencias y precauciones (5.9)].
Síndrome de lisis tumoral
Informe a los pacientes sobre el riesgo potencial de síndrome de lisis tumoral y pídales que informen a su proveedor de atención médica sobre cualquier signo y síntoma asociado con este evento para su evaluación [consulte Advertencias y precauciones (5.10)].
Reacción tumoral aguda
Informe a los pacientes sobre el riesgo potencial de reacción tumoral aguda y pídales que informen a su proveedor de atención médica sobre cualquier signo y síntoma asociado con este evento para su evaluación [consulte Advertencias y precauciones (5.11)].
Hipersensibilidad
Informe a los pacientes sobre la posibilidad de reacciones de hipersensibilidad graves, como angioedema y anafilaxia, a las cápsulas de lenalidomida. Indique a los pacientes que se comuniquen con su proveedor de atención médica de inmediato si presentan signos y síntomas de estas reacciones. Aconseje a los pacientes que busquen atención médica de emergencia si presentan signos o síntomas de reacciones de hipersensibilidad graves [consulte Advertencias y precauciones (5.15)].
Instrucciones de dosificación
Informe a los pacientes cómo tomar las cápsulas de lenalidomida [consulte Posología y administración (2)]
- Las cápsulas de lenalidomida deben tomarse una vez al día, aproximadamente a la misma hora todos los días,
- Las cápsulas de lenalidomida pueden tomarse con o sin alimentos.
- Las cápsulas no deben abrirse, romperse ni masticarse. Las cápsulas de lenalidomida deben tragarse enteras con agua.
- Indique a los pacientes que si olvidan una dosis de cápsulas de lenalidomida, aún pueden tomarla hasta 12 horas después de la hora en que normalmente la tomarían. Si han transcurrido más de 12 horas, se les debe indicar que omitan la dosis de ese día. Al día siguiente, deben tomar las cápsulas de lenalidomida a la hora habitual. Advierta a los pacientes que no tomen 2 dosis para compensar la que olvidaron.
SECCIÓN SIN CLASIFICAR DE SPL
Fabricado por:
Lotus Pharmaceutical Co., Ltd.
Ciudad de Nantou, Condado de Nantou
54066 Taiwán
O
Fabricado por:
Haupt Pharma Amareg GmbH
Ratisbona, Baviera D-93055,
Alemania
Distribuido por:
Alvogen, Inc.
Morristown, NJ 07960 EE. UU.
Producto de la India
PI483-00
Rev. 11/2023
GUÍA DEL MEDICAMENTO
| Esta Guía del Medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos. Revisado: Noviembre de 2023 PL483-00 |
|||
| GUÍA DEL MEDICAMENTO Lenalidomida (len” a lid’ oh mide) Cápsulas |
|||
| ¿Cuál es la información más importante que debo saber sobre las cápsulas de lenalidomida? Antes de comenzar a tomar cápsulas de lenalidomida, debe leer y aceptar todas las instrucciones del programa Lenalidomida REMS. Antes de recetarle cápsulas de lenalidomida, su proveedor de atención médica le explicará el programa Lenalidomida REMS y le hará firmar el Formulario de Acuerdo Paciente-Médico. Las cápsulas de lenalidomida pueden causar efectos secundarios graves, que incluyen:
|
|||
| ¿Qué son las cápsulas de lenalidomida? Las cápsulas de lenalidomida son un medicamento recetado, utilizado para tratar a adultos con:
Las cápsulas de lenalidomida no deben utilizarse para tratar a personas que tienen leucemia linfocítica crónica (LLC) a menos que sean participantes en un ensayo clínico controlado. |
|||
| ¿Quién no debe tomar cápsulas de lenalidomida? No tome cápsulas de lenalidomida si usted:
|
|||
| ¿Qué debo decirle a mi proveedor de atención médica antes de tomar cápsulas de lenalidomida? Antes de tomar cápsulas de lenalidomida, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si usted:
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos herbales. Las cápsulas de lenalidomida y otros medicamentos pueden afectar entre sí, causando efectos secundarios graves. Hable con su proveedor de atención médica antes de tomar cualquier medicamento nuevo. |
|||
¿Cómo debo tomar las cápsulas de lenalidomida?
|
|||
¿Qué debo evitar mientras tomo cápsulas de lenalidomida?
|
|||
| ¿Cuáles son los posibles efectos secundarios de las cápsulas de lenalidomida? Las cápsulas de lenalidomida pueden causar efectos secundarios graves, que incluyen:
|
|||
|
|
||
|
|||
|
|||
|
|
|
|
|
|||
|
|
||
Su proveedor de atención médica puede indicarle que disminuya la dosis, suspenda temporalmente o suspenda permanentemente la toma de las cápsulas de lenalidomida si desarrolla ciertos efectos secundarios graves durante el tratamiento con las cápsulas de lenalidomida.
Los efectos secundarios más comunes de las cápsulas de lenalidomida incluyen: |
|||
|
|
|
|
| Estos no son todos los posibles efectos secundarios de las cápsulas de lenalidomida. Llame a su médico para obtener consejo médico sobre los efectos secundarios. Puede informar sobre los efectos secundarios a la FDA al 1-800-FDA-1088. |
|||
¿Cómo debo almacenar las cápsulas de lenalidomida?
Mantenga las cápsulas de lenalidomida y todos los medicamentos fuera del alcance de los niños. |
|||
| Información general sobre el uso seguro y efectivo de las cápsulas de lenalidomida A veces se recetan medicamentos para fines distintos de los enumerados en una Guía de Medicación. No tome las cápsulas de lenalidomida para afecciones para las que no se le recetaron. No dé las cápsulas de lenalidomida a otras personas, incluso si tienen los mismos síntomas que usted. Puede causarles daño y provocar defectos de nacimiento. Si desea obtener más información, hable con su proveedor de atención médica. Puede preguntarle a su proveedor de atención médica o farmacéutico sobre las cápsulas de lenalidomida que están escritas para profesionales de la salud. |
|||
| ¿Cuáles son los ingredientes de las cápsulas de lenalidomida? Ingrediente activo: lenalidomida Ingredientes inactivos: croscarmelosa sódica, lactosa anhidra, estearato de magnesio y celulosa microcristalina. La cápsula de 2.5 mg contiene gelatina, óxido de hierro rojo, óxido de hierro amarillo, dióxido de titanio, FD&C azul #1, FD&C rojo #3, FD&C rojo #40 y tinta negra. La cápsula de 5 mg contiene gelatina, dióxido de titanio, óxido de hierro negro, óxido de hierro rojo, óxido de hierro amarillo, FD&C azul #1, FD&C amarillo #6 y tinta negra. La cápsula de 10 mg contiene gelatina, dióxido de titanio, FD&C azul #1, FD&C rojo #40, FD&C amarillo #6, FD&C amarillo #5 y tinta negra. La cápsula de 15 mg contiene gelatina, dióxido de titanio, FD&C azul #1, FD&C rojo #40, FD&C amarillo #5, óxido de hierro negro, óxido de hierro rojo, óxido de hierro amarillo y tinta negra. La cápsula de 20 mg contiene gelatina, dióxido de titanio, FD&C azul #1, FD&C rojo #40, óxido de hierro rojo, óxido de hierro amarillo y tinta negra. La cápsula de 25 mg contiene gelatina, dióxido de titanio y tinta negra. La tinta de impresión negra contiene goma laca, solución de amoníaco fuerte, óxido de hierro negro. Fabricado por: Lotus Pharmaceutical Co., Ltd., Nantou City, Nantou County 54066 Taiwan |
|||
ETIQUETA DEL ENVASE SECCIÓN DEL PANEL DE VISUALIZACIÓN PRINCIPAL
NDC 47781-483-28
Cápsulas de Lenalidomida
2.5 mg
ATENCIÓN FARMACÉUTICO: Entregue la Guía de Medicamentos adjunta a cada paciente.
ADVERTENCIA: POSIBILIDAD DE DEFECTOS DE NACIMIENTO
Rx only 28 Capsules

ETIQUETA PRINCIPAL DEL ENVASE
NDC 47781-484-28
Cápsulas de Lenalidomida
5 mg
ATENCIÓN FARMACÉUTICO: Entregue la Guía de Medicamentos adjunta a cada paciente.
ADVERTENCIA: POSIBILIDAD DE DEFECTOS DE NACIMIENTO EN HUMANOS
Rx solamente 28 Cápsulas

ETIQUETA PRINCIPAL DEL ENVASE
NDC 47781-485-28
Cápsulas de Lenalidomida
10 mg
ATENCIÓN FARMACÉUTICO: Entregue la Guía de Medicamentos adjunta a cada paciente.
ADVERTENCIA: POSIBILIDAD DE DEFECTOS DE NACIMIENTO HUMANOS
Rx solamente 28 Cápsulas

ETIQUETA DEL ENVASE SECCIÓN PRINCIPAL DEL PANEL DE VISUALIZACIÓN
NDC 47781-487-77
Cápsulas de Lenalidomida
20 mg
ATENCIÓN FARMACÉUTICO: Entregue la Guía de Medicamentos adjunta a cada paciente.
ADVERTENCIA: POSIBILIDAD DE DEFECTOS DE NACIMIENTO
Rx only 21 Cápsulas

ETIQUETA DEL PAQUETE PANEL PRINCIPAL
NDC 47781-488-77
Cápsulas de Lenalidomida
25 mg
ATENCIÓN FARMACÉUTICO: Dispense la Guía de Medicación adjunta a cada paciente.
ADVERTENCIA: POSIBLES DEFECTOS DE NACIMIENTO EN HUMANOS
Solo con receta médica 21 Cápsulas


