Fabricante de medicamentos: Pfizer Laboratories Div Pfizer Inc (Updated: 2025-01-08)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
CHANTIX® (vareniclina) comprimidos, para administración oral
Aprobación inicial en EE. UU.: 2006
CAMBIOS IMPORTANTES RECIENTES
|
Advertencias y precauciones, Eventos cardiovasculares (5.5) |
6/2018 |
INDICACIONES Y USO
DOSIFICACIÓN Y ADMINISTRACIÓN
- •
- Comience la dosificación de CHANTIX una semana antes de la fecha establecida por el paciente para dejar de fumar. Alternativamente, el paciente puede comenzar la dosificación de CHANTIX y luego dejar de fumar entre los días 8 y 35 del tratamiento. (2.1)
- •
- Semana inicial: 0.5 mg una vez al día los días 1–3 y 0.5 mg dos veces al día los días 4–7. (2.1)
- •
- Semanas siguientes: 1 mg dos veces al día durante un total de 12 semanas. (2.1)
- •
- Se recomiendan 12 semanas adicionales de tratamiento para quienes dejan de fumar con éxito a fin de aumentar la probabilidad de abstinencia a largo plazo. (2.1)
- •
- Considere un enfoque gradual para dejar de fumar con CHANTIX para los pacientes que están seguros de que no pueden o no quieren dejar de fumar abruptamente. Los pacientes deben comenzar la dosificación de CHANTIX y reducir el consumo de tabaco en un 50% desde la línea de base dentro de las primeras cuatro semanas, en un 50% adicional en las siguientes cuatro semanas y continuar reduciendo con el objetivo de lograr la abstinencia completa en 12 semanas. Continúe el tratamiento durante 12 semanas adicionales, para un total de 24 semanas. (2.1)
- •
- Insuficiencia renal grave (aclaramiento de creatinina estimado inferior a 30 mL/min): Comience con 0.5 mg una vez al día y aumente la dosis a 0.5 mg dos veces al día. Para pacientes con enfermedad renal en etapa terminal que se someten a hemodiálisis, se puede administrar un máximo de 0.5 mg diarios si se tolera. (2.2)
- •
- Considere la reducción de la dosis para los pacientes que no toleran los efectos adversos. (2.1)
- •
- Se recomienda otro intento de tratamiento para aquellos que no logran dejar de fumar o recaen cuando se han abordado los factores que contribuyen al intento fallido. (2.1)
- •
- Proporcione a los pacientes materiales educativos y asesoramiento adecuados para apoyar el intento de dejar de fumar. (2.1)
PRESENTACIONES Y CONCENTRACIONES
Tabletas: 0.5 mg y 1 mg (3)
CONTRAINDICACIONES
Antecedentes de hipersensibilidad grave o reacciones cutáneas a CHANTIX. (4)
ADVERTENCIAS Y PRECAUCIONES
- •
- Eventos adversos neuropsiquiátricos: Los informes posteriores a la comercialización de eventos adversos neuropsiquiátricos graves o clínicamente significativos han incluido cambios en el estado de ánimo (incluida la depresión y la manía), psicosis, alucinaciones, paranoia, delirios, ideación homicida, agresión, hostilidad, agitación, ansiedad y pánico, así como ideación suicida, intento de suicidio y suicidio consumado. Observe a los pacientes que intentan dejar de fumar con CHANTIX para detectar la aparición de dichos síntomas e indíqueles que interrumpan el uso de CHANTIX y se comuniquen con un proveedor de atención médica si experimentan dichos eventos adversos. (5.1)
- •
- Convulsiones: Se han observado convulsiones nuevas o que empeoran en pacientes que toman CHANTIX. CHANTIX debe usarse con precaución en pacientes con antecedentes de convulsiones u otros factores que puedan disminuir el umbral convulsivo. (5.2)
- •
- Interacción con el alcohol: Se han notificado efectos aumentados del alcohol. Indique a los pacientes que reduzcan la cantidad de alcohol que consumen hasta que sepan si CHANTIX les afecta. (5.3)
- •
- Lesiones accidentales: Se han notificado lesiones accidentales (por ejemplo, accidentes de tráfico). Indique a los pacientes que tengan precaución al conducir o manejar maquinaria hasta que sepan cómo CHANTIX puede afectarles. (5.4)
- •
- Eventos cardiovasculares: Los pacientes con enfermedad cardiovascular (CV) subyacente pueden tener un mayor riesgo de eventos CV; sin embargo, estas preocupaciones deben equilibrarse con los beneficios para la salud de dejar de fumar. Indique a los pacientes que notifiquen a sus proveedores de atención médica sobre síntomas CV nuevos o que empeoran y que busquen atención médica inmediata si experimentan signos y síntomas de infarto de miocardio (IM) o accidente cerebrovascular. (5.5 y 6.1)
- •
- Somnambulismo: Se han notificado casos de somnambulismo en pacientes que toman CHANTIX. Algunos casos describieron comportamiento dañino para sí mismos, para otros o para la propiedad. Indique a los pacientes que interrumpan el uso de CHANTIX y notifiquen a su proveedor de atención médica si experimentan somnambulismo. (5.6 y 6.2)
- •
- Angioedema y reacciones de hipersensibilidad: Se han notificado dichas reacciones, incluido el angioedema, con poca frecuencia potencialmente mortales. Indique a los pacientes que interrumpan el uso de CHANTIX y busquen atención médica inmediata si aparecen síntomas. (5.7 y 6.2)
- •
- Reacciones cutáneas graves: Se han notificado reacciones cutáneas raras, potencialmente mortales. Indique a los pacientes que interrumpan el uso de CHANTIX y se comuniquen con un proveedor de atención médica inmediatamente ante la primera aparición de erupción cutánea con lesiones mucosas. (5.8 y 6.2)
- •
- Náuseas: Las náuseas son la reacción adversa más común (tasa de incidencia de hasta el 30%). La reducción de la dosis puede ser útil. (5.9)
REACCIONES ADVERSAS
Las reacciones adversas más comunes (>5% y el doble de la tasa observada en pacientes tratados con placebo) fueron náuseas, sueños anormales (por ejemplo, vívidos, inusuales o extraños), estreñimiento, flatulencia y vómitos. (6)
Para notificar SOSPECHAS DE REACCIONES ADVERSAS, comuníquese con Pfizer Inc. al 1-800-438-1985 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES MEDICAMENTOSAS
- •
- Otras terapias para dejar de fumar: No se ha establecido la seguridad y eficacia en combinación con otras terapias para dejar de fumar. La administración conjunta de vareniclina y nicotina transdérmica provocó una alta tasa de interrupción debido a eventos adversos. (7.1)
- •
- Efecto de dejar de fumar en otros medicamentos: La farmacocinética o farmacodinamia de ciertos medicamentos (p. ej., teofilina, warfarina, insulina) puede alterarse, lo que requiere un ajuste de la dosis. (7.2)
Véase 17 para información para el paciente y guía de medicamentos.
Revisado: 2/2019
Tabla de contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis habitual para adultos
2.2 Dosis en poblaciones especiales
3 FORMAS Y CONCENTRACIONES FARMACÉUTICAS
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Eventos adversos neuropsiquiátricos, incluyendo suicidalidad
5.2 Convulsiones
5.3 Interacción con el alcohol
5.4 Lesiones accidentales
5.5 Eventos cardiovasculares
5.6 Somnambulismo
5.7 Angioedema y reacciones de hipersensibilidad
5.8 Reacciones cutáneas graves
5.9 Náuseas
6 REACCIONES ADVERSAS
6.1 Experiencia en ensayos clínicos
6.2 Experiencia postcomercialización
7 INTERACCIONES MEDICAMENTOSAS
7.1 Uso con otros medicamentos para dejar de fumar
7.2 Efecto de dejar de fumar en otros medicamentos
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso pediátrico
8.5 Uso geriátrico
8.6 Insuficiencia renal
9 ABUSO Y DEPENDENCIA DE MEDICAMENTOS
9.1 Sustancia controlada
9.3 Dependencia
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Inicio de la abstinencia
14.2 Deseo de fumar
14.3 Abstinencia a largo plazo
14.4 Instrucciones alternativas para establecer una fecha para dejar de fumar
14.5 Enfoque gradual para dejar de fumar
14.6 Estudio de retratamiento
14.7 Sujetos con enfermedad pulmonar obstructiva crónica
14.8 Sujetos con enfermedad cardiovascular y otros análisis cardiovasculares
14.9 Sujetos con trastorno depresivo mayor
14.10 Ensayo de resultados de seguridad neuropsiquiátrica postcomercialización
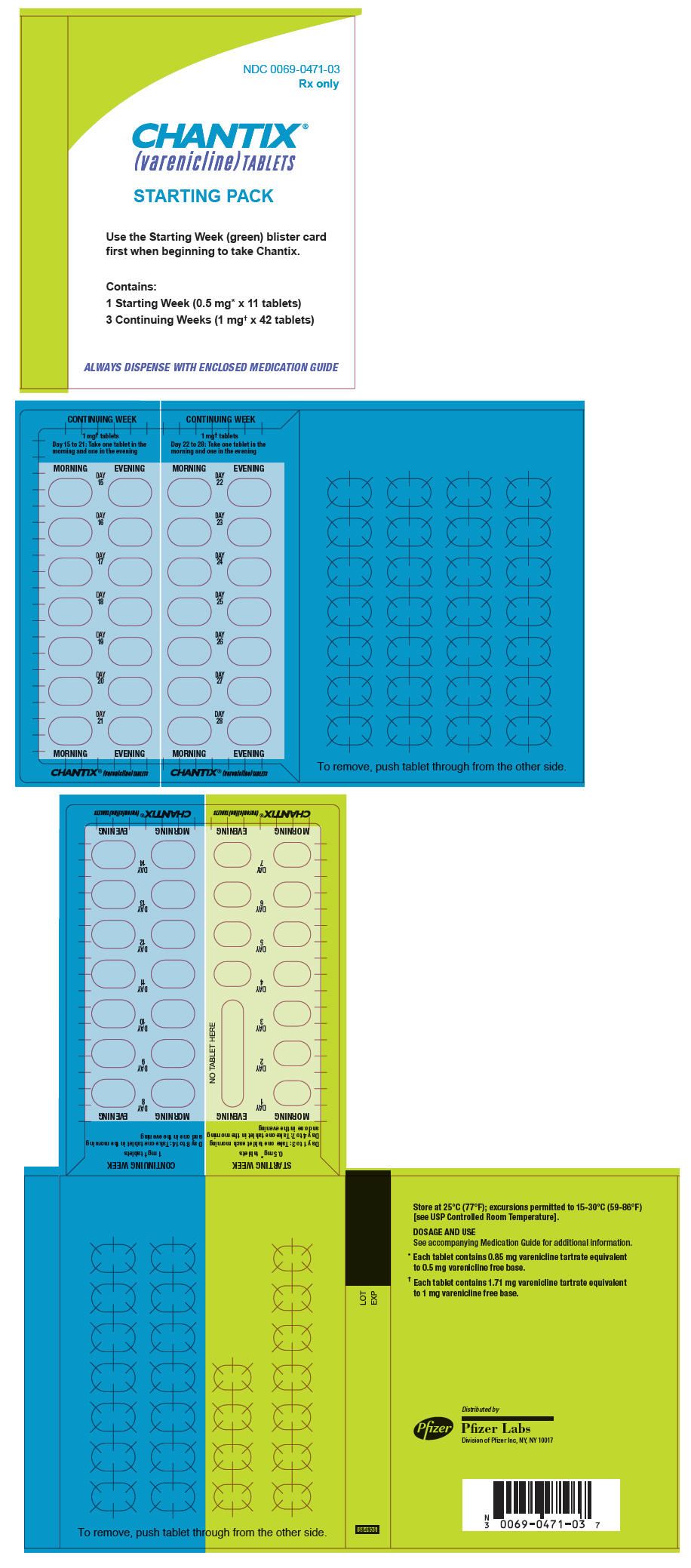
16 PRESENTACIÓN/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no se enumeran.
1 INDICACIONES Y USO
CHANTIX está indicado para usarse como ayuda en el tratamiento para dejar de fumar.
2 DOSIS Y ADMINISTRACIÓN
2.1 Dosis habitual para adultos
Las terapias para dejar de fumar tienen más probabilidades de éxito en pacientes que están motivados para dejar de fumar y que reciben asesoramiento y apoyo adicionales. Proporcione a los pacientes materiales educativos y asesoramiento adecuados para apoyar el intento de dejar de fumar.
El paciente debe fijar una fecha para dejar de fumar. Comience la dosificación de CHANTIX una semana antes de esta fecha. Alternativamente, el paciente puede comenzar la dosificación de CHANTIX y luego dejar de fumar entre los días 8 y 35 del tratamiento.
CHANTIX debe tomarse por vía oral después de comer y con un vaso lleno de agua.
La dosis recomendada de CHANTIX es de 1 mg dos veces al día después de una titulación de 1 semana de la siguiente manera:
|
Días 1 – 3: |
0.5 mg una vez al día |
|
Días 4 – 7: |
0.5 mg dos veces al día |
|
Día 8 – final del tratamiento: |
1 mg dos veces al día |
Los pacientes deben ser tratados con CHANTIX durante 12 semanas. Para los pacientes que han dejado de fumar con éxito al final de las 12 semanas, se recomienda un ciclo adicional de 12 semanas de tratamiento con CHANTIX para aumentar aún más la probabilidad de abstinencia a largo plazo.
Para los pacientes que están seguros de que no pueden o no quieren dejar de fumar abruptamente, considere un enfoque gradual para dejar de fumar con CHANTIX. Los pacientes deben comenzar la dosificación de CHANTIX y reducir el consumo de tabaco en un 50% desde el inicio dentro de las primeras cuatro semanas, en un 50% adicional en las próximas cuatro semanas y continuar reduciendo con el objetivo de alcanzar la abstinencia completa en 12 semanas. Continúe el tratamiento con CHANTIX durante 12 semanas adicionales, para un total de 24 semanas de tratamiento. Anime a los pacientes a intentar dejar de fumar antes si se sienten listos [see Clinical Studies (14.5)].
Los pacientes que están motivados para dejar de fumar y que no lograron dejar de fumar durante la terapia previa con CHANTIX por razones distintas a la intolerancia debido a eventos adversos o que recayeron después del tratamiento, deben ser alentados a hacer otro intento con CHANTIX una vez que los factores que contribuyeron al intento fallido hayan sido identificados y abordados.
Considere una reducción de dosis temporal o permanente en pacientes que no pueden tolerar los efectos adversos de CHANTIX.
2.2 Dosis en poblaciones especiales
Pacientes con insuficiencia renal
No es necesario ajustar la dosis en pacientes con insuficiencia renal leve a moderada. Para los pacientes con insuficiencia renal grave (aclaramiento estimado de creatinina inferior a 30 ml por minuto), la dosis inicial recomendada de CHANTIX es de 0,5 mg una vez al día. La dosis puede ajustarse según sea necesario hasta una dosis máxima de 0,5 mg dos veces al día. Para los pacientes con enfermedad renal en etapa terminal sometidos a hemodiálisis, se puede administrar una dosis máxima de 0,5 mg una vez al día si se tolera [see Use in Specific Populations (8.6), Clinical Pharmacology (12.3)].
Pacientes ancianos y pacientes con insuficiencia hepática
No es necesario ajustar la dosis en pacientes con insuficiencia hepática. Debido a que los pacientes ancianos tienen mayor probabilidad de tener una función renal disminuida, se debe tener cuidado en la selección de la dosis y puede ser útil controlar la función renal [see Use in Specific Populations (8.5)].
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Tabletas capsulares, biconvexas: 0.5 mg (blancas a blanquecinas, con la inscripción “Pfizer” en una cara y “CHX 0.5” en la otra) y 1 mg (azul claro, con la inscripción “Pfizer” en una cara y “CHX 1.0” en la otra).
4 CONTRAINDICACIONES
CHANTIX está contraindicado en pacientes con un historial conocido de reacciones de hipersensibilidad graves o reacciones cutáneas a CHANTIX.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Eventos Adversos Neuropsiquiátricos, Incluido el Suicidio
Se han reportado eventos adversos neuropsiquiátricos graves en pacientes tratados con CHANTIX [ver Reacciones Adversas (6.2)]. Estos informes posteriores a la comercialización han incluido cambios en el estado de ánimo (incluyendo depresión y manía), psicosis, alucinaciones, paranoia, delirios, ideas homicidas, agresión, hostilidad, agitación, ansiedad y pánico, así como ideas suicidas, intentos de suicidio y suicidio consumado. Algunos pacientes que dejaron de fumar pueden haber experimentado síntomas de abstinencia de nicotina, incluido el estado de ánimo deprimido. Se ha reportado depresión, raramente incluyendo ideas suicidas, en fumadores que intentan dejar de fumar sin medicación. Sin embargo, algunos de estos eventos adversos ocurrieron en pacientes que tomaban CHANTIX y continuaban fumando.
Los eventos adversos neuropsiquiátricos ocurrieron en pacientes sin y con enfermedad psiquiátrica preexistente; algunos pacientes experimentaron un empeoramiento de sus enfermedades psiquiátricas. Algunos eventos adversos neuropsiquiátricos, incluyendo comportamiento inusual y a veces agresivo dirigido a uno mismo o a otros, pueden haber empeorado por el consumo concomitante de alcohol [ver Advertencias y Precauciones (5.3), Reacciones Adversas (6.2)]. Observe a los pacientes para detectar la aparición de eventos adversos neuropsiquiátricos. Aconseje a los pacientes y a sus cuidadores que el paciente debe dejar de tomar CHANTIX y contactar a un profesional de la salud inmediatamente si se observa agitación, estado de ánimo deprimido o cambios en el comportamiento o el pensamiento que no son típicos del paciente, o si el paciente desarrolla ideas o comportamiento suicida. El profesional de la salud debe evaluar la gravedad de los síntomas y la medida en que el paciente se beneficia del tratamiento, y considerar opciones que incluyen la reducción de la dosis, la continuación del tratamiento bajo una supervisión más estrecha o la interrupción del tratamiento. En muchos casos posteriores a la comercialización, se reportó la resolución de los síntomas después de la interrupción de CHANTIX. Sin embargo, los síntomas persistieron en algunos casos; por lo tanto, se debe proporcionar un seguimiento continuo y atención de apoyo hasta que los síntomas se resuelvan.
La seguridad neuropsiquiátrica de CHANTIX se evaluó en un estudio aleatorizado, doble ciego, controlado con placebo y activo que incluyó a pacientes sin antecedentes de trastornos psiquiátricos (cohorte no psiquiátrica, N=3912) y pacientes con antecedentes de trastornos psiquiátricos (cohorte psiquiátrica, N=4003). En la cohorte no psiquiátrica, CHANTIX no se asoció con una mayor incidencia de eventos adversos neuropsiquiátricos clínicamente significativos en un criterio de valoración compuesto que comprendía ansiedad, depresión, sensación anormal, hostilidad, agitación, agresión, delirios, alucinaciones, ideas homicidas, manía, pánico e irritabilidad. En la cohorte psiquiátrica, se reportaron más eventos en cada grupo de tratamiento en comparación con la cohorte no psiquiátrica, y la incidencia de eventos en el criterio de valoración compuesto fue mayor para cada uno de los tratamientos activos en comparación con el placebo: las diferencias de riesgo (DR) (IC del 95%) frente al placebo fueron del 2,7% (-0,05; 5,4) para CHANTIX, del 2,2% (-0,5; 4,9) para bupropión y del 0,4% (-2,2; 3,0) para la nicotina transdérmica. En la cohorte no psiquiátrica, se reportaron eventos adversos neuropsiquiátricos de naturaleza grave en el 0,1% de los pacientes tratados con CHANTIX y en el 0,4% de los pacientes tratados con placebo. En la cohorte psiquiátrica, se reportaron eventos neuropsiquiátricos de naturaleza grave en el 0,6% de los pacientes tratados con CHANTIX, con un 0,5% que involucró hospitalización psiquiátrica. En los pacientes tratados con placebo, se produjeron eventos neuropsiquiátricos graves en el 0,6%, con un 0,2% que requirió hospitalización psiquiátrica [ver Estudios Clínicos (14.10)].
5.2 Convulsiones
Durante los ensayos clínicos y la experiencia posterior a la comercialización, se han reportado convulsiones en pacientes tratados con CHANTIX. Algunos pacientes no tenían antecedentes de convulsiones, mientras que otros tenían antecedentes de trastornos convulsivos que eran remotos o estaban bien controlados. En la mayoría de los casos, la convulsión ocurrió dentro del primer mes de terapia. Sopese este riesgo potencial frente a los beneficios potenciales antes de prescribir CHANTIX en pacientes con antecedentes de convulsiones u otros factores que pueden disminuir el umbral convulsivo. Aconseje a los pacientes que interrumpan el tratamiento con CHANTIX y que se pongan en contacto con un profesional de la salud inmediatamente si experimentan una convulsión durante el tratamiento [ver Reacciones Adversas (6.2)].
5.3 Interacción con el Alcohol
Ha habido informes posteriores a la comercialización de pacientes que experimentaron un aumento de los efectos intoxicantes del alcohol mientras tomaban CHANTIX. Algunos casos describieron un comportamiento inusual y a veces agresivo, y a menudo iban acompañados de amnesia de los eventos. Aconseje a los pacientes que reduzcan la cantidad de alcohol que consumen mientras toman CHANTIX hasta que sepan si CHANTIX afecta su tolerancia al alcohol [ver Reacciones Adversas (6.2)].
5.4 Lesiones Accidentales
Ha habido informes posteriores a la comercialización de accidentes de tráfico, incidentes de casi accidentes en el tráfico u otras lesiones accidentales en pacientes que toman CHANTIX. En algunos casos, los pacientes reportaron somnolencia, mareos, pérdida del conocimiento o dificultad para concentrarse que resultaron en un impedimento, o preocupación por un posible impedimento, para conducir o manejar maquinaria. Aconseje a los pacientes que tengan precaución al conducir o manejar maquinaria o al participar en otras actividades potencialmente peligrosas hasta que sepan cómo CHANTIX puede afectarlos.
5.5 Eventos Cardiovasculares
Una evaluación integral del riesgo cardiovascular (CV) con CHANTIX sugiere que los pacientes con enfermedad CV subyacente pueden tener un mayor riesgo; sin embargo, estas preocupaciones deben equilibrarse con los beneficios para la salud de dejar de fumar. El riesgo CV se ha evaluado para CHANTIX en ensayos controlados aleatorios (ECA) y metanálisis de ECA. En un ensayo para dejar de fumar en pacientes con enfermedad CV estable, los eventos CV fueron poco frecuentes en general; sin embargo, el infarto de miocardio (IM) no mortal y el accidente cerebrovascular no mortal ocurrieron con mayor frecuencia en pacientes tratados con CHANTIX en comparación con el placebo. La mortalidad por todas las causas y CV fue menor en los pacientes tratados con CHANTIX [ver Estudios Clínicos (14.8)]. Este estudio se incluyó en un metanálisis de 15 ensayos de eficacia de CHANTIX en diversas poblaciones clínicas que mostró un aumento en la razón de riesgo para eventos cardiovasculares adversos mayores (MACE) de 1.95; sin embargo, el hallazgo no fue estadísticamente significativo (IC del 95%: 0.79, 4.82). En el gran ensayo posterior a la comercialización de resultados de seguridad neuropsiquiátrica, se realizó un análisis de los eventos MACE adjudicados para los pacientes mientras estaban en el ensayo y durante un período de extensión sin tratamiento de 28 semanas. Se produjeron pocos eventos MACE durante el ensayo; por lo tanto, los hallazgos no contribuyeron sustancialmente a la comprensión del riesgo CV con CHANTIX. Indique a los pacientes que notifiquen a sus proveedores de atención médica sobre los síntomas CV nuevos o que empeoran y que busquen atención médica inmediata si experimentan signos y síntomas de IM o accidente cerebrovascular [ver Estudios Clínicos (14.10)].
5.6 Sonambulismo
Se han reportado casos de sonambulismo en pacientes que toman CHANTIX. Algunos casos describieron comportamientos dañinos para sí mismos, para otros o para la propiedad. Indique a los pacientes que suspendan CHANTIX y notifiquen a su proveedor de atención médica si experimentan sonambulismo [ver Reacciones Adversas (6.2)].
5.7 Angioedema y Reacciones de Hipersensibilidad
Ha habido informes posteriores a la comercialización de reacciones de hipersensibilidad, incluido angioedema, en pacientes tratados con CHANTIX [ver Reacciones Adversas (6.2), Información de Asesoramiento al Paciente (17)]. Los signos clínicos incluyeron hinchazón de la cara, boca (lengua, labios y encías), extremidades y cuello (garganta y laringe). Hubo informes poco frecuentes de angioedema que puso en peligro la vida y que requirió atención médica de emergencia debido a compromiso respiratorio. Indique a los pacientes que suspendan CHANTIX y busquen atención médica de inmediato si experimentan estos síntomas.
5.8 Reacciones Cutáneas Graves
Ha habido informes posteriores a la comercialización de reacciones cutáneas raras pero graves, incluido el síndrome de Stevens-Johnson y eritema multiforme, en pacientes que usan CHANTIX [ver Reacciones Adversas (6.2)]. Como estas reacciones cutáneas pueden poner en peligro la vida, indique a los pacientes que dejen de tomar CHANTIX y se comuniquen con un proveedor de atención médica de inmediato ante la primera aparición de una erupción cutánea con lesiones en las mucosas o cualquier otro signo de hipersensibilidad.
5.9 Náuseas
Las náuseas fueron la reacción adversa más común reportada con el tratamiento con CHANTIX. Las náuseas generalmente se describieron como leves o moderadas y a menudo transitorias; sin embargo, para algunos pacientes, persistió durante varios meses. La incidencia de náuseas fue dependiente de la dosis. El ajuste inicial de la dosis fue beneficioso para reducir la aparición de náuseas. Para los pacientes tratados con la dosis máxima recomendada de 1 mg dos veces al día después del ajuste inicial de la dosis, la incidencia de náuseas fue del 30% en comparación con el 10% en pacientes que tomaron un régimen de placebo comparable. En pacientes que tomaron CHANTIX 0.5 mg dos veces al día después del ajuste inicial, la incidencia fue del 16% en comparación con el 11% para el placebo. Aproximadamente el 3% de los pacientes tratados con CHANTIX 1 mg dos veces al día en estudios que involucraron 12 semanas de tratamiento interrumpieron el tratamiento prematuramente debido a las náuseas. Para los pacientes con náuseas intolerables, se debe considerar una reducción de la dosis.
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas graves se notificaron en la experiencia postcomercialización y se describen con mayor detalle en otras secciones del etiquetado:
- •
- Eventos adversos neuropsiquiátricos, incluida la suicidalidad [ver Advertencias y precauciones (5.1)]
- •
- Convulsiones [ver Advertencias y precauciones (5.2)]
- •
- Interacción con el alcohol [ver Advertencias y precauciones (5.3)]
- •
- Lesiones accidentales [ver Advertencias y precauciones (5.4)]
- •
- Eventos cardiovasculares [ver Advertencias y precauciones (5.5)]
- •
- Somnambulismo [ver Advertencias y precauciones (5.6)]
- •
- Angioedema y reacciones de hipersensibilidad [ver Advertencias y precauciones (5.7)]
- •
- Reacciones cutáneas graves [ver Advertencias y precauciones (5.8)]
En los estudios precomercialización controlados con placebo, los eventos adversos más comunes asociados con CHANTIX (>5% y el doble de la tasa observada en pacientes tratados con placebo) fueron náuseas, sueños anormales (vívidos, inusuales o extraños), estreñimiento, flatulencia y vómitos.
La tasa de interrupción del tratamiento debido a eventos adversos en pacientes tratados con 1 mg dos veces al día fue del 12% para CHANTIX, en comparación con el 10% para placebo en estudios de tres meses de tratamiento. En este grupo, las tasas de interrupción que son más altas que el placebo para los eventos adversos más comunes en pacientes tratados con CHANTIX fueron las siguientes: náuseas (3% vs. 0,5% para placebo), insomnio (1,2% vs. 1,1% para placebo) y sueños anormales (0,3% vs. 0,2% para placebo).
El abandono del hábito de fumar, con o sin tratamiento, se asocia con síntomas de abstinencia de nicotina y también se ha asociado con la exacerbación de enfermedades psiquiátricas subyacentes.
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones muy variables, las tasas de reacciones adversas observadas en los estudios clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica clínica.
Durante el desarrollo precomercialización de CHANTIX, más de 4500 sujetos estuvieron expuestos a CHANTIX, con más de 450 tratados durante al menos 24 semanas y aproximadamente 100 durante un año. La mayoría de los participantes del estudio fueron tratados durante 12 semanas o menos.
El evento adverso más común asociado con el tratamiento con CHANTIX son las náuseas, que ocurren en el 30% de los pacientes tratados con la dosis recomendada, en comparación con el 10% en los pacientes que toman un régimen de placebo comparable [ver Advertencias y precauciones (5.9)].
La Tabla 1 muestra los eventos adversos para CHANTIX y placebo en los estudios precomercialización de dosis fija de 12 semanas con titulación en la primera semana [Estudios 2 (solo brazo titulado), 4 y 5]. Los eventos adversos se categorizaron utilizando el Diccionario médico para actividades regulatorias (MedDRA, versión 7.1).
Se enumeran los términos de grupo de alto nivel (HLGT) de MedDRA notificados en ≥5% de los pacientes en el grupo de dosis de CHANTIX de 1 mg dos veces al día, y con más frecuencia que en el grupo placebo, junto con los términos preferidos (PT) subordinados notificados en ≥1% de los pacientes con CHANTIX (y al menos un 0,5% más frecuente que el placebo). Los términos preferidos estrechamente relacionados, como “Insomnio”, “Insomnio inicial”, “Insomnio medio”, “Despertar temprano por la mañana”, se agruparon, pero los pacientes individuales que informaron dos o más eventos agrupados solo se cuentan una vez.
| CLASE DE ÓRGANO DEL SISTEMA Término de grupo de alto nivel |
CHANTIX 0,5 mg BID |
CHANTIX 1 mg BID |
Placebo |
|---|---|---|---|
| Término preferido | N=129 | N=821 | N=805 |
|
GASTROINTESTINAL (GI) |
|||
|
Signos y síntomas de GI |
|||
|
Náuseas |
16 |
30 |
10 |
|
Dolor abdominal * |
5 |
7 |
5 |
|
Flatulencia |
9 |
6 |
3 |
|
Dispepsia |
5 |
5 |
3 |
|
Vómitos |
1 |
5 |
2 |
|
Trastornos de la motilidad/defecación GI |
|||
|
Estreñimiento |
5 |
8 |
3 |
|
Enfermedad por reflujo gastroesofágico |
1 |
1 |
0 |
|
Trastornos de las glándulas salivales |
|||
|
Boca seca |
4 |
6 |
4 |
|
TRASTORNO PSIQUIÁTRICOS |
|||
|
Trastornos/alteraciones del sueño |
|||
|
Insomnio † |
19 |
18 |
13 |
|
Sueños anormales |
9 |
13 |
5 |
|
Trastorno del sueño |
2 |
5 |
3 |
|
Pesadilla |
2 |
1 |
0 |
|
SISTEMA NERVIOSO |
|||
|
Cefaleas |
|||
|
Cefalea |
19 |
15 |
13 |
|
Trastornos neurológicos SN |
|||
|
Disgeusia |
8 |
5 |
4 |
|
Somnolencia |
3 |
3 |
2 |
|
Letargo |
2 |
1 |
0 |
|
TRASTRORNOS GENERALES |
|||
|
Trastornos Generales, sin especificar |
|||
|
Fatiga/Malestar/Astenia |
4 |
7 |
6 |
|
RESPIRATORIO/TORÁCICO/MEDIASTINO |
|||
|
Trastornos Respiratorios, sin especificar |
|||
|
Rinorrea |
0 |
1 |
0 |
|
Disnea |
2 |
1 |
1 |
|
Trastorno de las vías respiratorias superiores |
7 |
5 |
4 |
|
PIEL Y TEJIDO SUBCUTÁNEO |
|||
|
Afecciones epidérmicas y dérmicas |
|||
|
Erupción |
1 |
3 |
2 |
|
Prurito |
0 |
1 |
1 |
|
METABOLISMO Y NUTRICIÓN |
|||
|
Trastornos del apetito/Nutrición general |
|||
|
Aumento del apetito |
4 |
3 |
2 |
|
Disminución del apetito/Anorexia |
1 |
2 |
1 |
El patrón general y la frecuencia de los eventos adversos durante los ensayos precomercialización a largo plazo fueron similares a los descritos en la Tabla 1, aunque varios de los eventos más comunes fueron reportados por una mayor proporción de pacientes con uso a largo plazo (por ejemplo, náuseas fueron reportadas en el 40% de los pacientes tratados con CHANTIX 1 mg dos veces al día en un estudio de un año, en comparación con el 8% de los pacientes tratados con placebo).
A continuación, se presenta una lista de eventos adversos emergentes del tratamiento reportados por pacientes tratados con CHANTIX durante todos los ensayos clínicos precomercialización y actualizados en base a datos agrupados de 18 estudios pre y postcomercialización controlados con placebo, incluyendo aproximadamente 5,000 pacientes tratados con vareniclina. Los eventos adversos se categorizaron utilizando MedDRA, Versión 16.0. La lista no incluye aquellos eventos ya listados en las tablas anteriores o en otras partes del etiquetado, aquellos eventos para los cuales la causa del medicamento fue remota, aquellos eventos que fueron tan generales como para ser poco informativos, y aquellos eventos reportados solo una vez que no tuvieron una probabilidad sustancial de ser agudamente potencialmente mortales.
Trastornos de la sangre y del sistema linfático. Poco frecuentes: anemia, linfadenopatía. Raros: leucocitosis, esplenomegalia, trombocitopenia.
Trastornos cardíacos. Poco frecuentes: angina de pecho, infarto de miocardio, palpitaciones, taquicardia. Raros: síndrome coronario agudo, arritmia, fibrilación auricular, bradicardia, aleteo cardíaco, cor pulmonale, enfermedad de la arteria coronaria, extrasístoles ventriculares.
Trastornos del oído y del laberinto. Poco frecuentes: tinnitus, vértigo. Raros: sordera, enfermedad de Ménière.
Trastornos endocrinos. Poco frecuentes: trastornos de la glándula tiroides.
Trastornos oculares. Poco frecuentes: conjuntivitis, irritación ocular, dolor ocular, visión borrosa, discapacidad visual. Raros: ceguera transitoria, catarata subcapsular, ojo seco, ceguera nocturna, trastorno vascular ocular, fotofobia, moscas volantes.
Trastornos gastrointestinales. Frecuentes: diarrea, dolor de muelas. Poco frecuentes: disfagia, eructos, gastritis, hemorragia gastrointestinal, ulceración bucal. Raros: enterocolitis, esofagitis, úlcera gástrica, obstrucción intestinal, pancreatitis aguda.
Trastornos generales y alteraciones en el lugar de administración. Frecuentes: dolor torácico. Poco frecuentes: malestar torácico, escalofríos, edema, enfermedad similar a la gripe, pirexia.
Trastornos hepatobiliares. Raros: trastorno de la vesícula biliar.
Exploraciones complementarias. Frecuentes: prueba de función hepática anormal, aumento de peso. Poco frecuentes: electrocardiograma anormal. Raros: aumento de enzimas musculares, análisis de orina anormal.
Trastornos del metabolismo y de la nutrición. Poco frecuentes: diabetes mellitus, hipoglucemia. Raros: hiperlipidemia, hipokalemia.
Trastornos musculoesqueléticos y del tejido conjuntivo. Frecuentes: artralgia, dolor de espalda, mialgia. Poco frecuentes: artritis, calambres musculares, dolor musculoesquelético. Raros: miositis, osteoporosis.
Trastornos del sistema nervioso. Frecuentes: trastorno de la atención, mareos. Poco frecuentes: amnesia, convulsiones, migraña, parosmia, síncope, temblor. Raros: trastorno del equilibrio, accidente cerebrovascular, disartria, deterioro mental, esclerosis múltiple, parálisis del VIImo nervio craneal, nistagmo, hiperactividad psicomotora, deterioro de las habilidades psicomotoras, síndrome de piernas inquietas, trastorno sensorial, accidente isquémico transitorio, defecto del campo visual.
Trastornos psiquiátricos. Poco frecuentes: disociación, disminución de la libido, cambios de humor, pensamiento anormal. Raros: bradifrenia, desorientación, estado de ánimo eufórico.
Trastornos renales y urinarios. Poco frecuentes: nicturia, polaquiuria, anomalía urinaria. Raros: nefrolitiasis, poliuria, insuficiencia renal aguda, síndrome uretral, retención urinaria.
Trastornos del aparato reproductor y de la mama. Frecuentes: trastorno menstrual. Poco frecuentes: disfunción eréctil. Raros: disfunción sexual.
Trastornos respiratorios, torácicos y mediastínicos. Frecuentes: trastornos respiratorios. Poco frecuentes: asma, epistaxis, rinitis alérgica, inflamación de las vías respiratorias superiores. Raros: pleuritis, embolia pulmonar.
Trastornos de la piel y del tejido subcutáneo. Poco frecuentes: acné, piel seca, eccema, eritema, hiperhidrosis, urticaria. Raros: reacción de fotosensibilidad, psoriasis.
Trastornos vasculares. Poco frecuentes: sofocos. Raros: trombosis.
CHANTIX también se ha estudiado en ensayos postcomercialización que incluyen (1) un ensayo realizado en pacientes con enfermedad pulmonar obstructiva crónica (EPOC), (2) un ensayo realizado en pacientes generalmente sanos (similares a los de los estudios precomercialización) en los que se les permitió seleccionar una fecha para dejar de fumar entre los días 8 y 35 del tratamiento (“ensayo de instrucción de fecha alternativa para dejar de fumar”), (3) un ensayo realizado en pacientes que no lograron dejar de fumar durante la terapia previa con CHANTIX, o que recayeron después del tratamiento (“ensayo de retratamiento”), (4) un ensayo realizado en pacientes con enfermedad cardiovascular estable, (5) un ensayo realizado en pacientes con esquizofrenia estable o trastorno esquizoafectivo, (6) un ensayo realizado en pacientes con trastorno depresivo mayor, (7) un ensayo postcomercialización de resultados de seguridad neuropsiquiátrica en pacientes sin o con antecedentes de trastorno psiquiátrico, (8) una extensión sin tratamiento del ensayo postcomercialización de resultados de seguridad neuropsiquiátrica que evaluó la seguridad cardiovascular, (9) un ensayo en pacientes que no pudieron o no quisieron dejar de fumar abruptamente y a quienes se les indicó dejar de fumar gradualmente (“ensayo de enfoque gradual para dejar de fumar”).
Los eventos adversos en el ensayo de pacientes con EPOC (1), en el ensayo de instrucción de fecha alternativa para dejar de fumar (2) y en el ensayo de enfoque gradual para dejar de fumar (9) fueron similares a los observados en los estudios precomercialización. En el ensayo de retratamiento (3), el perfil de eventos adversos comunes fue similar al informado previamente, pero, además, los pacientes tratados con vareniclina también informaron comúnmente diarrea (6% vs. 4% en pacientes tratados con placebo), trastornos y alteraciones del estado de ánimo depresivo (6% vs. 1%) y otros trastornos y alteraciones del estado de ánimo (5% vs. 2%).
En el ensayo de pacientes con enfermedad cardiovascular estable (4), se informaron más tipos y un mayor número de eventos cardiovasculares en comparación con los estudios precomercialización, como se muestra en la Tabla 1 y en la Tabla 2 a continuación.
| CHANTIX 1 mg BID |
Placebo | |
|---|---|---|
| N=353 | N=350 | |
|
||
|
Eventos adversos ≥1% en cualquiera de los grupos de tratamiento |
||
|
Hasta 30 días después del tratamiento |
||
|
Angina de pecho |
3.7 |
2.0 |
|
Dolor en el pecho |
2.5 |
2.3 |
|
Edema periférico |
2.0 |
1.1 |
|
Hipertensión |
1.4 |
2.6 |
|
Palpitaciones |
0.6 |
1.1 |
|
Mortalidad cardiovascular adjudicada (hasta 52 semanas) |
0.3 |
0.6 |
|
Eventos cardiovasculares graves no mortales adjudicados ≥1% en cualquiera de los grupos de tratamiento |
||
|
Hasta 30 días después del tratamiento |
||
|
IM no mortal |
1.1 |
0.3 |
|
Hospitalización por angina de pecho |
0.6 |
1.1 |
|
Más allá de los 30 días después del tratamiento y hasta 52 semanas |
||
Necesidad de revascularización coronaria*
2.0
0.6
Hospitalización por angina de pecho
1.7
1.1
Nuevo diagnóstico de enfermedad vascular periférica (EVP) o ingreso para un procedimiento de EVP
1.4
0.6
En el ensayo con pacientes con esquizofrenia estable o trastorno esquizoafectivo (5), 128 fumadores con medicación antipsicótica se asignaron al azar en una proporción de 2:1 a vareniclina (1 mg dos veces al día) o placebo durante 12 semanas, con un seguimiento de 12 semanas sin fármacos. Los eventos adversos más frecuentes que surgieron del tratamiento notificados en este ensayo se muestran en la Tabla 3 a continuación.
| CHANTIX 1 mg BID |
Placebo | |
|---|---|---|
| N=84 | N=43 | |
|
Eventos adversos ≥10% en el grupo de vareniclina |
||
|
Náuseas |
24 |
14 |
|
Dolor de cabeza |
11 |
19 |
|
Vómitos |
11 |
9 |
|
Eventos adversos psiquiátricos ≥5% y a una tasa mayor que en el grupo placebo |
||
|
Insomnio |
10 |
5 |
Para el ensayo en pacientes con trastorno depresivo mayor (6), los eventos adversos más comunes que surgieron durante el tratamiento se muestran en la Tabla 4 a continuación. Además, en este ensayo, los pacientes tratados con vareniclina tuvieron más probabilidades que los pacientes tratados con placebo de informar uno de los eventos relacionados con hostilidad y agresión (3% vs. 1%).
| CHANTIX 1 mg BID |
Placebo | |
|---|---|---|
| N=256 | N=269 | |
|
Eventos adversos ≥10% en cualquiera de los grupos de tratamiento |
||
|
Nausea |
27 |
10 |
|
Dolor de cabeza |
17 |
11 |
|
Sueños anormales |
11 |
8 |
|
Insomnio |
11 |
5 |
|
Irritabilidad |
11 |
8 |
|
Eventos adversos psiquiátricos ≥2% en cualquier grupo de tratamiento y no incluidos anteriormente |
||
|
Trastornos y alteraciones del estado de ánimo depresivo |
11 |
9 |
|
Ansiedad |
7 |
9 |
|
Agitación |
7 |
4 |
|
Tensión |
4 |
3 |
|
Hostilidad |
2 |
0.4 |
|
Inquietud |
2 |
2 |
En el ensayo de pacientes sin o con antecedentes de trastorno psiquiátrico (7), los eventos adversos más comunes en los sujetos tratados con vareniclina fueron similares a los observados en los estudios previos a la comercialización. Los eventos adversos emergentes más comunes informados en este ensayo se muestran en la Tabla 5 a continuación.
| CHANTIX 1 mg BID |
Placebo | |
|---|---|---|
|
Eventos adversos ≥10% en el grupo de vareniclina |
||
|
Población total del estudio, N |
1982 |
1979 |
|
Náuseas |
25 |
7 |
|
Dolor de cabeza |
12 |
10 |
|
Eventos adversos psiquiátricos ≥2% en cualquier grupo de tratamiento |
||
|
Cohorte no psiquiátrica, N |
975 |
982 |
|
Sueños anormales |
8 |
4 |
|
Agitación |
3 |
3 |
|
Ansiedad |
5 |
6 |
|
Estado de ánimo deprimido |
3 |
3 |
|
Insomnio |
10 |
7 |
|
Irritabilidad |
3 |
4 |
|
Trastorno del sueño |
3 |
2 |
|
Cohorte psiquiátrica, N |
1007 |
997 |
|
Sueños anormales |
12 |
5 |
|
Agitación |
5 |
4 |
|
Ansiedad |
8 |
6 |
|
Estado de ánimo deprimido |
5 |
5 |
|
Depresión |
5 |
5 |
|
Insomnio |
9 |
7 |
|
Irritabilidad |
5 |
7 |
|
Nerviosismo |
2 |
3 |
|
Trastorno del sueño |
3 |
2 |
En la extensión sin tratamiento del ensayo de resultados de seguridad neuropsiquiátrica postcomercialización que evaluó la seguridad cardiovascular (8), los eventos adversos más comunes en los sujetos tratados con vareniclina y que ocurrieron hasta 30 días después de la última dosis del tratamiento fueron similares a los observados en los estudios precomercialización.
6.2 Experiencia postcomercialización
Los siguientes eventos adversos se han notificado durante el uso posterior a la aprobación de CHANTIX. Debido a que estos eventos se notifican voluntariamente a partir de una población de tamaño incierto, no es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Se han notificado casos de depresión, manía, psicosis, alucinaciones, paranoia, delirios, ideación homicida, agresión, hostilidad, ansiedad y pánico, así como ideación suicida, intento de suicidio y suicidio consumado en pacientes que intentaron dejar de fumar mientras tomaban CHANTIX [ver Advertencias y precauciones (5.1)].
Se han notificado casos postcomercialización de convulsiones nuevas o que empeoran en pacientes tratados con CHANTIX [ver Advertencias y precauciones (5.2)].
Se han notificado casos postcomercialización de pacientes que experimentaron un aumento de los efectos intoxicantes del alcohol mientras tomaban CHANTIX. Algunos notificaron eventos neuropsiquiátricos, incluyendo comportamiento inusual y a veces agresivo [ver Advertencias y precauciones (5.1) y (5.3)].
Se han notificado casos de reacciones de hipersensibilidad, incluyendo angioedema [ver Advertencias y precauciones (5.7)].
También se han notificado casos de reacciones cutáneas graves, incluyendo síndrome de Stevens-Johnson y eritema multiforme, en pacientes que toman CHANTIX [ver Advertencias y precauciones (5.8)].
Se han notificado casos de infarto de miocardio (IM) y accidente cerebrovascular (ACV), incluyendo eventos isquémicos y hemorrágicos en pacientes que toman CHANTIX. En la mayoría de los casos notificados, los pacientes tenían una enfermedad cardiovascular preexistente y/o otros factores de riesgo. Aunque fumar es un factor de riesgo para el IM y el ACV, basándonos en la relación temporal entre el uso del medicamento y los eventos, no se puede descartar una función contribuyente de la vareniclina [ver Advertencias y precauciones (5.5)].
Se han notificado casos de hiperglucemia en pacientes después del inicio de CHANTIX.
Se han notificado casos de sonambulismo, algunos resultando en comportamiento dañino para sí mismos, otros o propiedades en pacientes tratados con CHANTIX [ver Advertencias y precauciones (5.6)].
7 INTERACCIONES MEDICAMENTOSAS
Basándose en las características de la vareniclina y la experiencia clínica hasta la fecha, CHANTIX no presenta interacciones farmacocinéticas clínicamente significativas con otros fármacos [ver Farmacología Clínica (12.3)].
7.1 Uso con otros medicamentos para dejar de fumar
No se ha estudiado la seguridad y eficacia de CHANTIX en combinación con otras terapias para dejar de fumar.
Bupropion
La vareniclina (1 mg dos veces al día) no alteró la farmacocinética en estado estacionario del bupropion (150 mg dos veces al día) en 46 fumadores. No se ha establecido la seguridad de la combinación de bupropion y vareniclina.
Terapia de reemplazo de nicotina (TRN)
Aunque la administración conjunta de vareniclina (1 mg dos veces al día) y nicotina transdérmica (21 mg/día) durante un máximo de 12 días no afectó la farmacocinética de la nicotina, la incidencia de náuseas, dolor de cabeza, vómitos, mareos, dispepsia y fatiga fue mayor para la combinación que para la TRN sola. En este estudio, ocho de veintidós (36%) pacientes tratados con la combinación de vareniclina y TRN interrumpieron prematuramente el tratamiento debido a eventos adversos, en comparación con 1 de 17 (6%) de los pacientes tratados con TRN y placebo.
7.2 Efecto del abandono del hábito de fumar en otros medicamentos
Los cambios fisiológicos resultantes del abandono del hábito de fumar, con o sin tratamiento con CHANTIX, pueden alterar la farmacocinética o farmacodinamia de ciertos medicamentos (p. ej., teofilina, warfarina, insulina) para los que puede ser necesario un ajuste de la dosis.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de riesgos
Los datos disponibles no han sugerido un aumento del riesgo de defectos congénitos importantes tras la exposición a vareniclina durante el embarazo, en comparación con las mujeres que fuman [ver Datos]. Fumar durante el embarazo está asociado con riesgos maternos, fetales y neonatales (ver Consideraciones clínicas). En estudios con animales, la vareniclina no provocó malformaciones importantes, pero causó una disminución del peso fetal en conejos cuando se administró durante la organogénesis a exposiciones equivalentes a 50 veces la exposición a la dosis máxima recomendada en humanos (DMRH). Además, la administración de vareniclina a ratas preñadas durante la organogénesis a través de la lactancia produjo toxicidad para el desarrollo en las crías a exposiciones maternas equivalentes a 36 veces la exposición humana a la DMRH [ver Datos].
El riesgo estimado de fisuras orales aumenta aproximadamente un 30% en los bebés de mujeres que fuman durante el embarazo, en comparación con las mujeres embarazadas que no fuman. Se desconoce el riesgo de otros defectos congénitos importantes y abortos espontáneos para la población indicada. En la población general de EE. UU., el riesgo estimado de defectos congénitos importantes y abortos espontáneos en embarazos clínicamente reconocidos es del 2 al 4% y del 15 al 20%, respectivamente.
Riesgo materno y/o embrionario/fetal asociado a la enfermedad
Fumar durante el embarazo aumenta el riesgo de fisuras orofaciales, ruptura prematura de membranas, placenta previa, desprendimiento de placenta, embarazo ectópico, restricción del crecimiento fetal y bajo peso al nacer, muerte fetal, parto prematuro y gestación acortada, muerte neonatal, síndrome de muerte súbita del lactante y reducción de la función pulmonar en los bebés. Se desconoce si dejar de fumar con CHANTIX durante el embarazo reduce estos riesgos.
Datos humanos
Un estudio de cohorte observacional basado en la población que utilizó los registros nacionales de Dinamarca y Suecia comparó los resultados del embarazo y el parto entre mujeres expuestas a vareniclina (N=335, incluidas 317 expuestas en el primer trimestre) con mujeres que fumaron durante el embarazo (N=78,412) y con mujeres embarazadas no fumadoras (N=806,438). La prevalencia de malformaciones importantes, el resultado primario, fue similar en todos los grupos, incluso entre los grupos de fumadores y no fumadores. La prevalencia de resultados perinatales adversos en la cohorte expuesta a vareniclina no fue mayor que en la cohorte de mujeres que fumaron, y difirió un poco entre las tres cohortes. Las prevalencias de los resultados primarios y secundarios se muestran en la Tabla 6.
| Resultado | Cohorte de vareniclina (n=335) |
Cohorte de fumadoras (n=78,412) |
Cohorte de no fumadoras (n=806,438) |
|---|---|---|---|
|
Malformación congénita mayor* |
12 / 334 (3.6%) |
3,382 / 78,028 (4.3%) |
33,950 /804,020 (4.2%) |
|
Muerte fetal |
1 (0.3%) |
384 (0.5%) |
2,418 (0.3%) |
|
Pequeño para la edad gestacional |
42 (12.5%) |
13,433 (17.1%) |
73,135 (9.1%) |
|
Parto prematuro |
25 (7.5%) |
6,173 (7.9%) |
46,732 (5.8%) |
|
Ruptura prematura de membranas |
12 (3.6%) |
4,246 (5.4%) |
30,641 (3.8%) |
|
Síndrome de muerte súbita del lactante† |
0/307 (0.0%) |
51/71,720 (0.1%) |
58/755,939 (<0.1%) |
Las limitaciones del estudio incluyen la incapacidad de detectar malformaciones en embarazos que no resultan en un nacimiento vivo, y la posible clasificación errónea del resultado y de la exposición a la vareniclina o al tabaquismo.
Otros pequeños estudios epidemiológicos en mujeres embarazadas expuestas a la vareniclina no identificaron una asociación con malformaciones mayores, en consonancia con el estudio de cohorte observacional danés y sueco. Las limitaciones metodológicas de estos estudios incluyen muestras pequeñas y la falta de controles adecuados.
En general, los estudios disponibles no pueden establecer ni excluir definitivamente ningún riesgo asociado con la vareniclina durante el embarazo.
Datos de animales
Las ratas y conejos preñados recibieron vareniclina succinato durante la organogénesis en dosis orales de hasta 15 y 30 mg/kg/día, respectivamente. Si bien no se produjeron anomalías estructurales fetales en ninguna de las especies, se observó toxicidad materna, caracterizada por una disminución en el aumento de peso corporal, y pesos fetales reducidos en conejos en la dosis más alta (exposiciones 50 veces la exposición humana en la dosis máxima recomendada de 1 mg dos veces al día basada en el AUC). No se produjo una reducción en el peso fetal en conejos en exposiciones 23 veces la exposición humana en la dosis máxima recomendada basada en el AUC.
En un estudio de desarrollo pre y postnatal, las ratas preñadas recibieron hasta 15 mg/kg/día de vareniclina succinato oral desde la organogénesis hasta la lactancia. Se observó toxicidad materna, caracterizada por una disminución en el aumento de peso corporal, a 15 mg/kg/día (36 veces la exposición humana en la dosis máxima recomendada basada en el AUC). Sin embargo, se produjo una disminución en la fertilidad y un aumento en la respuesta de sobresalto auditivo en las crías en la dosis materna más alta de 15 mg/kg/día.
8.2 Lactancia
Resumen de riesgos
No hay datos sobre la presencia de vareniclina en la leche humana, los efectos en el lactante amamantado o los efectos en la producción de leche. En estudios en animales, la vareniclina estaba presente en la leche de ratas lactantes [ver Datos]. Sin embargo, debido a las diferencias específicas de especie en la fisiología de la lactancia, los datos de animales pueden no predecir de manera confiable los niveles de fármaco en la leche humana. La falta de datos clínicos durante la lactancia impide una determinación clara del riesgo de CHANTIX para un lactante durante la lactancia; sin embargo, se deben considerar los beneficios de desarrollo y salud de la lactancia materna junto con la necesidad clínica de la madre de CHANTIX y cualquier efecto adverso potencial en el niño amamantado por CHANTIX o por la condición materna subyacente.
Consideraciones clínicas
Debido a que no hay datos sobre la presencia de vareniclina en la leche humana y los efectos en el lactante, las mujeres que amamantan deben vigilar a sus lactantes en busca de convulsiones y vómitos excesivos, que son reacciones adversas que han ocurrido en adultos y que pueden ser clínicamente relevantes en lactantes.
8.4 Uso pediátrico
No se recomienda el uso de CHANTIX en pacientes pediátricos de 16 años o menores, ya que su eficacia en esta población no se demostró.
Se han investigado la farmacocinética de dosis única y múltiple de vareniclina en pacientes pediátricos de 12 a 17 años (inclusive) y fue aproximadamente proporcional a la dosis en el rango de dosis diarias de 0,5 mg a 2 mg estudiado. La exposición sistémica en estado de equilibrio en pacientes adolescentes con un peso corporal > 55 kg, evaluada por AUC (0-24), fue comparable a la observada para las mismas dosis en la población adulta. Cuando se administró 0,5 mg BID, la exposición diaria en estado de equilibrio de vareniclina fue, en promedio, más alta (aproximadamente un 40%) en pacientes adolescentes con un peso corporal ≤ 55 kg en comparación con la observada en la población adulta.
Se evaluó la eficacia y seguridad de la vareniclina en un estudio aleatorizado, doble ciego, controlado con placebo de 312 pacientes de 12 a 19 años, que fumaban un promedio de al menos 5 cigarrillos por día durante los 30 días previos al reclutamiento, tenían un puntaje de al menos 4 en la escala de Test de Fagerström para Dependencia de la Nicotina y al menos un intento previo fallido de abandono del tabaco. Los pacientes se estratificaron por edad (12 a 16 años, n = 216 y 17 a 19 años, n = 96) y por peso corporal (≤ 55 kg y > 55 kg). Los pacientes fueron aleatorizados a una de dos dosis de vareniclina, ajustadas por peso para proporcionar niveles plasmáticos en el rango eficaz (basado en estudios en adultos) y a placebo. Los pacientes recibieron tratamiento durante 12 semanas, seguido de un período sin tratamiento de 40 semanas, junto con asesoramiento apropiado para la edad durante todo el estudio. Los resultados de este estudio mostraron que la vareniclina, en cualquiera de las dosis estudiadas, no mejoró las tasas de abstinencia continua en las semanas 9 a 12 del tratamiento en comparación con el placebo en sujetos de 12 a 19 años. El perfil de seguridad de la vareniclina en este estudio fue consistente con el observado en estudios en adultos.
8.5 Uso geriátrico
Un estudio farmacocinético combinado de dosis única y múltiple demostró que la farmacocinética de 1 mg de vareniclina administrada una vez al día o dos veces al día a 16 fumadores sanos de edad avanzada (de 65 a 75 años) durante 7 días consecutivos fue similar a la de sujetos más jóvenes. No se observaron diferencias generales en la seguridad o la eficacia entre estos sujetos y los más jóvenes, y otra experiencia clínica reportada no ha identificado diferencias en las respuestas entre los pacientes ancianos y los más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos individuos mayores.
Se sabe que la vareniclina se excreta sustancialmente por el riñón, y el riesgo de reacciones tóxicas a este medicamento puede ser mayor en pacientes con insuficiencia renal. Debido a que los pacientes de edad avanzada tienen mayor probabilidad de tener una función renal disminuida, se debe tener cuidado en la selección de la dosis y puede ser útil controlar la función renal [see Dosage and Administration (2.2)].
No se recomienda ajuste de dosis en pacientes de edad avanzada.
8.6 Insuficiencia Renal
La vareniclina se elimina sustancialmente por filtración glomerular renal junto con la secreción tubular activa. No se requiere reducción de la dosis en pacientes con insuficiencia renal leve a moderada. Para pacientes con insuficiencia renal grave (aclaramiento de creatinina estimado <30 mL/min) y para pacientes con enfermedad renal en etapa terminal sometidos a hemodiálisis, es necesario ajustar la dosis [see Dosage and Administration (2.2), Clinical Pharmacology (12.3)].
9 ABUSO DE DROGAS Y DEPENDENCIA
9.3 Dependencia
Humanos
Menos de 1 de cada 1000 pacientes reportaron euforia en ensayos clínicos con CHANTIX. A dosis más altas (mayores de 2 mg), CHANTIX produjo informes más frecuentes de trastornos gastrointestinales como náuseas y vómitos. No hay evidencia de aumento de la dosis para mantener los efectos terapéuticos en estudios clínicos, lo que sugiere que no se desarrolla tolerancia. La interrupción abrupta de CHANTIX se asoció con un aumento de la irritabilidad y los trastornos del sueño en hasta el 3% de los pacientes. Esto sugiere que, en algunos pacientes, la vareniclina puede producir una dependencia física leve que no está asociada con la adicción.
En un estudio de laboratorio de abuso de la responsabilidad humana, una dosis oral única de 1 mg de vareniclina no produjo ninguna respuesta subjetiva positiva o negativa significativa en fumadores. En no fumadores, 1 mg de vareniclina produjo un aumento en algunos efectos subjetivos positivos, pero esto se acompañó de un aumento en los efectos adversos negativos, especialmente náuseas. Una dosis oral única de 3 mg de vareniclina produjo uniformemente respuestas subjetivas desagradables tanto en fumadores como en no fumadores.
Animales
Los estudios en roedores han demostrado que la vareniclina produce respuestas conductuales similares a las producidas por la nicotina. En ratas entrenadas para discriminar la nicotina de la solución salina, la vareniclina produjo una generalización completa a la señal de nicotina. En estudios de autoadministración, el grado en que la vareniclina sustituye a la nicotina depende del requisito de la tarea. Las ratas entrenadas para autoadministrarse nicotina en condiciones fáciles continuaron autoadministrándose vareniclina en un grado comparable al de la nicotina; sin embargo, en una tarea más exigente, las ratas se autoadministraron vareniclina en menor medida que la nicotina. El pretratamiento con vareniclina también redujo la autoadministración de nicotina.
10 SOBREDOSIS
En caso de sobredosis, se deben tomar las medidas de soporte estándar según sea necesario.
Se ha demostrado que la vareniclina se dializa en pacientes con enfermedad renal en etapa terminal [ver Farmacología clínica (12.3)], sin embargo, no hay experiencia en diálisis después de una sobredosis.
11 DESCRIPCIÓN
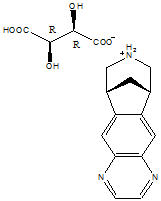
Los comprimidos de CHANTIX contienen vareniclina (como sal de tartrato), que es un agonista nicotínico parcial selectivo para los subtipos de receptores de acetilcolina nicotínicos α4β2 .
La vareniclina, como sal de tartrato, es un polvo que se presenta como un sólido blanco a blanquecino a ligeramente amarillo con el siguiente nombre químico: 7,8,9,10-tetrahidro-6,10-metano-6H-pirazino[2,3- h][3]benzazepina, (2R,3R)-2,3-dihidroxibutadionoato (1:1). Es altamente soluble en agua. El tartrato de vareniclina tiene un peso molecular de 361,35 Daltons y una fórmula molecular de C13H13N3 ∙ C4H6O6. La estructura química es:
CHANTIX se suministra para administración oral en dos concentraciones: un comprimido recubierto con película, biconvexo, blanco a blanquecino, de 0,5 mg con la inscripción “Pfizer” en un lado y “CHX 0.5” en el otro lado y un comprimido recubierto con película, biconvexo, azul claro de 1 mg con la inscripción “Pfizer” en un lado y “CHX 1.0” en el otro lado. Cada comprimido de CHANTIX de 0,5 mg contiene 0,85 mg de tartrato de vareniclina, equivalente a 0,5 mg de base libre de vareniclina; cada comprimido de CHANTIX de 1 mg contiene 1,71 mg de tartrato de vareniclina, equivalente a 1 mg de base libre de vareniclina. Los siguientes ingredientes inactivos se incluyen en los comprimidos: celulosa microcristalina, fosfato dicálcico dibásico anhidro, croscarmelosa sódica, dióxido de silicio coloidal, estearato de magnesio, Opadry® Blanco (para 0,5 mg), Opadry® Azul (para 1 mg) y Opadry® Claro.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
Varenicline se une con alta afinidad y selectividad a los receptores neuronales de acetilcolina nicotínicos α4β2. Se cree que la eficacia de CHANTIX para dejar de fumar es el resultado de la actividad de vareniclina en el subtipo α4β2 del receptor nicotínico, donde su unión produce actividad agonista, al tiempo que previene la unión de la nicotina a estos receptores.
Estudios de electrofisiología in vitro y estudios neuroquímicos in vivo han demostrado que la vareniclina se une a los receptores neuronales de acetilcolina nicotínicos α4β2 y estimula la actividad mediada por receptores, pero a un nivel significativamente más bajo que la nicotina. La vareniclina bloquea la capacidad de la nicotina para activar los receptores α4β2 y, por lo tanto, para estimular el sistema mesolímbico central de dopamina, que se cree que es el mecanismo neuronal subyacente al refuerzo y la recompensa que se experimentan al fumar. La vareniclina es altamente selectiva y se une con mayor potencia a los receptores α4β2 que a otros receptores nicotínicos comunes (>500 veces α3β4, >3,500 veces α7, >20,000 veces α1βγδ), o a receptores y transportadores no nicotínicos (>2,000 veces). La vareniclina también se une con afinidad moderada (Ki = 350 nM) al receptor 5-HT3.
12.3 Farmacocinética
Absorción
Las concentraciones plasmáticas máximas de vareniclina se producen típicamente dentro de las 3 a 4 horas posteriores a la administración oral. Después de la administración de dosis orales múltiples de vareniclina, se alcanzaron condiciones de estado estable en 4 días. En el rango de dosificación recomendado, la vareniclina exhibe una farmacocinética lineal después de dosis únicas o repetidas.
En un estudio de balance de masas, la absorción de vareniclina fue prácticamente completa después de la administración oral y la disponibilidad sistémica fue de ~90%.
Distribución
La unión de la vareniclina a las proteínas plasmáticas es baja (≤20%) e independiente tanto de la edad como de la función renal.
Eliminación
La vida media de eliminación de vareniclina es de aproximadamente 24 horas.
Poblaciones específicas
No existen diferencias clínicamente significativas en la farmacocinética de vareniclina debido a la edad, raza, sexo, estado de fumador o uso de medicamentos concomitantes, como se demostró en estudios farmacocinéticos específicos y en análisis farmacocinéticos poblacionales.
Edad: Pacientes geriátricos
Un estudio farmacocinético combinado de dosis única y múltiple demostró que la farmacocinética de 1 mg de vareniclina administrada una vez al día o dos veces al día a 16 fumadores sanos de edad avanzada, hombres y mujeres (de 65 a 75 años) durante 7 días consecutivos fue similar a la de sujetos más jóvenes.
Edad: Pacientes pediátricos
No se recomienda el uso de CHANTIX en pacientes pediátricos de 16 años o menores porque no se demostró su eficacia en esta población [ver Uso en poblaciones específicas (8.4)].
Insuficiencia renal
La farmacocinética de vareniclina no se modificó en sujetos con insuficiencia renal leve (aclaramiento estimado de creatinina >50 mL/min y ≤80 mL/min). En sujetos con insuficiencia renal moderada (aclaramiento estimado de creatinina ≥30 mL/min y ≤50 mL/min), la exposición a vareniclina aumentó 1.5 veces en comparación con sujetos con función renal normal (aclaramiento estimado de creatinina >80 mL/min). En sujetos con insuficiencia renal grave (aclaramiento estimado de creatinina <30 mL/min), la exposición a vareniclina aumentó 2.1 veces. En sujetos con enfermedad renal en etapa terminal (ESRD) sometidos a una sesión de hemodiálisis de tres horas durante tres días a la semana, la exposición a vareniclina aumentó 2.7 veces después de la administración de 0.5 mg una vez al día durante 12 días. La Cmáx y el AUC plasmáticas de vareniclina observadas en este contexto fueron similares a las de los sujetos sanos que recibieron 1 mg dos veces al día [ver Dosis y administración (2.2), Uso en poblaciones específicas (8.6)]. Además, en sujetos con ESRD, la vareniclina se eliminó eficazmente mediante hemodiálisis [ver Sobredosis (10)].
Interacciones medicamentosas
Estudios in vitro demostraron que la vareniclina no inhibe las siguientes enzimas del citocromo P450 (IC50 >6400 ng/mL): 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 y 3A4/5. Además, en hepatocitos humanos in vitro, la vareniclina no induce las enzimas del citocromo P450 1A2 y 3A4.
Estudios in vitro demostraron que la vareniclina no inhibe las proteínas de transporte renal humanas a concentraciones terapéuticas. Por lo tanto, es poco probable que los medicamentos que se eliminan por secreción renal (p. ej., metformina [ver a continuación]) se vean afectados por la vareniclina.
Estudios in vitro demostraron que la secreción renal activa de vareniclina está mediada por el transportador de cationes orgánicos humanos OCT2. La coadministración con inhibidores de OCT2 (p. ej., cimetidina [ver a continuación]) puede no requerir un ajuste de la dosis de CHANTIX, ya que no se espera que el aumento en la exposición sistémica a CHANTIX sea clínicamente significativo. Además, dado que el metabolismo de vareniclina representa menos del 10% de su aclaramiento, es poco probable que los medicamentos que se sabe que afectan el sistema del citocromo P450 alteren la farmacocinética de CHANTIX [ver Farmacología Clínica (12.3)]; por lo tanto, no se requeriría un ajuste de la dosis de CHANTIX.
Se realizaron estudios de interacción farmacológica con vareniclina y digoxina, warfarina, nicotina transdérmica, bupropión, cimetidina y metformina. No se han identificado interacciones farmacológicas farmacocinéticas clínicamente significativas.
Cuando se coadministró a 30 fumadores, vareniclina (1 mg dos veces al día) no alteró la farmacocinética en estado estacionario de metformina (500 mg dos veces al día), que es un sustrato de OCT2. La metformina no tuvo ningún efecto sobre la farmacocinética en estado estacionario de vareniclina.
La coadministración de un inhibidor de OCT2, cimetidina (300 mg cuatro veces al día), con vareniclina (2 mg en dosis única) a 12 fumadores aumentó la exposición sistémica de vareniclina en un 29% (IC del 90%: 21,5%, 36,9%) debido a una reducción en el aclaramiento renal de vareniclina.
Digoxina
Vareniclina (1 mg dos veces al día) no alteró la farmacocinética en estado estacionario de la digoxina administrada en una dosis diaria de 0,25 mg en 18 fumadores.
Warfarina
Vareniclina (1 mg dos veces al día) no alteró la farmacocinética de una dosis única de 25 mg de (R, S)-warfarina en 24 fumadores. El tiempo de protrombina (INR) no se vio afectado por vareniclina. Dejar de fumar en sí mismo puede resultar en cambios en la farmacocinética de la warfarina [ver Interacciones medicamentosas (7.2)].
Uso con otros medicamentos para dejar de fumar
Bupropión: Vareniclina (1 mg dos veces al día) no alteró la farmacocinética en estado estacionario de bupropión (150 mg dos veces al día) en 46 fumadores [ver Interacciones medicamentosas (7.1)].
TRT: Aunque la coadministración de vareniclina (1 mg dos veces al día) y nicotina transdérmica (21 mg/día) durante hasta 12 días no afectó la farmacocinética de la nicotina, la incidencia de reacciones adversas fue mayor para la combinación que para la TRT sola [ver Interacciones medicamentosas (7.1)].
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogenicidad, Mutagénesis, Deterioro de la Fertilidad
Carcinogenicidad
Se realizaron estudios de carcinogenicidad de por vida en ratones CD-1 y ratas Sprague-Dawley. No hubo evidencia de un efecto carcinogénico en ratones a los que se administró vareniclina por sonda gástrica durante 2 años a dosis de hasta 20 mg/kg/día (47 veces la exposición diaria máxima recomendada en humanos (MRHD) basada en el AUC). Las ratas recibieron vareniclina (1, 5 y 15 mg/kg/día) por sonda gástrica durante 2 años. En ratas macho (n = 65 por sexo por grupo de dosis), las incidencias de hibernoma (tumor de la grasa parda) aumentaron en la dosis intermedia (1 tumor, 5 mg/kg/día, 23 veces la exposición MRHD basada en el AUC) y la dosis máxima (2 tumores, 15 mg/kg/día, 67 veces la exposición MRHD basada en el AUC). No se ha establecido la relevancia clínica de este hallazgo para los humanos. No hubo evidencia de carcinogenicidad en ratas hembra.
Mutagénesis
La vareniclina no fue genotóxica, con o sin activación metabólica, en los siguientes ensayos: ensayo de mutación bacteriana de Ames; ensayo de CHO/HGPRT de mamíferos; y pruebas de aberraciones citogenéticas in vivo en la médula ósea de rata e in vitro en linfocitos humanos.
Deterioro de la Fertilidad
No hubo evidencia de deterioro de la fertilidad en ratas Sprague-Dawley machos o hembras a las que se administró vareniclina succinato hasta 15 mg/kg/día (67 y 36 veces, respectivamente, la exposición MRHD basada en el AUC a 1 mg dos veces al día). Se observó toxicidad materna, caracterizada por una disminución en el aumento de peso corporal, a 15 mg/kg/día. Sin embargo, se observó una disminución de la fertilidad en la descendencia de ratas preñadas a las que se administró vareniclina succinato a una dosis oral de 15 mg/kg/día. Esta disminución de la fertilidad en la descendencia de ratas hembras tratadas no fue evidente a una dosis oral de 3 mg/kg/día (9 veces la exposición MRHD basada en el AUC a 1 mg dos veces al día).
14 ESTUDIOS CLÍNICOS
La eficacia de CHANTIX en el abandono del hábito de fumar se demostró en seis ensayos clínicos en los que un total de 3659 fumadores crónicos de cigarrillos (≥10 cigarrillos por día) fueron tratados con CHANTIX. En todos los estudios clínicos, la abstinencia del tabaquismo se determinó mediante autoinforme del paciente y se verificó mediante la medición del monóxido de carbono exhalado (CO ≤10 ppm) en visitas semanales. Entre los pacientes tratados con CHANTIX inscritos en estos estudios, la tasa de finalización fue del 65 %. Excepto en el estudio de rango de dosis (Estudio 1) y el estudio de mantenimiento de la abstinencia (Estudio 6), los pacientes fueron tratados durante 12 semanas y luego se les realizó un seguimiento durante 40 semanas después del tratamiento. La mayoría de los pacientes inscritos en estos ensayos fueron blancos (79–96 %). Todos los estudios inscribieron un número casi igual de hombres y mujeres. La edad promedio de los pacientes en estos estudios fue de 43 años. Los pacientes, en promedio, habían fumado aproximadamente 21 cigarrillos por día durante un promedio de aproximadamente 25 años. Los pacientes fijaron una fecha para dejar de fumar (fecha objetivo de abandono) con el inicio de la dosificación una semana antes de esta fecha.
Siete estudios adicionales evaluaron la eficacia de CHANTIX en pacientes con enfermedad cardiovascular, en pacientes con enfermedad pulmonar obstructiva crónica [ver Estudios clínicos (14.7)], en pacientes con instrucciones de seleccionar su fecha de abandono dentro de los días 8 y 35 del tratamiento [ver Estudios clínicos (14.4)], pacientes con trastorno depresivo mayor [ver Estudios clínicos (14.9)], pacientes que habían intentado previamente dejar de fumar con CHANTIX y no habían tenido éxito en dejar de fumar o habían recaído después del tratamiento [ver Estudios clínicos (14.6)], en pacientes sin o con antecedentes de trastorno psiquiátrico inscritos en un ensayo de resultados de seguridad neuropsiquiátrica posterior a la comercialización [ver Advertencias y precauciones (5.1), Estudios clínicos (14.10)], y en pacientes que no podían o no estaban dispuestos a dejar de fumar abruptamente y recibieron instrucciones de dejar de fumar gradualmente [ver Estudios clínicos (14.5)].
En todos los estudios, los pacientes recibieron un folleto educativo sobre el abandono del hábito de fumar y recibieron hasta 10 minutos de asesoramiento sobre el abandono del hábito de fumar en cada visita semanal de tratamiento de acuerdo con las pautas de la Agencia para la Investigación y la Calidad de la Atención Médica.
14.1 Inicio de la abstinencia
Estudio 1
Este fue un estudio de rango de dosis de seis semanas que comparó CHANTIX con placebo. Este estudio proporcionó evidencia inicial de que CHANTIX a una dosis total de 1 mg por día o 2 mg por día fue eficaz como ayuda para dejar de fumar.
Estudio 2
Este estudio de 627 pacientes comparó CHANTIX 1 mg por día y 2 mg por día con placebo. Los pacientes fueron tratados durante 12 semanas (incluida una semana de titulación) y luego se les realizó un seguimiento durante 40 semanas después del tratamiento. CHANTIX se administró en dos dosis divididas al día. Cada dosis de CHANTIX se administró en dos regímenes diferentes, con y sin titulación de la dosis inicial, para explorar el efecto de los diferentes regímenes de dosificación en la tolerabilidad. Para los grupos titulados, la dosis se tituló durante el transcurso de una semana, y la dosis completa se logró a partir de la segunda semana de dosificación. Los grupos titulados y no titulados se agruparon para el análisis de eficacia.
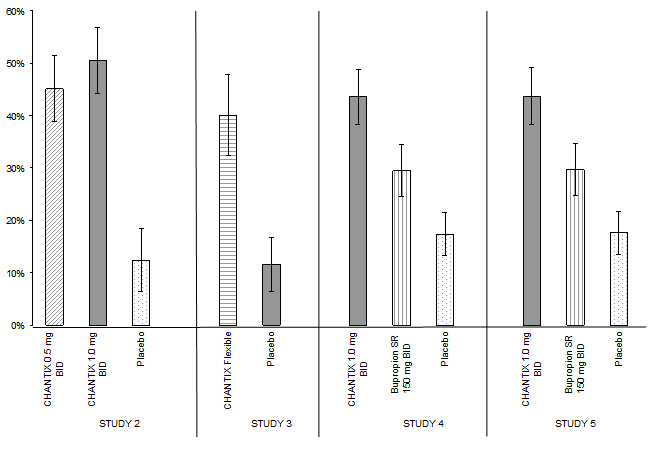
El cuarenta y cinco por ciento de los pacientes que recibieron CHANTIX 1 mg por día (0,5 mg dos veces al día) y el 51 % de los pacientes que recibieron 2 mg por día (1 mg dos veces al día) tuvieron abstinencia continua confirmada por CO durante las semanas 9 a 12 en comparación con el 12 % de los pacientes en el grupo placebo (Figura 1). Además, el 31 % del grupo de 1 mg por día y el 31 % del grupo de 2 mg por día fueron abstinentes continuamente desde una semana después de la FQD hasta el final del tratamiento en comparación con el 8 % del grupo placebo.
Estudio 3
Este estudio de dosificación flexible de 312 pacientes examinó el efecto de una estrategia de dosificación dirigida por el paciente de CHANTIX o placebo. Después de una titulación inicial de una semana a una dosis de 0,5 mg dos veces al día, los pacientes pudieron ajustar su dosis con la frecuencia que desearan entre 0,5 mg una vez al día y 1 mg dos veces al día por día. El sesenta y nueve por ciento de los pacientes titularon a la dosis máxima permitida en cualquier momento durante el estudio. Para el 44 % de los pacientes, la dosis modal seleccionada fue de 1 mg dos veces al día; para poco más de la mitad de los participantes del estudio, la dosis modal seleccionada fue de 1 mg/día o menos.
De los pacientes tratados con CHANTIX, el 40 % tuvo abstinencia continua confirmada por CO durante las semanas 9 a 12 en comparación con el 12 % en el grupo placebo. Además, el 29 % del grupo CHANTIX fueron abstinentes continuamente desde una semana después de la FQD hasta el final del tratamiento en comparación con el 9 % del grupo placebo.
Estudio 4 y Estudio 5
Estos estudios idénticos doble ciego compararon CHANTIX 2 mg por día, bupropión de liberación sostenida (SR) 150 mg dos veces al día y placebo. Los pacientes fueron tratados durante 12 semanas y luego se les realizó un seguimiento durante 40 semanas después del tratamiento. La dosis de CHANTIX de 1 mg dos veces al día se logró mediante una titulación de 0,5 mg una vez al día durante los 3 días iniciales, seguida de 0,5 mg dos veces al día durante los siguientes 4 días. La dosis de bupropión SR de 150 mg dos veces al día se logró mediante una titulación de 3 días de 150 mg una vez al día. El Estudio 4 inscribió a 1022 pacientes y el Estudio 5 inscribió a 1023 pacientes. Se excluyeron los pacientes inapropiados para el tratamiento con bupropión o los pacientes que habían usado bupropión previamente.
En el Estudio 4, los pacientes tratados con CHANTIX tuvieron una tasa superior de abstinencia confirmada por CO durante las semanas 9 a 12 (44 %) en comparación con los pacientes tratados con bupropión SR (30 %) o placebo (17 %). La tasa de abandono del bupropión SR también fue superior al placebo. Además, el 29 % del grupo CHANTIX fueron abstinentes continuamente desde una semana después de la FQD hasta el final del tratamiento en comparación con el 12 % del grupo placebo y el 23 % del grupo bupropión SR.
De forma similar en el Estudio 5, los pacientes tratados con CHANTIX tuvieron una tasa superior de abstinencia confirmada por CO durante las semanas 9 a 12 (44%) en comparación con los pacientes tratados con bupropión SR (30%) o placebo (18%). La tasa de abandono del bupropión SR también fue superior al placebo. Además, el 29% del grupo CHANTIX estuvo continuamente abstinente desde una semana después de TQD hasta el final del tratamiento, en comparación con el 11% del grupo placebo y el 21% del grupo bupropión SR.
| CHANTIX 0.5 mg BID |
CHANTIX 1 mg BID |
CHANTIX Flexible |
Bupropion SR | Placebo | |
|---|---|---|---|---|---|
| BID = dos veces al día | |||||
|
Estudio 2 |
45% |
51% |
12% |
||
|
Estudio 3 |
40% |
12% |
|||
|
Estudio 4 |
44% |
30% |
17% |
||
|
Estudio 5 |
44% |
30% |
18% |
||
14.2 Deseo de fumar
Basándose en las respuestas al Cuestionario breve de deseos de fumar y al ítem “deseo de fumar” de la escala de abstinencia de nicotina de Minnesota, CHANTIX redujo el deseo de fumar en comparación con el placebo.
14.3 Abstinencia a largo plazo
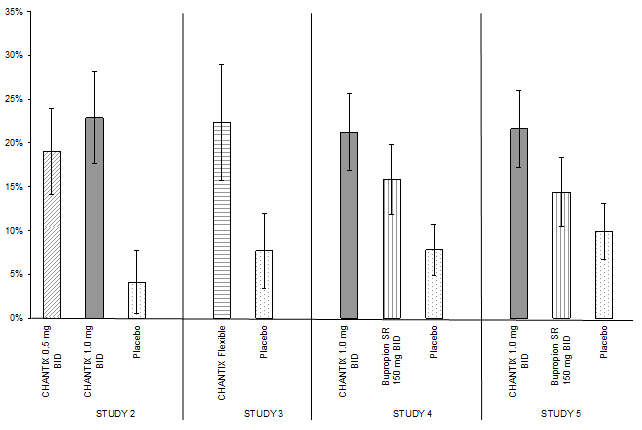
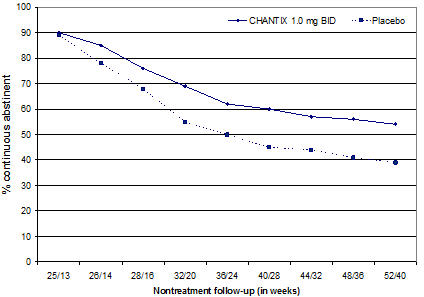
Los estudios 1 a 5 incluyeron 40 semanas de seguimiento posterior al tratamiento. En cada estudio, los pacientes tratados con CHANTIX tuvieron más probabilidades de mantener la abstinencia durante todo el período de seguimiento que los pacientes tratados con placebo (Figura 2, Tabla 8).
| CHANTIX 0.5 mg BID |
CHANTIX 1 mg BID |
CHANTIX Flexible |
Bupropion SR | Placebo | |
|---|---|---|---|---|---|
| BID = dos veces al día | |||||
|
Estudio 2 |
19% |
23% |
4% |
||
|
Estudio 3 |
22% |
8% |
|||
|
Estudio 4 |
21% |
16% |
8% |
||
|
Estudio 5 |
22% |
14% |
10% |
||
Estudio 6
Este estudio evaluó el efecto de 12 semanas adicionales de terapia con CHANTIX sobre la probabilidad de abstinencia a largo plazo. Los pacientes en este estudio (N=1927) fueron tratados con CHANTIX 1 mg dos veces al día con etiqueta abierta durante 12 semanas. Los pacientes que habían dejado de fumar durante al menos una semana en la semana 12 (N= 1210) fueron luego aleatorizados a un tratamiento doble ciego con CHANTIX (1 mg dos veces al día) o placebo durante 12 semanas adicionales y luego seguidos durante 28 semanas después del tratamiento.
La tasa de abstinencia continua de la semana 13 a la semana 24 fue mayor para los pacientes que continuaron el tratamiento con CHANTIX (70%) que para los pacientes que cambiaron a placebo (50%). La superioridad al placebo también se mantuvo durante las 28 semanas de seguimiento posterior al tratamiento (CHANTIX 54% versus placebo 39%).
En la Figura 3 a continuación, el eje x representa la semana del estudio para cada observación, lo que permite una comparación de grupos en momentos similares después de la interrupción de CHANTIX; el seguimiento posterior a CHANTIX comienza en la semana 13 para el grupo placebo y en la semana 25 para el grupo CHANTIX. El eje y representa el porcentaje de pacientes que habían estado abstinentes durante la última semana de tratamiento con CHANTIX y permanecieron abstinentes en el momento dado.
14.4 Instrucciones alternativas para establecer una fecha para dejar de fumar
CHANTIX se evaluó en un ensayo doble ciego controlado con placebo donde se indicó a los pacientes que seleccionaran una fecha objetivo para dejar de fumar entre el día 8 y el día 35 del tratamiento. Los sujetos se asignaron al azar en una proporción de 3:1 a CHANTIX 1 mg dos veces al día (N=486) o placebo (N=165) durante 12 semanas de tratamiento y se les realizó un seguimiento durante otras 12 semanas después del tratamiento. Los pacientes tratados con CHANTIX tuvieron una tasa superior de abstinencia confirmada por CO durante las semanas 9 a 12 (54%) en comparación con los pacientes tratados con placebo (19%) y de las semanas 9 a 24 (35%) en comparación con los sujetos tratados con placebo (13%).
14.5 Enfoque gradual para dejar de fumar
CHANTIX se evaluó en un estudio doble ciego controlado con placebo de 52 semanas con 1510 sujetos que no pudieron o no quisieron dejar de fumar en cuatro semanas, pero que estaban dispuestos a reducir gradualmente su consumo de tabaco durante un período de 12 semanas antes de dejar de fumar. Los sujetos se asignaron al azar a CHANTIX 1 mg dos veces al día (N=760) o placebo (N=750) durante 24 semanas y se les realizó un seguimiento después del tratamiento hasta la semana 52. Se indicó a los sujetos que redujeran el número de cigarrillos fumados en al menos un 50 por ciento al final de las primeras cuatro semanas de tratamiento, seguido de una reducción adicional del 50 por ciento de la semana cuatro a la semana ocho del tratamiento, con el objetivo de lograr la abstinencia completa en 12 semanas. Después de la fase inicial de reducción de 12 semanas, los sujetos continuaron el tratamiento durante otras 12 semanas. Los sujetos tratados con CHANTIX tuvieron una tasa de abstinencia continua significativamente mayor en comparación con el placebo en las semanas 15 a 24 (32% vs. 7%) y en las semanas 15 a 52 (24% vs. 6%).
14.6 Estudio de nuevo tratamiento
CHANTIX se evaluó en un ensayo doble ciego controlado con placebo en pacientes que habían intentado dejar de fumar previamente con CHANTIX y que no habían logrado dejar de fumar o habían recaído después del tratamiento. Los sujetos se asignaron al azar 1:1 a CHANTIX 1 mg dos veces al día (N=249) o placebo (N=245) durante 12 semanas de tratamiento y se les realizó un seguimiento durante 40 semanas después del tratamiento. Los pacientes incluidos en este estudio habían tomado CHANTIX para un intento de dejar de fumar en el pasado (durante una duración total del tratamiento de al menos dos semanas), al menos tres meses antes de la entrada en el estudio, y habían estado fumando durante al menos cuatro semanas.
Los pacientes tratados con CHANTIX tuvieron una tasa superior de abstinencia confirmada por CO durante las semanas 9 a 12 (45%) en comparación con los pacientes tratados con placebo (12%) y de las semanas 9 a 52 (20%) en comparación con los sujetos tratados con placebo (3%).
| Semanas 9 a 12 | Semanas 9 a 52 | |||
|---|---|---|---|---|
| CHANTIX 1 mg BID |
Placebo | CHANTIX 1 mg BID |
Placebo | |
| BID = dos veces al día | ||||
|
Estudio de nuevo tratamiento |
45% |
12% |
20% |
3% |
14.7 Sujetos con Enfermedad Pulmonar Obstructiva Crónica
CHANTIX se evaluó en un estudio aleatorizado, doble ciego, controlado con placebo en sujetos de ≥ 35 años con EPOC leve a moderada con FEV1/FVC post-broncodilatador <70% y FEV1 ≥ 50% del valor normal predicho. Los sujetos se asignaron aleatoriamente a CHANTIX 1 mg dos veces al día (N=223) o placebo (N=237) durante un tratamiento de 12 semanas y luego se les realizó un seguimiento durante 40 semanas después del tratamiento. Los sujetos tratados con CHANTIX tuvieron una tasa superior de abstinencia confirmada por CO durante las semanas 9 a 12 (41%) en comparación con los sujetos tratados con placebo (9%) y de la semana 9 a la 52 (19%) en comparación con los sujetos tratados con placebo (6%).
| Semanas 9 a 12 | Semanas 9 a 52 | |||
|---|---|---|---|---|
| CHANTIX 1 mg BID |
Placebo | CHANTIX 1 mg BID |
Placebo | |
| BID = dos veces al día | ||||
|
Estudio EPOC |
41% |
9% |
19% |
6% |
14.8 Sujetos con enfermedad cardiovascular y otros análisis cardiovasculares
CHANTIX se evaluó en un estudio aleatorizado, doble ciego, controlado con placebo en sujetos de 35 a 75 años con enfermedad cardiovascular estable y documentada (diagnósticos distintos de, o además de, hipertensión) que había sido diagnosticada durante más de 2 meses. Los sujetos se asignaron aleatoriamente a CHANTIX 1 mg dos veces al día (N=353) o placebo (N=350) durante un período de tratamiento de 12 semanas y luego se les realizó un seguimiento durante 40 semanas después del tratamiento. Los sujetos tratados con CHANTIX tuvieron una tasa superior de abstinencia confirmada por CO durante las semanas 9 a 12 (47%) en comparación con los sujetos tratados con placebo (14%) y de la semana 9 a la 52 (20%) en comparación con los sujetos tratados con placebo (7%).
| Semanas 9 a 12 | Semanas 9 a 52 | |||
|---|---|---|---|---|
| CHANTIX 1 mg BID |
Placebo | CHANTIX 1 mg BID |
Placebo | |
| BID = dos veces al día | ||||
|
Estudio ECV |
47% |
14% |
20% |
7% |
En este estudio, la mortalidad por todas las causas y la mortalidad cardiovascular fue menor en los pacientes tratados con CHANTIX, pero ciertos eventos cardiovasculares no mortales ocurrieron con más frecuencia en los pacientes tratados con CHANTIX que en los pacientes tratados con placebo [ver Advertencias y precauciones (5.5), Reacciones adversas (6.1)]. La Tabla 12 a continuación muestra la mortalidad y la incidencia de eventos cardiovasculares graves no mortales seleccionados que ocurrieron con más frecuencia en el grupo de CHANTIX en comparación con el grupo de placebo. Estos eventos fueron adjudicados por un comité ciego independiente. Los eventos cardiovasculares graves no mortales no listados ocurrieron con la misma incidencia o con mayor frecuencia en el grupo placebo. Los pacientes con más de un evento cardiovascular del mismo tipo se cuentan solo una vez por fila. Algunos de los pacientes que requirieron revascularización coronaria se sometieron al procedimiento como parte del manejo del infarto de miocardio no mortal y la hospitalización por angina.
| Mortalidad y eventos cardiovasculares | CHANTIX (N=353) n (%) |
Placebo (N=350) n (%) |
|---|---|---|
|
Mortalidad (Cardiovascular y todas las causas hasta 52 semanas) |
||
|
Cardiovascular |
1 (0.3) |
2 (0.6) |
|
Todas las causas |
2 (0.6) |
5 (1.4) |
|
|
||
|
Eventos cardiovasculares no mortales (tasa en CHANTIX > Placebo) |
||
|
Hasta 30 días después del tratamiento |
||
|
Infarto de miocardio no mortal |
4 (1.1) |
1 (0.3) |
|
Accidente cerebrovascular no mortal |
2 (0.6) |
0 (0) |
|
Más allá de los 30 días después del tratamiento y hasta 52 semanas |
||
|
Infarto de miocardio no mortal |
3 (0.8) |
2 (0.6) |
|
Necesidad de revascularización coronaria |
7 (2.0) |
2 (0.6) |
|
Hospitalización por angina de pecho |
6 (1.7) |
4 (1.1) |
|
Ataque isquémico transitorio |
1 (0.3) |
0 (0) |
|
Nuevo diagnóstico de enfermedad vascular periférica (EVP) o ingreso para un procedimiento de EVP |
5 (1.4) |
2 (0.6) |
Tras el estudio de CVD, se realizó un metaanálisis de 15 ensayos clínicos con una duración del tratamiento de ≥12 semanas, que incluyó a 7002 pacientes (4190 CHANTIX, 2812 placebo), para evaluar sistemáticamente la seguridad cardiovascular de CHANTIX. El estudio en pacientes con enfermedad cardiovascular estable descrito anteriormente se incluyó en el metaanálisis. Hubo tasas más bajas de mortalidad por todas las causas (CHANTIX 6 [0,14 %]; placebo 7 [0,25 %]) y mortalidad cardiovascular (CHANTIX 2 [0,05 %]; placebo 2 [0,07 %]) en los grupos de CHANTIX en comparación con los grupos de placebo en el metaanálisis.
El análisis clave de seguridad cardiovascular incluyó la aparición y el momento de un criterio de valoración compuesto de eventos cardiovasculares adversos mayores (MACE), definidos como muerte cardiovascular, infarto de miocardio no mortal y accidente cerebrovascular no mortal. Estos eventos incluidos en el criterio de valoración fueron adjudicados por un comité independiente ciego. En general, se produjo un pequeño número de MACE en los ensayos incluidos en el metaanálisis, como se describe en la Tabla 13. Estos eventos ocurrieron principalmente en pacientes con enfermedad cardiovascular conocida.
| CHANTIX N=4190 |
Placebo N=2812 |
|
|---|---|---|
|
||
|
Casos de MACE, n (%) |
13 (0,31 %) |
6 (0,21 %) |
|
Años-paciente de exposición |
1316 |
839 |
|
Razón de riesgo (IC del 95 %) |
||
|
1,95 (0,79; 4,82) |
||
|
Diferencia de tasas por 1000 años-paciente (IC del 95 %) |
||
|
6,30 (-2,40; 15,10) |
||
El metaanálisis mostró que la exposición a CHANTIX dio como resultado una razón de riesgo para MACE de 1,95 (intervalo de confianza del 95% de 0,79 a 4,82) para pacientes hasta 30 días después del tratamiento; esto equivale a un aumento estimado de 6,3 eventos de MACE por cada 1000 años-paciente de exposición. El metaanálisis mostró tasas más altas de criterios de valoración CV en pacientes con CHANTIX en relación con el placebo en diferentes períodos de tiempo y análisis de sensibilidad preespecificados, incluidos varios grupos de estudio y resultados CV. Aunque estos hallazgos no fueron estadísticamente significativos, fueron consistentes. Debido a que el número de eventos fue pequeño en general, la potencia para encontrar una diferencia estadísticamente significativa en una señal de esta magnitud es baja.
Además, se agregó un análisis de criterios de valoración cardiovasculares al estudio de resultados de seguridad neuropsiquiátrica posterior a la comercialización junto con una extensión sin tratamiento, [ver Advertencias y precauciones (5.5), Reacciones adversas (6.1), Estudios clínicos (14.10)].
14.9 Sujetos con trastorno depresivo mayor
CHANTIX se evaluó en un estudio aleatorizado, doble ciego, controlado con placebo de sujetos de 18 a 75 años con trastorno depresivo mayor sin características psicóticas (DSM-IV TR). Si estaban medicados, los sujetos debían estar con un régimen antidepresivo estable durante al menos dos meses. Si no estaban medicados, los sujetos debían haber experimentado un episodio depresivo mayor en los últimos 2 años, que fue tratado con éxito. Los sujetos se asignaron aleatoriamente a CHANTIX 1 mg dos veces al día (N=256) o placebo (N=269) durante un tratamiento de 12 semanas y luego se les realizó un seguimiento durante 40 semanas después del tratamiento. Los sujetos tratados con CHANTIX tuvieron una tasa superior de abstinencia confirmada por CO durante las semanas 9 a 12 (36%) en comparación con los sujetos tratados con placebo (16%) y de la semana 9 a la 52 (20%) en comparación con los sujetos tratados con placebo (10%).
| Semanas 9 a 12 | Semanas 9 a 52 | |||
|---|---|---|---|---|
| CHANTIX 1 mg BID |
Placebo | CHANTIX 1 mg BID |
Placebo | |
| BID = dos veces al día | ||||
|
Estudio TDM |
36% |
16% |
20% |
10% |
14.10 Ensayo de resultados de seguridad neuropsiquiátrica postcomercialización
CHANTIX se evaluó en un ensayo aleatorizado, doble ciego, controlado con activo y placebo que incluyó sujetos sin antecedentes de trastorno psiquiátrico (cohorte no psiquiátrica, N=3912) y con antecedentes de trastorno psiquiátrico (cohorte psiquiátrica, N=4003). Los sujetos de 18 a 75 años de edad, que fumaban 10 o más cigarrillos al día, fueron aleatorizados 1:1:1:1 a CHANTIX 1 mg BID, bupropión SR 150 mg BID, parche de TRN 21 mg/día con reducción gradual o placebo durante un período de tratamiento de 12 semanas; luego fueron seguidos durante otras 12 semanas después del tratamiento. [Véase Advertencias y precauciones (5.1)]
Un criterio de valoración de seguridad compuesto destinado a capturar eventos adversos neuropsiquiátricos (EAN) clínicamente significativos incluyó los siguientes eventos adversos neuropsiquiátricos: ansiedad, depresión, sensación de anormalidad, hostilidad, agitación, agresión, delirios, alucinaciones, ideación homicida, manía, pánico, paranoia, psicosis, irritabilidad, ideación suicida, comportamiento suicida o suicidio consumado.
Como se muestra en la Tabla 15, el uso de CHANTIX, bupropión y TRN en la cohorte no psiquiátrica no se asoció con un mayor riesgo de eventos adversos neuropsiquiátricos clínicamente significativos en comparación con el placebo. De manera similar, en la cohorte no psiquiátrica, el uso de CHANTIX no se asoció con un mayor riesgo de eventos adversos neuropsiquiátricos clínicamente significativos en el criterio de valoración de seguridad compuesto en comparación con bupropión o TRN.
| CHANTIX (N=975) n (%) |
Bupropión (N=968) n (%) |
TRN (N=987) n (%) |
Placebo (N=982) n (%) |
|
|---|---|---|---|---|
|
EAN clínicamente significativos |
30 (3.1) |
34 (3.5) |
33 (3.3) |
40 (4.1) |
|
EAN graves |
1 (0.1) |
5 (0.5) |
1 (0.1) |
4 (0.4) |
|
Hospitalizaciones psiquiátricas |
1 (0.1) |
2 (0.2) |
0 (0.0) |
1 (0.1) |
Como se muestra en la Tabla 16, se notificaron más eventos adversos de NPS clínicamente significativos en pacientes del grupo de cohorte psiquiátrica en cada grupo de tratamiento en comparación con la cohorte no psiquiátrica. La incidencia de eventos en el criterio de valoración compuesto fue mayor para cada uno de los tratamientos activos en comparación con el placebo: las diferencias de riesgo (RD) (IC del 95%) frente al placebo fueron del 2,7% (-0,05, 5,4) para CHANTIX, del 2,2% (-0,5, 4,9) para bupropión y del 0,4% (-2,2, 3,0) para la nicotina transdérmica NRT.
| CHANTIX (N=1007) n (%) |
Bupropion (N=1004) n (%) |
NRT (N=995) n (%) |
Placebo (N=997) n (%) |
|
|---|---|---|---|---|
|
NPS clínicamente significativos |
123 (12,2) |
118 (11,8) |
98 (9,8) |
95 (9,5) |
|
NPS graves |
6 (0,6) |
8 (0,8) |
4 (0,4) |
6 (0,6) |
|
Hospitalizaciones psiquiátricas |
5 (0,5) |
8 (0,8) |
4 (0,4) |
2 (0,2) |
Se registró un suicidio consumado, ocurrido durante el tratamiento en un paciente tratado con placebo en la cohorte no psiquiátrica. No se informaron suicidios consumados en la cohorte psiquiátrica.
En ambas cohortes, los sujetos tratados con CHANTIX tuvieron una tasa superior de abstinencia confirmada por CO durante las semanas 9 a 12 y 9 a 24 en comparación con los sujetos tratados con bupropión, parche de nicotina y placebo.
| CHANTIX 1 mg BID |
Bupropion SR 150 mg BID |
NRT 21 mg/día con reducción gradual |
Placebo | |
|---|---|---|---|---|
| BID = dos veces al día | ||||
|
Semanas 9 a 12 |
||||
|
Cohorte no psiquiátrica |
38% |
26% |
26% |
14% |
|
Cohorte psiquiátrica |
29% |
19% |
20% |
11% |
|
Semanas 9 a 24 |
||||
|
Cohorte no psiquiátrica |
25% |
19% |
18% |
11% |
|
Cohorte psiquiátrica |
18% |
14% |
13% |
8% |
Análisis de resultados cardiovasculares
Para obtener otra fuente de datos con respecto al riesgo cardiovascular de CHANTIX, se agregó un análisis de criterios de valoración cardiovasculares al estudio de seguridad de resultados neuropsiquiátricos posteriores a la comercialización junto con una extensión sin tratamiento. En el estudio principal (N=8027), los sujetos de 18 a 75 años de edad, que fumaban 10 o más cigarrillos por día, se asignaron al azar 1:1:1:1 a CHANTIX 1 mg BID, bupropion SR 150 mg BID, terapia de reemplazo de nicotina (TRN) parche de 21 mg/día o placebo durante un período de tratamiento de 12 semanas; luego se les realizó un seguimiento durante otras 12 semanas después del tratamiento. El estudio de extensión inscribió a 4590 (57,2%) de los 8027 sujetos que se asignaron al azar y trataron en el estudio principal y los siguió durante 28 semanas adicionales. De todos los sujetos tratados, 1743 (21,7%) tenían un riesgo cardiovascular medio y 640 (8,0%) tenían un riesgo cardiovascular alto, según la definición de la puntuación de Framingham. Tenga en cuenta que se excluyó un sitio del estudio principal en la evaluación de la seguridad cardiovascular y se excluyeron dos sitios en la evaluación de la seguridad neuropsiquiátrica.
El criterio de valoración cardiovascular principal fue el tiempo hasta el evento cardiovascular adverso mayor (MACE), definido como muerte cardiovascular, infarto de miocardio no mortal o accidente cerebrovascular no mortal durante el tratamiento. Las muertes y los eventos cardiovasculares fueron adjudicados por un comité independiente ciego. La Tabla 18 a continuación muestra la incidencia de MACE y las razones de riesgo en comparación con el placebo para todos los sujetos aleatorizados expuestos a al menos una dosis parcial del tratamiento del estudio en el estudio principal.
| CHANTIX N=2006 |
Bupropion N=1997 |
TRN N=2017 |
Placebo N=2007 |
|
|---|---|---|---|---|
| [IR] indica la tasa de incidencia por 1000 personas-año | ||||
|
Durante el tratamiento* |
||||
|
MACE, n [IR] |
1 [2.4] |
2 [4.9] |
1 [2.4] |
4 [9.8] |
|
Razón de riesgo (IC del 95%) vs. placebo |
0.24 |
0.49 |
0.24 |
|
|
Hasta el final del estudio† |
||||
|
MACE, n [IR] |
3 [2.1] |
9 [6.3] |
6 [4.3] |
8 [5.7] |
|
Razón de riesgo (IC del 95%) vs. placebo |
0.36 |
1.09 |
0.74 |
|
Para este estudio, MACE+ se definió como cualquier MACE o una enfermedad vascular periférica (EVP) de nueva aparición o que empeora que requiere intervención, la necesidad de revascularización coronaria u hospitalización por angina inestable. Las tasas de incidencia de MACE+ y la mortalidad por todas las causas para todos los sujetos aleatorizados expuestos a al menos una dosis parcial del tratamiento del estudio en el estudio principal se muestran para todos los grupos de tratamiento durante el tratamiento y hasta el final del estudio en la Tabla 19 a continuación.
| CHANTIX N=2006 |
Bupropion N=1997 |
NRT N=2017 |
Placebo N=2007 |
|
|---|---|---|---|---|
| [IR] indica la tasa de incidencia por 1000 personas-año | ||||
|
Durante el tratamiento* |
||||
|
MACE+, n [IR] |
5 [12.1] |
4 [9.9] |
2 [4.8] |
5 [12.2] |
|
Muertes por todas las causas, n [IR] |
0 |
2 [4.9] |
0 |
2 [4.9] |
|
Hasta el final del estudio† |
||||
|
MACE+, n [IR] |
10 [6.9] |
15 [10.5] |
10 [7.1] |
12 [8.6] |
|
Muertes por todas las causas, n [IR] |
2 [1.4] |
4 [2.8] |
3 [2.1] |
4 [2.9] |
El número de sujetos que experimentaron MACE, MACE+ y muerte por todas las causas fue similar o menor entre los pacientes tratados con CHANTIX que entre los pacientes tratados con placebo. El número de eventos observados en general fue demasiado bajo para distinguir diferencias significativas entre los brazos de tratamiento.
16 SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
CHANTIX se suministra para administración oral en dos concentraciones: un comprimido recubierto con película, biconvexo, blanco a blanquecino, de 0.5 mg, con la marca “Pfizer” en un lado y “CHX 0.5” en el otro lado, y un comprimido recubierto con película, biconvexo, azul claro de 1 mg, con la marca “Pfizer” en un lado y “CHX 1.0” en el otro lado. CHANTIX se suministra en las siguientes configuraciones de envases:
| Descripción | NDC | |
|---|---|---|
|
Envases |
Tarjeta inicial de 4 semanas: 0.5 mg × 11 comprimidos y 1 mg × 42 comprimidos |
NDC 0069-0471-03 |
|
Tarjeta continua de 4 semanas: 1 mg × 56 comprimidos |
NDC 0069-0469-03 |
|
|
Caja mensual inicial: 0.5 mg × 11 comprimidos y 1 mg × 42 comprimidos |
NDC 0069-0471-03 |
|
|
Caja mensual continua: 1 mg × 56 comprimidos |
NDC 0069-0469-03 |
|
|
Frascos |
0.5 mg – frasco de 56 |
NDC 0069-0468-56 |
|
1 mg – frasco de 56 |
NDC 0069-0469-56 |
Consérvese a 25ºC (77ºF); se permiten excursiones a 15–30ºC (59–86ºF) (véase Temperatura ambiente controlada USP).
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
Ver el etiquetado del paciente aprobado por la FDA (Guía de medicamentos)
Iniciar el tratamiento y continuar intentando dejar de fumar si hay recaídas
Indique a los pacientes que fijen una fecha para dejar de fumar y que inicien el tratamiento con CHANTIX una semana antes de la fecha de abandono. Alternativamente, el paciente puede comenzar la dosificación de CHANTIX y luego fijar una fecha para dejar de fumar entre los días 8 y 35 del tratamiento. Anime a los pacientes a que continúen intentando dejar de fumar si tienen recaídas tempranas después del día de abandono [ver Dosificación y administración (2.1)].
Para los pacientes que están seguros de que no pueden o no quieren dejar de fumar de forma abrupta, se puede considerar un enfoque gradual para dejar de fumar con CHANTIX. Los pacientes deben comenzar la dosificación de CHANTIX y reducir el consumo de tabaco durante las primeras 12 semanas de tratamiento, luego dejar de fumar al final de ese período y continuar el tratamiento durante 12 semanas adicionales para un total de 24 semanas [ver Dosificación y administración (2.1)].
Anime a los pacientes que están motivados para dejar de fumar y que no tuvieron éxito en dejar de fumar durante la terapia previa con CHANTIX por razones distintas a la intolerancia debido a eventos adversos, o que recayeron después del tratamiento, a que hagan otro intento con CHANTIX una vez que se hayan identificado y abordado los factores que contribuyeron al intento fallido [ver Dosificación y administración (2.1), Estudios clínicos (14.6)].
Cómo tomar
Aconseje a los pacientes que CHANTIX debe tomarse por vía oral después de comer y con un vaso lleno de agua [ver Dosificación y administración (2.1)].
Dosificación de la semana inicial
Instruya a los pacientes sobre cómo titular CHANTIX, comenzando con una dosis de 0.5 mg/día. Explique que se debe tomar una tableta de 0.5 mg al día durante los primeros tres días, y que durante los siguientes cuatro días, se debe tomar una tableta de 0.5 mg por la mañana y una tableta de 0.5 mg por la noche [ver Dosificación y administración (2.1)].
Dosificación de las semanas siguientes
Avise a los pacientes que, después de los primeros siete días, la dosis debe aumentarse a una tableta de 1 mg por la mañana y una tableta de 1 mg por la noche [ver Dosificación y administración (2.1)].
Ajuste de la dosis de CHANTIX u otros medicamentos
Informe a los pacientes que las náuseas y el insomnio son efectos secundarios de CHANTIX y suelen ser transitorios; sin embargo, avise a los pacientes que si estos síntomas les preocupan persistentemente, deben notificarlo al médico que les receta el medicamento para que se pueda considerar una reducción de la dosis.
Informe a los pacientes que algunos medicamentos pueden requerir un ajuste de la dosis después de dejar de fumar [ver Dosificación y administración (2.1)].
Asesoramiento y apoyo
Proporcione a los pacientes materiales educativos y el asesoramiento necesario para apoyar un intento de dejar de fumar [ver Dosificación y administración (2.1)].
Eventos adversos neuropsiquiátricos
Informe a los pacientes que algunos pacientes han experimentado cambios en el estado de ánimo (incluida la depresión y la manía), psicosis, alucinaciones, paranoia, delirios, ideación homicida, agresión, hostilidad, agitación, ansiedad y pánico, así como ideación suicida y suicidio al intentar dejar de fumar mientras toman CHANTIX. Indique a los pacientes que interrumpan el tratamiento con CHANTIX y se pongan en contacto con un profesional sanitario si experimentan estos síntomas [ver Advertencias y precauciones (5.1), Reacciones adversas (6.2)].
Historia de enfermedad psiquiátrica
Anime a los pacientes a revelar cualquier antecedente de enfermedad psiquiátrica antes de iniciar el tratamiento.
Abstinencia de nicotina
Informe a los pacientes que dejar de fumar, con o sin CHANTIX, puede estar asociado con síntomas de abstinencia de nicotina (incluida la depresión o la agitación) o exacerbación de una enfermedad psiquiátrica preexistente.
Convulsiones
Anime a los pacientes a informar sobre cualquier antecedente de convulsiones u otros factores que puedan disminuir el umbral convulsivo. Indique a los pacientes que interrumpan el tratamiento con CHANTIX y se pongan en contacto con un profesional sanitario inmediatamente si experimentan una convulsión durante el tratamiento [ver Advertencias y precauciones (5.2)].
Interacción con el alcohol
Aconseje a los pacientes que reduzcan la cantidad de alcohol que consumen mientras toman CHANTIX hasta que sepan si CHANTIX afecta su tolerancia al alcohol [ver Advertencias y precauciones (5.3), Reacciones adversas (6.2)].
Conducción de vehículos o manejo de maquinaria
Aconseje a los pacientes que tengan precaución al conducir o manejar maquinaria hasta que sepan cómo dejar de fumar y/o vareniclina puede afectarles [ver Advertencias y precauciones (5.4)].
Eventos cardiovasculares
Se debe indicar a los pacientes que notifiquen a sus proveedores de atención médica sobre los síntomas de eventos cardiovasculares nuevos o que empeoran y que busquen atención médica inmediata si experimentan signos y síntomas de infarto de miocardio o accidente cerebrovascular [ver Advertencias y precauciones (5.5), Reacciones adversas (6.1)].
Somnambulismo
Se debe indicar a los pacientes que interrumpan el tratamiento con CHANTIX y notifiquen a sus proveedores de atención médica si experimentan somnambulismo [ver Advertencias y precauciones (5.6)].
Angioedema
Informe a los pacientes que se han notificado casos de angioedema, con hinchazón de la cara, la boca (labio, encía, lengua) y el cuello (laringe y faringe) que pueden provocar un compromiso respiratorio que pone en peligro la vida. Indique a los pacientes que interrumpan el tratamiento con CHANTIX y busquen atención médica inmediata si experimentan estos síntomas [ver Advertencias y precauciones (5.7), Reacciones adversas (6.2)].
Reacciones cutáneas graves
Informe a los pacientes que algunos pacientes que toman CHANTIX notificaron reacciones cutáneas graves, como el síndrome de Stevens-Johnson y el eritema multiforme. Aconseje a los pacientes que dejen de tomar CHANTIX a la primera señal de erupción con lesiones mucosas o reacción cutánea y que se pongan en contacto con un proveedor de atención médica inmediatamente [ver Advertencias y precauciones (5.8), Reacciones adversas (6.2)].
Sueños vívidos, inusuales o extraños
Informe a los pacientes que pueden experimentar sueños vívidos, inusuales o extraños durante el tratamiento con CHANTIX.
Embarazo y lactancia
Se debe informar a las pacientes embarazadas, en período de lactancia o que planean quedar embarazadas sobre: los riesgos de fumar para una madre embarazada y su bebé en desarrollo, los posibles riesgos del uso de CHANTIX durante el embarazo y la lactancia, y los beneficios de dejar de fumar con y sin CHANTIX. Aconseje a las mujeres que amamantan que controlen al bebé para detectar convulsiones y vómitos [ver Uso en poblaciones específicas (8.1 y 8.2)].
SECCIÓN NO CLASIFICADA SPL
La etiqueta de este producto puede haber sido actualizada. Para obtener información completa de prescripción, visite www.pfizer.com.
LAB- 0327-24.0
Guía de medicación
| Esta Guía del Medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de los EE. UU. Revisado en febrero de 2019 | |||
|
GUÍA DEL MEDICAMENTO |
|||
|
¿Cuál es la información más importante que debo saber sobre CHANTIX? Cuando intenta dejar de fumar, con o sin CHANTIX, puede experimentar síntomas que pueden deberse a la abstinencia de nicotina, incluyendo: |
|||
|
|
|
|
|
Algunas personas incluso han experimentado pensamientos suicidas al intentar dejar de fumar sin medicamentos. A veces, dejar de fumar puede empeorar los problemas de salud mental que ya tiene, como la depresión. Algunas personas han tenido efectos secundarios graves mientras tomaban CHANTIX para ayudarles a dejar de fumar, incluyendo: Problemas de salud mental nuevos o peores, como cambios en el comportamiento o el pensamiento, agresión, hostilidad, agitación, estado de ánimo deprimido o pensamientos o acciones suicidas. Algunas personas tuvieron estos síntomas cuando comenzaron a tomar CHANTIX, y otras los desarrollaron después de varias semanas de tratamiento o después de suspender CHANTIX. Estos síntomas ocurrieron con más frecuencia en personas que tenían antecedentes de problemas de salud mental antes de tomar CHANTIX que en personas sin antecedentes de problemas de salud mental. Deje de tomar CHANTIX y llame a su proveedor de atención médica de inmediato si usted, su familia o su cuidador notan alguno de estos síntomas. Colabore con su proveedor de atención médica para decidir si debe continuar tomando CHANTIX. En muchas personas, estos síntomas desaparecieron después de suspender CHANTIX, pero en algunas personas los síntomas continuaron después de suspender CHANTIX. Es importante que realice un seguimiento con su proveedor de atención médica hasta que sus síntomas desaparezcan. Antes de tomar CHANTIX, informe a su proveedor de atención médica si alguna vez ha tenido depresión u otros problemas de salud mental. También debe informar a su proveedor de atención médica sobre cualquier síntoma que haya tenido en otras ocasiones en que intentó dejar de fumar, con o sin CHANTIX. |
|||
|
¿Qué es CHANTIX? CHANTIX es un medicamento recetado para ayudar a las personas a dejar de fumar. Dejar de fumar puede reducir sus probabilidades de tener enfermedades pulmonares, enfermedades cardíacas o contraer ciertos tipos de cáncer relacionados con el tabaquismo. No se ha demostrado que CHANTIX sea eficaz en niños menores de 16 años. CHANTIX no debe utilizarse en niños menores de 16 años. No se sabe si CHANTIX es seguro y eficaz cuando se usa con otros medicamentos para dejar de fumar. |
|||
|
¿Quién no debe tomar CHANTIX? No tome CHANTIX si ha tenido una reacción alérgica o cutánea grave a CHANTIX. Los síntomas pueden incluir:
|
|||
|
|
|
|
|
¿Qué debo decirle a mi proveedor de atención médica antes de tomar CHANTIX? Ver “¿Cuál es la información más importante que debo saber sobre CHANTIX?“ Antes de tomar CHANTIX, informe a su proveedor de atención médica si:
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos herbales. Es posible que su proveedor de atención médica deba cambiar la dosis de algunos de sus medicamentos cuando deje de fumar. No debe usar CHANTIX mientras usa otros medicamentos para dejar de fumar. Informe a su proveedor de atención médica si usa otros tratamientos para dejar de fumar. Conozca los medicamentos que toma. Lleve una lista con usted para mostrársela a su proveedor de atención médica y farmacéutico cuando obtenga un nuevo medicamento. |
|||
|
¿Cómo debo tomar CHANTIX?
|
|||
|
Semanas 1 a 4 |
Reduzca su consumo de cigarrillos a la mitad de la cantidad diaria inicial. Ejemplo: Si normalmente fuma 20 cigarrillos al día, reduzca su consumo a 10 cigarrillos al día durante las semanas 1 a 4. |
||
|
Semanas 5 a 8 |
Reduzca su consumo de cigarrillos a una cuarta parte de la cantidad diaria inicial. Ejemplo: Si normalmente fumaba 20 cigarrillos al día, reduzca su consumo a 5 cigarrillos al día durante las semanas 5 a 8. |
||
|
Semanas 9 a 12 |
Siga reduciendo su consumo de cigarrillos hasta que ya no fume (llegue a cero cigarrillos al día). |
||
|
Intente dejar de fumar al final de la semana 12 de tratamiento, o antes si se siente listo. Continúe tomando CHANTIX durante otras 12 semanas, para un total de 24 semanas de tratamiento. Comenzar a tomar CHANTIX antes de su fecha para dejar de fumar le da tiempo a CHANTIX para acumularse en su cuerpo. Puede seguir fumando durante este tiempo. Tome CHANTIX exactamente como se lo recetó su proveedor de atención médica. |
|||
|
|||
|
Día 1 al Día 3 |
|
||
|
Día 4 al Día 7 |
|
||
|
Día 8 hasta el final del tratamiento |
|
||
|
|||
|
¿Qué debo evitar mientras tomo CHANTIX?
|
|||
|
|
||
|
¿Cuáles son los posibles efectos secundarios de CHANTIX? Los efectos secundarios graves de CHANTIX pueden incluir:
Deje de tomar CHANTIX y busque ayuda médica de inmediato si tiene alguno de los siguientes síntomas:
Los efectos secundarios más comunes de CHANTIX incluyen:
Informe a su proveedor de atención médica sobre los efectos secundarios que le molesten o que no desaparezcan. Estos no son todos los efectos secundarios de CHANTIX. Consulte a su proveedor de atención médica o farmacéutico para obtener más información. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088. |
|||
|
¿Cómo debo guardar CHANTIX?
|
|||
|
Información general sobre el uso seguro y eficaz de CHANTIX A veces, los medicamentos se recetan para fines distintos de los que figuran en una Guía de medicamentos. No use CHANTIX para una afección para la que no se lo recetó. No le dé su CHANTIX a otras personas, incluso si tienen los mismos síntomas que usted. Puede dañarlos. Si desea obtener más información, hable con su proveedor de atención médica. Puede pedirle a su proveedor de atención médica o farmacéutico información sobre CHANTIX que esté escrita para profesionales de la salud. Para obtener más información sobre CHANTIX y consejos sobre cómo dejar de fumar, visite www.CHANTIX.com o llame al 1-877-242-6849. Si está motivado para dejar de fumar y no tuvo éxito durante el tratamiento previo con CHANTIX por razones distintas a los efectos secundarios, o si volvió a fumar después del tratamiento, hable con su proveedor de atención médica sobre si otro ciclo de terapia con CHANTIX puede ser adecuado para usted. |
|||
|
¿Cuáles son los ingredientes de CHANTIX? Ingrediente activo: tartrato de vareniclina Ingredientes inactivos: celulosa microcristalina, fosfato dicálcico dibásico anhidro, croscarmelosa sódica, dióxido de silicio coloidal, estearato de magnesio, Opadry® Blanco (para 0.5 mg), Opadry® Azul (para 1 mg) y Opadry® Claro. LAB-0328-17.0 |
|||
PRINCIPAL PANEL DE PRESENTACIÓN – Tableta de 0,5/1 mg, envase inicial
Contiene:
1 Semana Inicial (0.5 mg* x 11 comprimidos)
3 Semanas de Continuación (1 mg† x 42 comprimidos)
NDC 0069-0471-03
Rx solamente
CHANTIX®
(vareniclina) COMPRIMIDOS
CAJA PARA EL MES INICIAL
(Sus primeras 4 semanas)
Use primero el blíster de la Semana Inicial (verde)
cuando comience a tomar Chantix.
SIEMPRE DISPENSE CON LA GUÍA DE MEDICAMENTOS ADJUNTA
PRINCIPAL PANEL DE PRESENTACIÓN – Tableta de inicio de 0,5 mg / 1 mg
NDC 0069-0471-03
Rx only
CHANTIX®
(varenicline) TABLETS
PAQUETE DE INICIO
Use la tarjeta blíster de la Semana Inicial (verde)
primero cuando comience a tomar Chantix.
Contiene:
1 Semana Inicial (0.5 mg* x 11 tabletas)
3 Semanas de Continuación (1 mg† x 42 tabletas)
SIEMPRE DISPENSE CON LA GUÍA DE MEDICAMENTOS ADJUNTA
PANEL DE VISUALIZACIÓN PRINCIPAL – Etiqueta de la botella del comprimido de 0,5 mg
DISPENSAR SIEMPRE CON GUÍA DE MEDICAMENTOS
NDC 0069-0468-56
Pfizer
Chantix®
(varenicline) tablets
0.5 mg*
56 Tablets
Rx only
PANEL DE VISUALIZACIÓN PRINCIPAL – Etiqueta de la botella de tabletas de 1 mg
DISPENSAR SIEMPRE CON GUÍA DE MEDICAMENTOS
Pfizer
NDC 0069-0469-56
Chantix®
(vareniclina) tabletas
1 mg*
56 Tabletas
Rx solamente
PRINCIPAL PANEL DE PRESENTACIÓN – 1 mg x 56 comprimidos envase continuo
NDC 0069-0469-03
Rx only
CHANTIX®
(varenicline) TABLETS
ENVASE PARA CONTINUAR EL TRATAMIENTO
Contiene:
4 Semanas de Tratamiento Continuo (1 mg† x 56 comprimidos)
DISPENSAR SIEMPRE CON LA GUÍA DE MEDICAMENTOS INCLUIDA
PRINCIPAL PANEL DE PRESENTACIÓN – 1 mg x 56 Tabletas Envase para un Mes
Contiene:
4 Semanas Continuas (1 mg† x 56 comprimidos)
NDC 0069-0469-03
Rx solamente
CHANTIX®
(vareniclina) COMPRIMIDOS
CAJA PARA EL MES CONTINUO
(Sus próximas 4 semanas)
SIEMPRE DISPENSE CON LA GUÍA DE MEDICAMENTOS INCLUIDA