Fabricante de medicamentos: AstraZeneca Pharmaceuticals LP (Updated: 2023-11-06)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
LYNPARZA® (olaparib) tabletas, para uso oral
Aprobación inicial en EE.UU.: 2014
CAMBIOS IMPORTANTES RECIENTES
INDICACIONES Y USO
Lynparza es un inhibidor de poli (ADP-ribosa) polimerasa (PARP) indicado:
Cáncer de ovario
- •
- para el tratamiento de mantenimiento de pacientes adultas con cáncer epitelial avanzado de ovario, trompa de Falopio o peritoneal primario, con mutación germinal o somática deletérea o presuntamente deletérea de BRCA, que están en respuesta completa o parcial a la quimioterapia de primera línea basada en platino. Seleccionar pacientes para la terapia en base a un diagnóstico complementario aprobado por la FDA para Lynparza. (1.1, 2.1)
- •
- en combinación con bevacizumab para el tratamiento de mantenimiento de pacientes adultas con cáncer epitelial avanzado de ovario, trompa de Falopio o peritoneal primario, que están en respuesta completa o parcial a la quimioterapia de primera línea basada en platino y cuyo cáncer está asociado con un estado positivo de deficiencia de recombinación homóloga (HRD) definido por:
- •
- una mutación deletérea o presuntamente deletérea de BRCA, y/o
- •
- inestabilidad genómica.
- Seleccionar pacientes para la terapia en base a un diagnóstico complementario aprobado por la FDA para Lynparza. (1.2, 2.1)
- •
- para el tratamiento de mantenimiento de pacientes adultas con cáncer epitelial de ovario recurrente, trompa de Falopio o peritoneal primario con mutación germinal o somática deletérea o presuntamente deletérea de BRCA, que están en respuesta completa o parcial a quimioterapia basada en platino. Seleccionar pacientes para la terapia en base a un diagnóstico complementario aprobado por la FDA para Lynparza. (1.3, 2.1)
Cáncer de mama
- •
- para el tratamiento adyuvante de pacientes adultas con cáncer de mama temprano de alto riesgo, receptor 2 del factor de crecimiento epidérmico humano (HER2) negativo, con mutación germinal deletérea o presuntamente deletérea de BRCA (gBRCAm), que han sido tratadas con quimioterapia neoadyuvante o adyuvante. Seleccionar pacientes para la terapia en base a un diagnóstico complementario aprobado por la FDA para Lynparza. (1.4, 2.1)
- •
- para el tratamiento de pacientes adultos con cáncer de mama metastásico HER2-negativo, gBRCAm deletéreo o presuntamente deletéreo, que han sido tratadas con quimioterapia en el entorno neoadyuvante, adyuvante o metastásico. Las pacientes con cáncer de mama con receptores hormonales (HR) positivos deben haber recibido terapia endocrina previa o considerarse inapropiadas para terapia endocrina. Seleccionar pacientes para la terapia en base a un diagnóstico complementario aprobado por la FDA para Lynparza. (1.5, 2.1)
Cáncer de páncreas
- •
- para el tratamiento de mantenimiento de pacientes adultos con adenocarcinoma pancreático metastásico gBRCAm deletéreo o presuntamente deletéreo cuya enfermedad no ha progresado durante al menos 16 semanas de un régimen de quimioterapia de primera línea basado en platino. Seleccionar pacientes para la terapia en base a un diagnóstico complementario aprobado por la FDA para Lynparza. (1.6, 2.1)
Cáncer de próstata
- •
- para el tratamiento de pacientes adultos con cáncer de próstata metastásico resistente a la castración (mCRPC) con mutación deletérea o presuntamente deletérea germinal o somática en el gen de reparación por recombinación homóloga (HRR) que han progresado después de un tratamiento previo con enzalutamida o abiraterona. Seleccionar pacientes para la terapia en base a un diagnóstico complementario aprobado por la FDA para Lynparza. (1.7, 2.1)
- •
- en combinación con abiraterona y prednisona o prednisolona para el tratamiento de pacientes adultos con cáncer de próstata metastásico resistente a la castración (mCRPC) con mutación deletérea o presuntamente deletérea de BRCA (BRCAm). Seleccionar pacientes para la terapia en base a un diagnóstico complementario aprobado por la FDA para Lynparza. (1.8, 2.1)
DOSIS Y ADMINISTRACIÓN
- •
- La dosis recomendada es de 300 mg tomados por vía oral dos veces al día con o sin alimentos. Ver la Información de prescripción completa para la duración recomendada. (2.2)
- •
- Los pacientes que reciben Lynparza para mCRPC también deben recibir un análogo de la hormona liberadora de gonadotropina (GnRH) de forma concurrente o deben haberse sometido a una orquiectomía bilateral. (2.2)
- •
- Para insuficiencia renal moderada (CLcr 31-50 mL/min), reducir la dosis de Lynparza a 200 mg por vía oral dos veces al día. (2.5)
FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Tabletas: 150 mg, 100 mg (3)
CONTRAINDICACIONES
Ninguna. (4)
ADVERTENCIAS Y PRECAUCIONES
- •
- Síndrome mielodisplásico/leucemia mieloide aguda (MDS/AML): Ocurrió en aproximadamente el 1.2% de los pacientes con diversos cánceres BRCAm, gBRCAm, con mutaciones en genes HRR o HRD positivos expuestos a Lynparza y la mayoría de los eventos tuvieron un desenlace fatal. Monitorear a los pacientes para detectar toxicidad hematológica al inicio y mensualmente a partir de entonces. Discontinuar si se confirma MDS/AML. (5.1)
- •
- Neumonitis: Ocurrió en el 0.8% de los pacientes expuestos a Lynparza, y algunos casos fueron fatales. Interrumpir el tratamiento si se sospecha neumonitis. Discontinuar si se confirma neumonitis. (5.2)
- •
- Tromboembolismo venoso (VTE), incluyendo embolia pulmonar (PE) grave o fatal, ocurrió en pacientes tratados con Lynparza. VTE ocurrió en el 8% de los pacientes con mCRPC. Monitorear a los pacientes para detectar signos y síntomas de VTE y PE y tratar según sea médicamente apropiado. (5.3)
- •
- Toxicidad embriofetal: Puede causar daño fetal. Aconsejar sobre el riesgo potencial para el feto y usar anticoncepción efectiva. (5.4, 8.1, 8.3)
REACCIONES ADVERSAS
Las reacciones adversas más comunes (≥10%) en ensayos clínicos:
- •
- como agente único fueron náuseas, fatiga (incluyendo astenia), anemia, vómitos, diarrea, disminución del apetito, dolor de cabeza, disgeusia, tos, neutropenia, disnea, mareos, dispepsia, leucopenia y trombocitopenia. (6.1)
- •
- en combinación con bevacizumab fueron náuseas, fatiga (incluyendo astenia), anemia, linfopenia, vómitos, diarrea, neutropenia, leucopenia, infección del tracto urinario y dolor de cabeza. (6.1)
- •
- en combinación con abiraterona y prednisona o prednisolona fueron anemia, fatiga, náuseas, diarrea, disminución del apetito, linfopenia, mareos y dolor abdominal. (6.1)
Para reportar REACCIONES ADVERSAS SOSPECHADAS, contacte a AstraZeneca al 1-800-236-9933 o a la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES MEDICAMENTOSAS
Consulte la sección 17 para obtener INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y la Guía de medicación.
Revisado: 11/2023
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
1.1 Tratamiento de mantenimiento de primera línea del cáncer de ovario avanzado con mutación BRCA
1.2 Tratamiento de mantenimiento de primera línea del cáncer de ovario avanzado HRD-positivo en combinación con bevacizumab
1.3 Tratamiento de mantenimiento del cáncer de ovario recurrente con mutación BRCA
1.4 Tratamiento adyuvante del cáncer de mama temprano de alto riesgo HER2-negativo con mutación BRCA germinal
1.5 Cáncer de mama metastásico HER2-negativo con mutación BRCA germinal
1.6 Tratamiento de mantenimiento de primera línea del adenocarcinoma pancreático metastásico con mutación BRCA germinal
1.7 Cáncer de próstata resistente a la castración metastásico con mutación en el gen HRR
1.8 Tratamiento del cáncer de próstata resistente a la castración metastásico con mutación BRCA en combinación con abiraterona y prednisona o prednisolona
2 DOSIS Y ADMINISTRACIÓN
2.1 Selección de pacientes
2.2 Dosis recomendada
2.3 Modificaciones de dosis por reacciones adversas
2.4 Modificaciones de dosis por uso concomitante con inhibidores fuertes o moderados de CYP3A
2.5 Modificaciones de dosis por insuficiencia renal
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Síndrome mielodisplásico/leucemia mieloide aguda
5.2 Neumonitis
5.3 Tromboembolismo venoso
5.4 Toxicidad embriofetal
6 REACCIONES ADVERSAS
6.1 Experiencia en ensayos clínicos
6.2 Experiencia poscomercialización
7 INTERACCIONES MEDICAMENTOSAS
7.1 Uso con agentes anticancerígenos
7.2 Efecto de otros medicamentos sobre Lynparza
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.3 Mujeres y hombres con capacidad reproductiva
8.4 Uso pediátrico
8.5 Uso geriátrico
8.6 Insuficiencia renal
8.7 Insuficiencia hepática
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
12.2 Farmacodinámica
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Tratamiento de mantenimiento de primera línea del cáncer de ovario avanzado con mutación BRCA
14.2 Tratamiento de mantenimiento de primera línea del cáncer de ovario avanzado HRD-positivo en combinación con bevacizumab
14.3 Tratamiento de mantenimiento del cáncer de ovario recurrente con mutación BRCA
14.4 Tratamiento adyuvante del cáncer de mama temprano de alto riesgo HER2-negativo con mutación BRCA germinal
14.5 Tratamiento del cáncer de mama metastásico HER2-negativo con mutación BRCA germinal
14.6 Tratamiento de mantenimiento de primera línea del adenocarcinoma pancreático metastásico con mutación BRCA germinal
14.7 Cáncer de próstata resistente a la castración metastásico con mutación en el gen HRR
14.8 Tratamiento del cáncer de próstata resistente a la castración metastásico con mutación BRCA en combinación con abiraterona y prednisona o prednisolona
16 PRESENTACIÓN/ALMACENAMIENTO Y MANIPULACIÓN
17 INFORMACIÓN DE ASESORAMIENTO PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
1 INDICACIONES Y USO
1.1 Tratamiento de mantenimiento de primera línea del cáncer de ovario avanzado con mutación BRCA
Lynparza está indicado para el tratamiento de mantenimiento de pacientes adultos con cáncer epitelial de ovario avanzado, de trompa de Falopio o peritoneal primario con mutación germinal o somática BRCA deletérea o presuntamente deletérea que están en respuesta completa o parcial a la quimioterapia de primera línea basada en platino. Seleccione a los pacientes para la terapia basándose en una prueba diagnóstica complementaria aprobada por la FDA para Lynparza [ver Dosis y Administración (2.1)].
1.2 Tratamiento de mantenimiento de primera línea del cáncer de ovario avanzado con HRD positivo en combinación con bevacizumab
Lynparza está indicado en combinación con bevacizumab para el tratamiento de mantenimiento de pacientes adultos con cáncer epitelial de ovario avanzado, de trompa de Falopio o peritoneal primario que están en respuesta completa o parcial a la quimioterapia de primera línea basada en platino y cuyo cáncer está asociado con el estado positivo de deficiencia de recombinación homóloga (HRD) definido por:
-
- •
- una mutación BRCA deletérea o presuntamente deletérea, y/o
- •
- inestabilidad genómica.
Seleccione a los pacientes para la terapia basándose en una prueba diagnóstica complementaria aprobada por la FDA para Lynparza [ver Dosis y Administración (2.1)].
1.3 Tratamiento de mantenimiento del cáncer de ovario recurrente con mutación BRCA
Lynparza está indicado para el tratamiento de mantenimiento de pacientes adultos con cáncer epitelial de ovario, de trompa de Falopio o peritoneal primario recurrente con mutación germinal o somática BRCA deletérea o presuntamente deletérea, que están en respuesta completa o parcial a la quimioterapia basada en platino. Seleccione a los pacientes para la terapia basándose en una prueba diagnóstica complementaria aprobada por la FDA para Lynparza [ver Dosis y Administración (2.1)].
1.4 Tratamiento adyuvante del cáncer de mama temprano de alto riesgo HER2-negativo con mutación BRCA germinal
Lynparza está indicado para el tratamiento adyuvante de pacientes adultos con cáncer de mama temprano de alto riesgo HER2-negativo con mutación gBRCAm deletérea o presuntamente deletérea que han sido tratados con quimioterapia neoadyuvante o adyuvante. Seleccione a los pacientes para la terapia basándose en una prueba diagnóstica complementaria aprobada por la FDA para Lynparza [ver Dosis y Administración (2.1)].
1.5 Cáncer de mama metastásico HER2-negativo con mutación BRCA germinal
Lynparza está indicado para el tratamiento de pacientes adultos con cáncer de mama metastásico HER2-negativo con mutación gBRCAm deletérea o presuntamente deletérea, que han sido tratados con quimioterapia en el entorno neoadyuvante, adyuvante o metastásico. Los pacientes con cáncer de mama con receptor hormonal (HR) positivo deben haber sido tratados con una terapia endocrina previa o considerarse inapropiados para la terapia endocrina. Seleccione a los pacientes para la terapia basándose en una prueba diagnóstica complementaria aprobada por la FDA para Lynparza [ver Dosis y Administración (2.1)].
1.6 Tratamiento de mantenimiento de primera línea del adenocarcinoma pancreático metastásico con mutación BRCA germinal
Lynparza está indicado para el tratamiento de mantenimiento de pacientes adultos con adenocarcinoma pancreático metastásico con mutación gBRCAm deletérea o presuntamente deletérea cuya enfermedad no ha progresado en al menos 16 semanas de un régimen de quimioterapia de primera línea basado en platino. Seleccione a los pacientes para la terapia basándose en una prueba diagnóstica complementaria aprobada por la FDA para Lynparza [ver Dosis y Administración (2.1)].
1.7 Cáncer de próstata resistente a la castración metastásico con mutación del gen HRR
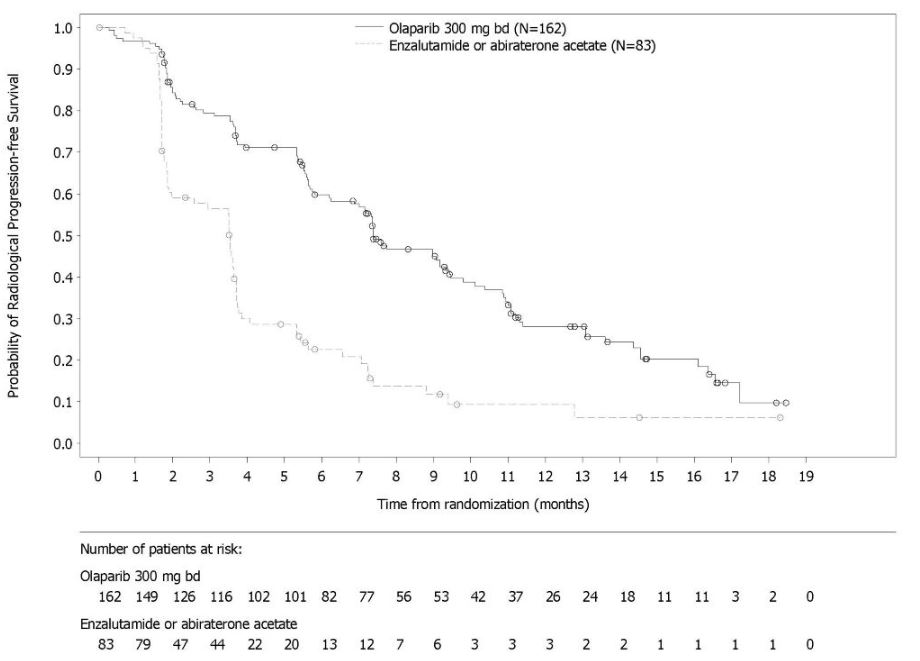
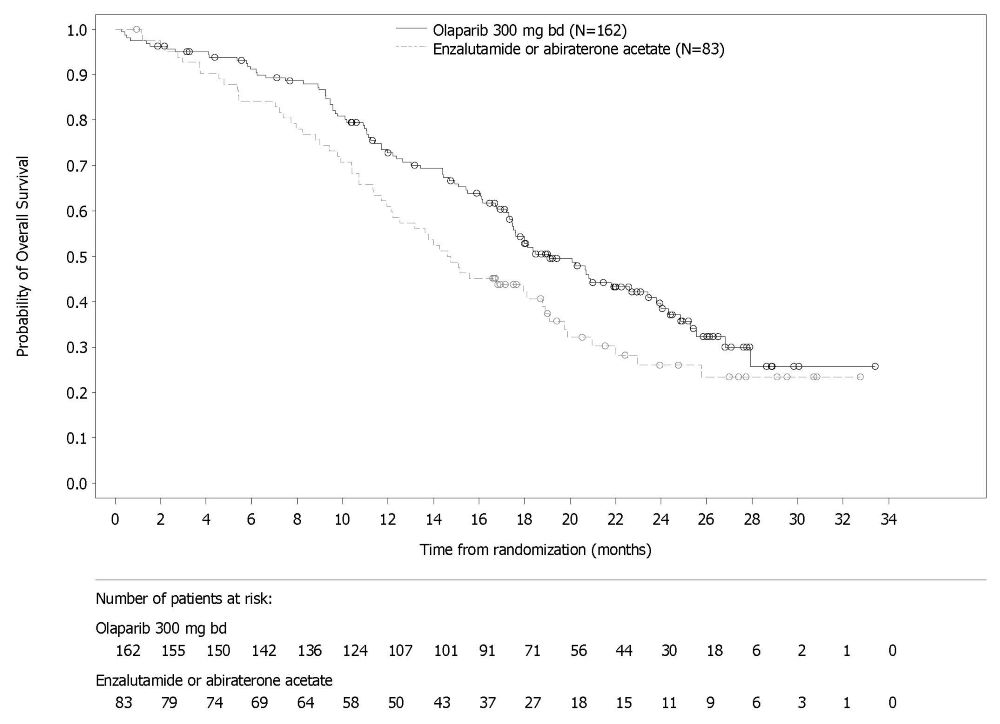
Lynparza está indicado para el tratamiento de pacientes adultos con cáncer de próstata resistente a la castración metastásico (mCRPC) con mutación deletérea o presuntamente deletérea germinal o somática del gen de reparación por recombinación homóloga (HRR) que han progresado después del tratamiento previo con enzalutamida o abiraterona. Seleccione a los pacientes para la terapia basándose en una prueba diagnóstica complementaria aprobada por la FDA para Lynparza [ver Dosis y Administración (2.1)].
1.8 Tratamiento del cáncer de próstata resistente a la castración metastásico con mutación BRCA en combinación con abiraterona y prednisona o prednisolona
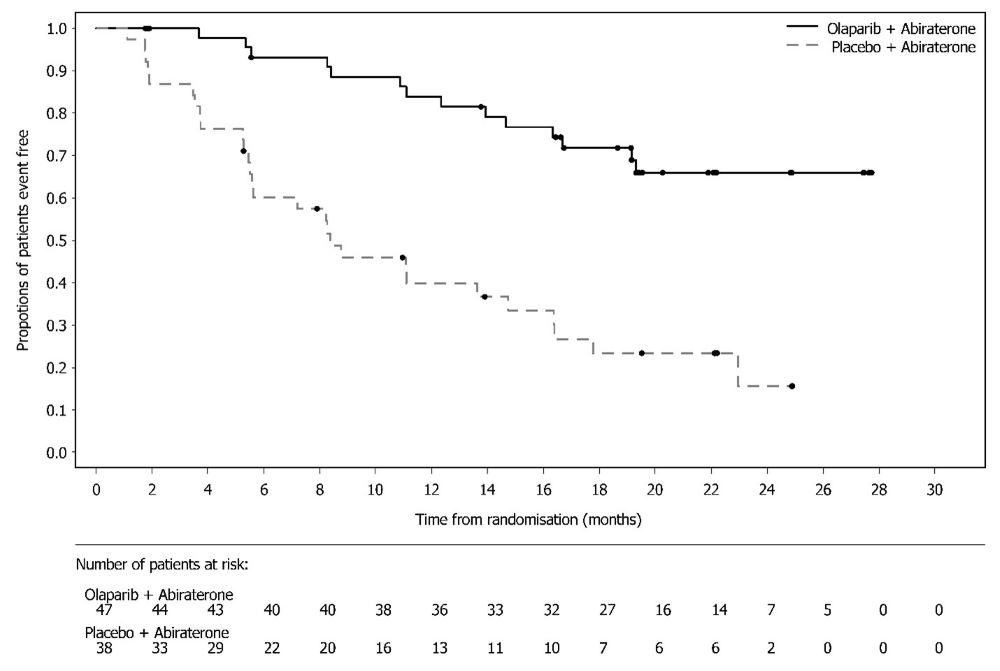
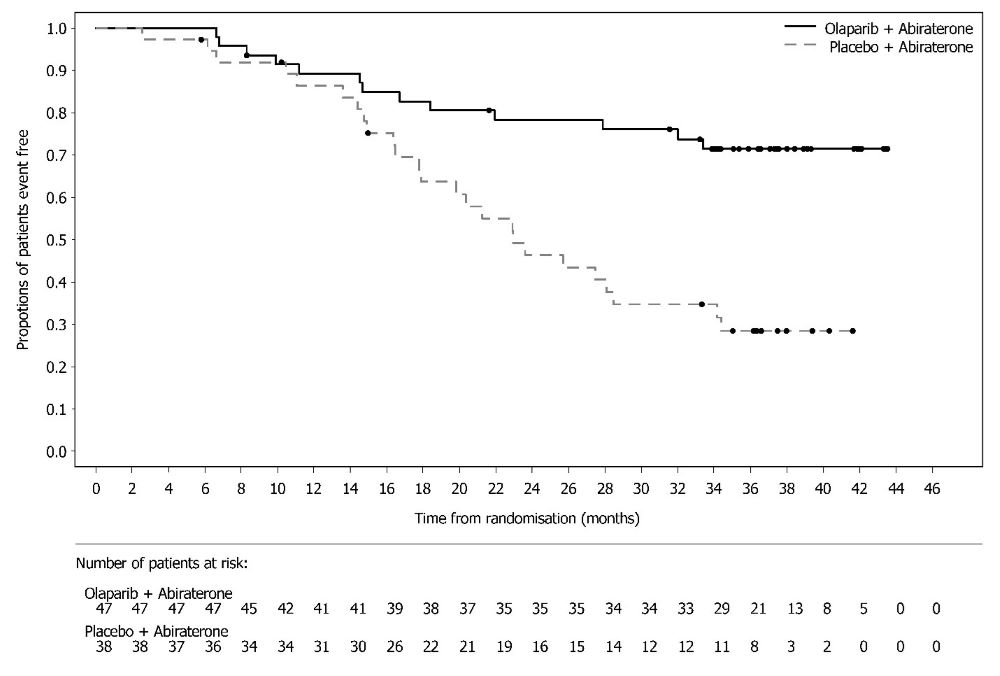
Lynparza está indicado en combinación con abiraterona y prednisona o prednisolona para el tratamiento de pacientes adultos con cáncer de próstata resistente a la castración metastásico (mCRPC) con mutación BRCA (BRCAm) deletérea o presuntamente deletérea. Seleccione a los pacientes para la terapia basándose en una prueba diagnóstica complementaria aprobada por la FDA para Lynparza [ver Dosis y Administración (2.1)].
2 POSOLOGÍA Y ADMINISTRACIÓN
2.1 Selección de Pacientes
Información sobre las pruebas aprobadas por la FDA para la detección de mutaciones genéticas está disponible en http://www.fda.gov/companiondiagnostics.
Seleccione pacientes para el tratamiento con Lynparza basándose en la presencia de mutaciones deletéreas o sospechadas deletéreas en los genes HRR, incluidas las mutaciones BRCA, o la inestabilidad genómica según la indicación, el biomarcador y el tipo de muestra (Tabla 1).
|
||||
|
Indicación |
Biomarcador |
Tipo de muestra |
||
|
Tumor |
Sangre |
Plasma (ctDNA) |
||
|
Tratamiento de mantenimiento de primera línea del cáncer de ovario avanzado BRCAm germinal o somático |
BRCA1m, BRCA2m |
X |
X |
|
|
Tratamiento de mantenimiento de primera línea del cáncer de ovario avanzado HRD-positivo en combinación con bevacizumab |
BRCA1m, BRCA2m y/o inestabilidad genómica |
X |
||
|
Tratamiento de mantenimiento del cáncer de ovario recurrente BRCAm germinal o somático |
BRCA1m, BRCA2m |
X |
X |
|
|
Tratamiento adyuvante del cáncer de mama temprano de alto riesgo HER2-negativo gBRCAm |
gBRCA1m, gBRCA2m |
X |
||
|
Cáncer de mama metastásico HER2-negativo gBRCAm |
gBRCA1m, gBRCA2m |
X |
||
|
Tratamiento de mantenimiento de primera línea del adenocarcinoma pancreático metastásico con mutación germinal BRCA |
gBRCA1m, gBRCA2m |
X |
||
|
Cáncer de próstata resistente a la castración metastásico con mutación germinal o somática del gen HRR |
ATMm, BRCA1m, BRCA2m, BARD1m, BRIP1m, CDK12m, CHEK1m, CHEK2m, FANCLm, PALB2m, RAD51Bm, RAD51Cm, RAD51Dm, RAD54Lm |
X |
||
|
gBRCA1m, gBRCA2m |
X |
|||
|
ATMm, BRCA1m, BRCA2m |
X |
|||
|
Cáncer de próstata resistente a la castración metastásico mutado por BRCA en combinación con abiraterona y prednisona o prednisolona |
BRCA1m, BRCA2m |
X |
X |
X |
2.2 Dosis recomendada
La dosis recomendada de Lynparza es de 300 mg tomados por vía oral dos veces al día, con o sin alimentos.
Si un paciente olvida una dosis de Lynparza, indique al paciente que tome su próxima dosis a la hora programada.
Indique a los pacientes que traguen los comprimidos enteros. No mastique, triture, disuelva o divida el comprimido.
Tratamiento de mantenimiento de primera línea del cáncer de ovario avanzado mutado por BRCA
Continuar el tratamiento hasta la progresión de la enfermedad, toxicidad inaceptable o finalización de 2 años de tratamiento. Los pacientes con una respuesta completa (sin evidencia radiológica de enfermedad) a los 2 años deben interrumpir el tratamiento. Los pacientes con evidencia de enfermedad a los 2 años, que en opinión del proveedor de atención médica tratante puedan obtener un mayor beneficio del tratamiento continuo, pueden ser tratados más allá de los 2 años.
Tratamiento de mantenimiento de primera línea del cáncer de ovario avanzado HRD positivo en combinación con bevacizumab
Continuar el tratamiento con Lynparza hasta la progresión de la enfermedad, toxicidad inaceptable o finalización de 2 años de tratamiento. Los pacientes con una respuesta completa (sin evidencia radiológica de enfermedad) a los 2 años deben interrumpir el tratamiento. Los pacientes con evidencia de enfermedad a los 2 años, que en opinión del proveedor de atención médica tratante puedan obtener un mayor beneficio del tratamiento continuo con Lynparza, pueden ser tratados más allá de los 2 años.
Cuando se usa con Lynparza, la dosis recomendada de bevacizumab es de 15 mg/kg cada tres semanas. Bevacizumab debe administrarse durante un total de 15 meses, incluido el período administrado con quimioterapia y administrado como mantenimiento. Consulte la Información de prescripción de bevacizumab cuando se usa en combinación con Lynparza para obtener más información.
Tratamiento adyuvante del cáncer de mama temprano de alto riesgo HER2 negativo mutado por BRCA germinal
Continuar el tratamiento durante un total de 1 año, o hasta la recurrencia de la enfermedad, o toxicidad inaceptable, lo que ocurra primero. Las pacientes que reciben Lynparza para el cáncer de mama HER2 negativo con receptores hormonales positivos deben continuar el tratamiento concurrente con terapia endocrina según las guías de práctica clínica actuales.
Cáncer de ovario recurrente mutado por BRCA germinal o somático, cáncer de mama metastásico HER2 negativo mutado por BRCA germinal, adenocarcinoma pancreático metastásico mutado por BRCA germinal y cáncer de próstata resistente a la castración metastásico mutado por el gen HRR
Continuar el tratamiento hasta la progresión de la enfermedad o toxicidad inaceptable para:
-
- •
- Tratamiento de mantenimiento del cáncer de ovario recurrente mutado por BRCA germinal o somático.
- •
- Cáncer de mama metastásico HER-2 negativo mutado por BRCA germinal.
- •
- Tratamiento de mantenimiento de primera línea del adenocarcinoma pancreático metastásico mutado por BRCA germinal.
- •
- Cáncer de próstata resistente a la castración metastásico mutado por el gen HRR.
Cáncer de próstata resistente a la castración metastásico mutado por BRCA en combinación con abiraterona y prednisona o prednisolona
Continuar el tratamiento hasta la progresión de la enfermedad o toxicidad inaceptable.
Cuando se usa con Lynparza, la dosis recomendada de abiraterona es de 1000 mg tomados por vía oral una vez al día. La abiraterona debe administrarse en combinación con 5 mg de prednisona o prednisolona por vía oral dos veces al día. Consulte la Información de prescripción de abiraterona para obtener información sobre la dosificación.
Los pacientes con mCRPC también deben recibir un análogo de la hormona liberadora de gonadotropina (GnRH) de forma concurrente o deben haber sido sometidos a una orquiectomía bilateral.
2.3 Modificaciones de la dosis por reacciones adversas
Para manejar las reacciones adversas, considere la interrupción del tratamiento o la reducción de la dosis. La reducción de dosis recomendada es de 250 mg tomados dos veces al día.
Si se requiere una reducción adicional de la dosis, reduzca a 200 mg tomados dos veces al día.
2.4 Modificaciones de la dosis para el uso concomitante con inhibidores fuertes o moderados de CYP3A
Evite el uso concomitante de inhibidores fuertes o moderados de CYP3A con Lynparza.
Si no se puede evitar el uso concomitante, reduzca la dosis de Lynparza a:
- •
- 100 mg dos veces al día cuando se usa concomitantemente con un inhibidor fuerte de CYP3A.
- •
- 150 mg dos veces al día cuando se usa concomitantemente con un inhibidor moderado de CYP3A.
Después de que el inhibidor se haya suspendido durante 3 a 5 vidas medias de eliminación, reanude la dosis de Lynparza tomada antes de iniciar el inhibidor de CYP3A [ver Interacciones farmacológicas (7.2) y Farmacología clínica (12.3)].
2.5 Modificaciones de la dosis por insuficiencia renal
Insuficiencia renal moderada
En pacientes con insuficiencia renal moderada (ClCr 31-50 ml/min), reduzca la dosis de Lynparza a 200 mg por vía oral dos veces al día [ver Uso en poblaciones específicas (8.6) y Farmacología clínica (12.3)].
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Comprimidos:
- •
- 150 mg: verde a verde/gris, oval, biconvexo, recubierto con película, con el grabado ‘OP150’ en un lado y liso en el reverso.
- •
- 100 mg: amarillo a amarillo oscuro, oval, biconvexo, recubierto con película, con el grabado ‘OP100’ en un lado y liso en el reverso.
4 CONTRAINDICACIONES
Ninguna.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Síndrome Mielodisplásico/Leucemia Mieloide Aguda
El síndrome mielodisplásico (SMD)/leucemia mieloide aguda (LMA) ha ocurrido en pacientes tratados con Lynparza y algunos casos fueron fatales.
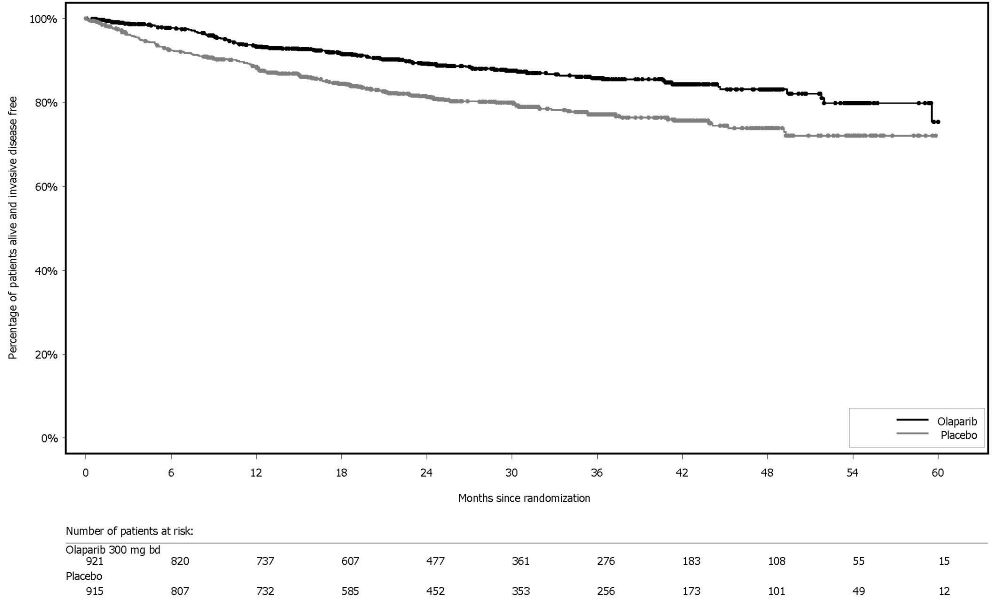
En estudios clínicos, entre 2219 pacientes con varios tipos de cáncer BRCAm, gBRCAm, con mutación del gen HRR o HRD-positivo que recibieron Lynparza como agente único o como parte de un régimen de combinación, consistente con las indicaciones aprobadas, la incidencia acumulada de SMD/LMA fue de aproximadamente 1.2% (26/2219) [ver Reacciones Adversas (6.1)]. De estos, el 54% (14/26) tuvo un desenlace fatal. La duración media de la terapia con Lynparza en pacientes que desarrollaron SMD/LMA fue de aproximadamente 2 años (rango: < 6 meses a > 4 años). Todos estos pacientes habían recibido quimioterapia previa con agentes de platino y/u otros agentes dañinos del ADN, incluyendo radioterapia.
En SOLO1, pacientes con cáncer de ovario avanzado BRCAm recién diagnosticado, la incidencia de SMD/LMA fue del 1.9% (5/260) en pacientes que recibieron Lynparza y del 0.8% (1/130) en pacientes que recibieron placebo según un análisis actualizado. En PAOLA-1, de pacientes con cáncer de ovario avanzado recién diagnosticado con estado HRD-positivo, la incidencia de SMD/LMA fue del 1.6% (4/255) en pacientes que recibieron Lynparza y del 2.3% (3/131) en el brazo de control.
En SOLO2, pacientes con cáncer de ovario recurrente BRCAm sensible al platino, la incidencia de SMD/LMA fue del 8% (15/195) en pacientes que recibieron Lynparza y del 4% (4/99) en pacientes que recibieron placebo. La duración del tratamiento con Lynparza antes del diagnóstico de SMD/LMA varió de 0.6 años a 4.5 años.
No inicie Lynparza hasta que los pacientes se hayan recuperado de la toxicidad hematológica causada por la quimioterapia previa (≤ Grado 1). Monitoree el hemograma completo para detectar citopenia al inicio y mensualmente a partir de entonces para cambios clínicamente significativos durante el tratamiento. Para toxicidades hematológicas prolongadas, interrumpa Lynparza y monitoree los recuentos sanguíneos semanalmente hasta la recuperación. Si los niveles no se han recuperado a Grado 1 o menos después de 4 semanas, remita al paciente a un hematólogo para investigaciones adicionales, incluido el análisis de médula ósea y una muestra de sangre para citogenética. Si se confirma SMD/LMA, discontinúe Lynparza.
5.2 Neumonitis
En estudios clínicos que inscribieron a 2901 pacientes con diversos tipos de cáncer que recibieron Lynparza como agente único [ver Reacciones Adversas (6.1)], la incidencia de neumonitis, incluidos casos fatales, fue del 0.8% (24/2901). Si los pacientes presentan síntomas respiratorios nuevos o que empeoran, como disnea, tos y fiebre, o se produce una anormalidad radiológica, interrumpa el tratamiento con Lynparza y evalúe rápidamente la fuente de los síntomas. Si se confirma neumonitis, discontinúe el tratamiento con Lynparza y trate al paciente adecuadamente.
5.3 Tromboembolismo Venoso
El tromboembolismo venoso (TEV), incluida la embolia pulmonar (EP) grave o fatal, ocurrió en pacientes tratados con Lynparza [ver Reacciones Adversas (6.1)].
En los datos combinados de dos estudios clínicos aleatorizados y controlados con placebo (PROfound y PROpel) en pacientes con cáncer de próstata resistente a la castración metastásico (N=1180), el TEV ocurrió en el 8% de los pacientes que recibieron Lynparza, incluida la embolia pulmonar en el 6%. En los brazos de control, el TEV ocurrió en el 2.5%, incluida la embolia pulmonar en el 1.5%.
Monitoree a los pacientes para detectar signos y síntomas clínicos de trombosis venosa y embolia pulmonar y trate según sea médicamente apropiado, lo que puede incluir anticoagulación a largo plazo según esté clínicamente indicado.
5.4 Toxicidad Embriofetal
Lynparza puede causar daño fetal cuando se administra a una mujer embarazada según su mecanismo de acción y los hallazgos en animales. En un estudio de reproducción animal, la administración de olaparib a ratas preñadas durante el período de organogénesis causó teratogenicidad y toxicidad embriofetal a exposiciones inferiores a las de los pacientes que reciben la dosis humana recomendada de 300 mg dos veces al día. Informe a las mujeres embarazadas sobre el peligro potencial para el feto y el riesgo potencial de pérdida del embarazo. Aconseje a las mujeres en edad fértil que utilicen un método anticonceptivo eficaz durante el tratamiento y durante los 6 meses posteriores a la última dosis de Lynparza. Según los hallazgos de los estudios de toxicidad genética y reproducción animal, aconseje a los pacientes masculinos con parejas femeninas en edad fértil o que estén embarazadas que usen un método anticonceptivo eficaz durante el tratamiento y durante los 3 meses posteriores a la última dosis de Lynparza [ver Uso en Poblaciones Específicas (8.1, 8.3)].
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas se discuten en otra parte del etiquetado:
- •
- Síndrome mielodisplásico/leucemia mieloide aguda [ver Advertencias y precauciones (5.1)]
- •
- Neumonitis [ver Advertencias y precauciones (5.2)]
- •
- Tromboembolismo venoso [ver Advertencias y precauciones (5.3)]
6.1 Experiencia de ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones muy variadas, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no pueden compararse directamente con las tasas de los ensayos clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica.
A menos que se especifique lo contrario, los datos descritos en ADVERTENCIAS Y PRECAUCIONES reflejan la exposición a Lynparza como agente único en 2901 pacientes; 2135 pacientes con exposición a una dosis de comprimidos de 300 mg dos veces al día, incluidos cinco ensayos controlados, aleatorizados (SOLO-1, SOLO-2, OlympiAD, POLO y PROfound) y una dosis de cápsulas de 400 mg dos veces al día en 766 pacientes en otros ensayos que se agruparon para realizar análisis de seguridad. Además de los 2901 pacientes, ciertas subsecciones en ADVERTENCIAS Y PRECAUCIONES incluyen reacciones adversas observadas con la exposición a Lynparza con abiraterona (n=398) en PROpel. Todos los pacientes con cáncer de próstata resistente a la castración metastásico recibieron TDA (terapia de deprivación androgénica) concomitante u orquiectomía bilateral previa.
En la población de seguridad agrupada, el 56% de los pacientes estuvieron expuestos durante 6 meses o más y el 28% estuvieron expuestos durante más de un año en el grupo de Lynparza.
En esta población de seguridad agrupada, las reacciones adversas más frecuentes en ≥10% de los pacientes fueron náuseas (60%), fatiga (55%), anemia (36%), vómitos (32%), diarrea (24%), disminución del apetito (22%), dolor de cabeza (16%), disgeusia (15%), tos (15%), neutropenia (14%), disnea (14%), mareos (12%), dispepsia (12%), leucopenia (11%) y trombocitopenia (10%).
Tratamiento de mantenimiento de primera línea del cáncer de ovario avanzado con mutación BRCA
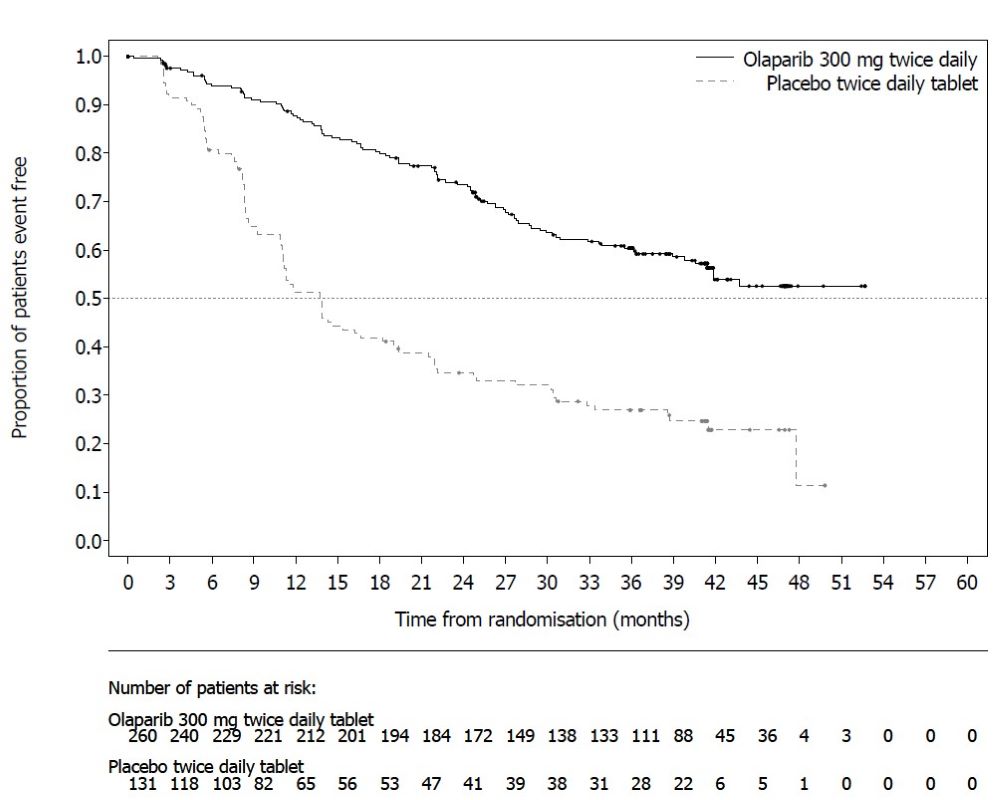
SOLO-1
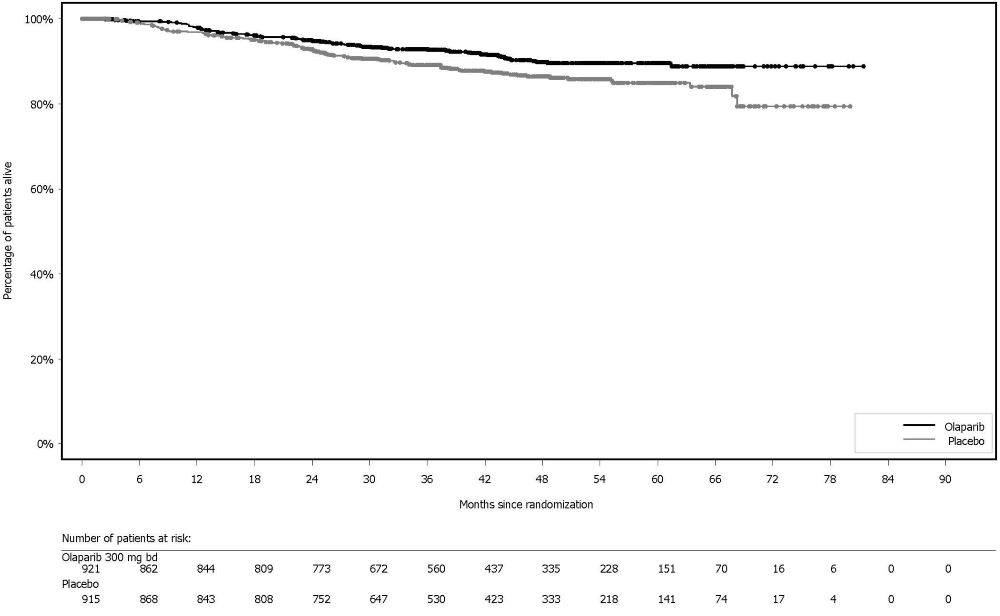
La seguridad de Lynparza para el tratamiento de mantenimiento de pacientes con cáncer de ovario avanzado con mutación BRCA después del tratamiento de primera línea con quimioterapia basada en platino se investigó en SOLO-1 [ver Estudios clínicos (14.1)]. Las pacientes recibieron comprimidos de Lynparza de 300 mg por vía oral dos veces al día (n=260) o placebo (n=130) hasta la progresión de la enfermedad o toxicidad inaceptable. La mediana de duración del tratamiento del estudio fue de 25 meses para las pacientes que recibieron Lynparza y de 14 meses para las pacientes que recibieron placebo.
Entre las pacientes que recibieron Lynparza, las interrupciones de dosis debido a una reacción adversa de cualquier grado ocurrieron en el 52% y las reducciones de dosis debido a una reacción adversa ocurrieron en el 28%. Las reacciones adversas más frecuentes que llevaron a la interrupción o reducción de la dosis de Lynparza fueron anemia (23%), náuseas (14%) y vómitos (10%). La interrupción debido a reacciones adversas ocurrió en el 12% de las pacientes que recibieron Lynparza. Las reacciones adversas más frecuentes que llevaron a la interrupción de Lynparza fueron fatiga (3,1%), anemia (2,3%) y náuseas (2,3%).
Las Tablas 2 y 3 resumen las reacciones adversas y las anomalías de laboratorio en SOLO-1.
|
||||
|
Reacción adversa |
Comprimidos de Lynparza n=260 |
Placebo n=130 |
||
|
Todos los grados (%) |
Grados 3 – 4 (%) |
Todos los grados (%) |
Grados 3 – 4 (%) |
|
|
Trastornos gastrointestinales |
||||
|
Náuseas |
77 |
1 |
38 |
0 |
|
Dolor abdominal† |
45 |
2 |
35 |
1 |
|
Vómito |
40 |
0 |
15 |
1 |
|
Diarrea‡ |
37 |
3 |
26 |
0 |
|
Estreñimiento |
28 |
0 |
19 |
0 |
|
Dispepsia |
17 |
0 |
12 |
0 |
|
Estomatitis§ |
11 |
0 |
2 |
0 |
|
Trastornos generales y alteraciones en el lugar de administración |
||||
|
Fatiga¶ |
67 |
4 |
42 |
2 |
|
Trastornos de la sangre y del sistema linfático |
||||
|
Anemia |
38 |
21 |
9 |
2 |
|
Neutropenia# |
17 |
6 |
7 |
3 |
|
LeucopeniaÞ |
13 |
3 |
8 |
0 |
|
Trombocitopeniaß |
11 |
1 |
4 |
2 |
|
Infecciones e infestaciones |
||||
|
Infección de las vías respiratorias superiores/influenza/nasofaringitis/bronquitis |
28 |
0 |
23 |
0 |
|
ITUà |
13 |
1 |
7 |
0 |
|
Trastornos del sistema nervioso |
||||
|
Disgeusia |
26 |
0 |
4 |
0 |
|
Mareos |
20 |
0 |
15 |
1 |
|
Trastornos del Metabolismo y de la Nutrición |
||||
|
Apetito disminuido |
20 |
0 |
10 |
0 |
|
Trastornos Respiratorios, Torácicos y Mediastínicos |
||||
|
Disneaè |
15 |
0 |
6 |
0 |
Las reacciones adversas clínicamente relevantes que ocurrieron en <10% de los pacientes que recibieron Lynparza fueron aumento de la creatinina sanguínea (8%), linfopenia (6%), ETV (3%), hipersensibilidad (2%), SMD/LMA (1.9%), dermatitis (1%), y aumento del volumen corpuscular medio (0.4%).
|
Parámetro de Laboratorio* |
Tabletas de Lynparza n†=260 |
Placebo n†=130 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Grados 1-4 (%) |
Grados 3-4 (%) |
Grados 1-4 (%) |
Grados 3-4 (%) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Disminución de la hemoglobina |
87 |
19 |
63 |
2 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Aumento del volumen corpuscular medio |
87 |
– |
43 |
– |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Disminución de leucocitos |
70 |
7 |
52 |
1 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Disminución de linfocitos |
67 |
14 |
29 |
5 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Disminución del recuento absoluto de neutrófilos |
51 |
9 |
38 |
6 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Disminución de plaquetas |
35 |
1 |
20 |
2 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Aumento de la creatinina sérica |
34 |
0 |
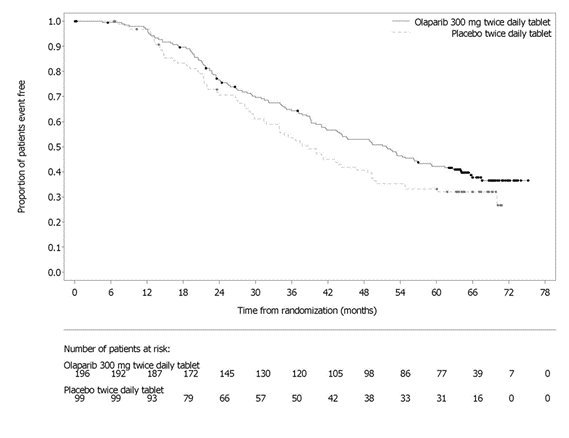
18 Tratamiento de mantenimiento de primera línea de cáncer de ovario avanzado HRD-positivo en combinación con bevacizumab PAOLA-1 La seguridad de Lynparza en combinación con bevacizumab para el tratamiento de mantenimiento de pacientes con cáncer de ovario avanzado después del tratamiento de primera línea que contiene quimioterapia basada en platino y bevacizumab se investigó en PAOLA-1 [ver Estudios clínicos (14.2)]. Este estudio fue un estudio doble ciego controlado con placebo en el que 802 pacientes recibieron Lynparza 300 mg BID en combinación con bevacizumab (n=535) o placebo en combinación con bevacizumab (n=267) hasta la progresión de la enfermedad o toxicidad inaceptable. La duración media del tratamiento con Lynparza fue de 17,3 meses y 11 meses para bevacizumab post-aleatorización en el brazo de Lynparza/bevacizumab. Se produjo una reacción adversa fatal en 1 paciente debido a neumonía concurrente y anemia aplásica. Se produjeron reacciones adversas graves en el 31% de los pacientes que recibieron Lynparza/bevacizumab. Las reacciones adversas graves en >5% de los pacientes incluyeron hipertensión (19%) y anemia (17%). Las interrupciones de dosis debido a una reacción adversa de cualquier grado ocurrieron en el 54% de los pacientes que recibieron Lynparza/bevacizumab y las reducciones de dosis debido a una reacción adversa ocurrieron en el 41% de los pacientes que recibieron Lynparza/bevacizumab. Las reacciones adversas más frecuentes que llevaron a la interrupción de la dosis en el brazo de Lynparza/bevacizumab fueron anemia (21%), náuseas (7%), vómitos (3%) y fatiga (3%), y las reacciones adversas más frecuentes que llevaron a la reducción en el brazo de Lynparza/bevacizumab fueron anemia (19%), náuseas (7%) y fatiga (4%). La interrupción debido a reacciones adversas ocurrió en el 20% de los pacientes que recibieron Lynparza/bevacizumab. Las reacciones adversas específicas que con mayor frecuencia llevaron a la interrupción en pacientes tratados con Lynparza/bevacizumab fueron anemia (4%) y náuseas (3%). Las reacciones adversas más comunes (≥ 10%) en pacientes que recibieron Lynparza/bevacizumab, independientemente de la frecuencia en comparación con el brazo placebo/bevacizumab, fueron náuseas (53%), fatiga (incluyendo astenia) (53%), anemia (41%), linfopenia (24%), vómitos (22%), diarrea (18%), neutropenia (18%), leucopenia (18%), infección del tracto urinario (15%) y dolor de cabeza (14%). Las Tablas 4 y 5 resumen las reacciones adversas y las anormalidades de laboratorio en PAOLA-1, respectivamente.
Reacciones adversas clínicamente relevantes que ocurrieron en <10% de los pacientes que recibieron Lynparza/bevacizumab fueron disgeusia (8%), disnea (8%), estomatitis (5%), dispepsia (4.3%), eritema (3%), mareos (2.6%), hipersensibilidad (1.7%) y MDS/AML (0.7%). La tromboembolia venosa ocurrió con más frecuencia en pacientes que recibieron Lynparza/bevacizumab (5%) que en aquellos que recibieron placebo/bevacizumab (1.9%).
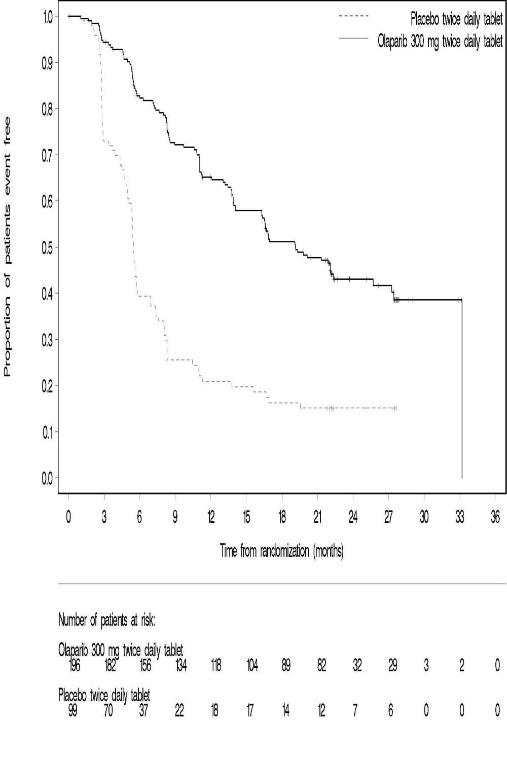
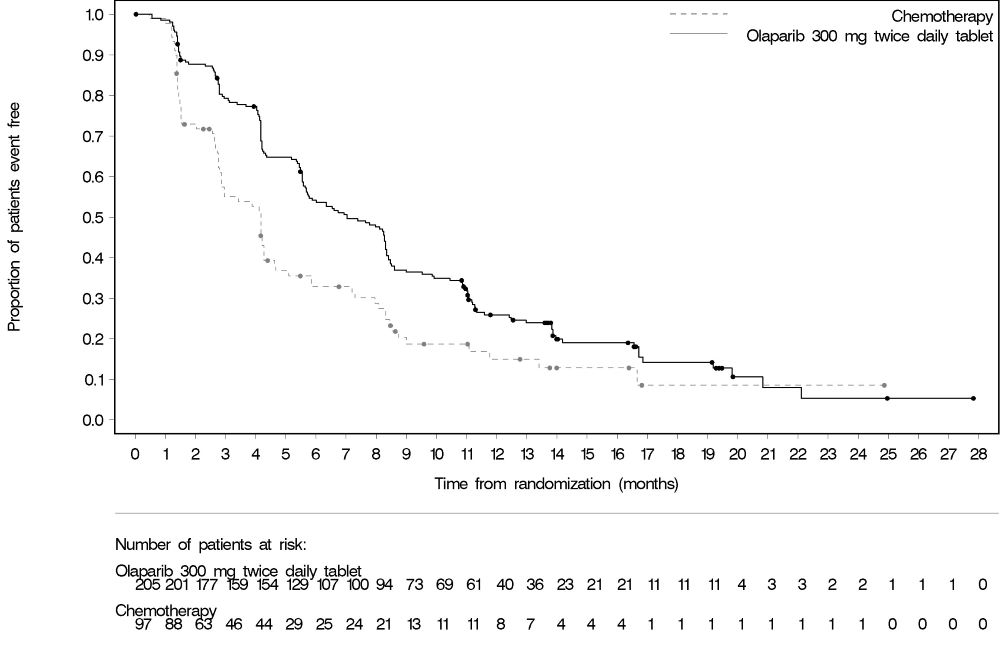
Tratamiento de Mantenimiento del Cáncer de Ovario Recurrente con mutación BRCA SOLO-2 La seguridad de Lynparza para el tratamiento de mantenimiento de pacientes con cáncer de ovario gBRCAm sensible al platino fue investigada en SOLO-2 [ver Estudios Clínicos (14.3)]. Los pacientes recibieron tabletas de Lynparza 300 mg por vía oral dos veces al día (n=195) o placebo (n=99) hasta la progresión de la enfermedad o toxicidad inaceptable. La duración media del tratamiento del estudio fue de 19,4 meses para los pacientes que recibieron Lynparza y de 5,6 meses para los pacientes que recibieron placebo. Entre los pacientes que recibieron Lynparza, las interrupciones de la dosis debido a una reacción adversa de cualquier grado ocurrieron en el 45% y las reducciones de la dosis debido a una reacción adversa ocurrieron en el 27%. Las reacciones adversas más frecuentes que llevaron a la interrupción o reducción de la dosis de Lynparza fueron anemia (22%), neutropenia (9%) y fatiga/astenia (8%). La discontinuación debido a una reacción adversa ocurrió en el 11% de los pacientes que recibieron Lynparza. Las Tablas 6 y 7 resumen las reacciones adversas y las anormalidades de laboratorio en SOLO-2.
Las reacciones adversas clínicamente relevantes que ocurrieron en <20% de los pacientes que recibieron Lynparza fueron neutropenia (19%), tos (18%), leucopenia (16%), hipomagnesemia (14%), trombocitopenia (14%), mareos (13%), dispepsia (11%), aumento de la creatinina (11%), MDS/AML (8%), edema (8%), erupción cutánea (6%), VTE (5%) y linfopenia (1%).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||