Fabricante de medicamentos: Takeda Pharmaceuticals America, Inc. (Updated: 2023-03-22)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
RIXUBIS [Factor IX de la coagulación (recombinante)]
Para inyección intravenosa, polvo liofilizado para solución
Aprobación inicial en EE. UU.: 2013
INDICACIONES Y USO
RIXUBIS (Factor IX de la coagulación [recombinante]) es un factor antihemofílico indicado en adultos y niños con hemofilia B para:
- Tratamiento a demanda y control de episodios de sangrado
- Manejo perioperatorio del sangrado
- Profilaxis de rutina para reducir la frecuencia de episodios de sangrado.
RIXUBIS no está indicado para la inducción de tolerancia inmunitaria en pacientes con hemofilia B. (1)
DOSIFICACIÓN Y ADMINISTRACIÓN
Para uso intravenoso después de la reconstitución únicamente. (2)
Tratamiento a demanda y control de episodios de sangrado y manejo perioperatorio del sangrado:
- Una unidad internacional de RIXUBIS por kg de peso corporal aumenta la actividad circulante del factor IX en 0,7 unidades internacionales/dL para pacientes <12 años de edad y 0,9 unidades internacionales/dL para pacientes ≥12 años de edad. (2.1)
Dosis inicial:
- Unidades internacionales requeridas = peso corporal (kg) × aumento deseado del factor IX (% de lo normal o UI/dL) × recíproco de la recuperación observada (UI/kg por UI/dL). (2.1)
- La dosis de mantenimiento depende del tipo de sangrado o cirugía, la intensidad del desafío hemostático y el número de días hasta que se logra una cicatrización adecuada de la herida. (2.2)
Profilaxis de rutina:
- Pacientes <12 años de edad: 60 a 80 unidades internacionales por kg dos veces por semana.
- Pacientes ≥12 años de edad: 40 a 60 unidades internacionales por kg dos veces por semana. (2.1)
FORMAS Y FUERZAS DE DOSIFICACIÓN
RIXUBIS está disponible como polvo liofilizado en viales de dosis única que contienen nominalmente 250, 500, 1000, 2000 o 3000 unidades internacionales. (3)
CONTRAINDICACIONES
ADVERTENCIAS Y PRECAUCIONES
- Pueden ocurrir reacciones de hipersensibilidad, incluida la anafilaxia. Si se presentan síntomas, suspenda RIXUBIS y administre el tratamiento adecuado. Los pacientes también pueden desarrollar hipersensibilidad a la proteína de hámster (CHO), que está presente en cantidades traza en el producto. (5.1)
- Puede ocurrir el desarrollo de anticuerpos neutralizantes (inhibidores) a RIXUBIS. Si no se alcanzan los niveles plasmáticos esperados de actividad del factor IX, o si el sangrado no se controla con una dosis adecuada, realice un ensayo que mida la concentración del inhibidor del factor IX. (5.2)
- Se ha informado síndrome nefrótico después de la inducción de tolerancia inmunitaria con productos de factor IX en pacientes con hemofilia B con inhibidores del factor IX. (5.3)
- El uso de productos que contienen factor IX se ha asociado con el desarrollo de complicaciones tromboembólicas. (5.4)
REACCIONES ADVERSAS
Las reacciones adversas comunes observadas en >1% de los sujetos en los ensayos clínicos fueron: disgeusia, dolor en las extremidades y prueba positiva para anticuerpos contra la furina. (6.1)
Para informar sobre REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Takeda Pharmaceuticals U.S.A., Inc. al 1-877-TAKEDA-7 (1-877-825-3327) o la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
USO EN POBLACIONES ESPECÍFICAS
Uso pediátrico: Se ha observado una recuperación 22% menor en pacientes pediátricos (<12 años, n=23). El aclaramiento (basado en el peso corporal por kg) fue 30% (6-12 años) y 59% (<6 años) mayor en niños que en adultos. Se necesita un ajuste de dosis. (2.1, 8.4)
Ver 17 para INFORMACIÓN PARA EL PACIENTE y el etiquetado del paciente aprobado por la FDA.
Revisado: 3/2023
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Pautas de dosificación
2.2 Tratamiento a demanda y control de episodios de sangrado y manejo perioperatorio del sangrado
2.3 Profilaxis de rutina
2.4 Preparación y reconstitución
2.5 Administración
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de hipersensibilidad
5.2 Inhibidores
5.3 Síndrome nefrótico
5.4 Complicaciones tromboembólicas
5.5 Monitoreo de pruebas de laboratorio
6 REACCIONES ADVERSAS
6.1 Experiencia en ensayos clínicos
6.2 Experiencia postcomercialización
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso pediátrico
8.5 Uso geriátrico
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad
14 ESTUDIOS CLÍNICOS
15 REFERENCIAS
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
1 INDICACIONES Y USO
RIXUBIS (Factor IX de Coagulación [Recombinante]) es un factor antihemofílico indicado en adultos y niños con hemofilia B para:
- Tratamiento a demanda y control de episodios de sangrado
- Manejo perioperatorio del sangrado
- Profilaxis de rutina para reducir la frecuencia de episodios de sangrado.
RIXUBIS no está indicado para la inducción de tolerancia inmunitaria en pacientes con hemofilia B [ver Advertencias y Precauciones (5.3)].
2 DOSIS Y ADMINISTRACIÓN
Para uso intravenoso después de la reconstitución únicamente.
- Cada vial de RIXUBIS tiene la potencia del Factor IX recombinante (rFIX) en unidades internacionales que se indica en el vial.
- Inicie el tratamiento bajo la supervisión de un médico con experiencia en el tratamiento de la hemofilia.
- La dosis y la duración del tratamiento con RIXUBIS dependen de la gravedad de la deficiencia de factor IX, la ubicación y la extensión del sangrado, la condición clínica del paciente, la edad y los parámetros farmacocinéticos del factor IX, como la recuperación incremental y la vida media.
- La dosificación de RIXUBIS puede diferir de la de los productos de factor IX derivados del plasma [ver Farmacología clínica (12)]. Los sujetos en el extremo inferior del rango de recuperación observado del factor IX pueden requerir un ajuste de la dosis de RIXUBIS.
- Controle a los pacientes utilizando un ensayo de actividad del factor IX para garantizar que se haya alcanzado el nivel plasmático deseado de actividad del factor IX. Si es necesario, ajuste la dosis y la frecuencia de las infusiones repetidas según corresponda.
- Evalúe al paciente para el desarrollo de inhibidores del factor IX si no se alcanzan los niveles plasmáticos esperados de actividad del factor IX o si el sangrado no se controla con una dosis adecuada [ver Advertencias y precauciones (5.2)].
2.1 Pautas de dosificación
Cálculo de la dosis inicial
La dosis inicial de RIXUBIS se calcula en base al hallazgo empírico de que se espera que una unidad internacional de RIXUBIS por kg de peso corporal aumente el nivel circulante de factor IX en 0,7 unidades internacionales/dL de plasma (0,7% de lo normal) para pacientes <12 años de edad y en 0,9 unidades internacionales/dL de plasma (0,9% de lo normal) en pacientes ≥12 años de edad.
Una guía para calcular la dosis inicial de RIXUBIS para el tratamiento de episodios de sangrado es la siguiente:
| Dosis inicial = peso corporal (kg) × aumento deseado del factor IX (% de lo normal o UI/dL) × recíproco de la recuperación observada (UI/kg por UI/dL) |
Recuperación incremental en pacientes previamente tratados (PPT)
Base el cálculo de la dosis en la recuperación incremental individual del paciente utilizando ensayos seriados de actividad del factor IX, debido a la amplia gama de diferencias interindividuales en la recuperación incremental. Titule la dosis en función de la respuesta clínica del paciente y la farmacocinética individual, en particular la recuperación incremental y la vida media.
Pacientes <12 años de edad
En promedio, se ha observado una recuperación 22% menor en pacientes pediátricos (<12 años, n=23). Para una recuperación incremental de 0,7 unidades internacionales/dL de plasma (0,7% de lo normal), la dosis se calcula de la siguiente manera:
| Dosis (unidades internacionales) = peso corporal (kg) × aumento deseado del factor IX (% de lo normal o UI/dL) × 1,4 dL/kg |
Ejemplo (asumiendo que el nivel basal de factor IX del paciente es <1% de lo normal)
- Una dosis de 1500 unidades internacionales de RIXUBIS, administrada a un paciente de 20 kg, debería esperarse que resulte en un aumento máximo del factor IX posterior a la infusión de 1500 unidades internacionales × {[0,7 UI/dL]/[UI/kg]}/[20 kg] = 53,6 unidades internacionales/dL (53,6% de lo normal).
Pacientes ≥12 años de edad
Para una recuperación incremental de 0,9 unidades internacionales/dL de plasma (0,9% de lo normal), la dosis se calcula de la siguiente manera:
| Dosis (unidades internacionales) = peso corporal (kg) × aumento deseado del factor IX (% de lo normal o UI/dL) × 1,1 dL/kg |
Ejemplos (asumiendo que el nivel basal de factor IX del paciente es <1% de lo normal):
- Se espera que una dosis de 4550 unidades internacionales de RIXUBIS, administrada a un paciente de 70 kg, resulte en un pico de aumento del factor IX posterior a la infusión de 4550 unidades internacionales × {[0.9 UI/dL]/[UI/kg]}/[70 kg] = 58.5 unidades internacionales/dL (58.5 % de lo normal).
- Se requiere un nivel máximo del 70% en un paciente de 60 kg. La dosis adecuada sería 60 kg × 70 unidades internacionales/dL/{[0.9 UI/dL]/[UI/kg]} = 4667 unidades internacionales.
2.2 Tratamiento a demanda y control de episodios de sangrado y manejo perioperatorio del sangrado
Se proporciona una guía para la dosificación de RIXUBIS en el tratamiento a demanda y el control de los episodios de sangrado y el manejo perioperatorio del sangrado en la Tabla 1 y la Tabla 2, respectivamente. Asegúrese de que el nivel de actividad del factor IX se logre y se mantenga en el período correspondiente.
| Tipo de episodios de sangrado | Nivel de factor IX circulante requerido (% o UI/dL) | Intervalo de dosificación (horas) | Duración de la terapia (días) |
|---|---|---|---|
| Adaptado de Roberts y Eberst1 | |||
| Menor Hemartrosis no complicada, muscular superficial o tejido blando |
20-30 | 12-24 | Al menos 1 día, hasta que se logre la curación |
| Moderado Intramuscular o tejido blando con disección, membranas mucosas, hematuria |
25-50 | 12-24 | 2-7 días, hasta que cese el sangrado y se logre la curación |
| Mayor Faríngeo, retrofaríngeo, retroperitoneal, SNC |
50-100 | 12-24 | 7-10 días, hasta que cese el sangrado y se logre la curación |
| Tipo de cirugía | Nivel de factor IX circulante requerido (% o UI/dL) | Intervalo de dosificación (horas) | Duración de la terapia (días) |
|---|---|---|---|
| Menor p. ej., extracción de dientes |
30-60 | 24 | Al menos 1 día, hasta que se logre la curación |
| Mayor p. ej., intracraneal, intraabdominal, intratorácica, reemplazo de articulaciones |
80-100 | 8-24 | 7-10 días, hasta que cese el sangrado y se logre la curación |
2.3 Profilaxis de rutina
La dosis para pacientes previamente tratados (PPT) es de 60 a 80 unidades internacionales por kg dos veces por semana para pacientes <12 años de edad y es de 40 a 60 unidades internacionales por kg dos veces por semana para pacientes ≥12 años de edad. Ajuste la dosis en función de la edad del paciente individual, el patrón de sangrado y la actividad física.
2.4 Preparación y reconstitución
Los procedimientos a continuación se proporcionan como pautas generales para la preparación y reconstitución de RIXUBIS. Siempre trabaje en una superficie limpia y lávese las manos antes de realizar los siguientes procedimientos:
- Utilice una técnica aséptica durante el procedimiento de reconstitución.
- Deje que el vial de RIXUBIS (concentrado de factor seco) y el vial de Agua estéril para inyección, USP (diluyente) alcancen la temperatura ambiente.
- Retire las tapas de los viales de concentrado de factor y diluyente.
- Limpie los tapones con una solución germicida y deje que el tapón se seque antes de usar. Coloque los viales sobre una superficie plana.
- Abra el paquete del dispositivo BAXJECT II pelando la tapa, sin tocar el interior (Figura A). No retire el dispositivo del paquete. Tenga en cuenta que el dispositivo BAXJECT II está diseñado para usarse con un solo vial de RIXUBIS y Agua estéril para inyección, USP únicamente; por lo tanto, la reconstitución y la extracción de un segundo vial en la jeringa requieren un segundo dispositivo BAXJECT II.
- Voltee el paquete. Presione hacia abajo para insertar completamente la espiga de plástico transparente a través del tapón del vial de diluyente (Figura B).
- Agarre el paquete BAXJECT II por el borde y tire del paquete del dispositivo (Figura C). No retire la tapa azul del dispositivo BAXJECT II. No toque la espiga de plástico blanco expuesta.
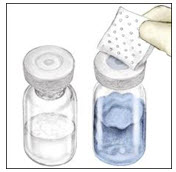
- Voltee el sistema para que el vial de diluyente quede en la parte superior. Inserte rápidamente la espiga de plástico blanco completamente en el tapón del vial de RIXUBIS empujando hacia abajo (Figura D). El vacío hará que el diluyente se introduzca en el vial de RIXUBIS.
- Agite suavemente hasta que el polvo se disuelva completamente. No refrigerar después de la reconstitución. Usar dentro de las 3 horas posteriores a la reconstitución.
2.5 Administración
Solo para infusión intravenosa en bolo.
- No se ha establecido la seguridad y eficacia de la administración de RIXUBIS mediante infusión continua.
- Inspeccione los productos farmacéuticos parenterales en busca de partículas y decoloración antes de la administración. La solución debe ser clara e incolora en apariencia. No use RIXUBIS si observa partículas o turbidez en la solución y notifique a Takeda Pharmaceuticals.
- Realice la administración del producto y la manipulación del equipo de administración y las agujas con precaución. La punción percutánea con una aguja contaminada con sangre puede transmitir virus infecciosos, incluidos el VIH (SIDA) y la hepatitis. Busque atención médica inmediata si se produce una lesión. Coloque las agujas en un contenedor para objetos punzantes después de un solo uso.
- Administre RIXUBIS a temperatura ambiente y dentro de las 3 horas posteriores a la reconstitución. Deseche cualquier producto no utilizado.
- Utilice una jeringa de plástico con este producto.
- Retire la tapa azul del dispositivo BAXJECT II. Conecte la jeringa al dispositivo BAXJECT II atornillándola en el sentido de las agujas del reloj hasta que la jeringa quede asegurada (Figura E). No apriete demasiado.
- No inyecte aire.
- Voltee el sistema (el vial de concentrado de factor ahora está en la parte superior). Extraiga el concentrado de factor en la jeringa tirando del émbolo lentamente (Figura F).
- Desconecte la jeringa desenroscándola en sentido contrario a las agujas del reloj; conecte una aguja adecuada a la jeringa e inyecte por vía intravenosa mediante infusión en bolo. Si un paciente va a recibir más de un vial de RIXUBIS, el contenido de varios viales se puede extraer en la misma jeringa.
- Velocidad de infusión máxima de 10 mL/min.
Figura A |
Figura B |
Figura C |
|
Figura D |
Figura E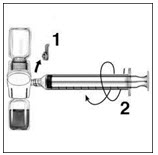 |
Figura F |
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
RIXUBIS es un polvo liofilizado blanco o casi blanco en viales de dosis única que contienen nominalmente 250, 500, 1000, 2000 o 3000 unidades internacionales.
4 CONTRAINDICACIONES
RIXUBIS está contraindicado en pacientes que tienen:
- Hipersensibilidad conocida a RIXUBIS o sus excipientes, incluida la proteína de hámster
- Coagulación intravascular diseminada (CID) [ver Advertencias y precauciones (5.4)]
- Signos de fibrinólisis [ver Advertencias y precauciones (5.4)]
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de hipersensibilidad
Se han notificado reacciones de hipersensibilidad con RIXUBIS. Es posible que se produzcan anafilaxia y otras reacciones de hipersensibilidad. El riesgo es mayor durante las primeras fases de la exposición inicial en pacientes no tratados previamente (PUP), en particular en pacientes con mutaciones genéticas de alto riesgo. Los primeros signos de reacciones alérgicas, que pueden progresar a anafilaxia, incluyen angioedema, opresión en el pecho, hipotensión, letargo, náuseas, vómitos, parestesia, inquietud, sibilancias y disnea. Interrumpa inmediatamente la administración e inicie el tratamiento adecuado si se producen reacciones de tipo alérgico o anafiláctico. En caso de reacciones alérgicas graves, deben considerarse medidas hemostáticas alternativas.
Se han notificado casos en la bibliografía que muestran una asociación entre la aparición de un inhibidor del factor IX y las reacciones alérgicas. Evalúe a los pacientes que experimenten reacciones alérgicas para detectar la presencia de un inhibidor.
RIXUBIS contiene trazas de proteínas de ovario de hámster chino (CHO). Los pacientes tratados con este producto pueden desarrollar hipersensibilidad a estas proteínas de mamíferos no humanos.
5.2 Inhibidores
Evalúe a los pacientes con regularidad para detectar el desarrollo de inhibidores del factor IX mediante las observaciones clínicas y las pruebas de laboratorio adecuadas. Realice un ensayo que mida la concentración del inhibidor del factor IX si no se alcanzan los niveles plasmáticos de actividad del factor IX esperados o si la hemorragia no se controla con la dosis esperada. Contacte con un centro especializado en el tratamiento de la hemofilia si un paciente desarrolla un inhibidor.
Los pacientes con inhibidores del factor IX tienen un mayor riesgo de sufrir reacciones de hipersensibilidad graves o anafilaxia si se vuelven a exponer a RIXUBIS. Es posible que RIXUBIS no sea eficaz en pacientes con inhibidores del factor IX de alto título y deben considerarse otras opciones terapéuticas.
5.3 Síndrome nefrótico
Se ha notificado síndrome nefrótico tras el intento de inducción de tolerancia inmunitaria en pacientes con hemofilia B con inhibidores del factor IX. No se ha establecido la seguridad y eficacia del uso de RIXUBIS para la inducción de tolerancia inmunitaria.
5.4 Complicaciones tromboembólicas
El uso de productos que contienen factor IX se ha asociado con el desarrollo de complicaciones tromboembólicas (p. ej., embolia pulmonar, trombosis venosa y trombosis arterial). Debido al riesgo potencial de complicaciones tromboembólicas, controle a los pacientes para detectar signos tempranos de coagulopatía tromboembólica y consuntiva, cuando administre RIXUBIS a pacientes con enfermedad hepática, con signos de fibrinólisis, en el período peri y posoperatorio, o con riesgo de eventos tromboembólicos o CID. El beneficio del tratamiento con RIXUBIS debe sopesarse frente al riesgo de estas complicaciones en pacientes con CID o en aquellos con riesgo de CID o eventos tromboembólicos.
5.5 Pruebas de laboratorio de monitorización
- Controle los niveles plasmáticos de actividad del factor IX mediante el ensayo de coagulación de una sola fase para confirmar que se han alcanzado y mantenido niveles adecuados de factor IX [ver Dosificación y administración (2)].
- Controle el desarrollo de inhibidores si no se alcanzan los niveles plasmáticos de actividad del factor IX esperados o si la hemorragia no se controla con la dosis recomendada de RIXUBIS. Los ensayos utilizados para determinar si hay presencia de inhibidores del factor IX deben titularse en unidades Bethesda (UB).
6 REACCIONES ADVERSAS
Las reacciones adversas comunes observadas en >1% de los sujetos en los estudios clínicos fueron disgeusia, dolor en las extremidades y prueba de anticuerpos furina positiva.
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica clínica.
Durante el desarrollo clínico, en un ensayo combinado, 99 pacientes masculinos previamente tratados (PTPs; expuestos a un producto que contiene factor IX durante ≥150 días) recibieron al menos una infusión de RIXUBIS como parte del tratamiento a demanda de episodios de sangrado, manejo perioperatorio de procedimientos quirúrgicos, dentales u otros invasivos mayores y menores, profilaxis de rutina o evaluación farmacocinética de RIXUBIS. Once sujetos (11.1%) tenían <6 años de edad, 12 (12.1%) tenían de 6 a <12 años de edad, 3 (3%) eran adolescentes (de 12 a <16 años de edad) y 73 (73.7%) eran adultos (de 16 años de edad o más). Los sujetos recibieron un total de 14,018 infusiones con una mediana de 163 infusiones de RIXUBIS (rango de 8 a 327 infusiones), durante una mediana de 156 días de exposición (rango de 8 a 316 días).
Se informaron un total de 337 eventos adversos en 80 (80.8%) de los 99 sujetos. Las reacciones adversas que ocurrieron en >1% de los sujetos se muestran en la Tabla 3.
| Clase de órgano del sistema | Reacciones adversas (AR) | Número de ARs (N) |
Número de sujetos (N=99) n (%) |
Porcentaje por infusión (N=14,018) |
|---|---|---|---|---|
|
||||
| Trastornos del sistema nervioso | Disgeusia | 2 | 1 (1.01%) | 0.014% |
| Trastornos musculoesqueléticos y del tejido conjuntivo | Dolor en las extremidades | 1 | 1 (1.01%) | 0.007% |
| Investigaciones | Prueba de anticuerpos furina positiva * | 2 | 2 (2.02%) | 0.014% |
Inmunogenicidad
Los 99 sujetos fueron monitoreados para detectar anticuerpos inhibitorios y de unión al factor IX, y anticuerpos de unión a la proteína CHO y furina, en los siguientes puntos de tiempo: en la selección, a las 72 horas después de la primera infusión de RIXUBIS y el producto comercial de factor IX recombinante en la parte cruzada del ensayo farmacocinético, después de 5 y 13 semanas después de la primera exposición a RIXUBIS, y posteriormente cada 3 meses. Los anticuerpos contra la furina se probaron mediante un ensayo inmunoabsorbente ligado a enzimas (ELISA) interno. Un título de 1:20 o 1:40 se consideró indeterminado para el ensayo validado anterior, ya que estos títulos eran demasiado bajos para ser verificados por el ensayo confirmatorio.
Ningún sujeto desarrolló anticuerpos neutralizantes al factor IX. Se observaron anticuerpos de bajo título y no neutralizantes contra el factor IX en 21 (21.2%) sujetos en uno o más puntos de tiempo. Se encontró que tres de estos 21 sujetos tenían estos anticuerpos en la selección, antes de recibir RIXUBIS. Seis de los 21 sujetos eran pediátricos (2 sujetos en el grupo de edad <6 años, 4 sujetos en el grupo de edad de 6 a <12 años). No se observaron hallazgos adversos clínicos en ninguno de estos 21 sujetos.
Diecinueve sujetos (19.2%) tenían señales de anticuerpos contra la furina (especificidad indeterminada). Cinco de estos 19 sujetos expresaron señales de anticuerpos en la selección, antes del tratamiento con RIXUBIS. Un sujeto tuvo una señal de anticuerpos después del tratamiento con el producto comparador y antes del tratamiento con RIXUBIS. Dos sujetos adicionales tuvieron un título positivo de 1:80 que no estaba presente cuando se verificó en un punto de tiempo posterior y, por lo tanto, se consideró transitorio. Dos de los 19 sujetos eran pediátricos (grupo de edad de 6 a <12 años). Todos los aumentos del título de anticuerpos después del tratamiento en estos dos sujetos pediátricos fueron <2 pasos de dilución y, por lo tanto, se consideraron no relacionados con el tratamiento. No se observaron hallazgos adversos clínicos en ninguno de estos 19 sujetos.
En un ensayo de 500 voluntarios normales, utilizando el mismo ensayo que en el ensayo clínico, el 7% tuvo títulos de 1:20 o 1:40 y el 1.2% tuvo títulos más altos que van de 1:80 a 1:320. Se cree que estos anticuerpos son parte de una respuesta natural del sistema inmunitario. Hasta la fecha, estos anticuerpos no se han asociado con ningún hallazgo adverso clínico.
La detección de la formación de anticuerpos depende de la sensibilidad y especificidad del ensayo. Además, la incidencia observada de positividad de anticuerpos (incluidos los anticuerpos neutralizantes) en un ensayo puede verse influenciada por varios factores, incluida la metodología del ensayo, el manejo de las muestras, el momento de la recolección de las muestras, los medicamentos concomitantes y la enfermedad subyacente.
Trombogenicidad
No hubo evidencia clínica de complicaciones tromboembólicas en ninguno de los sujetos. Los valores fuera de rango para los marcadores de trombogenicidad (trombina-antitrombina III, fragmento de protrombina 1.2 y dímero D), determinados durante la parte farmacocinética del ensayo combinado, no revelaron ningún patrón indicativo de trombogenicidad clínicamente relevante con RIXUBIS o un producto comparador que contiene factor IX.
6.2 Experiencia postcomercialización
Las siguientes reacciones adversas se han identificado durante el uso posterior a la aprobación de RIXUBIS. Debido a que las siguientes reacciones se informan voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos del sistema inmunitario: Hipersensibilidad (incluidos síntomas como disnea, prurito)
Trastornos de la piel y del tejido subcutáneo: Urticaria, erupción cutánea
Las siguientes reacciones adversas de clase se han observado con otro factor IX recombinante: recuperación inadecuada del factor IX, desarrollo de inhibidores, anafilaxia, angioedema, hipotensión y trombosis.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgos
No hay datos sobre el uso de RIXUBIS en mujeres embarazadas para informar un riesgo asociado a los medicamentos. No se han realizado estudios de reproducción animal con RIXUBIS. Tampoco se sabe si RIXUBIS puede causar daño fetal cuando se administra a una mujer embarazada o si puede afectar la capacidad de reproducción.
En la población general de los EE. UU., el riesgo de fondo estimado de defectos de nacimiento mayores y abortos espontáneos en embarazos clínicamente reconocidos es del 2-4% y del 15-20%, respectivamente, independientemente de la exposición a medicamentos.
8.2 Lactancia
Resumen de Riesgos
No hay información sobre la presencia de RIXUBIS en la leche materna, el efecto en el lactante o los efectos sobre la producción de leche.
Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de RIXUBIS y cualquier posible efecto adverso en el niño amamantado por RIXUBIS o por la condición materna subyacente.
8.4 Uso pediátrico
La seguridad, la eficacia y la farmacocinética de RIXUBIS se han evaluado en 23 pacientes pediátricos previamente tratados. Doce (52.2%) tenían entre 6 y <12 años de edad y 11 sujetos (47.8%) tenían <6 años de edad. Los sujetos pediátricos previamente tratados de 6 a <12 años de edad habían sido tratados previamente con concentrados de factor IX de origen plasmático y/o recombinante durante un mínimo de 150 días de exposición (según los registros médicos del sujeto). Los sujetos <6 años de edad habían sido tratados previamente con concentrados de factor IX de origen plasmático y/o recombinante durante > 50 días de exposición (según los registros médicos del sujeto).
Se observó que la recuperación incremental fue un 22% menor en pacientes pediátricos (<12 años) y es necesario ajustar la dosis [ver Dosificación y administración (2) y Farmacología clínica (12.3)]. La recuperación incremental media (en [IU/dL]/[IU/kg]) en la evaluación farmacocinética inicial fue de 0.67 (± 0.16) en sujetos de ambos grupos de edad, con valores más bajos en el grupo de edad más joven (0.59 ± 0.13) y valores más altos en el grupo de edad mayor (0.73 ± 0.16). El aclaramiento fue mayor en el grupo de edad más joven, con un aclaramiento medio de 10.6 ± 1.7 mL/(kg.hr) (mediana: 10.5; rango: 8.1-14.4) en el grupo de edad <6 años en comparación con un aclaramiento medio de 8.7 ± 1.2 mL/(kg.hr) (mediana: 8.6; rango: 6.9-10.8) en el grupo de edad de 6 a <12 años.
En un ensayo multicéntrico prospectivo, abierto, no controlado con pacientes <12 años de edad, se administraron un total de 41 infusiones para el tratamiento de 26 episodios de sangrado (7 articulares, 19 musculares y de tejidos blandos). El sangrado se controló en todos los episodios. En 23 de 26 (88.5%) de los episodios, se logró la hemostasia con una o dos infusiones. La tasa anualizada media de episodios de sangrado (ABR) para niños <12 años de edad fue de 2.7 sangrados por paciente por año ± 3.14 con una mediana de 2 que van de 0 a 10.8. Ver Estudios clínicos (14) para pacientes de 12 a <16 años de edad. La ABR mediana durante la profilaxis fue comparable entre niños, adolescentes y adultos.
8.5 Uso geriátrico
Los estudios clínicos de RIXUBIS no incluyeron sujetos de 65 años o más. No se sabe si los pacientes de edad avanzada responden de manera diferente a los pacientes más jóvenes. La selección de la dosis para un paciente de edad avanzada debe ser individualizada [ver Dosificación y administración (2)].
11 DESCRIPCIÓN
RIXUBIS [Factor IX de Coagulación (Recombinante)] es una proteína purificada producida por tecnología de ADN recombinante. Su secuencia de aminoácidos es idéntica a la de la forma alélica Ala-148 del factor IX derivado del plasma, y sus características estructurales y funcionales son similares a las del factor IX derivado del plasma. RIXUBIS se produce mediante una línea celular CHO genéticamente modificada. No se añaden proteínas humanas o animales durante ninguna etapa de la fabricación o formulación de RIXUBIS. La línea celular CHO secreta factor IX recombinante en un medio de cultivo celular definido que no contiene hormonas, y el factor IX recombinante se purifica mediante un proceso de purificación cromatográfica que no requiere un paso de anticuerpo monoclonal. El proceso incluye pasos validados de inactivación/eliminación de virus, a saber, tratamiento con solvente/detergente y nanofiltración de 15 nm. RIXUBIS es predominantemente un solo componente mediante la evaluación de electroforesis en gel de poliacrilamida con dodecil sulfato de sodio. La actividad específica de RIXUBIS es ≥200 unidades internacionales por miligramo de proteína. La preactivación del factor IX, el porcentaje de Factor IXa/Factor IX medido mediante ensayos de actividad, es ≤0.03%. La potencia en unidades internacionales se determina utilizando un ensayo de coagulación de un solo paso basado en el tiempo de tromboplastina parcial activado (in vitro) (aPTT) calibrado con el Estándar Internacional de la Organización Mundial de la Salud (OMS) para el concentrado de Factor IX. Los resultados de la potencia del Factor IX pueden verse afectados por el tipo de reactivo aPTT y el estándar de referencia utilizados en el ensayo; se han observado diferencias de hasta el 40%.
RIXUBIS se formula como un polvo liofilizado estéril, no pirogénico, para reconstituirse con Agua Estéril para Inyección para administración intravenosa. No contiene conservantes y está disponible en viales de dosis única que contienen la cantidad etiquetada de actividad del factor IX, expresada en unidades internacionales. Cada vial contiene nominalmente 250, 500, 1000, 2000 o 3000 unidades internacionales de factor IX de coagulación recombinante. Después de la reconstitución del polvo liofilizado, todas las concentraciones de dosis producen una solución clara e incolora. Las concentraciones de excipientes se muestran en la Tabla 4:
| Excipiente | Concentración |
|---|---|
| L-histidina | 20 mM |
| Cloruro de sodio | 60 mM |
| Cloruro de calcio | 4 mM |
| Manitol | 110 mM |
| Sacarosa | 35 mM |
| Polisorbato 80 | 0.005% |
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Los pacientes con hemofilia B tienen deficiencia del factor IX de coagulación, el cual se requiere para una hemostasia efectiva. El tratamiento con RIXUBIS reemplaza temporalmente el factor IX de coagulación faltante.
12.2 Farmacodinamia
La administración de RIXUBIS aumenta los niveles plasmáticos del factor IX y puede corregir temporalmente el defecto de coagulación en estos pacientes al disminuir el TPTA.
12.3 Farmacocinética
Pacientes ≥12 años de edad
Se realizó un ensayo farmacocinético aleatorizado, ciego y controlado de RIXUBIS en sujetos sin hemorragia (≥15 años de edad). Los sujetos recibieron RIXUBIS como infusión intravenosa. La velocidad de infusión para la primera administración durante el ensayo no debía exceder los 4 ml/minuto con una velocidad de infusión máxima de 10 ml/minuto. El rango de dosis de RIXUBIS fue de 71.3 a 79.4 unidades internacionales/kg (dosis media = 74.7 unidades internacionales/kg). Se obtuvieron muestras de sangre para las mediciones de la actividad del factor IX hasta las 72 horas y se utilizó un análisis no compartimental para estimar los parámetros farmacocinéticos.
La evaluación farmacocinética se repitió para RIXUBIS en un ensayo prospectivo, abierto y no controlado con RIXUBIS en sujetos que participaron en el ensayo inicial y que luego recibieron RIXUBIS durante 26 ± 1 (media ± DE) semanas para la profilaxis de rutina y acumularon al menos 30 días de exposición a RIXUBIS. El rango de dosis de RIXUBIS en este ensayo farmacocinético repetido fue de 64.5 a 79.2 unidades internacionales/kg (dosis media = 74.6 unidades internacionales/kg). La Tabla 5 presenta los parámetros farmacocinéticos para todos los sujetos evaluables (análisis por protocolo).
| Parámetro | Primera dosis (N=25) |
Dosis repetida (N=23) |
|---|---|---|
|
||
| AUC0-inf (UI∙hrs/dL) * | ||
| Media (DE) | 1207 (242) | 1305 (300) |
| Mín; Máx | 850; 1710 | 838; 1864 |
| Recuperación incremental en Cmax (UI/dL:UI/kg) † | ||
| Media (DE) | 0.87 (0.22) | 0.95 (0.25) |
| Mín; Máx | 0.53; 1.35 | 0.52; 1.38 |
| Vida media (hrs) | ||
| Media (DE) | 26.7 (9.6) | 25.4 (6.9) |
| Mín; Máx | 15.8; 52.3 | 16.2; 42.2 |
| Cmax (UI/dL) | ||
| Media (DE) | 66.2 (15.8) | 72.7 (19.7) |
| Mín; Máx | 41.7; 100.3 | 38.5; 106.3 |
| Tiempo medio de residencia (hrs) | ||
| Media (DE) | 30.8 (7.3) | 29.9 (4.2) |
| Mín; Máx | 22.3; 47.8 | 21.3; 37.5 |
| VSS‡(mL/kg) | ||
| Media (DE) | 201.9 (77.4) | 178.6 (45.2) |
| Mín; Máx | 110.0; 394.0 | 112.0; 272.0 |
| Depuración [mL/(kg∙hr)] | ||
| Media (DE) | 6.4 (1.3) | 6.0 (1.5) |
| Mín; Máx | 4.3; 9.1 | 4.1; 9.5 |
Los datos de los PTP que se sometieron a pruebas de recuperación in vivo repetidas durante un máximo de 26 semanas demostraron que la recuperación incremental del factor IX fue constante a lo largo del tiempo (Tabla 6).
| Recuperación incremental 30 min después de la infusión (UI/dl:UI/kg) * | Día 1 (N=73) |
Semana 5 (N=71) |
Semana 13 (N=68) |
Semana 26 (N=55) |
Al finalizar/completar el ensayo† (N=23) |
|---|---|---|---|---|---|
| Media ± DE | 0.79 ± 0.20 | 0.83 ± 0.21 | 0.85 ± 0.25 | 0.89 ± 0.12 | 0.87 ± 0.20 |
| Mediana (rango) | 0.78 (0.26-1.35) | 0.79 (0.46-1.48) | 0.83 (0.14-1.47) | 0.88 (0.52-1.29) | 0.89 (0.52-1.32) |
PTP <12 años de edad
Veintitrés sujetos varones se sometieron a una evaluación farmacocinética de RIXUBIS como parte del ensayo pediátrico combinado (<6 años y 6 -<12 años). La media (± DE) y la mediana de la dosis fueron de 75.5 ± 3.0 y 75.3 unidades internacionales/kg, respectivamente, con un rango de 70.0 a 83.6 unidades internacionales/kg. Se utilizó un modelo mixto no lineal (FC poblacional) para estimar los parámetros farmacocinéticos a partir de las mediciones de la actividad del factor IX en muestras de sangre obtenidas hasta 60 horas después de la infusión. Los parámetros farmacocinéticos para todos los sujetos se presentan en la Tabla 7.
| Parámetro | ≥12 años* (N=25) |
6 – <12 años (N=12) |
<6 años (N=11) |
|---|---|---|---|
|
|||
| AUC0–inf (UI∙hr/dl) * | |||
| Media ± DE | 1185 ± 273 | 886 ± 134 | 724 ± 119 |
| Mediana (rango) | 1197 (783-1780) | 864 (730-1138) | 717 (488-947) |
| Semivida (h) | |||
| Media ± DE | 25.7 ± 1.5 | 23.2 ± 1.6 | 27.7 ± 2.7 |
| Mediana (rango) | 25.6 (22.8-29.0) | 22.6 (21.8-27.4) | 27.3 (24.0-32.2) |
| Tiempo medio de residencia (h) | |||
| Media ± DE | 30.2 ± 2.2 | 25.3 ± 1.8 | 30.6 ± 3.3 |
| Mediana (rango) | 30.3 (25.9-33.9) | 24.7 (23.7-30.3) | 30.1 (26.2-36.2) |
| VSSb (ml/kg) | |||
| Media ± DE | 201.5 ± 47.2 | 220.9 ± 31.7 | 322.5 ± 52.3 |
| Mediana (rango) | 190.2 (138-300) | 218.5 (169.9-270.1) | 315.7 (264.7-441.5) |
| Aclaramiento (ml/[kg∙h]) | |||
| Media ± DE | 6.7 ± 1.5 | 8.7 ± 1.2 | 10.6 ± 1.7 |
| Mediana (rango) | 6.43 (4.1-9.9) | 8.6 (6.9-10.8) | 10.5 (8.1-14.4) |
La recuperación incremental 30 minutos después de la infusión se determinó para todos los sujetos en el ensayo combinado durante la evaluación farmacocinética (día de exposición 1), en las visitas de las semanas 5, 13 y 26, y en el momento de la finalización o la interrupción del ensayo, si no coincidía con la visita de la semana 26. Los datos demuestran que la recuperación incremental es consistente a lo largo del tiempo en todos los grupos de edad pediátricos. (consulte las Tablas 8 y 9)
| Incremental recovery 30 min after infusion | PK (ED 1) (N=10) |
Semana 5 (N=11) |
Semana 13 (N=10) |
Semana 26 (N=10) |
|---|---|---|---|---|
|
||||
| (IU/dL÷IU/kg) * | ||||
| Media ± DE | 0.59 ± 0.13 | 0.63 ± 0.10 | 0.68 ± 0.12 | 0.65 ± 0.13 |
| Mediana (rango) | 0.59 (0.31-0.75) | 0.6 (0.49-0.80) | 0.66 (0.51-0.84) | 0.61 (0.51-0.84) |
| Incremental recovery 30 min after infusion | PK (ED 1) N=12) |
Semana 5 (N=12) |
Semana 13 (N=11) |
Semana 26 (N=11) |
|---|---|---|---|---|
|
||||
| (IU/dL÷IU/kg) * | ||||
| Media ± DE | 0.73 ± 0.16 | 0.73 ± 0.13 | 0.73 ± 0.14 | 0.8 ± 0.14 |
| Mediana (rango) | 0.71 (0.51 – 1.00) | 0.70 (0.48-0.92) | 0.70 (0.54-1.00) | 0.78 (0.56-1.01) |
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
No se han realizado estudios no clínicos para evaluar el potencial carcinogénico y mutagénico de RIXUBIS.
No se observaron efectos adversos en los órganos reproductivos mediante investigaciones patológicas macroscópicas y microscópicas en estudios de toxicidad de dosis repetidas. No se han realizado investigaciones sobre el deterioro de la fertilidad.
14 ESTUDIOS CLÍNICOS
Tratamiento a demanda de episodios de sangrado en PTPs ≥12 años de edad
Se trataron un total de 249 episodios de sangrado con RIXUBIS, de los cuales 115 sangrados se registraron para los sujetos tratados en profilaxis y 134 sangrados para aquellos con el régimen a demanda. Hubo 197 sangrados articulares y 52 sangrados no articulares (tejido blando, músculo, cavidad corporal y otros). De los 249 episodios de sangrado, 15 fueron mayores, 163 fueron moderados y 71 fueron menores (ver Tabla 1 para las definiciones de mayor, moderado y menor). El tratamiento se individualizó en función de la gravedad, la causa y el lugar del sangrado. La mayoría (211; 84,7%) se trataron con 1 a 2 infusiones. De estas, 153 (61,4%) se trataron con 1 infusión y 58 (23,3%) se trataron con 2 infusiones. No se informó de ningún no respondedor.
La eficacia hemostática en la resolución de un sangrado se calificó como excelente o buena en el 96% de todos los episodios de sangrado tratados. (Excelente se define como alivio completo del dolor y cese de los signos objetivos de sangrado después de una sola infusión; no se requiere una infusión adicional para el control del sangrado; Bueno se define como alivio definido del dolor y/o mejora en los signos de sangrado después de una sola infusión; posiblemente requiere más de una infusión para la resolución completa).
Tratamiento a demanda de episodios de sangrado en PTPs <12 años de edad
Se trataron un total de 26 episodios de sangrado con RIXUBIS, de los cuales 23 sangrados se debieron a lesiones, 2 espontáneos y 1 de origen desconocido; 19 sangrados fueron no articulares (tejido blando, músculo, cavidad corporal, intracraneal y otros) y 7 fueron sangrados articulares de los cuales 1 fue un sangrado en una articulación diana. De los 26 episodios de sangrado, 15 fueron menores, 9 moderados y 2 mayores (Menor: poco o ningún dolor; poco o ningún cambio en el rango de movimiento de la articulación afectada (si se trata de un evento de sangrado articular); restricción leve de la movilidad y la actividad; Moderado: dolor leve a moderado; cierta disminución en el rango de movimiento de la articulación afectada (si se trata de un evento de sangrado articular); disminución moderada de la movilidad y la actividad; Mayor/potencialmente mortal: dolor significativo; disminución sustancial en el rango de movimiento de la articulación afectada (si se trata de un evento de sangrado articular); incapacidad; potencialmente mortal). El tratamiento se individualizó en función de la gravedad, la causa y el lugar del sangrado. La mayoría (23; 88,5%) se trataron con 1 a 2 infusiones. De los episodios de sangrado tratados, 15 (57,7%) recibieron 1 infusión, 8 (30,8%) recibieron 2 infusiones y 3 (11,5%) se trataron con 3 infusiones. La eficacia hemostática en la resolución de un sangrado se calificó como excelente o buena en el 96,2% de todos los episodios de sangrado tratados.
Manejo perioperatorio
El análisis de eficacia de RIXUBIS en el manejo perioperatorio incluyó 14 cirugías realizadas en 14 PTPs de entre 19 y 54 años de edad que se sometieron a cirugías mayores o menores (ver Tabla 2 para las definiciones de mayor y menor), dentales u otros procedimientos quirúrgicos invasivos. Once procedimientos (incluidas 7 cirugías ortopédicas y 1 cirugía dental) fueron mayores, 3 procedimientos (incluidas 2 extracciones dentales) fueron menores.
Los sujetos que se sometieron a cirugías mayores también se sometieron a una evaluación farmacocinética. Todos los sujetos recibieron la dosis en función de su recuperación incremental individual más reciente. La dosis de carga inicial recomendada de RIXUBIS se utilizó para garantizar que durante la cirugía se mantuvieran los niveles de actividad del factor IX del 80-100% para las cirugías mayores y del 30-60% para las cirugías menores. RIXUBIS se administró mediante infusiones intravenosas en bolo. La hemostasia se mantuvo durante toda la duración del ensayo. Los siguientes son los procedimientos quirúrgicos y los resultados de la evaluación de la respuesta hemostática en varios puntos.
Catorce cirugías (11 mayores; 3 menores), incluidas en la evaluación intraoperatoria, tuvieron una calificación de ‘excelente’. Al alta del hospital, 11/14 cirugías (8 mayores) tuvieron una calificación de ‘excelente’ y 3/14 (3 mayores) tuvieron una calificación de ‘buena’.
La calificación de excelente, buena, regular y ninguna a las 72 horas posteriores a la cirugía se basó en la hemostasia lograda en comparación con la esperada en sujetos hemostáticamente normales.
Profilaxis de rutina y control del sangrado en PTPs ≥12 años de edad
La eficacia de RIXUBIS se ha evaluado en un ensayo multicéntrico, prospectivo, abierto y no controlado, en el que un total de 73 PTPs masculinos de entre 12 y 65 años de edad recibieron RIXUBIS ya sea para profilaxis de rutina o tratamiento a demanda. Además, hay un ensayo multicéntrico, prospectivo, abierto, no controlado y en curso en el que 14 PTPs se sometieron a cirugías menores o mayores recibiendo RIXUBIS para el manejo perioperatorio. Los PTPs se definieron como sujetos que estuvieron expuestos a un producto que contiene factor IX durante ≥150 días. Todos los sujetos tenían hemofilia B grave (nivel de factor IX <1%) o moderadamente grave (nivel de factor IX ≤2%). La mayoría de los sujetos (88%) tenían artropatía y/o articulaciones diana (66%) en la selección. Los sujetos con antecedentes de un inhibidor detectable del factor IX ≥0,6 BU, antecedentes de reacciones alérgicas graves tras la exposición a productos que contienen factor IX, evidencia de enfermedad hepática crónica grave (INR >1,4), función renal deteriorada, recuento de CD4 <200 células/mm3, o cualquier otro defecto hemostático distinto de la hemofilia B, fueron excluidos del ensayo.
De los 59 sujetos que recibieron RIXUBIS para profilaxis de rutina, 56 sujetos recibieron el producto durante un mínimo de 3 meses y se incluyeron en la evaluación de eficacia. El régimen profiláctico consistió en 40 a 60 unidades internacionales/kg de RIXUBIS dos veces por semana. Otros 14 sujetos recibieron RIXUBIS a demanda para el tratamiento de episodios de sangrado únicamente. Estos sujetos tenían que haber tenido al menos 12 episodios de sangrado documentados que requerían tratamiento en los 12 meses anteriores a la inscripción.
En el brazo a demanda, la duración media del tratamiento fue de 3,5 ± 1 meses (mediana de 3,4, que oscila entre 1,2 y 5,1 meses) y la tasa media anualizada de sangrado total (ABR fue de 33,9 ± 17,37 con una mediana de 27 que oscila entre 12,9 y 73,1).
En el brazo de profilaxis, la ABR media fue de 4,3 para todos los sangrados, 1,7 para los sangrados espontáneos y 2,9 para los sangrados articulares (Tabla 10).
| *El régimen profiláctico consistió en 40 a 60 unidades internacionales/kg de RIXUBIS dos veces por semana. | ||
| ABR total | ||
| Media ± DE | 4,3 ± 5,80 | |
| Mediana (rango) | 2,0 (0,0-23,4) | |
| * El régimen profiláctico consistió en 40 a 80 unidades internacionales/kg de RIXUBIS dos veces por semana. | |
| Tasa anualizada total de hemorragias (ABR) | |
| Media ± DE | 2,7 ± 3,14 |
| Mediana (rango) | 2,0 (0,0–10,8) |
| ABR para hemorragias articulares | |
| Media ± DE | 0,8 ± 1,76 |
| Mediana (rango) | 0,0 (0,0–7,2) |
| ABR para hemorragias espontáneas | |
| Media ± DE | 0,2 ± 0,66 |
| Mediana (rango) | 0,0 (0,0–2,0) |
| Sujetos con cero hemorragias | |
| % (n) | 39,1.% (9) |
15 REFERENCIAS
- Roberts HR, Eberst ME. Manejo actual de la hemofilia B. Hematol Oncol Clin North Am. 1993;7(6):1269-1280.
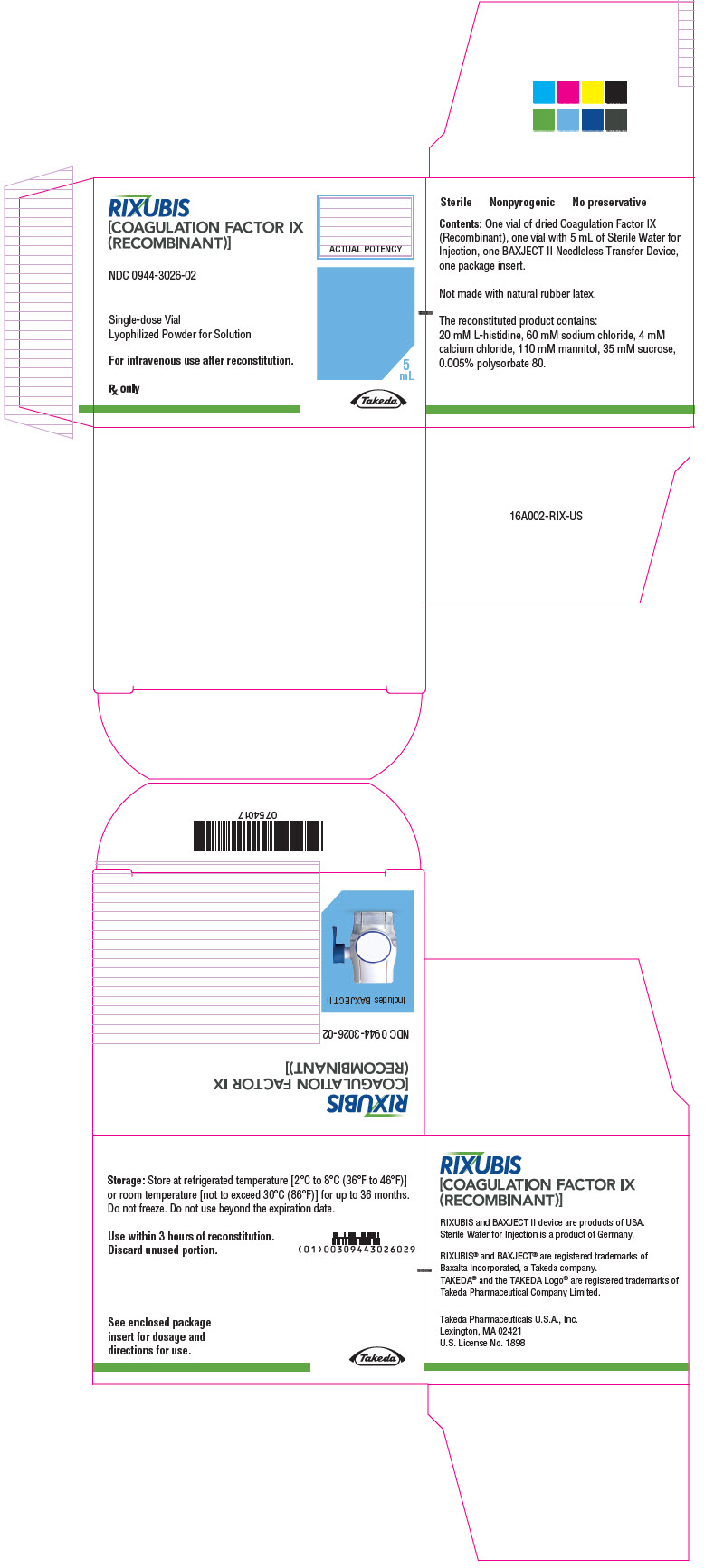
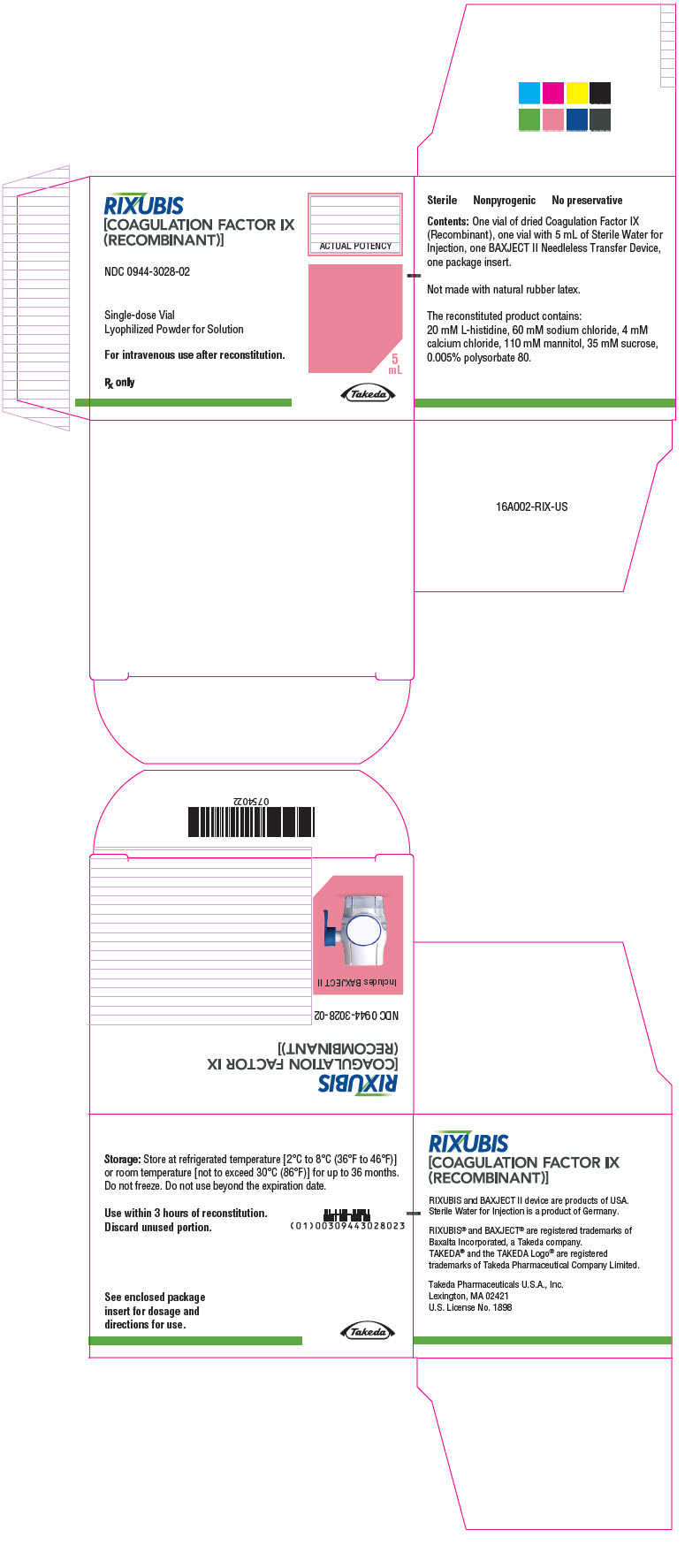
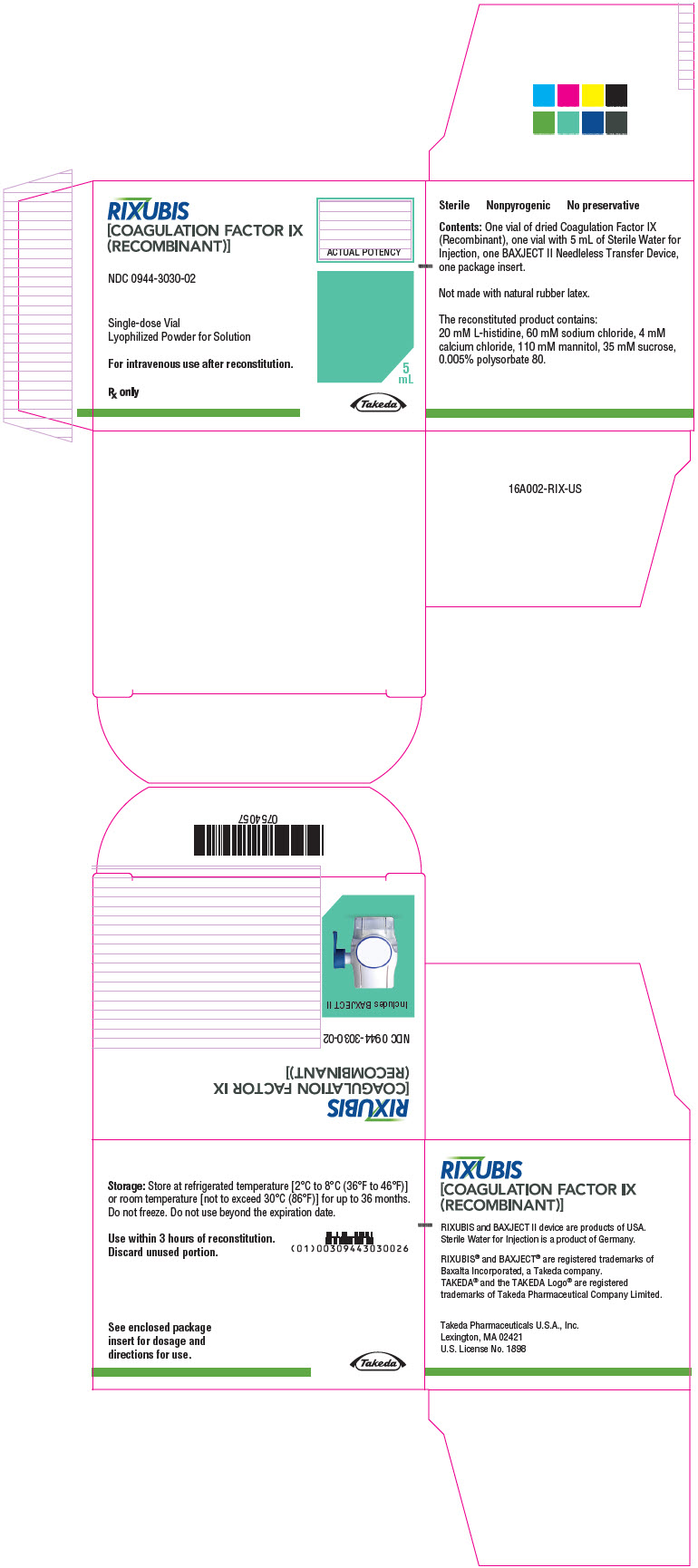
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Cómo se suministra
RIXUBIS está disponible en viales de dosis única con las siguientes concentraciones del producto:
| Código de color | Concentración nominal (unidades internacionales) | NDC del kit |
|---|---|---|
| Azul claro | 250 | 0944-3026-02 |
| Rosado | 500 | 0944-3028-02 |
| Verde | 1000 | 0944-3030-02 |
| Naranja | 2000 | 0944-3032-02 |
| Plata | 3000 | 0944-3034-02 |
La actividad real del factor IX en unidades internacionales se indica en la caja y la etiqueta del vial.
Cada kit también contiene 5 mL de Agua estéril para inyección y un dispositivo de transferencia BAXJECT II.
No fabricado con látex de caucho natural.
Almacenamiento y manipulación
- Almacenar a temperatura refrigerada [2°C a 8°C (36°F a 46°F)] o temperatura ambiente [no superior a 30°C (86°F)] durante hasta 36 meses. No congelar.
- No utilizar después de la fecha de vencimiento impresa en la caja o el vial.
17 INFORMACIÓN PARA EL PACIENTE
- Aconseje al paciente que lea el etiquetado para pacientes aprobado por la FDA (Información para el paciente e Instrucciones de uso).
- Aconseje a los pacientes que informen a su médico o proveedor de atención médica sobre cualquier reacción adversa o problema después de la administración de RIXUBIS.
- Informe a los pacientes sobre los primeros signos de reacciones de hipersensibilidad (incluidos urticaria, urticaria generalizada, opresión en el pecho, sibilancias e hipotensión) y anafilaxia. Indique a los pacientes que suspendan el uso del producto y se comuniquen con su médico si se presentan estos síntomas.
- Aconseje a los pacientes que se comuniquen con su médico o centro de tratamiento para recibir tratamiento adicional o una evaluación si experimentan una falta de respuesta clínica al tratamiento de reemplazo del factor IX, ya que en algunos casos esto puede ser una manifestación de un inhibidor.
- Pida a los pacientes que sigan los procedimientos específicos de preparación y administración proporcionados por su médico.
- Informe a los pacientes que sigan las recomendaciones del etiquetado para pacientes aprobado por la FDA.
SECCIÓN NO CLASIFICADA SPL
Takeda Pharmaceuticals U.S.A., Inc.
Lexington, MA 02421
U.S. License No. 1898
RIXUBIS® y BAXJECT® son marcas registradas de Baxalta Incorporated, una compañía de Takeda.
TAKEDA® y el Logotipo de TAKEDA® son marcas registradas de Takeda Pharmaceutical Company Limited.
INFORMACIÓN PARA EL PACIENTE
RIXUBIS
[Factor IX de Coagulación (Recombinante)]
Este folleto resume información importante sobre RIXUBIS. Léalo cuidadosamente antes de usar este medicamento. Esta información no reemplaza la conversación con su proveedor de atención médica y no incluye toda la información importante sobre RIXUBIS. Si tiene alguna pregunta después de leer esto, consulte a su proveedor de atención médica.
¿Qué es RIXUBIS?
RIXUBIS es un medicamento que se usa para reemplazar el factor de coagulación (Factor IX) que falta en personas con hemofilia B. La hemofilia B también se llama deficiencia congénita de factor IX o enfermedad de Christmas. La hemofilia B es un trastorno hemorrágico hereditario que evita que la sangre coagule normalmente. RIXUBIS se usa para prevenir y controlar el sangrado en personas con hemofilia B. Su proveedor de atención médica puede administrarle RIXUBIS cuando se someta a una cirugía. RIXUBIS puede reducir la cantidad de episodios de sangrado cuando se usa regularmente (profilaxis).
¿Quién no debe usar RIXUBIS?
No debe usar RIXUBIS si usted
- es alérgico a los hámsters
- es alérgico a cualquier ingrediente de RIXUBIS.
Informe a su proveedor de atención médica si está embarazada o amamantando porque RIXUBIS puede no ser adecuado para usted.
¿Qué debo decirle a mi proveedor de atención médica antes de usar RIXUBIS?
Debe informar a su proveedor de atención médica si usted
- tiene o ha tenido algún problema médico
- toma algún medicamento, incluidos medicamentos recetados y de venta libre, como medicamentos de venta libre, suplementos o remedios herbales
- tiene alguna alergia, incluidas alergias a los hámsters
- está amamantando. No se sabe si RIXUBIS pasa a la leche materna y si puede dañar a su bebé
- está embarazada o planea quedar embarazada. No se sabe si RIXUBIS puede dañar a su bebé por nacer
- le han dicho que tiene inhibidores del factor IX (porque RIXUBIS puede no funcionar para usted).
¿Cómo debo infundir RIXUBIS?
RIXUBIS se administra directamente en el torrente sanguíneo. RIXUBIS debe administrarse según lo ordenado por su proveedor de atención médica. Su proveedor de atención médica o el centro de tratamiento de la hemofilia deben capacitarlo sobre cómo realizar las infusiones. Muchas personas con hemofilia B aprenden a infundirse su RIXUBIS por sí mismas o con la ayuda de un familiar.
Su proveedor de atención médica le dirá cuánta RIXUBIS debe usar en función de su peso, la gravedad de su hemofilia B y dónde está sangrando. Es posible que deba hacerse análisis de sangre después de recibir RIXUBIS para asegurarse de que su nivel sanguíneo de factor IX sea lo suficientemente alto como para coagular su sangre. Llame a su proveedor de atención médica de inmediato si su sangrado no se detiene después de tomar RIXUBIS.
¿Cuáles son los posibles efectos secundarios de RIXUBIS?
Pueden ocurrir reacciones alérgicas con RIXUBIS. Llame a su proveedor de atención médica o busque atención de emergencia de inmediato si tiene erupción o urticaria, picazón, opresión en la garganta, dolor u opresión en el pecho, dificultad para respirar, mareos, aturdimiento, náuseas o desmayo. Algunos efectos secundarios comunes de RIXUBIS fueron sabor inusual en la boca y dolor en las extremidades. Informe a su proveedor de atención médica sobre cualquier efecto secundario que le moleste o que no desaparezca. Estos no son todos los efectos secundarios posibles con RIXUBIS. Puede pedirle a su proveedor de atención médica información que esté escrita para profesionales de la salud.
Su cuerpo puede formar inhibidores del factor IX. Un inhibidor es parte del sistema de defensa del cuerpo. Si forma inhibidores, puede evitar que RIXUBIS funcione correctamente. Consulte con su proveedor de atención médica para asegurarse de que lo monitoreen cuidadosamente con análisis de sangre para detectar el desarrollo de inhibidores del factor IX.
¿Cuáles son las concentraciones de dosis de RIXUBIS?
RIXUBIS viene en cinco concentraciones de dosis diferentes: 250, 500, 1000, 2000 y 3000 unidades internacionales. La concentración real estará impresa en la etiqueta y en la caja. Las cinco concentraciones diferentes están codificadas por colores, de la siguiente manera:
 |
Concentración de dosis de aproximadamente 250 unidades internacionales por vial |
 |
Concentración de dosis de aproximadamente 500 unidades internacionales por vial |
 |
Concentración de dosis de aproximadamente 1000 unidades internacionales por vial |
 |
Concentración de dosis de aproximadamente 2000 unidades internacionales por vial |
 |
Concentración de dosis de aproximadamente 3000 unidades internacionales por vial |
Siempre verifique la concentración de dosis real impresa en la etiqueta para asegurarse de que está usando la concentración prescrita por su proveedor de atención médica.
¿Cómo debo almacenar RIXUBIS?
- Almacenar a temperatura refrigerada [2 ° C a 8 ° C (36 ° F a 46 ° F)] o temperatura ambiente [no superior a 30 ° C (86 ° F)] durante un máximo de 36 meses. No congelar.
- No usar después de la fecha de vencimiento impresa en la caja o el vial.
- El producto reconstituido (después de mezclar el producto seco con el diluyente húmedo) debe usarse dentro de las 3 horas y no se puede almacenar ni refrigerar. Deseche cualquier RIXUBIS que quede en el vial al final de su infusión.
¿Qué más debo saber sobre RIXUBIS?
Los medicamentos a veces se recetan para fines distintos de los que se enumeran aquí. No use RIXUBIS para una condición para la que no esté prescrito. No comparta RIXUBIS con otras personas, incluso si tienen los mismos síntomas que usted.
Recursos disponibles para los pacientes
Para obtener información sobre los programas de asistencia al paciente que están disponibles para usted, comuníquese con el 1-888-229-8379.
Takeda Pharmaceuticals U.S.A., Inc.
Lexington, MA 02421
Licencia de EE. UU. No. 1898
RIXUBIS® y BAXJECT® son marcas comerciales registradas de Baxalta Incorporated, una empresa de Takeda.
TAKEDA® y el logotipo de TAKEDA® son marcas comerciales registradas de Takeda Pharmaceutical Company Limited.
INSTRUCCIONES DE USO
RIXUBIS
[Factor IX de Coagulación (Recombinante)]
Sólo para uso intravenoso
No intente autoinfundirse a menos que haya sido instruido por su proveedor de atención médica o centro de hemofilia.
Siempre siga las instrucciones específicas que le dé su proveedor de atención médica. Los pasos que se enumeran a continuación son pautas generales para el uso de RIXUBIS. Si no está seguro de los procedimientos, llame a su proveedor de atención médica antes de usar RIXUBIS. Llame a su proveedor de atención médica de inmediato si el sangrado no se controla después de usar RIXUBIS. Su proveedor de atención médica le recetará la dosis que debe tomar. Es posible que su proveedor de atención médica deba realizarle análisis de sangre de vez en cuando. Hable con su proveedor de atención médica antes de viajar. Planifique llevar suficiente RIXUBIS para su tratamiento durante este tiempo. Deseche todos los materiales, incluido cualquier producto RIXUBIS reconstituido sobrante, en un contenedor adecuado.
- Prepare una superficie plana limpia y reúna todos los materiales que necesitará para la infusión. Compruebe la fecha de caducidad y deje que el vial con el concentrado de RIXUBIS y el Agua Estéril para Inyección, USP (diluyente) se calienten a temperatura ambiente. Lávese las manos y póngase guantes de examen limpios. Si se autoinfunde en casa, el uso de guantes es opcional.
- Retire las tapas de los viales de concentrado de RIXUBIS y diluyente para exponer los centros de los tapones de goma.
- Desinfecte los tapones con una torunda de alcohol (u otra solución adecuada sugerida por su proveedor de atención médica o centro de hemofilia) frotando los tapones firmemente durante varios segundos y déjelos secar antes de usar. Coloque los viales sobre una superficie plana.
- Abra el paquete del dispositivo BAXJECT II despegando la tapa, sin tocar el interior del paquete. No retire el dispositivo BAXJECT II del paquete.
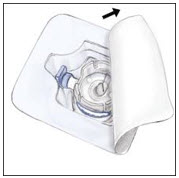
- Gire el paquete con el dispositivo BAXJECT II boca abajo y colóquelo sobre la parte superior del vial de diluyente. Inserte completamente la espiga de plástico transparente del dispositivo en el centro del tapón del vial de diluyente empujando hacia abajo. Agarre el paquete por el borde y levántelo del dispositivo. Tenga cuidado de no tocar la espiga de plástico blanco. No retire la tapa azul del dispositivo BAXJECT II. El vial de diluyente ahora tiene el dispositivo BAXJECT II conectado a él y está listo para conectarse al vial de RIXUBIS.

- Para conectar el vial de diluyente al vial de RIXUBIS, dé la vuelta al vial de diluyente y colóquelo sobre el vial que contiene el concentrado de RIXUBIS. Inserte completamente la espiga de plástico blanco en el tapón del vial de RIXUBIS empujando hacia abajo. El diluyente fluirá hacia el vial de RIXUBIS. Esto debe hacerse de inmediato para mantener el líquido libre de gérmenes.

- Gire suavemente y continuamente los viales conectados hasta que el polvo se disuelva completamente. No agite. La solución de RIXUBIS debe tener un aspecto claro e incoloro. Si no es así, no la use y notifique a Takeda Pharmaceuticals inmediatamente.

- Retire la tapa azul del dispositivo BAXJECT II y conecte la jeringa atornillándola en el sentido de las agujas del reloj hasta que la jeringa quede asegurada. No la apriete demasiado. Tenga cuidado de no inyectar aire.
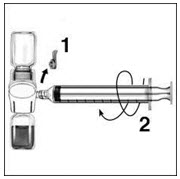
- Dé la vuelta a los viales conectados de modo que el vial de RIXUBIS quede en la parte superior. Extraiga la solución de RIXUBIS en la jeringa tirando lentamente del émbolo. Desconecte la jeringa del BAXJECT II desenroscándola en sentido contrario a las agujas del reloj.

- Si utiliza más de un vial de RIXUBIS, el contenido de más de un vial puede extraerse en la misma jeringa. Asegúrese de mezclar cada vial de RIXUBIS con el Agua Estéril para Inyección, USP que se proporciona en la caja (siguiendo los pasos 1-9). Necesitará un dispositivo BAXJECT II separado para mezclar cada vial adicional de RIXUBIS.
- Conecte la aguja de infusión a la jeringa utilizando un equipo de infusión con alas (mariposa), si está disponible. Apunte la aguja hacia arriba y elimine las burbujas de aire golpeando suavemente la jeringa con el dedo y empujando lenta y cuidadosamente el aire fuera de la jeringa y la aguja.
- Aplique un torniquete y prepare el sitio de infusión limpiando bien la piel con una torunda de alcohol (u otra solución adecuada sugerida por su proveedor de atención médica o centro de hemofilia).
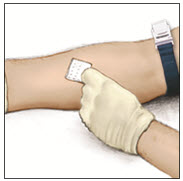
- Inserte la aguja en la vena y retire el torniquete. Infunda lentamente el RIXUBIS. No infunda a una velocidad superior a 10 mL por minuto.
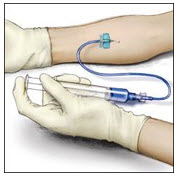
- Retire la aguja de la vena y utilice una gasa estéril para presionar el sitio de infusión durante varios minutos. No vuelva a tapar la aguja. Colóquela con la jeringa usada en un contenedor de objetos punzantes de pared dura para su eliminación adecuada.
- Deseche los viales usados y el sistema BAXJECT II en su contenedor de objetos punzantes de pared dura sin desmontarlos. No deseche estos suministros en la basura doméstica.
- Retire la etiqueta despegable del vial de RIXUBIS y colóquela en su libro de registro. Limpie cualquier derrame de sangre con una mezcla recién preparada de 1 parte de lejía y 9 partes de agua, jabón y agua, o cualquier solución desinfectante doméstica.
Importante: Póngase en contacto con su proveedor de atención médica o el centro local de tratamiento de la hemofilia si experimenta algún problema.
Takeda Pharmaceuticals U.S.A., Inc.
Lexington, MA 02421
U.S. License No. 1898
RIXUBIS® y BAXJECT® son marcas comerciales registradas de Baxalta Incorporated, una empresa de Takeda.
TAKEDA® y el logotipo de TAKEDA® son marcas comerciales registradas de Takeda Pharmaceutical Company Limited.
Edición 3/2023
Panel de visualización principal – Caja del kit de cartón – NDC 0944-3026-02
RIXUBIS
[FACTOR IX DE LA COAGULACIÓN
(RECOMBINANTE)]
NDC 0944-3026-02
Vial de dosis única
Pólvo liofilizado para solución
Para uso intravenoso después de la reconstitución.
Sólo receta médica
POTENCIA REAL
5
mL
Takeda
Panel principal de visualización – Etiqueta de vial de 5 mL – NDC 0944-3025-01
NDC 0944-3025-01
RIXUBIS
[FACTOR IX DE COAGULACIÓN
(RECOMBINANTE)]
Rx Sólo
Para Uso Intravenous Sólo.
Indicaciones de Uso: Ver inserto del paquete.
No fabricado con látex de caucho natural.
Takeda Pharmaceuticals U.S.A., Inc.
Lexington, MA 02421
N.º de licencia de EE.UU. 1898
Panel de visualización principal – Kit de cartón – NDC 0944-3028-02
RIXUBIS
[FACTOR IX DE COAGULACIÓN
(RECOMBINANTE)]
NDC 0944-3028-02
Vial de dosis única
Pólvo liofilizado para solución
Para uso intravenoso después de la reconstitución.
Receta médica solamente
POTENCIA REAL
5
mL
Takeda
Panel de visualización principal – Etiqueta del frasco de 5 mL – NDC 0944-3027-01
NDC 0944-3027-01
RIXUBIS
[FACTORE DE COAGULACIÓN IX
(RECOMBINANTE)]
Rx solo
Para uso intravenoso solamente.
Instrucciones de uso: Ver inserto del empaque.
No elaborado con látex natural de caucho.
Takeda Pharmaceuticals U.S.A., Inc.
Lexington, MA 02421
N.º de licencia de EE. UU. 1898

Panel principal de visualización – Kit de cartón – NDC 0944-3030-02
RIXUBIS
[FACTORES DE COAGULACIÓN IX
(RECOMBINANTE)]
NDC 0944-3030-02
Envase unidosis
Polvo liofilizado para solución
Para uso intravenoso tras la reconstitución.
Sólo con receta médica
5
mL
Takeda
PANEL DE EXPOSICIÓN PRINCIPAL – Etiqueta de frasco de 5 mL – NDC 0944-3029-01
NDC 0944-3029-01
RIXUBIS
[FACTORES DE COAGULACIÓN IX
(RECOMBINANTES)]
Sólo con receta médica
Para uso intravenoso solamente.
Instrucciones de uso: Ver inserto del paquete.
No fabricado con látex de caucho natural.
Takeda Pharmaceuticals U.S.A., Inc.
Lexington, MA 02421
No. de licencia de Estados Unidos 1898
PANEL DE MONITOR PRINCIPAL – Kit de cartón – NDC 0944-3032-02
RIXUBIS
[FACTOR IX DE COAGULACIÓN
(RECOMBINANTE)]
NDC 0944-3032-02
Frasco para dosis única
Pólder liofilizado para solución
Para uso intravenoso después de la reconstitución.
Receta médica solamente
5
mL
Takeda
PANEL DE DESPLIEGUE PRINCIPAL – Etiqueta de frasco de 5 mL – NDC 0944-3031-01
NDC 0944-3031-01
RIXUBIS
[FACTOR IX DE COAGULACIÓN
(RECOMBINANTE)]
Receta médica solamente
Sólo para uso intravenoso.
Instrucciones de uso: Consulte el prospecto del paquete.
No fabricado con látex de caucho natural.
Takeda Pharmaceuticals EE. UU., Inc.
Lexington, MA 02421
N.º de licencia de EE. UU. 1898

PANEL PRINCIPAL DE EXHIBICIÓN – Kit de Cartón – NDC 0944-3034-02
RIXUBIS
[FACTORE DE COAGULACIÓN IX
(RECOMBINANTE)]
NDC 0944-3034-02
Vial de dosis única
Pólvo liofilizado para solución
Para uso intravenoso después de la reconstitución.
Sólo bajo receta
5
mL
Takeda
Panel de visualización principal – Etiqueta de frasco de 5 mL – NDC 0944-3033-01
NDC 0944-3033-01
RIXUBIS
[FACTOR IX DE COAGULACIÓN
(RECOMBINANTE)]
Sólo con receta
Para uso intravenoso únicamente.
Indicaciones de uso: Consulte el prospecto del paquete.
No fabricado con látex de caucho natural.
Takeda Pharmaceuticals U.S.A., Inc.
Lexington, MA 02421
N.º de licencia estadounidense 1898
PANEL DE DESPLIEGUE PRINCIPAL – Etiqueta del Frasco de 5 mL – NDC 64764-515-50
5 mL
NDC 64764-515-50
Takeda
Agua estéril inyectable, USP
para la reconstitución del producto adjunto
No utilizar a menos que esté claro. No se ha añadido ningún agente antimicrobiano u otra sustancia
No utilizar para inyección intravascular sin hacer aproximadamente isotónica mediante la adición de un soluto adecuado.
Descartar la porción no utilizada.
Solo con receta
0754013
Envase de dosis única
No pirogénico


