Fabricante de medicamentos: Wyeth BioPharma Division of Wyeth Pharmaceuticals LLC (Updated: 2023-03-01)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
BeneFIX® [factor IX de coagulación (recombinante)]
polvo liofilizado para solución, para uso intravenoso
Aprobación inicial en EE. UU.: 1997
INDICACIONES Y USO
BeneFIX es un factor IX de coagulación sanguínea humano recombinante indicado para adultos y niños con hemofilia B (deficiencia congénita del factor IX o enfermedad de Christmas) para:
- o
- Tratamiento a demanda y control de episodios de sangrado. (1)
- o
- Manejo perioperatorio del sangrado. (1)
- o
- Profilaxis de rutina para reducir la frecuencia de episodios de sangrado. (1)
Limitaciones de uso
BeneFIX no está indicado para la inducción de tolerancia inmunitaria en pacientes con hemofilia B. (1)
DOSIFICACIÓN Y ADMINISTRACIÓN
Solo para uso intravenoso después de la reconstitución.
- •
- Una unidad internacional (UI) de BeneFIX por kilogramo de peso corporal aumentó la actividad circulante del factor IX de la siguiente manera:
- •
- Determine la dosis inicial estimada utilizando la siguiente fórmula:
|
Unidades requeridas = |
peso corporal (kg) × aumento deseado del factor IX (UI/dL o % de lo normal) × recíproco de la recuperación observada (UI/kg por UI/dL). (2.1) |
- •
- La dosis y la duración del tratamiento con BeneFIX dependen de la gravedad de la deficiencia del factor IX, la ubicación y la extensión del sangrado, y la condición clínica del paciente, la edad y la recuperación del factor IX. (2)
- •
- Profilaxis de rutina:
Para la profilaxis a largo plazo contra el sangrado, el régimen recomendado es de 100 UI/kg una vez por semana. Ajuste el régimen de dosificación (dosis o frecuencia) en función de la respuesta clínica del paciente. (2.1)
FORMAS Y FUERZAS DE DOSIFICACIÓN
BeneFIX está disponible como polvo liofilizado en viales de un solo uso que contienen nominalmente 250, 500, 1000, 2000 o 3000 UI. (3)
CONTRAINDICACIONES
No lo use en pacientes que hayan manifestado reacciones de hipersensibilidad inmediata potencialmente mortales, incluida la anafilaxia, al producto o sus componentes, incluida la proteína de hámster. (4)
ADVERTENCIAS Y PRECAUCIONES
- •
- Las reacciones de hipersensibilidad, incluida la anafilaxia, son posibles. Si ocurren síntomas, suspenda el tratamiento con el producto y busque atención médica de emergencia. Los pacientes pueden desarrollar hipersensibilidad a la proteína de hámster (CHO) ya que BeneFIX contiene cantidades traza. (5.1)
- •
- BeneFIX se ha asociado con el desarrollo de complicaciones tromboembólicas, incluso en pacientes que reciben infusión continua a través de un catéter venoso central. (5.2)
- •
- Se ha informado síndrome nefrótico después de la inducción de tolerancia inmunitaria con productos del factor IX en pacientes con hemofilia B con inhibidores del factor IX y antecedentes de reacciones alérgicas al factor IX. (5.3)
- •
- Puede ocurrir el desarrollo de anticuerpos neutralizantes (inhibidores) a BeneFIX. Si no se alcanzan los niveles esperados de actividad del factor IX en plasma, o si el paciente presenta una reacción alérgica, o si el sangrado no se controla con una dosis esperada, realice un ensayo que mida la concentración del inhibidor del factor IX. (5.4)
REACCIONES ADVERSAS
Las reacciones adversas más comunes (incidencia >5%) de los ensayos clínicos fueron fiebre, tos, náuseas, reacción en el sitio de inyección, dolor en el sitio de inyección, dolor de cabeza, mareos y erupción cutánea. (6)
Para informar sobre REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Wyeth Pharmaceuticals LLC al 1-800-934-5556 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
USO EN POBLACIONES ESPECÍFICAS
Uso pediátrico: Se ha observado una menor recuperación, una vida media más corta y una mayor depuración (en función del peso corporal en kg) en niños (<12 años). Puede ser necesario ajustar la dosis. (8.4, 12.3)
Consulte 17 para obtener INFORMACIÓN PARA EL PACIENTE y el etiquetado del paciente aprobado por la FDA.
Revisado: 11/2022
Tabla de Contenido
FULL PRESCRIBING INFORMATION: CONTENTS*
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis
2.2 Preparación y Reconstitución
2.3 Administración
3 FORMAS FARMACÉUTICAS Y CONCENTRACIONES
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de Hipersensibilidad
5.2 Complicaciones Tromboembólicas
5.3 Síndrome Nefrótico
5.4 Anticuerpos Neutralizantes (Inhibidores)
5.5 Monitoreo de Pruebas de Laboratorio
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Postcomercialización
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14 ESTUDIOS CLÍNICOS
15 REFERENCIAS
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANIPULACIÓN
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información de prescripción completa no se enumeran.
1 INDICACIONES Y USO
BeneFIX®, Factor IX de Coagulación (Recombinante), es un factor de coagulación sanguínea humano indicado en adultos y niños con hemofilia B (deficiencia congénita del factor IX o enfermedad de Christmas) para:
- o
- Tratamiento a demanda y control de episodios de sangrado
- o
- Manejo perioperatorio del sangrado
- o
- Profilaxis de rutina para reducir la frecuencia de episodios de sangrado
Limitación de Uso
BeneFIX no está indicado para la inducción de tolerancia inmunitaria en pacientes con hemofilia B [ver Advertencias y Precauciones (5.3)].
2 DOSIS Y ADMINISTRACIÓN
Para uso intravenoso después de la reconstitución únicamente.
- •
- Cada vial de BeneFIX tiene la potencia del Factor IX recombinante (rFIX) en las Unidades Internacionales (UI) indicadas en el vial.
- •
- Inicie el tratamiento bajo la supervisión de un médico con experiencia en el tratamiento de la hemofilia B.
- •
- La dosis y la duración del tratamiento con BeneFIX dependen de la gravedad de la deficiencia de factor IX, la ubicación y la extensión del sangrado, y la condición clínica del paciente, la edad y la recuperación del factor IX.
- •
- La dosificación de BeneFIX puede diferir de la de los productos de factor IX derivados del plasma [ver Farmacología clínica (12)]. Los sujetos en el extremo inferior de la recuperación observada del factor IX pueden requerir un ajuste ascendente de la dosis de BeneFIX hasta dos veces (2X) la dosis inicial calculada empíricamente para lograr el aumento deseado en la actividad circulante del factor IX.
- •
- Controle a los pacientes utilizando un ensayo de actividad del factor IX para asegurar que se ha logrado el nivel deseado de actividad del factor IX. Titule la dosis utilizando la actividad del factor IX, los parámetros farmacocinéticos, como la vida media y la recuperación, y teniendo en cuenta la situación clínica para ajustar la dosis según sea apropiado.
2.1 Dosis
Cálculo de la dosis inicial
Utilice la siguiente fórmula para calcular la dosis inicial de BeneFIX:
|
número de UI de factor IX requeridas (UI) |
= |
peso corporal (kg) |
× |
aumento deseado del factor IX (% de lo normal o UI/dL) |
× |
recíproco de la recuperación observada (UI/kg por UI/dL) |
Recuperación promedio
Adolescentes/Adultos (≥12 años)
En adultos, en promedio, una Unidad Internacional (UI) de BeneFIX por kilogramo de peso corporal aumentó la actividad circulante del factor IX en 0,8 ± 0,2 UI/dL (rango de 0,4 a 1,2 UI/dL). Utilice la siguiente fórmula para estimar la dosis con un aumento promedio de 0,8 UI/dL del factor IX por UI/kg de peso corporal administrado:
|
número de UI de factor IX requeridas (UI) |
= |
peso corporal (kg) |
× |
aumento deseado del factor IX (% de lo normal o UI/dL) |
× |
1,3 (UI/kg por UI/dL) |
Niños (<12 años)
En niños, en promedio, una unidad internacional de BeneFIX por kilogramo de peso corporal aumentó la actividad circulante del factor IX en 0,7 ± 0,3 UI/dL (rango de 0,2 a 2,1 UI/dL; mediana de 0,6 UI/dL por UI/kg). Utilice la siguiente fórmula para estimar la dosis con un aumento promedio de 0,7 UI/dL del factor IX por UI/kg de peso corporal administrado:
|
número de UI de factor IX requeridas (UI) |
= |
peso corporal (kg) |
× |
aumento deseado del factor IX (% de lo normal o UI/dL) |
× |
1,4 (UI/kg por UI/dL) |
Dosificación para el tratamiento a demanda y el control de episodios de sangrado y manejo perioperatorio
|
Tipo de hemorragia |
Actividad del factor IX circulante requerida [% de lo normal o (UI/dL)] |
Intervalo de dosificación [horas] |
Duración de la terapia [días] |
|
Menor Hemartrosis no complicadas, músculo superficial o tejido blando |
20-30 |
12-24 |
1-2 |
|
Moderado Intramuscular o tejido blando con disección, membranas mucosas, extracciones dentales o hematuria |
25-50 |
12-24 |
Tratar hasta que el sangrado se detenga y comience la cicatrización, aproximadamente de 2 a 7 días |
|
Mayor Faringe, retrofaringe, retroperitoneo, SNC, cirugía |
50-100 |
12-24 |
7-10 |
Profilaxis de rutina
Para la profilaxis a largo plazo contra el sangrado, el régimen recomendado es de 100 UI/kg una vez por semana. Los niños (<12 años) tienen una recuperación más baja, una vida media más corta y una mayor depuración (basada en el peso corporal por kg) en comparación con los adolescentes y los adultos. Ajuste el régimen de dosificación (dosis o frecuencia) en función de la respuesta clínica del paciente.
2.2 Preparación y reconstitución
Los procedimientos que se indican a continuación se proporcionan como directrices generales para la preparación y reconstitución de BeneFIX.
Preparación
- 1.
- Lávese siempre las manos antes de realizar los siguientes procedimientos.
- 2.
- Utilice una técnica aséptica (es decir, limpia y libre de gérmenes) durante el procedimiento de reconstitución.
- 3.
- Utilice todos los componentes en la reconstitución y administración de este producto lo antes posible después de abrir sus envases estériles para minimizar la exposición innecesaria a la atmósfera.
- 4.
- Mezcla: Si necesita más de un vial de BeneFIX por infusión, reconstituya cada vial de acuerdo con las siguientes instrucciones. Retire la jeringa del diluyente dejando el adaptador del vial en su lugar y utilice una jeringa de cierre de luer grande separada para extraer el contenido reconstituido de cada vial. No separe las jeringas del diluyente ni la jeringa de cierre de luer grande hasta que esté listo para conectar la jeringa de cierre de luer grande al siguiente adaptador del vial.
Reconstitución
- 1.
- Si está refrigerado, deje que el vial de BeneFIX liofilizado y la jeringa precargada con el diluyente alcancen la temperatura ambiente.
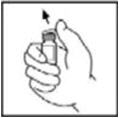
- 2.
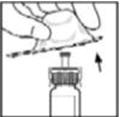
- Retire la tapa abatible de plástico del vial de BeneFIX para exponer las porciones centrales del tapón de goma.
- 3.
- Limpie la parte superior del vial con la torunda de alcohol proporcionada, o utilice otra solución antiséptica, y deje que se seque. Después de la limpieza, no toque el tapón de goma con la mano ni permita que toque ninguna superficie.
- 4.
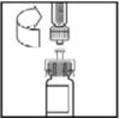
- Despegue la cubierta del paquete del adaptador de vial de plástico transparente. No retire el adaptador del paquete.
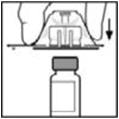
- 5.
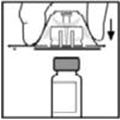
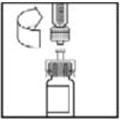
- Coloque el vial sobre una superficie plana. Mientras sujeta el adaptador en el paquete, coloque el adaptador del vial sobre el vial y presione firmemente sobre el paquete hasta que la punta del adaptador penetre el tapón del vial.
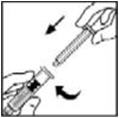
- 6.
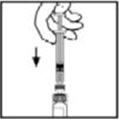
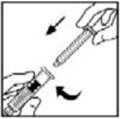
- Agarre la varilla del émbolo como se muestra en el diagrama. Evite el contacto con el eje de la varilla del émbolo. Conecte el extremo roscado de la varilla del émbolo al émbolo de la jeringa del diluyente empujando y girando firmemente.
- 7.
- Rompa la tapa de plástico a prueba de manipulaciones de la jeringa del diluyente rompiendo la perforación de la tapa. No toque el interior de la tapa ni la punta de la jeringa. Es posible que la jeringa del diluyente deba volver a taparse (si no se administra BeneFIX reconstituido inmediatamente), así que coloque la tapa sobre su parte superior en una superficie limpia en un lugar donde sea menos probable que se contamine ambientalmente.
- 8.
- Levante el paquete del adaptador y deseche el paquete.
- 9.
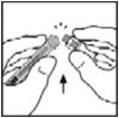
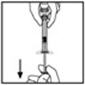
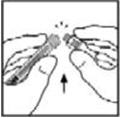
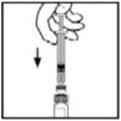
- Coloque el vial sobre una superficie plana. Conecte la jeringa del diluyente al adaptador del vial insertando la punta en la abertura del adaptador mientras empuja y gira firmemente la jeringa en el sentido de las agujas del reloj hasta que quede asegurada.
- 10.
- Presione lentamente la varilla del émbolo para inyectar todo el diluyente en el vial de BeneFIX.
- 11.
- Sin retirar la jeringa, agite suavemente el contenido del vial hasta que el polvo se disuelva.
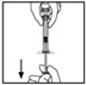
- 12.
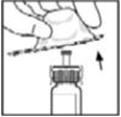
- Invierta el vial y aspire lentamente la solución en la jeringa.
- 13.
- Desconecte la jeringa del adaptador del vial tirando y girando suavemente la jeringa en sentido contrario a las agujas del reloj. Deseche el vial con el adaptador conectado.
- 14.
- La solución reconstituida debe ser transparente e incolora. Si no lo es, deséchela y utilice un nuevo kit. Si la solución no se va a utilizar inmediatamente, vuelva a tapar la jeringa. No toque la punta de la jeringa ni el interior de la tapa.
- 15.
- Almacene la solución reconstituida a temperatura ambiente y utilícela en un plazo de 3 horas.
Nota: BeneFIX, cuando se reconstituye, contiene polisorbato-80, que se sabe que aumenta la tasa de extracción de ftalato de di-(2-etilhexilo) (DEHP) del cloruro de polivinilo (PVC). Esto debe tenerse en cuenta durante la preparación y administración de BeneFIX, incluido el tiempo de almacenamiento transcurrido en un contenedor de PVC después de la reconstitución. Es importante que las recomendaciones de dosificación y administración se sigan cuidadosamente [ver Dosificación y administración (2.1, 2.3)].
Nota: El tubo del equipo de infusión incluido en este kit no contiene DEHP.
2.3 Administración
Sólo para uso intravenoso después de la reconstitución.
No se ha establecido la seguridad y eficacia de la administración por infusión continua [ver Advertencias y precauciones (5.2)].
- •
- Inspeccione la solución de BeneFIX en busca de partículas y decoloración antes de la administración, siempre que la solución y el contenedor lo permitan.
- •
- Administre BeneFIX utilizando el tubo proporcionado en este kit y la jeringa precargada con diluyente proporcionada, o una jeringa de plástico desechable estéril.
- •
- No mezcle ni administre BeneFIX en el mismo tubo o contenedor con otros productos medicinales.
Administración
- 1.
- Conecte la jeringa al extremo luer del tubo del equipo de infusión proporcionado.
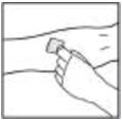
- 2.
- Aplique un torniquete y prepare el sitio de inyección limpiando bien la piel con una torunda de alcohol proporcionada en el kit.
- 3.
- Realice la punción venosa. Inserte la aguja del tubo del equipo de infusión en la vena y retire el torniquete. Inyecte el BeneFIX reconstituido por vía intravenosa durante varios minutos. Ajuste la velocidad de administración en función del nivel de comodidad del paciente.
Nota: Se ha informado de aglutinación de glóbulos rojos en el tubo/jeringa con la administración de BeneFIX. No se han notificado eventos adversos asociados con esta observación. Para minimizar la posibilidad de aglutinación, es importante limitar la cantidad de sangre que entra en el tubo. La sangre no debe entrar en la jeringa. Si se observa aglutinación de glóbulos rojos en el tubo o la jeringa, deseche todo el material (tubo, jeringa y solución de BeneFIX) y reanude la administración con un nuevo paquete.
- 4.
- Una vez finalizado el tratamiento con BeneFIX, retire y deseche el equipo de infusión. Deseche toda la solución no utilizada, los viales vacíos y las agujas y jeringas usadas en un contenedor adecuado.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
BeneFIX se suministra como un polvo liofilizado blanco en las siguientes dosis nominales:
- •
- 250 UI
- •
- 500 UI
- •
- 1000 UI
- •
- 2000 UI
- •
- 3000 UI
Cada vial de un solo uso de BeneFIX tiene la potencia real del factor IX recombinante (rFIX) en UI indicada en el vial.
4 CONTRAINDICACIONES
BeneFIX está contraindicado en pacientes que han manifestado reacciones de hipersensibilidad inmediata potencialmente mortales, incluida la anafilaxia, al producto o a sus componentes, incluida la proteína de hámster.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de hipersensibilidad
Se han notificado reacciones de hipersensibilidad, incluida la anafilaxia, con BeneFIX y se han manifestado como prurito, erupción cutánea, urticaria, ronchas, hinchazón facial, mareos, hipotensión, náuseas, molestias en el pecho, tos, disnea, sibilancias, rubor, malestar (generalizado) y fatiga. Con frecuencia, estos eventos han ocurrido en estrecha asociación temporal con el desarrollo de inhibidores del factor IX.
Controle de cerca a los pacientes para detectar signos y síntomas de reacciones de hipersensibilidad aguda, particularmente durante las primeras fases de la exposición inicial al producto. Debido al potencial de reacciones alérgicas con concentrados de factor IX, realice las administraciones iniciales (aproximadamente 10 a 20) de factor IX bajo supervisión médica donde se pueda brindar atención médica adecuada para las reacciones alérgicas. Avise a los pacientes que suspendan el uso del producto y que se pongan en contacto con su médico y/o busquen atención médica de emergencia inmediata. Suspenda inmediatamente la administración e inicie el tratamiento adecuado si se presentan síntomas.
BeneFIX contiene cantidades traza de proteínas de hámster (CHO). Los pacientes tratados con este producto pueden desarrollar hipersensibilidad a estas proteínas de mamíferos no humanos.
5.2 Complicaciones tromboembólicas
Ha habido informes postcomercialización de eventos trombóticos en pacientes que recibieron BeneFIX en infusión continua a través de un catéter venoso central, incluido el síndrome de la vena cava superior (SVC) que amenaza la vida en neonatos críticamente enfermos [ver Reacciones adversas (6.2)]. La seguridad y eficacia de la administración de BeneFIX mediante infusión continua no se han establecido [ver Dosificación y administración (2.1), 2.3)].
5.3 Síndrome nefrótico
Se ha notificado síndrome nefrótico después de la inducción de tolerancia inmunitaria con productos de factor IX en pacientes con hemofilia B con inhibidores del factor IX y antecedentes de reacciones alérgicas al factor IX. La seguridad y eficacia del uso de BeneFIX para la inducción de tolerancia inmunitaria no se han establecido.
5.4 Anticuerpos neutralizantes (inhibidores)
Se han notificado anticuerpos neutralizantes (inhibidores) después de la administración de BeneFIX [ver Reacciones adversas (6.1)]. Evalúe a los pacientes que usan BeneFIX para el desarrollo de inhibidores del factor IX mediante observaciones clínicas y pruebas de laboratorio apropiadas. Si no se alcanzan los niveles esperados de actividad del factor IX en plasma, o si el sangrado no se controla con una dosis esperada, realice un ensayo que mida la concentración del inhibidor del factor IX.
Los pacientes con inhibidores del factor IX tienen un mayor riesgo de reacciones de hipersensibilidad graves o anafilaxia tras un desafío posterior con factor IX.2 Evalúe a los pacientes que experimentan reacciones alérgicas para detectar la presencia de un inhibidor y controle de cerca a los pacientes con inhibidores para detectar signos y síntomas de reacciones de hipersensibilidad aguda, particularmente durante las primeras fases de la exposición inicial al producto [ver Advertencias y precauciones (5.1)].
5.5 Monitoreo de pruebas de laboratorio
- •
- Controle a los pacientes para detectar los niveles de actividad del factor IX mediante el ensayo de coagulación de un solo paso para confirmar que se han logrado y mantenido los niveles adecuados de factor IX, cuando esté clínicamente indicado [ver Dosificación y administración (2.1)].
- •
- Controle a los pacientes para detectar el desarrollo de inhibidores si no se alcanzan los niveles esperados de actividad del factor IX en plasma, o si el sangrado no se controla con la dosis recomendada de BeneFIX. Determine los niveles de inhibidor del factor IX en plasma en Unidades de Bethesda (BU).
6 REACCIONES ADVERSAS
Las reacciones adversas más graves son las reacciones de hipersensibilidad sistémica, incluidas las reacciones broncoespásticas o la hipotensión y la anafilaxia, y el desarrollo de inhibidores de alto título que requieren tratamientos alternativos a la terapia de reemplazo del factor IX.
Las reacciones adversas más comunes observadas en los ensayos clínicos [frecuencia > 5 % de los pacientes tratados previamente (PTP) o pacientes no tratados previamente (PUP)] fueron fiebre, tos, dolores de cabeza, mareos, náuseas, reacción en el lugar de la inyección, dolor en el lugar de la inyección y reacciones de hipersensibilidad cutánea (p. ej., erupción cutánea, urticaria).
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no se pueden comparar directamente con las tasas en los ensayos clínicos de otro medicamento y es posible que no reflejen las tasas observadas en la práctica clínica.
Durante los ensayos clínicos abiertos y no controlados con BeneFIX realizados en PTP, se notificaron 113 reacciones adversas con relación conocida o desconocida con la terapia con BeneFIX en el 38,5 % (25 de 65) de los sujetos (algunos sujetos notificaron más de un acontecimiento) que recibieron un total de 7573 infusiones. Estas reacciones adversas se resumen en la Tabla 2.
|
||
|
Sistema corporal |
Reacción adversa |
Número de pacientes (%) |
|
Trastornos de la sangre y del sistema linfático |
Inhibición del factor IX† |
1 (1.5%) |
|
Trastornos oculares |
Visión borrosa |
1 (1.5%) |
|
Trastornos gastrointestinales |
Náuseas |
4 (6.2%) |
|
Vómitos |
1 (1.5%) |
|
|
Trastornos generales y afecciones en el lugar de administración |
Reacción en el lugar de la inyección |
5 (7.7%) |
|
Dolor en el lugar de la inyección |
4 (6.2%) |
|
|
Fiebre |
2 (3.1%) |
|
|
Infecciones e infestaciones |
Celulitis en el lugar de la inyección intravenosa |
1 (1.5%) |
|
Flebilitis en el lugar de la inyección intravenosa |
1 (1.5%) |
|
|
Trastornos del sistema nervioso |
Dolor de cabeza |
7 (10.8%) |
|
Mareos |
5 (7.7%) |
|
|
Disgeusia (alteración del gusto) |
3 (4.6%) |
|
|
Temblores |
1 (1.5%) |
|
|
Somnolencia |
1 (1.5%) |
|
|
Trastornos renales y urinarios |
Infarto renal‡ |
1 (1.5%) |
|
Trastornos respiratorios, torácicos y mediastínicos |
Tos seca |
1 (1.5%) |
|
Hipoxia |
1 (1.5%) |
|
|
Chest tightness |
1 (1.5%) |
|
|
Trastornos cutáneos y subcutáneos |
Erupción cutánea |
4 (6.2%) |
|
Urticaria |
2 (3.1%) |
|
|
Trastornos vasculares |
Rubor |
2 (3.1%) |
En los 63 PUP que recibieron un total de 5538 infusiones, se notificaron 10 reacciones adversas en el 9.5 % de los pacientes (6 de 63) con una relación conocida o desconocida con BeneFIX. Estos eventos se resumen en la Tabla 3.
|
Sistema del cuerpo |
Reacción adversa |
Número de pacientes (%) |
|
Trastornos de la sangre y del sistema linfático |
Factor IX inhibition† |
2 (3.2%) |
|
Trastornos generales y afecciones en el sitio de administración |
Reacción en el lugar de la inyección |
1 (1.6%) |
|
Escalofríos |
1 (1.6%) |
|
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea (dificultad respiratoria) |
2 (3.2%) |
|
Trastornos cutáneos y subcutáneos |
Urticaria |
3 (4.8%) |
|
Erupción cutánea |
1 (1.6%) |
|
En un ensayo clínico multicéntrico, prospectivo y abierto con BeneFIX administrado a 100 UI/kg una vez por semana, se evaluó a 25 pacientes con hemofilia B (expuestos a un producto que contiene factor IX durante ≥100 días de exposición), con 25 sujetos tratados durante aproximadamente 52 semanas. Las reacciones adversas comunes (≥5%) fueron dolor de cabeza (36%), fiebre (20%) y tos (8%). Ningún sujeto se retiró del ensayo debido a una reacción adversa. En el ensayo, no se detectaron inhibidores y no se notificaron eventos trombóticos ni reacciones anafilácticas.
Inmunogenicidad
En ensayos clínicos con 65 pacientes con hemofilia B (definidos como aquellos con más de 50 días de exposición), se observó un inhibidor de bajo título en un paciente. El inhibidor fue transitorio, el paciente continuó en el ensayo y tuvo una recuperación normal del factor IX al finalizar el ensayo (aproximadamente 15 meses después de la detección del inhibidor).
En ensayos clínicos con pacientes pediátricos no tratados previamente, se observó el desarrollo de inhibidores en 2 de 63 pacientes (3.2%), ambos fueron inhibidores de alto título (>5 BU) detectados después de 7 y 15 días de exposición, respectivamente. Ambos pacientes fueron retirados del ensayo.
En un ensayo clínico de 25 pacientes con hemofilia B, con BeneFIX administrado a 100 UI/kg una vez por semana, no se detectaron inhibidores.
La detección de la formación de anticuerpos depende en gran medida de la sensibilidad y especificidad del ensayo. Además, la incidencia observada de positividad de anticuerpos (incluidos los anticuerpos neutralizantes) en un ensayo puede verse influenciada por varios factores, como la metodología del ensayo, la manipulación de las muestras, el momento de la toma de muestras, los medicamentos concomitantes y la enfermedad subyacente. Por estas razones, la comparación de la incidencia de anticuerpos contra BeneFIX con la incidencia de anticuerpos contra otros productos puede ser engañosa.
Complicaciones tromboembólicas
Todos los sujetos que participaron en los ensayos de pacientes con hemofilia B, pacientes pediátricos no tratados previamente y cirugía fueron monitoreados para detectar evidencia clínica de trombosis. No se notificaron complicaciones trombóticas en pacientes pediátricos no tratados previamente ni en sujetos de cirugía. Un sujeto con hemofilia B experimentó un infarto renal (véase la Tabla 2). Se obtuvieron estudios de laboratorio de trombogenicidad (fibrinopéptido A y fragmento 1 + 2 de protrombina) en 41 pacientes con hemofilia B y 7 sujetos de cirugía antes de la infusión y hasta 24 horas después de la infusión. Los resultados de estos estudios no fueron concluyentes. De los 29 sujetos con hemofilia B que se observó que tenían niveles elevados de fibrinopéptido A después de la infusión de BeneFIX, 22 también tenían niveles elevados al inicio del estudio. Los sujetos de cirugía no mostraron evidencia de un aumento significativo en la activación de la coagulación.
6.2 Experiencia posterior a la comercialización
Se han notificado las siguientes reacciones adversas posteriores a la comercialización para BeneFIX: recuperación inadecuada del factor IX, respuesta terapéutica inadecuada, desarrollo de inhibidores [véase Farmacología clínica (12)], anafilaxia [véase Advertencias y precauciones (5.1)], angioedema, disnea, hipotensión y trombosis.
Debido a que estas reacciones se notifican voluntariamente a partir de una población de tamaño incierto, no siempre es posible estimar de forma fiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Se han notificado casos posteriores a la comercialización de eventos trombóticos, incluido el síndrome de la vena cava superior potencialmente mortal en recién nacidos críticamente enfermos, mientras recibían BeneFIX en infusión continua a través de un catéter venoso central. También se han notificado casos de tromboflebitis periférica y trombosis venosa profunda. En algunos, BeneFIX se administró mediante infusión continua, que no es un método de administración aprobado [véase Dosificación y administración (2)]. No se ha establecido la seguridad y eficacia de la administración de BeneFIX mediante infusión continua [véase Advertencias y precauciones (5.2)].
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de riesgos
No hay datos sobre el uso de BeneFIX en mujeres embarazadas como para informar un riesgo asociado con el medicamento. No se han realizado estudios de reproducción animal con BeneFIX. Se desconoce si BeneFIX puede afectar la capacidad reproductiva o causar daño fetal cuando se administra a mujeres embarazadas.
En la población general de los EE. UU., el riesgo estimado de antecedentes de defectos de nacimiento importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2–4 % y del 15–20 %, respectivamente.
8.2 Lactancia
Resumen de riesgos
No hay información sobre la presencia de BeneFIX en la leche humana, el efecto en el lactante ni los efectos en la producción de leche. Se deben considerar los beneficios del desarrollo y la salud de la lactancia materna junto con la necesidad clínica de la madre de BeneFIX y cualquier efecto adverso potencial sobre el niño amamantado por BeneFIX o por la condición materna subyacente.
8.4 Uso pediátrico
Se evaluó la seguridad, eficacia y farmacocinética de BeneFIX en pacientes pediátricos previamente tratados (PTP) y no tratados previamente (PUP) [ver Estudios clínicos (14) y Reacciones adversas (6)]. En promedio, se observó una recuperación menor, una vida media más corta y una depuración más alta (según el peso corporal en kg) en niños menores de 12 años [ver Farmacología clínica (12.3)]. Es posible que se necesite ajustar la dosis [ver Dosificación y administración (2.1)].
8.5 Uso geriátrico
Los ensayos clínicos de BeneFIX no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes. La selección de la dosis para un paciente anciano debe individualizarse [ver Dosificación y administración (2.1)].
11 DESCRIPCIÓN
BeneFIX, Factor IX de la Coagulación (Recombinante), es una proteína purificada producida por tecnología de ADN recombinante. El producto está formulado como una preparación en polvo liofilizado estéril, no pirogénico, destinado a ser reconstituido para inyección intravenosa. Está disponible en viales de un solo uso que contienen la cantidad etiquetada de actividad del factor IX, expresada en Unidades Internacionales (UI). Cada vial contiene nominalmente 250, 500, 1000, 2000 o 3000 UI de factor IX de coagulación recombinante. La potencia (en UI) se determina utilizando un ensayo de coagulación de un solo paso in vitro contra el Estándar Internacional de la Organización Mundial de la Salud (OMS) para el concentrado de Factor IX. Una UI es la cantidad de actividad del factor IX presente en 1 mL de plasma humano normal agrupado. Después de la reconstitución del producto farmacéutico liofilizado, las concentraciones de excipientes son 0,234% de cloruro de sodio, 8 mM de L-histidina, 0,8% de sacarosa, 208 mM de glicina, 0,004% de polisorbato 80. La actividad específica de BeneFIX es mayor o igual a 200 UI por miligramo de proteína. BeneFIX no contiene conservantes y todas las concentraciones de dosificación producen una solución clara e incolora tras la reconstitución.
El factor IX de la coagulación es el ingrediente activo de BeneFIX. Tiene una secuencia de aminoácidos primaria que es idéntica a la forma alélica Ala148 del factor IX humano, y tiene características estructurales y funcionales similares a las del factor IX endógeno.
BeneFIX no se deriva de la sangre humana. Se produce mediante una línea celular de ovario de hámster chino (CHO) modificada genéticamente que está ampliamente caracterizada. No se utilizan aditivos de origen animal o humano durante los procesos de cultivo celular, purificación y formulación de BeneFIX. Los bancos de células almacenados están libres de productos sanguíneos o plasmáticos humanos. La línea celular CHO secreta factor IX recombinante en un medio de cultivo celular definido, y el factor IX recombinante se purifica mediante un proceso de purificación cromatográfica de cuatro pasos que no requiere un paso de anticuerpo monoclonal. El proceso también incluye un paso de nanofiltración de membrana que tiene la capacidad de retener moléculas con pesos moleculares aparentes >70.000 Da (como proteínas grandes y partículas virales). BeneFIX es un solo componente mediante la evaluación de electroforesis en gel de poliacrilamida SDS.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
BeneFIX reemplaza temporalmente el factor IX de coagulación faltante que se necesita para una hemostasia efectiva.
12.2 Farmacodinamia
El tiempo de tromboplastina parcial activado (aPTT) está prolongado en personas con hemofilia B. El tratamiento con concentrado de factor IX puede normalizar el aPTT al reemplazar temporalmente el factor IX. La administración de BeneFIX aumenta los niveles plasmáticos de factor IX y puede corregir temporalmente el defecto de coagulación en estos pacientes.
12.3 Farmacocinética
En un estudio farmacocinético aleatorizado, cruzado, se demostró que BeneFIX reconstituido en diluyente de cloruro de sodio al 0,234% era farmacocinéticamente equivalente al BeneFIX comercializado anteriormente (reconstituido con agua estéril para inyección) en 24 pacientes previamente tratados (≥12 años) a una dosis de 75 UI/kg. Además, los parámetros farmacocinéticos se realizaron un seguimiento en 23 pacientes previamente tratados después de la administración repetida de BeneFIX durante seis meses y se encontró que no cambiaron en comparación con los obtenidos en la evaluación inicial. Un resumen de los datos farmacocinéticos se presenta en la Tabla 4:
| Abreviaturas: AUC∞ = área bajo la curva de concentración plasmática-tiempo desde el tiempo cero hasta el infinito; Cmax = concentración máxima; t1/2 = vida media de eliminación plasmática; CL = aclaramiento; SD = desviación estándar. | ||
|
Parámetro |
Línea de base |
Mes 6 |
|
Cmax (UI/dL) |
54.5 ± 15.0 |
57.3 ± 13.2 |
|
AUC∞ (UI∙hr/dL) |
940 ± 237 |
923 ± 205 |
|
t1/2 (hr) |
22.4 ± 5.3 |
23.8 ± 6.5 |
|
CL (mL/hr/kg) |
8.47 ± 2.12 |
8.54 ± 2.04 |
|
Recuperación |
0.73 ± 0.20 |
0.76 ± 0.18 |
Pacientes pediátricos (<12 años)
Se desarrolló un modelo farmacocinético poblacional utilizando datos recopilados en pacientes de 7 meses a 60 años que recibieron dosis únicas de BeneFIX que van de 50 a 75 UI/kg. Los parámetros estimados utilizando el modelo final de 2 compartimentos se muestran en la Tabla 5. Los bebés y los niños tuvieron un aclaramiento más alto, un volumen de distribución más grande, una vida media más corta y una recuperación más baja que los adolescentes y los adultos.
| Grupo de edad | Bebés (<2 años) | Niños 2 a <6 años |
Niños 6 a <12 años |
Adolescentes y adultos (≥12 años) |
|---|---|---|---|---|
| Abreviaturas: DE = desviación estándar; Vss = volumen de distribución en estado estacionario. | ||||
|
Número de sujetos |
7 |
16 |
1 |
43 |
|
Aclaramiento (mL/h/kg) |
13.1 ± 2.1 |
13.1 ± 2.8 |
15.5 |
8.4 ± 2.4 |
|
Vss (mL/kg) |
252 ± 35 |
257 ± 25 |
303 |
229 ± 57 |
|
Vida media (h) |
15.6 ± 1.2 |
16.7 ± 1.9 |
16.3 |
23.1 ± 4.4 |
|
Recuperación (UI/dL por UI/kg) |
0.61 ± 0.10 |
0.60 ± 0.08 |
0.47 |
0.72 ± 0.19 |
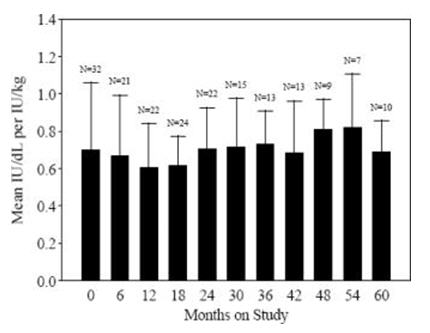
Los datos de 57 sujetos PUP que se sometieron a pruebas de recuperación repetidas durante un máximo de 60 meses demostraron que la recuperación promedio fue consistente en el tiempo, como se muestra en la Figura 1.
Figura 1. Recuperación promedio a lo largo del tiempo
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Se ha demostrado que BeneFIX no es mutagénico en la prueba de Ames y no clastogénico en una prueba de aberraciones cromosómicas. No se han realizado investigaciones sobre carcinogénesis o deterioro de la fertilidad.
14 ESTUDIOS CLÍNICOS
Se ha evaluado la eficacia de BeneFIX en ensayos clínicos en los que un total de 153 sujetos recibieron BeneFIX ya sea para el tratamiento a demanda y el control de episodios hemorrágicos, manejo perioperatorio y profilaxis de rutina en pacientes con hemofilia B.
Tratamiento a demanda y control de episodios hemorrágicos
Cincuenta y seis PTP y sesenta y tres PUP fueron tratados por episodios hemorrágicos en un tratamiento a demanda y control de hemorragias (consulte las Tablas 6 y 7). Los PTP fueron seguidos durante un intervalo promedio de 24 meses (media de 23.4 ± 5.3 meses) y durante una mediana de 83.5. Los PUP fueron seguidos durante un intervalo promedio de 37 meses (media de 38.1 ± 16.4 meses) y durante una mediana de 89 días de exposición.
Cincuenta y cinco PTP y cincuenta y cuatro PUP recibieron BeneFIX para el tratamiento de episodios hemorrágicos (consulte la Tabla 6). Los episodios hemorrágicos que se trataron con éxito incluyeron hemartrosis y hemorragia en tejidos blandos y músculos. No se informaron datos sobre la gravedad de los episodios hemorrágicos. En los PTP, el 88% del total de infusiones administradas para el tratamiento a demanda se calificaron como una respuesta “excelente” o “buena”.
|
|||||
|
Dosis media: UI/kg (rango) |
Tasa de hemorragias resueltas con 1 infusión |
Respuesta a la calificación de infusión 1st* Excelente/Bueno |
Respuesta a la calificación de infusión 1st* Moderado |
Respuesta a la calificación de infusión 1st* Sin respuesta |
|
|
PTP N = 55† |
42.8 |
81% |
90.9% |
7.1% |
0.7% |
|
PUP N = 54‡ |
62.7 |
75% |
94.1% |
2.9% |
1.0% |
Un total de 20 PTP fueron tratados con BeneFIX para profilaxis secundaria (la administración regular de terapia de reemplazo de FIX para prevenir el sangrado en pacientes que ya pueden haber demostrado evidencia clínica de artropatía hemofílica o enfermedad articular) a intervalos regulares durante el ensayo con un promedio de 2 infusiones por semana (ver Tabla 7). Treinta y dos PUP recibieron BeneFIX para profilaxis de rutina (primaria y secundaria) (ver Tabla 7). Veinticuatro PUP recibieron BeneFIX al menos dos veces por semana y ocho PUP recibieron BeneFIX una vez por semana. Siete PTP experimentaron un total de 26 episodios de sangrado espontáneo dentro de las 48 horas posteriores a una infusión. Se notificaron seis hemorragias espontáneas dentro de las 48 horas posteriores a una infusión en 5 PUP. La terapia de profilaxis se calificó como “excelente” o “eficaz” en el 93% de los PTP que recibieron profilaxis una o dos veces por semana.
| Exposición total (infusiones) | Duración de la profilaxis (meses) (media ± DE) |
Dosis UI/kg (media ± DE) |
Hemorragias espontáneas dentro de las 48 horas posteriores a la infusión | Calificación de la respuesta* Excelente |
Calificación de la respuesta* Efectiva |
Calificación de la respuesta* Inadecuada |
|---|---|---|---|---|---|---|
| Abreviatura: DE = desviación estándar. | ||||||
|
||||||
|
20 PTPs |
||||||
|
2985 |
18.2 ± 8.4† |
40.3 ± 15.2† |
28 |
56.0% |
37.1% |
4.3% |
|
32 PUPs |
||||||
|
3158 |
14.4 ± 8.1 |
73.3 ± 33.1 |
6 |
91.3% |
6.4% |
1.7% |
Manejo perioperatorio
El manejo de la hemostasia se evaluó en el ámbito quirúrgico tanto en pacientes tratados previamente (PTP) como en pacientes no tratados previamente (PUP) (ver Tabla 8 y Tabla 9). Se han realizado treinta y seis procedimientos quirúrgicos en 28 PTP, de los cuales 23 fueron procedimientos quirúrgicos mayores (incluidas 6 extracciones dentales complicadas). Se han realizado treinta procedimientos quirúrgicos en 23 PUP. Veintiocho de estos procedimientos se consideraron menores. La hemostasia se mantuvo durante todo el período quirúrgico; sin embargo, un sujeto PTP requirió la evacuación de un hematoma en el sitio de la herida quirúrgica, y otro sujeto PTP que recibió BeneFIX después de una extracción dental requirió una intervención quirúrgica adicional debido al exudado en el sitio de la extracción. No hubo evidencia clínica de complicaciones trombóticas en ninguno de los sujetos.
Entre los sujetos de cirugía PTP, el aumento medio en la actividad del factor IX circulante fue de 0.7 UI/dL por UI/kg infundido (rango 0.3–1.2 UI/dL; media 0.8 ± 0.2 UI/dL por UI/kg). La vida media de eliminación media para los sujetos de cirugía PTP fue de 19.4 horas (rango 10–37 horas; media 21.3 ± 8.1 horas).
|
||||
|
Tipo de cirugía* |
Número de procedimientos |
Respuesta Excelente/Buena |
Respuesta Moderada |
Respuesta Sin respuesta |
|
Cirugía de tobillo |
2 (2) |
2 (100%) |
– |
– |
|
Implante de prótesis de cadera (derecha) |
1 (1) |
1 (100%) |
– |
– |
|
Artroplastia de rodilla (2 bilaterales, 1 derecha) |
3 (3) |
3 (100%) |
– |
– |
|
Sinovectomía artroscópica de rodilla |
2 (2)† |
1 (50%) |
– |
– |
|
Trasplante de hígado (ortópico) |
1 (1) |
1 (100%) |
– |
– |
|
Esplenectomía |
1 (1) |
1 (100%) |
– |
– |
|
Retirada del dispositivo de fijación externa (muñeca) |
1 (1) |
1 (100%) |
– |
– |
|
Reparación de hernia |
3 (2) |
3 (100%) |
– |
– |
|
Descompresión subacromial (izquierda) |
1 (1) |
1 (100%) |
– |
– |
|
Desbridamiento de la pantorrilla, extracción dental‡ |
1 (1) |
1 (100%) |
– |
– |
|
Extirpación de ganglios linfáticos, extracción dental‡ |
1 (1) |
1 (100%) |
– |
– |
|
Alargamiento del cordón del talón izquierdo |
1 (1) |
1 (100%) |
– |
– |
|
Procedimientos dentales§ |
12 (11) |
11 (92%) |
1 (8%) |
– |
|
Procedimientos menores¶ |
6 (6) |
6 (100%) |
– |
– |
|
Tipo de cirugía* |
Número de procedimientos (número de sujetos) |
Respuesta Excelente/Buena |
Respuesta Moderada |
Respuesta Sin respuesta |
|
Reparación de hernia |
2 (2) |
2 (100%) |
– |
– |
|
Procedimientos menores† |
28 (21)‡ |
27 (96%) |
– |
– |
Nueve de los principales procedimientos quirúrgicos se realizaron en 8 PUP utilizando un régimen de infusión continua. Cinco de los procedimientos quirúrgicos se realizaron en PUP utilizando un régimen de infusión continua durante 3 a 5 días. Aunque se alcanzaron niveles de factor IX circulante dirigidos a restaurar y mantener la hemostasia con los regímenes de reemplazo de pulso e infusión continua, la experiencia de los ensayos clínicos con la infusión continua de BeneFIX para el manejo perioperatorio en la hemofilia B ha sido demasiado limitada para establecer la seguridad y la eficacia clínica de la administración del producto por infusión continua.
Profilaxis de rutina
En un ensayo abierto de 25 pacientes (rango de edad 12–54 años) que comparó el tratamiento a demanda versus la profilaxis cuando se administró a una dosis de 100 UI/kg una vez por semana, la tasa de hemorragia anualizada (ABR) para el período de profilaxis fue significativamente menor (p < 0.0001) que la ABR para el período a demanda (media ± desviación estándar (DE): 3.6 ± 4.6, mediana: 2.0, mín.-máx.: 0–13.8 versus media: 32.9 ± 17.4, mediana: 33.6, mín.-máx.: 6.1–69.0, respectivamente).
En un ensayo cruzado abierto en pacientes de 6 a 64 años, de 100 UI/kg una vez por semana (44 pacientes) y 50 UI/kg dos veces por semana (43 pacientes) con períodos de tratamiento de 4 meses, la ABR para el período de profilaxis de 100 UI/kg una vez por semana fue de una media de 4.4 ± 10.0 episodios por año (mediana: 0.0, mín.-máx.: 0–50.5) y una media de 2.8 ± 5.7 (mediana: 0.0, mín.-máx.: 0–24.1) para el período de 50 UI/kg dos veces por semana. Seis pacientes menores de 12 años tuvieron una ABR media de 1.6 ± 1.7 (mediana: 1.5, mín.-máx.: 0–3.3) en el período de 100 UI/kg una vez por semana y una ABR media de 0 ± 0 (mediana: 0, mín.-máx.: 0–0) en el período de 50 UI/kg dos veces por semana.
15 REFERENCIAS
- 1.
- Roberts HR, Eberst ME. Manejo actual de la hemofilia B. Hematol Oncol Clin North Am. 1993;7(6):1269–1280.
- 2.
- Shapiro AD, Ragni MV, Lusher JM, et al. Seguridad y eficacia del concentrado de factor IX purificado por anticuerpo monoclonal en pacientes previamente no tratados con hemofilia B. Thromb Haemost. 1996;75(1):30–35.
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Suministro
BeneFIX, Factor de Coagulación IX (Recombinante), se suministra en kits que incluyen viales de un solo uso que contienen nominalmente 250, 500, 1000, 2000 o 3000 UI por vial con una jeringa de diluyente precargada estéril, un dispositivo adaptador de vial para reconstitución, un equipo de infusión estéril y dos (2) hisopos con alcohol, una venda y una gasa. El medicamento, los diluyentes para inyección y el resto de los componentes incluidos en el kit de BeneFIX de 250, 500, 1000, 2000 o 3000 UI no están hechos de caucho natural ni de látex de caucho natural. La actividad real del factor IX en UI se indica en la etiqueta de cada vial.
|
BeneFIX |
||
|
Potencias nominales |
Código de color |
Número NDC del kit |
|
250 Unidades Internacionales |
Amarillo |
58394-633-03 |
|
500 Unidades Internacionales |
Azul |
58394-634-03 |
|
1000 Unidades Internacionales |
Verde |
58394-635-03 |
|
2000 Unidades Internacionales |
Rojo |
58394-636-03 |
|
3000 Unidades Internacionales |
Gris |
58394-637-03 |
Almacenamiento y manipulación
17 INFORMACIÓN PARA EL PACIENTE
- •
- Aconseje a los pacientes que lean el etiquetado del paciente aprobado por la FDA (Información para el paciente e Instrucciones de uso)
- •
- Son posibles reacciones de hipersensibilidad de tipo alérgico. Informe a los pacientes sobre los signos tempranos de reacciones de hipersensibilidad [incluidos urticaria (erupción con picazón), urticaria generalizada, opresión en el pecho, sibilancias, hipotensión] y anafilaxia. Aconseje a los pacientes que suspendan el uso del producto y se pongan en contacto con su médico si se presentan estos síntomas.
- •
- Aconseje a los pacientes que se pongan en contacto con su médico o centro de tratamiento para recibir tratamiento y/o evaluación adicionales si experimentan una falta de respuesta clínica a la terapia de reemplazo del factor IX, ya que en algunos casos esto puede ser una manifestación de un inhibidor.
SECCIÓN NO CLASIFICADA SPL
Es posible que el etiquetado de este producto se haya actualizado. Para obtener la información de prescripción más reciente, visite www.pfizer.com.
Para obtener información médica sobre BENEFIX, visite www.pfizermedinfo.com o llame al 1-800-438-1985.
Etiquetado del Paciente Aprobado por la FDA
Información para el paciente
BeneFIX® / BEN-uh-fiks/
[Factor IX de la coagulación (recombinante)]
Lea este Folleto para el paciente cuidadosamente antes de usar BeneFIX y cada vez que obtenga una nueva receta. Puede haber nueva información. Este Folleto para el paciente no reemplaza hablar con su médico sobre su condición médica o su tratamiento.
¿Qué es BeneFIX?
BeneFIX es un medicamento inyectable que se usa para ayudar a controlar y prevenir el sangrado en personas con hemofilia B. La hemofilia B también se llama deficiencia congénita del factor IX o enfermedad de Christmas.
BeneFIX NO se usa para tratar la hemofilia A.
¿Qué debo decirle a mi médico antes de usar BeneFIX?
Informe a su médico y farmacéutico sobre todos los medicamentos que toma, incluidos todos los medicamentos recetados y de venta libre, como medicamentos de venta libre, suplementos o hierbas medicinales.
Informe a su médico sobre todas sus afecciones médicas, incluso si:
- •
- tiene alguna alergia, incluidas las alergias a los hámsters.
- •
- está embarazada o planea quedar embarazada. No se sabe si BeneFIX puede dañar a su bebé por nacer.
- •
- está amamantando. No se sabe si BeneFIX pasa a la leche materna y si puede dañar a su bebé.
¿Cómo debo infundir BeneFIX?
Las administraciones iniciales de BeneFIX deben administrarse bajo la supervisión médica adecuada, donde se pueda proporcionar atención médica adecuada para reacciones alérgicas graves.
Vea las instrucciones paso a paso para infundir BeneFIX al final de este folleto. Siempre debe seguir las instrucciones específicas que le dé su médico. Los pasos que se enumeran a continuación son pautas generales para usar BeneFIX. Si no está seguro de los procedimientos, llame a su médico o farmacéutico antes de usar.
Llame a su médico de inmediato si el sangrado no se controla después de usar BeneFIX.
Su médico le recetará la dosis que debe tomar.
Es posible que su médico deba analizarle la sangre de vez en cuando.
BeneFIX no debe administrarse mediante infusión continua.
¿Qué pasa si tomo demasiado BeneFIX?
Llame a su médico si toma demasiado BeneFIX.
¿Cuáles son los posibles efectos secundarios de BeneFIX?
Pueden ocurrir reacciones alérgicas con BeneFIX. Llame a su médico o busque atención médica de emergencia de inmediato si tiene alguno de los siguientes síntomas:
- respiración sibilante
- dificultad para respirar
- opresión en el pecho
- ponerse azul (mire los labios y las encías)
- latidos cardíacos rápidos
- hinchazón de la cara
- desmayo
- erupción cutánea
- urticaria
Su cuerpo también puede producir anticuerpos, llamados “inhibidores”, contra BeneFIX, lo que puede evitar que BeneFIX funcione correctamente.
Algunos efectos secundarios comunes de BeneFIX son fiebre, tos, náuseas, reacción en el sitio de inyección, dolor en el sitio de inyección, dolor de cabeza, mareos y erupción cutánea.
BeneFIX puede aumentar el riesgo de tromboembolismo (coágulos sanguíneos anormales) en su cuerpo si tiene factores de riesgo para desarrollar coágulos sanguíneos, incluido un catéter venoso central a través del cual se administra BeneFIX mediante infusión continua. Se han reportado eventos de coagulación sanguínea grave, incluidos coágulos sanguíneos potencialmente mortales en neonatos críticamente enfermos, mientras recibían BeneFIX de infusión continua a través de un catéter venoso central. La seguridad y eficacia de la administración de BeneFIX mediante infusión continua no se han establecido.
Estos no son todos los posibles efectos secundarios de BeneFIX.
Informe a su médico sobre cualquier efecto secundario que le moleste o que no desaparezca.
¿Cómo debo almacenar BeneFIX?
NO CONGELAR el kit BeneFIX.
El kit BeneFIX se puede almacenar a temperatura ambiente (por debajo de 86 °F) o bajo refrigeración.
Deseche cualquier BeneFIX y diluyente no utilizado después de la fecha de vencimiento indicada en la etiqueta.
Se debe evitar la congelación para evitar daños a la jeringa de diluyente precargada.
BeneFIX no contiene conservante. Después de reconstituir BeneFIX, puede almacenarlo a temperatura ambiente hasta por 3 horas. Si no lo ha usado en 3 horas, deséchelo.
No use BeneFIX si la solución reconstituida no es clara e incolora.
¿Qué más debo saber sobre BeneFIX?
Los medicamentos a veces se recetan para fines distintos de los que se enumeran aquí. No use BeneFIX para una condición para la que no fue recetado. No comparta BeneFIX con otras personas, incluso si tienen los mismos síntomas que usted.
Este Folleto para el paciente resume la información más importante sobre BeneFIX. Si desea obtener más información, hable con su médico. Puede pedirle a su médico o farmacéutico información sobre BeneFIX que fue escrita para profesionales de la salud.
INSTRUCCIONES DE USO
BeneFIX® / BEN-uh-fiks/
[Factor IX de Coagulación (Recombinante)]
BeneFIX se suministra como un polvo. Antes de que pueda ser infundido en su vena (inyección intravenosa), debe reconstituir el polvo mezclándolo con el diluyente líquido suministrado. El diluyente líquido es cloruro de sodio al 0,234%. BeneFIX debe reconstituirse e infundirse utilizando el equipo de infusión, el diluyente, la jeringa y el adaptador proporcionados en este kit, y siguiendo las instrucciones que se indican a continuación.
RECONSTITUCIÓN
Lávese siempre las manos antes de realizar los siguientes pasos. Intente mantener todo limpio y libre de gérmenes mientras reconstituye BeneFIX. Una vez que abra los viales, debe terminar de reconstituir BeneFIX lo antes posible. Esto ayudará a mantener los materiales del equipo de infusión libres de gérmenes.
Nota: Si utiliza más de un vial de BeneFIX por infusión, reconstituya cada vial de acuerdo con los pasos 1 a 13.
- 1.
- Si está refrigerado, deje que el vial de BeneFIX y la jeringa precargada con diluyente alcancen la temperatura ambiente.
- 2.
- Retire la tapa abatible de plástico del vial de BeneFIX para mostrar la parte central del tapón de goma.
- 3.
- Limpie la parte superior del vial con la torunda de alcohol proporcionada, o utilice otra solución antiséptica, y deje que se seque. Después de la limpieza, no toque el tapón de goma con la mano ni permita que toque ninguna superficie.
- 4.
- Despegue la cubierta del paquete del adaptador de vial de plástico transparente. No retire el adaptador del paquete.
- 5.
- Coloque el vial sobre una superficie plana. Mientras sujeta el adaptador en el paquete, coloque el adaptador del vial sobre el vial. Presione firmemente sobre el paquete hasta que el adaptador encaje en su lugar en la parte superior del vial, con la punta del adaptador penetrando el tapón del vial.
- 6.
- Agarre la varilla del émbolo como se muestra en la imagen de abajo. No toque el eje de la varilla del émbolo. Conecte el extremo roscado de la varilla del émbolo al émbolo de la jeringa del diluyente empujando y girando firmemente.
- 7.
- Rompa la tapa de plástico a prueba de manipulaciones de la jeringa del diluyente rompiendo la perforación de la tapa. No toque el interior de la tapa ni la punta de la jeringa. Es posible que deba volver a tapar la jeringa del diluyente (si no se utiliza inmediatamente BeneFIX reconstituido), así que coloque la tapa en su punta sobre una superficie limpia en un lugar donde se mantenga limpia.
- 8.
- Levante el paquete del adaptador y deseche el paquete.
- 9.
- Coloque el vial sobre una superficie plana. Conecte la jeringa del diluyente al adaptador del vial insertando la punta de la jeringa en la abertura del adaptador mientras empuja y gira firmemente la jeringa en el sentido de las agujas del reloj hasta que la conexión esté asegurada.
- 10.
- Empuje lentamente la varilla del émbolo para inyectar todo el diluyente en el vial de BeneFIX.
- 11.
- Con la jeringa todavía conectada al adaptador, suavemente gire el contenido del vial hasta que el polvo se disuelva.
Observe la solución final antes de infundirla. La solución debe ser transparente a incolora. Si no lo es, deseche la solución y utilice un nuevo kit. - 12.
- Asegúrese de que la varilla del émbolo de la jeringa esté completamente presionada hacia abajo, luego dé la vuelta al vial. Tire lentamente de la solución hacia la jeringa. Vuelva a girar la jeringa hacia arriba y elimine las burbujas de aire golpeando suavemente la jeringa con el dedo y empujando lentamente el aire fuera de la jeringa.
Si reconstituyó más de un vial de BeneFIX, retire la jeringa del diluyente del adaptador del vial y deje el adaptador del vial conectado al vial. Conecte rápidamente una jeringa de cierre de luer grande separada y tire de la solución reconstituida como se indicó anteriormente. Repita este procedimiento con cada vial por turno. No separe las jeringas del diluyente ni la jeringa de cierre de luer grande hasta que esté listo para conectar la jeringa de cierre de luer grande al siguiente adaptador del vial. - 13.
- Retire la jeringa del adaptador del vial tirando y girando suavemente la jeringa en sentido contrario a las agujas del reloj. Deseche el vial con el adaptador conectado.
Si no va a utilizar la solución de inmediato, debe volver a colocar cuidadosamente la tapa de la jeringa. No toque la punta de la jeringa ni el interior de la tapa.
BeneFIX debe infundirse dentro de las 3 horas posteriores a la reconstitución. La solución reconstituida puede almacenarse a temperatura ambiente antes de la infusión.
INFUSIÓN (Inyección Intravenosa)
La infusión continua no es una forma aprobada de administrar BeneFIX.
Su médico o profesional sanitario debe enseñarle cómo infundir BeneFIX. Una vez que aprenda a autoinfundirse, puede seguir las instrucciones de este prospecto.
- 1.
- Conecte la jeringa al extremo luer del tubo del equipo de infusión proporcionado.
- 2.
- Aplique un torniquete y prepare el sitio de inyección limpiando bien la piel con una torunda de alcohol proporcionada en el kit.
- 3.
- Inserte la aguja mariposa del tubo del equipo de infusión en su vena según las instrucciones de su médico o profesional sanitario. Retire el torniquete. Infunda el producto BeneFIX reconstituido durante varios minutos. Su nivel de comodidad debe determinar la velocidad de infusión.
Se ha informado de la aglutinación de glóbulos rojos en el tubo/jeringa con la administración de BeneFIX. No se han notificado eventos adversos asociados a esta observación. Para minimizar la posibilidad de aglutinación, es importante limitar la cantidad de sangre que entra en el tubo. La sangre no debe entrar en la jeringa.
Nota: Si se observa aglutinación de glóbulos rojos en el tubo o la jeringa, deseche todo el material (tubo, jeringa y solución BeneFIX) y continúe la administración con un nuevo paquete. - 4.
- Después de infundir BeneFIX, retire el equipo de infusión y deséchelo. La cantidad de producto medicamentoso que quede en el equipo de infusión no afectará a su tratamiento. Deseche toda la solución no utilizada, el vial (los viales) vacío (s) y las agujas y jeringas usadas en un contenedor adecuado utilizado para desechar los residuos que podrían dañar a otras personas si no se manipulan correctamente.
Es una buena idea registrar el número de lote de la etiqueta del vial de BeneFIX cada vez que use BeneFIX. Puede utilizar la etiqueta despegable que se encuentra en el vial para registrar el número de lote.
Si tiene alguna pregunta o duda sobre BeneFIX, consulte a su médico o profesional sanitario.
Licencia del Gobierno de EE. UU. No. 3
LAB-0464-15.0
PANEL DE DESPLIEGUE PRINCIPAL – Etiqueta de jeringa de 5 mL – Utilizada en todos los kits
0.234% Cloruro de
Sodio Diluyente
5 mL
Jeringa desechable para
diluir el medicamento con BeneFix®
Factor IX de Coagulación (Recombinante)
Estéril, no pirogénico. No contiene
conservantes.
Fabricado para
Wyeth Pharmaceuticals LLC
Una subsidiaria de Pfizer Inc.
Filadelfia, PA 19101
Fabricado por
Vetter Pharma-Fertigung GmbH & Co. KG
Schuetzenstrasse 87, 99-101
88212 Ravensburg, Alemania
o
Vetter Pharma-Fertigung GmbH & Co. KG
Eisenbahnstrasse 2-4
88085 Langenargen, Alemania
Licencia del Gobierno de EE. UU. No. 3
Solo con receta médica
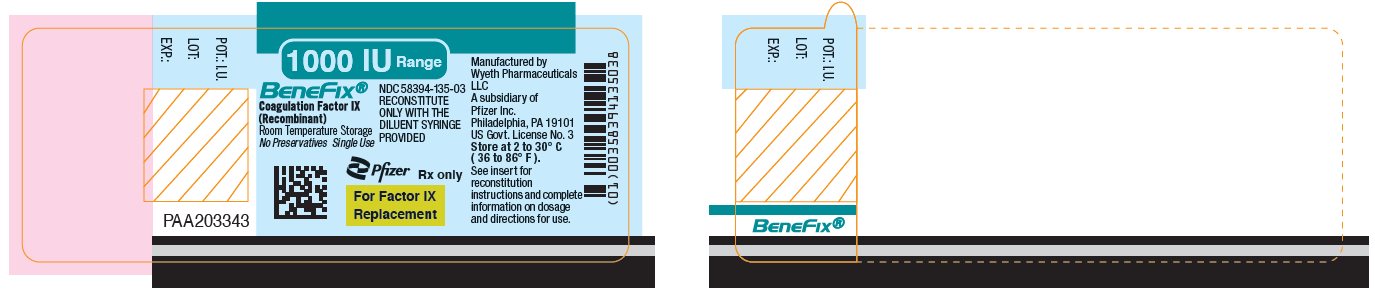
PANEL DE EXPOSICIÓN PRINCIPAL – Etiqueta del frasco de 1000 UI
Rango de 1000 UI
BeneFix®
Factor de Coagulación IX
(Recombinante)
NDC 58394-135-03
RECONSTITUIR
SÓLO CON LA
JERINGA DE DILUYENTE
PROPORCIONADA
Almacenamiento a temperatura ambiente
Sin conservantes. Uso único
Pfizer
Solo con receta médica
Para la reposición de Factor IX
PANEL DE PRESENTACIÓN PRINCIPAL – Kit de 1000 UI en cartón
Un vial de un solo uso con jeringa prellenada de diluyente de 5 mL
NDC 58394-635-03
Almacenamiento a temperatura ambiente
Rango de 1000 UI
BeneFix®
Factor de Coagulación IX (Recombinante)
Almacenamiento a temperatura ambiente
Sin Plasma. Sin Albúmina.
Para administración intravenosa
Administración
Almacenar a 2 a 30º C (36 a 86º F).
Solo para terapia de reemplazo del Factor IX
Reconstruya BeneFix® con la
jeringa prellenada estéril incluida
de Cloruro de Sodio al 0,234% para Inyección, SOLO.
Solo con receta médica
Pfizer
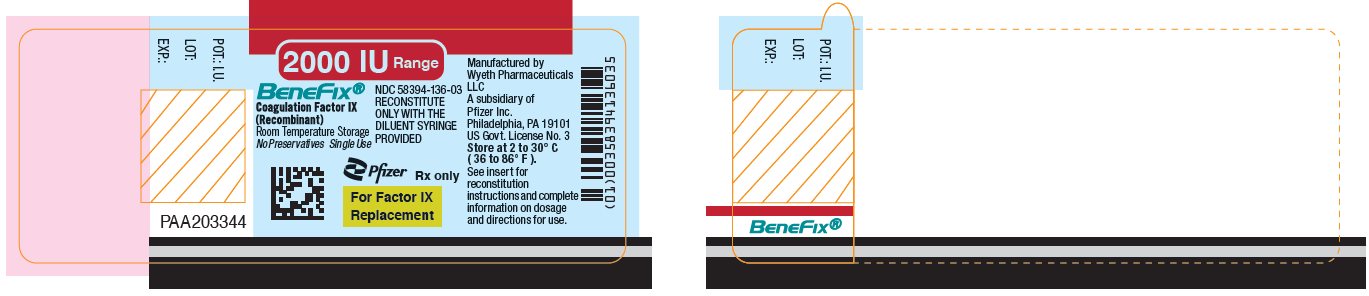
Panel principal de visualización – Etiqueta del vial de 2000 UI
Rango de 2000 IU
BeneFix®
Factor IX de coagulación
(Recombinante)
NDC 58394-136-03
RECONSTITUIR
SOLO CON LA
JERINGA DE DILUCIÓN SUMINISTRADA
Almacenamiento a temperatura ambiente
Sin conservantes Uso único
Pfizer
Sólo con receta médica
Para Factor IX
Reemplazo
PANEL DE EXHIBICIÓN PRINCIPAL – Kit de cartón de 2000 UI
Un vial de un solo uso con jeringa precargada con 5 ml de diluyente
NDC 58394-636-03
Conservar a temperatura ambiente
Rango de 2000 UI
BeneFix®
Factor de coagulación IX (recombinante)
Conservar a temperatura ambiente
Sin plasma. Sin albúmina.
Para administración intravenosa
Conservar entre 2 y 30 °C (36 y 86 °F).
Solo para la terapia de reemplazo del factor IX
Reconstituya BeneFix® con la
jeringa estéril precargada adjunta
de cloruro de sodio al 0,234 % para
inyección, SOLAMENTE.
Rx only
Pfizer
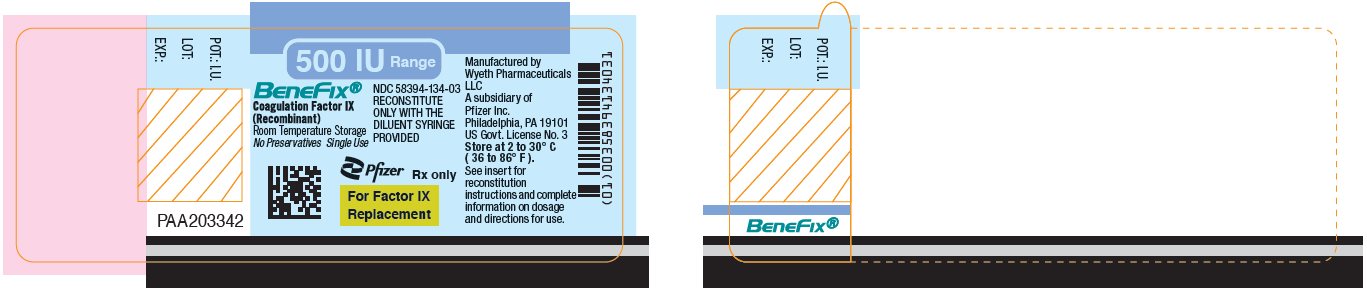
PANEL DE VISUALIZACIÓN PRINCIPAL – Etiqueta del vial 500 UI
Rango de 500 UI
BeneFix®
Factor de Coagulación IX
(Recombinante)
NDC 58394-134-03
RECONSTITUIR
SOLO CON LA
JERINGA DE DILUYENTE
PROPORCIONADA
Almacenamiento a Temperatura Ambiente
Sin Conservantes Uso Único
Pfizer
Sólo con receta médica
Para el Factor IX
Reemplazo
Panel principal de visualización – Kit de cartón de 500 UI
Un vial de un solo uso con jeringa prellenada de diluyente de 5 mL
NDC 58394-634-03
Almacenamiento a temperatura ambiente
Rango de 500 UI
BeneFix®
Factor de coagulación IX (recombinante)
Almacenamiento a temperatura ambiente
Sin plasma. Sin albúmina.
Para administración intravenosa
Administración
Almacenar a 2 a 30º C (36 a 86º F).
Solo para terapia de reemplazo del factor IX
Reconstruya BeneFix® con la
jeringa prellenada estéril incluida
de cloruro de sodio al 0,234% para inyección, SOLO.
Solo con receta médica
Pfizer
PANEL PRINCIPAL DE MOSTRACIÓN – Etiqueta del vial de 250 UI
Rango de 250 UI
BeneFix®
Factor IX de coagulación
(Recombinante)
NDC 58394-133-03
RECONSTITUIR
SÓLO CON LA
JERINGA DE DILUCIÓN
PROPORCIONADA
Almacenamiento a temperatura ambiente
Sin conservantes Uso único
Pfizer
Receta médica requerida
Para la sustitución de Factor IX
Panel de visualización principal – Kit de cartón de 250 UI
Un vial de un solo uso con jeringa precargada de diluyente de 5 mL
NDC 58394-633-03
Almacenamiento a temperatura ambiente
Rango de 250 UI
BeneFix®
Factor IX de coagulación (recombinante)
Almacenamiento a temperatura ambiente
Sin plasma. Sin albúmina.
Para administración intravenosa
Administración
Almacenar a 2 a 30° C (36 a 86° F).
Solo para terapia de reemplazo del factor IX
Reconstituir BeneFIX® con la
jeringa precargada estéril incluida
de cloruro de sodio al 0,234% para inyección, SOLO.
Solo con receta médica
Pfizer
Panel de visualización principal – Etiqueta de vial de 3000 UI
Rango de 3000 UI
BeneFix®
Factor de Coagulación IX
(Recombinante)
NDC 58394-137-03
RECONSTITUIR
SOLO CON LA
JERINGA DE DILUYENTE
PROPORCIONADA
Almacenamiento a Temperatura Ambiente
Sin Conservantes Uso Único
Pfizer
Sólo con receta médica
Para Reemplazo de Factor IX
PANEL DE DESPLIEGUE PRINCIPAL – Kit de cartón de 3000 UI
Un frasco para un uso único con una jeringa precargada de diluyente de 5 mL
NDC 58394-637-03
Almacenamiento a temperatura ambiente
Rango de 3000 IU
BeneFix®
Factor de coagulación IX (recombinante)
Almacenamiento a temperatura ambiente
Sin plasma. Sin albúmina.
Para administración intravenosa
Almacene a 2 – 30 ºC (36 – 86 ºF).
Solo para terapia de reemplazo de Factor IX
Reconstituya BeneFix® con la
jeringa estéril precargada adjunta
de 0,234% de cloruro de sodio
para inyección, SOLAMENTE.
Sólo con receta médica
Pfizer