Fabricante de medicamentos: Bioverativ Therapeutics Inc. (Updated: 2024-05-16)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
ALPROLIX® [factor IX de coagulación (recombinante), proteína de fusión Fc], polvo liofilizado para solución para inyección intravenosa.
Aprobación inicial en EE. UU.: 2014
INDICACIONES Y USO
ALPROLIX, Factor IX de coagulación (recombinante), proteína de fusión Fc, es un concentrado de Factor IX derivado de ADN recombinante indicado en adultos y niños con hemofilia B para:
- Tratamiento a demanda y control de episodios hemorrágicos,
- Manejo perioperatorio de la hemorragia,
- Profilaxis de rutina para reducir la frecuencia de episodios hemorrágicos.
Limitación de uso:
ALPROLIX no está indicado para la inducción de tolerancia inmunitaria en pacientes con hemofilia B. (1)
DOSIFICACIÓN Y ADMINISTRACIÓN
Solo para uso intravenoso después de la reconstitución.
Tratamiento a demanda y control de episodios hemorrágicos:
- Cada vial de ALPROLIX contiene la cantidad etiquetada de potencia del Factor IX de coagulación en unidades internacionales (UI). (2.1)
- En promedio, una unidad por kilogramo de peso corporal de ALPROLIX aumentó el nivel circulante de Factor IX aproximadamente un 1% (UI/dL) en adultos y niños ≥6 años de edad y un 0,6% (UI/dL) en niños menores de 6 años de edad. (2.1)
| Dosis inicial: Tipo de hemorragia | FIX circulante objetivo (UI/dL) | Intervalo de dosificación (horas) |
|---|---|---|
| Menor y moderada | 30–60 | Repita cada 48 horas según sea necesario si hay más evidencia de hemorragia. |
| Mayor | 80–100 | Considere una dosis de repetición después de 6–10 horas, luego cada 24 horas durante 3 días, luego cada 48 horas hasta que se logre la curación. |
Manejo perioperatorio:
- Cirugía menor: una sola infusión para alcanzar un nivel de FIX de 50–80 UI/dL puede ser suficiente. Repita según sea necesario después de 24–48 horas hasta que la hemorragia se detenga y se logre la curación. (2.1)
- Cirugía mayor: infusión inicial para alcanzar un nivel de FIX de 60–100 UI/dL. Considere una dosis de repetición después de 6–10 horas y luego cada 24 horas durante los primeros 3 días, luego cada 48 horas hasta que la hemorragia se detenga y se logre la curación. (2.1)
Profilaxis de rutina:
Para adultos y adolescentes ≥12 años de edad, comience con 50 UI/kg una vez por semana o 100 UI/kg una vez cada 10 días. Para niños <12 años de edad, comience con 60 UI/kg una vez por semana. Ajuste el régimen de dosificación según la respuesta individual. Es posible que se necesiten dosis más frecuentes o más altas en niños <12 años de edad. (2.1)
FORMAS Y FUERZAS DE DOSIFICACIÓN
ALPROLIX está disponible como polvo liofilizado en viales de dosis única que contienen nominalmente 250, 500, 1000, 2000, 3000 o 4000 unidades internacionales (UI). (3)
CONTRAINDICACIONES
No lo use en personas que tengan un historial conocido de reacciones de hipersensibilidad, incluida la anafilaxia, al producto o sus excipientes. (4)
ADVERTENCIAS Y PRECAUCIONES
- Se han notificado reacciones de hipersensibilidad, incluida la anafilaxia. Si se presentan síntomas, suspenda ALPROLIX y administre el tratamiento adecuado. (5.1)
- Se han notificado anticuerpos neutralizantes (inhibidores) contra FIX con ALPROLIX. Realice un ensayo que mida la concentración del inhibidor del Factor IX si el nivel plasmático del Factor IX no aumenta como se esperaba o si la hemorragia no se controla con una dosis adecuada. (5.2, 5.4)
- El uso de productos del Factor IX se ha asociado con el desarrollo de complicaciones tromboembólicas. (5.3)
- Se ha notificado síndrome nefrótico después de la inducción de tolerancia inmunitaria con productos que contienen Factor IX en pacientes con hemofilia B con inhibidores del Factor IX y antecedentes de reacciones alérgicas al Factor IX. (5.5)
REACCIONES ADVERSAS
Pacientes previamente tratados (PPT): Las reacciones adversas comunes (incidencia ≥1%) de los ensayos clínicos fueron dolor de cabeza, parestesia oral y uropatía obstructiva. (6)
Pacientes previamente no tratados (PPNT): Las reacciones adversas comunes (incidencia ≥1%) de los ensayos clínicos fueron inhibición del Factor IX, eritema en el sitio de inyección e hipersensibilidad. (6)
Para informar las REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Bioverativ Therapeutics Inc. al 1-855-692-5776 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
USO EN POBLACIONES ESPECÍFICAS
Pediátrico: Es posible que se necesiten dosis más altas por kilogramo de peso corporal o una dosificación más frecuente en pacientes <12 años de edad. (8.4)
Consulte 17 para obtener INFORMACIÓN PARA EL PACIENTE y el etiquetado del paciente aprobado por la FDA.
Revisado: 5/2023
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis
2.2 Reconstitución
2.3 Administración
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de hipersensibilidad
5.2 Anticuerpos neutralizantes
5.3 Complicaciones tromboembólicas
5.4 Monitoreo de pruebas de laboratorio
5.5 Síndrome nefrótico
6 REACCIONES ADVERSAS
6.1 Experiencia en ensayos clínicos
6.2 Experiencia postcomercialización
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso pediátrico
8.5 Uso geriátrico
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad
14 ESTUDIOS CLÍNICOS
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
1 INDICACIONES Y USO
ALPROLIX, Factor IX de la Coagulación (Recombinante), Proteína de Fusión Fc, es un concentrado de Factor IX de la coagulación derivado de ADN recombinante indicado en adultos y niños con hemofilia B (deficiencia congénita de Factor IX) para:
- Tratamiento a demanda y control de episodios de sangrado,
- Manejo perioperatorio del sangrado,
- Profilaxis de rutina para reducir la frecuencia de episodios de sangrado.
Limitación de Uso:
ALPROLIX no está indicado para la inducción de tolerancia inmunitaria en pacientes con hemofilia B.
2 DOSIS Y ADMINISTRACIÓN
Para uso intravenoso únicamente después de la reconstitución
2.1 Dosis
- La dosis y la duración del tratamiento dependen de la gravedad de la deficiencia del factor IX, la ubicación y la extensión de la hemorragia, el perfil farmacocinético del paciente individual y/o el estado clínico del paciente.
- Los pacientes pueden variar en sus respuestas farmacocinéticas (p. ej., vida media, recuperación in vivo) y clínicas. Base la dosis y la frecuencia de ALPROLIX en la respuesta clínica individual.
- Es posible que se necesiten dosis más frecuentes o más altas en niños <12 años, especialmente en niños <6 años [ver Uso en poblaciones específicas (8.4)]. Para pacientes de 12 años o mayores, generalmente no se requiere un ajuste de la dosis en función de la edad.
- Además de la potencia nominal (objetivo), la potencia real del factor IX en unidades internacionales (UI), determinada por el laboratorio de control de calidad en el momento de la liberación del producto, se indica en la etiqueta de cada vial de ALPROLIX. La potencia de ALPROLIX se asigna utilizando un ensayo de coagulación de una etapa in vitro validado, basado en el tiempo de tromboplastina parcial activada (TTPa), calibrado con el estándar internacional de la Organización Mundial de la Salud (OMS) para concentrados de factor IX.
- Las mediciones de la actividad del factor IX en el laboratorio clínico pueden verse afectadas por el tipo de reactivo TTPa o estándar de laboratorio utilizado [ver Advertencias y precauciones (5.4)].
En promedio, una UI de ALPROLIX por kg de peso corporal aumenta el nivel circulante de factor IX en aproximadamente un 1 % (UI/dl) en adultos y niños ≥6 años y en un 0,6 % (UI/dl) en niños menores de 6 años. Calcule la dosis requerida o el aumento máximo esperado in vivo en el nivel de factor IX expresado en UI/dl (o % del normal) utilizando las siguientes fórmulas:
| UI/dl (o % del normal) = (Dosis total [UI]/Peso corporal [kg]) × Recuperación (UI/dl por UI/kg) O Dosis (UI) = Peso corporal (kg) × Aumento deseado del factor IX (UI/dl o % del normal) × Recíproco de recuperación (UI/kg por UI/dl) |
- Considere la posibilidad de determinar la recuperación in vivo del paciente (en UI/dl por UI/kg) antes de una cirugía mayor electiva y verifique que se haya alcanzado el nivel objetivo de factor IX antes de una cirugía mayor y para hemorragias graves.
Tratamiento a demanda y control de episodios hemorrágicos
La dosificación de ALPROLIX para el tratamiento a demanda y el control de episodios hemorrágicos se proporciona en la Tabla 1.
| Tipo de hemorragia | Nivel de factor IX circulante requerido (UI/dl o % del normal) | Intervalo de dosificación (horas) |
|---|---|---|
| Leve y moderada Por ejemplo: Hemartrosis sin complicaciones, músculo superficial (excepto iliopsoas) sin compromiso neurovascular, tejido blando superficial, membranas mucosas |
30–60 | Repita cada 48 horas si hay más evidencia de hemorragia. |
| Grave Por ejemplo: Iliopsoas y músculo profundo con lesión neurovascular o pérdida sanguínea sustancial; faríngea, retrofaríngea, retroperitoneal, SNC |
80–100 | Considere una dosis repetida después de 6 a 10 horas y luego cada 24 horas durante los primeros 3 días. Debido a la larga vida media de ALPROLIX, la dosis puede reducirse y la frecuencia de administración puede extenderse después del día 3 a cada 48 horas o más hasta que la hemorragia se detenga y se logre la curación. |
Manejo perioperatorio de la hemorragia
La dosificación de ALPROLIX para el manejo perioperatorio se proporciona en la Tabla 2.
| Tipo de cirugía | Nivel de factor IX circulante requerido (UI/dl o % del normal) | Intervalo de dosificación (horas) |
|---|---|---|
| Menor (incluida la extracción dental sin complicaciones) |
50–80 | Una sola infusión puede ser suficiente. Repita según sea necesario después de 24 a 48 horas hasta que la hemorragia se detenga y se logre la curación. |
| Mayor | 60–100 (nivel inicial) | Considere una dosis repetida después de 6 a 10 horas y luego cada 24 horas durante los primeros 3 días. Debido a la larga vida media de ALPROLIX, la dosis puede reducirse y la frecuencia de administración en el entorno posquirúrgico puede extenderse después del día 3 a cada 48 horas o más hasta que la hemorragia se detenga y se logre la curación. |
Profilaxis rutinaria
- Los regímenes iniciales recomendados para adultos y adolescentes de 12 años o más son de 50 UI/kg una vez a la semana o 100 UI/kg cada 10 días.
- Para niños menores de 12 años, comenzar con 60 UI/kg una vez a la semana.
- Modificar el régimen de dosificación en función de la respuesta individual. Es posible que los niños menores de 12 años, especialmente los menores de 6 años, necesiten dosis más frecuentes o más altas.
2.2 Reconstitución
- Utilice la técnica aséptica (limpia y libre de gérmenes) y una superficie de trabajo plana durante el procedimiento de reconstitución.
- Permita que el frasco de ALPROLIX, que contiene el polvo liofilizado de color blanco a blanquecino y la jeringa precargada con diluyente alcancen la temperatura ambiente antes de usarse.
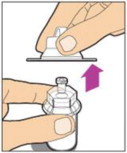
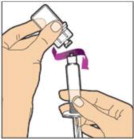
- Retire la tapa de plástico del frasco y limpie el tapón de goma del frasco con una toallita con alcohol. Deje que el tapón de goma se seque.
-
Retire completamente la lámina posterior del paquete del adaptador de frasco despegando la tapa. No retire el adaptador de frasco del paquete ni toque el interior del paquete del adaptador.
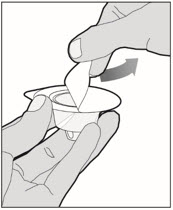
-
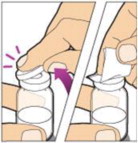
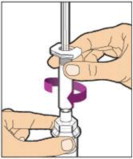
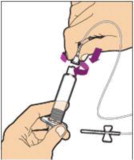
Coloque el frasco en una superficie plana y utilice una mano para sostener el frasco estable. Use la otra mano para colocar el adaptador del frasco sobre él. Coloque la punta del adaptador directamente encima del centro del tapón de goma y presione el adaptador hacia abajo hasta que la punta perfore el centro del tapón del frasco y esté completamente insertado.
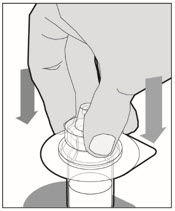
-
Levante la tapa del paquete del adaptador del frasco y deséchela.
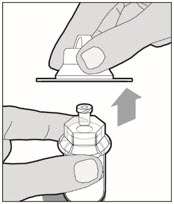
-
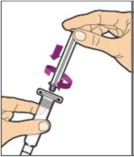
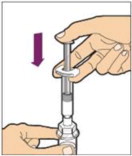
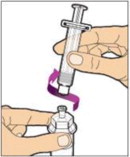
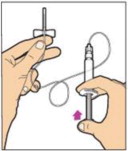
Sujete la varilla del émbolo en el disco circular. Coloque la punta de la varilla del émbolo en el extremo de la jeringa. Gire en sentido horario hasta que esté bien fijada. Sólo utilice la jeringa de diluyente proporcionada en el paquete de ALPROLIX.
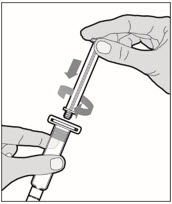
- Con una mano, sostenga la jeringa de diluyente por la parte acanalada directamente debajo de la tapa, con la tapa apuntando hacia arriba. No utilice si la tapa ha sido retirada o no está bien fijada.
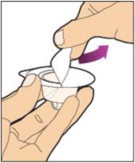
- Con la otra mano, agarre la tapa y doblela en un ángulo de 90° hasta que se rompa. Después de que la tapa se rompa, verá la punta de vidrio de la jeringa. No toque la punta de vidrio de la jeringa ni el interior de la tapa.
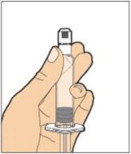
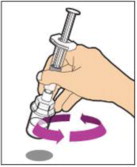
- Con el frasco reposando sobre una superficie plana, inserte la punta de la jeringa en la abertura del adaptador. Gire la jeringa en sentido horario hasta que esté bien fijada al adaptador.
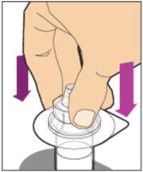
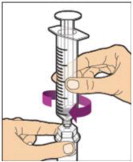
- Inyecte lentamente la varilla del émbolo para introducir todo el diluyente en el frasco. Después de este proceso, la varilla del émbolo puede subir ligeramente. Esto es normal.
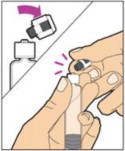
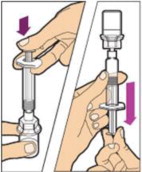
- Con la jeringa todavía conectada al adaptador, agite suavemente el frasco hasta que el producto esté completamente disuelto. La solución final debe ser clara a ligeramente opalescente e incolora. No agite. No utilice ALPROLIX reconstituido si contiene partículas visibles o está turbio.
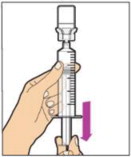
- Asegúrese de que la varilla del émbolo esté completamente presionada. Voltee el frasco boca abajo. Tira lentamente de la varilla del émbolo para introducir la solución en la jeringa. Tenga cuidado de no sacar completamente la varilla del émbolo de la jeringa.
- Utilice ALPROLIX reconstituido tan pronto como sea posible, pero no más tarde de 3 horas después de la reconstitución. Protéjalo de la luz solar directa. No refrigerar después de la reconstitución.
Para combinar dos o más frascos de ALPROLIX, después del paso 12 anterior, siga estos pasos de mezcla:
- Retire la jeringa de diluyente del adaptador del frasco girándola en sentido antihorario hasta que esté completamente desprendida. No desprenda la jeringa de diluyente ni la jeringa de gran tamaño con cierre luer lock hasta que esté listo para unir la jeringa de gran tamaño a la siguiente botella (con el adaptador del frasco unido).
- Deje el adaptador del frasco unido al frasco, ya que se necesita para unir una jeringa de gran tamaño con cierre luer lock.
- Une una jeringa independiente, de gran tamaño con cierre luer lock girando en sentido horario hasta que esté bien en su lugar.
- Tire lentamente de la varilla del émbolo para extraer la solución en la jeringa.
- Repita este procedimiento de mezcla con cada frasco necesario para obtener la dosis requerida. Una vez haya mezclado la dosis requerida, proceda a la administración utilizando la jeringa de gran tamaño con cierre luer lock.
2.3 Administración
Sólo para inyección intravenosa
- Inspeccione visualmente la solución de ALPROLIX reconstituida en busca de partículas y decoloración antes de la administración. No utilice si se observan partículas o decoloración.
- No administre ALPROLIX reconstituido en el mismo tubo o recipiente que otros medicamentos.
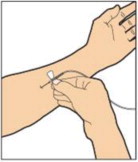
Pasos de administración:
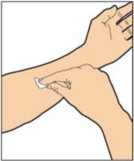
- Adjunte la jeringa al extremo conector del tubo de la vía de perfusión girando en sentido horario hasta que esté bien fijada.
- Presione el émbolo hasta que se elimine todo el aire de la jeringa y el ALPROLIX haya llegado al extremo del tubo de la vía de perfusión. No empuje el ALPROLIX a través de la aguja.
- Retire la tapa protectora de la aguja del tubo de la vía de perfusión.
- Realice la perfusión intravenosa en bolo. La velocidad de administración debe determinarse en función del nivel de comodidad del paciente y no debe ser más rápida de 10 mL por minuto.
Después de inyectar ALPROLIX, retire y elimine adecuadamente el juego de perfusión.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
ALPROLIX está disponible como un polvo liofilizado de color blanco a blanquecino en viales de dosis única que contienen nominalmente (aproximadamente) 250, 500, 1000, 2000, 3000 o 4000 unidades internacionales (UI) de potencia del Factor IX por vial. La potencia real del Factor IX se indica en cada vial de ALPROLIX.
4 CONTRAINDICACIONES
ALPROLIX está contraindicado en individuos que tienen un historial conocido de reacciones de hipersensibilidad, incluyendo anafilaxia, al producto o sus excipientes (sacarosa, manitol, cloruro de sodio, L-histidina y polisorbato 20).
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de hipersensibilidad
Se han notificado reacciones de hipersensibilidad de tipo alérgico, incluida la anafilaxia, con ALPROLIX.
La presencia de inhibidores se ha asociado con reacciones alérgicas con terapias de reemplazo del Factor IX, incluso con ALPROLIX. Evalúe a los pacientes que experimentan reacciones alérgicas para detectar la presencia de un inhibidor. Los signos tempranos de reacciones alérgicas, que pueden progresar a anafilaxia, pueden incluir angioedema, opresión en el pecho, hipotensión, erupción cutánea, náuseas, vómitos, parestesia, inquietud, sibilancias y disnea. Suspenda el uso de ALPROLIX si se presentan síntomas de hipersensibilidad e inicie el tratamiento adecuado.
5.2 Anticuerpos neutralizantes
Se ha notificado la formación de anticuerpos neutralizantes (inhibidores) al Factor IX después de la administración de ALPROLIX. Monitoree a todos los pacientes regularmente para detectar el desarrollo de inhibidores mediante observaciones clínicas y pruebas de laboratorio apropiadas [ver Advertencias y precauciones (5.4)].
Evalúe a los pacientes que experimentan reacciones alérgicas para detectar la presencia de un inhibidor. Observe de cerca a los pacientes para detectar signos y síntomas de reacciones de hipersensibilidad aguda, particularmente durante las primeras fases de exposición al producto.
Las personas con inhibidores del Factor IX pueden tener un mayor riesgo de anafilaxia tras una nueva exposición a ALPROLIX.
5.3 Complicaciones tromboembólicas
El uso de productos del Factor IX se ha asociado con el desarrollo de complicaciones tromboembólicas, especialmente en individuos que reciben infusión continua a través de un catéter venoso central. ALPROLIX debe administrarse como infusión en bolo durante varios minutos [ver Dosificación y administración (2.3)]. La seguridad de la administración de ALPROLIX mediante infusión continua no se ha estudiado.
5.4 Monitoreo de pruebas de laboratorio
- Para confirmar que se han logrado y mantenido niveles adecuados de Factor IX, controle los niveles de Factor IX en el plasma del paciente mediante la realización de un ensayo de coagulación de un solo paso validado [ver Dosificación y administración (2.1)]. Los resultados del Factor IX pueden verse afectados por el tipo de reactivo aPTT utilizado. Se ha demostrado que la medición con un ensayo de coagulación de un solo paso utilizando un reactivo aPTT basado en caolín da como resultado una subestimación de los niveles de Factor IX.
- Controle el desarrollo de inhibidores del Factor IX si no se alcanzan los niveles esperados de Factor IX en el plasma del paciente, o si el sangrado no se controla con la dosis recomendada de ALPROLIX. Realice un ensayo de Bethesda para determinar si hay inhibidores del Factor IX presentes.
5.5 Síndrome nefrótico
Se ha notificado síndrome nefrótico después de intentar la inducción de tolerancia inmunitaria en pacientes con hemofilia B con inhibidores del Factor IX y antecedentes de reacciones alérgicas al Factor IX. La seguridad y eficacia del uso de ALPROLIX para la inducción de tolerancia inmunitaria no se han establecido.
6 REACCIONES ADVERSAS
Las reacciones adversas más comunes (incidencia ≥1%) en pacientes previamente no tratados (PUP) fueron eritema en el sitio de inyección, hipersensibilidad e inhibición del Factor IX [ver Advertencias y precauciones (5.1), (5.2)]. Las reacciones adversas más comunes (incidencia ≥1%) en pacientes previamente tratados (PTP) fueron dolor de cabeza, parestesia oral y uropatía obstructiva.
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y es posible que no reflejen las tasas observadas en la práctica clínica.
Pacientes previamente tratados (PTP)
ALPROLIX se ha evaluado en tres estudios completados (un estudio en adultos y adolescentes, un estudio pediátrico y un estudio de extensión) en pacientes previamente tratados (PTP) con hemofilia B grave a moderadamente grave (≤2% de actividad FIX endógena). De los 153 sujetos tratados, 30 (20%) fueron niños (de 1 a 11 años de edad), 11 (7%) fueron adolescentes (de 12 a 17 años de edad) y 112 (73%) fueron adultos (de 18 a 71 años de edad). Hubo 126 sujetos (82.4%) tratados durante al menos 52 semanas, 107 sujetos (69.9%) durante al menos 104 semanas y 67 (43.8%) tratados durante al menos 208 semanas. El número total de días de exposición (ED) fue de 26,106 con una mediana de 165 (rango 1–528) ED por sujeto. Los eventos adversos se monitorearon durante un total de 561 años-sujeto.
Se informaron reacciones adversas (AR) en 14 de 153 (9.2%) sujetos tratados con ALPROLIX. Se resumen en la Tabla 3.
Ningún sujeto fue retirado de los ensayos debido a una reacción adversa. En estos ensayos de PTP, no se detectaron inhibidores y no se informaron eventos de anafilaxia o tromboembolismo vascular.
| Clase de órgano del sistema | Reacciones adversas | Número de sujetos (%) N=153* |
|---|---|---|
| Trastornos del sistema nervioso | Dolor de cabeza Mareos Disgeusia |
2 (1.3) 1 (0.7) 1 (0.7) |
| Trastornos gastrointestinales | Parestesia oral Olor a aliento |
2 (1.3) 1 (0.7) |
| Trastornos generales y condiciones del sitio de administración | Fatiga Dolor en el sitio de infusión |
1 (0.7) 1 (0.7) |
| Trastornos cardíacos | Palpitaciones | 1 (0.7) |
| Trastornos renales y urinarios | Uropatía obstructiva† | 2 (1.3) |
| Hematuria | 1 (0.7) | |
| Cólico renal | 1 (0.7) | |
| Trastornos vasculares | Hipotensión | 1 (0.7) |
| Trastornos del metabolismo y la nutrición | Disminución del apetito | 1 (0.7) |
Pacientes previamente no tratados (PUP)
La seguridad de ALPROLIX también se evaluó en un estudio completado (estudio PUP) en 33 sujetos con hemofilia B (≤2% de actividad FIX endógena). En general, el número mediano de semanas de tratamiento fue de 83.01 (rango: 6.7–226.7 semanas). El número de sujetos con al menos 10 ED fue de 28 (84.8%), al menos 20 ED fue de 26 (78.8%) y al menos 50 ED fue de 21 (63.6%). El número mediano de ED fue de 76 (rango: 1–137) por sujeto.
Los eventos adversos se monitorearon durante un total de 57.51 años-sujeto. Se informaron reacciones adversas a los medicamentos en 2 de 33 (6.1%) sujetos tratados con ALPROLIX. Un sujeto (3.0%) en el estudio PUP desarrolló el SAE de inhibición del Factor IX y el mismo sujeto (3.0%) desarrolló hipersensibilidad. Un sujeto adicional (3.0%) en el estudio PUP desarrolló eritema en el sitio de inyección.
Inmunogenicidad
Los sujetos de los ensayos clínicos se monitorearon para detectar anticuerpos neutralizantes contra el Factor IX, y no se detectaron inhibidores en los PTP durante el estudio. De 33 PUP, un total de 1 sujeto (3.0%) desarrolló un inhibidor del Factor IX neutralizante de bajo título.
La detección de anticuerpos que son reactivos al Factor IX depende en gran medida de muchos factores, incluida la sensibilidad y especificidad del ensayo, la metodología del ensayo, el manejo de la muestra, el momento de la recolección de la muestra, los medicamentos concomitantes y la enfermedad subyacente. Por lo tanto, puede ser engañoso comparar la incidencia de anticuerpos a ALPROLIX con la incidencia de anticuerpos a otros productos.
6.2 Experiencia postcomercialización
Las siguientes reacciones adversas se han identificado durante el uso posterior a la aprobación de ALPROLIX. Debido a que estas reacciones se informan voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos de la sangre y del sistema linfático: desarrollo de inhibidores del Factor IX
Trastornos del sistema inmunitario: hipersensibilidad, incluida la anafilaxia
Para obtener información adicional, consulte las Advertencias y precauciones 5.1 y 5.2.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgos
No hay estudios sobre el uso de ALPROLIX en mujeres embarazadas que permitan informar sobre un riesgo asociado al fármaco.
El riesgo de fondo de defectos de nacimiento mayores y aborto espontáneo para la población indicada es desconocido; sin embargo, el riesgo de fondo en la población general de EE. UU. de defectos de nacimiento mayores es del 2% al 4% y de aborto espontáneo del 15% al 20% de los embarazos clínicamente reconocidos.
No se han realizado estudios de toxicidad reproductiva y del desarrollo en animales con ALPROLIX. En un estudio de transferencia placentaria, ALPROLIX se detectó en muestras de sangre fetal de ratón a aproximadamente el 2,6% de los niveles de sangre materna (rango, 1,7% a 3,3%), de 3 a 4 horas después de la administración a ratones preñados con 3,3 a 6,6 veces la dosis clínica de 50 a 100 UI/kg de ALPROLIX [ver Datos].
Se desconoce si ALPROLIX puede causar daño fetal cuando se administra a una mujer embarazada o puede afectar la capacidad reproductiva. Si ALPROLIX es claramente necesario para tratar a una mujer embarazada, informe al paciente que se desconocen los riesgos para la madre y para el feto.
Datos
Datos en animales
Ratones preñados, genéticamente modificados, deficientes en FIX (ratones HemB) fueron inyectados por vía intravenosa con una sola dosis de 330 UI/kg de ALPROLIX al final del embarazo en el Día de Gestación 18, o con dosis repetidas de 330 UI/kg de ALPROLIX en los Días de Gestación 18 y 20. Se tomaron muestras de sangre de los ratones madres y los fetos después de la administración, y se midió la actividad del FIX en el plasma materno y fetal utilizando un ensayo cromogénico del FIX. Después de la administración de ALPROLIX a ratones HemB preñados, la actividad del FIX en la sangre fetal fue aproximadamente del 2,6% de los niveles de sangre materna, lo que sugiere que la transferencia placentaria de ALPROLIX puede ocurrir en pacientes mujeres embarazadas. La relevancia de estos datos para los humanos es desconocida.
8.2 Lactancia
Resumen de Riesgos
Se desconoce si ALPROLIX se excreta en la leche materna. No hay datos disponibles para evaluar los efectos de ALPROLIX en la producción de leche o en el niño amamantado.
Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de ALPROLIX y cualquier posible efecto adverso en el niño amamantado por ALPROLIX o por la condición materna subyacente.
8.4 Uso pediátrico
La seguridad, eficacia y farmacocinética de ALPROLIX se han evaluado en pacientes previamente tratados (PTPs) del estudio en adultos y adolescentes (de 12 a <17 años de edad) y del estudio pediátrico (de 1 a 11 años de edad) [ver Reacciones adversas (6), Experiencia en ensayos clínicos (6.1), Farmacología clínica (12.3) y Estudios clínicos (14)]. La seguridad de ALPROLIX se ha evaluado en pacientes previamente no tratados (PUPs) menores de 18 años de edad (mediana: 0,6 años; rango: 0,08-2 años) en el estudio PUPs [ver Reacciones adversas (6), Experiencia en ensayos clínicos (6.1) y Farmacología clínica (12.3)].
No se requiere ajuste de dosis para adolescentes. Los niños menores de 12 años pueden tener un aclaramiento de Factor IX ajustado al peso corporal más alto y una recuperación más baja. Es posible que se necesiten dosis más frecuentes o más altas en niños menores de 12 años. Al calcular las dosis máximas objetivo para el tratamiento de hemorragias o cirugía, utilice el valor medio de recuperación in vivo de 0,6 UI/dL por UI/kg, o la recuperación in vivo determinada individualmente, para niños menores de 6 años [ver Farmacología clínica (12.3)].
8.5 Uso geriátrico
Los estudios clínicos de ALPROLIX no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes.
11 DESCRIPCIÓN
ALPROLIX es un polvo liofilizado estéril, no pirogénico, sin conservantes, de color blanco a blanquecino, para reconstitución con el diluyente para inyección intravenosa. Después de la reconstitución, la solución tiene un aspecto transparente a ligeramente opalescente y contiene los excipientes sacarosa, manitol, cloruro de sodio, L-histidina y polisorbato 20. ALPROLIX está disponible en viales de dosis única que contienen nominalmente (aproximadamente) 250 UI, 500 UI, 1000 UI, 2000 UI, 3000 UI o 4000 UI de Factor IX recombinante. La potencia real determinada por el laboratorio de control de calidad en el lanzamiento del producto se indica directamente en la etiqueta de cada vial.
El Factor IX de coagulación (recombinante), proteína de fusión Fc (rFIXFc), el ingrediente activo de ALPROLIX, es una proteína de fusión del Factor IX de coagulación recombinante que consiste en la secuencia del Factor IX de coagulación humano unida covalentemente al dominio Fc de la inmunoglobulina G humana1 (IgG1). La porción del Factor IX de rFIXFc tiene una secuencia de aminoácidos primaria que es idéntica a la forma alélica Thr148 del Factor IX derivado del plasma y tiene propiedades estructurales y funcionales similares al Factor IX endógeno. El dominio Fc de rFIXFc contiene las regiones bisagra, CH2 y CH3 de IgG1. rFIXFc contiene 867 aminoácidos con un peso molecular de aproximadamente 98 kilodaltons.
ALPROLIX no se deriva de sangre humana y no contiene conservantes. La proteína de fusión Factor IX Fc recombinante se expresa en una línea celular de riñón embrionario humano (HEK), que produce rFIXFc en un medio de cultivo celular definido que no contiene proteínas derivadas de fuentes animales o humanas. El proceso de purificación de rFIXFc no incluye el uso de un reactivo de anticuerpo monoclonal. Para mejorar la seguridad viral, el proceso de producción también incorpora dos pasos dedicados de eliminación viral: un paso de tratamiento con detergente para la inactivación y un paso de filtración de 15 nm para la eliminación de virus. El contenido de proteína de fusión Factor IX Fc activada (FIXaFc) está limitado a ≤0,035 por ciento molar FIXaFc/FIXFc.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
ALPROLIX es una proteína de fusión recombinante que reemplaza temporalmente el Factor IX de coagulación faltante necesario para una hemostasia efectiva. ALPROLIX contiene la región Fc de la IgG1 humana, que se une al receptor Fc neonatal (FcRn). El FcRn es parte de una vía natural que retrasa la degradación lisosomal de las inmunoglobulinas al devolverlas a la circulación y prolongar su vida media plasmática.
12.2 Farmacodinamia
La hemofilia B es un trastorno hemorrágico caracterizado por una deficiencia del Factor IX de coagulación funcional (FIX), que conduce a un tiempo de coagulación prolongado en el ensayo de tiempo de tromboplastina parcial activada (aPTT), una prueba in vitro establecida para la actividad biológica del Factor IX. El tratamiento con ALPROLIX acorta el aPTT durante el período de dosificación efectivo.
12.3 Farmacocinética
Los parámetros farmacocinéticos (PK) para ALPROLIX se calcularon con base en la actividad del FIX plasmático medida mediante el ensayo de coagulación de una etapa.
Adultos (≥18 años)
La farmacocinética (PK) de ALPROLIX (rFIXFc) se evaluó en 22 adultos (≥18 años de edad) después de una infusión intravenosa de 10 minutos de una dosis única de 50 UI/kg. Se tomaron muestras de sangre para el análisis farmacocinético antes de la dosificación y hasta 240 horas (10 días) después de la dosificación con 50 UI/kg. Además, se evaluó la farmacocinética en 27 pacientes que recibieron la dosis de 100 UI/kg (Tabla 4). Se tomaron muestras de sangre hasta 336 horas después de la dosificación. La Tabla 4 presenta los parámetros farmacocinéticos en adultos. La farmacocinética de ALPROLIX después de una dosis única y dosis repetidas (en la semana 26) fue similar.
| Parámetros farmacocinéticos | ALPROLIX (50 UI/kg) (N=22) |
ALPROLIX (100 UI/kg) (N=24) |
|---|---|---|
| Abreviaturas: CV = coeficiente de variación; IR = recuperación incremental; AUCinf = área bajo la curva de tiempo de actividad del FIX hasta el infinito; T1/2 terminal = vida media de eliminación de la fase terminal; MRT = tiempo medio de residencia; CL = aclaramiento ajustado al peso corporal; Vss = volumen de distribución ajustado al peso corporal en estado estacionario; Tiempo hasta el 1 % de actividad del FIX = tiempo estimado en días después de la dosis cuando la actividad del FIX ha disminuido a aproximadamente 1 UI/dl por encima del valor inicial | ||
| Cmáx (UI/dl) | 46 (68 %) | 101 (20 %) |
| AUCinf (h*UI/dl) | 1619 (26 %) | 3964 (19 %) |
| CL (ml/h/kg) | 3.3 (28 %) | 2.6 (23 %) |
| Vss (ml/kg) | 327 (28 %) | 236 (24 %) |
| T1/2 terminal (h) | 86 (37 %) | 97 (35 %) |
| MRT (h) | 102 (30 %) | 91 (23 %) |
| IR (UI/dl por UI/kg) | 1.02 (59 %) | 1.12 (22 %) |
| Tiempo hasta el 1 % de actividad del FIX (d) | 12 (24 %) | 16 (20 %) |
Adolescentes (de 12 a 17 años)
Se evaluaron los parámetros farmacocinéticos después de una infusión intravenosa de 10 minutos en 11 adolescentes evaluables (de 12 a 17 años de edad) que recibieron una dosis única de 50 UI/kg o 100 UI/kg de ALPROLIX. Se tomaron muestras de sangre antes de la administración y en múltiples puntos de tiempo hasta 336 horas (14 días) después de la administración. Los parámetros farmacocinéticos de ALPROLIX en adolescentes se resumen en la Tabla 5. La farmacocinética de ALPROLIX en adolescentes es comparable a la de los adultos.
Pediatría (de 2 a 10 años)
En el estudio pediátrico, se evaluaron los parámetros farmacocinéticos después de una infusión intravenosa de 10 minutos en 24 niños evaluables (de 2 a 10 años de edad) que recibieron una dosis única de 50 UI/kg de ALPROLIX. Se tomaron muestras farmacocinéticas antes de la administración y en múltiples puntos de tiempo hasta 168 horas (7 días) después de la administración.
La Tabla 5 presenta los parámetros farmacocinéticos en adolescentes y niños. En comparación con los adultos, la recuperación incremental fue menor y el aclaramiento ajustado al peso corporal fue mayor en niños menores de 12 años, particularmente en niños menores de 6 años. La recuperación incremental en niños de 2 a 4 años y de 6 a 10 años fue menor en un 41 % y un 27 %, respectivamente. En comparación con los adultos, el aclaramiento ajustado al peso corporal en niños de 2 a 4 años y de 6 a 10 años fue mayor en un 36 % y un 11 %, respectivamente. Esto puede resultar en la necesidad de ajustes de dosis e/o intervalo por kg de peso corporal en niños menores de 12 años [ver Uso en poblaciones específicas (8.4)].
| Parámetros farmacocinéticos | <6 años (rango: 2 a 4 años) (N=11, 50 UI/kg) |
6 a <12 años (rango: 6 a 10 años) (N=13, 50 UI/kg) |
12 a 17 años (N=8, 50 UI/kg) |
12 a 17 años (N=3, 100 UI/kg) |
|---|---|---|---|---|
|
Abreviaturas: CV = Coeficiente de variación; IR = recuperación incremental; AUCinf = área bajo la curva de tiempo de actividad del FIX hasta el infinito; T ½ terminal = vida media de eliminación de la fase terminal; MRT = tiempo medio de residencia; CL = aclaramiento ajustado al peso corporal; Vss = volumen de distribución ajustado al peso corporal en estado estacionario |
||||
| Cmax (UI/dL) | 30 (19%) | 37 (29%) | 43 (44%) | 96 (9%) |
| IR (UI/dL por UI/kg) | 0.60 (20%) | 0.74 (29%) | 0.87 (44%) | 0.96 (10%) |
| AUCinf (h*UI/dL) | 1169 (15%) | 1471 (27%) | 1439 (24%) | 3420 (13%) |
| Terminal T½ (h) | 68 (24%) | 72 (23%) | 80 (15%) | 94 (24%) |
| MRT (h) | 86 (23%) | 84 (19%) | 95 (17%) | 95 (29%) |
| CL (mL/h/kg) | 4.4 (17%) | 3.6 (25%) | 3.7 (26%) | 3.0 (12%) |
| Vss (mL/kg) | 373 (23%) | 302 (29%) | 345 (24%) | 275 (20%) |
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogenesis, Mutagenesis, Impairment of Fertility
No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico de ALPROLIX, ni estudios para determinar los efectos de ALPROLIX sobre la genotoxicidad o la fertilidad. Se completó una evaluación del potencial carcinogénico de ALPROLIX y no se ha identificado ningún riesgo carcinogénico por el uso del producto.
14 ESTUDIOS CLÍNICOS
La seguridad y eficacia de ALPROLIX se evaluó en un estudio multicéntrico, prospectivo, abierto en pacientes previamente tratados (PPT): pacientes adultos y adolescentes de 12 a 71 años de edad y un estudio en pacientes pediátricos de 1 a 11 años de edad.
Estudio en adultos y adolescentes (12 a 71 años)
El estudio no aleatorizado en adultos y adolescentes comparó cada uno de los dos regímenes de tratamiento profiláctico (intervalo fijo semanal e individualizado) con el tratamiento episódico (a demanda); determinó la eficacia hemostática en el tratamiento de episodios hemorrágicos; y determinó la eficacia hemostática durante el manejo perioperatorio de los sujetos sometidos a procedimientos quirúrgicos mayores. Un total de 123 pacientes previamente tratados (PPT) con hemofilia B grave a moderadamente grave (≤2% de actividad FIX endógena) fueron seguidos durante un máximo de 77 semanas. Los sujetos que estaban en profilaxis antes del estudio fueron asignados a uno de los brazos de profilaxis. Los sujetos que estaban tratando a demanda antes del estudio fueron asignados a uno de los dos brazos de profilaxis o al brazo de tratamiento a demanda. Las asignaciones de los brazos de tratamiento se basaron en el estándar de atención y la discusión entre el investigador y el sujeto.
Sesenta y tres sujetos en el brazo de intervalo fijo semanal recibieron ALPROLIX para la profilaxis de rutina comenzando con una dosis inicial de 50 UI/kg. La dosis se ajustó para mantener el nivel mínimo de FIX entre 1% y 3% por encima del nivel basal o más alto, según lo indicado clínicamente para prevenir el sangrado. Cincuenta sujetos (79%) requirieron al menos un ajuste de dosis y el número mediano de ajustes de dosis fue uno. La dosis mediana general en el estudio fue de 45,2 UI/kg (rango intercuartílico: 38,1, 53,7). La dosis semanal mediana durante los últimos 6 meses en el estudio en 58 sujetos que estuvieron en el estudio durante al menos 9 meses fue de 40,7 UI/kg (rango intercuartílico: 32,3, 54,1).
Veintinueve sujetos en el brazo de intervalo individualizado recibieron inicialmente ALPROLIX para la profilaxis de rutina a una dosis de 100 UI/kg cada 10 días, con el intervalo ajustado para mantener el nivel mínimo de FIX entre 1% y 3% por encima del nivel basal o más alto, según lo indicado clínicamente para prevenir el sangrado. El intervalo mediano general en el estudio fue de 12,5 días (rango intercuartílico: 10,4, 13,4). El intervalo mediano durante los últimos 6 meses en 26 sujetos que estuvieron en el estudio durante al menos 9 meses fue de 13,8 días (rango intercuartílico: 10,5, 14,0).
Veintisiete sujetos recibieron ALPROLIX según fuera necesario para el tratamiento de episodios hemorrágicos en el brazo de tratamiento episódico (a demanda).
Doce sujetos recibieron ALPROLIX para el manejo perioperatorio en 14 procedimientos quirúrgicos mayores. La cirugía mayor se definió como cualquier procedimiento quirúrgico con o sin anestesia general en el que se penetró y expuso una cavidad corporal mayor, o se produjo un deterioro sustancial de las funciones físicas o fisiológicas. Cuatro sujetos en este brazo no participaron en los otros brazos.
Estudio pediátrico (1 a 11 años)
El estudio pediátrico reclutó un total de 30 pacientes pediátricos masculinos previamente tratados con hemofilia B grave a moderadamente grave (≤2% de actividad FIX endógena). Los sujetos tenían menos de 12 años de edad (15 tenían de 1 a 5 años de edad y 15 tenían de 6 a 11 años de edad). Todos los sujetos recibieron tratamiento con ALPROLIX y fueron seguidos durante un máximo de 52 semanas.
Los 30 sujetos fueron tratados con ALPROLIX en un régimen de dosis profiláctica individualizado comenzando con 50–60 UI/kg cada 7 días, con ajuste de la dosis a un máximo de 100 UI/kg y el intervalo de dosificación ajustado entre una y dos veces por semana. El intervalo de dosificación mediano fue de 7,0 días (rango intercuartílico: 6,9 a 7,0) sin diferencia entre los grupos de edad. La dosis semanal promedio mediana de ALPROLIX fue de 59,4 UI/kg y (rango intercuartílico: 53,0 a 64,8) para los sujetos de 1 a 5 años de edad y 57,8 UI/kg (rango intercuartílico: 51,7 a 65,0) para los sujetos de 6 a 11 años de edad. Al final del ensayo, la dosis profiláctica semanal mediana prescrita fue de 60 UI/kg en ambos subgrupos de edad pediátrica (rango: 40 a 70 UI/kg).
Tratamiento a demanda y control de episodios hemorrágicos
Estudio en adultos y adolescentes (12 a 71 años)
Se observaron un total de 636 eventos hemorrágicos en 114 sujetos en los brazos de profilaxis de intervalo fijo semanal, profilaxis de intervalo individualizado y episódico (a demanda). La dosis total mediana para tratar un episodio hemorrágico fue de 47,0 UI/kg (rango intercuartílico: 33,3, 62,5). Los sujetos registraron la evaluación de la respuesta a cada inyección a las 8–12 horas después del tratamiento. La eficacia en el control de los episodios hemorrágicos se resume en la Tabla 6.
| Episodios hemorrágicos | (N=636) |
|---|---|
| Número de inyecciones para tratar episodios hemorrágicos | |
|
|
| 1 inyección | 575 (90,4%) |
| 2 inyecciones | 44 (6,9%) |
| 3 inyecciones | 17 (2,7%) |
| Respuesta a la primera inyección* | (N=613) |
| Excelente o bueno | 513 (83,7%) |
| Moderado | 90 (14,7%) |
| Ninguno | 10 (1,6%) |
Estudio pediátrico (1 a 11 años)
Se observaron un total de 60 eventos hemorrágicos en 20 sujetos durante el estudio. La dosis total mediana para tratar un episodio hemorrágico fue de 68,2 UI/kg (rango intercuartílico: 50,9, 126,2). Los sujetos registraron la evaluación de la respuesta a cada inyección de 8 a 12 horas después del tratamiento. La eficacia en el control de los episodios hemorrágicos se resume en la Tabla 7.
| 1 a 5 años | 6 a 11 años | Total (1 a 11 años) |
|
|---|---|---|---|
| Episodios hemorrágicos | (N=22) | (N=38) | (N=60) |
| Número de inyecciones para tratar los episodios hemorrágicos | |||
|
|||
| 1 inyección | 19 (86,4%) | 26 (68,4%) | 45 (75,0%) |
| 2 inyecciones | 2 (9,1 %) | 8 (21,1%) | 10 (16,7%) |
| 3 inyecciones | 1 (4,5%) | 4 (10,5%) | 5 (8,3%) |
| Respuesta a la primera inyección* | (N=53) | ||
| Excelente o bueno | 47 (88,7%) | ||
| Moderado | 5 (9,4%) | ||
| Ninguno | 1 (1,9%) | ||
Manejo Perioperatorio
Se realizaron 35 procedimientos quirúrgicos mayores en 22 sujetos (rango de edad: 10–63 años) en el estudio de adultos y adolescentes y en el estudio de extensión. De las 35 cirugías mayores, 28 cirugías (80.0%) requirieron una sola dosis perioperatoria para mantener la hemostasia durante la cirugía. La dosis promedio mediana por inyección para mantener la hemostasia durante la cirugía fue de 94.7 UI/kg (rango: 49 a 152). El reemplazo perioperatorio del Factor IX con ALPROLIX fue solo por infusión en bolo. La seguridad de la infusión continua no se evaluó.
La hemostasia fue evaluada por el investigador después de la cirugía. La evaluación de la respuesta hemostática intraoperatoria y posoperatoria para cirugías mayores en el estudio de adultos y adolescentes y el estudio de extensión en curso se resumen en la Tabla 8.
| Respuesta | |||||
|---|---|---|---|---|---|
| Cirugía Mayor | Número de Procedimientos (Número de Sujetos)* |
Excelente | Bueno | Regular | Pobre/Ninguna |
| Ablación de Lesión Hepática | 1 (1) | 1 | |||
| Artroscopia | 2 (2) | 2 | |||
| Cierre de Fístula Rectal | 1 (1) | 1 | |||
| Craneotomía† | 1 (1) | 1 | |||
| Absceso Dental | 1 (1) | 1 | |||
| Amputación de Dedo o Amputación Parcial | 2 (1) | 2 | |||
| Reemplazo o Reparación de Cadera | 2 (2) | 1 | 1 | ||
| Instalación o Retiro de Fijación Externa de Ilizarov | 2 (1) | 2 | |||
| Trasplante de Hígado | 1 (1) | 1 | |||
| Resección Hepática | 1 (1) | 1 | |||
| Orquidectomía | 1 (1) | 1 | |||
| Ablación Percutánea de Carcinoma Hepático | 1 (1) | 1 | |||
| Repavimentación Patelar | 1 (1) | 1 | |||
| Quiste Pilonidal | 1 (1) | 1 | |||
| Liberación de Pin | 1 (1) | 1 | |||
| Cirugía Espinal | 1 (1) | 1 | |||
| Transferencia de Tendón en Brazo Derecho | 1 (1) | 1 | |||
| Tonsillectomy | 1 (1) | 1 | |||
| Fusión de tobillo unilateral | 2 (2) | 2 | |||
| Reemplazo o revisión de tobillo unilateral | 1 (1) | 1 | |||
| Reemplazo o revisión de rodilla unilateral | 8 (8) | 6 | 2 | ||
Hubo 62 procedimientos quirúrgicos menores adicionales en 37 sujetos en el estudio de adultos y adolescentes, el estudio pediátrico y el estudio de extensión. La respuesta hemostática se evaluó para 38 cirugías menores; 36 cirugías menores se calificaron como excelentes o buenas y 2 como regulares.
Profilaxis de rutina
Estudio de adultos y adolescentes (12 a 71 años)
Usando un modelo binomial negativo, se observó una reducción en la tasa de sangrado anualizada (ABR) del 83% (76%–89%) para los sujetos en el brazo de intervalo semanal fijo y una reducción del 87% (80%–92%) para los sujetos en el brazo de intervalo individualizado en comparación con el brazo de tratamiento episódico (a demanda).
La duración media del tratamiento en el estudio fue de 51,4 semanas (rango <1–77). Una comparación de las ABR en los sujetos evaluables para la eficacia se resume en la Tabla 9.
| Episodios de sangrado | Profilaxis Intervalo Semanal Fijo (N=61) | Profilaxis Intervalo Individualizado (N=26) | Episódico (A Demanda) (N=27) |
|---|---|---|---|
|
|||
| ABR general (IQR)* |
2.95 (1.01, 4.35) |
1.38 (0.00, 3.43) |
17.69 (10.77, 23.24) |
| ABR espontánea (IQR)* | 1.04 (0.00, 2.19) |
0.88 (0.00, 2.30) |
11.78 (2.62, 19.78) |
| ABR conjunta (IQR)* |
1.11 (0.00, 4.01) |
0.36 (0.00, 3.24) |
13.58 (6.13, 21.61) |
Estudio pediátrico (1 a 11 años)
La duración media del tratamiento en el estudio fue de 49,4 semanas (rango 12–52). Una comparación de las ABR medianas en los sujetos pediátricos evaluables para la eficacia se resume en la Tabla 10.
| Episodios de sangrado | 1 a 5 Años (N=15) |
6 a 11 Años (N=15) |
Total (<12 Años) (N=30) |
|---|---|---|---|
|
|||
| ABR general (IQR)* |
1.09 (0.00, 2.90) |
2.13 (0.00, 4.17) |
1.97 (0.00, 3.13) |
| ABR espontánea (IQR)* |
0.00 (0.00, 1.09) |
0.00 (0.00, 2.09) |
0.00 (0.00, 1.16) |
| ABR conjunta (IQR)* |
0.00 (0.00, 0.00) |
1.06 (0.00, 2.09) |
0.00 (0.00, 1.12) |
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Presentación
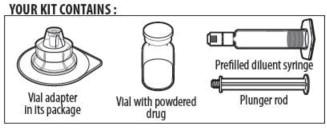
ALPROLIX se suministra como un kit que comprende:
- un vial de vidrio de dosis única que contiene polvo de rFIXFc,
- una jeringa precargada que contiene 5 mL de diluyente y está sellada con un tapón de émbolo y una tapa de punta, y
- un adaptador de vial estéril (dispositivo de reconstitución).
ALPROLIX está disponible en potencias de dosis nominales (aproximadas) de 250 UI, 500 UI, 1000 UI, 2000 UI, 3000 UI o 4000 UI. La potencia real del Factor IX, expresada en UI, se indica en cada vial de rFIXFc y en la etiqueta de la caja. No fabricado con látex de caucho natural.
| Potencia Nominal (Aproximada) | Código de Color de la Potencia | Número de Kit NDC |
|---|---|---|
| 250 UI | Amarillo | 71104-966-01 |
| 500 UI | Azul | 71104-911-01 |
| 1000 UI | Verde | 71104-922-01 |
| 2000 UI | Rojo | 71104-933-01 |
| 3000 UI | Gris | 71104-944-01 |
| 4000 UI | Naranja | 71104-977-01 |
Almacenamiento y manipulación
- Almacenar ALPROLIX en el envase original para protegerlo de la luz.
- Almacenar ALPROLIX a 2°C a 8°C (36°F a 46°F). No congelar. La congelación dañará la jeringa precargada con diluyente.
- ALPROLIX se puede almacenar a temperatura ambiente, no superior a 30°C (86°F), durante un período único de hasta 6 meses dentro de la fecha de caducidad impresa en la caja y la etiqueta del vial. Si se almacena a temperatura ambiente, registre la fecha en la caja cuando el producto se retiró de la refrigeración. Utilice el producto antes del final de este período de 6 meses o deséchelo. No vuelva a colocar el producto en refrigeración después de calentarlo a temperatura ambiente. La vida útil entonces expira después del almacenamiento a temperatura ambiente durante 6 meses, o después de la fecha de caducidad en el vial del producto, lo que ocurra primero.
- No utilice el producto o el diluyente después de la fecha de caducidad impresa en la caja, el vial o la jeringa.
- El producto reconstituido se puede almacenar a temperatura ambiente, no superior a 30°C (86°F) durante no más de 3 horas. Proteger de la luz solar directa. Deseche cualquier producto que no se haya utilizado dentro de las 3 horas posteriores a la reconstitución.
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente que:
- Lea el etiquetado del paciente aprobado por la FDA (Información para el paciente e Instrucciones de uso).
- Informe a su médico o proveedor de atención médica sobre cualquier reacción adversa o problema que ocurra después de la administración de ALPROLIX.
- Se ponga en contacto con su proveedor de atención médica o centro de tratamiento para recibir tratamiento y/o evaluación adicionales si experimenta una falta de respuesta clínica al tratamiento con Factor IX, ya que esto puede indicar el desarrollo de un inhibidor [ver Advertencias y precauciones (5.2)].
- Deje de usar el producto y póngase en contacto con su proveedor de atención médica si se presentan signos tempranos de reacciones de hipersensibilidad (incluidas urticaria, opresión en el pecho, sibilancias, dificultad para respirar e hinchazón de la cara) y anafilaxia. [ver Advertencias y precauciones (5.1)].
- Se ponga en contacto con su proveedor de atención médica o busque atención médica de emergencia inmediatamente si se produce un evento trombótico/tromboembólico [ver Advertencias y precauciones (5.3)].
Fabricado por:
Bioverativ Therapeutics Inc.
Waltham, MA 02451
A SANOFI COMPANY
Número de licencia de EE. UU. 2078
©2023 Bioverativ Therapeutics Inc. Todos los derechos reservados.
Para obtener información sobre patentes: https://www.sanofi.us/en/products-and-resources/patents
INSERTO PARA EL PACIENTE
Información para el paciente
ALPROLIX® /all’ prō liks /
[Factor de coagulación IX (recombinante), proteína de fusión Fc]
Lea atentamente esta Información para el paciente antes de usar ALPROLIX y cada vez que renueve su receta, ya que puede haber nueva información. Esta Información para el paciente no sustituye la conversación con su proveedor de atención médica sobre su afección médica o su tratamiento.
¿Qué es ALPROLIX?
ALPROLIX es un medicamento inyectable que se usa para ayudar a controlar y prevenir el sangrado en personas con hemofilia B. La hemofilia B también se denomina deficiencia congénita del factor IX.
Su proveedor de atención médica puede administrarle ALPROLIX cuando se someta a una cirugía.
¿Quiénes no deben usar ALPROLIX?
No debe usar ALPROLIX si es alérgico a ALPROLIX o a alguno de los demás ingredientes de ALPROLIX. Informe a su proveedor de atención médica si ha tenido una reacción alérgica a cualquier producto del factor IX antes de usar ALPROLIX.
¿Qué debo decirle a mi proveedor de atención médica antes de usar ALPROLIX?
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos todos los medicamentos recetados y de venta libre, como medicamentos de venta libre, suplementos o medicamentos a base de hierbas.
Informe a su médico sobre todas sus afecciones médicas, incluso si:
- está embarazada o planea quedar embarazada. Se desconoce si ALPROLIX puede dañar al feto.
- está amamantando. Se desconoce si ALPROLIX pasa a la leche materna o si puede dañar a su bebé.
- le han dicho que tiene inhibidores del factor IX (porque ALPROLIX puede no funcionar para usted).
¿Cómo debo usar ALPROLIX?
ALPROLIX debe administrarse según las indicaciones de su proveedor de atención médica. Su proveedor de atención médica debe capacitarlo sobre cómo administrar las infusiones. Muchas personas con hemofilia B aprenden a infundirse ALPROLIX por sí mismas o con la ayuda de un familiar.
Consulte las Instrucciones de uso para obtener instrucciones sobre cómo infundir ALPROLIX. Los pasos de las Instrucciones de uso son pautas generales para el uso de ALPROLIX. Siga siempre las instrucciones específicas de su proveedor de atención médica. Si no está seguro del procedimiento, consulte a su proveedor de atención médica. No use ALPROLIX como infusión intravenosa continua.
Comuníquese con su proveedor de atención médica de inmediato si el sangrado no se controla después de usar ALPROLIX.
¿Cuáles son los posibles efectos secundarios de ALPROLIX?
Los efectos secundarios comunes de ALPROLIX incluyen dolor de cabeza, sensación anormal en la boca y dolor en el costado con sangre en la orina, lo que puede ser un signo de formación de coágulos en el sistema colector urinario.
Pueden producirse reacciones alérgicas. Llame a su proveedor de atención médica u obtenga tratamiento de emergencia de inmediato si tiene alguno de los siguientes síntomas: urticaria, opresión en el pecho, sibilancias, dificultad para respirar o hinchazón de la cara.
También puede producirse enrojecimiento de la piel en el lugar de la inyección.
ALPROLIX puede aumentar el riesgo de formación de coágulos sanguíneos anormales en su cuerpo, especialmente si tiene factores de riesgo para desarrollar coágulos sanguíneos. Llame a su proveedor de atención médica o busque atención de emergencia si tiene síntomas de un posible coágulo sanguíneo anormal, que pueden incluir: dolor en el pecho, dificultad para respirar, hinchazón inesperada de un brazo o una pierna con o sin dolor o sensibilidad.
Su cuerpo también puede producir anticuerpos llamados “inhibidores” contra ALPROLIX, que pueden impedir que ALPROLIX funcione correctamente. Es posible que su proveedor de atención médica deba analizar su sangre para detectar inhibidores de vez en cuando.
Estos no son todos los posibles efectos secundarios de ALPROLIX.
Hable con su proveedor de atención médica sobre cualquier efecto secundario que le moleste o que no desaparezca.
¿Cómo debo almacenar ALPROLIX?
Guarde los viales de ALPROLIX a una temperatura de 2 °C a 8 °C (36 °F a 46 °F). No congelar.
Los viales de ALPROLIX también se pueden almacenar a temperatura ambiente hasta 30 °C (86 °F) por un solo período de 6 meses.
Si elige almacenar ALPROLIX a temperatura ambiente:
- Anote en la caja la fecha en que el producto se retiró del refrigerador.
- Use el producto antes de que finalice este período de 6 meses o deséchelo.
- No vuelva a colocar el producto en el refrigerador.
No use el producto ni el diluyente después de la fecha de vencimiento impresa en la caja, el vial o la jeringa.
Después de la reconstitución:
- Use el producto reconstituido tan pronto como sea posible; sin embargo, puede almacenar el producto reconstituido a temperatura ambiente hasta 30 °C (86 °F) hasta por 3 horas. Proteja el producto reconstituido de la luz solar directa. Deseche cualquier producto que no se haya usado dentro de las 3 horas posteriores a la reconstitución.
- No use ALPROLIX si la solución reconstituida está turbia, contiene partículas o no es incolora.
¿Qué más debo saber sobre ALPROLIX?
Los medicamentos a veces se recetan para fines distintos a los que se enumeran aquí. No use ALPROLIX para una afección para la que no fue recetado. No comparta ALPROLIX con otras personas, incluso si tienen los mismos síntomas que usted.
Esta Información para el paciente ha sido aprobada por la Administración de Alimentos y Medicamentos de los EE. UU.
Fabricado por:
Bioverativ Therapeutics Inc.
Waltham, MA 02451
A SANOFI COMPANY
US License Number 2078
©2023 Bioverativ Therapeutics Inc. Todos los derechos reservados.
Revisado: mayo de 2023
INSTRUCCIONES DE USO
ALPROLIX®
Factor IX de coagulación (recombinante), proteína de fusión Fc
INSTRUCCIONES DE USO
Lea las Instrucciones de Uso antes de empezar a usar ALPROLIX® y cada vez que obtenga un repuesto. Puede haber información nueva. Esta información no sustituye la conversación con su proveedor de atención médica sobre su condición médica o su tratamiento.
Su proveedor de atención médica debe mostrarle a usted o a su cuidador cómo reconstituir y administrar ALPROLIX la primera vez que se use ALPROLIX.
Compruebe la fecha de caducidad del kit de ALPROLIX.
No utilice el producto si ha pasado la fecha de caducidad.
Permita que el frasco de ALPROLIX y el diluyente alcancen la temperatura ambiente.
No utilice fuentes de calor externas, como colocar el frasco y/o el diluyente en agua caliente.
Encuentre una superficie de trabajo limpia y plana y recoja todos los suministros que necesitará para reconstituir y administrar ALPROLIX.
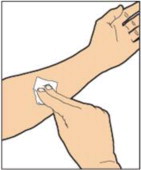
Lávese las manos con agua y jabón. Debe utilizarse una técnica aséptica (limpia y libre de gérmenes).
SU KIT CONTIENE:
RECONSTITUCIÓN
VOLTEE PARA LA AGRUPACIÓN Y LA ADMINISTRACIÓN
VOLTEE HACIA LA PARTE FRONTAL PARA LA RECONSTITUCIÓN
AGRUPACIÓN
AGRUPACIÓN es el proceso de combinar dos o más frascos reconstituídos en una jeringa más grande (no en la jeringa de diluyente) antes de la administración intravenosa.
Si va a utilizar dos o más frascos, siga estos pasos de agrupación.
Asegúrese de dejar el adaptador del frasco adjunto al frasco, ya que lo necesitará para sujetar una jeringa grande con enganche luer lock.
No desenganche la jeringa de diluyente o la jeringa grande con enganche luer hasta que esté listo para sujetar la jeringa grande con enganche luer al siguiente frasco (con el adaptador del frasco adjunto).
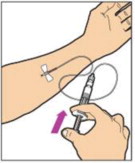
ADMINISTRACIÓN (Inyección intravenosa)
ALPROLIX se administra mediante infusión intravenosa después de reconstituir el polvo del medicamento con el diluyente.
Su proveedor de atención médica debe enseñarle cómo infundir ALPROLIX. Una vez que le hayan enseñado a autoinfundirse, puede seguir estas instrucciones.
No administre ALPROLIX reconstituido si contiene partículas, está descolorido o turbio.
CONDICIONES DE ALMACENAMIENTO – KIT DE PRODUCTO
Mantener refrigerado hasta su uso.
Mantener alejado de la luz solar directa.
CONDICIONES DE ALMACENAMIENTO – RECONSTITUIDO
ALPROLIX debe administrarse dentro de las 3 horas posteriores a la reconstitución.
No refrigerar después de la reconstitución.
Mantener alejado de la luz solar directa.
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos.
Fabricado por:
Bioverativ Therapeutics Inc.
Waltham, MA 02451
A SANOFI COMPANY
Número de licencia de EE. UU. 2078
©2023 Bioverativ Therapeutics Inc. Todos los derechos reservados.
Para obtener más información, visite www.ALPROLIX.com o llame al 1-855-692-5776
Revisado: Mayo de 2023
PANEL PRINCIPAL DE EXHIBICIÓN – Caja del kit – 500 UI
500 UI Nominal
NDC 71104-911-01
Un vial de un solo uso
con una jeringa precargada
de diluyente de 5 mL
ALPROLIX®
Factor IX de coagulación
(recombinante), proteína de fusión Fc
Para administración intravenosa
Solo con receta médica
Fabricado por:
Bioverativ Therapeutics Inc.
Waltham, MA 02451
Número de licencia en EE. UU. 2078
www.ALPROLIX.com
Bioverativ®
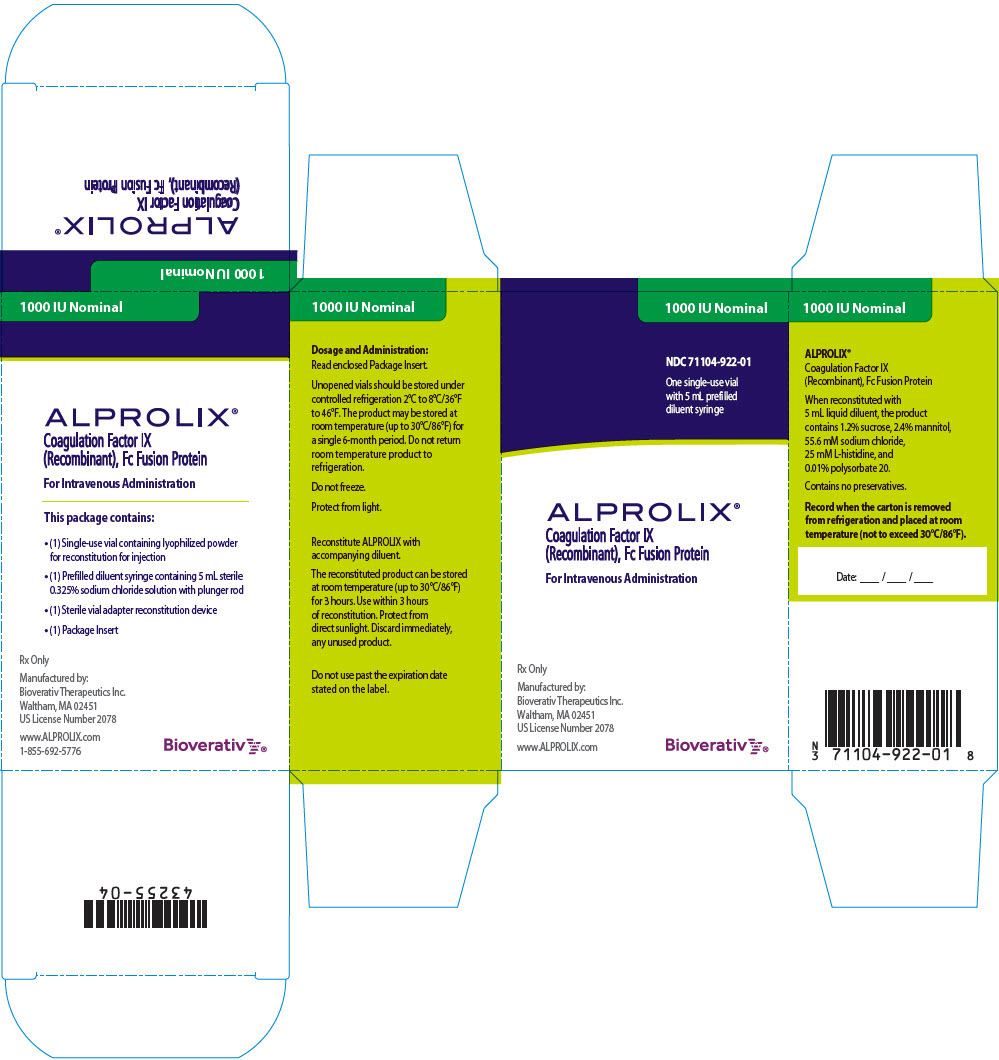
PANEL PRINCIPAL DE VISUALIZACIÓN – Caja de kit – 1000 UI
1000 UI nominal
NDC 71104-922-01
Un vial de un solo uso
con 5 mL de diluyente precargado en jeringa
ALPROLIX®
Factor IX de la coagulación
(Recombinant), Proteína de fusión Fc
Para administración intravenosa
Sólo bajo receta
Fabricado por:
Bioverativ Therapeutics Inc.
Waltham, MA 02451
Número de licencia de EE.UU. 2078
www.ALPROLIX.com
Bioverativ®
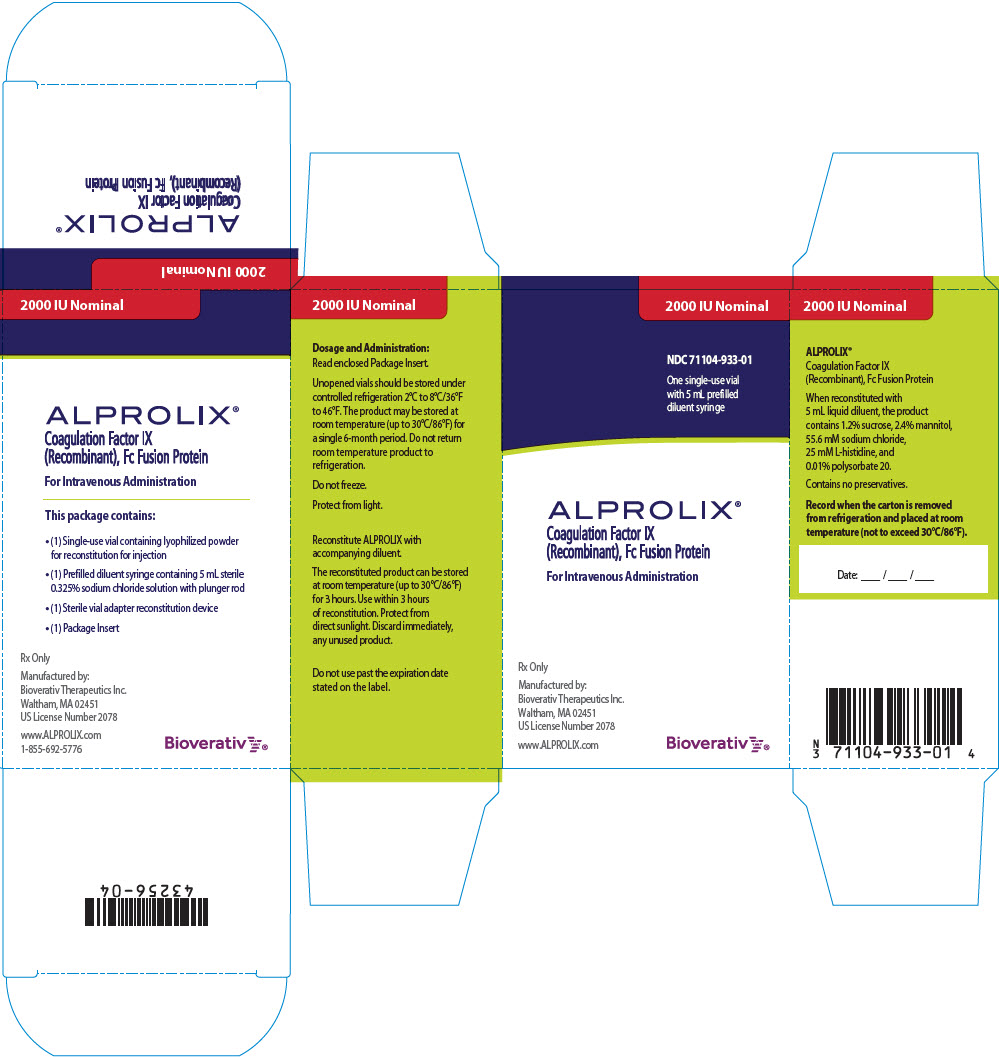
PANEL PRINCIPAL DE VISUALIZACIÓN – Caja de Kit – 2000 UI
2000 UI nominal
NDC 71104-933-01
Un frasco para un solo uso
con una jeringa precargada de 5 mL
de diluyente
ALPROLIX®
Factor IX de coagulación
(Recombinante), Proteína de fusión Fc
Para administración intravenosa
Sólo bajo receta
Fabricado por:
Bioverativ Therapeutics Inc.
Waltham, MA 02451
Número de licencia de EE. UU. 2078
www.ALPROLIX.com
Bioverativ®
PANEL PRINCIPAL DE VISUALIZACIÓN – Caja del kit – 3000 UI
3000 UI Nominal
NDC 71104-944-01
Un vial de un solo uso
con una jeringa precargada
de 5 mL de diluyente
ALPROLIX®
Factor IX de coagulación
(recombinante), proteína de fusión Fc
Para administración intravenosa
Solo para uso con receta médica
Fabricado por:
Bioverativ Therapeutics Inc.
Waltham, MA 02451
Número de licencia en EE. UU. 2078
www.ALPROLIX.com
Bioverativ®
PANEL PRINCIPAL DE VISUALIZACIÓN – Caja de Kit – 250 UI
250 UI Nominal
NDC 71104-966-01
Un vial de un solo uso
con una jeringa precargada
de diluyente de 5 mL
ALPROLIX®
Factor IX de coagulación
(recombinante), proteína de fusión Fc
Para administración intravenosa
Solo con receta médica
Fabricado por:
Bioverativ Therapeutics Inc.
Waltham, MA 02451
Número de licencia en EE. UU. 2078
www.ALPROLIX.com
Bioverativ®
Panel de visualización principal – Kit de cartón – 4000 UI
4000 UI nominal
NDC 71104-977-01
Un vial de un solo uso
con 5 mL de jeringa precargada de diluyente
ALPROLIX®
Factor IX de la coagulación
(Recombinante), Proteína de fusión Fc
Para administración intravenosa
Sólo con receta
Fabricado por:
Bioverativ Therapeutics Inc.
Waltham, MA 02451
Número de licencia de EE. UU. 2078
www.ALPROLIX.com
Bioverativ®