Fabricante de medicamentos: Octapharma USA Inc (Updated: 2024-12-26)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
NUWIQ®, Factor antihemofílico (recombinante)
Polvo liofilizado para solución inyectable intravenosa
Aprobación inicial en EE. UU.: 2015
CAMBIOS IMPORTANTES RECIENTES
INDICACIONES Y USO
NUWIQ
es un factor antihemofílico recombinante [factor de coagulación sanguínea VIII (Factor VIII)] indicado en pacientes pediátricos y adultos con hemofilia A para (
1
):
•
Tratamiento a demanda y control de episodios hemorrágicos
•
Manejo perioperatorio del sangrado
•
Profilaxis de rutina para reducir la frecuencia de episodios hemorrágicos
NUWIQ no está indicado para el tratamiento de la enfermedad de von Willebrand. (
1
)
POSOLOGÍA Y ADMINISTRACIÓN
Para uso intravenoso después de la reconstitución
•
Cada vial de NUWIQ está etiquetado con la cantidad real de potencia del Factor VIII en unidades internacionales (UI). (
2.1
)
•
Determine la dosis usando la siguiente fórmula para adolescentes y adultos (
2.1
):
UI necesarias = peso corporal (kg) x aumento deseado del Factor VIII (%) (UI/dL) x 0.5 (UI/kg por UI/dL)
•
La dosis y la duración del tratamiento dependen de la gravedad de la deficiencia de FVIII, la ubicación y la extensión del sangrado, el nivel de FVIII y el estado clínico del paciente. (
2.1
)
•
Dosificación para profilaxis de rutina: (
2.1
)
| Pacientes | Dosis (UI/kg) | Frecuencia de las infusiones |
| Adultos y adolescentes de 12 a 17 años | 30 – 40 | Día por medio |
| Niños de 2 a 11 años | 30 – 50 | Día por medio o tres veces por semana |
| Niños < 2 años | 20 – 50 | Una vez por semana a día por medio |
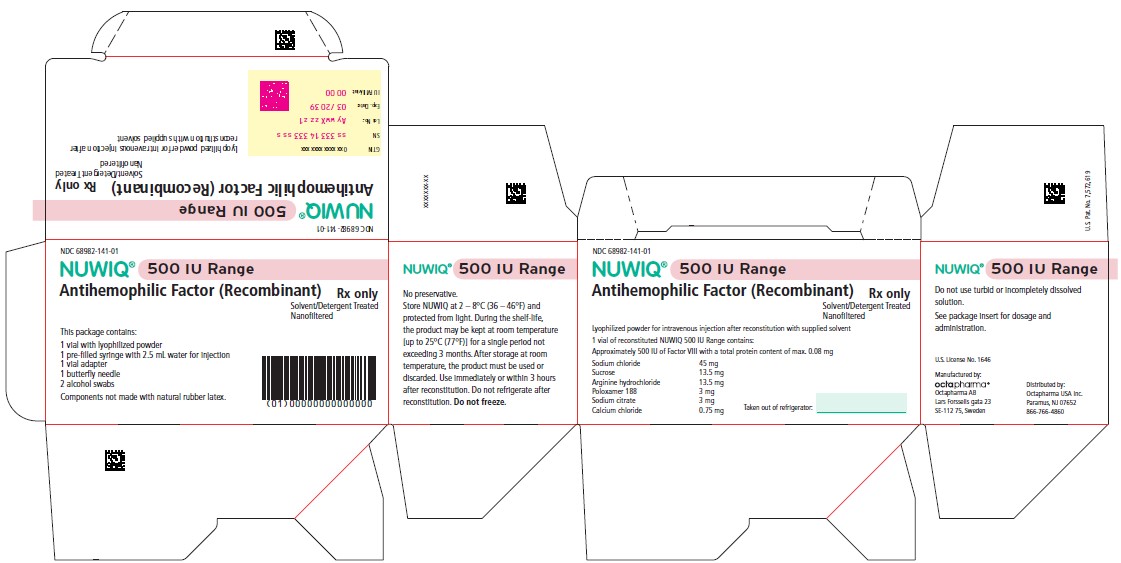
PRESENTACIONES Y CONCENTRACIONES
NUWIQ está disponible como un polvo liofilizado estéril, no pirógeno, blanco para reconstitución en viales de dosis única que contienen nominalmente 250, 500, 1000, 1500, 2000, 2500, 3000 o 4000 UI de potencia del Factor VIII. (
3
)
CONTRAINDICACIONES
NUWIQ está contraindicado en pacientes que han manifestado reacciones de hipersensibilidad potencialmente mortales, incluida la anafilaxia, al producto o sus componentes (
4
)
ADVERTENCIAS Y PRECAUCIONES
•
Son posibles reacciones de hipersensibilidad, incluida la anafilaxia. Si aparecen síntomas, suspenda la administración de NUWIQ y administre el tratamiento adecuado. (
5.1
)
•
Puede producirse el desarrollo de anticuerpos neutralizantes del Factor VIII (inhibidores). Si no se alcanzan los niveles esperados de actividad del Factor VIII en plasma, o si el sangrado no se controla con una dosis adecuada, realice un ensayo que mida la concentración del inhibidor del Factor VIII. (
5.2
)
•
Controle a todos los pacientes la actividad del Factor VIII y el desarrollo de anticuerpos inhibidores del Factor VIII. (
5.3
)
REACCIONES ADVERSAS
Las reacciones adversas que ocurrieron con mayor frecuencia (>5%) en los ensayos clínicos fueron infección del tracto respiratorio superior, cefalea, fiebre, tos, infección del tracto respiratorio inferior, rinitis, escalofríos, dolor abdominal, artralgia, anemia y faringitis. (
6
)
Para notificar SOSPECHAS DE REACCIONES ADVERSAS, comuníquese con Octapharma USA Inc. al 1- 866-766-4860 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
USO EN POBLACIONES ESPECÍFICAS
Uso pediátrico: menor recuperación, menor vida media y eliminación más rápida en niños menores de
≤
12 años. Se deben considerar dosis más altas o un régimen de dosificación más frecuente para el tratamiento profiláctico en pacientes pediátricos menores de
<
5 años. (
8.4
).
Consulte el punto 17 para obtener INFORMACIÓN PARA EL PACIENTE y el etiquetado del paciente aprobado por la FDA.
Revisado: 12/2024
Tabla de contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis
2.2 Preparación y Reconstitución
2.3 Administración
3 FORMAS FARMACÉUTICAS Y CONCENTRACIONES
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de Hipersensibilidad
5.2 Anticuerpos Neutralizantes
5.3 Monitoreo y Pruebas de Laboratorio
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Inmunogenicidad
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
13.2 Toxicología Animal y/o Farmacología
14 ESTUDIOS CLÍNICOS
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANIPULACIÓN
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información de prescripción completa no se enumeran.
SECCIÓN NO CLASIFICADA DE SPL
1 INDICACIONES Y USO
NUWIQ es un factor antihemofílico recombinante [factor de coagulación sanguínea VIII (Factor VIII)] indicado en pacientes pediátricos y adultos con Hemofilia A para:
- Tratamiento a demanda y control de episodios hemorrágicos
- Manejo perioperatorio de hemorragias
- Profilaxis de rutina para reducir la frecuencia de episodios hemorrágicos
NUWIQ no está indicado para el tratamiento de la enfermedad de von Willebrand.
2 DOSIS Y ADMINISTRACIÓN
Para uso intravenoso después de la reconstitución
2.1 Dosis
- Cada vial de NUWIQ está etiquetado con la potencia real del Factor VIII expresada en unidades internacionales (UI). Una UI de actividad del Factor VIII se define por la cantidad de Factor VIII en un mL de plasma humano normal combinado. El cálculo de la dosis requerida de Factor VIII se basa en el hallazgo empírico de que 1 UI de Factor VIII por kg de peso corporal aumenta la actividad plasmática del Factor VIII en aproximadamente un 2% de la actividad normal o 2 UI/dL cuando se evalúa utilizando el ensayo de coagulación en una etapa. Utilice las siguientes fórmulas para determinar la dosis requerida:
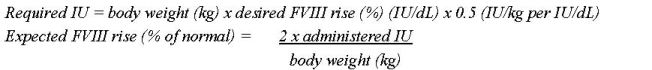
- La dosis y la duración del tratamiento dependen de la gravedad de la deficiencia del Factor VIII, la ubicación y la extensión del sangrado, el nivel de FVIII y el estado clínico del paciente.
Tratamiento a Demanda y Control de Episodios Hemorrágicos
En la
Tabla 1
se proporciona una guía para la dosificación de NUWIQ para el tratamiento a demanda y el control de los episodios hemorrágicos. El régimen de dosificación seleccionado debe mantener los niveles de actividad plasmática del Factor VIII en o por encima de los niveles plasmáticos (en % de lo normal o en UI/dL) descritos en la tabla.
Tabla 1: Dosificación para el Tratamiento y Control de Episodios Hemorrágicos
Tipo de Episodios Hemorrágicos |
Actividad máxima del Factor VIII requerida después de la infusión (% de lo normal o UI/dL) |
Frecuencia de Dosificación (horas) |
Duración del Tratamiento (días) |
Leve: Sangrado superficial de músculos o tejidos blandos y sangrado oral |
20–40 | 12-24 | Al menos 1 día, hasta que se resuelva el episodio hemorrágico. |
Moderado a Grave: Hemorragia en los músculos, en la cavidad oral, hemartrosis, traumatismo conocido |
30–60 | 12-24 | Durante 3 a 4 días o más hasta que se resuelva el episodio hemorrágico. |
Potencialmente mortal: Sangrado intracraneal, intraabdominal, gastrointestinal o intratorácico, sangrado del sistema nervioso central, sangrado en los espacios retrofaríngeos o la vaina del iliopsoas, ojos/retina, fracturas o traumatismo craneal |
60–100 | 8-24 | Hasta que se resuelva el riesgo de sangrado. |
Manejo Perioperatorio
En la
Tabla 2
se proporciona una guía para la dosificación de NUWIQ durante la cirugía (manejo perioperatorio). La dosificación debe tener como objetivo mantener un nivel de actividad plasmática del Factor VIII en o por encima de los niveles plasmáticos (en % de lo normal o en UI/dL) descritos en la tabla.
Tabla 2: Dosificación para el Manejo Perioperatorio
Tipo de Cirugía |
Actividad del Factor VIII requerida después de la infusión (% de lo normal o UI/dL) |
Frecuencia de Dosis (horas) |
Duración del Tratamiento (días) |
Menor incluida la extracción dental |
30–60 (pre y postoperatorio) |
24 | Al menos 1 día, hasta que se logre la cicatrización. |
Mayor Intracraneal, intraabdominal o terapia de reemplazo articular |
80–100 (pre y postoperatorio) |
8-24 | Hasta una cicatrización adecuada de la herida, luego continuar el tratamiento durante al menos otros 7 días para mantener una actividad del Factor VIII del 30% al 60% (UI/dL). |
Profilaxis de rutina
En la
Tabla 3
se proporciona una guía para la dosificación de NUWIQ para la profilaxis de rutina para reducir la frecuencia de sangrado. La dosificación exacta debe definirse según el estado clínico y la respuesta del paciente.
Tabla 3: Dosificación para la profilaxis de rutina
Pacientes |
Dosis (UI/kg) |
Frecuencia de las infusiones |
| Adultos y adolescentes de 12 a 17 años | 30 – 40 | Cada dos días |
| Niños de 2 a 11 años | 30 – 50 | Cada dos días o tres veces por semana |
| Niños < 2 años | 20 – 50 | Una vez por semana a cada dos días |
Un régimen puede ajustarse individualmente a una dosificación menos o más frecuente a discreción del médico tratante.
2.2 Preparación y Reconstitución
Contenido del paquete NUWIQ:
- vial de dosis única de concentrado de NUWIQ
- jeringa precargada que contiene 2,5 ml de agua estéril para inyección
- adaptador de vial
- aguja de mariposa
- dos toallitas con alcohol.
- Trabaje siempre sobre una superficie limpia y lávese las manos antes de realizar el procedimiento.
- Deje que el vial de NUWIQ y la jeringa precargada alcancen la temperatura ambiente.
- Retire la tapa abatible de plástico del vial de NUWIQ para exponer el tapón de goma. (Figura A).
- Limpie la parte superior del vial con una toallita con alcohol y deje secar el tapón de goma del vial.
- Retire la cubierta de papel del paquete del adaptador del vial, dejando al descubierto la punta del adaptador sin sacarlo del paquete (Figura B).
- Con el vial de concentrado sobre una superficie plana, inserte la punta del adaptador en el tapón de goma. El adaptador encaja en el vial cuando está listo (Figura C).
- Retire la cubierta de papel del paquete de la jeringa precargada. Conecte la varilla del émbolo uniendo el extremo roscado de la varilla del émbolo a la jeringa de disolvente, girando en el sentido de las agujas del reloj hasta que sienta una ligera resistencia (Figura D). Evite el contacto con el eje.
- Rompa la punta de plástico a prueba de manipulaciones de la jeringa rompiendo la perforación de la tapa. No toque el interior de la tapa ni la punta de la jeringa (Figura E).
- Retire el embalaje del adaptador y conecte la jeringa al adaptador del vial girando en el sentido de las agujas del reloj hasta que sienta resistencia (Figura F).
- Inyecte lentamente todo el líquido de la jeringa en el vial de concentrado (Figura G).
- Sin retirar la jeringa, disuelva el polvo concentrado en el vial moviéndolo o girándolo suavemente varias veces. NO AGITAR. Espere hasta que todo el polvo se disuelva por completo.
- Inspeccione la solución final en busca de partículas. La solución debe ser transparente, incolora y libre de partículas visibles. No la utilice si la solución está turbia o tiene partículas.
- Dé la vuelta al vial y a la jeringa (aún unidos).
- Extraiga lentamente la solución a la jeringa. Asegúrese de que todo el líquido se transfiere a la jeringa (Figura H).
- Separe la jeringa llena del adaptador del vial girando en sentido contrario a las agujas del reloj.
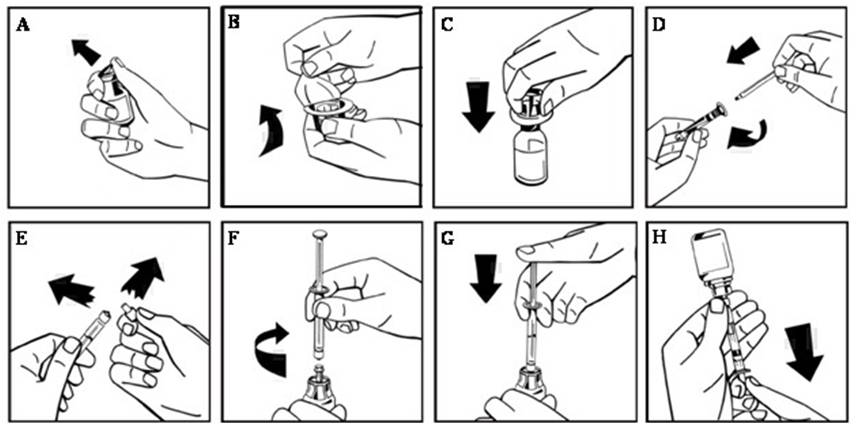
No refrigere la solución después de la reconstitución. Utilice la solución dentro de las 3 horas posteriores a la reconstitución. Si no se utiliza la solución dentro de este período de tiempo, cierre la jeringa llena con la punta de plástico a prueba de manipulaciones y deséchela.
2.3 Administración
Sólo para uso intravenoso después de la reconstitución
- Inspeccione la solución reconstituida de NUWIQ en busca de partículas visibles y decoloración antes de la administración. No la utilice si observa partículas o decoloración.
- No administre NUWIQ en el mismo tubo o contenedor que otros medicamentos.
- Limpie el lugar de inyección elegido con una toallita con alcohol.
- Conecte el equipo de infusión proporcionado a la jeringa. Inserte la aguja del equipo de infusión en la vena elegida.
- Realice una infusión intravenosa en bolo. La velocidad de administración debe determinarse según la comodidad del paciente, a una velocidad máxima de 4 ml por minuto.
- Después de infundir NUWIQ, retire y deseche adecuadamente el equipo de infusión. Después de la infusión, retire la etiqueta despegable que contiene el número de lote del vial de concentrado de factor y colóquela en el libro de registro para su registro.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
NUWIQ se presenta como un polvo liofilizado blanco, estéril, no pirógeno, para reconstitución en viales de dosis única que contienen nominalmente 250, 500, 1000, 1500, 2000, 2500, 3000 o 4000 UI de potencia de Factor VIII. La potencia real del Factor VIII se indica en cada vial de NUWIQ.
4 CONTRAINDICACIONES
NUWIQ está contraindicado en pacientes que han manifestado reacciones de hipersensibilidad potencialmente mortales, incluyendo anafilaxia, al producto o sus componentes.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de Hipersensibilidad
Con NUWIQ son posibles reacciones de hipersensibilidad, incluyendo anafilaxia. Los signos tempranos de reacciones de hipersensibilidad que pueden progresar a anafilaxia pueden incluir angioedema, opresión en el pecho, disnea, sibilancias, urticaria o prurito. Si se producen reacciones de hipersensibilidad, interrumpa inmediatamente la administración e inicie el tratamiento adecuado.
5.2 Anticuerpos Neutralizantes
Tras la administración de NUWIQ puede producirse la formación de anticuerpos neutralizantes (inhibidores) al Factor VIII. Supervise a todos los pacientes para detectar el desarrollo de inhibidores del Factor VIII mediante observaciones clínicas y pruebas de laboratorio apropiadas. Si el nivel plasmático del Factor VIII no aumenta como se espera, o si no se controla la hemorragia después de la administración de NUWIQ, se debe sospechar la presencia de un inhibidor (anticuerpo neutralizante)
[véase
Advertencias y precauciones (5.3)
]
.
5.3 Monitorización y Pruebas de Laboratorio
-
Controle la actividad del Factor VIII plasmático mediante la realización de una prueba validada (p. ej., ensayo de coagulación de una etapa), para confirmar que se han alcanzado y mantenido niveles adecuados de Factor VIII
[véase
Posología y administración (2.1)
]
. - Controle el desarrollo de inhibidores del Factor VIII. Realice un ensayo de inhibidores de Bethesda si no se alcanzan los niveles plasmáticos esperados de Factor VIII, o si la hemorragia no se controla con la dosis esperada de NUWIQ. Utilice Unidades de Bethesda (UB) para informar de los niveles de inhibidores.
6 REACCIONES ADVERSAS
Las reacciones adversas más comunes (>5% de los pacientes) notificadas en los ensayos clínicos fueron infección del tracto respiratorio superior, cefalea, fiebre, tos, infección del tracto respiratorio inferior, rinitis, escalofríos, dolor abdominal, artralgia, anemia y faringitis.
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con la tasa en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica.
El perfil de seguridad de NUWIQ se evaluó en siete estudios clínicos prospectivos, abiertos, en pacientes previamente tratados (PTP – expuestos a un producto que contiene Factor VIII durante ≥150 días de exposición (ED) en el caso de adolescentes y adultos o ≥50 ED en el caso de pacientes menores de 12 años) con hemofilia A grave (Factor VIII ≤ 1%). Se excluyeron los pacientes con antecedentes de inhibidor detectable del Factor VIII, enfermedad hepática o renal grave, que no fueran inmunocompetentes (recuento de CD4+ <200/µL) o que estuvieran programados para recibir fármacos inmunomoduladores.
En todos los estudios clínicos, se estratificaron 190 pacientes, de los cuales 129 fueron adultos, 3 fueron adolescentes de entre 12 y 17 años y 58 fueron pacientes pediátricos de entre 2 y 11 años. Un total de 182 (95,8%) pacientes fueron tratados durante al menos 180 días. Colectivamente, los pacientes recibieron entre 24.005 y 2.12 millones de UI (555 a 34.713 UI/kg) de 14 a 918 infusiones durante un período de 14 a 896 días de exposición. Un día de exposición se definió como cualquier día en que se inició al menos una infusión.
Con un total de 43.264 infusiones durante 42.808 ED, las reacciones adversas notificadas en al menos 5 de los 190 pacientes (2,6%) fueron infección del tracto respiratorio superior (22%), cefalea (11%), fiebre (10%), tos (9,5%), infección del tracto respiratorio inferior (8,4%), rinitis (7,9%), escalofríos (6,8%), dolor abdominal (5,3%), artralgia (5,3%), faringitis (5,3%), diarrea (4,7%), varicela (4,2%), problemas relacionados con el dispositivo (4,2%), dolor de espalda (3,7%), dolor en las extremidades (3,7%), dolor de muelas (3,2%), vómitos (3,2%), traumatismo craneoencefálico (2,6%), lesión (2,6%), erupción cutánea (2,6%), amigdalitis (2,6%) y absceso dental (2,6%). Cabe destacar que se notificó mareo en 4 pacientes (2,1%); disnea, insomnio y malestar en 2 pacientes (1,1%) cada uno; y dolor en el lugar de la inyección, inflamación en el lugar de la inyección, neoplasia renal benigna, deterioro de la función/comportamiento neurológico y síncope en 1 paciente (0,5%) cada uno.
Considerando solo la cohorte pediátrica de 59 pacientes (de 2 a 12 años de edad al momento de la inscripción inicial), 48 de los cuales continuaron participando en un estudio de extensión a largo plazo, se administraron 26.311 infusiones que totalizaron 1.019.528 UI/kg de NUWIQ. Las reacciones adversas más comúnmente notificadas (>10% de los 59 pacientes) fueron infección del tracto respiratorio superior (49%), infección del tracto respiratorio inferior (24%), tos (20%), fiebre (20%), rinitis (19%), faringitis (19%), escalofríos (15%), varicela (14%), cefalea (12%), dolor abdominal (10%) y dolor en las extremidades (10%). Se notificó mareo en 2 pacientes (3,4%), mientras que el deterioro de la función/comportamiento neurológico, el insomnio y el síncope se notificaron en 1 paciente (1,7%) cada uno.
6.2 Inmunogenicidad
Todos los pacientes de los ensayos clínicos (N = 190) fueron monitorizados para detectar anticuerpos neutralizantes (inhibidores) al Factor VIII mediante el ensayo de Bethesda modificado utilizando muestras de sangre obtenidas antes de la primera infusión de NUWIQ en todos los estudios, a intervalos definidos (a los ED 10 a 15, a los tres meses y cada tres meses posteriores) en cinco estudios, y cada tres meses en un estudio y en la visita de finalización en todos los estudios. Ningún paciente desarrolló anticuerpos neutralizantes al Factor VIII.
Se notificaron anticuerpos anti-Factor VIII no neutralizantes (sin actividad inhibitoria medida mediante el ensayo de Bethesda modificado) en cuatro de los 135 pacientes analizados, lo que representa una tasa del 3%. Tres de los cuatro pacientes tenían anticuerpos no neutralizantes preexistentes antes de la exposición a NUWIQ. Los anticuerpos de unión fueron transitorios en dos de estos tres pacientes. En un paciente que dio negativo en la evaluación inicial, el anticuerpo no neutralizante se midió una vez al final del estudio.
En un ensayo clínico, en el que se inscribieron 110 pacientes previamente no tratados (rango de edad de 0 a 146 meses, no se permitió ningún tratamiento previo con concentrados de FVIII u otros productos sanguíneos que contuvieran FVIII), 108 tuvieron datos evaluables después del tratamiento con NUWIQ. El criterio principal de valoración del estudio, la formación de inhibidores, se observó en 28 de 105 pacientes (26,7%; IC del 95%: 18,5-36,2) con al menos un análisis de inhibidores después de ED1. Diecisiete pacientes (16,2%; IC del 95%: 9,7-24,7) desarrollaron inhibidores de alto título y 11 (10,5%; IC del 95%: 5,3-18) desarrollaron inhibidores de bajo título, 5 de los cuales tuvieron inhibidores transitorios. De los 28 pacientes que desarrollaron un inhibidor, 25 lo hicieron con ≤20 ED antes de la detección. Todos los inhibidores se desarrollaron dentro de los 34 ED.
La detección de la formación de anticuerpos depende en gran medida de la sensibilidad y la especificidad del ensayo. Además, la incidencia observada de positividad de anticuerpos (incluidos los anticuerpos neutralizantes) en un ensayo puede verse influenciada por varios factores, como la metodología del ensayo, el manejo de las muestras, el momento de la recolección de las muestras, los medicamentos concomitantes y la enfermedad subyacente. Por estas razones, la comparación de la incidencia de anticuerpos a NUWIQ con la incidencia de anticuerpos a otros productos puede ser engañosa.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgo
No hay datos sobre el uso de NUWIQ en mujeres embarazadas que informen sobre un riesgo asociado al fármaco. No se han realizado estudios de reproducción en animales con NUWIQ. Se desconoce si NUWIQ puede causar daño fetal cuando se administra a una mujer embarazada o puede afectar la capacidad reproductiva. En la población general de EE. UU., el riesgo estimado de fondo de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2-4 % y del 15-20 %, respectivamente.
8.2 Lactancia
Resumen de Riesgo
No hay información sobre la presencia de NUWIQ en la leche materna, el efecto en el lactante o los efectos sobre la producción de leche. Se deben considerar los beneficios para el desarrollo y la salud de la lactancia materna junto con la necesidad clínica de la madre de NUWIQ y cualquier posible efecto adverso en el lactante amamantado por NUWIQ o por la enfermedad materna subyacente.
8.4 Uso Pediátrico
La seguridad y eficacia de NUWIQ se evaluaron en un estudio en 59 pacientes pediátricos previamente tratados (58 pacientes de 2 a 11 años) que recibieron al menos una dosis de NUWIQ para profilaxis de rutina. La seguridad y eficacia en la profilaxis de rutina y el tratamiento a demanda de episodios hemorrágicos son comparables entre niños y adultos
[ver
Reacciones adversas (6.1)
y
Estudios clínicos (14)
]
. Los datos farmacocinéticos pediátricos de NUWIQ se obtuvieron en 29 niños de entre 2 y 5 años y 30 niños de entre 6 y ≤12 años. La semivida (T
1/2
) y la recuperación
in vivo
incremental (IVR) son menores en niños que en adultos y el aclaramiento sistémico del fármaco es sustancialmente mayor en el grupo de edad pediátrica de 2 a 5 años en comparación con los adultos. La IVR en pacientes pediátricos menores de 2 años es menor que en todos los demás grupos de edad
[ver
Farmacología clínica (12.3)
]
. Se deben considerar dosis más altas o un régimen de dosificación más frecuente para el tratamiento profiláctico en pacientes pediátricos menores de 5 años.
La seguridad y eficacia de NUWIQ se evaluaron en un estudio en 110 pacientes pediátricos previamente no tratados (PUP, rango de edad 0-146 meses). De 110 PUP, 108 tenían datos evaluables y se investigaron para determinar la inmunogenicidad
[ver
Reacciones adversas (6.2)
]
de NUWIQ, el criterio principal de valoración. Los criterios de valoración secundarios fueron la eficacia durante la profilaxis, a demanda y la profilaxis quirúrgica, así como la seguridad y la tolerabilidad
[ver
Reacciones adversas (6.1)
]
.
8.5 Uso en Geriatría
Los estudios clínicos de NUWIQ no incluyeron un número suficiente de pacientes de 65 años o más para proporcionar evidencia concluyente sobre si responden de manera diferente a los pacientes más jóvenes.
11 DESCRIPCIÓN
NUWIQ, Factor Antihemofílico (Recombinante), es un polvo liofilizado estéril, no pirógeno, para reconstitución para inyección intravenosa. El producto se suministra en viales unidosis que contienen potencias nominales de Factor VIII de 250, 500, 1000, 1500, 2000, 2500, 3000 o 4000 UI. Cuando se reconstituye con 2,5 mL de disolvente (Agua estéril para inyección), las concentraciones nominales respectivas son 100, 200, 400, 600, 800, 1000, 1200 o 1600 UI/mL. El producto reconstituido contiene los siguientes excipientes por mL: 18 mg de cloruro de sodio, 5,4 mg de sacarosa, 5,4 mg de clorhidrato de L-arginina, 0,3 mg de cloruro de calcio dihidrato, 1,2 mg de poloxámero 188 y 1,2 mg de citrato de sodio dihidrato. La concentración de cada uno de los excipientes es la misma para todas las potencias. NUWIQ no contiene conservantes. Cada vial de NUWIQ está etiquetado con la potencia real del Factor VIII expresada en UI determinada utilizando un ensayo de coagulación de una etapa, utilizando un material de referencia calibrado contra un Estándar Internacional de la Organización Mundial de la Salud (OMS) para concentrados de Factor VIII. Una UI, según la define el estándar de la OMS para los concentrados de Factor VIII humano, es aproximadamente igual al nivel de actividad del Factor VIII en 1 mL de plasma humano normal fresco agrupado. La actividad específica media de NUWIQ es de 8124 UI/mg de proteína total.
El Factor VIII de coagulación recombinante con el dominio B delecionado (BDD-rFVIII) es el principio activo de NUWIQ. El BDD-rFVIII es una glicoproteína recombinante (un heterodímero) con una masa molecular aproximada de 170 kDa, que comprende los dominios del Factor VIII A1-A2 (denominada cadena pesada de ~90 kDa) y A3-C1-C2 (denominada cadena ligera de ~80 kDa), mientras que el dominio B, presente en el Factor VIII derivado del plasma de longitud completa, ha sido delecionado. La proteína purificada consta de 1440 aminoácidos. La secuencia de aminoácidos es comparable a la forma con el dominio B delecionado del Factor VIII del plasma humano (90 + 80 kDa).
El BDD-rFVIII se produce mediante tecnología de ADN recombinante en células genéticamente modificadas de riñón embrionario humano (HEK) 293F sin materiales de origen animal o humano añadidos durante el proceso de fabricación o al producto final. Como NUWIQ se produce utilizando una línea celular humana, contiene modificaciones postraduccionales comparables al Factor VIII derivado del plasma humano y carece de epítopos Neu5Gc o α-1,3-Gal que pueden estar presentes en productos producidos en células animales. Además, el BDD-rFVIII está completamente sulfatado en Tyr1680. La sustancia activa se concentra y purifica mediante una serie de pasos de cromatografía, que también incluyen dos pasos dedicados de eliminación viral: tratamiento con solvente/detergente (S/D) para la inactivación del virus y nanofiltración de 20 nm para la eliminación de virus.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
NUWIQ reemplaza temporalmente el factor VIII de coagulación faltante que se necesita para una hemostasia eficaz.
12.2 Farmacodinamia
La hemofilia A es un trastorno hemorrágico caracterizado por una deficiencia del factor VIII de coagulación funcional, lo que resulta en un tiempo de coagulación plasmático prolongado, según lo medido por la prueba de tiempo de tromboplastina parcial activado (aPTT). El tratamiento con NUWIQ normaliza el aPTT durante el período de dosificación eficaz.
12.3 Farmacocinética
La farmacocinética (FC) de NUWIQ se evaluó en un estudio clínico abierto, multicéntrico, de 22 pacientes previamente tratados (PPT) con hemofilia A grave (20 adultos y 2 adolescentes). Los parámetros de FC (
Tabla 4
) se basaron en la actividad del factor VIII plasmático medida mediante el ensayo de coagulación de una etapa después de una única infusión intravenosa de una dosis de 50 UI/kg.
El perfil farmacocinético obtenido después de 6 meses de dosificación repetida fue comparable con el perfil farmacocinético obtenido después de la primera dosis.
Tabla 4: Parámetros farmacocinéticos de NUWIQ en 22 adultos/adolescentes PPT (Dosis: 50 UI/kg)
Parámetros de FC |
Media ± DE |
| AUC (h·UI/mL) | 18,0 ± 5,6 |
|
AUC norm (h·UI/mL/(UI/kg)) |
0,4 ± 0,1 |
|
C maxnorm (UI/mL/(UI/kg)) |
0,022 ± 0,003 |
|
T 1/2 (h) |
17,1 ± 11,2* |
| IVR (%/UI/kg) | 2,1 ± 0,3 |
| MRT (h) | 22,5 ± 14,2 |
| CL (mL/h/kg) | 3,0 ± 1,0 |
|
V ss (mL/kg) |
59,8 ± 19,8 |
AUC = Área bajo la curva (Factor VIII:C); AUCnorm = AUC dividida por la dosis; Cmaxnorm = Concentración plasmática máxima dividida por la dosis; CL = Clearance; Factor VIII:C = Actividad de coagulación del Factor VIII; IVR = Recuperación incremental in vivo; MRT = Tiempo de residencia medio; PK = Farmacocinética; SD = Desviación estándar; T1/2 = Semivida terminal; Vss = Volumen de distribución en estado estacionario; *Mediana, cuartil inferior/superior: 13.7, 12.0/17.5
Farmacocinética Pediátrica
La farmacocinética (PK) de pacientes pediátricos se presenta en la Tabla 5 para los grupos de edad de 2 a 5 años y de 6 a 12 años. Se basaron en la actividad del Factor VIII plasmático medida mediante el ensayo de coagulación de un solo paso después de una única infusión intravenosa de una dosis de 50 UI/kg. En comparación con los adultos y los adolescentes, la IVR y la T
1/2
fueron menores y el aclaramiento sistémico del fármaco (basado en el peso corporal por kg) fue sustancialmente mayor en niños de 2 a 5 años.
El análisis de la IVR después de 3 y 6 meses de tratamiento profiláctico produjo resultados comparables con la IVR después de la primera dosis.
Al igual que en la población adulta, se obtuvieron valores de PK similares utilizando el ensayo cromogénico y el ensayo de un solo paso. Los valores en
Tabla 5
reflejan los obtenidos utilizando el ensayo de un solo paso.
Tabla 5: Parámetros farmacocinéticos de NUWIQ en 26 niños PTP de 2 a 5 años y de 6 a 12 años (Dosis: 50 UI/kg)
Parámetros PK |
2 a 5 años (N = 13) Media ± SD |
6 a ≤12 años (N = 13) Media ± SD |
| AUC (h·UI/mL) | 10.1 ± 4.6 | 11.8 ± 2.7 |
|
AUC norm (h·UI/mL/(UI/kg)) |
0.2 ± 0.1 | 0.3 ± 0.1 |
|
C maxnorm (UI/mL/(UI/kg)) |
0.016 ± 0.002 | 0.017 ± 0.004 |
|
T 1/2 (h) |
11.9 ± 5.4 * |
13.1 ± 2.6 # |
| IVR (%/UI/kg) | 1.6 ± 0.2 | 1.6 ± 0.4 |
| MRT (h) | 15.1 ± 7.4 | 16.5 ± 2.9 |
| CL (mL/h/kg) | 5.4 ± 2.3 | 4.1 ± 0.9 |
|
V ss (mL/kg) |
68.3 ± 10.4 | 66.1 ± 16.0 |
AUC = Área bajo la curva (Factor VIII:C); AUC
norm
= AUC dividida por la dosis; C
maxnorm
= Concentración plasmática máxima dividida por la dosis; CL = Clearance; Factor VIII:C = Actividad de coagulación del Factor VIII; IVR = Recuperación incremental in vivo; MRT = Tiempo de residencia medio; PK = Farmacocinética; SD = Desviación estándar; T
1/2
= Semivida terminal; V
ss
= Volumen de distribución en estado estacionario;
*
Mediana, cuartil inferior/superior: 10.1, 9.4/13.7;
#
Mediana, cuartil inferior/superior: 12.8, 11.2/15.9
En 39 niños PUP menores de 2 años de edad, se administró una dosis de 40 UI de FVIII/kg de peso corporal para determinar la recuperación. La IVR media en niños menores de 2 años fue de 1,1 %/UI/kg, inferior a la de los adultos y adolescentes (IVR 2,1 %/UI/kg) y a la de los niños de 2 a 11 años (IVR 1,6 %/UI/kg).
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico de NUWIQ ni estudios para determinar los efectos de NUWIQ sobre la genotoxicidad o la fertilidad.
13.2 Toxicología y/o Farmacología Animal
La evaluación de la tolerancia local de NUWIQ en conejos después de una administración perivénosa única en concentraciones de hasta 4000 UI no produjo hallazgos adversos.
14 ESTUDIOS CLÍNICOS
La eficacia de NUWIQ se evaluó en tres ensayos clínicos multicéntricos, abiertos y prospectivos en pacientes con hemofilia A grave. Para la profilaxis de rutina, la eficacia de NUWIQ se evaluó en dos estudios multicéntricos, uno en pacientes adultos (n = 32) y otro en pacientes pediátricos (n = 59). Para el tratamiento de episodios hemorrágicos, la eficacia se evaluó en un estudio multicéntrico en adolescentes (n = 2) y adultos (n = 20) que recibieron tratamiento a demanda únicamente, y también en pacientes que experimentaron episodios hemorrágicos intercurrentes en los dos estudios de profilaxis. En todos los estudios, se evaluó la eficacia hemostática en pacientes sometidos a procedimientos quirúrgicos durante el manejo perioperatorio.
Tratamiento a demanda y control de episodios hemorrágicos
Se trataron un total de 1124 episodios hemorrágicos en 69 pacientes (35 adultos, 2 adolescentes y 32 niños) con NUWIQ. La respuesta a cada tratamiento fue evaluada por los pacientes utilizando una escala ordinal de excelente (alivio del dolor abrupto y/o mejora inequívoca en los signos objetivos de hemorragia en aproximadamente 8 horas después de una sola infusión), buena (alivio definido del dolor y/o mejora en los signos de hemorragia en aproximadamente 8-12 horas después de una infusión que requiere hasta 2 infusiones para la resolución completa), moderada (efecto beneficioso probable o leve en aproximadamente 12 horas después de la primera infusión que requiere más de dos infusiones para la resolución completa), o ninguna (ninguna mejora en 12 horas, o empeoramiento de los síntomas, que requiere más de 2 infusiones para la resolución completa).
La mayoría de los episodios hemorrágicos tratados (n = 986) correspondieron al estudio donde los pacientes solo recibieron tratamiento a demanda. 642 (65%) episodios hemorrágicos ocurrieron espontáneamente, 341 (35%) fueron traumáticos, y 3 (0.3%) episodios hemorrágicos se debieron a otras causas. La dosis media por inyección utilizada para tratar un episodio hemorrágico fue de 32 UI/kg. La eficacia hemostática en respuesta al tratamiento con NUWIQ se calificó como excelente o buena en el 94% y como moderada en el 6% de las hemorragias.
En caso de episodios hemorrágicos intercurrentes, la dosis media por inyección utilizada para tratar un episodio hemorrágico fue de 33.3 UI/kg en adultos (n=15 con 30 episodios hemorrágicos) y 45 UI/kg en pacientes pediátricos (n=32 con 108 episodios hemorrágicos). La mediana del número de inyecciones para tratar un episodio hemorrágico fue de 1. La eficacia hemostática fue excelente o buena en el 100% de las hemorragias en adultos y en el 82% de las hemorragias en pacientes pediátricos.
Manejo perioperatorio de la hemorragia
En todos los estudios, la eficacia de NUWIQ en la profilaxis quirúrgica se evaluó en un total de 60 procedimientos quirúrgicos en 36 pacientes; 32 procedimientos en 16 pacientes se clasificaron como menores y 28 procedimientos en 23 pacientes se clasificaron como mayores. La dosificación preoperatoria de NUWIQ osciló entre 33 UI/kg y 90 UI/kg por infusión. El número total de infusiones administradas osciló entre una y 19 para procedimientos menores y entre tres y 76 para procedimientos mayores; tres procedimientos requirieron una inyección de NUWIQ durante la cirugía.
La eficacia de la profilaxis quirúrgica fue calificada para cada caso por un cirujano y un hematólogo, teniendo en cuenta la evaluación intra- y postoperatoria. La eficacia de la hemostasia fue calificada al final de la cirugía por el cirujano y postoperatoriamente por el cirujano y el hematólogo utilizando escalas ordinales como sigue:
- Excelente: Intraoperatorio: pérdida de sangre intraoperatoria inferior o igual a la pérdida de sangre media esperada para el tipo de procedimiento realizado en un paciente con hemostasia normal; Postoperatorio: Ausencia de hemorragia o exudación postoperatoria que no se deba a complicaciones de la cirugía. Toda hemorragia postoperatoria (debida a complicaciones de la cirugía) se controló con NUWIQ como se preveía para el tipo de procedimiento.
- Buena: Intraoperatorio: la pérdida de sangre intraoperatoria fue superior a la pérdida de sangre media esperada, pero inferior o igual a la pérdida de sangre máxima esperada para el tipo de procedimiento en un paciente con hemostasia normal; Postoperatorio: Ausencia de hemorragia o exudación postoperatoria que no se deba a complicaciones de la cirugía. El control de la hemorragia postoperatoria debida a complicaciones de la cirugía requirió un aumento de la dosis con NUWIQ o infusiones adicionales, no previstas originalmente para el tipo de procedimiento.
- Moderada: Intraoperatorio: la pérdida de sangre intraoperatoria fue superior a la pérdida de sangre máxima esperada para el tipo de procedimiento realizado en un paciente con hemostasia normal, pero la hemostasia se controló. Postoperatorio: Algo de hemorragia y exudación postoperatoria que no se debieron a complicaciones de la cirugía; el control de la hemorragia postoperatoria requirió un aumento de la dosis con NUWIQ o infusiones adicionales, no previstas originalmente para el tipo de procedimiento.
- Ninguna: Intraoperatorio: la hemostasia no se controló, lo que obligó a cambiar el régimen de sustitución del factor de coagulación. Postoperatorio: Hemorragia y exudación postoperatoria extensas e incontroladas. El control de la hemorragia postoperatoria requirió el uso de un concentrado de FVIII alternativo.
La eficacia para 28 cirugías mayores se calificó como excelente en 23 (82%) casos, buena en 4 (14%) casos y moderada en 1 (4%) caso. La eficacia de las 30 cirugías menores calificadas fue excelente.
Profilaxis de rutina y control de la hemorragia
En el estudio que evaluó la eficacia y la seguridad de NUWIQ para la profilaxis de rutina en 32 pacientes adultos (29 blancos, 3 asiáticos), el producto se administró cada dos días con una dosis de 30-40 UI/kg durante al menos 6 meses. En otro estudio que evaluó la seguridad, la inmunogenicidad y la eficacia hemostática en 59 pacientes pediátricos de 2 a 12 años de edad (todos blancos, 29 tenían entre 2 y 5 años, y 30 entre 6 y 12 años), los pacientes recibieron NUWIQ profilácticamente cada dos días o 3 veces por semana durante al menos 6 meses. Los resultados clínicos se resumen en
Tabla 6
.
Tabla 6. Resultados clínicos en pacientes adultos y pediátricos
| Adultos (N=32) | Niños (N=59) | ||
| Dosis media (± desviación estándar) | 32.8 ± 2.8 UI/kg | 38.9 ± 7.2 UI/kg |
| Pacientes con 0 episodios de hemorragia | 16 (50.0%) | 20 (33.9%) |
| Pacientes con 1 episodio de hemorragia | 11 (34.4%) | 14 (23.7%) |
| Pacientes con 2 episodios de hemorragia | – | 3 (5.1%) |
| Pacientes con ≥ 3 episodios de hemorragia | – | 22 (37.3%) |
| Pacientes con ≥5 episodios de hemorragia | 5 (15.6%) | |
| Tasa anualizada de hemorragia (por paciente) – hemorragias espontáneas | 1.16 ± 2.57 (mediana 0, rango 0-8.6) | 1.50 ± 3.32 (mediana 0, rango 0-13.8) |
| Tasa anualizada de hemorragia (por paciente) para todos los tipos de hemorragias | 2.28 ± 3.73 (mediana 0.9, rango 0-14.7) | 4.12 ± 5.22 (mediana 1.90, rango 0-20.7) |
| Reducción en la tasa anualizada de hemorragia en comparación con el tratamiento a demanda en un estudio diferente* | 96% | 93% |
La gravedad de las hemorragias (% de hemorragias) en los adultos fueron mayores 16 (36.4%), menores – 28 (63.6%), potencialmente mortales 0. La gravedad de las hemorragias en los niños fue moderada o mayor 64 (42.6%), menor 61 (56.5%), desconocida 1 (0.9%), potencialmente mortal 0. * Basado en un modelo binomial negativo.
En un estudio de 59 pacientes pediátricos previamente tratados de 2 a 12 años de edad, los niños recibieron un total de 5746 infusiones. De estas infusiones, 5316 (93%) fueron para profilaxis, 216 (4%) para el tratamiento de episodios de hemorragia, 41 (0.7%) para el manejo perioperatorio y 173 (3%) para evaluaciones farmacocinéticas (PK) y de recuperación.
El tratamiento a largo plazo con profilaxis de rutina se evaluó en una extensión del estudio pediátrico en el que 49 niños (2-5 años [N=26] y 6-12 años [N=23]) que habían completado el estudio pediátrico original fueron tratados con 20,518 infusiones adicionales de NUWIQ durante un promedio de 29.4 meses adicionales. En ambos estudios, se administraron un total de 26,289 infusiones y 33,724,769 UI (990,927 UI/kg). De estas infusiones, 25,040 (95.2%) fueron para profilaxis, 700 (2.7%) para el tratamiento de episodios de hemorragia, 304 (1.2%) para el manejo perioperatorio, 247 (0.9%) para evaluaciones de recuperación y 189 (0.7%) para análisis farmacocinéticos. La dosis mediana por infusión profiláctica fue de 37 UI/kg (rango 12.8-124 UI/kg).
La tasa anualizada media de hemorragia fue de 3.5 ± 4.4 (mediana 2.2, rango 0.0 – 24.7). Ocho de los 59 niños (14%) no presentaron hemorragias.
16 SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Presentación
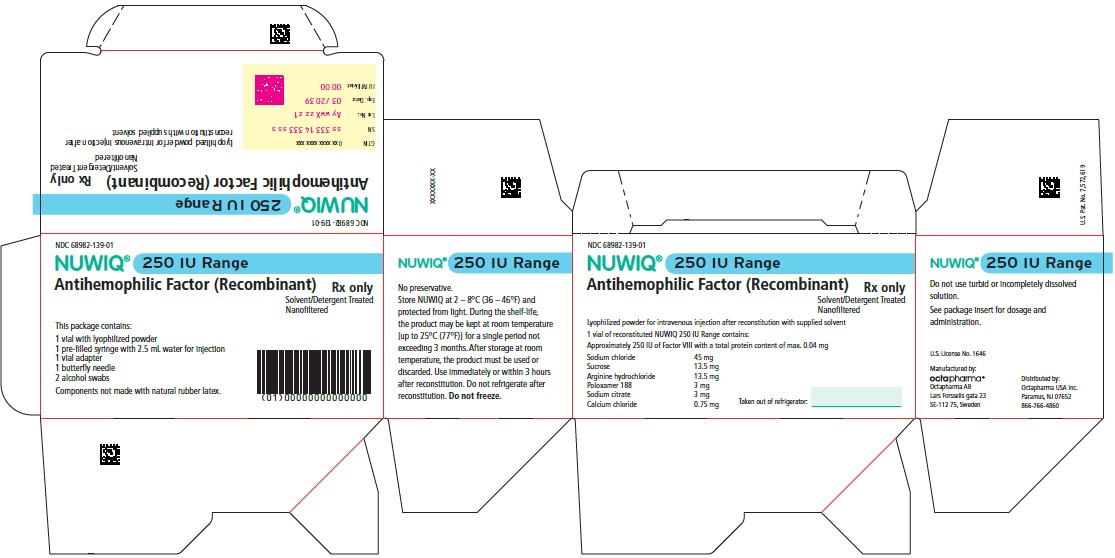
- NUWIQ se presenta en envases que contienen un vial de dosis única con 250, 500, 1000, 2000, 2500, 3000 o 4000 unidades internacionales (UI) nominales de Factor VIII, una jeringa precargada con 2,5 mL de disolvente (Agua para inyección), un adaptador para vial, una aguja mariposa y dos torundas de alcohol. La cantidad real de NUWIQ en UI se indica en cada caja y vial.
- Los componentes utilizados en el envase de NUWIQ no están fabricados con látex de caucho natural.
| Color | Concentración nominal | NDC del envase | NDC de la caja |
| azul pálido | NUWIQ 250 UI | 68982-140-01 | 68982-139-01 |
| rosa pálido | NUWIQ 500 UI | 68982-142-01 | 68982-141-01 |
| azul verdoso | NUWIQ 1000 UI | 68982-144-01 | 68982-143-01 |
| morado | NUWIQ 1500 UI | 68982-154-01 | 68982-153-01 |
| naranja | NUWIQ 2000 UI | 68982-146-01 | 68982-145-01 |
| marrón | NUWIQ 2500 UI | 68982-148-01 | 68982-147-01 |
| gris oscuro | NUWIQ 3000 UI | 68982-150-01 | 68982-149-01 |
| verde oscuro | NUWIQ 4000 UI | 68982-152-01 | 68982-151-01 |
Conservación y manipulación
- Conserve NUWIQ en su envase original para proteger los viales de NUWIQ de la luz.
- Conserve NUWIQ en polvo a 2 – 8°C (35 – 46°F) durante un máximo de 24 meses. No congelar.
- Durante su vida útil, el producto puede conservarse a temperatura ambiente [hasta 25°C (77°F)] durante un único periodo que no exceda los 3 meses. Después de conservarlo a temperatura ambiente, no vuelva a refrigerar el producto.
- No usar después de la fecha de caducidad.
- Mantenga la solución reconstituida a temperatura ambiente. No refrigerar después de la reconstitución. Utilice la solución reconstituida inmediatamente o en el plazo de 3 horas después de la reconstitución. Deseche cualquier solución restante.
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
-
Aconseje a los pacientes que lean el etiquetado del paciente aprobado por la FDA (
Información para el paciente
y
Instrucciones de uso
) - Debido a que son posibles reacciones de hipersensibilidad con NUWIQ, informe a los pacientes sobre los primeros signos de reacciones de hipersensibilidad, incluyendo urticaria, urticaria generalizada, opresión en el pecho, sibilancias, hipotensión y anafilaxia. Aconseje a los pacientes que interrumpan la inyección si surge alguno de estos síntomas y que se pongan en contacto con su médico y busquen tratamiento de emergencia inmediato.
- Aconseje a los pacientes que se pongan en contacto con su médico o centro de tratamiento para recibir más tratamiento o evaluación si experimentan una falta de respuesta clínica a la terapia de reemplazo del Factor VIII, ya que esto puede ser una manifestación de un inhibidor.
- Aconseje a los pacientes que consulten con su proveedor de atención médica antes de viajar. Durante el viaje, se debe aconsejar a los pacientes que lleven una cantidad suficiente de NUWIQ según su régimen de tratamiento actual.
Fabricado por:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Suecia
Licencia de EE. UU. N.º 1646
Distribuido por:
Octapharma USA, Inc.
117 West Century Road
Paramus, NJ 07652
PROSPECTO PARA EL PACIENTE
ETIQUETADO PARA EL PACIENTE APROBADO POR LA FDA
Información para el paciente
NUWIQ
/nu’ veek /
Factor Antihemofílico (Recombinante)
Lea atentamente esta información para el paciente antes de usar NUWIQ y cada vez que le surtan una nueva receta, ya que puede haber información nueva. Esta información para el paciente no sustituye las conversaciones con su proveedor de atención médica sobre su afección médica o su tratamiento.
¿Qué es NUWIQ
?
NUWIQ es un medicamento inyectable que se usa para ayudar a tratar y controlar el sangrado en adultos y niños con hemofilia A (deficiencia congénita del factor VIII de coagulación). NUWIQ puede reducir la cantidad de episodios de sangrado en niños y adultos cuando se usa regularmente (profilaxis). Por lo general, el tratamiento de la hemofilia A es de por vida.
Su proveedor de atención médica también puede administrarle NUWIQ cuando se someta a una cirugía.
NUWIQ NO se usa para tratar la enfermedad de von Willebrand.
¿Quién no debe usar NUWIQ
?
No debe usar NUWIQ si ha tenido una reacción alérgica a este en el pasado.
Informe a su proveedor de atención médica si está (o planea quedar) embarazada y/o amamantando, porque NUWIQ puede no ser adecuado para usted.
¿Qué debo decirle a mi proveedor de atención médica antes de usar NUWIQ
?
Hable con su proveedor de atención médica sobre cualquier afección médica que tenga o haya tenido, incluso si le han dicho que tiene inhibidores del factor VIII, porque NUWIQ puede no funcionar para usted.
Informe a su proveedor de atención médica sobre todos los medicamentos recetados y de venta libre que toma, incluidos los medicamentos de venta libre, los suplementos dietéticos y/o las medicinas herbales.
¿Cómo debo usar NUWIQ
?
Recibirá NUWIQ como una infusión en su vena. NUWIQ se vende como un polvo en un vial. El polvo se mezcla con agua estéril suministrada en una jeringa precargada. Consulte las instrucciones para la reconstitución e inyección de NUWIQ.
Su proveedor de atención médica le indicará cómo realizar las reconstituciones e infusiones por sí mismo o con la ayuda de un familiar. Su proveedor de atención médica puede observar cómo se administra la primera dosis de NUWIQ.
Debe seguir cuidadosamente las instrucciones de su proveedor de atención médica con respecto a la dosis y el horario para la infusión de NUWIQ para que su tratamiento funcione de manera óptima.
NUWIQ viene en diferentes concentraciones. La cantidad real de unidades internacionales (UI) de Factor VIII en el vial se imprimirá en la etiqueta y la caja. Siempre verifique la cantidad real de UI de Factor VIII impresa en la etiqueta para asegurarse de que está utilizando la concentración prescrita por su proveedor de atención médica.
Comuníquese con su proveedor de atención médica de inmediato si el sangrado no se controla después de usar NUWIQ.
Hable con su proveedor de atención médica antes de viajar. Planifique llevar suficiente NUWIQ para su tratamiento durante este tiempo.
No deje de usar NUWIQ sin consultar con su proveedor de atención médica.
¿Cuáles son los posibles efectos secundarios de NUWIQ
?
Pueden producirse reacciones alérgicas con NUWIQ. Detenga la inyección inmediatamente y llame a su proveedor de atención médica o al departamento de emergencias de inmediato si tiene alguno de los siguientes síntomas: mareos, pérdida del conocimiento, dificultad para respirar, sibilancias, opresión en el pecho, hinchazón de los labios y la lengua, erupción cutánea o urticaria.
Su cuerpo también puede producir anticuerpos (conocidos como inhibidores) contra el Factor VIII, lo que puede impedir que NUWIQ funcione correctamente. Su proveedor de atención médica puede analizar su sangre para detectar inhibidores a intervalos regulares.
Los efectos secundarios que se han notificado con NUWIQ incluyen: inflamación en el sitio de inyección, dolor en el sitio de inyección, sensación de hormigueo o pinchazos, dolor de cabeza, dolor de espalda, mareos y sequedad de boca.
Estos no son todos los posibles efectos secundarios de NUWIQ. Hable con su proveedor de atención médica sobre cualquier efecto secundario que le moleste o que no desaparezca.
¿Cómo debo almacenar NUWIQ
?
Mantenga NUWIQ en su caja original para protegerlo de la exposición a la luz. No congele NUWIQ.
Puede almacenar NUWIQ en el refrigerador hasta por 24 meses a 2-8 °C (36-46 °F). NUWIQ se puede conservar a temperatura ambiente [hasta 25 °C (77 °F)] durante un solo período que no exceda los 3 meses (anote en el cartón la fecha en que se retiró el producto del refrigerador). Después del almacenamiento a temperatura ambiente, el producto debe usarse o desecharse, y no debe volver a colocarse en el refrigerador.
No use NUWIQ después de la fecha de vencimiento impresa en el vial.
No use NUWIQ si la solución reconstituida está turbia, contiene partículas y/o no es incolora.
NUWIQ debe usarse lo antes posible después de la reconstitución. Proteja NUWIQ reconstituido de la luz y temperaturas superiores a 25 °C (77 °F). Deseche cualquier producto que no se use dentro de las tres horas.
Deseche todos los materiales, incluido cualquier NUWIQ sin usar, en un recipiente adecuado.
¿Qué más debo saber sobre NUWIQ
?
No use NUWIQ para una afección médica para la que no se le recetó. No comparta NUWIQ con otras personas, incluso si tienen el mismo diagnóstico y síntomas que usted.
Recursos de Octapharma disponibles para los pacientes
Para obtener más información sobre el producto NUWIQ, visite www.NUWIQ.com.
Para obtener más información sobre los programas de asistencia al paciente que están disponibles para usted, comuníquese con el Centro de atención al paciente de Octapharma al 1-800-554-4440.
Para obtener más información sobre recursos adicionales para pacientes de Octapharma, visite www.NUWIQ.com.
Fabricado por:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Suecia
Licencia de EE. UU. N.º 1646
Distribuido por:
Octapharma USA, Inc.
117 West Century Road
Paramus, NJ 07652
NUWIQ es una marca registrada de Octapharma.
INSTRUCCIONES DE USO
NUWIQ
/nu’ veek /
Factor Antihemofílico (Recombinante)
Lea estas instrucciones atentamente antes de usar NUWIQ por primera vez. Debe asegurarse de tener la capacitación adecuada de su proveedor de atención médica o centro de tratamiento de hemofilia antes de intentar una autoinfusión de NUWIQ. Siempre siga la dosis prescrita y las instrucciones específicas dadas por su proveedor de atención médica. Las pautas generales para mezclar e infundir NUWIQ se enumeran a continuación. Si no está seguro de alguno de estos pasos, comuníquese con su proveedor de atención médica antes de usar NUWIQ.
Instrucciones para Mezclar NUWIQ
- Siempre trabaje en una superficie limpia y lávese las manos antes de realizar el procedimiento.
- Deje que el vial de NUWIQ y la jeringa precargada alcancen la temperatura ambiente.
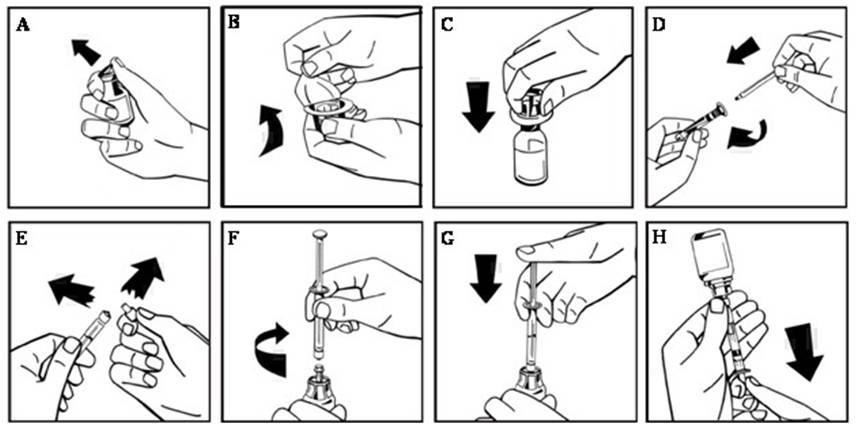
- Retire la tapa abatible de plástico del vial de NUWIQ para exponer el tapón de goma (Figura A).
- Limpie la parte superior del vial con un hisopo con alcohol y deje que el tapón de goma del vial se seque.
- Retire la cubierta de papel del paquete del adaptador del vial, dejando al descubierto la punta del adaptador sin sacarlo del paquete (Figura B).
- Con el vial sobre una superficie plana, inserte la punta del adaptador en el tapón de goma. El adaptador encaja en el vial cuando está listo (Figura C).
- Retire la cubierta de papel del paquete de la jeringa precargada. Conecte la varilla del émbolo uniendo el extremo roscado de la varilla del émbolo a la jeringa de disolvente, girando en el sentido de las agujas del reloj hasta que sienta una ligera resistencia (Figura D). Evite el contacto con el eje de la varilla del émbolo.
- Rompa la punta de plástico a prueba de manipulaciones de la jeringa rompiendo la perforación de la tapa. No toque el interior de la tapa ni la punta de la jeringa (Figura E).
- Retire el embalaje del adaptador y conecte la jeringa al adaptador del vial girando en el sentido de las agujas del reloj hasta que sienta resistencia (Figura F).
- Inyecte lentamente todo el líquido de la jeringa en el vial de concentrado (Figura G).
- Sin retirar la jeringa, disuelva el polvo concentrado en el vial moviéndolo o girándolo suavemente varias veces. NO AGITE. Espere hasta que todo el polvo se disuelva por completo.
- Inspeccione la solución final en busca de partículas. La solución debe ser transparente, incolora y libre de partículas visibles. No la use si la solución está turbia o si tiene partículas visibles.
- Dé la vuelta al vial y a la jeringa (aún unidos).
- Extraiga lentamente la solución en la jeringa. Asegúrese de que todo el líquido se transfiera a la jeringa (Figura H).
- Separe la jeringa llena del adaptador del vial girando en sentido contrario a las agujas del reloj.
- No refrigere la solución después de la reconstitución. Use la solución dentro de las 3 horas posteriores a la reconstitución. Si la solución no se usa dentro de este período de tiempo, cierre la jeringa llena con la punta de plástico a prueba de manipulaciones y deseche la jeringa.
Instrucciones para Inyectar NUWIQ
Para uso intravenoso después de la reconstitución únicamente.
- Inspeccione la solución reconstituida de NUWIQ para detectar partículas visibles y decoloración antes de la administración. No la use si se observan partículas o decoloración.
- No administre NUWIQ en el mismo tubo o contenedor que otros medicamentos.
- Limpie el lugar de inyección elegido con un hisopo con alcohol.
- Conecte el equipo de infusión provisto a la jeringa. Inserte la aguja del equipo de infusión en la vena elegida.
- Realice una infusión intravenosa en bolo. La velocidad de administración debe determinarse según la comodidad del paciente, a una velocidad máxima de 4 ml por minuto.
- Después de infundir NUWIQ, retire y deseche adecuadamente el equipo de infusión. Después de la infusión, retire la etiqueta despegable que contiene el número de lote del vial de concentrado de factor y colóquela en el libro de registro para su registro. Deseche el vial vacío.
Fabricado por:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Suecia
U.S. License No. 1646
Distribuido por:
Octapharma USA, Inc.
117 West Century Road
Paramus, NJ 07652
NUWIQ es una marca registrada de Octapharma.
Publicado en septiembre de 2020.
ETIQUETA DEL ENVASE – PANEL PRINCIPAL DE PRESENTACIÓN
Etiqueta de la caja – Panel de visualización principal
Rango de 250 UI
NDC 68982-139-01
NUWIQ
®
Factor Antihemofílico (Recombinante)
Polvo Liofilizado para Solución Inyectable Intravenosa
Fabricado por:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Suecia
Licencia de EE. UU. n.° 1646

Etiqueta de la caja – Panel de visualización principal
Rango de 500 UI
NDC 68982-141-01
NUWIQ
®
Factor Antihemofílico (Recombinante)
Polvo Liofilizado para Solución Inyectable Intravenosa
Fabricado por:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Suecia
Licencia de EE. UU. n.° 1646
Etiqueta de la caja – Panel de visualización principal
Rango de 1000 UI
NDC 68982-143-01
NUWIQ
®
Factor Antihemofílico (Recombinante)
Polvo Liofilizado para Solución Inyectable Intravenosa
Fabricado por:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Suecia
Licencia de EE. UU. n.° 1646

Etiqueta de la caja – Panel de visualización principal
Rango de 1500 UI
NDC 68982-153-01
NUWIQ
®
Factor Antihemofílico (Recombinante)
Polvo Liofilizado para Solución Inyectable Intravenosa
Fabricado por:
Octapharma AB
Lars Forssells gata 23
SE-112 75, Suecia
Licencia de EE. UU. n.° 1646