Fabricante de medicamentos: Takeda Pharmaceuticals Amercia, Inc. (Updated: 2024-01-05)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
ADYNOVATE, (Factor Antihemofílico, Recombinante, PEGilado) Polvo liofilizado para solución para inyección intravenosa
Aprobación inicial en EE. UU.: 2015
CAMBIOS PRINCIPALES RECIENTES
| Advertencias y precauciones (5.1) | 8/2023 |
INDICACIONES Y USO
ADYNOVATE, Factor Antihemofílico (Recombinante), PEGilado, es un factor antihemofílico humano indicado en niños y adultos con hemofilia A (deficiencia congénita del factor VIII) para:
- Tratamiento a demanda y control de episodios de sangrado
- Manejo perioperatorio
- Profilaxis de rutina para reducir la frecuencia de episodios de sangrado
Limitación de uso
ADYNOVATE no está indicado para el tratamiento de la enfermedad de von Willebrand. (1)
DOSIFICACIÓN Y ADMINISTRACIÓN
Para uso intravenoso después de la reconstitución únicamente.
- Una unidad por kilogramo de peso corporal elevará el nivel del factor VIII en un 2% de unidades internacionales por decilitro (UI por dL). Cada vial de ADYNOVATE está etiquetado con la cantidad real de factor VIII recombinante presente en UI. (2.1)
- Tratamiento a demanda y control de episodios de sangrado y manejo perioperatorio:
- Incremento estimado del factor VIII (UI/dL o % de normal) = [Dosis total (UI)/peso corporal (kg)] × 2 (UI/dL por UI/kg)
- Dosis (UI) = Peso corporal (kg) × Aumento deseado del factor VIII (UI/dL o % de normal) × 0.5 (UI/kg por UI/dL)
Profilaxis de rutina:
- Administrar 40-50 UI/kg de peso corporal dos veces por semana en adultos y adolescentes (12 años o más).
- Administrar 55 UI/kg dos veces por semana en niños (<12 años) con un máximo de 70 UI/kg
- Ajuste la dosis y los intervalos de dosificación según la respuesta clínica del paciente.
- Inyectar por vía intravenosa durante un período de menos de o igual a 5 minutos (velocidad de infusión máxima de 10 mL por minuto). (2.3)
FORMAS DE DOSIFICACIÓN Y FUERZAS
ADYNOVATE está disponible como polvo liofilizado en viales de dosis única que contienen nominalmente (aproximadamente) 250, 500, 750, 1000, 1500, 2000 o 3000 unidades internacionales. (3)
CONTRAINDICACIONES
No lo use en pacientes que hayan tenido una reacción anafiláctica previa a ADYNOVATE, la molécula madre (ADVATE), proteína de ratón o hámster, o excipientes de ADYNOVATE. (4)
ADVERTENCIAS Y PRECAUCIONES
- Se han reportado reacciones de hipersensibilidad, incluida la anafilaxis. Si ocurren síntomas, suspenda el tratamiento con ADYNOVATE y administre el tratamiento apropiado. (5.1)
- Puede ocurrir el desarrollo de anticuerpos neutralizantes del factor VIII (inhibidores). Si no se alcanzan los niveles esperados de actividad del factor VIII en plasma, o si el sangrado no se controla con una dosis apropiada, realice un ensayo que mida la concentración del inhibidor del factor VIII. (5.2, 5.3)
REACCIONES ADVERSAS
Las reacciones adversas más comunes reportadas en ≥1% de los sujetos en los estudios clínicos fueron dolor de cabeza, diarrea, erupción cutánea, náuseas, mareos y urticaria. (6)
Para reportar REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Takeda Pharmaceuticals U.S.A., Inc. al 1-877-TAKEDA-7 (1-877-825-3327) o la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
USO EN POBLACIONES ESPECÍFICAS
Uso pediátrico: Se ha observado una mayor depuración, una vida media más corta y una menor recuperación incremental del factor VIII en niños (<12 años). Puede ser necesario un ajuste de la dosis o una dosificación más frecuente en función del peso corporal por kg en esta población. (8.4)
Ver 17 para INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y etiquetado del paciente aprobado por la FDA.
Revisado: 8/2023
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis
2.2 Preparación y Reconstitución
2.3 Administración
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de Hipersensibilidad
5.2 Anticuerpos Neutralizantes
5.3 Monitoreo de Pruebas de Laboratorio
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Inmunogenicidad
6.3 Experiencia Postcomercialización
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14 ESTUDIOS CLÍNICOS
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
1 INDICACIONES Y USO
ADYNOVATE, Factor Antihemofílico (Recombinante), PEGilado, es un factor antihemofílico humano indicado en niños y adultos con hemofilia A (deficiencia congénita del factor VIII) para:
- Tratamiento a demanda y control de episodios de sangrado
- Manejo perioperatorio
- Profilaxis de rutina para reducir la frecuencia de episodios de sangrado
Limitación de Uso
ADYNOVATE no está indicado para el tratamiento de la enfermedad de von Willebrand.
2 DOSIS Y ADMINISTRACIÓN
Para uso intravenoso después de la reconstitución únicamente.
2.1 Dosis
- Cada etiqueta del vial de ADYNOVATE indica la potencia real del factor VIII en unidades internacionales. Esto puede ser más o menos que la potencia/contenido nominal del vial. Una unidad internacional corresponde a la actividad del factor VIII contenida en un mililitro de plasma humano normal.
- La dosis y la duración del tratamiento dependen de la gravedad de la deficiencia de factor VIII, la ubicación y la extensión del sangrado, y la condición clínica del paciente. Es necesario un control cuidadoso de la terapia de reemplazo en casos de episodios de sangrado graves o potencialmente mortales.
- La asignación de potencia se determina utilizando un ensayo de coagulación de un solo paso. Los niveles de factor VIII plasmático se pueden controlar clínicamente utilizando un ensayo de coagulación de un solo paso.
- Calcule la dosis de ADYNOVATE en base al hallazgo empírico de que una unidad internacional de ADYNOVATE por kg de peso corporal aumenta el nivel de factor VIII plasmático en 2 UI por dL de plasma. Utilice la siguiente fórmula para estimar el aumento máximo esperado in vivo en el nivel de factor VIII expresado como UI por dL (o % de normal) y la dosis para lograr un aumento máximo deseado in vivo en el nivel de factor VIII:
Incremento estimado del factor VIII (UI/dL o % de normal) = [Dosis total (UI)/peso corporal (kg)] × 2 (UI/dL por UI/kg)
Dosis (UI) = Peso corporal (kg) × Aumento deseado del factor VIII (UI/dL o % de normal) × 0.5 (UI/kg por UI/dL)
- Los pacientes varían en su respuesta farmacocinética (por ejemplo, aclaramiento, vida media, recuperación in vivo) y clínica. Base la dosis y la frecuencia de ADYNOVATE en la respuesta clínica individual.
Tratamiento a demanda y control de episodios de sangrado
Se proporciona una guía para la dosificación de ADYNOVATE para el tratamiento a demanda y el control de episodios de sangrado en la Tabla 1. Mantenga el nivel de actividad del factor VIII plasmático en o por encima de los niveles plasmáticos descritos (en UI por dL o % de normal).
| Tipo de sangrado | Nivel objetivo del factor VIII (UI/dL o % de normal) |
Dosis* (UI/kg) |
Frecuencia de dosificación (horas) |
Duración de la terapia |
|---|---|---|---|---|
|
||||
| Menor Hemartrosis temprana, sangrado muscular leve o episodio de sangrado oral leve. |
20-40 | 10-20 | 12-24 | Hasta que el sangrado se resuelva |
| Moderado Sangrado muscular, sangrado moderado en la cavidad oral, hemartrosis definidas y trauma conocido. |
30-60 | 15-30 | 12-24 | Hasta que el sangrado se resuelva |
| Mayor Sangrado gastrointestinal significativo, intracraneal, intraabdominal o intratorácico, sangrado del sistema nervioso central, sangrado en los espacios retrofaríngeos o retroperitoneales o vaina iliopsoas, fracturas, trauma craneal. |
60-100 | 30-50 | 8-24 | Hasta que el sangrado se resuelva. |
Manejo perioperatorio
Se proporciona una guía para la dosificación de ADYNOVATE durante la cirugía (manejo perioperatorio) en la Tabla 2. Se debe considerar mantener una actividad del factor VIII en o por encima del rango objetivo.
| Tipo de cirugía | Nivel de factor VIII requerido (% de normal o UI/dL) |
Dosis (UI/kg) |
Frecuencia de dosis (horas) |
Duración del tratamiento |
|---|---|---|---|---|
| Menor Incluyendo extracción de dientes |
60-100 | 30-50 | Dentro de una hora antes de la cirugía. Repetir después de 24 horas si es necesario |
Dosis única o repetir según sea necesario hasta que el sangrado se resuelva. |
| Mayor Cirugía intracraneal, intraabdominal o intratorácica, cirugía de reemplazo articular |
80-120 (pre y postoperatorio) |
40-60 | Dentro de una hora antes de la operación para lograr una actividad del 100%. Repetir cada 8 a 24 horas (6 a 24 horas para pacientes <12 años de edad) para mantener la actividad de FVIII dentro del rango objetivo |
Hasta que la cicatrización de la herida sea adecuada |
Profilaxis de rutina
Administrar 40-50 UI/ kg de peso corporal dos veces por semana en adultos y adolescentes (12 años y mayores). Administrar 55 UI por kg de peso corporal dos veces por semana en niños (< 12 años) con un máximo de 70 UI/kg. Ajuste la dosis y los intervalos de dosificación según la respuesta clínica del paciente.
2.2 Preparación y reconstitución
Preparación
- No retire los viales de ADYNOVATE o diluyente de la carcasa externa.
- Examine el embalaje que contiene ADYNOVATE para asegurarse de que no haya daños o desprendimiento de la tapa. No lo use si la tapa no está completamente sellada en la ampolla.
- Utilice una técnica aséptica (limpia y libre de gérmenes) y una superficie de trabajo plana durante el procedimiento de reconstitución.
Reconstitución
- Deje que el paquete de ADYNOVATE alcance la temperatura ambiente antes de usarlo.
- Abra el paquete pelando la tapa. Retire ADYNOVATE del paquete y verifique que la fecha de vencimiento en la etiqueta no haya pasado y que el número de unidades de potencia sea el mismo que se espera. Inspeccione los productos farmacéuticos parenterales para detectar decoloración y partículas. El polvo de ADYNOVATE debe ser de color blanco a blanquecino y el diluyente debe estar libre de partículas extrañas. No lo use si no se cumplen los criterios.
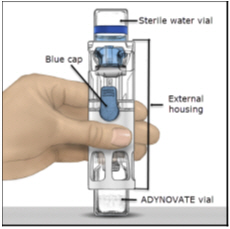
- Coloque el ADYNOVATE sobre una superficie plana con el vial de diluyente en la parte superior (Figura A). El vial de diluyente tiene una franja azul. No retire la tapa azul hasta que se le indique en un paso posterior.
Figura A 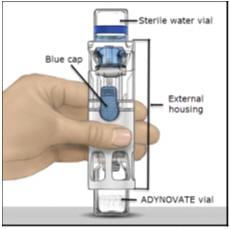
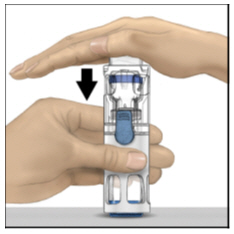
- Con una mano sujetando la carcasa de ADYNOVATE, presione firmemente sobre el vial de diluyente con la otra mano hasta que el sistema esté completamente colapsado y el diluyente fluya hacia el vial de ADYNOVATE (Figura B). No incline el sistema hasta que la transferencia esté completa.
Figura B 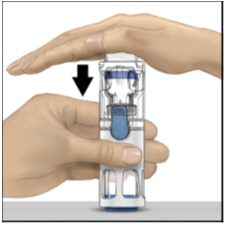
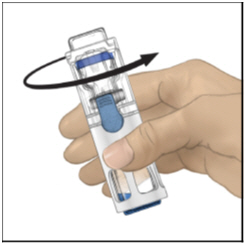
- Verifique que la transferencia del diluyente esté completa. Agite suavemente hasta que el polvo se disuelva completamente (Figura C). No agite. No refrigere después de la reconstitución.
Figura C 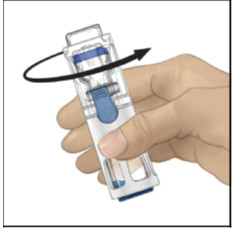
2.3 Administración
- Inspeccione visualmente la solución reconstituida de ADYNOVATE para detectar partículas y decoloración antes de la administración, siempre que la solución y el contenedor lo permitan. La solución final de ADYNOVATE debe ser transparente e incolora. No lo use si observa partículas o decoloración.
- Administre ADYNOVATE lo antes posible, pero no más tarde de 3 horas después de la reconstitución.
Pasos de administración:
- Retire la tapa azul de la carcasa. Conecte la jeringa al sistema (Figura D). No inyecte aire en el ADYNOVATE.
Figura D 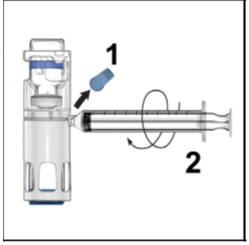
- Voltee el sistema boca abajo (el vial de ADYNOVATE ahora está en la parte superior). Extraiga la solución de ADYNOVATE en la jeringa tirando del émbolo lentamente (Figura E).
Figura E 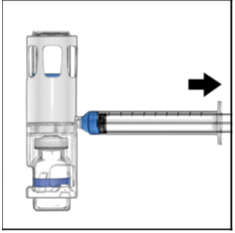
- Desconecte la jeringa, conecte una aguja adecuada e inyecte por vía intravenosa según las instrucciones. Si un paciente va a recibir más de un sistema ADYNOVATE -BAXJECT III o una combinación de un sistema ADYNOVATE -BAXJECT II y un sistema ADYNOVATE -BAXJECT III, el contenido se puede extraer en la misma jeringa.
- Administre ADYNOVATE por vía intravenosa durante un período de menos de o igual a 5 minutos (tasa de infusión máxima de 10 mL por minuto).
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
ADYNOVATE es un polvo liofilizado en viales de dosis única que contiene nominalmente (aproximadamente) 250, 500, 750, 1000, 1500, 2000 y 3000 Unidades Internacionales (UI, unidades). Las concentraciones de 250-1500 UI vienen con 2 mL de Agua Estéril para Inyección (sWFI); las concentraciones de 2000 y 3000 UI vienen con 5 mL de sWFI. La potencia/contenido real del factor VIII está etiquetada en cada vial de ADYNOVATE.
La asignación de potencia emplea un estándar de concentrado de factor VIII que se refiere a un estándar internacional de la OMS (Organización Mundial de la Salud) para concentrados de factor VIII y se evalúa mediante una metodología adecuada para garantizar la precisión de los resultados.
4 CONTRAINDICACIONES
ADYNOVATE está contraindicado en pacientes que han tenido una reacción anafiláctica previa a ADYNOVATE, a la molécula parental (ADVATE), proteína de ratón o hámster, o excipientes de ADYNOVATE (por ejemplo, Tris, manitol, trehalosa, glutatión y/o polisorbato 80).
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de hipersensibilidad
Se han notificado reacciones de hipersensibilidad, incluida la anafilaxia, con ADYNOVATE. Las reacciones de hipersensibilidad que pueden progresar a anafilaxia pueden incluir angioedema, opresión en el pecho, disnea, sibilancias, urticaria, prurito y náuseas y vómitos. Suspenda inmediatamente la administración e inicie el tratamiento adecuado si se producen reacciones de hipersensibilidad.
5.2 Anticuerpos neutralizantes
La formación de anticuerpos neutralizantes (inhibidores) al factor VIII puede ocurrir después de la administración de ADYNOVATE. Controle a los pacientes regularmente para detectar el desarrollo de inhibidores del factor VIII mediante observaciones clínicas y pruebas de laboratorio apropiadas. Realice un ensayo que mida la concentración del inhibidor del factor VIII si el nivel plasmático del factor VIII no aumenta como se esperaba, o si el sangrado no se controla con la dosis esperada.
5.3 Seguimiento de las pruebas de laboratorio
- Controle la actividad del factor VIII plasmático realizando un ensayo de coagulación de un solo paso validado para confirmar que se han alcanzado y mantenido los niveles adecuados de factor VIII [ver Dosificación y administración (2)].
- Controle el desarrollo de inhibidores del factor VIII. Realice el ensayo de inhibición de Bethesda para determinar si está presente el inhibidor del factor VIII. Si no se alcanzan los niveles plasmáticos esperados de actividad del factor VIII, o si el sangrado no se controla con la dosis esperada de ADYNOVATE, utilice unidades de Bethesda (BU) para determinar los niveles de inhibidores.
6 REACCIONES ADVERSAS
Las reacciones adversas más comunes (≥1 % de los sujetos) notificadas en los estudios clínicos fueron dolor de cabeza, diarrea, erupción cutánea, náuseas, mareos y urticaria.
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no pueden compararse directamente con las tasas en los ensayos clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica.
La seguridad de ADYNOVATE se evaluó en 365 pacientes previamente tratados (PPT) y pacientes no tratados previamente (PNP) con hemofilia A grave (factor VIII inferior al 1 % de lo normal), que recibieron al menos una dosis de ADYNOVATE en 6 estudios clínicos abiertos, prospectivos, multicéntricos completados y 1 estudio clínico en curso. El número total de infusiones en la base de datos de seguridad es de 74487. La Tabla 3 enumera las reacciones adversas notificadas durante los estudios clínicos.
| Sistema de clasificación de órganos de MedDRA | Término preferido de MedDRA | Número de sujetos n (%) (N=365) |
|---|---|---|
|
||
| Trastornos gastrointestinales | Diarrea | 25 (6.8%) |
| Náuseas | 8 (2.2%) | |
| Trastornos oculares | Hiperemia ocular | 3 (0.8%) |
| Trastorno del sistema inmunitario | Hipersensibilidad* | 2 (0.5%) |
| Trastornos del sistema nervioso | Dolor de cabeza | 41 (11.2%) |
| Mareos | 7 (1.9%) | |
| Trastornos de la piel y del tejido subcutáneo | Erupción cutánea | 10 (2.7%) |
| Urticaria | 7 (1.9%) | |
| Erupción pruriginosa | 1 (0.3%) | |
| Trastornos vasculares | Rubor | 1 (0.27%) |
| Investigaciones | Aumento del recuento de eosinófilos | 2 (0.5%) |
| Lesiones, intoxicaciones y complicaciones del procedimiento | Reacción relacionada con la infusión | 2 (0.5%) |
Se notificaron dos casos de pancreatitis aguda, sin causa precipitante identificada en un caso, en adultos durante un estudio de extensión del ensayo clínico en el que se evaluó a 216 sujetos. La administración de ADYNOVATE continuó y ambos casos se resolvieron.
6.2 Inmunogenicidad
Los sujetos de los ensayos clínicos fueron controlados para detectar anticuerpos neutralizantes (inhibidores) contra el FVIII. De los 6 ensayos clínicos completados en pacientes previamente tratados (PPT), en el ensayo controlado aleatorizado que comparaba diferentes regímenes de dosificación de Adynovate, un paciente previamente tratado desarrolló un inhibidor del FVIII transitorio de bajo título a 0.6 BU mientras recibía una dosificación más frecuente con Adynovate. En un estudio de continuación con Adynovate, un paciente desarrolló un inhibidor del FVIII transitorio de bajo título (0.6 BU). Las pruebas repetidas no confirmaron la presencia del inhibidor. Ambos sujetos continuaron el tratamiento sin cambios en la dosis de Adynovate.
La inmunogenicidad también se evaluó midiendo el desarrollo de anticuerpos IgG e IgM de unión contra el factor VIII, el factor VIII pegilado (PEG), el PEG y la proteína de ovario de hámster chino (CHO) utilizando ensayos ELISA validados. No se detectaron anticuerpos de unión emergentes del tratamiento persistentes contra el FVIII, el PEG-factor VIII o el PEG. De 365 sujetos, treinta y seis sujetos en total mostraron anticuerpos preexistentes contra el factor VIII (n=5), el PEG-factor VIII (n=31) y/o el PEG (n=6) antes de la primera exposición a ADYNOVATE. Veinticuatro sujetos que dieron negativo en la selección desarrollaron anticuerpos transitorios contra el factor VIII (n= 10), el PEG-factor VIII (n= 16) y/o el PEG (n=3) en una o dos visitas de estudio consecutivas. Los anticuerpos fueron transitorios y no detectables en las visitas posteriores. Dos sujetos mostraron resultados positivos para los anticuerpos de unión al finalizar el estudio o en el momento del corte de datos. Los anticuerpos de unión que se detectaron antes de la exposición a ADYNOVATE, que se desarrollaron transitoriamente durante el ensayo o que aún eran detectables al finalizar el estudio o en el momento del corte de datos no pudieron correlacionarse con ningún deterioro de la eficacia del tratamiento ni con la alteración de los parámetros farmacocinéticos. No hubo ninguna relación causal entre los eventos adversos observados y los anticuerpos de unión, excepto en un sujeto en el que no se puede descartar una relación causal basándose en los datos disponibles. Ningún sujeto tenía anticuerpos preexistentes o emergentes del tratamiento contra la proteína CHO.
De un estudio en curso en pacientes menores de 6 años no tratados previamente con hemofilia A grave, se notificaron 9 casos de desarrollo de inhibidores del FVIII asociados con el tratamiento con Adynovate.
La detección de anticuerpos que reaccionan con el factor VIII depende en gran medida de muchos factores, entre ellos: la sensibilidad y la especificidad del ensayo, la manipulación de las muestras, el momento de la toma de muestras, los medicamentos concomitantes y la enfermedad subyacente. Por estas razones, la comparación de la incidencia de anticuerpos contra ADYNOVATE con la incidencia de anticuerpos contra otros productos puede ser engañosa.
6.3 Experiencia posterior a la comercialización
Dado que la notificación de reacciones adversas posteriores a la comercialización es voluntaria y procede de una población de tamaño incierto, no siempre es posible estimar con fiabilidad la frecuencia de estas reacciones ni establecer una relación causal con la exposición al producto.
Trastornos del sistema inmunitario: Reacción anafiláctica
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgos
No hay datos sobre el uso de ADYNOVATE en mujeres embarazadas para informar un riesgo asociado a los medicamentos. No se han realizado estudios de reproducción animal con ADYNOVATE. Se desconoce si ADYNOVATE puede causar daño fetal cuando se administra a una mujer embarazada o puede afectar la capacidad de reproducción.
En la población general de los EE. UU., el riesgo de fondo estimado de defectos de nacimiento importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2-4% y del 15-20%, respectivamente.
8.2 Lactancia
Resumen de Riesgos
No hay información sobre la presencia de ADYNOVATE en la leche materna, el efecto en el lactante o los efectos sobre la producción de leche. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de ADYNOVATE y cualquier posible efecto adverso en el lactante amamantado por ADYNOVATE o por la condición materna subyacente.
8.4 Uso pediátrico
Se han realizado estudios de seguridad y eficacia en 91 pacientes pediátricos previamente tratados de 1 año a <18 años que recibieron al menos una dosis de ADYNOVATE como parte de la profilaxis de rutina, el tratamiento a demanda de episodios hemorrágicos o el manejo perioperatorio. Los sujetos adolescentes de 12 a <18 años (n=25) se inscribieron en el ensayo de seguridad y eficacia en adultos y adolescentes, y los sujetos de <12 años (n=66) se inscribieron en un ensayo pediátrico. La seguridad y eficacia de ADYNOVATE en la profilaxis de rutina y el tratamiento de episodios hemorrágicos fueron comparables entre niños y adultos. [ver Estudios clínicos (14)]
Los estudios farmacocinéticos en niños (<12 años) han demostrado una mayor depuración, una vida media más corta y una menor recuperación incremental del factor VIII en comparación con los adultos. Debido a que se ha demostrado que la depuración (basada en el peso corporal por kg) es mayor en niños (<12 años), puede ser necesario ajustar la dosis o administrar dosis más frecuentes basadas en el peso corporal por kg en esta población. [ver Farmacología clínica (12.3)]
11 DESCRIPCIÓN
ADYNOVATE, Factor Antihemofílico (Recombinante), PEGilado, se formula como un polvo liofilizado estéril, no pirogénico, de blanco a blanquecino para reconstitución para inyección intravenosa. El producto se suministra en viales de dosis única que contienen potencias nominales (aproximadas) de 250, 500, 750, 1000, 1500, 2000 o 3000 unidades internacionales (UI). Cada vial de ADYNOVATE está etiquetado con la actividad real del factor VIII en UI determinada utilizando un ensayo de coagulación de un solo paso, utilizando un material de referencia calibrado contra un Estándar Internacional de la Organización Mundial de la Salud (OMS) para concentrados de factor VIII. Una UI, según lo definido por el estándar de la OMS para el factor de coagulación sanguínea VIII, humano, es aproximadamente igual al nivel de actividad del factor VIII que se encuentra en 1 mL de plasma humano fresco combinado.
Cuando se reconstituye con 2 mL o 5 mL de agua estéril para inyección, la solución final contiene los siguientes excipientes y estabilizadores en cantidades objetivo por mL de producto reconstituido:
| Estabilizador y Excipiente | 2 mL Reconstitución (para 250, 500, 750, 1000, 1500 IU) Objetivo (por mL) |
5 mL Reconstitución (para 2000, 3000 IU) Objetivo (por mL) |
|---|---|---|
| Tris (hidroximetil) aminometano | 3.05 mg | 1.22 mg |
| Cloruro de Calcio | 0.60 mg | 0.24 mg |
| Manitol | 80 mg | 32 mg |
| Cloruro de Sodio | 13.15 mg | 5.26 mg |
| Trehalosa Dihidratada | 20 mg | 8 mg |
| Glutation | 0.2 mg | 0.08 mg |
| Histidina | 3.90 mg | 1.56 mg |
| Polisorbato 80 | 0.25 mg | 0.10 mg |
ADYNOVATE no contiene conservante. La actividad específica de ADYNOVATE es de 2700 – 8000 UI/mg de proteína.
ADYNOVATE es un factor de coagulación VIII humano recombinante de longitud completa (2.332 aminoácidos con un peso molecular (MW) de 280 kDa) conjugado covalentemente con una o más moléculas de polietilenglicol (MW 20 kDa) [ver Farmacología Clínica (12.1)]. La actividad terapéutica de ADYNOVATE se deriva de su sustancia farmacológica madre, ADVATE [Factor Antihemofílico (Recombinante)], que se produce mediante tecnología de ADN recombinante a partir de la línea celular CHO. ADVATE se purifica del medio de cultivo utilizando una serie de columnas cromatográficas. El proceso de purificación incluye un paso de cromatografía de inmunoafinidad en el que se utiliza un anticuerpo monoclonal dirigido contra el factor VIII para aislar selectivamente el factor VIII del medio. El proceso de producción incluye un paso dedicado de tratamiento con solvente-detergente de inactivación viral. La molécula de ADVATE se conjuga covalentemente con el polietilenglicol, que se dirige principalmente a los residuos de lisina.
El cultivo celular, la pegilación, el proceso de purificación y la formulación utilizados en la fabricación de ADYNOVATE no utilizan aditivos de origen humano o animal.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
ADYNOVATE, una forma PEGilada de factor antihemofílico recombinante (ADVATE), [ver Descripción (11)], reemplaza temporalmente el factor de coagulación VIII faltante que se necesita para una hemostasia efectiva en pacientes con hemofilia A congénita. ADYNOVATE exhibe una vida media terminal extendida a través de la PEGilación de la molécula madre, ADVATE, que reduce la unión al receptor fisiológico de eliminación del factor VIII (LRP1).
12.2 Farmacodinamia
La hemofilia A es un trastorno caracterizado por una deficiencia de factor de coagulación VIII funcional, lo que resulta en un tiempo de coagulación prolongado del plasma del paciente, medido por el tiempo de tromboplastina parcial activado (aPTT). El tratamiento con ADYNOVATE normaliza el aPTT durante el período de dosificación efectivo. La administración de ADYNOVATE aumenta los niveles plasmáticos de factor VIII y puede corregir temporalmente el defecto de coagulación en pacientes con hemofilia A.
12.3 Farmacocinética
La farmacocinética (PK) de ADYNOVATE se evaluó en un ensayo clínico multicéntrico, prospectivo, de etiqueta abierta y se comparó con ADVATE en 26 sujetos antes de iniciar el tratamiento profiláctico con ADYNOVATE y en 22 sujetos después de 6 meses de tratamiento con ADYNOVATE. Se utilizó una dosis única de 45 UI/kg para ambos productos. Los parámetros de PK, como se muestra en la Tabla 4, se basaron en la actividad del factor VIII de coagulación plasmática medida por el ensayo de coagulación de un solo paso y se presentan por grupos de edad.
La recuperación incremental fue comparable entre ambos productos. Los parámetros de PK determinados después de 6 meses de tratamiento profiláctico con ADYNOVATE fueron consistentes con las estimaciones de parámetros iniciales.
Farmacocinética pediátrica
Los parámetros farmacocinéticos calculados a partir de 39 sujetos <18 años de edad (análisis por intención de tratar) están disponibles para 14 niños (2 a <6 años), 17 niños mayores (6 a <12 años) y 8 sujetos adolescentes (12 a <18 años de edad), como se muestra en la Tabla 4. La depuración media (basada en el peso corporal) de ADYNOVATE fue mayor y la vida media media fue menor en niños <12 años de edad que en adultos. Puede ser necesario un ajuste de dosis en niños <12 años de edad.
| Parámetros de PK | Población pediátrica PK con muestreo disperso* |
Adultos y adolescentes PK individual con muestreo completo† |
||
|---|---|---|---|---|
| <6 años N=14 |
6 a <12 años N=17 |
12 a <18 años N = 8 |
≥18 años N = 18 |
|
| Abreviaturas: MRT: tiempo medio de residencia; CL: depuración; IC: intervalo de confianza; AUC: área bajo la curva; Vss: volumen de distribución ajustado al peso corporal en estado estacionario; Cmax: actividad máxima observada; Tmax: tiempo para alcanzar la concentración máxima. | ||||
|
||||
| Vida media terminal [h] | 11,8 ± 2,43 | 12,4 ± 1,67 | 13,43 ± 4,05 | 14,69 ± 3,79 |
| MRT [h] | 17,0 ± 3,50 | 17,8 ± 2,42 | 17,96 ± 5,49 | 20,27 ± 5,23 |
| CL [mL/(kg∙h)] | 3,53 ± 1,29 | 3,11 ± 0,76 | 3,87 ± 3,31 (2,73 ± 0,93)‡ |
2,27 ± 0,84 |
| Recuperación incremental [(UI/dL)/(UI/kg)] | 1,89 ± 0,49 | 1,95 ± 0,47 | 2,12 ± 0,60 | 2,66 ± 0,68 |
| AUC0-Inf [IU∙h/dL] | 1947 ± 757 | 2012 ± 495 | 1642 ± 752 | 2264 ± 729 |
| Vss [dL/kg] | 0,56 ± 0,12 | 0,54 ± 0,09 | 0,56 ± 0,18 | 0,43 ± 0,11 |
| Cmax [IU/dL] | 115 ± 30 | 115 ± 33 | 95 ± 25 | 122 ± 29 |
| Tmax [h] | –§ | –§ | 0,26 ± 0,10 | 0,46 ± 0,29 |
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico de ADYNOVATE o estudios para determinar los efectos de ADYNOVATE sobre la genotoxicidad o la fertilidad.
14 ESTUDIOS CLÍNICOS
Ensayo clínico original de seguridad y eficacia
La seguridad, eficacia y PK de ADYNOVATE se evaluaron en un ensayo clínico multicéntrico, abierto, prospectivo, no aleatorizado, de dos brazos que comparó la eficacia de un régimen de tratamiento profiláctico dos veces por semana con el tratamiento a demanda y determinó la eficacia hemostática en el tratamiento de episodios hemorrágicos. Un total de 137 PTP masculinos (de 12 a 65 años de edad) con hemofilia A grave recibieron al menos una infusión con ADYNOVATE. Veinticinco de los 137 sujetos fueron adolescentes (de 12 a menos de 18 años de edad).
Los sujetos recibieron tratamiento profiláctico (n = 120) con ADYNOVATE a una dosis de 40-50 UI por kg dos veces por semana o tratamiento a demanda (n = 17) con ADYNOVATE a una dosis de 10-60 UI por kg durante un período de 6 meses. La dosis media (DE) por infusión profiláctica fue de 44,4 (3,9) UI por kg con un intervalo de dosificación medio de 3,6 días. Hubo 91 de 98 (93%) sujetos tratados previamente con profilaxis antes de la inscripción, que experimentaron una reducción en la frecuencia de dosificación durante la profilaxis de rutina en el ensayo, con una reducción media del 33,7% (aproximadamente un día más entre dosis). Ciento dieciocho de 120 (98%) sujetos con profilaxis permanecieron en el régimen recomendado inicial sin ajuste de dosis, y 2 sujetos aumentaron su dosis a 60 UI/kg durante la profilaxis debido a hemorragias en las articulaciones diana.
Tratamiento a demanda y control de episodios hemorrágicos
Se trataron un total de 518 episodios hemorrágicos con ADYNOVATE en la población según el protocolo, es decir, dosificados de acuerdo con los requisitos específicos de dosificación del protocolo. De estos, 361 episodios hemorrágicos (n=17 sujetos) ocurrieron en el brazo a demanda y 157 (n=61 sujetos) ocurrieron en el brazo de profilaxis. La dosis media por infusión para tratar todos los episodios hemorrágicos en la población según el protocolo fue de 29 (Q1: 20,0; Q3: 39,2) UI por kg. La dosis media por infusión para tratar un episodio hemorrágico leve, moderado o grave/mayor en la población según el protocolo fue de 25,5 (Q1: 16,9; Q3: 37,6) UI/kg, 30,9 (Q1: 23,0; Q3: 43,1) UI/kg, o 36,4 (Q1: 29,0; Q3: 44,5) UI/kg, respectivamente.
Se trataron un total de 591 episodios hemorrágicos con ADYNOVATE en la población tratada, que fue idéntica al conjunto de análisis de seguridad de los sujetos asignados a profilaxis de rutina o tratamiento a demanda con ADYNOVATE y que recibieron al menos una dosis del producto. De estos, 361 episodios hemorrágicos (n=17 sujetos) ocurrieron en el brazo a demanda y 230 episodios hemorrágicos (n=75 sujetos) ocurrieron en el brazo de profilaxis de rutina. La eficacia en el control de los episodios hemorrágicos se resume en la Tabla 5.
| Etiología del episodio hemorrágico | Todo | Articulación | No articular | |
|---|---|---|---|---|
|
||||
| Número de hemorragias tratadas | 591 | 455 | 136 | |
| Número de infusiones para tratar episodios hemorrágicos | 1 infusión: | 85,4% | 85,9% | 83,8% |
| 2 infusiones: | 10,8% | 10,8% | 11,0% | |
| Total (1 o 2 infusiones): | 96,2% | 96,7% | 94,8% | |
| Tasa de éxito para tratar episodios hemorrágicos* | Excelente o bueno | 95,3% | 95,8% | 93,4% |
Profilaxis de rutina
Un total de 120 sujetos (población tratada) recibieron un régimen dos veces por semana en el brazo de profilaxis, y 17 sujetos adicionales fueron tratados episódicamente en el brazo a demanda. En la población tratada, la tasa de sangrado anualizada (ABR) mediana [media] en el brazo de tratamiento a demanda fue de 41,5 [40,8] en comparación con 1,9 [4,7] mientras estaban en un régimen de profilaxis dos veces por semana (Tabla 6). En la población según el protocolo, la tasa de sangrado anualizada (ABR) mediana [media] en el brazo de tratamiento a demanda fue de 41,5 [40,8] en comparación con 1,9 [3,7] mientras estaban en un régimen de profilaxis dos veces por semana. Utilizando un modelo binomial negativo para estimar el ABR, hubo una reducción significativa en el ABR (p <0,0001) para los sujetos en el brazo de profilaxis en comparación con el brazo a demanda.
| Etiología del episodio de sangrado | Tratamiento a demanda | Tratamiento de profilaxis de rutina | ||
|---|---|---|---|---|
| Mediana | Media (DE) | Mediana | Media (DE) | |
| General | 41,5 | 40,8 (16,3) | 1,9 | 4,7 (8,6) |
| Articulación | 38,1 | 34,7 (15,1) | 0,0 | 2,9 (8,0) |
| No articular | 3,7 | 6,1 (6,7) | 0,0 | 1,8 (3,0) |
| Espontáneo | 21,6 | 26,0 (19,6) | 0,0 | 2,9 (7,1) |
| Traumático | 9,3 | 14,9 (15,3) | 0,0 | 1,8 (3,1) |
En la población tratada, la ABR mediana [media] para los 23 sujetos adolescentes de 12 a <18 años de edad en profilaxis de rutina fue de 2,1 [5,2] en comparación con una ABR mediana [media] de 1,9 [4,6] para los 97 sujetos de 18 años y mayores. Se observó una reducción en el ABR entre los brazos de tratamiento independientemente de los subgrupos de referencia examinados, incluida la edad, la presencia o ausencia de articulaciones diana y el régimen de tratamiento previo al ensayo. La mayoría de los episodios de sangrado durante la profilaxis (95%) fueron de gravedad leve/moderada. Cuarenta y cinco de 120 sujetos (38%) no experimentaron episodios de sangrado y 68 de 120 sujetos (57%) no experimentaron episodios de sangrado articular en el brazo de profilaxis. De aquellos sujetos que cumplieron con el régimen (población según el protocolo), 40 de 101 sujetos (40%) no experimentaron episodios de sangrado. Todos los sujetos en el brazo a demanda experimentaron un episodio de sangrado, incluido un episodio de sangrado articular.
Ensayo clínico de profilaxis de rutina en sujetos pediátricos (<12 años de edad)
La seguridad y eficacia de ADYNOVATE se evaluó en un total de 73 PTP pediátricos con hemofilia A grave, de los cuales 66 sujetos recibieron dosis (32 sujetos de <6 años y 34 sujetos de 6 a <12 años) en un ensayo clínico pediátrico separado. El régimen profiláctico fue de 40 a 60 UI/kg de ADYNOVATE dos veces por semana, con una dosis media (DE) de 51,1 UI/kg (5,5). La ABR general mediana [media] fue de 2,0 [3,61] para los 66 sujetos en la población tratada y las ABR medianas [medias] para los episodios de sangrado espontáneo y articular fueron ambas de 0 [1,18 y 1,12, respectivamente]. De los 66 sujetos tratados profilácticamente, 25 (38%) no experimentaron episodios de sangrado, 44 (67%) no experimentaron episodios de sangrado espontáneo y 48 (73%) no experimentaron episodios de sangrado articular.
De los 70 episodios de sangrado observados durante el ensayo pediátrico, el 82,9% se controló con 1 infusión y el 91,4% se controló con 1 o 2 infusiones. El control del sangrado se calificó como excelente o bueno en 63 de 70 (90%) episodios de sangrado. Las definiciones de excelente o bueno en el ensayo clínico pediátrico no cambiaron en comparación con el ensayo clínico de profilaxis realizado previamente en sujetos adolescentes y adultos.
Un estudio de extensión en pacientes adultos y pediátricos evaluó la seguridad y eficacia del régimen de tratamiento profiláctico en 216 pacientes previamente tratados con hemofilia A grave. La mayoría había completado el estudio de adultos y adolescentes o el estudio pediátrico. Se observó una eficacia similar en este estudio de extensión.
Ensayo clínico de manejo perioperatorio
Se realizaron veintiún procedimientos quirúrgicos mayores que comprendían 14 ortopédicos y 7 no ortopédicos, y 5 cirugías menores adicionales en 21 sujetos. La dosis de carga preoperatoria osciló entre 36 UI/kg y 99 UI/kg (mediana: 60 UI/kg) y la dosis total posoperatoria osciló entre 23 UI/kg y 769 UI/kg (mediana: 183 UI/kg). La dosis total mediana (incluidas todas las administraciones desde las dosis de carga y PK prequirúrgicas hasta el seguimiento poshospitalario) fue de 629 UI/kg (rango: 464 – 1,457 UI/kg) para las cirugías ortopédicas mayores, 489 UI/kg (rango: 296 – 738 UI/kg) para las cirugías no ortopédicas mayores.
La eficacia hemostática general se calificó como excelente (pérdida de sangre menor o igual a la esperada para el mismo tipo de procedimiento realizado en un paciente no hemofílico, para los 24 (21 mayores, 3 menores) procedimientos con evaluaciones disponibles.
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Presentación
ADYNOVATE en un sistema BAXJECT III se envasa con 2 mL o 5 mL de Agua Estéril para Inyección, un juego de infusión Terumo Microbore (solo 2 mL), un folleto completo para el médico prescriptor y un folleto para el paciente. Los componentes no están hechos con látex de caucho natural.
ADYNOVATE está disponible en viales de dosis única que contienen las siguientes potencias nominales del producto:
| Potencia Nominal | Código de Color de la Potencia | NDC del Cartón (Incluye 2 mL de Diluyente sWFI) |
NDC del Cartón (Incluye 5 mL de Diluyente sWFI) |
|---|---|---|---|
| 250 UI | Azul Claro | 0944-4622-01 | |
| 500 UI | Rosa | 0944-4623-01 | |
| 750 UI | Rojo | 0944-4626-01 | |
| 1000 UI | Verde Claro | 0944-4624-01 | |
| 1500 UI | Morado | 0944-4627-01 | |
| 2000 UI | Naranja | 0944-4625-01 | |
| 3000 UI | Plata | 0944-4628-01 |
La actividad real del factor VIII en UI se indica en la etiqueta de cada caja y envase de ADYNOVATE.
Almacenamiento y manipulación
- Almacenar ADYNOVATE en forma de polvo a 2°C a 8°C (36°F a 46°F).
- No congelar.
- ADYNOVATE puede almacenarse a temperatura ambiente no superior a 30°C (86°F) durante un período de hasta 3 meses, sin exceder la fecha de caducidad. Si se almacena a temperatura ambiente, anote la fecha en la caja cuando ADYNOVATE se retire de la refrigeración.
- Después de almacenarlo a temperatura ambiente, no vuelva a colocar el producto en el refrigerador.
- No utilizar después de la fecha de caducidad impresa en la caja o el envase.
- Almacenar ADYNOVATE en la caja original y protegerlo de la exposición extrema a la luz.
17 INFORMACIÓN PARA EL PACIENTE
Aconseje a los pacientes que:
- Lean el etiquetado del paciente aprobado por la FDA (Información del paciente e Instrucciones de uso).
- Llame a su proveedor de atención médica o vaya al departamento de emergencias de inmediato si ocurre una reacción de hipersensibilidad. Los signos tempranos de reacciones de hipersensibilidad pueden incluir erupción cutánea, urticaria, picazón, hinchazón facial, opresión en el pecho y sibilancias. Aconseje a los pacientes que suspendan el uso del producto si se presentan estos síntomas y busquen tratamiento de emergencia inmediato.
- Comuníquese con su proveedor de atención médica o centro de tratamiento para recibir tratamiento y/o evaluación adicionales si experimentan una falta de respuesta clínica a la terapia con factor VIII, ya que esto puede ser un signo de desarrollo de inhibidores.
- Consulte con sus médicos o proveedores de atención médica antes de viajar. Mientras viaja, aconseje a los pacientes que lleven un suministro adecuado de ADYNOVATE en función de su régimen actual de tratamiento.
Para inscribirse en el Sistema de Notificación al Paciente confidencial de toda la industria, llame al 1-888-873-2838.
SECCIÓN NO CLASIFICADA SPL
Takeda Pharmaceuticals U.S.A., Inc.
Lexington, MA 02421
Licencia de EE. UU. N.° 1898
ADYNOVATE®, ADVATE® y BAXJECT® son marcas comerciales registradas de Baxalta Incorporated.
ADYNOVATE® es una marca comercial registrada de Baxalta Incorporated.
TAKEDA® y el logotipo de TAKEDA® son marcas comerciales registradas de Takeda Pharmaceutical Company Limited.
Patentado: consulte www.takeda.com/en-us/patents
Información para el Paciente Aprobada por la FDA
ADYNOVATE
[Factor VIII (Recombinante), PEGilado]
Este folleto resume información importante sobre ADYNOVATE. Léalo cuidadosamente antes de usar este medicamento. Esta información no reemplaza hablar con su proveedor de atención médica y no incluye toda la información importante sobre ADYNOVATE. Si tiene alguna pregunta después de leer esto, consulte a su proveedor de atención médica.
¿Cuál es la información más importante que necesito saber sobre ADYNOVATE?
No intente realizar una infusión usted mismo a menos que haya sido capacitado por su proveedor de atención médica o centro de hemofilia.
Debe seguir cuidadosamente las instrucciones de su proveedor de atención médica con respecto a la dosis y el horario para la infusión de ADYNOVATE para que su tratamiento funcione mejor para usted.
¿Qué es ADYNOVATE?
ADYNOVATE es un medicamento inyectable que se usa para ayudar a tratar y controlar el sangrado en niños y adultos con hemofilia A (deficiencia congénita del factor VIII). Su proveedor de atención médica puede administrarle ADYNOVATE cuando se someta a una cirugía.
ADYNOVATE puede reducir la cantidad de episodios de sangrado cuando se usa regularmente (profilaxis).
ADYNOVATE no se usa para tratar la enfermedad de von Willebrand.
¿Quién no debe usar ADYNOVATE?
No debe usar ADYNOVATE si usted:
- Es alérgico a la proteína de ratón o hámster
- Es alérgico a cualquier ingrediente de ADYNOVATE o ADVATE
Informe a su proveedor de atención médica si está embarazada o amamantando porque ADYNOVATE puede no ser adecuado para usted.
¿Cómo debo usar ADYNOVATE?
ADYNOVATE se administra directamente en el torrente sanguíneo.
Puede infundirse ADYNOVATE en un centro de tratamiento de hemofilia, en el consultorio de su proveedor de atención médica o en su hogar. Debe recibir capacitación sobre cómo realizar infusiones por parte de su proveedor de atención médica o centro de tratamiento de hemofilia. Muchas personas con hemofilia A aprenden a infundirse ADYNOVATE por sí mismas o con la ayuda de un familiar.
Su proveedor de atención médica le dirá cuánta ADYNOVATE debe usar en función de su peso individual, nivel de actividad física, la gravedad de su hemofilia A y dónde está sangrando.
El producto reconstituido (después de mezclar el producto seco con el diluyente húmedo) debe usarse dentro de las 3 horas y no se puede almacenar ni refrigerar. Deseche cualquier ADYNOVATE que quede en el vial al final de su infusión según las indicaciones de su profesional de la salud.
Es posible que deba hacerse análisis de sangre después de recibir ADYNOVATE para asegurarse de que su nivel de factor VIII en sangre sea lo suficientemente alto como para coagular su sangre.
Llame a su proveedor de atención médica de inmediato si su sangrado no se detiene después de tomar ADYNOVATE.
¿Qué debo decirle a mi proveedor de atención médica antes de usar ADYNOVATE?
Debe informar a su proveedor de atención médica si usted:
- Tiene o ha tenido algún problema médico.
- Toma algún medicamento, incluidos medicamentos recetados y de venta libre, como medicamentos de venta libre, suplementos o remedios herbales.
- Tiene alguna alergia, incluidas alergias a ratones o hámsters.
- Está amamantando. No se sabe si ADYNOVATE pasa a la leche materna y si puede dañar a su bebé.
- Está embarazada o planea quedar embarazada. No se sabe si ADYNOVATE puede dañar a su bebé por nacer.
- Le han dicho que tiene inhibidores del factor VIII (porque ADYNOVATE puede no funcionar para usted).
¿Cuáles son los posibles efectos secundarios de ADYNOVATE?
Puede tener una reacción alérgica a ADYNOVATE.
Llame a su proveedor de atención médica de inmediato y suspenda el tratamiento si tiene erupción cutánea o urticaria, picazón, opresión en la garganta, dolor u opresión en el pecho, dificultad para respirar, mareos, aturdimiento, náuseas o desmayo.
Los efectos secundarios comunes de ADYNOVATE son dolor de cabeza, diarrea, erupción cutánea, náuseas, mareos y urticaria. Informe a su proveedor de atención médica sobre cualquier efecto secundario que le moleste o que no desaparezca.
Estos no son todos los posibles efectos secundarios de ADYNOVATE. Puede pedirle a su proveedor de atención médica información que esté escrita para profesionales de la salud.
¿Cuáles son las concentraciones de dosis de ADYNOVATE?
ADYNOVATE con 2 mL o 5 mL de Agua Estéril para Inyección en un sistema BAXJECT III viene en siete concentraciones de dosis diferentes: 250 Unidades Internacionales (UI), 500 UI, 750 UI, 1000 UI, 1500 UI, 2000 UI y 3000 UI. La concentración real estará impresa en la etiqueta y en la caja. Las siete concentraciones diferentes están codificadas por colores, de la siguiente manera:
|
|
Concentración de dosis de aproximadamente 250 Unidades Internacionales por vial (con 2 mL de AEI) |
|
|
Concentración de dosis de aproximadamente 500 Unidades Internacionales por vial (con 2 mL de AEI) |
|
|
Concentración de dosis de aproximadamente 750 Unidades Internacionales por vial (con 2 mL de AEI) |
|
|
Concentración de dosis de aproximadamente 1000 Unidades Internacionales por vial (con 2 mL de AEI) |
|
|
Concentración de dosis de aproximadamente 1500 Unidades Internacionales por vial (con 2 mL de AEI) |
|
|
Concentración de dosis de aproximadamente 2000 Unidades Internacionales por vial (con 5 mL de Agua Estéril para Inyección) |
|
|
Concentración de dosis de aproximadamente 3000 Unidades Internacionales por vial (con 5 mL de Agua Estéril para Inyección) |
Siempre verifique la concentración real del medicamento impresa en la etiqueta para asegurarse de que está utilizando la concentración prescrita por su profesional de la salud. Siempre verifique la fecha de vencimiento impresa en la caja. No utilice el producto después de la fecha de vencimiento impresa en la caja.
¿Cómo guardo ADYNOVATE?
- No congelar.
- Almacenar a temperatura refrigerada de 2°C a 8°C (36°F a 46°F).
- Se puede almacenar a temperatura ambiente no superior a 30°C (86°F) durante un máximo de 3 meses.
- Anote la fecha en la caja cuando ADYNOVATE se retire de la refrigeración.
- Después de almacenarlo a temperatura ambiente, no vuelva a colocar el producto en el refrigerador.
- No utilizar después de la fecha de vencimiento impresa en la caja o el vial.
- Almacenar ADYNOVATE en la caja original y protegerlo de la exposición extrema a la luz.
¿Qué más debo saber sobre ADYNOVATE y la hemofilia A?
Su cuerpo puede formar inhibidores al Factor VIII. Un inhibidor es parte del sistema de defensa normal del cuerpo. Si forma inhibidores, puede impedir que ADYNOVATE funcione correctamente. Consulte con su profesional de la salud para asegurarse de que se le controle cuidadosamente con análisis de sangre para detectar el desarrollo de inhibidores al Factor VIII.
Los medicamentos a veces se recetan para fines distintos de los que se enumeran aquí. No utilice ADYNOVATE para una afección para la que no se lo haya recetado. No comparta ADYNOVATE con otras personas, incluso si tienen los mismos síntomas que usted.
Takeda Pharmaceuticals U.S.A., Inc.
Lexington, MA 02421
U.S. License No. 1898
ADYNOVATE®, ADVATE® y BAXJECT® son marcas registradas de Baxalta Incorporated.
ADYNOVATE® es una marca registrada de Baxalta Incorporated.
TAKEDA® y el logotipo de TAKEDA® son marcas registradas de Takeda Pharmaceutical Company Limited.
Patentado: consulte www.takeda.com/en-us/patents
Revisado: 3/2023
Información de etiquetado para pacientes aprobada por la FDAInstrucciones de uso
ADYNOVATE
[Factor Antihemofílico (Recombinante),
PEGilado]
(Solo para uso intravenoso)
No intente administrarse una infusión a menos que su proveedor de atención médica o centro de hemofilia le hayan enseñado cómo hacerlo.
Las instrucciones paso a paso para reconstituir ADYNOVATE se encuentran al final de este folleto.
Siga siempre las instrucciones específicas que le dé su proveedor de atención médica. Los pasos que se enumeran a continuación son pautas generales para el uso de ADYNOVATE. Si no está seguro de los procedimientos, llame a su proveedor de atención médica antes de usarlo.
Llame a su proveedor de atención médica de inmediato si el sangrado no se controla después de usar ADYNOVATE.
Su proveedor de atención médica le recetará la dosis que debe tomar.
El producto reconstituido (después de mezclar el producto seco con el diluyente húmedo) debe usarse dentro de las 3 horas y no se puede almacenar ni refrigerar.
Es posible que su proveedor de atención médica deba realizarle análisis de sangre de vez en cuando.
Hable con su proveedor de atención médica antes de viajar. Planee llevar suficiente ADYNOVATE para su tratamiento durante este tiempo.
Deseche todos los materiales, incluyendo cualquier producto ADYNOVATE reconstituido sobrante, en un contenedor apropiado.
- Prepare una superficie plana y limpia y reúna todos los materiales que necesitará para la infusión.
- Verifique la fecha de vencimiento y deje que ADYNOVATE alcance la temperatura ambiente.
- Lávese las manos y póngase guantes de examen limpios. Si se está infundiendo en casa, el uso de guantes es opcional.
- Abra el envase de ADYNOVATE retirando la tapa. Retire ADYNOVATE del envase e inspeccione visualmente el contenido del producto y el vial de diluyente. El polvo de ADYNOVATE debe ser de color blanco a blanquecino y el diluyente no debe contener partículas. No lo use si se observa decoloración o partículas.
- Coloque sobre una superficie plana con el vial de diluyente en la parte superior. El vial de diluyente tiene una raya azul.
- Con una mano sosteniendo la carcasa de ADYNOVATE, presione firmemente hacia abajo el vial de diluyente con la otra mano hasta que el sistema esté completamente colapsado y el diluyente fluya hacia abajo en el vial de ADYNOVATE. Ambos viales se moverán hacia la carcasa cuando se presionen. Si no ve que el diluyente se transfiere al vial del producto, presione los viales nuevamente para asegurarse de que estén completamente insertados. No retire la tapa azul hasta que se lo indiquen en un paso posterior.
- Gire ADYNOVATE suave y continuamente hasta que ADYNOVATE se disuelva por completo. No lo agite. No refrigerar después de la reconstitución. Inspeccione la solución de ADYNOVATE para detectar la presencia de partículas y decoloración antes de la administración. La solución debe tener una apariencia transparente e incolora. Si no es así, no use la solución y notifique a su proveedor de atención médica de inmediato.
- Retire la tapa azul de la carcasa y conecte la jeringa. Tenga cuidado de no inyectar aire en ADYNOVATE.
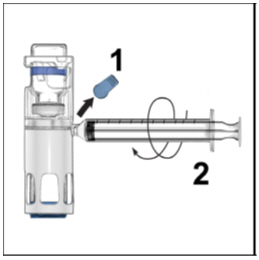
- Voltee ADYNOVATE para que el vial que contiene la solución de ADYNOVATE quede arriba. Extraiga la solución de ADYNOVATE en la jeringa tirando del émbolo lentamente. Si la solución no entra en la jeringa, asegúrese de que ambos viales estén presionados firmemente juntos. El contenido de más de un vial puede extraerse en una sola jeringa de tamaño adecuado si está utilizando más de un vial de ADYNOVATE.
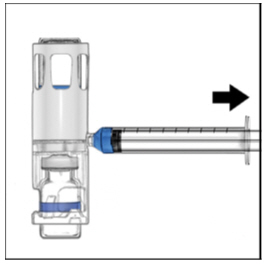
- Desconecte la jeringa del sistema. Conecte la aguja de infusión a la jeringa utilizando un juego de infusión con alas (mariposa), si está disponible. Apunte la aguja hacia arriba y elimine las burbujas de aire golpeando suavemente la jeringa con el dedo y empujando el aire fuera de la jeringa y la aguja de forma lenta y cuidadosa.
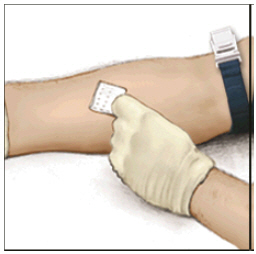
- Aplique un torniquete y prepare el sitio de inyección limpiando bien la piel con una torunda con alcohol (u otra solución adecuada sugerida por su proveedor de atención médica o centro de hemofilia).
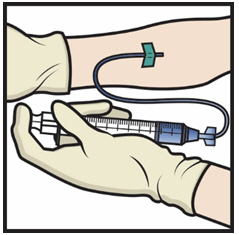
- Inserte la aguja en la vena y retire el torniquete. Infunda ADYNOVATE lentamente. No lo infunda a una velocidad superior a 10 ml por minuto.
- Retire la aguja de la vena y use una gasa estéril para ejercer presión sobre el sitio de infusión durante varios minutos.
- Retire la etiqueta despegable de la tapa del blíster y colóquela en su cuaderno de registro. Limpie cualquier derrame de sangre con una mezcla recién preparada de 1 parte de lejía y 9 partes de agua, agua y jabón, o cualquier solución desinfectante doméstica.
- No vuelva a tapar la aguja. Coloque la aguja, la jeringa y el sistema ADYNOVATE en un contenedor para objetos punzocortantes de paredes duras para su eliminación adecuada. No deseche estos suministros en la basura doméstica común.
Importante: Comuníquese con su proveedor de atención médica o centro local de tratamiento de la hemofilia si experimenta algún problema.
Takeda Pharmaceuticals U.S.A., Inc.
Lexington, MA 02421
U.S. License No. 1898
ADYNOVATE®, ADVATE® y BAXJECT® son marcas comerciales registradas de Baxalta Incorporated.
ADYNOVATE® es una marca comercial registrada de Baxalta Incorporated.
TAKEDA® y el logotipo de TAKEDA® son marcas comerciales registradas de Takeda Pharmaceutical Company Limited.
Patentado: consulte www.takeda.com/en-us/patents
Revisado: 3/2023
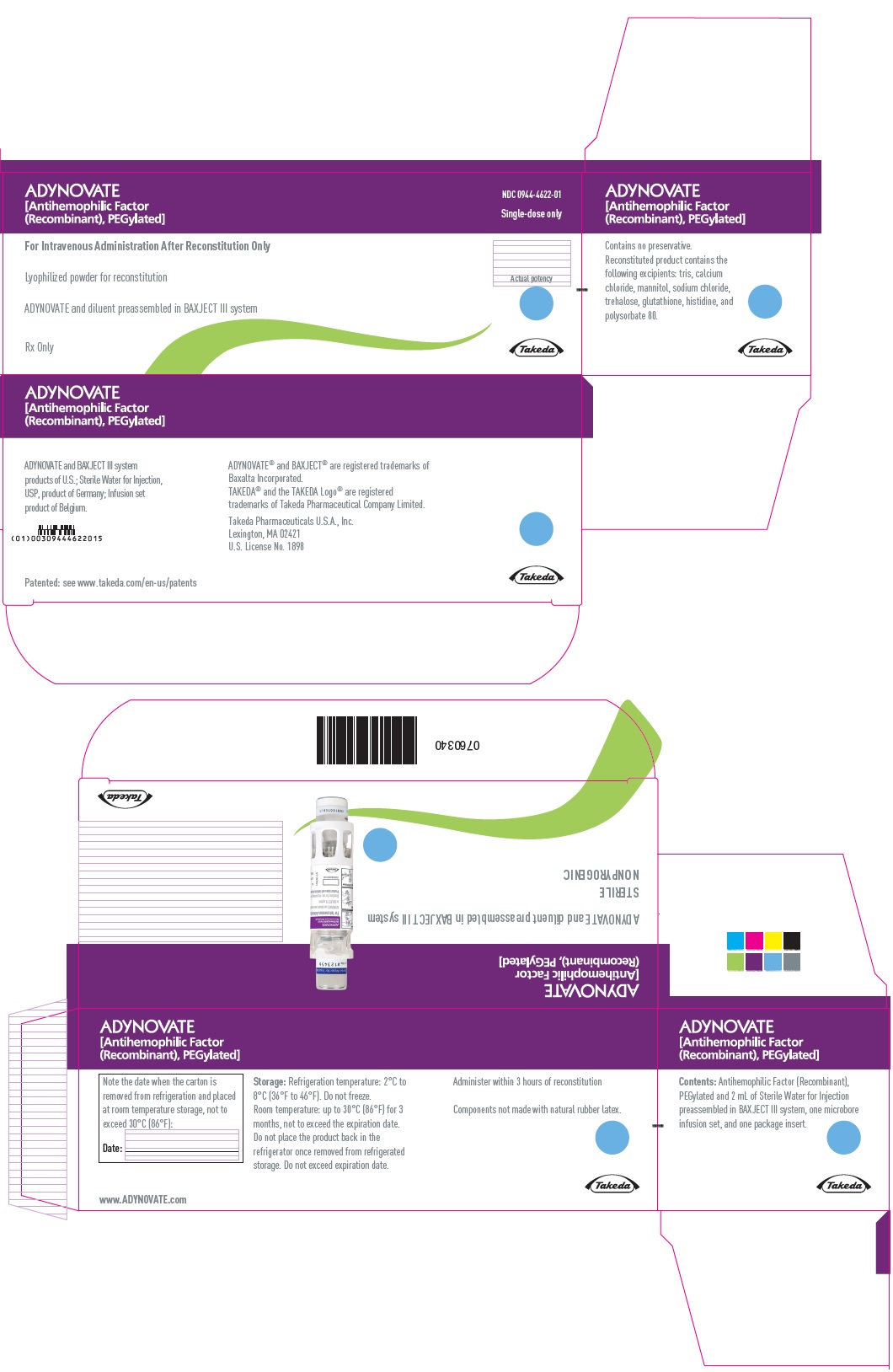
PANEL PRINCIPAL DE VISUALIZACIÓN – Caja de Kit – 250 UI
ADYNOVATE
[Factor antihemofílico
(Recombinante), PEGilado]
NDC 0944-4622-01
Únicamente dosis única
Únicamente para administración intravenosa después de la reconstitución
Polvo liofilizado para reconstitución
ADYNOVATE y diluyente preensamblados en el sistema BAXJECT III
Receta médica únicamente
Potencia real
Takeda
PANEL PRINCIPAL DE EXHIBICIÓN – Etiqueta del barril – 250 UI
ADYNOVATE
[Factor Antihemofílico
(Recombinante), PEGilado]
Solo para administración intravenosa
ADYNOVATE y diluyente preensamblados
en el sistema BAXJECT III
Instrucciones de uso: ver el prospecto
Solo con receta médica
UI:
LOTE:
CAD:
Takeda
0754163

PANEL PRINCIPAL DE LA PRESENTACIÓN – Etiqueta de blíster – 250 UI
ADYNOVATE
[Factor antihemofílico
(Recombinante), PEGilado]
NDC 0944-4622-02
Únicamente dosis única
0760339
Sólo para administración intravenosa
ADYNOVATE y diluyente preensamblado en el sistema BAXJECT III
No abrir hasta el momento del uso
No usar si el envase está abierto o dañado
Receta médica sólo
Takeda

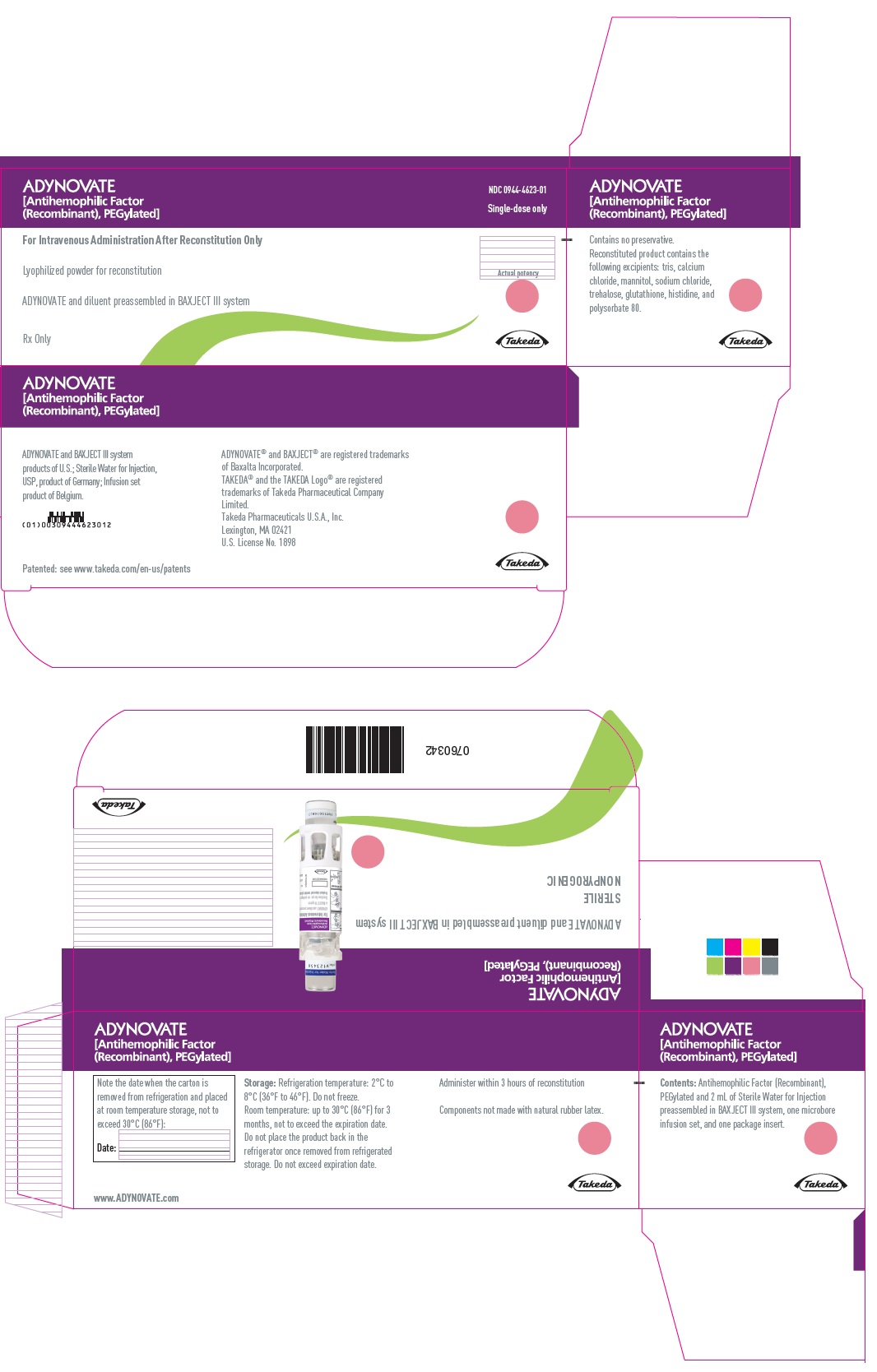
PANEL PRINCIPAL DE EXHIBICIÓN – Caja del kit – 500 UI
ADYNOVATE
[Factor antihemofílico
(Recombinante), PEGilado]
NDC 0944-4623-01
Únicamente dosis única
Sólo para administración intravenosa después de la reconstitución
Polvo liofilizado para reconstitución
ADYNOVATE y diluyente preensamblados en el sistema BAXJECT III
Sólo con receta
Eficacia real
Takeda
PANEL PRINCIPAL DE VISUALIZACIÓN – Etiqueta del Barril – 500 UI
ADYNOVATE
[Factor Antihemofílico
(Recombinante), PEGilado]
Solo para administración intravenosa
ADYNOVATE y diluyente preensamblados
en el sistema BAXJECT III
Instrucciones de uso: ver inserto del paquete
Solo con receta médica
UI:
LOTE:
VTO:
Takeda
0754167

PANEL PRINCIPAL DE VISUALIZACIÓN – Etiqueta de blíster – 500 UI
ADYNOVATE
[Factor Antihemofílico
(Recombinante), PEGilado]
NDC 0944-4623-02
Solo para dosis única
0760341
Solo para administración intravenosa
ADYNOVATE y diluyente preensamblados en el sistema BAXJECT III
No abrir hasta el momento de su uso
No utilizar si el envase está abierto o dañado
Solo con receta médica
Takeda

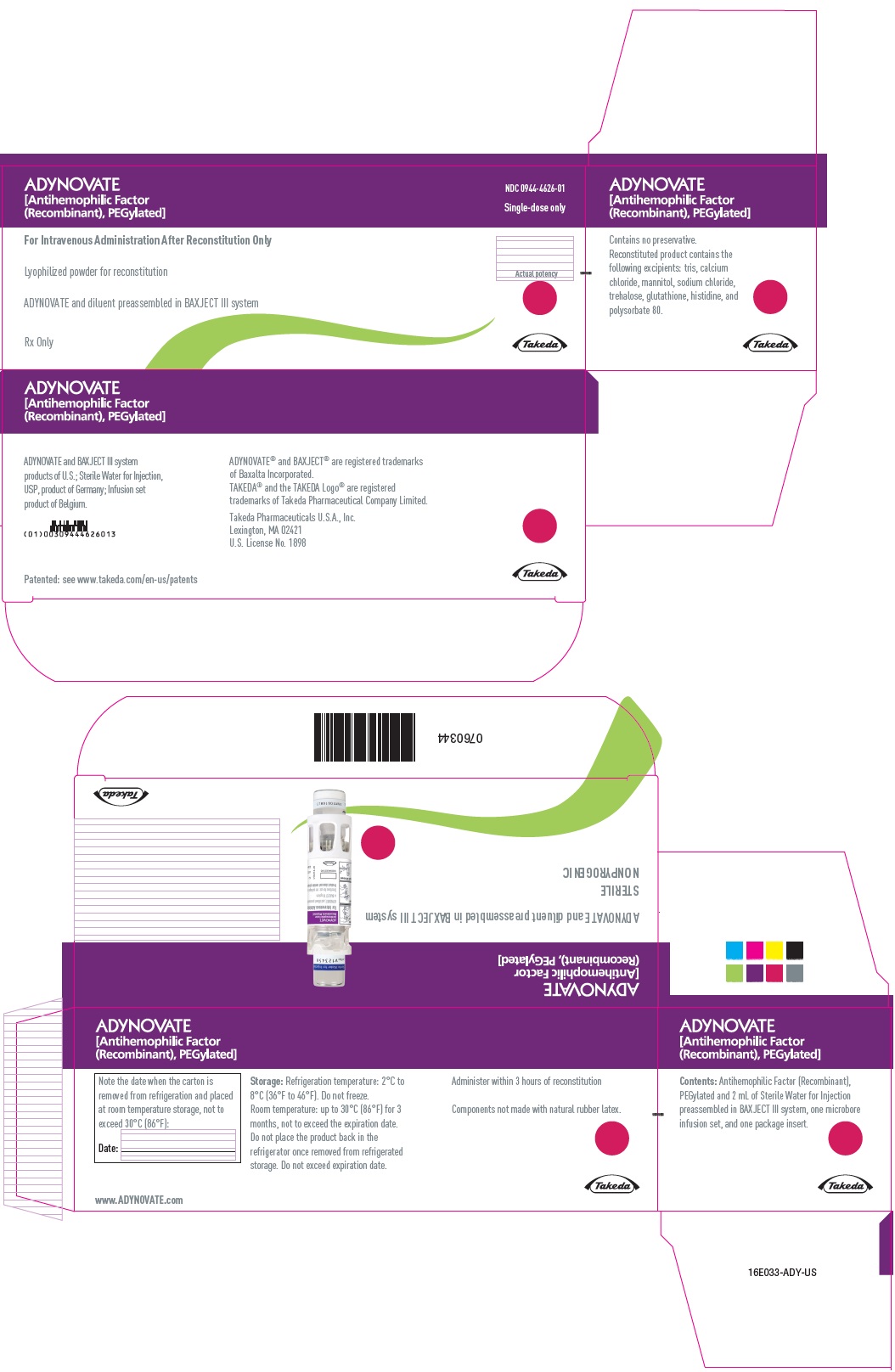
PANEL PRINCIPAL DE VISUALIZACIÓN – Caja de Kit – 750 UI
ADYNOVATE
[Factor antihemofílico
(recombinante), pegilado]
NDC 0944-4626-01
Única dosis
Para administración intravenosa solo después de reconstitución
Pólvo liofilizado para reconstitución
ADYNOVATE y diluyente preensamblado en el sistema BAXJECT III
Sólo con receta médica
Eficacia real
Takeda
PANEL PRINCIPAL DE VISUALIZACIÓN – Etiqueta del Barril – 750 UI
ADYNOVATE
[Factor antihemofílico
(Recombinante), PEGilado]
Para administración intravenosa únicamente
ADYNOVATE y diluyente preensamblados
en el sistema BAXJECT III
Instrucciones de uso: ver folleto de inserto de paquete
Sólo con receta médica
UI:
LOTE:
EXP:
Takeda
0754182

PANEL PRINCIPAL DE EXHIBICIÓN – Etiqueta de blíster – 750 UI
ADYNOVATE
[Factor antihemofílico
(recombinante), pegilado]
NDC 0944-4626-02
Únicamente dosis única
0760343
Para administración intravenosa únicamente
ADYNOVATE y diluyente preensamblados en el sistema BAXJECT III
No abrir hasta el momento de uso
No usar si el empaque está abierto o dañado
Receta médica solamente
Takeda

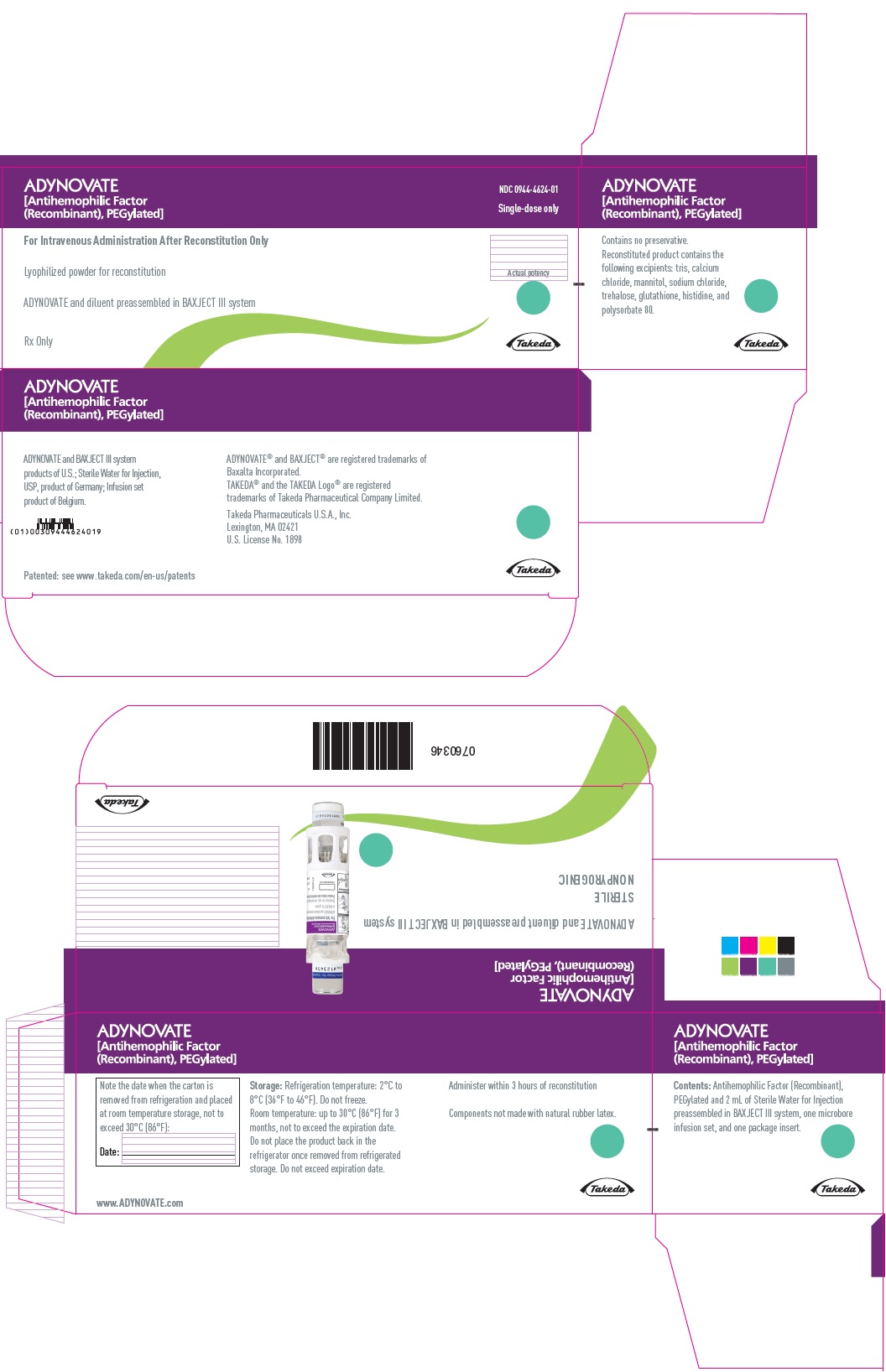
PANEL PRINCIPAL DE VISUALIZACIÓN – Caja de kit – 1000 UI
ADYNOVATE
[Factor antihemofílico
(recombinante), PEGilado]
NDC 0944-4624-01
Únicamente dosis única
Sólo para administración intravenosa después de la reconstitución
Pólvo liofilizado para reconstitución
ADYNOVATE y diluyente preensamblado en el sistema BAXJECT III
Sólo con receta
Potencia real
Takeda
PANEL PRINCIPAL DE VISUALIZACIÓN – Etiqueta del Barril – 1000 UI
ADYNOVATE
[Factor antihemofílico
(Recombinante), PEGilado]
Sólo para administración intravenosa
ADYNOVATE y diluyente preensamblados
en el sistema BAXJECT III
Instrucciones de uso: consulte el inserto del paquete
Rx Sólo
UI:
LOTE:
EXP:
Takeda
0754170

PANEL PRINCIPAL DE VISUALIZACIÓN – Etiqueta de blíster – 1000 UI
ADYNOVATE
[Factor antihemofílico
(recombinante), pegilado]
NDC 0944-4624-02
Unidosis solamente
0760345
Sólo para administración intravenosa
ADYNOVATE y diluyente preensamblado en el sistema BAXJECT III
No abrir hasta el momento de uso
No usar si el embalaje está abierto o dañado
Receta médica solamente
Takeda

PANEL PRINCIPAL DE VISUALIZACIÓN – Caja de kit – 1500 UI
ADYNOVATE
[Factor antihemofílico
(Recombinante), PEGilado]
NDC 0944-4627-01
Sólo dosis única
Únicamente para administración intravenosa después de la reconstitución
Pólvora liofilizada para reconstitución
ADYNOVATE y diluyente preensamblados en el sistema BAXJECT III
Rx Sólo
Eficacia real
Takeda
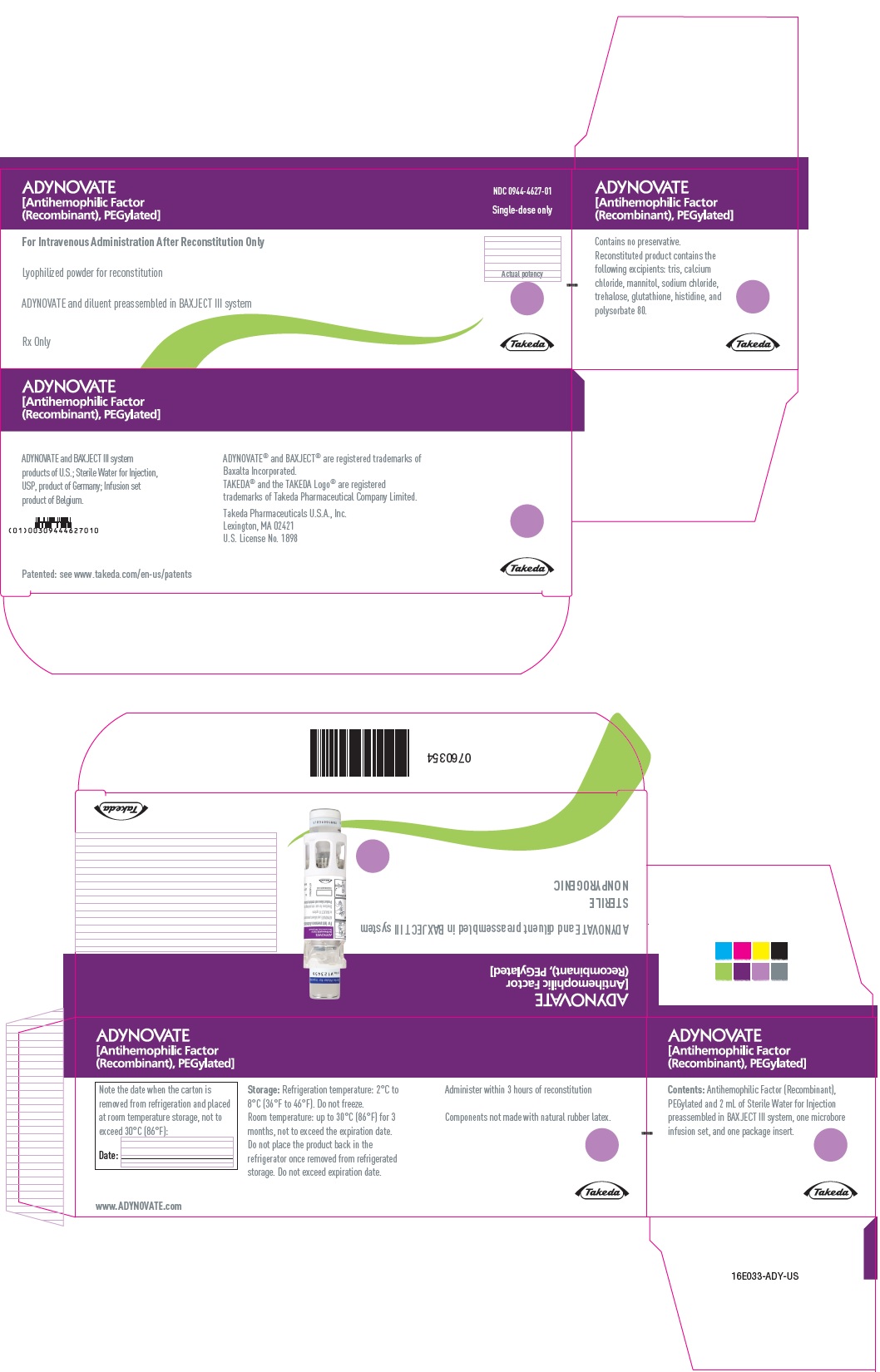
PANEL PRINCIPAL DE VISUALIZACIÓN – Etiqueta del Barril – 1500 UI
ADYNOVATE
[Factor antihemofílico
(recombinante), pegilado]
Para administración intravenosa únicamente
ADYNOVATE y diluyente preensamblados
en el sistema BAXJECT III
Instrucciones de uso: consulte el prospecto interno
Sólo con receta médica
UI:
LOTE:
EXP:
Takeda
0754173

PANEL PRINCIPAL DE VISUALIZACIÓN – Etiqueta de blíster – 1500 UI
ADYNOVATE
[Factor antihemofílico
(recombinante), pegilado]
NDC 0944-4627-02
Solo dosis única
0760353
Sólo para administración intravenosa
ADYNOVATE y diluyente prearmados en el sistema BAXJECT III
No abrir hasta el momento de uso
No utilizar si el empaque está abierto o dañado
Receta médica solamente
Takeda

PANEL PRINCIPAL DE VISUALIZACIÓN – Caja de Kit – 2000 UI
ADYNOVATE
[Factor antihemofílico
(Recombinante), PEGilado]
NDC 0944-4625-01
Únicamente dosis única
Potencia real
Únicamente para administración intravenosa después de la reconstitución
Polvo liofilizado para reconstitución
ADYNOVATE y diluyente preensamblados en
sistema BAXJECT III
Receta médica solamente
Takeda
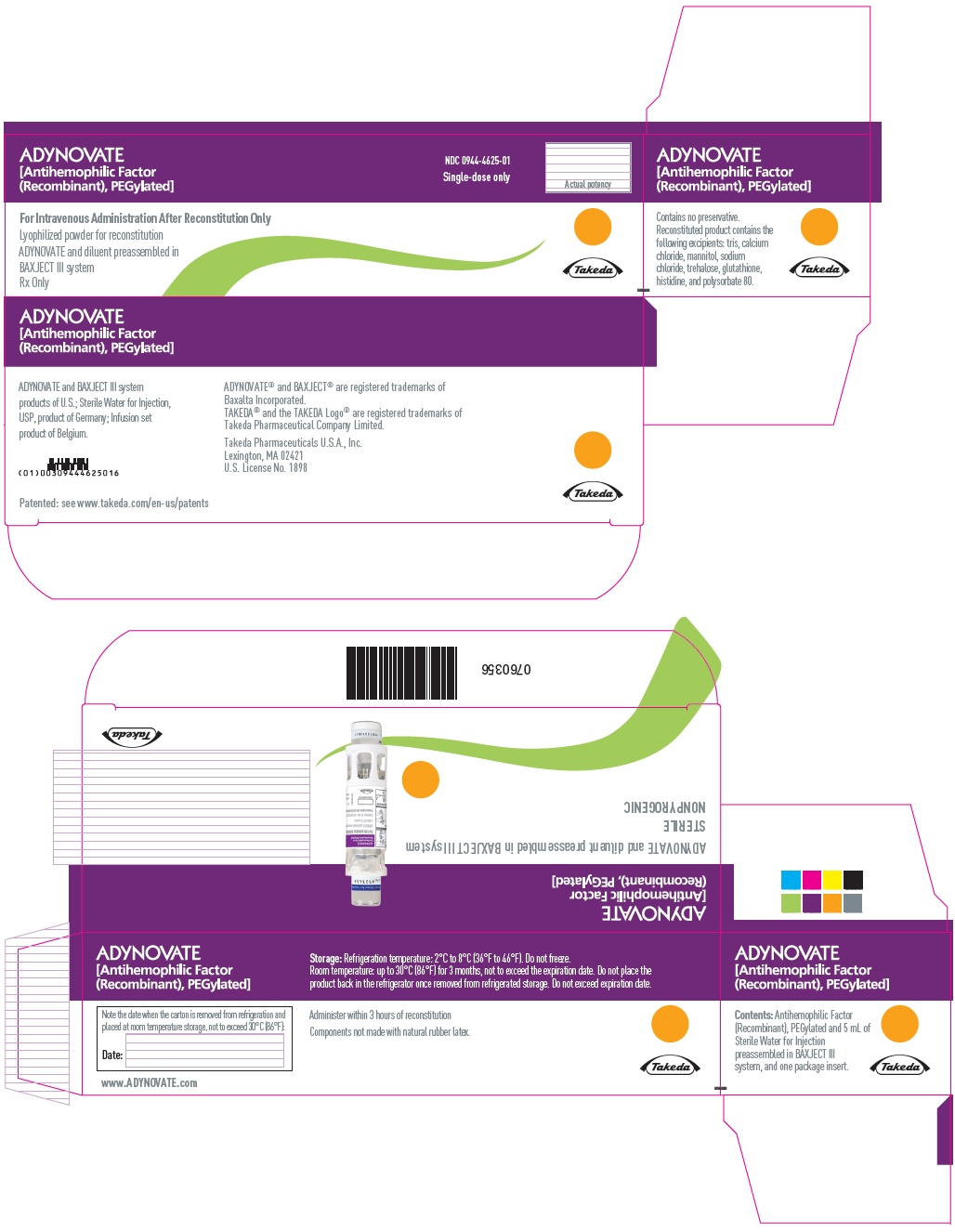
PANEL PRINCIPAL DE VISUALIZACIÓN – Etiqueta del Barril – 2000 UI
ADYNOVATE
[Factor antihemofílico
(Recombinante), PEGilado]
Solamente para administración intravenosa
ADYNOVATE y diluyente preensamblados
en el sistema BAXJECT III
Indicaciones de uso: ver inserto del paquete
Sólo receta médica
IU:
LOTE:
EXP:
Takeda
0754176

PANEL PRINCIPAL DE VISUALIZACIÓN – Etiqueta de blíster – 2000 UI
ADYNOVATE
[Factor antihemofílico
(recombinante), pegilado]
NDC 0944-4625-02
Únicamente dosis única
0760355
Solo para administración intravenosa
ADYNOVATE y diluyente preensamblado en el sistema BAXJECT III
No abrir hasta el momento de uso
No usar si el embalaje está abierto o dañado
Receta médica solamente
Takeda

PANEL PRINCIPAL DE VISUALIZACIÓN – Caja del kit – 3000 UI
ADYNOVATE
[Factor antihemofílico
(Recombinante), PEGilado]
NDC 0944-4628-01
Únicamente dosis única
Potencia real
Únicamente para administración intravenosa después de la reconstitución
Polvo liofilizado para reconstitución
ADYNOVATE y diluyente preensamblados en
sistema BAXJECT III
Receta médica solamente
Takeda
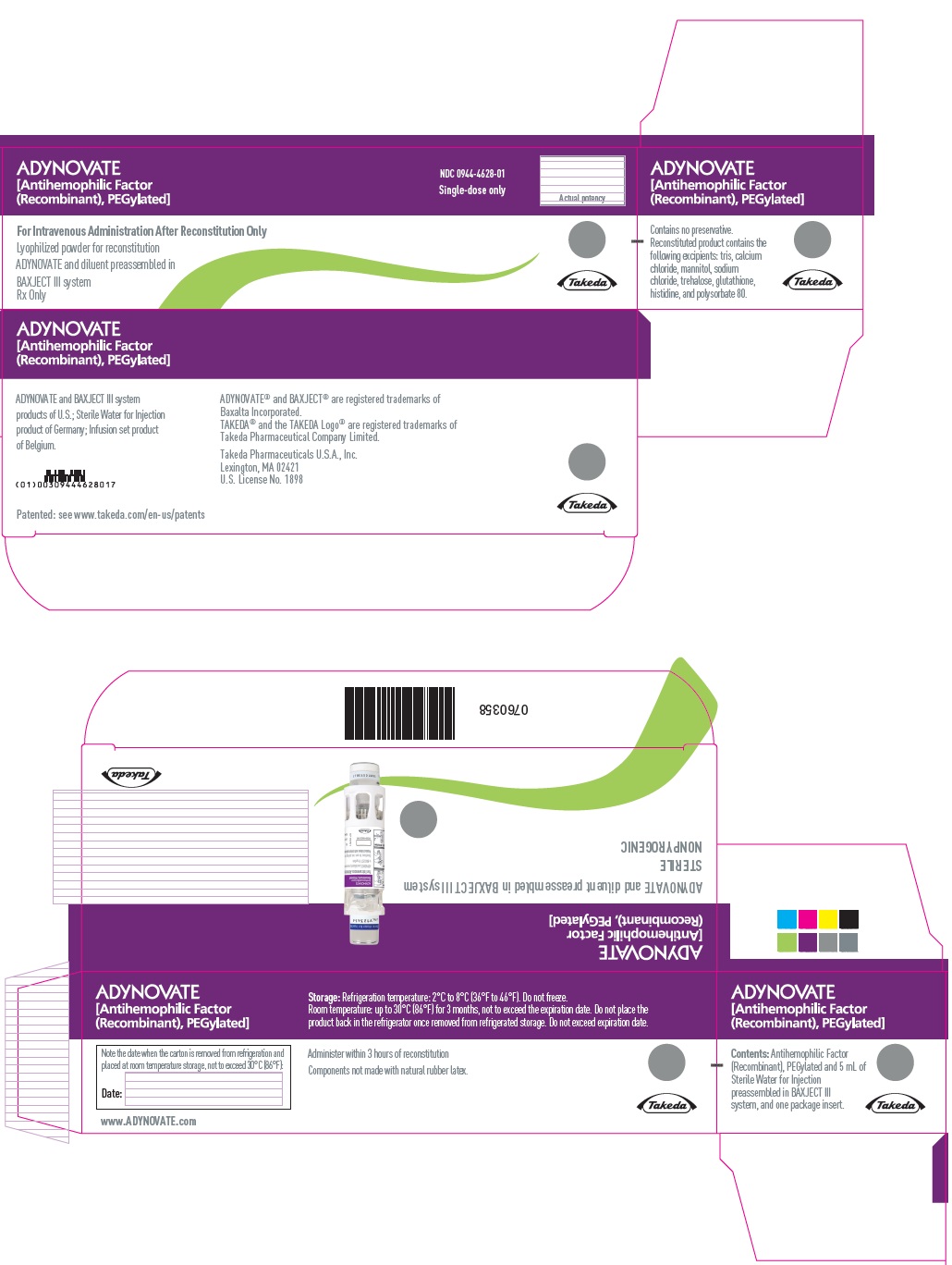
PANEL PRINCIPAL DE VISUALIZACIÓN – Etiqueta del Barril – 3000 UI
ADYNOVATE
[Factor antihemofílico
(recombinante), pegilado]
Para administración intravenosa solamente
ADYNOVATE y diluyente preensamblados
en el sistema BAXJECT III
Indicaciones de uso: ver prospecto
Rx Sólo
IU:
LOTE:
EXP:
Takeda
0754179

PANEL PRINCIPAL DE VISUALIZACIÓN – Etiqueta de blíster – 3000 UI
ADYNOVATE
[Factor antihemofílico
(Recombinante), PEGilado]
NDC 0944-4628-02
Única dosis
0760357
Para administración intravenosa únicamente
ADYNOVATE y diluyente preensamblados en el sistema BAXJECT III
No abrir hasta el momento de uso
No usar si el embalaje está abierto o dañado
Sólo receta médica
Takeda

PANEL PRINCIPAL DE VISUALIZACIÓN – Etiqueta del Vial de Factor Antihemofílico
Factor antihemofílico (recombinante), pegilado
0754164
Takeda
Número de lote:

PANEL PRINCIPAL DE VISUALIZACIÓN – Etiqueta del Vial de Agua Estéril para Inyección
Agua estéril para inyección
Lote No.:
Siegfried Hameln GmbH
0742211









