Fabricante de medicamentos: Otsuka America Pharmaceutical, Inc. (Updated: 2025-01-14)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
REXULTI® (brexpiprazole) comprimidos, para administración oral
Aprobación inicial en EE. UU.: 2015
ADVERTENCIA: AUMENTO DE LA MORTALIDAD EN PACIENTES ANCIANOS CON PSICOSIS ASOCIADA A DEMENTIA y PENSAMIENTOS Y COMPORTAMIENTOS SUICIDAS
Consulte la información completa de prescripción para ver la advertencia completa en recuadro.
- Los pacientes ancianos con psicosis asociada a demencia tratados con fármacos antipsicóticos presentan un mayor riesgo de muerte. REXULTI no está aprobado para el tratamiento de pacientes con psicosis asociada a demencia sin agitación asociada a demencia debida a la enfermedad de Alzheimer. (5.1)
- Los antidepresivos aumentaron el riesgo de pensamientos y comportamientos suicidas en pacientes pediátricos y adultos jóvenes. Se debe controlar estrechamente a todos los pacientes tratados con antidepresivos para detectar el empeoramiento clínico y la aparición de pensamientos y comportamientos suicidas. No se ha establecido la seguridad y eficacia de REXULTI en pacientes pediátricos con TDM. (5.2, 8.4)
CAMBIOS IMPORTANTES RECIENTES
| Advertencia en recuadro | 5/2024 |
| Advertencias y precauciones (5.14) | 5/2024 |
INDICACIONES Y USO
REXULTI es un antipsicótico atípico indicado para:
- Uso como terapia complementaria a los antidepresivos para el tratamiento del trastorno depresivo mayor (TDM) en adultos (1, 14.1)
- Tratamiento de la esquizofrenia en adultos y pacientes pediátricos de 13 años o más (1, 14.2)
- Tratamiento de la agitación asociada a la demencia debida a la enfermedad de Alzheimer (1, 14.3)
Limitaciones de uso: REXULTI no está indicado como tratamiento según necesidad (“prn”) para la agitación asociada a la demencia debida a la enfermedad de Alzheimer (1)
POSOLOGÍA Y ADMINISTRACIÓN
Administrar REXULTI por vía oral una vez al día con o sin alimentos. (2, 12.3)
| Indicación | Dosis inicial | Dosis objetivo recomendada | Dosis máxima |
|---|---|---|---|
| TDM Adultos (2.2) |
0,5 mg/día o 1 mg/día |
2 mg/día | 3 mg/día |
| Esquizofrenia Adultos (2.3) |
1 mg/día | 2 a 4 mg/día | 4 mg/día |
| Esquizofrenia Pediátrica (13 – 17 años) (2.3) |
0,5 mg/día | 2 a 4 mg/día | 4 mg/día |
| Agitación asociada a la demencia debida a la enfermedad de Alzheimer (2.4) |
0,5 mg/día | 2 mg/día | 3 mg/día |
- Insuficiencia hepática moderada a grave: La dosis máxima recomendada es de 2 mg una vez al día para pacientes con TDM o agitación asociada a demencia debido a la enfermedad de Alzheimer y 3 mg una vez al día para pacientes con esquizofrenia. (2.5)
- CrCl<60 mL/minuto: La dosis máxima recomendada es de 2 mg una vez al día para pacientes con TDM o agitación asociada a demencia debido a la enfermedad de Alzheimer y 3 mg una vez al día para pacientes con esquizofrenia. (2.6)
- Consulte la información completa de prescripción para las modificaciones de la dosis en metabolizadores lentos del CYP2D6 y para el uso concomitante con inhibidores o inductores del CYP. (2.7)
FORMAS Y CONCENTRACIONES FARMACÉUTICAS
Comprimidos: 0,25 mg, 0,5 mg, 1 mg, 2 mg, 3 mg y 4 mg (3)
CONTRAINDICACIONES
Hipersensibilidad conocida a REXULTI o a cualquiera de sus componentes (4)
ADVERTENCIAS Y PRECAUCIONES
- Reacciones adversas cerebrovasculares en pacientes ancianos con psicosis relacionada con la demencia: Mayor incidencia de reacciones adversas cerebrovasculares (p. ej., accidente cerebrovascular, accidente isquémico transitorio) (5.3)
- Síndrome neuroléptico maligno: Manejar con la interrupción inmediata y una estrecha vigilancia. (5.4)
- Discinesia tardía: Interrumpir si es clínicamente apropiado. (5.5)
- Cambios metabólicos: Controlar la hiperglucemia/diabetes mellitus, la dislipidemia y el aumento de peso. (5.6)
- Juego patológico y otras conductas compulsivas: Considere la reducción de la dosis o la interrupción. (5.7)
- Leucopenia, neutropenia y agranulocitosis: Realizar hemogramas completos (CBC) en pacientes con recuento bajo preexistente de leucocitos (WBC) o antecedentes de leucopenia o neutropenia. Considere la interrupción de REXULTI si se produce una disminución clínicamente significativa en los leucocitos en ausencia de otros factores causantes. (5.8)
- Hipotensión ortostática y síncope: Controlar la frecuencia cardíaca y la presión arterial y advertir a los pacientes con enfermedad cardiovascular o cerebrovascular conocida y riesgo de deshidratación o síncope. (5.9)
- Convulsiones: Usar con precaución en pacientes con antecedentes de convulsiones o con afecciones que disminuyen el umbral convulsivo. (5.11)
- Posible deterioro cognitivo y motor: Tenga precaución al operar maquinaria. (5.14)
REACCIONES ADVERSAS
Las reacciones adversas más comunes en adultos fueron (6.1):
- TDM: Aumento de peso, somnolencia y acatisia (≥5% y al menos el doble de la tasa del placebo)
- Esquizofrenia: Aumento de peso (≥4% y al menos el doble de la tasa del placebo)
- Agitación asociada a demencia debida a la enfermedad de Alzheimer: Nasofaringitis, mareos (≥4% y al menos el doble de la tasa del placebo)
Para notificar SOSPECHAS DE REACCIONES ADVERSAS, comuníquese con Otsuka America Pharmaceutical, Inc. al 1-800-438-9927 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES MEDICAMENTOSAS
|
|
| Factores | Ajustes de dosis para REXULTI (2.7) |
| Inhibidores potentes del CYP2D6* o CYP3A4 | Administrar la mitad de la dosis recomendada. |
| Inhibidores potentes/moderados del CYP2D6 con inhibidores potentes/moderados del CYP3A4 | Administrar una cuarta parte de la dosis recomendada. |
| Metabolizadores lentos del CYP2D6 conocidos que toman inhibidores potentes/moderados del CYP3A4 | Administrar una cuarta parte de la dosis recomendada. |
| Inductores potentes del CYP3A4 | Duplicar la dosis recomendada y ajustar aún más según la respuesta clínica. |
USO EN POBLACIONES ESPECÍFICAS
Embarazo: Puede causar síntomas extrapiramidales y/o de abstinencia en neonatos con exposición en el tercer trimestre (8.1)
Ver 17 para información para el paciente y guía de medicamentos.
Revisado: 5/2024
Tabla de contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
ADVERTENCIA: MAYOR MORTALIDAD EN PACIENTES DE EDAD AVANZADA CON PSICOSIS RELACIONADA CON LA DEMENCIA y PENSAMIENTOS Y COMPORTAMIENTOS SUICIDAS
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Información de Administración
2.2 Dosis Recomendada para el Tratamiento Adyuvante del Trastorno Depresivo Mayor (Adultos)
2.3 Dosis Recomendada para la Esquizofrenia (Adultos y Pacientes Pediátricos de 13 a 17 Años)
2.4 Dosis Recomendada para la Agitación Asociada con la Demencia Debido a la Enfermedad de Alzheimer
2.5 Dosis Recomendada en Pacientes con Insuficiencia Hepática
2.6 Dosis Recomendada en Pacientes con Insuficiencia Renal
2.7 Modificaciones de la Dosis para Metabolizadores Lentos de CYP2D6 y para el Uso Concomitante con Inhibidores o Inductores de CYP
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Mayor Mortalidad en Pacientes de Edad Avanzada con Psicosis Relacionada con la Demencia
5.2 Pensamientos y Comportamientos Suicidas en Niños, Adolescentes y Adultos Jóvenes
5.3 Reacciones Adversas Cerebrovasculares, Incluido Accidente Cerebrovascular en Pacientes de Edad Avanzada con Psicosis Relacionada con la Demencia
5.4 Síndrome Neuroléptico Maligno (SNM)
5.5 Discinesia Tardía
5.6 Cambios Metabólicos
5.7 Ludopatía y Otros Comportamientos Compulsivos
5.8 Leucopenia, Neutropenia y Agranulocitosis
5.9 Hipotensión Ortostática y Síncope
5.10 Caídas
5.11 Convulsiones
5.12 Desregulación de la Temperatura Corporal
5.13 Disfagia
5.14 Posibilidad de Deterioro Cognitivo y Motor
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Posterior a la Comercialización
7 INTERACCIONES CON MEDICAMENTOS
7.1 Medicamentos con Interacciones Clínicamente Importantes con REXULTI
7.2 Medicamentos sin Interacciones Clínicamente Importantes con REXULTI
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
8.6 Metabolizadores Lentos de CYP2D6
8.7 Insuficiencia Hepática
8.8 Insuficiencia Renal
8.9 Otras Poblaciones Específicas
9 ABUSO Y DEPENDENCIA DE MEDICAMENTOS
9.1 Sustancia Controlada
9.2 Abuso
9.3 Dependencia
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Tratamiento Adyuvante del Trastorno Depresivo Mayor
14.2 Esquizofrenia
14.3 Agitación Asociada con la Demencia Debido a la Enfermedad de Alzheimer
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANIPULACIÓN
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no se enumeran.
ADVERTENCIA RECUADRO
ADVERTENCIA: AUMENTO DE LA MORTALIDAD EN PACIENTES ANCIANOS CON PSICOSIS ASOCIADA A DEMENTIA y PENSAMIENTOS Y COMPORTAMIENTOS SUICIDAS
Aumento de la mortalidad en pacientes ancianos con psicosis asociada a demencia
Los pacientes ancianos con psicosis asociada a demencia tratados con fármacos antipsicóticos presentan un mayor riesgo de muerte. REXULTI no está aprobado para el tratamiento de pacientes con psicosis asociada a demencia sin agitación asociada a demencia debida a la enfermedad de Alzheimer [véase Advertencias y precauciones (5.1)].
Pensamientos y comportamientos suicidas
Los antidepresivos aumentaron el riesgo de pensamientos y comportamientos suicidas en pacientes pediátricos y pacientes adultos jóvenes en estudios a corto plazo. Se debe controlar estrechamente a todos los pacientes tratados con antidepresivos para detectar cualquier empeoramiento clínico y la aparición de pensamientos y comportamientos suicidas [véase Advertencias y precauciones (5.2)]. No se ha establecido la seguridad y eficacia de REXULTI en pacientes pediátricos con TDM [véase Advertencias y precauciones (5.2), Uso en poblaciones específicas (8.4)].
1 INDICACIONES Y USO
REXULTI está indicado para:
- Tratamiento adyuvante del trastorno depresivo mayor (TDM) en adultos
- Tratamiento de la esquizofrenia en adultos y pacientes pediátricos de 13 años o mayores
- Tratamiento de la agitación asociada a la demencia debida a la enfermedad de Alzheimer
Limitaciones de uso:
REXULTI no está indicado como tratamiento según necesidad (“prn”) para la agitación asociada a la demencia debida a la enfermedad de Alzheimer [véase Estudios clínicos (14.3)].
2 DOSIS Y ADMINISTRACIÓN
2.1 Información de Administración
Administrar REXULTI por vía oral, una vez al día con o sin alimentos [see Clinical Pharmacology (12.3)]
2.2 Dosis Recomendada para el Tratamiento Adjunto del Trastorno Depresivo Mayor (Adultos)
La dosis inicial recomendada de REXULTI para el tratamiento adjunto del TDM en adultos es de 0.5 mg o 1 mg por vía oral una vez al día. Ajuste la dosis a 1 mg una vez al día, luego ajuste a la dosis objetivo de 2 mg una vez al día (según la respuesta clínica y la tolerabilidad del paciente, aumente la dosis a intervalos semanales). La dosis diaria máxima recomendada es de 3 mg. Reevalúe periódicamente para determinar la necesidad continua y la dosis adecuada para el tratamiento.
2.3 Dosis Recomendada para la Esquizofrenia (Adultos y Pacientes Pediátricos de 13 a 17 Años)
Adultos
La dosis inicial recomendada de REXULTI para el tratamiento de la esquizofrenia en adultos es de 1 mg por vía oral una vez al día en los días 1 a 4. Ajuste la dosis a 2 mg una vez al día del día 5 al día 7. En el día 8, la dosis se puede aumentar a la dosis diaria máxima recomendada de 4 mg según la respuesta clínica y la tolerabilidad. La dosis objetivo recomendada es de 2 mg a 4 mg una vez al día.
Pacientes Pediátricos (de 13 a 17 años de edad)
La dosis inicial recomendada de REXULTI para el tratamiento de la esquizofrenia en pacientes pediátricos de 13 a 17 años de edad es de 0.5 mg por vía oral una vez al día en los Días 1 a 4. En los Días 5 a 7, ajuste la dosis a 1 mg por día y en el Día 8 ajuste la dosis a 2 mg según la respuesta clínica y la tolerabilidad. Los aumentos de dosis semanales se pueden realizar en incrementos de 1 mg. Una dosis objetivo recomendada es de 2 a 4 mg una vez al día. La dosis diaria máxima recomendada es de 4 mg.
2.4 Dosis Recomendada para la Agitación Asociada con la Demencia Debido a la Enfermedad de Alzheimer
La dosis inicial recomendada de REXULTI para el tratamiento de la agitación asociada con la demencia debido a la enfermedad de Alzheimer es de 0.5 mg por vía oral una vez al día en los días 1 a 7. Aumente la dosis en los días 8 a 14 a 1 mg una vez al día, y en el día 15 a 2 mg una vez al día. La dosis objetivo recomendada es de 2 mg una vez al día. La dosis se puede aumentar a la dosis diaria máxima recomendada de 3 mg una vez al día después de al menos 14 días, según la respuesta clínica y la tolerabilidad.
2.5 Dosis Recomendada en Pacientes con Insuficiencia Hepática
La dosis máxima recomendada en pacientes con insuficiencia hepática moderada a grave (puntuación Child-Pugh ≥7) es [see Use in Specific Populations (8.7), Clinical Pharmacology (12.3)].
2 mg por vía oral una vez al día en pacientes con TDM o agitación asociada con demencia debido a la enfermedad de Alzheimer, y
3 mg por vía oral una vez al día en pacientes con esquizofrenia
2.6 Dosis Recomendada en Pacientes con Insuficiencia Renal
La dosis máxima recomendada en pacientes con aclaramiento de creatinina CrCl<60 mL/minuto es [see Use in Specific Populations (8.8), Clinical Pharmacology (12.3)].
2 mg por vía oral una vez al día en pacientes con TDM o agitación asociada con demencia debido a la enfermedad de Alzheimer y
3 mg por vía oral una vez al día en pacientes con esquizofrenia
2.7 Modificaciones de la Dosis para Metabolizadores Lentos de CYP2D6 y para el Uso Concomitante con Inhibidores o Inductores de CYP
Se recomiendan modificaciones de la dosis en pacientes que son metabolizadores lentos conocidos del citocromo P450 (CYP) 2D6 y en pacientes que toman inhibidores concomitantes de CYP3A4, inhibidores de CYP2D6 o inductores fuertes de CYP3A4 (consulte la Tabla 1). Si se suspende el fármaco concomitante, ajuste la dosis de REXULTI a su nivel original. Si se suspende el inductor concomitante de CYP3A4, reduzca la dosis de REXULTI al nivel original durante 1 a 2 semanas [see Drug Interactions (7.1), Clinical Pharmacology (12.3)].
| Factores | Dosis Ajustada de REXULTI |
|---|---|
|
|
| Metabolizadores Lentos de CYP2D6 | |
| Metabolizadores lentos de CYP2D6 | Administrar la mitad de la dosis recomendada. |
| Metabolizadores lentos conocidos de CYP2D6 que toman inhibidores fuertes/moderados de CYP3A4 | Administrar una cuarta parte de la dosis recomendada. |
| Pacientes que Toman Inhibidores de CYP2D6 y/o Inhibidores de CYP3A4 | |
| Inhibidores fuertes de CYP2D6* | Administrar la mitad de la dosis recomendada. |
| Inhibidores fuertes de CYP3A4 | Administrar la mitad de la dosis recomendada. |
| Inhibidores fuertes/moderados de CYP2D6 con inhibidores fuertes/moderados de CYP3A4 | Administrar una cuarta parte de la dosis recomendada. |
| Pacientes que Toman Inductores de CYP3A4 | |
| Inductores fuertes de CYP3A4 | Duplicar la dosis recomendada durante 1 a 2 semanas. |
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Las tabletas REXULTI están disponibles en 6 concentraciones:
- Las tabletas de 0.25 mg son de color marrón claro, redondas, ligeramente convexas, con bordes biselados y con “BRX” y “0.25” impreso en un lado.
- Las tabletas de 0.5 mg son de color naranja claro, redondas, ligeramente convexas, con bordes biselados y con “BRX” y “0.5” impreso en un lado.
- Las tabletas de 1 mg son de color amarillo claro, redondas, ligeramente convexas, con bordes biselados y con “BRX” y “1” impreso en un lado.
- Las tabletas de 2 mg son de color verde claro, redondas, ligeramente convexas, con bordes biselados y con “BRX” y “2” impreso en un lado.
- Las tabletas de 3 mg son de color púrpura claro, redondas, ligeramente convexas, con bordes biselados y con “BRX” y “3” impreso en un lado.
- Las tabletas de 4 mg son de color blanco, redondas, ligeramente convexas, con bordes biselados y con “BRX” y “4” impreso en un lado.
4 CONTRAINDICACIONES
REXULTI está contraindicado en pacientes con hipersensibilidad conocida a la brexpiprazole o a cualquiera de sus componentes. Las reacciones han incluido erupción cutánea, hinchazón facial, urticaria y anafilaxia.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Aumento de la Mortalidad en Pacientes Ancianos con Psicosis Relacionada con la Demencia
Los pacientes ancianos con psicosis relacionada con la demencia tratados con fármacos antipsicóticos presentan un mayor riesgo de muerte. Los análisis de 17 ensayos controlados con placebo (duración modal de 10 semanas), en gran parte en pacientes que tomaban fármacos antipsicóticos atípicos, revelaron un riesgo de muerte en los pacientes tratados con fármacos de entre 1,6 y 1,7 veces el riesgo de muerte en los pacientes tratados con placebo. En el transcurso de un ensayo controlado típico de 10 semanas, la tasa de mortalidad en los pacientes tratados con fármacos fue de aproximadamente el 4,5 %, en comparación con una tasa de aproximadamente el 2,6 % en el grupo placebo.
Aunque las causas de muerte fueron variadas, la mayoría de las muertes parecieron ser de naturaleza cardiovascular (p. ej., insuficiencia cardíaca, muerte súbita) o infecciosa (p. ej., neumonía). REXULTI no está aprobado para el tratamiento de pacientes con psicosis relacionada con la demencia sin agitación asociada a la demencia debida a la enfermedad de Alzheimer [véase Advertencia en recuadro, Advertencias y precauciones (5.3)].
5.2 Pensamientos y Comportamientos Suicidas en Niños, Adolescentes y Adultos Jóvenes
En análisis agrupados de ensayos controlados con placebo de fármacos antidepresivos (ISRS y otras clases de antidepresivos) que incluyeron aproximadamente 77 000 pacientes adultos y más de 4400 pacientes pediátricos, la incidencia de pensamientos y comportamientos suicidas en pacientes de 24 años o menos fue mayor en los pacientes tratados con antidepresivos que en los pacientes tratados con placebo. Las diferencias entre el fármaco y el placebo en el número de casos de pensamientos y comportamientos suicidas por cada 1000 pacientes tratados se proporcionan en la Tabla 2.
No se produjeron suicidios en ninguno de los estudios pediátricos. Hubo suicidios en los estudios para adultos, pero el número no fue suficiente para llegar a ninguna conclusión sobre el efecto de los fármacos antidepresivos en el suicidio.
| Rango de Edad (años) | Diferencia entre Fármaco y Placebo en el Número de Pacientes con Pensamientos o Comportamientos Suicidas por cada 1000 Pacientes Tratados |
|---|---|
|
|
| Aumentos en Comparación con Placebo | |
| <18 | 14 pacientes adicionales |
| 18 a 24 | 5 pacientes adicionales |
| Disminuciones en Comparación con Placebo | |
| 25 a 64 | 1 paciente menos |
| ≥65 | 6 pacientes menos |
Se desconoce si el riesgo de pensamientos y conductas suicidas en niños, adolescentes y adultos jóvenes se extiende a un uso a más largo plazo, es decir, más allá de los cuatro meses. Sin embargo, existen pruebas sustanciales de estudios de mantenimiento controlados con placebo en adultos con TDM que indican que los antidepresivos retrasan la recurrencia de la depresión.
Controle a todos los pacientes tratados con antidepresivos para detectar cualquier empeoramiento clínico y la aparición de pensamientos y conductas suicidas, especialmente durante los primeros meses de tratamiento farmacológico y en momentos de cambios de dosis. Aconseje a los familiares o cuidadores de los pacientes que controlen los cambios de comportamiento y que informen al profesional sanitario. Considere cambiar el régimen terapéutico, incluyendo la posible interrupción de REXULTI, en pacientes cuya depresión empeora persistentemente o que experimentan pensamientos o conductas suicidas emergentes.
5.3 Reacciones adversas cerebrovasculares, incluido el accidente cerebrovascular, en pacientes de edad avanzada con psicosis relacionada con la demencia
En ensayos controlados con placebo en pacientes de edad avanzada con demencia, los pacientes asignados al azar a risperidona, aripiprazol y olanzapina tuvieron una mayor incidencia de accidente cerebrovascular y accidente isquémico transitorio, incluido el accidente cerebrovascular mortal. REXULTI no está aprobado para el tratamiento de pacientes con psicosis relacionada con la demencia sin agitación asociada a la demencia debida a la enfermedad de Alzheimer [véase Advertencia en recuadro, Advertencias y precauciones (5.1)].
5.4 Síndrome neuroléptico maligno (SNM)
Se ha notificado el síndrome neuroléptico maligno (SNM), un complejo de síntomas potencialmente mortal, en asociación con la administración de fármacos antipsicóticos, incluido REXULTI.
Las manifestaciones clínicas del SNM son hipertermia, rigidez muscular, alteración del estado mental y evidencia de inestabilidad autonómica (pulso o presión arterial irregular, taquicardia, diaforesis y disritmia cardíaca). Otros signos pueden incluir aumento de la creatina fosfocinasa, mioglobinuria (rabdomiólisis) e insuficiencia renal aguda.
Si se sospecha SNM, interrumpa inmediatamente REXULTI y proporcione tratamiento sintomático intensivo y monitorización.
5.5 Discinesia tardía
La discinesia tardía, un síndrome que consiste en movimientos discinéticos involuntarios, potencialmente irreversibles, puede desarrollarse en pacientes tratados con fármacos antipsicóticos. El riesgo parece ser mayor entre las personas mayores, especialmente las mujeres mayores, pero es imposible predecir qué pacientes desarrollarán el síndrome. Se desconoce si los fármacos antipsicóticos difieren en su potencial para causar discinesia tardía.
El riesgo de discinesia tardía y la probabilidad de que se vuelva irreversible parecen aumentar a medida que aumenta la duración del tratamiento y la dosis acumulativa. El síndrome puede desarrollarse después de períodos de tratamiento relativamente breves, a dosis bajas. También puede ocurrir después de la interrupción del tratamiento.
La discinesia tardía puede remitir, parcial o completamente, si se interrumpe el tratamiento antipsicótico. El tratamiento antipsicótico en sí mismo puede suprimir (o suprimir parcialmente) los signos y síntomas del síndrome, posiblemente enmascarando el proceso subyacente. Se desconoce el efecto que la supresión sintomática tiene sobre el curso a largo plazo de la discinesia tardía.
Dadas estas consideraciones, REXULTI debe prescribirse de la manera más probable para reducir la aparición de discinesia tardía. El tratamiento antipsicótico crónico generalmente debe reservarse para pacientes que padecen una enfermedad crónica que 1) se sabe que responde a los fármacos antipsicóticos y 2) para los que no hay tratamientos alternativos, igualmente eficaces, pero potencialmente menos dañinos, disponibles o apropiados. En pacientes que requieren tratamiento crónico, utilice la dosis más baja y la duración más corta del tratamiento necesarias para producir una respuesta clínica satisfactoria. Reevalúe periódicamente la necesidad de un tratamiento continuado.
Si aparecen signos y síntomas de discinesia tardía en un paciente tratado con REXULTI, debe considerarse la interrupción del fármaco. Sin embargo, algunos pacientes pueden requerir tratamiento con REXULTI a pesar de la presencia del síndrome.
5.6 Cambios metabólicos
Los fármacos antipsicóticos atípicos, incluido REXULTI, han causado cambios metabólicos que incluyen hiperglucemia, diabetes mellitus, dislipidemia y aumento de peso. Aunque todos los fármacos de esta clase hasta la fecha han demostrado producir algunos cambios metabólicos, cada fármaco tiene su propio perfil de riesgo específico.
Hiperglucemia y diabetes mellitus
Se han notificado hiperglucemia y diabetes mellitus, en algunos casos extremos y asociados con cetoacidosis diabética, coma hiperosmolar o muerte, en pacientes tratados con antipsicóticos atípicos. Ha habido informes de hiperglucemia en pacientes tratados con REXULTI. Evalúe la glucosa plasmática en ayunas antes o poco después del inicio del tratamiento antipsicótico y controle periódicamente durante el tratamiento a largo plazo.
Tratamiento adyuvante del trastorno depresivo mayor: En los estudios clínicos controlados con placebo de 6 semanas con dosis fijas en pacientes adultos con TDM, las proporciones de pacientes con cambios en la glucosa en ayunas de normal (<100 mg/dL) a alta (≥126 mg/dL) y de límite (≥100 y <126 mg/dL) a alta fueron similares en pacientes tratados con REXULTI y placebo. En los estudios de depresión a largo plazo, abiertos, el 5% de los pacientes adultos con glucosa en ayunas basal normal experimentaron un cambio a alta mientras tomaban REXULTI más un antidepresivo (ADT); el 25% de los pacientes con glucosa en ayunas límite experimentaron cambios a alta. En conjunto, el 9% de los pacientes con glucosa en ayunas normal o límite experimentaron cambios a glucosa en ayunas alta durante los estudios de depresión a largo plazo.
Esquizofrenia (Adultos): En los estudios clínicos controlados con placebo de 6 semanas con dosis fijas en pacientes adultos con esquizofrenia, las proporciones de pacientes con cambios en la glucosa en ayunas de normal (<100 mg/dL) a alta (≥126 mg/dL) o de límite (≥100 y <126 mg/dL) a alta fueron similares en los pacientes tratados con REXULTI y placebo. En los estudios a largo plazo, abiertos, sobre esquizofrenia, el 8% de los pacientes adultos con glucosa en ayunas basal normal experimentaron un cambio de normal a alta mientras tomaban REXULTI; el 17% de los pacientes con glucosa en ayunas en el límite experimentaron cambios de límite a alta. En conjunto, el 10% de los pacientes con glucosa en ayunas normal o en el límite experimentaron cambios a glucosa en ayunas alta durante los estudios a largo plazo sobre esquizofrenia.
Pacientes pediátricos con esquizofrenia (13 a 17 años de edad): En el estudio abierto a largo plazo en pacientes pediátricos con esquizofrenia, el 2,7% de los pacientes pediátricos con glucosa en ayunas basal normal experimentaron un cambio de normal (<100 mg/dL) a alta (≥126 mg/dL) mientras tomaban REXULTI.
Agitación asociada a la demencia debida a la enfermedad de Alzheimer: En los estudios controlados con placebo de 12 semanas con dosis fijas en pacientes (de 51 a 90 años de edad) con agitación asociada a la demencia debida a la enfermedad de Alzheimer, las proporciones de pacientes con cambios en la glucosa en ayunas de normal (<100 mg/dL) a alta (≥126 mg/dL) o alterada (≥100 y <126 mg/dL) a alta fueron similares en los pacientes tratados con REXULTI (14%) y en los pacientes tratados con placebo (16%).
De los pacientes que habían sido tratados previamente con REXULTI durante 12 semanas y continuaron en un estudio de extensión de tratamiento activo de 12 semanas, el 15% de los pacientes con glucosa en ayunas basal normal experimentaron un cambio de normal (<100 mg/dL) a glucosa en ayunas alta (≥126 mg/dL) mientras tomaban REXULTI; el 30% de los pacientes con glucosa en ayunas alterada experimentaron cambios de glucosa en ayunas alterada (≥100 y <126 mg/dL) a glucosa en ayunas alta. En conjunto, el 20% de los pacientes con glucosa en ayunas normal o alterada experimentaron cambios a glucosa en ayunas alta.
Dislipidemia
Los antipsicóticos atípicos causan alteraciones adversas en los lípidos. Antes o poco después de iniciar la medicación antipsicótica, obtenga un perfil lipídico en ayunas al inicio y controle periódicamente durante el tratamiento.
Tratamiento adyuvante del trastorno depresivo mayor: En los estudios clínicos controlados con placebo de 6 semanas con dosis fijas en pacientes adultos con TDM, los cambios en el colesterol total en ayunas, el colesterol LDL y el colesterol HDL fueron similares en los pacientes tratados con REXULTI y con placebo. La Tabla 3 muestra las proporciones de pacientes con cambios en los triglicéridos en ayunas.
| Proporción de pacientes con cambios de basal a post-basal | ||||
|---|---|---|---|---|
| Triglicéridos | Placebo | 1 mg/día | 2 mg/día | 3 mg/día |
| n=el número de pacientes con cambio | ||||
|
||||
| Normal a alta (<150 mg/dL a ≥200 y <500 mg/dL) |
6% (15/257)* |
5% (7/145)* |
13% (15/115)* |
9% (13/150)* |
| Normal/Límite a muy alta (<200 mg/dL a ≥500 mg/dL) |
0% (0/309)* |
0% (0/177)* |
0.7% (1/143)* |
0% (0/179)* |
En los estudios de depresión a largo plazo, abiertos, se notificaron cambios en el colesterol basal en ayunas de normal a alto en el 9% (colesterol total), el 3% (colesterol LDL) y cambios en el valor basal de normal a bajo en el 14% (colesterol HDL) de los pacientes que tomaban REXULTI. De los pacientes con triglicéridos basales normales, el 17% experimentó cambios a altos y el 0,2% experimentó cambios a muy altos. En conjunto, el 0,6% de los pacientes con triglicéridos basales normales o limítrofes experimentaron cambios a triglicéridos basales muy altos durante los estudios de depresión a largo plazo.
Esquizofrenia (Adultos): En los estudios clínicos de 6 semanas, controlados con placebo, a dosis fijas en pacientes adultos con esquizofrenia, los cambios en el colesterol total en ayunas, el colesterol LDL y el colesterol HDL fueron similares en los pacientes tratados con REXULTI y con placebo. La Tabla 4 muestra las proporciones de pacientes con cambios en los triglicéridos en ayunas.
| Proporción de pacientes con cambios del valor basal al valor posterior al basal | ||||
|---|---|---|---|---|
| Triglicéridos | Placebo | 1 mg/día | 2 mg/día | 4 mg/día |
| n=número de pacientes con cambio | ||||
|
||||
| Normal a alto (<150 mg/dL a ≥200 y <500 mg/dL) |
6% (15/253)* |
10% (7/72)* |
8% (19/232)* |
10% (22/226)* |
| Normal/Limítrofe a muy alto (<200 mg/dL a ≥500 mg/dL) |
0% (0/303)* |
0% (0/94)* |
0% (0/283)* |
0.4% (1/283)* |
En los estudios de esquizofrenia a largo plazo, abiertos, en pacientes adultos, se informaron cambios en el colesterol basal en ayunas de normal a alto en el 6% (colesterol total), 2% (colesterol LDL) y cambios en la línea de base de normal a bajo en el 17% (colesterol HDL) de los pacientes que tomaban REXULTI. De los pacientes con triglicéridos basales normales, el 13% experimentó cambios a altos y el 0,4% experimentó cambios a triglicéridos muy altos. En conjunto, el 0,6% de los pacientes con triglicéridos en ayunas normales o limítrofes experimentaron cambios a triglicéridos en ayunas muy altos durante los estudios de esquizofrenia a largo plazo.
Esquizofrenia [Pacientes pediátricos (de 13 a 17 años de edad)]: En el estudio abierto a largo plazo en pacientes pediátricos con esquizofrenia, se informaron cambios en el colesterol total basal en ayunas de normal a alto (<170 a ≥200 mg/dL) en el 7% de los pacientes que tomaban REXULTI, y cambios en el colesterol HDL basal de normal a bajo (≥40 a <40 mg/dL) se informaron en el 12,9% de los pacientes que tomaban REXULTI. De los pacientes con triglicéridos basales normales, el 8,5% experimentó cambios de normales a altos (<150 a ≥200 mg/dL).
Agitación asociada con demencia debida a la enfermedad de Alzheimer: En los estudios clínicos controlados con placebo, de dosis fija y de 12 semanas de duración, en pacientes (de 55 a 90 años de edad) con agitación asociada con demencia debida a la enfermedad de Alzheimer, los cambios en el colesterol total, el colesterol LDL y el colesterol HDL fueron similares en los pacientes tratados con REXULTI y con placebo.
La Tabla 5 muestra las proporciones de pacientes con cambios en los triglicéridos en ayunas en pacientes tratados con REXULTI y con placebo.
| Proporción de pacientes con cambios de la línea de base a la post-línea de base | ||||
|---|---|---|---|---|
| Triglicéridos | Placebo | 1 mg/día | 2 mg/día | 3 mg/día |
| n=el número de pacientes con cambio | ||||
|
||||
| Normal a alto (<150 y 200 a <500 mg/dL) |
6% (10/157)* |
9% (9/99)* |
13% (17/133)* |
6% (6/94)* |
| Limítrofe a alto (150 y <200 mg/dL a 200 y <500 mg/dL) |
12% (3/26)* |
33% (2/6)* |
28% (7/25)* |
26% (6/23)* |
| Normal/Limítrofe a alto (<200 mg/dL a 200 y <500 mg/dL) |
7% (13/183)* |
11% (11/105)* |
15% (24/158)* |
10% (12/117)* |
De los pacientes que previamente fueron tratados con REXULTI durante 12 semanas y continuaron en un estudio de extensión de tratamiento activo de 12 semanas, el 9% de los pacientes que tomaron REXULTI mostraron cambios en el colesterol total en ayunas basal de normal (<200 mg/dL) a alto (≥240 mg/dL), y el 16% de los pacientes que tomaron REXULTI mostraron cambios en el colesterol HDL basal de normal a bajo (≥40 a <40 mg/dL). De los pacientes con triglicéridos basales normales, el 18% experimentó cambios de normal (<150 mg/dL) a alto (200 a <500 mg/dL).
Aumento de peso
Se ha observado aumento de peso en pacientes tratados con antipsicóticos atípicos, incluido REXULTI. Controle el peso al inicio y con frecuencia a partir de entonces.
Tratamiento adyuvante del trastorno depresivo mayor: La Tabla 6 muestra los datos de aumento de peso en la última visita y el porcentaje de pacientes adultos con un aumento ≥7% en el peso corporal al final del tratamiento de los estudios clínicos de 6 semanas controlados con placebo, a dosis fijas en pacientes con TDM.
| Placebo | 1 mg/día | 2 mg/día | 3 mg/día | |
|---|---|---|---|---|
| n=407 | n=225 | n=187 | n=228 | |
| n= el número de pacientes con un cambio ≥7% | ||||
|
||||
| Cambio medio desde el inicio (kg) en la última visita | ||||
| Todos los pacientes | +0.3 | +1.3 | +1.6 | +1.6 |
| Proporción de pacientes con un aumento ≥7% en el peso corporal (kg) en cualquier visita (*n/N) | ||||
| 2% | 5% | 5% | 2% | |
| (8/407)* | (11/225)* | (9/187)* | (5/228)* | |
En los estudios de depresión a largo plazo, abiertos, el 4% de los pacientes interrumpieron el tratamiento debido al aumento de peso. REXULTI se asoció con un cambio medio desde la línea de base en el peso de 2,9 kg en la semana 26 y 3,1 kg en la semana 52. En los estudios de depresión a largo plazo, abiertos, el 30% de los pacientes mostraron un aumento de ≥7% en el peso corporal, y el 4% mostraron una disminución de ≥7% en el peso corporal.
Esquizofrenia (Adultos): La Tabla 7 muestra los datos de aumento de peso en la última visita y el porcentaje de pacientes adultos con un aumento de ≥7% en el peso corporal al final del estudio a partir de los estudios clínicos de 6 semanas controlados con placebo y dosis fija en pacientes adultos con esquizofrenia.
| Placebo | 1 mg/día | 2 mg/día | 4 mg/día | |
|---|---|---|---|---|
| n=362 | n=120 | n=362 | n=362 | |
| n=el número de pacientes con un cambio ≥7% | ||||
|
||||
| Cambio medio desde la línea de base (kg) en la última visita | ||||
| Todos los pacientes | +0,2 | +1,0 | +1,2 | +1,2 |
| Proporción de pacientes con un aumento de ≥7% en el peso corporal (kg) en cualquier visita (*n/N) | ||||
| 4% | 10% | 11% | 10% | |
| (15/362)* | (12/120)* | (38/362)* | (37/362)* | |
A largo plazo, en estudios de esquizofrenia abiertos y sin enmascaramiento en pacientes adultos, el 0,6% de los pacientes interrumpieron el tratamiento debido al aumento de peso. REXULTI se asoció con un cambio medio respecto al valor basal en el peso de 1,3 kg en la semana 26 y de 2,0 kg en la semana 52. En los estudios de esquizofrenia abiertos y sin enmascaramiento a largo plazo, el 20% de los pacientes presentaron un aumento de peso ≥7%, y el 10% presentaron una disminución de peso ≥7%.
Esquizofrenia [Pacientes pediátricos (de 13 a 17 años de edad)]: En el estudio abierto y sin enmascaramiento a largo plazo en pacientes pediátricos con esquizofrenia, el 0,5% de los pacientes interrumpieron el tratamiento debido al aumento de peso. El aumento medio de peso desde el valor basal del estudio abierto hasta la última visita fue de 3,8 kg. Para ajustar el crecimiento normal, se derivaron puntuaciones z (medidas en desviaciones estándar [DE]), que se normalizan para el crecimiento natural de niños y adolescentes mediante comparaciones con estándares de población ajustados por edad y sexo. Un cambio en la puntuación z <0,5 DE se considera no clínicamente significativo. En este estudio, el cambio medio en la puntuación z desde el valor basal abierto hasta la última visita fue de 0,10 DE para el peso corporal, mientras que el 20% de los pacientes tuvieron un aumento en la puntuación z del peso corporal ajustado por edad y sexo de al menos 0,5 DE desde el valor basal. Al tratar a pacientes pediátricos, se debe controlar y evaluar el aumento de peso en relación con el esperado para el crecimiento normal.
Agitación asociada a la demencia debida a la enfermedad de Alzheimer: En los estudios clínicos controlados con placebo de 12 semanas y dosis fija en pacientes (de 51 a 90 años de edad) con agitación asociada a la demencia debida a la enfermedad de Alzheimer, la proporción de pacientes con un aumento de peso (kg) ≥7% en cualquier visita fue del 2% en el grupo de REXULTI en comparación con el 0% en el grupo placebo.
En los pacientes que habían sido tratados previamente con REXULTI durante 12 semanas y que continuaron en un estudio de extensión de tratamiento activo de 12 semanas, no hubo ningún cambio medio en el peso (kg) desde el valor basal hasta la última visita en asociación con REXULTI. En este estudio de extensión, el 4% de los pacientes presentaron un aumento de peso ≥7%, y el 5% presentaron una disminución de peso ≥7% desde el valor basal hasta la última visita.
5.7 Juego patológico y otras conductas compulsivas
Los informes de casos posteriores a la comercialización sugieren que los pacientes pueden experimentar impulsos intensos, particularmente por el juego, y la incapacidad de controlar estos impulsos mientras toman REXULTI. Otros impulsos compulsivos, informados con menos frecuencia, incluyen impulsos sexuales, compras, alimentación o atracones y otras conductas impulsivas o compulsivas. Debido a que los pacientes pueden no reconocer estas conductas como anormales, es importante que los médicos pregunten específicamente a los pacientes o a sus cuidadores sobre el desarrollo de impulsos nuevos o intensos por el juego, impulsos sexuales compulsivos, compras compulsivas, atracones o alimentación compulsiva, u otros impulsos mientras se tratan con REXULTI. En algunos casos, aunque no en todos, se informó que los impulsos cesaron cuando se redujo la dosis o se interrumpió el medicamento. Las conductas compulsivas pueden causar daño al paciente y a otras personas si no se reconocen. Considere la reducción de la dosis o la interrupción del medicamento si un paciente desarrolla tales impulsos.
5.8 Leucopenia, neutropenia y agranulocitosis
Se ha informado de leucopenia y neutropenia durante el tratamiento con agentes antipsicóticos. Se ha informado de agranulocitosis (incluidos casos mortales) con otros agentes de esta clase.
Los posibles factores de riesgo de leucopenia y neutropenia incluyen recuento bajo preexistente de leucocitos (WBC) o recuento absoluto de neutrófilos (ANC) y antecedentes de leucopenia o neutropenia inducida por fármacos. En pacientes con un recuento bajo preexistente de leucocitos o ANC o antecedentes de leucopenia o neutropenia inducida por fármacos, realice un hemograma completo (CBC) con frecuencia durante los primeros meses de terapia. En tales pacientes, considere la interrupción de REXULTI a la primera señal de una disminución clínicamente significativa de los leucocitos en ausencia de otros factores causales.
Controle a los pacientes con neutropenia clínicamente significativa en busca de fiebre u otros síntomas o signos de infección y trátelos rápidamente si aparecen dichos síntomas o signos. Suspenda REXULTI en pacientes con recuento absoluto de neutrófilos <1000/mm3 y controle sus leucocitos hasta la recuperación.
5.9 Hipotensión ortostática y síncope
Los antipsicóticos atípicos causan hipotensión ortostática y síncope. En general, el riesgo es mayor durante la titulación inicial de la dosis y al aumentar la dosis. En los estudios clínicos controlados con placebo a corto plazo de REXULTI más ADT en pacientes adultos con TDM, la incidencia de reacciones adversas relacionadas con la hipotensión ortostática en pacientes tratados con REXULTI más ADT en comparación con pacientes tratados con placebo más ADT incluyó: mareos (2% versus 2%) e hipotensión ortostática (0,1% versus 0%). En los estudios clínicos controlados con placebo a corto plazo de REXULTI en pacientes adultos con esquizofrenia, la incidencia de reacciones adversas relacionadas con la hipotensión ortostática en pacientes tratados con REXULTI en comparación con pacientes tratados con placebo incluyó: mareos (2% versus 2%), hipotensión ortostática (0,4% versus 0,2%) y síncope (0,1% versus 0%). En los estudios clínicos controlados con placebo de 12 semanas de REXULTI en pacientes con agitación asociada a la demencia debida a la enfermedad de Alzheimer, la incidencia de reacciones adversas relacionadas con la hipotensión ortostática en pacientes tratados con REXULTI en comparación con pacientes tratados con placebo incluyó: mareos (3% versus 3%), hipotensión ortostática (1% versus 1%) y síncope (0,2% versus 0,8%).
Se deben controlar los signos vitales ortostáticos en pacientes vulnerables a la hipotensión (por ejemplo, pacientes ancianos, pacientes con deshidratación, hipovolemia, tratamiento concomitante con medicamentos antihipertensivos), pacientes con enfermedad cardiovascular conocida (antecedentes de infarto de miocardio, cardiopatía isquémica, insuficiencia cardíaca o anomalías de la conducción) y pacientes con enfermedad cerebrovascular. REXULTI no se ha evaluado en pacientes con antecedentes recientes de infarto de miocardio o enfermedad cardiovascular inestable. Dichos pacientes fueron excluidos de los estudios clínicos previos a la comercialización.
5.10 Caídas
Los antipsicóticos, incluido REXULTI, pueden causar somnolencia, hipotensión postural, inestabilidad motora y sensorial, lo que puede llevar a caídas y, en consecuencia, fracturas u otras lesiones. Para los pacientes con enfermedades, afecciones o medicamentos que puedan exacerbar estos efectos, se deben realizar evaluaciones completas del riesgo de caídas al iniciar el tratamiento antipsicótico y de forma recurrente en los pacientes en tratamiento antipsicótico a largo plazo.
5.11 Convulsiones
Al igual que otros fármacos antipsicóticos, REXULTI puede causar convulsiones. Este riesgo es mayor en pacientes con antecedentes de convulsiones o con afecciones que disminuyan el umbral convulsivo. Las afecciones que disminuyen el umbral convulsivo pueden ser más prevalentes en pacientes de mayor edad.
5.12 Desregulación de la temperatura corporal
Los antipsicóticos atípicos pueden alterar la capacidad del cuerpo para reducir la temperatura corporal central. El ejercicio intenso, la exposición al calor extremo, la deshidratación y los medicamentos anticolinérgicos pueden contribuir a un aumento de la temperatura corporal central; se debe usar REXULTI con precaución en pacientes que puedan experimentar estas condiciones.
5.13 Disfagia
La dismotilidad esofágica y la aspiración se han asociado con el uso de fármacos antipsicóticos. Los fármacos antipsicóticos, incluido REXULTI, deben usarse con precaución en pacientes con riesgo de aspiración.
5.14 Potencial de deterioro cognitivo y motor
REXULTI, al igual que otros antipsicóticos, puede causar somnolencia y tiene el potencial de afectar el juicio, el pensamiento o las habilidades motoras. En los estudios clínicos controlados con placebo de 6 semanas en pacientes con MDD, se informó somnolencia (incluyendo sedación e hipersomnia) en el 4% de los pacientes tratados con REXULTI más ADT en comparación con el 1% de los pacientes tratados con placebo más ADT.
En los estudios clínicos controlados con placebo de 6 semanas en pacientes adultos con esquizofrenia, se informó somnolencia (incluyendo sedación e hipersomnia) en el 5% de los pacientes tratados con REXULTI en comparación con el 3% de los pacientes tratados con placebo.
En los estudios clínicos controlados con placebo, de dosis fija de 12 semanas en pacientes (de 51 a 90 años de edad) con agitación asociada a la demencia por enfermedad de Alzheimer, se informó somnolencia (incluyendo sedación) en el 3% de los pacientes tratados con REXULTI en comparación con el 1% de los pacientes tratados con placebo.
Se debe advertir a los pacientes que tengan cuidado al operar maquinaria peligrosa, incluidos vehículos de motor, hasta que estén razonablemente seguros de que la terapia con REXULTI no les afecta negativamente.
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas se describen con más detalle en otras secciones del etiquetado:
- Aumento de la mortalidad en pacientes de edad avanzada con psicosis relacionada con la demencia [ver Advertencia en recuadro, Advertencias y precauciones (5.1)]
- Pensamientos y conductas suicidas en adolescentes y adultos jóvenes [ver Advertencia en recuadro, Advertencias y precauciones (5.2)]
- Reacciones adversas cerebrovasculares, incluyendo accidente cerebrovascular en pacientes de edad avanzada con psicosis relacionada con la demencia [ver Advertencias y precauciones (5.3)]
- Síndrome neuroléptico maligno (SNM) [ver Advertencias y precauciones (5.4)]
- Discinesia tardía [ver Advertencias y precauciones (5.5)]
- Cambios metabólicos [ver Advertencias y precauciones (5.6)]
- Juego patológico y otras conductas compulsivas [ver Advertencias y precauciones (5.7)]
- Leucopenia, neutropenia y agranulocitosis [ver Advertencias y precauciones (5.8)]
- Hipotensión ortostática y síncope [ver Advertencias y precauciones (5.9)]
- Caídas [ver Advertencias y precauciones (5.10)]
- Convulsiones [ver Advertencias y precauciones (5.11)]
- Disregulación de la temperatura corporal [ver Advertencias y precauciones (5.12)]
- Disfagia [ver Advertencias y precauciones (5.13)]
- Potencial de deterioro cognitivo y motor [ver Advertencias y precauciones (5.14)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica clínica.
Tratamiento adyuvante en el trastorno depresivo mayor (TDM)
La seguridad de REXULTI se evaluó en 1054 pacientes adultos (de 18 a 65 años de edad) diagnosticados con TDM que participaron en dos estudios clínicos de 6 semanas controlados con placebo y de dosis fija en pacientes con trastorno depresivo mayor, en los que REXULTI se administró en dosis de 1 mg a 3 mg diarios como tratamiento adyuvante a la terapia antidepresiva continua; los pacientes del grupo placebo continuaron recibiendo terapia antidepresiva [ver Estudios clínicos (14.1)].
Reacciones adversas notificadas como motivos para la interrupción del tratamiento
Un total del 3% (17/643) de los pacientes tratados con REXULTI y el 1% (3/411) de los pacientes tratados con placebo interrumpieron el tratamiento debido a reacciones adversas.
Reacciones adversas en los estudios de REXULTI para el TDM adyuvante en adultos
Las reacciones adversas asociadas con el uso adyuvante de REXULTI (incidencia del 2% o mayor e incidencia de REXULTI adyuvante mayor que la del placebo adyuvante) que se produjeron durante la terapia aguda (hasta 6 semanas en pacientes con TDM) se muestran en la Tabla 8.
| Placebo (N=411) % |
REXULTI | ||||
|---|---|---|---|---|---|
| 1 mg/día (N=226) % |
2 mg/día (N=188) % |
3 mg/día (N=229) % |
Todos los REXULTI (N=643) % |
||
| Trastornos gastrointestinales | |||||
| Estreñimiento | 1 | 3 | 2 | 1 | 2 |
| Trastornos generales y afecciones en el lugar de administración | |||||
| Fatiga | 2 | 3 | 2 | 5 | 3 |
| Infecciones e infestaciones | |||||
| Nasofaringitis | 2 | 7 | 1 | 3 | 4 |
| Pruebas | |||||
| Aumento de peso | 2 | 7 | 8 | 6 | 7 |
| Disminución del cortisol en sangre | 1 | 4 | 0 | 3 | 2 |
| Metabolismo y Nutrición | |||||
| Aumento del apetito | 2 | 3 | 3 | 2 | 3 |
| Trastornos del sistema nervioso | |||||
| Acatisia | 2 | 4 | 7 | 14 | 9 |
| Dolor de cabeza | 6 | 9 | 4 | 6 | 7 |
| Somnolencia | 0.5 | 4 | 4 | 6 | 5 |
| Temblor | 2 | 4 | 2 | 5 | 4 |
| Mareo | 1 | 1 | 5 | 2 | 3 |
| Trastornos psiquiátricos | |||||
| Ansiedad | 1 | 2 | 4 | 4 | 3 |
| Inquietud | 0 | 2 | 3 | 4 | 3 |
Adultos
La seguridad de REXULTI se evaluó en 852 pacientes adultos (de 18 a 65 años de edad) diagnosticados con esquizofrenia que participaron en dos estudios clínicos de 6 semanas controlados con placebo y de dosis fija en los que se administró REXULTI a dosis diarias de 1 mg, 2 mg y 4 mg [ver Estudios clínicos (14.2)].
Reacciones adversas que ocurren con una incidencia del 2% o más en pacientes tratados con REXULTI para la esquizofrenia
Las reacciones adversas asociadas con REXULTI (incidencia del 2% o mayor e incidencia de REXULTI mayor que la del placebo) durante los estudios a corto plazo (hasta 6 semanas) en pacientes adultos con esquizofrenia se muestran en la Tabla 9.
| Placebo (N=368) % |
REXULTI | ||||
|---|---|---|---|---|---|
| 1 mg/día (N=120) % |
2 mg/día (N=368) % |
4 mg/día (N=364) % |
TODOS LOS REXULTI (N=852) % |
||
| Trastornos gastrointestinales | |||||
| Dispepsia | 2 | 6 | 2 | 3 | 3 |
| Diarrea | 2 | 1 | 3 | 3 | 3 |
| Investigaciones | |||||
| Aumento de peso | 2 | 3 | 4 | 4 | 4 |
| Creatincinasa fosfokinasa sanguínea aumentada | 1 | 4 | 2 | 2 | 2 |
| Trastornos del sistema nervioso | |||||
| Acatisia | 5 | 4 | 5 | 7 | 6 |
| Temblor | 1 | 2 | 2 | 3 | 3 |
| Sedación | 1 | 2 | 2 | 3 | 2 |
Agitación asociada a la demencia debida a la enfermedad de Alzheimer
La seguridad de REXULTI se evaluó en 503 pacientes (de 51 a 90 años de edad), con un diagnóstico probable de agitación asociada a la demencia debida a la enfermedad de Alzheimer, que participaron en dos estudios clínicos de 12 semanas, controlados con placebo y de dosis fija, en los que se administró REXULTI a dosis diarias de 2 mg a 3 mg [véase Estudios clínicos (14.3)].
Interrupción del tratamiento debido a reacciones adversas
En dos estudios clínicos de 12 semanas, controlados con placebo, de dosis fija, un total del 5,6% (28/503) de los pacientes tratados con REXULTI y el 4,8% (12/251) de los pacientes tratados con placebo interrumpieron el tratamiento debido a reacciones adversas.
Reacciones adversas que ocurrieron con una incidencia del 2% o más en pacientes tratados con REXULTI para la agitación asociada a la demencia debida a la enfermedad de Alzheimer
Las reacciones adversas asociadas con REXULTI (incidencia ≥2% y mayor que el placebo) durante los estudios clínicos de 12 semanas con dosis fija en pacientes geriátricos para el tratamiento de la agitación asociada a la demencia debida a la enfermedad de Alzheimer se muestran en la Tabla 10.
| Placebo (N=251) % |
REXULTI | ||||
|---|---|---|---|---|---|
| 1 mg/día* (N=137) % |
2 mg/día (N=213) % |
3 mg/día (N=153) % |
TODOS LOS REXULTI (N=503) % |
||
|
|||||
| Infecciones e infestaciones | |||||
| Nasofaringitis | 2 | 4 | 2 | 3 | 3 |
| Infección del tracto urinario | 1 | 2 | 3 | 3 | 3 |
| Trastornos del sistema nervioso | |||||
| Mareos† | 2 | 1 | 5 | 3 | 3 |
| Cefalea | 8 | 9 | 9 | 7 | 8 |
| Somnolencia‡ | 1 | 2 | 3 | 4 | 3 |
| Trastornos psiquiátricos | |||||
| Insomnio§ | 3 | 5 | 5 | 2 | 4 |
Síntomas extrapiramidales
Tratamiento adyuvante del trastorno depresivo mayor
La incidencia de reacciones adversas relacionadas con síntomas extrapiramidales (SEP), excluyendo la acatisia, fue del 6% para los pacientes tratados con REXULTI más ADT frente al 3% para los pacientes tratados con placebo más ADT. La incidencia de eventos de acatisia para los pacientes tratados con REXULTI más ADT fue del 9% frente al 2% para los pacientes tratados con placebo más ADT.
En los estudios de TDM controlados con placebo de 6 semanas, los datos se recogieron objetivamente en la Escala de Calificación de Simpson-Angus (SAS) para SEP, la Escala de Calificación de Acatisia de Barnes (BARS) para acatisia y la Puntuación de Movimientos Involuntarios Anormales (AIMS) para discinesia. El cambio medio desde la línea de base en la última visita para los pacientes tratados con REXULTI más ADT para la SAS, BARS y AIMS fue comparable al de los pacientes tratados con placebo. El porcentaje de pacientes que pasaron de normal a anormal fue mayor en los pacientes tratados con REXULTI más ADT frente a los pacientes tratados con placebo más ADT para la BARS (4% frente a 0,6%) y la SAS (4% frente a 3%).
Esquizofrenia
La incidencia de reacciones adversas relacionadas con SEP, excluyendo la acatisia, fue del 5% para los pacientes tratados con REXULTI frente al 4% para los pacientes tratados con placebo. La incidencia de eventos de acatisia para los pacientes tratados con REXULTI fue del 6% frente al 5% para los pacientes tratados con placebo.
En los estudios de esquizofrenia en adultos controlados con placebo de 6 semanas y dosis fija, los datos se recogieron objetivamente en la Escala de Calificación de Simpson-Angus (SAS) para SEP, la Escala de Calificación de Acatisia de Barnes (BARS) para acatisia y la Escala de Movimientos Involuntarios Anormales (AIMS) para discinesia. El cambio medio desde la línea de base en la última visita para los pacientes tratados con REXULTI para la SAS, BARS y AIMS fue comparable al de los pacientes tratados con placebo. El porcentaje de pacientes que pasaron de normal a anormal fue mayor en los pacientes tratados con REXULTI frente al placebo para la BARS (2% frente a 1%) y la SAS (7% frente a 5%).
Agitación asociada a la demencia debida a la enfermedad de Alzheimer
La incidencia de reacciones adversas relacionadas con SEP, excluyendo la acatisia, fue del 3% para los pacientes tratados con REXULTI frente al 2% para los pacientes tratados con placebo. La incidencia de eventos de acatisia para los pacientes tratados con REXULTI fue del 1% frente al 0% para los pacientes tratados con placebo.
En los estudios controlados con placebo de 12 semanas y dosis fija sobre la agitación asociada a la demencia debida a la enfermedad de Alzheimer, los datos se recogieron objetivamente en la Escala de Calificación de Simpson-Angus (SAS) para SEP, la Escala de Calificación de Acatisia de Barnes (BARS) para acatisia y la Escala de Movimientos Involuntarios Anormales (AIMS) para discinesia. El cambio medio desde la línea de base en la última visita para los pacientes tratados con REXULTI para la SAS, BARS y AIMS fue comparable al de los pacientes tratados con placebo. El porcentaje de pacientes que pasaron de normal a anormal fue mayor en los pacientes tratados con REXULTI frente al placebo para la SAS (6% frente a 2%).
Distonía
Los síntomas de distonía pueden aparecer en individuos susceptibles durante los primeros días de tratamiento. Los síntomas distónicos incluyen espasmo de los músculos del cuello, que a veces progresan a tensión en la garganta, dificultad para tragar, dificultad para respirar y/o protrusión de la lengua. Si bien estos síntomas pueden aparecer con dosis bajas, se presentan con mayor frecuencia y gravedad con fármacos antipsicóticos de primera generación de alta potencia y a dosis más altas. Se observa un mayor riesgo de distonía aguda en varones y grupos de edad más jóvenes.
Otras reacciones adversas observadas durante la evaluación de ensayos clínicos de REXULTI
A continuación se muestran otras reacciones adversas (≥1% de frecuencia y mayor que el placebo) dentro de los ensayos controlados con placebo a corto plazo en pacientes adultos con TDM y esquizofrenia. La siguiente lista no incluye reacciones adversas: 1) ya incluidas en tablas anteriores o en otras partes del etiquetado, 2) para las que la causa del fármaco fue remota, 3) que fueron tan generales que no fueron informativas, 4) que no se consideraron que tuvieran implicaciones clínicamente significativas, o 5) que ocurrieron a una tasa igual o inferior al placebo.
Trastornos oculares: Visión borrosa
Trastornos gastrointestinales: Náuseas, sequedad de boca, hipersecreción salival, dolor abdominal, flatulencia
Pruebas complementarias: Aumento de la prolactina en sangre
Trastornos musculoesqueléticos y del tejido conjuntivo: Mialgia
Trastornos psiquiátricos: Sueños anormales
Trastornos de la piel y del tejido subcutáneo: Hiperhidrosis
Pacientes pediátricos (de 13 a 17 años de edad)
En un estudio abierto de 2 años en curso en pacientes pediátricos de 13 a 17 años de edad con esquizofrenia, en el que se evaluó la seguridad en 194 pacientes, de los cuales 140 recibieron REXULTI durante al menos 6 meses. Las reacciones adversas notificadas en los estudios clínicos para este grupo de edad fueron generalmente similares a las observadas en pacientes adultos.
6.2 Experiencia postcomercialización
La siguiente reacción adversa se ha identificado durante el uso posterior a la aprobación de REXULTI. Debido a que estas reacciones se notifican voluntariamente a partir de una población de tamaño incierto, no siempre es posible estimar su frecuencia de forma fiable o establecer una relación causal con la exposición al fármaco.
Trastornos del sistema nervioso: Síndrome neuroléptico maligno
7 INTERACCIONES MEDICAMENTOSAS
7.1 Fármacos con interacciones clínicamente importantes con REXULTI
Véase la Tabla 11 para ver las interacciones farmacológicas clínicamente importantes con REXULTI.
|
|
| Inhibidores potentes del CYP3A4 | |
| Impacto clínico: | El uso concomitante de REXULTI con inhibidores potentes del CYP3A4 aumentó la exposición a brexpiprazol en comparación con el uso de REXULTI solo [véase Farmacología clínica (12.3)]. |
| Intervención: | Con el uso concomitante de REXULTI con un inhibidor potente del CYP3A4, reduzca la dosis de REXULTI [véase Dosificación y administración (2.7)]. |
| Inhibidores potentes del CYP2D6* | |
| Impacto clínico: | El uso concomitante de REXULTI con inhibidores potentes del CYP2D6 aumentó la exposición a brexpiprazol en comparación con el uso de REXULTI solo [véase Farmacología clínica (12.3)]. |
| Intervención: | Con el uso concomitante de REXULTI con un inhibidor potente del CYP2D6, reduzca la dosis de REXULTI [véase Dosificación y administración (2.7)]. |
| Inhibidores del CYP3A4 y del CYP2D6 | |
| Impacto clínico: | El uso concomitante de REXULTI con 1) un inhibidor potente del CYP3A4 y un inhibidor potente del CYP2D6; o 2) un inhibidor moderado del CYP3A4 y un inhibidor potente del CYP2D6; o 3) un inhibidor potente del CYP3A4 y un inhibidor moderado del CYP2D6; o 4) un inhibidor moderado del CYP3A4 y un inhibidor moderado del CYP2D6 aumentó la exposición a brexpiprazol en comparación con el uso de REXULTI solo [véase Farmacología clínica (12.3)]. |
| Intervención: | Con el uso concomitante de REXULTI con 1) un inhibidor potente del CYP3A4 y un inhibidor potente del CYP2D6; o 2) un inhibidor moderado del CYP3A4 y un inhibidor potente del CYP2D6; o 3) un inhibidor potente del CYP3A4 y un inhibidor moderado del CYP2D6; o 4) un inhibidor moderado del CYP3A4 y un inhibidor moderado del CYP2D6, disminuya la dosis de REXULTI [véase Dosificación y administración (2.7)]. |
| Inductores potentes del CYP3A4 | |
| Impacto clínico: | El uso concomitante de REXULTI y un inductor potente del CYP3A4 disminuyó la exposición a brexpiprazol en comparación con el uso de REXULTI solo [véase Farmacología clínica (12.3)]. |
| Intervención: | Con el uso concomitante de REXULTI con un inductor potente del CYP3A4, aumente la dosis de REXULTI [véase Dosificación y administración (2.7)]. |
7.2 Fármacos sin interacciones clínicamente importantes con REXULTI
Según estudios farmacocinéticos, no se requiere ajuste de dosis de REXULTI cuando se administra concomitantemente con inhibidores del CYP2B6 (p. ej., ticlopidina) o modificadores del pH gástrico (p. ej., omeprazol). Además, no se requiere ajuste de dosis para sustratos del CYP2D6 (p. ej., dextrometorfano), CYP3A4 (p. ej., lovastatina), CYP2B6 (p. ej., bupropión), BCRP (p. ej., rosuvastatina) o P-gp (p. ej., fexofenadina) cuando se administran concomitantemente con REXULTI.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Registro de exposición durante el embarazo
Existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a REXULTI durante el embarazo. Para obtener más información, comuníquese con el Registro Nacional de Embarazos para Medicamentos Psiquiátricos al 1-866-961-2388 o visite http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/.
Resumen de riesgos
No se han realizado estudios adecuados y bien controlados con REXULTI en mujeres embarazadas para informar los riesgos asociados con el medicamento. Sin embargo, los recién nacidos cuyas madres están expuestas a medicamentos antipsicóticos, como REXULTI, durante el tercer trimestre del embarazo corren el riesgo de sufrir síntomas extrapiramidales y/o de abstinencia. En estudios de reproducción animal, no se observó teratogenicidad con la administración oral de brexpiprazol a ratas y conejas preñadas durante la organogénesis a dosis de hasta 73 y 146 veces, respectivamente, la dosis máxima recomendada en humanos (DMRH) de 4 mg/día en mg/m2. Sin embargo, cuando a las ratas preñadas se les administró brexpiprazol durante el período de organogénesis hasta la lactancia, el número de muertes perinatales de las crías aumentó 73 veces la DMRH [ver Datos]. Se desconoce el riesgo de defectos congénitos importantes y aborto espontáneo para la(s) población(es) indicada(s). En la población general de EE. UU., el riesgo estimado de defectos congénitos importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2 al 4 % y del 15 al 20 %, respectivamente.
Consideraciones clínicas
Reacciones adversas fetales/neonatales
Se han notificado síntomas extrapiramidales y/o de abstinencia, como agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria y trastornos de la alimentación, en recién nacidos cuyas madres estuvieron expuestas a fármacos antipsicóticos durante el tercer trimestre del embarazo. Estos síntomas han variado en gravedad. Algunos recién nacidos se recuperaron en cuestión de horas o días sin tratamiento específico; otros requirieron hospitalización prolongada. Controle a los recién nacidos para detectar síntomas extrapiramidales y/o de abstinencia y maneje los síntomas adecuadamente.
Datos
Datos en animales
Se trató a ratas preñadas con dosis orales de 3, 10 y 30 mg/kg/día (7,3, 24 y 73 veces la DMRH en mg/m2) de brexpiprazol durante el período de organogénesis. El brexpiprazol no fue teratogénico y no causó efectos adversos en el desarrollo a dosis de hasta 73 veces la DMRH.
Se trató a conejas preñadas con dosis orales de 10, 30 y 150 mg/kg/día (49, 146 y 730 veces la DMRH) de brexpiprazol durante el período de organogénesis. El brexpiprazol no fue teratogénico y no causó efectos adversos en el desarrollo a dosis de hasta 146 veces la DMRH. Se observaron hallazgos de disminución del peso corporal, osificación retardada y mayor incidencia de variaciones viscerales y esqueléticas en fetos a 730 veces la DMRH, una dosis que indujo toxicidad materna.
En un estudio en el que se administró a ratas preñadas dosis orales de 3, 10 y 30 mg/kg/día (7,3, 24 y 73 veces la DMRH) durante el período de organogénesis y durante la lactancia, el número de crías nacidas vivas disminuyó y las muertes postnatales tempranas aumentaron a una dosis de 73 veces la DMRH. Se observó dificultad para amamantar por parte de las madres, bajo peso al nacer y disminución del aumento de peso corporal en las crías a 73 veces, pero no a 24 veces, la DMRH.
8.2 Lactancia
Resumen de riesgos
No se han realizado estudios de lactancia para evaluar la presencia de brexpiprazol en la leche humana, los efectos del brexpiprazol en el lactante o los efectos del brexpiprazol en la producción de leche. El brexpiprazol está presente en la leche de rata. Se deben considerar los beneficios para el desarrollo y la salud de la lactancia materna junto con la necesidad clínica de la madre de REXULTI y cualquier posible efecto adverso en el lactante por REXULTI o por la condición materna subyacente.
8.4 Uso pediátrico
Esquizofrenia
Se ha establecido la seguridad y eficacia de REXULTI para el tratamiento de la esquizofrenia en pacientes pediátricos de 13 años de edad y mayores. El uso de REXULTI en esta población está respaldado por evidencia de estudios adecuados y bien controlados en adultos con esquizofrenia, datos farmacocinéticos de adultos y pacientes pediátricos y datos de seguridad en pacientes pediátricos de 13 a 17 años de edad [ver Advertencias y precauciones (5.6), Reacciones adversas (6.1), Farmacología clínica (12.3)].
No se ha establecido la seguridad y eficacia de REXULTI para el tratamiento de la esquizofrenia en pacientes pediátricos menores de 13 años.
Trastorno depresivo mayor
No se ha establecido la seguridad y eficacia de REXULTI para el tratamiento del trastorno depresivo mayor en pacientes pediátricos. Los antidepresivos aumentaron el riesgo de pensamientos y comportamientos suicidas en pacientes pediátricos [consulte Recuadro de advertencia, Advertencias y precauciones (5.2)].
Irritabilidad asociada con el trastorno del espectro autista
No se ha establecido la seguridad y eficacia de REXULTI para el tratamiento de la irritabilidad asociada con el trastorno del espectro autista en pacientes pediátricos. No se demostró la eficacia en un estudio clínico de 8 semanas, doble ciego, controlado con placebo, con dosis flexible, realizado en 119 pacientes pediátricos tratados con REXULTI de 5 a 17 años de edad con irritabilidad asociada con el trastorno del espectro autista diagnosticado por el Manual Diagnóstico y Estadístico de los Trastornos Mentales, 5th Edición [DSM-5]. En este estudio, la somnolencia (incluida la sedación) se produjo a una tasa mayor que la informada en otros estudios de REXULTI que evaluaron a pacientes adultos y ancianos (16 % en pacientes pediátricos tratados con REXULTI frente al 5 % para el placebo). El aumento medio en la puntuación z del peso corporal ajustado por edad y sexo desde el inicio hasta la última visita fue de 0,3 para los pacientes tratados con REXULTI frente a 0,1 para los pacientes tratados con placebo. Los aumentos en la puntuación z del peso corporal ajustado por edad y sexo de al menos 0,5 DE desde el inicio fueron mayores en los pacientes tratados con REXULTI frente al placebo (19 % frente al 5 %).
De los 119 pacientes de este estudio, 95 ingresaron al estudio de tratamiento abierto y recibieron hasta 26 semanas de tratamiento diario con brexpiprazol. Durante el período de tratamiento abierto, el 2 % de los pacientes interrumpieron el tratamiento debido al aumento de peso. En pacientes previamente tratados con REXULTI durante 8 semanas, el aumento medio de peso desde el inicio del estudio abierto hasta la última visita fue de 4,5 kg y el 26 % de los pacientes tuvo un aumento en la puntuación z del peso corporal ajustado por edad y sexo de al menos 0,5 DE desde el inicio.
Estudios en Animales Juveniles
A ratas juveniles se les administraron dosis orales de brexpiprazol de 3, 10 y 20 mg/kg/día una vez al día desde el destete (día 21 posnatal) hasta la edad adulta (día 90 posnatal), seguido de un período de recuperación (sin dosificación) de 4 semanas. Los resultados fueron similares a los observados en estudios previos de toxicidad a dosis repetidas en ratas adolescentes (8 semanas de edad). La mortalidad se produjo con la dosis alta de 20 mg/kg/día, así como un retraso en la maduración sexual en los machos y una disminución de la actividad motora y de crianza. No hubo evidencia de neurotoxicidad o efectos sobre la fertilidad y la función reproductiva. Los cambios histopatológicos en los órganos reproductores y las glándulas mamarias se produjeron en todas las dosis, se relacionaron con la farmacología del brexpiprazol y fueron comparables a los de las ratas adultas. Todos los hallazgos fueron al menos parcialmente reversibles. A perros juveniles se les administraron dosis orales de brexpiprazol de 1, 3 y 30 mg/kg/día una vez al día a partir de las 8 o 9 semanas de edad durante 26 semanas, seguido de un período de recuperación (sin dosificación) de 8 semanas. Se observaron disminuciones en el peso corporal, letargo, cambios en la frecuencia cardíaca y órganos sexuales masculinos inmaduros a 30 mg/kg/día. Estos hallazgos fueron al menos parcialmente reversibles.
8.5 Uso Geriátrico
Los fármacos antipsicóticos aumentan el riesgo de muerte en pacientes ancianos con psicosis relacionada con la demencia. REXULTI no está aprobado para el tratamiento de pacientes con psicosis relacionada con la demencia [ver Recuadro de Advertencia, Advertencias y Precauciones (5.1)].
Tratamiento Adyuvante del Trastorno Depresivo Mayor (TMD) y Esquizofrenia
Del número total de pacientes tratados con REXULTI en los estudios clínicos para la terapia adyuvante a los antidepresivos para el TMD y para la esquizofrenia, 248 (3 %) tenían 65 años o más (que incluían 45 (18 %) pacientes que tenían 75 años o más). Los estudios clínicos de REXULTI en estos pacientes no incluyeron un número suficiente de pacientes de 65 años o más para determinar si responden de manera diferente a los pacientes adultos más jóvenes. En general, la selección de la dosis para el tratamiento del TMD o la esquizofrenia en un paciente geriátrico debe ser cautelosa, comenzando generalmente en el extremo inferior del rango de dosificación, lo que refleja la mayor frecuencia de disminución de la función hepática, renal y cardíaca, enfermedades concomitantes y otras terapias farmacológicas.
Agitación Asociada con Demencia Debido a la Enfermedad de Alzheimer
El número total de pacientes tratados con REXULTI de 65 años o más en los estudios clínicos para la agitación asociada con la demencia debido a la enfermedad de Alzheimer (Estudios 6 y 7) fue de 448 (86 %), incluidos 170 (33 %) pacientes de 65 a 74 años, 228 (44 %) pacientes de 75 a 84 años y 50 (10 %) pacientes de 85 años o más [ver Estudios Clínicos (14.3)].
En los estudios clínicos de REXULTI para el tratamiento de la agitación asociada con la demencia debido a la enfermedad de Alzheimer no se incluyó un número suficiente de pacientes adultos más jóvenes para determinar si los pacientes de 65 años o más responden de manera diferente a los pacientes adultos más jóvenes.
8.6 Metabolizadores Lentos de CYP2D6
Se recomienda el ajuste de la dosis en metabolizadores lentos de CYP2D6 conocidos porque estos pacientes tienen concentraciones de brexpiprazol más altas que los metabolizadores normales de CYP2D6. Aproximadamente el 8 % de los caucásicos y del 3 al 8 % de los negros/afroamericanos no pueden metabolizar los sustratos de CYP2D6 y se clasifican como metabolizadores lentos [ver Dosis y Administración (2.7), Farmacología Clínica (12.3)].
8.7 Insuficiencia Hepática
La dosis máxima recomendada en pacientes con insuficiencia hepática moderada a grave (puntuación Child-Pugh ≥7) es menor que en aquellos con insuficiencia hepática leve y aquellos con función hepática normal [ver Dosis y Administración (2.4)]. Los pacientes con insuficiencia hepática moderada a grave generalmente tuvieron una mayor exposición al brexpiprazol que los pacientes con función hepática normal [ver Farmacología Clínica (12.3)]. Una mayor exposición puede aumentar el riesgo de reacciones adversas asociadas con REXULTI .
8.8 Insuficiencia Renal
La dosis máxima recomendada en pacientes con CrCl<60 mL/minuto es menor que en aquellos con insuficiencia renal leve y en aquellos con función renal normal [ver Dosificación y Administración (2.6)]. Los pacientes con insuficiencia renal tuvieron una mayor exposición a brexpiprazol que los pacientes con función renal normal [ver Farmacología Clínica (12.3)]. Una mayor exposición puede aumentar el riesgo de reacciones adversas asociadas con REXULTI.
8.9 Otras Poblaciones Específicas
La dosis recomendada de REXULTI es la misma en hombres y mujeres, en diferentes grupos raciales y en fumadores y no fumadores [ver Farmacología Clínica (12.3)].
9 ABUSO DE DROGAS Y DEPENDENCIA
9.2 Abuso
Los animales a los que se les dio acceso a REXULTI no se autoadministraron el fármaco, lo que sugiere que REXULTI no tiene propiedades gratificantes.
9.3 Dependencia
Los humanos y los animales que recibieron administración crónica de REXULTI no demostraron ningún signo de abstinencia al suspender el fármaco. Esto sugiere que REXULTI no produce dependencia física.
10 SOBREDOSIS
Existe una experiencia limitada en ensayos clínicos con respecto a la sobredosis humana con REXULTI.
El manejo de una sobredosis de REXULTI debe concentrarse en terapia de apoyo, manteniendo una vía aérea adecuada, oxigenación y ventilación, y manejo de los síntomas. La supervisión y monitorización médica estrecha deben continuar hasta que el paciente se recupere. Considere contactar con la Línea de Ayuda para Envenenamiento (1-800-222-1222) o un toxicólogo médico para recomendaciones adicionales sobre el manejo de la sobredosis.
El carbón activado oral y el sorbitol (50 g/240 mL), administrados una hora después de la ingestión oral de REXULTI, disminuyeron la Cmax y el área bajo la curva (AUC) de brexpiprazole en aproximadamente un 5% a 23% y un 31% a 39% respectivamente; sin embargo, no hay suficiente información disponible sobre el potencial terapéutico del carbón activado en el tratamiento de una sobredosis con REXULTI.
No hay información sobre el efecto de la hemodiálisis en el tratamiento de una sobredosis con REXULTI; es poco probable que la hemodiálisis sea útil porque la brexpiprazole se une en gran medida a las proteínas plasmáticas.
11 DESCRIPCIÓN
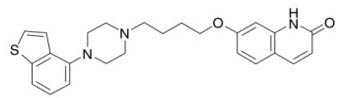
Brexpiprazole, un antipsicótico atípico, está disponible como comprimidos REXULTI® (brexpiprazole). Brexpiprazole es 7-{4-[4-(1-Benzotiofen-4-il)piperazin-1-il]butoxi}quinolin-2(1H)-ona. La fórmula empírica es C25H27N3O2S, y su peso molecular es 433.57. La estructura química es:
 |
Los comprimidos de REXULTI son para administración oral y están disponibles en concentraciones de 0.25 mg, 0.5 mg, 1 mg, 2 mg, 3 mg y 4 mg. Los ingredientes inactivos incluyen monohidrato de lactosa, almidón de maíz, celulosa microcristalina, hidroxipropilcelulosa, hidroxipropilcelulosa de baja sustitución, estearato de magnesio, hipromelosa y talco. Los colorantes incluyen dióxido de titanio, óxido de hierro y óxido ferroso férrico.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Se desconoce el mecanismo de acción de REXULTI en el tratamiento adyuvante del trastorno depresivo mayor, el tratamiento de la agitación asociada a la demencia debida a la enfermedad de Alzheimer o el tratamiento de la esquizofrenia. Sin embargo, la eficacia de REXULTI puede estar mediada por una combinación de actividad agonista parcial en los receptores de serotonina 5-HT1A y dopamina D2, y actividad antagonista en los receptores de serotonina 5-HT2A.
12.2 Farmacodinamia
La brexpiprazole tiene afinidad (expresada como Ki) por múltiples receptores monoaminérgicos, incluyendo serotonina 5-HT1A (0,12 nM), 5-HT2A (0,47 nM), 5-HT2B (1,9 nM), 5-HT7 (3,7 nM), dopamina D2 (0,30 nM), D3 (1,1 nM), y receptores noradrenérgicos α1A (3,8 nM), α1B (0,17 nM), α1D (2,6 nM), y α2C (0,59 nM). La brexpiprazole actúa como agonista parcial en los receptores 5-HT1A, D2, y D3 y como antagonista en los receptores 5-HT2A, 5-HT2B, 5-HT7, α1A, α1B, α1D, y α2C. La brexpiprazole también muestra afinidad por el receptor de histamina H1 (19 nM) y por el receptor muscarínico M1 (67% de inhibición a 10 µM).
Electrofisiología cardíaca
A una dosis 3 veces superior a la dosis máxima recomendada para el tratamiento de la esquizofrenia y 4 veces superior a la dosis máxima recomendada para la terapia adyuvante a los antidepresivos para el tratamiento del TDM o la agitación asociada a la demencia debida a la enfermedad de Alzheimer, REXULTI no prolonga el intervalo QTc en ningún grado clínicamente relevante.
12.3 Farmacocinética
Absorción
Después de la administración de una dosis única de comprimidos de REXULTI, las concentraciones plasmáticas máximas de brexpiprazole se produjeron en las 4 horas posteriores a la administración, y la biodisponibilidad oral absoluta fue del 95%. Las concentraciones en estado estacionario de brexpiprazole se alcanzaron entre los 10 y los 12 días de dosificación.
REXULTI puede administrarse con o sin alimentos. La administración de un comprimido de REXULTI de 4 mg con una comida estándar rica en grasas no afectó significativamente la Cmax o el AUC de brexpiprazole. Después de la administración de dosis únicas y múltiples una vez al día, la exposición a brexpiprazole (Cmax y AUC) aumentó proporcionalmente a la dosis administrada. Los estudios in vitro de brexpiprazole no indicaron que brexpiprazole sea un sustrato de transportadores de eflujo como MDRI (P-gp) y BCRP.
Distribución
El volumen de distribución de brexpiprazole después de la administración intravenosa es alto (1,56 ± 0,42 L/kg), lo que indica una distribución extravascular. La brexpiprazole se une en gran medida a las proteínas plasmáticas (más del 99%) a la albúmina sérica y a la glucoproteína ácida α1, y su unión a proteínas no se ve afectada por la insuficiencia renal o hepática. Según los resultados de los estudios in vitro, la unión a proteínas de brexpiprazole no se ve afectada por la warfarina, el diazepam o la digitoxina.
Eliminación
Metabolismo
Según los estudios de metabolismo in vitro de brexpiprazole utilizando citocromo P450 humano recombinante (CYP1A1, 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 y 3A4), se demostró que el metabolismo de brexpiprazole está mediado principalmente por CYP3A4 y CYP2D6.
In vivo, la brexpiprazole se metaboliza principalmente mediante las enzimas CYP3A4 y CYP2D6. Después de las administraciones de dosis únicas y múltiples, la brexpiprazole y su principal metabolito, DM-3411, fueron las fracciones farmacológicas predominantes en la circulación sistémica. En estado estacionario, DM-3411 representó del 23% al 48% de la exposición a brexpiprazole (AUC) en plasma. Se considera que DM-3411 no contribuye a los efectos terapéuticos de brexpiprazole.
Según los datos in vitro, brexpiprazole mostró poca o ninguna inhibición de las isoenzimas CYP450.
Excreción
Después de una dosis oral única de brexpiprazole marcada con [14C], aproximadamente el 25% y el 46% de la radiactividad administrada se recuperó en la orina y las heces, respectivamente. Menos del 1% de brexpiprazole sin cambios se excretó en la orina, y aproximadamente el 14% de la dosis oral se recuperó sin cambios en las heces. El aclaramiento oral aparente de un comprimido oral de brexpiprazole después de la administración una vez al día es de 19,8 (±11,4) mL/h/kg. Después de múltiples administraciones una vez al día de REXULTI, las semividas de eliminación terminal de brexpiprazole y su principal metabolito, DM-3411, fueron de 91 horas y 86 horas, respectivamente.
Estudios en poblaciones específicas
La exposición a brexpiprazole en poblaciones específicas se resume en la Figura 1. El análisis farmacocinético (PK) de la población indicó que la exposición a brexpiprazole en pacientes con insuficiencia renal moderada fue mayor en comparación con los pacientes con función renal normal.
Figura 1 Efecto de los factores intrínsecos en la farmacocinética de brexpiprazole
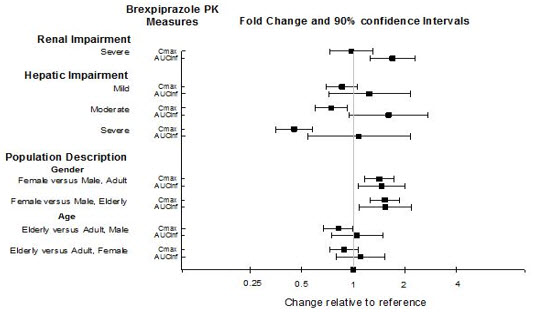
Pacientes pediátricos
Se ha realizado un estudio de PK de dosis múltiples (0,5, 1, 2, 3 o 4 mg/día) en 43 pacientes pediátricos de 13 a 17 años de edad. El análisis de PK poblacional indicó que la exposición sistémica (Cmax y AUC) de brexpiprazol en pacientes pediátricos (de 13 a 17 años de edad) fue comparable a la de los pacientes adultos en el rango de dosis de 0,5 a 4 mg.
Estudios de interacción medicamentosa
El efecto de otros medicamentos en la exposición a brexpiprazol se resume en la Figura 2. Según la simulación, se espera un aumento de 5,1 veces en los valores de AUC en estado estacionario cuando los metabolizadores extensos de CYP2D6 reciben inhibidores potentes de CYP2D6 y CYP3A4. Se espera un aumento de 4,8 veces en los valores medios de AUC en estado estacionario en metabolizadores lentos de CYP2D6 que reciben inhibidores potentes de CYP3A4 [ver Interacciones medicamentosas (7.1)].
Figura 2 El efecto de otros medicamentos en la farmacocinética de brexpiprazol
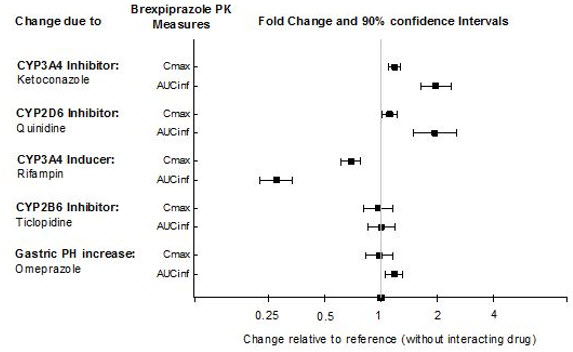
El efecto de REXULTI en la exposición a otros medicamentos se resume en la Figura 3.
Figura 3 El efecto de REXULTI en la farmacocinética de otros medicamentos
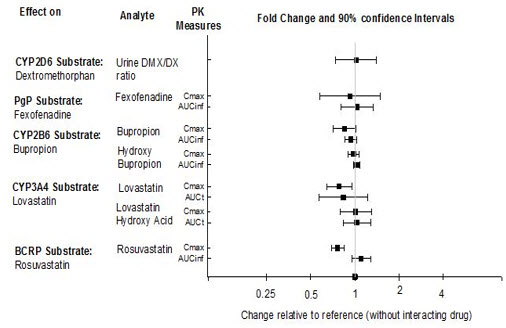
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Carcinogénesis
Se realizaron estudios de carcinogenicidad de por vida en ratones ICR y ratas Sprague Dawley. Se administró brexpiprazol por vía oral durante dos años a ratones machos y hembras a dosis de 0,75, 2 y 5 mg/kg/día (0,9 a 6,1 veces la dosis máxima recomendada para humanos (MRHD) oral de 4 mg/día basada en mg/m2 de superficie corporal) y a ratas machos y hembras a dosis de 1, 3 y 10 mg/kg y 3, 10 y 30 mg/kg/día, respectivamente (2,4 a 24 y 7,3 a 73 veces la MRHD oral, machos y hembras). En las ratonas hembra, la incidencia de adenocarcinoma de glándula mamaria aumentó en todas las dosis, y la incidencia de carcinoma adenoescamoso aumentó en 2,4 y 6,1 veces la MRHD. No se observó un aumento en la incidencia de tumores en los ratones machos. En el estudio en ratas, el brexpiprazol no fue carcinogénico en ninguno de los sexos a dosis de hasta 73 veces la MRHD.
Se han observado cambios proliferativos y/o neoplásicos en las glándulas mamarias y pituitarias de roedores después de la administración crónica de fármacos antipsicóticos y se consideran mediados por la prolactina. Se demostró el potencial de aumento del nivel de prolactina sérica del brexpiprazol tanto en ratones como en ratas. Se desconoce la relevancia para el riesgo humano de los hallazgos de tumores endocrinos mediados por prolactina en roedores.
Mutagénesis
El brexpiprazol no fue mutagénico cuando se probó en el ensayo de mutación inversa bacteriana in vitro (prueba de Ames). El brexpiprazol fue negativo para la actividad clastogénica en el ensayo de micronúcleos in vivo en ratas y no fue genotóxico en el ensayo de síntesis de ADN no programada in vivo/in vitro en ratas. In vitro con células de mamíferos, el brexpiprazol fue clastogénico, pero solo a dosis que indujeron citotoxicidad. Con base en un peso de la evidencia, no se considera que el brexpiprazol presente un riesgo genotóxico para los humanos.
Deterioro de la Fertilidad
Las ratas hembra fueron tratadas con dosis orales de 0,3, 3 o 30 mg/kg/día (0,7, 7,3 y 73 veces la MRHD oral en base a mg/m2) antes del apareamiento con machos no tratados y continuando hasta la concepción e implantación. Se observaron irregularidades en el ciclo estral y disminución de la fertilidad a 3 y 30 mg/kg/día. Se observó una duración prolongada del apareamiento y un aumento de las pérdidas preimplantacionales a 30 mg/kg/día.
Las ratas macho fueron tratadas con dosis orales de 3, 10 o 100 mg/kg/día (7,3, 24 y 240 veces la MRHD oral en base a mg/m2) durante 63 días antes del apareamiento con hembras no tratadas y durante los 14 días de apareamiento. No se observaron diferencias en la duración del apareamiento o los índices de fertilidad en los machos a ninguna dosis de brexpiprazol.
14 ESTUDIOS CLÍNICOS
14.1 Tratamiento Adyuvante del Trastorno Depresivo Mayor
La eficacia de REXULTI en el tratamiento adyuvante del trastorno depresivo mayor (TDM) se evaluó en dos estudios de 6 semanas, doble ciego, controlados con placebo, de dosis fija, en pacientes adultos que cumplían los criterios del DSM-IV-TR para el TDM, con o sin síntomas de ansiedad, que habían tenido una respuesta inadecuada a la terapia antidepresiva previa (de 1 a 3 tratamientos) en el episodio actual y que también habían demostrado una respuesta inadecuada durante las 8 semanas de tratamiento antidepresivo prospectivo (con escitalopram, fluoxetina, paroxetina de liberación controlada, sertralina, duloxetina de liberación retardada o venlafaxina de liberación prolongada). La respuesta inadecuada durante la fase de tratamiento antidepresivo prospectivo se definió como la persistencia de síntomas sin una mejora sustancial durante el curso del tratamiento.
Los pacientes del Estudio 1 (NCT01360645) se asignaron aleatoriamente a REXULTI 2 mg una vez al día o placebo. Los pacientes del Estudio 2 (NCT01360632) se asignaron aleatoriamente a REXULTI 1 o 3 mg una vez al día o placebo. Para los pacientes asignados aleatoriamente a REXULTI, todos los pacientes iniciaron el tratamiento con 0,5 mg una vez al día durante la Semana 1. En la Semana 2, la dosis de REXULTI se aumentó a 1 mg en todos los grupos de tratamiento, y se mantuvo a 1 mg o se aumentó a 2 mg o 3 mg una vez al día, según la asignación del tratamiento, a partir de la Semana 3 en adelante. Las dosis se mantuvieron durante las 4 semanas restantes.
El criterio principal de valoración fue el cambio desde el inicio hasta la semana 6 en la Escala de Calificación de Depresión de Montgomery-Asberg (MADRS), una escala de 10 ítems relacionada con el clínico que se utiliza para evaluar el grado de sintomatología depresiva, donde 0 representa la ausencia de síntomas y 60 representa los peores síntomas.
En la aleatorización, la puntuación total media de la MADRS fue de 27. En los Estudios 1 y 2, REXULTI (más ADT) 2 mg una vez al día y 3 mg una vez al día fueron superiores al placebo más ADT en la reducción de las puntuaciones totales medias de la MADRS. Los resultados de los parámetros de eficacia principales de ambos estudios de dosis fija se muestran a continuación en la Tabla 12. La Figura 4 que se muestra a continuación muestra el curso temporal de la respuesta en función de la medida de eficacia principal (MADRS) en el Estudio 1.
| Estudio | Grupo de tratamiento | N | Puntuación basal media (DE) | Cambio medio de mínimos cuadrados desde el inicio (EE) | Diferencia sustraída del placebo* (IC del 95%) |
|
|---|---|---|---|---|---|---|
| DE: desviación estándar; EE: error estándar; Media de MC: media de mínimos cuadrados; IC: intervalo de confianza no ajustado | ||||||
| 1 | REXULTI (2 mg/día) + ADT† | 175 | 26.9 (5.7) | -8.4 (0.6) | -3.2 (-4.9, -1.5) | |
| Placebo + ADT | 178 | 27.3 (5.6) | -5.2 (0.6) | — | ||
| 2 | REXULTI (1 mg/día) + ADT | 211 | 26.5 (5.6) | -7.6 (0.5) | -1.3 (-2.7, 0.1) | |
| REXULTI (3 mg/día) + ADT | 213 | 26.5 (5.3) | -8.3 (0.5) | -2.0 (-3.4, -0.5) | ||
| Placebo + ADT | 203 | 26.5 (5.2) | -6.3 (0.5) | — | ||
Un examen de los subgrupos de población no sugirió una respuesta diferencial basada en la edad, el sexo, la raza o la elección del antidepresivo prospectivo.
Figura 4 Cambio desde la línea de base en la puntuación total de MADRS por visita de estudio (semana) en pacientes con TDM en adultos (Estudio 1)
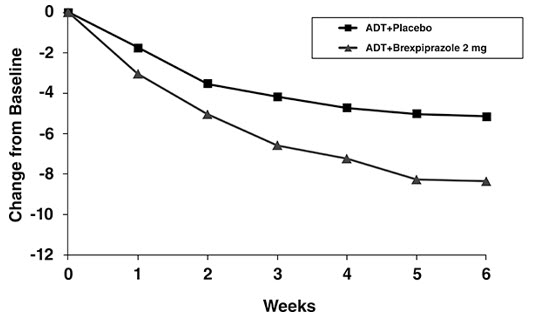
14.2 Esquizofrenia
La eficacia de REXULTI en el tratamiento de adultos con esquizofrenia se demostró en dos estudios clínicos aleatorizados, doble ciego, controlados con placebo y de dosis fija de 6 semanas en pacientes que cumplían los criterios del DSM-IV-TR para la esquizofrenia.
En ambos estudios, Estudio 3 (NCT01396421) y Estudio 4 (NCT01393613), los pacientes fueron aleatorizados a REXULTI 2 o 4 mg una vez al día o placebo. Los pacientes de los grupos de REXULTI iniciaron el tratamiento con 1 mg una vez al día los días 1 a 4. La dosis de REXULTI se aumentó a 2 mg los días 5 a 7. La dosis se mantuvo luego en 2 mg una vez al día o se aumentó a 4 mg una vez al día, según la asignación del tratamiento, durante las 5 semanas restantes.
El criterio principal de valoración de la eficacia de ambos estudios fue el cambio desde la línea de base hasta la semana 6 en la puntuación total de la Escala de Síndromes Positivos y Negativos (PANSS). La PANSS es una escala de 30 ítems que mide los síntomas positivos de la esquizofrenia (7 ítems), los síntomas negativos de la esquizofrenia (7 ítems) y la psicopatología general (16 ítems), cada uno calificado en una escala de 1 (ausente) a 7 (extremo); las puntuaciones totales de PANSS oscilan entre 30 (mejor) y 210 (peor).
En el Estudio 3, REXULTI a 2 mg una vez al día y a 4 mg una vez al día fue superior al placebo en la puntuación total de PANSS. En el Estudio 4, REXULTI 4 mg una vez al día fue superior al placebo en la puntuación total de PANSS (Tabla 13). La Figura 5 muestra el curso temporal de la respuesta según la medida principal de eficacia (cambio desde la línea de base en la puntuación total de PANSS) en el Estudio 3.
El examen de los subgrupos de población según la edad, el sexo y la raza no sugirió una respuesta diferencial.
| Estudio | Grupo de tratamiento | N | Puntuación basal media (DE) |
Cambio medio LS desde la línea de base (EE) | Diferencia sustraída del placebo* (IC del 95%) |
|---|---|---|---|---|---|
| DE: desviación estándar; EE: error estándar; Media LS: media de mínimos cuadrados; IC: intervalo de confianza no ajustado | |||||
| 3 | REXULTI (2 mg/día)† | 180 | 95.9 (13.8) | -20.7 (1.5) | -8.7 (-13.1, -4.4) |
| REXULTI (4 mg/día) † | 178 | 94.7 (12.1) | -19.7 (1.5) | -7.6 (-12.0, -3.1) | |
| Placebo | 178 | 95.7 (11.5) | -12.0 (1.6) | — | |
| 4 | REXULTI (2 mg/día) | 179 | 96.3 (12.9) | -16.6 (1.5) | -3.1 (-7.2, 1.1) |
| REXULTI (4 mg/día) † | 181 | 95.0 (12.4) | -20.0 (1.5) | -6.5 (-10.6, -2.4) | |
| Placebo | 180 | 94.6 (12.8) | -13.5 (1.5) | — | |
Figura 5 Cambio desde la línea base en la puntuación total de PANSS por visita de estudio (semana) en pacientes adultos con esquizofrenia (Estudio 3)
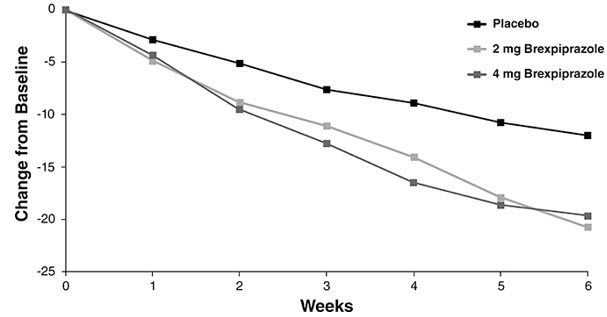
La seguridad y eficacia de REXULTI como tratamiento de mantenimiento en adultos con esquizofrenia de 18 a 65 años se demostraron en la fase de mantenimiento de un estudio de retirada aleatorizado (Estudio 5, NCT01668797). Los pacientes se estabilizaron durante al menos 12 semanas con 1 a 4 mg/día de REXULTI (N=202). Luego se asignaron al azar en la fase de tratamiento doble ciego para continuar con REXULTI a su dosis establecida (N=97) o para cambiar a placebo (N=105).
El criterio de valoración principal en el Estudio 5 fue el tiempo desde la aleatorización hasta la recaída inminente durante la fase doble ciego, definida como: 1) Puntuación de Mejora Clínica Global de ≥5 (mínimo peor) y un aumento a una puntuación >4 en los ítems de desorganización conceptual, comportamiento alucinatorio, desconfianza o contenido de pensamiento inusual de PANSS, con un aumento ≥2 en un ítem específico o un aumento de ≥4 puntos en los cuatro ítems combinados de PANSS, 2) hospitalización debido al empeoramiento de los síntomas psicóticos, 3) comportamiento suicida actual o 4) comportamiento violento/agresivo.
Un análisis intermedio preespecificado demostró un tiempo significativamente más largo hasta la recaída en los pacientes asignados al azar al grupo REXULTI en comparación con los pacientes tratados con placebo. El estudio se terminó posteriormente antes de tiempo porque se había demostrado el mantenimiento de la eficacia. Las curvas de Kaplan-Meier de la proporción acumulada de pacientes con recaída durante la fase de tratamiento doble ciego para los grupos REXULTI y placebo se muestran en la Figura 6. El criterio de valoración secundario clave, la proporción de pacientes que cumplieron con los criterios de recaída inminente, fue estadísticamente significativamente menor en los pacientes tratados con REXULTI en comparación con el grupo placebo.
Figura 6 Estimación de Kaplan-Meier del porcentaje de recaída inminente en el Estudio 5
| Nota: Se asignaron al azar un total de 202 pacientes. Entre ellos, un paciente del grupo placebo no tomó el medicamento en investigación y un paciente del grupo REXULTI no tuvo evaluaciones de eficacia posteriores a la aleatorización. Estos dos pacientes fueron excluidos del análisis de eficacia. |
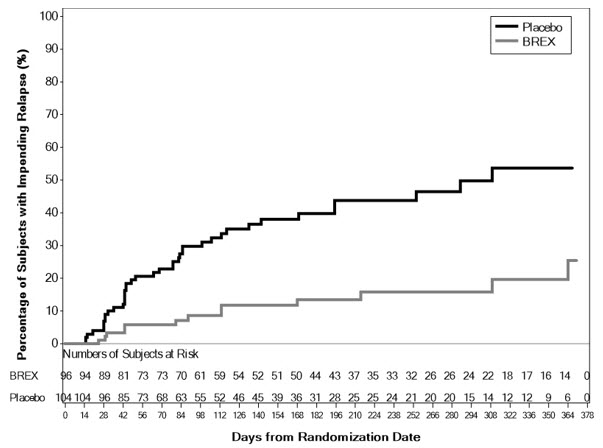 |
14.3 Agitación asociada a la demencia debida a la enfermedad de Alzheimer
La eficacia de REXULTI en el tratamiento de la agitación asociada a la demencia debida a la enfermedad de Alzheimer se demostró en dos estudios de 12 semanas, aleatorizados, doble ciego, controlados con placebo y de dosis fija (Estudio 6, NCT01862640 y Estudio 7, NCT03548584). En estos estudios, se requirió que los pacientes:
- Tuvieran un diagnóstico de enfermedad de Alzheimer probable según los criterios NINCDS-ADRDA,
- Tuvieran una puntuación en la Mini-Mental State Examination (MMSE) de ≥5 y ≤22 y una puntuación total de ≥4 en el ítem de agitación/agresión de la NPI/NPI-NH, y
- Mostraran comportamientos de agitación suficientes en el momento de la inclusión para justificar el uso de farmacoterapia, después de excluir otros factores.
Pacientes en:
- El Estudio 6 se asignaron aleatoriamente a una dosis oral de REXULTI 1 mg una vez al día, REXULTI 2 mg una vez al día o placebo. Los pacientes de ambos grupos de REXULTI comenzaron con 0,25 mg una vez al día durante aproximadamente tres días, luego recibieron 0,5 mg una vez al día durante aproximadamente 12 días. Posteriormente, los pacientes del grupo de 1 mg recibieron 1 mg una vez al día durante el resto del estudio de 12 semanas, y los pacientes del grupo de 2 mg recibieron 1 mg una vez al día durante aproximadamente dos semanas y luego recibieron 2 mg durante el resto del estudio.
- El Estudio 7 se asignaron aleatoriamente a una dosis oral de REXULTI 2 mg o 3 mg una vez al día (brazo de tratamiento combinado) o placebo. Los pacientes de ambos grupos de REXULTI comenzaron con 0,5 mg una vez al día durante 7 días, luego recibieron 1 mg una vez al día durante 7 días y luego 2 mg una vez al día durante 14 días. Posteriormente, los pacientes del grupo de 2 mg recibieron 2 mg una vez al día durante el resto del estudio de 12 semanas, y los pacientes del grupo de 3 mg recibieron 3 mg una vez al día durante el resto del estudio.
El Estudio 6 incluyó 433 pacientes con una edad media de 74 años, y un rango de 51 y 90 años; el 45% eran hombres; el 96%, el 3% y el 1% eran blancos, negros o afroamericanos y asiáticos, respectivamente; y el 16% y el 83% eran latinos/hispanos y no latinos/hispanos, respectivamente. El Estudio 7 incluyó 345 pacientes con una edad media de 74 años, y un rango de 56 y 90 años; el 44% eran hombres; el 95%, el 4% y el 1% eran blancos, negros o afroamericanos y asiáticos, respectivamente; y el 31% y el 69% eran latinos/hispanos y no latinos/hispanos, respectivamente.
El criterio principal de valoración de la eficacia en estos dos estudios fue el cambio desde el inicio en la puntuación total del Inventario de Agitación de Cohen-Mansfield (CMAI) en la semana 12. El CMAI es un cuestionario evaluado por un clínico que consta de 29 ítems, que evalúan la frecuencia de las manifestaciones de comportamientos agitados en pacientes ancianos, basándose en la información del cuidador. Se pueden derivar tres factores específicos de la escala CMAI: 1) Comportamiento agresivo (p. ej., gritar, tirar cosas, maldecir/agresión verbal, patear, empujar, arañar, hacerse daño a sí mismo o a otros); 2) Comportamiento físicamente no agresivo (p. ej., manierismos repetitivos, inquietud general, deambular); y 3) Comportamiento verbalmente agitado (p. ej., quejarse, preguntas repetitivas, solicitudes constantes de atención). Cada comportamiento del CMAI se calificó en una escala de 1 (nunca) a 7 (comportamientos agitados muy frecuentes); las puntuaciones totales del CMAI oscilan entre 29 (mejor) y 203 (peor). Un cambio negativo indica una mejora.
En el Estudio 6, los pacientes del grupo de REXULTI 2 mg mostraron una mejora en las puntuaciones totales del CMAI en comparación con los pacientes del grupo placebo en la semana 12. En el Estudio 7, los pacientes del grupo de REXULTI 2 mg/3 mg mostraron una mejora en las puntuaciones totales del CMAI en comparación con los pacientes del grupo placebo en la semana 12.
Como se muestra en la Tabla 14 y la Figura 7, el cambio medio desde el inicio en la puntuación total del CMAI después de 12 semanas en el grupo de REXULTI 2 mg/o 3 mg fue estadísticamente significativamente superior al del grupo placebo. El grupo de REXULTI 1 mg no demostró cambios medios significativamente mayores en el inicio con respecto al grupo placebo en la puntuación total del CMAI en esta población de pacientes. La dosis de REXULTI de 1 mg una vez al día no está aprobada y no se recomienda para el tratamiento de la agitación asociada a la demencia debida a la enfermedad de Alzheimer [véase Posología y administración (2.4)].
| Estudio | Grupo de tratamiento | N | Puntuación basal media (DE) |
Cambio medio de mínimos cuadrados desde el inicio (EE) |
Diferencia sustraída del placebo† (IC del 95%) |
|---|---|---|---|---|---|
| DE: desviación estándar; EE: error estándar; Media de mínimos cuadrados: media de mínimos cuadrados; IC: intervalo de confianza no ajustado | |||||
|
|||||
| 6 | REXULTI 1 mg/día | 134 | 70.5 (16.0) | -17.6 (1.3) | 0.2 (-3.4, 3.9) |
| REXULTI 2 mg/día‡ | 138 | 71.0 (16.6) | -21.6 (1.3) | -3.8 (-7.4, -0.2) | |
| Placebo | 131 | 72.2 (17.9) | -17.8 (1.3) | — | |
| 7 | REXULTI 2 mg/día o 3 mg/día‡ | 225 | 80.6 (16.6) | -22.6 (1.1) | -5.3 (-8.8, -1.9) |
| Placebo | 116 | 79.2 (17.5) | -17.3 (1.4) | — |
Figura 7: Cambio desde la línea base en la puntuación total de CMAI por semana de estudio en pacientes con agitación asociada a demencia debida a la enfermedad de Alzheimer (Estudio 7)
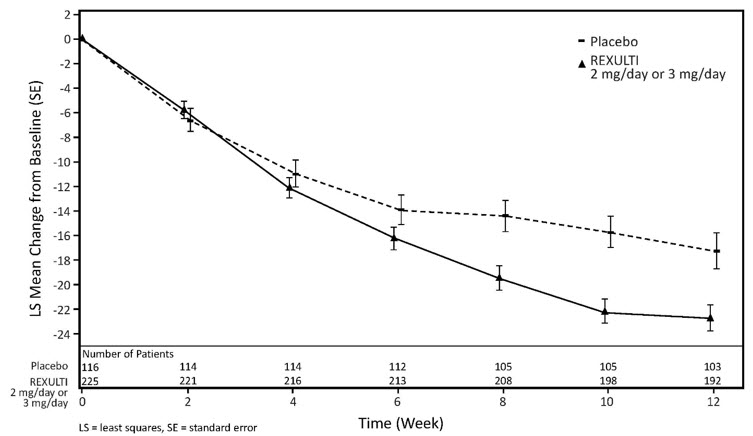
16 SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Cómo se suministra
Los comprimidos de REXULTI (brexpiprazole) tienen marcas en un lado y están disponibles en las siguientes concentraciones y configuraciones de envases (véase a continuación):
- Los comprimidos de 0,25 mg son de color marrón claro, redondos, ligeramente convexos, con borde biselado y con “BRX” y “0,25” impresos en un lado
NDC 59148-035-13 Frascos de 30
- Comprimidos de 0,5 mg: son de color naranja claro, redondos, ligeramente convexos, con borde biselado y con “BRX” y “0,5” impresos en un lado
NDC 59148-036-13 Frascos de 30
- Los comprimidos de 1 mg son de color amarillo claro, redondos, ligeramente convexos, con borde biselado y con “BRX” y “1” impresos en un lado
NDC 59148-037-13 Frascos de 30
- Los comprimidos de 2 mg son de color verde claro, redondos, ligeramente convexos, con borde biselado y con “BRX” y “2” impresos en un lado
NDC 59148-038-13 Frascos de 30
- Los comprimidos de 3 mg son de color morado claro, redondos, ligeramente convexos, con borde biselado y con “BRX” y “3” impresos en un lado
NDC 59148-039-13 Frascos de 30
- Los comprimidos de 4 mg son blancos, redondos, ligeramente convexos, con borde biselado y con “BRX” y “4” impresos en un lado
NDC 59148-040-13 Frascos de 30
Almacenamiento
Conserve los comprimidos de REXULTI a 20°C a 25°C (68°F a 77°F); se permiten excursiones a 15°C a 30°C (59°F a 86°F) [véase Temperatura ambiente controlada USP].
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
Aconseje al paciente o cuidador que lea el etiquetado del paciente aprobado por la FDA (Guía de medicamentos).
Pensamientos y comportamientos suicidas
Avise a los pacientes y cuidadores que estén atentos a la aparición de suicidios, especialmente al principio del tratamiento y cuando se ajuste la dosis hacia arriba o hacia abajo, y dígales que informen de dichos síntomas al proveedor de atención médica [ver Advertencia en recuadro, Advertencias y precauciones (5.2)].
Dosis y administración
Avise a los pacientes que REXULTI se puede tomar con o sin alimentos. Avise a los pacientes sobre la importancia de seguir las instrucciones de aumento de la dosis [ver Dosis y administración (2)].
Síndrome neuroléptico maligno (SNM)
Informe a los pacientes sobre una reacción adversa potencialmente mortal, el síndrome neuroléptico maligno (SNM), que se ha notificado en asociación con la administración de fármacos antipsicóticos. Avise a los pacientes que contacten con un proveedor de atención médica o que se dirijan a la sala de urgencias si experimentan signos o síntomas de SNM [ver Advertencias y precauciones (5.4)].
Discinesia tardía
Informe a los pacientes sobre los signos y síntomas de la discinesia tardía y que contacten con su proveedor de atención médica si se producen estos movimientos anormales [ver Advertencias y precauciones (5.5)].
Cambios metabólicos
Eduque a los pacientes sobre el riesgo de cambios metabólicos, cómo reconocer los síntomas de hiperglucemia y diabetes mellitus, y la necesidad de una monitorización específica, incluyendo glucosa en sangre, lípidos y peso [ver Advertencias y precauciones (5.6)].
Juego patológico y otras conductas compulsivas
Avise a los pacientes y a sus cuidadores de la posibilidad de que experimenten impulsos compulsivos de comprar, impulsos intensos de apostar, impulsos sexuales compulsivos, atracones y/u otros impulsos compulsivos y la incapacidad de controlar estos impulsos mientras toman REXULTI. En algunos casos, pero no en todos, se informó que los impulsos habían cesado cuando se redujo o se interrumpió la dosis [ver Advertencias y precauciones (5.7)].
Leucopenia, neutropenia y agranulocitosis
Avise a los pacientes con un recuento bajo de leucocitos preexistente o con antecedentes de leucopenia/neutropenia inducida por fármacos que deben controlar su hemograma completo mientras toman REXULTI [ver Advertencias y precauciones (5.8)].
Hipotensión ortostática y síncope
Eduque a los pacientes sobre el riesgo de hipotensión ortostática y síncope, especialmente al principio del tratamiento, y también en los momentos de reiniciar el tratamiento o aumentar la dosis [ver Advertencias y precauciones (5.9)].
Exposición al calor y deshidratación
Aconseje a los pacientes sobre los cuidados adecuados para evitar el sobrecalentamiento y la deshidratación [ver Advertencias y precauciones (5.12)].
Potencial de deterioro cognitivo y motor
Advierta a los pacientes sobre la realización de actividades que requieren agudeza mental, como el manejo de maquinaria peligrosa o la conducción de un vehículo de motor, hasta que estén razonablemente seguros de que la terapia con REXULTI no afecta negativamente su capacidad para participar en dichas actividades [ver Advertencias y precauciones (5.14)].
Medicamentos concomitantes
Avise a los pacientes que informen a sus proveedores de atención médica de cualquier cambio en sus medicamentos recetados o de venta libre actuales, ya que existe un potencial de interacciones clínicamente significativas [ver Interacciones medicamentosas (7.1)].
Embarazo
Avise a las pacientes que el uso de REXULTI en el tercer trimestre puede causar síntomas extrapiramidales y/o de abstinencia en un recién nacido y que notifiquen a su proveedor de atención médica si tienen un embarazo conocido o sospechoso. Avise a las pacientes de que existe un registro de exposición al embarazo que monitoriza los resultados del embarazo en mujeres expuestas a REXULTI durante el embarazo [ver Uso en poblaciones específicas (8.1)].
SECCIÓN NO CLASIFICADA DE SPL
Fabricado por Otsuka Pharmaceutical Co., Ltd., Tokio 101-8535, Japón
Distribuido y comercializado por Otsuka America Pharmaceutical, Inc., Rockville, MD 20850 EE. UU.
Comercializado por Lundbeck, Deerfield, IL 60015 EE. UU.
©2024, Otsuka Pharmaceutical Co., Ltd., Tokio 101-8535, Japón
GUÍA DEL MEDICAMENTO
| GUÍA DEL MEDICAMENTO REXULTI ® (REX-ul-TE) (brexpiprazole) tabletas, para uso oral |
|||
|---|---|---|---|
| Esta Guía del Medicamento ha sido aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos. | Revisado: 5/2024 | ||
| ¿Cuál es la información más importante que debo saber sobre REXULTI? REXULTI puede causar efectos secundarios graves, que incluyen:
|
|||
|
|
||
| Consulte “¿Cuáles son los posibles efectos secundarios de REXULTI?” para obtener más información sobre los efectos secundarios. | |||
| ¿Qué es REXULTI? REXULTI es un medicamento recetado que se usa:
REXULTI no debe usarse como un tratamiento “según sea necesario” para la agitación que puede ocurrir con la demencia debido a la enfermedad de Alzheimer. |
|||
| ¿Quién no debe tomar REXULTI? No tome REXULTI si es alérgico al brexpiprazol o a alguno de los ingredientes de REXULTI. Consulte la lista completa de ingredientes de REXULTI al final de esta Guía del Medicamento. |
|||
Antes de tomar REXULTI, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si:
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluyendo medicamentos recetados y de venta libre, vitaminas y suplementos herbales. |
|||
¿Cómo debo tomar REXULTI?
|
|||
¿Qué debo evitar mientras tomo REXULTI?
|
|||
| ¿Cuáles son los posibles efectos secundarios de REXULTI? REXULTI puede causar efectos secundarios graves, que incluyen:
|
|||
|
|
||
|
|||
|
|
||
|
|||
Los efectos secundarios más comunes de REXULTI incluyen aumento de peso, somnolencia, mareos, síntomas de resfriado común e inquietud o sensación de necesidad de moverse (acatisia). |
|||
¿Cómo debo almacenar REXULTI?
Mantenga REXULTI y todos los medicamentos fuera del alcance de los niños. |
|||
| Información general sobre el uso seguro y eficaz de REXULTI. A veces se recetan medicamentos para fines distintos a los enumerados en una Guía del Medicamento. No use REXULTI para una afección para la que no fue recetado. No le dé REXULTI a otras personas, incluso si tienen los mismos síntomas que usted. Podría perjudicarles. Puede pedirle a su farmacéutico o proveedor de atención médica información sobre REXULTI que esté escrita para profesionales de la salud. |
|||
| ¿Cuáles son los ingredientes de REXULTI? Ingrediente activo: brexpiprazole Ingredientes inactivos: lactosa monohidrato, almidón de maíz, celulosa microcristalina, hidroxipropilcelulosa, hidroxipropilcelulosa de baja sustitución, estearato de magnesio, hipromelosa y talco Para el color: dióxido de titanio, óxido de hierro y óxido ferrosoférrico Fabricado por Otsuka Pharmaceutical Co., Ltd., Tokio 101-8535, Japón Distribuido y comercializado por Otsuka America Pharmaceutical, Inc., Rockville, MD 20850 EE. UU. Comercializado por Lundbeck, Deerfield, IL 60015 EE. UU. ©2024 Para obtener más información sobre REXULTI, visite www.REXULTI.com o llame al 1-800-441-6763. |
|||
PRINCIPAL PANEL DE PRESENTACIÓN – Botella de comprimidos de 0,25 mg
0.25 mg
30 Tabletas
NDC 59148-035-13
REXULTI®
brexpiprazole
tabletas
Rx solamente
Mantener fuera del alcance de los niños
ENTREGUE LA
GUÍA DEL MEDICAMENTO
A CADA PACIENTE
Otsuka
Lundbeck
PANEL PRINCIPAL DE VISUALIZACIÓN – Caja de frasco de tabletas de 0.25 mg
0.25 mg
30 Tabletas
NDC 59148-035-13
REXULTI®
brexpiprazole
tabletas
Rx solamente
Manténgase fuera del
alcance de los niños
ENTREGUE LA
GUÍA DE MEDICAMENTOS
A CADA PACIENTE

PANEL DE VISUALIZACIÓN PRINCIPAL – Etiqueta de la botella del comprimido de 0,5 mg
0.5 mg
30 Tabletas
NDC 59148-036-13
REXULTI®
brexpiprazole
tabletas
Rx solamente
Manténgase fuera del alcance de los niños
ENTREGUE LA
GUÍA DE MEDICAMENTOS
A CADA PACIENTE
Otsuka
Lundbeck
PRINCIPAL PANEL DE PRESENTACIÓN – Frasco con 0,5 mg de comprimidos
0.5 mg
30 Tabletas
NDC 59148-036-13
REXULTI®
brexpiprazole
tabletas
Rx solamente
Manténgase fuera del
alcance de los niños
ENTREGUE LA
GUÍA DE MEDICAMENTOS
A CADA PACIENTE

PANEL DE VISUALIZACIÓN PRINCIPAL – Etiqueta de la botella de tabletas de 1 mg
1 mg
30 Comprimidos
NDC 59148-037-13
REXULTI®
brexpiprazole
tablets
Rx solamente
Manténgase fuera del alcance de los niños
ENTREGUE LA
GUÍA DE MEDICAMENTOS
A CADA PACIENTE
Otsuka
Lundbeck
PRINCIPAL PANEL DE PRESENTACIÓN – Frasco con 1 mg de comprimidos
1 mg
30 Tabletas
NDC 59148-037-13
REXULTI®
brexpiprazole
tabletas
Rx only
Mantener fuera del
alcance de los niños
ENTREGUE LA
GUÍA DEL MEDICAMENTO
ADJUNTA A CADA
PACIENTE
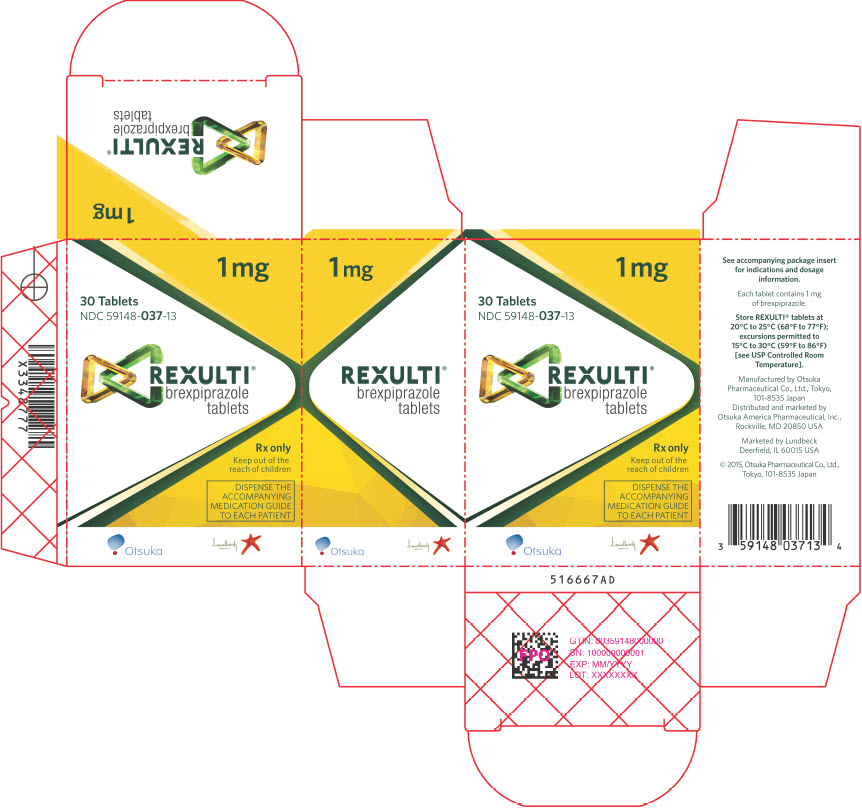
PRINCIPAL PANEL DE PRESENTACIÓN – Botella de comprimidos de 2 mg
2 mg
30 Comprimidos
NDC 59148-038-13
REXULTI®
brexpiprazole
tablets
Rx solamente
Manténgase fuera del alcance de los niños
DISPENSE LA
GUÍA DE MEDICAMENTOS
A CADA PACIENTE
Otsuka
Lundbeck
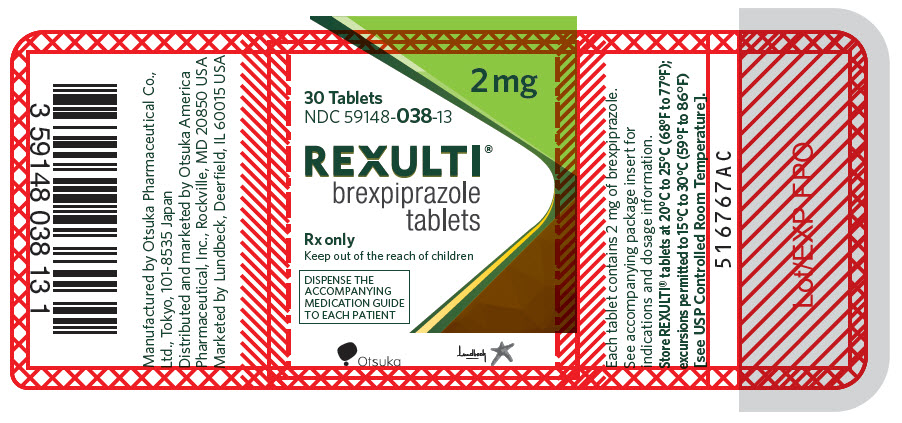
PRINCIPAL PANEL DE PRESENTACIÓN – Frasco con 2 mg de comprimidos
2 mg
30 Tabletas
NDC 59148-038-13
REXULTI®
brexpiprazole
tabletas
Rx solamente
Manténgase fuera del
alcance de los niños
ENTREGUE LA
GUÍA DE MEDICAMENTOS
A CADA PACIENTE

PRINCIPAL PANEL DE PRESENTACIÓN – Botella de comprimidos de 3 mg
3 mg
30 Comprimidos
NDC 59148-039-13
REXULTI®
brexpiprazole
tablets
Rx solamente
Manténgase fuera del alcance de los niños
ENTREGUE LA
GUÍA DEL MEDICAMENTO
A CADA PACIENTE
Otsuka
Lundbeck
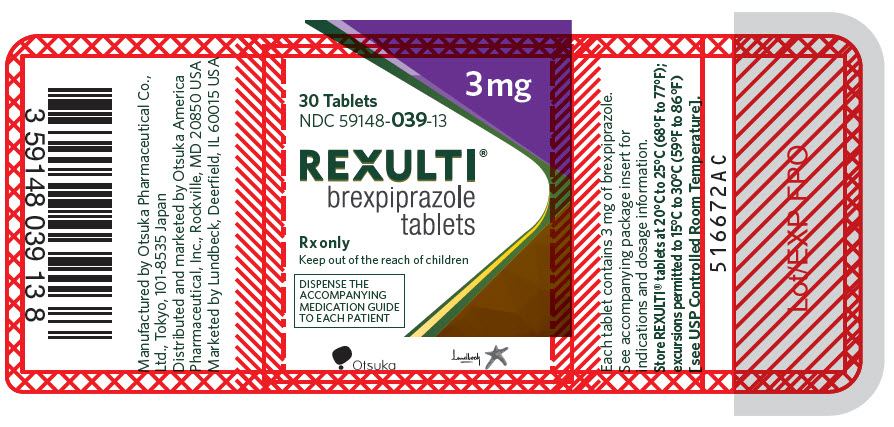
PRINCIPAL PANEL DE PRESENTACIÓN – Frasco con 3 mg de comprimidos
3 mg
30 Tabletas
NDC 59148-039-13
REXULTI®
brexpiprazole
tabletas
Rx solamente
Manténgase fuera del
alcance de los niños
ENTREGUE LA
GUÍA DE MEDICAMENTOS
A CADA PACIENTE
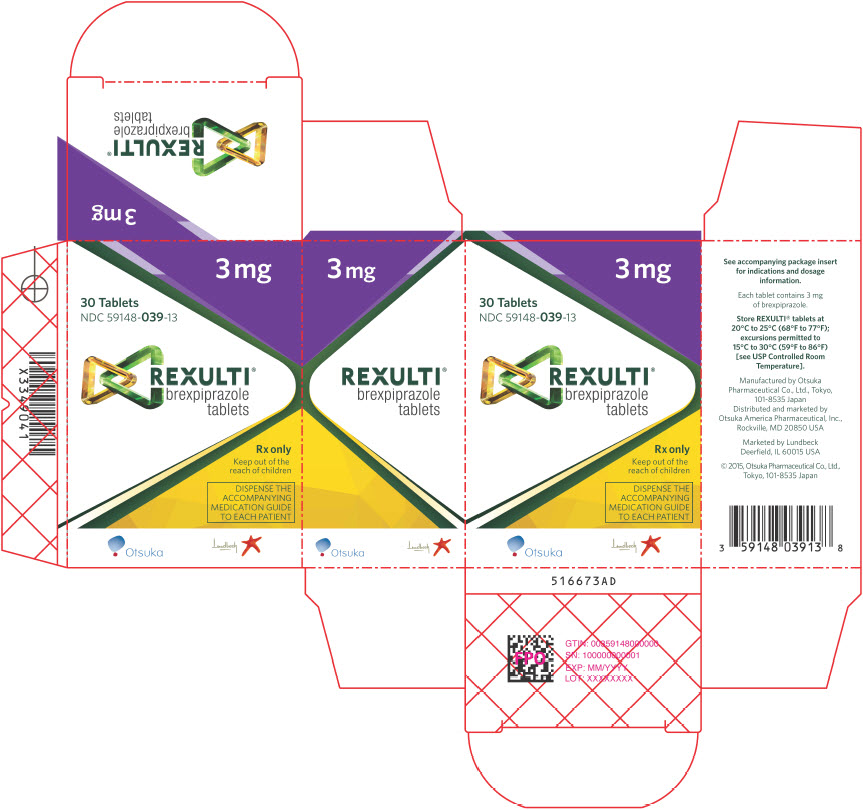
PRINCIPAL PANEL DE PRESENTACIÓN – Botella de comprimidos de 4 mg
4 mg
30 Comprimidos
NDC 59148-040-13
REXULTI®
brexpiprazole
tablets
Rx solamente
Manténgase fuera del alcance de los niños
DISPENSE LA
GUÍA DE
MEDICAMENTOS
A CADA PACIENTE
Otsuka
Lundbeck
PRINCIPAL PANEL DE PRESENTACIÓN – Frasco con 4 mg de comprimidos
4 mg
30 Tabletas
NDC 59148-040-13
REXULTI®
brexpiprazole
tabletas
Rx solamente
Manténgase fuera del
alcance de los niños
ENTREGUE LA
GUÍA DE MEDICAMENTOS
A CADA PACIENTE