Fabricante de medicamentos: Radius Health, Inc. (Updated: 2024-02-08)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
TYMLOS® (abaloparatide) inyección, para uso subcutáneo
Aprobación inicial en EE. UU.: 2017
INDICACIONES Y USO
TYMLOS es un análogo del péptido relacionado con la hormona paratiroidea humana [PTHrP(1-34)] indicado para:
- Tratamiento de mujeres posmenopáusicas con osteoporosis con alto riesgo de fractura o pacientes que han fallado o son intolerantes a otras terapias disponibles para la osteoporosis. (1.1)
- Tratamiento para aumentar la densidad ósea en hombres con osteoporosis con alto riesgo de fractura o pacientes que han fallado o son intolerantes a otras terapias disponibles para la osteoporosis. (1.2)
DOSIFICACIÓN Y ADMINISTRACIÓN
- La dosis recomendada es de 80 mcg por vía subcutánea una vez al día; los pacientes deben recibir calcio y vitamina D suplementarios si la ingesta dietética es inadecuada. (2.1)
- Administrar como una inyección subcutánea en la región periumbilical del abdomen. (2.2)
- Administrar inicialmente donde el paciente pueda sentarse o acostarse en caso de que ocurran síntomas de hipotensión ortostática. (2.2, 5.2)
FORMAS DE DOSIFICACIÓN Y FUERZAS
Inyección: 3120 mcg/1.56 ml (2000 mcg/ml) de abaloparatide en solución transparente e incolora en un bolígrafo prellenado de un solo paciente. El bolígrafo prellenado proporciona 30 dosis diarias de 80 mcg de abaloparatide en 40 mcl. (3)
CONTRAINDICACIONES
Hipersensibilidad conocida a TYMLOS. (4)
ADVERTENCIAS Y PRECAUCIONES
- Osteosarcoma: Evite el uso en pacientes con mayor riesgo de osteosarcoma, incluidos pacientes con epífisis abiertas, enfermedades óseas metabólicas, incluida la enfermedad de Paget, metástasis óseas o antecedentes de neoplasias esqueléticas, radioterapia previa con haz externo o implante que involucre el esqueleto y trastornos hereditarios que predisponen al osteosarcoma. (5.1)
- Hipotensión ortostática: Indique a los pacientes que se sienten o acuesten si desarrollan síntomas después de la administración de la dosis. (5.2)
- Hipercalcemia: Evite el uso en pacientes con hipercalcemia preexistente y aquellos que se sabe que tienen un trastorno hipercalcémico subyacente, como el hiperparatiroidismo primario. (5.3)
- Hipercalciuria y urolitiasis: Controle el calcio en la orina si se sospecha hipercalciuria preexistente o urolitiasis activa. (5.4)
REACCIONES ADVERSAS
- Osteoporosis en mujeres posmenopáusicas: Las reacciones adversas más comunes (incidencia ≥2%) son hipercalciuria, mareos, náuseas, dolor de cabeza, palpitaciones, fatiga, dolor abdominal superior y vértigo. (6.1)
- Osteoporosis en hombres: Las reacciones adversas más comunes (incidencia ≥2%) son eritema en el sitio de inyección, mareos, artralgia, hinchazón en el sitio de inyección, dolor en el sitio de inyección, contusión, náuseas, diarrea, distensión abdominal, dolor abdominal y dolor óseo. (6.1)
Para informar sobre REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Radius Health, Inc. al 1-855-672-3487 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
Ver 17 para INFORMACIÓN PARA EL PACIENTE y Guía de medicamentos.
Revisado: 12/2023
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
1.1 Tratamiento de mujeres posmenopáusicas con osteoporosis en alto riesgo de fractura
1.2 Tratamiento para aumentar la densidad ósea en hombres con osteoporosis en alto riesgo de fractura
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis recomendada
2.2 Instrucciones de administración
2.3 Duración del tratamiento
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Riesgo de osteosarcoma
5.2 Hipotensión ortostática
5.3 Hipercalcemia
5.4 Hipercalciuria y urolitiasis
6 REACCIONES ADVERSAS
6.1 Experiencia en ensayos clínicos
6.2 Experiencia postcomercialización
7 INTERACCIONES MEDICAMENTOSAS
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso pediátrico
8.5 Uso geriátrico
8.6 Deterioro renal
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
12.2 Farmacodinamia
12.3 Farmacocinética
12.6 Inmunogenicidad
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad
13.2 Toxicología y farmacología animal
14 ESTUDIOS CLÍNICOS
14.1 Estudio de eficacia en mujeres con osteoporosis posmenopáusica
14.2 Hombres con osteoporosis
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANEJO
16.1 Cómo se suministra
16.2 Almacenamiento y manejo
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
1 INDICACIONES Y USO
1.1 Tratamiento de mujeres posmenopáusicas con osteoporosis en alto riesgo de fractura
TYMLOS está indicado para el tratamiento de mujeres posmenopáusicas con osteoporosis en alto riesgo de fractura (definido como antecedentes de fractura osteoporótica o múltiples factores de riesgo de fractura), o pacientes que han fallado o son intolerantes a otras terapias disponibles para la osteoporosis. En mujeres posmenopáusicas con osteoporosis, TYMLOS reduce el riesgo de fracturas vertebrales y no vertebrales.
1.2 Tratamiento para aumentar la densidad ósea en hombres con osteoporosis en alto riesgo de fractura
TYMLOS está indicado para aumentar la densidad ósea en hombres con osteoporosis en alto riesgo de fractura (definido como antecedentes de fractura osteoporótica o múltiples factores de riesgo de fractura), o pacientes que han fallado o son intolerantes a otras terapias disponibles para la osteoporosis.
2 DOSIS Y ADMINISTRACIÓN
2.1 Dosis recomendada
- La dosis recomendada de TYMLOS es de 80 mcg administrados por vía subcutánea una vez al día.
- Los pacientes deben recibir suplementos de calcio y vitamina D si la ingesta dietética es inadecuada.
2.2 Instrucciones de administración
- Administre TYMLOS como una inyección subcutánea en la región periumbilical del abdomen. Rote el sitio de la inyección todos los días y adminístrelo aproximadamente a la misma hora todos los días. No lo administre por vía intravenosa o intramuscular.
- Administre las primeras dosis donde el paciente pueda sentarse o acostarse si es necesario, en caso de que se presenten síntomas de hipotensión ortostática [consulte Advertencias y precauciones (5.2) y Reacciones adversas (6.1)].
- Inspeccione visualmente TYMLOS para detectar partículas y decoloración antes de la administración. TYMLOS es una solución transparente e incolora. No lo use si aparecen partículas sólidas o si la solución está turbia o coloreada.
- Brinde capacitación e instrucción adecuadas a los pacientes y cuidadores sobre el uso adecuado de la pluma de TYMLOS.
2.3 Duración del tratamiento
No se ha evaluado la seguridad y eficacia de TYMLOS más allá de los 2 años de tratamiento. No se recomienda el uso del medicamento durante más de 2 años durante la vida del paciente.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Inyección: 3120 mcg/1.56 mL (2000 mcg/mL) de abaloparatide en solución transparente e incolora en un bolígrafo prellenado de un solo paciente. El bolígrafo prellenado administra 30 dosis de TYMLOS, cada una de las cuales contiene 80 mcg de abaloparatide en 40 mcL.
4 CONTRAINDICACIONES
TYMLOS está contraindicado en pacientes con antecedentes de hipersensibilidad sistémica a abaloparatide o a cualquier componente de la formulación del producto. Las reacciones han incluido anafilaxia, disnea y urticaria [ver Reacciones adversas (6.2)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Riesgo de Osteosarcoma
Abaloparatide causó un aumento dependiente de la dosis en la incidencia de osteosarcoma en ratas macho y hembra después de la administración subcutánea a exposiciones de 4 a 28 veces la exposición humana a la dosis clínica de 80 mcg [ver Toxicología no clínica (13.1)]. Se desconoce si TYMLOS causará osteosarcoma en humanos.
Se ha informado osteosarcoma en pacientes tratados con un análogo de PTH en el entorno posterior a la comercialización; sin embargo, no se ha observado un mayor riesgo de osteosarcoma en estudios observacionales en humanos. Hay datos limitados que evalúan el riesgo de osteosarcoma más allá de los 2 años de TYMLOS y/o el uso de un análogo de PTH [ver Posología y administración (2.3) y Toxicología no clínica (13.1)].
Evite el uso de TYMLOS en pacientes con (estos pacientes tienen un mayor riesgo basal de osteosarcoma):
- Epífisis abiertas (pacientes pediátricos y adultos jóvenes) (TYMLOS no está aprobado en pacientes pediátricos) [ver Uso en poblaciones específicas (8.4)].
- Enfermedades óseas metabólicas distintas de la osteoporosis, incluida la enfermedad ósea de Paget.
- Metástasis óseas o antecedentes de malignidades esqueléticas.
- Radioterapia previa con haz externo o implante que involucre el esqueleto.
- Trastornos hereditarios que predisponen al osteosarcoma.
5.2 Hipotensión ortostática
Puede ocurrir hipotensión ortostática con TYMLOS, generalmente dentro de las 4 horas posteriores a la inyección. Los síntomas asociados pueden incluir mareos, palpitaciones, taquicardia o náuseas, y pueden resolverse haciendo que el paciente se recueste. Para las primeras dosis, TYMLOS debe administrarse donde el paciente pueda sentarse o recostarse si es necesario [ver Reacciones adversas (6.1)].
5.3 Hipercalcemia
TYMLOS puede causar hipercalcemia. TYMLOS no se recomienda en pacientes con hipercalcemia preexistente o en pacientes que tienen un trastorno hipercalcèmico subyacente, como el hiperparatiroidismo primario, debido a la posibilidad de exacerbar la hipercalcemia [ver Reacciones adversas (6.1)].
5.4 Hipercalciuria y urolitiasis
TYMLOS puede causar hipercalciuria. Se desconoce si TYMLOS puede exacerbar la urolitiasis en pacientes con urolitiasis activa o antecedentes de urolitiasis. Si se sospecha urolitiasis activa o hipercalciuria preexistente, se debe considerar la medición de la excreción urinaria de calcio [ver Reacciones adversas (6.1)].
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas se describen con mayor detalle en otras secciones:
- Hipotensión ortostática [ver Advertencias y precauciones (5.2)]
- Hipercalcemia [ver Advertencias y precauciones (5.3)]
- Hipercalciuria y urolitiasis [ver Advertencias y precauciones (5.4)]
6.1 Experiencia en ensayos clínicos
Debido a que los estudios clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los estudios clínicos de un fármaco no se pueden comparar directamente con las tasas en los estudios clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica.
Reacciones adversas de los ensayos clínicos en mujeres posmenopáusicas con osteoporosis
La seguridad de TYMLOS se evaluó en un ensayo clínico aleatorizado, multicéntrico, doble ciego, controlado con placebo en mujeres posmenopáusicas con osteoporosis de 49 a 86 años (edad media 69 años) que fueron aleatorizadas para recibir 80 mcg de TYMLOS (N = 824) o placebo (N = 821), administrado por vía subcutánea una vez al día durante 18 meses [ver Estudios clínicos (14.1)].
En este estudio, la incidencia de mortalidad por todas las causas fue del 0,4% en el grupo de TYMLOS y del 0,6% en el grupo de placebo. La incidencia de eventos adversos graves fue del 10% en el grupo de TYMLOS y del 11% en el grupo de placebo. El porcentaje de pacientes que suspendieron el fármaco del estudio debido a eventos adversos fue del 10% en el grupo de TYMLOS y del 6% en el grupo de placebo. Las reacciones adversas más comunes que llevaron a la suspensión del fármaco del estudio en el grupo de TYMLOS fueron náuseas (2%), mareos (1%), dolor de cabeza (1%) y palpitaciones (1%).
Tabla 1 muestra las reacciones adversas más comunes en el ensayo. Estas reacciones adversas generalmente no estaban presentes al inicio del estudio, ocurrieron con más frecuencia con TYMLOS que con placebo y ocurrieron en al menos el 2% de los pacientes tratados con TYMLOS.
|
* Reacciones adversas notificadas en ≥2% de los pacientes tratados con TYMLOS. |
||
| Término preferido | TYMLOS (N=822) (%) |
Placebo (N=820) (%) |
| Hipercalciuria | 11 | 9 |
| Mareos | 10 | 6 |
| Náuseas | 8 | 3 |
| Dolor de cabeza | 8 | 6 |
| Palpitaciones | 5 | 0.4 |
| Fatiga | 3 | 2 |
| Dolor abdominal superior | 3 | 2 |
| Vértigo | 2 | 2 |
Hipotensión ortostática
En el ensayo clínico de mujeres con osteoporosis posmenopáusica, la incidencia de disminución de la presión arterial ortostática ≥20 mmHg sistólica o ≥10 mmHg diastólica a la 1 hora después de la primera inyección fue del 4% en el grupo TYMLOS y del 3% en el grupo placebo. En puntos de tiempo posteriores, la incidencia fue generalmente similar entre los grupos de tratamiento. Se informaron reacciones adversas de hipotensión ortostática en el 1% de los pacientes que recibieron TYMLOS y en el 0,5% de los pacientes que recibieron placebo. Se informó mareo en más pacientes tratados con TYMLOS (10%) en comparación con placebo (6%) [ver Advertencias y precauciones (5.2)].
Taquicardia
En mujeres con osteoporosis posmenopáusica, se informaron reacciones adversas de taquicardia, incluida la taquicardia sinusal, en el 2% de los pacientes que recibieron TYMLOS y en el 1% de los pacientes del grupo placebo. En 5 de los 13 pacientes que recibieron TYMLOS que experimentaron taquicardia, los síntomas ocurrieron dentro de la 1 hora de la administración. TYMLOS se ha asociado con un aumento dependiente de la dosis en la frecuencia cardíaca que se desarrolló dentro de los 15 minutos posteriores a la inyección y se resolvió en aproximadamente 6 horas [ver Farmacología clínica (12.2)].
Reacciones en el sitio de inyección
Durante el primer mes del ensayo, las reacciones en el sitio de inyección se evaluaron diariamente una hora después de la inyección. TYMLOS tuvo una mayor incidencia que el placebo de enrojecimiento en el sitio de inyección (58% vs. 28%), edema (11% vs. 3%) y dolor (10% vs. 7%). Se informó enrojecimiento severo, edema severo y dolor severo en el 2,9%, 0,4% y 0,4% de los pacientes tratados con TYMLOS.
Anormalidades de laboratorio
Hipercalcemia
En el ensayo clínico de mujeres con osteoporosis posmenopáusica, TYMLOS causó aumentos en las concentraciones de calcio en suero [ver Advertencias y precauciones (5.3)]. La incidencia de hipercalcemia, definida como calcio en suero corregido por albúmina ≥10,7 mg/dL a las 4 horas después de la inyección en cualquier visita, fue del 3% en los pacientes tratados con TYMLOS y del 0,1% con placebo. El calcio en suero previo a la dosis fue similar al basal en ambos grupos. Hubo 2 (0,2%) pacientes tratados con TYMLOS y ningún paciente tratado con placebo que abandonó el estudio debido a hipercalcemia. La incidencia de hipercalcemia con TYMLOS fue mayor en pacientes con insuficiencia renal leve o moderada (4%) en comparación con pacientes con función renal normal (1%).
Aumentos en el ácido úrico en suero
TYMLOS aumentó las concentraciones de ácido úrico en suero. En el ensayo de osteoporosis posmenopáusica, entre los pacientes con concentraciones basales normales de ácido úrico, el 25% de los pacientes del grupo TYMLOS y el 6% de los pacientes del grupo placebo tuvieron al menos una concentración posterior al basal por encima del rango normal. La hiperuricemia observada en los pacientes tratados con TYMLOS no se asoció con un aumento en las reacciones adversas de gota o artralgia sobre lo observado con placebo.
Hipercalciuria y urolitiasis
En el ensayo clínico de mujeres con osteoporosis posmenopáusica, la incidencia general de la relación calcio en orina:creatinina >400 mg/g fue mayor con TYMLOS que con placebo (20% vs 15%, respectivamente). Se informaron urolitiasis en el 2,1% de los pacientes tratados con TYMLOS y en el 1,7% de los pacientes tratados con placebo.
Reacciones adversas del estudio de extensión en mujeres posmenopáusicas con osteoporosis
Después de 18 meses de tratamiento con TYMLOS o placebo, 1139 mujeres pasaron a tratamiento con alendronato 70 mg administrado por vía oral una vez por semana. La incidencia de eventos adversos que ocurrieron durante el tratamiento con alendronato fue similar en pacientes con terapia previa con placebo o TYMLOS [ver Estudios clínicos (14.1)].
Reacciones adversas del ensayo clínico en hombres con osteoporosis
La seguridad de TYMLOS se evaluó en un ensayo clínico aleatorizado, multicéntrico, doble ciego, controlado con placebo en hombres con osteoporosis de 42 a 85 años (edad media 68 años) que fueron aleatorizados para recibir 80 mcg de TYMLOS (N = 149) o placebo (N = 79), administrado por vía subcutánea una vez al día durante 12 meses [ver Estudios clínicos (14.2)].
En este estudio, ningún paciente de ninguno de los grupos de tratamiento tuvo una reacción adversa con un desenlace fatal durante el ensayo. Se informaron reacciones adversas graves en el 5,4% de los sujetos tratados con TYMLOS y en el 5,1% de los sujetos del grupo placebo. Se informaron reacciones adversas que llevaron a la interrupción del fármaco del estudio para el 6,7% de los pacientes tratados con TYMLOS y el 5,1% de los pacientes que recibieron placebo. La reacción adversa más común que llevó a la interrupción del fármaco del estudio en el grupo TYMLOS fue el mareo (2%).
La tabla 2 muestra las reacciones adversas más comunes en el ensayo. Estas reacciones adversas generalmente no estaban presentes al inicio, ocurrieron con mayor frecuencia con TYMLOS que con placebo y ocurrieron en al menos el 2% de los pacientes tratados con TYMLOS.
| Término preferido | TYMLOS (N=149) (%) |
Placebo (N=79) (%) |
|---|---|---|
|
||
| Eritema en el sitio de inyección | 13 | 5 |
| Mareo | 9 | 1 |
| Artralgia | 7 | 1 |
| Hinchazón en el lugar de la inyección | 7 | 0 |
| Dolor en el lugar de la inyección | 6 | 0 |
| Contusión | 3 | 0 |
| Distensión abdominal | 3 | 0 |
| Diarrea | 3 | 0 |
| Náusea | 3 | 0 |
| Dolor abdominal | 2 | 0 |
| Dolor óseo | 2 | 0 |
Hipotensión ortostática
En el ensayo clínico en hombres con osteoporosis, la incidencia de disminuciones en la presión arterial ortostática de ≥ 20 mmHg sistólicos o ≥ 10 mmHg diastólicos a 1 hora después de la primera inyección fue del 6% en el grupo de TYMLOS y del 3% en el grupo placebo. Las reacciones adversas de hipotensión ortostática se informaron en el 1% de los pacientes que recibieron TYMLOS y en 0 pacientes que recibieron placebo. El mareo fue reportado por más pacientes tratados con TYMLOS (9%) en comparación con el placebo (1%) [ver Advertencias y Precauciones (5.2)].
Anomalías de laboratorio
Hipercalcemia
En el ensayo clínico en hombres con osteoporosis, TYMLOS causó aumentos en las concentraciones de calcio sérico [ver Advertencias y Precauciones (5.3)]. La incidencia de hipercalcemia, definida como calcio sérico corregido por albúmina ≥ 10.8 mg/dL a las 4 horas después de la inyección en cualquier visita, fue del 3% en los pacientes tratados con TYMLOS y del 0% con placebo. El calcio sérico antes de la dosis fue similar al basal en ambos grupos. La incidencia de hipercalcemia, definida como calcio sérico corregido por albúmina ≥ 10.8 mg/dL a las 4 horas después de la inyección, con TYMLOS fue mayor en pacientes con insuficiencia renal leve o moderada (4%) en comparación con pacientes con función renal normal (0%).
Aumentos en el ácido úrico sérico
TYMLOS aumentó las concentraciones de ácido úrico sérico. En el ensayo de osteoporosis masculina, entre los pacientes con concentraciones basales normales de ácido úrico, el 7% de los pacientes en el grupo de TYMLOS y el 6% de los pacientes en el grupo placebo tuvieron al menos una concentración posterior al basal por encima del rango normal. La hiperuricemia observada en pacientes tratados con TYMLOS no se asoció con un aumento en las reacciones adversas de gota o artralgia en comparación con lo observado con placebo.
Hipercalciuria y urolitiasis
En el ensayo clínico en hombres con osteoporosis, la incidencia global de la relación calcio en la orina: creatinina > 400 mg/g no fue mayor con TYMLOS que con placebo. Las urolitiasis se informaron en el 2% de los pacientes tratados con TYMLOS y en el 1% de los pacientes tratados con placebo.
6.2 Experiencia postcomercialización
Las siguientes reacciones adversas se han identificado durante el uso posterior a la aprobación de TYMLOS. Dado que estas reacciones se informan voluntariamente de una población de tamaño incierto, no siempre es posible estimar fiablemente su frecuencia o establecer una relación causal con la exposición al fármaco.
- Distensión abdominal, dolor abdominal
- Constipación, diarrea, vómitos
- Astenia, letargo, malestar
- Insomnio
- Reacciones de hipersensibilidad y anafilácticas, disnea (en el contexto de reacciones alérgicas)
- Prurito, erupción cutánea
- Dolor generalizado y dolor en hueso, articulación, espalda y extremidad
- Espasmo muscular en la pierna y la espalda
- Reacciones en el lugar de la inyección, incluidos hematoma, hemorragia, prurito y erupción cutánea
7 INTERACCIONES MEDICAMENTOSAS
No se han realizado estudios específicos de interacción fármaco-fármaco [ver Farmacología clínica (12.3)].
8 USO EN POBLACIONES ESPECÍFICAS
8.4 Uso pediátrico
No se ha establecido la seguridad y eficacia de TYMLOS en pacientes pediátricos. No se recomienda el uso de TYMLOS en pacientes pediátricos con epífisis abiertas o trastornos hereditarios que predispongan al osteosarcoma debido a un mayor riesgo inicial de osteosarcoma [ver Advertencias y precauciones (5.1)].
8.5 Uso geriátrico
Del número total de pacientes en los estudios clínicos de osteoporosis posmenopáusica de TYMLOS, el 82% tenía 65 años o más y el 19% tenía 75 años o más. En el estudio de osteoporosis masculina, el 74% tenía 65 años o más y el 23% tenía 75 años o más. No se observaron diferencias generales en la seguridad o eficacia entre estos sujetos y los sujetos más jóvenes, pero no se puede descartar una mayor sensibilidad de algunas personas mayores.
8.6 Insuficiencia renal
No es necesario ajustar la dosis en pacientes con insuficiencia renal leve, moderada o grave. Se realizó un estudio de una dosis única de 80 mcg de TYMLOS administrada por vía subcutánea en sujetos con función renal normal o insuficiencia renal leve, moderada o grave. La concentración máxima (Cmáx) y el área bajo la curva de concentración-tiempo (AUC) de abaloparatida aumentaron 1.4 y 2.1 veces, respectivamente, en sujetos con insuficiencia renal grave, en comparación con sujetos con función renal normal. Los pacientes con insuficiencia renal grave pueden tener una mayor exposición a la abaloparatida, lo que puede aumentar el riesgo de reacciones adversas; por lo tanto, controle las reacciones adversas [ver Farmacología clínica (12.3)].
10 SOBREDOSIS
En un estudio clínico, se informó una sobredosis accidental en un paciente que recibió 400 mcg en un día (5 veces la dosis clínica recomendada); la dosificación se interrumpió temporalmente. El paciente experimentó astenia, dolor de cabeza, náuseas y vértigo. El calcio sérico no se evaluó el día de la sobredosis, pero al día siguiente el calcio sérico del paciente estaba dentro del rango normal. Los efectos de la sobredosis pueden incluir hipercalcemia, náuseas, vómitos, mareos, taquicardia, hipotensión ortostática y dolor de cabeza.
Manejo de la sobredosis
No existe un antídoto específico para TYMLOS. El tratamiento de una sobredosis sospechosa debe incluir la interrupción de TYMLOS, el control del calcio y el fósforo séricos y la implementación de medidas de apoyo apropiadas, como la hidratación. Con base en el peso molecular, la unión a proteínas plasmáticas y el volumen de distribución, no se espera que abaloparatide sea dializable.
11 DESCRIPCIÓN
La inyección de TYMLOS para administración subcutánea contiene abaloparatida, un péptido sintético de 34 aminoácidos. Abaloparatida es un análogo del péptido relacionado con la hormona paratiroidea humana, PTHrP(1-34). Tiene un 41% de homología con hPTH(1-34) (hormona paratiroidea humana 1-34) y un 76% de homología con hPTHrP(1-34) (péptido relacionado con la hormona paratiroidea humana 1-34).
Abaloparatida tiene una fórmula molecular de C174H300N56O49 y un peso molecular de 3961 daltons con la secuencia de aminoácidos que se muestra a continuación:
- Ala-Val-Ser-Glu-His-Gln-Leu-Leu-His-Asp-Lys-Gly-Lys-Ser-Ile-Gln-Asp-Leu-Arg-Arg-Arg-Glu-Leu-Leu-Glu-Lys-Leu-Leu-Aib-Lys-Leu-His-Thr-Ala-NH2
La inyección de TYMLOS se suministra como una solución estéril, incolora y transparente en un cartucho de vidrio que está preensamblado en una pluma desechable de un solo uso para un paciente. La pluma está diseñada para administrar 30 dosis diarias de abaloparatida de 80 mcg en 40 mcL. Cada cartucho contiene 1.56 mL de solución de TYMLOS que contiene 3.12 mg de abaloparatida, y los siguientes ingredientes inactivos: 9.95 mg de ácido acético al 99%, 7.8 mg de fenol, 7.92 mg de trihidrato de acetato de sodio y agua para inyección con un rango de pH objetivo de 5.1 a 5.2.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
El abaloparatida es un análogo de la PTHrP(1-34) que actúa como agonista en el receptor de la PTH1 (PTH1R). Esto produce la activación de la vía de señalización del cAMP en las células diana. La administración de abaloparatida una vez al día estimula la formación de hueso nuevo en las superficies óseas trabeculares y corticales mediante la estimulación de la actividad osteoblástica. En ratas y monos, el abaloparatida tuvo un efecto anabólico sobre el hueso, demostrado por aumentos en la DMO y el contenido mineral óseo (CMO) que se correlacionaron con aumentos en la resistencia ósea en sitios vertebrales y/o no vertebrales [véase Toxicología no clínica (13.2)].
12.2 Farmacodinámica
Efectos sobre los marcadores de la renovación ósea
Un estudio de determinación de la dosis de abaloparatida administrado una vez al día durante 24 semanas en mujeres posmenopáusicas con osteoporosis demostró una relación dosis-respuesta para la DMO y los marcadores de formación ósea.
La administración diaria de TYMLOS a mujeres posmenopáusicas con osteoporosis durante 18 meses aumentó el marcador de formación ósea propéptido aminoterminal del procolágeno tipo I en suero (sPINP) y el marcador de resorción ósea telopéptido C reticulado del colágeno tipo I en suero (sCTX). El aumento de las medias geométricas de los niveles de sPINP alcanzó su punto máximo en el mes 1 con un 93 % por encima del valor basal en mujeres posmenopáusicas, y luego disminuyó lentamente con el tiempo hasta un 45 % por encima del valor basal en el mes 18. El aumento de las medias geométricas de los niveles de sCTX en mujeres posmenopáusicas alcanzó su punto máximo en el mes 3 con un 26 % por encima del valor basal, y luego disminuyó hasta los niveles basales en el mes 18.
La administración diaria de TYMLOS a hombres con osteoporosis durante 12 meses aumentó el marcador de formación ósea sPINP y el marcador de resorción ósea sCTX. El aumento de las medias geométricas de los niveles de sPINP alcanzó su punto máximo en el mes 1 con un 133 % por encima del valor basal en los hombres, y luego disminuyó lentamente con el tiempo hasta un 84 % por encima del valor basal en el mes 12. El aumento de las medias geométricas de los niveles de sCTX en los hombres alcanzó su punto máximo en el mes 6 con un 46 % por encima del valor basal, y fue del 35 % por encima del valor basal en el mes 12.
Electrofisiología cardíaca
Se realizó un estudio cruzado de cuatro vías del intervalo QT/QTc corregido en 55 sujetos sanos que recibieron dosis únicas de placebo, dosis subcutáneas de abaloparatida de 80 mcg y 240 mcg (tres veces la dosis recomendada) y 400 mg de moxifloxacina por vía oral. El abaloparatida aumentó la frecuencia cardíaca, con un aumento máximo medio de 15 latidos por minuto (lpm) y 20 lpm en el primer punto temporal (15 minutos) después de la administración de 80 mcg y 240 mcg, respectivamente. No se observaron efectos clínicamente significativos del abaloparatida sobre el QTcI (intervalos QT corregidos individualmente) ni sobre la electrofisiología cardíaca.
12.3 Farmacocinética
Después de siete días de administración subcutánea de 80 mcg de abaloparatida, la exposición media (DE) al abaloparatida fue de 812 (118) pg/ml para la Cmáx y de 1622 (641) pg∙h/ml para el AUC0–24 en mujeres posmenopáusicas con osteoporosis.
Absorción
La mediana (rango) del tiempo hasta la concentración máxima de 80 mcg de abaloparatida fue de 0.51 h (0.25 a 0.52 h) después de la administración subcutánea. La biodisponibilidad absoluta del abaloparatida en mujeres sanas después de la administración subcutánea de una dosis de 80 mcg fue del 36 %.
Distribución
La unión a proteínas plasmáticas in vitro del abaloparatida fue de aproximadamente el 70 %. El volumen de distribución fue de aproximadamente 50 L.
Eliminación
Poblaciones específicas
Sujetos masculinos y femeninos
Los perfiles medios de concentración-tiempo del abaloparatida en suero observados en un estudio realizado en hombres sanos con una media (± DE) de edad de 53.1 (± 6.9) años fueron comparables a los observados en las mujeres sanas con una media (± DE) de edad de 53.7 (± 7.1) años utilizando el mismo régimen de dosificación.
Pacientes geriátricos
No se observaron diferencias relacionadas con la edad en la farmacocinética del abaloparatida en hombres y mujeres posmenopáusicas de entre 18 y 85 años de edad.
Raza
No se observaron diferencias en la farmacocinética del abaloparatida en función de la raza en los ensayos clínicos.
Pacientes con insuficiencia renal
Se administró una dosis única subcutánea de 80 mcg de abaloparatida a pacientes hombres y mujeres con insuficiencia renal: 8 pacientes con insuficiencia renal leve (CLCr de 60 a 89 ml/min), 7 pacientes con insuficiencia renal moderada (CLCr de 30 a 59 ml/min), 8 pacientes con insuficiencia renal grave (CLCr de 15 a 29 ml/min) y 8 sujetos sanos con función renal normal (CLCr de 90 ml/min o superior) emparejados por sexo, edad e índice de masa corporal (IMC). La Cmáx. de abaloparatida aumentó 1.0, 1.3 y 1.4 veces en pacientes con insuficiencia renal leve, moderada y grave, en comparación con los sujetos sanos con función renal normal. El AUC de abaloparatida aumentó 1.2, 1.7 y 2.1 veces en pacientes con insuficiencia renal leve, moderada y grave, en comparación con los sujetos sanos con función renal normal. Los pacientes sometidos a diálisis no se incluyeron en el estudio.
12.6 Inmunogenicidad
La incidencia observada de anticuerpos contra el fármaco depende en gran medida de la sensibilidad y especificidad del ensayo. Las diferencias en los métodos de análisis impiden realizar comparaciones significativas de la incidencia de anticuerpos contra el fármaco en los estudios que se describen a continuación con la incidencia de anticuerpos contra el fármaco en otros estudios, incluidos los de abaloparatida o de otros productos de abaloparatida.
Mujeres posmenopáusicas con osteoporosis
De las pacientes que recibieron TYMLOS durante 18 meses, el 41 % (318/773) desarrolló anticuerpos contra la abaloparatida y el 26 % (204/773) desarrolló anticuerpos neutralizantes contra la abaloparatida. De las pacientes con anticuerpos contra la abaloparatida a las que se les realizó la prueba de reactividad cruzada, el 2.4 % (7/297) desarrolló reactividad cruzada a la PTHrP, de las cuales 3 de las 7 pacientes desarrollaron anticuerpos neutralizantes contra la PTHrP. Solo el 0.3 % (1/297) desarrolló anticuerpos de reacción cruzada a la PTH, que no neutralizaron la PTH. La formación de anticuerpos no pareció tener ningún impacto clínicamente significativo en las variables de seguridad o eficacia, incluida la respuesta de la densidad mineral ósea (DMO), la reducción de fracturas o los eventos adversos.
La mayoría de las pacientes con anticuerpos contra la abaloparatida durante el tratamiento con TYMLOS, el 86 % (275/318), se sometieron a mediciones de anticuerpos de seguimiento cada seis meses después de finalizar el tratamiento con TYMLOS hasta que se seroconvirtieron a anticuerpos negativos o se perdieron durante el seguimiento. De estas pacientes, 127 siguieron siendo positivas a los anticuerpos al año de interrumpir el tratamiento, 55 siguieron siendo positivas a los anticuerpos a los 2 años y 6 siguieron siendo positivas a los anticuerpos a los 3 años.
Hombres con osteoporosis
De los pacientes varones que recibieron TYMLOS durante 12 meses, el 25 % (36/142) desarrolló anticuerpos contra la abaloparatida y el 1.4 % (2/142) desarrolló anticuerpos neutralizantes contra la abaloparatida. De los pacientes con anticuerpos contra la abaloparatida a los que se les realizó la prueba de reactividad cruzada, ninguno desarrolló reactividad cruzada a la PTHrP o la PTH. La formación de anticuerpos no pareció tener ningún impacto clínicamente significativo en las variables de seguridad o eficacia, incluida la respuesta de la densidad mineral ósea (DMO) o los eventos adversos.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad
Carcinogénesis
En un estudio de carcinogénesis de 2 años de duración, se administró abaloparatida una vez al día a ratas Fischer machos y hembras mediante inyección subcutánea a dosis de 10, 25 y 50 mcg/kg. Estas dosis dieron como resultado exposiciones sistémicas a abaloparatida que fueron 4, 16 y 28 veces, respectivamente, la exposición sistémica observada en humanos después de la dosis subcutánea recomendada de 80 mcg (según las comparaciones del AUC). Los cambios neoplásicos relacionados con el tratamiento con abaloparatida consistieron en aumentos marcados dependientes de la dosis en la incidencia de osteosarcoma y osteoblastoma en todos los grupos de dosis de machos y hembras. La incidencia de osteosarcoma fue del 0-2% en los controles no tratados y alcanzó el 87% y el 62% en los grupos de dosis altas de machos y hembras, respectivamente. Las neoplasias óseas se acompañaron de aumentos marcados en la masa ósea.
Se desconoce la relevancia de los hallazgos en ratas para los humanos. No se recomienda el uso de TYMLOS en pacientes con mayor riesgo de osteosarcoma [ver Advertencias y precauciones (5.1)].
Mutagénesis
La abaloparatida no fue genotóxica ni mutagénica en una batería estándar de pruebas que incluyeron la prueba de Ames para la mutagénesis bacteriana, la prueba de aberración cromosómica utilizando linfocitos periféricos humanos y la prueba de micronúcleos de ratón.
Deterioro de la fertilidad
Los efectos de la abaloparatida sobre la fertilidad femenina no se han evaluado de forma no clínica. No se observaron efectos adversos de la abaloparatida sobre la fertilidad masculina en ratas macho. En un estudio de fertilidad en ratas macho, se administró abaloparatida por inyección subcutánea 2 semanas antes del apareamiento, durante el período de apareamiento y durante aproximadamente 2 semanas después del período de apareamiento (durante un total de 6 semanas) a dosis de 10, 25 y 70 µg/kg/día. La abaloparatida no causó efectos adversos sobre el apareamiento, los índices de fertilidad, la tasa de concepción, el peso de los órganos reproductores ni los parámetros del esperma hasta 70 µg/kg/día (28 veces la exposición sistémica observada en humanos después de la dosis subcutánea recomendada de 80 mcg [según las comparaciones del AUC]).
13.2 Toxicología y farmacología en animales
En estudios de toxicidad en ratas y monos de hasta 26 y 39 semanas de duración, respectivamente, los hallazgos incluyeron vasodilatación, aumentos en el calcio sérico, disminuciones en el fósforo sérico y mineralización de tejidos blandos a dosis ≥10 mcg/kg/día. La dosis de 10 mcg/kg/día dio como resultado exposiciones sistémicas a abaloparatida en ratas y monos que fueron 2 y 3 veces, respectivamente, la exposición en humanos a dosis subcutáneas diarias de 80 mcg.
Los efectos farmacológicos de la abaloparatida en el esqueleto se evaluaron en estudios de 12 y 16 meses en ratas y monos ovariectomizados (OVX), a dosis de hasta 11 y 1 vez la exposición humana a la dosis subcutánea recomendada de 80 mcg, respectivamente (según las comparaciones del AUC). En estos modelos animales de osteoporosis posmenopáusica, el tratamiento con abaloparatida dio como resultado aumentos dependientes de la dosis en la masa ósea en sitios vertebrales y/o no vertebrales, lo que se correlaciona con aumentos en la resistencia ósea. El efecto anabólico de la abaloparatida se debió al aumento predominante en la formación ósea osteoblástica y se evidenció por aumentos en el grosor trabecular y/o el grosor cortical debido a la aposición ósea endostal. La abaloparatida mantuvo o mejoró la calidad ósea en todos los sitios esqueléticos evaluados y no causó ningún defecto de mineralización.
En un estudio de 8 semanas en ratas macho orquidectomizadas (ORX) con deficiencia de andrógenos, un modelo de osteoporosis masculina, se examinaron los efectos de 5 y 25 mcg/kg/día de abaloparatida (≥47 veces las exposiciones clínicas por AUC) sobre la formación ósea, la masa ósea y la resistencia ósea. La abaloparatida indujo la formación ósea y mejoró la DMO cortical y trabecular, la geometría y la arquitectura sin aumentar los parámetros de reabsorción ósea.
14 ESTUDIOS CLÍNICOS
14.1 Estudio de eficacia en mujeres con osteoporosis posmenopáusica
La eficacia de TYMLOS para el tratamiento de la osteoporosis posmenopáusica se evaluó en el Estudio 003 (NCT 01343004), un ensayo clínico aleatorizado, multicéntrico, doble ciego, controlado con placebo de 18 meses en mujeres posmenopáusicas de 49 a 86 años (edad media de 69) que fueron aleatorizadas para recibir TYMLOS 80 mcg (N = 824) o placebo (N = 821) administrado subcutáneamente una vez al día. Aproximadamente el 80% de las pacientes eran caucásicas, 16% asiáticas y 3% negras; el 24% eran hispanas. En la línea de base, las puntuaciones T medias eran -2.9 en la columna lumbar, -2.1 en el cuello femoral y -1.9 en la cadera total. En la línea de base, el 24% de las pacientes tenían al menos una fractura vertebral prevalente y el 48% tenía al menos una fractura no vertebral previa. Las pacientes tomaban calcio suplementario diario (500 a 1000 mg) y vitamina D (400 a 800 UI).
El estudio de eficacia se extendió como Estudio 005 (NCT 01657162), un estudio de etiqueta abierta en el que las pacientes ya no recibían TYMLOS ni placebo, pero se mantuvieron en su grupo de tratamiento aleatorizado original y recibieron 70 mg de alendronato semanalmente, con suplementos de calcio y vitamina D durante 6 meses. El Estudio 005 incluyó a 1139 pacientes, que representaban el 92% de las pacientes que completaron el Estudio 003. Esto incluyó 558 pacientes que habían recibido previamente TYMLOS y 581 pacientes que habían recibido previamente placebo. El conjunto de datos de eficacia acumulado de 25 meses incluyó 18 meses de exposición a TYMLOS o placebo en el Estudio 003, 1 mes sin tratamiento, seguido de 6 meses de terapia con alendronato en el Estudio 005. El Estudio 005 luego se continuó para completar 18 meses adicionales de exposición al alendronato durante los cuales las pacientes ya no estaban ciegas a su grupo de tratamiento original del Estudio 003.
Efecto en las nuevas fracturas vertebrales
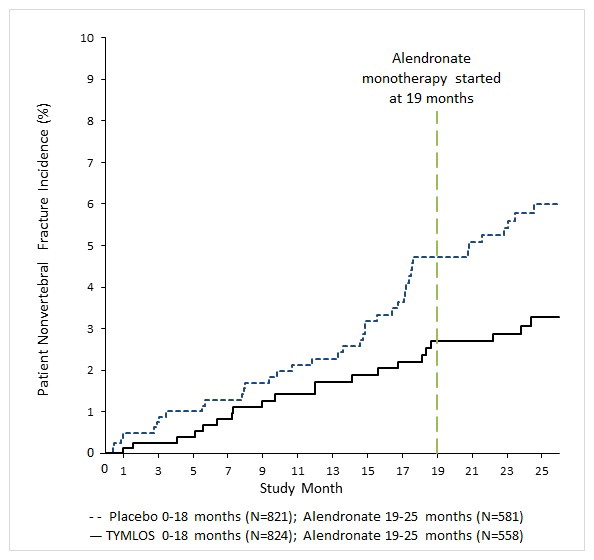
El punto final primario fue la incidencia de nuevas fracturas vertebrales en pacientes tratadas con TYMLOS en comparación con placebo. TYMLOS resultó en una reducción significativa en la incidencia de nuevas fracturas vertebrales en comparación con placebo a los 18 meses (0,6% TYMLOS en comparación con 4,2% placebo, p < 0,0001). La reducción absoluta del riesgo de nuevas fracturas vertebrales fue del 3,6% a los 18 meses y la reducción relativa del riesgo fue del 86% para TYMLOS en comparación con placebo (Tabla 3). La incidencia de nuevas fracturas vertebrales a los 25 meses fue del 0,6% en pacientes tratadas con TYMLOS seguido de alendronato, en comparación con el 4,4% en pacientes tratadas con placebo seguido de alendronato (p < 0,0001). La reducción relativa del riesgo de nuevas fracturas vertebrales a los 25 meses fue del 87% en pacientes tratadas con TYMLOS seguido de alendronato, en comparación con pacientes tratadas con placebo seguido de alendronato, y la reducción absoluta del riesgo fue del 3,9% (Tabla 3). Después de 24 meses de terapia abierta con alendronato, la reducción del riesgo de fractura vertebral lograda con el tratamiento con TYMLOS se mantuvo.
| Porcentaje de mujeres posmenopáusicas con fracturas | Reducción absoluta del riesgo (%) (95% CI‡) |
Reducción relativa del riesgo (%) (95% CI‡) |
||
| TYMLOS (N = 690*) (%) |
Placebo (N = 711*) (%) |
|||
| 0-18 meses | 0,6 | 4,2 | 3,6 (2,1, 5,4) |
86 (61, 95) |
| TYMLOS/ Alendronato (N = 544†) (%) |
Placebo/ Alendronato (N = 568†) (%) |
|||
| 0-25 meses | 0,6 | 4,4 | 3,9 (2,1, 5,9) |
87 (59, 96) |
Efecto en las fracturas no vertebrales
TYMLOS produjo una reducción significativa en la incidencia de fracturas no vertebrales al final de los 18 meses de tratamiento más 1 mes de seguimiento donde no se administró ningún medicamento (2.7% para los pacientes tratados con TYMLOS en comparación con 4.7% para los pacientes tratados con placebo). La reducción relativa del riesgo de fracturas no vertebrales para TYMLOS en comparación con placebo fue del 43% (prueba de logrank p = 0.049) y la reducción absoluta del riesgo fue del 2.0%.
Después de 6 meses de tratamiento con alendronato en el Estudio 005, la incidencia acumulada de fracturas no vertebrales a los 25 meses fue del 2.7% para las mujeres en el grupo TYMLOS previo en comparación con el 5.6% para las mujeres en el grupo placebo previo (Figura 1). A los 25 meses, la reducción relativa del riesgo de fracturas no vertebrales fue del 52% (prueba de logrank p = 0.017) y la reducción absoluta del riesgo fue del 2.9%.
Figura 1: Incidencia acumulada de fracturas no vertebrales1 durante 25 meses (población de intención de tratar)2
TYMLOS demostró reducciones consistentes en el riesgo de fracturas vertebrales y no vertebrales independientemente de la edad, los años transcurridos desde la menopausia, la presencia o ausencia de fractura previa (vertebral, no vertebral) y la BMD al inicio del estudio.
Efecto en la densidad mineral ósea (DMO)
El tratamiento con TYMLOS durante 18 meses en el Estudio 003 produjo aumentos significativos en la DMO en comparación con placebo en la columna lumbar, la cadera total y el cuello femoral, cada uno con p<0.0001 (Tabla 4). Se observaron hallazgos similares después de 6 meses de tratamiento con alendronato en el Estudio 005 (Tabla 4).
|
* Incluye pacientes aleatorizados en el Estudio 003 |
|||
|
† Incluye pacientes inscritos en el Estudio 005 |
|||
|
‡ Última observación llevada hacia adelante |
|||
|
§ Intervalo de confianza |
|||
| TYMLOS (N=824*) (%) |
Placebo (N=821*) (%) |
Diferencia de tratamiento (%) (IC del 95%§) |
|
| 18 meses | |||
| Columna lumbar | 9.2 | 0.5 | 8.8 (8.2, 9.3) |
| Cadera total | 3.4 | -0.1 | 3.5 (3.3, 3.8) |
| Cuello femoral | 2.9 | -0.4 | 3.3 (3.0, 3.7) |
| TYMLOS/ Alendronato (N=558†) (%) |
Placebo/ Alendronato (N=581†) (%) |
||
| 25 meses | |||
| Columna lumbar | 12.8 | 3.5 | 9.3 (8.6, 10.1) |
| Cadera total | 5.5 | 1.4 | 4.1 (3.7, 4.5) |
| Cuello femoral | 4,5 | 0,5 | 4,1 (3,6, 4,6) |
No se encontró evidencia de diferencias en los efectos de TYMLOS en la densidad mineral ósea (BMD) en los subgrupos definidos por edad, años desde la menopausia, raza, etnia, región geográfica, presencia o ausencia de fractura previa (vertebral, no vertebral) y BMD en el punto de partida.
Efecto en la Histología Ósea
Se obtuvieron muestras de biopsias óseas de 71 pacientes con osteoporosis después de 12 – 18 meses de tratamiento (36 en el grupo de TYMLOS y 35 en el grupo placebo). De las biopsias obtenidas, 55 fueron adecuadas para la evaluación cuantitativa de la histomorfometría (27 en el grupo de TYMLOS y 28 en el grupo placebo). La evaluación cualitativa y cuantitativa de la histología mostró una arquitectura ósea normal y no hubo evidencia de hueso tejido, fibrosis de la médula ósea o defectos de mineralización.
14.2 Hombres con osteoporosis
La eficacia de TYMLOS para el tratamiento de hombres con osteoporosis fue evaluada en el Estudio 019 (NCT 03512262), un ensayo clínico aleatorizado, multicéntrico, doble ciego, controlado por placebo de 12 meses en hombres de 42 a 85 años (edad media de 68) que fueron aleatorizados para recibir TYMLOS 80 mcg (N = 149) o placebo (N = 79) administrado por vía subcutánea una vez al día. Aproximadamente el 95% de los pacientes eran caucásicos, el 4% eran asiáticos y <1% (0,4%) eran negros; el 16% eran hispanos. En el punto de partida, las puntuaciones T medias eran -2,1 en la columna lumbar, -2,1 en el cuello femoral y -1,7 en la cadera total. Los pacientes tomaron calcio suplementario diario (500 a 1000 mg) y vitamina D (400 a 800 UI).
Efecto en la densidad mineral ósea (BMD)
El punto final primario era el porcentaje de cambio desde el punto de partida en la BMD de la columna lumbar a los 12 meses en pacientes tratados con TYMLOS en comparación con el placebo. El tratamiento con TYMLOS durante 12 meses en el Estudio 019 resultó en aumentos significativos en la BMD en comparación con el placebo en la columna lumbar, la cadera total y el cuello femoral, cada uno con p < 0.0001 (Tabla 5).
| TYMLOS (N = 149*) (%) |
Placebo (N = 79*) (%) |
Diferencia de tratamiento (%) (IC 99% †) |
|
|---|---|---|---|
| 12 meses | |||
| Columna lumbar | 8,5 | 1,2 | 7,3 (5,1, 9,6) |
| Cadera total | 2,1 | <0,1 | 2,1 (1,0, 3,2) |
| Cuello femoral | 3,0 | 0,2 | 2,8 (1,4, 4,2) |
No se encontró evidencia de diferencias en los efectos de TYMLOS en la BMD en el Mes 12 en todos los subgrupos definidos por edad, raza, etnia, región geográfica, presencia o ausencia de fractura previa y BMD en el punto de partida.
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
16.1 Cómo se suministra
La inyección de TYMLOS (abaloparatida) es una solución clara e incolora, disponible como un bolígrafo desechable precargado de uso individual para un paciente (NDC 70539-001-01) empaquetado en una caja de cartón (NDC 70539-001-02) con las Instrucciones de Uso y Guía de Medicación. Cada bolígrafo desechable contiene un cartucho de vidrio que contiene 3120 mcg de abaloparatida en 1.56 mL (2000 mcg/mL). Cada bolígrafo proporciona un suministro de 30 días para inyección una vez al día de 80 mcg de abaloparatida en 40 mcL.
Las agujas estériles no están incluidas.
16.2 Almacenamiento y manipulación
- Antes del primer uso, almacenar TYMLOS en refrigeración entre 2°C y 8°C (36°F y 46°F).
- Después del primer uso, almacenar durante hasta 30 días a 20°C a 25°C (68°F a 77°F).
- No congelar ni exponer al calor.
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente que lea el etiquetado del paciente aprobado por la FDA (Guía de medicamentos e Instrucciones de uso).
Riesgo de osteosarcoma
Avise a los pacientes que el ingrediente activo en TYMLOS, abaloparatide, causó un aumento dependiente de la dosis en la incidencia de osteosarcoma en ratas machos y hembras y que se desconoce si TYMLOS causará osteosarcoma en humanos [ver Advertencias y precauciones (5.1)].
Instruya a los pacientes para que informen de inmediato los signos y síntomas de un posible osteosarcoma, como dolor localizado persistente o la aparición de una nueva masa de tejido blando que es sensible a la palpación.
Hipercalcemia
Avise a los pacientes que TYMLOS puede causar hipercalcemia y discuta los síntomas de la hipercalcemia (por ejemplo, náuseas, vómitos, estreñimiento, letargo, debilidad muscular) [ver Advertencias y precauciones (5.3)].
Instruya a los pacientes para que informen de inmediato los signos y síntomas de hipercalcemia.
Hipotensión ortostática
Avise a los pacientes que se sienten o se acuesten si se sienten mareados o tienen palpitaciones después de la inyección hasta que sus síntomas desaparezcan. Si estos síntomas persisten o empeoran, aconseje a los pacientes que consulten a su proveedor de atención médica antes de continuar el tratamiento [ver Dosificación y administración (2.2)].
Reacciones de hipersensibilidad
Avise a los pacientes que busquen atención médica inmediata si experimentan signos o síntomas de una reacción de hipersensibilidad, incluida la anafilaxis, la disnea o la urticaria [ver Contraindicaciones (4) y Reacciones adversas (6.2)].
Uso de TYMLOS Pen
Instruya a los pacientes y cuidadores que administran TYMLOS sobre cómo usar correctamente el bolígrafo TYMLOS y seguir las recomendaciones de eliminación de objetos punzantes [ver Dosificación y administración (2.2)]. Avise a los pacientes que no compartan su bolígrafo TYMLOS o agujas con otros pacientes y que no transfieran el contenido del bolígrafo a una jeringa.
Avise a los pacientes que cada bolígrafo TYMLOS se puede usar hasta por 30 días y, después del período de uso de 30 días, deseche el bolígrafo TYMLOS, incluso si aún contiene solución no utilizada [ver Cómo se suministra / Almacenamiento y manipulación (16.2)].
Fabricado para:
Radius Health, Inc.
22 Boston Wharf Road, 7th Floor
Boston, MA 02210
TYMLOS es una marca registrada de Radius Health, Inc.
Copyright © 2023, Radius Health, Inc. Todos los derechos reservados.
Revisado: Diciembre 2023
US-PI-000001-v10.0
Guía de medicación
| GUÍA DEL MEDICAMENTO TYMLOS® (tim lows’) (abaloparatide) inyección, para uso subcutáneo |
||
|
¿Cuál es la información más importante que debo saber sobre TYMLOS? TYMLOS puede causar efectos secundarios graves, que incluyen:
|
||
| ¿Qué es TYMLOS?
TYMLOS es un medicamento recetado que se usa para:
No se sabe si TYMLOS es seguro y eficaz para niños de 18 años o menos. TYMLOS no debe usarse en niños y adultos jóvenes cuyos huesos aún están creciendo. |
||
No tome TYMLOS:
|
||
Antes de tomar TYMLOS, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si usted:
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos a base de hierbas. |
||
¿Cómo debo usar TYMLOS?
|
||
| ¿Cuáles son los posibles efectos secundarios de TYMLOS?
TYMLOS puede provocar efectos secundarios graves, incluidos:
Los efectos secundarios más comunes de TYMLOS en mujeres con osteoporosis posmenopáusica incluyen: |
||
|
|
|
|
|
|
|
||
|
Los efectos secundarios más comunes de TYMLOS en hombres con osteoporosis incluyen: |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Estos no son todos los posibles efectos secundarios de TYMLOS. Llame a su médico para recibir asesoramiento médico sobre los efectos secundarios. Puede reportar los efectos secundarios a la FDA al 1-800-FDA-1088. |
||
¿Cómo debo almacenar TYMLOS?
Mantenga TYMLOS y todos los medicamentos fuera del alcance de los niños. |
||
| Información general sobre el uso seguro y eficaz de TYMLOS. Los medicamentos a veces se recetan para fines diferentes a los indicados en una Guía de Medicamentos. No use TYMLOS para una condición para la que no se haya prescrito. No le dé TYMLOS a otras personas, incluso si tienen la misma condición que usted. Puede hacerles daño. Puede pedirle a su farmacéutico o proveedor de atención médica información sobre TYMLOS escrita para profesionales de la salud. |
||
| ¿Cuáles son los ingredientes de TYMLOS? Ingrediente activo: abaloparatida Ingredientes inactivos: ácido acético, fenol, acetato de sodio trihidrato y agua para inyección. |
||
|
Radius Health, Inc., 22 Boston Wharf Road, 7th Floor, Boston, MA 02210 TYMLOS es una marca registrada de Radius Health, Inc. US-MG-000001 v8.0 Copyright © 2023, Radius Health, Inc. Todos los derechos reservados. Para más información sobre TYMLOS, visite nuestro sitio web en www.TYMLOS.com o llame a Radius Health, Inc., al 1-855-672-3487. |
||
| Esta Guía de Medicamentos ha sido aprobada por la Administración de Alimentos y Medicamentos de los EE. UU. | Revisado: 12/2023 | |
INSTRUCCIONES DE USO
INSTRUCCIONES DE USO
TYMLOS® (tim lows’)
(abaloparatide)
inyección, para uso subcutáneo
Instrucciones de uso
Lea y siga estas Instrucciones de uso para inyectar correctamente el bolígrafo TYMLOS. Llame a su proveedor de atención médica si tiene alguna pregunta sobre la forma correcta de inyectar el bolígrafo TYMLOS.
Información importante sobre su bolígrafo TYMLOS
- No intente inyectarse TYMLOS usted mismo hasta que usted o su cuidador reciban capacitación de un proveedor de atención médica sobre la forma correcta de usar el bolígrafo TYMLOS.
- No comparta su bolígrafo TYMLOS ni las agujas del bolígrafo con otras personas, incluso si se ha cambiado la aguja. Puede transmitir una infección grave a otras personas o contraer una infección grave de ellas.
- Cada bolígrafo TYMLOS es un bolígrafo precargado que contiene 30 dosis de TYMLOS. Cada dosis contendrá 80 mcg de TYMLOS. No tiene que medir su dosis. El bolígrafo mide cada dosis de TYMLOS por usted.
- Utilice una aguja nueva para cada inyección. Mantenga la tapa puesta en el bolígrafo TYMLOS cuando no lo esté usando.
- Antes de usar el bolígrafo, siempre revise la etiqueta para asegurarse de que es su bolígrafo TYMLOS.
- No utilice su bolígrafo TYMLOS si parece dañado. Si se le cae el bolígrafo TYMLOS o se daña, llame a su proveedor de atención médica o farmacéutico o llame al 1-855-672-3487.
- Para limpiar su bolígrafo TYMLOS, limpie el exterior del bolígrafo con un paño limpio y húmedo, si es necesario.
- No se recomienda el uso del bolígrafo TYMLOS para personas ciegas o con discapacidad visual sin la ayuda de una persona capacitada en la forma correcta de usar el bolígrafo.
Agujas del bolígrafo para usar con su bolígrafo TYMLOS
- Las agujas del bolígrafo no están incluidas con su bolígrafo TYMLOS. Necesitará una receta de su proveedor de atención médica para obtener agujas del bolígrafo en su farmacia.
- Las agujas correctas para usar con su bolígrafo TYMLOS son de 5 a 8 mm, de calibre 31. Las agujas compatibles incluyen Clickfine®, BD Ultra-Fine™, MedtFine®, Easy Comfort, Clever Choice™ Comfort EZ™ y SureComfort™. Si no está seguro de qué tipo de aguja usar, consulte a su proveedor de atención médica o farmacéutico.
Suministros que necesitará para cada inyección con su bolígrafo TYMLOS
- 1 bolígrafo TYMLOS
- 1 aguja del bolígrafo
- 1 torunda con alcohol
- 1 bola de algodón o gasa
- 1 contenedor de eliminación de objetos punzantes para agujas del bolígrafo y bolígrafos TYMLOS. Consulte “¿Cómo debo desechar (eliminar) las agujas del bolígrafo y los bolígrafos TYMLOS?” en la columna de la derecha.
¿Cómo debo almacenar el bolígrafo TYMLOS?
- Antes del primer uso, almacene los bolígrafos TYMLOS en el refrigerador entre 36°F y 46°F (2°C y 8°C).
- No almacene los bolígrafos con la aguja puesta.
- No congele el bolígrafo TYMLOS ni lo exponga al calor.
Durante 30 días de uso:
- Después del primer uso, almacene el bolígrafo TYMLOS hasta por 30 días a temperatura ambiente entre 68°F y 77°F (20°C y 25°C).
- Mantenga la tapa puesta en su bolígrafo TYMLOS al almacenarlo. No almacene el bolígrafo TYMLOS con la aguja puesta.
- Utilice su bolígrafo TYMLOS solo durante 30 días.
- Anote la fecha de su primer uso de TYMLOS aquí: _____/_____/_____. Deseche su bolígrafo TYMLOS 30 días después de abrirlo por primera vez, incluso si todavía contiene medicamento sin usar.
Mantenga el bolígrafo TYMLOS, las agujas del bolígrafo y todos los medicamentos fuera del alcance de los niños.

¿Cómo debo desechar (eliminar) las agujas del bolígrafo y los bolígrafos TYMLOS?
- Deseche (elimine) su bolígrafo TYMLOS, en un contenedor de eliminación de objetos punzantes aprobado por la FDA o un contenedor resistente a las perforaciones, 30 días después de abrirlo por primera vez, incluso si todavía contiene medicamento sin usar.
- Coloque las agujas del bolígrafo usadas en un contenedor de eliminación de objetos punzantes aprobado por la FDA inmediatamente después de su uso. No deseche (elimine) su contenedor de eliminación de objetos punzantes usados en la basura de su hogar.
- Si no tiene un contenedor de eliminación de objetos punzantes aprobado por la FDA, puede usar un contenedor doméstico que sea:
- hecho de plástico resistente,
- se puede cerrar con una tapa hermética y resistente a las perforaciones, sin que los objetos punzantes puedan salir,
- vertical y estable durante el uso,
- a prueba de fugas y correctamente etiquetado para advertir sobre los residuos peligrosos dentro del contenedor.
- Cuando su contenedor de eliminación de objetos punzantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de desechar su contenedor de eliminación de objetos punzantes. Puede haber leyes estatales o locales sobre cómo debe desechar las agujas, jeringas y jeringas precargadas usadas.
- Para obtener más información sobre la eliminación segura de objetos punzantes y para obtener información específica sobre la eliminación de objetos punzantes en el estado en el que vive, visite el sitio web de la FDA en: https://www.fda.gov/safesharpsdisposal.
- No deseche su contenedor de eliminación de objetos punzantes usado en la basura de su hogar a menos que las pautas de su comunidad lo permitan. No recicle su contenedor de eliminación de objetos punzantes usado.
Para obtener más información sobre el bolígrafo TYMLOS
Para obtener más información, visite www.TYMLOS.com o llame al 1-855-672-3487.
Fabricado para:
Radius
Radius Health, Inc.
22 Boston Wharf Road, 7th Floor
Boston, MA 02210
TYMLOS es una marca registrada de Radius Health, Inc.
US-IFU-000001-v8.0
Comience la inyección.
Revise el bolígrafo TYMLOS®
Paso 1. Lávese y séquese las manos.
Paso 2. Revise la fecha de caducidad (Exp.) en el bolígrafo TYMLOS.
- No utilice el bolígrafo si la fecha de caducidad ha pasado.
- Llame a su proveedor de atención médica o farmacéutico si la fecha de caducidad ha pasado.
Conecte la aguja del bolígrafo a su bolígrafo TYMLOS
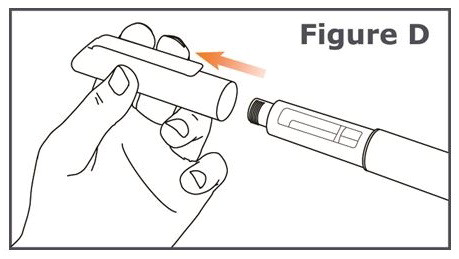
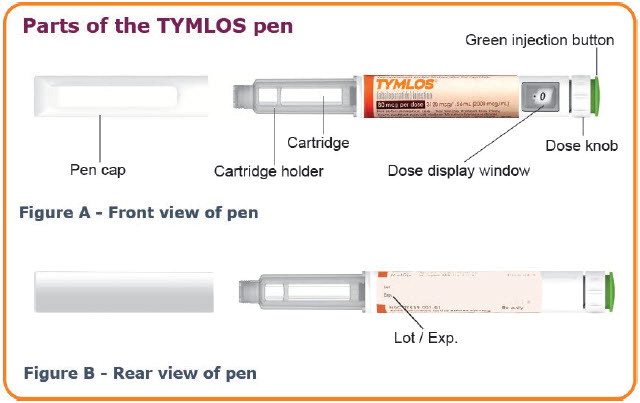
Paso 3. Retire la tapa del bolígrafo de su bolígrafo TYMLOS. (Vea Figura D.)
- Revise el cartucho de TYMLOS. El líquido debe ser transparente, incoloro y sin partículas; si no es así, no lo use.
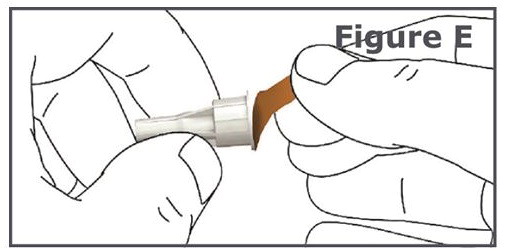
Paso 4. Retire el papel protector de la tapa exterior de la aguja de la pluma. (Vea Figura E.)
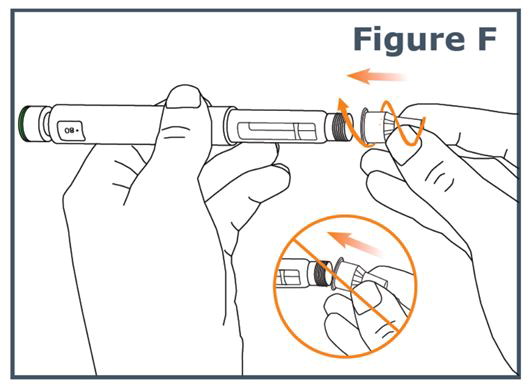
Paso 5. Mantenga la aguja recta y atorníllela en la pluma hasta que quede fija; se garantiza un ajuste seguro incluso si no hay una parada notable. No apriete demasiado. (Vea Figura F.)
Paso 6. Retire la tapa exterior de la aguja de la pluma de la aguja y guárdela para usarla después de la inyección. (Vea Figura G.)
Paso 7. Retire con cuidado la tapa interior de la aguja de la pluma y deséchela. (Vea Figura H.)
Paso 8. Si está utilizando esta pluma por primera vez, vaya a la “Configuración de la nueva pluma – Solo día 1” para preparar (primar) su pluma.
- Si ya ha utilizado esta pluma antes, vaya al Paso 13 para los días 2 a 30.
Configuración de la nueva pluma – Solo día 1 (Preparando (primando) su pluma TYMLOS)

No repita la configuración de la nueva pluma en los días 2 a 30.
Paso 9. La “Configuración de la nueva pluma” elimina las burbujas de aire (prepara (prima) su pluma). Sólo necesita preparar (primar) su pluma en el Día 1 para cada pluma nueva. De lo contrario, desperdiciará el medicamento.
- Omitir los Pasos 10 a 12 en los días 2 a 30.
Paso 10. Gire el botón de dosis de su pluma TYMLOS lejos de usted (en el sentido de las agujas del reloj) hasta que se detenga. (Vea Figura I.)
Nota: Verá ” • 80 ” alineado en la ventana de visualización de la dosis.
Paso 11. Sostenga la pluma TYMLOS con la aguja de la pluma apuntando hacia arriba. Golpee ligeramente con el dedo en el soporte de la cartuchera para mover las burbujas de aire en la cartuchera hacia la parte superior de la cartuchera. (Vea Figura J.)
Nota: Haga el Paso 11 incluso si no ve burbujas de aire.
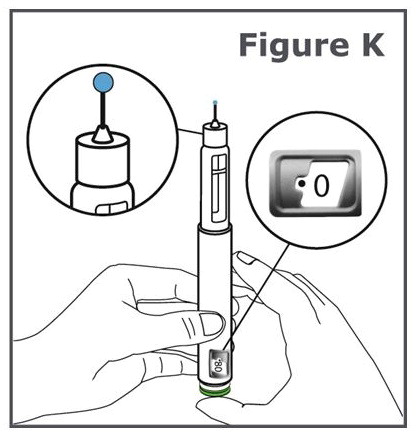
Paso 12. Presione el botón de inyección verde hasta que no pueda avanzar más. (Vea Figura K).
Nota: Debe ver que salga líquido de la punta de la aguja.
Nota: Verá “•0” alineado en la ventana de visualización de la dosis.
¿Qué debo hacer si no sale líquido de la punta de la aguja?
- Si no ve una gota de TYMLOS, repita los Pasos 10 a 12. Debe salir una gota de líquido de la punta de la aguja.
- Si aún no ve una gota de líquido, llame a su proveedor de atención médica o farmacéutico y utilice una pluma TYMLOS nueva.
- Cuando esté listo para utilizar su nueva pluma TYMLOS por primera vez, recuerde repetir todos los Pasos 9 a 12 para preparar (primar) su nueva pluma TYMLOS.
Establecer la dosis en su pluma TYMLOS
No presione el botón de inyección verde mientras establece su dosis.
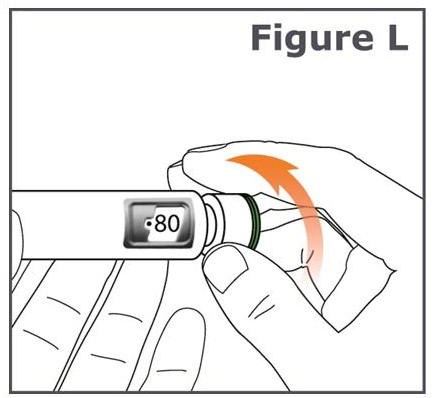
Paso 13. Gire el botón de dosis de su pluma lejos de usted (en el sentido de las agujas del reloj) hasta que el botón de dosis se detenga y “•80” esté alineado en la ventana de visualización de la dosis. (Vea Figura L.)
Si estableció la dosis antes de estar listo para administrar su inyección, gire el botón de dosis hacia usted (en sentido contrario a las agujas del reloj) hasta que “•0” esté en la ventana de visualización de la dosis.
Si no puede establecer la pluma TYMLOS en “•80”, deséche la pluma y utilice una pluma TYMLOS nueva para su inyección, repitiendo los Pasos 1 a 13.
- Si la pluma no puede ser establecida en “•80”, no hay suficiente medicamento en la pluma TYMLOS para su dosis completa. Vea “¿Cómo debo tirar (eliminar) las agujas y las plumas TYMLOS?” en el otro lado.
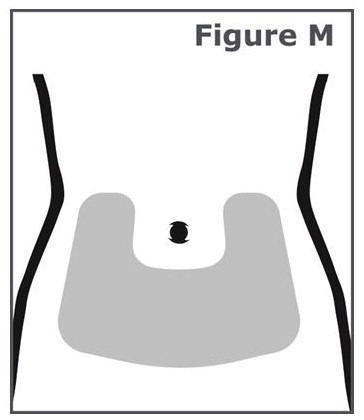
Elija y limpie el lugar de la inyección
Paso 14. Las inyecciones deben ser aplicadas en la zona inferior del estómago (abdomen). (Vea Figura M.) Evite el área de 2 pulgadas alrededor de su ombligo.
Para cada inyección, cambie (gire) el lugar de la inyección alrededor de su abdomen. Hable con su proveedor de atención médica sobre cómo cambiar (rotar) el lugar de la inyección para cada inyección. No utilice la misma zona de inyección para cada inyección. No inyecte en áreas donde la piel esté sensible, magullada, roja, escamosa o dura. Evite las áreas con cicatrices o estrías.
Paso 15. Limpie el lugar de la inyección con un paño con alcohol y deje que se seque. No toque, agite ni sople sobre el lugar de la inyección después de haberlo limpiado.
Administrando la inyección con su pluma TYMLOS
Lea el Paso 16 y el Paso 17 antes de administrar su inyección.
Inyecte su pluma TYMLOS de la manera que le haya mostrado su proveedor de atención médica.
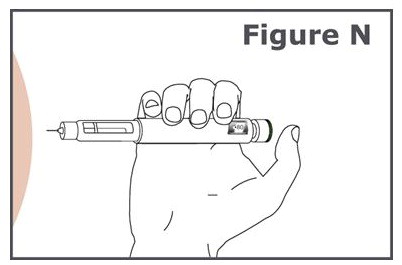
Paso 16. (Vea Figura N.)
- Sostenga la pluma de modo que pueda ver la ventana de visualización de la dosis durante la inyección.
- Inserte la aguja de la pluma directamente en su piel.
Paso 17. (Vea Figura O.)
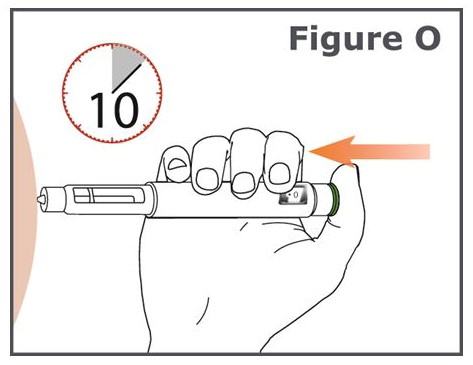
- Presione el botón de inyección verde hasta que no pueda avanzar más y “•0” esté en la ventana de visualización de la dosis. No mueva la pluma TYMLOS después de insertar la aguja.
- Continúe presionando el botón de inyección verde mientras cuenta hasta 10. Contando hasta 10 permitirá que se administre la dosis completa de TYMLOS.
Paso 18. Después de contar hasta 10, suelte su dedo del botón de inyección verde y retire lentamente la pluma TYMLOS del lugar de la inyección sacando la aguja de la pluma directamente hacia afuera.
Retire la aguja de la pluma
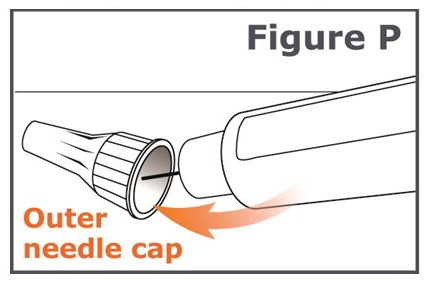
Paso 19. Coloque cuidadosamente la tapa de la aguja exterior en la aguja de la pluma. Presione sobre la tapa de la aguja exterior hasta que encaje y esté segura. (Vea Figura P.)
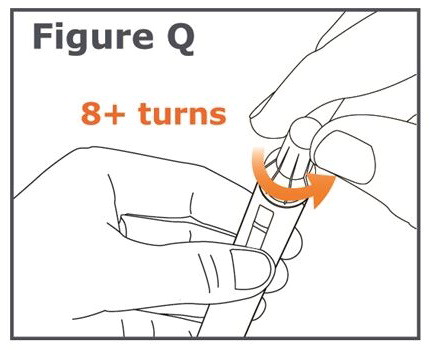
Advertencia: Para evitar lesiones por pinchazo de aguja, siga cuidadosamente el Paso 20.
Paso 20. Desenrosque la aguja con la tapa (como desenroscar una tapa de un frasco). Para desenroscar la aguja con la tapa puede que tenga que girarla 8 o más vueltas y luego tire suavemente hasta que la aguja con la tapa se desprenda. (Vea Figura Q.)
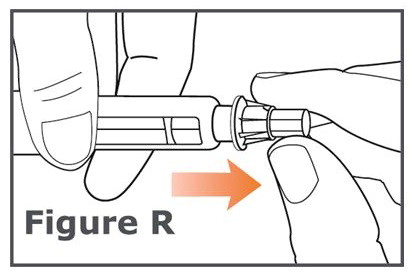
Nota: No presione sobre la tapa de la aguja exterior mientras desenrosca la aguja. Debe ver que se va ampliando el hueco entre la tapa de la aguja exterior y la pluma mientras desenrosca la aguja. (Vea Figura R.)
Reemplace la tapa de la pluma
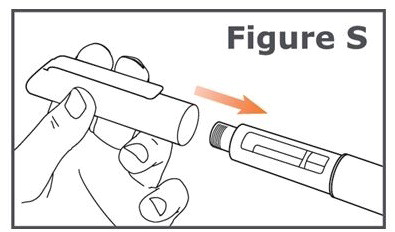
Paso 21. Reemplace firmemente la tapa de la pluma en la pluma TYMLOS. (Vea Figura S.)
Mantenga la tapa de la pluma en su pluma TYMLOS entre inyecciones.
Después de su inyección
Paso 22. Presione una bolita de algodón o una gasa sobre el lugar de la inyección y manténgala durante 10 segundos. No roce el lugar de la inyección. Puede tener un sangrado leve. Esto es normal.
Puede cubrir el lugar de la inyección con una pequeña venda adhesiva, si es necesario.
- Deshágase de la aguja de la pluma. Vea “¿Cómo debo tirar (deshacerme) de las agujas de las plumas y las plumas TYMLOS?“.
Estas Instrucciones de Uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos.
Fecha de emisión: 04/2021
PANEL DE VISUALIZACIÓN PRINCIPAL – Etiqueta de pluma precargada de 80 mcg
NDC 70539-001-01
Rx only
Lea las Instrucciones de uso ANTES de inyectar.
Fecha de primer uso ________/________/________.
Deseche la porción no utilizada 30 días después de la primera apertura.
TYMLOS®
(abaloparatide) injection
80 mcg por dosis
3120 mcg/1.56 mL (2000 mcg/mL)
Para uso subcutáneo
Para uso exclusivo de un solo paciente
Cada pluma precargada administrará 30 dosis subcutáneas.
Antes del primer uso, conservar en nevera entre 2 °C y 8 °C (36 °F y 46 °F).
Después del primer uso, conservar hasta 30 días a una temperatura de 20 °C a 25 °C
(68 °F a 77 °F). No congelar ni exponer al calor.
Mfg. for: Radius Health, Inc.
Boston, MA 02210 USA
10006074-04
Lot:
Exp.:
PANEL DE EXHIBICIÓN PRINCIPAL – Etiqueta de cartón de 80 mcg
NDC 70539-001-02
TYMLOS®
(abaloparatide) inyección
80 mcg por dosis
3120 mcg/1.56 mL (2000 mcg/mL)
Para uso subcutáneo
Para uso en un solo paciente
Rx solamente
Estéril
1 pluma precargada
Agujas no incluidas
Cada pluma precargada administrará
30 dosis subcutáneas.
Entregue la Guía de medicamentos
e Instrucciones de uso
adjuntas a cada paciente.
PANEL DE EXHIBICIÓN PRINCIPAL – Muestra de 80 mcg Pluma precargada Etiqueta
NDC 70539-001-99
Solo con receta
Lea las instrucciones de uso ANTES de inyectar.
Fecha de primer uso ________/________/________.
Deseche la porción no utilizada 30 días después de la primera apertura.
TYMLOS®
(abaloparatida) inyección
EJEMPLO—NO PARA VENTA
80 mcg por dosis
3120 mcg/1.56 mL (2000 mcg/mL)
Para uso subcutáneo
Solo para uso de un paciente individual
Cada pluma precargada suministrará 30 dosis subcutáneas.
Antes del primer uso, guárdela en el refrigerador a 2°C – 8°C (36°F – 46°F).
Después del primer uso, almacénela hasta 30 días a 20°C – 25°C
(68°F – 77°F). No congele ni exponga al calor.
Fabricado para: Radius Health, Inc.
Boston, MA 02210 EE.UU.
10006645-04
Lote:
Caducidad:
PANEL DE MONITORIO PRINCIPAL – Etiqueta del Cartón de Muestra 80 mcg
NDC 70539-001-98
TYMLOS®
(abaloparatide) inyección
80 mcg por dosis
3120 mcg/1.56 mL (2000 mcg/mL)
Para uso subcutáneo
Solo para uso en un solo paciente
Estéril
Rx solamente
MUESTRA—NO PARA LA VENTA
1 pluma precargada
Agujas no incluidas
Cada pluma precargada administrará
30 dosis subcutáneas.
Entregue la Guía de medicamentos
y las Instrucciones de uso
adjuntas a cada paciente.