Fabricante de medicamentos: Eli Lilly and Company (Updated: 2021-03-11)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
EMGALITY (galcanezumab-gnlm) inyección, para uso subcutáneo
Aprobación inicial en EE. UU.: 2018
INDICACIONES Y USO
DOSIFICACIÓN Y ADMINISTRACIÓN
- Solo para uso subcutáneo. (2.1, 2.2, 2.3)
- Dosis recomendada para la migraña: dosis de carga de 240 mg (administrada como dos inyecciones consecutivas de 120 mg cada una), seguida de dosis mensuales de 120 mg. (2.1)
- Dosis recomendada para la cefalea en racimos episódica: 300 mg (administrada como tres inyecciones consecutivas de 100 mg cada una) al inicio del período de racimos, y luego mensualmente hasta el final del período de racimos. (2.2)
- Administrar en el abdomen, muslo, parte posterior de la parte superior del brazo o glúteos por vía subcutánea. (2.3)
FORMAS Y FUERZAS DE DOSIFICACIÓN
CONTRAINDICACIONES
EMGALITY está contraindicado en pacientes con hipersensibilidad grave a galcanezumab-gnlm o a cualquiera de los excipientes. (4)
ADVERTENCIAS Y PRECAUCIONES
Reacciones de hipersensibilidad: si se produce una reacción de hipersensibilidad grave, suspenda la administración de EMGALITY e inicie la terapia adecuada. Las reacciones de hipersensibilidad pueden ocurrir días después de la administración y pueden ser prolongadas. (5.1)
REACCIONES ADVERSAS
Las reacciones adversas más comunes (incidencia ≥2% y al menos 2% mayor que el placebo) en los estudios clínicos de EMGALITY fueron reacciones en el sitio de inyección. (6.1)
Para informar sobre REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Eli Lilly and Company al 1-800-LillyRx (1-800-545-5979) o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
Ver 17 para INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y etiquetado del paciente aprobado por la FDA.
Revisado: 3/2021
Tabla de Contenido
FULL PRESCRIBING INFORMATION: CONTENTS*
1 INDICACIONES Y USO
1.1 Migraña
1.2 Cefalea en Racimos Episódica
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosificación Recomendada para la Migraña
2.2 Dosificación Recomendada para la Cefalea en Racimos Episódica
2.3 Instrucciones Importantes de Administración
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de Hipersensibilidad
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Inmunogenicidad
6.3 Experiencia Postcomercialización
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Migraña
14.2 Cefalea en Racimos Episódica
16 CÓMO SUMINISTRARLO/ALMACENAMIENTO Y MANIPULACIÓN
16.1 Cómo Suministrarlo
16.2 Almacenamiento y Manipulación
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información de prescripción completa no se enumeran.
1 INDICACIONES Y USO
1.2 Cefalea en racimos episódica
EMGALITY está indicado para el tratamiento de la cefalea en racimos episódica en adultos.
2 DOSIS Y ADMINISTRACIÓN
2.1 Dosis recomendada para la migraña
La dosis recomendada de EMGALITY es de 240 mg (dos inyecciones subcutáneas consecutivas de 120 mg cada una) una vez como dosis de carga, seguida de dosis mensuales de 120 mg inyectadas por vía subcutánea.
Si se olvida una dosis de EMGALITY, administre la dosis lo antes posible. A partir de entonces, EMGALITY se puede programar mensualmente a partir de la fecha de la última dosis.
2.2 Dosis recomendada para la cefalea en racimos episódica
La dosis recomendada de EMGALITY es de 300 mg (tres inyecciones subcutáneas consecutivas de 100 mg cada una) al inicio del período de racimos, y luego mensualmente hasta el final del período de racimos.
Si se olvida una dosis de EMGALITY durante un período de racimos, administre la dosis lo antes posible. A partir de entonces, EMGALITY se puede programar mensualmente a partir de la fecha de la última dosis hasta el final del período de racimos.
2.3 Instrucciones importantes de administración
EMGALITY es solo para uso subcutáneo.
EMGALITY está destinado a la autoadministración del paciente. Antes de su uso, proporcione una capacitación adecuada a los pacientes y/o cuidadores sobre cómo preparar y administrar EMGALITY utilizando la pluma precargada de dosis única o la jeringa precargada de dosis única, incluida la técnica aséptica [consulte Presentación/Conservación y manipulación (16.2) e Instrucciones de uso]:
- Proteja EMGALITY de la luz solar directa.
- Antes de la administración subcutánea, deje que EMGALITY repose a temperatura ambiente durante 30 minutos. No caliente utilizando una fuente de calor como agua caliente o un microondas.
- No agite el producto.
- Inspeccione visualmente EMGALITY en busca de partículas y decoloración antes de la administración, siempre que la solución y el contenedor lo permitan [consulte Formas farmacéuticas y concentraciones (3) y Presentación/Conservación y manipulación (16.1)]. No utilice EMGALITY si está turbio o si hay partículas visibles.
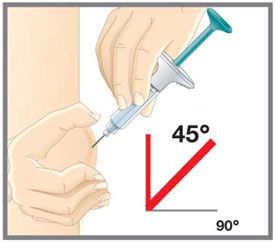
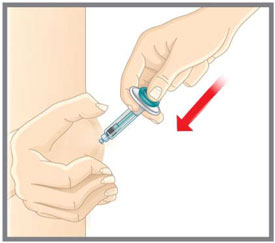
- Administre EMGALITY en el abdomen, el muslo, la parte posterior de la parte superior del brazo o las nalgas por vía subcutánea. No inyecte en áreas donde la piel esté sensible, magullada, roja o dura.
- Tanto la pluma precargada como la jeringa precargada son de dosis única y administran todo el contenido.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
EMGALITY es una solución estéril de transparente a opalescente, de incoloro a ligeramente amarillo a ligeramente marrón disponible de la siguiente manera:
- Inyección: 120 mg/mL en una pluma precargada de dosis única
- Inyección: 120 mg/mL en una jeringa precargada de dosis única
- Inyección: 100 mg/mL en una jeringa precargada de dosis única
4 CONTRAINDICACIONES
EMGALITY está contraindicado en pacientes con hipersensibilidad grave a galcanezumab-gnlm o a cualquiera de los excipientes [ver Advertencias y precauciones (5.1)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de hipersensibilidad
Se han producido reacciones de hipersensibilidad, incluyendo disnea, urticaria y erupción cutánea, con EMGALITY en estudios clínicos y en el entorno postcomercialización. También se han notificado casos de anafilaxia y angioedema en el entorno postcomercialización. Si se produce una reacción de hipersensibilidad grave o severa, suspenda la administración de EMGALITY e inicie la terapia adecuada [ver Contraindicaciones (4), Reacciones adversas (6.1), e Información para el paciente (17)]. Las reacciones de hipersensibilidad pueden ocurrir días después de la administración y pueden ser prolongadas.
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas clínicamente significativas se describen en otra parte de la etiqueta:
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica clínica.
Migraña
La seguridad de EMGALITY se ha evaluado en 2586 pacientes con migraña que recibieron al menos una dosis de EMGALITY, lo que representa 1487 años-paciente de exposición. De estos, 1920 pacientes estuvieron expuestos a EMGALITY una vez al mes durante al menos 6 meses, y 526 pacientes estuvieron expuestos durante 12 meses.
En estudios clínicos controlados con placebo (Estudios 1, 2 y 3), 705 pacientes recibieron al menos una dosis de EMGALITY 120 mg una vez al mes, y 1451 pacientes recibieron placebo, durante 3 meses o 6 meses de tratamiento doble ciego [ver Estudios clínicos (14.1)]. De los pacientes tratados con EMGALITY, aproximadamente el 85% eran mujeres, el 77% eran blancos y la edad media era de 41 años al inicio del estudio.
La reacción adversa más común fueron las reacciones en el lugar de la inyección. En los Estudios 1, 2 y 3, el 1,8% de los pacientes interrumpieron el tratamiento doble ciego debido a eventos adversos. Tabla 1 resume las reacciones adversas que ocurrieron hasta 6 meses después del tratamiento en los estudios de migraña.
|
a Las reacciones en el lugar de la inyección incluyen múltiples términos de eventos adversos relacionados, como dolor en el lugar de la inyección, reacción en el lugar de la inyección, eritema en el lugar de la inyección y prurito en el lugar de la inyección. |
||
|
Reacción adversa |
EMGALITY 120 mg Mensual (N=705) % |
Placebo Mensual (N=1451) % |
| Reacciones en el lugar de la inyeccióna | 18 | 13 |
Cefalea en racimos episódica
EMGALITY se estudió durante un máximo de 2 meses en un ensayo controlado con placebo en pacientes con cefalea en racimos episódica (Estudio 4) [ver Estudios clínicos (14.2)]. Se estudió un total de 106 pacientes (49 con EMGALITY y 57 con placebo). De los pacientes tratados con EMGALITY, aproximadamente el 84% eran hombres, el 88% eran blancos y la edad media era de 47 años al inicio del estudio. Dos pacientes tratados con EMGALITY interrumpieron el tratamiento doble ciego debido a eventos adversos.
En general, el perfil de seguridad observado en pacientes con cefalea en racimos episódica tratados con EMGALITY 300 mg mensuales es consistente con el perfil de seguridad en pacientes con migraña.
6.2 Inmunogenicidad
Como ocurre con todas las proteínas terapéuticas, existe la posibilidad de inmunogenicidad. La detección de la formación de anticuerpos depende en gran medida de la sensibilidad y la especificidad del ensayo. Además, la incidencia observada de positividad de anticuerpos (incluidos los anticuerpos neutralizantes) en un ensayo puede verse influenciada por varios factores, incluida la metodología del ensayo, el manejo de las muestras, el momento de la recolección de las muestras, los medicamentos concomitantes y la enfermedad subyacente.
Por estas razones, la comparación de la incidencia de anticuerpos contra galcanezumab-gnlm en los estudios descritos a continuación con la incidencia de anticuerpos en otros estudios o con otros productos puede ser engañosa.
La inmunogenicidad de EMGALITY se ha evaluado utilizando un inmunoensayo in vitro para la detección de anticuerpos de unión anti-galcanezumab-gnlm. Para los pacientes cuyas sueros dieron positivo en el inmunoensayo de detección, se realizó un inmunoensayo de unión a ligando in vitro para detectar anticuerpos neutralizantes.
En estudios controlados con EMGALITY hasta 6 meses (Estudio 1, Estudio 2 y Estudio 3), la incidencia de desarrollo de anticuerpos anti-galcanezumab-gnlm fue del 4,8% (33/688) en pacientes que recibieron EMGALITY una vez al mes (32 de los 33 de los cuales tenían actividad neutralizante in vitro). Con 12 meses de tratamiento en un estudio abierto, hasta el 12,5% (16/128) de los pacientes tratados con EMGALITY desarrollaron anticuerpos anti-galcanezumab-gnlm, la mayoría de los cuales dieron positivo para anticuerpos neutralizantes.
Aunque no se encontró que el desarrollo de anticuerpos anti-galcanezumab-gnlm afectara la farmacocinética, la seguridad o la eficacia de EMGALITY en estos pacientes, los datos disponibles son demasiado limitados para sacar conclusiones definitivas.
6.3 Experiencia postcomercialización
Las siguientes reacciones adversas se han identificado durante el uso posterior a la aprobación de EMGALITY. Debido a que estas reacciones se informan voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición a EMGALITY.
Trastornos del sistema inmunitario— Anafilaxia, angioedema [ver Contraindicaciones (4) y Advertencias y precauciones (5.1)].
Trastornos de la piel y del tejido subcutáneo— Erupción cutánea.
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Registro de exposición durante el embarazo
Existe un registro de exposición durante el embarazo que monitorea los resultados del embarazo en mujeres expuestas a EMGALITY durante este periodo. Se recomienda a los profesionales de la salud que registren a las pacientes embarazadas, o las mujeres embarazadas pueden inscribirse en el registro llamando al 1-833-464-4724 o comunicándose con la compañía a través de www.migrainepregnancyregistry.com.
Resumen de riesgos
No existen datos suficientes sobre el riesgo para el desarrollo asociado con el uso de EMGALITY en mujeres embarazadas. La administración de galcanezumab-gnlm a ratas y conejas durante el periodo de organogénesis o a ratas durante el embarazo y la lactancia a exposiciones plasmáticas mayores que las esperadas clínicamente no produjo efectos adversos en el desarrollo (ver Datos en animales).
En la población general de los EE. UU., el riesgo estimado de defectos de nacimiento importantes y aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente. La tasa estimada de defectos de nacimiento importantes (2.2% – 2.9%) y aborto espontáneo (17%) entre los partos de mujeres con migraña es similar a las tasas reportadas en mujeres sin migraña.
Datos
Datos en animales
Cuando se administró galcanezumab-gnlm a ratas hembra mediante inyección subcutánea en dos estudios (0, 30 o 100 mg/kg; 0 o 250 mg/kg) antes y durante el apareamiento y continuando durante toda la organogénesis, no se observaron efectos adversos sobre el desarrollo embriofetal. La dosis más alta probada (250 mg/kg) se asoció con una exposición plasmática (Cpromedio, ee) 38 o 18 veces mayor que en humanos a la dosis humana recomendada (DHR) para la migraña (120 mg) o la cefalea en racimos episódica (300 mg), respectivamente. La administración de galcanezumab-gnlm (0, 30 o 100 mg/kg) mediante inyección subcutánea a conejas preñadas durante el periodo de organogénesis no produjo efectos adversos en el desarrollo embriofetal. La dosis más alta probada se asoció con una Cpromedio, ee plasmática 64 o 29 veces mayor que en humanos a 120 mg o 300 mg, respectivamente.
La administración de galcanezumab-gnlm (0, 30 o 250 mg/kg) mediante inyección subcutánea a ratas durante el embarazo y la lactancia no produjo efectos adversos en el desarrollo pre y posnatal. La dosis más alta probada se asoció con una Cpromedio, ee plasmática 34 o 16 veces mayor que en humanos a 120 mg o 300 mg, respectivamente.
8.2 Lactancia
Resumen de riesgos
No hay datos sobre la presencia de galcanezumab-gnlm en la leche humana, los efectos en el lactante o los efectos en la producción de leche. Se deben considerar los beneficios del desarrollo y la salud de la lactancia materna junto con la necesidad clínica de la madre de EMGALITY y cualquier posible efecto adverso en el lactante por EMGALITY o por la condición materna subyacente.
8.5 Uso geriátrico
Los estudios clínicos de EMGALITY no incluyeron un número suficiente de pacientes de 65 años o más para determinar si responden de manera diferente a los pacientes más jóvenes.
11 DESCRIPCIÓN
Galcanezumab-gnlm es un anticuerpo monoclonal IgG4 humanizado específico para el ligando del péptido relacionado con el gen de la calcitonina (CGRP). Galcanezumab-gnlm se produce en células ováricas de hámster chino (CHO) mediante tecnología de ADN recombinante. Galcanezumab-gnlm está compuesto por dos cadenas ligeras idénticas de inmunoglobulina kappa y dos cadenas pesadas idénticas de inmunoglobulina gamma y tiene un peso molecular total de aproximadamente 147 kDa.
EMGALITY (galcanezumab-gnlm) inyección es una solución estéril, sin conservantes, transparente a opalescente e incolora a ligeramente amarilla a ligeramente marrón, para uso subcutáneo. EMGALITY se suministra en una pluma precargada de dosis única de 1 mL para administrar 120 mg de galcanezumab-gnlm o una jeringa precargada de dosis única de 1 mL para administrar 100 mg o 120 mg de galcanezumab-gnlm. Cada mL de solución contiene 100 mg o 120 mg de galcanezumab-gnlm; L-histidina (0.5 mg); L-histidina clorhidrato monohidratado (1.5 mg); Polisorbato 80 (0.5 mg); Cloruro de sodio (8.8 mg); Agua para inyección, USP. El rango de pH es de 5.3 – 6.3.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Galcanezumab-gnlm es un anticuerpo monoclonal humanizado que se une al ligando del péptido relacionado con el gen de la calcitonina (CGRP) y bloquea su unión al receptor.
12.2 Farmacodinamia
No hay datos relevantes sobre los efectos farmacodinámicos de galcanezumab-gnlm.
12.3 Farmacocinética
Galcanezumab-gnlm exhibe una farmacocinética lineal y la exposición aumenta proporcionalmente con las dosis entre 1 y 600 mg.
Una dosis de carga de 240 mg logró la concentración sérica de galcanezumab-gnlm en estado estacionario después de la primera dosis. Una dosis de 300 mg mensuales alcanzaría la concentración en estado estacionario después de la cuarta dosis. El tiempo para alcanzar la concentración máxima es de 5 días, y la vida media de eliminación es de 27 días.
No hubo diferencia en los parámetros farmacocinéticos entre voluntarios sanos, pacientes con migraña episódica o crónica y pacientes con cefalea en racimos episódica.
Absorción
Después de una dosis subcutánea de galcanezumab-gnlm, el tiempo para alcanzar la concentración máxima fue de aproximadamente 5 días.
La ubicación del sitio de inyección no influyó significativamente en la absorción de galcanezumab-gnlm.
Distribución
El volumen aparente de distribución (V/F) de galcanezumab-gnlm fue de 7.3 L (34% de variabilidad interindividual [IIV]).
Metabolismo y eliminación
Se espera que galcanezumab-gnlm se degrade en pequeños péptidos y aminoácidos a través de vías catabólicas de la misma manera que la IgG endógena.
El aclaramiento aparente (CL/F) de galcanezumab-gnlm fue de 0.008 L/h y la vida media de eliminación de galcanezumab fue de aproximadamente 27 días.
Poblaciones específicas
Edad, sexo, peso, raza, etnia
La farmacocinética de galcanezumab-gnlm no se vio afectada por la edad, el sexo, la raza, los subtipos del espectro de migraña (migraña episódica o crónica) o el diagnóstico de cefalea (migraña vs. cefalea en racimos episódica) según un análisis farmacocinético poblacional. El peso corporal no tiene un efecto clínicamente relevante en la farmacocinética de galcanezumab-gnlm.
Pacientes con insuficiencia renal o hepática
No se espera que la insuficiencia renal y hepática afecten la farmacocinética de galcanezumab-gnlm. El análisis farmacocinético poblacional de datos integrados de los estudios clínicos de galcanezumab-gnlm reveló que el aclaramiento de creatinina no afectó la farmacocinética de galcanezumab-gnlm en pacientes con insuficiencia renal leve o moderada. No se han estudiado pacientes con insuficiencia renal grave (aclaramiento de creatinina <30 mL/min). Según un análisis de PK poblacional, la concentración de bilirrubina no influyó significativamente en el CL/F de galcanezumab-gnlm.
No se realizaron estudios clínicos dedicados para evaluar el efecto de la insuficiencia hepática o renal en la farmacocinética de galcanezumab-gnlm.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad
Deterioro de la fertilidad
Cuando se administró galcanezumab-gnlm (0, 30 o 250 mg/kg) a ratas macho mediante inyección subcutánea antes y durante el apareamiento, no se observaron efectos adversos sobre la fertilidad. La dosis más alta probada se asoció con una exposición plasmática (Cave, ss) 8 o 4 veces mayor que en humanos a la dosis humana recomendada (DHR) para la migraña (120 mg) o la cefalea en racimos episódica (300 mg), respectivamente. Cuando se administró galcanezumab-gnlm a ratas hembra mediante inyección subcutánea en dos estudios (0, 30 o 100 mg/kg; 0 o 250 mg/kg) antes y durante el apareamiento y continuando durante la organogénesis, no se observaron efectos adversos sobre la fertilidad. La dosis más alta probada (250 mg/kg) se asoció con una Cave, ss plasmática 38 o 18 veces mayor que en humanos a 120 mg o 300 mg, respectivamente.
14 ESTUDIOS CLÍNICOS
14.1 Migraña
La eficacia de EMGALITY se evaluó como tratamiento preventivo de la migraña episódica o crónica en tres estudios multicéntricos, aleatorizados, doble ciego y controlados con placebo: dos estudios de 6 meses en pacientes con migraña episódica (Estudios 1 y 2) y un estudio de 3 meses en pacientes con migraña crónica (Estudio 3).
Migraña episódica
El Estudio 1 (NCT02614183) y el Estudio 2 (NCT02614196) incluyeron adultos con antecedentes de migraña episódica (de 4 a 14 días de migraña por mes). Todos los pacientes fueron aleatorizados en una proporción de 1:1:2 para recibir inyecciones subcutáneas mensuales de EMGALITY 120 mg, EMGALITY 240 mg o placebo. Todos los pacientes del grupo de EMGALITY 120 mg recibieron una dosis de carga inicial de 240 mg. Los pacientes pudieron usar tratamientos para el dolor de cabeza agudo, incluidos medicamentos específicos para la migraña (es decir, triptanes, derivados de la ergotamina), AINE y acetaminofén durante el estudio.
Los estudios excluyeron a los pacientes que estaban en cualquier otro tratamiento preventivo para la migraña, los pacientes con dolor de cabeza por abuso de medicamentos, los pacientes con anomalías en el ECG compatibles con un evento cardiovascular agudo y los pacientes con antecedentes de accidente cerebrovascular, infarto de miocardio, angina inestable, intervención coronaria percutánea, injerto de derivación de la arteria coronaria, trombosis venosa profunda o embolia pulmonar dentro de los 6 meses de la selección.
El criterio de valoración principal de eficacia para los Estudios 1 y 2 fue el cambio medio desde el inicio en el número de días de dolor de cabeza por migraña mensuales durante el período de tratamiento de 6 meses. Los criterios de valoración secundarios clave incluyeron las tasas de respuesta (los porcentajes medios de pacientes que alcanzaron al menos una reducción del 50%, 75% y 100% desde el inicio en el número de días de dolor de cabeza por migraña mensuales durante el período de tratamiento de 6 meses), el cambio medio desde el inicio en el número de días de dolor de cabeza por migraña mensuales con el uso de cualquier medicamento para el dolor de cabeza agudo durante el período de tratamiento de 6 meses, y el impacto de la migraña en las actividades diarias, según lo evaluado por el cambio medio desde el inicio en la puntuación media del dominio Función de rol restrictivo del Cuestionario específico de la migraña sobre la calidad de vida versión 2.1 (MSQ v2.1) durante los últimos 3 meses de tratamiento (meses 4 a 6). Las puntuaciones se escalan de 0 a 100, con puntuaciones más altas que indican un menor impacto de la migraña en las actividades diarias.
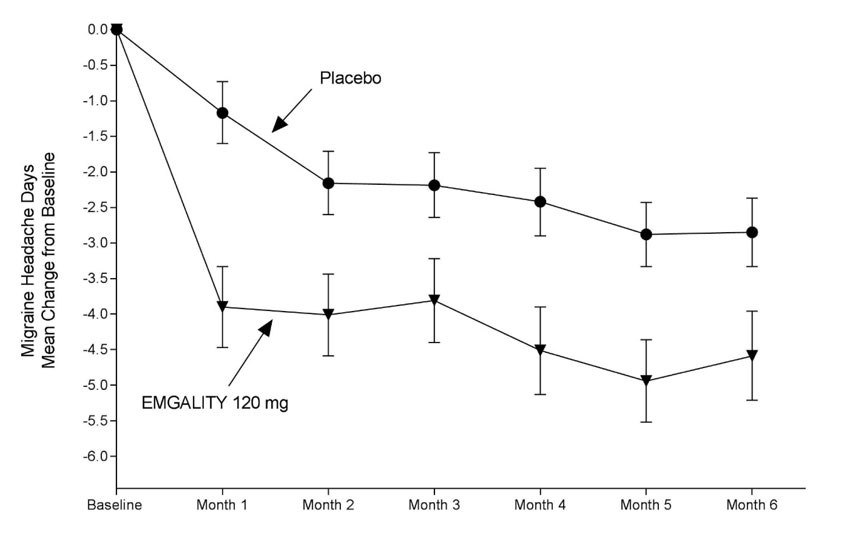
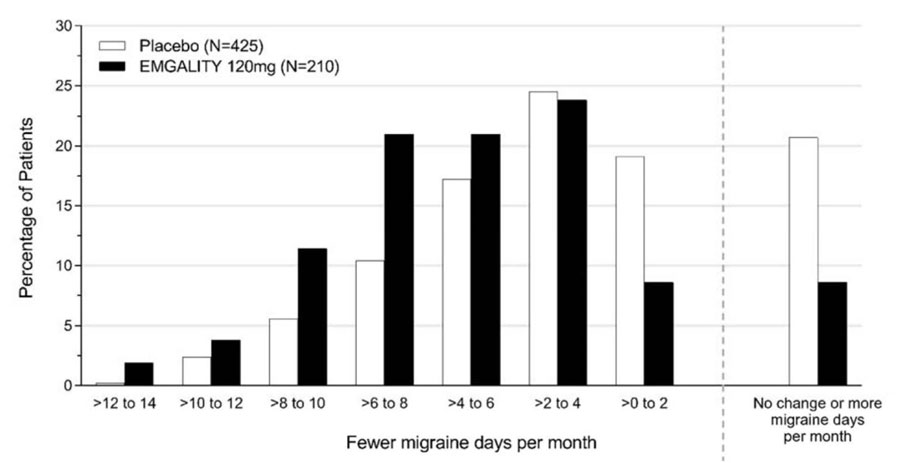
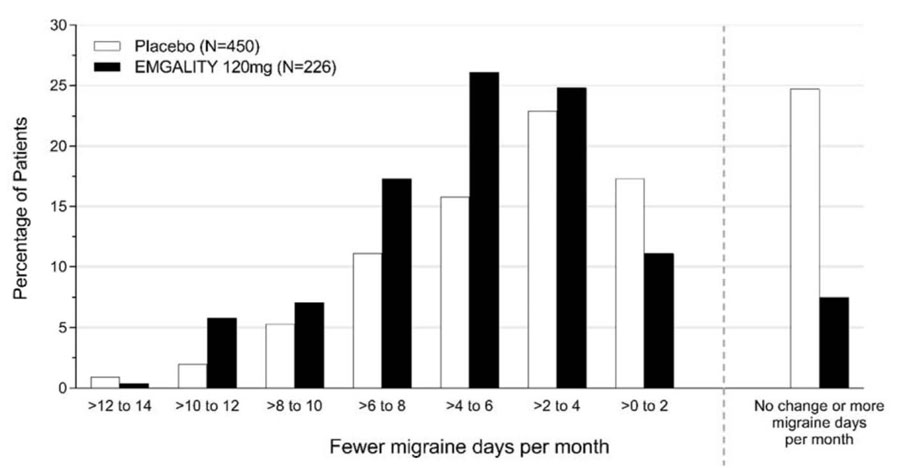
En el Estudio 1, se aleatorizaron un total de 858 pacientes (718 mujeres, 140 hombres) con edades comprendidas entre los 18 y los 65 años. Un total de 703 pacientes completaron la fase doble ciego de 6 meses. En el Estudio 2, se aleatorizaron un total de 915 pacientes (781 mujeres, 134 hombres) con edades comprendidas entre los 18 y los 65 años. Un total de 785 pacientes completaron la fase doble ciego de 6 meses. En el Estudio 1 y el Estudio 2, la frecuencia media de la migraña en el inicio fue de aproximadamente 9 días de migraña por mes, y fue similar en todos los grupos de tratamiento.
EMGALITY 120 mg demostró mejoras estadísticamente significativas para los criterios de valoración de eficacia en comparación con el placebo durante el período de 6 meses, como se resume en Tabla 2. El tratamiento con EMGALITY con la dosis de 240 mg una vez al mes no mostró ningún beneficio adicional sobre la dosis de EMGALITY 120 mg una vez al mes.
|
a p<0.001 |
||||
|
b N = 189 para EMGALITY 120 mg y N = 377 para placebo en el Estudio 1; N = 213 para EMGALITY 120 mg y N = 396 para placebo en el Estudio 2. |
||||
| Estudio 1 | Estudio 2 | |||
| EMGALITY 120 mg N = 210 |
Placebo
N = 425 |
EMGALITY 120 mg N = 226 |
Placebo
N = 450 |
|
| Días de dolor de cabeza por migraña mensuales (durante los meses 1 a 6) | ||||
| Días de dolor de cabeza por migraña en el inicio | 9.2 | 9.1 | 9.1 | 9.2 |
| Cambio medio desde el inicio | -4.7 | -2.8 | -4.3 | -2.3 |
| Diferencia con respecto al placeboa | -1.9 | -2.0 | ||
| ≥50% de los respondedores a los días de dolor de cabeza por migraña (durante los meses 1 a 6) | ||||
| % de respondedoresa | 62% | 39% | 59% | 36% |
| ≥75% de los respondedores a los días de dolor de cabeza por migraña (durante los meses 1 a 6) | ||||
| % de respondedoresa | 39% | 19% | 34% | 18% |
| 100% de los días con cefalea migrañosa que responden (durante los meses 1 a 6) | ||||
| % de respondedoresa | 16% | 6% | 12% | 6% |
| Días con cefalea migrañosa al mes en los que se tomó medicación aguda (durante los meses 1 a 6) | ||||
| Cambio medio desde el inicio (días)a | -4.0 | -2.2 | -3.7 | -1.9 |
| Puntuación del dominio de función restrictiva de la escala de impacto de la migraña (MSQ) (durante los meses 4 a 6) | ||||
| Inicio | 51.4 | 52.9 | 52.5 | 51.4 |
| Cambio medio desde el iniciob | 32.4 | 24.7 | 28.5 | 19.7 |
| Diferencia con respecto al placeboa | 7.7 | 8.8 | ||
Figura 1: Cambio desde la línea de base en los días mensuales de cefalea migrañosa en el Estudio 1a
a Se presentan las medias de mínimos cuadrados y los intervalos de confianza del 95%.
Figura 2: Cambio desde la línea de base en los días mensuales de cefalea migrañosa en el Estudio 2a
a Se presentan las medias de mínimos cuadrados y los intervalos de confianza del 95%.
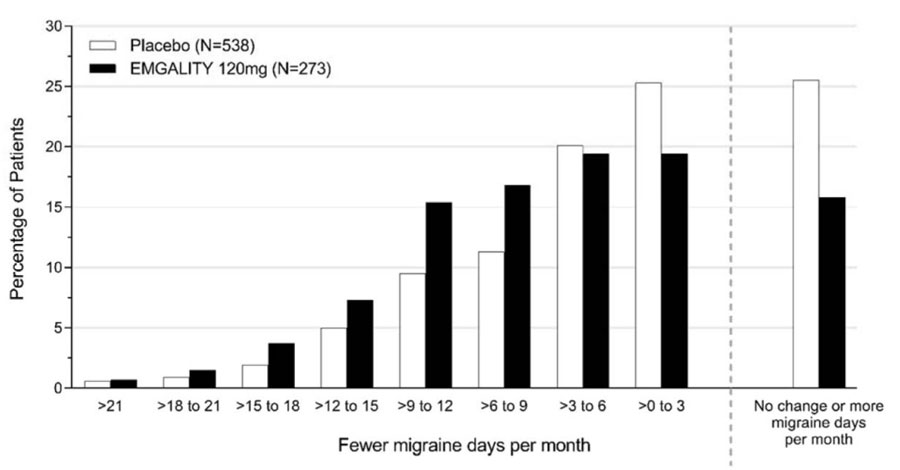
Figura 3 muestra la distribución del cambio desde la línea de base en el número medio de días mensuales de cefalea migrañosa en intervalos de 2 días, por grupo de tratamiento, en el Estudio 1. Se observa un beneficio del tratamiento sobre el placebo para EMGALITY en un rango de cambios desde la línea de base en los días mensuales de cefalea migrañosa.
Figura 3: Distribución del cambio desde la línea de base en el número medio de días mensuales de cefalea migrañosa durante los meses 1 a 6 por grupo de tratamiento en el Estudio 1
Figura 4 muestra la distribución del cambio desde la línea de base en el número medio de días mensuales de cefalea migrañosa en intervalos de 2 días, por grupo de tratamiento, en el Estudio 2. Se observa un beneficio del tratamiento sobre el placebo para EMGALITY en un rango de cambios desde la línea de base en los días mensuales de cefalea migrañosa.
Figura 4: Distribución del cambio desde la línea de base en el número medio de días mensuales de cefalea migrañosa durante los meses 1 a 6 por grupo de tratamiento en el Estudio 2
Migraña crónica
El Estudio 3 (NCT02614261) incluyó adultos con antecedentes de migraña crónica (≥15 días de cefalea al mes con ≥8 días de migraña al mes). Todos los pacientes fueron aleatorizados en una proporción de 1:1:2 para recibir inyecciones subcutáneas mensuales de EMGALITY 120 mg, EMGALITY 240 mg o placebo durante un período de tratamiento de 3 meses. Todos los pacientes del grupo de EMGALITY de 120 mg recibieron una dosis de carga inicial de 240 mg.
Se permitió a los pacientes utilizar tratamientos para la cefalea aguda, incluidos los medicamentos específicos para la migraña (es decir, triptanes, derivados de la ergotamina), AINE y acetaminofén. A un subgrupo de pacientes (15%) se le permitió utilizar un medicamento preventivo de la migraña concomitante. Se permitió la inscripción de pacientes con cefalea por abuso de medicamentos.
El estudio excluyó a los pacientes con anomalías en el ECG compatibles con un evento cardiovascular agudo, y a los pacientes con antecedentes de accidente cerebrovascular, infarto de miocardio, angina inestable, intervención coronaria percutánea, injerto de derivación de la arteria coronaria, trombosis venosa profunda o embolia pulmonar en los 6 meses previos a la selección.
El criterio de valoración principal fue el cambio medio desde la línea de base en el número de días mensuales de cefalea migrañosa durante el período de tratamiento de 3 meses. Los criterios de valoración secundarios fueron las tasas de respuesta (los porcentajes medios de pacientes que alcanzaron al menos una reducción del 50%, 75% y 100% desde la línea de base en el número de días mensuales de cefalea migrañosa durante el período de tratamiento de 3 meses), el cambio medio desde la línea de base en el número de días mensuales de cefalea migrañosa con el uso de cualquier medicamento para la cefalea aguda durante el período de tratamiento de 3 meses, y el impacto de la migraña en las actividades diarias, según lo evaluado por el cambio medio desde la línea de base en la puntuación del dominio de función restrictiva del MSQ v2.1 en el mes 3. Las puntuaciones se escalan de 0 a 100, con puntuaciones más altas que indican un menor impacto de la migraña en las actividades diarias.
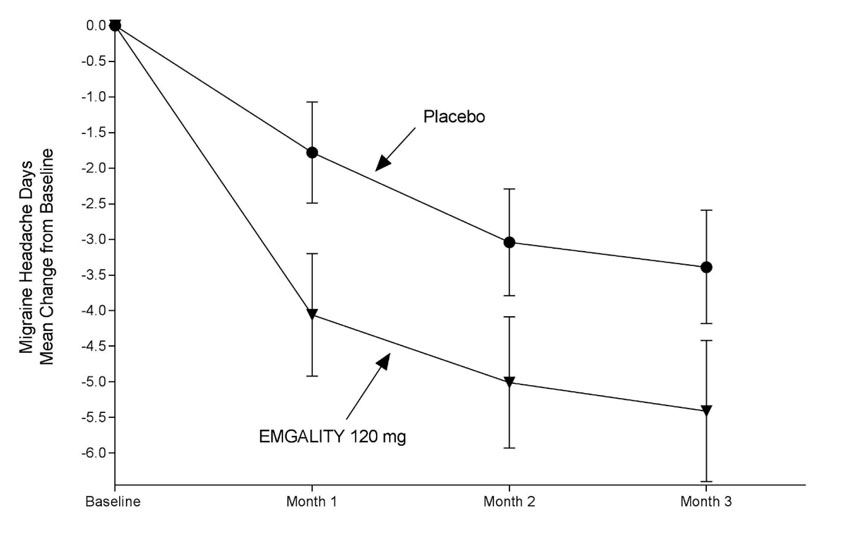
En el Estudio 3, se aleatorizó un total de 1113 pacientes (946 mujeres, 167 hombres) con edades comprendidas entre los 18 y los 65 años. Un total de 1037 pacientes completaron la fase doble ciego de 3 meses. El número medio de días mensuales de cefalea migrañosa en la línea de base fue de aproximadamente 19.
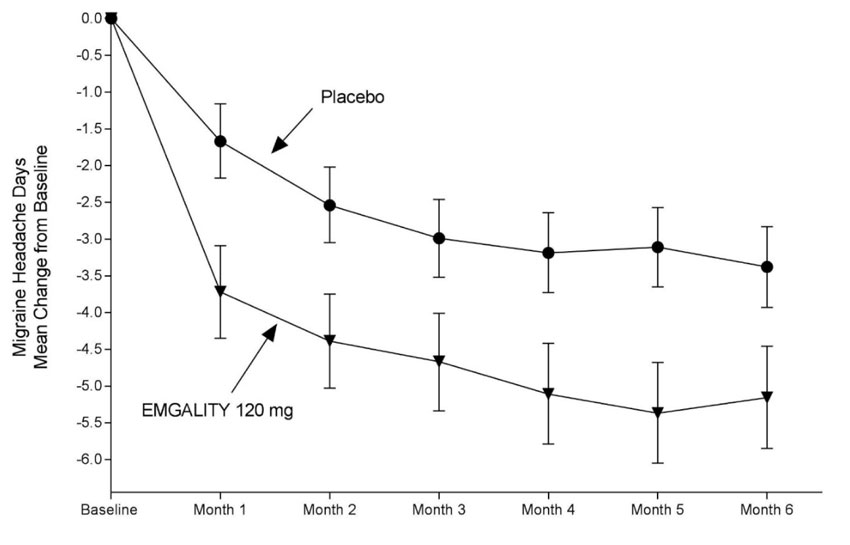
EMGALITY 120 mg demostró una mejora estadísticamente significativa para el cambio medio desde la línea de base en el número de días mensuales de cefalea migrañosa durante el período de tratamiento de 3 meses, y en el porcentaje medio de pacientes que alcanzaron al menos una reducción del 50% desde la línea de base en el número de días mensuales de cefalea migrañosa durante el período de tratamiento de 3 meses, como se resume en Tabla 3. El tratamiento con EMGALITY con la dosis de 240 mg una vez al mes no mostró ningún beneficio adicional sobre la dosis de EMGALITY de 120 mg una vez al mes.
|
a p<0.001 |
||
| EMGALITY 120 mg N = 273 |
Placebo
N =538 |
|
| Días mensuales de cefalea migrañosa (durante los meses 1 a 3) | ||
| Días de cefalea migrañosa en la línea de base | 19.4 | 19.6 |
| Cambio medio desde la línea de base | -4.8 | -2.7 |
| Diferencia con respecto al placeboa | -2.1 | |
| ≥50% de los respondedores a los días de cefalea migrañosa (durante los meses 1 a 3) | ||
| % de respondedoresa | 28% | 15% |
El estudio 3 utilizó un procedimiento de prueba secuencial para controlar la tasa de error de tipo I para los múltiples criterios de valoración secundarios. Una vez que un criterio de valoración secundario no alcanzó el nivel requerido para la significancia estadística, la prueba formal de hipótesis se terminó para los criterios de valoración subsiguientes, y los valores de p se consideraron solo nominales. En el estudio 3, EMGALITY 120 mg no fue significativamente mejor que el placebo para la proporción de pacientes con una reducción ≥75% o 100% en los días de cefalea migrañosa. Los pacientes tratados con EMGALITY 120 mg mostraron una reducción nominalmente mayor en el número de días de cefalea migrañosa mensual en los que se tomó la medicación aguda (-4,7 para EMGALITY 120 mg vs. -2,2 para placebo; valor de p nominal <0,001), y el cambio medio desde el inicio en la puntuación del dominio de función restrictiva de la MSQ en el mes 3 fue nominalmente mayor en los pacientes tratados con EMGALITY 120 mg que en los pacientes que recibieron placebo (21,8 para EMGALITY 120 mg vs. 16,8 para placebo; valor de p nominal <0,001).
Figura 5: Cambio desde el inicio en los días de cefalea migrañosa mensual en el estudio 3a
a Se presentan las medias de mínimos cuadrados y los intervalos de confianza del 95%.
Figura 6 muestra la distribución del cambio desde el inicio en el número medio de días de cefalea migrañosa mensual para el período de estudio de 3 meses en intervalos de 3 días por grupo de tratamiento. Se observa un beneficio del tratamiento sobre el placebo para EMGALITY en un rango de cambios desde el inicio en los días de cefalea migrañosa mensual.
Figura 6: Distribución del cambio desde el inicio en los días de cefalea migrañosa mensual media durante los meses 1 a 3 por grupo de tratamiento en el estudio 3
14.2 Cefalea en racimos episódica
La eficacia de EMGALITY se evaluó para el tratamiento de la cefalea en racimos episódica en un estudio aleatorizado, doble ciego, controlado con placebo de 8 semanas (Estudio 4).
El estudio 4 (NCT02397473) incluyó adultos que cumplían los criterios diagnósticos de la tercera edición (versión beta) de la Clasificación Internacional de Trastornos de Cefalea para la cefalea en racimos episódica y tenían un máximo de 8 ataques por día, un mínimo de un ataque cada dos días y al menos 4 ataques durante el período de referencia prospectivo de 7 días. Todos los pacientes fueron aleatorizados en una proporción de 1:1 para recibir inyecciones subcutáneas mensuales de EMGALITY 300 mg o placebo. Se permitió a los pacientes utilizar ciertos tratamientos agudos/abortivos específicos para la cefalea en racimos, incluidos los triptanos, el oxígeno, el acetaminofén y los AINE durante el estudio.
El estudio excluyó a los pacientes que estaban en otros tratamientos destinados a reducir la frecuencia de los ataques de cefalea en racimos; los pacientes con cefalea por abuso de medicamentos; los pacientes con anomalías en el ECG compatibles con un evento cardiovascular agudo o retraso en la conducción; y los pacientes con antecedentes de infarto de miocardio, angina inestable, intervención coronaria percutánea, injerto de derivación de arteria coronaria, trombosis venosa profunda o embolia pulmonar dentro de los 6 meses previos a la selección. Además, se excluyeron los pacientes con antecedentes de accidente cerebrovascular, aneurisma intracraneal o carotídeo, hemorragia intracraneal o angina vasoespástica; evidencia clínica de enfermedad vascular periférica; o diagnóstico de enfermedad de Raynaud.
El criterio de valoración principal de eficacia para el estudio 4 fue el cambio medio desde el inicio en la frecuencia semanal de ataques de cefalea en racimos durante las semanas 1 a 3. Un criterio de valoración secundario fue el porcentaje de pacientes que lograron una respuesta (definida como una reducción desde el inicio del 50% o más en la frecuencia semanal de ataques de cefalea en racimos) en la semana 3.
En el estudio 4, un total de 106 pacientes (88 hombres, 18 mujeres) con edades comprendidas entre los 19 y los 65 años fueron aleatorizados y tratados. Un total de 90 pacientes completaron la fase doble ciego de 8 semanas. En la fase de referencia prospectiva, el número medio de ataques semanales de cefalea en racimos fue de 17,5, y fue similar en los grupos de tratamiento.
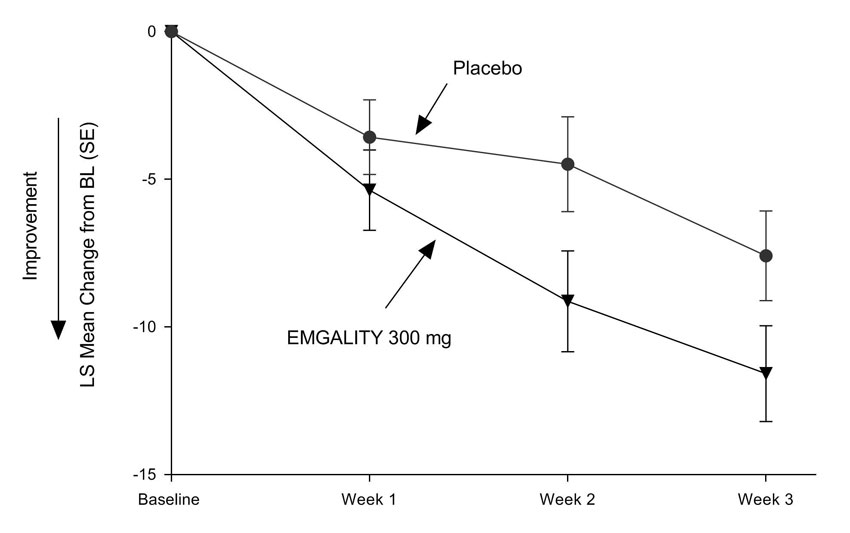
EMGALITY 300 mg demostró mejoras estadísticamente significativas para los criterios de valoración de eficacia en comparación con el placebo, como se resume en Tabla 4.
| EMGALITY 300 mg N = 49 |
Placebo
N = 57 |
|
| Reducción media en la frecuencia semanal de ataques de cefalea en racimos (durante las semanas 1 a 3) | ||
| Frecuencia de ataques de cefalea en racimos de referencia prospectiva | 17,8 | 17,3 |
| Cambio medio desde el inicio | -8,7 | -5,2 |
| Diferencia con respecto al placebo | -3,5 | |
| Valor de p | 0,036 | |
| ≥50% de respondedores a la frecuencia de ataques de cefalea en racimos semanal (en la semana 3) | ||
| % de respondedores | 71,4% | 52,6% |
| Diferencia con respecto al placebo | 18,8% | |
| Valor de p | 0,046 | |
Figura 7: Cambio medio en la frecuencia semanal de ataques de cefalea en racimos durante las semanas 1 a 3 en el estudio 4a
a Abreviaturas: BL = línea de base; LS = mínimos cuadrados; SE = error estándar.
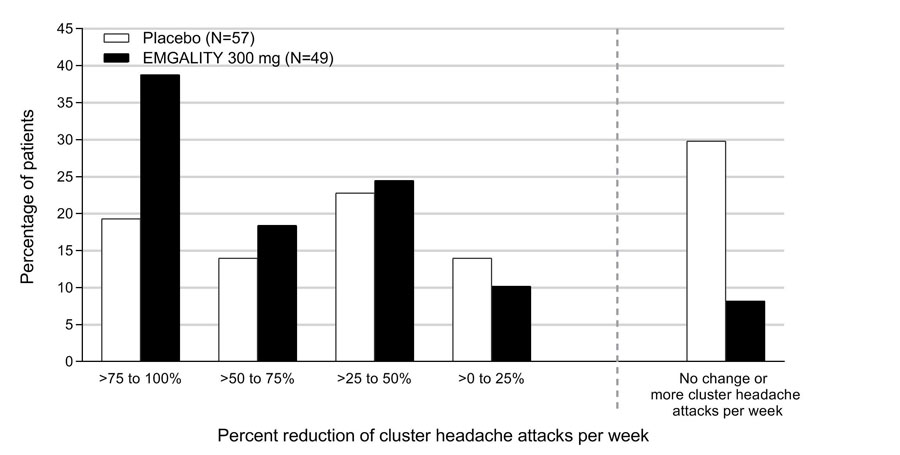
Figura 8 muestra la distribución del cambio porcentual promedio desde la línea de base en la frecuencia semanal de ataques de cefalea en racimos durante las semanas 1 a 3 en intervalos del 25%, por grupo de tratamiento, en el estudio 4.
Figura 8: Distribución del cambio porcentual promedio desde la línea de base en la frecuencia semanal de ataques de cefalea en racimos durante las semanas 1 a 3 en el estudio 4a
a N = número de pacientes con intención de tratar con cambio porcentual promedio no faltante desde la línea de base en la frecuencia semanal de ataques de cefalea en racimos durante las semanas 1 a 3.
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
16.1 Cómo se suministra
La inyección de EMGALITY (galcanezumab-gnlm) es una solución estéril, sin conservantes, de transparente a opalescente, de incolora a ligeramente amarilla a ligeramente marrón para administración subcutánea.
EMGALITY no está fabricado con látex de caucho natural.
EMGALITY se suministra de la siguiente manera:
| Tamaño del envase | NDC | |
| Pluma precargada | ||
| 120 mg/mL dosis única | Caja de 1 | 0002-1436-11 |
| 120 mg/mL dosis única | Caja de 2 | 0002-1436-27 |
| Jeringa precargada | ||
| 100 mg/mL dosis única | Caja de 3 | 0002-3115-09 |
| 120 mg/mL dosis única | Caja de 1 | 0002-2377-11 |
| 120 mg/mL dosis única | Caja de 2 | 0002-2377-27 |
16.2 Almacenamiento y manipulación
- Conservar en nevera entre 2 °C y 8 °C (36 °F y 46 °F) en el embalaje original para proteger EMGALITY de la luz hasta su uso.
- No congelar.
- No agitar.
- EMGALITY puede conservarse fuera de la nevera en el embalaje original a temperaturas de hasta 30 °C (86 °F) hasta 7 días. Una vez que se haya sacado de la nevera, no lo vuelva a meter.
- Si se superan estas condiciones, EMGALITY debe desecharse.
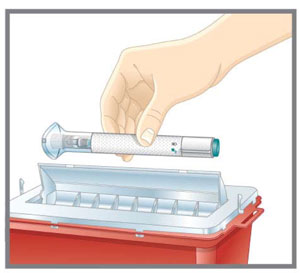
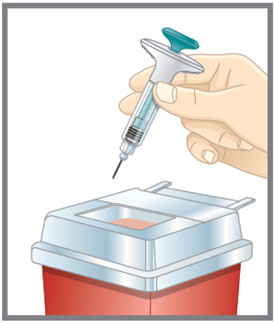
- Deseche la pluma precargada o la jeringa precargada de dosis única de EMGALITY después de su uso en un contenedor resistente a pinchazos.
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente que lea el etiquetado del paciente aprobado por la FDA (Información para el paciente e Instrucciones de uso).
Instrucciones de autoadministración: Proporcione orientación a los pacientes y/o cuidadores sobre la técnica de inyección subcutánea adecuada, incluida la técnica aséptica, y cómo usar correctamente la pluma precargada o la jeringa precargada [ver Instrucciones de uso]. Instruya a los pacientes y/o cuidadores que lean y sigan las Instrucciones de uso cada vez que usen EMGALITY.
Reacciones de hipersensibilidad: Aconseje a los pacientes que busquen atención médica inmediata si experimentan algún síntoma de reacciones de hipersensibilidad graves o severas [ver Advertencias y precauciones (5.1)].
Registro de exposición al embarazo: Aconseje a los pacientes que existe un registro de exposición al embarazo que monitorea los resultados del embarazo en mujeres expuestas a EMGALITY durante el embarazo [ver Uso en poblaciones específicas (8.1)].
Para obtener más información, visite www.emgality.com o llame al 1-833-EMGALITY (1-833-364-2548).
Literatura revisada: 03/2021
Eli Lilly and Company, Indianápolis, IN 46285, EE. UU.
Número de licencia de EE. UU. 1891
Copyright © 2018, 2021, Eli Lilly and Company. Todos los derechos reservados.
EMG-0006-USPI-20210311
INSERTO PARA EL PACIENTE
|
Esta información para el paciente ha sido aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos. |
Revisado: 03/2021 |
| INFORMACIÓN PARA EL PACIENTE EMGALITY® (em-GAL-it-ē) (galcanezumab-gnlm) inyección, para uso subcutáneo |
|
| ¿Qué es EMGALITY? EMGALITY es un medicamento recetado que se usa en adultos para:
|
|
| No se sabe si EMGALITY es seguro y eficaz en niños. | |
| ¿Quién no debe usar EMGALITY? No use EMGALITY si es alérgico a galcanezumab-gnlm o a cualquiera de los ingredientes de EMGALITY. Consulte el final de esta Información para el paciente para obtener una lista completa de los ingredientes de EMGALITY. |
|
Antes de usar EMGALITY, informe a su proveedor de atención médica si:
|
|
| Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos herbales. Conozca los medicamentos que toma. Mantenga una lista de sus medicamentos con usted para mostrársela a su proveedor de atención médica y farmacéutico cuando obtenga un nuevo medicamento. | |
¿Cómo debo usar EMGALITY?
|
|
| ¿Cuáles son los posibles efectos secundarios de EMGALITY? EMGALITY puede causar efectos secundarios graves, que incluyen:
|
|
Los efectos secundarios más comunes de EMGALITY incluyen:
|
|
| Informe a su proveedor de atención médica si tiene algún efecto secundario que le moleste o que no desaparezca. Estos no son todos los posibles efectos secundarios de EMGALITY. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico. Llame a su proveedor de atención médica para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088. |
|
¿Cómo debo almacenar EMGALITY?
|
|
| Mantenga EMGALITY y todos los medicamentos fuera del alcance de los niños. | |
| Información general sobre el uso seguro y eficaz de EMGALITY. Los medicamentos a veces se recetan para fines distintos de los que se enumeran en la Información para el paciente. No use EMGALITY para una afección para la que no fue recetado. No le dé EMGALITY a otras personas, incluso si tienen los mismos síntomas que usted. Puede hacerles daño. Puede pedirle a su farmacéutico o proveedor de atención médica información sobre EMGALITY que esté escrita para profesionales de la salud. |
|
| ¿Cuáles son los ingredientes de EMGALITY? Ingrediente activo: galcanezumab-gnlm Ingredientes inactivos: L-histidina, L-histidina clorhidrato monohidrato, Polisorbato 80, Cloruro de sodio y Agua para inyección, USP. El bolígrafo prellenado y las jeringas prellenadas de EMGALITY no están hechos con látex de caucho natural. EMGALITY® es una marca registrada de Eli Lilly and Company. |
|
INSTRUCCIONES DE USO
| INSTRUCCIONES DE USO | |
| EMGALITY® (em-GAL-it-ē) | |
| (galcanezumab-gnlm) | |
| inyección, para uso subcutáneo | |
| Pluma precargada | |
 |
|
| Estas Instrucciones de uso son para pacientes con migraña. | |
| Solo para inyección subcutánea. | |
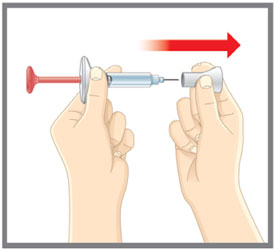
| Antes de usar la pluma precargada EMGALITY (Pluma), lea y siga cuidadosamente todas las instrucciones paso a paso. | |
| Información importante | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| INSTRUCCIONES DE USO |
| Antes de usar la Pluma EMGALITY, lea y siga cuidadosamente todas las instrucciones paso a paso. |
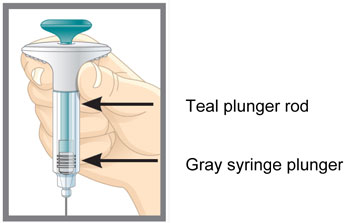
| Partes de la Pluma EMGALITY |
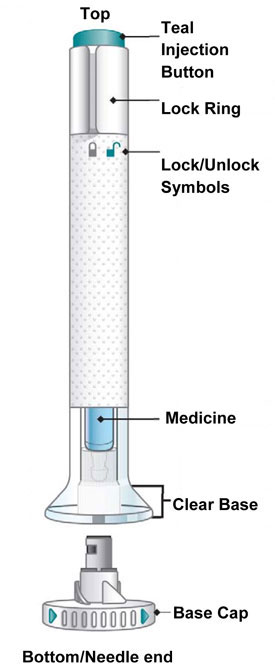 |
| Antes de empezar | |
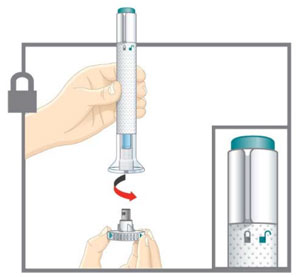
| Saque la pluma del refrigerador | Revise su receta.
Vuelva a colocar el paquete original con las plumas sin usar en el refrigerador. |
| Deje la tapa base puesta hasta que esté listo para inyectar. | |
| Deje la pluma a temperatura ambiente durante 30 minutos antes de inyectar. | |
| No caliente la pluma en el microondas, no la ponga bajo agua caliente ni la deje a la luz directa del sol. | |
| No la agite. | |
| Reúna los materiales | Para cada inyección necesitará:
|
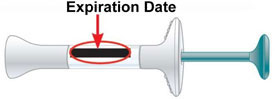
| Inspeccione la pluma y el medicamento | Asegúrese de tener el medicamento correcto. El medicamento dentro debe ser transparente. Su color puede ser incoloro a ligeramente amarillo a ligeramente marrón.
No use la pluma y deséchela (elimínela) según las indicaciones de su proveedor de atención médica o farmacéutico si:
|
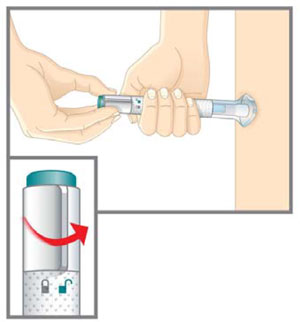
| Prepárese para la inyección | Lávese las manos con agua y jabón antes de inyectarse EMGALITY. Asegúrese de tener un contenedor para desechar objetos punzantes cerca. |
| Su proveedor de atención médica puede ayudarlo a elegir el lugar de la inyección que sea mejor para usted. | |
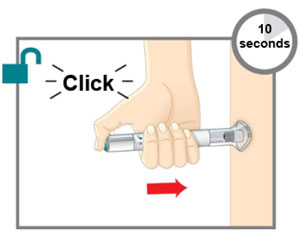
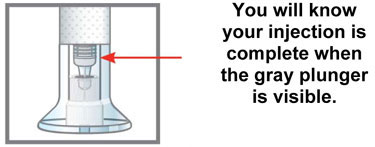
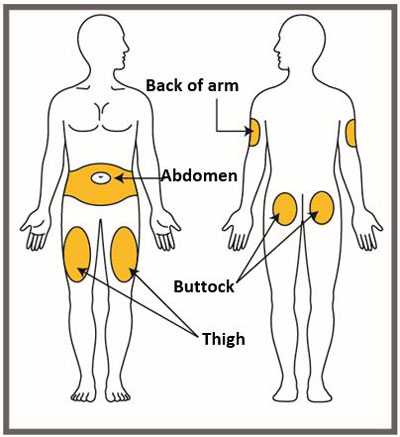 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Lea la información completa de prescripción e información para el paciente de EMGALITY dentro de esta caja para obtener más información sobre su medicamento. | |
|
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos. |
||
|
Eli Lilly and Company Indianapolis, IN 46285, USA |
||
| Número de licencia de EE. UU. 1891 | ||
|
EMGALITY® es una marca registrada de Eli Lilly and Company. |
||
|
Copyright © 2018, 2019, Eli Lilly and Company. Todos los derechos reservados. |
||
|
Revisado: 11/2019 |
||
|
La pluma cumple con los requisitos actuales de precisión de dosis y funcionales de ISO 11608-1 y 11608-5. |
||
|
EMG-0005-AI-120MG-IFU-20191127 |
INSTRUCCIONES DE USO
| INSTRUCCIONES DE USO |
| EMGALITY® (em-GAL-it-ē) |
| (galcanezumab-gnlm) |
| inyección, para uso subcutáneo |
| Jeringa precargada |
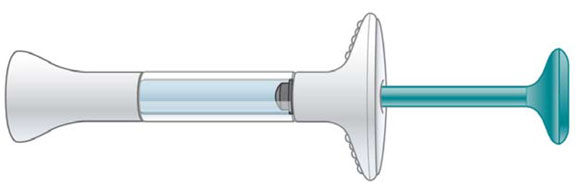 |
| Estas Instrucciones de uso son para pacientes con migraña. |
|
| Solo para inyección subcutánea. |
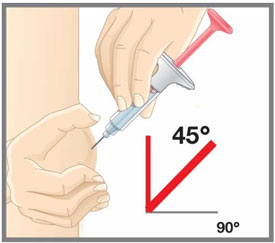
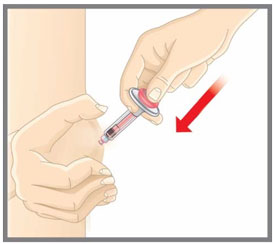
| Antes de usar la jeringa precargada EMGALITY, lea y siga cuidadosamente todas las instrucciones paso a paso. |
| Información importante |
|
|
|
|
|
|
| INSTRUCCIONES DE USO |
| Antes de usar la jeringa precargada EMGALITY, lea y siga cuidadosamente todas las instrucciones paso a paso. |
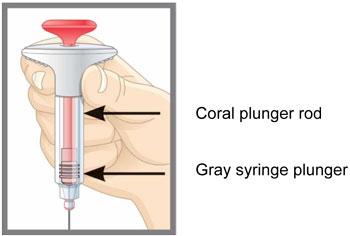
| Partes de la jeringa precargada EMGALITY |
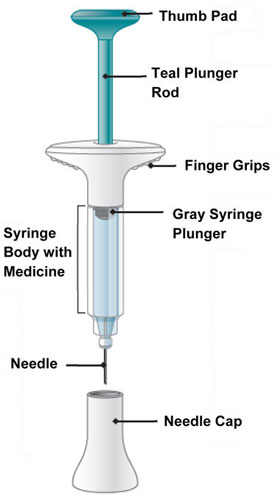 |
| Antes de empezar | |
| Tome la jeringa precargada del refrigerador | Revise su receta.
|
| Vuelva a colocar el paquete original con las jeringas no utilizadas en el refrigerador. | |
| Deje el protector de la aguja puesta hasta que esté listo para inyectarse. | |
| Deje la jeringa precargada a temperatura ambiente durante 30 minutos antes de inyectarse. | |
| No caliente la jeringa precargada en el microondas, moje con agua caliente o la exponga directamente a la luz del sol. | |
| No agite. | |
| Reúna los materiales | Para cada inyección necesitará:
|
| Inspeccione la jeringa precargada y el medicamento | Asegúrese de tener el medicamento correcto. El medicamento dentro debería ser claro. Su color puede variar de incoloro a ligeramente amarillo o ligeramente marrón. |
No use la jeringa precargada y deseche (elimine) como le indiquen su proveedor de atención médica o farmacéutico si:
|
|
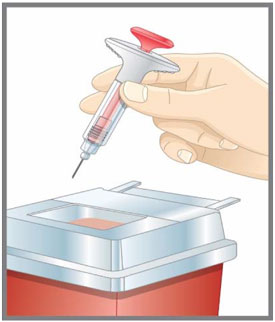
| Prepárese para la inyección | Lávese las manos con agua y jabón antes de inyectarse EMGALITY. Asegúrese de tener cerca un contenedor para desechos de agujas. |
| Su proveedor de atención médica puede ayudarle a elegir el lugar de inyección que sea más adecuado para usted. | |
 |
|
|
|
|
|
|
|
|
|
|
|
| Información sobre almacenamiento y manipulación | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Lea la información completa de prescripción e información para el paciente de EMGALITY dentro de esta caja para obtener más información sobre su medicamento. |
|
|
Estas Instrucciones de Uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos. |
||
| Eli Lilly and Company | ||
| Indianapolis, IN 46285, USA | ||
| Número de Licencia de EE. UU. 1891 | ||
|
EMGALITY® es una marca registrada de Eli Lilly and Company. |
||
|
Copyright © 2018, 2019, Eli Lilly and Company. Todos los derechos reservados. |
||
|
Revisado: 06/2019 |
||
|
EMG-0004-PFS-120MG-IFU-20190604 |
INSTRUCCIONES DE USO
| INSTRUCCIONES DE USO |
| EMGALITY® (em-GAL-it-ē) |
| (galcanezumab-gnlm) |
| inyección, para uso subcutáneo |
| Jeringa precargada |
 |
| Estas Instrucciones de uso son para pacientes con cefalea en racimos episódica. |
|
| Solo para inyección subcutánea. |
| Antes de usar la jeringa precargada EMGALITY, lea y siga cuidadosamente todas las instrucciones paso a paso. |
| Información importante |
|
|
|
|
|
|
| INSTRUCCIONES DE USO |
| Antes de usar la jeringa precargada EMGALITY, lea y siga cuidadosamente todas las instrucciones paso a paso. |
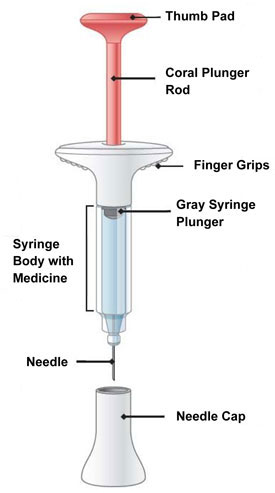
| Partes de la jeringa precargada EMGALITY |
 |
| Antes de comenzar | |
| Saque las jeringas precargadas del refrigerador | Saque 3 jeringas precargadas EMGALITY del refrigerador. |
Revise su receta.
|
|
| Deje las tapas de las agujas puestas hasta que esté listo para inyectar. | |
| Deje las jeringas precargadas a temperatura ambiente durante 30 minutos antes de inyectar. | |
| No caliente las jeringas precargadas en el microondas, no las ponga bajo agua caliente ni las deje a la luz solar directa. | |
| No agite. | |
| Reúna los suministros | Para cada inyección necesitará:
|
| Inspeccione la jeringa precargada y el medicamento | Asegúrese de tener el medicamento correcto. El medicamento dentro debe estar claro. Su color puede ser incoloro a ligeramente amarillo a ligeramente marrón. |
No use la jeringa precargada y deséchela (elimínela) según las indicaciones de su proveedor de atención médica o farmacéutico si:
|
|
Fecha de caducidad |
|
| Prepárese para la inyección | Lávese las manos con agua y jabón antes de inyectarse EMGALITY. Asegúrese de tener un contenedor de eliminación de objetos punzantes cerca. |
|
Su profesional sanitario puede ayudarle a elegir el sitio de inyección que mejor le convenga. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Lea la información completa de prescripción e información para el paciente de EMGALITY dentro de esta caja para obtener más información sobre su medicamento. | |
|
Estas Instrucciones de Uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos. |
||
| Eli Lilly and Company | ||
| Indianapolis, IN 46285, USA | ||
| Número de Licencia de EE. UU. 1891 | ||
|
EMGALITY® es una marca registrada de Eli Lilly and Company. |
||
|
Copyright © 2019, Eli Lilly and Company. Todos los derechos reservados. |
||
|
Emitido: 06/2019 |
||
|
EMG-0001-PFS-100MG-IFU-20190604 |
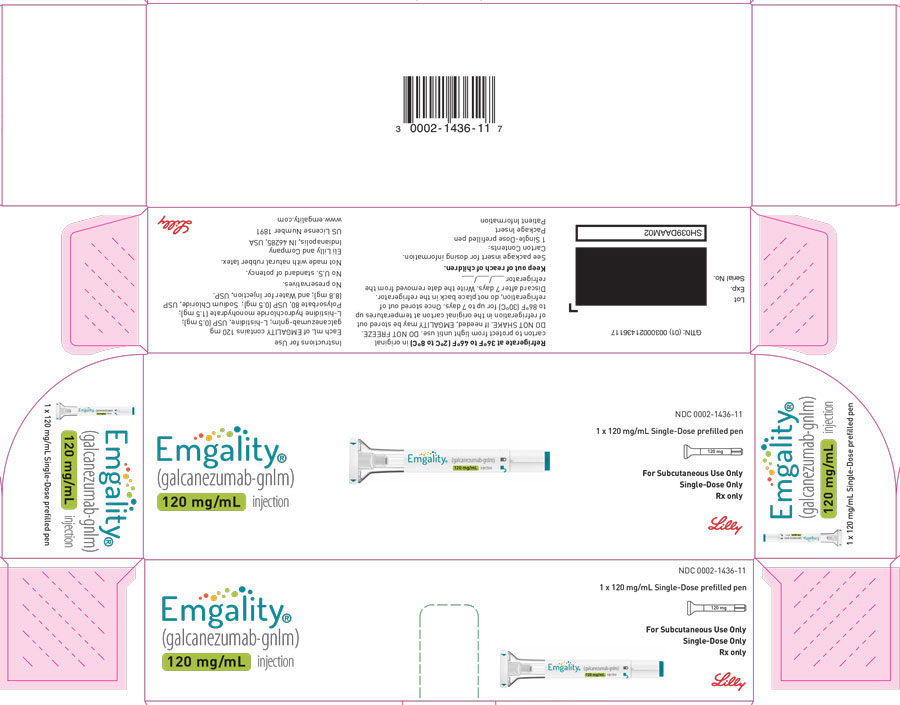
PANEL DE VISUALIZACIÓN PRINCIPAL
CARTÓN DE LA PAQUETE – EMGALITY Inyector automático 120 mg
NDC 0002-1436-11
EMGALITY®
(galcanezumab-gnlm) inyección
120 mg/mL
1 x 120 mg/mL Pluma precargada de una sola dosis
Para uso subcutáneo solamente
Única dosis solamente
Sólo receta médica
Lilly
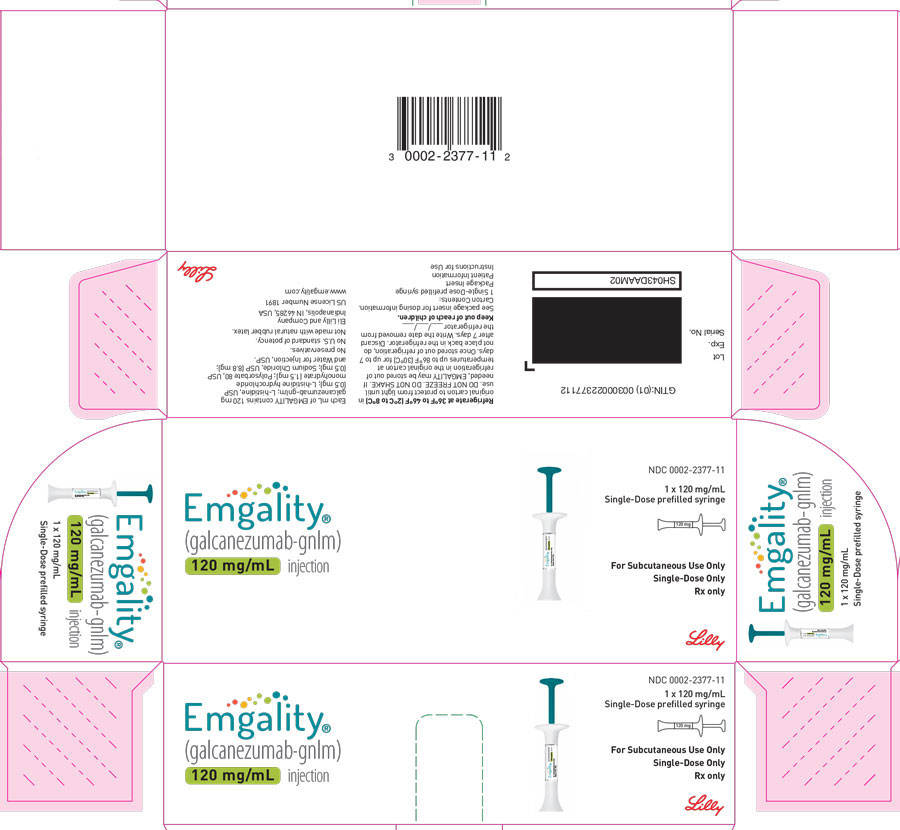
PANEL DE VISUALIZACIÓN PRINCIPAL
CAJA DEL PAQUETE – Jeringa precargada de EMGALITY 120 mg
NDC 0002-2377-11
EMGALITY®
Inyección de galcanezumab-gnlm
120 mg/mL
1x jeringa precargada de 120 mg/mL de dosis única
Solo para uso subcutáneo
Solo dosis única
Solo con receta médica
Lilly
PANEL DE VISUALIZACIÓN PRINCIPAL
CAJA DE CARTÓN DEL PAQUETE – Jeringa precargada de EMGALITY de 100 mg
NDC 0002-3115-09
EMGALITY®
(galcanezumab-gnlm)
Inyección de 100 mg/mL
Se deben administrar las 3 jeringas para recibir la dosis de 300 mg.
3 x 100 mg/mL Jeringa precargada de dosis única
Solo para uso subcutáneo
Dosis única
Rx only
Lilly





 Tags:
Tags: