Fabricante de medicamentos: Actelion Pharmaceuticals US, Inc. (Updated: 2024-04-02)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
OPSUMIT
®(macitentan) tabletas, para uso oral
Aprobación inicial en EE. UU.: 2013
ADVERTENCIA: TOXICIDAD EMBRIONARIA-FETAL
Consulte la información completa de prescripción para obtener la advertencia completa en recuadro.
-
No administre OPSUMIT a una mujer embarazada porque puede causar daño fetal (
4.1,
5.1,
8.1).
-
Mujeres en edad fértil: excluya el embarazo antes de comenzar el tratamiento, mensualmente durante el tratamiento y 1 mes después de suspender el tratamiento. Evite el embarazo durante el tratamiento y durante un mes después del tratamiento utilizando métodos anticonceptivos aceptables (
2.2,
8.3).
-
Para todas las pacientes mujeres, OPSUMIT solo está disponible a través de un programa restringido llamado Macitentan–
Productos que contienen Estrategia de evaluación y mitigación de riesgos (REMS) (
5.2).
INDICACIONES Y USO
OPSUMIT es un antagonista del receptor de endotelina (ERA) indicado para el tratamiento de la hipertensión arterial pulmonar (HAP, Grupo I de la OMS) para reducir los riesgos de progresión de la enfermedad y hospitalización por HAP (
1.1).
DOSIFICACIÓN Y ADMINISTRACIÓN
- 10 mg una vez al día
.No se han estudiado dosis superiores a 10 mg una vez al día en pacientes con HAP y no se recomiendan (
2.1).
FORMAS Y FUERZAS DE DOSIFICACIÓN
- Tableta: 10 mg (
3)
ADVERTENCIAS Y PRECAUCIONES
- Los ERA causan hepatotoxicidad e insuficiencia hepática. Obtenga enzimas hepáticas basales y controle según esté clínicamente indicado (
5.3).
- La retención de líquidos puede requerir intervención (
5.4)
- Disminuciones en la hemoglobina (
5.5).
- Edema pulmonar en pacientes con enfermedad veno-oclusiva pulmonar. Si se confirma, suspenda el tratamiento (
5.6).
- Se han observado disminuciones en el recuento de espermatozoides en pacientes que toman ERA (
5.7).
REACCIONES ADVERSAS
Las reacciones adversas más comunes (más frecuentes que el placebo en ≥3%) son anemia, nasofaringitis/faringitis, bronquitis, dolor de cabeza, influenza e infección del tracto urinario (
6.1).
Para informar sobre REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Janssen al 1-800-526-7736 (1-800-JANSSEN) o con la FDA al 1-800-FDA-1088 o
www.fda.gov/medwatch.
INTERACCIONES MEDICAMENTOSAS
- Los inductores fuertes del CYP3A4 (rifampicina) reducen la exposición a macitentan: evite la administración conjunta con OPSUMIT (
7.1,
12.3).
- Los inhibidores fuertes del CYP3A4 (ketoconazol, ritonavir) aumentan la exposición a macitentan: evite la administración conjunta con OPSUMIT (
7.2,
12.3)
.
- Los inhibidores duales moderados del CYP3A4 y CYP2C9 (fluconazol, amiodarona) o el uso de inhibidores combinados del CYP3A4 y CYP2C9 pueden aumentar la exposición a macitentan: evite la administración conjunta con OPSUMIT (
7.3,
12.3).
Consulte 17 para obtener INFORMACIÓN PARA EL PACIENTE y la Guía de medicamentos.
Revisado: 3/2024
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
ADVERTENCIA: TOXICIDAD EMBRIOFETAL
1 INDICACIONES Y USO
1.1 Hipertensión Arterial Pulmonar
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis Recomendada
2.2 Prueba de Embarazo en Mujeres en Edad Fértil
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
4.1 Embarazo
4.2 Hipersensibilidad
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Toxicidad Embriofetal
5.2 Productos que Contienen Macitentan REMS
5.3 Hepatotoxicidad
5.4 Retención de Líquidos
5.5 Disminución de la Hemoglobina
5.6 Edema Pulmonar con Enfermedad Veno-oclusiva Pulmonar (PVOD)
5.7 Disminución del Recuento de Espermatozoides
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Postcomercialización
7 INTERACCIONES MEDICAMENTOSAS
7.1 Inductores Fuertes del CYP3A4
7.2 Inhibidores Fuertes del CYP3A4
7.3 Inhibidores Duales o Combinados Moderados del CYP3A4 y CYP2C9
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.3 Mujeres y Hombres en Edad Fértil
8.4 Uso Pediátrico
8.5 Uso Geriátrico
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
13.2 Toxicología Animal
14 ESTUDIOS CLÍNICOS
14.1 Hipertensión Arterial Pulmonar
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están listadas.
ADVERTENCIA RECUADRADA
ADVERTENCIA: TOXICIDAD EMBRIOFETAL
-
No administre OPSUMIT a mujeres embarazadas porque puede causar daño fetal
[consulte
Advertencias y precauciones (5.1),
Uso en poblaciones específicas (8.1)].
-
Mujeres en edad fértil: Excluya el embarazo antes de comenzar el tratamiento, mensualmente durante el tratamiento y 1 mes después de suspenderlo. Prevenga el embarazo durante el tratamiento y durante un mes después de suspenderlo utilizando métodos anticonceptivos aceptables
[consulte
Prueba de embarazo en mujeres en edad fértil (2.2),
Uso en poblaciones específicas (8.3)].
-
Para todas las pacientes, OPSUMIT está disponible solo a través de un programa restringido llamado Estrategia de mitigación y evaluación de riesgos de productos que contienen macitentan (REMS, por sus siglas en inglés)
[consulte
Advertencias y precauciones (5.2)]
.
1 INDICACIONES Y USO
1.1 Hipertensión Arterial Pulmonar
OPSUMIT es un antagonista del receptor de endotelina (ERA) indicado para el tratamiento de la hipertensión arterial pulmonar (HAP, Grupo I de la OMS) para reducir los riesgos de progresión de la enfermedad y hospitalización por HAP.
La efectividad se estableció en un estudio a largo plazo en pacientes con HAP con síntomas predominantemente de clase funcional II–III de la OMS tratados durante un promedio de 2 años. Los pacientes tenían HAP idiopática y hereditaria (57 %), HAP causada por trastornos del tejido conectivo (31 %) y HAP causada por enfermedad cardíaca congénita con derivaciones reparadas (8 %)
[ver
.
2 DOSIS Y ADMINISTRACIÓN
2.1 Dosis recomendada
La dosis recomendada de OPSUMIT es de 10 mg una vez al día por vía oral. No se han estudiado dosis superiores a 10 mg una vez al día en pacientes con HAP y no se recomiendan.
2.2 Prueba de embarazo en mujeres en edad fértil
Realice una prueba de embarazo en mujeres en edad fértil antes del tratamiento con OPSUMIT, mensualmente durante el tratamiento y un mes después de suspender OPSUMIT. Inicie el tratamiento con OPSUMIT en mujeres en edad fértil solo después de una prueba de embarazo negativa.
[ver
Advertencias y precauciones (5.1), y
Uso en poblaciones específicas (8.3)]
.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Tabletas: 10 mg, biconvexas, recubiertas con película, redondas, blancas y con la marca “10” en ambos lados.
4 CONTRAINDICACIONES
4.1 Embarazo
OPSUMIT puede causar daño fetal cuando se administra a una mujer embarazada. OPSUMIT está contraindicado en mujeres embarazadas. Se demostró de manera consistente que OPSUMIT tiene efectos teratógenos cuando se administra a animales. Si se usa OPSUMIT durante el embarazo, informe al paciente sobre el riesgo potencial para el feto
[ver
Advertencias y precauciones (5.1) y
Uso en poblaciones específicas (8.1)]
.
4.2 Hipersensibilidad
OPSUMIT está contraindicado en pacientes con antecedentes de reacción de hipersensibilidad a macitentan o cualquier componente del producto
[ver
.
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Embryo-fetal Toxicity
OPSUMIT puede causar daño fetal cuando se administra durante el embarazo y está contraindicado en mujeres embarazadas. En mujeres en edad fértil, descarte el embarazo antes de iniciar el tratamiento, asegúrese de utilizar métodos anticonceptivos aceptables y realice pruebas de embarazo mensuales
[ver
Dosificación y administración (2.2)y
Uso en poblaciones específicas (8.1,
8.3)]
.
OPSUMIT está disponible para mujeres a través del programa REMS para productos que contienen macitentan, un programa de distribución restringida
[ver
Advertencias y precauciones (5.2)]
.
5.2 Macitentan-Containing Products REMS
Para todas las mujeres, OPSUMIT está disponible solo a través de un programa restringido llamado Macitentan-Containing Products REMS, debido al riesgo de toxicidad embriofetal
[ver
Advertencias y precauciones (5.1), y
Uso en poblaciones específicas (8.1,
8.3)]
.
Los requisitos notables del programa Macitentan-Containing Products REMS incluyen los siguientes:
- Los médicos que prescriben deben estar certificados con el programa Macitentan-Containing Products REMS inscribiéndose y completando la capacitación.
- Todas las mujeres, independientemente de su potencial reproductivo, deben inscribirse en el programa Macitentan-Containing Products REMS antes de iniciar el tratamiento con OPSUMIT. Los pacientes varones no están inscritos en el REMS.
- Las mujeres en edad fértil deben cumplir con los requisitos de prueba de embarazo y anticoncepción
[ver
Uso en poblaciones específicas (8.3)]
.
- Las farmacias deben estar certificadas con el programa Macitentan-Containing Products REMS y solo deben dispensar a pacientes que estén autorizados a recibir OPSUMIT.
Puede encontrar más información en www.MacitentanREMS.com o llamando al 1-888-572-2934. Puede obtener información sobre las farmacias o los mayoristas certificados por el programa Macitentan-Containing Products REMS llamando al 1-888-572-2934.
5.3 Hepatotoxicity
Los ERA han causado elevaciones de las aminotransferasas, hepatotoxicidad e insuficiencia hepática. La incidencia de aminotransferasas elevadas en el estudio de OPSUMIT en PAH se muestra en la Tabla 1.
| OPSUMIT 10 mg (N=242) |
Placebo (N=249) |
|
|---|---|---|
| >3 × ULN | 3.4% | 4.5% |
| >8 × ULN | 2.1% | 0.4% |
En el estudio controlado con placebo de OPSUMIT, las interrupciones por eventos adversos hepáticos fueron del 3.3% en el grupo de OPSUMIT 10 mg frente al 1.6% en el grupo de placebo.
Obtenga pruebas de enzimas hepáticas antes de iniciar el tratamiento con OPSUMIT y repítalas durante el tratamiento según esté clínicamente indicado
[ver
.
Aconseje a los pacientes que informen sobre los síntomas que sugieran daño hepático (náuseas, vómitos, dolor en el cuadrante superior derecho, fatiga, anorexia, ictericia, orina oscura, fiebre o picazón). Si se producen elevaciones clínicamente relevantes de las aminotransferasas, o si las elevaciones se acompañan de un aumento de la bilirrubina >2 × ULN, o de síntomas clínicos de hepatotoxicidad, interrumpa el tratamiento con OPSUMIT. Considere la posibilidad de reiniciar el tratamiento con OPSUMIT cuando los niveles de enzimas hepáticas se normalicen en pacientes que no hayan experimentado síntomas clínicos de hepatotoxicidad.
5.4 Retención de líquidos
El edema periférico y la retención de líquidos son consecuencias clínicas conocidas de la PAH y efectos conocidos de los ERA. En el estudio controlado con placebo de OPSUMIT en PAH, la incidencia de edema fue del 21.9% en el grupo de OPSUMIT 10 mg y del 20.5% en el grupo de placebo.
Los pacientes con disfunción ventricular izquierda subyacente pueden tener un riesgo particular de desarrollar una retención de líquidos significativa después del inicio del tratamiento con ERA. En un estudio pequeño de OPSUMIT en pacientes con hipertensión pulmonar debido a una disfunción ventricular izquierda, más pacientes en el grupo de OPSUMIT desarrollaron una retención de líquidos significativa y tuvieron más hospitalizaciones debido al empeoramiento de la insuficiencia cardíaca en comparación con los asignados al azar a placebo. Se han notificado casos posteriores a la comercialización de edema y retención de líquidos que ocurrieron a las pocas semanas de comenzar a tomar OPSUMIT, algunos de los cuales requirieron intervención con un diurético u hospitalización por insuficiencia cardíaca descompensada
[ver
.
Controle los signos de retención de líquidos después del inicio del tratamiento con OPSUMIT. Si se desarrolla una retención de líquidos clínicamente significativa, evalúe al paciente para determinar la causa, como OPSUMIT o insuficiencia cardíaca subyacente, y la posible necesidad de suspender OPSUMIT.
5.5 Disminución de la hemoglobina
Se han producido disminuciones en la concentración de hemoglobina y el hematocrito después de la administración de otros ERA y se observaron en estudios clínicos con OPSUMIT. Estas disminuciones ocurrieron temprano y se estabilizaron a partir de entonces. En el estudio controlado con placebo de OPSUMIT en PAH, OPSUMIT 10 mg causó una disminución media de la hemoglobina desde el inicio hasta los 18 meses de aproximadamente 1.0 g/dL en comparación con ningún cambio en el grupo de placebo. Se notificó una disminución de la hemoglobina a menos de 10.0 g/dL en el 8.7% del grupo de OPSUMIT 10 mg y en el 3.4% del grupo de placebo. Las disminuciones en la hemoglobina rara vez requieren transfusión. No se recomienda el inicio de OPSUMIT en pacientes con anemia grave. Mida la hemoglobina antes de iniciar el tratamiento y repita durante el tratamiento según esté clínicamente indicado
[ver
.
5.6 Edema pulmonar con enfermedad veno-oclusiva pulmonar (PVOD)
Si se presentan signos de edema pulmonar, considere la posibilidad de PVOD asociada. Si se confirma, suspenda OPSUMIT.
5.7 Disminución del recuento de espermatozoides
OPSUMIT, al igual que otros ERA, puede tener un efecto adverso sobre la espermatogénesis. Aconseje a los hombres sobre los posibles efectos sobre la fertilidad
[ver
Uso en poblaciones específicas (8.3) y
Toxicología no clínica (13.1)]
.
6 REACCIONES ADVERSAS
Las reacciones adversas clínicamente significativas que aparecen en otras secciones del etiquetado incluyen:
- Toxicidad embrio-fetal
[ver
Advertencias y precauciones (5.1)]
- Hepatotoxicidad
[ver
Advertencias y precauciones (5.3)]
- Retención de líquidos
[ver
Advertencias y precauciones (5.4)]
- Disminución de la hemoglobina
[ver
Advertencias y precauciones (5.5)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica clínica.
Los datos de seguridad para OPSUMIT se obtuvieron principalmente de un estudio clínico controlado con placebo en 742 pacientes con HAP (estudio SERAPHIN)
[ver
La exposición a OPSUMIT en este ensayo fue de hasta 3,6 años con una exposición media de aproximadamente 2 años (N=542 para 1 año; N=429 para 2 años; y N=98 para más de 3 años). La incidencia general de interrupciones del tratamiento debido a eventos adversos fue similar en los grupos de tratamiento con OPSUMIT 10 mg y placebo (aproximadamente el 11%).
La Tabla 2 presenta las reacciones adversas más frecuentes con OPSUMIT que con placebo por ≥3%.
| Reacción adversa | OPSUMIT 10 mg (N=242) (%) |
Placebo (N=249) (%) |
|---|---|---|
| Anemia | 13 | 3 |
| Nasofaringitis/faringitis | 20 | 13 |
| Bronquitis | 12 | 6 |
| Dolor de cabeza | 14 | 9 |
| Influenza | 6 | 2 |
| Infección del tracto urinario | 9 | 6 |
6.2 Experiencia postcomercialización
Las siguientes reacciones adversas se han identificado durante el uso de OPSUMIT después de la aprobación. Debido a que estas reacciones se notifican voluntariamente de una población de tamaño incierto, no siempre es posible estimar de forma fiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos del sistema inmunitario:reacciones de hipersensibilidad (angioedema, prurito y erupción cutánea)
Trastornos vasculares: rubor
Trastornos respiratorios, torácicos y mediastínicos: congestión nasal
Trastornos gastrointestinales: Se han notificado elevaciones de las aminotransferasas hepáticas (ALT, AST) y lesiones hepáticas con el uso de OPSUMIT; en la mayoría de los casos se pudieron identificar causas alternativas (insuficiencia cardíaca, congestión hepática, hepatitis autoinmune). Los antagonistas de los receptores de la endotelina se han asociado con elevaciones de las aminotransferasas, hepatotoxicidad y casos de insuficiencia hepática
[ver
Advertencias y precauciones (5.3)]
.
Trastornos generales y condiciones del lugar de administración:edema/retención de líquidos. Se produjeron casos de edema y retención de líquidos en las semanas posteriores al inicio de OPSUMIT, algunos de los cuales requirieron intervención con un diurético, manejo de líquidos u hospitalización por insuficiencia cardíaca descompensada.
[ver
Advertencias y precauciones (5.4)].
Trastornos cardíacos: hipotensión sintomática
7 INTERACCIONES MEDICAMENTOSAS
7.1 Inductores Fuertes de CYP3A4
Los inductores fuertes de CYP3A4, como la rifampicina, reducen significativamente la exposición a macitentan. Se debe evitar el uso concomitante de OPSUMIT con inductores fuertes de CYP3A4
[ver
.
7.2 Inhibidores Fuertes de CYP3A4
El uso concomitante de inhibidores fuertes de CYP3A4 como el ketoconazol duplica aproximadamente la exposición a macitentan. Muchos medicamentos para el VIH, como el ritonavir, son inhibidores fuertes de CYP3A4. Evite el uso concomitante de OPSUMIT con inhibidores fuertes de CYP3A4
[ver
. Use otras opciones de tratamiento para la HAP cuando se necesiten inhibidores fuertes de CYP3A4 como parte del tratamiento del VIH
[ver
.
7.3 Inhibidores Duales o Combinados Moderados de CYP3A4 y CYP2C9
Se predice que el uso concomitante de inhibidores duales moderados de CYP3A4 y CYP2C9, como el fluconazol, aumentará la exposición a macitentan aproximadamente 4 veces según el modelado farmacocinético basado en la fisiología (PBPK). Evite el uso concomitante de OPSUMIT con inhibidores duales moderados de CYP3A4 y CYP2C9 (como fluconazol y amiodarona)
[ver
.
También se debe evitar el tratamiento concomitante de un inhibidor moderado de CYP3A4 y un inhibidor moderado de CYP2C9 con OPSUMIT
[ver
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgos
Basado en datos de estudios de reproducción animal, OPSUMIT puede causar toxicidad embrio-fetal, incluyendo defectos de nacimiento y muerte fetal, cuando se administra a una hembra embarazada y está contraindicado durante el embarazo. Existen riesgos para la madre y el feto asociados con la hipertensión arterial pulmonar en el embarazo
[ver
. Hay datos limitados sobre el uso de OPSUMIT en mujeres embarazadas. Macitentan fue teratógeno en conejos y ratas a todas las dosis probadas. Si este medicamento se usa durante el embarazo, o si la paciente queda embarazada mientras toma este medicamento, informe a la paciente del riesgo para el feto
[ver
.
El riesgo de fondo estimado de defectos de nacimiento mayores y aborto espontáneo para la población indicada es desconocido. Todos los embarazos tienen un riesgo de fondo de defectos de nacimiento, pérdida u otros resultados adversos. En la población general de los EE. UU., el riesgo de fondo estimado de defectos de nacimiento mayores y aborto espontáneo en embarazos clínicamente reconocidos es del 2 al 4% y del 15 al 20%, respectivamente.
Datos
Datos de Animales
Tanto en conejos como en ratas, hubo anomalías cardiovasculares y de fusión del arco mandibular. La administración de macitentan a ratas hembras desde el final del embarazo hasta la lactancia provocó una reducción de la supervivencia de las crías y un deterioro de la fertilidad masculina de la descendencia a todos los niveles de dosis probados.
8.2 Lactancia
Resumen de Riesgos
No hay datos sobre la presencia de macitentan en la leche materna, los efectos en el lactante o el efecto sobre la producción de leche. Debido al potencial de reacciones adversas graves en los lactantes de OPSUMIT, se recomienda a las mujeres que no amamanten durante el tratamiento con OPSUMIT.
8.3 Mujeres y Hombres en Edad Reproductiva
Prueba de Embarazo
Verifique el estado de embarazo de las mujeres en edad reproductiva antes de iniciar OPSUMIT, mensualmente durante el tratamiento y un mes después de suspender el tratamiento con OPSUMIT. La paciente debe comunicarse con su médico de inmediato para hacerse una prueba de embarazo si se retrasa el inicio de la menstruación o se sospecha un embarazo. Si la prueba de embarazo es positiva, el médico y la paciente deben discutir los riesgos para ella, el embarazo y el feto
[ver
Advertencias y Precauciones (5.1), y
Dosificación y Administración (2.2) y
Contraindicación (4.1)]
.
Anticoncepción
Las pacientes de sexo femenino en edad reproductiva deben utilizar métodos anticonceptivos aceptables durante el tratamiento con OPSUMIT y durante 1 mes después del tratamiento con OPSUMIT. Las pacientes pueden elegir una forma de anticoncepción altamente efectiva (dispositivos intrauterinos (DIU), implantes anticonceptivos o esterilización tubárica) o una combinación de métodos (método hormonal con un método de barrera o dos métodos de barrera). Si la vasectomía de un compañero es el método anticonceptivo elegido, se debe utilizar un método hormonal o de barrera junto con este método. Oriente a las pacientes sobre la planificación y prevención del embarazo, incluida la anticoncepción de emergencia, o designe la orientación por otro proveedor de atención médica capacitado en orientación anticonceptiva
[ver
Advertencias y Precauciones (5.1)]
.
Infertilidad
Basado en hallazgos en animales, OPSUMIT puede afectar la fertilidad en hombres en edad reproductiva. No se sabe si los efectos sobre la fertilidad serían reversibles
[ver
Advertencias y Precauciones (5.7),
Reacciones Adversas (6.1) y
Toxicología No Clínica (13.1)]
.
8.5 Uso Geriátrico
Del total de sujetos en el estudio clínico de OPSUMIT para HAP, el 14% tenía 65 años o más. No se observaron diferencias generales en la seguridad o eficacia entre estos sujetos y los sujetos más jóvenes.
10 SOBREDOSIS
OPSUMIT se ha administrado como una dosis única de hasta 600 mg inclusive a sujetos sanos (60 veces la dosis aprobada). Se observaron reacciones adversas de dolor de cabeza, náuseas y vómitos. En caso de sobredosis, se deben tomar medidas de apoyo estándar, según sea necesario. Es poco probable que la diálisis sea efectiva porque macitentan se une en gran medida a las proteínas.
11 DESCRIPCIÓN
OPSUMIT
® (macitentan) es un antagonista del receptor de endotelina. El nombre químico de macitentan es N-[5-(4-Bromofenil)-6-[2-[(5-bromo-2-pirimidinil)oxi]etoxi]-4-pirimidinil]-N’-propilsulfamida. Tiene una fórmula molecular de C
19H
20Br
2N
6O
4S y un peso molecular de 588,27. Macitentan es aquiral y tiene la siguiente fórmula estructural:
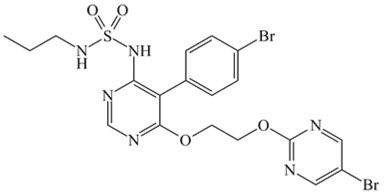
Macitentan es un polvo cristalino que es insoluble en agua. En estado sólido, macitentan es muy estable, no es higroscópico y no es sensible a la luz.
OPSUMIT está disponible como un comprimido recubierto con película de 10 mg para administración oral una vez al día. Los comprimidos incluyen los siguientes ingredientes inactivos: lactosa monohidrato, estearato de magnesio, celulosa microcristalina, polisorbato 80, povidona y almidón glicolato de sodio Tipo A. Los comprimidos están recubiertos con película con un material de recubrimiento que contiene alcohol polivinílico, lecitina de soja, talco, dióxido de titanio y goma xantana.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
La endotelina (ET)-1 y sus receptores (ET
A y ET
B) median una variedad de efectos deletéreos, como vasoconstricción, fibrosis, proliferación, hipertrofia e inflamación. En condiciones de enfermedad como la HAP, el sistema ET local está regulado positivamente y está involucrado en la hipertrofia vascular y en el daño orgánico.
Macitentan es un antagonista del receptor de endotelina que inhibe la unión de ET-1 a ambos ET
A y ET
B receptores. Macitentan muestra alta afinidad y ocupación sostenida de los receptores ET en las células musculares lisas arteriales pulmonares humanas. Uno de los metabolitos de macitentan también es farmacológicamente activo en los receptores ET y se estima que es aproximadamente un 20% tan potente como el fármaco original
in vitro. Se desconoce el impacto clínico del bloqueo dual de la endotelina.
12.2 Farmacodinamia
Hemodinámica pulmonar
El estudio de eficacia clínica en pacientes con hipertensión arterial pulmonar evaluó los parámetros hemodinámicos en un subgrupo de pacientes después de 6 meses de tratamiento. Los pacientes tratados con OPSUMIT 10 mg (N=57) lograron una reducción mediana del 37% (IC del 95% 22–49) en la resistencia vascular pulmonar y un aumento de 0,6 L/min/m
2(IC del 95% 0,3–0,9) en el índice cardíaco en comparación con placebo (N=67).
12.3 Farmacocinética
La farmacocinética de macitentan y su metabolito activo se ha estudiado principalmente en sujetos sanos. La farmacocinética de macitentan es proporcional a la dosis en un rango de 1 mg a 30 mg después de la administración una vez al día.
Una comparación de estudios cruzados muestra que las exposiciones a macitentan y su metabolito activo en pacientes con HAP son similares a las observadas en sujetos sanos.
Absorción y distribución
La concentración plasmática máxima de macitentan se alcanza aproximadamente 8 horas después de la administración oral. La biodisponibilidad absoluta después de la administración oral no se conoce. En un estudio en sujetos sanos, la exposición a macitentan y su metabolito activo no se modificó después de un desayuno rico en grasas. Por lo tanto, macitentan se puede tomar con o sin alimentos.
Macitentan y su metabolito activo están altamente unidos a las proteínas plasmáticas (>99%), principalmente a la albúmina y en menor medida a la alfa-1-ácido glicoproteína. Los volúmenes aparentes de distribución (Vss/F) de macitentan y su metabolito activo fueron de aproximadamente 50 L y 40 L, respectivamente, en sujetos sanos.
Metabolismo y eliminación
Después de la administración oral, las semividas de eliminación aparentes de macitentan y su metabolito activo son de aproximadamente 16 horas y 48 horas, respectivamente. Macitentan se metaboliza principalmente por despropilación oxidativa de la sulfamida para formar el metabolito farmacológicamente activo. Esta reacción depende del sistema del citocromo P450 (CYP), principalmente CYP3A4 con contribuciones menores de CYP2C8, CYP2C9 y CYP2C19. En estado estacionario en pacientes con HAP, la exposición sistémica al metabolito activo es 3 veces la exposición a macitentan y se espera que contribuya aproximadamente el 40% de la actividad farmacológica total. En un estudio en sujetos sanos con macitentan marcado radiactivamente, aproximadamente el 50% del material del fármaco radiactivo se eliminó en la orina, pero ninguno estaba en forma de fármaco sin cambios o del metabolito activo. Alrededor del 24% del material del fármaco radiactivo se recuperó de las heces.
Poblaciones especiales
No hay efectos clínicamente relevantes de la edad, el sexo o la raza en la farmacocinética de macitentan y su metabolito activo.
Insuficiencia renal
La exposición a macitentan y su metabolito activo en pacientes con insuficiencia renal grave (CrCl 15–29 mL/min) en comparación con sujetos sanos aumentó un 30% y un 60%, respectivamente. Este aumento no se considera clínicamente relevante.
Insuficiencia hepática
La exposición a macitentan disminuyó un 21%, 34% y 6% y la exposición al metabolito activo disminuyó un 20%, 25% y 25% en sujetos con insuficiencia hepática leve, moderada o grave (Child-Pugh Clase A, B y C), respectivamente. Esta disminución no se considera clínicamente relevante.
Interacciones medicamentosas
Estudios in vitro
A los niveles plasmáticos obtenidos con la dosificación a 10 mg una vez al día, macitentan no tiene efectos inhibitorios o inductores relevantes sobre las enzimas CYP. Macitentan no es un sustrato o inhibidor de la proteína de resistencia a múltiples fármacos (P-gp, MDR-1). El metabolito activo de macitentan tampoco es un inhibidor de P-gp/MDR-1 a concentraciones clínicamente relevantes.
No se espera que macitentan y su metabolito activo tengan una interacción significativa con los transportadores de fármacos como la polipéptido transportador de aniones orgánicos (OATP1B1, OATP1B3), la proteína de extrusión de múltiples fármacos y toxinas (MATE-1, MATE-2K), la bomba de exportación de sales biliares (BSEP), el polipéptido cotransportador de taurocolato de sodio (NTCP), el transportador de cationes orgánicos (OCT-1, OCT-3), el transportador de aniones orgánicos (OAT-1, OAT-3) o el transportador BCRP a concentraciones plasmáticas clínicamente relevantes.
Estudios in vivo
Efecto de otros fármacos sobre macitentan
El efecto de otros medicamentos en macitentan y su metabolito activo se estudió en sujetos sanos y se muestra en la Figura 1 a continuación.
Figura 1
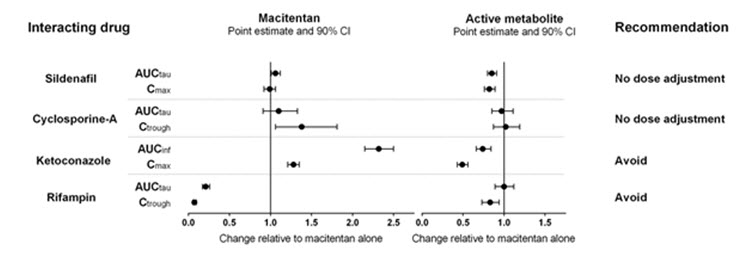
Los efectos de otros inhibidores potentes del CYP3A4 como el ritonavir en macitentan no se estudiaron, pero es probable que provoquen un aumento en la exposición a macitentan en estado estacionario similar al observado con ketoconazol
[ver
Interacciones medicamentosas (7.2)]
.
El modelado PBPK y los análisis basados en simulaciones mostraron que se predice que un inhibidor dual moderado de CYP3A4 y CYP2C9 como fluconazol (400 mg una vez al día) aumentará la exposición a macitentan aproximadamente 4 veces sin un efecto relevante en la exposición a su metabolito activo
[ver
Interacciones medicamentosas (7.3)]
.
Efecto de macitentan en otros medicamentos
Warfarina: La dosificación diaria de macitentan no alteró la exposición a la R- y S-warfarina o su efecto en la relación internacional normalizada (INR).
Sildenafilo: En estado estacionario, la exposición al sildenafilo 20 mg t.i.d. aumentó un 15% durante la administración concomitante de macitentan 10 mg una vez al día. Este cambio no se considera clínicamente relevante.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Carcinogénesis
Los estudios de carcinogenicidad de 2 años de duración no revelaron ningún potencial carcinogénico a exposiciones 75 veces y 140 veces la exposición humana (basada en AUC) en ratones machos y hembras, respectivamente, y 8.3 y 42 veces en ratas machos y hembras, respectivamente.
Mutagénesis
Macitentan no fue genotóxico en una batería estándar de
in vitro y
in vivo ensayos que incluyeron un ensayo de mutación inversa bacteriana, un ensayo para mutaciones genéticas en células de linfoma de ratón, una prueba de aberración cromosómica en linfocitos humanos y una
in vivo prueba de micronúcleos en ratas.
Deterioro de la Fertilidad
El tratamiento de ratas juveniles desde el día 4 posnatal hasta el día 114 condujo a una reducción del aumento de peso corporal y atrofia tubular testicular a exposiciones 7 veces la exposición humana. La fertilidad no se vio afectada.
Se observó dilatación tubular testicular reversible en estudios de toxicidad crónica a exposiciones superiores a 7 veces y 23 veces la exposición humana en ratas y perros, respectivamente. Después de 2 años de tratamiento, se observó atrofia tubular en ratas a 4 veces la exposición humana. Macitentan no afectó la fertilidad masculina o femenina a exposiciones que van desde 19 a 44 veces la exposición humana, respectivamente, y no tuvo ningún efecto en el conteo de espermatozoides, la motilidad y la morfología en ratas macho. No se observaron hallazgos testiculares en ratones después del tratamiento hasta por 2 años.
13.2 Toxicología Animal
En perros, macitentan disminuyó la presión arterial a exposiciones similares a la exposición humana terapéutica. Se observó engrosamiento íntimo de las arterias coronarias a 17 veces la exposición humana después de 4 a 39 semanas de tratamiento. Debido a la sensibilidad específica de la especie y el margen de seguridad, este hallazgo se considera no relevante para los humanos.
No hubo hallazgos adversos en el hígado en estudios a largo plazo realizados en ratones, ratas y perros a exposiciones de 12 a 116 veces la exposición humana.
14 ESTUDIOS CLÍNICOS
14.1 Hipertensión Arterial Pulmonar
El efecto de macitentan sobre la progresión de la HAP se demostró en un estudio multicéntrico, a largo plazo (duración media de la exposición aproximadamente 2 años), controlado con placebo en 742 pacientes con HAP sintomática [clase funcional (FC) II-IV de la OMS] que fueron asignados aleatoriamente a placebo (n=250), 3 mg de macitentan (n=250) o 10 mg de macitentan (n=242) una vez al día. Los pacientes fueron tratados con OPSUMIT en monoterapia o en combinación con inhibidores de la fosfodiesterasa-5 o prostanoide inhalados.
El criterio de valoración principal del estudio fue el tiempo hasta la primera aparición de la muerte, un evento de morbilidad significativo, definido como septostomía atrial, trasplante de pulmón, inicio de prostanoides IV o subcutáneos (SC), u “otro empeoramiento de la HAP” durante el tratamiento doble ciego más 7 días. El empeoramiento de la HAP se definió como todos los siguientes: 1) una disminución sostenida ≥15% desde el inicio en la distancia recorrida en 6 minutos (6MWD), 2) empeoramiento de los síntomas de la HAP (empeoramiento de la FC de la OMS), y 3) necesidad de tratamiento adicional para la HAP. Todos estos otros eventos de empeoramiento fueron confirmados por un comité de adjudicación independiente, ciego a la asignación del tratamiento. Un criterio de valoración secundario crítico fue el tiempo hasta la muerte por HAP u hospitalización por HAP.
La edad media de los pacientes fue de 46 años (el 14% tenía 65 años o más). La mayoría de los pacientes eran blancos (55%) o asiáticos (29%) y mujeres (77%). Aproximadamente el 52%, el 46% y el 2% de los pacientes estaban en la FC II, III y IV de la OMS, respectivamente.
La HAP idiopática o hereditaria fue la etiología más común en la población del estudio (57%), seguida de la HAP causada por trastornos del tejido conectivo (31%), la HAP causada por cardiopatía congénita con derivaciones reparadas (8%) y la HAP causada por otras etiologías [medicamentos y toxinas (3%) y VIH (1%)].
En el inicio, la mayoría de los pacientes inscritos (64%) estaban siendo tratados con una dosis estable de terapia específica para la HAP, ya sea inhibidores orales de la fosfodiesterasa (61%) y/o prostanoides inhalados/orales (6%).
Los resultados del estudio se describen para los grupos placebo y OPSUMIT 10 mg. Las duraciones medias del tratamiento fueron de 101 y 118 semanas en los grupos placebo y OPSUMIT 10 mg, respectivamente, hasta un máximo de 188 semanas.
El tratamiento con OPSUMIT 10 mg dio como resultado una reducción del 45% (HR 0,55, IC del 97,5% 0,39-0,76; p de logrank <0,0001) en la aparición del criterio de valoración principal hasta el final del tratamiento doble ciego en comparación con el placebo (Tabla 3 y Figura 2). El efecto beneficioso de OPSUMIT 10 mg se atribuyó principalmente a una reducción en los eventos de empeoramiento clínico (deterioro en la 6MWD y empeoramiento de los síntomas de la HAP y necesidad de tratamiento adicional para la HAP).
Figura 2 Estimaciones de Kaplan-Meier de la aparición del evento del criterio de valoración principal en el estudio SERAPHIN
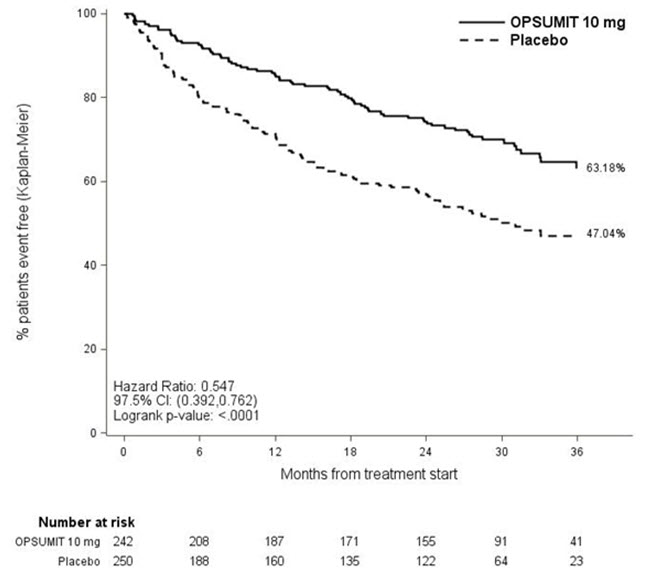
| Placebo N=250 n (%) |
OPSUMIT 10 mg N=242 n (%) |
|
|---|---|---|
|
||
| Pacientes con un evento del criterio de valoración principal | 116 (46.4) | 76 (31.4) |
| Componente como primer evento | ||
| Empeoramiento de la HAP | 93 (37.2) | 59 (24.4) |
| Muerte | 17 (6.8) | 16 (6.6) |
| Prostanoides IV/SC | 6 (2.4) | 1 (0.4) |
Se realizaron análisis de subgrupos para examinar su influencia en el resultado, como se muestra en la Figura 3. Se observó una eficacia consistente de OPSUMIT 10 mg en el criterio de valoración principal en todos los subgrupos de edad, sexo, raza, etiología, por monoterapia o en combinación con otra terapia para la HAP, 6MWD basal y FC basal de la OMS.
Figura 3 Análisis de subgrupos del estudio SERAPHIN
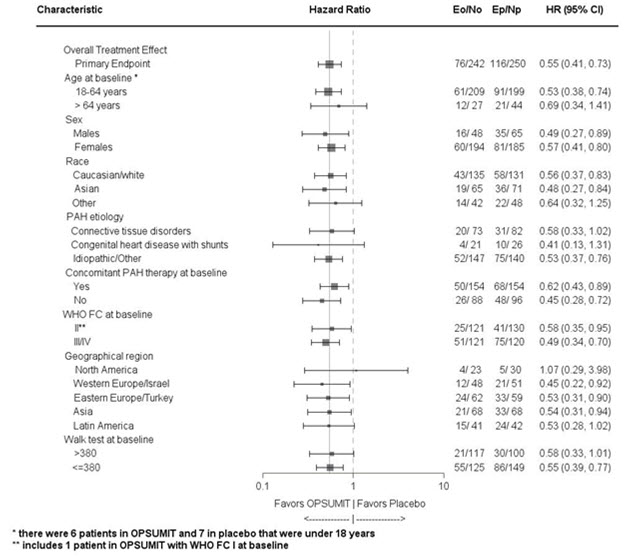
Eo = Número de eventos OPSUMIT 10 mg; No = Número de pacientes aleatorizados a OPSUMIT 10 mg
Ep = Número de eventos placebo; Np = Número de pacientes aleatorizados a placebo
La muerte relacionada con la HAP u hospitalización por HAP se evaluó como criterio de valoración secundario. El riesgo de muerte relacionada con la HAP u hospitalización por HAP se redujo en un 50% en los pacientes que recibieron OPSUMIT 10 mg en comparación con el placebo (HR 0,50, IC del 97,5% 0,34-0,75; p de logrank <0,0001) (Tabla 4 y Figura 4).
Figura 4 Estimaciones de Kaplan-Meier de la aparición de la muerte por HAP u hospitalización por HAP en SERAPHIN
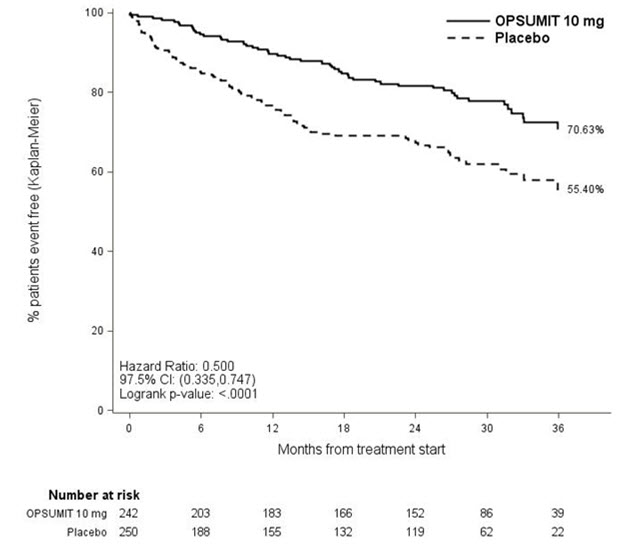
| Placebo (N=250) n (%) |
OPSUMIT 10 mg (N=242) n (%) |
|
|---|---|---|
| Muerte por HAP u hospitalización por HAP | 84 (33.6) | 50 (20.7) |
| Componente como primer evento | ||
| Muerte por HAP | 5 (2.0) | 5 (2.1) |
| Hospitalización por HAP | 79 (31.6) | 45 (18.6) |
El tratamiento con OPSUMIT 10 mg dio como resultado un aumento medio corregido por placebo en la D6MW de 22 metros al mes 6 (IC del 97,5% 3–41; p=0,0078), con una mejora significativa en la D6MW al mes 3. La D6MW aumentó más en pacientes con peor clase funcional de la OMS de referencia (37 metros y 12 metros de aumento medio corregido por placebo en la FC III/IV y FC I/II de la OMS, respectivamente). El aumento de la D6MW logrado con OPSUMIT se mantuvo durante la duración del estudio.
El tratamiento con OPSUMIT 10 mg condujo a una mejora de al menos una clase funcional de la OMS al mes 6 en el 22% de los pacientes en comparación con el 13% de los pacientes tratados con placebo.
Tratamiento a largo plazo de la HAP
En el seguimiento a largo plazo de los pacientes que fueron tratados con OPSUMIT 10 mg en el estudio controlado con placebo (N=242) y el estudio de extensión de etiqueta abierta, las estimaciones de Kaplan-Meier de supervivencia a 1, 2, 5 y 7 años fueron del 95%, 89%, 73% y 63%, respectivamente. La exposición media a OPSUMIT fue de 4,6 años. Estas observaciones no controladas no permiten la comparación con un grupo que no recibió OPSUMIT y no se pueden utilizar para determinar el efecto a largo plazo de OPSUMIT sobre la mortalidad.
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
OPSUMIT
® (macitentan) las tabletas son de 10 mg, blancas, recubiertas con película, biconvexas, con “10” en ambos lados y se suministran de la siguiente manera:
15 unidades / blísteres de aluminio de PVC/ PE/PVDC en caja (NDC 66215-501-15)
30 unidades en frasco blanco de polietileno de alta densidad en caja (NDC 66215-501-30)
Almacenar a 20ºC a 25ºC (68ºF a 77ºF). Se permiten excursiones entre 15°C y 30°C (59°F y 86°F).
[Ver USP Temperatura ambiente controlada].
Mantener fuera del alcance de los niños.
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente que lea el etiquetado del paciente aprobado por la FDA (Guía de medicamentos).
Toxicidad embrionaria y fetal
Aconseje a las pacientes en edad fértil sobre la necesidad de utilizar métodos anticonceptivos fiables durante el tratamiento con OPSUMIT y durante un mes después de la interrupción del tratamiento. Las mujeres en edad fértil deben hacerse pruebas de embarazo mensuales y deben utilizar métodos anticonceptivos fiables mientras toman OPSUMIT y durante un mes después de dejar de tomar OPSUMIT
[ver
Uso en poblaciones específicas (8.1)]
.
Productos que contienen macitentan REMS
Para las pacientes, OPSUMIT solo está disponible a través de un programa restringido llamado Macitentan-Containing Products REMS
[ver
Advertencias y precauciones (5.2)]
. Los pacientes masculinos no están inscritos en el Macitentan-Containing Products REMS.
Las pacientes pueden elegir una forma de anticoncepción altamente efectiva (dispositivos intrauterinos (DIU), implantes anticonceptivos o esterilización tubárica) o una combinación de métodos (método hormonal con un método de barrera o dos métodos de barrera).
Se debe instruir a las pacientes para que se pongan en contacto con su médico si sospechan que pueden estar embarazadas. Las pacientes deben buscar asesoramiento anticonceptivo adicional de un ginecólogo o un experto similar según sea necesario.
Informe a las pacientes (y a sus tutores, si corresponde) de los siguientes requisitos notables.
- Las pacientes deben firmar un formulario de inscripción.
- Las pacientes en edad fértil deben cumplir con los requisitos de pruebas de embarazo y anticoncepción
[ver
Uso en poblaciones específicas (8.3)]
.
Eduque y aconseje a las mujeres en edad fértil sobre el uso de la anticoncepción de emergencia en caso de relaciones sexuales sin protección o fallo anticonceptivo.
Aconseje a las mujeres prepubertales que informen inmediatamente a su médico de cualquier cambio en su estado reproductivo.
Revise la Guía de medicamentos y los materiales educativos de REMS con las pacientes.
Lactancia
Aconseje a las mujeres que no den el pecho durante el tratamiento con OPSUMIT
[ver
Uso en población específica (8.2)]
.
Hepatotoxicidad
Algunos miembros de esta clase farmacológica son hepatotóxicos. Eduque a los pacientes sobre los signos de hepatotoxicidad. Aconseje a los pacientes que deben ponerse en contacto con su médico si tienen náuseas inexplicables, vómitos, dolor en el cuadrante superior derecho, fatiga, anorexia, ictericia, orina oscura, fiebre o picazón.
Retención de líquidos
Eduque a los pacientes sobre los signos de retención de líquidos. Aconseje a los pacientes que deben ponerse en contacto con su médico si tienen un aumento de peso inusual o hinchazón de los tobillos o las piernas.
SECCIÓN NO CLASIFICADA SPL
Fabricado para:
Actelion Pharmaceuticals US, Inc.,
una compañía farmacéutica de Janssen
Titusville, NJ 08560, USA
Para información de patentes: www.janssenpatents.com
© 2013 – 2019 Actelion Pharmaceuticals US, Inc. Todos los derechos reservados.
Guía de medicación
| GUÍA DE MEDICAMENTOS OPSUMIT ® (OP-sum-it) (macitentan) tabletas |
||
|---|---|---|
| Esta Guía de Medicamentos ha sido aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos. | Revisada: 03/2024 | |
| Lea esta Guía de Medicamentos de OPSUMIT antes de comenzar a tomar OPSUMIT y cada vez que obtenga un recambio. Puede haber nueva información. Esta Guía de Medicamentos no reemplaza la conversación con su proveedor de atención médica sobre su condición médica o su tratamiento. | ||
|
¿Cuál es la información más importante que debo saber acerca de OPSUMIT? |
||
|
||
| OPSUMIT puede provocar defectos congénitos graves si se toma durante el embarazo. | ||
|
||
| Las mujeres que puedan quedar embarazadas deben utilizar dos formas aceptables de anticoncepción durante el tratamiento con OPSUMIT y durante un mes después de dejar de tomar OPSUMIT porque el medicamento puede seguir en el cuerpo. | ||
|
||
Vea la tabla a continuación para las Opciones de Anticoncepción Aceptables durante el tratamiento con OPSUMIT. 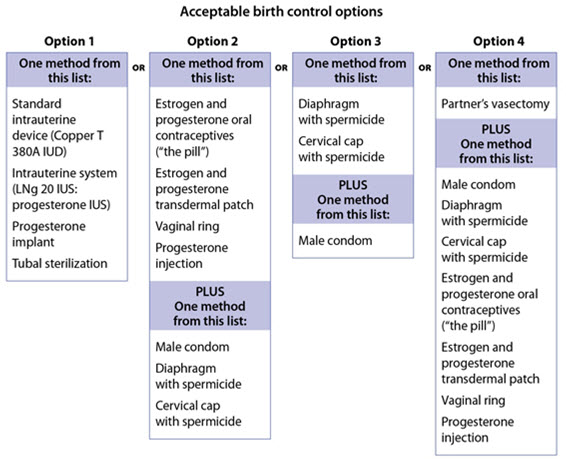 |
||
|
||
| Si usted es el padre o cuidador de una niña que comenzó a tomar OPSUMIT antes de alcanzar la pubertad, debe controlarla periódicamente para ver si está desarrollando signos de pubertad. Dígale inmediatamente a su proveedor de atención médica si nota que está desarrollando bultos en los pechos o cualquier vello púbico. Su proveedor de atención médica debe decidir si su hija ha alcanzado la pubertad. Su hija puede alcanzar la pubertad antes de tener su primer periodo menstrual. | ||
| Las mujeres solo pueden recibir OPSUMIT a través de un programa restringido llamado Estrategia de Evaluación y Mitigación de Riesgos de Productos que Contienen Macitentan (REMS). Si usted es una mujer que puede quedar embarazada, debe hablar con su proveedor de atención médica, comprender los beneficios y riesgos de OPSUMIT y aceptar todas las instrucciones en el REMS de Productos que Contienen Macitentan. | ||
| Los hombres pueden recibir OPSUMIT sin participar en el REMS de Productos que Contienen Macitentan. | ||
| ¿Qué es OPSUMIT? | ||
|
||
| ¿Quién no debe tomar OPSUMIT? | ||
¿Cuál es la información más importante que debo saber sobre OPSUMIT?“).
No tome OPSUMIT si es alérgico a macitentan o a cualquiera de los ingredientes de OPSUMIT. Vea al final de esta Guía de medicamentos una lista completa de los ingredientes de OPSUMIT.
- Tome OPSUMIT exactamente como su proveedor de atención médica le indique. No deje de tomar OPSUMIT a menos que su proveedor de atención médica se lo indique.
- Puede tomar OPSUMIT con o sin alimentos.
- Si toma demasiado OPSUMIT, llame a su proveedor de atención médica o vaya a la sala de emergencias del hospital más cercano de inmediato.
- Si olvida una dosis de OPSUMIT, tómela tan pronto como lo recuerde ese día. Tome la siguiente dosis a su hora habitual. No tome 2 dosis al mismo tiempo para compensar una dosis olvidada.
-
No se quede embarazada mientras toma OPSUMIT. Vea la sección sobre defectos de nacimiento graves de la Guía de medicamentos arriba llamada ”
¿Cuál es la información más importante que debo saber sobre OPSUMIT?” Si se pierde un período menstrual o cree que podría estar embarazada, llame a su proveedor de atención médica de inmediato. - No se sabe si OPSUMIT pasa a la leche materna. No debe amamantar si toma OPSUMIT. Hable con su proveedor de atención médica sobre la mejor manera de alimentar a su bebé si toma OPSUMIT.
-
Defectos de nacimiento graves. Vea ”
¿Cuál es la información más importante que debo saber sobre OPSUMIT?” - Algunos medicamentos que son como OPSUMIT pueden causar problemas hepáticos. Su proveedor de atención médica debe hacerle análisis de sangre para controlar su hígado antes de que comience a tomar OPSUMIT. Informe a su proveedor de atención médica si tiene alguno de los siguientes síntomas de problemas hepáticos mientras toma OPSUMIT.
- náuseas o vómitos
- dolor en la parte superior derecha del estómago
- cansancio
- pérdida de apetito
- color amarillento de la piel o el blanco de los ojos
- orina oscura
- fiebre
- picazón
- Retención de líquidos puede ocurrir dentro de las semanas posteriores al inicio de OPSUMIT. Informe a su proveedor de atención médica de inmediato si tiene algún aumento de peso inusual o hinchazón de los tobillos o las piernas. Su proveedor de atención médica buscará la causa de cualquier retención de líquidos.
- Niveles bajos de glóbulos rojos (anemia) pueden ocurrir con el tratamiento con OPSUMIT, generalmente durante las primeras semanas después de comenzar la terapia. En algunos casos, puede ser necesaria una transfusión de sangre, pero esto no es común. Su proveedor de atención médica le hará análisis de sangre para controlar sus glóbulos rojos antes de comenzar a tomar OPSUMIT. Su proveedor de atención médica también puede necesitar hacer estas pruebas durante el tratamiento con OPSUMIT.
- Disminución del conteo de espermatozoides. OPSUMIT y otros medicamentos como OPSUMIT pueden causar una disminución del conteo de espermatozoides en los hombres que toman estos medicamentos. Una disminución del conteo de espermatozoides puede afectar la capacidad de engendrar un hijo. Informe a su proveedor de atención médica si la posibilidad de tener hijos es importante para usted.
- Nariz congestionada o dolor de garganta
- Irritación de las vías respiratorias (bronquitis)
- Dolor de cabeza
- Gripe
- Infección del tracto urinario
- Almacene las tabletas de OPSUMIT a temperatura ambiente entre 68 °F y 77 °F (20 °C y 25 °C).
- Mantenga OPSUMIT y todos los medicamentos fuera del alcance de los niños.
Actelion Pharmaceuticals US, Inc.,
una compañía farmacéutica de Janssen
Titusville, NJ 08560, USA
Para información de patentes: www.janssenpatents.com
© 2013 – 2019 Actelion Pharmaceuticals US, Inc. Todos los derechos reservados.
PANEL DE EXHIBICIÓN PRINCIPAL – Botella de comprimidos de 10 mg Caja de cartón
NDC 66215-501-30
Opsumit
®
(macitentan) tablets
10 mg
Dispense the
accompanying
Medication Guide
to each patient
Rx only
30 film-coated tablets
janssen