Fabricante de medicamentos: AbbVie Inc. (Updated: 2024-06-18)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
SKYRIZI® (risankizumab-rzaa) inyección, para uso subcutáneo o intravenoso uso
Aprobación inicial en EE. UU.: 2019
CAMBIOS MAYORES RECIENTES
| Indicaciones y uso, Colitis ulcerosa (1.4) | 6/2024 |
| Dosificación y administración, Consideraciones generales para la administración (2.2) | 1/2024 |
| Instrucciones de preparación y administración (Psoriasis en placas y artritis psoriásica) (2.5) | 1/2024 |
| Dosificación y administración, Dosificación recomendada para la colitis ulcerosa (2.7) | 6/2024 |
| Dosificación y administración, Instrucciones de preparación y administración (Enfermedad de Crohn y colitis ulcerosa) (2.8) | 6/2024 |
| Advertencias y precauciones, Hepatotoxicidad en el tratamiento de la enfermedad inflamatoria intestinal (5.4) | 6/2024 |
INDICACIONES Y USO
SKYRIZI es un antagonista de la interleucina-23 indicado para el tratamiento de:
DOSIFICACIÓN Y ADMINISTRACIÓN
- Para el tratamiento de la enfermedad de Crohn y la colitis ulcerosa: Obtenga los niveles de enzimas hepáticas y bilirrubina antes de iniciar el tratamiento con SKYRIZI. (2.1, 5.4)
- Complete todas las vacunas apropiadas para la edad según lo recomendado por las pautas de inmunización actuales (2.1, 5.5)
Dosis recomendada
Psoriasis en placas y artritis psoriásica:
- 150 mg administrados por inyección subcutánea en la Semana 0, la Semana 4 y cada 12 semanas a partir de entonces. (2.3, 2.4)
- En pacientes con artritis psoriásica, SKYRIZI se puede administrar solo o en combinación con fármacos antirreumáticos modificadores de la enfermedad (FARME) no biológicos. (2.4)
Enfermedad de Crohn:
- La dosis de inducción recomendada es de 600 mg administrados por infusión intravenosa durante al menos una hora en la Semana 0, la Semana 4 y la Semana 8. La dosis de mantenimiento recomendada es de 180 mg o 360 mg administrados por inyección subcutánea en la Semana 12 y cada 8 semanas a partir de entonces. Use la dosis efectiva más baja para mantener la respuesta terapéutica. (2.6)
Colitis ulcerosa:
- La dosis de inducción recomendada es de 1,200 mg administrados por infusión intravenosa durante al menos dos horas en la Semana 0, la Semana 4 y la Semana 8. La dosis de mantenimiento recomendada es de 180 mg o 360 mg administrados por inyección subcutánea en la Semana 12 y cada 8 semanas a partir de entonces. Use la dosis efectiva más baja para mantener la respuesta terapéutica. (2.7)
FORMAS Y FUERZAS DE DOSIFICACIÓN
Inyección subcutánea (3)
- Inyección: 150 mg/mL en cada pluma precargada de dosis única.
- Inyección: 90 mg/mL en cada jeringa precargada de dosis única.
- Inyección: 150 mg/mL en cada jeringa precargada de dosis única.
- Inyección: 180 mg/1.2 mL (150 mg/mL) en cada cartucho precargado de dosis única.
- Inyección: 360 mg/2.4 mL (150 mg/mL) en cada cartucho precargado de dosis única.
Infusión intravenosa (3)
- Inyección: 600 mg/10 mL (60 mg/mL) en cada vial de dosis única.
CONTRAINDICACIONES
- SKYRIZI está contraindicado en pacientes con antecedentes de reacción de hipersensibilidad grave a risankizumab-rzaa o a cualquiera de los excipientes (4)
ADVERTENCIAS Y PRECAUCIONES
- Reacciones de hipersensibilidad: Pueden ocurrir reacciones de hipersensibilidad graves, incluida la anafilaxia. (5.1)
- Infecciones: SKYRIZI puede aumentar el riesgo de infección. Indique a los pacientes que busquen atención médica si se presentan signos o síntomas de infección clínicamente importante. Si se desarrolla dicha infección, no administre SKYRIZI hasta que la infección se resuelva. (5.2)
- Tuberculosis (TB): Evalúe la TB antes de iniciar el tratamiento con SKYRIZI. (5.3)
- Hepatotoxicidad en el tratamiento de la enfermedad inflamatoria intestinal: Se ha informado de lesión hepática inducida por fármacos durante la inducción. Controle los niveles de enzimas hepáticas y bilirrubina al inicio y, durante la inducción, hasta al menos 12 semanas de tratamiento. Controle posteriormente de acuerdo con la gestión rutinaria del paciente. (5.4)
- Administración de vacunas: Evite el uso de vacunas vivas. (5.5)
REACCIONES ADVERSAS
Las reacciones adversas más comunes son:
- Psoriasis en placas y artritis psoriásica (≥ 1%): infecciones del tracto respiratorio superior, dolor de cabeza, fatiga, reacciones en el sitio de inyección e infecciones por tiña. (6.1)
-
Enfermedad de Crohn (>3%):
◦ Inducción: infecciones del tracto respiratorio superior, dolor de cabeza y artralgia. (6.1)
◦ Mantenimiento: artralgia, dolor abdominal, reacciones en el sitio de inyección, anemia, pirexia, dolor de espalda, artropatía e infección del tracto urinario. (6.1) -
Colitis ulcerosa (≥3%):
◦ Inducción: artralgia. (6.1)
◦ Mantenimiento: artralgia, pirexia, reacciones en el sitio de inyección y erupción cutánea. (6.1)
Para informar sobre REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con AbbVie Inc. al 1-800-633-9110 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
Ver 17 para INFORMACIÓN DE ASESORAMIENTO AL PACIENTE y Guía de medicamentos.
Revisado: 6/2024
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
1.1 Psoriasis en Placas
1.2 Artritis Psoriásica
1.3 Enfermedad de Crohn
1.4 Colitis Ulcerosa
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Procedimientos previos al inicio del tratamiento
2.2 Consideraciones generales para la administración
2.3 Dosis recomendada para la psoriasis en placas
2.4 Dosis recomendada para la artritis psoriásica
2.5 Instrucciones de preparación y administracións (Psoriasis en placas y artritis psoriásica)
2.6 Dosis recomendada para la enfermedad de Crohn
2.7 Dosis recomendada para la colitis ulcerosa
2.8 Instrucciones de preparación y administración (Enfermedad de Crohn y colitis ulcerosa)
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de hipersensibilidad
5.2 Infecciones
5.3 Tuberculosis
5.4 Hepatotoxicidad en el tratamiento de Enfermedad inflamatoria intestinal
5.5 Administración de vacunas
6 REACCIONES ADVERSAS
6.1 Experiencia en ensayos clínicos
6.2 Inmunogenicidad
6.3 Experiencia postcomercialización
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso pediátrico
8.5 Uso geriátrico
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, mutagénesis, deterioro de la fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Psoriasis en placas
14.2 Artritis psoriásica
14.3 Enfermedad de Crohn
14.4 Colitis ulcerosa
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
1 INDICACIONES Y USO
1.1 Psoriasis en placa
SKYRIZI® está indicado para el tratamiento de la psoriasis en placa de moderada a grave en adultos que son candidatos a terapia sistémica o fototerapia.
1.2 Artritis psoriásica
SKYRIZI está indicado para el tratamiento de la artritis psoriásica activa en adultos.
1.3 Enfermedad de Crohn
SKYRIZI está indicado para el tratamiento de la enfermedad de Crohn activa de moderada a grave en adultos.
1.4 Colitis ulcerosa
SKYRIZI está indicado para el tratamiento de la colitis ulcerosa activa de moderada a grave en adultos.
2 DOSIS Y ADMINISTRACIÓN
2.1 Procedimientos previos al inicio del tratamiento
- Para el tratamiento de la enfermedad de Crohn y la colitis ulcerosa, obtenga los niveles de enzimas hepáticas y bilirrubina antes de iniciar el tratamiento con SKYRIZI [ver Advertencias y precauciones (5.4)]
- Evalúe a los pacientes para detectar infección por tuberculosis (TB) antes de iniciar el tratamiento con SKYRIZI [ver Advertencias y precauciones (5.3)].
- Complete todas las vacunas apropiadas para la edad según lo recomendado por las pautas de inmunización actuales [ver Advertencias y precauciones (5.5)].
2.2 Consideraciones generales para la administración
-
Inspeccione visualmente SKYRIZI para detectar partículas y decoloración antes de la administración. La solución puede contener algunas partículas traslúcidas a blancas.
◦ SKYRIZI 150 mg/mL, 180 mg/1.2 mL, y 360 mg/2.4 mL: una solución incolora a amarilla, y transparente a ligeramente opalescente.
◦ SKYRIZI 90 mg/mL y 600 mg/10 mL: una solución incolora a ligeramente amarilla, y transparente a ligeramente opalescente.
◦ No use si la solución contiene partículas grandes o está turbia o descolorida.
- Deseche después de su uso. No reutilice.
2.3 Dosis recomendada para la psoriasis en placas
La dosis recomendada es de 150 mg administrados por inyección subcutánea en la Semana 0, la Semana 4 y cada 12 semanas a partir de entonces.
2.4 Dosis recomendada para la artritis psoriásica
La dosis recomendada es de 150 mg administrados por inyección subcutánea en la Semana 0, la Semana 4 y cada 12 semanas a partir de entonces.
SKYRIZI puede administrarse solo o en combinación con fármacos antirreumáticos modificadores de la enfermedad (FARME) no biológicos.
2.5 Instrucciones de preparación y administracións (psoriasis en placas y artritis psoriásica)
• Administre SKYRIZI 150 mg/mL pluma precargada o jeringa precargada por vía subcutánea.
• Los pacientes pueden autoinyectarse SKYRIZI después de recibir capacitación en la técnica de inyección subcutánea. Capacite adecuadamente a los pacientes y/o cuidadores sobre la técnica de inyección subcutánea de SKYRIZI.
• Antes de inyectar, retire la caja con SKYRIZI del refrigerador y, sin retirar la pluma precargada o la jeringa precargada de la caja, deje que SKYRIZI alcance la temperatura ambiente fuera de la luz solar directa (de 30 a 90 minutos para la pluma precargada y de 15 a 30 minutos para la jeringa precargada).
• No inyecte en áreas donde la piel esté sensible, magullada, eritematosa, indurada o afectada por psoriasis. La administración de SKYRIZI en la parte superior del brazo solo puede ser realizada por un profesional sanitario o un cuidador.
• Si se olvida una dosis, administre la dosis lo antes posible. Después, reanude la dosificación en el momento programado habitual.
Las “Instrucciones de uso” de SKYRIZI contienen instrucciones más detalladas sobre la preparación y administración de SKYRIZI [ver Instrucciones de uso]. Indique al paciente que lea las Instrucciones de uso antes de la administración.
2.6 Dosis recomendada para la enfermedad de Crohn
Pacientes adultos: Inducción
La dosis de inducción recomendada de SKYRIZI es de 600 mg administrados por infusión intravenosa durante un período de al menos una hora en la Semana 0, la Semana 4 y la Semana 8.
Pacientes adultos: Mantenimiento
La dosis de mantenimiento recomendada de SKYRIZI es de 180 mg o 360 mg administrados por inyección subcutánea en la Semana 12 y cada 8 semanas a partir de entonces. Use la dosis efectiva más baja necesaria para mantener la respuesta terapéutica.
2.7 Dosis recomendada para la colitis ulcerosa
Pacientes adultos: Inducción
La dosis de inducción recomendada de SKYRIZI es de 1,200 mg administrados por infusión intravenosa durante un período de al menos dos horas en la Semana 0, la Semana 4 y la Semana 8.
Pacientes adultos: Mantenimiento
La dosis de mantenimiento recomendada de SKYRIZI es de 180 mg o 360 mg administrados por inyección subcutánea en la Semana 12 y cada 8 semanas a partir de entonces. Use la dosis efectiva más baja necesaria para mantener la respuesta terapéutica.
2.8 Instrucciones de preparación y administración (enfermedad de Crohn y colitis ulcerosa)
Régimen de dosificación de inducción intravenosa:
1. El vial de SKYRIZI para administración intravenosa está diseñado para ser administrado por un profesional de la salud utilizando una técnica aséptica.
2. Antes de la administración intravenosa, determine la dosis y el número de viales de SKYRIZI necesarios según la indicación del paciente (consulte la tabla a continuación). Extraiga 10 ml de solución de SKYRIZI de un vial (600 mg/10 ml) e inyéctelos en una bolsa de infusión intravenosa o en un frasco de vidrio que contenga inyección de dextrosa al 5% o inyección de cloruro de sodio al 0,9% (consulte la Tabla 1 a continuación) para obtener una concentración final de aproximadamente 1,2 mg/ml a 6 mg/ml. Deseche la solución restante en el vial.
|
Indicación |
Dosis de inducción intravenosa | Número de viales de SKYRIZI de 600 mg/10 ml | Volumen total de inyección de dextrosa al 5% o de cloruro de sodio al 0,9% |
| Enfermedad de Crohn | 600 mg | 1 | 100 ml o 250 ml o 500 ml |
| Colitis ulcerosa | 1200 mg | 2 | 250 ml o 500 ml |
3. Infunda la solución diluida por vía intravenosa durante un período de al menos una hora para la dosis de SKYRIZI 600 mg; al menos dos horas para la dosis de SKYRIZI 1,200 mg. Si se almacena refrigerado, permita que la solución diluida de SKYRIZI en la bolsa de infusión o el frasco de vidrio se caliente a temperatura ambiente antes de comenzar la infusión intravenosa.
4. No administre la solución diluida de SKYRIZI de forma concomitante en la misma vía intravenosa con otros medicamentos.
Manipulación y almacenamiento del vial y la solución diluida:
• No agite el vial o la solución diluida en la bolsa de infusión o el frasco de vidrio.
• Use la infusión preparada inmediatamente. Si no se usa inmediatamente, almacene la solución diluida de SKYRIZI refrigerada y protegida de la luz durante un máximo de 20 horas entre 36°F y 46°F (2°C y 8°C).
• Inmediatamente después de la preparación o la extracción de la refrigeración, la solución diluida de SKYRIZI se puede almacenar a temperatura ambiente hasta 77°F (25°C) (protegida de la luz solar) durante 4 horas (tiempo acumulado desde el inicio de la dilución hasta el inicio de la infusión).
• La exposición a la luz interior es aceptable durante el almacenamiento y la administración a temperatura ambiente.
• No congelar.
Régimen de dosificación de mantenimiento subcutáneo:
Uso del cartucho prellenado de dosis única de 180 mg o 360 mg con el inyector de cuerpo:
• SKYRIZI está destinado a ser utilizado bajo la guía y supervisión de un profesional sanitario.
• Los pacientes pueden autoinyectarse SKYRIZI utilizando el inyector de cuerpo con cartucho prellenado después de recibir capacitación en la técnica de inyección subcutánea. Proporcione capacitación adecuada a los pacientes y/o cuidadores sobre la técnica de inyección subcutánea de SKYRIZI.
• Antes de usar el inyector de cuerpo con cartucho prellenado, retire la caja del refrigerador y permita que alcance la temperatura ambiente fuera de la luz solar directa (45 a 90 minutos) sin retirar el cartucho prellenado o el inyector de cuerpo de la caja.
• Use el inyector de cuerpo para administrar el cartucho prellenado de SKYRIZI 180 mg/1.2 mL o SKYRIZI 360 mg/2.4 mL por vía subcutánea en el muslo o el abdomen.
• Comience la inyección dentro de los 5 minutos posteriores a la inserción del cartucho prellenado en el inyector de cuerpo.
• No inyecte en áreas donde la piel esté sensible, magullada, eritematosa, indurada o afectada por alguna lesión.
• Si se olvida una dosis, administre la dosis lo antes posible. Después de eso, reanude la dosificación en el momento programado habitual.
Las “Instrucciones de uso” de SKYRIZI contienen instrucciones más detalladas sobre la preparación y administración de SKYRIZI [ver Instrucciones de uso]. Indique al paciente que lea las Instrucciones de uso antes de la administración.
Uso de la jeringa prellenada de 90 mg/mL:
• Administre cada jeringa prellenada de SKYRIZI 90 mg/mL por vía subcutánea.
• Los pacientes pueden autoinyectarse SKYRIZI después de recibir capacitación en la técnica de inyección subcutánea. Proporcione capacitación adecuada a los pacientes y/o cuidadores sobre la técnica de inyección subcutánea de SKYRIZI.
• Antes de inyectar, retire la caja del refrigerador y, sin retirar las jeringas prellenadas de la caja, permita que SKYRIZI alcance la temperatura ambiente fuera de la luz solar directa (15 a 30 minutos).
• Use las jeringas prellenadas de 90 mg/mL para administrar SKYRIZI 180 mg o SKYRIZI 360 mg por vía subcutánea de la siguiente manera:
◦ Cuando se usan jeringas prellenadas de SKYRIZI 90 mg/mL, para una dosis de mantenimiento de 180 mg, se requieren dos jeringas prellenadas de 90 mg. Inyecte una jeringa prellenada después de la otra en diferentes ubicaciones anatómicas (como los muslos o el abdomen).
◦ Cuando se usan jeringas prellenadas de SKYRIZI 90 mg/mL, para una dosis de mantenimiento de 360 mg, se requieren cuatro jeringas prellenadas de 90 mg. Inyecte una jeringa prellenada después de la otra en diferentes ubicaciones anatómicas (como los muslos o el abdomen).
• No inyecte en áreas donde la piel esté sensible, magullada, eritematosa, indurada o afectada por alguna lesión. La administración de SKYRIZI en la parte superior del brazo solo puede ser realizada por un profesional sanitario o un cuidador.
• Si se olvida una dosis, administre la dosis lo antes posible. Después de eso, reanude la dosificación en el momento programado habitual.
Las “Instrucciones de uso” de SKYRIZI contienen instrucciones más detalladas sobre la preparación y administración de SKYRIZI [ver Instrucciones de uso]. Indique al paciente que lea las Instrucciones de uso antes de la administración.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Inyección subcutánea
SKYRIZI Pen
- Inyección: 150 mg/mL como una solución incolora a amarilla y transparente a ligeramente opalescente en cada pluma precargada de dosis única.
SKYRIZI Jeringa precargada
- Inyección: 90 mg/mL como una solución incolora a ligeramente amarilla y transparente a ligeramente opalescente en cada jeringa precargada de dosis única.
- Inyección: 150 mg/mL como una solución incolora a amarilla y transparente a ligeramente opalescente en cada jeringa precargada de dosis única.
SKYRIZI Cartucho precargado con inyector de cuerpo suministrado
- Inyección: 180 mg/1.2 mL (150 mg/mL) como una solución incolora a amarilla y transparente a ligeramente opalescente en cada cartucho precargado de dosis única para usar con el inyector de cuerpo.
- Inyección: 360 mg/2.4 mL (150 mg/mL) como una solución incolora a amarilla y transparente a ligeramente opalescente en cada cartucho precargado de dosis única para usar con el inyector de cuerpo.
Intravenosa Infusion
SKYRIZI Vial
- Inyección: 600 mg/10 mL (60 mg/mL) como una solución incolora a ligeramente amarilla y transparente a ligeramente opalescente en cada vial de dosis única.
4 CONTRAINDICACIONES
SKYRIZI está contraindicado en pacientes con antecedentes de reacción de hipersensibilidad grave a risankizumab-rzaa o a cualquiera de los excipientes [ver Advertencias y precauciones (5.1)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Reacciones de hipersensibilidad
Se han notificado reacciones de hipersensibilidad graves, incluida la anafilaxia, con el uso de SKYRIZI. Si se produce una reacción de hipersensibilidad grave, suspenda SKYRIZI e inicie inmediatamente la terapia adecuada [ver Reacciones adversas (6.1)].
5.2 Infecciones
SKYRIZI puede aumentar el riesgo de infecciones [ver Reacciones adversas (6.1)].
No se debe iniciar el tratamiento con SKYRIZI en pacientes con cualquier infección activa clínicamente importante hasta que la infección se resuelva o se trate adecuadamente.
En pacientes con una infección crónica o antecedentes de infección recurrente, considere los riesgos y beneficios antes de prescribir SKYRIZI. Indique a los pacientes que busquen atención médica si se presentan signos o síntomas de infección clínicamente importante. Si un paciente desarrolla dicha infección o no responde a la terapia estándar, controle al paciente de cerca y no administre SKYRIZI hasta que la infección se resuelva.
5.3 Tuberculosis
Evalúe a los pacientes para detectar infección por tuberculosis (TB) antes de iniciar el tratamiento con SKYRIZI. En todos los estudios clínicos de psoriasis de fase 3, de los 72 sujetos con TB latente que fueron tratados simultáneamente con SKYRIZI y profilaxis adecuada para la TB durante los estudios, ninguno desarrolló TB activa durante el seguimiento medio de 61 semanas con SKYRIZI. Dos sujetos que tomaban isoniazida para el tratamiento de la TB latente interrumpieron el tratamiento debido a una lesión hepática. De los 31 sujetos del estudio PsO-3 con TB latente que no recibieron profilaxis durante el estudio, ninguno desarrolló TB activa durante el seguimiento medio de 55 semanas con SKYRIZI. Considere la terapia anti-TB antes de iniciar SKYRIZI en pacientes con antecedentes de TB latente o activa en quienes no se puede confirmar un curso de tratamiento adecuado. Controle a los pacientes para detectar signos y síntomas de TB activa durante y después del tratamiento con SKYRIZI. No administre SKYRIZI a pacientes con TB activa.
5.4 Hepatotoxicidad en el tratamiento de la enfermedad inflamatoria intestinal
Se notificó una reacción adversa grave de lesión hepática inducida por fármacos en combinación con una erupción que requirió hospitalización en un paciente con enfermedad de Crohn (ALT 54x ULN, AST 30x ULN y bilirrubina total 2.2x ULN) después de dos dosis intravenosas de 600 mg de SKYRIZI. Las anomalías en las pruebas hepáticas se resolvieron después de la administración de esteroides. Posteriormente se suspendió SKYRIZI.
Para el tratamiento de la enfermedad de Crohn y la colitis ulcerosa, evalúe las enzimas hepáticas y la bilirrubina al inicio y durante la inducción, al menos hasta las 12 semanas de tratamiento. Controle posteriormente de acuerdo con la gestión rutinaria del paciente.
Considere otras opciones de tratamiento en pacientes con evidencia de cirrosis hepática. Se recomienda una investigación rápida de la causa de la elevación de las enzimas hepáticas para identificar posibles casos de lesión hepática inducida por fármacos. Interrumpa el tratamiento si se sospecha una lesión hepática inducida por fármacos, hasta que se excluya este diagnóstico. Indique a los pacientes que busquen atención médica inmediata si experimentan síntomas sugestivos de disfunción hepática.
5.5 Administración de vacunas
Evite el uso de vacunas vivas en pacientes tratados con SKYRIZI. Los medicamentos que interactúan con el sistema inmunitario pueden aumentar el riesgo de infección después de la administración de vacunas vivas. Antes de iniciar la terapia con SKYRIZI, complete todas las vacunas apropiadas para la edad de acuerdo con las pautas de inmunización actuales. No hay datos disponibles sobre la respuesta a las vacunas vivas o inactivas.
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas se discuten en otras secciones de la etiqueta:
- Reacciones de hipersensibilidad [ver Advertencias y precauciones (5.1)]
- Infecciones [ver Advertencias y precauciones (5.2)]
- Tuberculosis [ver Advertencias y precauciones (5.3)]
- Hepatotoxicidad en el tratamiento de la enfermedad inflamatoria intestinal [ver Advertencias y precauciones (5.4)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas a los medicamentos observadas en los ensayos clínicos de un medicamento no se pueden comparar directamente con las tasas en los ensayos clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica.
Psoriasis en placas
Un total de 2234 sujetos fueron tratados con SKYRIZI en ensayos de desarrollo clínico en psoriasis en placas. De estos, 1208 sujetos con psoriasis estuvieron expuestos a SKYRIZI durante al menos un año.
Los datos de los ensayos controlados con placebo y activos se agruparon para evaluar la seguridad de SKYRIZI durante un máximo de 16 semanas. En total, 1306 sujetos fueron evaluados en el grupo de SKYRIZI 150 mg.
La Tabla 2 resume las reacciones adversas a los medicamentos que ocurrieron a una tasa de al menos el 1% y a una tasa más alta en el grupo de SKYRIZI que en el grupo placebo durante el período controlado de 16 semanas de los ensayos clínicos agrupados.
| Reacciones adversas a los medicamentos | SKYRIZI N = 1306 n (%) |
Placebo N = 300 n (%) |
| Infecciones del tracto respiratorio superiora | 170 (13.0) | 29 (9.7) |
| Dolor de cabezab | 46 (3.5) | 6 (2.0) |
| Fatigac | 33 (2.5) | 3 (1.0) |
| Reacciones en el sitio de inyecciónd | 19 (1.5) | 3 (1.0) |
| Infecciones por tiñae | 15 (1.1) | 1 (0.3) |
| a Incluye: infección del tracto respiratorio (viral, bacteriana o no especificada), sinusitis (incluida la aguda), rinitis, nasofaringitis, faringitis (incluida la viral), amigdalitis b Incluye: dolor de cabeza, cefalea tensional, cefalea sinusal, cefalea cervicogénica c Incluye: fatiga, astenia d Incluye: hematomas en el sitio de inyección, eritema, extravasación, hematoma, hemorragia, infección, inflamación, irritación, dolor, prurito, reacción, hinchazón, calor e Incluye: tiña pedis, tiña cruris, tiña corporal, tiña versicolor, tiña manuum, tiña, onicomicosis |
||
Las reacciones adversas a los medicamentos que ocurrieron en < 1% pero > 0.1% de los sujetos en el grupo SKYRIZI y a una tasa más alta que en el grupo placebo hasta la semana 16 fueron foliculitis y urticaria.
Reacciones adversas específicas a los medicamentos
Infecciones
En las primeras 16 semanas, las infecciones ocurrieron en el 22.1% del grupo SKYRIZI (90.8 eventos por 100 años-sujeto) en comparación con el 14.7% del grupo placebo (56.5 eventos por 100 años-sujeto) y no llevaron a la interrupción de SKYRIZI. Las tasas de infecciones graves para el grupo SKYRIZI y el grupo placebo fueron ≤0.4%. Las infecciones graves en el grupo SKYRIZI incluyeron celulitis, osteomielitis, sepsis y herpes zóster. En los estudios PsO-1 y PsO-2, hasta la semana 52, la tasa de infecciones (73.9 eventos por 100 años-sujeto) fue similar a la tasa observada durante las primeras 16 semanas de tratamiento.
Seguridad Through Week 52
Hasta la semana 52, no se identificaron nuevas reacciones adversas, y las tasas de las reacciones adversas fueron similares a las observadas durante las primeras 16 semanas de tratamiento. Durante este período, las infecciones graves que llevaron a la interrupción del estudio incluyeron neumonía.
Artritis psoriásica
El perfil de seguridad general observado en sujetos con artritis psoriásica tratados con SKYRIZI es generalmente consistente con el perfil de seguridad en sujetos con psoriasis en placas. Además, en los ensayos de fase 3 controlados con placebo, la incidencia de eventos hepáticos fue mayor en el grupo SKYRIZI (5.4%, 16.7 eventos por 100 años-paciente) en comparación con el grupo placebo (3.9%, 12.6 eventos por 100 años-paciente). De estos, los eventos más comunes que se informaron con mayor frecuencia tanto en el grupo placebo como en el grupo SKYRIZI fueron aumento de ALT (placebo: n=12 (1.7%); SKYRIZI: n=16 (2.3%)), aumento de AST (placebo: n=9 (1.3%); SKYRIZI: n=13 (1.8%)), y aumento de GGT (placebo: n=5 (0.7%); SKYRIZI: n=8 (1.1%)). No se informaron eventos hepáticos graves. La incidencia de reacciones de hipersensibilidad fue mayor en el grupo SKYRIZI (n=16, 2.3%) en comparación con el grupo placebo (n=9, 1.3%). En los ensayos de fase 3 controlados con placebo, las reacciones de hipersensibilidad informadas a una tasa más alta en el grupo SKYRIZI incluyeron erupción cutánea (placebo: n=4 (0.6%); SKYRIZI: n=5 (0.7%), rinitis alérgica (placebo: n=1 (0.1%); SKYRIZI: n=2 (0.3%), e hinchazón facial (placebo: n=0 (0.0%); SKYRIZI n=1 (0.1%). Se informó un caso de anafilaxia en un sujeto que recibió SKYRIZI en el ensayo clínico de fase 2.
Enfermedad de Crohn
SKYRIZI se estudió hasta 12 semanas en sujetos con enfermedad de Crohn moderada a gravemente activa en dos estudios de inducción aleatorizados, doble ciego, controlados con placebo (CD-1, CD-2) y un estudio de búsqueda de dosis aleatorizado, doble ciego, controlado con placebo (CD-4; NCT02031276). La seguridad a largo plazo hasta 52 semanas se evaluó en sujetos que respondieron a la terapia de inducción en un estudio de mantenimiento aleatorizado, doble ciego, controlado con placebo (CD-3) [ver Estudios clínicos (14.3)].
En los dos estudios de inducción (CD-1, CD-2) y el estudio de búsqueda de dosis (CD-4), 620 sujetos recibieron el régimen de inducción intravenosa de SKYRIZI en las semanas 0, 4 y 8. En el estudio de mantenimiento (CD-3), 297 sujetos que lograron una respuesta clínica, definida como una reducción en CDAI de al menos 100 puntos desde el inicio después de 12 semanas de tratamiento de inducción con SKYRIZI intravenoso en los estudios CD-1 y CD-2, recibieron un régimen de mantenimiento de SKYRIZI ya sea 180 mg o 360 mg por vía subcutánea en la semana 12 y cada 8 semanas a partir de entonces por hasta 52 semanas adicionales.
Las reacciones adversas informadas en > 3% de los sujetos en los estudios de inducción y a una tasa más alta que el placebo se muestran en la Tabla 3.
| Reacciones adversas a los medicamentos | SKYRIZI 600 mg Infusión intravenosaa N = 620 n (%) |
Placebo N = 432 n (%) |
| Infecciones de las vías respiratorias superioresb | 66 (10.6) | 40 (9.3) |
| Dolor de cabezac | 41 (6.6) | 24 (5.6) |
| Artralgia | 31 (5.0) | 19 (4.4) |
| a SKYRIZI 600 mg como infusión intravenosa en la semana 0, la semana 4 y la semana 8. b Incluye: enfermedad similar a la influenza, nasofaringitis, influenza, faringitis, infección de las vías respiratorias superiores, infección viral de las vías respiratorias superiores, COVID-19, congestión nasal, infección viral de las vías respiratorias, faringitis viral, amigdalitis, inflamación de las vías respiratorias superiores c Incluye: dolor de cabeza, dolor de cabeza tensional |
||
Las reacciones adversas notificadas en >3% de los sujetos en el estudio de mantenimiento y a una tasa más alta que el placebo se muestran en la Tabla 4.
| Reacciones adversas a los medicamentos | SKYRIZI 180 mg Inyección subcutánea N = 155 n (%) |
SKYRIZI 360 mg Inyección subcutánea N = 142 n (%) |
Placebo N = 143 n (%) |
| Artralgia | 13 (8.4) | 13 (9.2) | 12 (8.4) |
| Dolor abdominalb | 9 (5.8) | 12 (8.5) | 6 (4.2) |
| Reacciones en el sitio de inyecciónc,d | 7 (4.5) | 8 (5.6) | 4 (2.8) |
| Anemia | 7 (4.5) | 7 (4.9) | 6 (4.2) |
| Pirexia | 4 (2.6) | 7 (4.9) | 4 (2.8) |
| Dolor de espalda | 3 (1.9) | 6 (4.2) | 3 (2.1) |
| Artropatía | 1 (0.6) | 5 (3.5) | 2 (1.4) |
| Infección del tracto urinario | 1 (0.6) | 5 (3.5) | 4 (2.8) |
| a SKYRIZI 180 mg o 360 mg en la semana 12 y cada 8 semanas a partir de entonces durante un máximo de 52 semanas adicionales b Incluye: dolor abdominal, dolor abdominal superior, dolor abdominal inferior c Incluye: erupción en el sitio de inyección, eritema en el sitio de inyección, hinchazón en el sitio de inyección, urticaria en el sitio de inyección, calor en el sitio de inyección, dolor en el sitio de inyección, hipersensibilidad en el sitio de inyección, reacción en el sitio de inyección d Algunos sujetos tuvieron múltiples ocurrencias de reacciones en el sitio de inyección. En esta tabla, las reacciones en el sitio de inyección se cuentan solo una vez por sujeto para los cálculos de la tasa. |
|||
Reacciones adversas específicas a los medicamentos
Infecciones
En el estudio de mantenimiento (CD-3) hasta la semana 52, la tasa de infecciones fue del 32,3% (50,2 eventos por 100 años-sujeto) en los sujetos que recibieron SKYRIZI 180 mg y del 36,6% (60,8 eventos por 100 años-sujeto) en los sujetos que recibieron SKYRIZI 360 mg en comparación con el 36,4% (60,3 eventos por 100 años-sujeto) en los sujetos que recibieron placebo después de la inducción con SKYRIZI. La tasa de infecciones graves fue del 2,6% (2,7 eventos por 100 años-sujeto) en los sujetos que recibieron SKYRIZI 180 mg y del 5,6% (7,4 eventos por 100 años-sujeto) en los sujetos que recibieron SKYRIZI 360 mg en comparación con el 2,1% (2,4 eventos por 100 años-sujeto) en los sujetos que recibieron placebo después de la inducción con SKYRIZI.
Elevaciones de lípidos
Las elevaciones en los parámetros lipídicos (colesterol total y colesterol de lipoproteínas de baja densidad [LDL-C]) se evaluaron por primera vez a las 4 semanas después del inicio de SKYRIZI en los ensayos de inducción (CD-1, CD-2). Se observaron aumentos desde el inicio y aumentos en relación con el placebo en la semana 4 y se mantuvieron estables hasta la semana 12. Después de la inducción con SKYRIZI, el colesterol total medio aumentó 9,4 mg/dL desde el inicio hasta un valor absoluto medio de 175,1 mg/dL en la semana 12. De manera similar, el LDL-C medio aumentó 6,6 mg/dL desde el inicio hasta un valor absoluto medio de 92,6 mg/dL en la semana 12. El LDL-C medio aumentó 3,1 mg/dL desde el inicio hasta un valor absoluto medio de 99,0 mg/dL en la semana 52 con tratamiento de mantenimiento con SKYRIZI 180 mg y 2,3 mg/dL desde el inicio hasta un valor absoluto medio de 102,2 mg/dL en la semana 52 con tratamiento de mantenimiento con SKYRIZI 360 mg (CD-3).
Colitis ulcerosa
SKYRIZI se estudió hasta 12 semanas en sujetos con colitis ulcerosa de moderada a gravemente activa en un estudio de inducción aleatorizado, doble ciego, controlado con placebo (UC-1) y un estudio de búsqueda de dosis aleatorizado, doble ciego, controlado con placebo (UC-3). La seguridad a largo plazo hasta las 52 semanas se evaluó en sujetos que respondieron a la terapia de inducción en un estudio de mantenimiento aleatorizado, doble ciego, controlado con placebo (UC-2) [ver Estudios clínicos (14.4)].
En los estudios de inducción (UC-1 y UC-3), 712 sujetos recibieron el régimen de inducción intravenosa de SKYRIZI 1200 mg en las semanas 0, 4 y 8. En el estudio de mantenimiento (UC-2), 347 sujetos que lograron una respuesta clínica, definida como una disminución en mMS de ≥2 puntos y ≥30% desde el inicio y una disminución en RBS ≥1 desde el inicio o un RBS absoluto ≤1, recibieron un régimen de mantenimiento de SKYRIZI ya sea 180 mg o 360 mg por vía subcutánea en la semana 12 y cada 8 semanas a partir de entonces durante un máximo de 52 semanas adicionales.
La reacción adversa notificada en ≥3% de los sujetos tratados con SKYRIZI en los estudios de inducción de colitis ulcerosa (UC-1 y UC-3) y a una tasa mayor que el placebo fue artralgia (3% SKYRIZI vs 1% placebo).
Las reacciones adversas notificadas en ≥3% de los sujetos tratados con SKYRIZI en el estudio de mantenimiento (UC-2) y a una tasa mayor que el placebo se muestran en la Tabla 5.
| Reacciones adversas a los medicamentos | SKYRIZI 180 mg Inyección subcutánea N = 170 n (%) |
SKYRIZI 360 mg Inyección subcutánea N = 177 n (%) |
Placebo N = 173 n (%) |
| Artralgia | 9 (5.3) | 17 (9.6) | 8 (4.6) |
| Pirexia | 8 (4.7) | 7 (4.0) | 6 (3.5) |
| Reacciones en el sitio de inyecciónb,c | 5 (2.9) | 5 (2.8) | 2 (1.2) |
| Erupciónd | 7 (4.1) | 1 (0.6) | 3 (1.7) |
| a SKYRIZI 180 mg o 360 mg en la semana 12 y cada 8 semanas a partir de entonces durante un máximo de 52 semanas adicionales b Incluye: dolor en el sitio de aplicación, eritema en el sitio de inyección, dolor en el sitio de inyección, prurito en el sitio de inyección, reacción en el sitio de inyección c Algunos sujetos tuvieron múltiples ocurrencias de reacciones en el sitio de inyección. En esta tabla, las reacciones en el sitio de inyección se cuentan solo una vez por sujeto para los cálculos de la tasa. d Incluye: erupción y erupción macular |
|||
6.2 Inmunogenicidad
Al igual que con todas las proteínas terapéuticas, existe la posibilidad de inmunogenicidad. La detección de la formación de anticuerpos depende en gran medida de la sensibilidad y la especificidad de la prueba. Además, la incidencia observada de positividad de anticuerpos (incluidos los anticuerpos neutralizantes) en una prueba puede verse influenciada por varios factores, incluida la metodología de la prueba, el manejo de las muestras, el momento de la recolección de las muestras, los medicamentos concomitantes y la enfermedad subyacente. Por estas razones, la comparación de la incidencia de anticuerpos en los estudios descritos a continuación con la incidencia de anticuerpos en otros estudios o con otros productos, incluidos otros productos de risankizumab, puede ser engañosa.
Psoriasis en placas
Para la semana 52, aproximadamente el 24% (263/1079) de los sujetos tratados con SKYRIZI a la dosis recomendada desarrollaron anticuerpos contra risankizumab-rzaa. De los sujetos que desarrollaron anticuerpos contra risankizumab-rzaa, aproximadamente el 57% (14% de todos los sujetos tratados con SKYRIZI) tenían anticuerpos que se clasificaron como neutralizantes. Títulos de anticuerpos más altos en aproximadamente el 1% de los sujetos tratados con SKYRIZI se asociaron con concentraciones más bajas de risankizumab-rzaa y una respuesta clínica reducida.
Artritis psoriásica
Para la semana 28, aproximadamente el 12,1% (79/652) de los sujetos tratados con SKYRIZI a la dosis recomendada desarrollaron anticuerpos contra risankizumab-rzaa. Ninguno de los sujetos que desarrollaron anticuerpos contra risankizumab-rzaa tenía anticuerpos que se clasificaran como neutralizantes. Los anticuerpos contra risankizumab-rzaa no se asociaron con cambios en la respuesta clínica para la artritis psoriásica. Una proporción mayor de sujetos con anticuerpos contra el fármaco experimentó reacciones de hipersensibilidad (6,3% (5/79)) y reacciones en el lugar de la inyección (2,5% (2/79)) en comparación con los sujetos sin anticuerpos contra el fármaco (3,8% (22/574) con reacciones de hipersensibilidad y 0,7% (4/574) con reacciones en el lugar de la inyección). Ninguna de estas reacciones de hipersensibilidad y en el lugar de la inyección provocó la interrupción de risankizumab-rzaa.
Enfermedad de Crohn
Para la semana 64, los anticuerpos contra risankizumab-rzaa se desarrollaron en aproximadamente el 3,4% (2/58) de los sujetos tratados con SKYRIZI en inducción seguido de un régimen de mantenimiento de 360 mg. Ningún sujeto (0/57) tratado con SKYRIZI en inducción seguido de un régimen de mantenimiento de 180 mg desarrolló anticuerpos contra risankizumab-rzaa. Ninguno de los sujetos que desarrollaron anticuerpos contra risankizumab-rzaa tenía anticuerpos que se clasificaran como neutralizantes.
Colitis ulcerosa
Para la semana 64, los anticuerpos contra risankizumab-rzaa se desarrollaron en aproximadamente el 8,9% (8/90) o el 4,4% (4/91) de los sujetos tratados con SKYRIZI en inducción seguido del régimen de mantenimiento de 180 mg o 360 mg, respectivamente. De los sujetos que desarrollaron anticuerpos contra risankizumab-rzaa, el 75% (6,7% de todos los sujetos tratados con SKYRIZI en inducción seguido del régimen de mantenimiento de 180 mg) o el 50% (2,2% de todos los sujetos tratados con SKYRIZI en inducción seguido del régimen de mantenimiento de 360 mg), respectivamente, tenían anticuerpos que se clasificaron como neutralizantes.
6.3 Experiencia postcomercialización
Las siguientes reacciones adversas se han notificado durante la posaprobación de SKYRIZI. Debido a que estas reacciones se notifican voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición a SKYRIZI:
- Trastornos de la piel y del tejido subcutáneo: eczema y erupción cutánea
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Registro de Exposición al Embarazo
Existe un registro de exposición al embarazo que monitorea los resultados en mujeres que quedan embarazadas mientras reciben tratamiento con SKYRIZI. Se debe alentar a las pacientes a que se inscriban llamando al 1-877-302-2161 o visitando http://glowpregnancyregistry.com.
Resumen de Riesgos
Los datos disponibles de farmacovigilancia y ensayos clínicos con el uso de risankizumab en mujeres embarazadas son insuficientes para establecer un riesgo asociado al fármaco de defectos de nacimiento mayores, aborto espontáneo u otros resultados adversos maternos o fetales. Aunque no hay datos sobre risankizumab-rzaa, los anticuerpos monoclonales pueden transportarse activamente a través de la placenta, y SKYRIZI puede causar inmunosupresión en el lactante expuesto en el útero–expuesto. Hay resultados adversos del embarazo en mujeres con enfermedad inflamatoria intestinal (ver Consideraciones Clínicas).
En un estudio mejorado de toxicidad del desarrollo pre y postnatal, se administraron a monos cynomolgus embarazadas dosis subcutáneas de 5 o 50 mg/kg de risankizumab-rzaa una vez por semana durante el período de organogénesis hasta el parto. Se observó un aumento de la pérdida fetal/infantil en monos embarazadas a la dosis de 50 mg/kg (ver Datos). La dosis de 50 mg/kg en monos embarazadas resultó en aproximadamente 5 veces la exposición (AUC) en humanos que recibieron la dosis de inducción máxima recomendada (1.200 mg) y 32 veces la exposición (AUC) a la dosis de mantenimiento máxima recomendada (360 mg). No se observaron efectos relacionados con risankizumab-rzaa en el desarrollo funcional o inmunológico en monos bebés desde el nacimiento hasta los 6 meses de edad. La importancia clínica de estos hallazgos para los humanos es desconocida.
Todos los embarazos tienen un riesgo de fondo de defectos de nacimiento, pérdida u otros resultados adversos. El riesgo de fondo de defectos de nacimiento mayores y aborto espontáneo para la población indicada es desconocido. En la población general de EE. UU., el riesgo de fondo estimado de defectos de nacimiento mayores y aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente.
Consideraciones Clínicas
Riesgo materno y embrionario/fetal asociado a la enfermedad
Los datos publicados sugieren que el riesgo de resultados adversos del embarazo en mujeres con enfermedad inflamatoria intestinal está asociado con un aumento de la actividad de la enfermedad. Los resultados adversos del embarazo incluyen parto prematuro (antes de las 37 semanas de gestación), bebés con bajo peso al nacer (menos de 2.500 g) y pequeños para la edad gestacional al nacer.
Reacciones adversas fetales/neonatales
El transporte de anticuerpos IgG endógenos a través de la placenta aumenta a medida que avanza el embarazo y alcanza su punto máximo durante el tercer trimestre. Debido a que risankizumab puede interferir con la respuesta inmunitaria a las infecciones, se deben considerar los riesgos y beneficios antes de administrar vacunas vivas a los bebés expuestos a SKYRIZI en el útero. No hay datos suficientes sobre los niveles séricos de risankizumab en el bebé al nacer y la duración de la persistencia de risankizumab en el suero del bebé después del nacimiento. Aunque se desconoce un plazo específico para retrasar las inmunizaciones con virus vivos en bebés expuestos en el útero, se debe considerar un mínimo de 5 meses después del nacimiento debido a la vida media del producto.
Datos
Datos de animales
Se realizó un estudio mejorado de toxicidad del desarrollo pre y postnatal en monos cynomolgus. Se administraron a monos cynomolgus embarazadas dosis subcutáneas semanales de risankizumab-rzaa de 5 o 50 mg/kg desde el día 20 de gestación hasta el parto, y los monos cynomolgus (madre e hijos) fueron monitoreados durante 6 meses después del parto. No se observó toxicidad materna en este estudio. No hubo efectos relacionados con el tratamiento en el crecimiento y desarrollo, malformaciones, inmunotoxicología del desarrollo o desarrollo neuroconductual. Sin embargo, se observó un aumento dosis-dependiente de la pérdida fetal/infantil en los grupos tratados con risankizumab-rzaa (32% y 43% en los grupos de 5 mg/kg y 50 mg/kg, respectivamente) en comparación con el grupo control con vehículo (19%). El aumento de la pérdida fetal/infantil en el grupo de 50 mg/kg se consideró relacionado con el tratamiento con risankizumab-rzaa. El nivel de efecto adverso no observado (NOAEL) para la toxicidad materna se identificó como 50 mg/kg, y el NOAEL para la toxicidad del desarrollo se identificó como 5 mg/kg. La dosis de 5 mg/kg en monos embarazadas resultó en aproximadamente 0,6 veces la exposición (AUC) en humanos que recibieron la dosis de inducción máxima recomendada (1.200 mg) y 5 veces la exposición (AUC) en humanos que recibieron la dosis de mantenimiento máxima recomendada (360 mg). En los bebés, las concentraciones séricas medias aumentaron de forma dosis-dependiente y fueron aproximadamente del 17% al 86% de las concentraciones maternas respectivas. Después del parto, la mayoría de las monos cynomolgus hembras adultas y todos los bebés de los grupos tratados con risankizumab-rzaa tuvieron concentraciones séricas medibles de risankizumab-rzaa hasta 91 días después del parto. Las concentraciones séricas estaban por debajo de los niveles detectables a los 180 días después del parto.
8.2 Lactancia
Resumen de Riesgos
No hay datos sobre la presencia de risankizumab-rzaa en la leche materna, los efectos en el lactante amamantado o los efectos en la producción de leche. La IgG materna endógena y los anticuerpos monoclonales se transfieren en la leche materna. Se desconocen los efectos de la exposición gastrointestinal local y la exposición sistémica limitada en el lactante amamantado a risankizumab-rzaa. Se deben considerar los beneficios para el desarrollo y la salud de la lactancia materna junto con la necesidad clínica de la madre de SKYRIZI y cualquier posible efecto adverso en el lactante amamantado de SKYRIZI o de la condición materna subyacente.
8.4 Uso Pediátrico
No se ha establecido la seguridad y eficacia de SKYRIZI en pacientes pediátricos.
8.5 Uso Geriátrico
De los 6.862 sujetos expuestos a SKYRIZI, un total de 664 tenían 65 años o más (243 sujetos con psoriasis en placas, 246 sujetos con artritis psoriásica, 72 sujetos con enfermedad de Crohn y 103 sujetos con colitis ulcerosa), y 71 sujetos tenían 75 años o más.
Los estudios clínicos de SKYRIZI, dentro de cada indicación, no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos adultos más jóvenes.
No se observaron diferencias clínicamente significativas en la farmacocinética de risankizumab-rzaa en función de la edad[ver Farmacología Clínica (12.3)].
11 DESCRIPCIÓN
El risankizumab-rzaa, un antagonista de la interleucina 23 (IL-23), es un anticuerpo monoclonal humanizado de inmunoglobulina G1 (IgG1). El risankizumab-rzaa se produce mediante tecnología de ADN recombinante en células de ovario de hámster chino y tiene un peso molecular aproximado de 149 kDa.
Inyección de SKYRIZI (risankizumab-rzaa) 90 mg/mL jeringa precargada para uso subcutáneo
Cada jeringa precargada de SKYRIZI contiene una solución estéril, sin conservantes, incolora a ligeramente amarilla, y clara a ligeramente opalizante. Cada jeringa administra 90 mg de risankizumab-rzaa y los ingredientes inactivos polissorbato 20 (0,2 mg), succinato de sodio (0,63 mg), sorbitol (41 mg), ácido succínico (0,059 mg) y Agua para Inyección, USP. El pH es 6,2.
Inyección de SKYRIZI (risankizumab-rzaa) 150 mg/mL jeringa precargada o pluma precargada para uso subcutáneo
Cada pluma precargada o jeringa precargada de SKYRIZI contiene una solución estéril, sin conservantes, incolora a amarilla y clara a ligeramente opalizante. Cada jeringa y pluma administra 150 mg de risankizumab-rzaa y los ingredientes inactivos ácido acético glacial (0,054 mg), polissorbato 20 (0,2 mg), acetato de sodio (0,75 mg), trehalosa (63,33 mg) y Agua para Inyección, USP. El pH es 5,7.
Inyección de SKYRIZI (risankizumab-rzaa) 180 mg/1,2mL (150 mg/mL) cartucho precargado para uso con el inyector corporal suministrado para uso subcutáneo
Cada cartucho precargado de SKYRIZI contiene una solución estéril, sin conservantes, incolora a amarilla y clara a ligeramente opalizante. Cada cartucho administra 180 mg de risankizumab-rzaa y los ingredientes inactivos ácido acético glacial (0,065 mg), polissorbato 20 (0,24 mg), acetato de sodio (0,9 mg), trehalosa (76 mg) y Agua para Inyección, USP. El pH es 5,7.
Inyección de SKYRIZI (risankizumab-rzaa) 360 mg/2,4 mL (150 mg/mL) cartucho precargado para uso con el inyector corporal suministrado para uso subcutáneo
Cada cartucho precargado de SKYRIZI contiene una solución estéril, sin conservantes, incolora a amarilla y clara a ligeramente opalizante. Cada cartucho administra 360 mg de risankizumab-rzaa y los ingredientes inactivos ácido acético glacial (0,13 mg), polissorbato 20 (0,48 mg), acetato de sodio (1,8 mg), trehalosa (152 mg) y Agua para Inyección, USP. El pH es 5,7.
SKYRIZI 600 mg/10 mL (60 mg/mL) en un vial para infusión intravenosa
La inyección de SKYRIZI (risankizumab-rzaa) 600 mg/10 mL (60 mg/mL) es una solución estéril, sin conservantes, incolora a ligeramente amarilla y clara a ligeramente opalizante en un vial de dosis única de 10 mL.
Cada vial de dosis única de 10 mL contiene 600 mg de risankizumab-rzaa y los ingredientes inactivos ácido acético glacial (0,54 mg), polissorbato 20 (2 mg), acetato de sodio (7,5 mg), trehalosa (633,3 mg) y Agua para Inyección, USP. El pH es 5,7.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Risankizumab-rzaa es un anticuerpo monoclonal humanizado IgG1 que se une selectivamente a la subunidad p19 de la citocina IL-23 humana e inhibe su interacción con el receptor IL-23. IL-23 es una citocina natural que participa en las respuestas inflamatorias e inmunitarias.
Risankizumab-rzaa inhibe la liberación de citocinas y quimiocinas proinflamatorias.
12.3 Farmacocinética
Las concentraciones plasmáticas de risankizumab-rzaa, después de la administración de una dosis única, aumentaron proporcionalmente de 18 mg a 360 mg cuando se administraron por vía subcutánea (0,12 a 2,4 veces la dosis mínima recomendada y 0,05 a 1 veces la dosis máxima recomendada) y de 200 mg a 1800 mg cuando se administraron como una infusión intravenosa de hasta 3 horas (0,2 a 3 veces la dosis recomendada) en sujetos sanos.
En sujetos con psoriasis en placas tratados con 150 mg por vía subcutánea en las semanas 0, 4 y cada 12 semanas a partir de entonces, se estima que la concentración máxima en estado estacionario (Cmax) y la concentración mínima (Ctrough) son 12 mcg/mL y 2 mcg/mL, respectivamente.
Con el mismo régimen de dosificación subcutánea, la farmacocinética de risankizumab-rzaa en sujetos con artritis psoriásica fue similar a la de los sujetos con psoriasis en placas.
En sujetos con enfermedad de Crohn tratados con una dosis de inducción intravenosa de 600 mg en las semanas 0, 4 y 8, seguida de una dosis de mantenimiento subcutánea de 180 mg o 360 mg en la semana 12 y cada 8 semanas a partir de entonces, la Cmax y la Ctrough medianas se estiman en 156 mcg/mL y 38,8 mcg/mL, respectivamente, durante las semanas 8-12; y la Cmax y la Ctrough medianas en estado estacionario se estiman en 14,0 mcg/mL y 4,1 mcg/mL, respectivamente, para 180 mg o 28,0 mcg/mL y 8,1 mcg/mL, respectivamente, para 360 mg, durante las semanas 40-48.
En sujetos con colitis ulcerosa tratados con una dosis de inducción intravenosa de 1200 mg en las semanas 0, 4 y 8, seguida de una dosis de mantenimiento subcutánea de 180 mg o 360 mg en la semana 12 y cada 8 semanas a partir de entonces, la Cmax y la Ctrough medianas se estiman en 350 y 87,7 mcg/mL, respectivamente, durante el período de inducción (semanas 8-12); y la Cmax y la Ctrough medianas en estado estacionario se estiman en 19,6 y 4,64 µg/mL, respectivamente, para 180 mg o 39,2 mcg/mL y 9,29 mcg/mL, respectivamente, para 360 mg, durante el período de mantenimiento (semanas 40-48).
Según los análisis farmacocinéticos poblacionales, la farmacocinética de risankizumab-rzaa en sujetos con colitis ulcerosa fue generalmente similar a la de los sujetos con enfermedad de Crohn.
Absorción
La biodisponibilidad absoluta de risankizumab-rzaa se estimó en un 74 a 89% después de la inyección subcutánea. En sujetos sanos, después de la administración de una dosis subcutánea única, la Cmax se alcanzó entre 3 y 14 días.
Distribución
El volumen de distribución en estado estacionario estimado (CV% intersujeto) fue de 11,2 L (34%) en sujetos con psoriasis en placas y de 7,68 L (64%) en sujetos con enfermedad de Crohn.
Eliminación
El aclaramiento sistémico estimado (CV% intersujeto) fue de 0,31 L/día (24%) y 0,30 L/día (34%) y la vida media de eliminación terminal fue de aproximadamente 28 días y 21 días en sujetos con psoriasis en placas y enfermedad de Crohn, respectivamente.
Metabolismo
La vía metabólica de risankizumab-rzaa no se ha caracterizado. Como un anticuerpo monoclonal humanizado IgG1, se espera que risankizumab-rzaa se degrade en pequeños péptidos y aminoácidos a través de vías catabólicas de manera similar a la IgG endógena.
Poblaciones específicas
Las exposiciones a risankizumab-rzaa (Ctrough) en pacientes geriátricos (≥65 años) son comparables a las de los pacientes adultos más jóvenes dentro de cada indicación. No se han realizado estudios para determinar el efecto del deterioro renal o hepático en la farmacocinética de risankizumab-rzaa.
Peso corporal
El aclaramiento y el volumen de distribución de risankizumab-rzaa aumentan y las concentraciones plasmáticas disminuyen a medida que aumenta el peso corporal; sin embargo, no se recomienda ningún ajuste de dosis en función del peso corporal.
Estudios de interacción medicamentosa
Sustratos del citocromo P450
No se observaron cambios clínicamente significativos en la exposición a la cafeína (sustrato del CYP1A2), la warfarina (sustrato del CYP2C9), el omeprazol (sustrato del CYP2C19), el metoprolol (sustrato del CYP2D6) o el midazolam (sustrato del CYP3A) cuando se usaron de forma concomitante con risankizumab-rzaa en sujetos con psoriasis en placas (risankizumab-rzaa 150 mg administrado por vía subcutánea en las semanas 0, 4, 8 y 12) y sujetos con enfermedad de Crohn o colitis ulcerosa (risankizumab-rzaa 1800 mg administrado por vía intravenosa en las semanas 0, 4 y 8, es decir, 3 veces y 1,5 veces la dosis recomendada para la enfermedad de Crohn y la colitis ulcerosa, respectivamente).
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
No se han realizado estudios de carcinogenicidad y mutagénesis con SKYRIZI.
No se observaron efectos en los parámetros de fertilidad masculina en monos cynomolgus machos sexualmente maduros tratados semanalmente durante 26 semanas con 50 mg/kg de risankizumab-rzaa a 4 veces la exposición (AUC) en humanos que recibieron la dosis de inducción máxima recomendada (1,200 mg) y 39 veces la exposición en humanos que recibieron la dosis de mantenimiento máxima recomendada (360 mg).
14 ESTUDIOS CLÍNICOS
14.1 Psoriasis en Placas
Cuatro estudios multicéntricos, aleatorizados, doble ciego [PsO-1 (NCT02684370), PsO-2 (NCT02684357), PsO-3 (NCT02672852) y PsO-4 (NCT02694523)] reclutaron a 2.109 sujetos de 18 años de edad o mayores con psoriasis en placas de moderada a grave que tenían una afectación del área de superficie corporal (BSA) ≥10%, una puntuación de Evaluación Global del Médico Estática (sPGA) ≥3 (“moderada”) en la evaluación general (grosor/induración de la placa, eritema y descamación) de la psoriasis en una escala de gravedad de 0 a 4, y una puntuación del Índice de Área y Severidad de la Psoriasis (PASI) ≥12.
En general, los sujetos tenían una puntuación PASI media basal de 17,8 y una BSA media del 20%. La puntuación sPGA basal fue de 4 (“grave”) en el 19% de los sujetos. Un total del 10% de los sujetos del estudio tenían antecedentes de artritis psoriásica diagnosticada.
En todos los estudios, el 38% de los sujetos habían recibido fototerapia previa, el 48% habían recibido terapia sistémica no biológica previa y el 42% habían recibido terapia biológica previa para el tratamiento de la psoriasis.
Estudios PsO-1 y PsO-2
En los estudios PsO-1 y PsO-2, se reclutaron 997 sujetos (incluidos 598 sujetos aleatorizados al grupo de SKYRIZI 150 mg, 200 sujetos aleatorizados al grupo placebo y 199 al grupo de control activo biológico). Los sujetos recibieron tratamiento en las semanas 0, 4 y cada 12 semanas a partir de entonces.
Ambos estudios evaluaron las respuestas en la semana 16 en comparación con el placebo para los dos criterios de valoración coprimarios:
- la proporción de sujetos que alcanzaron una puntuación sPGA de 0 (“limpia”) o 1 (“casi limpia”)
- la proporción de sujetos que alcanzaron al menos una reducción del 90% desde el PASI basal (PASI 90)
Los criterios de valoración secundarios incluyeron la proporción de sujetos que alcanzaron PASI 100, sPGA 0 y Escala de Síntomas de la Psoriasis (PSS) 0 en la semana 16.
Los resultados se presentan en la Tabla 6.
| PsO-1 | PsO-2 | |||
| SKYRIZI (N=304) n (%) |
Placebo (N=102) n (%) |
SKYRIZI (N=294) n (%) |
Placebo (N=98) n (%) |
|
| sPGA 0 o 1 (“limpia o casi limpia”)a | 267 (88) | 8 (8) | 246 (84) | 5 (5) |
| PASI 90a | 229 (75) | 5 (5) | 220 (75) | 2 (2) |
| sPGA 0 (“limpia”) | 112 (37) | 2 (2) | 150 (51) | 3 (3) |
| PASI 100 | 109 (36) | 0 (0) | 149 (51) | 2 (2) |
| a Criterios de valoración coprimarios | ||||
El examen de la edad, el sexo, la raza, el peso corporal, la puntuación PASI basal y el tratamiento previo con agentes sistémicos o biológicos no identificó diferencias en la respuesta a SKYRIZI entre estos subgrupos en la semana 16.
En PsO-1 y PsO-2 en la semana 52, los sujetos que recibieron SKYRIZI lograron sPGA 0 (58% y 60%, respectivamente), PASI 90 (82% y 81%, respectivamente) y PASI 100 (56% y 60%, respectivamente).
Resultados reportados por el paciente
Se observaron mejoras en los signos y síntomas relacionados con el dolor, el enrojecimiento, la picazón y la quemadura en la semana 16 en comparación con el placebo en ambos estudios, según lo evaluado por el PSS. En PsO-1 y PsO-2, alrededor del 30% de los sujetos que recibieron SKYRIZI lograron PSS 0 (“ninguno”) en la semana 16 en comparación con el 1% de los sujetos que recibieron placebo.
Estudio PsO-3
El estudio PsO-3 reclutó a 507 sujetos (407 aleatorizados a SKYRIZI 150 mg y 100 a placebo). Los sujetos recibieron tratamiento en las semanas 0, 4 y cada 12 semanas a partir de entonces.
En la semana 16, SKYRIZI fue superior al placebo en los criterios de valoración coprimarios de sPGA 0 o 1 (84% SKYRIZI y 7% placebo) y PASI 90 (73% SKYRIZI y 2% placebo). Las tasas de respuesta respectivas para SKYRIZI y placebo en la semana 16 fueron: sPGA 0 (46% SKYRIZI y 1% placebo); PASI 100 (47% SKYRIZI y 1% placebo); y PASI 75 (89% SKYRIZI y 8% placebo).
Mantenimiento y durabilidad de la respuesta
En PsO-1 y PsO-2, entre los sujetos que recibieron SKYRIZI y tuvieron PASI 100 en la semana 16, el 80% (206/258) de los sujetos que continuaron con SKYRIZI tuvieron PASI 100 en la semana 52. Para los respondedores PASI 90 en la semana 16, el 88% (398/450) de los sujetos tuvieron PASI 90 en la semana 52.
En PsO-3, los sujetos que originalmente estaban en SKYRIZI y tenían sPGA 0 o 1 en la semana 28 fueron re-aleatorizados para continuar con SKYRIZI cada 12 semanas o retirar la terapia. En la semana 52, el 87% (97/111) de los sujetos re-aleatorizados para continuar el tratamiento con SKYRIZI tuvieron sPGA 0 o 1 en comparación con el 61% (138/225) que fueron re-aleatorizados para retirar SKYRIZI.
14.2 Artritis psoriásica
La seguridad y eficacia de SKYRIZI se evaluaron en 1407 sujetos en 2 estudios aleatorizados, doble ciego, controlados con placebo (964 en PsA-1 [NCT03675308] y 443 en PsA-2 [NCT03671148]) en sujetos de 18 años o más con artritis psoriásica (PsA) activa.
Los sujetos en estos estudios tenían un diagnóstico de PsA durante al menos 6 meses según los Criterios de Clasificación para la Artritis Psoriásica (CASPAR), una duración mediana de PsA de 4,9 años en el momento basal, ≥ 5 articulaciones sensibles y ≥ 5 articulaciones inflamadas, y psoriasis en placas activa o enfermedad ungueal psoriásica en el momento basal. Con respecto a la presentación clínica basal, el 55,9% de los sujetos tenían ≥3% BSA con psoriasis en placas activa; el 63,4% y el 27,9% de los sujetos tenían entesitis y dactilitis, respectivamente. En PsA-1, donde se evaluó más a fondo la enfermedad ungueal psoriásica, el 67,3% tenía enfermedad ungueal psoriásica.
En PsA-1, todos los sujetos tenían una respuesta inadecuada previa o intolerancia a la terapia DMARD no biológica y eran naive a biológicos. En PsA-2, el 53,5% de los sujetos tenían una respuesta inadecuada previa o intolerancia a la terapia DMARD no biológica, y el 46,5% de los sujetos tenían una respuesta inadecuada previa o intolerancia a la terapia biológica.
En ambos estudios, los sujetos fueron aleatorizados para recibir SKYRIZI 150 mg o placebo en las semanas 0, 4 y 16. A partir de la semana 28, todos los sujetos recibieron SKYRIZI cada 12 semanas. Ambos estudios incluyeron una extensión a largo plazo por hasta 204 semanas adicionales. Con respecto al uso de medicamentos concomitantes, el 59,6% de los sujetos estaban recibiendo metotrexato (MTX) concomitante, el 11,6% estaban recibiendo DMARD no biológicos concomitantes distintos de MTX y el 28,9% estaban recibiendo SKYRIZI en monoterapia.
Para ambos estudios, el criterio de valoración principal fue la proporción de sujetos que lograron una respuesta ACR 20 en la semana 24.
Respuesta clínica
En ambos estudios, el tratamiento con SKYRIZI resultó en una mejora significativa en las medidas de actividad de la enfermedad en comparación con el placebo en la semana 24. Consulte Tablas 7 y 8 para obtener los resultados clave de eficacia.
En ambos estudios, se observaron respuestas similares independientemente del uso concomitante de DMARD no biológicos, el número de DMARD no biológicos previos, la edad, el sexo, la raza y el IMC. En PsA-2, se observaron respuestas independientemente de la terapia biológica previa.
| Criterio de valoración | Placebo N=481 Tasa de respuesta |
SKYRIZI N=483 Tasa de respuesta |
Diferencia del placebo (IC del 95%) |
| Respuesta ACR20* | |||
| Semana 16 | 33,4% | 56,3%a | 23,1% (16,8, 29,4) |
| Semana 24 | 33,5% | 57,3%a | 24,0% (18,0, 30,0) |
| Respuesta ACR50* | |||
| Semana 16 | 11,1% | 26,4% | 15,4% (10,6, 20,2) |
| Semana 24 | 11,3% | 33,4 % | 22,2% (17,3, 27,2) |
| Respuesta ACR70* | |||
| Semana 16 | 2.7% | 11.8% | 9.2% (6.1, 12.4) |
| Semana 24 | 4.7% | 15.3% | 10.5% (6.9, 14.2) |
| a. multiplicity-controlled p≤0.001, SKYRIZI vs. placebo comparison. *A Subject was considered as a non-responder after initiation of rescue medication or concomitant medications for PsA that could meaningfully impact efficacy assessment. |
|||
| Variable | Placebo N=219 Tasa de respuesta |
SKYRIZI N=224 Tasa de respuesta |
Diferencia con respecto al placebo (IC del 95%) |
| Respuesta ACR20* | |||
| Semana 16 | 25.3% | 48.3% a | 22.6% (13.9, 31.2) |
| Semana 24 | 26.5% | 51.3% a | 24.5% (15.9, 33.0) |
| Respuesta ACR50* | |||
| Semana 16 | 6.8% | 20.3% | 13.5% (7.3, 19.7) |
| Semana 24 | 9.3% | 26.3% | 16.6% (9.7, 23.6) |
| Respuesta ACR70* | |||
| Semana 16 | 3.4% | 11.2% | 7.8% (3.0, 12.6) |
| Semana 24 | 5.9% | 12.0% | 6.0% (0.8, 11.3) |
| a. multiplicity-controlled p≤0.001, SKYRIZI vs. placebo comparison. *A Subject was considered as a non-responder after initiation of rescue medication or concomitant medications for PsA that could meaningfully impact efficacy assessment. |
|||
El porcentaje de sujetos que lograron respuestas ACR20 en el estudio PsA-1 hasta la semana 24 se muestra en la Figura 1.
Figura 1. Porcentaje de sujetos que lograron respuestas ACR20 en el estudio PsA-1 hasta la semana 24
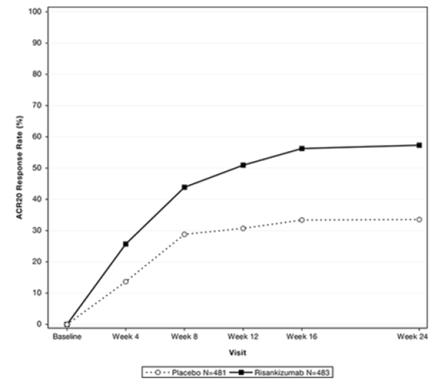
Los resultados de los componentes de los criterios de respuesta ACR para ambos estudios se muestran en la Tabla 9.
| PsA-1 | PsA-2 | |||
| Placebo (N=481) Media (DE) |
SKYRIZI (N=483) Media (DE) |
Placebo (N=219) Media (DE) |
SKYRIZI (N=224) Media (DE) |
|
| Número de articulaciones inflamadas (0-66) | ||||
| Inicio | 12.2 (8.0) | 12.1 (7.8) | 13.6 (9.0) | 13.0 (8.7) |
| Cambio medio en la semana 16 | -5.5 (7.0) | -7.7 (7.2) | -5.4 (8.5) | -8.0 (7.4) |
| Cambio medio en la semana 24 | -6.7 (7.2) | -8.7 (7.2) | -6.5 (7.8) | -9.1 (7.6) |
| Número de articulaciones dolorosas (0-68) | ||||
| Inicio | 20.5 (12.8) | 20.8 (14.0) | 22.3 (13.8) | 22.8 (14.9) |
| Cambio medio en la semana 16 | -6.3 (11.1) | -10.7 (11.4) | -6.0 (13.1) | -11.3 (13.0) |
| Cambio medio en la semana 24 | -7.9 (10.7) | -12.0 (12.3) | -8.3 (11.3) | -13.0 (12.5) |
| Evaluación del dolor por parte del paciente a | ||||
| Inicio | 57.1 (22.6) | 57.1 (22.6) | 57.0 (23.1) | 55.0 (23.5) |
| Cambio medio en la semana 16 | -8.6 (23.7) | -18.4 (26.3) | -5.7 (22.7) | -14.4 (26.4) |
| Cambio medio en la semana 24 | -10.9 (25.4) | -21.4 (26.5) | -8.7 (25.3) | -15.3 (26.5) |
| Evaluación global del paciente a | ||||
| Inicio | 57.4 (22.1) | 57.9 (21.7) | 56.2 (23.0) | 56.2 (21.8) |
| Cambio medio en la semana 16 | -10.2 (23.9) | -19.4 (25.7) | -4.9 (23.6) | -17.0 (27.1) |
| Cambio medio en la semana 24 | -11.1 (25.1) | -22.6 (26.9) | -8.7 (25.4) | -17.7 (27.7) |
| Evaluación global del médico a | ||||
| Línea de base | 62.4 (17.0) | 61.3 (17.6) | 60.7 (16.4) | 63.0 (17.0) |
| Cambio medio en la semana 16 | -18.3 (22.5) | -31.1 (23.4) | -19.0 (23.3) | -32.7 (24.7) |
| Cambio medio en la semana 24 | -22.2 (22.8) | -34.8 (23.2) | -21.3 (25.2) | -35.5 (25.6) |
| Cuestionario de evaluación de la salud – Índice de discapacidad (HAQ-DI) b | ||||
| Línea de base | 1.2 (0.7) | 1.2 (0.7) | 1.1 (0.6) | 1.1 (0.6) |
| Cambio medio en la semana 16 | -0.1 (0.5) | -0.3 (0.5) | -0.1 (0.5) | -0.2 (0.5) |
| Cambio medio en la semana 24 | -0.1 (0.5) | -0.3 (0.5) | -0.1 (0.4) | -0.2 (0.5) |
| Proteína C reactiva de alta sensibilidad (hs-CRP) mg/L | ||||
| Línea de base | 11.3 (14.1) | 11.9 (15.9) | 8.2 (17.1) | 7.4 (10.9) |
| Cambio medio en la semana 16 | -0.3 (14.7) | -4.8 (14.2) | -0.1 (6.8) | -2.1 (7.5) |
| Cambio medio en la semana 24 | -0.2 (11.7) | -4.3 (12.8) | -0.5 (14.5) | -1.8 (13.4) |
| SD= Desviación estándar. a. Evaluación basada en la Escala Visual Analógica (100 mm) con el extremo izquierdo que indica “sin dolor” (para la evaluación del dolor por parte del paciente), “muy bien” (para la evaluación global del paciente) o “sin actividad de artritis” (para la evaluación global del médico) y el extremo derecho que indica “el peor dolor posible” (para la evaluación del dolor por parte del paciente), “pobre” (para la evaluación global del paciente) o “artritis extremadamente activa” (para la evaluación global del médico). b. Índice de discapacidad del Cuestionario de evaluación de la salud; 0 = sin dificultad a 3 = incapacidad para realizar, mide la capacidad del paciente para realizar lo siguiente: vestirse, levantarse, comer, caminar, higiene, alcanzar, agarrar y actividades de la vida diaria. |
||||
El tratamiento con SKYRIZI resultó en una mejora en la dactilitis y la entesitis en sujetos con dactilitis o entesitis preexistentes.
En pacientes con psoriasis en placas coexistente que recibieron SKYRIZI, las lesiones cutáneas de la psoriasis mejoraron con el tratamiento, en relación con el placebo, según lo medido por el Índice de Severidad del Área de Psoriasis (PASI 90) en la semana 24.
Función física
En ambos estudios, los pacientes tratados con SKYRIZI mostraron una mejora estadísticamente significativa desde el inicio en la función física en comparación con el placebo, según lo evaluado por HAQ-DI en la semana 24 (Tabla 7). La diferencia media (IC del 95%) del placebo en el cambio de HAQ-DI desde el inicio en la semana 24 fue de -0,20 (-0,26, -0,14) en el estudio PsA-1 y -0,16 (-0,26, -0,07) en el estudio PsA-2.
En ambos estudios, una mayor proporción de sujetos logró una reducción de al menos 0,35 en la puntuación de HAQ-DI desde el inicio en el grupo SKYRIZI en comparación con el placebo en la semana 24.
Otros resultados relacionados con la salud
En ambos estudios, el estado general de salud se evaluó mediante la Encuesta de Salud de Formato Corto de 36 Ítems (SF-36 V2). La fatiga se evaluó mediante la Escala de Evaluación Funcional de la Terapia de Enfermedad Crónica de Fatiga (FACIT-Fatiga).
En ambos estudios en la semana 24, los sujetos tratados con SKYRIZI mostraron mejoras en las puntuaciones resumidas del componente físico de SF-36 en comparación con los sujetos que recibieron placebo. También hubo mejoras numéricas en los sujetos tratados con SKYRIZI en el funcionamiento físico, el papel físico, el dolor corporal, la salud general, la vitalidad, el funcionamiento social, la salud mental, las puntuaciones del dominio emocional del papel y las puntuaciones resumidas del componente mental en ambos estudios en la semana 24 en comparación con el placebo. En ambos estudios en la semana 24, los sujetos tratados con SKYRIZI mostraron mejoras en las puntuaciones de FACIT-Fatiga en comparación con los sujetos que recibieron placebo.
14.3 Enfermedad de Crohn
Ensayos de inducción (estudios CD-1 y CD-2)
En dos estudios de inducción de 12 semanas (CD-1; NCT03105128 y CD-2; NCT03104413), los sujetos con enfermedad de Crohn de moderada a gravemente activa se asignaron aleatoriamente para recibir SKYRIZI 600 mg, SKYRIZI 1.200 mg o placebo como una infusión intravenosa en la semana 0, la semana 4 y la semana 8. La enfermedad de Crohn de moderada a gravemente activa se definió como un Índice de Actividad de la Enfermedad de Crohn (CDAI) de 220 a 450 y una Puntuación Endoscópica Simple para la enfermedad de Crohn (SES-CD) ≥6 (o ≥4 para la enfermedad ileal aislada). Se inscribieron sujetos con respuesta inadecuada, pérdida de respuesta o intolerancia a los aminosalicilatos orales, corticosteroides, inmunosupresores y/o terapia biológica.
En el inicio, la mediana de CDAI fue de 307 (rango: 76 – 634) y 307 (rango: 72 – 651), y la mediana de SES-CD fue de 12 (rango: 4 – 45) y 13 (rango 4 – 40), en CD-1 y CD-2, respectivamente. En CD-1, el 58% (491/850) de los sujetos habían fallado o eran intolerantes al tratamiento con una o más terapias biológicas (fracaso biológico previo). Todos los sujetos en CD-2 tenían un fracaso biológico previo. En el inicio, el 30% y el 34% de los pacientes estaban recibiendo corticosteroides, el 24% y el 23% de los pacientes estaban recibiendo inmunomoduladores (azatioprina, 6-mercaptopurina, metotrexato) y el 31% y el 19% de los pacientes estaban recibiendo aminosalicilatos en CD-1 y CD-2, respectivamente. En CD-1 y CD-2 combinados, la mediana de edad fue de 36 años (de 16 a 80 años), el 81% (1145/1419) de los sujetos eran blancos y el 53% (753/1419) eran hombres.
En CD-1 y CD-2, los criterios de valoración coprimarios fueron la remisión clínica y la respuesta endoscópica en la semana 12. Los criterios de valoración secundarios incluyeron la respuesta clínica y la remisión endoscópica (ver Tabla 10 y Tabla 11). La dosis de SKYRIZI 1.200 mg no demostró un beneficio de tratamiento adicional sobre la dosis de 600 mg y no es un régimen recomendado [ver Dosificación y administración (2.6)].
| Criterio de valoración | Placebo |
SKYRIZI 600 mg Infusión intravenosaa |
Diferencia de tratamiento (IC del 95%) |
| Remisión clínicac,d | |||
| Población total | N=175 25% |
N=336 45% |
21% e (12%, 29%) |
| Fracaso biológico previof | N=97 26% |
N=195 42% |
|
| Sin fracaso biológico previo | N=78 23% |
N=141 49% |
|
| Respuesta endoscópicac,g | |||
| Población total | N=175 12% |
N=336 40% |
28% e (21%, 35%) |
| Fallo biológico previof | N=97 11% |
N=195 33% |
|
| Sin fallo biológico previo | N=78 13% |
N=141 50% |
|
| Respuesta clínicah | |||
| Población total | N=175 37% |
N=336 60% |
23% e (14%, 32%) |
| Fallo biológico previof | N=97 34% |
N=195 58% |
|
| Sin fallo biológico previo | N=78 40% |
N=141 62% |
|
| Remisión endoscópicai | |||
| Población total | N=175 9% |
N=336 24% |
15% e (9%, 21%) |
| Fallo biológico previof | N=97 5% |
N=195 18% |
|
| Sin fallo biológico previo | N=78 14% |
N=141 32% |
|
| a. SKYRIZI 600 mg como una infusión intravenosa en la semana 0, la semana 4 y la semana 8 b. Diferencia de tratamiento ajustada (IC del 95%) basada en el método de Cochran-Mantel-Haenszel ajustado por los factores de estratificación de la aleatorización c. Variables principales d. CDAI <150 e. p <0.001 f. El fallo biológico previo incluye respuesta inadecuada, pérdida de respuesta o intolerancia a uno o más tratamientos biológicos para la EC g. Una disminución en SES-CD > 50% desde el inicio, o una disminución de al menos 2 puntos para los sujetos con una puntuación inicial de 4 y enfermedad ileal aislada, basada en la lectura central h. Una reducción de CDAI ≥ 100 puntos desde el inicio i. SES-CD ≤ 4 y al menos una reducción de 2 puntos desde el inicio, sin ninguna subpuntuación individual mayor que 1, basada en la lectura central |
|||
| Variable | Placebo N=187 |
SKYRIZI 600 mg Infusión intravenosab N=191 |
Diferencia de tratamientoc (IC del 95%) |
| Remisión clínicad,e | 20% | 42% | 22% f (13%, 31%) |
| Respuesta endoscópica d,g | 11% | 29% | 18% f (10%, 25%) |
| Respuesta clínicah | 30% | 60% | 29% f (20%, 39%) |
| Remisión endoscópicai | 4% | 19% | 15% f (9%, 21%) |
| a. Todos los sujetos inscritos en CD-2 habían tenido un fallo biológico previo. El fallo biológico previo incluye respuesta inadecuada, pérdida de respuesta o intolerancia a uno o más tratamientos biológicos para la EC b. SKYRIZI 600 mg como una infusión intravenosa en la semana 0, la semana 4 y la semana 8 c. Diferencia de tratamiento ajustada (IC del 95%) basada en el método de Cochran-Mantel-Haenszel ajustado por los factores de estratificación de la aleatorización d. Variables principales e. Puntuación CDAI <150 f. p < 0.001 g. Una disminución en SES-CD > 50% desde el inicio, o una disminución de al menos 2 puntos para los sujetos con una puntuación inicial de 4 y enfermedad ileal aislada, basada en la lectura central h. Una reducción de CDAI ≥ 100 puntos desde el inicio i. SES-CD ≤ 4 y al menos una reducción de 2 puntos frente al inicio, con ninguna subpuntuación individual mayor que 1, basada en la lectura central |
|||
La aparición de la respuesta clínica y la remisión clínica basada en el CDAI se produjo tan pronto como la semana 4 en una mayor proporción de sujetos tratados con el régimen de inducción de SKYRIZI 600 mg en comparación con el placebo.
Se observaron reducciones en la frecuencia de las deposiciones y el dolor abdominal en una mayor proporción de sujetos tratados con el régimen de inducción de SKYRIZI 600 mg en comparación con el placebo en la semana 12.
Estudio CD-3
El estudio de mantenimiento CD-3 evaluó a 382 sujetos que lograron una respuesta clínica definida como una reducción en el CDAI de al menos 100 puntos desde el inicio después de 12 semanas de tratamiento de inducción con SKYRIZI intravenoso en los estudios CD-1 y CD-2. Los sujetos fueron aleatorizados para recibir un régimen de mantenimiento de SKYRIZI 180 mg o SKYRIZI 360 mg o placebo en la semana 12 y cada 8 semanas a partir de entonces durante un máximo de 52 semanas adicionales.
Los criterios de valoración coprimarios en CD-3 fueron la remisión clínica y la respuesta endoscópica en la semana 52 (ver Tabla 12).
| Criterio de valoración | Placeboa |
SKYRIZI 180 mg Inyección Subcutáneab |
SKYRIZI 360 mg Inyección Subcutáneac |
Diferencia de Tratamiento vs Placebod (95% IC) |
||
| SKYRIZI 180 mg |
SKYRIZI 360 mg |
|||||
| Remisión Clínicae,f | ||||||
| Población Total | N=130 46% |
N=135 61% |
N=117 57% |
17%g (6%, 28%) |
14%g (3%, 26%) |
|
| Fallo biológico previoh | N=99 40% |
N=95 56% |
N=83 51% |
|||
| Sin fallo biológico previo | N=31 65% |
N=40 75% |
N=34 71% |
|||
| Respuesta Endoscópicae,i | ||||||
| Población Total | N=130 22% |
N=135 50% |
N=117 48% |
30%g (20%, 39%) |
31%g (21%, 41%) |
|
| Fallo biológico previoh | N=99 21% |
N=95 44% |
N=83 44% |
|||
| Sin fallo biológico previo | N=31 23% |
N=40 65% |
N=34 59% |
|||
| a. El grupo placebo consistió en pacientes que estaban en respuesta a SKYRIZI y fueron aleatorizados para recibir placebo al inicio de la terapia de mantenimiento. b. SKYRIZI 180 mg en la semana 12 y cada 8 semanas a partir de entonces durante un máximo de 52 semanas adicionales c. SKYRIZI 360 mg en la semana 12 y cada 8 semanas a partir de entonces durante un máximo de 52 semanas adicionales d. Diferencia de tratamiento ajustada y 95% IC calculados utilizando el método de Cochran-Mantel-Haenszel ajustado por los factores de estratificación de la aleatorización e. Criterios de valoración coprimarios f. CDAI <150 g. p <0.05 h. El fallo biológico previo incluye respuesta inadecuada, pérdida de respuesta o intolerancia a uno o más tratamientos biológicos para la EC i. Una disminución en el SES-CD > 50% desde el inicio, o una disminución de al menos 2 puntos para los sujetos con una puntuación inicial de 4 y enfermedad ileal aislada, basada en la lectura central |
||||||
Se observó remisión endoscópica en la semana 52 en el 33% (44/135) de los sujetos tratados con el régimen de mantenimiento de SKYRIZI 180 mg y el 41% (48/117) de los sujetos tratados con el régimen de mantenimiento de SKYRIZI 360 mg, en comparación con el 13% (17/130) de los sujetos tratados con placebo. Este punto final no fue estadísticamente significativo bajo el procedimiento de prueba múltiple preespecificado.
14.4 Colitis ulcerosa
Ensayo de inducción (Estudio UC-1)
En el estudio de inducción de 12 semanas (UC-1; NCT03398148), 966 sujetos con colitis ulcerosa moderada a gravemente activa se asignaron aleatoriamente y recibieron SKYRIZI 1.200 mg o placebo como infusión intravenosa en la semana 0, la semana 4 y la semana 8. La actividad de la enfermedad se evaluó mediante la puntuación de Mayo modificada (mMS), una puntuación de Mayo de 3 componentes (0-9) que consta de las siguientes subpuntuaciones (0 a 3 para cada subpuntuación): frecuencia de las heces (SFS), sangrado rectal (RBS) y hallazgos en la puntuación de endoscopia leída centralmente (ES). Una ES de 2 se definió por eritema marcado, falta de patrón vascular, cualquier friabilidad y/o erosiones; una ES de 3 se definió por sangrado espontáneo y ulceración. Los sujetos inscritos tenían una mMS entre 5 y 9, con una ES de 2 o 3. Se inscribieron sujetos con respuesta inadecuada o intolerancia a los aminosalicilatos orales, corticosteroides, inmunomoduladores, biológicos, inhibidores de la cinasa de Janus (JAKi) y/o moduladores del receptor de esfingosina-1-fosfato (S1PRM).
En la línea de base en UC-1, la mMS mediana fue de 7; el 37% tenía enfermedad gravemente activa (mMS >7); el 69% tenía una ES de 3. En UC-1, el 52% (499/966) de los sujetos habían fallado (respuesta inadecuada o intolerancia) al tratamiento con uno o más biológicos, JAKi o S1PRM. De estos 499 sujetos, 484 (97%) fallaron los biológicos y 90 (18%) fallaron los inhibidores de JAK. Se permitió a los sujetos inscritos usar una dosis estable de corticosteroides orales (hasta 20 mg/día de prednisona o equivalente), inmunomoduladores y aminosalicilatos. En la línea de base, el 36% de los sujetos estaban recibiendo corticosteroides, el 16% de los sujetos estaban recibiendo inmunomoduladores (incluida la azatioprina, la 6-mercaptopurina, el metotrexato) y el 73% de los sujetos estaban recibiendo aminosalicilatos en UC-1.
En UC-1, el punto final primario fue la remisión clínica definida utilizando la mMS en la semana 12 (ver Tabla 13). Los puntos finales secundarios clave incluyeron la respuesta clínica, la mejora endoscópica y la mejora histológica endoscópica de la mucosa (ver Tabla 13).
| Punto final | Placebo | SKYRIZI 1.200 mg Infusión intravenosaa | Diferencia de tratamiento (IC del 95%)b |
| Remisión clínicac | |||
| Población total | N=320 8% |
N=646 24% |
16%h (12%, 20%) |
| Fallo previo de biológico, JAKi o S1PRMd | N=168 6% |
N=331 14% |
|
| Sin fallo previo de biológico, JAKi o S1PRM | N=152 9% |
N=315 33% |
|
| Respuesta clínicae | |||
| Población total | N=320 36% |
N=646 65% |
29%h (23%, 35%) |
| Fallo previo de biológico, JAKi o S1PRMd | N=168 32% |
N=331 56% |
|
| Sin fallo previo de biológico, JAKi o S1PRM | N=152 41% |
N=315 75% |
|
| Mejora endoscópicaf | |||
| Población total | N=320 12% |
N=646 36% |
25%h (20%, 30%) |
| Fallo previo de biológico, JAKi o S1PRMd | N=168 10% |
N=331 26% |
|
| Sin fallo previo de biológico, JAKi o S1PRM | N=152 14% |
N=315 47% |
|
| Mejora histológica endoscópica de la mucosa (HEMI)g | |||
| Población total | N=320 7% |
N=646 24% |
17%h (13%, 21%) |
| Fallo previo a biológico, JAKi o S1PRMd | N=168 7% |
N=331 16% |
|
| Sin fallo previo a biológico, JAKi o S1PRM | N=152 8% |
N=315 33% |
|
| a SKYRIZI 1,200 mg como infusión intravenosa en la semana 0, la semana 4 y la semana 8 b Diferencia de tratamiento ajustada (IC del 95%) basada en el método de Cochran-Mantel-Haenszel ajustado por factores de estratificación c Por mMS: SFS ≤ 1 y no mayor que la línea de base, RBS = 0 y ES ≤ 1 sin friabilidad d El fallo previo incluye respuesta inadecuada o intolerancia al tratamiento con una o más de las siguientes: terapias biológicas, inhibidores de la Janus Kinasa (JAKi) y/o moduladores del receptor de esfingosina-1-fosfato (S1PRM) e Por mMS: disminución ≥ 2 puntos y ≥ 30% desde la línea de base, y una disminución en RBS ≥ 1 desde la línea de base o un RBS absoluto ≤ 1 f ES ≤ 1 sin evidencia de friabilidad g ES ≤ 1 sin evidencia de friabilidad y puntuación de Geboes ≤ 3.1 (indicando infiltración de neutrófilos en <5% de las criptas, sin destrucción de criptas y sin erosiones, ulceraciones o tejido de granulación) h p < 0.001 |
|||
UC-1 no fue diseñado para evaluar la relación de la mejora mucosa endoscópica histológica en la semana 12 con la progresión de la enfermedad y los resultados a largo plazo.
Subpuntuaciones de frecuencia de heces y sangrado rectal
Se observaron disminuciones en las subpuntuaciones de sangrado rectal y frecuencia de heces en los sujetos tratados con SKYRIZI en comparación con placebo tan pronto como a las 4 semanas.
Evaluación endoscópica
La remisión endoscópica se definió como ES de 0. En la semana 12, una mayor proporción de sujetos tratados con SKYRIZI en comparación con placebo logró la remisión endoscópica (11% vs 3%).
Urgencia intestinal
Una mayor proporción de sujetos tratados con el régimen de inducción de SKYRIZI 1,200 mg en comparación con placebo no tuvo urgencia intestinal (44% vs 27%) en la semana 12.
Fatiga
En UC-1, los sujetos tratados con SKYRIZI experimentaron una mejora clínicamente significativa en la fatiga, evaluada por el cambio desde el inicio en la puntuación FACIT-F, en la semana 12, en comparación con los sujetos tratados con placebo. El efecto de SKYRIZI para mejorar la fatiga después de 12 semanas de inducción no se ha establecido.
Otros síntomas de UC
La proporción de sujetos que no tuvieron movimientos intestinales nocturnos fue mayor en los sujetos tratados con SKYRIZI en comparación con placebo en la semana 12 (67% vs 43%).
Estudio de mantenimiento UC-2
El estudio de mantenimiento (UC-2; NCT03398135) evaluó a 547 sujetos que recibieron uno de los tres regímenes de inducción de SKYRIZI, incluido el régimen de 1,200 mg, durante 12 semanas en los estudios UC-1 o UC-3 y demostró respuesta clínica por mMS después de 12 semanas. Los sujetos fueron aleatorizados para recibir un régimen de mantenimiento de SKYRIZI 180 mg subcutáneo (SC) o SKYRIZI 360 mg o placebo en la semana 12 y cada 8 semanas a partir de entonces durante un máximo de 52 semanas adicionales.
En UC-2, el 75% (411/547) de los sujetos habían fallado (respuesta inadecuada o intolerancia) al tratamiento con uno o más biológicos, JAKi o S1PRM. De estos 411 sujetos, 407 (99%) fallaron los biológicos y 78 (19%) fallaron los inhibidores de JAK.
El criterio de valoración principal en UC-2 fue la remisión clínica utilizando mMS en la semana 52 (ver Tabla 14). Los criterios de valoración secundarios clave incluyeron la remisión clínica sin corticosteroides, la mejora endoscópica y la mejora mucosa endoscópica histológica (ver Tabla 14).
| Criterio de valoración | Placeboa | SKYRIZI 180 mg inyección SCb |
SKYRIZI 360 mg inyección SCc |
| Remisión clínicad | |||
| Población total | N=182 26% |
N=179 45% |
N=186 41% |
| Diferencia de tratamiento vs placeboe (95% IC) | 20% j [11%, 29%] |
16% j [7%, 25%] |
|
| Fallo previo a biológico, JAKi o S1PRMf | N=138 24% |
N=134 41% |
N=139 32% |
| Sin fallo previo a biológico, JAKi o S1PRM | N=44 32% |
N=45 58% |
N=47 67% |
| Remisión clínica sin corticosteroidesg | |||
| Población total | N=182 26% |
N=179 45% |
N=186 40% |
| Diferencia de tratamiento vs placeboe (95% IC) | 20% j [11%, 29%] |
16%j [7%, 25%] |
|
| Fallo previo a biológico, JAKi o S1PRMf | N=138 24% |
N=134 40% |
N=139 32% |
| Sin fallo previo a biológico, JAKi o S1PRM | N=44 32% |
N=45 58% |
N=47 64% |
| Mejora endoscópicah | |||
| Población total | N=182 31% |
N=179 51% |
N=186 48% |
| Diferencia de tratamiento vs placeboe (95% IC) | 20% j [11%, 30%] |
18% j [8%, 27%] |
|
| Fallo previo a biológico, JAKi o S1PRMf | N=138 30% |
N=134 48% |
N=139 39% |
| Sin fallo previo a biológico, JAKi o S1PRM | N=44 34% |
N=45 60% |
N=47 76% |
| Mejora Mucosa Endoscópica Histológicai | |||
| Población Total | N=182 24% |
N=179 43% |
N=186 42% |
| Diferencia de Tratamiento vs Placeboe (95% IC) | 20% j [11%, 29%] |
20% j [11%, 29%] |
|
| Fallo previo a biológico, JAKi o S1PRMf | N=138 22% |
N=134 39% |
N=139 33% |
| Sin fallo previo a biológico, JAKi o S1PRM | N=44 30% |
N=45 55% |
N=47 69% |
| a El grupo placebo consistió en sujetos que estaban en respuesta a 12 semanas de inducción con SKYRIZI y fueron aleatorizados para recibir placebo al inicio de la terapia de mantenimiento. b SKYRIZI 180 mg en la Semana 12 y cada 8 semanas a partir de entonces durante un máximo de 52 semanas adicionales c SKYRIZI 360 mg en la Semana 12 y cada 8 semanas a partir de entonces durante un máximo de 52 semanas adicionales d Por mMS: SFS ≤ 1 y no mayor que la línea de base, RBS = 0 y ES ≤ 1 sin friabilidad e Diferencia de tratamiento ajustada (95% IC) basada en el método de Cochran-Mantel-Haenszel ajustado por factores de estratificación f El fallo previo incluye respuesta inadecuada o intolerancia al tratamiento con una o más de las siguientes: terapias biológicas, inhibidores de Janus Kinasa (JAKi) y/o moduladores del receptor de esfingosina-1-fosfato (S1PRM) g Remisión clínica por mMS en la Semana 52 y sin corticosteroides durante ≥90 días h ES ≤ 1 sin evidencia de friabilidad i ES ≤ 1 sin evidencia de friabilidad y puntuación de Geboes ≤ 3.1 (que indica infiltración de neutrófilos en <5% de las criptas, sin destrucción de criptas y sin erosiones, ulceraciones o tejido de granulación) j p < 0.001 |
|||
Evaluación Endoscópica
La remisión endoscópica se definió como ES de 0. En UC-2, una mayor proporción de sujetos tratados con SKYRIZI 180 mg y SKYRIZI 360 mg en comparación con placebo lograron la remisión endoscópica en la Semana 52 (23% y 24% vs 15%).
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Cómo se suministra
La inyección de SKYRIZI (risankizumab-rzaa) se suministra en las siguientes concentraciones:
| Concentración | Tamaño del paquete | NDC |
| 150 mg/mL pluma de dosis única | Caja de 1 | 0074-2100-01 |
| 90 mg/mL jeringa precargada de dosis única | Caja de 2 | 0074-7040-02 |
| Caja de 4 | 0074-7042-04 | |
| 150 mg/mL jeringa precargada de dosis única | Caja de 1 | 0074-1050-01 |
| 180 mg/1.2 mL (150 mg/mL) cartucho precargado de dosis única con inyector corporal | Kit | 0074-1065-01 |
| 360 mg/2.4 mL (150 mg/mL) cartucho precargado de dosis única con inyector corporal | Kit | 0074-1070-01 |
| Infusión intravenosa | ||
| 600 mg/10 mL (60 mg/mL) vial de dosis única | Caja de 1 | 0074-5015-01 |
Inyección subcutánea
La jeringa o la pluma precargada de 150 mg/mL de SKYRIZI contiene una solución estéril, sin conservantes, incolora a amarilla y clara a ligeramente opalescente. Cada jeringa o pluma precargada consiste en una jeringa de vidrio de 1 mL con una aguja fija de 27 G ½ pulgada con protector de aguja.
La jeringa precargada de 90 mg/mL de SKYRIZI es una solución estéril, sin conservantes, incolora a ligeramente amarilla y clara a ligeramente opalescente. Cada jeringa precargada consiste en una jeringa de vidrio de 1 mL con una aguja fija de 29 G ½ pulgada con protector de aguja.
El cartucho precargado de SKYRIZI 180 mg/1.2 mL (150 mg/mL) de polímero cíclico de olefina con una membrana y una tapa contiene una solución estéril, sin conservantes, incolora a amarilla y clara a ligeramente opalescente para el uso con el dispositivo de administración de inyector corporal suministrado.
El cartucho precargado de SKYRIZI 360 mg/2.4 mL (150 mg/mL) de polímero cíclico de olefina con una membrana y una tapa contiene una solución estéril, sin conservantes, incolora a amarilla y clara a ligeramente opalescente para el uso con el dispositivo de administración de inyector corporal suministrado.
Infusión intravenosa
El vial de SKYRIZI 600 mg/10 mL (60 mg/mL) contiene una solución estéril y sin conservantes, incolora a ligeramente amarilla y clara a ligeramente opalescente. Cada vial de vidrio está cerrado con un tapón y una tapa azul.
Almacenamiento y manipulación
- Almacene en un refrigerador a 36°F a 46°F (2°C a 8°C).
- No congele.
- No agite.
- Mantenga en las cajas originales para protegerse de la luz.
- No está fabricado con látex de caucho natural.
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente y/o cuidador que lea el etiquetado del paciente aprobado por la FDA (Guía de medicamentos e Instrucciones de uso).
Reacciones de hipersensibilidad
Aconseje a los pacientes que suspendan SKYRIZI y busquen atención médica inmediata si experimentan algún síntoma de reacciones graves de hipersensibilidad [ver Advertencias y precauciones (5.1)].
Infecciones
Informe a los pacientes que SKYRIZI puede disminuir la capacidad de su sistema inmunitario para combatir infecciones. Indique a los pacientes la importancia de comunicar cualquier antecedente de infecciones al profesional sanitario y de ponerse en contacto con su profesional sanitario si desarrollan algún síntoma de infección [ver Advertencias y precauciones (5.2)].
Hepatotoxicidad en el tratamiento de enfermedad inflamatoria intestinal
Informe a los pacientes que SKYRIZI puede causar daño hepático, especialmente durante las primeras 12 semanas de tratamiento. Indique a los pacientes que busquen atención médica inmediata si experimentan síntomas que sugieran disfunción hepática. (p. ej., erupción cutánea inexplicable, náuseas, vómitos, dolor abdominal, fatiga, anorexia o ictericia y/o orina oscura) [ver Advertencias y precauciones (5.4)].
Administración de vacunas
Aconseje a los pacientes que no se recomienda la vacunación con vacunas vivas durante el tratamiento con SKYRIZI e inmediatamente antes o después del tratamiento con SKYRIZI. Los medicamentos que interactúan con el sistema inmunitario pueden aumentar el riesgo de infección tras la administración de vacunas vivas. Indique a los pacientes que informen al profesional sanitario de que están tomando SKYRIZI antes de una posible vacunación [ver Advertencias y precauciones (5.5)].
Instrucciones de administración
Indique a los pacientes o cuidadores que realicen la primera dosis autoinyectada bajo la supervisión y orientación de un profesional sanitario cualificado para recibir formación en la preparación y administración de SKYRIZI, incluida la elección de los lugares anatómicos para la administración y la técnica de inyección subcutánea adecuada [ver Instrucciones de uso].
Si utiliza SKYRIZI 90 mg/mL, indique a los pacientes o cuidadores que administren dos jeringas de dosis única de 90 mg para alcanzar la dosis de mantenimiento completa de 180 mg o cuatro jeringas de dosis única de 90 mg para alcanzar la dosis de mantenimiento completa de 360 mg de SKYRIZI para la enfermedad de Crohn [ver Instrucciones de uso].
Indique a los pacientes o cuidadores la técnica de eliminación del bolígrafo o la jeringa [ver Instrucciones de uso].
Embarazo
Aconseje a los pacientes que existe un registro de embarazos que monitoriza los resultados del embarazo en mujeres expuestas a SKYRIZI durante el embarazo [ver Uso en poblaciones específicas (8.1)].
Fabricado por:
AbbVie Inc.
North Chicago, IL 60064, USA
Número de licencia de EE. UU. 1889
SKYRIZI® es una marca registrada de AbbVie Biotechnology Ltd.
© 2019-2024 AbbVie Inc.
20086179 R2 6/2024
Guía de medicación
| Guía del Medicamento SKYRIZI® (sky-RIZZ-ee) (risankizumab-rzaa) inyección, para uso subcutáneo o intravenoso |
|||||||
| ¿Cuál es la información más importante que debo saber sobre SKYRIZI? SKYRIZI puede causar efectos secundarios graves, que incluyen: Reacciones alérgicas graves. Deje de usar SKYRIZI y busque atención médica de emergencia de inmediato si presenta alguno de los siguientes síntomas de una reacción alérgica grave: |
|||||||
| ● desmayo, mareos, sensación de aturdimiento (presión arterial baja) | ● opresión en el pecho | ||||||
| ● hinchazón de la cara, los párpados, los labios, la boca, la lengua o la garganta | ● erupción cutánea, urticaria | ||||||
| ● dificultad para respirar o opresión en la garganta | ● picazón | ||||||
| Infecciones. SKYRIZI puede disminuir la capacidad de su sistema inmunitario para combatir infecciones y puede aumentar su riesgo de infecciones. Su proveedor de atención médica debe revisarlo para detectar infecciones y tuberculosis (TB) antes de comenzar el tratamiento con SKYRIZI y puede tratarlo para la TB antes de comenzar el tratamiento con SKYRIZI si tiene antecedentes de TB o tiene TB activa. Su proveedor de atención médica debe vigilarlo de cerca para detectar signos y síntomas de TB durante y después del tratamiento con SKYRIZI. Informe a su proveedor de atención médica de inmediato si tiene una infección o tiene síntomas de una infección, que incluyen: | |||||||
| ● fiebre, sudoración o escalofríos | ● dolores musculares | ● pérdida de peso | |||||
| ● tos | ● piel caliente, roja o dolorosa o llagas en su cuerpo diferentes de su psoriasis | ● diarrea o dolor de estómago | |||||
| ● dificultad para respirar | ● ardor al orinar o orinar con más frecuencia de lo normal | ||||||
| ● sangre en su moco (flema) |
|||||||
| Ver “¿Cuáles son los posibles efectos secundarios de SKYRIZI?” para obtener más información sobre los efectos secundarios. | |||||||
| ¿Qué es SKYRIZI? SKYRIZI es un medicamento recetado que se usa para tratar:
|
|||||||
| ¿Quién no debe usar SKYRIZI? No use SKYRIZI si es alérgico a risankizumab-rzaa o a cualquiera de los ingredientes de SKYRIZI. Consulte el final de esta Guía del Medicamento para obtener una lista completa de los ingredientes de SKYRIZI. |
|||||||
Antes de usar SKYRIZI, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si:
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos herbales. |
|||||||
| ¿Cómo debo usar SKYRIZI? Consulte las “Instrucciones de uso” detalladas que vienen con SKYRIZI para obtener información sobre cómo preparar e inyectar una dosis de SKYRIZI y cómo desechar correctamente (eliminar) un pluma precargada SKYRIZI precargada , jeringa precargada o cartucho precargado con inyector de cuerpo .
Los adultos con psoriasis en placas o artritis psoriásica recibirán SKYRIZI como una inyección debajo de la piel (inyección subcutánea) utilizando la pluma precargada o la jeringa precargada. |
|||||||
| ¿Cuáles son los posibles efectos secundarios de SKYRIZI? SKYRIZI puede causar efectos secundarios graves, que incluyen:
|
|||||||
|
|
|
|
||||
| Los efectos secundarios más comuness de SKYRIZI en personas tratadas para la enfermedad de Crohn incluyen y la colitis ulcerosa: | |||||||
|
|
|
|||||
| Los efectos secundarios más comunes de SKYRIZI en personas tratadas para la psoriasis en placas y la artritis psoriásica incluyen: | |||||||
|
|
|
|||||
| Estos no son todos los posibles efectos secundarios de SKYRIZI. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088. |
|||||||
¿Cómo debo almacenar SKYRIZI?
Mantenga SKYRIZI y todos los medicamentos fuera del alcance de los niños. |
|||||||
| Información general sobre el uso seguro y eficaz de SKYRIZI. Los medicamentos a veces se recetan para fines distintos de los que figuran en una Guía de medicamentos. No use SKYRIZI para una afección para la que no fue recetado. No le dé SKYRIZI a otras personas, incluso si tienen los mismos síntomas que usted. Puede hacerles daño. Puede pedirle a su farmacéutico o proveedor de atención médica información sobre SKYRIZI que esté escrita para profesionales de la salud. |
|||||||
| ¿Cuáles son los ingredientes de SKYRIZI? Ingrediente activo: risankizumab-rzaa. SKYRIZI 90 mg/mL ingredientes inactivos: polisorbato 20, succinato de sodio, sorbitol, ácido succínico y Agua para inyección, USP. SKYRIZI 150 mg/mL, 180 mg/1.2 mL, 360 mg/2.4 mL, y 600 mg/ 10 mL ingredientes inactivos: ácido acético glacial, polisorbato 20, acetato de sodio, trehalosa y Agua para inyección, USP. Fabricado por: AbbVie Inc., North Chicago, IL 60064, EE. UU. |
|||||||
| Esta Guía de medicamentos ha sido aprobada por la Administración de Alimentos y Medicamentos de los EE. UU. 20086179 R2 |
Revisado: 6/2024 | ||||||
INSTRUCCIONES DE USO
INSTRUCCIONES DE USO
SKYRIZI® (sky-RIZZ-ee) Pluma
(risankizumab-rzaa)
inyectable, para uso subcutáneo
Leer antes del primer uso
Haga referencia a la Guía de Medicación para obtener información sobre el producto.
Lea estas Instrucciones de Uso antes de utilizar la inyección SKYRIZI Pen (risankizumab-rzaa).
Antes de usar SKYRIZI, debe recibir capacitación de su proveedor de atención médica sobre cómo inyectarse SKYRIZI.
Pluma de Dosis Única SKYRIZI
Información importante
- Almacene SKYRIZI en el refrigerador a 36°F a 46°F (2°C a 8°C).
- Mantenga SKYRIZI en la caja original para protegerlo de la luz hasta que esté listo para usarlo.
-
Antes de inyectar, saque la caja de SKYRIZI del refrigerador. Deje la caja a temperatura ambiente y fuera de la luz directa durante de 30 a 90 minutos.
- El líquido en la ventana de inspección deberá parecer claro a amarillo y puede contener pequeñas partículas blancas o transparentes.
- No utilice SKYRIZI si el líquido está descolorido, turbio o contiene escamas o partículas grandes.
- No utilice SKYRIZI si la fecha de vencimiento (EXP) ha pasado.
- No utilice SKYRIZI si el líquido ha estado congelado, incluso si ha sido descongelado.
- No agite SKYRIZI.
- No utilice si la Pluma SKYRIZI ha sido caída o dañada.
-
No utilice SKYRIZI si las perforaciones de la caja están rotas. Devuelva el producto a la farmacia.
- No retire la tapa gris oscura hasta justo antes de la inyección.
- SKYRIZI no está fabricado con látex de caucho natural.
Preparar la inyección de SKYRIZI 
|
Tome la caja de SKYRIZI fuera del refrigerador. Deje la caja a temperatura ambiente y fuera de la luz directa durante 30 a 90 minutos antes de inyectar.
|

|
Revise la fecha de vencimiento (EXP). No utilice la Pluma si la fecha de vencimiento ha pasado. Coloque lo siguiente en una superficie limpia y plana:
Lávese y séquese las manos. |
|
Elija un lugar de inyección:
Limpie el lugar de inyección en movimiento circular con el hisopo de alcohol y déjelo secar.
|
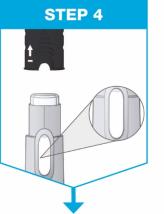
|
Sostenga la Pluma con la tapa gris oscura apuntando hacia arriba.
Revise el líquido a través de la ventana de inspección.
|
Administrar la inyección SKYRIZI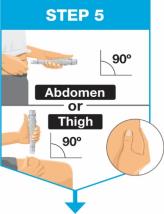
|
Sostenga la Pluma con los dedos en las asas grises. Gire la Pluma para que la funda blanca de la aguja apunte hacia el lugar de inyección y pueda ver el botón activador verde. Apriete la piel en el lugar de inyección para formar un área elevada y sosténgala firmemente. Coloque la funda blanca de la aguja recta (ángulo de 90 grados) contra el área elevada del lugar de inyección. |
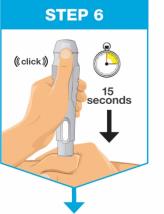
|
Sostenga el Lapicero de manera que pueda ver el botón activador verde y la ventana de inspección. Empuje y mantenga presionado el Lapicero hacia abajo contra el lugar de la inyección elevado.
Presione el botón activador verde y mantenga el Lapicero durante 15 segundos.
|
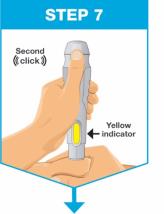
|
Siga presionando el Lapicero hacia abajo contra el lugar de la inyección. La inyección se ha completado cuando:
Esto puede tomar hasta 15 segundos. |
Después de la inyección de SKYRIZI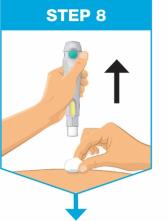
|
Cuando se complete la inyección, saque lentamente el Lapicero en línea recta de la piel. La funda blanca de la aguja cubrirá la punta de la aguja y habrá otro “clic”. Después de completar la inyección, coloque una bola de algodón o una gasa en la piel en el lugar de la inyección.
|

|
Arroje (descargue) el Lapicero usado en un contenedor de deshechos de agujas aprobado por la FDA inmediatamente después de usarlo. ● No descarte los Lapiceros usados en la basura doméstica a menos que las pautas comunitarias lo permitan. ● No recicle el contenedor de deshechos de agujas. La tapa gris oscura, la toallita con alcohol, la bola de algodón o la gasa y el embalaje se pueden colocar en la basura doméstica. Para más información, consulte “Descarte del Lapicero precargado de SKYRIZI usado“. |
Información importante
- Almacene SKYRIZI en el refrigerador a 36°F a 46°F (2°C a 8°C).
- Mantenga SKYRIZI en la caja original para protegerlo de la luz hasta que esté listo para usarlo.
- Antes de inyectar, saque la caja de SKYRIZI del refrigerador. Deje la caja a temperatura ambiente y fuera de la luz solar directa durante 30 a 90 minutos.
- El líquido en la ventana de inspección debe verse transparente a amarillo y puede contener pequeñas partículas blancas o transparentes.
- No use SKYRIZI si el líquido está descolorido, turbio o contiene copos o partículas grandes.
- No use SKYRIZI si la fecha de caducidad (EXP) ha pasado.
- No use SKYRIZI si el líquido se ha congelado, incluso si se ha descongelado.
- No agite SKYRIZI.
- No use si el bolígrafo SKYRIZI se ha caído o dañado.
- No use SKYRIZI si las perforaciones de la caja están rotas. Devuelva el producto a la farmacia.
- No retire la tapa gris oscura hasta justo antes de la inyección.
- SKYRIZI no está hecho con látex de caucho natural.
Mantenga el bolígrafo SKYRIZI y el contenedor de eliminación de objetos punzantes fuera del alcance de los niños.
Llame a su proveedor de atención médica o al (866) SKYRIZI o (866) 759-7494 si necesita ayuda o no sabe cómo proceder.
Preguntas sobre el uso del bolígrafo SKYRIZI
P.
¿Qué pasa si necesito ayuda sobre cómo inyectar SKYRIZI?
R.
Llame a su proveedor de atención médica o (866) SKYRIZI o (866) 759-7494 si necesita ayuda.
P.
He quitado la tapa gris oscura y he presionado el botón verde de activación. ¿Por qué no empieza mi inyección?
R.
El botón verde de activación no iniciará la inyección a menos que la funda blanca de la aguja se presione firmemente contra el sitio de inyección.
P.
¿Cómo sé cuándo se completa la inyección?
R.
La inyección está completa si el bolígrafo hace un segundo “clic” o el indicador amarillo llena la ventana de inspección. Esto tarda hasta 15 segundos.
P.
¿Qué debo hacer si hay más de unas pocas gotas de líquido en el sitio de inyección?
R.
Llame al (866) SKYRIZI o al (866) 759-7494 para obtener ayuda.
P.
¿Qué debo hacer con el bolígrafo usado después de mi inyección?
R.
Deseche el bolígrafo usado en un contenedor de eliminación de objetos punzantes inmediatamente después de su uso. No deseche el bolígrafo usado en la basura de su casa.
Puede registrarse para recibir contenedores de eliminación de objetos punzantes para la eliminación del bolígrafo SKYRIZI sin costo adicional visitando www.SKYRIZI.com o llamando al (866) SKYRIZI o (866) 759-7494.
Llame al (866) SKYRIZI o (866) 759-7494 o visite www.SKYRIZI.com para obtener ayuda con su inyección.
 |
Para ayudar a recordar cuándo inyectar, marque su calendario con la fecha en que se administra la inyección de SKYRIZI. |
Mantenga el bolígrafo SKYRIZI y el contenedor de eliminación de objetos punzantes fuera del alcance de los niños.
Llame a su proveedor de atención médica o al (866) SKYRIZI o al (866) 759-7494 si necesita ayuda o tiene preguntas sobre el uso de SKYRIZI.
Eliminación del bolígrafo prellenado SKYRIZI usado
Si no tiene un contenedor de eliminación de objetos punzantes aprobado por la FDA, puede usar un contenedor doméstico que sea:
- hecho de plástico de alta resistencia,
- se puede cerrar con una tapa hermética y resistente a las perforaciones, sin que los objetos punzantes puedan salir,
- vertical y estable durante el uso,
- resistente a las fugas, y
- adecuadamente etiquetado para advertir sobre los residuos peligrosos dentro del contenedor.
Cuando su contenedor de eliminación de objetos punzantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de desechar su contenedor de eliminación de objetos punzantes. Puede haber leyes estatales o locales sobre cómo debe desechar los bolígrafos usados.
Para obtener más información sobre la eliminación segura de objetos punzantes y para obtener información específica sobre la eliminación de objetos punzantes en el estado en el que vive, visite el sitio web de la FDA en: www.fda.gov/safesharpsdisposal.
No recicle su contenedor de eliminación de objetos punzantes usado.
Fabricado por: AbbVie Inc., North Chicago, IL 60064, EE. UU.
Número de licencia de EE. UU. 1889
SKYRIZI® es una marca registrada de AbbVie Biotechnology Ltd.
© 2019-2024 AbbVie Inc.
20086179
Estas instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos.
Revisado: 6/2024
INSTRUCCIONES DE USO
INSTRUCCIONES DE USO
SKYRIZI® (sky-RIZZ-ee)
(risankizumab-rzaa)
inyección, para uso subcutáneo
150 mg/mL jeringa precargada
Lea antes del primer uso
Consulte la Guía de medicamentos para obtener información sobre el producto.
Jeringa precargada de dosis única de SKYRIZI
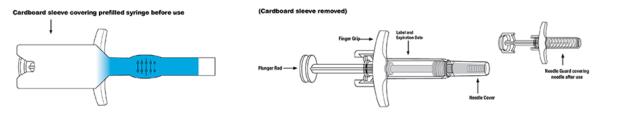
Información importante
- Mantenga SKYRIZI en la caja original para protegerlo de la luz hasta el momento de su uso.
- El líquido debe tener un aspecto transparente a amarillo y puede contener pequeñas partículas blancas o transparentes.
- No use SKYRIZI si el líquido está descolorido, turbio o contiene copos o partículas grandes.
- No use SKYRIZI si la fecha de caducidad (EXP:) que aparece en la caja y en la jeringa precargada ha pasado.
- No use SKYRIZI si el líquido se ha congelado (incluso si se ha descongelado).
- No agite SKYRIZI.
- No use SKYRIZI si la jeringa precargada se ha caído o dañado.
- No use SKYRIZI si las perforaciones de la caja están rotas. Devuelva el producto a la farmacia.
- No retire la cubierta de la aguja hasta justo antes de administrar la inyección.
Mantenga SKYRIZI y todos los medicamentos fuera del alcance de los niños.
Lea las instrucciones completas de uso antes de usar la jeringa precargada de SKYRIZI
Antes de inyectar
- Reciba capacitación sobre cómo inyectar SKYRIZI antes de administrar la inyección. Llame a su proveedor de atención médica o al (866) SKYRIZI o (866) 759-7494 si necesita ayuda.
- Marque su calendario con anticipación para recordar cuándo debe tomar SKYRIZI.
-
Deje la caja a temperatura ambiente y fuera de la luz solar directa durante 15 a 30 minutos para que se caliente.
- No retire la jeringa de la caja mientras permite que SKYRIZI alcance la temperatura ambiente.
- No caliente SKYRIZI de ninguna otra manera (por ejemplo, no lo caliente en un microondas o en agua caliente).
Información importante
- El líquido debe tener un aspecto transparente a amarillo y puede contener pequeñas partículas blancas o transparentes.
- No use SKYRIZI si el líquido está descolorido, turbio o contiene copos o partículas grandes.
- No use SKYRIZI si la fecha de caducidad (EXP:) que aparece en la caja y en la jeringa precargada ha pasado.
- No use SKYRIZI si la jeringa se ha caído o dañado.
- No use SKYRIZI si las perforaciones de la caja están rotas. Devuelva el producto a la farmacia.
Información de almacenamiento
- Almacene SKYRIZI en el refrigerador entre 36°F y 46°F (2°C y 8°C).
- No agite SKYRIZI.
- Mantenga SKYRIZI en la caja original para protegerlo de la luz hasta el momento de su uso.
- SKYRIZI no está hecho con látex de caucho natural.
- No use si el líquido se ha congelado (incluso si se ha descongelado).
Mantenga SKYRIZI y todos los medicamentos fuera del alcance de los niños.
Llame a su proveedor de atención médica o al (866) SKYRIZI o (866) 759-7494 si necesita ayuda o no sabe cómo proceder.
 |
Reúna los suministros para la inyección.
Coloque lo siguiente sobre una superficie limpia y plana:
Lávese y séquese las manos. |
|
 |
Retire la jeringa precargada de la funda de cartón sujetando la empuñadura para los dedos. | |
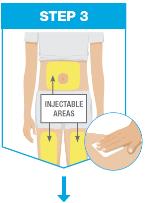
|
Elija de las 3 zonas de inyección:
Limpie el sitio de inyección en movimiento circular con el hisopo de alcohol antes de la inyección.
|
|
 |
Sostenga la jeringa precargada con la aguja cubierta hacia abajo, como se muestra. Revise el líquido en la jeringa precargada.
|
|
|
Retire el capuchón de la aguja.
|
|
 |
Sostenga el cuerpo de la jeringa precargada en una mano entre el pulgar y el dedo índice. Apunte el área de la piel limpia con la otra mano y sosténgala firmemente. Inserte la aguja en la piel con un ángulo de aproximadamente 45 grados con un movimiento rápido y corto. Mantenga el ángulo constante. |
|
|
Empuje lentamente el émbolo hacia adentro hasta que todo el líquido se inyecte y la jeringa precargada esté vacía. Saque la aguja de la piel manteniendo la jeringa precargada en el mismo ángulo. Libere el émbolo y permita que la jeringa precargada se mueva hacia arriba hasta que toda la aguja esté cubierta por el protector de la aguja. El protector de la aguja de la jeringa precargada no se activará a menos que todo el líquido se haya inyectado.
|
|

|
Coloque su jeringa precargada usada en un recipiente de eliminación de objetos punzantes aprobado por la FDA inmediatamente después de su uso.
Para más información, consulte la sección “Eliminación de la Jeringa Precargada Utilizada de SKYRIZI”. |
Preguntas sobre el uso de SKYRIZI
| Q. ¿Qué pasa si necesito ayuda para inyectarme SKYRIZI? |
| A. Llame a su proveedor de atención médica o (866) SKYRIZI o (866) 759-7494 si necesita ayuda. |
| Q.¿Qué debo hacer con la jeringa precargada usada después de mi inyección? |
| A. Tire (elimine) la jeringa precargada usada en un recipiente de eliminación de objetos punzantes y no en la basura doméstica. Puede registrarse para recibir recipientes para la eliminación de jeringas de SKYRIZI sin costo adicional visitando www.SKYRIZI.com o llamando al (866) SKYRIZI o (866) 759-7494. |
|
Q. ¿Cómo sé cuándo la inyección se ha completado? |
| A. La inyección se ha completado cuando la jeringa precargada está vacía, el émbolo está completamente empujado hacia adentro y el protector de la aguja de la jeringa se ha activado. |
Eliminación de la jeringa precargada usada de SKYRIZI
Si no tiene un contenedor de eliminación de objetos punzantes aprobado por la FDA, puede usar un contenedor doméstico que sea:
- hecho de plástico de alta resistencia,
- se puede cerrar con una tapa hermética y resistente a las perforaciones, sin que los objetos punzantes puedan salir,
- vertical y estable durante el uso,
- resistente a las fugas, y
- adecuadamente etiquetado para advertir sobre los residuos peligrosos dentro del contenedor.
Cuando su contenedor de eliminación de objetos punzantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de desechar su contenedor de eliminación de objetos punzantes. Puede haber leyes estatales o locales sobre cómo debe desechar las agujas y jeringas usadas.
Para obtener más información sobre la eliminación segura de objetos punzantes y para obtener información específica sobre la eliminación de objetos punzantes en el estado en el que vive, visite el sitio web de la FDA en: www.fda.gov/safesharpsdisposal.
No recicle su contenedor de eliminación de objetos punzantes usado.
Fabricado por: AbbVie Inc., North Chicago, IL 60064, EE. UU.
Número de licencia de EE. UU. 1889
SKYRIZI® es una marca registrada de AbbVie Biotechnology Ltd.
© 2019-2024 AbbVie Inc.
20086082
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos.
Revisado: 6/2024
INSTRUCCIONES DE USO
Instrucciones de uso
SKYRIZI® (sky-RIZZ-ee)
(risankizumab-rzaa)
inyección, para uso subcutáneo
2 jeringas precargadas de dosis única de 90 mg/mL para una dosis total de 180 mg/2 mL
Lea antes del primer uso
Consulte la Guía de medicamentos para obtener información sobre el producto.
Jeringa precargada de dosis única de SKYRIZI
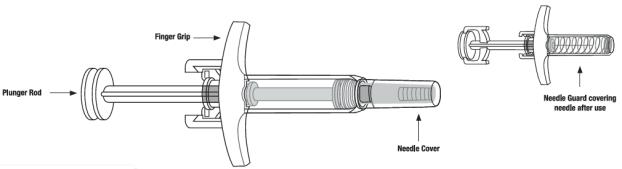
Mantenga SKYRIZI y todos los medicamentos fuera del alcance de los niños.
Información importante:
- Mantenga SKYRIZI en la caja original para protegerlo de la luz hasta el momento de su uso.
- El líquido debe tener un aspecto transparente a ligeramente amarillo y puede contener pequeñas partículas blancas o transparentes.
- No use SKYRIZI si el líquido está descolorido, turbio o contiene copos o partículas grandes. Devuelva el producto a la farmacia.
- No use SKYRIZI si la fecha de caducidad (EXP:) que aparece en la caja y en la jeringa precargada ha pasado. Devuelva el producto a la farmacia.
- No use SKYRIZI si el líquido se ha congelado (incluso si se ha descongelado).
- No agite la jeringa.
- No use SKYRIZI si la jeringa precargada se ha caído o dañado. Devuelva el producto a la farmacia.
- No use SKYRIZI si las perforaciones de la caja están rotas. Devuelva el producto a la farmacia.
- No retire la cubierta de la aguja hasta justo antes de administrar las inyecciones.
- SKYRIZI no está hecho con látex de caucho natural.
Lea las instrucciones completas de uso antes de usar la jeringa precargada de SKYRIZI
Antes de inyectar:
- Reciba formación sobre cómo inyectar SKYRIZI antes de administrar las inyecciones. Llame a su proveedor de atención médica o al (866) SKYRIZI o (866) 759-7494 si necesita ayuda.
- Marque su calendario con antelación para recordar cuándo debe tomar SKYRIZI.
-
Deje la caja a temperatura ambiente y fuera de la luz solar directa durante 15 a 30 minutos para que se caliente.
- No retire las jeringas precargadas de la caja mientras permite que SKYRIZI alcance la temperatura ambiente.
- No caliente SKYRIZI de ninguna otra manera (por ejemplo, no lo caliente en el microondas o en agua caliente).
Información importante:
- El líquido debe tener un aspecto transparente a ligeramente amarillo y puede contener pequeñas partículas blancas o transparentes.
- No use SKYRIZI si el líquido está descolorido, turbio o contiene copos o partículas grandes. Devuelva el producto a la farmacia.
- No use SKYRIZI si la fecha de caducidad (EXP:) que aparece en la caja y en la jeringa precargada ha pasado. Devuelva el producto a la farmacia.
- No use SKYRIZI si la jeringa precargada se ha caído o dañado. Devuelva el producto a la farmacia.
- No use SKYRIZI si las perforaciones de la caja están rotas. Devuelva el producto a la farmacia.
Información sobre el almacenamiento:
- Almacene SKYRIZI en el refrigerador entre 36°F to 46°F (2°C to 8°C).
- No agite SKYRIZI.
- Mantenga SKYRIZI en la caja original para protegerlo de la luz hasta el momento de su uso.
- SKYRIZI no está hecho con látex de caucho natural.
- No use si el líquido se ha congelado (incluso si se ha descongelado).
Mantenga SKYRIZI y todos los medicamentos fuera del alcance de los niños.
Llame a su proveedor de atención médica o al (866) SKYRIZI o (866) 759-7494 si necesita ayuda o no sabe cómo proceder.
|
 Reúna los suministros para las inyecciones y coloque lo siguiente en una superficie limpia y plana:
Lávese y séquese las manos. |
|
Elija entre las 3 áreas inyectables:
|
|
Sostenga la jeringa precargada con la aguja cubierta hacia abajo, como se muestra. Revise el líquido en la jeringa precargada.
|
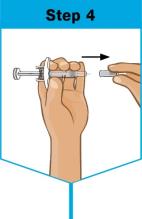
|
Retire la cubierta de la aguja.
|
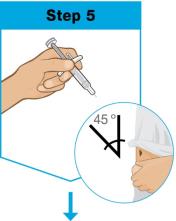
|
Sostenga el cuerpo de la jeringa precargada en 1 mano entre el pulgar y el dedo índice. Apriete suavemente el área de la piel limpiada con la otra mano y manténgala firmemente. Inserte la aguja en la piel con un ángulo de aproximadamente 45 grados con un movimiento rápido y corto. Mantenga el ángulo constante. |
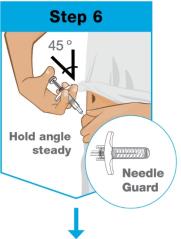
|
Empuje lentamente el vástago del émbolo todo el camino hasta que todo el líquido se haya inyectado y la jeringa esté vacía. Saque la aguja de la piel manteniendo la jeringa en el mismo ángulo. Libere el vástago del émbolo.
El protector de la aguja no se activará automáticamente a menos que todo el líquido se haya inyectado.
|

|
Repita los Pasos 2 a 6 con la 2.ª jeringa precargada para una dosis completa.
|
|
Ponga sus jeringas precargadas usadas en un contenedor de eliminación de objetos punzantes aprobado por la FDA inmediatamente después de usarlas.
Para más información, o si no tiene un contenedor de objetos punzantes aprobado por la FDA, consulte la sección “Eliminación de jeringas precargadas usadas de SKYRIZI” ubicada en el otro lado de estas instrucciones. |
Preguntas sobre el uso de la jeringa de SKYRIZI
P. ¿Qué sucede si no he recibido capacitación en persona de un profesional de la salud?
R. Llame a su proveedor de atención médica o al (866) SKYRIZI o al (866) 759-7494 si necesita ayuda. Reciba capacitación sobre cómo inyectar SKYRIZI antes de administrar las inyecciones.
P. ¿Qué debo hacer con ambas jeringas precargadas usadas después de mis inyecciones?
R. Deseche ambas jeringas precargadas usadas en un contenedor para objetos punzocortantes. No lo tire a la basura doméstica. Para obtener más información, consulte la sección “Eliminación de la jeringa precargada usada de SKYRIZI”.
Puede registrarse para recibir contenedores para objetos punzocortantes para la eliminación de jeringas precargadas de SKYRIZI sin costo adicional en www.SKYRIZI.com o llamando al (866) 759-7494
P. ¿Cómo sé cuándo se completó la inyección?
R. La inyección se completa cuando la jeringa precargada está vacía, el émbolo está completamente presionado y el protector de la aguja de la jeringa está activado.
Eliminación de la jeringa precargada usada de SKYRIZI
Deseche ambas jeringas precargadas usadas en un contenedor para objetos punzocortantes. No lo tire a la basura doméstica.
Si no tiene un contenedor para objetos punzocortantes aprobado por la FDA, puede usar un contenedor doméstico que:
- esté hecho de plástico resistente,
- se pueda cerrar con una tapa ajustada y resistente a perforaciones, sin que puedan salir objetos punzocortantes,
- se mantenga en posición vertical y estable durante su uso,
- sea resistente a fugas, y
- esté debidamente etiquetado para advertir sobre los desechos peligrosos dentro del contenedor.
Cuando su contenedor de objetos punzocortantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de desecharlo. Puede haber leyes estatales o locales sobre cómo desechar las agujas y jeringas usadas.
Para obtener más información sobre la eliminación segura de objetos punzocortantes e información específica sobre la eliminación de objetos punzocortantes en el estado en el que vive, visite el sitio web de la FDA en: www.fda.gov/safesharpsdisposal.
No recicle su contenedor de objetos punzocortantes usado.
Fabricado por: AbbVie Inc., North Chicago, IL 60064, U.S.A.
US License Number 1889
SKYRIZI® is a trademark of AbbVie Biotechnology Ltd.
© 2019-2024 AbbVie Inc.
20078139
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos.
Revisado: 3/2024
INSTRUCCIONES DE USO
Instrucciones de uso
SKYRIZI® (sky-RIZZ-ee)
(risankizumab-rzaa)
inyección, para uso subcutáneo
4 jeringas precargadas de dosis única de 90 mg/mL para una dosis total de 360 mg/4 mL
Lea antes del primer uso
Consulte la Guía de medicamentos para obtener información sobre el producto.
Jeringa precargada de dosis única de SKYRIZI

Mantenga SKYRIZI y todos los medicamentos fuera del alcance de los niños.
Información importante:
- Mantenga SKYRIZI en la caja original para protegerlo de la luz hasta el momento de su uso.
- El líquido debe tener un aspecto transparente a ligeramente amarillo y puede contener pequeñas partículas blancas o transparentes.
- No use SKYRIZI si el líquido está descolorido, turbio o contiene copos o partículas grandes. Devuelva el producto a la farmacia.
- No use SKYRIZI si la fecha de caducidad (EXP:) que aparece en la caja y en la jeringa precargada ha pasado. Devuelva el producto a la farmacia.
- No use SKYRIZI si el líquido se ha congelado (incluso si se ha descongelado).
- No agite la jeringa.
- No use SKYRIZI si la jeringa precargada se ha caído o dañado. Devuelva el producto a la farmacia.
- No use SKYRIZI si las perforaciones de la caja están rotas. Devuelva el producto a la farmacia.
- No retire la cubierta de la aguja hasta justo antes de administrar las inyecciones.
- SKYRIZI no está hecho con látex de caucho natural.
Lea las instrucciones completas de uso antes de usar la jeringa precargada de SKYRIZI
Antes de inyectar:
- Reciba formación sobre cómo inyectar SKYRIZI antes de administrar las inyecciones. Llame a su proveedor de atención médica o al (866) SKYRIZI o (866) 759-7494 si necesita ayuda.
- Marque su calendario con antelación para recordar cuándo debe tomar SKYRIZI.
-
Deje la caja a temperatura ambiente y fuera de la luz solar directa durante 15 a 30 minutos para que se caliente.
- No retire las jeringas precargadas de la caja mientras permite que SKYRIZI alcance la temperatura ambiente.
- No caliente SKYRIZI de ninguna otra manera (por ejemplo, no lo caliente en el microondas o en agua caliente).
Información importante:
- El líquido debe tener un aspecto transparente a ligeramente amarillo y puede contener pequeñas partículas blancas o transparentes.
- No use SKYRIZI si el líquido está descolorido, turbio o contiene copos o partículas grandes. Devuelva el producto a la farmacia.
- No use SKYRIZI si la fecha de caducidad (EXP:) que aparece en la caja y en la jeringa precargada ha pasado. Devuelva el producto a la farmacia.
- No use SKYRIZI si la jeringa precargada se ha caído o dañado. Devuelva el producto a la farmacia.
- No use SKYRIZI si las perforaciones de la caja están rotas. Devuelva el producto a la farmacia.
Información sobre el almacenamiento:
- Almacene SKYRIZI en el refrigerador entre 36°F to 46°F (2°C to 8°C).
- No agite SKYRIZI.
- Mantenga SKYRIZI en la caja original para protegerlo de la luz hasta el momento de su uso.
- SKYRIZI no está hecho con látex de caucho natural.
- No use si el líquido se ha congelado (incluso si se ha descongelado).
Mantenga SKYRIZI y todos los medicamentos fuera del alcance de los niños.
Llame a su proveedor de atención médica o al (866) SKYRIZI o (866) 759-7494 si necesita ayuda o no sabe cómo proceder.
|
 Reúna los suministros para las inyecciones y coloque lo siguiente sobre una superficie limpia y plana:
Lávese y séquese las manos. |
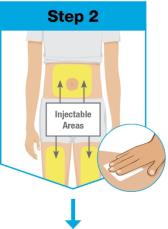
|
Elija entre las 3 áreas para inyección:
|
|
Sostenga la jeringa precargada con la aguja cubierta hacia abajo, como se muestra. Revise el líquido en la jeringa precargada.
|
|
Retire la cubierta de la aguja.
|
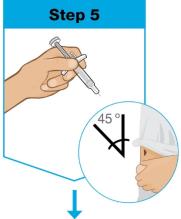
|
Sostenga el cuerpo de la jeringa precargada en 1 mano entre el pulgar y el dedo índice. Pellizque suavemente el área de la piel limpia con la otra mano y sosténgala firmemente. Inserte la aguja en la piel con un ángulo de aproximadamente 45 grados, mediante un movimiento rápido y corto. Mantenga el ángulo constante. |
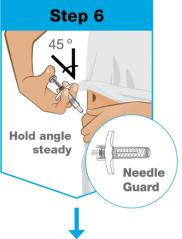
|
Empuje el émbolo lentamente hasta el final hasta que todo el líquido se haya inyectado y la jeringa esté vacía. Extraiga la aguja de la piel manteniendo la jeringa en el mismo ángulo. Libere el émbolo.
La protección de la aguja no se activará automáticamente a menos que todo el líquido se haya inyectado.
|

|
Repita los Pasos 2 a 6 con la 2ª, 3ª y 4ª jeringa precargada para una dosis completa.
|

|
Coloque sus jeringas precargadas usadas en un contenedor de eliminación de objetos punzantes aprobado por la FDA inmediatamente después de usarlas.
Para más información, o si no tiene un contenedor de objetos punzantes aprobado por la FDA, consulte la sección “Eliminación de Jeringas Precargadas Usadas de SKYRIZI” ubicada en el otro lado de estas instrucciones. |
Preguntas sobre el uso de la jeringa precargada de SKYRIZI
P. ¿Qué pasa si no he recibido capacitación en persona de un profesional de la salud?
R. Llame a su proveedor de atención médica o al (866) SKYRIZI o al (866) 759-7494 si necesita ayuda. Reciba capacitación sobre cómo inyectar SKYRIZI antes de administrar las inyecciones.
P. ¿Qué debo hacer con las cuatro jeringas precargadas usadas después de mis inyecciones?
R. Deseche (elimine) las 4 jeringas precargadas usadas en un contenedor para objetos punzantes. No las coloque en la basura doméstica. Para obtener más información, consulte la sección “Eliminación de jeringas precargadas usadas de SKYRIZI”.
Puede registrarse para recibir contenedores para objetos punzantes para la eliminación de jeringas precargadas de SKYRIZI sin costo adicional visitando www.SKYRIZI.com o llamando al (866) 759-7494
P. ¿Cómo sé cuándo se completa la inyección?
R. La inyección está completa cuando la jeringa precargada está vacía, la varilla del émbolo está completamente empujada hacia adentro y el protector de la aguja de la jeringa está activado.
Eliminación de jeringas precargadas usadas de SKYRIZI
Deseche (elimine) las cuatro jeringas precargadas usadas en un contenedor para objetos punzantes. No las coloque en la basura doméstica.
Si no tiene un contenedor para objetos punzantes aprobado por la FDA, puede usar un contenedor doméstico que:
- esté hecho de plástico resistente,
- se pueda cerrar con una tapa hermética y resistente a las perforaciones, sin que los objetos punzantes puedan salir,
- se mantenga en posición vertical y estable durante el uso,
- sea a prueba de fugas, y
- haya sido etiquetado adecuadamente para advertir sobre los residuos peligrosos dentro del contenedor.
Cuando su contenedor para objetos punzantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de desechar su contenedor para objetos punzantes. Puede haber leyes estatales o locales sobre cómo debe desechar las agujas y jeringas usadas.
Para obtener más información sobre la eliminación segura de objetos punzantes y para obtener información específica sobre la eliminación de objetos punzantes en el estado en el que vive, visite el sitio web de la FDA en: www.fda.gov/safesharpsdisposal.
No recicle su contenedor para objetos punzantes usado.
Fabricado por: AbbVie Inc., North Chicago, IL 60064, EE. UU.
Número de licencia de EE. UU. 1889
SKYRIZI® es una marca comercial de AbbVie Biotechnology Ltd.
© 2019-2024 AbbVie Inc.
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los EE. UU.
Revisado: 3/2024
INSTRUCCIONES DE USO
Instrucciones de uso
SKYRIZI® (sky-RIZZ-ee) Inyector de cuerpo
risankizumab-rzaa
inyección, solo para uso subcutáneo
Inyector de cuerpo y cartucho prellenado de 180 mg/1.2 mL,
Inyector de cuerpo y cartucho prellenado de 360 mg/2.4 mL
Lea estas Instrucciones de uso antes de comenzar a usar SKYRIZI y cada vez que reciba una recarga. Puede haber nueva información. Esta información no reemplaza hablar con su proveedor de atención médica sobre su condición médica o tratamiento.
Consulte la Guía de medicamentos para obtener información sobre el producto SKYRIZI. Llame a su proveedor de atención médica, llame al (866) SKYRIZI o al (866) 759-7494 o visite SKYRIZI.com si necesita ayuda.
Información importante que necesita saber antes de inyectar SKYRIZI
- Reciba capacitación sobre cómo inyectar SKYRIZI antes de administrar una inyección.
- No agite la caja de SKYRIZI, el inyector de cuerpo o el cartucho prellenado.
- No extraiga el inyector de cuerpo o el cartucho prellenado de la caja hasta que esté listo para inyectar.
- No espere más de 5 minutos para comenzar la inyección después de cargar el cartucho prellenado limpio en el inyector de cuerpo. Esperar secará el medicamento y el inyector de cuerpo no funcionará después.
-
No toque el botón de inicio hasta que coloque el inyector de cuerpo cargado con el cartucho prellenado sobre su piel y esté listo para inyectar.
◦ Solo puede presionar el botón de inicio 1 vez. - No use el inyector de cuerpo o el cartucho prellenado si alguno se ha caído o dañado.
- No reutilice el inyector de cuerpo o el cartucho prellenado. El inyector de cuerpo y el cartucho prellenado son solo para uso de 1 vez (monodosis).
- No deje que el inyector de cuerpo se moje con agua u otros líquidos.
- Este inyector de cuerpo de dosis única está diseñado para usarse solo con el cartucho prellenado de SKYRIZI.
- La actividad física debe limitarse durante el proceso de inyección. Se pueden realizar actividades físicas moderadas, como caminar, alcanzar y doblarse.
- No use SKYRIZI si la fecha de vencimiento (EXP:) ha pasado.
- No use el cartucho prellenado si el líquido está descolorido, turbio o contiene copos o partículas grandes. El líquido debe verse claro a amarillo y puede contener pequeñas partículas blancas o transparentes.
- El inyector de cuerpo y el cartucho prellenado no están hechos con látex de caucho natural.
- Mantenga SKYRIZI y todos los medicamentos fuera del alcance de los niños.
Almacenamiento y preparación para el uso
- Mantenga SKYRIZI en la caja original para protegerlo de la luz y los daños físicos hasta el momento de su uso.
- Almacene SKYRIZI en su refrigerador entre 36°F y 46°F (2°C y 8°C).
- Cuando esté listo para usar, saque la caja del refrigerador y déjela a temperatura ambiente durante al menos 45 minutos hasta 90 minutos para permitir que SKYRIZI se caliente.
- El inyector de cuerpo no funcionará si se deja a temperatura ambiente durante menos de 45 minutos.
- No deje al sol directo.
- No extraiga el inyector de cuerpo o el cartucho prellenado de la caja mientras permite que SKYRIZI alcance la temperatura ambiente.
- No caliente SKYRIZI de ninguna otra manera. Por ejemplo, no lo caliente en un microondas o en agua caliente.
- No use si el líquido se ha congelado (incluso si se descongeló).
-
No use SKYRIZI si las perforaciones de la caja están rotas. Devuelva el producto a la farmacia.
- No use el inyector de cuerpo y el cartucho prellenado si el sello de la bandeja de papel blanco falta o está dañado y devuelva la caja a la farmacia.
Conozca su inyector de cuerpo SKYRIZI y su cartucho prellenado
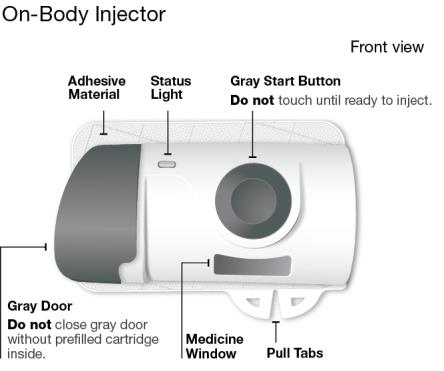
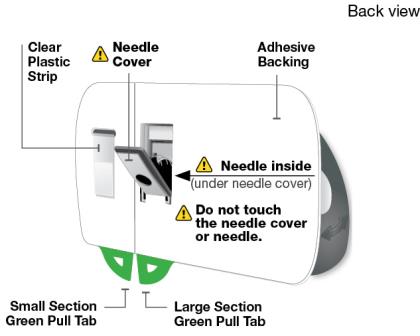
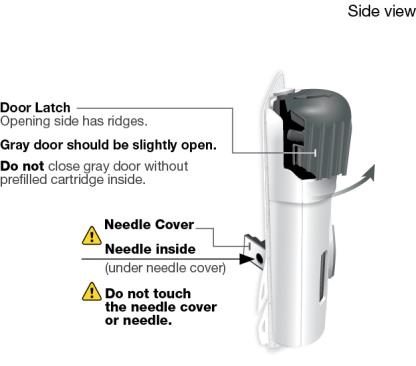
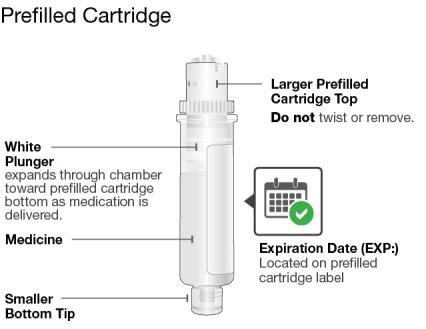
Lea las Instrucciones de uso completas antes de usar SKYRIZI. Llame a su proveedor de atención médica o al (866) SKYRIZI o al (866) 759-7494 o visite www.SKYRIZI.com si necesita ayuda o si no sabe cómo proceder.
| Paso 1 Prepárese | ||
| Antes de usar SKYRIZI, debe recibir capacitación sobre cómo inyectar SKYRIZI. | ||
|
Verifique la fecha de vencimiento
|
|
 |
Espere al menos 45 minutos
|
|
 |
Abra la caja y retire la bandeja de plástico
|
|
 |
Reúna todos los suministros y lávese las manos
|
|
|
Retire el sello de la bandeja de papel blanco
|
|
|
Levante la tapa de plástico
|
|
 |
Inspeccione el inyector de cuerpo
|
|
| Paso 2 Configurar el inyector de cuerpo | ||
 |
Abra completamente la puerta gris Evite tocar la cubierta de la aguja o la aguja en la parte posterior del inyector de cuerpo. La aguja está detrás de la cubierta de la aguja. Evite tocar la cubierta de la aguja o la aguja en la parte posterior del inyector de cuerpo. La aguja está detrás de la cubierta de la aguja.
|
|
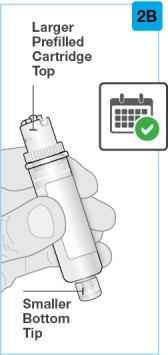 |
Inspeccione el cartucho prellenado
|
|
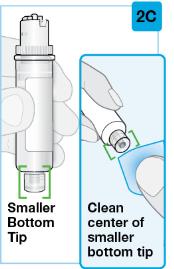 |
Limpie la punta inferior más pequeña del cartucho prellenado
|
|
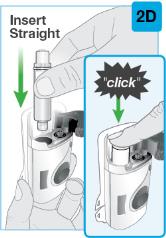
|
Cargue el cartucho prellenado limpio en el inyector de cuerpo
|
|
 |
Asegúrese de que inicia la inyección en los 5 minutos siguientes a la inserción del cartucho prellenado en el inyector de cuerpo. Esperar secará el medicamento y el inyector de cuerpo no funcionará después. | |
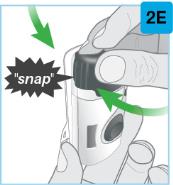 |
Cierre la puerta gris
|
|
| Paso 3 Prepararse para inyectar | ||
| Mantenga los dispositivos electrónicos, incluidos los teléfonos móviles, a una distancia de al menos 12 pulgadas (30 cm) del inyector de cuerpo hasta que la inyección esté completa | ||
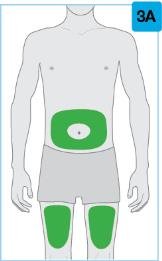 |
Elija su área de inyección Localice un área firme y plana en su piel desnuda. Asegúrese de que el área esté libre de ropa:
|
|
 |
Limpie el área de inyección
|
|
 |
Despegue ambas pestañas para exponer el adhesivo
|
|
 |
||
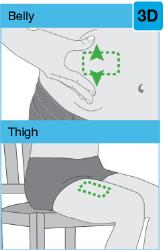
|
Prepare el inyector en el cuerpo para su colocación
|
|
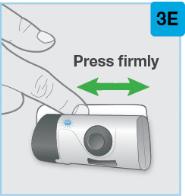 |
Coloque el inyector en el cuerpo sobre su piel
|
|
| Paso 4 Inyectar el medicamento | ||
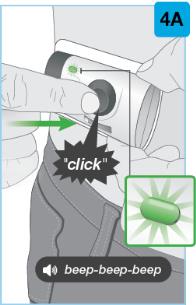 |
Iniciar la inyección
|
|
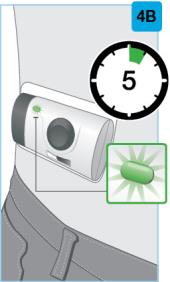 |
Espere a que la inyección termine
Durante la inyección:
|
|
 |
La inyección ha terminado
|
|
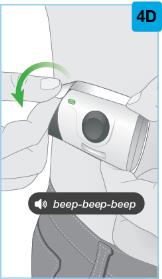 |
Retire el inyector de cuerpo
|
|
| Paso 5 Confirmar y desechar | ||

|
Revise el inyector de cuerpo
|
|
|
Coloque el inyector de cuerpo usado en un contenedor de eliminación de objetos punzantes aprobado por la FDA inmediatamente después de su uso
|
|

Lea atentamente las Instrucciones de uso completas antes de usar SKYRIZI. Llame a su proveedor de atención médica o al (866) SKYRIZI o al (866) 759-7494 o visite www.SKYRIZI.com si necesita ayuda o si no sabe cómo proceder.
Preguntas frecuentes
P. ¿Qué pasa si no puedo abrir la puerta del inyector en el cuerpo para insertar el cartucho prellenado?
R. Para abrir la puerta del inyector en el cuerpo, presione firmemente en el lado izquierdo de la puerta para liberar el pestillo de la puerta. Si aún no puede abrir la puerta, llame al (866) SKYRIZI o al (866) 759-7494.
P. ¿Qué pasa si presiono el botón de inicio gris antes de colocar el inyector en el cuerpo sobre mi piel?
R. El botón de inicio gris solo se puede presionar 1 vez. Si se presiona el botón de inicio gris antes de colocarlo en su cuerpo, ya no se puede usar. Llame al (866) SKYRIZI o al (866) 759-7494.
P. ¿Qué pasa si el inyector en el cuerpo no emite un pitido y la luz azul de estado no parpadea cuando quito las lengüetas verdes?
R. Despegar la pequeña lengüeta verde quitará la tira de plástico transparente, activando el inyector en el cuerpo. Si se ha quitado todo el papel adhesivo y el inyector en el cuerpo aún no se enciende, llame al (866) SKYRIZI o al (866) 759-7494.
P. ¿Qué pasa si presiono el botón de inicio como se indicó después de colocar el inyector en el cuerpo sobre la piel y la luz permanece azul?
R. Presione firmemente el botón de inicio gris nuevamente. Si la luz de estado permanece azul o parpadea en rojo, retire el inyector en el cuerpo despegándolo cuidadosamente de su piel. No vuelva a aplicar el inyector en el cuerpo. Llame al (866) SKYRIZI o al (866) 759-7494.
P. ¿Qué pasa si la luz de estado parpadea en rojo y emite un pitido mientras usa el inyector en el cuerpo?
R. Si la luz de estado parpadea continuamente en rojo y emite un pitido, no use el inyector en el cuerpo. Si está conectado a su cuerpo, retírelo con cuidado. Llame al (866) SKYRIZI o al (866) 759-7494.
P. ¿Qué debo hacer si el inyector en el cuerpo se sale de mi cuerpo durante la inyección?
R. El inyector en el cuerpo cargado ya no se puede usar. No lo vuelva a aplicar a su cuerpo. Llame al (866) SKYRIZI o al (866) 759-7494.
P. ¿Cómo sé cuándo se completa la inyección?
R. La inyección está completa cuando el inyector en el cuerpo emite un pitido, el émbolo blanco ha llenado completamente la ventana del medicamento y la luz de estado cambia de verde parpadeante a verde sólido.
P. ¿Qué debo hacer si hay más de unas pocas gotas de líquido en el área de inyección?
R. Llame al (866) SKYRIZI o al (866) 759-7494 para obtener ayuda.
P. ¿Qué debo hacer con el inyector en el cuerpo usado después de mi inyección?
R. Deseche (descarte) el inyector en el cuerpo usado en un contenedor de eliminación de objetos punzantes aprobado por la FDA y no en la basura de su hogar. Puede recibir un contenedor de objetos punzantes para la eliminación de SKYRIZI sin costo adicional visitando www.SKYRIZI.com o llamando al (866) SKYRIZI o al (866) 759-7494.
P. ¿Qué pasa si no he recibido capacitación en persona de un profesional de la salud?
R. Llame a su proveedor de atención médica o al (866) SKYRIZI o al (866) 759-7494 si necesita ayuda.
Reciba capacitación sobre cómo inyectar SKYRIZI antes de administrar las inyecciones.

Eliminación de SKYRIZI
- Coloque SKYRIZI en un contenedor de eliminación de objetos punzantes aprobado por la FDA inmediatamente después de su uso. No deseche (descarte) SKYRIZI en la basura de su hogar.
- Si no tiene un contenedor de eliminación de objetos punzantes aprobado por la FDA, puede usar un contenedor doméstico que sea:
◦ hecho de plástico resistente,
◦ se puede cerrar con una tapa hermética y resistente a las perforaciones, sin que los objetos punzantes puedan salir,
◦ vertical y estable durante el uso,
◦ a prueba de fugas, y
◦ debidamente etiquetado para advertir sobre los residuos peligrosos dentro del contenedor.
Cuando su contenedor de eliminación de objetos punzantes esté casi lleno, deberá seguir las pautas de su comunidad para la forma correcta de desechar su contenedor de eliminación de objetos punzantes. Puede haber leyes estatales o locales sobre cómo debe desechar las agujas y jeringas usadas.
Para obtener más información sobre la eliminación segura de objetos punzantes en el estado en el que vive, visite el sitio web de la FDA en: www.fda.gov/safesharpsdisposal.
No recicle su contenedor de eliminación de objetos punzantes usado.
Información adicional
● Parte aplicada tipo BF.
●  Inyector en el cuerpo esterilizado utilizando óxido de etileno.
Inyector en el cuerpo esterilizado utilizando óxido de etileno.
● El rango de altitud es de -1,312 pies a 10,499 pies (-400 metros a 3,200 metros).
Compatibilidad electromagnética (EMC) del inyector en el cuerpo
El inyector en el cuerpo está diseñado para uso doméstico o uso en un entorno de atención médica profesional y cumple con ISO 11608-1:2014 e IEC 60601-1-2:2014.
Se debe tener cuidado de usar el inyector en el cuerpo dentro de los siguientes límites y entornos específicos para evitar afectar negativamente el rendimiento (dosis de SKYRIZI omitida o incompleta).
- Mantenga los dispositivos electrónicos, incluidos los teléfonos celulares, a una distancia de al menos 12 pulgadas (30 cm) del inyector en el cuerpo hasta que se complete la inyección. Se desconoce el impacto potencial de la interferencia electrónica cuando el inyector en el cuerpo funciona a menos de 12 pulgadas (30 cm).
- No exponga el inyector en el cuerpo a un entorno de resonancia magnética (RM) (por ejemplo, IRM).
- Si se utiliza adyacente a otros equipos eléctricos, observe el inyector en el cuerpo y otros equipos para asegurarse de que funcione normalmente.
Emisiones
| Nombre de la prueba de emisiones | Niveles de prueba |
| Campos electromagnéticos de radiofrecuencia radiados | Según CISPR 11, clase B |
Inmunidad electromagnética
| Nombre de la prueba | Niveles de prueba |
| Descarga electrostática (ESD) | ± 8 kV contacto ± 2 kV, ± 4 kV, ± 8 kV, ± 15 kV aire |
| Campo electromagnético de radiofrecuencia | 10 V/m 80 MHz – 2.7 GHz |
| Campo magnético de frecuencia de potencia de 50 Hz | 30 A/m |
La inmunidad del puerto de la carcasa a los equipos de comunicaciones inalámbricas de RF cumple con IEC 60601-1-2:2014.
Glosario de símbolos
| Símbolo | Descripción del símbolo |
 |
Mantener seco |
 |
Esterilizado con óxido de etileno |
 |
No reutilizar |
 |
No usar si el paquete está dañado y consultar las instrucciones de uso |
 |
Fecha de fabricación |
 |
Lote |
 |
Número de catálogo |
 |
Número de serie |
 |
Consulte el manual de instrucciones / folleto |
 |
Tipo BF Parte aplicada |
 |
No seguro para RM |
Fabricado por:
AbbVie Inc., North Chicago, IL 60064, EE. UU.
Número de licencia de EE. UU. 1889
SKYRIZI® es una marca registrada de AbbVie Biotechnology Ltd.
©2024 AbbVie Inc.
Estas instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los EE. UU.
Revisado: 6/2024
20086115
PANEL DE VISUALIZACIÓN PRINCIPAL
NDC 0074-2100-01
Una pluma precargada de dosis única de 1 mL
Skyrizi® PEN 150 mg/mL
risankizumab-rzaa Inyección
SOLO PARA USO SUBCUTÁNEO
Devolver a la farmacia si las perforaciones del cartón están rotas.
ATENCIÓN FARMACÉUTICO:
Cada paciente debe recibir
la Guía de Medicamentos adjunta.
Este cartón completo se dispensa como una unidad.
ÁREA PARA LA ETIQUETA DE LA FARMACIA
www.SKYRIZI.com
Solo con receta médica
abbvie
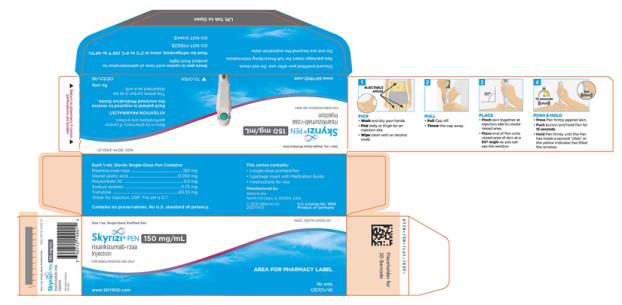
PANEL DE VISUALIZACIÓN PRINCIPAL
NDC 0074-1050-01
Una jeringa precargada de dosis única de 1 mL
Skyrizi® 150 mg/mL
risankizumab-rzaa
inyección
SOLO PARA USO SUBCUTÁNEO
Devolver a la farmacia si las perforaciones del cartón están rotas.
Todo este cartón se dispensa como una unidad.
ÁREA PARA LA ETIQUETA DE LA FARMACIA
www.SKYRIZI.com
Solo con receta médica
Abbvie
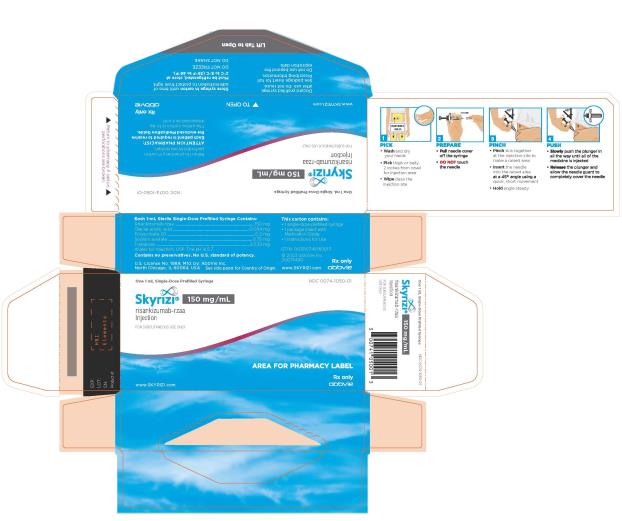
PANEL DE VISUALIZACIÓN PRINCIPAL
NDC 0074-1070-01
1 x 2,4 mL Cartucho rellenable
Skyrizi®
Inyección de risankizumab-rzaa
(360 mg/2,4 mL)
150 mg/mL
SOLO PARA USO SUBCUTÁNEO
Dosis única
SKYRIZI.com
Sólo receta médica
abbvie
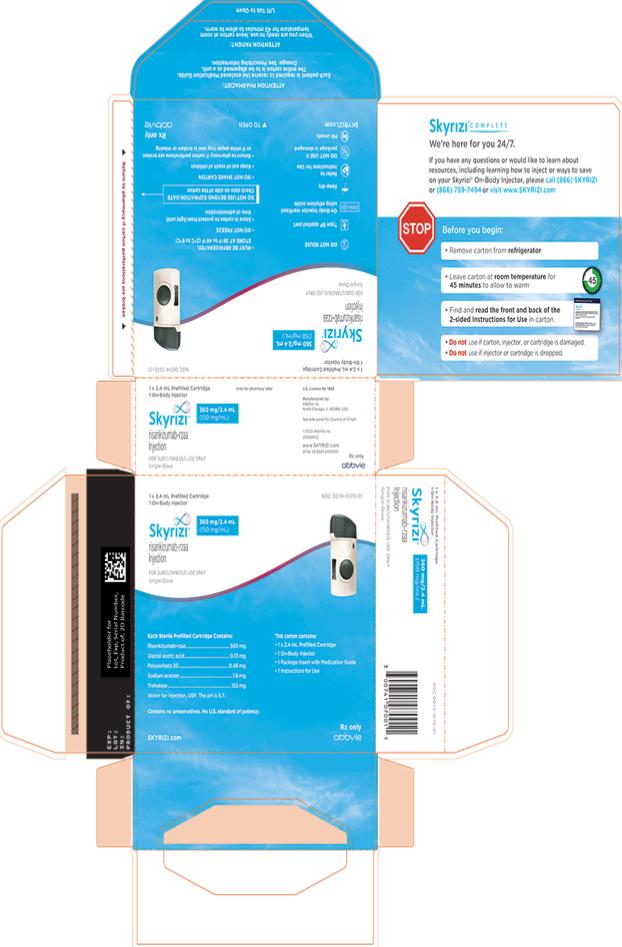
PANEL DE VISUALIZACIÓN PRINCIPAL
NDC 0074-5015-01
Skyrizi®
Inyección de risankizumab-rzaa
600 mg/10 mL
(60 mg/mL)
SOLO PARA USO INTRAVENOSO
Debe diluirse antes de su uso
Un frasco de dosis única de 10 mL –
Desechar la porción no utilizada
Atención: Entregar la Guía de Medicación adjunta a cada paciente.
Sólo con receta médica
abbvie
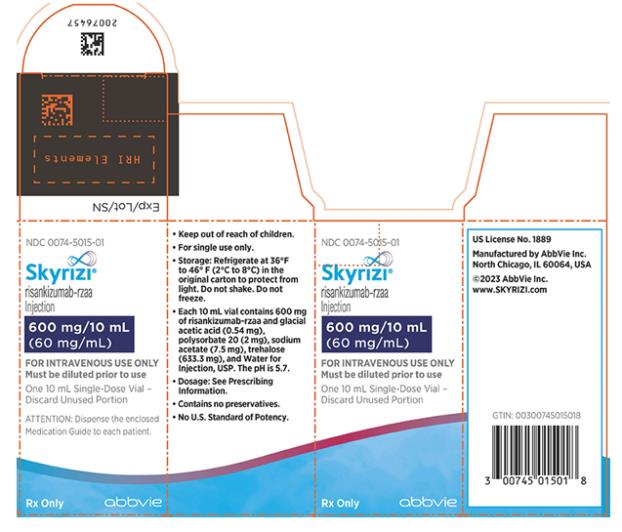
PANEL DE VISUALIZACIÓN PRINCIPAL
NDC 0074-1069-01
Skyrizi®
Risankizumab-rzaa
Inyección
360 mg/2.4 mL
(150 mg/mL)
SOLO PARA USO SUBCUTÁNEO
Dosis única
Rx solamente

PANEL DE VISUALIZACIÓN PRINCIPAL
NDC 0074-1069-02
NO SE VENDE
Skyrizi®
Risankizumab-rzaa
Inyección
360 mg/2.4 mL
(150 mg/mL)
SOLO PARA USO SUBCUTÁNEO
Dosis única
Rx Only

PANEL DE VISUALIZACIÓN PRINCIPAL
NDC 0074-1065-01
1 cartucho precargado de 1,2 mL
1 inyector corporal
Skyrizi®
Inyección de risankizumab-rzaa
(180 mg/1,2 mL)
150 mg/mL
SOLO PARA USO SUBCUTÁNEO
Dosis única
SKYRIZI.com
Sólo con receta médica
abbvie

PANEL DE VISUALIZACIÓN PRINCIPAL
NDC 0074-1066-01
Skyrizi®
Risankizumab-rzaa
Inyección
180 mg/1,2 mL
(150 mg/mL)
SOLO PARA USO SUBCUTÁNEO
Dosis única
Sólo con receta

PANEL DE VISUALIZACIÓN PRINCIPAL
NDC 0074-1066-02
NO VENTA
Skyrizi®
Risankizumab-rzaa
Inyección
180 mg/1,2 mL
(150 mg/mL)
SOLO PARA USO SUBCUTÁNEO
Dosis única
Rx solo

PANEL DE VISUALIZACIÓN PRINCIPAL
NDC 0074-7034-02
2 x 1 mL Jeringas precargadas
Skyrizi®
risankizumab-rzaa inyección
90 mg/mL por jeringa
2 x 90 mg/mL. Jeringas precargadas de dosis única
para una dosis total de 180 mg/2 mL
PARA USO SUBCUTÁNEO SOLAMENTE
PARA ADMINISTRACIÓN SOLAMENTE POR UN PROFESIONAL DE LA SALUD
www. SKYRIZI.com
Rx Only
abbvie

PANEL DE VISUALIZACIÓN PRINCIPAL
NDC 0074-7032-90
Una jeringa precargada de dosis única de 1 mL
Skyrizi®
risankizumab-rzaa Inyección
90 mg/mL
SOLO PARA USO SUBCUTÁNEO
SOLO PARA ADMINISTRACIÓN POR UN PROFESIONAL DE LA SALUD
www. SKYRIZI.com
Receta médica únicamente
abbvie
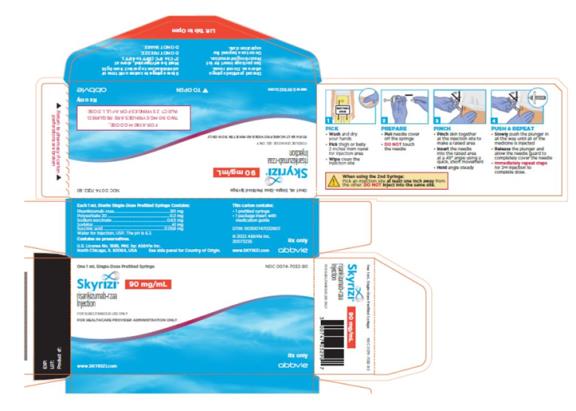
PANEL DE VISUALIZACIÓN PRINCIPAL
NDC 0074-7036-04
4 x 1 mL Jeringas precargadas
Skyrizi®
risankizumab-rzaa Inyección
90 mg/mL por jeringa
4 x 90 mg/mL Dosis única precargada
Jeringas para una dosis total de 360 mg/4 mL
SOLO PARA USO SUBCUTÁNEO
SOLO PARA ADMINISTRACIÓN POR UN PROFESIONAL DE LA SALUD
ATENCIÓN FARMACÉUTICO:
Cada paciente debe recibir la Guía del Medicamento adjunta.
La caja completa debe dispensarse como una unidad.
Devolver a la farmacia si el sello de la caja está roto o falta.
www. SKYRIZI.com
Receta médica únicamente
Abbvie

PANEL DE VISUALIZACIÓN PRINCIPAL
NDC 0074-7032-01
Skyrizi® 90 mg/mL
risankizumab-rzaa
Inyección
Solo para administración subcutánea
PARA ADMINISTRACIÓN SOLO POR UN PROFESIONAL DE LA SALUD
PARA UNA DOSIS DE 350 MG,
SE REQUIEREN CUATRO JERINGAS DE 90 MG,
INYECTE LAS 4 JERINGAS PARA UNA DOSIS COMPLETA
www.SKYRIZI.com
Rx Only
abbvie

NDC 0074-7040-02
2 x 90 mg/mL Jeringas precargadas de dosis única
Skyrizi®
90 mg/mL por jeringa
2 x 90 mg/mL Jeringas precargadas de dosis única
para una dosis total de 180 mg/2 mL
risankizumab-rzaa
Inyección
SOLO PARA USO SUBCUTÁNEO
Devuelva a la farmacia si las perforaciones de la caja están rotas.
ATENCIÓN FARMACÉUTICO:
Cada paciente debe recibir
la Guía de Medicamentos adjunta.
Esta caja completa se dispensa como una unidad.
PARA UNA DOSIS DE 180 MG,
SE REQUIEREN DOS JERINGAS DE 90 MG.
INYECTE 2 JERINGAS PARA UNA DOSIS COMPLETA.
www.SKYRIZI.com
Rx only
abbvie





