Fabricante de medicamentos: Sumitomo Pharma America, Inc. (Updated: 2025-01-31)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
LATUDA (clorhidrato de lurasidona) comprimidos, para administración oral
Aprobación inicial en EE. UU.: 2010
ADVERTENCIA: AUMENTO DE LA MORTALIDAD EN PACIENTES ANCIANOS CON PSICOSIS ASOCIADA A DEMENTIA; Y PENSAMIENTOS Y COMPORTAMIENTOS SUICIDAS
Consulte la información completa de la advertencia en recuadro.
- Los pacientes ancianos con psicosis relacionada con la demencia tratados con fármacos antipsicóticos presentan un mayor riesgo de muerte. LATUDA no está aprobado para el tratamiento de pacientes con psicosis relacionada con la demencia (5.1).
- Los antidepresivos aumentaron el riesgo de pensamientos y comportamientos suicidas en pacientes pediátricos y adultos jóvenes. Supervisar estrechamente la aparición de empeoramiento clínico y la aparición de pensamientos y comportamientos suicidas (5.2).
CAMBIOS IMPORTANTES RECIENTES
| Advertencias y precauciones (5.7) | 1/2025 |
INDICACIONES Y USO
LATUDA es un antipsicótico atípico indicado para el tratamiento de:
- Esquizofrenia en adultos y adolescentes (13 a 17 años) (1, 14.1)
- Episodio depresivo asociado con el trastorno bipolar I (depresión bipolar) en adultos y pacientes pediátricos (10 a 17 años) como monoterapia (1, 14.2)
- Episodio depresivo asociado con el trastorno bipolar I (depresión bipolar) en adultos como terapia complementaria con litio o valproato (1, 14.2)
POSOLOGÍA Y ADMINISTRACIÓN
LATUDA debe tomarse con alimentos (al menos 350 calorías). La administración con alimentos aumenta sustancialmente la absorción de LATUDA (2.3, 12.3).
| Indicación | Dosis inicial | Dosis recomendada |
| Esquizofrenia – adultos (2.1) | 40 mg al día | 40 mg a 160 mg al día |
| Esquizofrenia – adolescentes (13 a 17 años) (2.1) | 40 mg al día | 40 mg a 80 mg al día |
| Depresión bipolar – adultos (2.2) | 20 mg al día | 20 mg a 120 mg al día |
| Depresión bipolar – pacientes pediátricos (10 a 17 años) (2.2) | 20 mg al día | 20 mg a 80 mg al día |
- Insuficiencia renal moderada y grave: La dosis inicial recomendada es de 20 mg por día, y la dosis máxima recomendada es de 80 mg por día (2.4, 8.6).
- Insuficiencia hepática moderada y grave: La dosis inicial recomendada es de 20 mg por día. La dosis máxima recomendada es de 80 mg por día en insuficiencia hepática moderada y de 40 mg por día en insuficiencia hepática grave (2.5, 8.7).
-
Uso concomitante de un inhibidor moderado del CYP3A4 (p. ej., diltiazem):
La dosis de LATUDA debe reducirse a la mitad del nivel de dosis original. La dosis inicial recomendada es de 20 mg por día. La dosis máxima recomendada es de 80 mg por día (2.6, 7.1). -
Uso concomitante de un inductor moderado del CYP3A4:
Puede ser necesario aumentar la dosis de LATUDA (2.6, 7.1).
FORMAS Y CONCENTRACIONES FARMACÉUTICAS
Comprimidos: 20 mg, 40 mg, 60 mg, 80 mg y 120 mg (3)
CONTRAINDICACIONES
ADVERTENCIAS Y PRECAUCIONES
- Reacciones adversas cerebrovasculares en pacientes de edad avanzada con psicosis relacionada con la demencia: Mayor incidencia de eventos adversos cerebrovasculares (p. ej., accidente cerebrovascular, accidente isquémico transitorio) (5.3).
- Síndrome neuroléptico maligno: Manejar con la interrupción inmediata y una estrecha vigilancia (5.4).
- Discinesia tardía: Interrumpir si es clínicamente apropiado (5.5).
- Cambios metabólicos: Controlar la hiperglucemia/diabetes mellitus, la dislipidemia y el aumento de peso (5.6).
- Hiperprolactinemia: Pueden producirse elevaciones de prolactina (5.7).
- Leucopenia, neutropenia y agranulocitosis: Realizar hemogramas completos (CBC) en pacientes con un recuento bajo de leucocitos (WBC) preexistente o antecedentes de leucopenia o neutropenia. Considere la posibilidad de interrumpir LATUDA si se produce una disminución clínicamente significativa de los leucocitos en ausencia de otros factores causales (5.8).
- Hipotensión ortostática y síncope: Controlar la frecuencia cardíaca y la presión arterial y advertir a los pacientes con enfermedad cardiovascular o cerebrovascular conocida y riesgo de deshidratación o síncope (5.9).
REACCIONES ADVERSAS
Las reacciones adversas observadas comúnmente (incidencia ≥ 5% y al menos el doble de la tasa para el placebo) fueron (6.1):
- Pacientes adultos con esquizofrenia: somnolencia, acatisia, síntomas extrapiramidales y náuseas
- Pacientes adolescentes (13-17 años) con esquizofrenia: somnolencia, náuseas, acatisia, SEP (no acatisia), rinitis (solo 80 mg) y vómitos
- Pacientes adultos con depresión bipolar: acatisia, síntomas extrapiramidales y somnolencia
- Pacientes pediátricos (10-17 años) con depresión bipolar: náuseas, aumento de peso e insomnio.
Para notificar SOSPECHAS DE REACCIONES ADVERSAS, comuníquese con Sumitomo Pharma America, Inc. al 1-877-737-7226 o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
USO EN POBLACIONES ESPECÍFICAS
- Embarazo: Puede causar síntomas extrapiramidales y/o de abstinencia en neonatos con exposición en el tercer trimestre (8.1).
Ver 17 para INFORMACIÓN AL PACIENTE y Guía de Medicamentos.
Revisado: 1/2025
Tabla de contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
ADVERTENCIA: MAYOR MORTALIDAD EN PACIENTES DE EDAD AVANZADA CON PSICOSIS RELACIONADA CON LA DEMENCIA; y PENSAMIENTOS Y COMPORTAMIENTOS SUICIDAS
1 INDICACIONES Y USO
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Esquizofrenia
2.2 Episodios Depresivos Asociados con el Trastorno Bipolar I
2.3 Información de Administración
2.4 Modificaciones de la Dosis para la Insuficiencia Renal
2.5 Modificaciones de la Dosis para la Insuficiencia Hepática
2.6 Modificaciones de la Dosis Debido a Interacciones Farmacológicas de Inhibidores de CYP3A4 e Inductores de CYP3A4
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Mayor Mortalidad en Pacientes de Edad Avanzada con Psicosis Relacionada con la Demencia
5.2 Pensamientos y Comportamientos Suicidas en Pacientes Pediátricos y Adultos Jóvenes
5.3 Reacciones Adversas Cerebrovasculares, Incluido Accidente Cerebrovascular en Pacientes de Edad Avanzada con Psicosis Relacionada con la Demencia
5.4 Síndrome Neuroléptico Maligno
5.5 Discinesia Tardía
5.6 Cambios Metabólicos
5.7 Hiperprolactinemia
5.8 Leucopenia, Neutropenia y Agranulocitosis
5.9 Hipotensión Ortostática y Síncope
5.10 Caídas
5.11 Convulsiones
5.12 Potencial de Deterioro Cognitivo y Motor
5.13 Disregulación de la Temperatura Corporal
5.14 Activación de Manía/Hipomanía
5.15 Disfagia
5.16 Reacciones Adversas Neurológicas en Pacientes con Enfermedad de Parkinson o Demencia con Cuerpos de Lewy
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Poscomercialización
7 INTERACCIONES MEDICAMENTOSAS
7.1 Medicamentos con Interacciones Clínicamente Importantes con LATUDA
7.2 Medicamentos sin Interacciones Clínicamente Importantes con LATUDA
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
8.6 Insuficiencia Renal
8.7 Insuficiencia Hepática
8.8 Otras Poblaciones Específicas
9 ABUSO Y DEPENDENCIA DE DROGAS
9.1 Sustancia Controlada
9.2 Abuso
10 SOBREDOSIS
10.1 Experiencia Humana
10.2 Manejo de la Sobredosis
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Esquizofrenia
14.2 Episodios Depresivos Asociados con el Trastorno Bipolar I
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANIPULACIÓN
17 INFORMACIÓN DE ASESORAMIENTO AL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no se enumeran.
ADVERTENCIA RECUADRO
ADVERTENCIA: AUMENTO DE LA MORTALIDAD EN PACIENTES ANCIANOS CON PSICOSIS ASOCIADA A DEMENTIA; Y PENSAMIENTOS Y COMPORTAMIENTOS SUICIDAS
Aumento de la mortalidad en pacientes ancianos con psicosis asociada a demencia
Los pacientes ancianos con psicosis asociada a demencia tratados con fármacos antipsicóticos presentan un mayor riesgo de muerte. LATUDA no está aprobado para el tratamiento de pacientes con psicosis asociada a demencia
[ver Advertencias y precauciones (5.1)].
Pensamientos y comportamientos suicidas
Los antidepresivos aumentaron el riesgo de pensamientos y comportamientos suicidas en niños y adultos jóvenes en estudios a corto plazo. Monitorice estrechamente a todos los pacientes tratados con antidepresivos para detectar cualquier empeoramiento clínico y la aparición de pensamientos y comportamientos suicidas
[ver Advertencias y precauciones (5.2)].
1 INDICACIONES Y USO
LATUDA está indicado para:
- Tratamiento de pacientes adultos y adolescentes (de 13 a 17 años) con esquizofrenia [ver Estudios Clínicos (14.1)].
- Monoterapia para el tratamiento de pacientes adultos y pediátricos (de 10 a 17 años) con episodio depresivo mayor asociado con trastorno bipolar I (depresión bipolar) [ver Estudios Clínicos (14.2)].
- Tratamiento adyuvante con litio o valproato en pacientes adultos con episodio depresivo mayor asociado con trastorno bipolar I (depresión bipolar) [ver Estudios Clínicos (14.2)].
2 DOSIS Y ADMINISTRACIÓN
2.1 Esquizofrenia
Adultos
La dosis inicial recomendada de LATUDA es de 40 mg una vez al día. No se requiere titulación de la dosis inicial. Se ha demostrado que LATUDA es eficaz en un rango de dosis de 40 mg por día a 160 mg por día [ver Estudios Clínicos (14.1)]. La dosis máxima recomendada es de 160 mg por día.
Adolescentes (13 – 17 años)
La dosis inicial recomendada de LATUDA es de 40 mg una vez al día. No se requiere titulación de la dosis inicial. Se ha demostrado que LATUDA es eficaz en un rango de dosis de 40 mg por día a 80 mg por día [ver Estudios Clínicos (14.1)]. La dosis máxima recomendada es de 80 mg por día.
2.2 Episodios depresivos asociados con el trastorno bipolar I
Adultos
La dosis inicial recomendada de LATUDA es de 20 mg una vez al día como monoterapia o como terapia adjunta con litio o valproato. No se requiere titulación de la dosis inicial. Se ha demostrado que LATUDA es eficaz en un rango de dosis de 20 mg por día a 120 mg por día como monoterapia o como terapia adjunta con litio o valproato [ver Estudios Clínicos (14.2)]. La dosis máxima recomendada, como monoterapia o como terapia adjunta con litio o valproato, es de 120 mg por día. En el estudio de monoterapia, el rango de dosis más alto (80 mg a 120 mg por día) no proporcionó una eficacia adicional, en promedio, en comparación con el rango de dosis más bajo (20 a 60 mg por día) [ver Estudios Clínicos (14.2)].
Pacientes pediátricos (10 – 17 años)
La dosis inicial recomendada de LATUDA es de 20 mg una vez al día como monoterapia. No se requiere titulación de la dosis inicial. La dosis se puede aumentar después de una semana según la respuesta clínica. Se ha demostrado que LATUDA es eficaz en un rango de dosis de 20 mg por día a 80 mg por día como monoterapia. Al final del estudio clínico, la mayoría de los pacientes (67%) recibieron 20 mg o 40 mg una vez al día [ver Estudios Clínicos (14.2)]. La dosis máxima recomendada es de 80 mg por día.
No se ha establecido la eficacia de LATUDA en el tratamiento de la manía asociada con el trastorno bipolar.
2.3 Información de administración
LATUDA debe tomarse con alimentos (al menos 350 calorías). La administración con alimentos aumenta sustancialmente la absorción de LATUDA. La administración con alimentos aumenta el AUC aproximadamente 2 veces y aumenta la Cmax aproximadamente 3 veces. En los estudios clínicos, LATUDA se administró con alimentos [ver Farmacología Clínica (12.3)].
La eficacia de LATUDA para uso a largo plazo, es decir, durante más de 6 semanas, no se ha establecido en estudios controlados. Por lo tanto, el médico que opte por usar LATUDA durante períodos prolongados debe reevaluar periódicamente la utilidad a largo plazo del medicamento para el paciente individual [ver Dosis y Administración (2.1 y 2.2)].
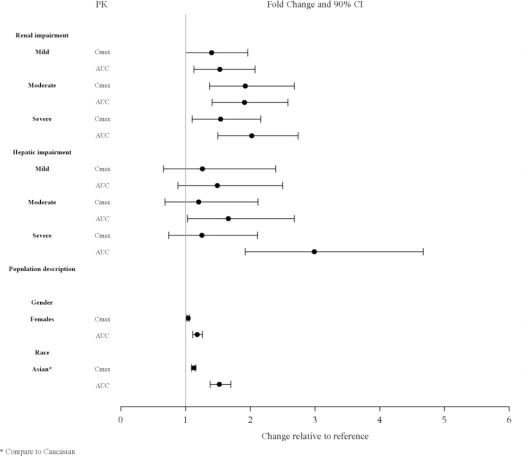
2.4 Modificaciones de la dosis para insuficiencia renal
Se recomienda el ajuste de la dosis en pacientes con insuficiencia renal moderada (aclaramiento de creatinina: 30 a <50 mL/min) y grave (aclaramiento de creatinina <30 mL/min). La dosis inicial recomendada es de 20 mg por día. La dosis en estos pacientes no debe exceder los 80 mg por día [ver Uso en poblaciones específicas (8.6)].
2.5 Modificaciones de la dosis para insuficiencia hepática
Se recomienda el ajuste de la dosis en pacientes con insuficiencia hepática moderada (puntuación de Child-Pugh = 7 a 9) y grave (puntuación de Child-Pugh = 10 a 15). La dosis inicial recomendada es de 20 mg por día. La dosis en pacientes con insuficiencia hepática moderada no debe exceder los 80 mg por día y la dosis en pacientes con insuficiencia hepática grave no debe exceder los 40 mg/día [ver Uso en poblaciones específicas (8.7)].
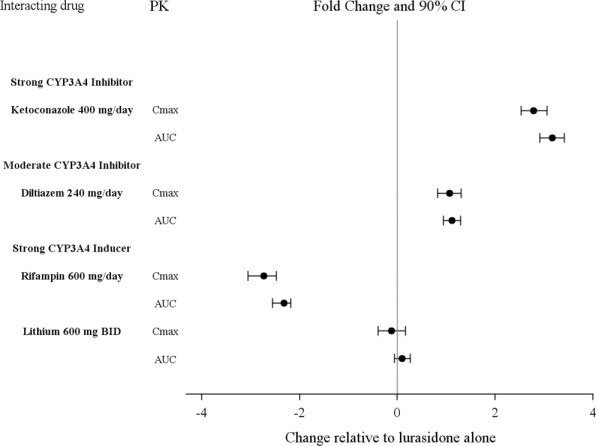
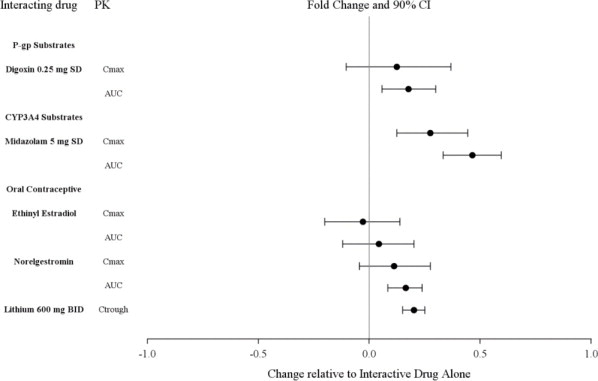
2.6 Modificaciones de la dosis debido a interacciones medicamentosas de inhibidores e inductores del CYP3A4
Uso concomitante con inhibidores del CYP3A4
LATUDA no debe usarse concomitantemente con un inhibidor potente del CYP3A4 (p. ej., ketoconazol, claritromicina, ritonavir, voriconazol, mibefradil, etc.) [ver Contraindicaciones (4)].
Si se prescribe LATUDA y se agrega un inhibidor moderado del CYP3A4 (p. ej., diltiazem, atazanavir, eritromicina, fluconazol, verapamilo, etc.) a la terapia, la dosis de LATUDA debe reducirse a la mitad del nivel de dosis original. De manera similar, si se prescribe un inhibidor moderado del CYP3A4 y se agrega LATUDA a la terapia, la dosis inicial recomendada de LATUDA es de 20 mg por día, y la dosis máxima recomendada de LATUDA es de 80 mg por día [ver Contraindicaciones (4), Interacciones medicamentosas (7.1)].
Se debe evitar el pomelo y el zumo de pomelo en pacientes que toman LATUDA, ya que estos pueden inhibir el CYP3A4 y alterar las concentraciones de LATUDA [ver Interacciones medicamentosas (7.1)].
Uso concomitante con inductores del CYP3A4
LATUDA no debe usarse concomitantemente con un inductor potente del CYP3A4 (p. ej., rifampicina, avasimibe, hierba de San Juan, fenitoína, carbamazepina, etc.) [ver Contraindicaciones (4); Interacciones medicamentosas (7.1)]. Si LATUDA se usa concomitantemente con un inductor moderado del CYP3A4, puede ser necesario aumentar la dosis de LATUDA después del tratamiento crónico (7 días o más) con el inductor del CYP3A4.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Los comprimidos de LATUDA están disponibles en las siguientes formas y colores (Tabla 1) con respectiva impresión en una sola cara.
| Concentración del comprimido | Color/Forma del comprimido | Marcas del comprimido |
|---|---|---|
| 20 mg | blanco a blanquecino redondo | L20 |
| 40 mg | blanco a blanquecino redondo | L40 |
| 60 mg | oblongo blanco a blanquecino | L60 |
| 80 mg | ovalado verde pálido | L80 |
| 120 mg | ovalado blanco a blanquecino | L120 |
4 CONTRAINDICACIONES
- Hipersensibilidad conocida a hidrocloruro de lurasidona o a cualquier componente de la formulación. Se ha observado angioedema con lurasidona [ver Reacciones adversas (6.1)].
- Inhibidores potentes del CYP3A4 (p. ej., ketoconazol, claritromicina, ritonavir, voriconazol, mibefradil, etc.) [ver Interacciones medicamentosas (7.1)].
- Inductores potentes del CYP3A4 (p. ej., rifampicina, avasimibe, hierba de San Juan, fenitoína, carbamazepina, etc.) [ver Interacciones medicamentosas (7.1)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Aumento de la Mortalidad en Pacientes Ancianos con Psicosis Relacionada con la Demencia
Los pacientes ancianos con psicosis relacionada con la demencia tratados con fármacos antipsicóticos presentan un mayor riesgo de muerte. Los análisis de 17 ensayos controlados con placebo (duración modal de 10 semanas), en gran parte en pacientes que tomaban fármacos antipsicóticos atípicos, revelaron un riesgo de muerte en los pacientes tratados con fármacos de entre 1,6 y 1,7 veces el riesgo de muerte en los pacientes tratados con placebo. En el transcurso de un ensayo controlado típico de 10 semanas, la tasa de mortalidad en los pacientes tratados con fármacos fue de aproximadamente el 4,5 %, en comparación con una tasa de aproximadamente el 2,6 % en el grupo placebo. Aunque las causas de muerte fueron variadas, la mayoría de las muertes parecieron ser de naturaleza cardiovascular (p. ej., insuficiencia cardíaca, muerte súbita) o infecciosa (p. ej., neumonía). LATUDA no está aprobado para el tratamiento de pacientes con psicosis relacionada con la demencia [véase Advertencia en recuadro, Advertencias y precauciones (5.3)].
5.2 Pensamientos y Comportamientos Suicidas en Pacientes Pediátricos y Adultos Jóvenes
En análisis agrupados de ensayos controlados con placebo de fármacos antidepresivos (ISRS y otras clases de antidepresivos) que incluyeron aproximadamente 77 000 pacientes adultos y más de 4400 pacientes pediátricos, la incidencia de pensamientos y comportamientos suicidas en pacientes pediátricos y adultos jóvenes fue mayor en los pacientes tratados con antidepresivos que en los pacientes tratados con placebo. Las diferencias entre el fármaco y el placebo en el número de casos de pensamientos y comportamientos suicidas por cada 1000 pacientes tratados se proporcionan en la Tabla 2.
No se produjeron suicidios en ninguno de los estudios pediátricos. Hubo suicidios en los estudios de adultos, pero el número no fue suficiente para llegar a ninguna conclusión sobre el efecto de los fármacos antidepresivos en el suicidio.
| Rango de Edad | Diferencia entre Fármaco y Placebo en el Número de Pacientes con Pensamientos o Comportamientos Suicidas por cada 1000 Pacientes Tratados |
|---|---|
| Aumentos en Comparación con Placebo | |
| <18 | 14 pacientes adicionales |
| 18-24 | 5 pacientes adicionales |
| Disminuciones en Comparación con Placebo | |
| 25-64 | 1 paciente menos |
| ≥65 | 6 pacientes menos |
Se desconoce si el riesgo de pensamientos y comportamientos suicidas en pacientes pediátricos y adultos jóvenes se extiende a un uso a más largo plazo, es decir, más allá de los cuatro meses. Sin embargo, hay evidencia sustancial de estudios de mantenimiento controlados con placebo en adultos con TDM que los antidepresivos retrasan la recurrencia de la depresión.
Monitoree a todos los pacientes tratados con antidepresivos para detectar el empeoramiento clínico y la aparición de pensamientos y comportamientos suicidas, especialmente durante los primeros meses de la terapia farmacológica y en momentos de cambios de dosis. Oriente a los familiares o cuidadores de los pacientes para que controlen los cambios de comportamiento y alerten al proveedor de atención médica. Considere cambiar el régimen terapéutico, incluso posiblemente suspender LATUDA, en pacientes cuya depresión empeora persistentemente o que experimentan pensamientos o comportamientos suicidas emergentes.
5.3 Reacciones adversas cerebrovasculares, incluido el accidente cerebrovascular en pacientes ancianos con psicosis relacionada con la demencia
En ensayos controlados con placebo con risperidona, aripiprazol y olanzapina en sujetos ancianos con demencia, hubo una mayor incidencia de reacciones adversas cerebrovasculares (accidentes cerebrovasculares y ataques isquémicos transitorios), incluidas las muertes, en comparación con los sujetos tratados con placebo. LATUDA no está aprobado para el tratamiento de pacientes con psicosis relacionada con la demencia [ver Advertencia en recuadro, Advertencias y precauciones (5.1)].
5.4 Síndrome neuroléptico maligno
Se ha informado un complejo de síntomas potencialmente mortal, a veces denominado síndrome neuroléptico maligno (SNM), en asociación con la administración de fármacos antipsicóticos, incluido LATUDA. Las manifestaciones clínicas del SNM son hipertermia, rigidez muscular, alteración del estado mental y evidencia de inestabilidad autonómica. Los signos adicionales pueden incluir creatina fosfocinasa elevada, mioglobinuria (rabdomiólisis) e insuficiencia renal aguda.
Si se sospecha SNM, suspenda inmediatamente LATUDA y proporcione tratamiento sintomático intensivo y monitoreo.
5.5 Discinesia tardía
La discinesia tardía es un síndrome que consiste en movimientos discinéticos involuntarios, potencialmente irreversibles, que pueden desarrollarse en pacientes tratados con fármacos antipsicóticos. Aunque la prevalencia del síndrome parece ser más alta entre las personas mayores, especialmente las mujeres mayores, es imposible confiar en las estimaciones de prevalencia para predecir, al inicio del tratamiento antipsicótico, qué pacientes probablemente desarrollarán el síndrome. Se desconoce si los productos farmacológicos antipsicóticos difieren en su potencial para causar discinesia tardía.
Se cree que el riesgo de desarrollar discinesia tardía y la probabilidad de que se vuelva irreversible aumentan a medida que aumentan la duración del tratamiento y la dosis acumulativa total de fármacos antipsicóticos administrados al paciente. Sin embargo, el síndrome puede desarrollarse, aunque con mucha menos frecuencia, después de períodos de tratamiento relativamente breves a dosis bajas o incluso puede surgir después de la interrupción del tratamiento.
El síndrome puede remitir, parcial o completamente, si se retira el tratamiento antipsicótico. Sin embargo, el tratamiento antipsicótico en sí mismo puede suprimir (o suprimir parcialmente) los signos y síntomas del síndrome y, por lo tanto, posiblemente enmascarar el proceso subyacente. Se desconoce el efecto que la supresión sintomática tiene sobre el curso a largo plazo del síndrome.
Dadas estas consideraciones, LATUDA debe prescribirse de la manera más probable para minimizar la aparición de discinesia tardía. El tratamiento antipsicótico crónico generalmente debe reservarse para pacientes que padecen una enfermedad crónica que (1) se sabe que responde a los fármacos antipsicóticos y (2) para quienes no hay tratamientos alternativos, igualmente efectivos pero potencialmente menos dañinos, disponibles o apropiados. En pacientes que requieren tratamiento crónico, se debe buscar la dosis más pequeña y la duración más corta del tratamiento que produzcan una respuesta clínica satisfactoria. La necesidad de tratamiento continuo debe reevaluarse periódicamente.
Si aparecen signos y síntomas de discinesia tardía en un paciente con LATUDA, se debe considerar la interrupción del fármaco. Sin embargo, algunos pacientes pueden requerir tratamiento con LATUDA a pesar de la presencia del síndrome.
5.6 Cambios metabólicos
Los fármacos antipsicóticos atípicos se han asociado con cambios metabólicos que pueden aumentar el riesgo cardiovascular/cerebrovascular. Estos cambios metabólicos incluyen hiperglucemia, dislipidemia y aumento de peso corporal. Si bien se ha demostrado que todos los fármacos de la clase producen algunos cambios metabólicos, cada fármaco tiene su propio perfil de riesgo específico.
Hiperglucemia y diabetes mellitus
Se ha informado hiperglucemia, en algunos casos extrema y asociada con cetoacidosis o coma hiperosmolar o muerte, en pacientes tratados con antipsicóticos atípicos. La evaluación de la relación entre el uso de antipsicóticos atípicos y las anomalías de la glucosa se complica por la posibilidad de un mayor riesgo de fondo de diabetes mellitus en pacientes con esquizofrenia y la creciente incidencia de diabetes mellitus en la población general. Dados estos factores de confusión, la relación entre el uso de antipsicóticos atípicos y los eventos adversos relacionados con la hiperglucemia no se comprende completamente. Sin embargo, los estudios epidemiológicos sugieren un mayor riesgo de eventos adversos relacionados con la hiperglucemia en pacientes tratados con antipsicóticos atípicos.
Los pacientes con un diagnóstico establecido de diabetes mellitus a quienes se les inicia tratamiento con antipsicóticos atípicos deben ser controlados regularmente para detectar un empeoramiento del control de la glucosa. Los pacientes con factores de riesgo de diabetes mellitus (p. ej., obesidad, antecedentes familiares de diabetes) que comienzan el tratamiento con antipsicóticos atípicos deben someterse a una prueba de glucosa en sangre en ayunas al comienzo del tratamiento y periódicamente durante el mismo. Cualquier paciente tratado con antipsicóticos atípicos debe ser controlado para detectar síntomas de hiperglucemia, incluyendo polidipsia, poliuria, polifagia y debilidad. Los pacientes que desarrollen síntomas de hiperglucemia durante el tratamiento con antipsicóticos atípicos deben someterse a una prueba de glucosa en sangre en ayunas. En algunos casos, la hiperglucemia se resolvió cuando se suspendió el antipsicótico atípico; sin embargo, algunos pacientes requirieron la continuación del tratamiento antidiabético a pesar de la suspensión del fármaco sospechoso.
Esquizofrenia
Adultos
Los datos agrupados de estudios de esquizofrenia a corto plazo controlados con placebo se presentan en la Tabla 3.
| LATUDA | ||||||
|---|---|---|---|---|---|---|
| Placebo | 20 mg/día | 40 mg/día | 80 mg/día | 120 mg/día | 160 mg/día | |
| Cambio medio desde el inicio (mg/dL) | ||||||
| n=680 | n=71 | n=478 | n=508 | n=283 | n=113 | |
| Glucosa sérica | -0.0 | -0.6 | +2.6 | -0.4 | +2.5 | +2.5 |
| Proporción de pacientes con cambios a ≥ 126 mg/dL | ||||||
| Glucosa sérica (≥ 126 mg/dL) |
8.3% (52/628) |
11.7% (7/60) |
12.7% ( 57/449) |
6.8% (32/472) |
10.0% (26/260) |
5.6% (6/108) |
En los estudios de esquizofrenia no controlados a largo plazo (principalmente estudios de extensión de etiqueta abierta), LATUDA se asoció con un cambio medio en la glucosa de +1,8 mg/dL en la semana 24 (n=355), +0,8 mg/dL en la semana 36 (n=299) y +2,3 mg/dL en la semana 52 (n=307).
Adolescentes
En estudios de adolescentes y adultos con esquizofrenia, los cambios en la glucosa en ayunas fueron similares. En el estudio a corto plazo, controlado con placebo, en adolescentes, los valores medios de glucosa sérica en ayunas fueron de -1,3 mg/dL para placebo (n=95), +0,1 mg/dL para 40 mg/día (n=90) y +1,8 mg/dL para 80 mg/día (n=92).
Depresión bipolar
Adultos
Monoterapia
Los datos del estudio de monoterapia para la depresión bipolar a corto plazo, de dosis flexible y controlado con placebo en adultos se presentan en la Tabla 4.
| LATUDA | |||
|---|---|---|---|
| Placebo | 20 a 60 mg/día | 80 a 120 mg/día | |
| Cambio medio desde el inicio (mg/dL) | |||
|
Los pacientes fueron aleatorizados a LATUDA con dosis flexible de 20 a 60 mg/día, LATUDA de 80 a 120 mg/día o placebo. |
|||
| n=148 | n=140 | n=143 | |
| Glucosa sérica | +1,8 | -0,8 | +1,8 |
| Proporción de pacientes con cambios a ≥ 126 mg/dL | |||
| Glucosa sérica (≥ 126 mg/dL) |
4,3% (6/141) |
2,2% (3/138) |
6,4% (9/141) |
En el estudio no controlado, abierto y a largo plazo de la depresión bipolar, los pacientes que recibieron LATUDA como monoterapia en el estudio a corto plazo y continuaron en el estudio a largo plazo tuvieron un cambio medio en la glucosa de +1,2 mg/dL en la semana 24 (n=129).
Terapia adjunta con litio o valproato
Los datos de los estudios de terapia adjunta para la depresión bipolar a corto plazo, de dosis flexible y controlados con placebo en adultos se presentan en la Tabla 5.
| LATUDA | ||
|---|---|---|
| Placebo | 20 a 120 mg/día | |
| Cambio medio desde el inicio (mg/dL) | ||
|
Los pacientes fueron aleatorizados a LATUDA con dosis flexible de 20 a 120 mg/día o placebo como terapia adjunta con litio o valproato. |
||
| n=302 | n=319 | |
| Glucosa sérica | -0,9 | +1,2 |
| Proporción de pacientes con cambios a ≥ 126 mg/dL | ||
| Glucosa sérica (≥ 126 mg/dL) |
1,0% (3/290) |
1,3% (4/316) |
En el estudio de depresión bipolar a largo plazo, abierto y sin control, los pacientes que recibieron LATUDA como terapia complementaria con litio o valproato en el estudio a corto plazo y continuaron en el estudio a largo plazo, tuvieron un cambio medio en la glucosa de +1,7 mg/dL en la semana 24 (n=88).
Pacientes pediátricos (10 a 17 años)
En estudios de pacientes pediátricos de 10 a 17 años y adultos con depresión bipolar, los cambios en la glucosa en ayunas fueron similares. En el estudio de 6 semanas, controlado con placebo, de pacientes pediátricos con depresión bipolar, el cambio medio en la glucosa en ayunas fue de +1,6 mg/dL para LATUDA 20 a 80 mg/día (n=145) y -0,5 mg/dL para placebo (n=145).
Pacientes pediátricos (6 a 17 años)
En un estudio abierto de 104 semanas en pacientes pediátricos con esquizofrenia, depresión bipolar o trastorno autista, el 7% de los pacientes con una glucosa en ayunas basal normal experimentaron un cambio a alta al final del tratamiento mientras tomaban lurasidona.
Dislipidemia
Se han observado alteraciones indeseables en los lípidos en pacientes tratados con antipsicóticos atípicos.
Esquizofrenia
Adultos
Los datos agrupados de los estudios de esquizofrenia a corto plazo controlados con placebo se presentan en la Tabla 6.
| LATUDA | ||||||
|---|---|---|---|---|---|---|
| Placebo | 20 mg/día | 40 mg/día | 80 mg/día | 120 mg/día | 160 mg/día | |
| Cambio medio desde la línea base (mg/dL) | ||||||
| n=660 | n=71 | n=466 | n=499 | n=268 | n=115 | |
| Colesterol total | -5,8 | -12,3 | -5,7 | -6,2 | -3,8 | -6,9 |
| Triglicéridos | -13,4 | -29,1 | -5,1 | -13,0 | -3,1 | -10,6 |
| Proporción de pacientes con cambios | ||||||
| Colesterol total (≥ 240 mg/dL) | 5,3% (30/571) |
13,8% (8/58) |
6,2% (25/402) |
5,3% (23/434) |
3,8% (9/238) |
4,0% (4/101) |
| Triglicéridos (≥ 200 mg/dL) |
10,1% (53/526) |
14,3% (7/49) |
10,8% (41/379) |
6,3% (25/400) |
10,5% (22/209) |
7,0% (7/100) |
En los estudios de esquizofrenia no controlados a largo plazo (principalmente estudios de extensión de etiqueta abierta), LATUDA se asoció con un cambio medio en el colesterol total y los triglicéridos de -3,8 (n=356) y -15,1 (n=357) mg/dL en la semana 24, -3,1 (n=303) y -4,8 (n=303) mg/dL en la semana 36 y -2,5 (n=307) y -6,9 (n=307) mg/dL en la semana 52, respectivamente.
Adolescentes
En el estudio a corto plazo, controlado con placebo, en adolescentes, los valores medios del colesterol sérico en ayunas fueron -9,6 mg/dL para placebo (n=95), -4,4 mg/dL para 40 mg/día (n=89) y +1,6 mg/dL para 80 mg/día (n=92), y los valores medios de triglicéridos séricos en ayunas fueron +0,1 mg/dL para placebo (n=95), -0,6 mg/dL para 40 mg/día (n=89) y +8,5 mg/dL para 80 mg/día (n=92).
Depresión Bipolar
Adultos
Monoterapia
Los datos del estudio de depresión bipolar en adultos a corto plazo, con dosis flexible, controlado con placebo y monoterapia se presentan en Tabla 7.
| LATUDA | ||||
|---|---|---|---|---|
| Placebo | 20 a 60 mg/día | 80 a 120 mg/día | ||
| Cambio medio desde el inicio (mg/dL) | ||||
|
Los pacientes fueron aleatorizados a LATUDA con dosis flexible de 20 a 60 mg/día, LATUDA de 80 a 120 mg/día o placebo |
||||
| n=147 | n=140 | n=144 | ||
| Colesterol total | -3,2 | +1,2 | -4,6 | |
| Triglicéridos | +6,0 | +5,6 | +0,4 | |
| Proporción de pacientes con cambios | ||||
| Colesterol total (≥ 240 mg/dL) | 4,2% (5/118) |
4,4% (5/113) |
4,4% (5/114) |
|
| Triglicéridos (≥ 200 mg/dL) |
4,8% (6/126) |
10,1% (12/119) |
9,8% (12/122) |
|
En el estudio de depresión bipolar a largo plazo, abierto y sin control, los pacientes que recibieron LATUDA como monoterapia a corto plazo y continuaron en el estudio a largo plazo tuvieron un cambio medio en el colesterol total y los triglicéridos de -0.5 mg/dL (n=130) y -1.0 mg/dL (n=130) en la semana 24, respectivamente.
Terapia adjunta con litio o valproato
Los datos de los estudios de depresión bipolar de terapia adjunta a corto plazo, dosis flexible, controlados con placebo en adultos se presentan en Tabla 8.
| LATUDA | ||
|---|---|---|
| Placebo | 20 to 120 mg/day | |
| Cambio medio desde el inicio (mg/dL) | ||
|
Los pacientes fueron aleatorizados a LATUDA con dosis flexible de 20 a 120 mg/día o placebo como terapia adjunta con litio o valproato. |
||
| n=303 | n=321 | |
| Colesterol total | -2.9 | -3.1 |
| Triglicéridos | -4.6 | +4.6 |
| Proporción de pacientes con cambios | ||
| Colesterol total (≥ 240 mg/dL) |
5.7% (15/263) |
5.4% (15/276) |
| Triglicéridos (≥ 200 mg/dL) |
8.6% (21/243) |
10.8% (28/260) |
En el estudio de depresión bipolar a largo plazo, abierto y sin control, los pacientes que recibieron LATUDA como terapia complementaria con litio o valproato en el estudio a corto plazo y continuaron en el estudio a largo plazo, tuvieron un cambio medio en el colesterol total y los triglicéridos de
-0.9 (n=88) y +5.3 (n=88) mg/dL en la semana 24, respectivamente.
Pacientes pediátricos (10 a 17 años)
En el estudio de depresión bipolar de 6 semanas, controlado con placebo, con pacientes pediátricos de 10 a 17 años, el cambio medio en el colesterol en ayunas fue de -6.3 mg/dL para LATUDA 20 a 80 mg/día (n=144) y
-1.4 mg/dL para placebo (n=145), y el cambio medio en los triglicéridos en ayunas fue de -7.6 mg/dL para LATUDA 20 a 80 mg/día (n=144) y +5.9 mg/dL para placebo (n=145).
Pacientes pediátricos (6 a 17 años)
En un estudio abierto de 104 semanas de pacientes pediátricos con esquizofrenia, depresión bipolar o trastorno autista, se informaron cambios en el colesterol en ayunas basal de normal a alto al final del estudio en el 12% (colesterol total), 3% (colesterol LDL), y cambios en la línea de base de normal a bajo en el 27% (colesterol HDL) de los pacientes que tomaban lurasidona. De los pacientes con triglicéridos en ayunas basales normales, el 12% experimentó cambios a altos.
Aumento de peso
Se ha observado aumento de peso con el uso de antipsicóticos atípicos. Se recomienda la monitorización clínica del peso.
Esquizofrenia
Adultos
Los datos agrupados de los estudios de esquizofrenia a corto plazo controlados con placebo se presentan en Tabla 9. El aumento de peso medio fue de +0.43 kg para los pacientes tratados con LATUDA en comparación con -0.02 kg para los pacientes tratados con placebo. El cambio de peso desde la línea de base para olanzapina fue de +4.15 kg y para quetiapina de liberación prolongada fue de +2.09 kg en los Estudios 3 y 5 [ver Estudios clínicos (14.1)], respectivamente. La proporción de pacientes con un aumento ≥7% en el peso corporal (al final del estudio) fue del 4.8% para los pacientes tratados con LATUDA y del 3.3% para los pacientes tratados con placebo.
| LATUDA | ||||||
|---|---|---|---|---|---|---|
| Placebo (n=696) |
20 mg/día (n=71) |
40 mg/día (n=484) |
80 mg/día (n=526) |
120 mg/día (n=291) |
160 mg/día (n=114) |
|
| Todos los pacientes | -0.02 | -0.15 | +0.22 | +0.54 | +0.68 | +0.60 |
En los estudios de esquizofrenia a largo plazo no controlados (principalmente estudios de extensión abiertos), LATUDA se asoció con un cambio medio de peso de -0.69 kg en la semana 24 (n=755), -0.59 kg en la semana 36 (n=443) y -0.73 kg en la semana 52 (n=377).
Adolescentes
Los datos del estudio de esquizofrenia en adolescentes a corto plazo controlado con placebo se presentan en Tabla 10. El cambio medio en el aumento de peso fue de +0.5 kg para los pacientes tratados con LATUDA en comparación con +0.2 kg para los pacientes tratados con placebo. La proporción de pacientes con un aumento ≥7% en el peso corporal (al final del estudio) fue del 3.3% para los pacientes tratados con LATUDA y del 4.5% para los pacientes tratados con placebo.
|
Placebo (n=111) |
LATUDA | ||
|---|---|---|---|
| 40 mg/día (n=109) |
80 mg/día (n=104) |
||
| Todos los pacientes | +0.2 | +0.3 | +0.7 |
Depresión Bipolar
Adultos
Monoterapia
Los datos del estudio de monoterapia para la depresión bipolar en adultos, a corto plazo, con dosis flexibles y controlado con placebo, se presentan en la Tabla 11. El cambio medio en el aumento de peso fue de +0,29 kg para los pacientes tratados con LATUDA en comparación con -0,04 kg para los pacientes tratados con placebo. La proporción de pacientes con un aumento de peso ≥7% (al final del estudio) fue del 2,4% para los pacientes tratados con LATUDA y del 0,7% para los pacientes tratados con placebo.
| LATUDA | ||||
|---|---|---|---|---|
| Placebo (n=151) |
20 a 60 mg/día (n=143) |
80 a 120 mg/día (n=147) |
||
|
Los pacientes fueron aleatorizados a LATUDA con dosis flexibles de 20 a 60 mg/día, LATUDA de 80 a 120 mg/día o placebo. |
||||
| Todos los pacientes | -0,04 | +0,56 | +0,02 | |
En el estudio de depresión bipolar a largo plazo, no controlado, abierto, los pacientes que recibieron LATUDA como monoterapia a corto plazo y continuaron en el estudio a largo plazo tuvieron un cambio medio de peso de -0,02 kg en la semana 24 (n=130).
Terapia adjunta con litio o valproato
Los datos de los estudios de terapia adjunta para la depresión bipolar en adultos, a corto plazo, con dosis flexibles y controlados con placebo, se presentan en la Tabla 12. El cambio medio en el aumento de peso fue de +0,11 kg para los pacientes tratados con LATUDA en comparación con +0,16 kg para los pacientes tratados con placebo. La proporción de pacientes con un aumento de peso ≥7% (al final del estudio) fue del 3,1% para los pacientes tratados con LATUDA y del 0,3% para los pacientes tratados con placebo.
| LATUDA | ||
|---|---|---|
| Placebo (n=307) |
20 a 120 mg/día (n=327) |
|
|
Los pacientes fueron aleatorizados a LATUDA con dosis flexibles de 20 a 120 mg/día o placebo como terapia adjunta con litio o valproato. |
||
| Todos los pacientes | +0,16 | +0,11 |
En el estudio de depresión bipolar a largo plazo, no controlado, abierto, los pacientes tratados con LATUDA como terapia adjunta con litio o valproato a corto plazo y que continuaron en el estudio a largo plazo tuvieron un cambio medio de peso de +1,28 kg en la semana 24 (n=86).
Pacientes pediátricos (10 a 17 años)
Los datos del estudio de depresión bipolar de 6 semanas, controlado con placebo, en pacientes de 10 a 17 años se presentan en la Tabla 13. El cambio medio en el aumento de peso fue de +0,7 kg para los pacientes tratados con LATUDA en comparación con +0,5 kg para los pacientes tratados con placebo. La proporción de pacientes con un aumento de peso ≥7% (al final del estudio) fue del 4,0% para los pacientes tratados con LATUDA y del 5,3% para los pacientes tratados con placebo.
| LATUDA | ||
|---|---|---|
| Placebo (n=170) |
20 a 80 mg/día (n=175) |
|
| Todos los pacientes | +0,5 | +0,7 |
Pacientes pediátricos (6 a 17 años)
En un estudio abierto a largo plazo en el que participaron pacientes pediátricos con esquizofrenia, depresión bipolar o trastorno autista de tres ensayos controlados con placebo a corto plazo, el 54% (378/701) recibió lurasidona durante 104 semanas. El aumento medio de peso desde el inicio del estudio abierto hasta la semana 104 fue de 5,85 kg. Para ajustar el crecimiento normal, se derivaron puntuaciones z (medidas en desviaciones estándar [DE]), que se normalizan para el crecimiento natural de niños y adolescentes mediante comparaciones con los estándares de la población ajustados por edad y sexo. Un cambio en la puntuación z <0,5 DE se considera no clínicamente significativo. En este ensayo, el cambio medio en la puntuación z desde el inicio del estudio abierto hasta la semana 104 fue de -0,06 DE para el peso corporal y de -0,13 DE para el índice de masa corporal (IMC), lo que indica una desviación mínima de la curva normal para el aumento de peso.
5.7 Hiperprolactinemia
Al igual que con otros fármacos que antagonizan los receptores D2 de dopamina, LATUDA eleva los niveles de prolactina.
La hiperprolactinemia puede suprimir la GnRH hipotalámica, lo que resulta en una reducción de la secreción de gonadotropina pituitaria. Esto, a su vez, puede inhibir la función reproductiva al deteriorar la esteroidogénesis gonadal tanto en pacientes mujeres como hombres. Se han notificado galactorrea, amenorrea, ginecomastia e impotencia con compuestos que elevan la prolactina. La hiperprolactinemia prolongada, cuando se asocia con hipogonadismo, puede provocar una disminución de la densidad ósea tanto en pacientes mujeres como hombres [véase Reacciones adversas (6)].
Los experimentos de cultivo de tejidos indican que aproximadamente un tercio de los cánceres de mama humanos dependen de la prolactina in vitro, un factor de importancia potencial si se considera la prescripción de estos fármacos en una paciente con cáncer de mama previamente detectado. Como es común con los compuestos que aumentan la liberación de prolactina, se observó un aumento en la neoplasia de la glándula mamaria en un estudio de carcinogenicidad realizado con lurasidona en ratas y ratones [véase Toxicología no clínica (13)]. Los estudios epidemiológicos publicados han mostrado resultados inconsistentes al explorar la posible asociación entre la hiperprolactinemia y el cáncer de mama.
Esquizofrenia
Adultos
En estudios de esquizofrenia a corto plazo controlados con placebo, el cambio mediano desde el inicio hasta el punto final en los niveles de prolactina para los pacientes tratados con LATUDA fue de +0,4 ng/mL y de -1,9 ng/mL en los pacientes tratados con placebo. El cambio mediano desde el inicio hasta el punto final para los hombres fue de +0,5 ng/mL y para las mujeres de -0,2 ng/mL. Los cambios medianos de prolactina por dosis se muestran en la Tabla 14.
| LATUDA | ||||||
|---|---|---|---|---|---|---|
| Placebo | 20 mg/día | 40 mg/día | 80 mg/día | 120 mg/día | 160 mg/día | |
| Todos los pacientes | -1,9 (n=672) |
-1,1 (n=70) |
-1,4 (n=476) |
-0,2 (n=495) |
+3,3 (n=284) |
+3,3 (n=115) |
| Mujeres | -5,1 (n=200) |
-0,7 (n=19) |
-4,0 (n=149) |
-0,2 (n=150) |
+6,7 (n=70) |
+7,1 (n=36) |
| Hombres | -1,3 (n=472) |
-1,2 (n=51) |
-0,7 (n=327) |
-0,2 (n=345) |
+3,1 (n=214) |
+2,4 (n=79) |
La proporción de pacientes con elevaciones de prolactina ≥5 veces el límite superior normal (LSN) fue del 2,8% para los pacientes tratados con LATUDA y del 1,0% para los pacientes tratados con placebo. La proporción de pacientes mujeres con elevaciones de prolactina ≥5 veces el LSN fue del 5,7% para las pacientes tratadas con LATUDA y del 2,0% para las pacientes mujeres tratadas con placebo. La proporción de pacientes varones con elevaciones de prolactina ≥5 veces el LSN fue del 1,6% y del 0,6% para los pacientes varones tratados con placebo.
En los estudios no controlados a largo plazo de esquizofrenia (principalmente estudios de extensión abiertos), LATUDA se asoció con un cambio mediano en la prolactina de -0,9 ng/mL en la semana 24 (n=357),
-5,3 ng/mL en la semana 36 (n=190) y -2,2 ng/mL en la semana 52 (n=307).
Adolescentes
En el estudio de esquizofrenia en adolescentes a corto plazo y controlado con placebo, el cambio mediano desde el inicio hasta el final en los niveles de prolactina para los pacientes tratados con LATUDA fue de +1,1 ng/mL y de +0,1 ng/mL para los pacientes tratados con placebo. Para los pacientes tratados con LATUDA, el cambio mediano desde el inicio hasta el final para los varones fue de +1,0 ng/mL y para las mujeres de +2,6 ng/mL. Los cambios medianos de prolactina por dosis se muestran en Tabla 15.
|
Placebo |
LATUDA 40 mg/día |
LATUDA 80 mg/día |
|
|---|---|---|---|
| Todos los pacientes | +0,10 (n=103) |
+0,75 (n=102) |
+1,20 (n=99) |
| Mujeres | +0,70 (n=39) |
+0,60 (n=42) |
+4,40 (n=33) |
| Varones | 0,00 (n=64) |
+0,75 (n=60) |
+1,00 (n=66) |
La proporción de pacientes con elevaciones de prolactina ≥5 veces el LSN fue del 0,5% para los pacientes tratados con LATUDA y del 1,0% para los pacientes tratados con placebo. La proporción de pacientes mujeres con elevaciones de prolactina ≥5 veces el LSN fue del 1,3% para las pacientes tratadas con LATUDA y del 0% para las pacientes mujeres tratadas con placebo. La proporción de pacientes varones con elevaciones de prolactina ≥5 veces el LSN fue del 0% para los pacientes tratados con LATUDA y del 1,6% para los pacientes varones tratados con placebo.
Depresión bipolar
Adultos
Monoterapia
El cambio mediano desde el inicio hasta el final en los niveles de prolactina, en el estudio de depresión bipolar en adultos a corto plazo, con dosis flexibles y controlado con placebo, fue de +1,7 ng/mL y +3,5 ng/mL con LATUDA 20 a 60 mg/día y 80 a 120 mg/día, respectivamente, en comparación con +0,3 ng/mL con los pacientes tratados con placebo. El cambio mediano desde el inicio hasta el final para los varones fue de +1,5 ng/mL y para las mujeres de +3,1 ng/mL. Los cambios medianos de prolactina por rango de dosis se muestran en Tabla 16.
| LATUDA | ||||
|---|---|---|---|---|
| Placebo | 20 a 60 mg/día | 80 a 120 mg/día | ||
|
Los pacientes fueron aleatorizados a LATUDA con dosis flexibles de 20 a 60 mg/día, LATUDA de 80 a 120 mg/día o placebo |
||||
| Todos los pacientes | +0,3 (n=147) |
+1,7 (n=140) |
+3,5 (n=144) |
|
| Mujeres | 0,0 (n=82) |
+1,8 (n=78) |
+5,3 (n=88) |
|
| Varones | +0,4 (n=65) |
+1,2 (n=62) |
+1,9 (n=56) |
|
La proporción de pacientes con elevaciones de prolactina ≥5 veces el límite superior normal (LSN) fue del 0,4% para los pacientes tratados con LATUDA y del 0,0% para los pacientes tratados con placebo. La proporción de pacientes mujeres con elevaciones de prolactina ≥5 veces el LSN fue del 0,6% para las pacientes tratadas con LATUDA y del 0% para las pacientes tratadas con placebo. La proporción de pacientes varones con elevaciones de prolactina ≥5 veces el LSN fue del 0% y del 0% para los pacientes varones tratados con placebo.
En el estudio de depresión bipolar a largo plazo, no controlado, abierto, los pacientes que fueron tratados con LATUDA como monoterapia a corto plazo y continuaron en el estudio a largo plazo, tuvieron un cambio mediano en la prolactina de -1,15 ng/mL en la semana 24 (n=130).
Terapia adjunta con litio o valproato
El cambio mediano desde el inicio hasta el final en los niveles de prolactina, en los estudios de terapia adjunta para la depresión bipolar a corto plazo, de dosis flexible y controlados con placebo en adultos, fue de +2,8 ng/mL con LATUDA 20 a 120 mg/día en comparación con 0,0 ng/mL con pacientes tratados con placebo. El cambio mediano desde el inicio hasta el final para los varones fue de +2,4 ng/mL y para las mujeres de +3,2 ng/mL. Los cambios medianos de prolactina en todo el rango de dosis se muestran en Tabla 17.
| LATUDA | ||
|---|---|---|
| Placebo | 20 a 120 mg/día | |
|
Los pacientes fueron aleatorizados a LATUDA con dosis flexible de 20 a 120 mg/día o placebo como terapia adjunta con litio o valproato. |
||
| Todos los pacientes | 0,0 (n=301) |
+2,8 (n=321) |
| Mujeres | +0,4 (n=156) |
+3,2 (n=162) |
| Varones | -0,1 (n=145) |
+2,4 (n=159) |
La proporción de pacientes con elevaciones de prolactina ≥5 veces el límite superior normal (LSN) fue del 0,0% para los pacientes tratados con LATUDA y del 0,0% para los pacientes tratados con placebo. La proporción de pacientes mujeres con elevaciones de prolactina ≥5 veces el LSN fue del 0% para las pacientes tratadas con LATUDA y del 0% para las pacientes tratadas con placebo. La proporción de pacientes varones con elevaciones de prolactina ≥5 veces el LSN fue del 0% y del 0% para los pacientes varones tratados con placebo.
En el estudio de depresión bipolar a largo plazo, no controlado, abierto, los pacientes que fueron tratados con LATUDA, como terapia adjunta con litio o valproato, a corto plazo y continuaron en el estudio a largo plazo, tuvieron un cambio mediano en la prolactina de -2,9 ng/mL en la semana 24 (n=88).
Pacientes pediátricos (10 a 17 años)
En el estudio de depresión bipolar de 6 semanas, controlado con placebo, con pacientes pediátricos de 10 a 17 años, el cambio mediano desde el inicio hasta el final en los niveles de prolactina para los pacientes tratados con LATUDA fue de +1,10 ng/mL y de +0,50 ng/mL para los pacientes tratados con placebo. Para los pacientes tratados con LATUDA, el cambio mediano desde el inicio hasta el final para los varones fue de +0,85 ng/mL y para las mujeres de +2,50 ng/mL. Los cambios medianos de prolactina se muestran en Tabla 18.
| LATUDA | ||
|---|---|---|
| Placebo | 20 a 80 mg/día | |
| Todos los pacientes | +0,50 (n=157) |
+1,10 (n=165) |
| Mujeres | +0,55 (n=78) |
+2,50 (n=83) |
| Varones | +0,50 (n=79) |
+0,85 (n=82) |
La proporción de pacientes con elevaciones de prolactina ≥5x ULN fue del 0% para los pacientes tratados con LATUDA y del 0,6% para los pacientes tratados con placebo. La proporción de pacientes mujeres con elevaciones de prolactina ≥5x ULN fue del 0% para las pacientes tratadas con LATUDA y del 1,3% para las pacientes mujeres tratadas con placebo. Ningún paciente varón en los grupos de tratamiento con placebo o LATUDA presentó elevaciones de prolactina ≥5x ULN.
Pacientes pediátricos (6 a 17 años)
En un estudio abierto de 104 semanas de pacientes pediátricos con esquizofrenia, depresión bipolar o trastorno autista, los cambios medianos desde el inicio hasta el final en los niveles de prolactina sérica fueron de -0,20 ng/mL (todos los pacientes), -0,30 ng/mL (mujeres) y -0,05 ng/mL (varones). Las proporciones de pacientes con un nivel de prolactina marcadamente alto (≥5 veces el límite superior de la normalidad) en cualquier momento durante el tratamiento abierto fueron del 2% (todos los pacientes), del 3% (mujeres) y del 1% (varones).
Los eventos adversos entre las mujeres en este ensayo que son potencialmente relacionados con la prolactina incluyen galactorrea (0,6%). Entre los pacientes varones en este estudio, se informó disminución de la libido en un paciente (0,2%) y no hubo informes de impotencia, ginecomastia o galactorrea.
5.8 Leucopenia, neutropenia y agranulocitosis
Se ha notificado leucopenia/neutropenia durante el tratamiento con agentes antipsicóticos. Se ha notificado agranulocitosis (incluidos casos mortales) con otros agentes de la clase.
Los posibles factores de riesgo de leucopenia/neutropenia incluyen un recuento bajo preexistente de leucocitos (WBC) y antecedentes de leucopenia/neutropenia inducida por fármacos. Los pacientes con un recuento bajo preexistente de leucocitos o antecedentes de leucopenia/neutropenia inducida por fármacos deben controlar su hemograma completo (CBC) con frecuencia durante los primeros meses de terapia y se debe interrumpir LATUDA a la primera señal de disminución de los leucocitos, en ausencia de otros factores causales.
Los pacientes con neutropenia deben ser cuidadosamente monitoreados para detectar fiebre u otros síntomas o signos de infección y tratados rápidamente si ocurren dichos síntomas o signos. Los pacientes con neutropenia grave (recuento absoluto de neutrófilos < 1000/mm3) deben interrumpir LATUDA y controlar sus leucocitos hasta la recuperación.
5.9 Hipotensión ortostática y síncope
LATUDA puede causar hipotensión ortostática y síncope, quizás debido a su antagonismo del receptor α1-adrenérgico. Las reacciones adversas asociadas pueden incluir mareos, aturdimiento, taquicardia y bradicardia. En general, estos riesgos son mayores al comienzo del tratamiento y durante el aumento de la dosis. Los pacientes con mayor riesgo de estas reacciones adversas o con mayor riesgo de desarrollar complicaciones por hipotensión incluyen aquellos con deshidratación, hipovolemia, tratamiento con medicamentos antihipertensivos, antecedentes de enfermedad cardiovascular (p. ej., insuficiencia cardíaca, infarto de miocardio, isquemia o anomalías de conducción), antecedentes de enfermedad cerebrovascular, así como pacientes que no han recibido tratamiento con antipsicóticos. En tales pacientes, considere usar una dosis inicial más baja y una titulación más lenta, y controle los signos vitales ortostáticos.
La hipotensión ortostática, evaluada mediante la medición de los signos vitales, se definió mediante los siguientes cambios en los signos vitales: disminución de ≥ 20 mm Hg en la presión arterial sistólica y aumento de ≥10 lpm en el pulso de la posición sentada a la de pie o de la posición supina a la de pie.
Esquizofrenia
Adultos
La incidencia de hipotensión ortostática y síncope notificada como eventos adversos en estudios de esquizofrenia a corto plazo controlados con placebo fue (incidencia de LATUDA, incidencia de placebo): hipotensión ortostática [0,3% (5/1508), 0,1% (1/708)] y síncope [0,1% (2/1508), 0% (0/708)].
En estudios clínicos de esquizofrenia a corto plazo, la hipotensión ortostática, evaluada mediante signos vitales, se produjo con una frecuencia del 0,8% con LATUDA 40 mg, del 2,1% con LATUDA 80 mg, del 1,7% con LATUDA 120 mg y del 0,8% con LATUDA 160 mg en comparación con el 0,7% con placebo.
Adolescentes
La incidencia de hipotensión ortostática notificada como eventos adversos en el estudio de esquizofrenia en adolescentes a corto plazo controlado con placebo fue del 0,5% (1/214) en los pacientes tratados con LATUDA y del 0% (0/112) en los pacientes tratados con placebo. No se notificó ningún evento de síncope.
La hipotensión ortostática, evaluada mediante signos vitales, se produjo con una frecuencia del 0% con LATUDA 40 mg y del 2,9% con LATUDA 80 mg, en comparación con el 1,8% con placebo.
Depresión bipolar
Monoterapia
En el estudio de depresión bipolar de monoterapia a corto plazo, de dosis flexible y controlado con placebo en adultos, no hubo eventos adversos notificados de hipotensión ortostática y síncope.
La hipotensión ortostática, evaluada mediante signos vitales, se produjo con una frecuencia del 0,6% con LATUDA 20 a 60 mg y del 0,6% con LATUDA 80 a 120 mg en comparación con el 0% con placebo.
Terapia adjunta con litio o valproato
En los estudios de terapia de depresión bipolar de terapia adjunta a corto plazo, de dosis flexible y controlada con placebo en adultos, no hubo eventos adversos notificados de hipotensión ortostática y síncope. La hipotensión ortostática, evaluada mediante signos vitales, se produjo con una frecuencia del 1,1% con LATUDA 20 a 120 mg en comparación con el 0,9% con placebo.
Pacientes pediátricos (10 a 17 años)
En el estudio de 6 semanas, controlado con placebo, de depresión bipolar en pacientes pediátricos de 10 a 17 años, no se reportaron eventos adversos de hipotensión ortostática o síncope.
La hipotensión ortostática, evaluada mediante signos vitales, se produjo con una frecuencia del 1,1% con LATUDA de 20 a 80 mg/día, en comparación con el 0,6% con placebo.
5.10 Caídas
LATUDA puede causar somnolencia, hipotensión postural, inestabilidad motora y sensorial, lo que puede llevar a caídas y, en consecuencia, fracturas u otras lesiones. Para pacientes con enfermedades, afecciones o medicamentos que puedan exacerbar estos efectos, realice evaluaciones completas del riesgo de caídas al iniciar el tratamiento antipsicótico y de forma recurrente para pacientes en tratamiento antipsicótico a largo plazo.
5.11 Convulsiones
Al igual que con otros fármacos antipsicóticos, LATUDA debe usarse con precaución en pacientes con antecedentes de convulsiones o con afecciones que disminuyan el umbral convulsivo, por ejemplo, la demencia de Alzheimer. Las condiciones que disminuyen el umbral convulsivo pueden ser más prevalentes en pacientes de 65 años o más.
Esquizofrenia
En estudios de corto plazo, controlados con placebo, de esquizofrenia en adultos, se produjeron convulsiones en el 0,1% (2/1508) de los pacientes tratados con LATUDA en comparación con el 0,1% (1/708) de los pacientes tratados con placebo.
5.12 Potencial de deterioro cognitivo y motor
LATUDA, al igual que otros antipsicóticos, tiene el potencial de afectar el juicio, el pensamiento o las habilidades motoras. Advierta a los pacientes sobre el manejo de maquinaria peligrosa, incluidos vehículos de motor, hasta que estén razonablemente seguros de que el tratamiento con LATUDA no les afecta de manera adversa.
En estudios clínicos con LATUDA, la somnolencia incluyó: hipersomnia, hipersomnolencia, sedación y somnolencia.
Esquizofrenia
Adultos
En estudios de corto plazo, controlados con placebo, de esquizofrenia en adultos, la somnolencia fue reportada por el 17,0% (256/1508) de los pacientes tratados con LATUDA (15,5% LATUDA 20 mg, 15,6% LATUDA 40 mg, 15,2% LATUDA 80 mg, 26,5% LATUDA 120 mg y 8,3% LATUDA 160 mg/día) en comparación con el 7,1% (50/708) de los pacientes tratados con placebo.
Adolescentes
En el estudio de corto plazo, controlado con placebo, de esquizofrenia en adolescentes, la somnolencia fue reportada por el 14,5% (31/214) de los pacientes tratados con LATUDA (15,5% LATUDA 40 mg y 13,5% LATUDA 80 mg/día) en comparación con el 7,1% (8/112) de los pacientes tratados con placebo.
Depresión bipolar
Adultos
Monoterapia
En el estudio de corto plazo, de dosis flexible, controlado con placebo, de monoterapia de depresión bipolar en adultos, la somnolencia fue reportada por el 7,3% (12/164) y el 13,8% (23/167) con LATUDA de 20 a 60 mg y de 80 a 120 mg, respectivamente, en comparación con el 6,5% (11/168) de los pacientes tratados con placebo.
Terapia adyuvante con litio o valproato
En los estudios de corto plazo, de dosis flexible, controlados con placebo, de terapia adyuvante de depresión bipolar en adultos, la somnolencia fue reportada por el 11,4% (41/360) de los pacientes tratados con LATUDA de 20 – 120 mg en comparación con el 5,1% (17/334) de los pacientes tratados con placebo.
Pacientes pediátricos (de 10 a 17 años)
En el estudio de 6 semanas, controlado con placebo, de depresión bipolar en pacientes pediátricos de 10 a 17 años, la somnolencia fue reportada por el 11,4% (20/175) de los pacientes tratados con LATUDA de 20 a 80 mg/día en comparación con el 5,8% (10/172) de los pacientes tratados con placebo.
5.13 Desregulación de la temperatura corporal
La interrupción de la capacidad del cuerpo para reducir la temperatura corporal central se ha atribuido a los agentes antipsicóticos. Se recomienda una atención adecuada al prescribir LATUDA a pacientes que estarán expuestos a condiciones que pueden contribuir a un aumento de la temperatura corporal central, por ejemplo, hacer ejercicio vigoroso, exponerse a un calor extremo, recibir medicamentos concomitantes con actividad anticolinérgica o estar sujetos a deshidratación.
En los estudios de monoterapia y terapia adjunta (con litio o valproato) en depresión bipolar en adultos, menos del 1% de los sujetos en los grupos de LATUDA y placebo desarrollaron episodios maníacos o hipomaníacos.