Fabricante de medicamentos: AstraZeneca Pharmaceuticals LP (Updated: 2024-09-25)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
TAGRISSO® (osimertinib) tabletas, para uso oral
Aprobación inicial en EE. UU.: 2015
CAMBIOS MAYORES RECIENTES
Indicaciones y uso (1.2) 09/2024
Indicaciones y uso (1.4) 02/2024
Dosis y administración, Selección del paciente (2.2) 09/2024
Dosis y administración, Dosis recomendada
y administración (2.3) 09/2024
Dosis y administración, Modificaciones de la dosis (2.5) 09/2024
Advertencias y precauciones, Enfermedad pulmonar intersticial
Neumonitis (5.1) 09/2024
Advertencias y precauciones, Prolongación del intervalo QTc (5.2) 09/2024
Advertencias y precauciones, Cardiomiopatía (5.3) 09/2024
Advertencias y precauciones, Queratitis (5.4) 09/2024
Advertencias y precauciones, Anemia aplásica (5.7) 02/2024
INDICACIONES Y USO
TAGRISSO es un inhibidor de la cinasa indicado para:
- •
- terapia adyuvante después de la resección tumoral en pacientes adultos con cáncer de pulmón de células no pequeñas (CPNP) cuyos tumores tienen deleciones del exón 19 del receptor del factor de crecimiento epidérmico (EGFR) o mutaciones L858R del exón 21, detectadas mediante una prueba aprobada por la FDA. (1.1, 2.2)
- •
- el tratamiento de pacientes adultos con CPNP localmente avanzado, irresecable (estadio III) cuya enfermedad no ha progresado durante o después de la quimiorradiación basada en platino concurrente o secuencial y cuyos tumores tienen deleciones del exón 19 del EGFR o mutaciones L858R del exón 21, detectadas mediante una prueba aprobada por la FDA. (1.2, 2.2)
- •
- el tratamiento de primera línea de pacientes adultos con CPNP metastásico cuyos tumores tienen deleciones del exón 19 del EGFR o mutaciones L858R del exón 21, detectadas mediante una prueba aprobada por la FDA. (1.3, 2.2)
- •
- en combinación con pemetrexed y quimioterapia basada en platino, el tratamiento de primera línea de pacientes adultos con CPNP localmente avanzado o metastásico cuyos tumores tienen deleciones del exón 19 del EGFR o mutaciones L858R del exón 21, detectadas mediante una prueba aprobada por la FDA. (1.4, 2.2)
- •
- el tratamiento de pacientes adultos con CPNP metastásico positivo para la mutación EGFR T790M, detectada mediante una prueba aprobada por la FDA, cuya enfermedad ha progresado durante o después de la terapia con TKI de EGFR. (1.5, 2.2)
DOSIS Y ADMINISTRACIÓN
Tratamiento adyuvante del CPNP en estadio temprano: 80 mg por vía oral una vez al día, con o sin alimentos, hasta la recurrencia de la enfermedad, o toxicidad inaceptable, o durante un máximo de 3 años. (2.3)
CPNP localmente avanzado, irresecable (estadio III): Después de la terapia con quimiorradiación basada en platino, 80 mg por vía oral una vez al día, con o sin alimentos, hasta la progresión de la enfermedad o la toxicidad inaceptable. (2.3)
CPNP metastásico: 80 mg por vía oral una vez al día, con o sin alimentos, hasta la progresión de la enfermedad o la toxicidad inaceptable. (2.3)
CPNP localmente avanzado o metastásico: 80 mg por vía oral una vez al día administrados en combinación con pemetrexed y quimioterapia basada en platino, con o sin alimentos, hasta la progresión de la enfermedad o la toxicidad inaceptable debido a TAGRISSO. (2.3)
FORMAS DE DOSIFICACIÓN Y FUERZAS
Tabletas: 80 mg y 40 mg. (3)
CONTRAINDICACIONES
Ninguna. (4)
REACCIONES ADVERSAS
Las reacciones adversas más comunes (>20%), incluidas las anomalías de laboratorio, fueron:
- •
- TAGRISSO en monoterapia: leucopenia, linfopenia, trombocitopenia, anemia, diarrea, erupción cutánea, dolor musculoesquelético, neutropenia, toxicidad ungueal, piel seca, estomatitis y fatiga. (6.1)
- •
- TAGRISSO en monoterapia después de la quimiorradiación a base de platino: linfopenia, leucopenia, EILD/neumonitis, trombocitopenia, neutropenia, erupción cutánea, diarrea, toxicidad ungueal, dolor musculoesquelético, tos y COVID-19. (6.1)
- •
- TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino: leucopenia, trombocitopenia, neutropenia, linfopenia, erupción cutánea, diarrea, estomatitis, toxicidad ungueal, piel seca y aumento de la creatinina en sangre. (6.1)
Para informar sobre REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con AstraZeneca al 1-800-236-9933 o www.TAGRISSO.com o la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES MEDICAMENTOSAS
USO EN POBLACIONES ESPECÍFICAS
Lactancia: No amamante. (8.2)
Ver 17 para INFORMACIÓN PARA EL PACIENTE y etiquetado del paciente aprobado por la FDA.
Revisado: 9/2024
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
1.1 Tratamiento Adyuvante del Cáncer de Pulmón de Células No Pequeñas (CPNP) Positivo a la Mutación EGFR
1.2 CPNP Positivo a la Mutación EGFR Localmente Avanzado, Irresecable (Estadio III)
1.3 Tratamiento de Primera Línea del CPNP Metastásico Positivo a la Mutación EGFR
1.4 Tratamiento de Primera Línea del CPNP Localmente Avanzado o Metastásico Positivo a la Mutación EGFR
1.5 CPNP Metastásico Positivo a la Mutación T790M EGFR Previamente Tratado
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Evaluación y Pruebas Recomendadas Antes de Iniciar TAGRISSO
2.2 Selección del Paciente
2.3 Dosis y Administración Recomendadas
2.4 Administración a Pacientes que Tienen Dificultad para Deglutir Sólidos
2.5 Modificaciones de la Dosis para Reacciones Adversas
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5.1 Enfermedad Pulmonar Intersticial/Neumonitis
5.2 Prolongación del Intervalo QTc
5.3 Cardiomiopatía
5.4 Queratitis
5.5 Eritema Multiforme Mayor, Síndrome de Stevens-Johnson y Necrólisis Epidérmica Tóxica
5.6 Vasculitis Cutánea
5.7 Anemia aplásica
5.8 Toxicidad Embriofetal
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Postcomercialización
7 INTERACCIONES MEDICAMENTOSAS
7.1 Efecto de Otros Medicamentos en Osimertinib
7.2 Efecto de Osimertinib en Otros Medicamentos
7.3 Medicamentos que Prolongan el Intervalo QTc
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.3 Mujeres y Hombres en Edad Reproductiva
8.4 Uso Pediátrico
8.5 Uso Geriátrico
8.6 Insuficiencia Renal
8.7 Insuficiencia Hepática
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
13.2 Toxicología y/o Farmacología Animal
14 ESTUDIOS CLÍNICOS
14.1 Tratamiento Adyuvante del Cáncer de Pulmón de Células No Pequeñas (CPNP) Positivo a la Mutación EGFR en Estadio Temprano
14.2 CPNP Positivo a la Mutación EGFR Localmente Avanzado, Irresecable (Estadio III)
14.3 CPNP Metastásico Positivo a la Mutación EGFR No Previamente Tratado
14.4 CPNP Localmente Avanzado o Metastásico Positivo a la Mutación EGFR No Previamente Tratado
14.5 CPNP Metastásico Positivo a la Mutación T790M EGFR Previamente Tratado
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
1 INDICACIONES Y USO
1.1 Tratamiento Adyuvante del Cáncer de Pulmón de Células No Pequeñas (CPNP) Positivo a la Mutación del EGFR
TAGRISSO está indicado como terapia adyuvante después de la resección tumoral en pacientes adultos con cáncer de pulmón de células no pequeñas (CPNP) cuyos tumores tienen deleciones del exón 19 del receptor del factor de crecimiento epidérmico (EGFR) o mutaciones L858R del exón 21, detectadas mediante una prueba aprobada por la FDA [ver Dosificación y Administración (2.2)].
1.2 CPNP Positivo a la Mutación del EGFR Localmente Avanzado, Irresecable (Estadio III)
TAGRISSO está indicado para el tratamiento de pacientes adultos con CPNP localmente avanzado, irresecable (estadio III) cuya enfermedad no ha progresado durante o después de la quimiorradiación basada en platino concurrente o secuencial y cuyos tumores tienen deleciones del exón 19 del EGFR o mutaciones L858R del exón 21, detectadas mediante una prueba aprobada por la FDA [ver Dosificación y Administración (2.2)].
1.3 Tratamiento de Primera Línea del CPNP Metastásico Positivo a la Mutación del EGFR
TAGRISSO está indicado para el tratamiento de primera línea de pacientes adultos con CPNP metastásico cuyos tumores tienen deleciones del exón 19 del EGFR o mutaciones L858R del exón 21, detectadas mediante una prueba aprobada por la FDA [ver Dosificación y Administración (2.2)].
1.4 Tratamiento de Primera Línea del CPNP Localmente Avanzado o Metastásico Positivo a la Mutación del EGFR
TAGRISSO en combinación con pemetrexed y quimioterapia basada en platino está indicado para el tratamiento de primera línea de pacientes adultos con CPNP localmente avanzado o metastásico cuyos tumores tienen deleciones del exón 19 del EGFR o mutaciones L858R del exón 21, detectadas mediante una prueba aprobada por la FDA [ver Dosificación y Administración (2.2)].
1.5 CPNP Metastásico Positivo a la Mutación del EGFR T790M Previamente Tratado
TAGRISSO está indicado para el tratamiento de pacientes adultos con CPNP metastásico positivo a la mutación del EGFR T790M, detectado mediante una prueba aprobada por la FDA, cuya enfermedad ha progresado durante o después de la terapia con inhibidor de la tirosina quinasa (TKI) del EGFR [ver Dosificación y Administración (2.2)].
2 DOSIS Y ADMINISTRACIÓN
2.1 Evaluación y Pruebas Recomendadas Antes de Iniciar TAGRISSO
TAGRISSO Monoterapia
- •
- Antes de iniciar la monoterapia con TAGRISSO en pacientes con factores de riesgo cardíaco, realice un monitoreo cardíaco, incluida la evaluación de la fracción de eyección del ventrículo izquierdo (FEVI) [ver Advertencias y Precauciones (5.3)].
- •
- Antes de iniciar TAGRISSO, realice un hemograma completo con diferencial [ver Advertencias y Precauciones (5.7)].
TAGRISSO en Combinación con Pemetrexed y Quimioterapia a Base de Platino
- •
- Antes de iniciar TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino, realice un monitoreo cardíaco en todos los pacientes, incluida la evaluación de la fracción de eyección del ventrículo izquierdo (FEVI) [ver Advertencias y Precauciones (5.3)].
- •
- Antes de iniciar TAGRISSO, realice un hemograma completo con diferencial [ver Advertencias y Precauciones (5.7)].
2.2 Selección del Paciente
La Tabla 1 a continuación presenta los criterios de selección de pacientes para el tratamiento con TAGRISSO.
|
Seleccione pacientes para el tratamiento con TAGRISSO en función de la presencia de una mutación detectada mediante una prueba aprobada por la FDA. |
|||
|
Indicación |
Régimen de Tratamiento |
Mutación Requerida |
Fuente para Pruebas |
|
Tratamiento Adyuvante de NSCLC EGFR Positivo a Mutación [ver Indicaciones y Uso (1.1)] |
TAGRISSO monoterapia |
Deleciones del exón 19 de EGFR o mutaciones L858R del exón 21 |
Tumor |
|
NSCLC EGFR Positivo a Mutación Localmente Avanzado, Irresecable (Estadio III) [ver Indicaciones y Uso (1.2)] |
Después de completar la terapia de quimiorradiación a base de platino, TAGRISSO monoterapia |
Deleciones del exón 19 de EGFR o mutaciones L858R del exón 21 |
Tumor |
|
Tratamiento de Primera Línea de NSCLC Metastásico EGFR Positivo a Mutación [ver Indicaciones y Uso (1.3)] |
TAGRISSO monoterapia |
Deleciones del exón 19 de EGFR o mutaciones L858R del exón 21 |
Plasma o tumor |
|
Tratamiento de Primera Línea de NSCLC Localmente Avanzado o Metastásico EGFR Positivo a Mutación [ver Indicaciones y Uso (1.4)] |
TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino |
Deleciones del exón 19 de EGFR o mutaciones L858R del exón 21 |
Plasma o tumor |
|
NSCLC Metastásico EGFR T790M Positivo a Mutación Previamente Tratado [ver Indicaciones y Uso (1.5)] |
TAGRISSO monoterapia |
Mutación EGFR T790M |
Plasma o tumor |
|
La información sobre las pruebas aprobadas por la FDA para la detección de mutaciones EGFR está disponible en http://www.fda.gov/companiondiagnostics. |
|||
2.3 Dosis y Administración Recomendadas
Dosis Recomendada
La Tabla 2 proporciona la dosis recomendada de TAGRISSO por indicación.
|
Indicación |
Dosis Recomendada de TAGRISSO |
Duración del Tratamiento |
|
Tratamiento Adyuvante de CPNM EGFR Positivo a Mutación |
Comprimidos de 80 mg por vía oral una vez al día con o sin alimentos |
Por un total de 3 años o hasta la recurrencia de la enfermedad o toxicidad inaceptable |
|
CPNM EGFR Positivo a Mutación Localmente Avanzado, Irresecable (Estadio III) |
Después de la quimiorradioterapia a base de platino, comprimidos de 80 mg por vía oral una vez al día con o sin alimentos |
Hasta la progresión de la enfermedad o toxicidad inaceptable |
|
Tratamiento de Primera Línea de CPNM EGFR Positivo a Mutación Metastásico |
Comprimidos de 80 mg por vía oral una vez al día con o sin alimentos |
Hasta la progresión de la enfermedad o toxicidad inaceptable |
|
Tratamiento de Primera Línea de CPNM EGFR Positivo a Mutación Localmente Avanzado o Metastásico |
Comprimidos de 80 mg por vía oral una vez al día con o sin alimentos en combinación con pemetrexed y quimioterapia a base de platino Consulte la Información de Prescripción para pemetrexed y cisplatino o carboplatino para la información de dosificación respectiva. |
Hasta la progresión de la enfermedad o toxicidad inaceptable debido a TAGRISSO |
|
CPNM Metastásico EGFR T790M Positivo a Mutación Previamente Tratado |
Comprimidos de 80 mg por vía oral una vez al día con o sin alimentos |
Hasta la progresión de la enfermedad o toxicidad inaceptable |
2. DOSIFICACIÓN Y ADMINISTRACIÓN
Administración
Administrar TAGRISSO 80 mg tableta por vía oral una vez al día con o sin alimentos. Las tabletas pueden dispersarse en agua para pacientes que tienen dificultad para tragar, o para la administración por sonda nasogástrica [ver Dosificación y administración (2.4)].
Dosis olvidada
Si se olvida una dosis de TAGRISSO, no tome la dosis olvidada y tome la siguiente dosis como estaba programado.
2.4 Administración a pacientes que tienen dificultad para tragar sólidos
Dispersar la tableta en 60 mL (2 onzas) de agua no carbonatada únicamente. Agitar hasta que la tableta se disperse en pequeños trozos (la tableta no se disolverá completamente) y tragar inmediatamente. No triturar, calentar o someter a ultrasonidos durante la preparación. Enjuague el recipiente con 120 mL a 240 mL (4 a 8 onzas) de agua y beba inmediatamente.
Si se requiere la administración por sonda nasogástrica, dispersar la tableta como se indicó anteriormente en 15 mL de agua no carbonatada y luego usar 15 mL adicionales de agua para transferir cualquier residuo a la jeringa. Los 30 mL de líquido resultantes deben administrarse de acuerdo con las instrucciones de la sonda nasogástrica con los enjuagues de agua apropiados (aproximadamente 30 mL). Repita este paso hasta que no queden trozos en la jeringa. Esto ayudará a garantizar que se administre la dosis completa prescrita de TAGRISSO. La dispersión y los residuos deben administrarse dentro de los 30 minutos posteriores a la adición de las tabletas al agua.
2.5 Modificaciones de la dosis para reacciones adversas
Las reducciones de dosis recomendadas para las reacciones adversas se proporcionan en la Tabla 3.
| Órgano diana | Reacción adversa* | Modificación de la dosis |
|---|---|---|
|
Pulmonar (Pacientes que no han recibido quimiorradiación basada en platino definitiva reciente) [ver Advertencias y precauciones (5.1)] |
Cualquier grado Enfermedad pulmonar intersticial (EPI)/Neumonitis |
Suspender permanentemente TAGRISSO. |
|
Pulmonar (Pacientes que han recibido quimiorradiación basada en platino definitiva reciente) [ver Advertencias y precauciones (5.1)] |
Grado 1 EPI/Neumonitis |
Retener o continuar TAGRISSO, según esté clínicamente indicado. |
|
Grado ≥2 EPI/Neumonitis |
Suspender permanentemente TAGRISSO. |
|
|
Cardíaco [ver Advertencias y precauciones (5.2, 5.3)] |
Intervalo QTc† mayor que 500 msec en al menos 2 ECG‡ separados |
Retener TAGRISSO hasta que el intervalo QTc sea menor que 481 msec o se recupere a la línea de base si la línea de base QTc es mayor o igual que 481 msec, luego reanudar a una dosis de 40 mg. |
|
Prolongación del intervalo QTc con signos/síntomas de arritmia potencialmente mortal |
Suspender permanentemente TAGRISSO. |
|
|
Insuficiencia cardíaca congestiva sintomática |
Suspender permanentemente TAGRISSO. |
|
|
Cutáneo |
Eritema multiforme mayor (EMM), síndrome de Stevens-Johnson (SSJ) y necrólisis epidérmica tóxica (NET) |
Retener TAGRISSO si se sospecha y suspender permanentemente si se confirma. |
Sangre y médula ósea [ver Advertencias y precauciones (5.7)]
Anemia aplásica
Suspenda TAGRISSO si se sospecha anemia aplásica y suspenda permanentemente si se confirma.
Otros [ver Reacciones adversas (6.1)]
Reacción adversa de Grado 3 o mayor gravedad
Suspenda TAGRISSO hasta por 3 semanas.
Si mejora a Grado 0-2 dentro de las 3 semanas
Reanude a 80 mg o 40 mg diarios.
Si no hay mejora dentro de las 3 semanas
Suspenda permanentemente TAGRISSO.
Modificaciones de la dosis para la terapia combinada
Cuando TAGRISSO se administra en combinación con pemetrexed y quimioterapia a base de platino, modifique la dosis de cualquiera de los tratamientos para el manejo de las reacciones adversas, según corresponda. Para obtener instrucciones sobre la modificación de la dosis de TAGRISSO, consulte la Tabla 2. Suspenda, reduzca la dosis o suspenda permanentemente pemetrexed, cisplatino o carboplatino de acuerdo con su respectiva Información de prescripción.
Interacciones medicamentosas
Inductores fuertes de CYP3A4
Evite el uso concomitante de inductores fuertes de CYP3A4 con TAGRISSO. Si el uso concurrente es inevitable, aumente la dosis de TAGRISSO a 160 mg diarios cuando se administre conjuntamente con un inductor fuerte de CYP3A. Reanude TAGRISSO a 80 mg 3 semanas después de la interrupción del inductor fuerte de CYP3A4 [ver Interacciones medicamentosas (7) y Farmacología clínica (12.3)].
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Tabletas de 80 mg: tableta beige, oval y biconvexa marcada con “AZ 80” en un lado y lisa en el reverso.
Tabletas de 40 mg: tableta beige, redonda y biconvexa marcada con “AZ 40” en un lado y lisa en el reverso.
4 CONTRAINDICACIONES
Ninguna.
ADVERTENCIAS Y PRECAUCIONES
5.1 Enfermedad Pulmonar Intersticial/Neumonitis
TAGRISSO puede causar ILD/neumonitis grave y fatal.
En los ensayos clínicos, la enfermedad pulmonar intersticial (ILD)/neumonitis se produjo en el 4% de los 1813 pacientes tratados con TAGRISSO en monoterapia que no habían recibido quimiorradiación definitiva reciente; el 0,4% de los casos fueron fatales.
ILD/Neumonitis con TAGRISSO en combinación con Pemetrexed y quimioterapia a base de platino
En el estudio FLAURA2, la ILD/neumonitis se produjo en el 3,3% de los 276 pacientes que recibieron TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino; el 0,4% de los casos fueron fatales.
ILD/Neumonitis después de la quimiorradiación definitiva a base de platino
En el estudio LAURA, después de la quimiorradiación definitiva a base de platino, la ILD/neumonitis, incluida la neumonitis por radiación, se produjo en 80 de los 143 pacientes (56%) que recibieron TAGRISSO en monoterapia y 28 de los 73 pacientes (38%) que recibieron placebo. Hubo un caso fatal (0,7%), 3,5% de reacciones adversas de grado 3, 34% de grado 2 y 18% de grado 1 de ILD/neumonitis en los pacientes tratados con TAGRISSO. Para los pacientes tratados con TAGRISSO, la ILD/neumonitis provocó la interrupción permanente de TAGRISSO en el 7% de los pacientes y las interrupciones de la dosis de TAGRISSO en el 35% de los pacientes. Entre los 46 pacientes que fueron retados con TAGRISSO, el 11% tuvo una recurrencia de ILD/neumonitis. En los 80 pacientes tratados con TAGRISSO, la ILD/neumonitis se resolvió en el 40%, se resolvió con secuelas en el 1,3%, se estaba resolviendo en el 16%, no se resolvió en el 41% y provocó la muerte en el 1,3%.
Para los pacientes que reciben TAGRISSO que no han recibido quimiorradiación definitiva a base de platino reciente, suspenda TAGRISSO e investigue rápidamente la ILD en los pacientes que presenten un empeoramiento o síntomas respiratorios que puedan ser indicativos de ILD (por ejemplo, disnea, tos y fiebre). Suspenda permanentemente TAGRISSO si se confirma la ILD/neumonitis [ver Dosis y administración (2.5) y Reacciones adversas (6.1)].
Para los pacientes que han recibido quimiorradiación definitiva a base de platino reciente con ILD/neumonitis de grado 1, continúe con TAGRISSO o interrumpa y reinicie, según corresponda. Suspenda permanentemente TAGRISSO en los pacientes diagnosticados con ILD/neumonitis de grado ≥2 [ver Dosis y administración (2.5) y Reacciones adversas (6.1)].
5.2 Prolongación del Intervalo QTc
TAGRISSO puede causar prolongación del intervalo QT corregido por la frecuencia cardíaca (QTc). De los 1813 pacientes tratados con TAGRISSO en monoterapia en ensayos clínicos, el 1,1% presentó un QTc >500 mseg y el 4,3% de los pacientes tuvieron un aumento del QTc desde el valor basal >60 mseg [ver Farmacología clínica (12.2)].
De los 276 pacientes tratados con TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino en el estudio FLAURA2, el 1,8% presentó un QTc >500 mseg y el 10,5% de los pacientes tuvieron un aumento del QTc desde el valor basal >60 mseg.
No se notificaron arritmias relacionadas con el QTc.
Los ensayos clínicos de TAGRISSO no incluyeron pacientes con un QTc basal de >470 mseg. Realice un seguimiento periódico con ECG y electrolitos en pacientes con síndrome de QT largo congénito, insuficiencia cardíaca congestiva, anomalías electrolíticas o aquellos que están tomando medicamentos que se sabe que prolongan el intervalo QTc. Suspenda permanentemente TAGRISSO en los pacientes que desarrollen prolongación del intervalo QTc con signos/síntomas de arritmia potencialmente mortal [ver Dosis y administración (2.5)].
5.3 Cardiomiopatía
TAGRISSO puede causar cardiomiopatía, incluida la insuficiencia cardíaca, la insuficiencia cardíaca crónica, la insuficiencia cardíaca congestiva, el edema pulmonar o la disminución de la fracción de eyección.
En los ensayos clínicos, la cardiomiopatía se produjo en el 3,8% de los 1813 pacientes tratados con TAGRISSO; el 0,1% de los casos de cardiomiopatía fueron fatales.
En el estudio FLAURA2, la cardiomiopatía se produjo en el 9% de los 276 pacientes que recibieron TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino; el 1,1% de los casos de cardiomiopatía fueron fatales.
Una disminución de la fracción de eyección del ventrículo izquierdo (FEVI) ≥10 puntos porcentuales desde el valor basal y a menos del 50% de FEVI se produjo en el 4,2% de los 1557 pacientes que tenían una evaluación basal y al menos una evaluación de seguimiento de la FEVI. En el estudio ADAURA, el 1,5% (5/325) de los pacientes tratados con TAGRISSO experimentaron disminuciones de la FEVI mayores o iguales a 10 puntos porcentuales y una caída a menos del 50%. En el estudio LAURA, después de la quimiorradiación a base de platino, el 3% (4/135) de los pacientes tratados con TAGRISSO y ningún paciente tratado con placebo experimentaron disminuciones de la FEVI mayores o iguales a 10 puntos porcentuales y una caída a menos del 50%. En el estudio FLAURA2, el 8% (21/262) de los pacientes tratados con TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino, que tenían una evaluación basal y al menos una evaluación de seguimiento de la FEVI, experimentaron disminuciones de la FEVI mayores o iguales a 10 puntos porcentuales y una caída a menos del 50%.
Para los pacientes que recibirán TAGRISSO en monoterapia, realice un seguimiento cardíaco, incluida la evaluación de la FEVI al inicio y durante el tratamiento, en pacientes con factores de riesgo cardíaco.
Para los pacientes que recibirán TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino, realice la monitorización cardíaca, incluida la evaluación de la FEVI en la línea de base y durante el tratamiento, en todos los pacientes.
Evalúe la FEVI en pacientes que desarrollen signos o síntomas cardíacos relevantes durante el tratamiento. En caso de insuficiencia cardíaca congestiva sintomática, suspenda permanentemente TAGRISSO [ver Dosificación y administración (2.5)].
5.4 Queratitis
Se informó queratitis en el 0,6% de 1813 pacientes tratados con TAGRISSO en monoterapia en ensayos clínicos. Refiera de inmediato a los pacientes con signos y síntomas sugestivos de queratitis (como inflamación ocular, lagrimeo, sensibilidad a la luz, visión borrosa, dolor ocular y/o ojo rojo) a un oftalmólogo.
5.5 Eritema multiforme mayor, síndrome de Stevens-Johnson y necrólisis epidérmica tóxica
Se han notificado casos postcomercialización compatibles con eritema multiforme mayor (EMM), síndrome de Stevens-Johnson (SSJ) y necrólisis epidérmica tóxica (NET) en pacientes que reciben TAGRISSO [ver Postcomercialización (6.2)]. Suspenda TAGRISSO si se sospecha EMM, SSJ o NET y suspenda permanentemente si se confirma.
5.6 Vasculitis cutánea
Se han notificado casos postcomercialización de vasculitis cutánea, incluida la vasculitis leucocitoclástica, la vasculitis urticarial y la vasculitis por IgA, en pacientes que reciben TAGRISSO [ver Postcomercialización (6.2)]. Suspenda TAGRISSO si se sospecha vasculitis cutánea, evalúe la participación sistémica y considere la consulta de dermatología. Si no se puede identificar ninguna otra etiología, considere la suspensión permanente de TAGRISSO en función de la gravedad.
5.7 Anemia aplásica
Se ha notificado anemia aplásica en pacientes tratados con TAGRISSO en ensayos clínicos (0,06% de 1813) y postcomercialización [ver Postcomercialización (6.2)]. Algunos casos tuvieron un desenlace fatal. Informe a los pacientes sobre los signos y síntomas de la anemia aplásica, que incluyen, entre otros, fiebre nueva o persistente, hematomas, sangrado y palidez. Si se sospecha anemia aplásica, suspenda TAGRISSO y obtenga una consulta de hematología. Si se confirma la anemia aplásica, suspenda permanentemente TAGRISSO [ver Dosificación y administración (2.5)].
Realice un hemograma completo con diferencial antes de comenzar TAGRISSO, periódicamente durante el tratamiento y con mayor frecuencia si está indicado.
5.8 Toxicidad embrio-fetal
Con base en los datos de estudios en animales y su mecanismo de acción, TAGRISSO puede causar daño fetal cuando se administra a una mujer embarazada. En estudios de reproducción en animales, el osimertinib causó pérdida fetal postimplantación cuando se administró durante el desarrollo temprano a una dosis de exposición 1,5 veces la exposición a la dosis clínica recomendada. Cuando los machos fueron tratados antes del apareamiento con hembras no tratadas, hubo un aumento en la pérdida embrionaria preimplantación a exposiciones plasmáticas de aproximadamente 0,5 veces las observadas a la dosis recomendada de 80 mg una vez al día. Verifique el estado de embarazo de las mujeres en edad fértil antes de iniciar TAGRISSO. Advierta a las mujeres embarazadas sobre el riesgo potencial para el feto. Aconseje a las mujeres en edad fértil que utilicen métodos anticonceptivos eficaces durante el tratamiento con TAGRISSO y durante 6 semanas después de la dosis final. Aconseje a los hombres con parejas femeninas en edad fértil que utilicen métodos anticonceptivos eficaces durante 4 meses después de la dosis final [ver Uso en poblaciones específicas (8.1y 8.3)].
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas se analizan con mayor detalle en otras secciones del etiquetado:
- •
- Enfermedad pulmonar intersticial/neumonitis [ver Advertencias y precauciones (5.1)]
- •
- Prolongación del intervalo QTc [ver Advertencias y precauciones (5.2)]
- •
- Cardiomiopatía [ver Advertencias y precauciones (5.3)]
- •
- Queratitis [ver Advertencias y precauciones (5.4)]
- •
- Eritema multiforme, síndrome de Stevens-Johnson y necrólisis epidérmica tóxica [ver Advertencias y precauciones (5.5)]
- •
- Vasculitis cutánea [ver Advertencias y precauciones (5.6)]
- •
- Anemia aplásica [ver Advertencias y precauciones (5.7)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variables, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no se pueden comparar directamente con las tasas en los ensayos clínicos de otro fármaco y pueden no reflejar las tasas observadas en la práctica.
Los datos de la sección ADVERTENCIAS Y PRECAUCIONES reflejan la exposición a TAGRISSO en 1813 pacientes con CPNM positivo a la mutación del EGFR que recibieron TAGRISSO en monoterapia a la dosis recomendada de 80 mg por vía oral una vez al día hasta la progresión de la enfermedad o la toxicidad inaceptable en cuatro ensayos aleatorizados y controlados [ADAURA (n=337), FLAURA (n=338), FLAURA2 (brazo de monoterapia; n=275) y AURA3 (n=279)] [ver Estudios clínicos (14)], dos ensayos de un solo brazo [AURA Extension (n=201) {NCT01802632} y AURA2 (n=210)]{NCT02094261} y un estudio de búsqueda de dosis, AURA1 (n=173). Entre los 1813 pacientes que recibieron TAGRISSO en monoterapia, el 82% estuvo expuesto durante 6 meses o más y el 67% estuvo expuesto durante más de un año. En esta población de seguridad agrupada, las reacciones adversas más comunes en ≥20% de los 1813 pacientes que recibieron TAGRISSO en monoterapia fueron diarrea (47%), erupción cutánea (46%), dolor musculoesquelético (38%), toxicidad en las uñas (34%), piel seca (32%), estomatitis (24%) y fatiga (21%). Las anomalías de laboratorio más comunes en ≥20% de los 1813 pacientes que recibieron TAGRISSO en monoterapia fueron leucopenia (65%), linfopenia (64%), trombocitopenia (53%), anemia (52%) y neutropenia (36%). Además de los 1813 pacientes, ciertas subsecciones en las ADVERTENCIAS Y PRECAUCIONES describen reacciones adversas observadas con la exposición a TAGRISSO en monoterapia (80 mg por vía oral una vez al día hasta la progresión de la enfermedad o la toxicidad inaceptable) después de la quimiorradiación definitiva basada en platino (n=143) en el estudio LAURA.
Los datos descritos a continuación reflejan la exposición a TAGRISSO (80 mg diarios) en 337 pacientes con CPNM resecable positivo a la mutación del EGFR, 143 pacientes con CPNM localmente avanzado, irresecable (estadio III) positivo a la mutación del EGFR y 833 pacientes con CPNM localmente avanzado o metastásico positivo a la mutación del EGFR en cinco ensayos aleatorizados y controlados [ADAURA (n=337), LAURA (n=143), FLAURA (n=279), FLAURA2 (brazo de monoterapia; n=275) y AURA3 (n=279)]. Los datos también reflejan la exposición a TAGRISSO a la dosis recomendada de 80 mg diarios administrados en combinación con pemetrexed y quimioterapia basada en platino en 276 pacientes con CPNM localmente avanzado o metastásico positivo a la mutación del EGFR en un ensayo aleatorizado y controlado [FLAURA2 (n=276)]. Los pacientes con antecedentes de enfermedad pulmonar intersticial, enfermedad intersticial inducida por fármacos o neumonitis por radiación que requirieron tratamiento con esteroides, arritmia grave o intervalo QTc basal mayor de 470 msec en el electrocardiograma fueron excluidos de la inscripción en estos estudios.
Tratamiento adyuvante del CPNM positivo a la mutación del EGFR – Monoterapia
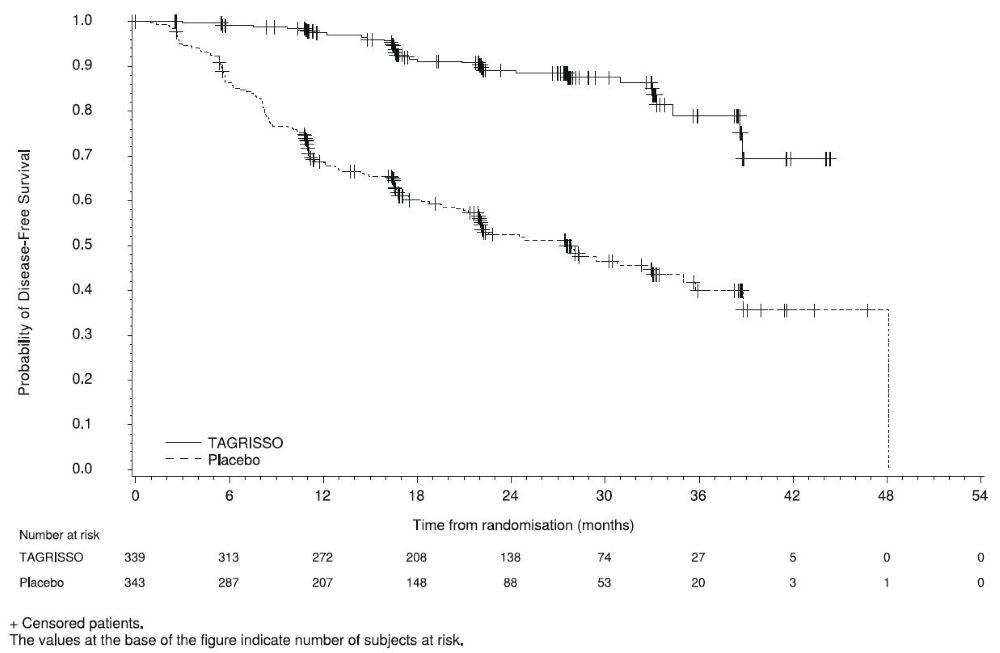
La seguridad de TAGRISSO se evaluó en ADAURA, un ensayo aleatorizado, doble ciego, controlado con placebo para el tratamiento adyuvante de pacientes con CPNM positivo a la mutación del EGFR con deleciones del exón 19 o la mutación L858R del exón 21 que habían tenido una resección tumoral completa, con o sin quimioterapia adyuvante previa. En el momento del análisis de la SLP, la duración media de la exposición a TAGRISSO fue de 22,5 meses.
Se informaron reacciones adversas graves en el 16% de los pacientes tratados con TAGRISSO. La reacción adversa grave más común (≥1%) fue la neumonía (1,5%). Las reacciones adversas que llevaron a reducciones de dosis ocurrieron en el 9% de los pacientes tratados con TAGRISSO. Las reacciones adversas más frecuentes que llevaron a reducciones o interrupciones de la dosis fueron diarrea (4,5%), estomatitis (3,9%), toxicidad en las uñas (1,8%) y erupción cutánea (1,8%). Las reacciones adversas que llevaron a la interrupción permanente ocurrieron en el 11% de los pacientes tratados con TAGRISSO. Las reacciones adversas más frecuentes que llevaron a la interrupción de TAGRISSO fueron la enfermedad pulmonar intersticial (2,7%) y la erupción cutánea (1,2%).
Las tablas 4 y 5 resumen las reacciones adversas comunes y las anomalías de laboratorio que ocurrieron en ADAURA.
| Reacción adversa | TAGRISSO (N=337) |
PLACEBO (N=343) |
||
|---|---|---|---|---|
| Todos los grados (%) |
Grado 3 o superior† (%) |
Todos los grados (%) |
Grado 3 o superior† (%) |
|
|
||||
|
Trastornos gastrointestinales |
||||
|
Diarrea‡ |
47 |
2.4 |
20 |
0.3 |
|
Estomatitis§ |
32 |
1.8 |
7 |
0 |
|
Dolor abdominal¶ |
12 |
0.3 |
7 |
0 |
|
Trastornos de la piel |
||||
|
Erupción cutánea# |
40 |
0.6 |
19 |
0 |
|
Toxicidad de las uñasÞ |
37 |
0.9 |
3.8 |
0 |
|
Piel secaß |
29 |
0.3 |
7 |
0 |
|
Pruritoà |
19 |
0 |
9 |
0 |
|
Trastornos respiratorios, torácicos y mediastínicos |
||||
|
Tosè |
19 |
0 |
19 |
0 |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
||||
|
Dolor musculoesqueléticoð |
18 |
0.3 |
25 |
0.3 |
|
Trastornos de infección e infestación |
||||
|
Nasofaringitis |
14 |
0 |
10 |
0 |
|
Infección del tracto respiratorio superior |
13 |
0.6 |
10 |
0 |
|
Infección del tracto urinarioø |
10 |
0.3 |
7 |
0 |
|
Trastornos generales y condiciones del sitio de administración |
||||
|
Fatigaý |
13 |
0.6 |
9 |
0.3 |
|
Trastornos del metabolismo y la nutrición |
||||
|
Disminución del apetito |
13 |
0.6 |
3.8 |
0 |
|
Trastornos del sistema nervioso |
||||
|
Mareos£ |
10 |
0 |
9 |
0 |
Las reacciones adversas clínicamente relevantes en ADAURA en <10% de los pacientes que recibieron TAGRISSO fueron alopecia (6%), epistaxis (6%), enfermedad pulmonar intersticial (3%), síndrome de eritrodisestesia palmar-plantar (1.8%), hiperpigmentación de la piel (1.8%), urticaria (1.5%), queratitis (0.6%), prolongación del intervalo QTc (0.6%) y eritema multiforme (0.3%). La prolongación del intervalo QTc representa la incidencia de pacientes que tuvieron una prolongación del QTcF >500 mseg.
| Anormalidad de laboratorio*† | TAGRISSO (N=337) |
PLACEBO (N=343) |
|||
|---|---|---|---|---|---|
| Todos los grados (%) | Grado 3 o Grado 4 (%) | Todos los grados (%) |
Grado 3 o Grado 4 (%) |
||
|
Hematología |
|||||
|
Leucopenia |
54 |
0 |
25 |
0 |
|
|
Trombocitopenia |
47 |
0 |
7 |
0.3 |
|
|
Linfopenia |
44 |
3.4 |
14 |
0.9 |
|
|
Anemia |
30 |
0 |
12 |
0.3 |
|
|
Neutropenia |
26 |
0.6 |
10 |
0.3 |
|
|
Química |
|||||
|
Hiperglucemia |
25 |
2.3 |
30 |
0.9 |
|
|
Hipermagnesemia |
24 |
1.3 |
14 |
1.5 |
|
|
Hiponatremia |
20 |
1.8 |
16 |
1.5 |
|
Las anormalidades de laboratorio en ADAURA que ocurrieron en <20% de los pacientes que recibieron TAGRISSO fue un aumento de la creatinina en sangre (10%).
Estadio III (Localmente Avanzado, Irresecable) NSCLC Positivo a Mutación EGFR
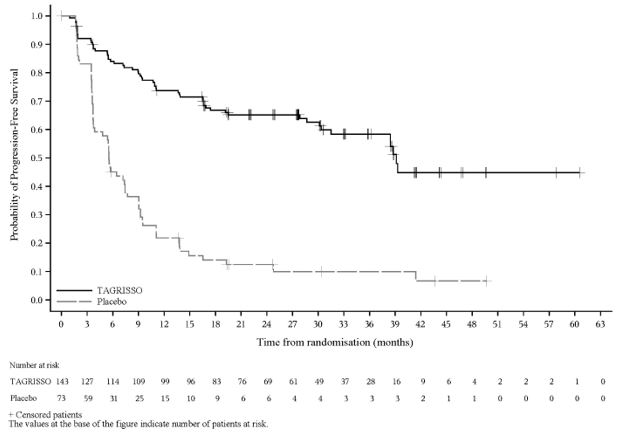
La seguridad de TAGRISSO se evaluó en LAURA, un estudio doble ciego, aleatorizado (2:1), controlado con placebo realizado en 216 pacientes con mutaciones de EGFR en el exón 19 o en el exón 21 L858R positivo, NSCLC localmente avanzado, irresecable (estadio III), que no habían progresado durante o después de la terapia definitiva con quimiorradiación a base de platino. Entre los pacientes que recibieron TAGRISSO, el 81% estuvo expuesto durante 6 meses o más y el 74% estuvo expuesto durante un año o más.
Se informaron reacciones adversas graves en el 38% de los pacientes tratados con TAGRISSO. Las reacciones adversas graves más comunes (≥1%) incluyeron ILD/neumonitis (13%), neumonía (6%) y gastroenteritis (1.4%). Las reacciones adversas fatales ocurrieron en el 1.4% de los pacientes que recibieron TAGRISSO debido a neumonía (0.7%) e ILD/neumonitis (0.7%).
La interrupción permanente de TAGRISSO debido a una reacción adversa ocurrió en el 13% de los pacientes. Las reacciones adversas que provocaron la interrupción permanente de TAGRISSO en > 1 paciente fueron ILD/neumonitis (7%) y neumonía (1.4%).
Las interrupciones de la dosis de TAGRISSO debido a una reacción adversa ocurrieron en el 56% de los pacientes. Las reacciones adversas que requirieron interrupción de la dosis en ≥2% de los pacientes fueron ILD/neumonitis (35%), neumonía (6%), COVID-19 (4.2%), neutropenia (2.1%) y prolongación del intervalo QTc (2.1%).
Las reducciones de dosis de TAGRISSO debido a una reacción adversa ocurrieron en el 8% de los pacientes.
Las reacciones adversas más comunes, incluidas las anormalidades de laboratorio que empeoraron desde el inicio, fueron linfopenia, leucopenia, ILD/neumonitis, trombocitopenia, neutropenia, erupción cutánea, diarrea, toxicidad en las uñas, dolor musculoesquelético, tos y COVID-19.
Las tablas 6 y 7 resumen las reacciones adversas comunes y las anormalidades de laboratorio que ocurrieron en LAURA.
| Reacción adversa | TAGRISSO (N=143) |
Placebo (N=73) |
||
|---|---|---|---|---|
| Cualquier Grado (%) | Grado 3 o 4 (%) | Cualquier Grado (%) | Grado 3 o 4 (%) |
|
|
||||
|
Trastornos respiratorios, torácicos y mediastínicos |
||||
|
ILD/neumonitis† |
56 |
3.5 |
38 |
0 |
|
Tos‡ |
20 |
0 |
15 |
0 |
|
Trastornos de la piel |
||||
|
Erupción§ |
39 |
0.7 |
19 |
0 |
|
Toxicidad en las uñas¶ |
23 |
0 |
1.4 |
0 |
|
Piel seca# |
17 |
0.7 |
5 |
0 |
|
Prurito |
13 |
0 |
7 |
0 |
|
Trastornos gastrointestinales |
||||
|
DiarreaÞ |
36 |
2.1 |
14 |
0 |
|
Estomatitisß |
15 |
0 |
5 |
0 |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
||||
|
Dolor musculoesqueléticoà |
20 |
0.7 |
26 |
0 |
|
Trastornos de infección e infestación |
||||
|
COVID-19è |
20 |
0.7 |
10 |
0 |
|
Neumoníað |
15 |
3.5 |
10 |
5 |
|
Trastornos del metabolismo y la nutrición |
||||
|
Disminución del apetito |
15 |
0.7 |
5 |
0 |
Las reacciones adversas clínicamente relevantes en LAURA en <10% de los pacientes que recibieron TAGRISSO fueron disnea (8%), infección del tracto urinario (8%), alopecia (1.4%), urticaria (1.4%), epistaxis (0.7%), queratitis (0.7%) y prolongación del intervalo QTc (0.7%). La prolongación del intervalo QTc representa la incidencia de pacientes que tuvieron una prolongación del QTc >500 mseg.
| Anormalidad de laboratorio*† | TAGRISSO (N=143) |
Placebo (N=73) |
||
|---|---|---|---|---|
| Todos los grados (%) | Grado 3 o 4 (%) |
Todos los grados (%) |
Grado 3 o 4 (%) |
|
|
Hematología |
||||
|
Linfopenia |
70 |
3.5 |
40 |
1.4 |
|
Leucopenia |
66 |
2.8 |
24 |
0 |
|
Trombocitopenia |
51 |
1.4 |
8 |
1.4 |
|
Neutropenia |
42 |
2.1 |
15 |
1.4 |
Una anomalía de laboratorio clínicamente relevante en LAURA que ocurrió en <20% de los pacientes que recibieron TAGRISSO fue un aumento de la creatinina en sangre (19%).
Cáncer de pulmón de células no pequeñas metastásico positivo a la mutación EGFR previamente no tratado – Monoterapia
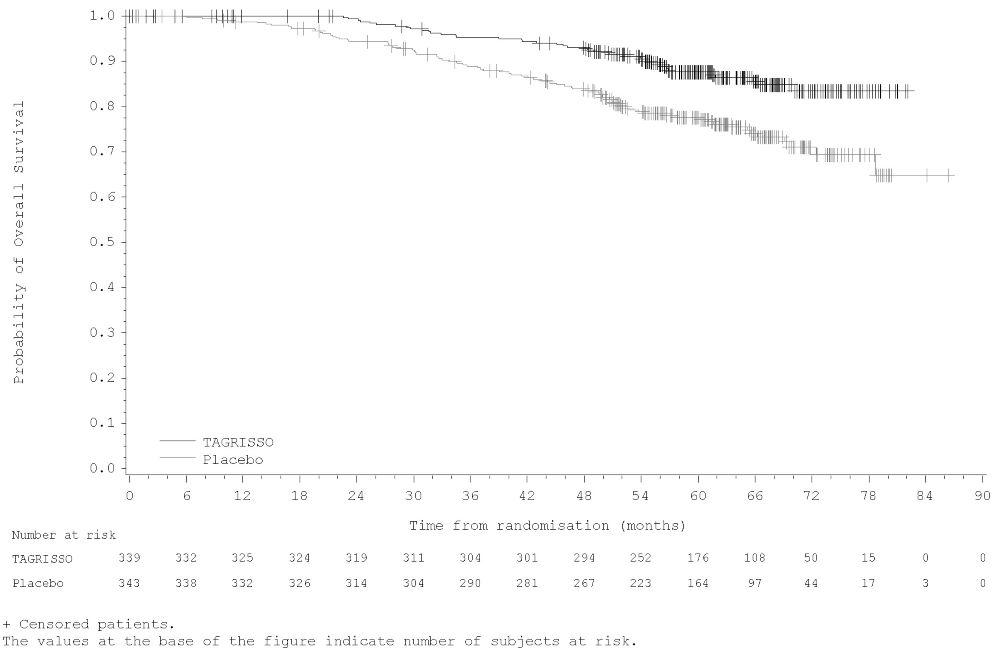
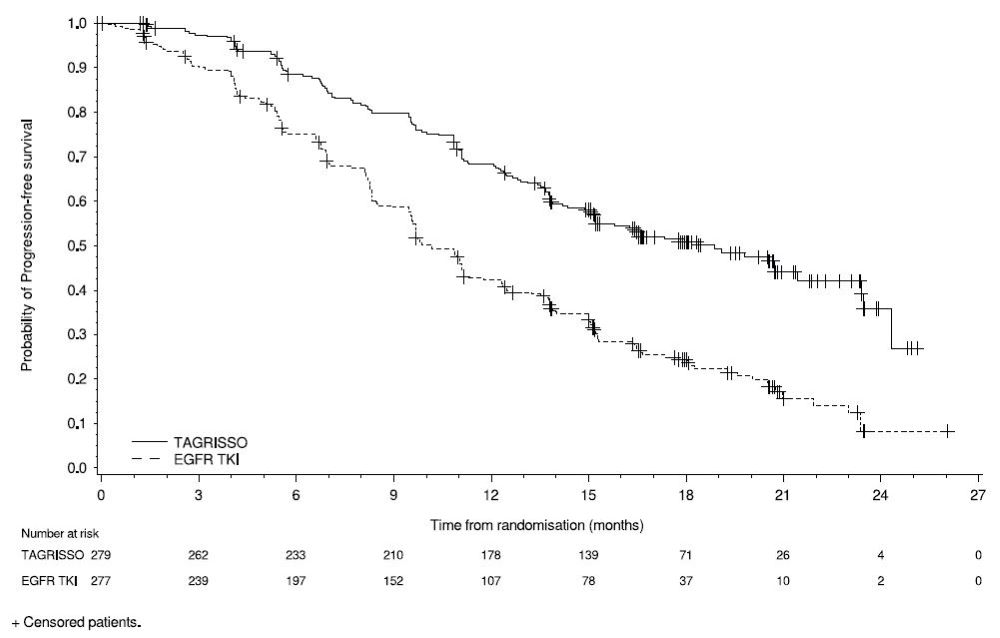
La seguridad de TAGRISSO se evaluó en FLAURA, un ensayo multicéntrico internacional doble ciego aleatorizado (1:1) controlado con activo realizado en 556 pacientes con deleción del exón 19 del EGFR o mutación positiva del exón 21 L858R, NSCLC irresecable o metastásico que no habían recibido tratamiento sistémico previo para la enfermedad avanzada. La duración media de la exposición a TAGRISSO fue de 16,2 meses.
Se informaron reacciones adversas graves en el 4% de los pacientes tratados con TAGRISSO; las reacciones adversas graves más comunes (≥1%) fueron neumonía (2,9%), ILD/neumonitis (2,1%) y embolia pulmonar (1,8%). Las reducciones de dosis ocurrieron en el 2,9% de los pacientes tratados con TAGRISSO. Las reacciones adversas más frecuentes que llevaron a reducciones o interrupciones de la dosis fueron la prolongación del intervalo QT según lo evaluado por ECG (4,3%), diarrea (2,5%) y linfopenia (1,1%). Las reacciones adversas que llevaron a la interrupción permanente ocurrieron en el 13% de los pacientes tratados con TAGRISSO. La reacción adversa más frecuente que llevó a la interrupción de TAGRISSO fue ILD/neumonitis (3,9%).
Las tablas 8 y 9 resumen las reacciones adversas comunes y las anomalías de laboratorio que ocurrieron en FLAURA.
|
||||
|
Reacción adversa |
TAGRISSO (N=279) |
Comparador EGFR TKI (gefitinib o erlotinib) (N=277) |
||
|
Cualquier grado (%) |
Grado 3 o superior (%) |
Cualquier grado (%) |
Grado 3 o superior (%) |
|
|
Trastornos gastrointestinales |
||||
|
Diarrea† |
58 |
2.2 |
57 |
2.5 |
|
Estomatitis‡ |
32 |
0.7 |
22 |
1.1 |
|
Náuseas |
14 |
0 |
19 |
0 |
|
Constipation |
15 |
0 |
13 |
0 |
|
Vomiting |
11 |
0 |
11 |
1.4 |
|
Skin Disorders |
||||
|
Rash§ |
58 |
1.1 |
78 |
7 |
|
Dry skin¶ |
36 |
0.4 |
36 |
1.1 |
|
Nail toxicity# |
35 |
0.4 |
33 |
0.7 |
|
PruritusÞ |
17 |
0.4 |
17 |
0 |
|
General Disorders and Administration Site Conditions |
||||
|
Fatigueß |
21 |
1.4 |
15 |
1.4 |
|
Pyrexia |
10 |
0 |
4 |
0.4 |
|
Metabolism and Nutrition Disorders |
||||
|
Decreased appetite |
20 |
2.5 |
19 |
1.8 |
|
Respiratory, Thoracic and Mediastinal Disorders |
||||
|
Cough |
17 |
0 |
15 |
0.4 |
|
Dyspnea |
13 |
0.4 |
7 |
1.4 |
|
Neurologic Disorders |
||||
|
Headache |
12 |
0.4 |
7 |
0 |
|
Trastornos cardíacos |
||||
|
Intervalo QT prolongadoà |
10 |
2.2 |
4 |
0.7 |
|
Infecciones e infestaciones |
||||
|
Infección de las vías respiratorias altas |
10 |
0 |
7 |
0 |
Las reacciones adversas clínicamente relevantes en FLAURA en <10% de los pacientes que recibieron TAGRISSO fueron alopecia (7%), epistaxis (6%), enfermedad pulmonar intersticial (3.9%), urticaria (2.2%), síndrome de eritrodisestesia palmar-plantar (1.4%), prolongación del intervalo QTc (1.1%), queratitis (0.4%) e hiperpigmentación de la piel (0.4)%. La prolongación del intervalo QTc representa la incidencia de pacientes que tuvieron una prolongación del QTcF >500 mseg.
|
|||||
|
TAGRISSO (N=279) |
Comparador de EGFR TKI (gefitinib o erlotinib) (N=277) |
||||
|
Todos los grados (%) |
Grado 3 o Grado 4 (%) |
Todos los grados (%) |
Grado 3 o Grado 4 (%) |
||
|
Hematología |
|||||
|
Linfopenia |
63 |
6 |
36 |
4.2 |
|
|
Anemia |
59 |
0.7 |
47 |
0.4 |
|
|
Trombocitopenia |
51 |
0.7 |
12 |
0.4 |
|
|
Neutropenia |
41 |
3 |
10 |
0 |
|
|
Química |
|||||
|
Hiperglucemia‡ |
37 |
0 |
31 |
0.5 |
|
|
Hipermagnesemia |
30 |
0.7 |
11 |
0.4 |
|
|
Hiponatremia |
26 |
1.1 |
27 |
1.5 |
|
|
AST aumentado |
22 |
1.1 |
43 |
4.1 |
|
ALT aumentado |
21 |
0.7 |
52 |
8 |
|
Hipokalemia |
16 |
0.4 |
22 |
1.1 |
|
Hiperbilirrubinemia |
14 |
0 |
29 |
1.1 |
Las anormalidades de laboratorio clínicamente relevantes en FLAURA que ocurrieron en <20% de los pacientes que recibieron TAGRISSO fue un aumento de la creatinina en sangre (9%).
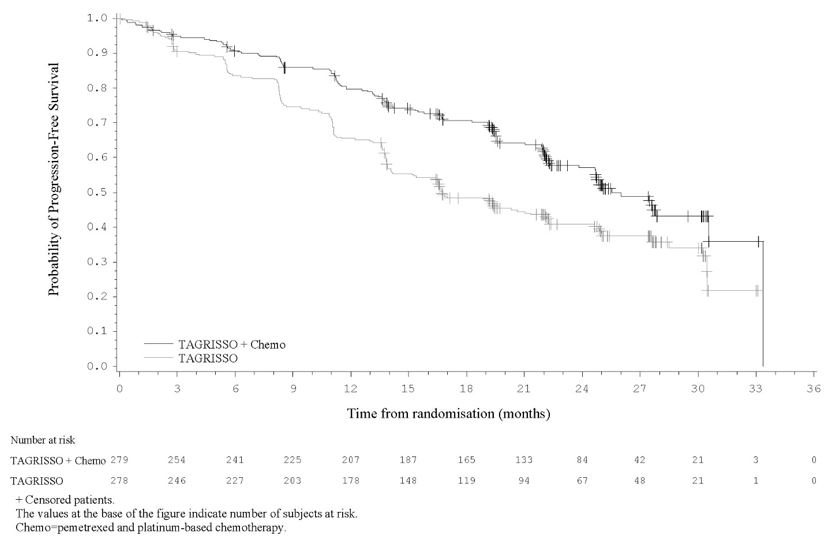
Cáncer de pulmón de células no pequeñas metastásico o localmente avanzado previamente no tratado con mutación positiva de EGFR – TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino
La seguridad de TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino se evaluó en FLAURA2, un ensayo multicéntrico internacional abierto, aleatorizado (1:1), controlado con activo realizado en 557 pacientes con deleción del exón 19 de EGFR o mutación positiva del exón 21 L858R, localmente avanzado o metastásico NSCLC que no habían recibido tratamiento sistémico previo para la enfermedad avanzada. La duración media de la exposición a TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino fue de 22,3 meses y la duración media de la exposición a TAGRISSO en monoterapia fue de 19,3 meses.
Se informaron reacciones adversas graves en el 38% de los pacientes tratados con TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino; las reacciones adversas graves más frecuentes (≥2%) en el brazo de combinación fueron anemia (3,3%), COVID-19 (2,5%), neumonía (2,5%), neutropenia febril (2,2%), trombocitopenia (2,2%) y embolia pulmonar (2,2%). Las reacciones adversas fatales ocurrieron en el 7% de los pacientes que recibieron TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino, incluida la embolia pulmonar (1,1%), la neumonía (1,1%) y la miocardiopatía (1,1%).
Las interrupciones de la dosis de TAGRISSO, cuando se administra con pemetrexed y quimioterapia a base de platino, debido a una reacción adversa ocurrieron en el 44% de los pacientes. Las reacciones adversas que requirieron interrupción de la dosis en ≥ 2% de los pacientes incluyeron anemia (4,7%), neutropenia (4,3%), diarrea (3,6%), neutropenia febril (3,3%) y trombocitopenia (2,9%).
La interrupción permanente de TAGRISSO cuando se administra en combinación con pemetrexed y quimioterapia a base de platino debido a una reacción adversa ocurrió en el 11% de los pacientes. Las reacciones adversas que provocaron la interrupción permanente de TAGRISSO en ≥1% de los pacientes incluyeron ILD/neumonitis (2,9%), neumonía (1,4%) y disminución de la fracción de eyección (1,1%).
Las reacciones adversas que llevaron a la reducción de la dosis de TAGRISSO ocurrieron en el 10% de los pacientes tratados con TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino. Las reacciones adversas más frecuentes que llevaron a la reducción de la dosis de TAGRISSO en el brazo de combinación en ≥1% de los pacientes fueron diarrea (1,1%) y erupción cutánea (1,1%).
Las tablas 10 y 11 resumen las reacciones adversas comunes y las anormalidades de laboratorio que ocurrieron en FLAURA2.
| Reacción adversa | TAGRISSO con pemetrexed y quimioterapia a base de platino (N=276) | TAGRISSO (N=275) |
||
|---|---|---|---|---|
| Cualquier grado (%) | Grado 3 o superior (%) |
Cualquier grado (%) | Grado 3 o superior (%) |
|
|
||||
|
Trastornos de la piel |
||||
|
Erupción cutánea† |
49 |
2.5 |
44 |
1.5 |
|
Toxicidad de las uñas‡ |
27 |
0.7 |
32 |
0.4 |
|
Piel seca§ |
24 |
0 |
31 |
0 |
|
Prurito¶ |
8 |
0 |
11 |
0 |
|
Trastornos gastrointestinales |
||||
|
Diarrea |
43 |
2.9 |
41 |
0.4 |
|
Estomatitis# |
31 |
0.4 |
21 |
0.4 |
Las reacciones adversas clínicamente relevantes en FLAURA2 en <10% de los pacientes que recibieron TAGRISSO en combinación con pemetrexed y quimioterapia basada en platino fueron alopecia (9%), epistaxis (7%), síndrome de eritrodisestesia palmar-plantar (5%), enfermedad pulmonar intersticial (3.3%), hiperpigmentación de la piel (2.5%), prolongación del intervalo QTc (1.8%), eritema multiforme (1.4%), urticaria (1.4%) y queratitis (0.7%). La prolongación del intervalo QTc representa la incidencia de pacientes que tuvieron una prolongación del QTcF >500 mseg.
| Anormalidad de laboratorio‡ | TAGRISSO con pemetrexed y quimioterapia basada en platino (N=276) | TAGRISSO (N=275) |
||
|---|---|---|---|---|
| Todos los grados (%) | Grado 3 o Grado 4 (%) |
Todos los grados (%) |
Grado 3 o Grado 4 (%) |
|
|
||||
|
Hematología |
||||
|
Leucopenia |
88 |
20 |
53 |
3.3 |
|
Trombocitopenia |
85 |
16 |
44 |
1.8 |
|
Neutropenia |
85 |
36 |
40 |
4.7 |
|
Linfopenia |
78 |
16 |
55 |
7 |
|
Química |
||||
|
Creatinina en sangre aumentada |
22 |
0.4 |
8 |
0 |
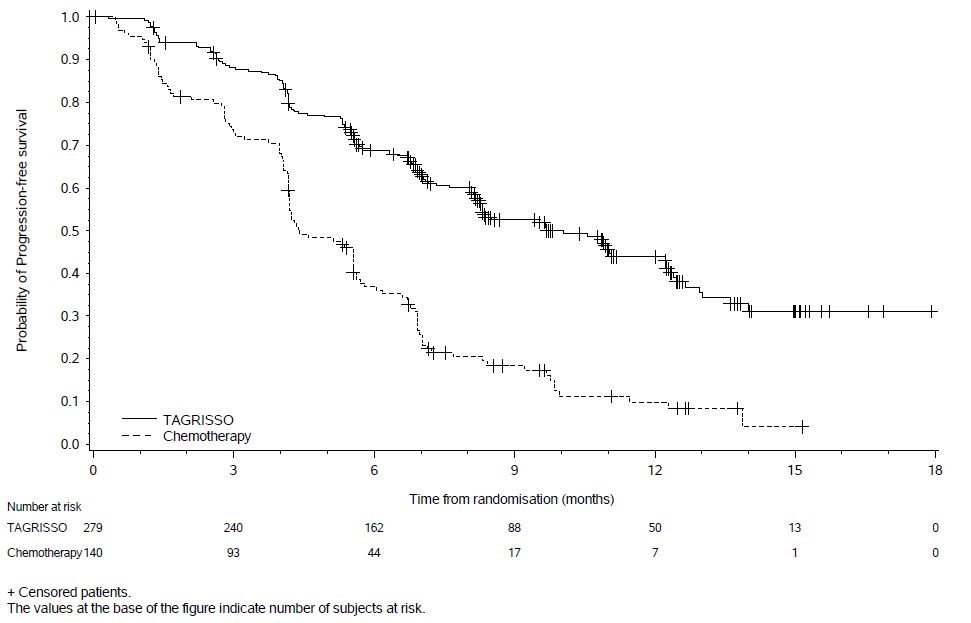
Cáncer de pulmón de células no pequeñas metastásico positivo para la mutación EGFR T790M previamente tratado – Monoterapia
La seguridad de TAGRISSO se evaluó en AURA3, un ensayo clínico controlado, aleatorizado (2:1), abierto, multicéntrico e internacional que se llevó a cabo en 419 pacientes con NSCLC positivo para la mutación EGFR T790M irresecable o metastásico que habían presentado progresión de la enfermedad tras el tratamiento de primera línea con TKI de EGFR. Un total de 279 pacientes recibieron TAGRISSO 80 mg por vía oral una vez al día hasta la intolerancia al tratamiento, la progresión de la enfermedad o la determinación del investigador de que el paciente ya no se beneficiaba del tratamiento. Un total de 136 pacientes recibieron pemetrexed más carboplatino o cisplatino cada tres semanas durante un máximo de 6 ciclos; los pacientes que no presentaron progresión de la enfermedad después de 4 ciclos de quimioterapia pudieron continuar con el mantenimiento de pemetrexed hasta la progresión de la enfermedad, la toxicidad inaceptable o la determinación del investigador de que el paciente ya no se beneficiaba del tratamiento. La fracción de eyección del ventrículo izquierdo (FEVI) se evaluó en la selección y cada 12 semanas. La duración media del tratamiento fue de 8,1 meses para los pacientes tratados con TAGRISSO y de 4,2 meses para los pacientes tratados con quimioterapia. Las características de la población del ensayo fueron: edad media de 62 años, edad inferior a 65 (58%), mujeres (64%), asiáticos (65%), nunca fumadores (68%) y ECOG PS 0 o 1 (100%).
Se notificaron reacciones adversas graves en el 18% de los pacientes tratados con TAGRISSO y en el 26% del grupo de quimioterapia. No se notificó ninguna reacción adversa grave única en el 2% o más de los pacientes tratados con TAGRISSO. Un paciente (0,4%) tratado con TAGRISSO experimentó una reacción adversa mortal (ILD/neumonitis).
Se produjeron reducciones de la dosis en el 2,9% de los pacientes tratados con TAGRISSO. Las reacciones adversas más frecuentes que llevaron a reducciones o interrupciones de la dosis fueron la prolongación del intervalo QT según la evaluación mediante ECG (1,8%), la neutropenia (1,1%) y la diarrea (1,1%). Las reacciones adversas que provocaron la interrupción permanente de TAGRISSO se produjeron en el 7% de los pacientes tratados con TAGRISSO. La reacción adversa más frecuente que llevó a la interrupción de TAGRISSO fue la ILD/neumonitis (3%).
Las tablas 12 y 13 resumen las reacciones adversas comunes y las anomalías de laboratorio que se produjeron en los pacientes tratados con TAGRISSO en AURA3.
|
|||||
|
Reacción adversa |
TAGRISSO (N=279) |
Quimioterapia (Pemetrexed/Cisplatino o Pemetrexed/Carboplatino) (N=136) |
|||
|
Todos los grados† (%) |
Grado 3/4† (%) |
Todos los grados† (%) |
Grado 3/4† (%) |
||
|
Trastornos gastrointestinales |
|||||
|
Diarrea |
41 |
1.1 |
11 |
1.5 |
|
|
Náuseas |
16 |
0.7 |
49 |
3.7 |
|
|
Estomatitis‡ |
19 |
0 |
15 |
1.5 |
|
|
Estreñimiento |
14 |
0 |
35 |
0 |
|
|
Vómitos |
11 |
0.4 |
20 |
2.2 |
|
|
Trastornos de la piel |
|||||
|
Erupción§ |
34 |
0.7 |
6 |
0 |
|
|
Piel seca¶ |
23 |
0 |
4.4 |
0 |
|
|
Toxicidad ungueal# |
22 |
0 |
1.5 |
0 |
|
|
PruritoÞ |
13 |
0 |
5 |
0 |
|
|
Trastornos generales y condiciones del lugar de administración |
|||||
|
Fatigaß |
22 |
1.8 |
40 |
5.1 |
|
|
Trastornos del metabolismo y la nutrición |
|||||
|
Disminución del apetito |
18 |
1.1 |
36 |
2.9 |
|
|
Trastornos respiratorios, torácicos y mediastínicos |
|||||
|
Tos |
17 |
0 |
14 |
0 |
|
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
|||||
|
Dolor de espalda |
10 |
0.4 |
9 |
0.7 |
|
Las reacciones adversas clínicamente relevantes en AURA3 en <10% de los pacientes que recibieron TAGRISSO fueron epistaxis (5%), enfermedad pulmonar intersticial (3.9%), alopecia (3.6%), urticaria (2.9%), síndrome de eritrodisestesia palmar-plantar (1.8%), prolongación del intervalo QTc (1.4%), queratitis (1.1%), y eritema multiforme (0.7%), e hiperpigmentación de la piel (0.4%). La prolongación del intervalo QTc representa la incidencia de pacientes que tuvieron una prolongación del QTcF >500 mseg.
|
|||||
|
TAGRISSO (N=279) |
Quimioterapia (Pemetrexed/Cisplatino o Pemetrexed/Carboplatino) (N=131) |
||||
|
Todos los grados (%) |
Grado 3 o Grado 4 (%) |
Todos los grados (%) |
Grado 3 o Grado 4 (%) |
||
|
Hematología |
|||||
|
Anemia |
43 |
0 |
79 |
3.1 |
|
|
Linfopenia |
63 |
8 |
61 |
10 |
|
|
Trombocitopenia |
46 |
0.7 |
48 |
7 |
|
|
Neutropenia |
27 |
2.2 |
49 |
12 |
|
|
Química |
|||||
|
Hipermagnesemia† |
27 |
1.8 |
9 |
1.5 |
|
|
Hiponatremia† |
26 |
2.2 |
36 |
1.5 |
|
|
Hiperglucemia‡ |
20 |
0 |
NA |
NA |
|
|
Hipokalemia† |
9 |
1.4 |
18 |
1.5 |
|
|
NA=No Aplica |
|||||
Las anormalidades de laboratorio clínicamente relevantes en AURA3 que ocurrieron en <20% de los pacientes que recibieron TAGRISSO incluyeron aumento de la creatinina en sangre (7%).
Otra experiencia en ensayos clínicos
La siguiente reacción adversa se ha reportado después de la administración de TAGRISSO: aumento de la creatina fosfoquinasa en sangre.
6.2 Experiencia postcomercialización
Las siguientes reacciones adversas se han identificado durante el uso posterior a la aprobación de TAGRISSO. Debido a que estas reacciones se reportan voluntariamente de una población de tamaño incierto, no siempre es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición al fármaco.
-
- •
- Piel y tejido subcutáneo: Eritema multiforme mayor (EMM), síndrome de Stevens-Johnson (SJS), necrólisis epidérmica tóxica (TEN), vasculitis cutánea, eritema discrómico persistente
- •
- Trastornos de la sangre y del sistema linfático: Anemia aplásica
7 INTERACCIONES MEDICAMENTOSAS
7.1 Efecto de otros medicamentos en Osimertinib
Inductores fuertes de CYP3A
La administración conjunta de TAGRISSO con un inductor fuerte de CYP3A4 disminuyó la exposición a osimertinib en comparación con la administración de TAGRISSO solo [ver Farmacología clínica (12.3)]. La disminución de la exposición a osimertinib puede conducir a una reducción de la eficacia.
Evite la administración conjunta de TAGRISSO con inductores fuertes de CYP3A. Aumente la dosis de TAGRISSO cuando se administre conjuntamente con un inductor fuerte de CYP3A4 si el uso concurrente es inevitable [ver Dosificación y administración (2.5)]. No se requieren ajustes de dosis cuando TAGRISSO se usa con inductores moderados y/o débiles de CYP3A.
7.2 Efecto de Osimertinib en otros medicamentos
La administración conjunta de TAGRISSO con un sustrato de proteína de resistencia al cáncer de mama (BCRP) o glicoproteína P (P-gp) aumentó la exposición del sustrato en comparación con su administración sola [ver Farmacología clínica (12.3)]. El aumento de la exposición al sustrato de BCRP o P-gp puede aumentar el riesgo de toxicidad relacionada con la exposición.
Controle las reacciones adversas del sustrato de BCRP o P-gp, a menos que se indique lo contrario en su etiquetado aprobado, cuando se administre conjuntamente con TAGRISSO.
7.3 Medicamentos que prolongan el intervalo QTc
Se desconoce el efecto de la administración conjunta de medicamentos conocidos por prolongar el intervalo QTc con TAGRISSO. Cuando sea posible, evite la administración concomitante de medicamentos conocidos por prolongar el intervalo QTc con riesgo conocido de Torsades de pointes. Si no es posible evitar la administración concomitante de dichos medicamentos, realice un control periódico del ECG [ver Advertencias y precauciones (5.2) y Farmacología clínica (12.3)].
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen de Riesgos
Basado en datos de estudios en animales y su mecanismo de acción [ver Farmacología Clínica (12.1)], TAGRISSO puede causar daño fetal cuando se administra a una mujer embarazada. No hay datos disponibles sobre el uso de TAGRISSO en mujeres embarazadas. La administración de osimertinib a ratas embarazadas se asoció con embrioletalidad y reducción del crecimiento fetal a exposiciones plasmáticas 1.5 veces la exposición a la dosis clínica recomendada (ver Datos). Advierta a las mujeres embarazadas sobre el riesgo potencial para un feto.
En la población general de los EE. UU., el riesgo de fondo estimado de defectos de nacimiento mayores y aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente.
Datos
Datos de animales
Cuando se administró a ratas embarazadas antes de la implantación embrionaria hasta el final de la organogénesis (días de gestación 2-20) a una dosis de 20 mg/kg/día, lo que produjo exposiciones plasmáticas de aproximadamente 1.5 veces la exposición clínica, osimertinib causó pérdida postimplantación y muerte embrionaria temprana. Cuando se administró a ratas embarazadas desde la implantación hasta el cierre del paladar duro (días de gestación 6 a 16) a dosis de 1 mg/kg/día y superiores (0.1 veces el AUC observado a la dosis clínica recomendada de 80 mg una vez al día), se observó un aumento equívoco en la tasa de malformaciones fetales y variaciones en las camadas tratadas en relación con las de los controles concurrentes. Cuando se administró a ratas embarazadas a dosis de 30 mg/kg/día durante la organogénesis hasta el día 6 de lactancia, osimertinib causó un aumento en la pérdida total de la camada y la muerte postnatal. A una dosis de 20 mg/kg/día, la administración de osimertinib durante el mismo período resultó en un aumento de la muerte postnatal, así como una ligera reducción en el peso medio de las crías al nacer que aumentó en magnitud entre los días 4 y 6 de lactancia.
8.2 Lactancia
Resumen de Riesgos
No hay datos sobre la presencia de osimertinib o sus metabolitos activos en la leche materna, los efectos de osimertinib en el lactante amamantado o en la producción de leche. La administración a ratas durante la gestación y la lactancia temprana se asoció con efectos adversos, incluida la reducción de las tasas de crecimiento y la muerte neonatal [ver Uso en Poblaciones Específicas (8.1)]. Debido al potencial de reacciones adversas graves en los lactantes amamantados por osimertinib, se debe aconsejar a las mujeres que no amamanten durante el tratamiento con TAGRISSO y durante 2 semanas después de la dosis final.
8.3 Mujeres y Hombres con Potencial Reproductivo
Basado en datos de animales, TAGRISSO puede causar malformaciones, embrioletalidad y muerte postnatal a dosis que producen exposiciones 1.5 veces o menos la exposición humana a la dosis clínica de 80 mg diarios [ver Uso en Poblaciones Específicas (8.1)].
Prueba de Embarazo
Verifique el estado de embarazo de las mujeres con potencial reproductivo antes de iniciar TAGRISSO.
Anticoncepción
Mujeres
Se debe aconsejar a las mujeres con potencial reproductivo que utilicen métodos anticonceptivos efectivos durante el tratamiento con TAGRISSO y durante 6 semanas después de la dosis final [ver Uso en Poblaciones Específicas (8.1)].
Hombres
Se debe aconsejar a los pacientes masculinos con parejas femeninas con potencial reproductivo que utilicen métodos anticonceptivos efectivos durante y durante 4 meses después de la dosis final de TAGRISSO [ver Toxicología No Clínica (13.1)].
Infertilidad
Basado en estudios en animales, TAGRISSO puede afectar la fertilidad en mujeres y hombres con potencial reproductivo. Los efectos sobre la fertilidad femenina mostraron una tendencia hacia la reversibilidad. No se sabe si los efectos sobre la fertilidad masculina son reversibles [ver Toxicología No Clínica (13.1)].
8.4 Uso Pediátrico
La seguridad y eficacia de TAGRISSO en pacientes pediátricos no se han establecido.
8.5 Uso Geriátrico
Monoterapia
De los 1813 pacientes con NSCLC positivo para deleción del exón 19 del EGFR o mutación L858R del exón 21 que fueron tratados con monoterapia con TAGRISSO, 770 pacientes tenían ≥65 años y 207 pacientes tenían ≥75 años de edad [ver Reacciones Adversas (6.1)]. El análisis exploratorio sugiere una mayor incidencia de reacciones adversas de Grado 3 o superior (43% vs 33%) y modificaciones de dosis más frecuentes para reacciones adversas (34% vs 23%) en pacientes de 65 años o más en comparación con aquellos menores de 65 años. No se observaron diferencias generales en la seguridad o eficacia entre los pacientes de 65 años o más y los pacientes más jóvenes.
TAGRISSO después de la terapia de quimiorradiación definitiva basada en platino
De los 142 pacientes con NSCLC localmente avanzado irresecable (Estadio III) positivo para deleción del exón 19 del EGFR o mutación L858R del exón 21 tratados con TAGRISSO después de la terapia de quimiorradiación definitiva basada en platino, 62 pacientes tenían ≥65 años y 13 pacientes tenían ≥75 años de edad [ver Reacciones Adversas (6.1)]. No se observaron diferencias generales en la seguridad o eficacia entre los pacientes de 65 años o más y los pacientes más jóvenes.
TAGRISSO en combinación con pemetrexed y quimioterapia basada en platino
De los 276 pacientes con deleción del exón 19 de EGFR o mutación positiva del exón 21 L858R, con NSCLC localmente avanzado o metastásico tratados con TAGRISSO en combinación con pemetrexed y quimioterapia basada en platino, 104 pacientes tenían ≥65 años y 23 pacientes tenían ≥75 años de edad [ver Reacciones adversas (6.1)]. El análisis exploratorio sugiere una mayor incidencia de reacciones adversas de Grado 3 o superior (68% vs 61%) y modificaciones de dosis más frecuentes para reacciones adversas (55% vs 43%) en pacientes de 65 años o más en comparación con aquellos menores de 65 años. Los estudios clínicos de TAGRISSO en combinación con pemetrexed y quimioterapia basada en platino no incluyeron un número suficiente de pacientes de 65 años o más para determinar si responden de manera diferente a los pacientes más jóvenes.
8.6 Insuficiencia renal
No se recomienda el ajuste de la dosis en pacientes con aclaramiento de creatinina (CLcr) de 15 a 89 mL/min, según lo estimado por Cockcroft-Gault. No hay una dosis recomendada de TAGRISSO para pacientes con enfermedad renal en etapa terminal (CLcr <15 mL/min) [ver Farmacología clínica (12.3)].
8.7 Insuficiencia hepática
No se recomienda el ajuste de la dosis en pacientes con insuficiencia hepática leve a moderada (Child-Pugh A y B o bilirrubina total ≤ ULN y AST > ULN o bilirrubina total de 1 a 3 veces ULN y cualquier AST). No hay una dosis recomendada de TAGRISSO para pacientes con insuficiencia hepática grave (bilirrubina total entre 3 y 10 veces ULN y cualquier AST) [ver Farmacología clínica (12.3)].
11 DESCRIPCIÓN
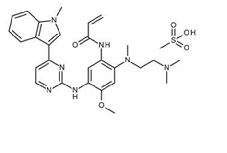
Osimertinib es un inhibidor de quinasa para uso oral. La fórmula molecular del mesilato de osimertinib es C28H33N7O2•CH4O3S, y el peso molecular es 596 g/mol. El nombre químico es sal de mesilato de N-(2-{2-dimetilaminoetil-metilamino}-4-metoxi-5-{[4-(1-metilindol-3-il)pirimidin-2-il]amino}fenil)prop-2-enamida. Osimertinib tiene la siguiente fórmula estructural (como mesilato de osimertinib):
Las tabletas TAGRISSO contienen 40 o 80 mg de osimertinib, equivalentes a 47,7 y 95,4 mg de mesilato de osimertinib, respectivamente. Los ingredientes inactivos en el núcleo de la tableta son manitol, celulosa microcristalina, celulosa de hidroxipropilo de baja sustitución y fumarato de estearilo sódico. El recubrimiento de la tableta consta de alcohol polivinílico, dióxido de titanio, macrogol 3350, talco, óxido ferroso amarillo, óxido ferroso rojo y óxido ferroso negro.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
Osimertinib es un inhibidor de la cinasa del receptor del factor de crecimiento epidérmico (EGFR), que se une irreversiblemente a ciertas formas mutantes de EGFR (T790M, L858R y deleciones del exón 19) a concentraciones aproximadamente 9 veces más bajas que el tipo salvaje. Se han identificado dos metabolitos farmacológicamente activos (AZ7550 y AZ5104 que circulan aproximadamente al 10% del fármaco original) con perfiles inhibitorios similares a osimertinib en el plasma después de la administración oral de osimertinib. AZ7550 mostró una potencia similar a osimertinib, mientras que AZ5104 mostró una mayor potencia contra la deleción del exón 19 y los mutantes T790M (aproximadamente 8 veces) y el EGFR de tipo salvaje (aproximadamente 15 veces). In vitro, osimertinib también inhibió la actividad de HER2, HER3, HER4, ACK1 y BLK a concentraciones clínicamente relevantes.
En cultivos celulares y modelos de implantación tumoral en animales, osimertinib exhibió actividad antitumoral contra líneas de NSCLC que albergaban mutaciones de EGFR (T790M/L858R, L858R, T790M/deleción del exón 19 y deleción del exón 19) y, en menor medida, amplificaciones de EGFR de tipo salvaje. Osimertinib se distribuyó al cerebro en múltiples especies animales (mono, rata y ratón) con relaciones AUC de cerebro a plasma de aproximadamente 2 después de la dosificación oral. Estos datos son consistentes con las observaciones de regresión tumoral y aumento de la supervivencia en animales tratados con osimertinib en comparación con los animales tratados con control en un modelo preclínico de xenotrasplante de metástasis intracraneal de ratón EGFR mutante (PC9; deleción del exón 19).
12.2 Farmacodinamia
Basándose en un análisis de las relaciones dosis-respuesta de exposición en el rango de dosis de 20 mg (0,25 veces la dosis recomendada) a 240 mg (3 veces la dosis recomendada), no se identificó ninguna relación aparente entre la exposición a osimertinib y la tasa de respuesta general, la duración de la respuesta y la supervivencia libre de progresión; sin embargo, había datos limitados disponibles a la dosis de 20 mg. En el mismo rango de dosis, el aumento de la exposición condujo a una mayor probabilidad de reacciones adversas, específicamente erupción cutánea, diarrea e ILD.
Electrofisiología cardíaca
El potencial de prolongación del intervalo QTc de osimertinib se evaluó en 210 pacientes que recibieron TAGRISSO 80 mg diarios en AURA2. Un análisis de tendencia central de los datos de QTcF en estado estacionario demostró que el cambio medio máximo desde el inicio fue de 16,2 mseg (límite superior del intervalo de confianza (IC) de dos caras del 90% de 17,6 mseg). Un análisis farmacocinético/farmacodinámico en AURA2 sugirió una prolongación del intervalo QTc dependiente de la concentración de 14 mseg (límite superior del intervalo de confianza (IC) de dos caras del 90% de 16 mseg) a una dosis de TAGRISSO 80 mg.
12.3 Farmacocinética
El área bajo la curva de concentración plasmática-tiempo (AUC) y la concentración plasmática máxima (Cmax) de osimertinib aumentaron proporcionalmente a la dosis en el rango de dosis de 20 a 240 mg (es decir, 0,25 a 3 veces la dosis recomendada) después de la administración oral y exhibieron una farmacocinética (PK) lineal. La administración de TAGRISSO por vía oral una vez al día dio lugar a una acumulación de aproximadamente 3 veces, con exposiciones en estado estacionario alcanzadas después de 15 días de dosificación. En estado estacionario, la relación Cmax a Cmin (concentración mínima) fue de 1,6 veces.
La farmacocinética en pacientes tratados con osimertinib en combinación con pemetrexed y quimioterapia basada en platino es similar a la de los pacientes tratados con osimertinib en monoterapia.
Absorción
El tiempo medio hasta Cmax de osimertinib fue de 6 horas (rango de 3 a 24 horas).
Tras la administración de un comprimido de TAGRISSO de 20 mg con una comida rica en grasas y calorías (que contenía aproximadamente 58 gramos de grasa y 1000 calorías), la Cmax y el AUC de osimertinib fueron comparables a los obtenidos en condiciones de ayuno.
Distribución
El volumen de distribución medio en estado estacionario (Vss/F) de osimertinib fue de 918 L. La unión a proteínas plasmáticas de osimertinib fue del 95%. Los estudios de imagen cerebral PET en voluntarios sanos y en pacientes con metástasis cerebrales muestran que osimertinib se distribuye al cerebro tras la inyección intravenosa de una microdosis de 11C-osimertinib marcado.
Eliminación
Las concentraciones plasmáticas de osimertinib disminuyeron con el tiempo y la vida media media estimada de la población de osimertinib fue de 48 horas, y el aclaramiento oral (CL/F) fue de 14,3 (L/h).
Metabolismo
Las principales vías metabólicas de osimertinib fueron la oxidación (predominantemente CYP3A) y la desalquilación in vitro. Se han identificado dos metabolitos farmacológicamente activos (AZ7550 y AZ5104) en el plasma después de la administración oral de TAGRISSO. La media geométrica de la exposición (AUC) de cada metabolito (AZ5104 y AZ7550) fue de aproximadamente el 10% de la exposición de osimertinib en estado estacionario.
Excreción
Osimertinib se elimina principalmente en las heces (68%) y en menor medida en la orina (14%). El osimertinib sin cambios representó aproximadamente el 2% de la eliminación.
Poblaciones específicas
No se observaron diferencias clínicamente significativas en la farmacocinética de osimertinib en función de la edad, el sexo, la etnia, el peso corporal, la albúmina basal, la línea de tratamiento, el estado de fumador, la función renal (aclaramiento de creatinina (CLcr) ≥15 ml/min según Cockcroft-Gault) o la insuficiencia hepática (Child-Pugh A y B, o bilirrubina total ≤ ULN y AST > ULN o bilirrubina total entre 1 y 3 veces ULN y cualquier AST). Se desconoce la farmacocinética de osimertinib en pacientes con enfermedad renal terminal (CLcr <15 ml/min) o insuficiencia hepática grave (bilirrubina total de 3 a 10 veces ULN y cualquier AST) [véase Uso en poblaciones específicas (8.6) y (8.7)].
Estudios de interacción medicamentosa
Efecto de otros medicamentos en TAGRISSO en estudios farmacocinéticos clínicos Inductores fuertes de CYP3A: El AUC en estado estacionario de osimertinib se redujo en un 78% en pacientes cuando se administró conjuntamente con rifampicina (600 mg diarios durante 21 días) [ver Interacciones medicamentosas (7.1)].
Inhibidores fuertes de CYP3A: La administración conjunta de TAGRISSO con 200 mg de itraconazol dos veces al día (un inhibidor fuerte de CYP3A4) no tuvo un efecto clínicamente significativo en la exposición de osimertinib (AUC aumentó en un 24% y Cmax disminuyó en un 20%).
Agentes reductores del ácido gástrico: La exposición de osimertinib no se vio afectada por la administración concomitante de un solo comprimido de TAGRISSO de 80 mg después de la administración de 40 mg de omeprazol durante 5 días.
Efecto de osimertinib en otros medicamentos en estudios farmacocinéticos clínicos
Sustratos de BCRP: La administración conjunta de TAGRISSO con rosuvastatina (un sustrato de BCRP) aumentó el AUC de rosuvastatina en un 35% y Cmax en un 72% [ver Interacciones medicamentosas (7.2)].
Sustratos de P-gp: La administración conjunta de TAGRISSO con fexofenadina (un sustrato de P-gp) aumentó el AUC y Cmax de fexofenadina en un 56% y un 76% después de una dosis única y un 27% y un 25% en estado estacionario, respectivamente.
Sustratos de CYP3A4: La administración conjunta de TAGRISSO con simvastatina (un sustrato de CYP3A4) no tuvo un efecto clínicamente significativo en la exposición de simvastatina.
Estudios in vitro
Vías metabólicas de CYP450: Osimertinib no inhibe CYP1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6 y 2E1. Osimertinib indujo enzimas CYP1A2.
Sistemas de transporte: Osimertinib es un sustrato de P-glicoproteína y BCRP y no es un sustrato de OATP1B1 y OATP1B3. Osimertinib es un inhibidor de BCRP y no inhibe OAT1, OAT3, OATP1B1, OATP1B3, MATE1, MATE2K y OCT2.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
Se llevó a cabo un estudio de carcinogenicidad de 2 años en ratas macho y hembra a dosis orales de osimertinib de 1, 3 y 10 mg/kg/día. Osimertinib aumentó la incidencia de hemangioma y hemangioma/hemangiosarcoma combinado en el ganglio linfático mesentérico y en todo el cuerpo a 10 mg/kg/día (0,2 veces la exposición humana basada en el AUC a la dosis clínica de 80 mg una vez al día). La administración de osimertinib a ratones transgénicos rasH2 macho y hembra por sonda gástrica diariamente durante 26 semanas no provocó un aumento de la incidencia de neoplasias a dosis de hasta 10 mg/kg/día.
Osimertinib no indujo mutaciones en la prueba de reversión de mutación bacteriana (Ames) y no fue genotóxico en células de linfoma de ratón o en la prueba de micronúcleos in vivo de rata.
Según los estudios en animales, la fertilidad masculina puede verse afectada por el tratamiento con TAGRISSO. Se observaron cambios degenerativos en los testículos de ratas y perros expuestos a osimertinib durante 1 mes o más, con evidencia de reversibilidad en la rata. Tras la administración de osimertinib a ratas durante aproximadamente 10 semanas a una dosis de 40 mg/kg, a exposiciones 0,5 veces el AUC observado a la dosis clínica recomendada de 80 mg una vez al día, se produjo una reducción de la fertilidad masculina, demostrada por un aumento de la pérdida preimplantatoria en hembras no tratadas apareadas con machos tratados.
Según los estudios en animales, la fertilidad femenina puede verse afectada por el tratamiento con TAGRISSO. En estudios de toxicidad de dosis repetidas, se observó evidencia histológica de anestro, degeneración del cuerpo lúteo en los ovarios y adelgazamiento epitelial en el útero y la vagina en ratas expuestas a osimertinib durante 1 mes o más a exposiciones 0,3 veces el AUC observado a la dosis clínica recomendada de 80 mg una vez al día. Los hallazgos en los ovarios observados después de 1 mes de dosificación mostraron evidencia de reversibilidad. En un estudio de fertilidad femenina en ratas, la administración de osimertinib desde 2 semanas antes del apareamiento hasta el día 8 de gestación a una dosis de 20 mg/kg/día (aproximadamente 1,5 veces la Cmax a la dosis recomendada de 80 mg una vez al día) no tuvo efectos en el ciclo estral o en el número de hembras que quedaron embarazadas, pero provocó muertes embrionarias tempranas. Estos hallazgos mostraron evidencia de reversibilidad cuando las hembras se aparearon 1 mes después de la interrupción del tratamiento.
13.2 Toxicología y/o Farmacología Animal
La administración de osimertinib provocó hallazgos histológicos de degeneración de las fibras del cristalino en el estudio de carcinogenicidad de 2 años en ratas a ≥3 mg/kg/día (exposiciones 0,2 veces la exposición humana basada en el AUC). Estos hallazgos fueron consistentes con la observación oftalmoscópica de opacidades del cristalino, que se observaron por primera vez a partir de la semana 52 y mostraron un aumento gradual de la incidencia y la gravedad con el aumento de la duración de la dosificación.
14 ESTUDIOS CLÍNICOS
14.1 Tratamiento Adyuvante del Cáncer de Pulmón de Células No Pequeñas (CPNP) en Estadio Temprano Positivo para la Mutación EGFR
La eficacia de TAGRISSO se demostró en un ensayo aleatorizado, doble ciego, controlado con placebo (ADAURA [NCT02511106]) para el tratamiento adyuvante de pacientes con CPNP positivo para la mutación EGFR con deleciones del exón 19 o mutación L858R del exón 21 que habían tenido una resección tumoral completa, con o sin quimioterapia adyuvante previa. Los pacientes elegibles con tumores resecables (estadios IB – IIIA según la 7ma edición de la Comisión Conjunta Americana sobre el Cáncer [AJCC]) debían tener una histología predominantemente no escamosa y deleciones del exón 19 o mutaciones L858R del exón 21 EGFR identificadas prospectivamente a partir del tejido tumoral en un laboratorio central mediante la prueba de mutación EGFR cobas®. Los pacientes con enfermedad cardíaca clínicamente significativa no controlada, antecedentes de ILD/neumonitis o que recibieron tratamiento con algún inhibidor de la cinasa EGFR no fueron elegibles para el estudio.
Los pacientes fueron aleatorizados (1:1) para recibir TAGRISSO 80 mg por vía oral una vez al día o placebo después de la recuperación de la cirugía y la quimioterapia adyuvante estándar si se administró. Los pacientes que no recibieron quimioterapia adyuvante fueron aleatorizados dentro de las 10 semanas y los pacientes que recibieron quimioterapia adyuvante fueron aleatorizados dentro de las 26 semanas después de la cirugía. La aleatorización se estratificó por tipo de mutación (deleciones del exón 19 o mutaciones L858R del exón 21), raza (asiática o no asiática) y estadificación pTNM (IB o II o IIIA) según la 7ma edición de AJCC. El tratamiento se administró durante 3 años o hasta la recurrencia de la enfermedad o la toxicidad inaceptable.
La principal medida de resultado de eficacia fue la supervivencia libre de enfermedad (SLE, definida como la reducción del riesgo de recurrencia de la enfermedad o muerte) en pacientes con CPNP en estadio II – IIIA determinada por la evaluación del investigador. Las medidas de resultado de eficacia adicionales incluyeron la SLE en la población general (pacientes con CPNP en estadio IB – IIIA) y la supervivencia general (SG) en pacientes con CPNP en estadio II – IIIA y en la población general.
Se aleatorizaron un total de 682 pacientes a TAGRISSO (n=339) o placebo (n=343). La edad media fue de 63 años (rango 30-86 años); el 70% eran mujeres; el 64% eran asiáticos y el 72% nunca habían fumado. El estado de rendimiento de la Organización Mundial de la Salud (OMS) al inicio del estudio fue 0 (64%) o 1 (36%); el 31% tenía estadio IB, el 35% II y el 34% IIIA. Con respecto al estado de la mutación EGFR, el 55% fueron deleciones del exón 19 y el 45% fueron mutaciones L858R del exón 21. La mayoría (60%) de los pacientes recibieron quimioterapia adyuvante antes de la aleatorización (27% IB; 70% II, 79% IIIA).
ADAURA demostró una diferencia estadísticamente significativa en la SLE para los pacientes tratados con TAGRISSO en comparación con los pacientes tratados con placebo. El análisis final de la SG demostró una mejora estadísticamente significativa en la SG para los pacientes tratados con TAGRISSO en comparación con los pacientes tratados con placebo. La SG mediana no se alcanzó en ninguno de los brazos. En la población general (IB-IIIA), el tiempo de seguimiento medio fue de 61,5 meses en ambos brazos de tratamiento. Los resultados de eficacia de ADAURA se resumen en la Tabla 14 y las Figuras 1 y 2, respectivamente.
|
POBLACIÓN EN ESTADIO II-IIIA |
POBLACIÓN EN ESTADIO IB-IIIA |
|||
|
Parámetro de eficacia |
TAGRISSO |
PLACEBO |
TAGRISSO |
PLACEBO |
|
Supervivencia libre de enfermedad (SLE) |
||||
|
Eventos de SLE (%) |
26 (11) |
130 (55) |
37 (11) |
159 (46) |
|
Enfermedad recurrente (%) |
26 (11) |
129 (54) |
37 (11) |
157 (46) |
|
Muertes (%) |
0 |
1 (0.4) |
0 |
2 (0.6) |
|
Mediana DFS, meses (IC 95%) |
NR (38.8, NE) |
19.6 (16.6, 24.5) |
NR (NE, NE) |
27.5 (22.0, 35.0) |
|
0.17 (0.12, 0.23) |
0.20 (0.15, 0.27) |
|||
|
<0.0001 |
<0.0001 |
|||
|
Supervivencia general (SG) |
||||
|
Número de muertes (%) |
35 (15) |
65 (27) |
42 (12) |
82 (24) |
|
0.49 (0.33, 0.73) |
0.49 (0.34, 0.70) |
|||
|
0.0004 |
<0.0001 |
|||
|
Los resultados de DFS se basan en la evaluación del investigador. IC=Intervalo de confianza; NE=No estimable; NR=No alcanzado |
||||
Figura 1. Curvas de Kaplan-Meier de Supervivencia Libre de Enfermedad (Población General) por Evaluación del Investigador en ADAURA
Figura 2. Curvas de Kaplan-Meier de Supervivencia General (Población General) en ADAURA
En un análisis exploratorio de los sitios de recaída, la proporción de pacientes con afectación del SNC en el momento de la recurrencia de la enfermedad fue de 5 pacientes (1,5%) en el brazo de TAGRISSO y 34 pacientes (10%) en el brazo de placebo.
14.2 Carcinoma de células no pequeñas (CCNP) con mutación positiva del EGFR localmente avanzado, irresecable (Estadio III)
La eficacia de TAGRISSO se evaluó en el ensayo LAURA [NCT03521154], un estudio doble ciego, aleatorizado, controlado con placebo en pacientes adultos con CCNP en estadio III localmente avanzado, irresecable, con deleciones del exón 19 o mutaciones L858R del exón 21 del EGFR cuya enfermedad no había progresado durante o después de la terapia de quimiorradiación definitiva basada en platino. Los pacientes elegibles fueron aleatorizados dentro de los 42 días previos a la aleatorización del estudio y tenían un estado de rendimiento de la OMS de 0 o 1. Antes de la inscripción en el estudio, los pacientes recibieron regímenes de quimiorradiación concurrente (cCRT) o quimiorradiación secuencial (sCRT), donde al menos 2 ciclos cada 3 semanas o 5 dosis de quimioterapia semanal basada en platino y radiación definitiva debían completarse ≤6 semanas antes de la aleatorización. El estudio excluyó a los pacientes que habían presentado progresión de la enfermedad durante o después de la terapia de quimiorradiación definitiva y a los pacientes con neumonitis de grado ≥2 después de la terapia de quimiorradiación o cualquier ILD antes de la terapia de quimiorradiación. Se requirió que las muestras de tejido tumoral del paciente tuvieran una deleción del exón 19 o una mutación L858R del exón 21 del EGFR, según lo identificado por la prueba de mutación del EGFR cobas® v2 en un laboratorio central o por una prueba aprobada por la FDA en un laboratorio certificado o acreditado por CLIA.
Los pacientes fueron aleatorizados (2:1) para recibir TAGRISSO 80 mg por vía oral una vez al día o placebo hasta la progresión de la enfermedad o la toxicidad inaceptable. La aleatorización se estratificó por la estrategia de quimiorradiación previa (cCRT frente a sCRT), la estadificación tumoral previa a la quimiorradiación (IIIA frente a IIIB/IIIC) y por región (China frente al resto del mundo). Después de la progresión, a todos los pacientes se les ofreció TAGRISSO de etiqueta abierta si, en opinión del profesional sanitario que los atiende, había un beneficio clínico esperado. Las evaluaciones tumorales se realizaron cada 8 semanas hasta la semana 48, y luego cada 12 semanas.
La principal medida de resultado de eficacia fue la supervivencia libre de progresión (SLP) evaluada mediante revisión central independiente ciega (BICR). Las medidas de resultado de eficacia adicionales incluyeron la OS y la SLP del SNC.
Se aleatorizó un total de 216 pacientes (2:1) a TAGRISSO (n=143) o placebo (n=73). Las características de la población del estudio fueron: edad media de 63 años (rango de 36 a 84 años); 13% ≥75 años; 61% mujeres; 82% asiáticos, 14% blancos, 1,4% indios americanos o nativos de Alaska y 2,3% habían informado de su raza como otra; 6% eran hispanos o latinos; y 70% nunca habían fumado. El estado de rendimiento de la OMS basal fue 0 (51%) o 1 (49%); 35% de los pacientes tenían CCNP en estadio IIIA, 49% de los pacientes tenían CCNP en estadio IIIB y 16% de los pacientes tenían CCNP en estadio IIIC; 4% tenían histología escamosa y 96% tenían histología no escamosa; 54% tenían deleciones del exón 19 y 45% tenían mutaciones L858R del exón 21. Antes de la aleatorización, el 89% de los pacientes recibieron cCRT y el 11% de los pacientes recibieron sCRT. Todos los pacientes recibieron quimioterapia basada en platino (55% quimioterapia basada en carboplatino y 44% quimioterapia basada en cisplatino). La dosis total media de radiación fue de 60 Gy para los pacientes de ambos brazos.
LAURA demostró una mejora estadísticamente significativa en la SLP para los pacientes aleatorizados a TAGRISSO en comparación con el placebo. Los resultados de eficacia de LAURA se resumen en la Tabla 15, y la curva de Kaplan-Meier para la SLP se muestra en la Figura 3. Si bien los resultados de la OS fueron inmaduros en el análisis actual, con el 36% de las muertes preespecificadas para el análisis final informado, no se observó ninguna tendencia hacia un detrimento.
| Parámetro de eficacia | TAGRISSO (N=143) |
Placebo (N=73) |
|---|---|---|
|
Supervivencia libre de progresión |
||
|
Eventos de SLP (%) |
57 (40) |
63 (86) |
|
53 (37) |
62 (85) |
|
4 (3) |
1 (1) |
|
Mediana de PFS en meses (IC del 95%) |
39.1 (31.5, NE) |
5.6 (3.7, 7.4) |
|
0.16 (0.10, 0.24) |
||
|
<0.001 |
||
|
Tasa de respuesta general¶ |
||
|
ORR, % (IC del 95%) |
54 (45, 62) |
26 (17, 38) |
|
Los resultados de PFS y ORR se evaluaron mediante BICR. |
||
Figura 3. Curvas de Kaplan-Meier de la SPP según la evaluación por BICR en LAURA
Todos los pacientes se sometieron a resonancia magnética (RM) del cerebro al inicio y en cada seguimiento durante el estudio. En un análisis exploratorio de los sitios de recaída, la proporción de pacientes con nuevas lesiones del SNC en el momento de la progresión de la enfermedad fue de 17/143 pacientes (12%) en el brazo de TAGRISSO y de 26/73 pacientes (36%) en el brazo de placebo.
14.3 Cáncer de pulmón de células no pequeñas metastásico positivo para la mutación del EGFR previamente no tratado
FLAURA – Monoterapia con TAGRISSO
La eficacia de TAGRISSO se demostró en un ensayo aleatorizado, multicéntrico, doble ciego, controlado con activo (FLAURA [NCT02296125]) en pacientes con mutaciones positivas del EGFR en el exón 19 o en el exón 21 L858R, con cáncer de pulmón de células no pequeñas metastásico, que no habían recibido tratamiento sistémico previo para la enfermedad metastásica. Los pacientes debían tener enfermedad medible según RECIST v1.1, un estado de rendimiento de la OMS de 0-1 y mutaciones del EGFR en el exón 19 o en el exón 21 L858R en el tumor identificadas prospectivamente mediante la prueba de mutación del EGFR cobas® en un laboratorio central o mediante un ensayo de investigación en un laboratorio certificado o acreditado por CLIA. Los pacientes con metástasis del SNC que no requirieran esteroides y con estado neurológico estable durante al menos dos semanas después de la finalización de la cirugía definitiva o la radioterapia eran elegibles. Los pacientes fueron evaluados a discreción del investigador para detectar metástasis del SNC si tenían antecedentes de, o sospecha de, metástasis del SNC al inicio del estudio.
Los pacientes fueron aleatorizados (1:1) para recibir TAGRISSO 80 mg por vía oral una vez al día o para recibir gefitinib 250 mg por vía oral una vez al día o erlotinib 150 mg por vía oral una vez al día hasta la progresión de la enfermedad o la toxicidad inaceptable. La aleatorización se estratificó por tipo de mutación del EGFR (deleciones del exón 19 o mutación del exón 21 L858R) y etnia (asiática o no asiática). Los pacientes aleatorizados al brazo de control recibieron TAGRISSO en el momento de la progresión de la enfermedad si las muestras tumorales dieron positivo para la mutación T790M del EGFR. La principal medida de resultado de eficacia fue la supervivencia libre de progresión (SPP), según la evaluación del investigador. Las medidas de resultado de eficacia adicionales incluyeron la SO y la tasa de respuesta global (TRG).
Se aleatorizaron un total de 556 pacientes a TAGRISSO (n=279) o a control (gefitinib n=183; erlotinib n=94). La edad media fue de 64 años (rango 26-93 años); el 54% tenía <65 años de edad; el 63% eran mujeres; el 62% eran asiáticos y el 64% nunca habían fumado. El estado de rendimiento de la OMS al inicio fue 0 (41%) o 1 (59%); el 5% tenía estadio IIIb y el 95% tenía estadio IV; y el 7% recibió quimioterapia citotóxica sistémica previa como terapia neoadyuvante o adyuvante. Con respecto a las pruebas tumorales del EGFR, el 63% fueron deleciones del exón 19 y el 37% fueron L858R del exón 21; 5 pacientes (<1%) también tenían una mutación T790M de novo concomitante. El estado de la mutación del EGFR se confirmó centralmente utilizando la prueba de mutación del EGFR cobas® en el 90% de los pacientes. En el momento del corte final de datos, de los aleatorizados a TAGRISSO y al brazo de erlotinib o gefitinib a elección del investigador, 133 (48%) y 180 (65%) pacientes habían recibido al menos un tratamiento posterior, respectivamente. De los 180 pacientes aleatorizados a erlotinib o gefitinib que recibieron tratamiento posterior, 85 (47%) pacientes recibieron TAGRISSO como primera terapia posterior.
FLAURA demostró una mejora estadísticamente significativa en la SPP para los pacientes aleatorizados a TAGRISSO en comparación con erlotinib o gefitinib (ver Tabla 16 y Figura 4). El análisis final de la supervivencia global demostró una mejora estadísticamente significativa en la supervivencia global en los pacientes aleatorizados a TAGRISSO en comparación con erlotinib o gefitinib (ver Tabla 16 y Figura 4).
| Parámetro de eficacia | TAGRISSO (N=279) |
TKI del EGFR (gefitinib o erlotinib) (N=277) |
|---|---|---|
|
Supervivencia libre de progresión (SPP) |
||
|
Eventos de SPP (%) |
136 (49) |
206 (74) |
|
Enfermedad progresiva (%) |
125 (45) |
192 (69) |
|
Muerte* (%) |
11 (4) |
14 (5) |
|
SPP mediana en meses (IC del 95%) |
18,9 (15,2, 21,4) |
10,2 (9,6, 11,1) |
|
0.46 (0.37, 0.57) |
||
|
<0.0001 |
||
|
Supervivencia General (SG) |
||
|
Número de muertes (%) |
155 (56) |
166 (60) |
|
SG mediana en meses (95% CI) |
38.6 (34.5, 41.8) |
31.8 (26.6, 36.0) |
|
0.80 (0.64, 1.00) |
||
|
0.0462 |
||
|
Tasa de Respuesta General (TRG)¶ |
||
|
TRG, % (95% CI)† |
77 (71, 82) |
69 (63, 74) |
|
Respuesta completa, % |
2 |
1 |
|
Respuesta parcial, % |
75 |
68 |
|
Duración de la Respuesta (DoR)¶ |
||
|
Mediana en meses (95% CI) |
17.6 (13.8, 22.0) |
9.6 (8.3, 11.1) |
Figura 4. Curvas de Kaplan-Meier de PFS por evaluación del investigador en FLAURA
En un análisis de apoyo de PFS de acuerdo con la revisión central independiente ciega (BICR), la PFS mediana fue de 17,7 meses en el brazo de TAGRISSO en comparación con 9,7 meses en el brazo de comparador de EGFR TKI (HR = 0,45; IC del 95%: 0,36, 0,57).
Figura 5. Curvas de Kaplan-Meier de la supervivencia general en FLAURA
De 556 pacientes, 200 pacientes (36%) tuvieron exploraciones cerebrales basales revisadas por BICR; esto incluyó 106 pacientes en el brazo de TAGRISSO y 94 pacientes en el brazo de elección del investigador de EGFR TKI. De estos 200 pacientes, 41 tenían lesiones del SNC medibles según RECIST v1.1. Los resultados de los análisis exploratorios preespecificados de ORR del SNC y la duración de la respuesta (DoR) por BICR en el subconjunto de pacientes con lesiones del SNC medibles en la línea de base se resumen en la Tabla 13.
|
TAGRISSO N=22 |
EGFR TKI (gefitinib o erlotinib) N=19 |
|
|
Evaluación de la respuesta del tumor del SNC* |
||
|
ORR del SNC, % (IC del 95%) |
77 (55, 92) |
63 (38, 84) |
|
Respuesta completa, % |
18 |
0 |
|
Duración de la respuesta del SNC† |
||
|
Número de respondedores |
17 |
12 |
|
Duración de la respuesta ≥6 meses, % |
88 |
50 |
|
Duración de la respuesta ≥12 meses, % |
47 |
33 |
14.4 Carcinoma de células no pequeñas (CCNP) metastásico o localmente avanzado con mutación positiva de EGFR no tratado previamente
FLAURA2 – TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino
La eficacia de TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino se demostró en un ensayo aleatorizado, multicéntrico, abierto (FLAURA2 [NCT04035486]) en pacientes con CCNP metastásico o localmente avanzado con mutación positiva de deleción del exón 19 o L858R del exón 21 de EGFR, que no habían recibido tratamiento sistémico previo para la enfermedad avanzada. Los pacientes debían tener enfermedad medible según RECIST v1.1, un estado de rendimiento de la OMS de 0-1 y deleciones del exón 19 de EGFR o mutaciones L858R del exón 21 identificadas mediante la prueba de mutación de EGFR cobas® v2 realizada prospectivamente en muestras de tejido en un laboratorio central o mediante una prueba local realizada en un laboratorio certificado o acreditado por CLIA.
Los pacientes se aleatorizaron (1:1) a uno de los siguientes brazos de tratamiento:
- •
- TAGRISSO (80 mg) por vía oral una vez al día con pemetrexed (500 mg/m2) y la elección del investigador de cisplatino (75 mg/m2) o carboplatino (AUC5) administrados por vía intravenosa el día 1 de los ciclos de 21 días durante 4 ciclos, seguido de TAGRISSO (80 mg) por vía oral una vez al día y pemetrexed (500 mg/m2) administrados por vía intravenosa cada 3 semanas
- •
- TAGRISSO (80 mg) por vía oral una vez al día
La aleatorización se estratificó por raza (chino/asiático, no chino/asiático o no asiático), estado de rendimiento de la OMS (0 o 1) y método de prueba de tejido (central o local). Los pacientes recibieron terapia del estudio hasta la intolerancia a la terapia, o hasta que el investigador determinó que el paciente ya no experimentaba beneficio clínico.
La supervivencia libre de progresión, evaluada por el investigador según RECIST 1.1, fue la medida de resultado de eficacia primaria. La supervivencia general fue una medida de resultado secundaria clave. Las medidas de resultado de eficacia adicionales incluyeron la RTO y la DTR.
Se aleatorizaron un total de 557 pacientes a TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino (n=279) o TAGRISSO en monoterapia (n=278). La edad media fue de 61 años (rango 26-85 años); el 39% tenía ≥65 años y el 8% tenía ≥75 años de edad; el 61% eran mujeres; el 64% eran asiáticos y el 66% nunca habían fumado. El PS de la OMS basal fue 0 (37%) o 1 (63%); el 4% tenía CCNP localmente avanzado y el 96% tenía CCNP metastásico; y el 1,8% recibió quimioterapia citotóxica sistémica previa como terapia neoadyuvante o adyuvante. Con respecto a las pruebas tumorales de EGFR, el 61% de los tumores tenían deleciones del exón 19 y el 38% tenían mutaciones L858R del exón 21; el 0,7% de los pacientes tenían tumores con deleciones del exón 19 y L858R del exón 21. El estado de la mutación de EGFR se confirmó centralmente utilizando la prueba de mutación de EGFR cobas® v2 en el 96% de los pacientes.
FLAURA2 demostró una mejora estadísticamente significativa en la SLP para los pacientes aleatorizados a TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino en comparación con TAGRISSO en monoterapia (ver Tabla 18 y Figura 6). Si bien los resultados de la SG fueron inmaduros en el análisis actual, con el 45% de las muertes preespecificadas para el análisis final informado, no se observó ninguna tendencia hacia un detrimento.
| Parámetro de eficacia | TAGRISSO con pemetrexed y quimioterapia a base de platino (N=279) |
TAGRISSO (N=278) |
|---|---|---|
|
||
|
Supervivencia libre de progresión (SLP)* |
||
|
Eventos de SLP (%) |
120 (43) |
166 (60) |
|
95 (34) |
158 (57) |
|
25 (9) |
8 (2.9) |
|
SLP mediana en meses (IC del 95%) |
25.5 (24.7, NE) |
16.7 (14.1, 21.3) |
|
Razón de riesgos (IC del 95%)‡ |
0.62 (0.49, 0.79) |
|
|
<0.0001 |
||
|
Tasa de respuesta general (ORR) |
||
|
ORR, % (IC del 95%) |
77 (71, 82) |
69 (63, 74) |
|
0.4 |
0.4 |
|
76 |
68 |
|
Duración de la respuesta (DoR) |
||
|
Mediana en meses (IC del 95%) |
24.9 (22.1, NE) |
17.9 (15.2, 20.9) |
|
NE=No estimable; NR=No alcanzado |
||
Figura 6. Curvas de Kaplan-Meier de PFS por evaluación del investigador en FLAURA2
Todos los pacientes tenían disponibles exploraciones cerebrales basales revisadas por BICR utilizando RECIST modificado; 78/557 (14%) pacientes tenían lesiones medibles en el SNC. Los resultados de los análisis exploratorios preespecificados de ORR y DoR del SNC por BICR se resumen en la Tabla 19.
|
||
|
Parámetro de eficacia |
Lesiones medibles en el SNC |
|
|
TAGRISSO con pemetrexed y quimioterapia basada en platino |
TAGRISSO |
|
|
Evaluación de la respuesta del tumor en el SNC* |
||
|
ORR del SNC, % (IC del 95%) |
80 (64, 91) |
76 (60, 89) |
|
48 |
16 |
|
33 |
61 |
|
Duración de la respuesta en el SNC |
||
|
Número de respondedores |
32 |
29 |
|
75 |
50 |
|
65 |
34 |
14.5 Carcinoma de células no pequeñas (CCNP) metastásico positivo para la mutación EGFR T790M previamente tratado
La eficacia de TAGRISSO se demostró en un ensayo aleatorizado, multicéntrico, abierto, controlado con activo en pacientes con CCNP metastásico positivo para la mutación EGFR T790M que habían progresado con terapia sistémica previa, incluido un TKI de EGFR (AURA3). Todos los pacientes debían tener CCNP positivo para la mutación EGFR T790M identificado mediante la prueba de mutación EGFR cobas® realizada en un laboratorio central antes de la aleatorización.
Se aleatorizó un total de 419 pacientes en una proporción de 2:1 para recibir TAGRISSO (n=279) o quimioterapia doble basada en platino (n=140). La aleatorización se estratificó por origen étnico (asiático frente a no asiático). Los pacientes del brazo de TAGRISSO recibieron TAGRISSO 80 mg por vía oral una vez al día hasta la intolerancia a la terapia, la progresión de la enfermedad o la determinación del investigador de que el paciente ya no se beneficiaba del tratamiento. Los pacientes del brazo de quimioterapia recibieron pemetrexed 500 mg/m2 con carboplatino AUC5 o pemetrexed 500 mg/m2 con cisplatino 75 mg/m2 el día 1 de cada ciclo de 21 días durante un máximo de 6 ciclos. Los pacientes cuya enfermedad no había progresado después de cuatro ciclos de quimioterapia basada en platino podían haber recibido terapia de mantenimiento con pemetrexed (pemetrexed 500 mg/m2 el día 1 de cada ciclo de 21 días).
La principal medida de resultado de eficacia fue la SP según los Criterios de Evaluación de Respuesta en Tumores Sólidos (RECIST v1.1) mediante la evaluación del investigador. Las medidas de resultado de eficacia adicionales incluyeron la TR, la DuR y la SO. Los pacientes aleatorizados al brazo de quimioterapia que habían presentado progresión radiológica según la evaluación del investigador y el BICR pudieron cambiar al tratamiento con TAGRISSO.
Las características demográficas y de la enfermedad de referencia de la población total del ensayo fueron: edad media de 62 años (rango: 20-90 años), ≥75 años (15%), mujeres (64%), blancas (32%), asiáticas (65%), nunca fumadoras (68%), estado de rendimiento de la OMS 0 o 1 (100%). El 54% de los pacientes presentaban metástasis viscerales extratorácicas, incluido el 34% con metástasis en el sistema nervioso central (SNC) (incluido el 11% con metástasis mensurables en el SNC) y el 23% con metástasis hepáticas. El 42% de los pacientes presentaban enfermedad ósea metastásica.
En AURA3, se observó una mejora estadísticamente significativa en la SP en los pacientes aleatorizados a TAGRISSO en comparación con la quimioterapia (véase la tabla 20 y la figura 7). No se observó ninguna diferencia estadísticamente significativa entre los brazos de tratamiento en el análisis final de la SO. En el momento del análisis final de la SO, 99 pacientes (71%) aleatorizados a quimioterapia habían cambiado al tratamiento con TAGRISSO.
| Parámetro de eficacia | TAGRISSO (N=279) |
Quimioterapia (N=140) |
|
|---|---|---|---|
|
Supervivencia libre de progresión |
|||
|
Número de eventos (%) |
140 (50) |
110 (79) |
|
|
Enfermedad progresiva (%) |
129 (46) |
104 (74) |
|
|
Muerte (%)* |
11 (4) |
6 (4) |
|
|
SP mediana en meses (IC del 95%) |
10.1 (8.3, 12.3) |
4.4 (4.2, 5.6) |
|
|
0.30 (0.23,0.41) |
|||
|
<0.001 |
|||
|
Supervivencia global |
|||
|
Número de muertes (%) |
188 (67) |
93 (66) |
|
|
OS mediana en meses (IC del 95%) |
26.8 (23.5, 31.5) |
22.5 (20.2, 28.8) |
|
|
0.87 (0.67, 1.12) |
|||
|
0.277 |
|||
|
Tasa de respuesta general¶ |
|||
|
ORR, % (IC del 95%) |
65 (59, 70) |
29 (21, 37) |
|
|
Respuesta completa, % |
1 |
1 |
|
|
Respuesta parcial, % |
63 |
27 |
|
|
<0.001 |
|||
|
Duración de la respuesta (DoR) |
|||
|
Mediana en meses (IC del 95%) |
11.0 (8.6, 12.6) |
4.2 (3.0, 5.9) |
|
Figura 7. Curvas de Kaplan-Meier de PFS por evaluación del investigador en AURA3
En un análisis de apoyo de PFS según BICR, la PFS mediana fue de 11 meses en el brazo de TAGRISSO en comparación con 4,2 meses en el brazo de quimioterapia (HR 0,28; IC del 95%: 0,20, 0,38).
De 419 pacientes, 205 (49%) tuvieron exploraciones cerebrales basales revisadas por BICR; esto incluyó 134 (48%) pacientes en el brazo de TAGRISSO y 71 (51%) pacientes en el brazo de quimioterapia. La evaluación de la eficacia del SNC según RECIST v1.1 se realizó en el subgrupo de 46/419 (11%) pacientes identificados por BICR que tenían lesiones del SNC medibles en una exploración cerebral basal. Los resultados se resumen en la Tabla 21.
|
TAGRISSO N=30 |
Quimioterapia N=16 |
|
|
ORR del SNC, % (IC del 95%) |
57 (37, 75) |
25 (7, 52) |
|
Respuesta completa, % |
7 |
0 |
|
Número de respondedores |
17 |
4 |
|
Duración de la respuesta ≥6 meses, % |
47 |
0 |
|
Duración de la respuesta ≥9 meses, % |
12 |
0 |
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Comprimidos de 80 mg: comprimidos beige, ovalados y biconvexos marcados con “AZ 80” en una cara y lisos en la otra. Se presentan en frascos de 30 (NDC 0310-1350-30).
Comprimidos de 40 mg: comprimidos beige, redondos y biconvexos marcados con “AZ 40” en una cara y lisos en la otra. Se presentan en frascos de 30 (NDC 0310-1349-30).
Conservar los frascos de TAGRISSO a 25 °C (77 °F). Se permiten desviaciones de temperatura de entre 15 y 30 °C (59 y 86 °F) [ver USP Controlled Room Temperature].
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente que lea la etiqueta del paciente aprobada por la FDA (Información para el paciente).
Enfermedad pulmonar intersticial/Neumonitis
- •
- Informe a los pacientes sobre los riesgos de ILD grave o fatal, incluida la neumonitis. Aconseje a los pacientes que se pongan en contacto con su proveedor de atención médica de inmediato para informar sobre cualquier síntoma respiratorio nuevo o que empeore [ver Advertencias y precauciones (5.1)].
Prolongación del intervalo QTc
- •
- Informe a los pacientes sobre los síntomas que pueden ser indicativos de una prolongación significativa del QTc, que incluyen mareos, aturdimiento y síncope. Aconseje a los pacientes que informen estos síntomas y que informen a su médico sobre el uso de cualquier medicamento para el corazón o la presión arterial [ver Advertencias y precauciones (5.2)].
Cardiomiopatía
- •
- Informe a los pacientes que TAGRISSO puede causar cardiomiopatía. Aconseje a los pacientes que informen de inmediato cualquier signo o síntoma de insuficiencia cardíaca a su proveedor de atención médica [ver Advertencias y precauciones (5.3)].
Queratitis
- •
- Aconseje a los pacientes que se pongan en contacto con su proveedor de atención médica de inmediato si desarrollan síntomas oculares (inflamación ocular, lagrimeo, sensibilidad a la luz, dolor ocular, ojo rojo o cambios en la visión) [ver Advertencias y precauciones (5.4)].
Eritema multiforme mayor, síndrome de Stevens-Johnson y necrólisis epidérmica tóxica
- •
- Informe a los pacientes sobre los signos y síntomas que pueden ser indicativos de EMM, SJS o TEN. Aconseje a los pacientes que se pongan en contacto con su proveedor de atención médica de inmediato si desarrollan lesiones en diana o ampollas graves o descamación de la piel [ver Advertencias y precauciones (5.5)].
Vasculitis cutánea
- •
- Informe a los pacientes sobre los signos y síntomas que pueden ser indicativos de vasculitis cutánea. Aconseje a los pacientes que se pongan en contacto con su proveedor de atención médica de inmediato si desarrollan múltiples pápulas rojas no blanqueables en los antebrazos, las piernas o las nalgas, o urticaria grande en el tronco que no desaparece en 24 horas y desarrolla un aspecto amoratado [ver Advertencias y precauciones (5.6)].
Anemia aplásica
- •
- Informe a los pacientes sobre los signos y síntomas de anemia aplásica, que incluyen, entre otros, fiebre nueva o persistente, hematomas, sangrado, palidez, infección, cansancio o debilidad. Aconseje a los pacientes que se pongan en contacto con su proveedor de atención médica de inmediato si desarrollan signos y síntomas sugestivos de anemia aplásica [ver Advertencias y precauciones (5.7)].
Toxicidad embrio-fetal
- •
- Aconseje a las mujeres embarazadas y a las mujeres en edad fértil sobre el riesgo potencial para el feto. Aconseje a las mujeres que informen a su proveedor de atención médica si quedan embarazadas o si sospechan de un embarazo mientras toman TAGRISSO [ver Advertencias y precauciones (5.8) y Uso en poblaciones específicas (8.1)].
Mujeres y hombres en edad fértil
- •
- Aconseje a las mujeres en edad fértil que utilicen métodos anticonceptivos eficaces durante el tratamiento con TAGRISSO y durante 6 semanas después de la dosis final [ver Uso en poblaciones específicas (8.3)].
- •
- Aconseje a los hombres que utilicen métodos anticonceptivos eficaces durante el tratamiento y durante 4 meses después de la dosis final de TAGRISSO [ver Uso en poblaciones específicas (8.3)].
Lactancia
- •
- Aconseje a las mujeres que no den el pecho durante el tratamiento con TAGRISSO y durante 2 semanas después de la dosis final [ver Uso en poblaciones específicas (8.2)].
Distribuido por:
AstraZeneca Pharmaceuticals LP
Wilmington, DE 19850
TAGRISSO es una marca registrada del grupo de empresas AstraZeneca.
©AstraZeneca 2024
INSERTO PARA EL PACIENTE
|
INFORMACIÓN PARA EL PACIENTE |
||
|
¿Cuál es la información más importante que debo saber sobre TAGRISSO? TAGRISSO puede causar efectos secundarios graves, que incluyen:
|
||
|
|
|
|
Vea “¿Cuáles son los posibles efectos secundarios de TAGRISSO?” para obtener más información sobre los efectos secundarios. |
||
|
¿Qué es TAGRISSO? TAGRISSO es un medicamento recetado que se usa para tratar a adultos con cáncer de pulmón de células no pequeñas (CPCNP) que tiene ciertos genes anormales del receptor del factor de crecimiento epidérmico (EGFR):
No se sabe si TAGRISSO es seguro y eficaz en niños. |
||
|
Antes de tomar TAGRISSO, informe a su proveedor de atención médica sobre todas sus afecciones médicas, incluso si:
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas o los suplementos herbales. Dígale especialmente a su proveedor de atención médica si toma un medicamento para el corazón o la presión arterial. |
||
|
¿Cómo debo tomar TAGRISSO?
|
||
|
¿Cuáles son los posibles efectos secundarios de TAGRISSO? TAGRISSO puede causar efectos secundarios graves:
Los efectos secundarios más comunes de TAGRISSO cuando se administra solo incluyen: |
||
|
|
|
|
Los efectos secundarios más comunes de TAGRISSO en combinación con pemetrexed y quimioterapia a base de platino incluyen: |
||
|
|
|
|
Informe a su proveedor de atención médica si tiene algún efecto secundario que le moleste o que no desaparezca. Estos no son todos los posibles efectos secundarios de TAGRISSO. Para obtener más información, consulte a su proveedor de atención médica o farmacéutico. Llame a su médico para obtener asesoramiento médico sobre los efectos secundarios. Puede informar los efectos secundarios a la FDA al 1-800-FDA-1088. |
||
|
¿Cómo debo almacenar TAGRISSO?
|
||
|
Información general sobre el uso seguro y eficaz de TAGRISSO. Los medicamentos a veces se recetan para fines distintos a los enumerados en un prospecto de información para el paciente. No use TAGRISSO para una afección para la que no fue prescrito. No le dé TAGRISSO a otras personas, incluso si tienen los mismos síntomas que usted. Puede dañarlos. Puede pedir a su farmacéutico o proveedor de atención médica información sobre TAGRISSO escrita para profesionales de la salud. |
||
|
¿Cuáles son los ingredientes de TAGRISSO? Ingrediente activo: osimertinib Ingredientes inactivos: manitol, celulosa microcristalina, celulosa hidroxipropil de baja sustitución y fumarato de estearilo sódico. El recubrimiento de la tableta contiene: alcohol polivinílico, dióxido de titanio, macrogol 3350, talco, óxido ferroso amarillo, óxido ferroso rojo y óxido ferroso negro. Distribuido por: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850 © AstraZeneca 2024 Para más información, vaya a www.Tagrisso.com o llame al 1-800-236-9933. |
||
Esta Información para el Paciente ha sido aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos. Revisado: 09/2024
PANEL PRINCIPAL DE VISUALIZACIÓN DEL ENVASE/ETIQUETA – 40 mg
NDC 0310-1349-30 30 Tabletas
Tagrisso®
(osimertinib) tablets
40 mg per tablet
Rx only
AstraZeneca
PANEL PRINCIPAL DE VISUALIZACIÓN DEL ENVASE/ETIQUETA – 80 mg
NDC 0310-1350-30 30 Tabletas
Tagrisso®
(osimertinib) tablets
80 mg por tableta
Rx only
AstraZeneca