Fabricante de medicamentos: Takeda Pharmaceuticals America, Inc. (Updated: 2023-07-25)
ASPECTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN
DEXILANT (dexlansoprazol) cápsulas de liberación retardada, para administración oral
Aprobación inicial en EE. UU.: 1995 (lansoprazol)
INDICACIONES Y USO
DEXILANT es un inhibidor de la bomba de protones (IBP) indicado en pacientes de 12 años de edad o mayores para:
DOSIFICACIÓN Y ADMINISTRACIÓN
Dosis recomendada en pacientes de 12 años de edad o mayores:
- Consulte la información completa de prescripción para obtener información completa sobre la dosificación de DEXILANT por indicación y grupo de edad y ajuste de la dosis en pacientes con insuficiencia hepática. (2.1, 2.2)
Instrucciones de administración (2.3):
- Tomar sin tener en cuenta los alimentos.
- Traga entero; no mastique.
- Consulte la información completa de prescripción para obtener opciones alternativas de administración.
FORMAS Y FUERZAS DE DOSIFICACIÓN
Cápsulas de liberación retardada: 30 mg y 60 mg. (3)
CONTRAINDICACIONES
ADVERTENCIAS Y PRECAUCIONES
- Neoplasia gástrica: En adultos, la respuesta sintomática con DEXILANT no excluye la presencia de neoplasia gástrica. Considere el seguimiento adicional y las pruebas de diagnóstico. (5.1)
- Nefritis tubulointersticial aguda: Suspenda el tratamiento y evalúe a los pacientes. (5.2)
- Clostridium difficile-Diarrea asociada: La terapia con IBP puede estar asociada con un mayor riesgo. (5.3)
- Fractura ósea: La terapia con IBP a largo plazo y con múltiples dosis diarias puede estar asociada con un mayor riesgo de fracturas relacionadas con la osteoporosis de la cadera, la muñeca o la columna vertebral. (5.4)
- Reacciones adversas cutáneas graves: Suspenda al primer signo o síntoma de reacciones adversas cutáneas graves u otros signos de hipersensibilidad y considere una evaluación adicional. (5.5)
- Lupus eritematoso cutáneo y sistémico: Principalmente cutáneo; aparición de nuevo o exacerbación de la enfermedad existente; suspenda DEXILANT y consulte a un especialista para su evaluación. (5.6)
- Deficiencia de cianocobalamina (vitamina B12): El uso diario a largo plazo (por ejemplo, más de 3 años) puede provocar malabsorción o deficiencia de cianocobalamina. (5.7)
- Hipomagnesemia y metabolismo mineral: Se ha informado raramente con el tratamiento prolongado con IBP. (5.8)
- Interacciones con las investigaciones para tumores neuroendocrinos: Los aumentos en el pH intragástrico pueden provocar hipergastrinemia e hiperplasia de células similares a las enterocromafines y aumento de los niveles de cromogranina A, lo que puede interferir con las investigaciones de diagnóstico para tumores neuroendocrinos. (5.9, 7)
- Interacción con metotrexato: El uso concomitante con IBP puede elevar y/o prolongar las concentraciones séricas de metotrexato y/o su metabolito, lo que puede provocar toxicidad. Con la administración de metotrexato en dosis altas, considere la retirada temporal de DEXILANT. (5.10, 7)
- Pólipos de las glándulas fúndicas: El riesgo aumenta con el uso a largo plazo, especialmente más allá de 1 año. Utilice la duración más corta de la terapia. (5.11)
- Riesgo de engrosamiento de las válvulas cardíacas en pacientes pediátricos menores de dos años de edad: DEXILANT no se recomienda en pacientes pediátricos menores de 2 años de edad. (5.12, 8.4)
REACCIONES ADVERSAS
Las reacciones adversas más comunes son:
- Adultos (≥2%): diarrea, dolor abdominal, náuseas, infección del tracto respiratorio superior, vómitos y flatulencia. (6.1)
- Pacientes de 12 a 17 años de edad (≥5%): dolor de cabeza, dolor abdominal, diarrea, nasofaringitis y dolor orofaríngeo. (6.1)
Para informar sobre REACCIONES ADVERSAS SOSPECHOSAS, comuníquese con Takeda Pharmaceuticals America, Inc. al 1-877-TAKEDA-7 (1-877-825-3327) o con la FDA al 1-800-FDA-1088 o www.fda.gov/medwatch.
INTERACCIONES MEDICAMENTOSAS
Consulte la información completa de prescripción para obtener una lista de interacciones medicamentosas clínicamente importantes. (7)
USO EN POBLACIONES ESPECÍFICAS
- Embarazo: Con base en datos de animales, puede causar efectos adversos en el crecimiento y desarrollo óseo fetal. (8.1)
- Pediatría: Con base en datos con lansoprazol, DEXILANT no es eficaz en pacientes con ERGE sintomática de 1 mes a menos de 1 año de edad y los estudios no clínicos han demostrado efectos adversos en ratas juveniles. (8.4)
Consulte 17 para obtener INFORMACIÓN PARA EL PACIENTE y la Guía de medicamentos.
Revisado: 7/2023
Tabla de Contenido
INFORMACIÓN COMPLETA DE PRESCRIPCIÓN: CONTENIDO*
1 INDICACIONES Y USO
1.1 Curación de la Esofagitis Erosiva
1.2 Mantenimiento de la Esofagitis Erosiva Curada y Alivio de la Acidez Estomacal
1.3 Tratamiento de la Enfermedad por Reflujo Gastroesofágico Sin Erosión Sintomática
2 DOSIFICACIÓN Y ADMINISTRACIÓN
2.1 Dosis Recomendada en Pacientes de 12 Años de Edad o Mayores
2.2 Ajuste de la Dosis en Pacientes con Insuficiencia Hepática para la Curación de la Esofagitis Erosiva
2.3 Información Importante sobre la Administración
3 FORMAS Y FUERZAS DE DOSIFICACIÓN
4 CONTRAINDICACIONES
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Presencia de Malignidad Gástrica
5.2 Nefritis Tubulointersticial Aguda
5.3 Clostridium difficile-Diarrea Asociada
5.4 Fractura Ósea
5.5 Reacciones Adversas Cutáneas Graves
5.6 Lupus Eritematoso Cutáneo y Sistémico
5.7 Deficiencia de Cianocobalamina (Vitamina B12)
5.8 Hipomagnesemia y Metabolismo Mineral
5.9 Interacciones con las Investigaciones para Tumores Neuroendocrinos
5.10 Interacción con Metotrexato
5.11 Pólipos de la Glándula Fundica
5.12 Riesgo de Engrosamiento de la Válvula Cardiaca en Pacientes Pediátricos Menores de Dos Años de Edad
6 REACCIONES ADVERSAS
6.1 Experiencia en Ensayos Clínicos
6.2 Experiencia Postcomercialización
7 INTERACCIONES MEDICAMENTOSAS
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
8.2 Lactancia
8.4 Uso Pediátrico
8.5 Uso Geriátrico
8.6 Insuficiencia Hepática
10 SOBREDOSIS
11 DESCRIPCIÓN
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de Acción
12.2 Farmacodinamia
12.3 Farmacocinética
12.5 Farmacogenómica
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
14 ESTUDIOS CLÍNICOS
14.1 Curación de la Esofagitis Erosiva en Adultos
14.2 Mantenimiento de la Esofagitis Erosiva Curada y Alivio de la Acidez Estomacal en Adultos
14.3 Tratamiento de la ERGE Sintomática No Erosiva en Adultos
14.4 ERGE Pediátrica
16 CÓMO SE SUMINISTRA/ALMACENAMIENTO Y MANEJO
17 INFORMACIÓN PARA EL PACIENTE
- *
- Las secciones o subsecciones omitidas de la información completa de prescripción no están enumeradas.
1 INDICACIONES Y USO
1.1 Curación de la Esofagitis Erosiva
DEXILANT está indicado en pacientes de 12 años de edad o mayores para la curación de todos los grados de esofagitis erosiva (EE) por hasta ocho semanas.
1.2 Mantenimiento de la Esofagitis Erosiva Curada y Alivio de la Acidez Estomacal
DEXILANT está indicado en pacientes de 12 años de edad o mayores para mantener la curación de la EE y el alivio de la acidez estomacal por hasta seis meses en adultos y 16 semanas en pacientes de 12 a 17 años de edad.
1.3 Tratamiento de la Enfermedad por Reflujo Gastroesofágico Sintomática No Erosiva
DEXILANT está indicado en pacientes de 12 años de edad o mayores para el tratamiento de la acidez estomacal asociada con la enfermedad por reflujo gastroesofágico sintomática no erosiva (GERD) durante cuatro semanas.
2 DOSIS Y ADMINISTRACIÓN
2.1 Dosis recomendada en pacientes de 12 años de edad y mayores
| Indicación | Dosis de las cápsulas de DEXILANT | Duración |
|---|---|---|
| Cicatrización de la EE | Una cápsula de 60 mg una vez al día. | Hasta 8 semanas. |
| Mantenimiento de la EE cicatrizada y alivio de la acidez estomacal | Una cápsula de 30 mg una vez al día. | Los estudios controlados no se extendieron más allá de 6 meses en adultos y 16 semanas en pacientes de 12 a 17 años de edad. |
| GERD sintomática no erosiva | Una cápsula de 30 mg una vez al día. | 4 semanas. |
2.2 Ajuste de la dosis en pacientes con insuficiencia hepática para la cicatrización de la esofagitis erosiva
Para pacientes con insuficiencia hepática moderada (clase B de Child-Pugh), la dosis recomendada es de 30 mg de DEXILANT una vez al día durante un máximo de ocho semanas. No se recomienda el uso de DEXILANT en pacientes con insuficiencia hepática grave (clase C de Child-Pugh) [ver Uso en poblaciones específicas (8.6)].
2.3 Información importante sobre la administración
- Tomar sin tener en cuenta las comidas.
- Dosis olvidadas: Si olvida tomar una dosis, tómela tan pronto como sea posible. Sin embargo, si falta poco para la siguiente dosis programada, no tome la dosis olvidada y tome la siguiente dosis a la hora habitual. No tome una dosis doble para compensar la dosis olvidada.
- Tragar entera; no masticar.
- Para los pacientes que tengan dificultades para tragar cápsulas, las cápsulas de DEXILANT pueden abrirse y administrarse con puré de manzana de la siguiente manera:
- Coloque una cucharada de puré de manzana en un recipiente limpio.
- Abra la cápsula.
- Espolvoree los gránulos intactos sobre el puré de manzana.
- Trague el puré de manzana y los gránulos inmediatamente. No mastique los gránulos. No guarde el puré de manzana ni los gránulos para su uso posterior.
- Como alternativa, la cápsula puede administrarse con agua mediante una jeringa oral o una sonda nasogástrica (SNG).
Administración con agua en una jeringa oral- Abra la cápsula y vacíe los gránulos en un recipiente limpio con 20 ml de agua.
- Extraiga toda la mezcla en una jeringa.
- Agite suavemente la jeringa para evitar que los gránulos se asienten.
- Administre la mezcla inmediatamente en la boca. No guarde la mezcla de agua y gránulos para su uso posterior.
- Vuelva a llenar la jeringa con 10 ml de agua, agítela suavemente y adminístrela.
- Vuelva a llenar la jeringa con 10 ml de agua, agítela suavemente y adminístrela.
Administración con agua a través de una sonda nasogástrica (≥16 French)
- Abra la cápsula y vacíe los gránulos en un recipiente limpio con 20 ml de agua.
- Extraiga toda la mezcla en una jeringa con punta de catéter.
- Agite suavemente la jeringa con punta de catéter para evitar que los gránulos se asienten e inyecte inmediatamente la mezcla a través de la sonda nasogástrica en el estómago. No guarde la mezcla de agua y gránulos para su uso posterior.
- Vuelva a llenar la jeringa con punta de catéter con 10 ml de agua, agítela suavemente y enjuague la sonda.
- Vuelva a llenar la jeringa con punta de catéter con 10 ml de agua, agítela suavemente y adminístrela.
3 FORMAS DE DOSIFICACIÓN Y CONCENTRACIONES
Cápsulas de liberación retardada DEXILANT
- 30 mg: la concentración es una cápsula opaca, azul y gris impresa con “TAP” y “30”.
- 60 mg: la concentración es una cápsula opaca, azul impresa con “TAP” y “60”.
4 CONTRAINDICACIONES
- DEXILANT está contraindicado en pacientes con hipersensibilidad conocida a cualquier componente de la formulación [consulte Descripción (11)]. Las reacciones de hipersensibilidad pueden incluir anafilaxia, choque anafiláctico, angioedema, broncoespasmo, nefritis tubulointersticial aguda y urticaria [consulte Advertencias y precauciones (5.2), Reacciones adversas (6)].
- Los IBP, incluido DEXILANT, están contraindicados con productos que contienen rilpivirina [consulte Interacciones medicamentosas (7)].
5 ADVERTENCIAS Y PRECAUCIONES
5.1 Presencia de maligancía gástrica
En adultos, la respuesta sintomática al tratamiento con DEXILANT no excluye la presencia de una neoplasia gástrica maligna. Considere un seguimiento adicional y pruebas de diagnóstico en pacientes adultos que tengan una respuesta subóptima o un reingreso sintomático temprano tras completar el tratamiento con un IPP. En pacientes de mayor edad, también considere una endoscopia.
5.2 Nefritis túbulointersticial aguda
Se ha observado nefritis túbulointersticial aguda (TIN) en pacientes que toman IPP y puede ocurrir en cualquier momento durante el tratamiento con IPP. Los pacientes pueden presentar signos y síntomas variados, desde reacciones de hipersensibilidad sintomáticas a síntomas inespecíficos de disminución de la función renal (por ejemplo, malestar general, náuseas, anorexia). En series de casos reportadas, algunos pacientes fueron diagnosticados por biopsia y en ausencia de manifestaciones extrarrenales (por ejemplo, fiebre, exantema o artralgia). Suspenda DEXILANT y evalúe a los pacientes con sospecha de TIN aguda [véase Contraindicaciones (4)].
5.3 Diarrea asociada a Clostridium difficile
Estudios observacionales publicados sugieren que el tratamiento con IPP como DEXILANT puede estar asociado con un mayor riesgo de diarrea asociada a Clostridium difficile, especialmente en pacientes hospitalizados. Este diagnóstico debe considerarse en caso de diarrea que no mejore [véase Reacciones adversas (6.2)].
Los pacientes deben usar la dosis más baja y la duración más corta de tratamiento con IPP que sea apropiada para la afección que se esté tratando.
5.4 Fractura ósea
Varios estudios observacionales publicados sugieren que el tratamiento con IPP puede estar asociado con un mayor riesgo de fracturas relacionadas con la osteoporosis de la cadera, la muñeca o la columna vertebral. El riesgo de fractura aumentó en pacientes que recibieron dosis altas, definidas como varias dosis diarias, y tratamiento con IPP a largo plazo (un año o más). Los pacientes deben usar la dosis más baja y la duración más corta de tratamiento con IPP que sea apropiada para las condiciones que se estén tratando. Los pacientes en riesgo de fracturas relacionadas con la osteoporosis deben ser manejados de acuerdo con las pautas de tratamiento establecidas [véase Dosis y administración (2), Reacciones adversas (6.2)].
5.5 Reacciones adversas cutáneas graves
Se han notificado reacciones adversas cutáneas graves, incluyendo el síndrome de Stevens-Johnson (SJS), la necrólisis epidérmica tóxica (TEN), la reacción medicamentosa con eosinofilia y síntomas sistémicos (DRESS) y la pústula exantemática generalizada aguda (AGEP) en asociación con el uso de IPP [véase Reacciones adversas (6.2)]. Suspenda DEXILANT en los primeros signos o síntomas de reacciones adversas cutáneas graves u otros signos de hipersensibilidad y considere una evaluación adicional.
5.6 Lupus eritematoso cutáneo y sistémico
Se han notificado casos de lupus eritematoso cutáneo (CLE) y lupus eritematoso sistémico (SLE) en pacientes que toman IPP. Estos eventos se han presentado tanto como un inicio nuevo como una exacerbación de la enfermedad autoinmune existente. La mayoría de los casos de lupus eritematoso inducidos por IPP fueron CLE.
La forma más común de CLE reportada en pacientes tratados con IPP fue CLE subaguda (SCLE) y se produjo en semanas a años después del tratamiento continuo con el fármaco en pacientes que van desde lactantes hasta ancianos. Generalmente, se observaron hallazgos histológicos sin afectación orgánica.
El lupus eritematoso sistémico (SLE) se notifica con menos frecuencia que el CLE en pacientes que reciben IPP. El SLE asociado a IPP suele ser más leve que el SLE no inducido por fármacos. El inicio del SLE ocurrió típicamente en días a años después de iniciar el tratamiento principalmente en pacientes que van desde adultos jóvenes hasta ancianos. La mayoría de los pacientes presentaron erupción cutánea; sin embargo, también se informaron artralgias y citopenia.
Evite la administración de IPP durante más tiempo que el indicado médicamente. Si se observan signos o síntomas consistentes con CLE o SLE en pacientes que reciben DEXILANT, suspenda el fármaco y refiera al paciente al especialista adecuado para la evaluación. La mayoría de los pacientes mejoran con la suspensión del IPP solo en cuatro a 12 semanas. Las pruebas serológicas (por ejemplo, ANA) pueden ser positivas y los resultados de las pruebas serológicas elevadas pueden tardar más en resolverse que las manifestaciones clínicas.
5.7 Deficiencia de cianocobalamina (vitamina B12)
El tratamiento diario con cualquier medicamento que suprima el ácido durante un largo período de tiempo (por ejemplo, más de tres años) puede llevar a una malabsorción de cianocobalamina (vitamina B12) causada por hipo o aclorhidria. Se han reportado raras noticias de deficiencia de cianocobalamina que ocurre con el tratamiento que suprime el ácido en la literatura. Este diagnóstico debe ser considerado si se observan síntomas clínicos consistentes con deficiencia de cianocobalamina en pacientes tratados con DEXILANT.
5.8 Hipomagnesemia y metabolismo mineral
Se ha informado raramente de hipomagnesemia, sintomática y asintomática, en pacientes tratados con IPP durante al menos tres meses, en la mayoría de los casos después de un año de tratamiento. Los eventos adversos graves incluyen tetania, arritmias y convulsiones. La hipomagnesemia puede llevar a hipocalcemia y/o hipopotasemia y puede exacerbar la hipocalcemia subyacente en pacientes en riesgo. En la mayoría de los pacientes, el tratamiento de la hipomagnesemia requirió la reposición de magnesio y la suspensión del IPP.
Para los pacientes que se espera que estén en un tratamiento prolongado o que tomen IPP con medicamentos como la digoxina o fármacos que puedan causar hipomagnesemia (por ejemplo, diuréticos), los profesionales de la salud pueden considerar monitorear los niveles de magnesio antes del inicio del tratamiento con IPP y periódicamente [véase Reacciones adversas (6.2)].
Considere monitorear los niveles de magnesio y calcio antes del inicio de DEXILANT y periódicamente durante el tratamiento en pacientes con un riesgo preexistente de hipocalcemia (por ejemplo, hipoparatiroidismo). Suplemente con magnesio y/o calcio según sea necesario. Si la hipocalcemia es refractaria al tratamiento, considere suspender el IPP.
5.9 Interacciones con las investigaciones para tumores neuroendocrinos
Los niveles séricos de cromogranina A (CgA) aumentan como consecuencia secundaria de la disminución de la acidez gástrica inducida por fármacos. El aumento del nivel de CgA puede causar resultados falsos positivos en las investigaciones de diagnóstico para tumores neuroendocrinos. Los profesionales de la salud deben suspender temporalmente el tratamiento con dexlansoprazol al menos 14 días antes de evaluar los niveles de CgA y considerar la repetición de la prueba si los niveles iniciales de CgA son altos. Si se realizan pruebas seriadas (por ejemplo, para el seguimiento), se debe utilizar el mismo laboratorio comercial para las pruebas, ya que los rangos de referencia entre las pruebas pueden variar [ver Interacciones medicamentosas (7), Farmacología clínica (12.2)].
5.10 Interacción con metotrexato
La literatura sugiere que el uso concomitante de IBP con metotrexato (principalmente a dosis altas) puede elevar y prolongar los niveles séricos de metotrexato y/o su metabolito, lo que posiblemente conduzca a toxicidades por metotrexato. En la administración de metotrexato a dosis altas, se puede considerar la retirada temporal del IBP en algunos pacientes [ver Interacciones medicamentosas (7)].
5.11 Pólipos de las glándulas fúndicas
El uso de IBP se asocia a un mayor riesgo de pólipos de las glándulas fúndicas que aumenta con el uso a largo plazo, especialmente más allá de un año. La mayoría de los usuarios de IBP que desarrollaron pólipos de las glándulas fúndicas fueron asintomáticos y los pólipos de las glándulas fúndicas se identificaron incidentalmente en la endoscopia. Utilice la duración más corta de la terapia con IBP adecuada para la afección que se está tratando.
5.12 Riesgo de engrosamiento de las válvulas cardíacas en pacientes pediátricos menores de dos años de edad
DEXILANT no se recomienda en pacientes pediátricos menores de dos años de edad. Los estudios no clínicos en ratas juveniles con lansoprazol han demostrado un efecto adverso de engrosamiento de las válvulas cardíacas. Dexlansoprazol es el R-enantiómero de lansoprazol [ver Uso en poblaciones específicas (8.4)].
6 REACCIONES ADVERSAS
Las siguientes reacciones adversas graves se describen a continuación y en otras partes de la etiqueta:
- Nefritis tubulointersticial aguda [ver Advertencias y Precauciones (5.2)]
- Diarrea asociada a Clostridium difficile [ver Advertencias y Precauciones (5.3)]
- Fractura ósea [ver Advertencias y Precauciones (5.4)]
- Reacciones adversas cutáneas graves [ver Advertencias y Precauciones (5.5)]
- Lupus eritematoso cutáneo y sistémico [ver Advertencias y Precauciones (5.6)]
- Deficiencia de cianocobalamina (vitamina B12) [ver Advertencias y Precauciones (5.7)]
- Hipomagnesemia y metabolismo mineral [ver Advertencias y Precauciones (5.8)]
- Pólipos de las glándulas fúndicas [ver Advertencias y Precauciones (5.11)]
- Riesgo de engrosamiento de válvulas cardíacas en pacientes pediátricos menores de dos años de edad [ver Advertencias y Precauciones (5.12)]
6.1 Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se llevan a cabo en condiciones muy variadas, las tasas de reacciones adversas observadas en los ensayos clínicos de un fármaco no pueden compararse directamente con las tasas en los ensayos clínicos de otro fármaco y puede que no reflejen las tasas observadas en la práctica.
Adultos
La seguridad de DEXILANT se evaluó en 4548 pacientes adultos en ensayos clínicos controlados y de un solo brazo, incluidos 863 pacientes tratados durante al menos seis meses y 203 pacientes tratados durante un año. Los pacientes tenían edades que oscilaban entre 18 y 90 años (edad mediana de 48 años), siendo el 54% mujeres, el 85% caucásicos, el 8% negros, el 4% asiáticos y el 3% de otras razas. Se realizaron seis ensayos clínicos controlados aleatorizados para el tratamiento de EE, el mantenimiento de EE curada y el GERD sintomático, que incluyeron 896 pacientes con placebo, 455 pacientes con DEXILANT 30 mg, 2218 pacientes con DEXILANT 60 mg y 1363 pacientes con lansoprazol 30 mg una vez al día.
Reacciones adversas comunes
Las reacciones adversas más comunes (≥ 2%) que se presentaron con una mayor incidencia para DEXILANT que para el placebo en los estudios controlados se muestran en Tabla 2.
| Reacción adversa | Placebo (N=896) % |
DEXILANT 30 mg (N=455) % |
DEXILANT 60 mg (N=2218) % |
DEXILANT Total (N=2621) % |
Lansoprazol 30 mg (N=1363) % |
|---|---|---|---|---|---|
| Diarrea | 2.9 | 5.1 | 4.7 | 4.8 | 3.2 |
| Dolor abdominal | 3.5 | 3.5 | 4.0 | 4.0 | 2.6 |
| Náusea | 2.6 | 3.3 | 2.8 | 2.9 | 1.8 |
| Infección del tracto respiratorio superior | 0.8 | 2.9 | 1.7 | 1.9 | 0.8 |
| Vómito | 0.8 | 2.2 | 1.4 | 1.6 | 1.1 |
| Flatulencia | 0.6 | 2.6 | 1.4 | 1.6 | 1.2 |
Reacciones adversas que provocan la interrupción del tratamiento
En estudios clínicos controlados, la reacción adversa más común que provocó la interrupción del tratamiento con DEXILANT fue la diarrea (0,7%).
Reacciones adversas menos frecuentes
Otras reacciones adversas que se notificaron en estudios controlados con una incidencia inferior al 2% se enumeran a continuación por sistema orgánico:
Trastornos de la sangre y del sistema linfático: anemia, linfadenopatía
Trastornos cardíacos: angina de pecho, arritmia, bradicardia, dolor torácico, edema, infarto de miocardio, palpitaciones, taquicardia
Trastornos del oído y del laberinto: dolor de oído, tinnitus, vértigo
Trastornos endocrinos: bocio
Trastornos oculares: irritación ocular, hinchazón ocular
Trastornos gastrointestinales: molestias abdominales, dolor abdominal, heces anormales, molestias anales, esófago de Barrett, bezoar, ruidos intestinales anormales, halitosis, colitis microscópica, pólipo colónico, estreñimiento, sequedad de boca, duodenitis, dispepsia, disfagia, enteritis, eructos, esofagitis, pólipo gástrico, gastritis, gastroenteritis, trastornos gastrointestinales, trastornos de la hipermotilidad gastrointestinal, ERGE, úlceras y perforaciones gastrointestinales, hematemesis, hematochezia, hemorroides, vaciamiento gástrico deteriorado, síndrome del intestino irritable, heces mucosas, ampollas en la mucosa oral, defecación dolorosa, proctitis, parestesia oral, hemorragia rectal, arcadas
Trastornos generales y condiciones del lugar de administración: reacción adversa a medicamentos, astenia, dolor torácico, escalofríos, sensación anormal, inflamación, inflamación de la mucosa, nódulo, dolor, pirexia
Trastornos hepatobiliares: cólico biliar, colelitiasis, hepatomegalia
Trastornos del sistema inmunitario: hipersensibilidad
Infecciones e infestaciones: infecciones por cándida, gripe, nasofaringitis, herpes oral, faringitis, sinusitis, infección vírica, infección vulvovaginal
Lesiones, envenenamiento y complicaciones de procedimientos: caídas, fracturas, esguinces, sobredosis, dolor por procedimiento, quemaduras solares
Pruebas de laboratorio: ALP aumentada, ALT aumentada, AST aumentada, bilirrubina disminuida/aumentada, creatinina en sangre aumentada, gastrina en sangre aumentada, glucosa en sangre aumentada, potasio en sangre aumentado, pruebas de función hepática anormales, recuento de plaquetas disminuido, proteína total aumentada, aumento de peso
Trastornos del metabolismo y de la nutrición: cambios en el apetito, hipercalcemia, hipopotasemia
Trastornos musculoesqueléticos y del tejido conjuntivo: artralgia, artritis, calambres musculares, dolor musculoesquelético, mialgia
Trastornos del sistema nervioso: alteración del gusto, convulsiones, mareos, dolores de cabeza, migraña, deterioro de la memoria, parestesia, hiperactividad psicomotora, temblor, neuralgia del trigémino
Trastornos psiquiátricos: sueños anormales, ansiedad, depresión, insomnio, cambios en la libido
Trastornos renales y urinarios: disuria, urgencia miccional
Trastornos del aparato reproductor y de las mamas: dismenorrea, dispareunia, menorragia, trastorno menstrual
Trastornos respiratorios, torácicos y mediastínicos: aspiración, asma, bronquitis, tos, disnea, hipo, hiperventilación, congestión de las vías respiratorias, dolor de garganta
Trastornos de la piel y del tejido subcutáneo: acné, dermatitis, eritema, prurito, erupción cutánea, lesión cutánea, urticaria
Trastornos vasculares: trombosis venosa profunda, sofocos, hipertensión
Reacciones adversas adicionales que se notificaron en un ensayo a largo plazo de un solo brazo y que se consideraron relacionadas con DEXILANT por el médico tratante incluyeron: anafilaxia, alucinaciones auditivas, linfoma de células B, bursitis, obesidad central, colecistitis aguda, deshidratación, diabetes mellitus, disfonía, epistaxis, foliculitis, gota, herpes zóster, hiperlipidemia, hipotiroidismo, aumento de neutrófilos, disminución de la CMHC, neutropenia, tenesmo rectal, síndrome de piernas inquietas, somnolencia, amigdalitis.
Pediatría
La seguridad de DEXILANT se evaluó en ensayos clínicos controlados y de un solo brazo que incluyeron 166 pacientes pediátricos de 12 a 17 años de edad para el tratamiento de la ERGE sintomática no erosiva, la cicatrización de la EE, el mantenimiento de la EE cicatrizada y el alivio de la acidez estomacal [ver Estudios clínicos (14.4)].
El perfil de reacciones adversas fue similar al de los adultos. Las reacciones adversas más frecuentes que se produjeron en ≥5% de los pacientes fueron dolor de cabeza, dolor abdominal, diarrea, nasofaringitis y dolor orofaríngeo.
6.2 Experiencia postcomercialización
Las siguientes reacciones adversas se han identificado durante el uso postaprobación de DEXILANT. Debido a que estas reacciones se notifican voluntariamente de una población de tamaño incierto, no siempre es posible estimar de forma fiable su frecuencia o establecer una relación causal con la exposición al fármaco.
Trastornos de la sangre y del sistema linfático: anemia hemolítica autoinmune, púrpura trombocitopénica idiopática
Trastornos del oído y del laberinto: sordera
Trastornos oculares: visión borrosa
Trastornos gastrointestinales: edema oral, pancreatitis, pólipos de las glándulas fúndicas
Trastornos generales y condiciones del lugar de administración: edema facial
Trastornos hepatobiliares: hepatitis inducida por fármacos
Trastornos del sistema inmunitario: shock anafiláctico (que requiere intervención de emergencia), dermatitis exfoliativa, SJS/TEN (algunas mortales), DRESS, AGEP, eritema multiforme
Infecciones e infestaciones: Clostridium difficile-diarrea asociada
Trastornos del metabolismo y de la nutrición: hipomagnesemia, hipocalcemia, hipopotasemia, hiponatremia
Trastornos del sistema musculoesquelético: fractura ósea
Trastornos del sistema nervioso: accidente cerebrovascular, ataque isquémico transitorio
Trastornos renales y genitourinarios: insuficiencia renal aguda, disfunción eréctil
Trastornos respiratorios, torácicos y mediastínicos: edema faríngeo, opresión en la garganta
Trastornos de la piel y del tejido subcutáneo: erupción generalizada, vasculitis leucocitoclástica
7 INTERACCIONES MEDICAMENTOSAS
Las tablas 3 y 4 incluyen medicamentos con interacciones medicamentosas clínicamente importantes e interacción con diagnósticos cuando se administran concomitantemente con DEXILANT e instrucciones para prevenirlas o manejarlas.
Consulte el etiquetado de los medicamentos utilizados concomitantemente para obtener más información sobre las interacciones con los IBP.
| Antiretrovirales | |
| Impacto clínico: | El efecto de los IBP sobre los medicamentos antirretrovirales es variable. No siempre se conoce la importancia clínica y los mecanismos que subyacen a estas interacciones.
|
| Intervención: | Productos que contienen rilpivirina: El uso concomitante con DEXILANT está contraindicado [ver Contraindicaciones (4)]. Consulte la información de prescripción. Atazanavir: Consulte la información de prescripción de atazanavir para obtener información sobre la dosificación. Nelfinavir: Evite el uso concomitante con DEXILANT. Consulte la información de prescripción de nelfinavir. Saquinavir: Consulte la información de prescripción de saquinavir y controle las posibles toxicidades de saquinavir. Otros antirretrovirales: Consulte la información de prescripción. |
| Warfarina | |
| Impacto clínico: | Aumento del INR y del tiempo de protrombina en pacientes que reciben IBP y warfarina concomitantemente. Los aumentos en el INR y el tiempo de protrombina pueden provocar hemorragias anormales e incluso la muerte. |
| Intervención: | Controle el INR y el tiempo de protrombina. Puede ser necesario ajustar la dosis de warfarina para mantener el rango objetivo del INR. Consulte la información de prescripción de la warfarina. |
| Metotrexato | |
| Impacto clínico: | El uso concomitante de IBP con metotrexato (principalmente a dosis altas) puede elevar y prolongar las concentraciones séricas de metotrexato y/o de su metabolito hidroxitrexato, lo que podría provocar toxicidades por metotrexato. No se han realizado estudios formales de interacción farmacológica de dosis altas de metotrexato con IBP [ver Advertencias y precauciones (5.10)]. |
| Intervención: | Se puede considerar la suspensión temporal de DEXILANT en algunos pacientes que reciben dosis altas de metotrexato. |
| Digoxina | |
| Impacto clínico: | Posibilidad de aumento de la exposición a la digoxina. |
| Intervención: | Controle las concentraciones de digoxina. Puede ser necesario ajustar la dosis de digoxina para mantener las concentraciones terapéuticas del fármaco. Consulte la información de prescripción de la digoxina. |
| Medicamentos cuya absorción depende del pH gástrico (p. ej., sales de hierro, erlotinib, dasatinib, nilotinib, micofenolato mofetilo, ketoconazol/itraconazol) | |
| Impacto clínico: | El dexlansoprazol puede reducir la absorción de otros medicamentos debido a su efecto reductor de la acidez intragástrica. |
| Intervención: | Micofenolato mofetilo (MMF): Se ha notificado que la administración conjunta de IBP en sujetos sanos y en pacientes trasplantados que reciben MMF reduce la exposición al metabolito activo, ácido micofenólico (MPA), posiblemente debido a una disminución de la solubilidad del MMF al aumentar el pH gástrico. No se ha establecido la relevancia clínica de la reducción de la exposición al MPA sobre el rechazo del órgano en pacientes trasplantados que reciben DEXILANT y MMF. Utilice DEXILANT con precaución en pacientes trasplantados que reciben MMF. Consulte la información de prescripción de otros medicamentos cuya absorción depende del pH gástrico. |
| Tacrolimus | |
| Impacto clínico: | Posible aumento de la exposición al tacrolimus, especialmente en pacientes trasplantados que son metabolizadores intermedios o lentos del CYP2C19. |
| Intervención: | Controle las concentraciones mínimas de tacrolimus en sangre total. Puede ser necesario ajustar la dosis de tacrolimus para mantener las concentraciones terapéuticas del fármaco. Consulte la información de prescripción de tacrolimus. |
| Interacciones con las investigaciones de tumores neuroendocrinos | |
| Impacto clínico: | Los niveles de CgA aumentan de forma secundaria a las disminuciones de la acidez gástrica inducidas por los IBP. El aumento del nivel de CgA puede causar resultados falsos positivos en las pruebas de diagnóstico de tumores neuroendocrinos [see Warnings and Precautions (5.9), Clinical Pharmacology (12.2)]. |
| Intervención: | Interrumpa temporalmente el tratamiento con DEXILANT al menos 14 días antes de evaluar los niveles de CgA y considere la posibilidad de repetir la prueba si los niveles iniciales de CgA son altos. Si se realizan pruebas seriadas (por ejemplo, para la monitorización), se debe utilizar el mismo laboratorio comercial para las pruebas, ya que los rangos de referencia entre las pruebas pueden variar. |
| Interacción con la prueba de estimulación con secretina | |
| Impacto clínico: | Hiperrespuesta en la secreción de gastrina en respuesta a la prueba de estimulación con secretina, lo que sugiere falsamente un gastrinoma. |
| Intervención: | Interrumpa temporalmente el tratamiento con DEXILANT al menos 30 días antes de la evaluación para permitir que los niveles de gastrina vuelvan a los valores basales [see Clinical Pharmacology (12.2)]. |
| Pruebas de orina falsas positivas para THC | |
| Impacto clínico: | Se han notificado casos de pruebas de detección de tetrahidrocannabinol (THC) en orina falsas positivas en pacientes tratados con IBP. |
| Intervención: | Se debe considerar un método de confirmación alternativo para verificar los resultados positivos. |
| Inductores de CYP2C19 o CYP3A4 | |
| Impacto clínico: | Disminución de la exposición de dexlansoprazol cuando se utiliza de forma concomitante con inductores fuertes [see Clinical Pharmacology (12.3)]. |
| Intervención: | Hierba de San Juan, rifampicina: Evite el uso concomitante con DEXILANT. Productos que contienen ritonavir: Consulte la información de prescripción. |
| Inhibidores de CYP2C19 o CYP3A4 | |
| Impacto clínico: | Se espera un aumento de la exposición al dexlansoprazol cuando se utiliza de forma concomitante con inhibidores potentes [see Clinical Pharmacology (12.3)]. |
| Intervención: | Voriconazol: Consulte la información de prescripción. |
8 USO EN POBLACIONES ESPECÍFICAS
8.1 Embarazo
Resumen del riesgo
No hay estudios con el uso de dexlansoprazole en mujeres embarazadas para informar sobre el riesgo asociado a la droga. Dexlansoprazole es el enantiómero R de lansoprazole, y los estudios observacionales publicados del uso de lansoprazole durante el embarazo no demostraron una asociación de resultados adversos relacionados con el embarazo con lansoprazole (véase Datos).
En estudios de reproducción en animales, la administración oral de lansoprazole a ratas durante la organogénesis hasta la lactancia a 1,8 veces la dosis máxima recomendada en humanos de dexlansoprazole provocó reducciones en la descendencia en el peso del fémur, la longitud del fémur, la longitud de la coronilla al rabadilla y el grosor de la placa de crecimiento (solo machos) en el día 21 postnatal (véase Datos). Estos efectos se asociaron con una reducción en el aumento de peso corporal. Avisar a las mujeres embarazadas del riesgo potencial para el feto.
El riesgo estimado basal de defectos de nacimiento mayores y abortos espontáneos en la población indicada es desconocido. Todos los embarazos tienen un riesgo basal de defecto de nacimiento, pérdida u otros resultados adversos. En la población general de EE.UU., el riesgo estimado basal de defectos de nacimiento mayores y abortos espontáneos en embarazos reconocidos clínicamente es del 2 al 4% y del 15 al 20%, respectivamente.
Datos
Datos humanos
Dexlansoprazole es el enantiómero R de lansoprazole. Los datos disponibles de estudios observacionales publicados no demostraron una asociación de resultados adversos relacionados con el embarazo y el uso de lansoprazole. Las limitaciones metodológicas de estos estudios observacionales no pueden establecer o excluir definitivamente ningún riesgo asociado a la droga durante el embarazo. En un estudio prospectivo de la Red Europea de Servicios de Información sobre Teratología, los resultados de un grupo de 62 mujeres embarazadas que recibieron dosis diarias medianas de 30 mg de lansoprazole se compararon con un grupo de control de 868 mujeres embarazadas que no tomaron ningún IPP. No hubo diferencia en la tasa de malformaciones mayores entre las mujeres expuestas a los IPP y el grupo de control, correspondiendo a un Riesgo Relativo (RR) = 1.04, [Intervalo de Confianza (IC) del 95% 0.25-4.21]. En un estudio de cohorte retrospectivo poblacional que abarcó todos los nacidos vivos en Dinamarca desde 1996 hasta 2008, no hubo un aumento significativo en las malformaciones mayores durante el análisis de la exposición en el primer trimestre a lansoprazole en 794 nacidos vivos. Un metanálisis que comparó 1.530 mujeres embarazadas expuestas a los IPP al menos en el primer trimestre con 133.410 mujeres embarazadas no expuestas mostró no hay aumentos significativos en el riesgo de malformaciones congénitas o abortos espontáneos con la exposición a los IPP (para malformaciones mayores la Razón de Oportunidades (OR) = 1.12, [IC 95% 0.86-1.45] y para abortos espontáneos OR = 1.29, [IC 95% 0.84-1.97]).
Datos de animales
Un estudio de desarrollo embriofetal realizado en conejos con dosis orales de dexlansoprazole de hasta 30 mg/kg/día (aproximadamente nueve veces la dosis máxima recomendada en humanos de dexlansoprazole [60 mg/día] basado en el área de la superficie corporal) durante la organogénesis no mostró efectos en los fetos debido al dexlansoprazole. Además, estudios de desarrollo embriofetal realizados en ratas con lansoprazole oral en dosis de hasta 150 mg/kg/día (40 veces la dosis recomendada en humanos de lansoprazole basada en el área de la superficie corporal) durante la organogénesis y en conejos con lansoprazole oral en dosis de hasta 30 mg/kg/día (16 veces la dosis recomendada en humanos de lansoprazole basada en el área de la superficie corporal) durante la organogénesis no revelaron efectos en los fetos debido a lansoprazole.
Se realizó un estudio de toxicidad de desarrollo pre y postnatal en ratas con puntos finales adicionales para evaluar el desarrollo óseo con lansoprazole en dosis orales de 10 a 100 mg/kg/día (0.2 a 1.8 veces la dosis máxima recomendada en humanos de dexlansoprazole de 60 mg basada en el AUC [área bajo la curva de la concentración plasmática-tiempo] de dexlansoprazole) administradas durante la organogénesis hasta la lactancia. Los efectos maternos observados en 100 mg/kg/día (1.8 veces la dosis máxima recomendada en humanos de dexlansoprazole de 60 mg basados en el AUC de dexlansoprazole) incluyeron un período de gestación aumentado, una pérdida de peso corporal durante la gestación y una disminución en el consumo de alimentos. El número de nacimientos muertos aumentó en esta dosis, lo que puede haber sido secundario a la toxicidad materna. El peso corporal de las crías se redujo en 100 mg/kg/día a partir del día 11 postnatal. El peso del fémur, la longitud del fémur y la longitud de la coronilla al rabadilla se redujeron en 100 mg/kg/día en el día 21 postnatal. El peso del fémur seguía disminuyendo en el grupo de 100 mg/kg/día a las edades de 17 a 18 semanas. El grosor de la placa de crecimiento disminuyó en machos de 100 mg/kg/día en el día 21 postnatal y aumentó en machos de 30 y 100 mg/kg/día a las edades de 17 a 18 semanas. Los efectos en los parámetros óseos se asociaron con una reducción en el aumento de peso corporal.
8.2 Lactancia
Resumen del riesgo
No hay información sobre la presencia de dexlansoprazole en la leche humana, sus efectos en el infante amamantado o sus efectos en la producción de leche. Sin embargo, lansoprazole y sus metabolitos están presentes en la leche de rata. Se deben considerar los beneficios del desarrollo y la salud de la lactancia, junto con la necesidad clínica de la madre de DEXILANT y cualquier efecto adverso potencial en el niño amamantado por DEXILANT o por la condición materna subyacente.
8.4 Uso pediátrico
La seguridad y eficacia de DEXILANT se ha establecido en pacientes pediátricos de 12 años a 17 años de edad para la cicatrización de todos los grados de EE, el mantenimiento de la EE curada y el alivio de la pirosis, y el tratamiento de la pirosis asociada con GERD sintomática no erosiva. El uso de DEXILANT en este grupo de edad está respaldado por la evidencia de estudios adecuados y bien controlados de DEXILANT en adultos con datos adicionales de seguridad, eficacia y farmacocinética en pacientes pediátricos de 12 a 17 años de edad. El perfil de reacciones adversas en pacientes de 12 a 17 años de edad fue similar al de los adultos [véase Dosis y Administración (2.1), Reacciones Adversas (6.1), Farmacología Clínica (12.3), Estudios Clínicos (14)].
La seguridad y eficacia de DEXILANT no se ha establecido en pacientes pediátricos menores de 12 años de edad.
DEXILANT no se recomienda en pacientes pediátricos menores de dos años de edad [ver Advertencias y precauciones (5.12)]. Los estudios no clínicos en ratas juveniles tratadas con lansoprazol (la mezcla racémica) han demostrado efectos adversos de engrosamiento de la válvula cardíaca y cambios óseos a exposiciones de dexlansoprazol que se espera que sean similares o superiores a la exposición de dexlansoprazol en pacientes pediátricos de uno a dos años de edad, como se describe a continuación en Datos de toxicidad animal juvenil.
No se recomienda el uso de DEXILANT para el tratamiento de la ERGE sintomática en pacientes pediátricos de un mes a menos de un año de edad porque no se demostró que el lansoprazol fuera eficaz en un ensayo controlado multicéntrico, doble ciego.
Datos de toxicidad animal juvenil
Engrosamiento de la válvula cardíaca
En dos estudios de toxicidad oral, se produjo un engrosamiento de la válvula mitral del corazón en ratas juveniles tratadas con lansoprazol. El engrosamiento de la válvula cardíaca se observó principalmente con la administración oral iniciada en el día postnatal 7 (edad equivalente a los humanos neonatales) y el día postnatal 14 (edad humana equivalente a aproximadamente un año) a dosis de 250 mg/kg/día y superiores (en el día postnatal 7 y el día postnatal 14 respectivamente, 2,5 y 1,8 veces la exposición esperada de dexlansoprazol basada en el AUC en pacientes pediátricos de uno a dos años de edad). Las duraciones del tratamiento asociadas con el engrosamiento de la válvula cardíaca oscilaron entre 5 días y 8 semanas. Los hallazgos se revirtieron o tendieron a revertirse después de un período de recuperación sin fármacos de 4 semanas. La incidencia de engrosamiento de la válvula cardíaca después del inicio de la dosificación en el día postnatal 21 (edad humana equivalente a aproximadamente dos años) se limitó a una sola rata (1/24) en grupos que recibieron 500 mg/kg/día durante 4 u 8 semanas (2,1 veces la exposición esperada de dexlansoprazol basada en el AUC en pacientes pediátricos de uno a dos años de edad). Con base en la baja incidencia de engrosamiento de la válvula cardíaca en ratas de 21 días de edad y la edad humana equivalente, el riesgo de lesión de la válvula cardíaca no parece ser relevante para los pacientes de dos años de edad o mayores.
Cambios óseos
En un estudio de toxicidad oral de ocho semanas de lansoprazol en ratas juveniles con dosificación iniciada en el día postnatal 7, las dosis iguales o superiores a 100 mg/kg/día (exposición de dexlansoprazol basada en el AUC aproximadamente igual a la de los pacientes pediátricos de uno a dos años de edad) produjeron un crecimiento retardado, con deterioro de la ganancia de peso observado tan pronto como el día postnatal 10 (edad equivalente a los humanos neonatales). Al final del tratamiento, los signos de crecimiento deteriorado a 100 mg/kg/día y superiores incluyeron reducciones en el peso corporal (14 a 44% en comparación con los controles), peso absoluto de múltiples órganos, peso del fémur, longitud del fémur y longitud de la corona-nalgas. El grosor de la placa de crecimiento femoral se redujo solo en los machos y solo a la dosis de 500 mg/kg/día. Los efectos relacionados con el crecimiento retardado persistieron hasta el final del período de recuperación de cuatro semanas. No se recopilaron datos a largo plazo.
8.5 Uso en geriatría
Del número total de pacientes (n=4548) en estudios clínicos de DEXILANT, el 11% de los pacientes tenían 65 años o más, mientras que el 2% tenían 75 años o más. No se observaron diferencias generales en la seguridad o la eficacia entre estos pacientes y los pacientes más jóvenes, y otras experiencias clínicas informadas no han identificado diferencias significativas en las respuestas entre los pacientes geriátricos y los pacientes más jóvenes, pero no se puede descartar una mayor sensibilidad de algunos individuos mayores [ver Farmacología clínica (12.3)].
8.6 Insuficiencia hepática
No es necesario ajustar la dosis de DEXILANT para pacientes con insuficiencia hepática leve (Clase A de Child-Pugh).
En un estudio de pacientes adultos con insuficiencia hepática moderada (Clase B de Child-Pugh) que recibieron una dosis única de 60 mg de DEXILANT, hubo un aumento significativo en la exposición sistémica de dexlansoprazol en comparación con los sujetos sanos con función hepática normal [ver Farmacología clínica (12.3)]. Por lo tanto, para pacientes con insuficiencia hepática moderada (Clase B de Child-Pugh), se recomienda la reducción de la dosis para la curación de EE [ver Dosificación y administración (2.2)].
No se han realizado estudios en pacientes con insuficiencia hepática grave (Clase C de Child-Pugh); no se recomienda el uso de DEXILANT para estos pacientes [ver Dosificación y administración (2.2)].
10 SOBREDOSIS
No se han reportado casos de sobredosis significativa con DEXILANT. Múltiples dosis de DEXILANT 120 mg y una dosis única de DEXILANT 300 mg no resultaron en muerte u otros eventos adversos graves. Sin embargo, se han reportado eventos adversos graves de hipertensión en asociación con dosis de DEXILANT 60 mg dos veces al día. Las reacciones adversas no graves observadas con dosis de DEXILANT 60 mg dos veces al día incluyen sofocos, contusión, dolor orofaríngeo y pérdida de peso. No se espera que el dexlansoprazol se elimine de la circulación mediante hemodiálisis.
En caso de sobreexposición, el tratamiento debe ser sintomático y de apoyo.
Si ocurre una sobreexposición, llame a su centro de control de envenenamiento al 1-800-222-1222 para obtener información actualizada sobre el manejo de envenenamiento o sobreexposición.
11 DESCRIPCIÓN
El ingrediente activo en DEXILANT (cápsulas de dexlansoprazol) de liberación retardada, un inhibidor de la bomba de protones, es (+)-2-[(R)-{[3-metil-4-(2,2,2-trifluoroetoxi)piridin-2-il] metil} sulfinil]-1H-benzimidazol, un compuesto que inhibe la secreción de ácido gástrico. El dexlansoprazol es el enantiómero R del lansoprazol (una mezcla racémica de los enantiómeros R y S). Su fórmula empírica es: C16H14F3N3O2S, con un peso molecular de 369.36.
El dexlansoprazol tiene la siguiente estructura química:
El dexlansoprazol es un polvo cristalino blanco a casi blanco que se funde con descomposición a 140°C. El dexlansoprazol es libremente soluble en dimetilformamida, metanol, diclorometano, etanol y acetato de etilo; y soluble en acetonitrilo; ligeramente soluble en éter; y muy ligeramente soluble en agua; y prácticamente insoluble en hexano.
El dexlansoprazol es estable cuando se expone a la luz. El dexlansoprazol es más estable en condiciones neutras y alcalinas que en condiciones ácidas.
El dexlansoprazol se suministra para administración oral como una formulación de liberación retardada dual en cápsulas. Las cápsulas contienen dexlansoprazol en una mezcla de dos tipos de gránulos recubiertos entéricos con perfiles de disolución dependientes del pH [ver Farmacología Clínica (12.3)].
Las cápsulas de liberación retardada de DEXILANT están disponibles en dos concentraciones: 30 y 60 mg por cápsula. Cada cápsula contiene gránulos recubiertos entéricos que consisten en dexlansoprazol (ingrediente activo) y los siguientes ingredientes inactivos: esferas de azúcar, carbonato de magnesio, sacarosa, hidroxipropilcelulosa de baja sustitución, dióxido de titanio, hidroxipropilcelulosa, hipromelosa 2910, talco, copolímeros de ácido metacrílico, polietilenglicol 8000, citrato de trietilo, polisorbato 80 y dióxido de silicio coloidal. Los componentes de la cápsula incluyen los siguientes ingredientes inactivos: hipromelosa, carragenina y cloruro de potasio. Según el color de la cápsula, el azul contiene FD&C Blue No. 2 (o laca de aluminio FD&C Blue No. 2); el gris contiene óxido férrico negro; y ambos contienen dióxido de titanio.
12 FARMACOLOGÍA CLÍNICA
12.1 Mecanismo de acción
El dexlansoprazol pertenece a una clase de compuestos antisecretores, los benzimidazoles sustituidos, que suprimen la secreción de ácido gástrico mediante la inhibición específica de la (H+, K+)-ATPasa en la superficie secretora de la célula parietal gástrica. Dado que esta enzima se considera la bomba de ácido (protón) dentro de la célula parietal, el dexlansoprazol se ha caracterizado como un inhibidor de la bomba de protones gástrica, ya que bloquea el paso final de la producción de ácido.
12.2 Farmacodinamia
Actividad antisecretora
Los efectos de DEXILANT 60 mg (n=20) o lansoprazol 30 mg (n=23) una vez al día durante cinco días sobre el pH intragástrico de 24 horas se evaluaron en sujetos sanos en un estudio cruzado de dosis múltiples. Los resultados se resumen en la Tabla 5.
| DEXILANT 60 mg |
Lansoprazol 30 mg |
|---|---|
| pH intragástrico medio | |
| 4.55 | 4.13 |
| % Tiempo pH intragástrico >4 (horas) | |
| 71 (17 horas) |
60 (14 horas) |
Efectos sobre la gastrina sérica
El efecto del dexlansoprazol sobre las concentraciones séricas de gastrina se evaluó en aproximadamente 3460 pacientes en ensayos clínicos de hasta ocho semanas de duración y en 1023 pacientes durante un período de hasta 6 a 12 meses. Las concentraciones medias de gastrina en ayunas aumentaron desde el inicio durante el tratamiento con 30 y 60 mg de DEXILANT. En los pacientes tratados durante más de seis meses, las concentraciones séricas medias de gastrina aumentaron durante aproximadamente los tres primeros meses de tratamiento y se mantuvieron estables durante el resto del tratamiento. Las concentraciones séricas medias de gastrina volvieron a los niveles previos al tratamiento en el plazo de un mes tras la interrupción del mismo.
El aumento de la gastrina provoca hiperplasia de las células enterocromafines y aumento de las concentraciones séricas de CgA. El aumento de las concentraciones de CgA puede provocar resultados falsos positivos en las pruebas diagnósticas de tumores neuroendocrinos [véase Advertencias y precauciones (5.9)].
Efectos sobre las células enterocromafines (ECL)
No hubo informes de hiperplasia de células ECL en las biopsias gástricas obtenidas de 653 pacientes tratados con DEXILANT 30, 60 o 90 mg durante un período de hasta 12 meses.
Durante la exposición de por vida de ratas a dosis diarias de hasta 150 mg/kg/día de lansoprazol, se observó hipergastrinemia marcada seguida de proliferación de células ECL y formación de tumores carcinoides, especialmente en ratas hembra [véase Toxicología no clínica (13.1)].
12.3 Farmacocinética
La formulación de liberación retardada dual de DEXILANT da como resultado un perfil de concentración plasmática de dexlansoprazol en función del tiempo con dos picos distintos; el primer pico se produce entre una y dos horas después de la administración, seguido de un segundo pico entre cuatro y cinco horas (véase la Figura 1). El dexlansoprazol se elimina con una semivida de aproximadamente una a dos horas en sujetos sanos y en pacientes con ERGE sintomática. No se produce acumulación de dexlansoprazol después de dosis múltiples de 30 o 60 mg de DEXILANT una vez al día, aunque los valores medios del AUCt y la Cmáx del dexlansoprazol fueron ligeramente superiores (menos del 10%) en el día 5 que en el día 1.
| Figura 1: Concentración plasmática media de dexlansoprazol – Perfil temporal tras la administración oral de 30 o 60 mg de DEXILANT una vez al día durante 5 días en sujetos adultos sanos |
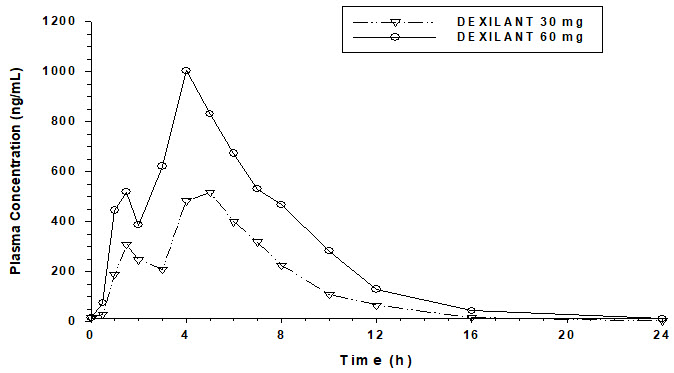 |
La farmacocinética del dexlansoprazol es muy variable, con valores del coeficiente de variación porcentual (%CV) para la Cmáx, el AUC y el CL/F superiores al 30% (véase la Tabla 6).
| Dosis (mg) |
Cmáx (ng/mL) |
AUC24 (ng∙h/mL) |
CL/F (L/h) |
|---|---|---|---|
| 30 | 658 (40%) (N=44) |
3275 (47%) (N=43) |
11.4 (48%) (N=43) |
| 60 | 1397 (51%) (N=79) |
6529 (60%) (N=73) |
11.6 (46%) (N=41) |
Absorción
Después de la administración oral de DEXILANT 30 o 60 mg a sujetos sanos y pacientes con ERGE sintomática, la Cmáx. y el AUC medios de dexlansoprazol aumentaron de forma aproximadamente proporcional a la dosis (ver Figura 1).
Cuando los gránulos de DEXILANT 60 mg se mezclan con agua y se administran por sonda nasogástrica u oralmente por medio de una jeringa, la biodisponibilidad (Cmáx. y AUC) de dexlansoprazol fue similar a la observada cuando DEXILANT 60 mg se administró como una cápsula intacta [ver Dosificación y administración (2.3)].
Efecto de los alimentos
En estudios de efecto de los alimentos en sujetos sanos que recibieron DEXILANT en diversas condiciones de alimentación en comparación con el ayuno, los aumentos en la Cmáx. oscilaron entre el 12 y el 55 %, los aumentos en el AUC oscilaron entre el 9 y el 37 %, y la Tmáx. varió (desde una disminución de 0.7 horas hasta un aumento de tres horas) [ver Dosificación y administración (2.3)].
Distribución
La unión a proteínas plasmáticas de dexlansoprazol osciló entre el 96 y el 99 % en sujetos sanos y fue independiente de la concentración de 0.01 a 20 mcg/ml. El volumen de distribución aparente (Vz/F) después de dosis múltiples en pacientes con ERGE sintomática fue de 40 L.
Eliminación
Metabolismo
El dexlansoprazol se metaboliza ampliamente en el hígado por oxidación, reducción y posterior formación de conjugados de sulfato, glucurónido y glutatión a metabolitos inactivos. Los metabolitos oxidativos se forman mediante el sistema enzimático del citocromo P450 (CYP), incluida la hidroxilación principalmente por CYP2C19, y la oxidación a sulfona por CYP3A4.
El CYP2C19 es una enzima hepática polimórfica que presenta tres fenotipos en el metabolismo de los sustratos del CYP2C19: metabolizadores extensos (*1/*1), metabolizadores intermedios (*1/mutante) y metabolizadores lentos (mutante/mutante). El dexlansoprazol es el principal componente circulante en plasma independientemente del estado metabolizador del CYP2C19. En los metabolizadores intermedios y extensos del CYP2C19, los principales metabolitos plasmáticos son el 5-hidroxidexlansoprazol y su conjugado glucurónido, mientras que en los metabolizadores lentos del CYP2C19, el principal metabolito plasmático es la sulfona de dexlansoprazol.
Excreción
Después de la administración de DEXILANT, no se excreta dexlansoprazol inalterado en la orina. Después de la administración de dexlansoprazol [14C] a seis sujetos varones sanos, aproximadamente el 50.7 % (desviación estándar [DE]: 9.0 %) de la radiactividad administrada se excretó en la orina y el 47.6 % (DE: 7.3 %) en las heces. El aclaramiento aparente (CL/F) en sujetos sanos fue de 11.4 a 11.6 L/hora, respectivamente, después de cinco días de administración de 30 o 60 mg una vez al día.
Poblaciones específicas
Edad: población pediátrica
No se ha estudiado la farmacocinética de dexlansoprazol en pacientes menores de 12 años.
Pacientes de 12 a 17 años
Se estudió la farmacocinética de dexlansoprazol en 36 pacientes de 12 a 17 años con ERGE sintomática en un ensayo multicéntrico. Los pacientes fueron aleatorizados para recibir DEXILANT 30 o 60 mg una vez al día durante siete días. La Cmáx. y el AUC medios de dexlansoprazol en pacientes de 12 a 17 años fueron del 105 y el 88 %, respectivamente, en comparación con los observados en adultos a la dosis de 30 mg, y fueron del 81 y el 78 %, respectivamente, a la dosis de 60 mg (ver Tablas 6 y 7).
| Dosis | Cmáx. (ng/ml) |
AUCtau (ng∙h/ml) |
CL/F (L/h) |
|---|---|---|---|
| 30 mg (N=17) |
691 (53) |
2886 (47) |
12.8 (48) |
| 60 mg (N=18) |
1136 (51) |
5120 (58) |
15.3 (49) |
Edad: Población geriátrica La vida media de eliminación terminal del dexlansoprazol aumenta significativamente en sujetos geriátricos en comparación con sujetos más jóvenes (2.2 y 1.5 horas, respectivamente). El dexlansoprazol exhibió una mayor exposición sistémica (AUC) en sujetos geriátricos (34 % más alta) que en sujetos más jóvenes [ver Uso en poblaciones específicas (8.5)].
Sexo
En un estudio de 12 hombres y 12 mujeres sanos que recibieron una dosis única de DEXILANT 60 mg, las mujeres tuvieron una mayor exposición sistémica (AUC) (43 % más alta) que los hombres. Esta diferencia en la exposición entre hombres y mujeres no representa un problema de seguridad significativo.
Insuficiencia renal
El dexlansoprazol se metaboliza ampliamente en el hígado a metabolitos inactivos, y no se recupera fármaco original en la orina después de una dosis oral de dexlansoprazol. Por lo tanto, no se espera que la farmacocinética del dexlansoprazol se vea alterada en pacientes con insuficiencia renal, y no se realizaron estudios en pacientes con insuficiencia renal. Además, la farmacocinética del lansoprazol no fue clínicamente diferente en pacientes con insuficiencia renal leve, moderada o grave en comparación con sujetos sanos con función renal normal.
Insuficiencia hepática
En un estudio de 12 pacientes con insuficiencia hepática moderada (clase B de Child-Pugh) que recibieron una dosis única de 60 mg de DEXILANT, la exposición sistémica (AUC) de dexlansoprazol ligado y no ligado fue aproximadamente dos veces mayor en comparación con los sujetos con función hepática normal. Esta diferencia en la exposición no se debió a una diferencia en la unión a proteínas. No se han realizado estudios en pacientes con insuficiencia hepática grave (clase C de Child-Pugh) [ver Dosificación y administración (2.2), Uso en poblaciones específicas (8.6)].
Interacciones medicamentosas
Efecto de dexlansoprazol en otros medicamentos
Interacciones del citocromo P 450
El dexlansoprazol se metaboliza, en parte, por CYP2C19 y CYP3A4 [ver Farmacología clínica (12.3)].
In vitro Los estudios han demostrado que no es probable que el dexlansoprazol inhiba las isoformas 1A1, 1A2, 2A6, 2B6, 2C8, 2C9, 2D6, 2E1 o 3A4 del CYP. Como tal, no se esperarían interacciones clínicamente relevantes con fármacos metabolizados por estas enzimas CYP. Además, in vivo Los estudios demostraron que DEXILANT no tuvo un impacto en la farmacocinética de la fenitoína coadministrada (sustrato de CYP2C9) o la teofilina (sustrato de CYP1A2).
No se determinaron los genotipos CYP1A2 de los sujetos en el estudio de interacción fármaco-fármaco con teofilina. Aunque in vitro Los estudios indicaron que DEXILANT tiene el potencial de inhibir CYP2C19 in vivo, un in vivo El estudio de interacción fármaco-fármaco en metabolizadores extensos e intermedios de CYP2C19 ha demostrado que DEXILANT no afecta la farmacocinética del diazepam (sustrato de CYP2C19).
Clopidogrel
El clopidogrel se metaboliza a su metabolito activo en parte por CYP2C19. Se realizó un estudio en sujetos sanos que eran metabolizadores extensos de CYP2C19, que recibieron una administración diaria de 75 mg de clopidogrel solo o concomitantemente con 60 mg de DEXILANT (n = 40), durante nueve días. El AUC media del metabolito activo de clopidogrel se redujo en aproximadamente un 9 % (la relación AUC media fue del 91 %, con un IC del 90 % de 86 a 97 %) cuando se coadministró DEXILANT en comparación con la administración de clopidogrel solo. También se midieron los parámetros farmacodinámicos y se demostró que el cambio en la inhibición de la agregación plaquetaria (inducida por 5 mcM de ADP) estaba relacionado con el cambio en la exposición al metabolito activo de clopidogrel. El efecto sobre la exposición al metabolito activo de clopidogrel y sobre la inhibición plaquetaria inducida por clopidogrel no se considera clínicamente importante.
12.5 Farmacogenómica
Efecto del polimorfismo CYP2C19 sobre la exposición sistémica de dexlansoprazol
La exposición sistémica al dexlansoprazol es generalmente mayor en metabolizadores intermedios y lentos. En sujetos japoneses varones que recibieron una dosis única de DEXILANT 30 o 60 mg (N = 2 a 6 sujetos / grupo), los valores medios de C máx. Y AUC de dexlansoprazol fueron hasta dos veces más altos en metabolizadores intermedios en comparación con los metabolizadores extensos; en metabolizadores lentos, la C máx. Media fue hasta cuatro veces mayor y la AUC media fue hasta 12 veces mayor en comparación con los metabolizadores extensos. Aunque dicho estudio no se realizó en caucásicos y afroamericanos, se espera que la exposición al dexlansoprazol en estas razas también se vea afectada por los fenotipos CYP2C19.
13 TOXICOLOGÍA NO CLÍNICA
13.1 Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
El potencial carcinogénico del dexlansoprazol se evaluó utilizando estudios con lansoprazol. En dos estudios de carcinogenicidad de 24 meses, las ratas Sprague-Dawley fueron tratadas por vía oral con lansoprazol en dosis de 5 a 150 mg/kg/día, aproximadamente de una a 40 veces la exposición en una base de superficie corporal (mg/m2) de una persona de 50 kg de altura promedio [1.46 m2 superficie corporal (BSA)] dada la dosis humana recomendada de lansoprazol 30 mg/día.
El lansoprazol produjo hiperplasia de células ECL gástricas y carcinoides de células ECL relacionados con la dosis en ratas macho y hembra [ver Farmacología Clínica (12.2)].
En ratas, el lansoprazol también aumentó la incidencia de metaplasia intestinal del epitelio gástrico en ambos sexos. En ratas macho, el lansoprazol produjo un aumento relacionado con la dosis de adenomas de células intersticiales testiculares. La incidencia de estos adenomas en ratas que recibieron dosis de 15 a 150 mg/kg/día (cuatro a 40 veces la dosis humana recomendada de lansoprazol basada en BSA) superó la baja incidencia de fondo (rango = 1.4 a 10%) para esta cepa de rata.
En un estudio de carcinogenicidad de 24 meses, los ratones CD-1 fueron tratados por vía oral con dosis de lansoprazol de 15 a 600 mg/kg/día, dos a 80 veces la dosis humana recomendada de lansoprazol basada en BSA. El lansoprazol produjo un aumento relacionado con la dosis en la incidencia de hiperplasia de células ECL gástricas. También produjo un aumento en la incidencia de tumores hepáticos (adenoma hepatocelular más carcinoma). Las incidencias tumorales en ratones machos tratados con 300 y 600 mg de lansoprazol/kg/día (40 a 80 veces la dosis humana recomendada de lansoprazol basada en BSA) y ratonas tratadas con 150 a 600 mg de lansoprazol/kg/día (20 a 80 veces la dosis humana recomendada de lansoprazol basada en BSA) superaron los rangos de incidencias de fondo en controles históricos para esta cepa de ratones. El tratamiento con lansoprazol produjo adenoma de rete testis en ratones machos que recibieron de 75 a 600 mg/kg/día (10 a 80 veces la dosis humana recomendada de lansoprazol basada en BSA).
Un estudio de carcinogenicidad de 26 semanas en ratones transgénicos p53 (+/-) no fue positivo.
El lansoprazol fue positivo en la prueba de Ames y en el ensayo de aberración cromosómica de linfocitos humanos in vitro. El lansoprazol no fue genotóxico en la prueba de síntesis de ADN no programada (UDS) de hepatocitos de rata ex vivo, la prueba de micronúcleos de ratón in vivo o la prueba de aberración cromosómica de células de médula ósea de rata.
El dexlansoprazol fue positivo en la prueba de Ames y en la prueba de aberración cromosómica in vitro utilizando células de pulmón de hámster chino. El dexlansoprazol fue negativo en la prueba de micronúcleos de ratón in vivo.
Los posibles efectos del dexlansoprazol sobre la fertilidad y el rendimiento reproductivo se evaluaron utilizando estudios con lansoprazol. Se encontró que el lansoprazol en dosis orales de hasta 150 mg/kg/día (40 veces la dosis humana recomendada de lansoprazol basada en BSA) no tuvo ningún efecto sobre la fertilidad y el rendimiento reproductivo de las ratas macho y hembra.
14 ESTUDIOS CLÍNICOS
14.1 Curación de la esofagitis erosiva en adultos
Se llevaron a cabo dos estudios multicéntricos, doble ciego, activo controlado, aleatorizados y de ocho semanas en pacientes con EE confirmada endoscópicamente. La gravedad de la enfermedad se clasificó según el Sistema de Graduación de Clasificación de Los Ángeles (Grados A-D). Los pacientes fueron aleatorizados en uno de los siguientes tres grupos de tratamiento: DEXILANT 60 mg una vez al día, DEXILANT 90 mg una vez al día o lansoprazol 30 mg una vez al día. Los pacientes que eran positivos para H. pylori o que tenían esófago de Barrett y/o cambios displásicos definidos al inicio fueron excluidos de estos estudios. Un total de 4092 pacientes fueron inscritos y tenían edades entre 18 y 90 años (edad mediana 48 años) con un 54% de hombres. La raza se distribuyó de la siguiente manera: 87% caucásicos, 5% negros y 8% otros. Basado en la Clasificación de Los Ángeles, el 71% de los pacientes tenían EE leve (Grados A y B) y el 29% de los pacientes tenían EE moderada a grave (Grados C y D) antes del tratamiento.
Los estudios estaban diseñados para probar la no inferioridad. Si se demostraba la no inferioridad, entonces se probaría la superioridad. Aunque se demostró la no inferioridad en ambos estudios, el hallazgo de superioridad en un estudio no se replicó en el otro.
La proporción de pacientes con EE curada en la semana 4 o 8 se presenta a continuación en Tabla 8.
| Estudio | Número de pacientes (N)† | Grupo de tratamiento (diario) | Semana 4 % Curado |
Semana 8‡ % Curado |
(95% IC) de la diferencia de tratamiento (DEXILANT – Lansoprazol) en la semana 8 |
|---|---|---|---|---|---|
| IC = Intervalo de confianza | |||||
|
|||||
| 1 | 657 | DEXILANT 60 mg | 70 | 87 | (-1,5, 6,1)§ |
| 648 | Lansoprazol 30 mg | 65 | 85 | ||
| 2 | 639 | DEXILANT 60 mg | 66 | 85 | (2,2, 10,5)§ |
| 656 | Lansoprazol 30 mg | 65 | 79 | ||
Se estudió DEXILANT 90 mg una vez al día y no proporcionó un beneficio clínico adicional en comparación con DEXILANT 60 mg una vez al día.
14.2 Mantenimiento de la esofagitis erosiva curada y alivio de la ardor de estómago en adultos
Se llevó a cabo un estudio multicéntrico, doble ciego, controlado con placebo, aleatorizado en pacientes que completaron con éxito un estudio de EE y mostraron EE curada confirmada endoscópicamente. Se evaluó el mantenimiento de la curación y la resolución de los síntomas durante un período de seis meses con DEXILANT 30 o 60 mg una vez al día en comparación con placebo. Un total de 445 pacientes fueron inscritos y tenían edades entre 18 y 85 años (edad mediana 49 años), con un 52% mujeres. La raza se distribuyó de la siguiente manera: 90% caucásicos, 5% negros y 5% otros.
El 66% de los pacientes tratados con 30 mg de DEXILANT permanecieron curados durante el período de seis meses según la confirmación endoscópica (véase Tabla 9).
DEXILANT 60 mg una vez al día se estudió y no proporcionó un beneficio clínico adicional sobre DEXILANT 30 mg una vez al día.
También se evaluó el efecto de DEXILANT 30 mg en el mantenimiento del alivio de la acidez estomacal. Al ingresar al estudio de mantenimiento, la mayoría de los pacientes tenían una gravedad de acidez estomacal basal calificada como ninguna. DEXILANT 30 mg demostró un porcentaje estadísticamente significativamente mayor de períodos de 24 horas sin acidez estomacal en comparación con el placebo durante el período de tratamiento de seis meses (ver Tabla 10). La mayoría de los pacientes tratados con placebo suspendieron el tratamiento debido a una recaída de EE entre el mes 2 y el mes 6.
| Tratamiento general* | Mes 1 | Mes 6 | ||||
|---|---|---|---|---|---|---|
| Grupo de tratamiento (diario) |
N | Períodos de 24 horas sin acidez estomacal (%) |
N | Períodos de 24 horas sin acidez estomacal (%) |
N | Períodos de 24 horas sin acidez estomacal (%) |
| DEXILANT 30 mg | 132 | 96.1† | 126 | 96.7 | 80 | 98.3 |
| Placebo | 141 | 28.6 | 117 | 28.6 | 23 | 73.3 |
14.3 Tratamiento de la ERGE sintomática no erosiva en adultos
Se realizó un estudio multicéntrico, doble ciego, controlado con placebo, aleatorizado de cuatro semanas en pacientes con un diagnóstico de ERGE sintomática no erosiva realizado principalmente por la presentación de síntomas. Estos pacientes que identificaron la acidez estomacal como su síntoma principal, tenían antecedentes de acidez estomacal durante seis meses o más, tenían acidez estomacal en al menos cuatro de siete días inmediatamente antes de la aleatorización y no tenían erosiones esofágicas según lo confirmado por endoscopia. Sin embargo, los pacientes con síntomas que no estaban relacionados con el ácido pueden no haber sido excluidos utilizando estos criterios de inclusión. Los pacientes fueron aleatorizados a uno de los siguientes grupos de tratamiento: DEXILANT 30 mg al día, 60 mg al día o placebo. Se inscribieron un total de 947 pacientes y su edad osciló entre los 18 y los 86 años (edad media de 48 años), con un 71% de mujeres. La raza se distribuyó de la siguiente manera: 82% caucásica, 14% negra y 4% otra.
DEXILANT 30 mg proporcionó un porcentaje estadísticamente significativamente mayor de días con períodos de 24 horas sin acidez estomacal en comparación con el placebo, según lo evaluado por el diario diario durante cuatro semanas (ver Tabla 11). DEXILANT 60 mg una vez al día se estudió y no proporcionó ningún beneficio clínico adicional sobre DEXILANT 30 mg una vez al día.
| N | Grupo de tratamiento (diario) |
Períodos de 24 horas sin acidez estomacal (%) |
|---|---|---|
|
||
| 312 | DEXILANT 30 mg | 54.9* |
| 310 | Placebo | 18.5 |
Un porcentaje mayor de pacientes que recibieron DEXILANT 30 mg tuvieron períodos de 24 horas sin acidez estomacal en comparación con el placebo ya en los primeros tres días de tratamiento, y esto se mantuvo durante todo el período de tratamiento (porcentaje de pacientes en el día 3: DEXILANT 38% vs placebo 15%; en el día 28: DEXILANT 63% vs placebo 40%).
14.4 GERD pediátrica
El uso de DEXILANT en pacientes de 12 a 17 años de edad está respaldado por evidencia de estudios adecuados y bien controlados de cápsulas de DEXILANT en adultos, con datos adicionales de seguridad, eficacia y farmacocinética de estudios realizados en pacientes pediátricos.
Curación de EE, mantenimiento de EE curada y alivio de la acidez estomacal
En un ensayo multicéntrico de 36 semanas, se inscribieron 62 pacientes de 12 a 17 años de edad con un historial documentado de GERD durante al menos tres meses y esofagitis erosiva (EE) probada endoscópicamente para evaluar la curación de EE, el mantenimiento de EE curada y el alivio de la acidez estomacal, seguido de 12 semanas adicionales sin tratamiento. La edad media fue de 15 años, y los hombres representaron el 61% de los pacientes. Según la escala de clasificación de Los Ángeles, el 97% de los pacientes tenían EE leve (grados A y B), y el 3% de los pacientes tenían EE moderada a grave (grados C y D) antes del tratamiento.
En las primeras ocho semanas, 62 pacientes fueron tratados con DEXILANT 60 mg una vez al día para evaluar la curación de EE. De los 62 pacientes, 58 pacientes completaron el ensayo de ocho semanas, y 51 (88%) pacientes lograron la curación de EE, como se confirmó mediante endoscopia, durante ocho semanas de tratamiento (ver Tabla 12).
| DEXILANT 60 mg | |
|---|---|
| Proporción de pacientes aleatorizados curados n (%) |
51/62 (82%) |
| IC del 95% | (70, 91)* |
| Proporción de pacientes evaluables curados† n (%) |
51/58 (88%) |
| IC del 95% | (77, 95)* |
Después de las primeras ocho semanas de tratamiento, los 51 pacientes con EE curada se asignaron aleatoriamente para recibir tratamiento con DEXILANT 30 mg o placebo, una vez al día durante 16 semanas adicionales para evaluar el mantenimiento de la curación y la resolución de los síntomas. El mantenimiento de la curación se evaluó mediante endoscopia en la semana 24. De los 51 pacientes aleatorizados, 13 pacientes abandonaron el estudio prematuramente. De estos, cinco pacientes no se sometieron a endoscopia posterior a la línea de base. Dieciocho de 22 (82%) pacientes evaluables tratados con DEXILANT 30 mg permanecieron curados durante el período de tratamiento de 16 semanas, como se confirmó mediante endoscopia, en comparación con 14 de 24 (58%) en placebo (ver Tabla 13).
| DEXILANT 30 mg | Placebo | |
|---|---|---|
| Proporción de pacientes aleatorizados que mantuvieron la curación de EE n (%) |
18/25 (72%) | 14/26 (54%) |
| IC del 95% | (51, 88)† | (33, 73)† |
| Proporción de pacientes evaluables que mantuvieron la curación de EE‡ n (%) |
18/22 (82%) | 14/24 (58%) |
| IC del 95% | (60, 95)† | (37, 78)† |
El alivio de la acidez estomacal se evaluó en pacientes aleatorizados durante el período de mantenimiento de 16 semanas. El porcentaje mediano de períodos de 24 horas sin acidez estomacal fue del 87% para aquellos que recibieron DEXILANT 30 mg en comparación con el 68% para aquellos que recibieron placebo.
De los 32 pacientes que mantuvieron la curación de EE al final del período de mantenimiento de 16 semanas, 27 pacientes (16 tratados con DEXILANT y 11 tratados con placebo durante la fase doble ciego) fueron seguidos durante 12 semanas adicionales sin terapia. Veinticuatro de los 27 pacientes completaron el período de seguimiento de 12 semanas. Un paciente requirió tratamiento con terapia de supresión de ácido.
Tratamiento de la ERGE sintomática no erosiva
En un ensayo multicéntrico, abierto, de un solo brazo, 104 pacientes pediátricos de 12 a 17 años de edad con ERGE sintomática no erosiva fueron tratados con DEXILANT 30 mg una vez al día, durante cuatro semanas para evaluar la seguridad y la eficacia. Los pacientes tenían un historial documentado de síntomas de ERGE durante al menos tres meses antes de la selección, informaron acidez estomacal en al menos tres de siete días durante la selección y no tenían erosiones esofágicas, según lo confirmado por endoscopia. La edad media fue de 15 años, con mujeres que representan el 70% de los pacientes. Durante el período de tratamiento de cuatro semanas, el porcentaje mediano de períodos de 24 horas sin acidez estomacal fue del 47%.
16 FORMA DE SUMINISTRO/ALMACENAMIENTO Y MANIPULACIÓN
Las cápsulas de liberación retardada de DEXILANT de 30 mg son opacas, azules y grises con las inscripciones “TAP” y “30” en la cápsula y se suministran en:
| Número de NDC | Tamaño |
|---|---|
| 64764-171-11 | Paquete de dosis unitaria de 100 |
| 64764-171-30 | Frasco de 30 |
| 64764-171-90 | Frasco de 90 |
| 64764-171-19 | Frasco de 1000 |
Las cápsulas de liberación retardada de DEXILANT de 60 mg son opacas y azules con las inscripciones “TAP” y “60” en la cápsula y se suministran en:
| Número de NDC | Tamaño | |
|---|---|---|
| 64764-175-11 | Paquete de dosis unitaria de 100 | |
| 64764-175-30 | Frasco de 30 | |
| 64764-175-90 | Frasco de 90 | |
| 64764-175-19 | Frasco de 1000 |
Almacenar a 20 a 25°C (68 a 77°F); se permiten excursiones de 15 a 30°C (59 a 86°F) [consultar la temperatura controlada según USP].
17 INFORMACIÓN PARA EL PACIENTE
Aconseje al paciente que lea el etiquetado del paciente aprobado por la FDA (Guía de medicamentos e Instrucciones de uso).
Reacciones adversas
Aconseje a los pacientes que informen a su proveedor de atención médica si experimentan algún signo o síntoma compatible con:
- Reacciones de hipersensibilidad [ver Contraindicaciones (4)]
- Nefritis tubulointersticial aguda [ver Advertencias y precauciones (5.2)]
- Clostridium difficile-Diarrea asociada [ver Advertencias y precauciones (5.3)]
- Fractura ósea [ver Advertencias y precauciones (5.4)]
- Reacciones adversas cutáneas graves [ver Advertencias y precauciones (5.5)]
- Lupus eritematoso cutáneo y sistémico [ver Advertencias y precauciones (5.6)]
- Deficiencia de cianocobalamina (vitamina B12) [ver Advertencias y precauciones (5.7)]
- Hipomagnesemia y metabolismo mineral [ver Advertencias y precauciones (5.8)]
Interacciones medicamentosas
Aconseje a los pacientes que informen a su proveedor de atención médica si están tomando productos que contienen rilpivirina [ver Contraindicaciones (4)] o metotrexato en dosis altas [ver Advertencias y precauciones (5.10)].
Embarazo
Avise a una mujer embarazada del riesgo potencial para un feto. Avise a las mujeres en edad fértil que informen a su proveedor de atención médica sobre un embarazo conocido o sospechado [ver Uso en poblaciones específicas (8.1)].
Administración
- Tomar sin tener en cuenta los alimentos.
- Dosis olvidadas: Si se olvida una dosis, administre lo antes posible. Sin embargo, si la próxima dosis programada es debida, no tome la dosis olvidada y tome la próxima dosis a tiempo. No tome dos dosis al mismo tiempo para compensar una dosis olvidada.
- Traga entero; no mastique.
- Se puede abrir y espolvorear sobre puré de manzana para los pacientes que tienen problemas para tragar la cápsula.
- Alternativamente, la cápsula se puede administrar con agua a través de una jeringa oral o un tubo NG, como se describe en las Instrucciones de uso.
Guía de medicación
| This Medication Guide has been approved by the U.S. Food and Drug Administration. Revised: 4/2023 |
| GUÍA DEL MEDICAMENTO DEXILANT (decks-i-launt) (dexlansoprazole) cápsulas de liberación retardada, para administración oral |
| Lea esta Guía del Medicamento antes de empezar a tomar DEXILANT y cada vez que renueve su receta. Es posible que haya nueva información. Esta información no sustituye a las conversaciones con su médico sobre su enfermedad o su tratamiento. |
| ¿Cuál es la información más importante que debo saber sobre DEXILANT? DEXILANT puede ayudar con sus síntomas relacionados con el ácido, pero aun así podría tener problemas estomacales graves. Hable con su médico. DEXILANT puede causar efectos secundarios graves, que incluyen:
DEXILANT puede tener otros efectos secundarios graves. Consulte “¿Cuáles son los posibles efectos secundarios de DEXILANT?“. |
| ¿Qué es DEXILANT? DEXILANT es un medicamento recetado llamado inhibidor de la bomba de protones (IBP). DEXILANT reduce la cantidad de ácido en el estómago. DEXILANT se usa en personas mayores de 12 años:
La ERGE ocurre cuando el ácido del estómago ingresa al tubo (esófago) que conecta la boca con el estómago. Esto puede causar una sensación de ardor en el pecho o la garganta, sabor amargo o eructos. |
¿Quién no debe tomar DEXILANT? No tome DEXILANT si usted:
|
| ¿Qué debo decirle a mi médico antes de tomar DEXILANT? Antes de tomar DEXILANT, informe a su médico sobre todas sus afecciones médicas, incluso si usted:
Informe a su médico sobre todos los medicamentos que toma, incluidos los medicamentos recetados y de venta libre, las vitaminas y los suplementos a base de hierbas. Lleve una lista de estos para mostrársela a su médico y farmacéutico cuando le receten un nuevo medicamento. |
¿Cómo debo tomar DEXILANT?
|
| ¿Cuáles son los posibles efectos secundarios de DEXILANT? DEXILANT puede causar efectos secundarios graves, entre ellos:
Los efectos secundarios más comunes de DEXILANT en adultos incluyen:
Los efectos secundarios más comunes de DEXILANT en niños de 12 a 17 años de edad incluyen:
Otros efectos secundarios:
Su médico puede suspender DEXILANT si ocurren estos síntomas. |
¿Cómo debo almacenar DEXILANT?
Mantenga DEXILANT y todos los medicamentos fuera del alcance de los niños. |
| Información general sobre el uso seguro y efectivo de DEXILANT. Algunas veces, los medicamentos se prescriben para propósitos distintos a los que aparecen en una Guía de Medicación. No use DEXILANT para una afección para la que no ha sido prescrito. No le dé DEXILANT a otras personas, incluso si tienen los mismos síntomas que usted. Puede hacerles daño. Esta Guía de Medicación resume la información más importante sobre DEXILANT. Si desea más información, hable con su médico. Puede pedir a su médico o al farmacéutico información sobre DEXILANT escrita para profesionales de la salud. Para más información, vaya a www.DEXILANT.com o llame al 1-877-TAKEDA-7 (1-877-825-3327). |
| ¿Cuáles son los ingredientes de DEXILANT? Ingrediente activo: dexlansoprazole. Ingredientes inactivos: esferas de azúcar, carbonato de magnesio, sacarosa, celulosa hidroxipropílica de baja sustitución, dióxido de titanio, celulosa hidroxipropílica, hipromelosa 2910, talco, copolímeros de ácido metacrílico, polietilenglicol 8000, citrato de trietilo, polisorbato 80 y dióxido de silicio coloidal. La cápsula está hecha de hipromelosa, carragenina y cloruro de potasio. Según el color de la cápsula, la azul contiene FD&C Blue No. 2 (o FD&C Blue No. 2 lago de aluminio); la gris contiene óxido férrico negro; y ambas contienen dióxido de titanio. Distribuido por: Takeda Pharmaceuticals América, Inc. Lexington, MA 02421 DEXILANT y el logotipo de DEXILANT son marcas registradas de Takeda Pharmaceuticals U.S.A., Inc. © 2023 Takeda Pharmaceuticals América, Inc. |
INSTRUCCIONES DE USO
DEXILANT (decks-i-launt)
(dexlansoprazole)
cápsulas de liberación retardada, para administración oral
Tomando DEXILANT con puré de manzana:
- Coloque 1 cucharada de puré de manzana en un recipiente limpio.
- Abra la cápsula con cuidado y espolvoree los gránulos sobre el puré de manzana.
- Traga el puré de manzana y los gránulos inmediatamente. No mastique los gránulos. No guarde el puré de manzana y los gránulos para usarlos más tarde.
Administrando DEXILANT con agua usando una jeringa oral:
- Coloque 20 mL de agua en un recipiente limpio.
- Abra la cápsula con cuidado y vacíe los gránulos en el recipiente con agua.
- Use una jeringa oral para aspirar la mezcla de agua y gránulos.
- Gire suavemente la jeringa oral para evitar que los gránulos se depositen.
- Coloque la punta de la jeringa oral en su boca. Administre el medicamento inmediatamente. No guarde la mezcla de agua y gránulos para usarla más tarde.
- Vuelva a llenar la jeringa con 10 mL de agua y gire suavemente. Coloque la punta de la jeringa oral en su boca y administre el medicamento que queda en la jeringa.
- Repita el paso 6.
Administrando DEXILANT con agua a través de una sonda nasogástrica (sonda NG):
Para las personas que tienen una sonda NG de tamaño 16 French o más grande, DEXILANT puede administrarse de la siguiente manera:
- Coloque 20 mL de agua en un recipiente limpio.
- Abra la cápsula con cuidado y vacíe los gránulos en el recipiente con agua.
- Use una jeringa con punta de catéter de 60 mL para aspirar la mezcla de agua y gránulos.
- Gire suavemente la jeringa con punta de catéter para evitar que los gránulos se depositen.
- Conecte la jeringa con punta de catéter a la sonda NG.
- Administre la mezcla inmediatamente a través de la sonda NG que va al estómago. No guarde la mezcla de agua y gránulos para usarla más tarde.
- Vuelva a llenar la jeringa con punta de catéter con 10 mL de agua y gire suavemente. Lave la sonda NG con el agua.
- Repita el paso 7.
¿Cómo debo almacenar DEXILANT?
- Almacene DEXILANT a temperatura ambiente entre 68°F y 77°F (20°C y 25°C).
Mantenga DEXILANT y todos los medicamentos fuera del alcance de los niños.
Estas Instrucciones de uso han sido aprobadas por la Administración de Alimentos y Medicamentos de los Estados Unidos.
Distribuido por:
Takeda Pharmaceuticals America, Inc.
Lexington, MA 02421
DEXILANT y el logotipo de DEXILANT son marcas comerciales registradas de Takeda Pharmaceuticals U.S.A., Inc.
© 2023 Takeda Pharmaceuticals America, Inc.
Revisado: Abril 2023
DEX006 R36
PANEL DE MOSTRACIÓN PRINCIPAL – Etiqueta de Frasco de Cápsulas de 30 mg
NDC 64764-171-30
Rx only
30 Cápsulas
DEXILANT
dexlansoprazole
liberación retardada
cápsulas
Entregue la
Guía de Medicamentos
adjunta
a cada paciente.
30 mg

PANEL PRINCIPAL DE VISUALIZACIÓN – Etiqueta de botella de cápsulas de 60 mg
NDC 64764-175-30
Rx only
30 Cápsulas
DEXILANT
dexlansoprazole
delayed release
capsules
Entregue la
Guía de Medicamentos
adjunta
a cada paciente.
60 mg


